Производные изотиазолона, их фармацевтически приемлемые соли и сольваты, фармацевтическая композиция с антивирусной, противовоспалительной и антиатериосклеротической активностью
Номер патента: 898
Опубликовано: 26.06.2000
Авторы: Санчез Джозеф Питер, Джоглиотти Рокко Дин, Домагала Джон Майкл, Триведи Бхарат Калидас, Перчейз Тэрри, Болтон Гэри Луис, Элслагер Эдвард Фэйт
Формула / Реферат
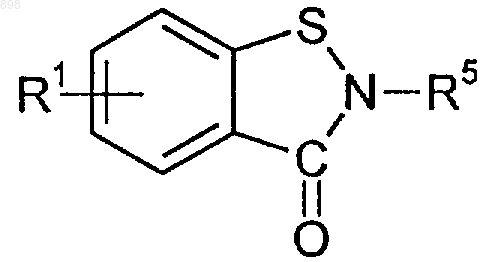
1. Производные изотиазолона общей формулы (I)

где R1 и R2, независимо друг от друга, означают водород, галоген, алкил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, замещенный или незамещенный остаток фенил-(СR6R7)m-, замещенный или незамещенный остаток Het(CR6R7)m-, где Het означает гетероцикл, a m - числа 0, 1 или 2, алкоксил с 1-6 атомами углерода, гидроксил, цианогруппу, NR3COR4, CO2R3, CONR3R4, S(O)mR3, сульфогруппу, остаток S(O)NR3R4, COR3 или вместе образуют оксогруппу или метилендиоксигруппу;
R3 и R4 независимо друг от друга означают водород, алкил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, остаток Het (CR6R7)m- или фенил-(СR6R7)m-, где Het и m имеют вышеуказанные значения,
R5 означает алкил с 1-6 атомами углерода, ацил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, замещенный остаток фенил-(СR6R7)m-, незамещенный или замещенный остаток Het (CR6R7)m-, где Het и m имеют вышеуказанные значения,
при этом алкильные, ацильные и циклоалкильные группы могут быть замещены 1-3 остатками из группы, включающей NR3COR4, CO2R3, СОNR3R4, S(O)mR3, сульфогруппу, S(O)mNR3R4 и COR3, а фенильные и гетероциклические группы могут быть замещены галогеном, гидроксилом, NR3R4, NR3COR4, CO2R3, CONR3R4, S(O)mR3, сульфогруппой, S(O)mNR3R4 или COR3, где R3, R4, Het и m имеют вышеуказанные значения,
R6 и R7 независимо друг от друга означают водород, алкил с 1-6 атомами углерода, CO2R3, гидроксил, CONR3R4 или цианогруппу;
при условии, что R5 имеет значение, отличное от замещенного фенил-(CR6R7)m-, если заместителем фенильного кольца являются алкил, галоген, алкоксил или NR3R4, и их фармацевтически приемлемыми солями и сольватами.
2. Производные изотиазолона общей формулы (I) по п.1, где R5 означает
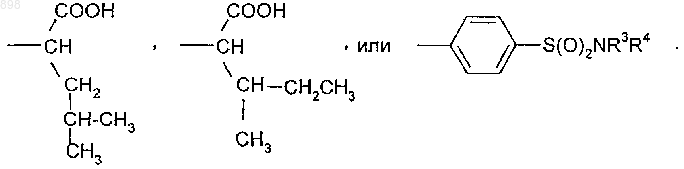
3. Производные изотиазолона общей формулы (I) по п.2, где R2 означает водород.
4. Производные изотиазолона по п.3, где R5 означает
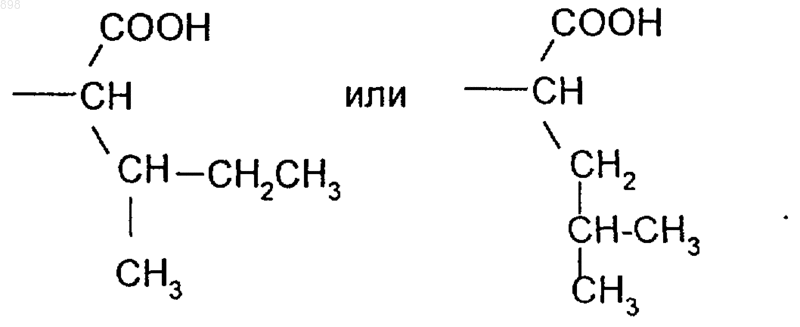
5. Производные изотиазолона общей формулы (I) по п.4, представляющие собой
[S-(R*,R*)]-3-метил-2-(3-оксо-3Н-бензо[d]изотиазол-2-ил)-пентановую кислоту;
2-(6-метокси-3-оксо-3Н-бензо[d]изотиазол-2-ил)-пентановую кислоту;
(S)-4-метил-2-(5-фтор-3-оксо-3Н-бензо[d]изотиазол-2-ил)-пентановую кислоту;
(S)-4-метил-2-(6-метил-3-оксо-3Н-бензо[d]изотиазол-2-ил)-пентановую кислоту.
6. Производные изотиазолона общей формулы (I) по п.3, где R5 означает
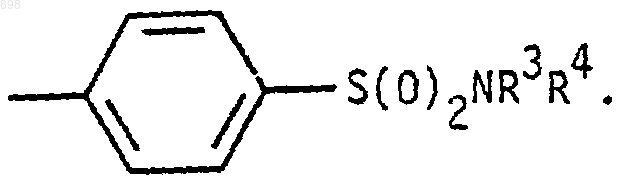
7. Производные изотиазолона общей формулы (I) по п.6, где R3 означает водород.
8. Производное изотиазолона формулы (I) по п.7, представляющее собой N-aцeтил-4-(3-oкco-3H-бeнзo[d]-изoтиaзoл-2-ил)-бeнзoлcyльфoнaмид.
9. Производные изотиазолона по п.7, где R4 означает водород.
10. Производные изотиазолона по п.9, представляющие собой
4-(3-оксо-3Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид;
4-(5-метокси-3-оксо-3Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид;
4-(6-метил-3-оксо-3Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид;
4-(6-фтор-3-оксо-3Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид;
4-(5-метил-3-оксо-3Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид.
11. Фармацевтическая композиция с антивирусной, противовоспалительной и антиатериосклеротической активностью, содержащая активное вещество на основе производных изотиазолона и, по меньшей мере, один фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производного изотиазолона содержит соединения общей формулы (I) по п.1 или их фармацевтически приемлемую соль или сольват в эффективном количестве.
12. Фармацевтическая композиция по п.11, отличающаяся тем, что в качестве производного изотиазолона содержит соединение формулы
13. Фармацевтическая композиция по п.12, отличающаяся тем, что в качестве производного изотиазолона содержит соединение, где R2 означает водород.
14. Фармацевтическая композиция по п.13, отличающаяся тем, что в качестве производного изотиазолона содержит соединение, где R5 означает
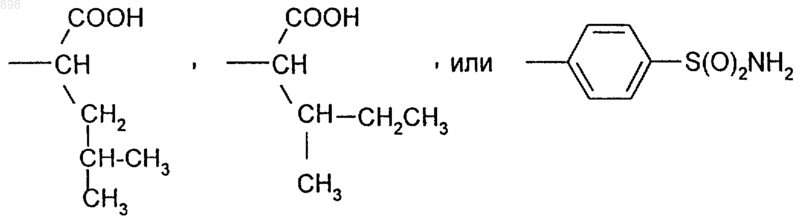
15. Фармацевтическая композиция по п.14, отличающаяся тем, что в качестве производного изотиазолона содержит [S-(R*,R*)]-3-метил-2-(3-оксо-3Н-бензо[d]изотиазол-2-ил)-пентановую кислоту.
16. Фармацевтическая композиция по п.14, отличающаяся тем, что в качестве производного изотиазолона содержит 4-(3-оксо-3Н-бензо[d]изотиазол-2-ил)-бензолсульфонамид.
Текст
1 Изобретение относится к новым азот и серосодержащим гетероциклическим соединениям, обладающим биологической активностью, в частности к производным изотиазолона, их фармацевтически приемлемым солям и сольватом, и к фармацевтической композиции с антивирусной, противовоспалительной и антиатериосклеротической активностью. Известны производные бензизотиазолинона, обладающие биологической активностью, в частности микробиоцидной активностью (см. патент США 3 761 489, кл. С 07d 91/10,25.09.1973). Задачей изобретения является разработка производных изотиазолона, которые могут представлять собой активное вещество фармацевтической композиции, обладающей антивирусной, противовоспалительной и антиатериосклеротической активностью. Поставленная задача решается предлагаемыми производными изотиазолона общей формулы (I)R6 и R7 независимо друг от друга означают водород, алкил с 1 - 6 атомами углерода, CO2R3,гидроксил, СОNR3R4 или цианогруппу; при условии, что R5 имеет значение, отличное от замещенного фенил-(СR6R7)m-,если заместителем фенильного кольца являются алкил, галоген, алкоксил или NR3R4,и их фармацевтически приемлемыми солями и сольватами. В первую группу предпочтительных производных изотиазолона формулы (I) входят соединения, у которых R5 означает При этом R2 предпочтительно означает водород. Во второю группу предпочтительных производных изотиазолона формулы (I) входят соединения, у которых R5 означаетR1 и R2, независимо друг от друга, означают водород, галоген, алкил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, замещенный или незамещенный остаток фенил(СR6R7)m-, замещенный или незамещенный остаток Het(CR6R7)m-, где Het означает гетероцикл, a m- числа 0, 1 или 2, алкоксил с 1 - 6 атомами углерода, гидроксил, цианогруппу,NR3COR4, CO2R3, CONR3R4, S(O)mR3, сульфогруппу, остаток S(O)mNR3R4, COR3 или вместе образуют оксогруппу или метилендиоксигруппу;R3 и R4 независимо друг от друга означают водород, алкил с 1 - 6 атомами углерода, циклоалкил с 3-6 атомами углерода, остаток Het(СR6R7)m-или фенил-(СR6R7)m-, где Het и m имеют вышеуказанные значения,R5 означает алкил с 1 - 6 атомами углерода,ацил с 1 - 6 атомами углерода, циклоалкил с 3 6 атомами углерода, замещенный остаток фенил-(CR6R7)m-, незамещенный или замещенный остаток Het (CR6R7)m-, где Het и m имеют вышеуказанные значения, при этом алкильные,ацильные и циклоалкильные группы могут быть замещены 1 - 3 остатками из группы, включающей NR3COR4, CO2R3, СОNR3R4, S(O)mR3, сульфогруппу, S(O)mNR3R4 и COR3, а фенильные и гетероциклические группы могут быть замещены галогеном, гидроксилом, NR3R4, NR3COR4,CO2R3, CONR3R4, S(O)mR3, сульфогруппой,S(O)m NR3R4 или COR3, где R3, R4, Het и m имеют вышеуказанные значения, В третью группу предпочтительных производных изотиазолона формулы (I) входят соединения, представляющие собой [S-(R,R)]метил-2-(3-оксо-3 Н-бензо[d]изотиазол-2-ил)-пентановую кислоту; 2-(6-метокси-3-оксо-3 Н-бензо[d]изотиазол-2-ил)пентановую кислоту;[d]изотиазол-2-ил)-пентановую кислоту. В четвертую группу предпочтительных производных изотиазолона формулы (I) входят соединения, у которых R5 означает При этом R3 и R4 предпочтительно означают водород. Из числа данных соединений в частности предпочитается N-ацетил-4-(3-оксо 3 Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид. В пятую группу предпочтительных производных изотиазолона формулы (I) входят соединения, представляющие собой 4-(3-оксо-3 Нбензо[d]-изотиазол-2-ил)бензолсульфонамид; 4-(5-метокси-3-оксо-3 Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид; 4-(6-метил-3-оксо-3 Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид; 4-(6-фтор-3-оксо-3 Н-бензо[d]-изотиазол-2 ил)бензолсульфонамид; 3 4-(5-метил-3-оксо-3 Н-бензо[d]-изотиазол 2-ил)бензолсульфонамид. Термин "алкил с 1-6 атомами углерода" означает линейную или разветвленную алифатическую группу с 1-6 атомами углерода. Примерами являются метил, этил, изобутил, нпентил и изогексил. Типичными "циклоалкильными группами с 3-6 атомами углерода" являются циклопропил, циклопентил, циклогексил и тому подобные."Нет" означает гетероцикл, включающий от четырех до десяти атомов, от одного до четырех из которых выбирают среди кислорода,серы или азота. Термин "Нет" включает неароматические группы, такие как морфолиногруппа и пирролидиногруппа. Предпочтительными группами "Нет" являются пяти- или шестичленные ароматические циклы с одним или двумя гетероатомами. Термин "Нет" включает бициклы, такие как бензофуран, изотиазолон, индол и тому подобные. Типичные группы, обозначаемые как "Нет", включают: и тому подобные. Другими типичными предпочтительными группами "Нет" являются пиримидин, пиридазин, пиразин, оксазол, пиразол,тиазол и тому подобные. Как указано выше, алкильные, циклоалкильные, фенильные группы и группы "Нет",входящие в определения R1, R2, R3, R4 и R5, могут быть замещены от однократно до трехкратно группами, выбираемыми из галогена, гидроксила, NR3 COR4, CO2R3, NR3R4, CONR3R4,S(O)mR3, сульфогруппы, S(O)mNR3R4 и COR3,где m, R3 и R4 имеют вышеуказанное значение. Таким образом типичные замещенные алкильные группы включают хлорметил,3 бромпропил, трифторметил, 4-гидроксигексил,1-карбокси-2-метилбутил, 3-метилтиобутил, 4 метилсульфонилбутил,диметиламинометил,2,3-дибромбутил,2-амино-3-хлор-4 карбоксибутил,3-ацетамидопропил,2 ацетилэтил,2-метоксикарбонилэтил,1,1 диацетилпропил и тому подобные. Предпочтительными замещенными алкильными группами являются таковые, содержащие один, два или три заместителя, выбираемых из галогена, гидроксила и карбоксила. Такие предпочтительные группы включают 1 бром-2-гидроксипропил,1,1-диметил-3 000898 4 гидроксипропил,1-гидроксиметил-2 фторметил-3-карбоксибутил,1-карбокси-2 метилбутил, 1-карбокси-3-метилбутил, 1,2,3 тригидроксипентил и тому подобные. Типичные замещенные циклоалкильные группы включают 2-фторциклопропил, 2,2 дибромциклопропил,2-карбоксициклобутил,2-аминосульфонилциклопентил,2 амино-3-карбоксициклопентил и 3-изопропилсульфинилциклогексил. В вышеприведенных формулах R1 и R2 могут означать галоген, представляющий собой фтор, хлор, бром и иод. R1, R2 и R5 могут означать группу фенил-(CR6R7)m-, в которой фенил может быть незамещен или замещен галогеном,гидроксилом,NR3R4,NR3COR4,CO2R3,3 4 3 3 4CO2R3, являются свободная карбоксильная группа, когда R3 означает водород, и группы сложных эфиров, таких, как сложные алкиловые эфиры с 1-6 атомами углерода в алкильной части, сложные бензиловые эфиры, сложные циклобутиловые эфиры и тому подобные. Амидные заместители обозначают группой CONR3R4, и они включают карбоксамид,Nметилкарбоксамид и N,N-диэтилкарбоксамид. Типичными, обозначаемыми как S(O)mR3 заместителями являются метилтиогруппа, этилсульфинил, циклопропилсульфонил и тому подобные. Сульфонамидные заместители S(O)mNR3R4 включают Производные изотиазолона формулы (I) можно получать известными в органике способами. Так, например, оксогалогенсульфенилбензоилгалогенид можно вводить во взаимодействие с амином согласно нижеследующей схеме,которая представляет собой общий способ Фишера и Харни, Arzneimittel Forsch., 14, 1301 где R1, R2 и R5 имеют вышеуказанное значение и "галоген" означает хлор, бром, иод и тому подобный. Обычно амин и галогенсульфенилбензоилгалогенид используют приблизительно в эквимолярных количествах; однако, если желательно, можно использовать избыток амина. Реакция как правило по существу заканчивается в течение примерно от одного до восьми часов,когда ее проводят в общем растворителе, таком,как толуол, 1,2-дихлорэтан или дихлорметан,при температуре примерно от 0 до 45 С. Если желательно, можно использовать акцепторы кислоты, такие как триэтиламин. Полученный изотиазолон легко выделяют путем удаления реакционного растворителя и, если желательно,можно осуществлять дальнейшую очистку путем кристаллизации или хроматографии. Альтернативный способ синтеза включает взаимодействие незамещенного в положении 2 изотиазолона с соединением R5L, где L означает удаляемую группу, такую, как галоген. Эту реакцию можно представить следующим образом: Конкретные реакционные условия, такие,как выбор растворителей, температура, молярные соотношения, акцепторы кислоты и тому подобные, аналогичны таковым вышеописанного способа и хорошо известны специалисту. Предпочтительный способ получения изотиазолонов включает диспропорционирование 2,2'-дитиобисариламида путем введения во взаимодействие с окислителем, таким, как хлор или бром, согласно следующей схеме: где R1, R2 и R5 имеют вышеуказанное значение. Для этой реакции диспропорци-онирования необходимо использовать в качестве исходного вещества 2,2'-дитиобисариламид, который легко получают из 2,2'-дитиобисарилкарбоновых кислот путем введения во взаимодействие кислоты с хлорирующим агентом, таким, как оксалилхлорид или тионилхлорид, с получением соответствующего хлорангидрида кислоты и затем реакции хлорангидрида кислоты с амином R5" МН 2. Типичный синтез протекает по следующей схеме: 2,2'-Дитиобисарилкарбоновые кислоты легко превращают в соответствующие хлорангидриды кислот путем введения во взаимодействие с хлорирующим агентом, таким, как тионилхлорид или оксалилхлорид. Реакцию можно проводить без растворителя или в инертном органическом растворителе, таком, как дихлорметан, тетрагидрофуран, диэтиловый эфир, диметилформамид или тому подобный. Реакция как правило заканчивается в течение времени примерно от одного часа до примерно восьми часов, когда ее проводят при температуре примерно от 0 С до примерно 100 С. Полученные хлорангидриды кислот легко выделяют просто путем удаления реакционного растворителя и избытка хлорирующего агента, например, путем выпаривания при пониженном давлении. Хлорангидриды 2,2'-дитиобисарилкарбоновых кислот затем превращают в 2,2'дитиобисариламиды путем введения во взаимодействие с первичным амином формулы R5NH2. Обычно используемыми типичными первичными аминами являются алкиламины и замещенные алкиламины, такие как метиламин, лейцин,изолейцин, серин, треонин, лизин, аспарагин и тому подобные. Также могут быть использованы анилин и замещенные анилины, такие как 4 гидроксианилин,3-аминоанилин,3-метилтиоанилин, 4-диметилсульфамоиланилин и тому подобные. Амин обычно смешивают с хлорангидридом кислоты примерно в эквимолярных количествах в общем растворителе, таком, как ацетон, дихлор-метан, тетрагидрофуран, метанол и тому подобный. Если желательно, можно использовать акцепторы кислоты, такие, как пиридин, триэтиламин, N-метилморфолин и 7 тому подобные. Реакция как правило заканчивается в течение времени примерно от одного часа до примерно восемнадцати часов, когда ее проводят при температуре примерно от 0 С до примерно 100 С. Образовавшиеся 2,2'дитиобисариламиды легко выделяют путем простого удаления реакционных растворителей и всех избыточных реагентов выпариванием при пониженном давлении, и дальнейшей очистки обычно не требуется. 2,2'-Дитиобисарилкарбоксамиды можно превращать в изотиазолоны согласно изобретению любым из двух способов. Карбоксамиды легко взаимодействуют с окислителями, такими,как бром или хлор, при протекании циклизации с получением соответствующих изотиазолонов. Окисление обычно проводят путем смешения избытка хлора или брома с карбоксамидом в соответствующем растворителе, таком как галогенированный углеводород, диметилсульфоксид, диметилформамид или тому подобный,обычно при пониженной температуре примерно от 0 С до примерно 5 С. Полученный изотиазолон является как правило твердым при комнатной температуре и обычно осаждается из реакционной смеси. Его можно выделять путем отфильтровывания и, если желательно, очищать далее обычными способами, такими, как промывка, например, с помощью водного раствора гидрокарбоната натрия или тому подобного, и кристаллизация из обычных растворителей, таких, как ацетон, этанол, этилацетат и тому подобные. Альтернативный способ получения изотиазолонов из 2,2'-дитиобисарилкарбоксамидов включает сначала превращение промежуточного 2,2'-дитиобисарилкарбоксамида в соответствующее арилтиолкарбоксамидное производное и затем циклизацию тиола с карбоксамидом с образованием целевого продукта. Эта схема получения представлена ниже: Промежуточные дитиобисарилкарбоксамиды вводят во взаимодействие с восстановителем, таким, как дитиотреитол, в общем растворителе, таком, как диметилформамид, диметилсульфоксид, диоксан и тому подобный. Восстановление обычно проводят при температуре примерно от 10 С до примерно 30 С и как правило оно заканчивается в течение времени примерно от получаса до примерно четырех часов. Полученный арилтиолкарбоксамид обычно выделяют за счет удаления полностью реакционного растворителя путем выпаривания. Арилтиолкарбоксамид также можно получать из легко доступных 2-гидроксикарбоновых кислот согласно следующей схеме: В случае этого способа, 2-гидроксикарбоновую кислоту вводят во взаимодействие с избытком обычного хлорирующего агента, такого, как тионилхлорид или пентахлорид фосфора, в инертном органическом растворителе,таком, как 1,2-дихлорэтан, хлороформ, этилхлорид, толуол или тому подобный, обычно при температуре примерно от 25 С до примерно 60 С. Полученный продукт, а именно хлорангидрид 2-хлоркарбоновой кислоты, как правило выделяют путем простого удаления реакционного растворителя и избытка хлорирующего агента, например, путем выпаривания при пониженном давлении. Хлорангидрид хлоркарбоновой кислоты затем вводят во взаимодействие с первичным амином формулы R5NH2 в инертном органическом растворителе, таком, как хлороформ, дихлорметан, этилхлорид или тому подобный. Обычно используемыми типичными первичными аминами являются природные аминокислоты, такие как глицин, лейцин, изолейцин, лизин, аспарагиновая кислота и тому подобные. Третичные и ароматические амины,такие как триэтиламин, пиридин или Nметилморфолин, могут быть добавлены в целях воздействия в качестве акцептора выделяющегося во время реакции хлороводорода. Полученный хлоркарбоксамид легко выделяют путем удаления реакционного растворителя, и дальнейшую очистку можно осуществлять обычными способами, такими, как кристаллизация,хроматография и тому подобные. Хлоркарбоксамид затем вводят во взаимодействие с гидросульфидом натрия в полярном растворителе,таком, как метанол, этанол, изопропанол или тому подобный, с получением соответствующего 2-тиолкарбоксамидного производного. Арилтиолкарбоксамид затем вводят во взаимодействие с вызывающим циклизацию агентом. Обычно используемыми типичными агентами являются хлоркарбонилсульфенилхлорид, иод, бром и тому подобные. Циклизацию осуществляют путем смешения эквимолярных количеств тиолкарбоксамида и циклизующего агента в инертном органическом растворителе, таком как тетрагидрофуран или тому подобный, и перемешивания смеси в течение времени примерно от получаса до примерно восемнадцати часов при температуре примерно от 0 С до примерно 30 С. Получаемый изотиазолон обычно осаждается по мере образования и его легко выделяют путем отфильтровывания и 9 очищают далее, если желательно, путем кристаллизации, хроматографии и тому подобными методами. Многие из отвечающих формуле (I) соединений могут содержать функциональные заместители (например, R1 и R2), для которых может быть необходима дериватизация для избежания нежелательных побочных реакций в процессе синтеза. Такими функциональными заместителями являются, например, гидроксильные группы, аминогруппы, главным образом первичные и вторичные аминогруппы, и карбоксильные группы. Например, в целях предотвращения нежелательных побочных реакций гидроксильные группы нужно превращать в защищенные гидроксильные группы, такие, как простые эфиры или сложные эфиры, во время химических реакций в других местах молекулы. Защитную для гидроксильной функции группу потом удаляют, чтобы получить свободную гидроксильную группу. Аминогруппы и карбоксильные группы подобным образом дериватизируют для их защиты от нежелательных побочных реакций. Карбоксильные группы как правило превращают в сложные эфиры, такие как трет,бутиловый сложный эфир, бензиловый или пнитро-бензиловый сложный эфир и тому подобные. Аминогруппы обычно ацилируют, например, с помощью ацетилхлорида или тому подобного, или силилируют с помощью триметилсилильной или трет.-бутилдиметилсилильной групп. Типичные защитные группы, а также способы их введения и отщепления описываются полностью Грином и Вутсом в книге "Защитные группы в органическом синтезе", изд. JonnWiley and Sons, Нью-Йорк (второе издание; 1991 г.), и МакОми в книге "Защитные группы в органической химии", изд. Plenum Press, НьюЙорк, 1973 г. Многие из изотиазолонов формулы (I) способны образовывать фармацевтически приемлемые соли, включая соли присоединения кислоты и соли присоединения основания, также,как сольваты, такие как гидраты и алкоголяты. Все эти фармацевтические формы рассматриваются в настоящем изобретении и включены в его объем охраны. Соли присоединения кислоты легко образуются, если соединение формулы (I) содержит аминогруппы в качестве заместителей или в циклической системе А присутствуют атомы азота. Основные соли могут быть получены, если имеются карбоксильные группы в качестве заместителей, например, когда R5 означает замещенный карбоксилом алкил, такой,как карбоксиметил или тому подобный. Фармацевтически приемлемые соли присоединения кислоты соединений формулы (I) включают соли, происходящие от неорганических кислот, таких как соляная кислота, азотная кислота, фосфорная кислота, серная кислота,бромоводородная кислота, иодоводородная кислота и тому подобные, также как соли, проис 000898 10 ходящие от органических кислот, таких как алифатические моно-или дикарбоновые кислоты, замещенные фенилом алкановые кислоты,гидроксиалкановые кислоты, алкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты и тому подобные. Такие соли таким образом представляют собой сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат,каприлат, изобутират, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, тартрат, метансульфонат и тому подобные. Также используют соли аминокислот, такие, как аргинат, глюконат, галактуронат и тому подобные(см., например, Berge S.M. и др. "Фармацевтические соли", J. Of Pharmaceutical Science, 66, 119 (1977. Соли присоединения кислоты основных соединений получают путем введения в контакт соединения в форме свободного основания с достаточным количеством желательной кислоты для получения обычным образом соли. Свободная основная форма может быть регенерирована путем введения в контакт образовавшейся соли с основанием и выделения свободного основания обычным образом. Свободные основные формы отчасти отличаются от соответствующих им солевых форм некоторыми физическими свойствами, такими, как растворимость в полярных растворителях, но в других отношениях для целей настоящего изобретения соли эквивалентны соответствующему им свободному основанию. Фармацевтически приемлемые соли присоединения основания образуются с металлами или аминами, такими как щелочные и щелочноземельные металлы или органические амины. Примерами используемых в качестве катионов металлов являются натрий, калий, магний, кальций и тому подобные. Примерами пригодных аминов являются N,N'-дибензилэтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метилглюкамин и прокаин (см., например, Веrgе S.M. и др. "Фармацевтические соли",J. Of Pharmaceutical Science, 66, 1-19 (1977. Соли присоединения основания кислых соединений получают путем введения в контакт соединения в форме свободной кислоты с достаточным количеством желательного основания для получения обычным образом соли. Свободная кислотная форма может быть регенерирована путем введения в контакт образовавшейся солевой формы с кислотой и выделения свободной кислоты обычным образом. Свободные кислотные формы отчасти отличаются от соответствующих им солевых форм некоторыми физическими свойствами, такими как растворимость 11 в полярных растворителях, но в других отношениях для целей настоящего изобретения соли эквивалентны соответствующей им свободной кислоте. Многие из изотиазолонов формулы (I) содержат один или более асимметрических атомов углерода и как таковые могут существовать в оптически активных формах. Например, предпочтительную группу соединений образуют такие соединения, где R5 означает остаток аминокислоты, такой как аланин, валин, лейцин,треонин и тому подобная. Такие группы содержат один или более асимметрических центров. Рацематы можно расщеплять на их соответствующие энантиомеры путем обычных методов,включая фракционную кристаллизацию, высокоэффективную жидкостную хроматографию,асимметрический анализ и тому подобные. Настоящее изобретение равным образом относится к рацематам и индивидуальным энантиомерам. Нижеследующие примеры иллюстрируют получение производных изотиазолона вышеприведенной формулы (I) и получение промежуточных соединений для их получения. Если не указано ничего другого, то все реагенты получают из коммерческих источников. Многие из арилтиокарбоксамидов, которые используют в качестве исходных веществ, известны или могут быть получены способами,описанными, например, Bell, J. Am. Chem. Soc.,2905 ( 1942 ); Carmellino и др., Eur. J. Med.(1968 ). Примеры получения промежуточных соединений Пример I. 2.2-Дитиобисбензоилхлорид. Смесь 25 г (81,6 ммоль) 2,2'-дитиобисбензойной кислоты и 350 мл тионилхлорида кипятят с обратным холодильником в течение восемнадцати часов. Полученный раствор охлаждают и избыток тионилхлорида удаляют в вакууме. Сырое твердое вещество суспендируют в гексане и целевое соединение получают путем отфильтровывания с выходом 21,2 г; температура плавления от 150 С до 151 С. Это соединение используют без дальнейшей очистки. Пример II. 2.2'-Дитиобис(5-фторбензоилхлорид). Смесь 5,0 г (14,6 ммоль) 2,2'-дитиобис(5 фторбензойной кислоты) и 40 мл тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 4,9 г 2,2'дитиобис(5-фторбензоилхлорида). Это соединение используют без дальнейшей очистки. Пример III. 2,2'-Дитиобис(5-метоксибензоилхлорид). Смесь 0,8 г (2,0 ммоль) 2,2'-дитиобис(5 метоксибензойной кислоты) и 10 мл тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 0,8 г 12 2,2'-дитиобис(5-метоксибензоилхлорида). Это соединение используют без дальнейшей очистки. Пример IV. 2.2'-Дитиобис(5-метилбензоилхлорид). Смесь 0,6 г (1,8 ммоль) 2,2'-дитиобис(5 метилбензойной кислоты) и 10 мл тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 0,3 г 2,2'-дитиобис(5-метилбензоилхлорида). Соединение используют без дальнейшей очистки. Пример V. 2.2'-Дитиобис(4-фторбензоилхлорид). Смесь 5,0 г (14,6 ммоль) 2,2'-дитиобис(4 фторбензойной кислоты) и тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 4,1 г 2,2'-дитиобис(4 фторбензоилхлорида). Соединение используют без дальнейшей очистки. Пример VI. 2,2'-Дитиобис(4-метоксибензоилхлорид). Смесь 2,2 г ( 6,6 ммоль ) 2,2'-дитиобис(4 метоксибензойной кислоты ) и 20 мл тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 2,1 г 2,2'-дитиобис(4-метоксибензоилхлорида). Дальнейшая очистка необязательна. Пример VII. 2,2'-Дитиобис(4-метилбензоилхлорид). Смесь 3,8 г (11,9 ммоль) 2,2'-дитиобис(4 метилбензойной кислоты) и 50 мл тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 3,6 г 2,2'дитиобис(4-метилбензоилхлорида). Соединение используют без дальнейшей очистки. Пример VIII. 2,2'-Дитиобис(3-пиридинкарбонилхлорид). Смесь 1,5 г (4,8 ммоль) 2,2'-дитиобис(3 пиридинкарбоновой кислоты) и 20 мл тионилхлорида вводят во взаимодействие согласно вышеописанной методике с получением 1,3 г 2,2'-дитиобис(3-пиридинкарбонилхлорида). Соединение используют без дальнейшей очистки. Пример IX. 2.2'-Дитиобис(4'-сульфамоилбензанилид) (общая методика). Раствор 5,0 г (14,0 ммоль) 2,2'-дитиобисбензоилхлорида, полученного согласно примеру I, в 50 мл дихлорметана прикапывают к охлажденному до температуры 0 С раствору 6,2 г(36,0 ммоль) 4-(аминосульфонил )анилина в 125 мл пиридина. Смесь перемешивают в течение восемнадцати часов, и полученное твердое вещество отфильтровывают, промывают с помощью 1 н. соляной кислоты, воды и сушат в вакууме, получая 7,6 г сырого продукта. Это сырое вещество в количестве 6,5 г суспендируют в смеси из 50 мл диметилформамида и 60 мл этанола, отфильтровывают и осаждают из отфильтрованного раствора путем добавления 10 мл четырехпроцентного водного раствора гид 13 рокарбоната натрия. Продукт отфильтровывают,промывают этанолом и водой, получая 4,3 г целевого соединения; температура плавления от 311 до 312 С. Пример Х. 2,2'-Дитиобис[4'-сульфамоил(4-метоксибензанилид)]. Это соединение получают согласно общей методике, описанной в примере IX, используя 1,1 г(2,7 ммоль) 2,2'-дитиобис(4 метоксибензоилхлорида) в 10 мл дихлорметана и 1,1 г (6,8 ммоль)4-(аминосульфонил) анилина в 15 мл пиридина. Сырой продукт перекристаллизуют из диметилформамида, этанола и воды,получая 0,8 г целевого соединения. Пример XI. 2,2'-Дитиобис[4'-сульфамоил-(4-метилбензанилид)]. Это соединение получают согласно общей методике, описанной в примере IX, используя 2,0 г(5,5 ммоль) 2,2'-дитиобис(4 метилбензоилхлорида) в 20 мл дихлорметана и 3,4 г (19,9 ммоль) 4-(аминосульфонил) анилина в 40 мл пиридина. Сырой продукт перекристаллизуют из диметилформамида, этанола и воды,получая 2,1 г целевого соединения. ПримерXII. 2,2'-Дитиобис[4'-сульфамоил-(4-фторбензанилид)]. Это соединение получают согласно общей методике, описанной в примере IX, используя 2,0 г(5,2 ммоль) 2,2'-дитиобис(4 фторбензоилхлорида) в 20 мл дихлорметана и 2,2 г (13,0 ммоль) 4-(аминосульфонил) анилина в 30 мл пиридина. Сырой продукт перекристаллизуют из диметилформамида, этанола и воды,получая 2,6 г целевого соединения. Пример XIII. 2,2'-Дитиобис[4'-сульфамоил-(5-метилбензанилид)]. Это соединение получают согласно общей методике, описанной в примере IX, используя 2,0 г(5,3 ммоль) 2,2'-дитиобис(5 метилбензоилхлорида) в 20 мл дихлорметана и 2,3 г (13,3 ммоль) 4-(аминосульфонил) анилина в 30 мл пиридина. Сырой продукт перекристаллизуют из диметилформамида, этанола и воды, получая 1,8 г целевого соединения. Пример XIV. трет.-Бутиловый эфир [S(R,R)]-2-2-[2-(1-трет.-бутоксикарбонил-3 метилбутил-карбамоил)-5-метоксифенилдисульфанил]-4-метоксибензоиламино-4 метилпентановой кислоты (общая методика). Раствор 1,1 г (2,7 ммоль) 2,2'-дитиобис(4 метоксибензоилхлорида), полученного согласно примеру IX, в 10 мл дихлорметана прикапывают к охлажденному до температуры от 0 С до 5 С раствору 1,5 г (6,8 ммоль) гидрохлорида трет.бутилового эфира L-лейцина и 1,6 мл (14,0 ммоль) N-метилморфолина в 25 мл дихлорметана. Полученный в результате раствор перемешивают в течение восемнадцати часов и затем нагревают до комнатной температуры (25 С). Смесь экстрагируют с помощью 0,5 н. соляной кислоты, воды, восьмипроцентного водного 14 раствора гидрокарбоната натрия и рассола. Органический слой сушат над сульфатом магния,отфильтровывают и фильтрат концентрируют в вакууме. Сырой продукт перекристаллизуют из этилацетата, получая 1,2 г целевого соединения. Пример XV. трет.-Бутиловый эфир [S(R,R)]-2-2-[2-(1-трет.-бутоксикарбонил-3 метилбутил-карбамоил)-4-фторфенилдисульфанил]-5-фторбензоиламино-4-метилпентановой кислоты. Это соединение получают согласно общей методике, описанной в примере XIV, используя 2,0 г(5,2 ммоль) 2,2'-дитиобис(5 фторбензоилхлорида) в 20 мл дихлорметана, 2,5 г (11,4 ммоль) гидрохлорида трет.-бутилового эфира L-лейцина и 1,4 мл (12,5 ммоль) Nметилморфолина в 30 мл дихлорметана. Сырой продукт перекристаллизуют из этилацетата, получая 1,8 г целевого соединения. Пример XVI. трет.-Бутиловый эфир [S(R,R)]-2-2-[2-(1-трет.-бутоксикарбонил-3 метилбутил-карбамоил)-5-метилфенилдисульфанил]-4-метилбензоиламино-4 метилпентановой кислоты. Это соединение получают согласно общей методике, описанной в примере XIV, используя 1,8 г(7,8 ммоль) 2,2'-дитиобис(4 метилбензоилхлорида) в 20 мл дихлорметана,4,0 г (17,9 ммоль) гидрохлорида трет.бутилового эфира L-лейцина и 4,6 мл (41 ммоль) N-метилморфолина в 60 мл дихлорметана. Сырой продукт перекристаллизуют из этилацетата, получая 1,9 г целевого соединения. Пример XVII. трет.-Бутиловый эфир [S(R,R)]-2-2-[3-(1-трет.-бутоксикарбонил-3 метилбутилкарбамоил)пиридин-2-илдисульфанил]пиридин-3-карбониламино-4-метилпентановой кислоты. Это соединение получают согласно общей методике, описанной в примере XIX, используя 0,8 г(2,1 ммоль) 2,2'-дитиобис(3 пиридинкарбонилхлорида) в 10 мл дихлорметана и 1,5 г (5,7 ммоль) гидрохлорида трет.бутилового эфира L-лейцина в 20 мл пиридина. Сырой продукт перекристаллизуют из этилацетата, получая 1,9 г целевого соединения. Пример XVIII. трет.-Бутиловый эфир [S(R,R)]-2-2-[2-(1-карбокси-2-метилбутилкарбамоил)-фенилдисульфанил]бензоиламино-3-метилпентановой кислоты. Раствор 10,0 г (53,2 ммоль) трет.бутилового эфира L-изолейцина в 100 мл дихлорметана смешивают с 5,6 г (55,0 ммоль) Nметилморфолина. Полученный в результате раствор охлаждают до температуры 0 С и вводят во взаимодействие путем быстрого прикапывания раствора 8,3 г ( 24,2 ммоль ) 2,2'-дитиобисбензоилхлорида (из примера I) в 100 мл дихлорметана, поддерживая температуру ниже 0 С. Смесь перемешивают в течение одного часа при температуре 0 С и затем в течение восемнадцати часов при комнатной температуре. 15 Образовавшееся твердое вещество отфильтровывают, промывают водой и сушат в вакууме,получая 6,5 г целевого соединения. Фильтрат промывают водой, 0,5 М соляной кислотой, водой, сушат над сульфатом натрия, отфильтровывают и фильтрат выпаривают в вакууме, получая дополнительные 6,9 г целевого соединения сопоставимой чистоты.Пример[S-(R,R)]-2-2-[2-(1 Карбокси-2-метилбутилкарбамоил) фенилдисульфанил]-бензоиламино-3-метилпентановая кислота. Раствор 13,2 г (20,5 ммоль) полученного согласно примеру XVIII сложного трет.бутилового эфира в 50 мл трифторуксусной кислоты перемешивают в течение восемнадцати часов при комнатной температуре. Растворитель удаляют в вакууме, а остаток растворяют в 50 мл дихлорметана. Дихлорметан удаляют в вакууме, остаток порошкуют с помощью 150 мл смеси диэтилового эфира с пентаном в объемном соотношении 2:1 и полученное в результате твердое вещество отфильтровывают. После промывки с помощью 50 мл смеси диэтилового эфира с пентаном в соотношении 2:1 и затем пентана твердое вещество высушивают в вакууме и идентифицируют как 9,9 г целевого соединения; температура плавления от 211 до 213 С. Пример[S-(R,R)]-2-2-[2-(1-трет.-бутоксикарбонил-3-метилбутилкарбамоил)-5-метоксифенилдисульфанил]-4-метоксибензоиламино 4-метилпентановой кислоты и 1 мл анизола в 10 мл дихлорметана, охлажденный примерно до температуры 0 С, обрабатывают путем прикапывания 10 мл трифторуксусной кислоты. Смесь оставляют стоять для нагревания до комнатной температуры. Спустя четыре часа добавляют 5 мл толуола и растворители удаляют в вакууме. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 0,7 г целевого соединения. Пример[S-(R,R)]-2-2-[2-(1 Карбокси-3-метилбутилкарбамоил)-4-фторфенилдисульфанил]-5-фторбензоиламино-4 метилпентановая кислота. Это соединение получают согласно общей методике, описанной в примере XX, используя 1,8 г (2,6 ммоль) трет.-бутилового эфира [S(R,R)]-2-2-[2-(1-трет.-бутоксикарбонил-3 метилбутилкарбамоил)-4-фторфенилдисульфанил]-5-фторбензоиламино-4-метилпентановой кислоты в 20 мл дихлорметана, 2 мл анизола и 20 мл трифторуксусной кислоты. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 0,9 г целевого соединения.[S-(R,R)]-2-2-[2-(1 Карбокси-3-метилбутилкарбамоил)-5-метилфенилдисульфанил]-4-метилбензоиламино-4 метилпентановая кислота. Следуют общей методике примера XX, используя 1,9 г (2,8 ммоль) трет.-бутилового эфира[S-(R,R)]-2-2-[2-(1-трет.-бутоксикарбонил-3-метил-бутилкарбамоил)-5-метилфенилдисульфанил]-4-метилбензоиламино-4 метилпентановой кислоты в 20 мл дихлорметана, 2,0 мл анизола и 10 мл трифторуксусной кислоты. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 1,1 г целевого соединения. Пример[S-(R,R)]-2-2-[3-(1 Карбокси-3-метилбутилкарбамоил)пиридин-2 ил-дисульфанил]пиридин-3-карбониламино-4-метилпентановая кислота. Следуют общей методике примера XX, используя 1,9 г (2,9 ммоль) трет.-бутилового эфира[S-(R,R)]-2-2-[3-(1-трет.-бутоксикарбонил-3-метилбутилкарба-моил)пиридин-2 илдисульфанил]пиридин-3-карбониламино-4 метилпентановой кислоты в 20 мл дихлорметана, 1,5 мл анизола и 10 мл трифторуксусной кислоты. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 1,2 г целевого соединения. Пример XXIV. 2-Хлор-5-нитробензамид. Смесь 15,0 г (74,0 ммоль) 2-хлор-5 нитробензойной кислоты с 200 мл дихлорметана вводят во взаимодействие с 16,2 мл (186,0 ммоль) оксалилхлорида и каталитическим количеством диметилформамида. Реакционную смесь перемешивают в течение трех часов при температуре 25 С. Растворитель удаляют в вакууме, а остаток снова растворяют в 200 мл дихлорметана. Раствор охлаждают до температуры 0 С, и через охлажденный раствор в течение пяти минут барботируют аммиак, вследствие чего из раствора осаждается продукт, который отфильтровывают, получая 6,8 г целевого соединения; температура плавления от 174 до 175 С. Пример XXV. 2,2'-Дитиобис(5-нитробензамид). К кипящему с обратным холодильником раствору 6,8 г (33,0 ммоль) 2-хлор-5 нитробензамида, полученного согласно примеруXXIV, в 90 мл этанола порциями добавляют 2,6 г (20,5 ммоль) нонагидрата сульфида натрия и 0,7 г (20,5 ммоль) серы. Смесь кипятят с обратным холодильником в течение одного часа, затем охлаждают до комнатной температуры,вследствие чего образуется твердое вещество,которое отфильтровывают, получая 2,6 г целевого соединения; температура плавления от 266 С до 269 С. Пример XXVI. 2,2'-Дитиобис(5-аминобензамид). 2,6 г (7,0 ммоль) 2,2'-Дитиобис(5-нитробензамида) порциями добавляют к кипящей с 17 обратным холодильником суспензии 8,7 г восстановленного железа в 65 мл воды, содержащей 0,1 мл уксусной кислоты. Полученную в результате суспензию кипятят с обратным холодильником в течение двух часов, затем охлаждают до комнатной температуры. Суспензию сильно подщелачивают до значения рН, равного 11, путем добавления 14 мл 1 н. раствора гидроксида натрия. Щелочную смесь отфильтровывают и к раствору добавляют уксусную кислоту до установления значения рН, равного 7,0. Во время барботирования кислорода в раствор значение рН поддерживают равным 6-7 путем добавления уксусной кислоты. Когда значение рН начинает стабилизироваться, постепенно образуется твердое вещество. Путем отфильтровывания получают 1,1 г продукта; температура плавления от 188 до 190 С. Пример XXVII. 2,2'-Дитиобис(5-ацетиламино)бензамид. 1,1 г (3,4 ммоль) 2,2'-Дитиобис(5 аминобензамида) растворяют в 6 мл ледяной уксусной кислоты при нагревании на паровой бане и вводят во взаимодействие с 0,7 мл (7,2 ммоль) уксусного ангидрида. После охлаждения из раствора осаждается продукт. Дополнительно добавляют 4 мл ледяной уксусной кислоты и 0,1 мл уксусного ангидрида и смесь кипятят с обратным холодильником в течение тридцати минут, после чего охлаждают до комнатной температуры. Сырой продукт отфильтровывают и перекристаллизуют из смеси диметилформамида с диметилсульфоксидом и водой, получая 0,8 г целевого продукта; температура плавления от 301 до 303 С. ПримерXXVIII. 2,2'-Дитиобис[N-4[(ацетиламино)сульфонил]фенилбензамид]. Соединение получают согласно общей методике, описанной в примере IX, используя 3,0 г(8,0 ммоль) 2,2'-дитиобисбензоилхлорида в 30 мл дихлорметана и 5,6 г (26,0 ммоль) 4[(ацетиламино)сульфонил]анилина в 100 мл пиридина. Сырой продукт очищают на колонке с силикагелем, используя смесь хлороформа с метанолом в объемном соотношении 1 : 1 в качестве подвижной фазы. Чистые фракции объединяют, концентрируют в вакууме и полученное твердое вещество кристаллизуют из смеси этанола с водой в объемном соотношении 1:1, получая 0,5 г целевого соединения; температура плавления от 180 до 182 С. Пример XXIX. 2-Меркапто-N-(4-сульфамоилфенил)бензамид. 0,1 г (0,2 ммоль) 2,2'-Дитиобис(4'сульфамоилбензанилида) растворяют в 4 мл диметилформамида и 1,6 мл 2,7 %-ного водного раствора дигидрофосфата натрия. Добавляют 0,1 г (0,7 ммоль) дитиотреитола и смесь перемешивают в течение получаса при температуре 25 С. Добавляют 10 мл 10 %-ного водного раствора муравьиной кислоты для осаждения продукта, который отфильтровывают, промывают 18 водой и диэтиловым эфиром, получая 72 мг целевого соединения; температура плавления от 230 до 231 С. Пример XXX. 2-2-[2-(карбоксиметилкарбамоил)фенилдисульфанил]бензоиламиноуксусная кислота. К раствору 18 г (0,24 моль) глицина в 75 мл абсолютного этанола добавляют 100 мл раствора этилата натрия, полученного путем растворения 4,6 г (0,2 моль) натрия. Смесь охлаждают до температуры -60 С и порциями добавляют 17,2 г(0,05 моль) 2,2'дитиобисбензоилхлорида. Смесь доводят до комнатной температуры и перемешивают в течение ночи. Твердый продукт отфильтровывают, и фильтрат подкисляют с помощью 2 н. соляной кислоты. Твердый продукт отфильтровывают, растворяют в растворе гидрокарбоната натрия и полученный раствор фильтруют. Фильтрат подкисляют с помощью соляной кислоты, твердый продукт отфильтровывают и сушат при температуре 110 С в течение двадцати четырех часов, получая 6,8 г целевого соединения; температура плавления от 213 до 215 С. Пример XXXI. 2-2-[2-(1-Карбокси-2 метилпропилкарбамоил)фенилдисульфанил]бензоиламино-3-метилбутановая кислота. Используя применяемую в примере XXX методику, 17,8 г (0,15 моль) D, L-валина вводят во взаимодействие с 17,2 г (0,05 моль) 2,2'дитиобисбензоилхлорида с получением 11,4 г целевого соединения после перекристаллизации из уксусной кислоты; температура плавления от 226,5 до 227,5 С. Пример XXXII. 4-2-[2-(3-Карбоксипропилкарбамоил)фенилдисульфанил]бензоиламинобутановая кислота. Следуя описанной в примере XXX методике, 16 г (0,15 моль) 4-аминобутановой кислоты вводят во взаимодействие с 10,8 г (0,03 моль) 2,2'-дитиобисбензоилхлорида с получением 7,14 г целевого соединения. Пример XXXIII. (2-Пиридин-2-илэтил) амид 8-хлор-[1,3]диоксол[4,5-g]хинолин-7-карбоновой кислоты. К раствору 23,3 г (0,10 моль) 8-гидрокси[1,3]диоксол[4,5-g]хинолин-7-карбоновой кислоты (J. Med. Chem., 11 160 (1968 в 500 мл 1,2-дихлорэтана добавляют 35 мл (0,47 моль) тионилхлорида и 1 мл диметилформамида. Смесь кипятят с обратным холодильником в течение ночи, концентрируют до объема 100 мл и твердое вещество отфильтровывают, получая 18,7 г 8-хлор-[1,3]диоксол[4,5-g]хинолин-7 карбонилхлорида, который используют без очистки. К раствору 13,5 г (примерно 0,05 моль) вышеполученного соединения в 1000 мл 1,2 дихлорэтана добавляют 10 мл (0,07 моль) триэтиламина и смесь охлаждают до 15 С. К этой смеси добавляют 6,25 г (0,51 моль) 2-(2 аминоэтил)пиридина и смесь перемешивают в 19 течение двадцати четырех часов при комнатной температуре. Реакцию прекращают путем добавления 500 мл воды. Органический слой промывают водой, сушат над сульфатом магния и концентрируют, получая 16 г целевого соединения; температура плавления от 145 до 146 С. Пример XXXIV. (2-Пиридин-2-илэтил) амид 8-меркапто-[1,3]диоксол[4,5-g]хинолин-7 карбоновой кислоты. К раствору 10,4 г (0,025 моль) (2-пиридин 2-илэтил)амида 8-хлор-[1,3]диоксол-[4,5g]хинолин-7-карбоновой кислоты в 100 мл этанола добавляют 7,2 г (0,1 моль) гидросульфида натрия и смесь кипятят с обратным холодильником в течение трех часов. Смесь охлаждают и твердое вещество отфильтровывают, промывают этанолом и затем водой. Фильтрат концентрируют и твердый остаток суспендируют в воде, отфильтровывают и перекристаллизуют из этанола, получая 6,8 г целевого соединения; температура плавления от 258 до 260 С. Пример XXXV. (2-Диэтиламиноэтил) амид 4-хлор-2-фенилпиримидин-5-карбоновой кислоты. Согласно описанной в примере XXXIII методике, 15,5 г (0,072 моль) 4-гидрокси-2 фенилпиримидин-5-карбоновой кислоты (J.Med. Chem., 7, 68 (1964 вводят во взаимодействие с 8,5 г (0,073 моль) 2-диэтиламиноэтиламина, получая 18 г целевого соединения после перекристаллизации из бензола; температура плавления от 40 до 45 С. Пример XXXVI. (2-Диэтиламиноэтил) амид-4-меркапто-2-фенилпиримидин-5-карбоновой кислоты. Согласно описанной в примере XXXIV методике, 6,4 г (0,02 моль) (2-диэтиламиноэтил) амида 4-хлор-2-фенилпиримидин-5-карбоновой кислоты вводят во взаимодействие с 4,8 г (0,066 моль) гидросульфида натрия с получением 4,2 г целевого соединения; температура плавления от 178 до 180 С. Пример XXXVII. (2-Пиридин-2-илэтил) амид 5-хлор-3-метил-1-фенил-1 Н-пиразол-4 карбоновой кислоты. Согласно описанной в примере XXXIII методике, 28,4 г (0,13 моль) 5-гидрокси-3-метил-1 фенил-1 Н-пиразол-4-карбоновой кислоты вводят во взаимодействие с 15,9 г (0,13 моль) 2-(2 аминоэтил)пиридина, получая целевое соединение, которое используют без очистки. Пример XXXVIII. (2-Пиридин-2-илэтил) амид 5-меркапто-3-метил-1-фенил-1 Н-пиразол 4-карбоновой кислоты. Согласно описанной в примере XXXIV методике, 29,3 г (0,087 моль) (2-пиридин-2-илэтил) амида 5-хлор-3-метил-1-фенил-1 Н-пиразол-4 карбоновой кислоты вводят во взаимодействие с 19,3 г (0,27 моль) гидросульфида натрия в целлозольве, получая 24,0 г целевого соединения,которое используют в примере XXII без очистки. 20 Пример XXXIX. Бензиламид 4-хлор-2 диметиламинопиримидин-5-карбоновой кислоты. Согласно описанной в примере XXXIII методике, 61,6 г (0,337 моль) 2-диметиламино-4-гидроксипиримидин-5-карбоновой кислоты вводят во взаимодействие с 37 г (0,34 моль) 2-аминометилпиридина, получая 14,3 г целевого соединения, которое используют без очистки. Пример XL. Бензиламид 2-диметиламино-4-меркаптопиримидин-5-карбоновой кислоты. Согласно описанной в примере XXXIV методике, 14,3 г (0,045 моль) бензиламида 4-хлор 2-диметиламинопиримидин-5-карбоновой кислоты вводят во взаимодействие с 12 г(0,21 моль) гидросульфида натрия, получая 5,7 г целевого соединения; температура плавления от 175 до 178 С. Пример XXXXI. Бензиламид 4-хлор-2 фенилпиримидин-5-карбоновой кислоты. Согласно описанной в примере XXXIII методике, 31,0 г (0,143 моль) 4-гидрокси-2 фенилпиримидин-5-карбоновой кислоты вводят во взаимодействие с 60 мл (0,82 моль) тионилхлорида, получая 37,8 г сырого хлорангидрида хлоркарбоновой кислоты. Часть хлорангидрида кислоты в количестве 5,0 г (19,8 ммоль) вводят во взаимодействие с 2,12 г (19,8 ммоль) бензиламина, получая 6,27 г целевого соединения,которое используют без очистки. Пример ХХХХII. Бензиламид 4-меркапто 2-фенилпиримидин-5-карбоновой кислоты. Согласно описанной в примере XXXIV методике, 5,8 г (17,9 ммоль) бензиламида 4-хлор 2-фенилпиримидин-5-карбоновой кислоты вводят во взаимодействие с 5,1 г (72 ммоль) гидросульфида натрия, получая 3,75 г целевого соединения; температура плавления от 189 до 193 С. Получение целевых продуктов Пример 1. 4-(3-Оксо-3 Н-бензо[d]изотиазол-2-ил)бензолсульфонамид. К раствору 60 мл метанола и 60 мл тетрагидрофурана, охлажденному до температуры 0 С, прикапывают 3,9 г (30,0 ммоль) хлоркарбонилсульфенилхлорида. Смесь перемешивают при температуре 0 С в течение двадцати минут и затем добавляют 9,0 г (29,2 ммоль) 2-тио-N-(4 сульфамоилфенил) бензамида. Реакционную смесь перемешивают при температуре 0 С в течение получаса, нагревают до комнатной температуры и перемешивают в течение восемнадцати часов. Суспензию разбавляют с помощью 200 мл диэтилового эфира, перемешивают в течение одного часа и твердое вещество отфильтровывают. После промывки свежим диэтиловым эфиром твердое вещество сушат в вакууме, получая 7,8 г целевого соединения. Дополнительные 2,2 г получают путем концентрирования маточного раствора и порошкования 21 остатка с помощью диэтилового эфира. Температура плавления обеих фракций составляет от 283 до 285 С. Пример 2. [S-(R,R)]-3-Метил-2-(3-оксо 3 Н-бензо[d]изотиазол-2-ил)пентановая кислота. К перемешиваемой суспензии 5,3 г (10,0 ммоль) [S-(R,R)]-2-2-[2-(1-карбокси-2-метилбутилкарбамоил)фенилдисульфанил] бензоиламино-3-метилпентановой кислоты (из примера XIX) в 200 мл дихлорметана прикапывают 2,4 г (15,0 ммоль) брома. Реакционную смесь перемешивают при комнатной температуре в течение двух часов и концентрируют досуха в вакууме. Остаток порошкуют с помощью дихлорметана. Дихлорметан удаляют путем выпаривания в вакууме вместе с избытком брома. Остаток распределяют между дихлорметаном и пятипроцентным водным раствором гидрокарбоната натрия, используя по 200 мл каждого. Водный слой отделяют, промывают свежим дихлорметаном и подкисляют до значения рН,равного 1,5, с помощью 6,0 М соляной кислоты. Подкисленный водный раствор экстрагируют двукратно по 75 мл дихлорметаном. Органические слои объединяют, промывают водой, сушат над сульфатом магния, отфильтровывают и фильтрат концентрируют досуха в вакууме, получая 4,8 г целевого соединения; температура плавления от 50 до 52 С. Пример 3. N-Ацетил-4-(3-оксо-3 Н-бензо[d] изотиазол-2-ил)бензолсульфонамид (общая методика). Раствор 1,0 г (1,5 ммоль) 2,2'-дитиобис-N4-[(ацетиламино)сульфонил]фенил-бензамида в 1 мл диметилформамида разбавляют с помощью 20 мл дихлорметана, вследствие чего выпадает мелкий осадок. К смеси прикапывают раствор 0,3 г (1,8 ммоль) брома в 5 мл дихлорметана. Постепенно образуется однородный раствор, после чего снова осаждается твердое вещество, которое отфильтровывают и перекристаллизуют из смеси уксусной кислоты с водой в объемном соотношении 1:1, получая 0,6 г целевого соединения; температура плавления от 254 до 255 С. Пример 4. N-(3-Оксо-2,3-дигидробензо[d] изотиазол-5-ил)ацетамид. Согласно общей методике, описанной в примере 3, суспензию 2,0 г (4,8 ммоль) 2,2'дитиобис(5-ацетиламино)бензамида в 4 мл диметилсульфоксида и 20 мл дихлорметана вводят во взаимодействие с 0,8 г (5,0 ммоль) брома в 10 мл дихлорметана. Твердый продукт отфильтровывают и перекристаллизуют из 5 мл горячей уксусной кислоты, получая 0,8 г целевого соединения. Пример 5. 4-(5-Метокси-3-оксо-3 Н-бензо 22 лида)] в 2 мл диметилформамида и 20 мл дихлорметана вводят во взаимодействие с раствором 0,2 г (1,3 ммоль) брома в 10 мл дихлорметана. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 0,2 г целевого соединения. Пример 6. 4-(6-Метил-3-оксо-3 Н-бензо[d] изотиазол-2-ил)бензолсульфонамид. Согласно общей методике, описанной в примере 3, суспензию 2,1 г (3,2 ммоль) 2,2'дитиобис[4'-сульфамоил-(4-метилбензанилида)] (из примера XI) в смеси 4 мл диметилформамида с 40 мл дихлорметана вводят во взаимодействие с раствором 0,6 г (3,6 ммоль) брома в 15 мл дихлорметана. Сырой продукт перекристаллизуют из смеси диметилформамида с водой, получая 0,9 г целевого соединения. Пример 7. 4-(6-Фтор-3-оксо-3 Н-бензо[d] изотиазол-2-ил)бензолсульфонамид. Согласно общей методике, описанной в примере 3, суспензию 1,8 г (2,7 ммоль) 2,2'дитиобис[4'-сульфамоил-(4-фторбензанилида)] (из примера XII) в 4 мл диметилформамида и 30 мл дихлорметана вводят во взаимодействие с раствором 0,5 г (3,2 ммоль) брома в 20 мл дихлорметана. Сырой продукт перекристаллизуют из смеси диметилформамида с водой, получая 1,1 г целевого соединения; температура плавления от 265 до 266 С. Пример 8. 4-(5-Метил-3-оксо-3 Н-бензо[d] изотиазол-2-ил)бензолсульфонамид. Согласно общей методике, описанной в примере 3, суспензию 1,1 г (1,7 ммоль) 2,2'дитиобис[4'-сульфамоил-(5-метилбензанилида)](из примера XIII ) в 2 мл диметилформамида и 20 мл дихлорметана обрабатывают раствором 0,3 г (1,9 ммоль ) брома в 10 мл дихлорметана. Сырое соединение перекристаллизуют из смеси диметилформамида с водой, получая 0,4 г целевого соединения. Пример 9. (S)-4-Метил-2-(6-метокси-3 оксо-3 Н-бензо[d]изотиазол-2-ил)пентановая кислота. Согласно общей методике, описанной в примере 3, суспензию 1,4 г (2,3 ммоль) [S(R,R)]-2-2-[2-(1-карбокси-3-метилбутилкарбамоил)-5-метоксифенил-дисульфанил]-4 метоксибензоиламино-4-метилпентановой кислоты (из примера XX) в 4 мл ацетонитрила и 10 мл дихлорметана обрабатывают раствором 0,4 г ( 2,6 ммоль ) брома в 10 мл дихлорметана. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 0,8 г целевого соединения. Пример 10. (S)-4-Метил-2-(5-фтор-3-оксо 3 Н-бензо[d]изотиазол-2-ил)пентановая кислота. Согласно общей методике, описанной в примере 3, суспензию 2,1 г (3,6 ммоль) -[S(R,R)]-2-2-[2-(1-карбокси-3-метилбутилкарбамоил)-4-фторфенилдисульфанил]-5-фторбензоиламино-4-метилпентановой кислоты (из примера XXI) в 8 мл ацетонитрила и 25 мл ди 23 хлорметана обрабатывают раствором 0,7 г (4,4 ммоль) брома в 15 мл дихлорметана. Сырое соединение перекристаллизуют из смеси метанола с водой, получая 1,4 г целевого соединения; температура плавления от 161 до 162 С. Пример 11. (S)-4-Метил-2-(6-метил-3-оксо 3 Н-бензо[d]изотиазол-2-ил)пентановая кислота. Согласно общей методике, описанной в примере 3, суспензию 1,8 г (3,2 ммоль) [S(R,R)]-2-2-[2-(1-карбокси-3-метилбутилкарбамоил)-4-метилфенилдисульфанил]-5-метилбензоиламино-4-метилпентановой кислоты (из примера XXII) в 5 мл ацетонитрила и 20 мл дихлорметана вводят во взаимодействие с раствором 0,6 г (3,7 ммоль) брома в 10 мл дихлорметана. Сырой продукт перекристаллизуют из смеси метанола с водой, получая 1,3 г целевого соединения. Пример 12. (S)-4-Метил-2-(3-оксо-3 Низотиазоло[5,4-b]пиридин-2-ил)пентановая кислота. Согласно общей методике, описанной в примере 3, суспензию 2,1 г (4,1 ммоль) [S(R,R)]-2-2-[3-(1-карбокси-3-метилбутилкарбамоил)пиридин-2-илдисульфанил]-пиридин-3 карбониламино-4-метилпентановой кислоты(из примера XXIII) в 3 мл ацетонитрила и 10 мл дихлорметана вводят во взаимодействие с раствором 0,3 г (1,8 ммоль) брома в 8 мл дихлорметана. Сырое соединение перекристаллизуют из смеси метанола с водой, получая 0,3 г целевого соединения. Пример 13. 2-(3-Оксо-3 Н-бензо[d]изотиазол-2-ил)уксусная кислота. К суспензии 6,0 г (13,3 ммоль) 2-2-[2(карбоксиметилкарбамоил)фенилдисульфанил] бензоиламиноуксусной кислоты (из примераXXX ) в 50 мл тетрахлорида углерода в течение одного часа раствор 0,83 мл (16,1 ммоль ) брома в 15 мл тетрахлорида углерода. Твердый продукт отфильтровывают и его часть в количестве 6,0 г в 25 мл уксусной кислоты кипятят с обратным холодильником в течение одного часа. Смесь охлаждают и твердый продукт отфильтровывают. В результате перекристаллизации из 90 %-ного метилцеллозольва с последующим высушиванием при температуре 50 С в течение двадцати четырех часов получают 3,0 г целевого соединения; температура плавления от 236 до 238 С. Пример 14. 3-Метил-2-(3-оксо-3 Н-бензо[d] изотиазол-2-ил)бутановая кислота. Согласно описанной в примере 13 методике, 6,0 г (13,6 моль)2-2-[2-(1-карбокси-3 метилбутилкарбамоил)фенилдисульфанил] бензоиламино-3-метилбутановой кислоты вводят во взаимодействие с бромом, получая 2,25 г целевого соединения; температура плавления от 166 до 168 С. Пример 15. 2-Фенил-3-оксо-3 Н-бензо[d] изотиазол. 24 Согласно описанной в примере 13 методике, 20 г ( 43,7 ммоль ) 2,2'-дитиобисбензанилида (получают как описано в J. Med. Chem.,28,1772 ( 1985 вводят во взаимодействие с бромом, получая 10,55 г сырого изотиазола. После кристаллизации из абсолютного этанола и затем изопропанола получают 5,4 г 3-фенил-3 оксо-3 Н-бензо[d]изотиазола; температура плавления от 143 до 145 С. Пример 16. 2-(4-Ацетилфенил)-3-оксо-3 Нбензо[d]изотиазол. К 7,0 г ( 12,9 ммоль ) 2,2'-дитиобис[4'ацетил(бензанилида)] в 50 мл тетрахлорида углерода в течение одного часа прикапывают раствор 0,7 мл (13,5 ммоль ) брома в 5 мл тетрахлорида углерода. Твердый осадок отфильтровывают. Часть твердого вещества в количестве 1,3 г суспендируют в течение тридцати минут в растворе гидрокарбоната натрия. Твердый продукт отфильтровывают и высушивают при температуре 70 С в течение двадцати четырех часов, получая 0,87 г целевого соединения; температура плавления от 183 до 185 С. Пример 17. 4-(3-Оксо-2 Н-бензо[d]изотиазол-2-ил )бутановая кислота. Согласно описанной в примере 13 методике, 2,4 г (5,0 ммоль) 4-2-[2-(3-карбоксипропилкарбамоил)фенилдисульфанил]бензоиламинобутановой кислоты (из примераXXXII) вводят во взаимодействие с бромом,получая 0,85 г сырого изотиазолона, который перекристаллизуют из изопропанола, получая 0,76 г целевого соединения; температура плавления от 97 до 99 С. Пример 18. 2-(4-Метилпиридин-2-ил)-3 оксо-3H-бензо[d]изотиазол. Согласно способу Фишера и Харни (Arzneimittel Forsch., 14, 1301 (1964, 5,4 г (0,05 моль) 2-амино-4-метилпиридина в 50 мл пиридина при температуре 10 С вводят во взаимодействие с 10,3 г(0,05 моль) 2 хлорсульфенилбензоилхлорида. Смесь нагревают до температуры 50 С и выдерживают при этой температуре в течение двух часов, затем охлаждают до температуры 25 С и фильтруют. Твердый продукт перекристаллизуют из бензола, получая 4,5 г целевого соединения; температура плавления от 195 до 196,5 С. Пример 19. 4-(3-Оксо-3 Н-бензо[d]изотиазол-2-ил)фенилуксусная кислота. К смеси 7,55 г (0,05 моль) 4-аминофенилуксусной кислоты и 15,15 г (0,15 моль) триэтиламина в 25 мл этилцеллозольва добавляют 10,3 г(1964. Смесь перемешивают при комнатной температуре в течение трех часов, концентрируют в вакууме и к остатку добавляют воду. Смесь подкисляют с помощью соляной кислоты и отфильтровывают, получая 9,9 г целевого соединения; температура плавления от 173 до 175 С. 25 Пример 20. 2-[2-(2-Пиридинил)этил][1,3]диоксол[4,5-g]изотиазол[4,5-c]хинолин 3(2 Н)-он. К 4,1 г (0,012 моль) (2-пиридин-2-илэтил) амида 8-меркапто-[1,3]диоксол[4,5-g]-хинолин 7-карбоновой кислоты (из примера XXXIV) и 5 мл (0,035 моль) триэтиламина в 750 мл метанола добавляют 2,95 г (0,012 моль) иода в 100 мл метанола. Смесь кипятят с обратным холодильником в течение двух часов, охлаждают и затем концентрируют с получением масла. Остаток суспендируют в воде, твердый продукт отделяют и перекристаллизуют из этанола, получая 3,5 г целевого соединения; температура плавления от 200 до 201 С. Пример 21. 2-[2-(Диэтиламино)этил]-6 фенилизотиазол[5,4-d]пиримидин-3(2 Н)-он. Согласно описанной в примере 20 методике, 3,3 г (0,01 моль) (2-диэтиламиноэтил)-амида 4-меркапто-2-фенилпиримидин-5-карбоновой кислоты (из примера XXXVI) вводят во взаимодействие с 2,54 г (0,01 моль) иода, получая 2,25 г целевого соединения после перекристаллизации из изопропанола; температура плавления от 106 до 107 С. Пример 22. 3-Метил-1-фенил-5-[2-(2 пиридинил)этил]-1 Н-пиразол[4,5-d]изотиазол-4(5 Н)-он. Согласно описанной в примере 20 методике, 24 г (0,069 моль) (2-пиридин-2-ил-этил) амида 5-меркапто-3-метил-1-фенил-1 Н-пиразол-4 карбоновой кислоты (из примера XXXVIII ) вводят во взаимодействие с 17,6 г (0,069 моль ) иода, получая 4,8 г целевого соединения после двух перекристаллизаций из изопропанола; температура плавления от 137 до 138 С. Пример 23. 6-(Диметиламино)-2-(2 пиридинилметил)дизотиазол[5,4-d]пиримидин-3(2 Н)-он. Согласно описанной в примере 20 методике, 5,7 г (0,02 моль) бензиламида 2 диметиламино-4-меркаптопиримидин-5 карбоновой кислоты ( из примера XL ) вводят во взаимодействие с 5,0 г (0,02 моль) иода, получая 2,27 г целевого соединения после кристаллизации из этанола; температура плавления от 145 до 146 С. Пример 24. 2-Бензил-6-фенилизотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 2,0 г ( 6,22 моль ) бензиламида 4-меркапто-2 фенилпиримидин-5-карбоновой кислоты ( из примера XXXXII ) вводят во взаимодействие с 1,74 г (6,8 моль) иода, получая 1,74 г целевого соединения после кристаллизации из изопропанола; температура плавления от 166 до 167 С. Пример 25. 4-(3-Оксо-3 Н-бензо[d]изотиазол-2-ил)фенилуксусная кислота. Согласно описанной в примере 13 методике, 1,5 г (2,6 ммоль) 4-2-[2-(4-карбоксиметилфенилкарбамоил)фенилдисульфанил] бензоиламинофенилуксусной кислоты вводят во 26 взаимодействие с бромом, получая 0,62 г целевого соединения; температура плавления от 173 до 175 С. Пример 26. Метиловый эфир (S)-2,6-бис(3 оксо-3 Н-бензо[d]изотиазол-2-ил)гексановой кислоты. Согласно описанной в примере 18 методике, 0,77 г (3,3 ммоль) дигидрохлорида метилового эфира лизина и 2,1 мл (15 ммоль) триэтиламина в 60 мл дихлорметана вводят во взаимодействие с 1 г (3,0 ммоль) 2-хлорсульфенилбензоилхлорида. Смесь перемешивают при комнатной температуре в течение восемнадцати часов, затем раствор промывают с помощью 1 н. соляной кислоты, насыщенного раствора гидрокарбоната натрия и рассола. Раствор сушат и концентрируют, получая 1 г масла. Соединение очищают путем хроматографии на диоксиде кремния при использовании хлороформа и смеси хлороформа с метанолом в соотношении 98 : 2 в качестве элюирующего средства, получая 0,16 г целевого соединения в виде стекла. 1(м, 2 Н). Пример 27. 2-(2-Морфолин-4-илэтил)-6 фенилизотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 2,0 г (5,81 ммоль) (2-морфолин-4-илэтил) амида 4-меркапто-2-фенилпиримидин-5 карбоновой кислоты обрабатывают с помощью 1,47 г (5,81 ммоль) иода, получая 1,21 г целевого соединения после перекристаллизации из изопропанола; температура плавления от 163 до 165 С. Пример 28. 2-Фенетил-6-фенилизотиазол [5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 2,0 г (5,96 ммоль) фенэтиламида 4-меркапто 2-фенилпиримидин-5-карбоновой кислоты обрабатывают с помощью 1,66 г (6,56 ммоль) иода, получая 1,42 г целевого соединения после перекристаллизации из изопропанола; температура плавления от 144 до 147 С. Пример 29. 6-Фенил-2-пиридин-2-илметилизотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 2,0 г (6,20 ммоль) (пиридин-2-ил-метил) амида 4-меркапто-2-фенилпиримидин-5-карбоновой кислоты обрабатывают с помощью 1,73 г (6,82 ммоль) иода, получая 1,62 г целевого соединения после перекристаллизации из изопропанола; температура плавления от 154 до 156 С. Пример 30. 6-Фенил-2-(2-пиридин-2-илэтил)изотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 14,0 г (41,6 ммоль) (2-пиридин-2-илэтил)амида 4-меркапто-2-фенилпиримидин-5 27 карбоновой кислоты обрабатывают с помощью 10,6 г (41,7 ммоль) иода, получая 12,7 г целевого соединения после перекристаллизации из этанола; температура плавления от 132 до 133 С. Пример 31. 6-Пиперидин-1-ил-2-(2-пиридин-2-илэтил)изотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 33,0 г (96,2 ммоль) (2-пиридин-2-илэтил)амида 4-меркапто-2-пиперидин-1-илпиримидин-5-карбоновой кислоты обрабатывают с помощью 24,4 г (96,1 ммоль) иода, получая 21,4 г целевого соединения после перекристаллизации из водного этанола; температура плавления от 109 до 110 С. Пример 32. 6-Пиперидин-1-илизотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 20,8 г (87,4 ммоль) амида 4-мер-капто-2 пиперидин-1-илпиримидин-5-карбоновой кислоты обрабатывают с помощью 2,2 г (87,4 ммоль) иода, получая 14,37 г целевого соединения после перекристаллизации из диметилформамида; температура плавления от 268 до 269 С. Пример 33. 6-Морфолино-4-ил-2-(2 пиперидин-1-илэтил)изотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 5,2 г (14,8 ммоль) (2-пиперидин-1-илэтил) амида 4-меркапто-2-морфолин-4-илпиримидин 5-карбоновой кислоты обрабатывают с помощью 3,81 г (15,0 ммоль) иода, получая 2,6 г целевого соединения после перекристаллизации из водного изопропанола; температура плавления от 98 до 100 С. Пример 34. 6-Диметиламино-2-(2-пиридин-2-илэтил)изотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 7,5 г (24,8 ммоль) (2-пиридин-2-илэтил) амида 2-диметиламино-4-меркаптопиримидин-5-карбоновой кислоты обрабатывают с помощью 6,4 г (25,2 ммоль) иода, получая 4,21 г целевого соединения после перекристаллизации из изопропанола; температура плавления от 134 до 136 С. Пример 35. 6-Диметиламино-2-(2 пиперидин-1-илэтил)изотиазол[5,4-d]пиримидин-3-он. Согласно описанной в примере 20 методике, 6,2 г (20,1 ммоль) (2-пиперидин-1-илэтил)амида 2-диметиламино-4-меркаптопиримидин-5-карбоновой кислоты обрабатывают с помощью 5,08 г (20,0 ммоль) иода, получая 5,31 г целевого соединения после перекристаллизации из этилацетата; температура плавления от 128 до 129 С. Как уже указывалось выше, производные изотиазолона формулы (I) могут представлять собой активное вещество фармацевтической композиции с антивирусной, противовосполительной и антиатериосклеротической активно 000898 28 стью. Данная фармацевтическая, содержащая активное вещество в эффективном количестве и по меньшей мере один фармацевтически приемлемый носитель, является дополнительным объектом настоящего изобретения. Предлагаемая фармацевтическая композиция может иметься в виде любого стандартного препарата, как, например, таблетки, пастилки,пилюли, капсулы и тому подобные лекарственные формы, которые в качестве фармацевтически приемлемого носителя могут содержать обычные фармацевтические эксципиенты, такие, как связующие, подслащивающие агенты и тому подобные. Типичными связующими являются трагантовая камедь, аравийская камедь,кукурузный крахмал и желатина, также, как такие эксципиенты, как дикальцийфосфат. Типичные дезинтегрирующие агенты включают кукурузный крахмал, альгиновую кислоту и тому подобные. Обычно используемой смазкой является стеарат магния. Типичными подслащивающими агентами являются сахароза, лактоза или сахарин; кроме того, могут быть использованы вкусовые добавки, такие, как мята перечная, винтергреневое масло или вишневый ароматизатор. Когда лекарственной формой с разовой дозой является капсула, она может содержать, в дополнение к веществам вышеуказанного типа, жидкий носитель. Также могут присутствовать различные другие вещества в качестве покрытий или для иной модификации физической формы разовой дозы. Например, таблетки,пилюли или капсулы могут быть покрыты шеллаком, сахаром или обоими вместе. Сироп или эликсир может содержать активное соединение,сахарозу в качестве подслащивающего агента,метиловый или пропиловый эфиры паминобензойной кислоты в качестве консервантов, краситель и ароматизатор, такой как вишневый или апельсиновый ароматизатор. Само собой разумеется, любое вещество, используемое для получения любой лекарственной формы с разовой дозой, должно быть фармацевтически чистым и по существу нетоксичным в используемых количествах. С помощью изотиазолонов согласно изобретению также можно приготовлять лекарственные формы для топического применения,например, как пластыри, мази, кремы, притирания и тому подобные. Также могут быть использованы агенты, обычно применяемые для усиления проникновения через кожу. Соединения также могут сочетать с восками и тому подобными компонентами с получением лекарственных форм, пригодных для ректального введения. Кроме того, активное соединение можно вводить парентерально или интраперитонеально. Также можно приготовлять дисперсии в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. При обычных условиях хранения и использования эти лекарственные пре 29 параты могут содержать консервант для предотвращения роста микроорганизмов. Пригодные для инъекций лекарственные формы включают стерильные водные растворы(в случае водорастворимых веществ) или дисперсии и стерильные порошки для приготовления в момент употребления стерильных растворов или дисперсий для инъекции. Во всех случаях лекарственная форма должна быть стерильной и жидкой в такой степени, чтобы ее можно было легко вводить шприцом. Эта форма должна быть стабильной в условиях приготовления и хранения и должна быть предохранена от заражающего воздействия микроорганизмов,таких, как бактерии и грибки. Носитель может представлять собой среду для растворения или диспергирования, содержащую, например, воду,этанол, многоатомный спирт (например, как глицерин, пропиленгликоль, жидкий полиэтиленгликоль и тому подобный), их соответствующие смеси и растительные масла. Надлежащую текучесть можно сохранять, например,путем использования покрытия, такого, как лецитин, путем поддерживания необходимого размера частиц в случае дисперсии и путем использования поверхностно-активных агентов. Предохранение от воздействия микроорганизмов можно осуществлять с помощью различных антибактериальных и противогрибковых агентов, таких как, например, эфиры паминобензойной кислоты, хлорбутанол, фенол,сорбиновая кислоты, тимеросаль и тому подобные. Во многих случаях может оказаться предпочтительным включение изотонических агентов, как, например, сахара или хлорид натрия. Пролонгированную абсорбцию предназначенным для инъекции композициям можно придавать путем использования в композициях замедляющих абсорбцию агентов, например, моностеарат алюминия и желатина. Стерильные растворы для инъекций получают путем введения активного соединения в необходимом количестве в соответствующий растворитель вместе с различными другими вышеуказанными ингредиентами, при необходимости с последующей стерилизацией фильтрованием. Дисперсии обычно готовят путем введения различных стерилизованных активных ингредиентов в стерильный эксципиент, содержащий основную диспергирующую среду и другие необходимые ингредиенты из вышеуказанных. Предпочтительными способами получения стерильных порошков для приготовления стерильных растворов для инъекции являются вакуумная сушка и сушка вымораживанием, в результате которых получают порошок, включающий активный ингредиент вместе с любым другим дополнительным желательным ингредиентом, из содержащего эти ингредиенты предварительно стерилизованного фильтрованием раствора. 30 Используемый в настоящем описании термин "фармацевтически приемлемый носитель" включает любой или все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и тому подобные. Использование таких сред и агентов для фармацевтически активных веществ хорошо известно в уровне техники. За исключением тех случаев, когда какие-либо обычные среды или агенты несовместимы с активным ингредиентом, их можно использовать в терапевтических композициях. В композиции также могут быть включены дополнительные активные ингредиенты. Особенно предпочтительным является получение парентеральных композиций в виде готовой лекарственной формы с разовой дозой для легкости введения и постоянства дозировки. Используемое в данном случае понятие "готовая лекарственная форма с разовой дозой" относится к физически раздельным готовым разовым лекарственным формам, пригодным в качестве разовых доз для излечиваемых млекопитающих; каждая такая разовая лекарственная форма содержит заданное количество активного вещества, рассчитанное на достижение терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация для новых готовых лекарственных форм с разовой дозой согласно изобретению диктуется и непосредственно зависит от (а) индивидуальных характеристик активного вещества и конкретно достигаемого терапевтического эффекта и (б) ограничений, свойственных типу составления лекарственной формы с активным веществом для лечения заболевания у субъектов с ухудшенным физическим здоровьем вследствие болезненного состояния, как здесь описывается подробно. Для удобного и эффективного введения,основной активный ингредиент в эффективных количествах смешивают с соответствующим фармацевтически приемлемым носителем в виде лекарственной формы с разовой дозой, как здесь описывается. Термин "эффективное количество" означает такое количество изотиазолона, которое дает положительный терапевтический эффект при лечении вирусной инфекции,воспаления или атеросклероза в случае пораженного болезнью млекопитающего, которого нужно лечить. Готовая лекарственная форма с разовой дозой, например, может содержать активное соединение в количествах примерно от 5 до примерно 1000 мг и предпочтительно примерно от 25 до примерно 750 мг. Типичная доза составляет примерно от 50 до примерно 500 мг. В случае композиций, содержащих дополнительные активные ингредиенты, дозировки определяют в соответствии с рекомендуемыми стандартными дозами и способом введения вышеуказанных ингредиентов. Разовые дозы обычно вводят от одного до четырех раз в сутки или иным образом, требующимся для эффективного лечения болезненного состояния. В качестве примеров предлагаемой фармацевтической композиции приводятся следующие препараты. Препарат А Мягкие желатиновые капсулы получают,используя следующие ингредиенты: Соединение согласно примеру 1 Бутилгидроксианизол (фармакопея Великобритании) Фракционированное кокосовое масло Вышеуказанные ингредиенты смешивают и полученной смесью заполняют мягкую желатиновую капсулу, компонентами оболочки которой являются желатина и глицерин. Капсулы вводят при норме от одного до четырех раз в сутки. Препарат Б. Получают таблетки, используя следующие компоненты: Соединение согласно примеру 5 Микрокристаллическая целлюлоза Натриевая соль карбоксиметилкрахмала Стеарат магния Бутилгидроксианизол (фармакопея Великобритании ) Ингредиенты смешивают до получения однородной массы и прессуют в таблетку для перорального введения. Для лечения вирусных инфекций принимают от одной до четырех таблеток в сутки. Препарат В. Аэрозоль получают при использовании следующих компонентов: Соединение согласно примеру 4 Пропиленгликоль Дихлортетрафторэтан (пропеллент 14) Дихлордифторметан (пропеллент 12) Компоненты смешивают при температуре 20 С и помещают в герметически закрытый резервуар, который может быть снабжен приспособлением для измерения. Препарат Г. Раствор готовят нижеследующим образом,используя следующие ингредиенты: Соединение согласно примеру 6 Вода 1 н. Соляная кислота Ингредиенты смешивают, получая раствор, который можно использовать для обработки путем мытья прилавков, чтобы предотвратить и подавить рост бактерий. Соединения согласно настоящему изобретению обладают способностью вытеснять цинк из нуклеокапсидного белка (NСр 7) вируса иммунодефицита человека типа 1 (ВИЧ-1). Нук 32 леокапсидный белок является очень устойчивым из всех ретровирусов (South Т., Blake Р. и др., Biochemistry, 29, 7786 (1990 и весьма важным для вирусной инфекционности (Aldovini А. и Young R., Virology, 64, 1920 (1990), и GorelickR., Nigida S. и др., J. Virology, 64, 3207 (1990. В нуклеокапсидных белках цинк обычно находится в одном или двух "цинковых пальцах". В случае ВИЧ-1 имеются два "цинковых пальца"PSI-сайтом вырусной РНК, который контролирует упаковку вирусной РНК. Интерференция этой упаковки вызывает образование неинфекционных вирионов (Dannull J., Surovoy А. и др.,ЕМВО, 13, 1525 (1994. Предварительно было показано, что вытесняющие цинк соединения обладают высокой активностью против вируса иммунодефицита человека в многочисленных клеточных линиях и против всех ретровирусов(1993. Разработан основанный на флуоресценции анализ для контролирования удаления цинка из очищенного NСр 7 вируса иммунодефицита человека типа 1. Флуорофор, N-(6-метокси-8 хинолил)-п-толуолсульфонамид, дает усиленный флуоресцентный сигнал после связывания с ионом цинка в растворе. Белок NCp7, содержащий два "цинковых пальца" и два иона цинка,инкубируют с лекарственным средством, вызывающим вытеснение ионов цинка. Высвобожденный цинк затем связывают с N-(6-метокси-8 хинолил )-п-толуолсульфонамидом и определяют усиленную флуоресценцию относительно контроля. Анализ осуществляют следующим образом: 10 мкмоль соединения добавляют к 2,8 мкмоль NCp7 и 47 мкмоль N-(6-метокси-8 хинолил)-п-толуолсульфонамида в 20 мкл буфера со значением рН, равным 7,4, и выдерживают в течение девяноста минут при температуре 26 С. Флуоресценцию (возбуждение: 355 нм; эмиссия: 400 нм) регистрируют с течением времени. Контролем являются NCp7 при условиях анализа без лекарственного средства и apoNCp7(без цинка) с лекарственным средством. Количество вытесненного цинка в процентах рассчитывают на основе фактически измеренной величины флуоресценции, деленной на значение флуоресценции всего теоретически рассчитанного количества вытесненного цинка (5,6 мкмоль) и умноженной на сто. Также осуществляют масс-спектральный анализ с ионизацией электронным распылением. К 40 мкмоль NСр 7 в аммонийацетатном буфере со значением рН, равным 6, добавляют 320 мкмоль 4-(3-оксо-3 Н-бензо[d] изотиазол-2-ил) бензолсульфонамида (Пример 1) в ацетонитриле. Спустя три минуты появляется молекулярный пик при 6360 (100 %), соответствующий 33 суммарной молекулярной массе NCp7 плюс 308 плюс цинк. Этот пик означает NСр 7 с одним вытесненным ионом цинка и ковалентно связанное соединение с молекулярной массой 308,точно соответствующий молекулярной массе соединения согласно примеру 1, что указывает на вытеснение цинка и образование ковалентной связи между цистеином "цинкового пальца" и изотиазолоном. Тест-системы, используемые для установления антивирусной клеточной активности изотиазолонов формулы (I), хорошо известны в уровне техники и их обычно используют для такой цели. Например, анализ, используемый для оценки активности соединений против вируса иммунодефицита человека, представляет собой метод, применяемый Национальным Институтом Рака США, как описано Weislow О. S. и др., J. Natl. Cancer Inst, 81, 577 - 586 (1989),включенный в настоящее описание в качестве ссылки. Методика предназначена для определения агентов, действующих на любой стадии вирусного репродуктивного цикла. Анализ по существу включает цитолиз Т 4-лимфоцитов вирусом иммунодефицита человека. К клеткам добавляют небольшие количества вируса иммунодефицита человека, и необходимы, по крайней мере,два полных цикла репродукции вируса для достижения необходимого цитолиза клеток. Агенты, которые взаимодействуют с вирионами,клетками или вирусными ген-продуктами, при интерферировании с вирусными активностями способны защищать клетки от цитолиза. По некоторым параметрам система автоматизирована для приспособления к большему числу потенциальных агентов и как правило предназначена для определения активности против вируса иммунодефицита человека. Однако, соединения,которые разрушаются или быстро метаболизируются в условиях культивирования, не могут проявлять активность в этом скрининге. Другую тест-систему, используемую для оценки соединений согласно изобретению, называют ВИЧ-Н 9-анализ. Согласно анализу клеток линии Н 9 вируса иммунодефицита человека определяют ингибирующую концентрацию,необходимую для подавления репликации вируса иммунодефицита человека типа 1. В этой системе рост вируса происходит через многочисленные стадии жизненного цикла. Результатом любого подавления кинетики репликации является уменьшение продуцирования вируса в геометрической прогрессии. Таким образом,этот анализ представляет собой чувствительный способ определения способности соединения ингибировать репликацию вируса иммунодефицита человека типа 1. Линию Н 9 Т-клеток инфицируют вирусом иммунодефицита человека при множественности заражения 0,01. После абсорбции в течение двух часов клетки промывают, суспендируют в 34 среде RPMI-1640 с 10 % фетальной телячьей сывороткой и осуществляют посев из расчета 5 10-3 клеток на лунку девяностошестилуночного планшета. Для реакции цитотоксичности готовят аналогичный планшет с неинфицированными клетками линии Н 9. Лекарственные средства последовательно разбавляют в 1/3,16 раза в диметилсульфоксиде, переносят в среду с концентрацией (8 х) и затем добавляют к культурам в трехкратном повторении. Конечная концентрация в диметилсульфоксиде составляет 0,02 (0,2 %). Продуцирование вируса определяют путем анализа с использованием обратной транскриптазы, а цитотоксичность определяют путем анализа с использованием 2,3-бис(2-метокси-4 нитро-5-сульфофенил)-2 Н-тетразолий-5 карбоксанилида натрия (ХТТ) спустя семь дней после инфекции. Анализ с использованием обратной транскриптазы выполняют в модификации Borroto-Esoda и Boone, J. Virol., 65, 1952 1959 (1991), и количественное определение осуществляют, используя устройство фирмы Молекуляр Динамикс Фосфоимиджер с программным обеспечением Имиджквант. Анализ с использованием ХТТ выполняют в модификации Roehm и др., J. Immuno. Methods, 142, 257 265 (1991), и количественное определение осуществляют, используя молекулярный планшетридер фирмы Дивайс Термомакс с программным обеспечением Софт-макс. При использовании электронных устройств данные переносят в электронную таблицу фирмы Микрософт Экселл для анализа. Получаемые в результате анализа с использованием обратной транскриптазы значения, эквивалентные ингибированию продуцирования вируса на 50 и 90 %, рассчитывают по отношению к необработанному контролю. Концентрации ингибитора, необходимые для достижения этих значений (ИК 50 и ИК 90), интерполируют из полученных данных, фланкирующих эти активности обратной транскриптазы. Получаемые в результате анализа с использованием ХТТ значения, эквивалентные 50% цитотоксичности, рассчитывают по отношению к необработанному контролю. Концентрации ингибитора, необходимые для достижения этого значения, интерполируют из полученных данных, фланкирующих эти значения ХТТ. Еще одну тест-систему, используемую для определения антивирусной активности, называют анализ клеток СЕМ. Т 4-Лимфоциты (линия клеток СЕМ) подвергают воздействию вируса иммунодефицита человека из расчета соотношения вируса на клетку приблизительно 0,05 и высевают вместе с неинфицированными контрольными клетками в девяностошестилуночные микролитровые планшеты. Потенциальный агент растворяют в диметилсульфоксиде (если не указано ничего друго 35 го), затем разбавляют в соотношении 1 : 200 в среде для культивирования клеток. Дальнейшие разбавления (половина lоg10) осуществляют перед добавлением к равному объему среды, содержащей или инфицированные или неинфицированные клетки. Культуры инкубируют при температуре 37 С в содержащей 5% диоксида углерода атмосфере в течение шести или семи дней. Во все лунки добавляют тетразолиевую соль, ХТТ, и культуры инкубируют вплоть до появления окраски, присущей формазану, который образуется за счет жизнеспособных клеток ( J. NationalCancer Institute, 81, 577 - 586 ( 1989 . Содержимое отдельных лунок анализируют спектрофотометрически для определения количества продуцированного формазана и, кроме того,проводят оценку с помощью микроскопа для определения жизнеспособных клеток в подтверждение защитной активности. Испытываемые по отношению к лекарственному средству инфицированные вирусом клетки сравнивают с обработанными лекарственным средством неинфицированными клетками и с другими соответствующими контрольными образцами (необработанные инфицированные клетки и необработанные неинфицированные клетки, содержащие лекарственное средство лунки без клеток и т.д.) на одном и том же планшете. Данные рассматривают в сравнении с другими, проводимыми одновременно тестами и определяют активность. В нижеприводимой таблице 1 представлены результаты тестирования некоторых из соединений согласно изобретению в вышеописанном анализе по вытеснению цинка. Соединения оценивают на их способность вытеснять цинк из нуклеокапсидного белка NСр 7 (выражено в процентах по отношению к контролю). Таблица 1. Вытеснение цинка из "цинковых пальцев" нуклеокапсидного белка (NCр 7) вируса иммунодефицита человека типа 1 Процент вытеснения Соединение цинка по отношению к примераконтролю Этилендиаминтетраук 10 сусная кислота а) 1 100 2 30 13 75 14 71 15 97 17 78 18 100 25 89 а) Этилендиаминтетрауксусная кислота удаляет приблизительно 10 % цинка из "цинкового пальца" в течение двадцати четырех часов 36 В нижеприводимой таблице 2 представлены данные для некоторых соединений согласно изобретению, когда проводят оценку путем анализов клеток линии Н 9 и клеток СЕМ. Полученные данные показывают, что соединения согласно настоящему изобретению являются эффективными против вируса иммунодефицита человека, когда проводят оценку в обеих тестсистемах. Таблица 2. Активность против вируса иммунодефицита человека Анализ клеток СЕМ Соединение примераЭК 50 (мкмоль)a) ТК 50(мкмоль)б) 1 5,1 21 2 14 100 14 21 100 17 5,8 100 25 5,8 69 а) Эффективная концентрация, которая защищает клетки вирусных цитопатических воздействий. б) Токсическая концентрация, которая ингибирует рост клеток на 50% по отношению к контролю. Соединения согласно изобретению полезны против большого ряда ретровирусных инфекций и поэтому находят широкое применение. Примеры возможных вирусов, которые вызывают заболевания, можно лечить согласно настоящему изобретению, включают ретровирусы типа С и типа D, вирус Т-клеточной лимфомы человека типа 1, вирус Т-клеточной лимфомы человека типа 2, вирус лейкоза кошек,обезьяний вирус иммунодефицита, вирус мышиного лейкоза, бычий вирус иммунодефицита,бычий вирус лейкоза, вирусы инфекционной анемии у лошадей, вирусы саркомы птиц и тому подобные. Изотиазолоны формулы (1) также эффективны для лечения воспаления и атеросклероза. Характерным признаком атеросклероза является аккумуляция сложных эфиров холестерина, пополняемая пенистыми клетками. Пенистые клетки происходят от циркулирующих моноцитов, которые захватывают артериальные стенки в ответ на гиперхолестеринемию и созревают до тканевых макрофагов. Фермент 15-липоксигеназа принимает участие в воспалительных нарушениях и в происхождении и пополнении пенистых клеток (см. Harats и др., Trends Cardiovasc. Med., 5(1 ), 29 - 36 (1995. Этот фермент способен к окислительной этерификации полилноевых жирных кислот, таких, как найденные в фосфолипидах. Обработка экспериментальных животных с помощью антиоксидантов, которые восстанавливают продуцируемые 15-липоксигеназой гидропероксиды, приводит к торможению прогрессирования атеросклеротических поражений. Следовательно,введение соединений, которые ингибируют 15 37 липоксигеназу, является эффективным способом лечения и профилактики атеросклероза. Изотиазолоны формулы (I) являются эффективными ингибиторами 15-липоксигеназы, когда их оценивают в стандартных анализах, обычно проводимых для определения активности 15 липоксигеназы. В особенности, представленные здесь соединения оценивают с помощью способов, описанных Auerbach и др., Analytical Biochemistry, 201, 375 - 380 ( 1992 ). Проводят два анализа ин-витро, причем в обоих используют 15-липоксигеназу ретикулоцитов кролика и линолевую кислоту в качестве субстрата, с целью ферментативного продуцирования пероксидного продукта окисления, известного как 13(S)HPODE. N-бензоиллейкометиленовый синий используют в качестве колориметрического реагента для обнаружения и количественного определения образовавшегося пероксида. Также используют высокоэффективную жидкостную хроматографию для количественного определения продукта окисления после инкубации при температуре 4 С в течение десяти минут. Ингибирующая 15-липоксигеназу активность описываемых здесь изотиазолонов представлена в таблицах 3 и 4. В таблице 3 указывается концентрация соединения, необходимая для ингибирования 50% активности 15 липоксигеназы (ИК 50), когда определение проводят по методу высокоэффективной жидкостной хроматографии согласно Ауэрбаху и др. В Таблице 4 указывается процент ингибирования 15-липоксигеназы, когда оценку проводят колориметрическим методом. Таблица 3. Анализ путем высокоэффективной жидкостной хроматографии в отношении ингибирования 15-липоксигеназы Соединение примераИK50 (мкмоль) 23 0,4 24 0,3 27 0,27 28 0,76 29 0,39 30 0,29 31 1,3 32 3,2 33 0,12 34 1,7 35 0,16 Таблица 4. Колориметрический анализ в отношении ингибирования 15-липоксигеназы Соединение примера% Ингибирования 1 35 при 10 мкмоль 3 75 при 10 мкмоль 21 95 при 10 мкмоль 5010 мкмоль 5910 мкмоль 9110 мкмоль 9310 мкмоль Следовательно, соединения формулы (I) пригодны для лечения атеросклероза вследствие их способности ингибировать 15-липоксигеназу. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные изотиазолона общей формулы (I) где R1 и R2, независимо друг от друга, означают водород, галоген, алкил с 1-6 атомами углерода,циклоалкил с 3-6 атомами углерода, замещенный или незамещенный остаток фенил(СR6R7)m-, замещенный или незамещенный остаток Het(CR6R7)m-, где Het означает гетероцикл, a m - числа 0, 1 или 2, алкоксил с 1-6 атомами углерода, гидроксил, цианогруппу,NR3COR4, CO2R3, CONR3R4, S(O)mR3, сульфогруппу, остаток S(O)mNR3R4, COR3 или вместе образуют оксогруппу или метилендиоксигруппу;R3 и R4 независимо друг от друга означают водород, алкил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, остаток Het(CR6R7)m- или фенил-(СR6R7)m-, где Het и m имеют вышеуказанные значения,R5 означает алкил с 1-6 атомами углерода,ацил с 1-6 атомами углерода, циклоалкил с 3-6 атомами углерода, замещенный остаток фенил(СR6R7)m-, незамещенный или замещенный остаток Het (CR6R7)m-, где Het и m имеют вышеуказанные значения,при этом алкильные, ацильные и циклоалкильные группы могут быть замещены 1-3 остатками из группы, включающей NR3COR4,CO2R3, СОNR3R4, S(O)mR3, сульфогруппу,S(O)mNR3R4 и COR3, а фенильные и гетероциклические группы могут быть замещены галогеном, гидроксилом, NR3R4, NR3COR4, CO2R3,CONR3R4, S(O)mR3, сульфогруппой, S(O)mNR3R4 или COR3, где R3, R4, Het и m имеют вышеуказанные значения,R6 и R7 независимо друг от друга означают водород, алкил с 1-6 атомами углерода, CO2R3,гидроксил, CONR3R4 или цианогруппу; при условии, что R5 имеет значение, отличное от замещенного фенил-(CR6R7)m-, если заместителем фенильного кольца являются алкил, галоген, алкоксил или NR3R4, и их фармацевтически приемлемыми солями и сольватами. 2. Производные изотиазолона общей формулы (I) по п.1, где R5 означает 3. Производные изотиазолона общей формулы (I) по п.2, где R2 означает водород. 4. Производные изотиазолона по п.3, где 5. Производные изотиазолона общей формулы (I) по п.4, представляющие собой[d]изотиазол-2-ил)-пентановую кислоту. 6. Производные изотиазолона общей формулы (I) по п.3, где R5 означает 7. Производные изотиазолона общей формулы (I) по п.6, где R3 означает водород. 8. Производное изотиазолона формулы (I) по п.7, представляющее собой N-aцeтил-4-(3oкco-3H-бeнзo[d]-изoтиaзoл-2-ил)-бeнзoлcyльфoнaмид. 9. Производные изотиазолона по п.7, гдеR4 означает водород. 10. Производные изотиазолона по п.9,представляющие собой 4-(3-оксо-3 Н-бензо[d]-изотиазол-2-ил) бензолсульфонамид; 4-(5-метокси-3-оксо-3 Н-бензо[d]-изотиазол-2-ил)бензолсульфонамид; 40 4-(6-метил-3-оксо-3 Н-бензо[d]-изотиазол 2-ил)бензолсульфонамид; 4-(6-фтор-3-оксо-3 Н-бензо[d]-изотиазол-2 ил)бензолсульфонамид; 4-(5-метил-3-оксо-3 Н-бензо[d]-изотиазол 2-ил)бензолсульфонамид. 11. Фармацевтическая композиция с антивирусной, противовоспалительной и антиатериосклеротической активностью, содержащая активное вещество на основе производных изотиазолона и, по меньшей мере, один фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производного изотиазолона содержит соединения общей формулы (I) по п.1 или их фармацевтически приемлемую соль или сольват в эффективном количестве. 12. Фармацевтическая композиция по п.11,отличающаяся тем, что в качестве производного изотиазолона содержит соединение формулы 13. Фармацевтическая композиция по п.12,отличающаяся тем, что в качестве производного изотиазолона содержит соединение, где R2 означает водород. 14. Фармацевтическая композиция по п.13,отличающаяся тем, что в качестве производного изотиазолона содержит соединение, где R5 означает 15. Фармацевтическая композиция по п.14,отличающаяся тем, что в качестве производного изотиазолона содержит [S-(R,R)]-3-метил-2-(3 оксо-3 Н-бензо[d]изотиазол-2-ил)-пентановую кислоту. 16. Фармацевтическая композиция по п.14,отличающаяся тем, что в качестве производного изотиазолона содержит 4-(3-оксо-3 Н-бензо[d] изотиазол-2-ил)-бензолсульфонамид.
МПК / Метки
МПК: C07D 513/14, C07D 513/04, A61K 31/426, C07D 275/06, A61P 31/12
Метки: противовоспалительной, производные, антиатериосклеротической, антивирусной, композиция, фармацевтическая, соли, активностью, приемлемые, изотиазолона, фармацевтически, сольваты
Код ссылки
<a href="https://eas.patents.su/22-898-proizvodnye-izotiazolona-ih-farmacevticheski-priemlemye-soli-i-solvaty-farmacevticheskaya-kompoziciya-s-antivirusnojj-protivovospalitelnojj-i-antiaterioskleroticheskojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Производные изотиазолона, их фармацевтически приемлемые соли и сольваты, фармацевтическая композиция с антивирусной, противовоспалительной и антиатериосклеротической активностью</a>
Следующий патент: Моющие составы и способ их получения
Случайный патент: Способы и устройство для добычи полезных ископаемых












