Замещенные имидазолы, обладающие антиканцерогенной и цитокин-ингибирующей активностью
Номер патента: 1203
Опубликовано: 25.12.2000
Авторы: Ливертон Найджел Дж., Селник Гарольд Г., Клэйрмон Дэвид А.
Формула / Реферат
1. Соединение, представленное формулой I:
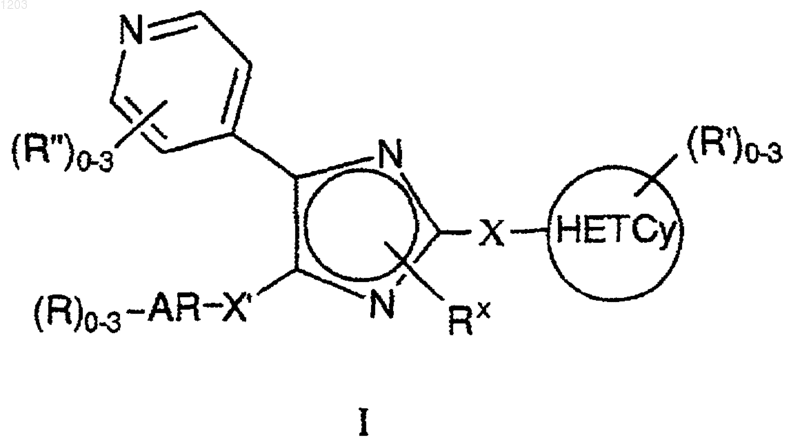
или его фармацевтически приемлемая соль, где
AR представляет собой ароматическую группу, содержащую 6-10 атомов;
Х и X', каждый независимо представляют -(CH2)m-Y- (CH2)n-, где m и n представляют собой целые числа от 0 до 4, таким образом, что сумма m и n равна от 0 до 6; Y представляет собой член, выбранный из группы, состоящей из прямой связи; О; S(O)у, с у, равным 0, 1 или 2; NRq', с Rq', как указано ниже; С(O); ОС(O); С(О)О; SOxNRq' с X, равным 1 или 2, и Rq', как указано ниже; NRq'SOx; С(О)NRq' и NRq'С(О);
 представляет собой 4-10-членный неароматический гетероцикл, содержащий, по меньшей мере, один атом N и необязательно содержащий 1-2 дополнительных атомов N и 0-1 атомов О или S;
представляет собой 4-10-членный неароматический гетероцикл, содержащий, по меньшей мере, один атом N и необязательно содержащий 1-2 дополнительных атомов N и 0-1 атомов О или S;
Rx представляет Н, C1-6алкил (Rq)3, OC1-6 алкил (Rq)3, или С(О)C1-6алкил (Rq)3;
каждый из R и R" независимо представляет член, выбранный из группы, состоящей из галогена; гидрокси; C1-6алкил (Rq)3; OC1-6aлкил (Rq)3; С3-8циклоалкил (Rq)3; CN; CONH2; CONH C1-6aлкил (Rq)3; СON(С1-6алкил (Rq)3)2; NH2; NHC1-6алкил (Rq)3; N(C1-6aлкил (Rq)3)2; СО2Н; СO2С1-6алкил (Rq)3; С(О)C1-6алкил (Rq)3; apил (Rq)3; гетероарил (Rq)3; СF3; SH; NO2; SOyC1-6 алкил (Rq)3, с у как описано выше; SO2NH2; SО2NHС1-6алкил (Rq)3; SO2N(C1-6aлкил (Rq)3)2; NHSO2C1-6алкил (Rq)3; NНSО2 арил (Rq)3, NHSO2гeтepoapил (Rq)3, N (Rq')С(О)C1-6aлкил (Rq)3; NRq'C(O)NН(С1-6алкил (Rq)3); С2-4алкенил (Rq)2-3 и С2-4алкинил (Rq)1-3;
каждый из R' независимо представляет собой член, выбранный из группы, состоящей из: гидрокси; C1-6алкил (Rq)3; C3-8циклоалкил (Rq)3; OC1-6aлкил (Rq)3; ОС3-8циклоалкил (Rq)3; гeтepoциклил (Rq)3; CN; NH (Rq"); NHC1-6aлкил (Rq)3; N(C1-6алкил (Rq)3)2; NНС3-8циклоалкил (Rq)3; N(С3-8циклоалкил (Rq)3)2; СF3; SH; NO2; С2-4алкенил (Rq)2-3, apил (Rq)3, гетероарил (Rq)3; C2-4aлкинил (Rq)1-3 -ОС(О)С3-8циклоалкил (Rq)3; SO2NH2; SO2NHC1-6aлкил (Rq)3; SО2N(C1-6aлкил (Rq)3)2; NНSO2С1-6алкил (Rq)3, NHSO2apил (Rq)3, NHSO2гeтepoapил (Rq)3, -ОС(О)гетеро-циклил (Rq)3; N(Rq')C(O)C1-6aлкил (Rq)3; NRq'C(O)NH(C1-6алкил (Rq)3); -OC(O)C1-6aлкил (Rq)3; -ОС(О)арил (Rq)3, -ОС(О)гетероарил (Rq)3; -С(=NRq')NH2; -С(=Nq')NHC1-6алкил (Rq)3, -С(=Nq')N(C1-6алкил (Rq)3)2; CONH2; CONHC1-6aлкил (Rq)3; CON(C1-6алкил (Rq)3)2; CONHC3-8циклоалкил (Rq)3; СОN(С3-8циклоалкил (Rq)3)2; СO2Н; СO2С1-6алкил (Rq)3; С(О)C1-6aлкил (Rq)3; СO2С3-8циклоалкил (Rq)3; C(O)C3-8циклоалкил (Rq)3; -[С(О)(СН2)j-CR5R6-(CH2)k-NR7]p-R8; -С(О)C3-8циклоалкил (Rq)3; -С(О)гетероциклил (Rq)3; -CON[C1-6aлкил (Rq)3] [С3-8циклоалкил (Rq)3]; -С(O)apил (Rq)3, -С(О) гетероарил (Rq)3;
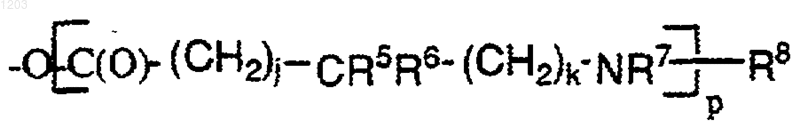
и
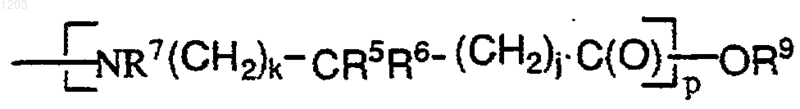
j и k независимо представляют целые числа от 0 до 3;
R5 и R6 независимо являются Н, арил, C1-6 aлкил (Rq)3, или же CR5R6 в комбинации представляет 3, 4, 5 или 6-членную циклоалкильную или гетероциклильную группу, арильную группу или гетероарильную группу;
р представляет собой 1, 2 или 3 с условием, что когда р представляет 1, CR5R6 представляет 3, 4, 5 или 6-членную циклоалкильную группу или гетероциклильную группу, арильную группу или гетероарильную группу и, по меньшей мере, одно из j и k равны 1, 2 или 3;
R7 и R8 являются независимо Н, C1-6 алкилом или арилом;
R9 представляет собой Н, отрицательный заряд уравновешен положительно заряженной группой или защитной группой;
Rq представляет собой член, выбранный из группы, состоящей из: Rq'; CN; СО2Н; СО2С1-4 алкил; С(О)С1-4алкил; NH (Rq"); apил (Ra)3; гетероарил (Ra)3; NНС1-4алкил; N(С1-4алкил)2; CONH2; SH; S(O)yC1-6алкил (Ra)3; С(О)NHC1-6алкил (Ra)3; С(О)N(C1-6алкил (Ra)3)2; NHC(NH)NH2; -гeтepoaлкил (Ra)3; -NHC(O)NH2;
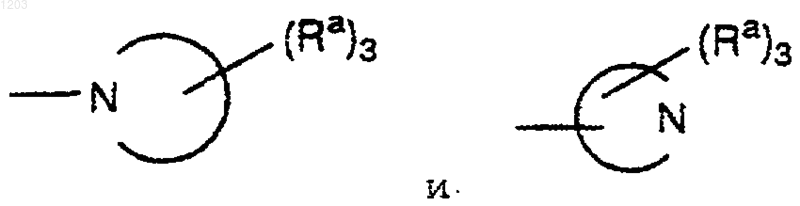
где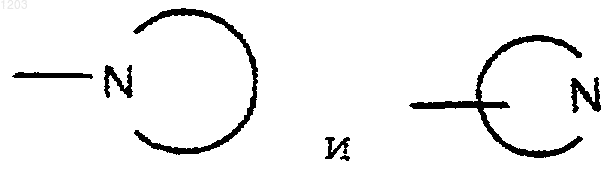 независимо представляют моно- или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)у, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы;
независимо представляют моно- или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)у, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы;
каждый Ra независимо представляет член, выбранный из группы, состоящей из: Н, C1-6 алкила, OC1-6алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси, галогена, гидрокси, CN, CONH2, CONHC1-6 алкила, СОN(С1-6алкил)2, СО2Н, СО2С1-6aлкила, С(О)C1-6алкила, фенила, СF3, SN, NO2, SOyC1-6 алкила, с у, как указано выше; SO2NH2, SO2NHC1-6алкилa, NHSO2 (замещенного арила), NHSO2 (замещенного гетероарила), NНSО2С1-6 алкила, NНSО2арила, NНSО2гетероарила, NH2, NHC1-6алкила, N(С1-6алкила)2, NHC(O)C1-6 алкила, NНС(O)NН(С1-6алкила), С2-4алкенила и С2-4алкинила;
Rq' представляет собой Н, ОН, С1-4алкил, -ОС1-4алкил, арил или С(O)С1-4алкил, и
Rq" представляет собой Н, ОН или ОС1-4 алкил.
2. Соединение по п.1, в котором один или два R" независимо представлены как член, выбранный из группы, состоящей из: NH2, NHC1-6 aлкил (Rq)3, N(С1-6алкил)2, N(Rq')С(О)C1-6алкил (Rq)3 и NRq' С(О)NHC1-6алкил (Rq)3.
3. Соединение по п.1, в котором AR представляет собой фенильное кольцо, незамещенное или замещенное одной или двумя R группами.
4. Соединение по п.3, в котором AR представляет собой фенил и присутствует одна или две R группы, которые выбираются из группы, состоящей из: гидроксила, галогена, C1-6алкил (Rq)3, OC1-6aлкил (Rq)3, NH2 СF3 и NO2.
5. Соединение по п.4, в котором каждый R представляет собой галоген, гидрокси, или СF3.
6. Соединение по п.1, в котором: НЕТСу представляет собой 5-6-членный неароматический гетероцикл с содержащимися в нем 1-2 атомами азота.
7. Соединение по п.1, в котором каждый R' выбран из группы, состоящей из: C1-6алкил (Rq)3, OC1-6алкил (Rq)3, CN и NO2.
8. Соединение по п.1, в котором Rq выбран из Rq', CN,

Rq' представляет собой Н, С1-4алкил, ОН или арил;
Rq" представляет собой Н или ОН;
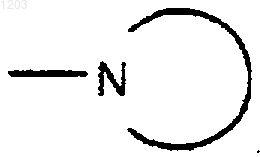 представляет собой бициклическую частично
представляет собой бициклическую частично
ароматическую группу, выбранную из фталидила или сахаринила, и
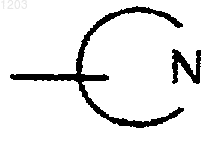 представляет собой пиперидинил.
представляет собой пиперидинил.
9. Соединение по п. 1, в котором каждый R' представлен как член, выбранный из группы, состоящей из -ОС(О)С3-8циклоалкил (Rq)3, ОС(О)гетероциклил (Rq)3, N(Rq')C(O)C1-6aлкил (Rq)3, -N(Rq')С(О)NH(C1-6алкил (Rq)3), -ОС(О) C1-6алкил (Rq)3, -ОС(О)арил (Rq)3, -ОС(О) гетероарил (Rq)3, -O[С(О)(СН2)j-СR5R6-(СН2)k-NR7]p R8, и -[NR7-(CH2)kCR5R6-(СН2)j-(СО)]p-OR9.
10. Соединение по п.9, в котором Rq представляет собой Н, С1-4алкил или ОС1-4алкил;
Rq" представляет собой Н или С1-4алкил;
р представляет 1 или 2; если р представляет 1, j представляет собой 1, и k представляет собой 0, 1 или 2; если р представляет 2, j представляет собой 0 или 1, и k представляет собой 0, 1 или 2;
R5 и R6 представляют собой Н или C1-6 алкил (Rq)3 или один из R5 и R6 представляет собой арил, а другой является Н или C1-6aлкил (Rq)3,
R7 и R8 представляют собой Н или C1-6 алкил (Rq)3, и R9 представляет собой Н.
11. Соединение по п.1, в котором каждый R' представляет собой член, выбранный из группы, состоящей из CONH2; CONHC1-6aлкил (Rq)3; СОN(С1-6алкил (Rq)3)2; СОNНС3-8 циклоалкил (Rq)3; CON(С3-8циклоалкил (Rq)3)2; СО2Н; CO2C1-6aлкил (Rq)3; С(О)C1-6алкил (Rq)3; СO2С3-8 циклоалкил (Rq)3; C(O)C3-8циклоалкил (Rq)3; -[C(O)(CH2)j-CR5R6-(CH2)k-NR7]p-R8; -С(О)С3-8 циклоалкил (Rq)3; -С(О)гетероциклил (Rq)3; CON[C1-6aлкил (Rq)3] [С3-8циклоалкил (Rq)3]; С(O)арил (Rq)3 и С(О)гетероарил (Rq)3;
р представляет собой 1, 2 или 3, и другие переменные соответствуют указанному выше.
12. Соединение по п.1, в котором каждый R' независимо представлен членом, выбранным из группы, состоящей из: CONH2; CONHC1-6 aлкил (Rq)3; СОN(С1-6алкил (Rq)3)2; СО2Н; СО2С1-6алкил (Rq)3; C(O)C1-6aлкил (Rq)3; -[С(О)(СН2)j-CR5R6-(СН2)k-NR7]pR8; С(О)арил (Rq)3 и С(О)гетероарил (Rq)3;
Rq является Rq', CN,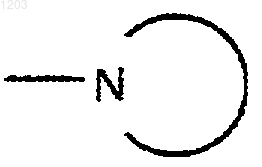 или
или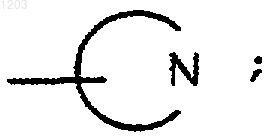
Rq' представляет Н, С1-4алкил, ОН или арил;
 представляет собой бициклическую частично ароматическую группу, выбранную из фталидила и сахаринила, и
представляет собой бициклическую частично ароматическую группу, выбранную из фталидила и сахаринила, и
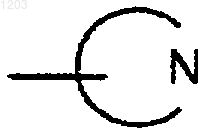 представляет пиперидинил.
представляет пиперидинил.
13. Соединение по п.12, в котором R' представляет собой член, выбранный из группы, состоящей из CONH2; СО2Н; СО2С1-6алкил (Rq)3; С(О)C1-6алкил (Rq)3; и -[С(О)(CH2)j-CR5R6-(СН2)k-NR7]pR8;
Rq представляет собой Н, С1-4алкил или ОС1-4алкил;
р представляет собой 1;
j представляет собой 0 или 1;
k представляет собой 0, 1 или 2; и
каждый R7 и R8 предпочтительно представляет собой Н или C1-6алкил (Rq)3.
14. Соединение по п.1, в котором Rx представляет собой Н или C1-6алкил (Rq)3.
15. Соединение по п.1, в котором X' представляет собой прямую связь.
16. Соединение по п.1, в котором Х представляет собой -(CH2)m-Y-(CH2)n-, Y представляет собой прямую связь, О, S или С(О); m представляет собой 0 или 1, и n представляет собой 0 или 1.
17. Соединение по п.16, в котором Х представляет собой прямую связь.
18. Соединение по п.1, в котором
AR представляет собой фенил или нафтил;
Х и X' представляют собой -(CH2)m-Y-(CH2)n-, где m и n являются нулем, a Y представляет собой связь;
НЕТСу представляет собой пирролидинильную или пиперидинильную группу;
присутствует одна или две R группы, которые выбираются из группы, состоящей из галогена, гидрокси, C1-6алкил (Rq)3, OC1-6алкил (Rq)3, CN, NH2, СO2Н, СF3, NO2 и CO2NH2;
присутствуют одна или две R' группы, которые выбираются из группы, состоящей из C1-6 алкил (Rq)3, OC1-6алкил (Rq)3, CN и NO2;
Rq представляет собой Rq', CN, CO2H, NH(Rq"),
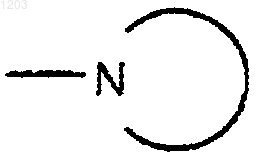 или
или 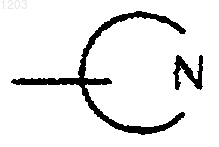
Rq' представляет собой Н, С1-4алкил, ОН или фенил;
Rq" представляет собой Н или ОН;
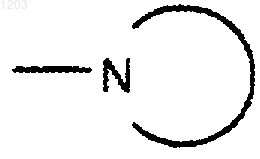 представляет собой фталидил или сахаринил, и
представляет собой фталидил или сахаринил, и
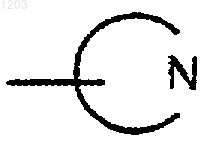 представляет собой пиперидинил.
представляет собой пиперидинил.
19. Соединение по п.1, в котором AR представляет собой ароматическую группу, содержащую 6-10 атомов;
Х и X' каждый независимо представляет -(CH2)m-Y- (СН2)n-, где m и n представляют собой целые числа в интервале от 0 до 4, таким образом, чтобы сумма m и n была от 0 до 6; Y представляет собой член, выбранный из группы, состоящей из: прямой связи; О; S(O)у, с у, равным 0, 1 или 2; NRq', с Rq' как указано ниже; С(O); ОС(O); С(O)O; SOxNRq' с х равным 1 или 2, и Rq' как определено ниже; NRq'SOx; C(O)NRq' и NRq'C(O);
 представляет 4-10-членный неароматический гетероцикл, содержащий, по меньшей мере, один N атом и по желанию содержащий 1-2 дополнительных N атомов и 0-1 О или S атом;
представляет 4-10-членный неароматический гетероцикл, содержащий, по меньшей мере, один N атом и по желанию содержащий 1-2 дополнительных N атомов и 0-1 О или S атом;
Rx представляет Н, C1-6aлкил (Rq)3, OC1-6aлкил (Rq)3, или C(O)C1-6aлкил (Rq)3;
каждый R независимо представляет собой член, выбранный из группы, состоящей из: галогена; гидрокси; C1-6aлкил (Rq)3; OC1-6aлкил (Rq)3; С3-8циклоалкил (Rq)3; CN; CONH2; CONHC1-6aлкил (Rq)3; CON(C1-6aлкил (Rq)3)2; NH2; NHC1-6aлкил (Rq)3; N(C1-6aлкил (Rq)3)2; CO2H; CO2C1-6aлкил (Rq)3; С(О)C1-6aлкил (Rq)3; apил (Rq)3; гeтepoapил (Rq)3; СF3; SH; NO2; NНSО2C1-6aлкил (Rq)3; NНSО2арил (Rq)3, NНSО2гетероарил (Rq)3, N (Rq')С(О)C1-6aлкил (Rq)3; NRq'C(O)NH(C1-6aлкил (Rq)3); С2-4алкенил (Rq)2-3 и С2-4алкинил (Rq)1-3;
каждый R" независимо представляет собой член, выбранный из группы, состоящей из галогена; гидрокси; C1-6aлкил (Rq)3; OC1-6aлкил (Rq)3; С3-8циклоалкил (Rq)3; CN; CONH2; CONHC1-6aлкил (Rq)3; CON(C1-6aлкил (Rq)3)2; NH2; NHC1-6aлкил (Rq)3; N(C1-6aлкил (Rq)3)2; CO2H; CO2C1-6aлкил (Rq)3; С(О)C1-6aлкил (Rq)3, apил (Rq)3; гетероарил (Rq)3; СF3; SH; NO2; SOyC1-6aлкил (Rq)3, с у как описано выше; SO2NH2; SO2NНC1-6aлкил (Rq)3; SO2N(C1-6aлкил (Rq)3)2; NHSO2C1-6aлкил (Rq)3; NНSО2арил (Rq)3, NНSО2гетероарил (Rq)3, N(Rq')C(O)C1-6 aлкил (Rq)3; NRq'C(O)NH(C1-6aлкил (Rq)3; С2-4 алкенил (Rq)2-3 и С2-4алкинил (Rq)1-3;
каждый R' независимо представляет собой член, выбранный из группы, состоящей из гидрокси; C1-6aлкил (Rq)3; С3-8циклоалкил (Rq)3; OC1-6aлкил (Rq)3; ОС3-8циклоалкил (Rq)3; гeтepoциклил (Rq)3; CN; NH(Rq"); NHC1-6aлкил (Rq)3; N(C1-6aлкил (Rq)3)2; NНС3-8циклоалкил (Rq)3; N(С3-8циклоалкил (Rq)3)2; СF3; SH; NO2; C2-4aлкенил (Rq)2-3, apил (Rq)3, гетероарил (Rq)3; С2-4алкинил (Rq)1-3, -ОС(О)С3-8циклоалкил (Rq)3; SO2NH2; SО2NHC1-6aлкил (Rq)3; SO2N(C1-6aлкил (Rq)3)2; NНSО2C1-6aлкил (Rq)3, NHSO2apил (Rq)3, NНSO2гетероарил (Rq)3, -ОС(О)гeтepoциклил (Rq)3; N(Rq')C(O)C1-6aлкил (Rq)3; NRq'C(O)NH(C1-6aлкил (Rq)3); -OC(O)C1-6aлкил (Rq)3; -OC(O)арил (Rq)3, -OC(O)гетероарил (Rq)3; -С(=NRq')NH2; -С(=Nq')NHC1-6aлкил (Rq)3, -С(=Nq')N(C1-6aлкил (Rq)3)2; CONH2; CONHC1-6aлкил (Rq)3; CON(C1-6aлкил (Rq)3)2; CONHC3-8циклоалкил (Rq)3; СОN(С3-8циклоалкил (Rq)3)2; CO2H; СO2C1-6aлкил (Rq)3; С(О) C1-6aлкил (Rq)3; СO2С3-8циклоалкил (Rq)3; С(О)С3-8циклоалкил (Rq)3; -[С(О)(СН2)j-CR5R6-(CH2)k-NR7]p-R8; -С(О)С3-8циклоалкил (Rq)3; -С(О)гетероциклил (Rq)3; -CON[C1-6aлкил (Rq)3] [С3-8циклоалкил (Rq)3]; С(О)арил (Rq)3, С(О)гетероарил (Rq)3;
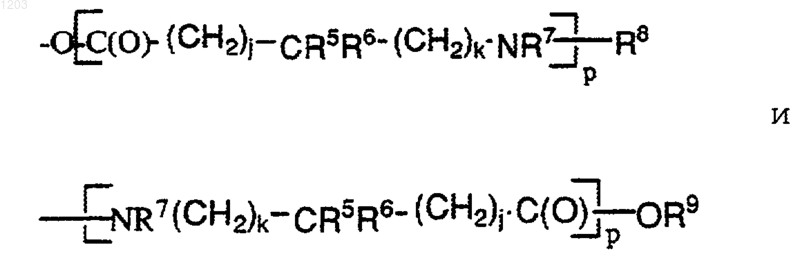
j и k независимо представляют целые числа от 0 до 3;
R5 и R6 независимо являются Н, арил, C1-6 aлкил (Rq)3, или же CR5R6 в комбинации представляет 3, 4, 5 или 6-членную циклоалкильную или гетероциклильную группу, арильную группу или гетероарильную группу;
р представляет собой 1, 2 или 3 с условием, что когда р представляет 1, CR5R6 представляет 3, 4, 5 или 6-членную циклоалкильную группу или гетероциклильную группу, арильную группу или гетероарильную группу и, по меньшей мере, одно из j и k равны 1, 2 или 3;
R7 и R8 независимо являются Н, C1-6 алкилом или арилом;
R9 представляет собой Н, отрицательный заряд уравновешен положительно заряженной группой или защитной группой;
Rq представляет собой член, выбранный из группы, состоящей из Rq'; CN; CO2H; СO2С1-4 алкил; С(О)С1-4алкил; NH(Rq"); apил(Ra)3; гетероарил (Rа)3; NНС1-4алкил; N(С1-4 алкил)2; CONH2; SH; S[O)yC1-6aлкил (Ra)3; С(О)NHC1-6 aлкил (Ra)3; С(О)N(C1-6aлкил (Ra)3)2; NHC(NH) NH2; -гетероалкил (Ra)3; -NHC(O)NH2;
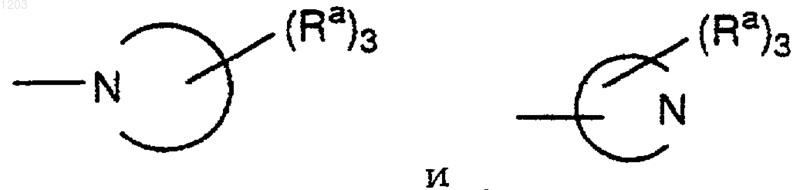
где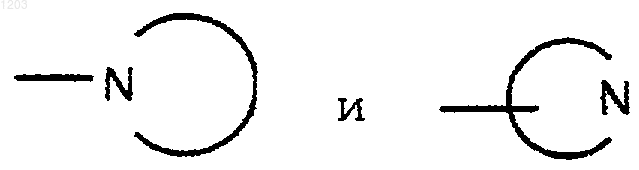 независимо представляют моно- или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)у, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы;
независимо представляют моно- или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)у, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы;
каждый Ra независимо представляет член, выбранный из группы, состоящей из Н, C1-6 алкила, OC1-6алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси, галогена, гидрокси, CN, CONH2, CONHC1-6 алкила, СОN(С1-6алкил)2, СО2Н, СО2С1-6aлкила, С(О)C1-6алкила, фенила, СF3, SN, NO2, SOyC1-6 алкила, с у, как указано выше; SO2NH2, SO2NНС1-6алкила, NHSO2 (замещенного арила), NHSO2 (замещенного гетероарила), NНSО2С1-6 алкила, NНSО2арила, NНSО2гетероарила, NH2, NHC1-6алкила, N(С1-6алкила)2, NНС(O)С1-6 алкила, NHC(О)NH(C1-6алкила), С2-4алкенила и С2-4 алкинила;
Rq' представляет собой Н, ОН, С1-4алкил, -ОС1-4алкил, арил или С(О)С1-4алкил и
Rq" представляет собой Н, ОН или ОС1-4алкил.
20. Соединение в соответствии с п.19, в котором Х представляет связь.
21. Соединение, представленное формулой Iа:
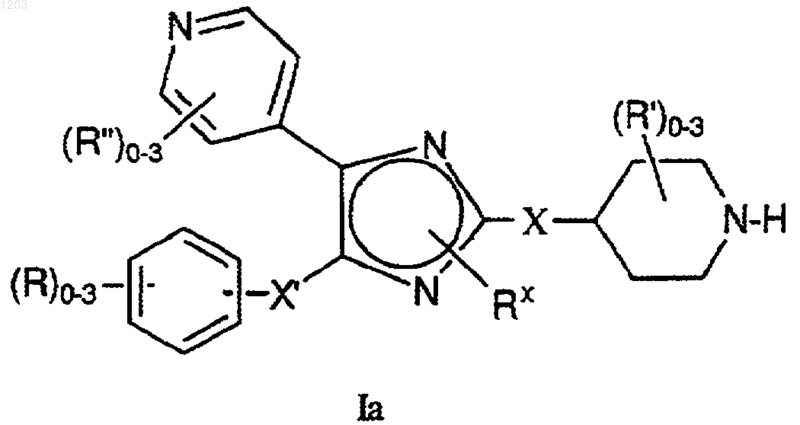
или его фармацевтически приемлемая соль, где
Х и Х', каждый независимо представляют -(CH2)m-Y-(CH2)n-, где m ш n представляют собой целые числа от 0 до 4, таким образом, что сумма m и n равна от 0 до 6; Y представляет собой член, выбранный из группы, состоящей из прямой связи; О; S(O)у, с у, равным 0, 1 или 2; NRq', с Rq', как указано ниже; С(О); ОС(О); С(О)О; SOxNRq' с х, равным 1 или 2 и Rq', как указано ниже; NRq'SOx; C(O)NRq' и NRq'C(O);
Rх представляет Н, C1-6aлкил (Rq)3 или OC1-6aлкил (Rq)3;
каждый R независимо представляет член, выбранный из группы, состоящей из галогена; гидрокси; C1-6aлкил (Rq)3; OC1-6aлкил (Rq)3; С3-8 циклоалкил (Rq)3; CN; CONH2; CONHC1-6aлкил (Rq)3; CON(C1-6aлкил (Rq)3)2; NH2; NHC1-6aлкил (Rq)3; N(C1-6aлкил (Rq)3)2; CO2H; CO2C1-6aлкил (Rq)3; С(О)C1-6aлкил (Rq)3; apил (Rq)3; гетероарил (Rq)3; CF3; SH; NO2; NНSО2C1-6aлкил (Rq)3; NНSO2арил (Rq)3, NНSO2гетероарил (Rq)3, N (Rq')С(О)C1-6aлкил (Rq)3; NRq'C(O)NH(C1-6
Текст
1 Обоснование изобретения Настоящее изобретение относится к замещенным имидазольным соединениям, обладающим антиканцерогенной активностью. Многочисленные антиканцерогенные соединения различных классов были синтезированы или выделены из естественных растительных и животных источников. Ни одно из доступных в настоящее время соединений, проявляющих антиканцерогенную активность, не относится к соединениям настоящего изобретения. Соединения настоящего изобретения проявляют антиканцерогенную активность за счет антагонистического действия на киназу Raf. Гены raf кодируют семейство белков, которые при злокачественном перерождении могут быть активированы за счет слияния, укорочения или точечных мутаций N-конца. RAF может быть активирован и подвергнут быстрому фосфорилированию в ответ на действие PDGF (фактора роста тромбоцитов), EGF (эпидермального фактора роста),инсулина, тромбина, эндотелина, кислого FGF(фактора роста фибробластов), CSF1 (колониистимулирующего фактора 1) или ТРА, а также в ответ на онкобелки -v-fms, v-src, v-sis, Hras и среднего Т антигена полиомы. Антисмысловые последовательности, снижающие уровни c-Raf и, следовательно, активность Raf в клетке, тормозят рост трансформированных онкогеном фибробластов грызунов в мягком агаре, и в то же время проявляют низкую общую цитотоксичность или не обладают ею вовсе. Поскольку по торможению роста в мягком агаре можно с высокой долей вероятности предсказать реактивность опухоли в целом организме животных,эти исследования позволяют предполагать, что антагонизм в отношении RAF может быть эффективно применен для лечения раковых опухолей, в которых существенную роль играетRAF. Примеры таких опухолей, в развитие которых вовлечен RAF за счет его гиперэкспрессии,включают опухоли мозга, урогенитального тракта, лимфатической системы, желудка, гортани и легких. Более конкретно такие примеры включают гистиоцитную лимфому, аденокарциному легких и мелко клеточные опухоли легких. Дополнительные примеры включают опухоли, в которых наблюдается повышенная экспрессия или активация Raf-активирующих онкогенов (например, K-ras, erb-B). Более конкретно такие опухоли включают карциному поджелудочной железы и молочной железы. Многочисленные соединения настоящего изобретения снижают также концентрацию цитокинов и тормозят развитие патологии, ассоциированной с болезнями, при которых цитокины присутствуют в высоких концентрациях. Заболевания, опосредуемые цитокинами, относятся к болезням или условиям, при которых имеет место избыточная или нерегулируемая продукция или активность одного или более 2 цитокинов. Интерлейкин-1 (IL-1) и фактор некроза опухолей (TNF) являются цитокинами, образуемыми широким спектром клеток, которые участвуют в иммунорегуляции и других физиологических реакциях. Существует множество патологических состояний, в которых участвует IL-1. Среди этих заболеваний находятся ревматоидный артрит, остеоартрит, эндотоксимия, синдром токсического шока, острые и хронические воспалительные заболевания, такие как воспалительная реакция, индуцированная эндотоксином, или воспалительное заболевание кишечника; туберкулез, атеросклероз, мышечная дегенерация,кахексия, псориазный артрит, синдром Рейтера,ревматоидный артрит, подагра, травматический артрит, артрит при краснухе и острый синовит. Недавно полученные доказательства связывают также активность IL-1 с диабетом. Было также показано, что интерлейкин-1 опосредует широкий спектр биологических эффектов, которые, как полагают, важны для иммунорегуляции и других физиологических реакций. [Смотри, например, Dinarello et al., Rev.Infect. Disease, 6, 51(1984)]. Известное биологическое действие IL-1 включает активацию Тхелперов, индукцию лихорадочного состояния,стимуляцию продукции простагландинов и коллагеназы, хемотаксис нейтрофилов, индукцию белков острой фазы и снижение уровня железа в плазме. Также было показано, что избыточная или нерегулируемая продукция или активность фактора некроза опухолей (TNF) вовлечена в опосредование или обострение ревматоидного артрита, ревматоидного спондилита, остеоартрита,подагрического артрита и других артритных состояний, сепсиса, септического шока, эндотоксического шока, грамотрицательного сепсиса, синдрома токсического шока, синдрома респираторного дистресса взрослых, церебральной малярии, хронического воспаления легких, силикоза, многоочаговой саркомы легких, заболеваниях, связанных с резорбцией костей, недостаточности кровоснабжения, реакции трансплантата против хозяина, отторжения аллотрансплантата, лихорадки и миалгии, вызванных инфекцией, вторичной кахексии, вызванной инфекцией или малигнизацией, вторичной кахексией, вызванной синдромом приобретенного иммунодефицита (AIDS), комплексом, связанным с AIDS (ARC), образования келоида, образования рубцовой ткани, болезни Крона, язвенного колита и пирез. Было показано также, что монокины, такие как TNF, активируют репликацию HIV (вируса иммунодефицита человека) в моноцитах и/или макрофагах [смотри Poli et al., Proc. Natl. Acad.Sci., 87:782-784 (1990)], таким образом, торможение образования или активности монокина способствует ограничению прогрессии HIV.TNF, как было показано, вовлечен разными спо 3 собами в развитие других вирусных инфекций,таких как цитомегаловирусная (CMV), инфекции, индуцируемые вирусом гриппа и вирусом герпеса. Интерлейкин-6 (IL-6) является цитокином,влияющим на иммунную систему и гематопоэз. Он образуется несколькими типами клеток млекопитающих в ответ на агенты типа IL-1, и его продукция коррелирует с такими патологическими состояниями, как ангиофолликулярная лимфоидная гиперплазия. Интерлейкин-8 (IL-8) представляет собой фактор хемотаксиса впервые идентифицированный и охарактеризованный в 1987 году. IL-8 присваивалось много различных имен, таких как белок 1 - аттрактант/активатор нейтрофилов(NAP-1), фактор хемотаксиса нейтрофилов из моноцитов (MDNCF), фактор активации нейтрофилов (NAF) и фактор хемотаксиса Тлимфоцитов. Подобно IL-1, IL-8 образуется несколькими типами клеток, включая мононуклеарные клетки, фибробласты, эндотелиальные клетки и кератиноциты. Его образование индуцируется IL-1, TNF и липополисахаридом (LPS).IL-8 стимулирует ряд клеточных функций invivo. Он является хемоаттрактантом для нейтрофилов, Т-лимфоцитов и базофилов. Он вызывает высвобождение гистамина из базофилов. Он вызывает высвобождение лизосомального фермента из нейтрофилов и скачок их клеточного дыхания, и было также показано увеличение экспрессии Мас-1 (CD11b/CD 18) на поверхности нейтрофилов без синтеза белка de novo. Сохраняется потребность в соединениях,эффективных при лечении рака, в развитии которого участвует RAF, а также в соединениях,которые тормозят, подавляют или являются антагонистами образования или активности цитокинов, таких как IL-1, IL-6, IL-8 и TNF. Резюме изобретения Настоящее изобретение относится к соединению, представленному формулой I: или фармацевтически приемлемой его соли, где:AR представляет собой ароматическую группу, содержащую 6-10 атомов; Х и X', каждый независимо представляют-(CH2)m-Y- (CH2)n-, где тип представляют собой целые числа от 0 до 4, таким образом, что суммаm и n равна от 0 до 6; Y представляет собой член, выбранный из группы, состоящей из прямой связи; О; S(O)у, с у, равным 0, 1 или 2; NRq',с Rq', как указано ниже; С(O); ОС(O); С(О)О;(Rq)3); С 2-4 алкенил (Rq)2-3 и С 2-4 алкинил (Rq)1-3; каждый из R' независимо представляет собой член, выбранный из группы, состоящей из: гидрокси; C1-6 алкил (Rq)3; С 3-8 циклоалкил (Rq)3;j и k независимо представляют целые числа от 0 до 3; 5 или гетероциклильную группу, арильную группу или гетероарильную группу; р представляет собой 1, 2 или 3 с условием, что когда р представляет 1, CR5R6 представляет 3, 4, 5 или 6-членную циклоалкильную группу или гетероциклильную группу, арильную группу или гетероарильную группу и, по меньшей мере, одно из j и k равны 1, 2 или 3;R9 представляет собой Н, отрицательный заряд уравновешен положительно заряженной группой или защитной группой; где независимо представляют моно или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)y, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы; Каждый Ra независимо представляет член,выбранный из группы, состоящей из: Н, C1-6 алкила, OC1-6 алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси,галогена, гидрокси, CN, CONH2, CONHC1-6 алкила, СОN(С 1-6 алкил)2, СО 2 Н, СО 2 С 1-6aлкила,С(О)C1-6 алкила, фенила, CF3, SN, NO2, SOyC1-6 алкила, с у, как указано выше;Rq" представляет собой Н, ОН или ОС 1-4 алкил. В описанное здесь изобретение включается также фармацевтическая композиция, которая включает соединение формулы 1, как описано выше, в комбинации с фармацевтически приемлемым носителем. Сюда включен также метод лечения рака,состоящий из введения млекопитающему пациенту, нуждающемуся в таком лечении, соединения формулы 1, как описано выше, в количестве, эффективном для лечения рака. 6 В изобретение включен также метод лечения патологии млекопитающих, опосредуемой цитокином, включающий введение млекопитающему пациенту, нуждающемуся в таком лечении, количества соединения формулы 1, эффективного для лечения указанной патологии,опосредуемой цитокином. Детальное описание изобретения Изобретение детально описывается в данном документе с помощью терминов, определяемых ниже, если это не отмечено специально. Термин "алкил" относится к радикалу, являющемуся производным моновалентного алкана (углеводорода), содержащему от 1 до 15 атомов углерода, если это специально не оговорено. Он может быть неразветвленным, разветвленным или циклическим. Предпочтительные неразветвленные или разветвленные алкильные группы включают метил, этил, пропил, изопропил, бутил и трет-бутил. Предпочтительные циклоалкильные группы включают циклопентил и циклогексил. Алкил включает также неразветвленную или разветвленную алкильную группу, которая содержит циклоалкиленовую часть или прерывается ею. Примеры включают: где х и у = от 0 до 10; и w и z = от 0 до 9. Алкиленовая и моновалентная алкильная часть(части) алкильной группы может быть присоединена в любой доступной точке присоединения к циклоалкиленовой части. Когда присутствует замещенный алкил,это относится к неразветвленной, разветвленной или циклической алкильной группе, как описано выше, замещенной 1-3 группами, как указано в отношении каждого переменной. Гетероалкил обозначает алкильную группу, содержащую от 2 до 15 углеродных атомов и прерванную 1-4 гетероатомами, выбранными из О, S и N. Термин "алкенил" относится к углеводородному неразветвленному, разветвленному или циклическому радикалу, содержащему от 2 до 15 углеродных атомов и, по меньшей мере, одну углерод-углеродную двойную связь. Предпочтительно, чтобы присутствовала одна углеродуглеродная двойная связь, и могут присутствовать до четырех неароматических (нерезонирующих) углерод-углеродных двойных связей. Предпочтительные алкенильные группы включают этенил, пропенил, бутенил и циклогексенил. Как описано выше в отношении алкила,неразветвленная, разветвленная или циклическая часть алкенильной группы может содержать двойные связи и может быть замещенной,когда используется замещенная алкенильная группа. 7 Термин "алкинил" относится к неразветвленному, разветвленному или циклическому углеводородному радикалу, содержащему от 2 до 15 углеродных атомов и, по меньшей мере,одну углерод-углеродную тройную связь. Может присутствовать до трех углерод-углеродных тройных связей. Предпочтительные алкинильные группы включают этинил, пропинил и бутинил. Как описано выше в отношении алкила,неразветвленная, разветвленная или циклическая часть алкинильной группы может содержать тройные связи и может быть замещенной,когда используется замещенная алкинильная группа. Арил относится к ароматическим кольцам,например, фенилу, замещенному фенилу и подобным группам, а также к конденсированным кольцам, например, нафтилу и ему подобным. Арил, таким образом, содержит, по меньшей мере, одно кольцо, имеющее, по меньшей мере,6 атомов, при этом присутствуют до двух таких колец, содержащих в себе до 10 атомов, с чередующимися (резонирующими) двойными связями между соседними углеродными атомами. Предпочтительными арильными группами являются фенил и нафтил. Арильные группы могут быть также замещенными, как описано выше. Предпочтительные замещенные арилы включают фенил и нафтил, замещенные одной или двумя группами. Термин "гетероарил" относится к моноциклической ароматической углеводородной группе, имеющей 5 или 6 атомов кольца, или бициклическую ароматическую группу, имеющую от 8 до 10 атомов, содержащую, по меньшей мере, один гетероатом, О, S или N, в которой атом углерода или азота служит точкой присоединения, и в которой один дополнительный углеродный атом необязательно замещен гетероатомом, выбранным из О или S, и в которой от 1 до 3 дополнительных углеродных атомов необязательно замещены гетероатомами азота. Гетероарильная группа необязательно замещена группами в количестве до трех. Гетероарил, таким образом, включает ароматическую и частично ароматическую группы,которые содержат один или более гетероатомов. Примерами этого типа являются тиофен, пурин, имидазопиридин, пиридин, оксазол,тиазол, оксазин, пиразол, тетразол, имидазол,пиридин, пиримидин, пиразин и триазин. Примерами частично ароматических групп являются тетрагидроимидазо-[4,5-с]пиридин, фталидил и сахаринил, как описано ниже. Каждый Ra независимо представляет член,выбранный из группы, состоящей из: Н, С 1-6 алкила, OC1-6 алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси,гало, гидрокси, CN, CONH2, CONH-C1-6 алкила,СON(С 1-6 алкил)2, СO2 Н, СО 2 С 1-6 алкила, С(О)C1-6 алкила, фенила, СF3, SH, NO2, SOyC1-6 алкила, с(C1-6-алкила), С 2-4 алкенила и С 2-4 алкинила. В замещенном аралкиле, в замещенном гетероаралкиле и в замещенном аралкокси арильная,гетероарильная или алкильная их части соответственно могут быть замещены. Замещенные алкил, арил и гетероарил и замещенные части аралкила, аралкокси, гетероаралкила, гетероаралкокси и подобные им группы замещаются 1-3 группами, выбранными из группы, состоящей из: галогена, гидрокси,циано, ацил, ациламино, аралкокси, алкилсульфонил, арилсульфонил, алкилсульфониламино,арилсульфониламино,алкиламинокарбонил,алкил, алкокси, арил, арилокси, аралокси, амино, алкиламино, диалкиламино и сульфониламино. Термины "гетероциклоалкил" и "гетероциклил" относятся к циклоалкильной группе(неароматической), в которой один из углеродных атомов в кольце замещен гетероатомом,выбранным из О, S(O)у или N, и в которой дополнительно до трех углеродных атомов могут быть замещены указанными гетероатомами. Когда в гетероцикле присутствуют три гетероатома, они не связаны между собой. Примерами гетероциклилов являются пиперидинил, морфолинил, пирролидинил, тетрагидрофуранил, имидазолинил, пиперазинил, пиролидин-2-он, пиперидин-2-он и подобные им. Термин "ацил", применяемый здесь, относится к -C(O)C1-6-алкилу и -С(O)-арилу. Ациламино относится к группе -NНС(O) С 1-6 алкилу и -NНС(O)арилу. Аралкокси относится к группе -OC1-6 алкиларилу. Алкилсульфонил относится к группе -SО 2 С 1-6 алкилу. Алкилсульфониламино относится к группе -NНSО 2 С 1-6 алкилу. Арилсульфониламино относится к группе -NНSО 2 арилу. Алкиаминокарбонил относится к группе -С(O)-NНSО 3 Н. Галоген означает Cl, F, Вr и I, выбранные независимо друг от друга. независимо представляют моно или бициклическую кольцевую систему, неароматические или частично ароматические, содержащие от 5 до 10 атомов в кольце, 1-4 из которых являются N и 01 из которых являются О или S(O)y, с у, равным 0, 1 или 2, и в случае частичной ароматизации, 9 их неароматическая часть необязательно может содержать 1-2 углеродных атома. Следовательно, эти кольцевые системы могут быть гетероарилом или гетероциклической системой, как указано выше. присоединена к НЕТСу через атом азота, содержащийся в кольцевой системе, или прямо или через связующую группу, которая является частью R'. Примеры включают фталидинил и сахаринил, как описывается далее ниже. сходным образом присоединена к НЕТЕСу, но через углеродный атом, содержащийся в кольцевой системе. Термин фталидинил относится к гетероарильной группе: Термин сахаринил относится к гетероарильной группе:(СН 2)kNR7R8. В -[C(O)(CH2)j-CR5R6-(CH2)k-NR7]p-R8 может быть от 1 до 3 групп -С(O)(CH2)j-CR5R6(CH2)k-NR7]-. Таким образом, - [С(О)(CH2)jCR5R6-(CH2)k-NR7]p-R8 с р, равным 1, 2 или 3 означает следующее:(CH2)jCO2R9. Переменные определяются независимо в пределах каждой группы. Так, например, когда j больше единицы, они могут быть такими же или отличаться. Величины R5 и R6 могут быть Н,C1-6 алкил (Rq)3 или арилом, или CR5R6, взятый в 10 комбинации, представляет собой 3-6-членный циклоалкильную или гетероциклильную группу,арильную группу или гетероарильную группу. Примеры приемлемых CR5R6 групп включают: Характер присоединения, упомянутый выше, может также включать соответствующие гетероатомы. Когда арильная или гетероарильная группа представлена CR5R6, присоединение не может происходить через тот же атом углерода. Термин "TNF-опосредуемая патология или патологическое состояние" относится к патологическим состояниям, при которых TNF имеет значение, либо благодаря образованию или повышенным уровням активности самого TNF,либо за счет стимуляции выделения другого монокина, такого как IL-1 или IL-6 не ограничиваясь ими. Патологическое состояние, при котором IL-1, например, является основным компонентом, и его образование или действие усиливается, или он секретируется в ответ на TNF,будет, таким образом, рассматриваться как патологическое состояние, опосредуемое TNF. Используемый здесь термин "цитокин" обозначает любой секретируемый полипептид,влияющий на функции клеток, и являющийся молекулой, которая модулирует взаимодействия между клетками при иммунной, воспалительной или гематопоэтической реакциях. Цитокин включает монокины и лимфокины, независимо от типа продуцирующих их клеток, но не ограничивается ими. Примеры цитокинов включают,но не ограничиваются этим, интерлейкин-1 (IL1), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8),фактор некроза опухолей альфа (TNF-a) и фактор некроза опухолей бета (TNF-b). Под термином "влияющие на цитокин или цитокинподавляющее количество" понимается эффективное количество соединения формулы I,которое вызывает снижение активности in vivo или уровня цитокина до нормального или субнормального уровня при назначении пациенту для профилактики или терапевтического лечения патологического состояния, которое усиливается или вызывается избыточной или нерегулируемой продукцией или активностью цитокина. Соединения настоящего изобретения могут содержать один или более асимметрических атомов углерода и могут находиться в рацемической или оптически активной формах. Все они включаются в объем настоящего изобретения. 11 Одна подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой присутствуют один или два R", каждый из которых независимо представляет собой член, выбранный из группы, состоящей из: NH2, NHC1-6 алкилNRq'С(О)NHC1-6 алкил (Rq)3. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой AR представляет собой фенильное кольцо, незамещенное или замещенное одной или двумя R группами. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой AR является фенилом и присутствуют одна или две R группы, которые выбираются из группы, состоящей из: гидроксила, галогена, C1-6 алкил(Rq)3, OC1-6 алкил (Rq)3, NH2 СF3 и NO2. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой каждыйR представляет собой галоген, гидрокси или СF3. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой НЕТСу представляет собой 5-6-членный неароматический гетероцикл с содержащимися в нем 1-2 атомами азота. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой каждыйR' выбирается из группы, состоящей из: C1-6 алкил (Rq)3, ОС 1-6 алкил (Rq)3, CN и NO2. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой Rq выбирается из Rq', CN, 001203(CH2)k-NR7]pR8, и -[NR7-(CH2)kCR5R6-(CH2)j (СО)]p-OR9. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой Rq представляет собой Н, С 1-4 алкил или ОС 1-4 алкил;aлкил (Rq)3 или один из R5 и R6 представляет собой арил, а другой является Н или C1-6 алкилaлкил (Rq)3, а R9 представляет собой Н. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой каждыйCON[C1-6aлкил (Rq)3] [С 3-8 циклоалкил (Rq)3]; С(О)арил (Rq)3 и С(О)гетероарил (Rq)3; р представляет собой 1, 2 или 3, и все другие переменные соответствуют указанному выше. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой каждыйRq" представляет Н или ОН; арил; представляет бициклическую частично ароматическую группу, выбранную из фталидина или сахаринила, и представляет пиперидинил. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой каждый представляет бициклическую частично ароматическую группу, выбранную из фталидила и сахаринила, и представляет пиперидинил. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой R' представляет член, выбранный из группы, состоящей из: CONH2; CO2 Н; CO2C1-6aлкил (Rq)3; С(О)C1-6 алкил (Rq)3; и -[С(O)(СН 2)j-СR5R6-(CH2)k-NR7]pRq представляет Н, С 1-4 алкил или ОС 1-4 ал р представляет собой 1;k представляет собой 0, 1 или 2; и каждый R7 и R8 предпочтительно представляют собой Н или C1-6 алкил (Rq)3. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой Rx является Н или C1-6 алкил (Rq)3. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой X' представляет собой прямую связь. Другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которой Х представляет собой -(CH2)m-Y-(СН 2)n-. Y представляет собой прямую связь, О, S или С(O); m представляет собой 0 или 1, и n представляет 0 или 1. Более конкретно другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулыI, в которой Х представляет собой прямую связь. Более конкретно в отношении, связанном с изобретением, подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы I, в которойAR представляет собой фенил или нафтил; Х и X' представляют собой -(СН 2)m-Y(СН 2)n-, в которой m и n равны нулю и Y является связью; НЕТСу представляет собой пирролидинильную или пиперидинильную группу; присутствуют одна или две R группы и выбираются из группы, состоящей из: гало, гидрокси, C1-6 алкил (Rq)3, OC1-6 алкил (Rq)3, CN,NH2, СO2 Н, СF3, NO2 и CO2NH2; присутствуют одна или две R' группы и выбираются из группы, состоящей из C1-6 алкилRq" представляет собой Н или ОН; представляет фталидил или сахаринил, и представляет пиперидинил. Более конкретно другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы-(CH2)m-Y-(СН 2)n-, в которой m и n представляют целые числа в диапазоне от 0 до 4, так что сумма m и n равняется от 0 до 6; Y представляет собой член, выбранный из группы, состоящей из: прямой связи; О; S(O)у, с у равным 0, 1 или 2; NRq', с Rq' как описано ниже; С(О); ОС(O); С(O)O; SOxNRq' с х равным 1 или 2, и Rq' как описано ниже; NRq'SOx; С(О)NRq' и NRq'С (О); представляет 4-10-членный неароматический гетероцикл, содержащий, по меньшей мере, один атом N и необязательно содержащий 1-2 дополнительных N атомов и 0-1 О или S атомов;Rx представляет Н, C1-6 алкил (Rq)3, OC1-6 алкил (Rq)3, или С(О)C1-6 алкил (Rq)3; каждый R независимо представляет собой член, выбранный из группы, состоящей из: галогена; гидрокси; C1-6 алкил (Rq)3; OC1-6aлкил(Rq)2-3 и С 2-4 алкинил (Rq)1-3; каждый R" независимо представляет собой член, выбранный из группы, состоящей из: галогена; гидрокси; C1-6 алкил (Rq)3; OC1-6aлкилaлкил (Rq)3; NRq'C(O)NH(C1-6 алкил (Rq)3); С 2-4 алкенил (Rq)2-3 и С 2-4 алкинил (Rq)1-3; каждый R' независимо представляет собой член, выбранный из группы, состоящей из гидрокси; C1-6 алкил (Rq)3; С 3-8 циклоалкил (Rq)3;j и k независимо представляют целые числа от 0 до 3;R5 и R6 независимо являются Н, арил, C15 6 6 алкил (Rq)3, или же CR R в комбинации представляет 3, 4, 5 или 6-членную циклоал-кильную или гетероциклильную группу, арильную группу или гетероарильную группу; р представляет собой 1, 2 или 3 с условием, что когда р представляет 1, CR5R6 представляет 3, 4, 5 или 6-членную цикло-алкильную группу или гетероциклильную группу, арильную группу или гетероарильную группу и, по меньшей мере, одно из j и k равны 1, 2 или 3;R9 представляет собой Н, отрицательный заряд уравновешен положительно заряженной группой или защитной группой; где независимо представляют моно или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)y, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы; каждый Ra независимо представляет член,выбранный из группы, состоящей из: Н, C1-6 алкила, ОС 1-6 алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси,галогена, гидрокси, CN, CONH2, CONHC1-6 алкила, СОN(С 1-6 алкил)2, СО 2 Н, СО 2 С 1-6 алкила,С(О)C1-6 алкила, фенила, СF3, SN, NO2, SOyC1-6 алкила, с у, как указано выше; SO2NH2, 001203Rq' представляет собой Н, ОН, С 1-4 алкил,-ОС 1-4 алкил, арил или С(О)С 1-4 алкил, и Rq" представляет собой Н, ОН или ОС 1-4 алкил. В этой подгруппе другое соединение настоящего изобретения, представляющее интерес, относится к соединениям формулы I, в которой Х представляет связь. Более конкретно подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы Iа: или фармацевтически приемлемые их соли, где: Х и X', каждый независимо представляют (CH2)m-Y-(CH2)n-, где m и n представляют собой целые числа от 0 до 4, таким образом, что сумма 17 каждый R' независимо представляет собой член, выбранный из группы, состоящей из: гидрокси; C1-6 алкил (Rq)3; С 3-8 циклоалкил (Rq)3; где независимо представляют моно- или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)у, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы; каждый Ra независимо представляет член,выбранный из группы, состоящей из: Н, C1-6 алкила, OC1-6 алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси,галогена, гидрокси, CN, CONH2, CONHC1-6 алкила, CON(C1-6 алкил)2, СO2 Н, СO2 С 1-6 алкила,С(О)C1-6 алкила, фенила, СF3, SN, NO2, SOyC1-6 алкила, с у, как указано выше; SO2NH2,SO2NHC1-6aлкилa, NHSO2 (замещенного арила),NHSO2 (замещенного гетероарила), NНSО 2 С 1-6 алкила, NHSO2apилa, NHSO2 гeтepoapилa, NH2,N(C1-6 алкила)2,NHC(О)C1-6Rq" представляет собой Н, ОН или ОС 1-4 алкил. Более конкретно другая подгруппа соединений настоящего изобретения, представляющая интерес, относится к соединениям формулы 1b: или фармацевтически приемлемыми их солями,где:(Rq)3); С 2-4 алкенил (Rq)2-3 и С 2-4 алкинил (Rq)1-3; каждый R' независимо представляет собой член, выбранный из группы, состоящей из гидрокси; C1-6 алкил (Rq)3; С 3-8 циклоалкил (Rq)3; независимо представгде ляют моно- или бициклические кольцевые системы, неароматические или частично ароматические, состоящие из 5-10 атомов кольца, 1-4 из которых являются N и 0-1 из которых являются О или S(O)у, с у равным 0, 1 или 2, необязательно содержащие 1-2 карбонильные группы; каждый Ra независимо представляет член,выбранный из группы, состоящей из: Н, C1-6 алкила, OC1-6 алкила, аралкила, замещенного аралкила, гетероаралкила, замещенного гетероаралкила, аралкокси, замещенного аралкокси,галогена, гидрокси, CN, CONH2, CONHC1-6 алкила, СОN(С 1-6 алкил)2, СО 2 Н, CO2C1-6 алкила,С(О)C1-6 алкила, фенила, СF3, SN, NO2, SOyC1-6 алкила, с у, как указано выше; SO2NH2,SO2NHC1-6aлкилa, NHSO2 (замещенного арила),NHSO2 (замещенного гетероарила), NНSO2 С 1-6 алкила, NНSО 2 арила, NНSО 2 гетероарила, NH2,NHC1-6 алкила,N(С 1-6 алкила)2,NHC(О)C1-6 алкила, NНС(O)NН(С 1-6 алкила), С 2-4 алкенила и С 2-4 алкинила;Rq" представляет собой Н, ОН или ОС 1-4 алкил. Характерные примеры соединений настоящего изобретения включают следующие варианты: 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-пиперидин-1-карбоновой кислоты трет-бутиловый эфир; 4-бензил-[4-(4-фторфенил)-5-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-карбоновой кислоты трет-бутиловый эфир; 3-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-пиперидин-1-карбоновой кислоты трет-бутиловый эфир; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-1-ацетилпиперидин; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-пиперидин; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-1-метил-пиперидин; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-1-бензил-пиперидин; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-1-этилпиперидин; 4-[5-(3,4-дихлорфенил)-4-пиридин-4-ил 1 Н-имидазол-2-ил]-пиперидин; 4-[5-(3,4-дихлорфенил)-4-пиридин-4-ил 1 Н-имидазол-2-ил]-1-метилпиперидин; 2-(4-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-ил-бутил)изоиндол-1,3-дион; 2-(5-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илпентил)-изоиндол-1,3-дион; 2-(6-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илгексил)-изоиндол-1,3-дион; 4-[5-(3,4-дихлорфенил)-4-пиридин-4-ил 1 Н-имидазол-2-ил]-1-бензилпиперидин; 2-(5-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илпентил)-2,3-дигидро-изоиндол-1-он; 4-(4-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-ил-этил)пиридин; 2-(5-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илпентил)-1,1-диоксобензо[d]изотиазол-3-он; 2-(4-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-ил-бутил)1,1-диоксобензо[d]изотиазол-3-он; 4-[5-(3-гидроксифенил)-4-пиридин-4-ил 1 Н-имидазол-2-ил]-1-метилпиперидин; 3-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-пиперидин; 3-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил)-1-метилпиперидин; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-1,4-диметилпиперидин; 4-бензил-[4-(4-фторфенил)-5-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-карбоновой кислоты трет-бутиловый эфир; 4-бензил-[4-(4-фторфенил)-5-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин; 2-амино-1-5-[4-(3,4-дихлорфенил)-4 пиридин-4-ил-1 Н-имидазол-2-ил]-пиперидин-1 ил-этанон; 4-5-(3,4-дихлорфенил)-2-[1-(2-фенилэтил)-пиперидин-4-ил]-1 Н-имидазол-4 илпиридин; 4-5-(3,4-дихлорфенил)-2-[1-(3 фенилпропил)-пиперидин-4-ил]-1 Н-имидазол-4 ил-пиридин; 2-(6-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илгексил)-1,1-диоксобензо[d]изотиазол-3-он; 2-(3-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илпропил)-1,1-диоксобензо[d]изотиазол-3-он; 4-(5-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-ил-метилимидазол-1-ил-метил)-бензонитрил; 4-[2-[1-(4-бензилоксибензил)-пиперидин-4 ил-5-(3,4-дихлорфенил)-1H-имидазол-4-илпиридин; 4-[4-фторфенил)-3-пиридин-ил-1 Нимидазол-2-ил]-1-ацетилпиперидин; 3-[(4-фторфенил)-3-пиридин-ил-1 Нимидазол-2-ил]-1-ацетилпиперидин; и 2-(3-4-[5-(3,4-дихлорфенил)-4-пиридин-4 ил-1 Н-имидазол-2-ил]-пиперидин-1-илпропил)-изоиндол-1,3-дион,а также их фармацевтически приемлемые соли. 21 Дополнительные примеры соединений настоящего изобретения можно найти в следующей таблице: а также их фармацевтически приемлемые соли. Дополнительные примеры соединений настоящего изобретения представляют собой следующее: 4-[5-(3,4-дихлорфенил)-4-пиридин-4-ил 1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты бензиловый эфир; 4-[5-(3-метоксифенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]пиперидин-1-карбоновой кислоты трет-бутиловый эфир; 4-[5-(4-фторфенил)-4-пиридин-4-ил-1 Нимидазол-2-ил]-4-метилпиперидин-1 карбоновой кислоты трет-бутиловый эфир; 4-[1-пропил-5-пиридин-4-ил-4-(3-трифторметилфенил)-1H-имидазол-2-ил]пиперидин-1 карбоновой кислоты бензиловый эфир; 4-[1-гидрокси-5-(2-фторпиридин-4-ил)-4(3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты бензиловый эфир; 4-[5-(2-фторпиридин-4-ил)-4-(3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты бензиловый эфир; 4-[5-(2-фторпиридин-4-ил)-1-метил-4-(3 трифторметилфенил)-1 Н-имидазол-2-ил]-пиперидин-1-карбоновой кислоты бензиловый эфир и(S)-4-[5-(2-(1-фенилэтиламино)пиридин-4 ил)-1-метил-4-(3-трифторметилфенил)-1 Нимидазол-2-ил]-пиперидин-1-карбоновой кислоты бензиловый эфир. Соединения настоящего изобретения получаются с помощью методов, иллюстрируемых прилагаемыми схемами. Два основных способа получения имидазольного ядра представлены на схемах 1 и 2. В первом методе соответственно защищенный пиколиловый спирт подвергается удалению протона с помощью сильного основания, такого как н-бутил лития или диизопропиламид лития, и полученный анион вступает в реакцию с соответствующим N,O-диметилгидроксамидом для получения защищенного альфа-гидроксикетона. Защищенный альфагидроксикетон затем конденсируется с соответствующим образом активированным и защищенным аминоальдегидом в присутствии ацетата аммония, уксусной кислоты и ацетата меди. Все альдегиды, используемые в настоящих примерах, содержат соответствующим образом защищенный атом азота. После формирования имидазольного ядра с азота снимается защита, и затем он взаимодействует с соответствующим электрофильным реагентом для получения конечных соединений. Во втором методе соответственно защищенный пиколиловый спирт подвергается удалению протона с помощью сильного основания,такого как н-бутил лития или диизопропиламид лития, и полученный анион вступает в реакцию с подходящим ариловым или алкиловым альдегидом для получения моно-защищенного диола. Защитная группа удаляется и образующийся диол окисляется (методом Swern или Moffat) до диона. Дион затем конденсируется с соответствующим образом активированным и защищенным аминоальдегидом в присутствии ацетата аммония в уксусной кислоте для получения имидазола. 25 Тем же способом осуществляется снятие защиты с азота и проводится реакция с соответствующим электрофильным реагентом для получения соединений формулы I. Дополнительный способ получения соединений, описываемых в изобретении показан на схеме 6. Анион 4-диметоксиметилпиридина образуется с помощью сильного основания, такого как н-бутил лития и гасится электрофилом, например, соответствующим образом замещенным галидом бензила. Кеталь затем гидролизуется в кислых условиях и вводится оксимовая группа обработкой соответствующим алкилом или нитритом металла в кислой среде. Оксиминокетон может быть затем конденсирован соответствующим образом защищенным гетероциклическим альдегидом и амином для получения имидазол-N-оксида. Восстановление соответствующего имидазола может быть затем проведено при различных условиях, например, с помощью хлорида титана (III). Последующее снятие защиты позволяет получить желаемые соединения. Следующий способ получения соединений представлен на схеме 7. Анион 2-фтор-4 метилпиридина образуется с помощью сильного основания, такого как диизопропиламид лития и гасится соответствующим образом замещеннымN-метокси-О-метоксиамидом для получения кетона. Затем может быть введена оксииминогруппа, например, обработкой алкилнитритом в кислой среде. Конденсация с соответственно защищенным гетероциклическим альдегидом и ацетатом аммония в уксусной кислоте позволяет после восстановления получить имидазол. Фторпиридиновый заместитель может быть затем заменен нуклеофилом, например, первичным или вторичным амином для получения замещенного пиридина, с которого может быть снята защита. Схема 1 При использовании в приведенных выше схемах TBDMSO относится к т-бутилдиметилсилилокси, TFAA относится к трифторуксусному ангидриду, TBDMS относится к т-бутилдиметилсилилу, TBAF относится к тетрабутиламмония фториду, Cbz относится к карбокисбензилу, Ас относится к ацетилу, LDA относится к диизопропиламиду лития и EDC относится к этилдиметиламинопропил карбодиимиду. Е представляет собой электрофил, присоединенный к атому азота гетероциклического кольца. Примеры приемлемых электрофилов включают галиды алкила, трифлаты алкила,мезилаты алкила, галиды бензила, винилпиридин и подобные им. Таким образом, Е представляет алкил, бензил, пиридилэтил и им подобные. 29 Соединения настоящего изобретения применимы в различных фармацевтически приемлемых солевых формах. Термин "фармацевтически приемлемая соль" относится к тем солевым формам, которые могли бы быть бесспорно приемлемы для химика-фармацевта, то есть такие соли, которые не обладают явным токсическим действием и которые обеспечивают желаемые фармакокинетические свойства, вкусовые качества, всасывание, распределение, метаболизм или экскрецию. Другими факторами,более значимыми для практики, которые также важны при выборе, являются стоимость исходных материалов, легкость кристаллизации, выход, стабильность, гигроскопичность и подвижность получаемой крупной (молекулы) лекарства. Традиционно фармацевтические композиции могут быть получены из активных составляющих в комбинации с фармацевтически подходящими носителями. Фармацевтически подходящие соли соединений формулы I включают общепринятые нетоксичные соли или четвертичные соли аммония соединений формулы I, образуемые, например, из нетоксических неорганических или органических кислот. Например, нетоксичные соли включают соли неорганических кислот, таких как соляная, бромистоводородная, серная,сульфаминовая, фосфорная, азотная и тому подобных; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая,pamoic, сульфаниловая, 2-ацетоксибенойная,фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтионовая, трифторуксусная и тому подобное. Фармацевтически приемлемые соли настоящего изобретения могут быть синтезированы общепринятыми химическими методами. В общем виде, соли готовятся с помощью за счет реакции свободного основания или кислоты со стехиометрическими количествами или с избытком желаемых для образования соли неорганической или органической кислоты или основания в подходящем растворителе или комбинации растворителей. Соединения настоящего изобретения могут иметь асимметрические центры и существовать как рацематы, рацемические смеси и как индивидуальные диастереомеры. Все такие изомеры, включая оптические изомеры, включаются в настоящее изобретение. Описываемое здесь изобретение также включает фармацевтическую композицию, состоящую из описываемого здесь соединения в комбинации с фармацевтически приемлемым носителем. Описываемое здесь изобретение также включает способ лечения рака, состоящий из введения млекопитающему пациенту, нуждающемуся в таком лечении, описываемого здесь 30 соединения в количестве, эффективном для лечения рака. Описываемое здесь изобретение также включает способ лечения заболевания млекопитающего, опосредуемого цитокинами, включающий введение млекопитающему пациенту,нуждающемуся в таком лечении, количества описываемого здесь соединения в количестве,эффективном для лечения указанного заболевания, опосредуемого цитокинами. Особый интерес представляет способ лечения воспаления у млекопитающего пациента,нуждающегося в таком лечении, который включает введение указанному пациенту эффективного в плане антивоспалительного действия количества описываемого здесь соединения. Другим способом, представляющим особый интерес, является способ лечения заболевания, опосредуемого цитокинами, как описывается здесь, в случае, если этим заболеванием является остеопороз. Другим способом, представляющим особый интерес, является способ лечения заболевания, опосредуемого цитокинами, как описывается здесь, в случае, если этим заболеванием является резорбция кости, не обусловленная остеопорозом. Еще одним способом, представляющим особый интерес, является способ лечения заболевания, опосредуемого цитокинами, как описывается здесь, в случае, если этим заболеванием является болезнь Крона. Это изобретение также относится к способу подавления рака у млекопитающего, нуждающегося в таком лечении, который включает введение указанному млекопитающему количества соединения формулы I, которое эффективно для лечения рака. Такой способ включает лечение рака мозга, урогенитального тракта,лимфатической системы, желудка, гортани и легкого. Кроме того, такой метод включает лечение гистиоцитной лимфомы, аденокарциномы легких и мелкоклеточных раковых опухолей легких. При введении пациенту для лечения рака применяемая доза может изменяться в зависимости от типа рака, возраста и общего состояния пациента, особенностей вводимого соединения, наличия или уровня токсичности или неблагоприятных эффектов, выявленных для лекарства в эксперименте, и других факторов. Характерным примером приемлемого интервала доз являются дозы от нижней около 0,01 мг/кг до верхней около 100 мг/кг. Однако, вводимая доза обычно оставляется на выбор врача. Это изобретение также относится к способу торможения цитокина или цитокинов у млекопитающего, нуждающегося в этом, который включает введение упомянутому млекопитающему эффективного количества соединения формулы I для торможения названного цитокина или цитокинов до нормального уровня или 31 в некоторых случаях до уровня ниже нормы для облегчения, предотвращения или лечения патологического состояния. Соединения формулы I могут быть применены в профилактике или терапевтическом лечении патологических состояний у млекопитающих, которые усиливаются или вызываются избыточными или нерегулируемыми цитокинами, более конкретно IL-1, IL-6, IL-8 или TNF. Поскольку соединения формулы I тормозят цитокины, такие как IL-1, IL-6, IL-8 и TNF,соединения пригодны для лечения заболеваний,в которые вовлечены наличие или активность цитокина, таких как ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния. Соединения формулы I также пригодны для лечения других патологических состояний,опосредуемых избыточным или нерегулируемым образованием или активностью TNF. Такие заболевания включают, не ограничиваясь ими,сепсис, септический шок, эндотоксический шок,грамотрицательный сепсис, синдром токсического шока, синдром респираторного дистресса взрослых, церебральную малярию, хроническое воспаление легких, силикоз, многоочаговую саркому легких, заболевания, связанные с резорбцией костей, такие как остеопороз, недостаточность кровоснабжения, реакции трансплантата против хозяина, отторжение аллотрансплантата, лихорадку и миальгию, вызванных инфекцией, вторичную кахексию, вызванную инфекцией или малигнизацией, вторичную кахексию, вызванную синдромом приобретенного иммунодефицита (AIDS), AIDS, комплекс, связанный с AIDS (ARC), образование келоида,образование рубцовой ткани, болезнь Крона,язвенный колит, пирез, AIDS и другие вирусные инфекции, такие как цитомегаловирусная(CMV), инфекции, индуцируемые вирусом гриппа и вирусами семейства Герпес (Неrреs),такими как Herpes Zoster или Simplex I или II. Соединения формулы I применимы также местно, при лечении воспалительных состояний, таких как ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния; воспаление суставов, экзема, псориаз или другие воспалительные состояния кожи, такие как солнечный ожог; воспалительные состояния глаза,включая конъюнктивит; пирез, боль и другие состояния, связанные с воспалением. Соединения формулы I применимы также для лечения заболеваний, характеризующихся избыточной активностью IL-8. Эти патологические состояния включают псориаз, воспалительные заболевания кишечника, астму, недостаточность кровоснабжения сердца и почек,синдром респираторного дистресса взрослых,тромбоз и гломерулонефрит. Изобретение, таким образом, включает способ лечения псориаза, воспалительного за 001203 32 болевания кишечника, астмы, недостаточности кровоснабжения сердца и почек, синдрома респираторного дистресса взрослых, тромбоза и гломерулонефрита у млекопитающего, нуждающегося в таком лечении, который включает введение названному млекопитающему соединения формулы I в количестве, эффективном для лечения указанной болезни или состояния. При введении пациенту для лечения заболевания, в развитие которого вовлечены цитокин или цитокины применяемая дозировка может варьировать в зависимости от типа заболевания, возраста и общего состояния пациента,особенностей вводимого соединения, наличия или уровня токсичности или неблагоприятных эффектов, выявленных для лекарства в эксперименте, и других факторов. Характерным примером приемлемого интервала доз являются дозы от нижней около 0,01 мг/кг до верхней около 100 мг/кг. Однако, вводимая доза обычно оставляется на выбор врача. Методы лечения преимущественно выполняются доставкой соединения формулы I парентерально. Используемый здесь термин "парентеральный" включает внутривенное, внутримышечное или внутрибрюшинное введение. В целом предпочтительны подкожная и внутримышечная формы парентерального введения. Настоящее изобретение может также осуществляться доставкой соединения формулы I подкожно, интраназально, интраректально, внутрикожно или интравагинально. Соединения формулы I могут также вводиться с помощью ингаляции. "Ингаляция" означает введение с помощью интраназальной или пероральной ингаляции. Подходящие формы дозировки для такого введения, такие как аэрозольный состав или градуированный по дозам ингалятор могут быть приготовлены общепринятыми методами. Изобретение также относится к фармацевтической композиции, включающей соединение формулы I и фармацевтически приемлемый носитель. Соединения формулы I могут быть также включены в фармацевтическую композицию в комбинации со вторым терапевтически активным соединением. Применяемый фармацевтический носитель может быть, например, твердым, жидким или газообразным. Примеры твердых носителей включают лактозу, белую глину, сахарозу,тальк, желатин, агар, пектин, камедь, стеарат магния, стеариновую кислоту и тому подобное. Примерами жидких носителей являются сироп,арахисовое масло, оливковое масло, вода и тому подобное. Примеры газообразных носителей включают диоксид углерода и азот. Сходным образом носитель или растворитель могут включать замедляющее вещество,хорошо известное в этой области науки, такое как моностеарат глицерина или дистеарат глицерина, отдельно или вместе с воском. 33 Может быть использовано широкое разнообразие фармацевтических форм дозировки. Если для перорального введения применяется твердая форма дозировки, то препарат может быть в форме таблетки, твердой желатиновой капсулы, пастилки или лепешки. Количество твердого носителя может широко варьировать,но в целом может составлять от около 0,025 мг до около 1 г. Когда желательна жидкая форма дозировки для перорального введения, препарат находится обычно в форме сиропа, эмульсии,мягкой желатиновой капсулы, суспензии или раствора. Когда используется парентеральная форма дозировки лекарство может быть в твердой или жидкой форме и может быть составлено для введения прямо или может быть пригодным для окончательного приготовления. Включены также формы дозировки для местного действия. Примерами форм дозировки для местного действия являются твердые, жидкие и полутвердые составы. Твердые составы могут включать порошковые присыпки, припарки и тому подобное. Жидкости включают растворы, суспензии и эмульсии. Полутвердые составы включают кремы, мази, желе и тому подобное. Количество соединения формулы I, используемого местно, конечно, меняется в зависимости от выбранного соединения, природы и тяжести состояния и может меняться в соответствии с выбором врача. Характерная местная доза соединения формулы I составляет по нижнему пределу около 0,01 мг и по верхнему пределу около 2 г, вводимая от одного до четырех раз, предпочтительно один, два раза в день. Для местного введения активный ингредиент может составлять от около 0,001 % до около 10 весовых процентов. Капли, согласно настоящему изобретению,могут составлять стерильные или нестерильные водные или масляные растворы или суспензии,и могут быть приготовлены растворением активного ингредиента в подходящем водном растворе, включающем необязательно бактерицидный и/или фунгицидный агент и/или любой другой подходящий защитный агент и по желанию включающий поверхностно-активный агент. Полученный раствор может быть затем осветлен фильтрацией, перенесен в подходящий контейнер, который затем запаивается и стерилизуется автоклавированием или выдерживанием при 98-100 С в течение получаса. В противоположном варианте раствор может быть стерилизован фильтрацией и перенесен в контейнер в асептических условиях. Примерами бактерицидных и фунгицидных агентов, пригодных для включения в капли, служат ртутьнитратфенил или ртутьацетатфенил (0,002%), бензалкония хлорид (0,01%) и хлорогексидина ацетат(0,01%). Подходящие растворители для получения масляных растворов включают глицерин,разведенный спирт и пропиленгликоль. 34 Примочки в соответствии с настоящим изобретением включают такие примочки, которые пригодны для нанесения на кожу или глаз. Примочка для глаза может включать стерильный водный раствор, необязательно содержащий бактерицидный агент, и может быть получена методами, сходными с таковыми для приготовления капель. Примочки или линименты для нанесения на кожу могут также включать агент для быстрого высушивания и охлаждения кожи, такой как спирт или ацетон и/или увлажнитель, такой как глицерин или масло, такое как касторовое масло или арахисовое масло. Кремы, мази или пасты в соответствии с настоящим изобретением являются полутвердыми составами активного ингредиента для поверхностного нанесения. Они могут быть получены смешиванием активного ингредиента в мелкодисперсной форме или в форме порошка,отдельно или в растворе, или суспензии в водной или неводной жидкости, с жировой или нежировой основой. Основа может включать углеводороды, такие как твердый, мягкий или жидкий парафин, глицерин, пчелиный воск, металлическое мыло; камедь; масло природного происхождения, такое как миндальное, кукурузное, арахисовое, касторовое или оливковое масло; ланолин или его производные, или жирная кислота, такая как стеариновая или олеиновая кислота совместно со спиртом, таким как пропиленгликоль или макрогели. Состав может включать любой пригодный поверхностноактивный агент, такой как анионный, катионный или неионный сурфактант, такой как эфиры сорбитана или их полиоксиэтиленовые производные. Могут быть включены также суспендирующие агенты, такие как природные смолы,производные целлюлозы или неорганические материалы, такие как кремнеземы и другие ингредиенты, такие как ланолин. Пример 1. 4-[5-(4-Фторфенил)-4-пиридин 4-ил-1 Н-имидазол-2-ил]-пиперидин-1 карбоновой кислоты трет-бутиловый эфир. Стадия 1-А. 1-(4-Фторфенил)-2-гидрокси 2-пиридин-4-ил-этанона трет-бутилдиметилсилиловый эфир. К перемешиваемому раствору диизопропиламина (0,42 моля, 42,5 г) в THF (400 мл),охлажденному до -78 С добавляли н-бутил лития (0,42 моля, 263 мл, 1,6 М раствора в гексанах). Температуру реакционной смеси увеличивали до -20 С и добавляли 4-пиридилкарбинола трет-бутилдиметилсилиловый эфир (0,32 моля,67,0 г) в THF (100 мл). Реакционную смесь перемешивали при -20 С в течение 0,5 ч и добавляли 4-фторфенил-N,О-диметилбензгидрокса 35 мид и раствор перемешивали при -20 С в течение 0,5 ч. Реакционную смесь разводили 1 л насыщенного водного бикарбоната натрия, фазы разделяли и водный слой экстрагировали этилацетатом (2 х 200 мл). Объединенные органические слои промывали насыщенным раствором соли, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Сухой остаток хроматографировали на двуокиси кремния и элюировали 20% ЕtOАс:гексаном. Чистые фракции собирали и упаривали при пониженном давлении для получения 74,65 г светло-оранжевого масла. 1N-третичный бутоксикарбонил-4-пиперидина карбальдегид (1,7 ммоля, 0,35 г), аммония ацетат (15,0 ммолей, 1,15 г), ацетат меди (3,0 ммоля, 0,54 г). Реакционную смесь нагревали с обратным холодильником в течение 1 ч. После этого реакционную смесь выливали в охлажденный на ледяной бане 30% водный аммония гидрохлорид (100 мл) и этилацетат (50 мл) и эту смесь перемешивали в течение 0,5 ч. Фазы разделяли и водную фазу экстрагировали этилацетатом (50 мл). Органические слои объединяли,промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния с использованием для элюрования 2,5% MeOH:CH2Cl2. Фракции, содержащие продукт, собирали и упаривали при пониженном давлении. Полученный пенистый продукт кристаллизовали из диэтилового эфира для получения 0,28 г соединения,поименованного в заголовке в виде белого порошка. т.п.=157-160 С. 1 36 Стадия 2-А. 4-Бензилпиперидин-1,4 дикарбоновой кислоты трет-бутилового эфира этиловый эфир. К перемешиваемому раствору диизопропиламина (38,0 ммоля, 3,84 г) в THF (50 мл),охлажденному до -78 С, добавляли по каплям нбутил лития (41,2 ммоля, 16,5 мл, 1,6 М раствора в гексане). К этому раствору добавляли пиперидин-1,4-дикарбоновой кислоты трет-бутилового эфира этиловый эфир (31,7 ммоля, 8,16 г) в 20 мл THF. Реакционную смесь перемешивали в течение 5 мин и добавляли бензилбромид (31,7 ммоля, 5,42 г). Реакционную смесь затем нагревали до комнатной температуры. Затем реакционную смесь разводили этилацетатом (200 мл) и промывали 10% KHSO4. Водные слои экстрагировали этилацетатом (100 мл). Органические фазы объединяли, промывали насыщенным раствором соли и высушивали над безводным сульфатом натрия. Раствор фильтровали и упаривали при пониженном давлении для получения 12,13 г поименованного в заголовке соединения в виде желтого масла. 1(m, 2H), 2,90-2,70 (m, 4H), 2,15-2,02 (m, 2H),1,50-1,35 (m, 3H), 1,44 (s, 9H), 1,18 (t, J=6,9 Гц,3H). Стадия 2-В. 4-Бензилпиперидин-1,4-дикарбоновой кислоты трет-бутиловый эфир. К перемешиваемому раствору 4-бензилпиперидин-1,4-дикарбоновой кислоты третбутилового эфира этилового эфира (31,6 ммоля,11,01 г) в изопропиловом спирте (50 мл) и THF(50 мл) добавляли 3N NaOH (63,4 ммоля, 21,1 мл) и двухфазный раствор нагревали с обратным холодильником. Реакционную смесь нагревали в течение 8 ч и затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь затем разводили водой (200 мл) и подкисляли до рН=4 ледяной уксусной кислотой. Водную смесь экстрагировали затем этилацетатом (2 х 500 мл). Органические слои объединяли, промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Полученный твердый продукт растирали в порошок в диэтиловом эфире для получения 6,7 г белого твердого вещества. 1(60 мл) добавляли тионилхлорид (13,8 ммоля,1,64 г) и пиридин (0,2 мл). Реакционную смесь перемешивали при комнатной температуре в 37 течение 1 ч. Реакционную смесь упаривали затем при пониженном давлении и остаток переносили в CH2Cl2 (50 мл). К этому раствору добавляли N,O-диметилгидрокисиламина гидрохлорид (13,8 ммоля, 1,35 г) и триэтиламин (25,0 ммолей, 2,53 г). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разводили затем CH2Cl2(100 мл) и промывали 10% KHSO4 (100 мл) и насыщенным бикарбонатом натрия (100 мл). Органические слои промывали солевым раствором, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток упаривали из этилового эфира:гексана для получения 4,14 г соединения, поименованного в заголовке в виде белого твердого вещества. 1 Н NMR (CDCl3) d 7,30-7,18 (m, 3H), 7,14 7,00 (m, 2H), 4,02-3,75 (m, 2H), 3,66(s, 3H), 3,20(s, 3H), 3,12-2,85 (m, 4H), 2,30-2,15 (m, 2H), 1,501,35 (m, 2H), 1,44 (s, 9H). Стадия 2-D. 2-(трет-бутилдиметилсилилокси)-1-(4-фторфенил)-2-пиридин-4-ил-этанон. К перемешиваемому раствору 4-(метоксиметилкарбамоил)-пиперидин-1-карбоновой кислоты трет-бутилового эфира (1,0 г, 2,8 ммоля) в THF (10 мл) добавляли алюмогидрид лития (2,8 ммоля, 2,8 мл в 1 М растворе THF). Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч. Реакцию затем гасили водой (2 мл) и разводили этилацетатом (50 мл). Реакционную смесь фильтровали, фильтрат промывали 10% KHSO4 (50 мл), солевым раствором сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении для получения 0,82 г соединения, поименованного в заголовке в виде бесцветного масла. 1(m, 3H), 7,06-6,98 (m, 2H), 4,02-3,75 (m, 2H),2,90-2,68 (m, 2H), 2,80 (s, 2H), 2,00-1,85 (m, 2H),1,50-1,35 (m, 2H), 1,44 (s, 9H). Стадия 2-Е. 4-Бензил-4-[4-(4-фторфенил)5-пиридин-4-ил-1 Н-имидазол-2-ил]пиперидин 1-карбоновой кислоты трет-бутиловый эфир. К перемешиваемому раствору 2-(третбутилдиметил-силилокси)-1-(4-фторфенил)-2 пиридин-4-ил-этанона (2,4 ммоля, 0,80 г) в уксусной кислоте (10 мл) добавляли 4-бензил-4 формилпиперидин-1-карбоновой кислоты третбутиловый эфир (2,7 ммоля, 0,82 г), ацетат аммония (24,0 ммоля, 1,84 г) и ацетат меди (4,8 ммоля, 0,87 г). Эту смесь нагревали с обратным холодильником в течение 1 ч. После этого реакционную смесь выливали в охлажденный на ледяной бане 30% водный аммония гидроксид(200 мл) и перемешивали в течение 0,5 ч. Фазы разделяли и водную фазу экстрагировали этилацетатом (2 х 100 мл). Органические слои объединяли, промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Остаток хроматографировали на двуоки 001203 38 си кремния с использованием для элюции 3 % МеОН:СН 2 Сl2. Фракции, содержащие продукт,собирали и упаривали при пониженном давлении для получения не совсем белого твердого вещества. Этот остаток хроматографировали на двуокиси кремния с использованием для элюции 1% MeOH:EtOAc. Чистые фракции собирали и упаривали при пониженном давлении для получения 133 мг соединения, поименованного в заголовке, в виде не совсем белого пенистого вещества. 1 Стадия 3-А. Трет-бутоксикарбонил-3 пиперидин-карбоновая кислота. К перемешиваемому раствору нипекотиновой кислоты (38,7 ммоля, 5 г) в 1,4-диоксане(20 мл) добавляли 1N NaOH (4,6 ммоля, 4,6 мл) и ди-трет-бутилдикарбонат (38,7 ммоля, 8,45 г). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разводили 10% KHSO4 (50 мл) и экстрагировали этилацетатом (2 х 100 мл). Объединенные органические фазы промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении для получения 8,53 г соединения, поименованного в заголовке,в виде белого порошка. 1H NMR (СDСl3) d 4,25-4,00 (m, 1H), 3,953,85 (m, 1H), 3,15-2,92 (m, 1H), 2,92-2,78 (m,1H), 2,55-2,42 (m, 1H), 2,14-2,00 (m, 1H), 1,781,55 (m, 2H), 1,55-1,35 (m, 1H), 1,45 (s, 9H). Стадия 3-В N-трет-бутоксикарбонил-3 пиперидин-N-метокси-N-метилкарбоксамид К перемешиваемому раствору N-третбутоксикарбонил-3-пиперидин-карбоновой кислоты (17,4 ммоля, 4,0 г) в THF (50 мл) добавляли тионилхлорид (19,2 ммоля, 2,28 г) и пиридин (0,1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, упаривали при пониженном давлении и остаток,собранный в метиленхлориде (10 мл) добавляли по каплям к перемешиваемой суспензии N,Oдиметилгидроксиламина гидрохлорида (17,4 ммоля, 1,69 г). К реакционной смеси добавляли триэтиламин (34,8 ммоля, 3,52 г) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь затем разводили метиленхлоридом (50 мл) и промывали 39 10% KHSO4 (50 мл), насыщенным бикарбонатом натрия (50 мл) и насыщенным раствором соли,сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении для получения 4,14 г соединения, поименованного в заголовке, в виде светло-желтого масла. 1(40 мл), охлажденному на ледяной бане, добавляли алюмогидрид лития (14,8 ммоля, 14,8 мл в 1 М растворе THF). Реакционную смесь перемешивали в течение 0,5 ч, и реакцию затем гасили водой (3 мл). Реакционную смесь разводили этилацетатом (100 мл), фильтровали, и фильтраты промывали 10% KHSO4 (50 мл), сушили над безводным сульфатом натрия и упаривали при пониженном давлении для получения 2,54 г соединения, поименованного в заголовке, в виде бесцветного масла. 1 Н NMR (СDСl3) d 9,69 (s, 1H), 4,00-3,85(0,12 молей, 9,25 г) и ацетат меди (23,8 ммоля,4,32 г). Реакционную смесь нагревали с обратным холодильником в течение 1 ч. Реакционную смесь выливали в охлажденный на ледяной бане 30% водный аммония гидроксид (500 мл) и полученную суспензию экстрагировали этилацетатом (2 х 200 мл). Органические фазы объединяли, промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния с использованием для элюции 3%MeOH:CH2Cl2. Чистые фракции собирали и упаривали при пониженном давлении. Полученное твердое вещество растирали с диэтиловым эфиром для получения 1,75 г соединения, поименованного в заголовке, в виде белого порошка. т.п.=193-194 С. 1 К перемешиваемому раствору 4-[5-(4 фторфенил)-4-пиридин-4-ил-1 Н-имидазол-2-ил] пиперидин (0,76 ммоля, 0,30 г) в THF (5 мл) добавляли триэтиламин (2,7 ммоля, 0,27 г) и ацетилхлорид (0,91 ммоль, 71,5 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили водой(50 мл) и насыщенным бикарбонатом натрия (10 мл) и водную фазу экстрагировали этилацетатом (2 х 50 мл). Объединенные органические фазы сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния с использованием для элюирования от 2,5 до 5% MeOH:CH2Cl2. Фракции, содержащие продукт, объединяли и упаривали для получения желтого масла. Это масло кристаллизовали из диэтилового эфира для получения 75 мг соединения, поименованного в заголовке, в виде белого порошка. т.п.=235-236 С. 1 Через перемешиваемый раствор 4-[5-(4 фторфенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты третбутилового эфира (0,36 ммоля, 0,15 г) в этилацетате (5 мл) пропускали газообразный хлористый водород в течение 0,5 ч. Растворитель упаривали затем при пониженном давлении и остаток разводили насыщенным бикарбонатом натрия (50 мл). Полученную суспензию экстрагировали метиленхлоридом (5 х 20 мл), органические фазы объединяли, промывали насыщенным раствором соли, сушили над безводным сульфатом натрия, и растворитель упаривали при пониженном давлении. Полученный материал кристаллизовали из диэтилового эфира для получения 30 мг соединения, поименованного в заголовке, в виде белого порошка. т.п.=267270 С. 1 хроматографировали на двуокиси кремния с использованием для элюции от 2,5 до 10%MeOH:CH2Cl2. Фракции, содержащие продукт,упаривали при пониженном давлении и кристаллизовали из диэтилового эфира для получения 74 мг соединения, поименованного в заголовке, в виде белого порошка. т.п.=212-215 С. 1 К перемешиваемому раствору 4-[5-(4 фторфенил)-4-пиридин-4-ил-1 Н-имидазол-2-ил] пиперидин-1-карбоновой кислоты трет-бутилового эфира (0,90 ммоля, 0,38 г) в THF (10 мл) добавляли алюмогидрид лития (2,7 ммоля, 2,7 мл в 1 М растворе тетрагидрофурана). Реакционную смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь разводили этилацетатом (20 мл) и реакцию гасили водой (2,0 мл). Суспензию фильтровали, и фильтраты сушили над безводным сульфатом натрия. Фильтраты затем упаривали при пониженном давлении. Полученное твердое вещество растирали с диэтиловым эфиром, фильтровали и перекристаллизовывали из этанол:диэтилового эфира для получения 160 мг соединения, поименованного в заголовке, в виде белого порошка. т.п.=259-261 С. 1THF (1 мл) добавляли алюмогидрид лития (0,14 ммоля, 0,14 мл в 1 М растворе THF) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакцию гасили водой (0,1 мл), разводили этилацетатом (25 мл), суспензию фильтровали, фильтраты сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Остаток растирали с диэтиловым эфиром для получения 25 мг соединения, поименованного в заголовке, в виде белого порошка. т.п.=242-244 С. 1(4,0 мл) и метаноле (2,0 мл) добавляли бикарбонат натрия (1,8 ммоля/ 0,15 г) и бензилхлорид(0,51 ммоля, 64,0 мг). Реакционную смесь нагревали с обратным холодильником в течение ночи, охлаждали, разводили водой (50 мл) и экстрагировали этилацетатом (2 х 50 мл). Объединенные органические слои сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Остаток Стадия 9-А. 1-(3,4-дихлорфенил)-2-пиридин-4-ил-этан-1,2-диол. К перемешиваемому раствору диизопропиламина (14,9 г, 19,4 мл, 148 ммолей) в тетрагидрофуране (500 мл), при -78 С добавляли по каплям н-бутил лития (59 мл, 2,5 М раствора в тетрагидрофуране). Через десять минут добавляли по каплям раствор 4-пиридилкарбинола трет-бутилдиметилсилиловый эфир (30 г, 134 ммоля) в тетрагидрофуране (150 мл) и температуру повышали до -15 С. Раствор затем вновь охлаждали до -78 С и добавляли по каплям рас 43 твор 3,4-дихлоробензальдегида (25,9 г, 134 ммоля) в тетрагидрофуране (150 мл). После нагревания раствора до -20 С его выливали в насыщенный водный бикарбонат натрия (2 л). Водный слой экстрагировали этилацетатом (3 х 400 мл), объединенные органические слои высушивали над безводным сульфатом магния,фильтровали и концентрировали при пониженном давлении. Полученное масло растворяли в тетрагидрофуране (400 мл) и к этому раствору добавляли тетрабутиламмония фторид (148 мл,1,0 М раствора в тетрагидрофуране) по каплям. Через 10 мин реакционную смесь концентрировали при пониженном давлении и полученное масло хроматографировали на двуокиси кремния и элюировали 95:5 дихлорометан:метанол для получения соединения, поименованного в заголовке, в виде смеси диастереомерных диолов в виде пены (31,7 г), которое использовали без дальнейшей очистки. Стадия 9-В. 1-(3,4-Дихлорфенил)-2-пиридин-4-ил-этан-1,2-дион. К перемешиваемому раствору метилсульфоксида (38,3 г, 35 мл, 490 ммолей) в дихлорметане (750 мл) при -78 С добавляли по каплям ангидрид трифторуксусной кислоты (77 г, 52 мл, 368 ммолей). Через 10 мин по каплям добавляли 1-(3,4-дихлорофенил)-2-пиридин-4-илэтан-1,2-диол (31,7 г, 112 ммолей) в дихлорметане (500 мл). Через дополнительные 10 мин добавляли по каплям триэтиламин (70 г, 96 мл,690 ммолей) и реакционную смесь немедленно нагревали до 0 С и выливали в насыщенный водный раствор бикарбоната натрия (300 мл). Водную фазу экстрагировали этилацетатом (3 х 200 мл) и органические слои объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество растирали с этилацетатом для получения диона в виде желтого твердого вещества (23 г). 1H NMR (300 МГц, CDCl3) d 8,90 (dd, J=3,7 и 2,9 Гц, 2 Н), 8,09 (d, J=1,9 Гц, 1H), 7,85-7,73 (m,3 Н), 7,63 (d, J=8,3 Гц, 1 Н). Стадия 9-С. 4-[5-(3,4-Дихлорфенил)-4 пиридин-4-ил-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты бензиловый эфир. 1-(3,4-Дихлорфенил)-2-пиридин-4-ил-этан 1,2-дион (2,8 г, 10 ммолей), 4-формилпиперидин-1-карбоновой кислоты бензиловый эфир (2,47 г, 10 ммолей) и аммония ацетат (7,7 г, 100 ммолей) растворяли в уксусной кислоте(65 мл) и нагревали с обратным холодильником в течение 2,5 ч и давали остыть до температуры окружающей среды. Реакционную смесь выливали на смесь гидроксида аммония (100 мл) и льда. Этот водный слой экстрагировали этилацетатом (3 х 200 мл) и органические слои объединяли, промывали солевым раствором (100 мл), сушили над безводным сульфатом магния,фильтровали и концентрировали при пониженном давлении. Полученное масло хроматогра 001203 44 фировали на силикагеле, элюируя смесью 97:3 дихлорметан:метанол для получения имидазола в виде пены (2,3 г). 1 Н NMR (300 МГц, CD3OD) d 8,45 (d, J=5,9 Гц, 2 Н), 7,61 (d, J=1,8 Гц, 1H), 7,53 (d, J=8,3 Гц,1H), 7,44 (d, J=4,6 Гц, 2 Н), 7,40-7,26 (m, 8 Н),5,15 (s, 2H), 4,29 (d, J=13,6 Гц, 2 Н), 3,10-2,91 (m,4 Н), 2,08-19,5 (m, 2H), 1,91-1,73 (m, 2H). Стадия 9-D. 4-[5-(3,4-Дихлорфенил)-4 пиридин-4-ил-1 Н-имидазол-2-ил]пиперидин. 4-[5-(3,4-Дихлорфенил)-4-пиридин-4-ил 1 Н-имидазол-2-ил]пиперидин-1-карбоновой кислоты бензиловый эфир (3,8 г, 7,5 ммоля),растворенный в бромоводороде (30 вес.%) в уксусной кислоте (20 мл), нагревали до 80 С в течение 1 ч, после чего реакционной смеси давали остыть до температуры окружающей среды и концентрировали при пониженном давлении. Осадок затем растворяли в соляной кислоте (100 мл, 1N) и экстрагировали этилацетатом 100 мл). Водный слой затем защелачивали гидроокисью натрия (35 мл, 3N) и забуферивали насыщенным водным бикарбонатом натрия (300 мл). Водный слой экстрагировали хлороформом (5 х 200 мл) и объединенные органические слои высушивали над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении,Полученную пену кристаллизовали из этилацетат/гексана для получения свободного амина К перемешиваемому раствору 4-[5-(3,4 дихлорфенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил] пиперидин-1-карбоновой кислоты бензилового эфира (0,75 г, 1,5 ммоля) (из описанной выше стадии 9-С) в тетрагидрофуране (20 мл) под аргоном добавляли по каплям алюмогидрид лития (4,5 мл 1 М раствора в тетрагидрофуране), после чего раствор нагревали с обратным холодильником. Через 30 мин реакционной смеси давали остыть до температуры окружающей среды и медленно добавляли воду (5 мл). Добавляли этилацетат (10 мл), смесь фильтровали под вакуумом через бумажный фильтр для 45 удаления солей алюминия, растворяли в насыщенном водном бикарбонате натрия (100 мл) и экстрагировали этилацетатом (3 х 75 мл). Органические слои объединяли, промывали солевым раствором (100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении для получения твердого вещества, которое перекристаллизовывали из этилацетат/гексана, для получения белого твердого продукта (280 мг). 1 К перемешиваемому раствору 4-[5-(3,4 дихлорфенил)-4-пиридин-4-ил-1H-имидазол-2 ил]-пиперидин (90 мг, 0,24 ммоля) в ацетонитриле (3 мл) добавляли N-(5-бромфенил) фталимид (82 мг, 0,28 ммоля) и бикарбонат натрия (101 мг, 1,2 ммоля) и суспензию нагревали с обратным холодильником в течение 4 ч. После охлаждения до температуры окружающей среды смесь выливали в воду (50 мл) и экстрагировали этилацетатом (3 х 50 мл). Органические слои объединяли, промывали насыщенным раствором соли (40 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученный остаток хроматографировали на силикагеле, используя для элюции смесь 97:3 хлороформ (насыщенный аммонием):метанол и затем кристаллизовали из этилацетат/гексана (45 мг). т.п.=199202 С. 1 46 Примеры 12, 13 и 14 были выполнены, используя такую же процедуру, что и описано выше для примера 11. Пример 12. 2-(5-4-[5-(3,4-Дихлорфенил)4-пиридин-4-ил-1 Н-имидазол-2-ил]пиперидин 1 ил-пентил)изоиндол-1,3-дион. К перемешиваемому раствору 2-(5-4-[5(3,4-дихлорфенил)-4-пиридин-4-ил-1 Н-имидазол-2-ил]-пиперидин-1-ил-пентил)-изоиндол 1,3-диона (200 мг, 0,34 ммоля) (пример 14,смотри выше) в уксусной кислоте (3 мл) добавляли порошок цинка (65 мг) и смесь нагревали до 100 С в течение 2 ч, и затем давали остыть до температуры окружающей среды. Смесь защелачивали до рН 9 водной гидроокись натрия и экстрагировали хлороформом (3 х 75 мл). Органические слои объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученное масло хроматографировали на силикагеле,используя для элюции смесь 90:10 дихлорметан: метанол для получения твердого вещества, которое дополнительно очищали препаративной высокоэффективной жидкостной хроматографией (HPLC) и лиофилизировали для получения трифторуксусной соли (25 мг). 1 Н NMR (300 МГц, CD3OD) d 8,60 (d, J=7,1 Гц, 2H), 8,04 (d, J=7,1 Гц, 2 Н), 7,80-7,42 (m, 7H),3,80-3,63 (m, 4H), 3,55-3,48 (m, 1H), 2,48-2,05 К перемешиваемому раствору 4-[5-(3,4 дихлорфенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил]-пиперидину (пример 11, смотри выше) (250 мг, 0,67 ммоля) в метаноле (6 мл) добавляли 4 винилпиридин (82 мг, 0,28 ммолей) и бикарбонат натрия (101 мг, 1,2 ммоля) и суспензию нагревали до 55 С в течение 18 ч. Суспензии давали остыть до температуры окружающей среды, выливали в воду (100 мл) и водный слой 48 экстрагировали этилацетатом (3 х 100 мл). Органические слои объединяли, промывали солевым раствором (80 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле, используя для элюции смесь 95:5 дихлорметан:метанол и затем кристаллизовали из этилацетат/гексана (150 мг). Т.п.=189-190 С. 1 К перемешиваемому раствору 4-[5-(3,4 дихлорфенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил]-пиперидину (200 мг, 0,54 ммоля) (пример 11, смотри выше) в N,N-диметилформамиде (2 мл) добавляли N-(5-бромопентил)-1,1-диоксобензо[d]изотиазол-3-он (213 мг, 0,65 ммоля) и триэтиламин (137 мг, 0,19 мл, 1,35 ммоля). После 6 ч при температуре окружающей среды реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия (125 мл) и экстрагировали этилацетатом (3 х 100 мл). Органические слои объединяли, промывали солевым раствором (100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле, используя для элюции смесь 95:5 дихлорметан:метанол, что давало пенистое вещество (200 мг). 1 49 Пример 18 осуществляется точно так же,как описано в примере 17. Пример 18. 2-(4-4-[5-(3,4-дихлорфенил)4-пиридин-4-ил-1 Н-имидазол-2-ил]пиперидин 1-илбутил)-1,1-диоксобензол[D]изотиазол-3 ОН. Стадия 19-А. 1-(3-Метоксифенил)-2-пиридин-4-илэтан-1,2-диол. К перемешиваемому раствору диизопропиламина (4,5 г, 5,8 мл, 44 ммоля) в тетрагидрофуране (170 мл) при -78 С добавляли по каплям н-бутиллитий (17,7 мл 2,5 М раствор в тетрагидрофуране). Через 10 мин по каплям добавляли раствор 4-пиридилкарбинола третбутилдиметилсилиловый эфир (9,0 г, 40 ммолей) в тетрагидрофуране (35 мл) и температуре давали подняться до -15 С. Раствор вновь охлаждали до -78 С и к нему добавляли по каплям раствор 3-анисальдегида (5,5 г, 4,9 мл, 40 ммолей) в тетрагидрофуране (35 мл). Раствору давали нагреться до -20 С и выливали в насыщенный водный раствор бикарбоната натрия (300 мл). Водный слой экстрагировали этилацетатом(3 х 200 мл) и органические слои объединяли,сушили над безводным сульфатом магния,фильтровали и концентрировали при пониженном давлении. Полученное масло растворяли в тетрагидрофуране (120 мл) и к этому раствору добавляли по каплям тетрабутиламмония фторид (48 мл, 1,0 М раствор в тетрагидрофуране). Через 10 мин реакционную смесь концентрировали при пониженном давлении и полученное масло хроматографировали на силикагеле используя для элюирования 97:3 этилацетат:метанол для получения смеси диастерео 001203 50 мерных диолов в виде пены (8,5 г), которую использовали без дальнейшей очистки. Стадия 19-В. 1-(3-Метоксифенил)-2-пиридин-4-илэтан-1,2-дион. К перемешиваемому раствору метилсульфоксида (11,8 г, 10,7 мл, 150 ммолей) в дихлорметане (150 мл) при -78 С добавляли по каплям ангидрид трифторуксусной кислоты (23,7 г, 16 мл, 113 ммолей). Через 10 мин по каплям добавляли 1-(3-метоксифенил)-2-пиридин-4-илэтан 1,2-диол (8,5 г, 34 ммолей) в дихлорметане (60 мл). Через дополнительные 10 мин добавляли по каплям триэтиламин (21,3 г, 29,4 мл, 211 ммолей) и реакционную смесь немедленно нагревали до 0 С и выливали в насыщенный водный раствор бикарбоната натрия (300 мл). Водную фазу экстрагировали этилацетатом (3 х 200 мл) и органические слои объединяли, сушили над безводным сульфатом магния, и концентрировали при пониженном давлении. Полученное масло хроматографировали на силикагеле, используя для элюции смесь 1:3 этилацетат:гексан для получения диона в виде желтого твердого вещества (5,1 г). 1H NMR (300 МГц, СDСl3) d 8,88 (dd, J=4,4 и 2,5 Гц, 2 Н), 7,77 (dd, J=4,4 и 2,5 Гц, 2 Н), 7,567,51 (m, 1H), 7,50-7,39 (m, 2H), 7,22-7,19 (m,1H), 3,85 (s, 3 Н). Стадия 19-С. 4-[5-(3-Метоксифенил)-4 пиридин-4-ил-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты трет-бутиловый эфир. 1-(3-метоксифенил)-2-пиридин-4-илэтан 1,2-дион (1,93 г, 8,0 ммолей), 4-формилпиперидин-1-карбоновой кислоты трет-бутиловый эфир (1,7 г, 8,0 ммолей) и аммония ацетат (6,2 г,80 ммолей) растворяли в уксусной кислоте (20 мл) и нагревали с обратным холодильником в течение 2 ч, после чего давали остыть до температуры окружающей среды. Реакционную смесь выливали на смесь гидроксида аммония (50 мл) и льда, экстрагировали этилацетатом (3 х 125 мл) и объединенные органические слои сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученное масло хроматографировали на силикагеле, элюируя этилацетатом для получения имидазола в виде пены (1,2 г), которую использовали без дальнейшей очистки. Стадия 19-D. 4-[5-(3-Гидроксифенил)-4 пиридин-4-ил-1 Н-имидазол-2-ил]-1-метилпиперидин. К перемешиваемому раствору 4-[5-(3 метоксифенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты третбутилового эфира (250 мг, 0,58 ммоля) в тетрагидрофуране (7 мл) под аргоном добавляли по каплям алюмогидрид лития (1,7 мл 1 М раствора в тетрагидрофуране), после чего раствор нагревали с обратным холодильником в течение 1,5 ч. Реакционной смеси давали остыть до температуры окружающей среды и медленно добавляли воду (3 мл). Добавляли этилацетат (5 мл), смесь 51 фильтровали под вакуумом через бумажный фильтр для удаления солей алюминия. Фильтрат разводили водным бикарбонатом натрия (100 мл) и экстрагировали этилацетатом (3 х 50 мл). Органические слои объединяли, промывали насыщенным раствором соли (50 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении для получения твердого вещества (150 мг). Это твердое вещество растворяли в бромистом водороде в уксусной кислоте (30 весовых процентов, 5 мл) и смесь нагревали при 100 С в течение 5 ч. После того, как раствору давали остыть до температуры окружающей среды, его защелачивали водным раствором гидроокиси натрия,забуференным водным раствором бикарбоната натрия, и экстрагировали этилацетатом (6 х 50 мл). Органические слои объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток растирали с этилацетатом для получения твердого вещества (40 мг). 1 Через перемешиваемый раствор 3-[5-(4 фторфенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил]пиперидин-1-карбоновой кислоты трет-бутилового эфира в метаноле (30 мл) пропускали газообразный хлористый водород в течение 0,5 ч. Реакционную смесь затем упаривали при пониженном давлении для получения 1,6 г бледножелтого пенистого продукта. 0,2 г этой пены разводили насыщенным бикарбонатом натрия(20 мл) и экстрагировали 1% МеОН:СН 2 Сl2 (3 х 50 мл). Органические слои объединяли и сушили над безводным сульфатом натрия. Полученное твердое вещество растирали с диэтиловым эфиром для получения 92 мг соединения, поименованного в заголовке, в виде светложелтого порошка. т.п.=252-254 С. 1 К перемешиваемому раствору 3-[5-(4 фторфенил)-4-пиридин-4-ил-1 Н-имидазол-2-ил] пиперидин-1-карбоновой кислоты трет-бутилового эфира (200 мг) в THF (2 мл) добавляли алюмогидрид лития (1,14 ммоля, 1,14 мл 1 М раствора в THF) и смесь нагревали с обратным холодильником в течение 6 ч. Реакцию гасили водой (2,0 мл), разводили этилацетатом (25 мл) и фильтровали. Фильтрат промывали насыщенным бикарбонатом натрия (50 мл) и водный слой экстрагировали CH2Cl2 (2 х 30 мл). Органические слои объединяли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении; остаток кристаллизовали из диэтилового эфира для получения 60 мг соединения, поименованного в заголовке, в виде почти белого порошка. т.п.=195-197 С 1 Стадия 22-А. N-трет-бутоксикарбонилизонипекотиновой кислоты этиловый эфир. К перемешиваемому раствору изонипекотиновой кислоты этилового эфира (31,8 ммоля,5 г) в THF (50 мл) добавляли ди-третбутилдикарбонат (31,8 ммоля, 6,94 г). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, разводили этилацетатом (300 мл) и промывали 10% KHSO4(200 мл). Органическую фазу сушили над безводным сульфатом натрия и упаривали при пониженном давлении для получения 9,09 г соединения, поименованного в заголовке, в виде светло-желтого масла. 1 53 Стадия 22-В. N-трет-бутоксикарбонил-4 метилизонипекотиновой кислоты этиловый эфир. К перемешиваемому раствору диизопропиламина (20,0 ммоля, 2,02 г) в THF (50 мл),охлажденному до -78 С добавляли н-бутиллитий (21,7 ммоля, 8,68 мл 2,5 М раствора в гексане). Затем по каплям добавляли N-третбутоксикарбонил-изонипекотиновой кислоты этиловый эфир (16,7 ммоля, 4,5 г), после чего добавляли йодистый метил (16,7 ммоля, 2,37 г) и реакционной смеси давали нагреться до комнатной температуры. Смесь затем разводили этилацетатом (500 мл) и промывали водой (1 х 200 мл), 10% KHSO4 (200 мл) и насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении для получения 4,76 г соединения, поименованного в заголовке, в виде светло-желтого масла. 1(m, 1H), 1,50-1,10 (m, 19H). Стадия 22-С. N-трет-бутоксикарбонил-4 метилизонипекотиновая кислота. К перемешиваемому раствору N-третбутоксикарбонил-4-метилизонипекотиновой кислоты этилового эфира (17,4 ммоля, 4,73 г) вNaOH (50 мл) и смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь разводили 10% KHSO4 (600 мл) и концентрированной H2SO4 (5 мл) и экстрагировали этилацетатом (2 х 250 мл). Органические слои объединяли, промывали водой (500 мл) и насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток растирали с диэтиловым эфиром:гексаном и фильтровали для получения 1,12 г оранжевого твердого вещества. Фильтраты упаривали для получения 2,71 г соединения, поименованного в заголовке, в виде оранжевого твердого вещества. 1H NMR (CDCl3) d 3,85-3,65 (m, 2H), 3,052,88 (m, 2H), 2,10-1,95 (m, 2H), 1,50-1,30 (m,3 Н), 1,45 (s, 9H), 1,27 (s, 3 Н). Стадия 22-D. N-трет-бутоксикарбонил-4 метил-4-пиперидин-N-метокси-N-метил карбоксамид. К перемешиваемому раствору N-третбутоксикарбонил-4-метил-4-пиперидин карбоновой кислоты (4,6 ммоля, 1,12 г) в CH2Cl2 (15 мл) добавляли хлористый тионил (5,0 ммоля,0,60 г) и пиридин (0,1 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь затем упаривали при пониженном давлении и остаток в метиленхлориде(20 мл) добавляли по каплям к перемешиваемой суспензии N,O-диметилгидроксиламина гидрохлорида (5,0 ммоля, 0,49 г). Затем добавляли триэтиламин (10,1 ммоля, 0,49 г) и реакционную смесь перемешивали при комнатной температу 001203 54 ре в течение 1 ч. Смесь затем разводили метиленхлоридом (100 мл), промывали 10% KHSO4(50 мл), сушили над безводным сульфатом натрия и упаривали при пониженном давлении для получения 1,05 г соединения, поименованного в заголовке, в виде оранжевого масла, использовавшегося без дальнейшей очистки. Стадия 22-Е. N-трет-бутоксикарбонил-4 метил-4-пиперидина карбоксальдегид. К перемешиваемому раствору N-третбутоксикарбонил-4-метил-4-пиперидин-Nметокси-N-метилкарбоксамида (1,1 ммоля, 0,31 г) в THF (5,0 мл) добавляли алюмогидрид лития(1,1 ммоля, 1,1 мл 1 М раствора в THF) и реакционную смесь перемешивали в течение 0,5 ч при комнатной температуре. Реакцию гасили водой (0,5 мл), разводили этилацетатом (50 мл),фильтровали и фильтраты промывали 10%KHSO4 (50 мл). Органические слои сушили над безводным сульфатом натрия и упаривали при пониженном давлении для получения 0,15 г соединения, поименованного в заголовке, в виде бесцветного масла. 1N-трет-бутоксикарбонил-4-метил-4-пиперидинкарбоксальдегид (2,2 ммоля, 0,5 г), ацетат аммония (20,0 ммолей, 1,54 г) и ацетат меди (4,0 ммоля, 0,73 г) и смесь нагревали с обратным холодильником в течение 1 ч. Реакционную смесь затем выливали в охлажденную на ледяной бане 30% водную гидроокись аммония (200 мл), перемешивали в течение 0,5 ч, фазы разделяли и водную фазу экстрагировали этилацетатом (2 х 200 мл). Органические слои объединяли, промывали насыщенным раствором соли и сушили над безводным сульфатом натрия, после чего упаривали при пониженном давлении. Остаток хроматографировали на силикагеле,элюируя 2% MeOH:CH2Cl2. Собирали фракции,содержащие продукт, и упаривали при пониженном давлении для получения 0,12 г соединения, поименованного в заголовке, в виде белого порошка. т.п.=157-160 С. 1 Н NMR (CD3OD) d 8,40 (s, 2H), 7,55-7,40THF (2 мл) добавляли алюмогидрид лития (0,56 ммоля, 0,56 мл 1 М раствора). Реакционную смесь нагревали с обратным холодильником в течение 6 ч, охлаждали, разводили этилацетатом(20 мл) и реакцию гасили водой (0,5 мл). Суспензию фильтровали и фильтраты промывали водой (20 мл), сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Полученное твердое вещество растирали с диэтиловым эфиром и фильтровали для получения 20 мг соединения, поименованного в заголовке, в виде белого порошка. т.п.=227-229 С. 1 Н NMR (CD3OD) d 8,39 (d, J=6,1 Гц, 2H),7,50-7,40 (m, 4 Н), 7,18 (t, J=8,8 Гц, 2H), 2,75-2,62 Через перемешиваемый раствор 4-бензил 4-[(4-фторфенил)-5-пиридин-4-ил-1 Н-имидазол 2-ил]-пиперидин-1-карбоновой кислоты третбутилового эфира в этилацетате (10 мл) и метаноле (2 мл) пропускали газообразный НСl в течение 1,25 ч. Раствор затем упаривали при пониженном давлении и остаток собирали насыщенным бикарбонатом натрия (30 мл) и этилацетатом (30 мл). Водный слой экстрагировали этилацетатом (30 мл), органические фазы объединяли, промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния,используя для элюции 5% МеОН:СНСl3 насыщенный аммонием. Чистые фракции собирали и упаривали. Остаток упаривали из СН 2 Сl2: гексана для получения 75 мг соединения, поименованного в заголовке, в виде не совсем белой пены. 1 К перемешиваемому раствору 4-[5-(3,4 дихлорфенил)-4-пиридин-4-ил-1 Н-имидазол-2 ил]-пиперидина (200 мг, 0,54 ммоля) в N,Nдиметилформииде (1 мл) добавляли N-(третбутоксикарбонил)-глицин (113 мг, 0,59 ммоля),1-этил-3-(3-диметиламино-пропил)-карбодиимида гидрохлорид (113 мг, 0,59 ммоля) и 1 гидроксибензотриазолгидрат (80 мг, 0,59 ммоля) и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь затем выливали в насыщенный водный бикарбонат натрия (125 мл) и экстрагировали этилацетатом(3 х 100 мл). Органические слои объединяли,промывали насыщенным раствором соли (100 мл), сушили над безводным сульфатом магния,фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле, элюируя смесью 97:3 дихлорметан:метанол. Полученную пену растворяли в этилацетате (25 мл), охлаждали до 0 С и через раствор пропускали хлористый водород в течение 30 мин. Дигидрохлорид продукта осаждали из раствора и фильтровали для получения желтого твердого продукта (150 мг). т.п.=208214 С. 1THF (5,0 мл) добавляли триэтиламин (3,3 ммоля, 0,33 г) и ацетилхлорид (2,3 ммоля, 0,18 г). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, разводили 10%(2 х 50 мл). Органические фазы объединяли,промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния с исполь 57 зованием для элюции 3% МеОН:СН 2 Сl2. Очищенные фракции собирали и упаривали при пониженном давлении. Полученную пленку выпаривали из CH2Cl2:гексан для получения 0,2 г соединения, поименованного в заголовке, в виде белой пены. Результаты элементного анализа, рассчитанные для C21H21N4OF0,75H2O 0,25 гексан: С 67,65, Н 6,56, N 14,02; обнаружено: С 67,72, Н 6,30, N 13,91. Пример 26. 4-[1-Пропил-5-пиридин-4-ил-4(3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин.THF, охлажденному до -78 С под аргоном, добавляли по каплям н-бутиллития (0,139 моля,55,1 мл 2,5 М раствора в гексане) и реакцию проводили в течение 10 мин до добавления по каплям 3-трифторметилбензила хлорид (0,134 моля, 26,0 г). Реакционную смесь перемешивали 20 мин при -78 С, разводили насыщенным водным бикарбонатом натрия (500 мл) и экстрагировали этилацетатом (3 х 250 мл). Объединенные органические слои промывали солевым раствором, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток растворяли в 96% муравьиной кислоте (80 мл), растворенной в воде (20 мл) и нагревали с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до температуры окружающей среды и летучие соединения удаляли при пониженном давлении. Полученное коричневое масло защелачивали до рН 7 водным NaOH (водн.), затем до рН 10 насыщенным карбонатом калия и экстрагировали этилацетатом (3 х 200 мл). Органические слои объединяли, высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния и элюировали градиентом 20%-65% этилацетат:гексан. Чистые фракции объединяли для получения 24,43 г коричневого масла. 1(92 ммоля, 24,43 г) в смеси с уксусной кислотой (80 мл) и водой (8 мл) добавляли при 0 С раствор нитрита натрия (138 ммоля, 9,53 г) в воде (8 мл) и реакционную смесь перемешивали при 0 С 10 58 мин. Образовавшийся преципитат отделяли фильтрацией под вакуумом и промывали водой(50 мл), затем высушивали в вакууме для получения 24,43 г (90%) бледно-желтого твердого вещества. 1 Н NMR выявил смесь изомеров оксима. Синглет при d 4,36 из продукта стадии 1 больше не присутствует. Стадия 26-С. 4-[1-Пропил-5-пиридин-4-ил 4-(3-трифторметилфенил)-1H-имидазол-2-ил] пиперидин-1-карбоновой кислоты бензиловый эфир. К перемешиваемому раствору 1-(пиридин 4-ил)-2-[3-(трифторметил)фенил]этан-1,2-дион 2-оксима (83 ммоля, 24,43 г) и 1 бензилоксикарбонил-пиперидин-4-карбоксальдегида [Amici et al Eur. J. Med. Chem. 26, 625631 (1991)] (108 ммолей, 26,7 г) в уксусной кислоте (300 мл) добавляли по каплям при температуре окружающей среды пропиламин (1,24 ммоля, 73,6 г). Реакционную смесь нагревали с обратным холодильником в течение 3 ч, давали остыть до температуры окружающей среды и защелачивали до рН 8 концентрированной гидроокисью аммония на льду и экстрагировали этилацетатом (3 х 500 мл). Объединенные органические слои промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и выпаривали при пониженном давлении. Остаток растворяли в метаноле (100 мл) и обрабатывали раствором трихлорида титана (3 х 150 мл 10-20 весовых процента в 20-30% НСl) и перемешивали в течение 18 ч. Реакционную смесь защелачивали до рН 10 насыщенным карбонатом калия и экстрагировали этилацетатом(4 х 300 мл). Органические слои объединяли,промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и выпаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния, элюируя градиентом 30%-60% этилацетат:гексан для получения желтого масла, которое рехроматографировали на двуокиси кремния элюируя градиентом 25%-50% этилацетат:гексан для получения 10,8 г светло-желтого масла. 1H NMR (300 МГц, CDCl3) d 8,71 (dd, J=4,4 Гц, 1,6 Гц, 2 Н), 7,74 (s, 1H), 7,44-7,24 (m, 10 Н),5,16 (s, 2H), 4,41-4,30 (m, 2H), 3,78 (dd, J=7,9 Гц,7,7 Гц, 2H), 3,04-2,93 (m, 2H), 2,87 (dddd, J=11,1 Гц, 11,1 Гц, 3,8 Гц, 3,8 Гц, 1H), 2,10-2,05 (m,2H), 1,93-1,90 (m, 2H), 1,57-1,47 (m, 2H), 0,80 (t,J=7,5 Гц, 3 Н). Стадия 26-D. 4-[1-Пропил-5-пиридин-4-ил 4-(3-трифторметилфенил)-1 Н-имидазол-2-ил] пиперидин. Суспензию 4-[1-пропил-5-пиридин-4-ил-4(3-трифторметилфенил)-1H-имидазол-2-ил]пиперидин-1-карбоновой кислоты бензилового эфира (7,8 ммолей, 4,3 г) в 3 М соляной кислоте(70 мл) нагревали до 60 С в течение 3 ч, охлаждали до температуры окружающей среды и промывали эфиром (2 х 50 мл), и органические фазы отбрасывали. Водный слой защелачивали 59 водной гидроокисью натрия до рН 10 и экстрагировали дихлорметаном (3 х 100 мл) и этилацетатом (100 мл). Объединенные органические слои. сушили над безводным сульфатом натрия и выпаривали при пониженном давлении. Остаток хроматографировали на двуокиси кремния,элюируя градиентом от 95:5:0,5 до 90:10:1 смеси дихлорметан:метанол:гидроокись аммония для получения почти белой пены, которую перекристаллизовывали из 25% этилацетата в гексанах для получения соединения, поименованного в заголовке, в виде почти белого твердого вещества. 1 Стадия 27-А. 2-(2-Фторпиридин-4-ил)-1(3-трифторметилфенил)этанон. К раствору диизопропиламина (17,69 мл,0,135 моля) в THF (200 мл) при -78 С под аргоном добавляли н-бутиллития (54,0 мл, 2,5 М в гексане, 0,135 моля), и спустя 5 мин раствор 2 фтор-4-метилпиридина (Lancaster Synthesis Inc.)N-метокси-N-метил-3-трифторметилбензамида (23,08 г, 0,099 моля) в THE (10 мл). После перемешивания в течение 5 мин реакционной смеси давали нагреться до 0 С и реакцию гасили выливанием в воду (400 мл) и этилацетат(400 мл). Слои разделяли и водный слой промывали этилацетатом (200 мл). Этилацетатные экстракты объединяли, высушивали над безводным сульфатом натрия, фильтровали и концентрировали до масла, которое хроматографировали на силикагеле с использованием 20% этилацетата в гексане для получения 21,6 г соединения, поименованного в заголовке.(1 Н, d, J=5,1 Гц); 8,18 (1H, d, J=9,3 Гц); 7,88 (1H,d, J=7,8 Гц); 7,67 (1H, t, J=7,8 Гц); 7,09 (1H, d,J=5,1 Гц); 6,86 (1H, s); 4,37 (2 Н, s). Стадия 27-В. 1-(2-Фторпиридин-4-ил)-2-(3 трифторметилфенил)-этан-1,2-диона-1-оксим. К смеси 2-(2-фторпиридин-4-ил)-1-(3-трифторметилфенил)-этанона (10,80 г 0,038 моля) в этаноле (200 мл) при -10 С под аргоном добав 001203 60 ляли трет-бутилнитрит (5,0 мл, 0,042 моля) с последующим добавлением по каплям соляной кислоты (12,2 мл, 2,5 М в этаноле, 0,031 моля) поддерживая температуру ниже -5 С. После окончания добавления реакционной смеси давали нагреться до комнатной температуры в течение 2 ч. Реакционную смесь концентрировали в вакууме, разводили водой (100 мл), защелачивали насыщенным бикарбонатом натрия (200 мл). Эту смесь затем экстрагировали этилацетатом (1 х 600 мл, 2 х 300 мл). Органические слои объединяли, промывали водой (300 мл), насыщенным раствором соли (300 мл), высушивали над безводным сульфатом натрия, фильтровали и концентрировали до масла (11,4 г). 1et al Eur. J. Med. Chem. 26, 625-631 (1991)] (9,93 г, 0,040 моля) в уксусной кислоте (250 мл) добавляли ацетат аммония (56,29 г, 0,730 моля). Смесь нагревали до 75 С в течение 1 ч, охлаждали и концентрировали для удаления основной части уксусной кислоты. Остаток выливали в смесь концентрированного NH4OH (100 мл),льда (200 г) и метиленхлорида (800 мл) и рН доводили до 8 с помощью NH4OH. Метиленхлоридный слой удаляли, а водный слой промывали метиленхлоридом (2 х 300 мл). Объединенные органические фазы промывали водой(300 мл), насыщенным раствором соли (300 мл),сушили над безводным сульфатом натрия,фильтровали и концентрировали для получения масла, используемого в следующей стадии без дальнейшей очистки. Стадия 27-D. 4-[5-(2-Фторпиридин-4-ил)4-(3-трифторметилфенил)-1H-имидазол-2 ил]пиперидин-1-карбоновой кислоты бензиловый эфир. К перемешиваемому раствору сырого 4-[1 гидрокси-5-(2-фторпиридин-4-ил)-4(3-трифторметилфенил)-1 Н-имидазол-2-ил]пиперидин-1 карбоновой кислоты бензилового эфира (из предыдущей стадии) в метаноле (400 мл) при 0 С медленно добавляли хлористый титан (III)(150 мл, 0,174 моля, 15 вес.% в 20-30% НСl). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции реакционную смесь концентрировали для удаления метанола и реакцию гасили в насыщенном водном бикарбонате натрия (750 мл) и этилацетате (1500 мл). После перемешивания в течение 4 ч органический слой удаляли, а вод
МПК / Метки
МПК: A61P 35/00, C07D 233/76
Метки: цитокин-ингибирующей, имидазолы, антиканцерогенной, активностью, замещенные, обладающие
Код ссылки
<a href="https://eas.patents.su/30-1203-zameshhennye-imidazoly-obladayushhie-antikancerogennojj-i-citokin-ingibiruyushhejj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные имидазолы, обладающие антиканцерогенной и цитокин-ингибирующей активностью</a>
Предыдущий патент: Производные 2-циклогексан-1,3-дионбензоила.
Случайный патент: Ингибиторы cmet












