Тетрагидрохинолиновые производные и способ их получения
Номер патента: 11670
Опубликовано: 28.04.2009
Авторы: Сугахара Масакацу, Такано Маюми, Фурукава Марико, Кубота Хитоси, Мотомура Дайсуке
Формула / Реферат
1. Соединение формулы (I)
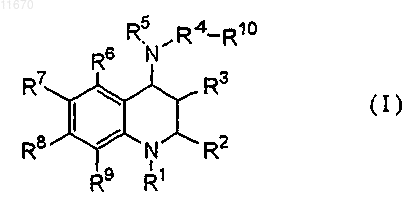
где R1 представляет собой C1-6алкоксикарбонильную группу, необязательно замещенную 1-5 заместителями, независимо выбранными из гидроксигруппы, карбоксильной группы, C1-6алкоксикарбонильной группы, C1-6алкоксигруппы (указанная C1-6алкоксигруппа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы и C1-6алкоксикарбонильной группы), С2-6алкенильной группы, атома галогена, С3-10циклоалкильной группы (указанная С3-10циклоалкильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6алкоксикарбонильной группы, карбоксиС1-6алкильной группы и C1-6алкоксикарбонилC1-6алкильной группы), фенильной группы (указанная фенильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6алкоксикарбонильной группы, карбоксиС1-6алкильной группы и C1-6алкоксикарбонилC1-6алкильной группы), пиперидинильной группы (указанная пиперидинильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6алкоксикарбонильной группы, карбоксиC1-6алкильной группы и C1-6алкоксикарбонилC1-6алкильной группы) и пирролидинильной группы (указанная пирролидинильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6 алкоксикарбонильной группы, карбоксиС1-6алкильной группы и C1-6алкоксикарбонилC1-6алкильной группы); или дигидрооксазолильную группу, необязательно замещенную 1 или 2 заместителями, независимо выбранными из карбоксильной группы, C1-6алкоксикарбонильной группы, карбоксиC1-6алкильной группы, C1-6 алкоксикарбонилC1-6алкильной группы и гидроксиC1-6алкильной группы;
R2 представляет собой C1-6алкильную группу;
R3 представляет собой атом водорода;
R4 представляет собой С1-4алкиленовую группу;
R5 представляет собой группу формулы
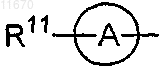
R6 и R9 каждый представляет собой атом водорода;
R7 и R8 независимо представляют собой атом водорода, C1-6алкильную группу, необязательно замещенную атомом галогена, C1-6алкильной группой или моно- или ди-С1-6алкиламиногруппой; или объединены по концевым частям этих групп с образованием C1-4алкилендиоксигруппы; и
R10 представляет собой фенильную группу, замещенную 1-3 заместителями, выбранными из цианогруппы, C1-6алкильной группы, необязательно замещенной атомом галогена и C1-6алкоксигруппы;
кольцо А представляет собой пиримидинильную группу, пиридильную группу, тетразолильную группу, оксадиазолильную группу или тиазолильную группу и
R11 представляет собой карбоксильную группу; цианогруппу; нитрогруппу; C1-6алкильную группу, замещенную группой, выбранной из гидроксигруппы, карбоксильной группы, C1-6алкоксикарбонильной группы, C1-6алкоксигруппы, фенилC1-6алкоксигруппы, карбоксиC1-6алкоксигруппы, C1-6алкилтиогруппы, C1-6алкилсульфонильной группы, C1-6алкилсульфинильной группы, аминогруппы, моно- или ди-С1-6 алкиламиногруппы, моно- или ди-C1-6алкилсульфамоиламиногруппы, моно- или ди-С1-6 алкилуреидогруппы, необязательно замещенной морфолинильной группой, оксиранильной группы, ди-С1-6 алкилдиоксоланильной группы, пиперазинильной группы, необязательно замещенной алкильной группой, и морфолинильной группы; С2-6алкенильную группу, необязательно замещенную карбоксильной группой; C1-6 алкоксигруппу, замещенную группой, выбранной из цианогруппы, гидроксигруппы, карбоксильной группы, C1-6алкоксикарбонильной группы, C1-6алкоксигруппы, фенилC1-6алкоксигруппы, карбоксиC1-6 алкоксигруппы, C1-6алкилтиогруппы, C1-6алкилсульфонильной группы, C1-6алкилсульфинильной группы, аминогруппы, моно- или ди-C1-6алкиламиногруппы, моно- или ди-C1-6алкилсульфамоиламиногруппы, моно- или ди-С1-6алкилуреидогруппы, необязательно замещенной морфолинильной группой, оксиранильной группы, ди-С1-6алкилдиоксоланильной группы, пиперазинильной группы, необязательно замещенной C1-6алкильной группой, и морфолинильной группы; гидроксикарбамимидоильную группу; C1-6 алкилтиогруппу; C1-6алкилсульфонильную группу, необязательно замещенную C1-6алкоксикарбонильной группой; моно- или ди-C1-6алкиламиногруппу, необязательно замещенную гидроксигруппой, карбоксильной группой или C1-6алкоксигруппой; морфолинильную группу; необязательно окисленную тиоморфолинильную группу; пиперазинильную группу, необязательно замещенную группой, выбранной из C1-6 алкильной группы, C1-6алканоильной группы и гидроксиC1-6алканоильной группы; пирролидинильную группу, необязательно замещенную карбоксильной группой, C1-6алкильной группой, карбоксиC1-6 алкильной группой или C1-6алкоксикарбонильной группой; пиперидинильную группу, необязательно замещенную карбоксильной группой, C1-6алкильной группой, карбоксиC1-6алкильной группой или C1-6 алкоксикарбонильной группой; тетразолильную группу, необязательно замещенную C1-6алкильной группой, гидроксиC1-6алкильной группой или морфолинилC1-6алкильной группой; оксодигидрооксадиазолильную группу; пиримидинильную группу; или тетрагидропиранильную группу,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой C1-6алкоксикарбонильную группу, необязательно замещенную 1 или 5 заместителями, независимо выбранными из карбоксильной группы, С1-6 алкоксикарбонильной группы, атома галогена, гидроксигруппы и С3-10циклоалкильной группы;
кольцо А представляет собой пиримидинильную группу, пиридильную группу, тетразолильную группу или оксадиазолильную группу;
R11 представляет собой карбоксильную группу; С1-6алкильную группу, замещенную гидроксигруппой, карбоксильной группой, C1-6алкоксигруппой или C1-6алкилсульфонильной группой; С2-6 алкенильную группу, необязательно замещенную карбоксильной группой; C1-6алкоксигруппу, замещенную карбоксильной группой, цианогруппой, гидроксигруппой, C1-6алкоксигруппой, C1-6алкилтиогруппой или C1-6 алкилсульфонильной группой; моно- или ди-С1-6алкиламиногруппу, необязательно замещенную карбоксильной группой или C1-6алкоксигруппой; морфолинильную группу; пиперидинильную группу, замещенную карбоксильной группой; или тетразолильную группу, замещенную гидроксиC1-6алкильной группой;
R7 представляет собой C1-6алкильную группу, необязательно замещенную атомом галогена, C1-6 алкоксигруппой или моно- или ди-C1-6алкиламиногруппой; и
R8 представляет собой атом водорода.
3. Соединение по п.2, где R1 представляет собой этоксикарбонильную группу, гидроксиэтоксикарбонильную группу, 2-фторэтоксикарбонильную группу, 2,2-дифторэтоксикарбонильную группу или 2,2,2-трифторэтоксикарбонильную группу;
R2 представляет собой этильную группу;
R10 представляет собой фенильную группу, замещенную 1-2 заместителями, выбранными из цианогруппы, трифторметильной группы и метоксигруппы; и
R7 представляет собой трифторметильную группу или метоксигруппу.
4. Соединение по п.2, где R1 представляет собой карбокси(C1-6алкокси)карбонильную группу или C1-6алкоксикарбонил(C1-6алкокси)карбонильную группу;
R2 представляет собой этильную группу;
R10 представляет собой фенильную группу, замещенную 1-2 заместителями, выбранными из цианогруппы, трифторметильной группы и метоксигруппы; и
R7 представляет собой трифторметильную группу или метоксигруппу.
5. Соединение, выбранное из следующих соединений или их фармацевтически приемлемых солей:
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-[[3,5-бис(трифторметил)бензил]-(5-{[метил-(2-метоксиэтил)]амино}пиримидин-2-ил)]амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-карбоксипиримидин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-карбоксиэтил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-([3,5-бис(трифторметил)бензил]-{5-[2-(2-гидроксиэтил)-2Н-тетразол-5-ил]пиримидин-2-ил})амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{(3,5-диметоксибензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{(3,5-дицианобензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{(3-цианобензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R*,4S*)-4-([3,5-бис(трифторметил)бензил]-{5-[2-(2-гидроксиэтил)-2Н-тетразол-5-ил]пиримидин-2-ил})амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[2-(2-гидроксиэтил)-2Н-тетразол-5-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[2-(2-метансульфонилэтил)-2Н-тетразол-5-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-окисэтиловый эфир (2R*,4S*)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин-1-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-карбоксиэтил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-[[3,5-бис(трифторметил)бензил]-(5-{[метил-(2-карбоксиэтил)]амино}пиримидин-2-ил)]амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-([3,5-бис(трифторметил)бензил]-{5-[3-(тетразол-5-ил)пропокси]пиримидин-2-ил})амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксибутокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(5-карбоксипентилокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-карбоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
(2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксиметилпиперидин-1-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксибутокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(4-карбоксибутокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси)пиримидин-2-ил]}амино-2-этил-6-диметиламино-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2,2,2-трифторэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин-1-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
этиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин-1-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2,2,2-трифторэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси) пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2,2,2-трифторэтиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(3-карбоксипропокси) пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-окисэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин-1-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
5-карбоксипентиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
5-карбоксипентиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты или
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты.
6. Соединения, выбранные из следующих соединений или их фармацевтически приемлемых солей:
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
5-карбоксипентиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
5-карбоксипентиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
5-карбоксипентиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2-ил)}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиридин-2-ил]}амино-2-этил-6-трифторметил-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
3-карбоксипропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
4-карбоксибутиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]}амино-2-этил-6-метокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты;
2-карбоксиэтиловый эфир (2R,4S)-4-{[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]}амино-2-этил-6,7-этилендиокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты или
2-карбоксиэтиловый эфир (2R,4S)-4-{(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]}амино-2-этил-6,7-этилендиокси-3,4-дигидро-2Н-хинолин-1-карбоновой кислоты.
7. Способ получения тетрагидрохинолинового производного формулы (I)
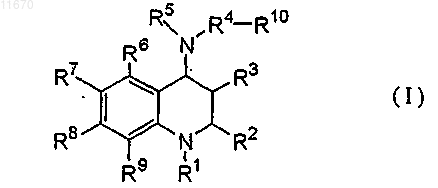
где символы R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют такое же значение, как определено в п.1, включающий конденсирование соединения формулы (II)

где каждый символ имеет такое же значение, как определено выше, с соединением формулы (III)
R10 - R4 - Z1 (III)
где Z1 представляет собой удаляемую группу, а другие символы имеют такое же значение, как определено выше.
8. Соединение формулы (II)
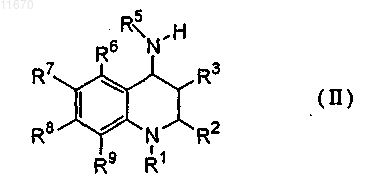
где символы R1, R2, R3, R5, R6, R7, R8 и R9 имеют такое же значение, как определено в п.1, или его соль.
9. Способ профилактики или лечения артериосклероза, заболевания периферических сосудов, дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, наследственной гиперхолестеринемии, сердечно-сосудистых заболеваний, стенокардии, ишемии, ишемии сердца, удара, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии, церебрального инфаркта, инсульта, диабета, сосудистых осложнений диабета, тромботических заболеваний, ожирения или эндотоксемии, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-6 или его фармацевтически приемлемой соли.
10. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли для лечения пациентов, страдающих от артериосклероза, заболевания периферических сосудов, дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, наследственной гиперхолестеринемии, сердечно-сосудистых заболеваний, стенокардии, ишемии, ишемии сердца, удара, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии, церебрального инфаркта, инсульта, диабета, сосудистых осложнений диабета, тромботических заболеваний, ожирения или эндотоксемии.
Текст
011670 Настоящее изобретение относится к новому тетрагидрохинолиновому производному, обладающему активностью ингибирования белка переноса холестерилового эфира (CETP). В результате многочисленных эпидемиологических наблюдений было обнаружено, что гиперхолестеринемия, особенно высокий уровень содержания в сыворотке холестерина липопротеидов низкой плотности (LDL), является фактором риска артериосклеротических заболеваний. Действительно, лекарственные средства, способные снижать уровень холестерина LDL, такие как ингибиторы 3-гидрокси-3 метилглутарил-СоА (HMG-CoA)редуктазы, применялись для профилактики заболеваний коронарных артерий, и многие крупномасштабные клинические испытания показали, что эти средства обладают некоторыми благоприятными эффектами. Однако профилактическое действие этих средств на коронарные заболевания в некоторой степени ограничено и на сегодняшний день не является достаточно эффективным. Недавно в результате многочисленных эпидемиологических наблюдений и крупномасштабных клинических испытаний было обнаружено, что низкий уровень содержания в сыворотке холестерина липопротеидов высокой плотности (HDL) является сильным фактором риска артериосклеротических заболеваний. Известно, что HDL обладает различными антиартериосклеротическими эффектами, и внимание было сфокусировано на потенциальных возможностях лекарственных средств, повышающих уровень холестерина HDL, в качестве средств для профилактики или лечения артериосклеротических заболеваний. Однако нет никаких лекарственных средств, которые можно успешно использовать для этой цели. Фибраты и ингибиторы HMG-CoA редуктазы обладают низкой активностью повышения холестерина HDL; производные никотиновой кислоты могут существенно повышать HDL, но существуют серьезные проблемы, связанные с переносимостью этих средств. Следовательно, существовала потребность в хорошо переносимом средстве, которое может существенно повышать уровень холестерина HDL, тем самым предотвращая или способствуя обратному развитию артериосклероза. Известно, что многие белки участвуют в механизме регуляции катаболизма различных липопротеидов. Из таких белков внимание стала привлекать роль белка переноса холестерилового эфира (CETP).CETP представляет собой белок, ответственный за перенос холестерилового эфира (CE) и триглицерида между липопротеидами и опосредует перенос CE из HDL к LDL или к липопротеидам очень низкой плотности (VLDL). Следовательно, активность CETP сильно влияет на композицию липидов в частицах липопротеидов. Например, известно, что введение кролику или хомяку нейтрализующего моноклонального антитела к CETP повышает уровни холестерина HDL и снижает уровни холестерина LDL. Более того, у людей, у которых понижена или отсутствует активность CETP из-за генной мутации, наблюдают повышенные уровни в крови холестерина HDL и пониженные уровни в крови холестерина LDL. С другой стороны, известно, что трансгенные мыши и крысы, экспрессирующие CETP, демонстрируют пониженные уровни холестерина HDL и повышенные уровни холестерина LDL. Таким образом, считают, чтоCETP значительным образом способствует регулированию содержания липидов в сыворотке, влияя, таким образом, на изменение профиля липидов в сыворотке, например на снижение уровня холестеринаHDL и на повышение уровня холестерина LDL. Следовательно, высокое значение активности CETP, как полагают, может индуцировать артериосклероз. На самом деле активность CETP варьирует в зависимости от вида животного. Известно, что артериосклеротические поражения легко образуются при холестериновой нагрузке у животных с высокой активностью CETP, таких как кролики, тогда как такие поражения редко возникают у животных с низкой активностью CETP, таких как крысы. Кроме того, подтверждено, что постоянное подавление активностиCETP путем введения антисмысловых олигонуклеотидов приводит к таким эффектам, как повышенный уровень в крови холестерина HDL сокращение артериосклеротических поражений у потребляющих богатый холестерином корм кроликов. Указанные выше открытия показывают, что активность CETP находится в отрицательной взаимозависимости с холестерином HDL и что ингибирование активности CETP может снизить степень риска артериосклеротических заболеваний. Поэтому ожидается, что соединения, способные ингибировать активность CETP, могут блокировать перенос холестерина из HDL к LDL, повышая, таким образом, уровни холестерина HDL, что ведет к предотвращению артериосклероза, в то же время снижая уровни холестерина LDL, что способствует развитию артериосклероза. В этом отношении, такие соединения могут служить как полезное профилактическое или терапевтическое средство против артериосклеротических заболеваний, гиперлипидемии или дислипидемии и для обеспечения, прежде всего, эффективного медицинского лечения. Примеры соединений, обладающих активностью ингибирования CETP, включают тетрагидрохинолиновые производные. См. WO 00/17164, WO 00/17165, WO 00/17166. Однако эти соединения имеют недостатки. А именно, они плохо растворимы в воде и недостаточно абсорбируются в условиях in vivo, достаточный уровень в крови для достижения лечебного эффекта трудно достижим даже при введении в форме обычного препарата для перорального применения. См.WO 03/63868. Следовательно, существует сильная потребность в новых соединениях, где проблемы, связанные с указанными выше недостатками, решены.-1 011670 Раскрытие изобретения Настоящее изобретение обеспечивает новые тетрагидрохинолиновые производные, обладающие высокой активностью ингибирования CETP, где устранены недостатки, присущие существующим в настоящее время соединениям-ингибиторам CETP. Таким образом, настоящее изобретение обеспечивает соединение формулы (I) где R1 представляет собой С 1-6 алкоксикарбонильную группу, необязательно замещенную 1-5 заместителями, независимо выбранными из гидроксигруппы, карбоксильной группы, C1-6 алкоксикарбонильной группы, C1-6 алкоксигруппы (указанная C1-6 алкоксигруппа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы и C1-6 алкоксикарбонильной группы), С 2-6 алкенильной группы, атома галогена, С 3-10 циклоалкильной группы(указанная С 3-10 циклоалкильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6 алкоксикарбонильной группы, карбоксиС 1-6 алкильной группы и C1-6 алкоксикарбонилC1-6 алкильной группы), фенильной группы(указанная фенильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6 алкоксикарбонильной группы,карбоксиС 1-6 алкильной группы и C1-6 алкоксикарбонилC1-6 алкильной группы), пиперидинильной группы(указанная пиперидинильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6 алкоксикарбонильной группы, карбоксиC1-6 алкильной группы и C1-6 алкоксикарбонилC1-6 алкильной группы) и пирролидинильной группы (указанная пирролидинильная группа является необязательно замещенной 1-3 заместителями, независимо выбранными из гидроксигруппы, атома галогена, карбоксильной группы, C1-6 алкоксикарбонильной группы, карбоксиC1-6 алкильной группы и C1-6 алкоксикарбонилC1-6 алкильной группы); или дигидрооксазолильную группу, необязательно замещенную 1 или 2 заместителями, независимо выбранными из карбоксильной группы, C1-6 алкоксикарбонильной группы, карбоксиC1-6 алкильной группы, C1-6 алкоксикарбонилC1-6 алкильной группы и гидроксиC1-6 алкильной группы;R3 представляет собой атом водорода;R5 представляет собой группу формулыR6 и R9 каждый представляет собой атом водорода;R7 и R8 независимо представляют собой атом водорода, C1-6 алкильную группу, необязательно замещенную атомом галогена, C1-6 алкильной группой или моно- или ди-С 1-6 алкиламиногруппой; или объединены по концевым частям этих групп с образованием C1-4 алкилендиоксигруппы; иR10 представляет собой фенильную группу, замещенную 1-3 заместителями, выбранными из цианогруппы, C1-6 алкильной группы, необязательно замещенной атомом галогена и С 1-6 алкоксигруппы. Кольцо А представляет собой пиримидинильную группу, пиридильную группу, тетразолильную группу, оксадиазолильную группу или тиазолильную группу; иR11 представляет собой карбоксильную группу; цианогруппу; нитрогруппу; С 1-6 алкильную группу,замещенную группой, выбранной из гидроксигруппы, карбоксильной группы, C1-6 алкоксикарбонильной группы, C1-6 алкоксигруппы, фенилC1-6 алкоксигруппы, карбоксиC1-6 алкоксигруппы, C1-6 алкилтиогруппы,C1-6 алкилсульфонильной группы, С 1-6 алкилсульфинильной группы, аминогруппы, моно- или ди-С 1-6 алкиламиногруппы, моно- или ди-С 1-6 алкилсульфамоиламиногруппы, моно- или ди-С 1-6 алкилуреидогруппы, необязательно замещенной морфолинильной группой, оксиранильной группы, ди-C1-6 алкилдиоксоланильной группы, пиперазинильной группы, необязательно замещенной алкильной группой, и морфолинильной группы; С 2-6 алкенильную группу, необязательно замещенную карбоксильной группой; C1-6 алкоксигруппу, замещенную группой, выбранной из цианогруппы, гидроксигруппы, карбоксильной группы, C1-6 алкоксикарбонильной группы, C1-6 алкоксигруппы, фенилC1-6 алкоксигруппы,карбоксиC1-6 алкоксигруппы, C1-6 алкилтиогруппы, C1-6 алкилсульфонильной группы, C1-6 алкилсульфинильной группы, аминогруппы, моно- или ди-C1-6 алкиламиногруппы, моно- или ди-С 1-6 алкилсульфамоиламиногруппы, моно- или ди-С 1-6 алкилуреидогруппы, необязательно замещенной морфолинильной группой, оксиранильной группы, ди-С 1-6 алкилдиоксоланильной группы, пиперазинильной группы, необязательно замещенной С 1-6 алкильной группой, и морфолинильной группы; гидроксикарбамидоильную группу; C1-6 алкилтиогруппу; C1-6 алкилсульфонильную группу, необязательно замещенную C1-6-2 011670 алкоксикарбонильной группой; моно- или ди-C1-6 алкиламиногруппу, необязательно замещенную гидроксигруппой, карбоксильной группой или C1-6 алкоксигруппой; морфолинильную группу; необязательно окисленную тиоморфолинильную группу; пиперазинильную группу, необязательно замещенную группой, выбранной из C1-6 алкильной группы, C1-6 алканоильной группы и гидроксиC1-6 алканоильной группы; пирролидинильную группу, необязательно замещенную карбоксильной группой, C1-6 алкильной группой,карбоксиC1-6 алкильной группой или C1-6 алкоксикарбонильной группой; пиперидинильную группу, необязательно замещенную карбоксильной группой, C1-6 алкильной группой, карбоксиC1-6 алкильной группой или C1-6 алкоксикарбонильной группой; тетразолильную группу, необязательно замещенную C1-6 алкильной группой, гидроксиC1-6 алкильной группой или морфолинилC1-6 алкильной группой; оксодигидрооксадиазолильную группу; пиримидинильную группу; или тетрагидропиранильную группу, или его фармацевтически приемлемую соль. Фармацевтически приемлемые соли соединения (I) по настоящему изобретению включают внутримолекулярную соль, гидрат, сольват и т.п. Как он используется в настоящем описании, термин "ароматическое кольцо, необязательно содержащее 1-3 гетероатома, независимо выбранных из атомов кислорода, серы и азота" предпочтительно относится к "5-7-членному моноциклическому ароматическому кольцу, необязательно содержащему 1-3 гетероатома, независимо выбранных из атомов кислорода, серы и азота", конкретные примеры которого включают фенильную, фурильную, тиенильную, пирролильную, оксазолильную, тиазолильную, имидазолильную, пиразолильную, изоксазолильную, изотиазолильную, пиридильную, пиридазинильную, пиримидинильную, пиразинильную, азепинильную, оксепинильную и тиепинильную группы и т.п. Термин "насыщенная или ненасыщенная моноциклическая или бициклическая гетероциклическая группа, содержащая от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота" предпочтительно относится к "насыщенной или ненасыщенной 5-8-членной гетероциклической группе,содержащей от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота", конкретные примеры которой включают группы, перечисленные далее. Примеры 5-членной гетероциклической группы включают 2 Н-пирролильную, 3 Н-пирролильную, 2 пирролильную, 3-пирролильную, пирролидинильную, 1,3-диоксоланильную, оксазолильную, оксазолинильную, оксазолидинильную, тиазолильную, имидазолильную, имидазолинильную, имидазолидинильную, пиразолильную, 2-пиразолинильную, пиразолидинильную, изоксазолильную, изотиазолильную,тетразолильную, 1,2-дитиолильную, 1,3-дитиолильную, 3 Н-1,2-оксатиолильную, 1,2,3-оксадиазолильную, 1,2,4-оксадиазолильную, 1,2,5-оксадиазолильную, 1,3,4-оксадиазолильную, 1,2,3-триазолильную,1,2,4-триазолильную, 1,3,4-тиадиазолильную, 1,2,3,4-оксатриазолильную, 1,2,3,5-оксатриазолильную,3 Н-1,2,3-диоксазолильную, 1,2,4-диоксазолильную, 1,3,2-диоксазолильную, 1,3,4-диоксазолильную, 5 Н 1,2,5-оксатиазолильную и 1,3-оксатиолильную группы и т.п. Примеры 6-членной гетероциклической группы включают 2 Н-пиранильную, 4 Н-пиранильную, пиридильную, пиперидинильную, 1,2-диоксинильную, 1,3-диоксинильную, 1,4-диоксанильную, морфолинильную, 1,4-дитианильную, тиоморфолинильную, пиридазинильную, пиримидинильную, пиразинильную, пиперазинильную, 1,3,5-триазинильную, 1,2,4-триазинильную, 1,2,3-триазинильную, 1,3,5 тритианильную, 4 Н-1,2-оксазинильную, 2 Н-1,3-оксазинильную, 6 Н-1,3-оксазинильную, 6H-1,2 оксазинильную, 1,4-оксазинильную, 2 Н-1,2-оксазинильную, 4 Н-1,4-оксазинильную, 1,2,5-оксатиазинильную, 1,4-оксазинильную, о-изоксазинильную, п-изоксазинильную, 1,2,5-оксатиазинильную, 1,2,6 оксатиазинильную, 1,4,2-оксадиазинильную и 1,3,5,2-оксадиазинильную группы и т.п. Примеры 7-членной гетероциклической группы включают азепинильную, оксепинильную и тиепинильную группы и т.п. Примеры 8-членной гетероциклической группы включают азоцинильную, оксоцинильную и тиоцинильную группы и т.п. Как используется в настоящем описании, гетероциклический фрагмент "насыщенной или ненасыщенной моноциклической или бициклической гетероциклической оксигруппы, содержащей от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота", "насыщенной или ненасыщенной моноциклической или бициклической гетероциклической карбонильной группы, содержащей от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота", и "насыщенной или ненасыщенной моноциклической или бициклической гетероциклической карбониламиногруппы, содержащей от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота," относится к указанной выше "насыщенной или ненасыщенной моноциклической или бициклической гетероциклической группе, содержащей от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота". В тех случаях, когда положение связывания для такого ароматического кольца, гетероциклической группы и т.п. конкретно не указано, предполагается, что определение охватывает все возможные положения связывания. Например, термин "пиридильная группа" означает 2-, 3- или 4-пиридильную группу, а термин "тиенильная группа" означает 2- или 3-тиенильную группу. То же относится и к другим ароматическим кольцам и гетероциклическим группам. Когда указанная насыщенная или ненасыщенная моноциклическая или бициклическая гетероциклическая группа, гетероциклическая оксигруппа, гетероциклическая карбонильная группа и гетероцик-3 011670 лическая карбониламиногруппа, каждая, содержащая от 1 до 4 гетероатомов, независимо выбранных из атомов кислорода, серы и азота, содержит заместитель(заместители), такое замещение включает окисление гетероатома(гетероатомов) в гетероцикле в соответствующих группах. Конкретно, соединения, содержащие гетероатом(ы) в гетероцикле указанных групп, такие как N-оксид, S-оксид (SO) или 3,3 диоксид (SO2), также входят в объем настоящего изобретения. Термин "галоген" относится к фтору, хлору, брому или иоду. Термин "алкильная группа" или "алкил" означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 10 атомов углерода, и циклическую насыщенную углеводородную цепь, содержащую от 3 до 10 атомов углерода. В качестве линейной или разветвленной углеводородной цепи предпочтительными являются цепи, содержащие от 2 до 10 атомов углерода, и более предпочтительными являются цепи, содержащие от 2 до 6 атомов углерода. Другие предпочтительные примеры включают алкильные группы с линейной цепью, содержащие от 1 до 6 атомов углерода, особенно группы, содержащие от 1 до 4 атомов углерода. Примеры алкильной группы включают метильную, этильную, пропильную, изопропильную, бутильную,втор-бутильную, трет-бутильную, пентильную, изопентильную, неопентильную, трет-пентильную, 1 метилбутильную, 2-метилбутильную, 3-метилбутильную, гексильную и изогексильную группы и т.п. Термин "алкоксигруппа" или "алкокси" означает линейную или разветвленную алкилоксигруппу,содержащую от 1 до 10 атомов углерода, и циклическую алкилоксигруппу, содержащую от 3 до 10 атомов углерода. В качестве линейной или разветвленной углеводородной цепи предпочтительными являются цепи, содержащие от 2 до 10 атомов углерода, и более предпочтительными являются цепи, содержащие от 2 до 6 атомов углерода. Другие предпочтительные примеры включают алкоксигруппы с линейной цепью, содержащие от 1 до 6 атомов углерода, особенно группы, содержащие от 1 до 4 атомов углерода. Примеры алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентокси, изопентокси, неопентокси, трет-пентокси, гексокси и изогексоксигруппы и т.п. Термин "алкиленовая группа" или "алкилен" означает насыщенную углеводородную цепь, где атом водорода удален у каждого из концевых атомов углерода линейной углеводородной цепи. Предпочтительные примеры включают алкиленовую группу, содержащую от 1 до 6 атомов углерода, конкретно,метиленовую, этиленовую, триметиленовую и тетраметиленовую группы и т.п. Когда алкиленовая группа, используемая, как указано в настоящем описании, содержит 1-3 гетероатома, независимо выбранных из атомов азота, серы и кислорода, термин "алкилен" включает группу формулы -О-(CH2)m-O-, -S-(CH2)mS-, -NH-(CH2)m-NH- или -О-(CH2)m-NH- (где m представляет собой целое число, имеющее значение от 1 до 4) или т.п. Термин "алканоильная группа" или "алканоил" означает линейную или разветвленную алкилкарбонильную группу, содержащую от 1 до 10 атомов углерода, предпочтительно алкилкарбонильную группу,содержащую от 1 до 6 атомов углерода, более предпочтительно алкилкарбонильную группу, содержащую от 1 до 4 атомов углерода. Примеры алканоильной группы включают ацетильную, пропионильную,бутирильную, валерильную и пивалоильную группы и т.п. Термин "алкенильная группа" или "алкенил" означает линейную или разветвленную углеводородную цепь, содержащую от 2 до 10 атомов углерода и содержащую по меньшей мере одну двойную связь,предпочтительно алкенильную группу, содержащую от 2 до 6 атомов углерода, более предпочтительно алкенильную группу, содержащую от 2 до 4 атомов углерода. Примеры алкенильной группы включают винильную, 1-пропенильную, аллильную, изопропенильную, бутенильную, бутадиенильную и пентенильную группы и т.п. Как он использован везде в настоящей заявке, как в формуле изобретения, так и в описании изобретения, когда термин "моно- или диалкил" относится к диалкилу, такие алкильные фрагменты могут быть независимы друг от друга. Кроме того, соединение формулы, представленной ниже, означает, что оно может принимать конфигурацию (2R,4S), где (2R,4S) означает смесь (2R,4S) и (2S,4R). Содинения по настоящему изобретению обладают активностью ингибирования CETP и являются эффективными для повышения уровня HDL холестерина и снижения уровня LDL холестерина. Следовательно, указанные соединения являются полезными для профилактики и/или лечения заболеваний, таких как артериосклероз, гиперлипидемия и т.п. Лучший способ осуществления изобретения Предпочтительные соединения включают такие соединения, где R1 представляет собой алкоксикарбонильную группу, необязательно замещенную 1 или 5 заместителями, независимо выбранными из карбоксильной группы, алкоксикарбонильной группы, атома галогена, гидроксигруппы и циклоалкильной группы;R10 представляет собой фенильную группу, замещенную 1-3 заместителями, выбранными из циано-4 011670 группы, алкильной группы, необязательно замещенной атомом галогена, и алкоксигруппы; кольцо А представляет собой пиримидинильную группу, пиридильную группу, тетразолильную группу или оксадиазолильную группу;R11 представляет собой карбоксильную группу; алкильную группу, замещенную гидроксигруппой,карбоксильной группой, алкоксигруппой или алкилсульфонильной группой; алкенильную группу, необязательно замещенную карбоксильной группой; алкоксигруппу, замещенную цианогруппой, карбоксильной группой, гидроксигруппой, алкоксигруппой, алкилтиогруппой или алкилсульфонильной группой; моно- или диалкиламиногруппу, необязательно замещенную карбоксильной группой или алкоксигруппой; морфолинильную группу; пиперидинильную группу, замещенную карбоксильной группой; или тетразолильную группу, замещенную гидроксиалкильной группой;R7 представляет собой алкильную группу, необязательно замещенную атомом галогена, алкоксигруппой или моно- или диалкиламиногруппой; иR8 представляет собой атом водорода. Особенно предпочтительные соединения включают такие соединения, где R1 представляет собой этоксикарбонильную группу, гидроксиэтоксикарбонильную группу, 2-фторэтоксикарбонильную группу,2,2-дифторэтоксикарбонильную группу или 2,2,2-трифторэтоксикарбонильную группу; R2 представляет собой этильную группу; R10 представляет собой фенильную группу, замещенную 1-2 заместителями, выбранными из цианогруппы, трифторметильной группы и метоксигруппы; R7 представляет собой трифторметильную группу или метоксигруппу. В этой связи другие примеры особенно предпочтительных соединений включают такие соединения, где R1 представляет собой карбокси(С 2-10 алкокси)карбонильную группу или алкоксикарбонил(С 2-10 алкокси)карбонильную группу, и R2, R10 и R7 имеют значения, определенные выше. Еще более предпочтительные соединения включают такие соединения, где R1 представляет собой этоксикарбонильную группу или гидроксиэтоксикарбонильную группу; R2 представляет собой этильную группу; R10 представляет собой фенильную группу, замещенную 1-2 заместителями, выбранными из цианогруппы, трифторметильной группы и метоксигруппы; R7 представляет собой трифторметильную группу или метоксигруппу. Наиболее предпочтительные соединения включают соединения, перечисленные ниже. Этиловый эфир(2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(4-карбоксибутокси)пиридин-2 ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; этиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(4-карбоксибутокси)пиримидин-2 ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси)пиримидин-2 ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси)пиримидин-2 ил]амино-2-этил-6-диметиламино-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2,2,2-трифторэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин 1-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин-1-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2,2,2-трифторэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(3-карбоксипропокси) пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2,2,2-трифторэтиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(3-карбоксипропокси) пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-окисэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(4-карбоксипиперидин-1-ил) пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4 ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 5-карбоксипентиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 5-карбоксипентиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[-3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты или 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин 2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты или их фармацевтически приемлемые соли. Следующие примеры наиболее предпочтительных соединений включают 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты;(2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4 ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4 ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин 2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин 2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4 ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-гидроксиэтокси)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин 2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(3-цианопропокси)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2-7 011670 ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин 2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2 ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-диметиламинопиридин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4 ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4 ил)пиримидин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4 ил)пиримидин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин 2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 3-карбоксипропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиридин 2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4 ил)пиридин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 4-карбоксибутиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4-ил)пиридин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбокси-2-метилпропиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(морфолин-4 ил)пиридин-2-ил]амино-2-этил-6-метокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; 2-карбоксиэтиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4-ил)пиримидин-2-ил]амино-2-этил-6,7-этилендиокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты или 2-карбоксиэтиловый эфир (2R,4S)-4-(3-циано-5-трифторметилбензил)-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6,7-этилендиокси-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты; или их фармацевтически приемлемые соли. Соединение (I) по настоящему изобретению или его фармацевтически приемлемую соль можно вводить либо перорально, либо парентерально, и их можно формулировать в фармацевтические препараты с традиционно используемыми для таких целей фармацевтически приемлемыми носителями. Фармацевтически приемлемые соли соединений (I) могут включать, например, соли щелочных металлов, такие как соли лития, натрия или калия; соли щелочно-земельных металлов, такие как соли кальция или магния; соли с цинком или алюминием; соли с органическими основаниями, такими как амоний,холин, диэтаноламин, лизин, этилендиамин, трет-бутиламин, трет-октиламин, трис(гидроксиметил)аминометан, N-метилглюкозамин, триэтаноламин или дегидроабиэтиламин; соли с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, иодисто-водородная кислота, серная кислота, азотная кислота или фосфорная кислота; соли с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота,янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота или толуолсульфоновая кислота; или соли, образованные аминокислотами кислотного типа, такими как аспарагиновая кислота или глутаминовая кислота. Кроме того, фармацевтически приемлемые соли соединений (I) могут включать, например, четвер-8 011670 тичные соли, образованные соединением формулы (I) вместе с алкилгалегенидом или фенилалкилгалогенидом. Предпочтительные фармацевтические препараты для перорального введения соединения (I) по настоящему изобретению или его фармацевтически приемлемой соли включают твердые формы препаратов, такие как таблетки, гранулы, капсулы или порошки; и жидкие формы препаратов, такие как растворы, суспензии или эмульсии. Предпочтительные фармацевтические препараты для парентерального введения включают препараты для инъекций или инфузий, сформулированные в композицию с использованием дистиллированной воды для инъекций, физиологического солевого раствора или водного раствора глюкозы; суппозитории; или препараты для ингаляции. Такие фармацевтические препараты включают соединение (I) по настоящему изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, который обычно используют для перорального или парентерального введения. Фармацевтически приемлемые носители для перорального введения включают, например, связующее (сироп, аравийская камедь, желатин, сорбит, трагакант, поливинилпирролидон и т.п.), эксципиент (лактоза, сахар, кукурузный крахмал, фосфат калия,сорбит, глицин и т.п.), смазывающее вещество (стеарат магния, тальк, полиэтиленгликоль, диоксид кремния и т.п.), разрыхлитель (картофельный крахмал и т.п.) и смачивающее вещество (безводный лаурилсульфат натрия и т.п.). Фармацевтически приемлемые носители для парентерального введения включают, например, дистиллированную воду для инъекций, физиологический солевой раствор и водный раствор глюкозы. Доза соединения (I) по настоящему изобретению или его фармацевтически приемлемой соли варьирует в зависимости от пути введения, возраста, веса тела, тяжести заболевания/состояния пациента. Однако она, как правило, находится в пределах от около 0,001 до 1000 мг/кг/день, предпочтительно в пределах от около 0,01 до 100 мг/кг/день, более предпочтительно в пределах от около 0,1 до 10 мг/кг/день. Содинения по настоящему изобретению обладают активностью ингибирования, направленной против CETP, и демонстрируют эффекты повышения уровней HDL холестерина и снижения уровней LDL холестерина. Следовательно, они полезны для профилактики или лечения субъекта (в частности, млекопитающего, включая человека), страдающего от артериосклероза, заболевания периферических сосудов,дислипидемии, гипербеталипопротеинемии, гипоальфалипопротеинемии, гиперхолестеринемии, гипертриглицеридемии, наследственной гиперхолестеринемии, сердечно-сосудистых заболеваний, стенокардии, ишемии, ишемии сердца, удара, инфаркта миокарда, реперфузионного повреждения, рестеноза после ангиопластики, гипертензии, церебрального инфаркта, инсульта, диабета, сосудистых осложнений диабета, тромботических заболеваний, ожирения, эндотоксемии или т.п. Кроме того, соединения по настоящему изобретению можно использовать в сочетании с другими лекарственными средствами, полезными для лечения таких заболеваний. Например, соединения по настоящему изобретению можно использовать в сочетании с ингибитором синтеза холестерина, таким как ингибитор HMG-CoA редуктазы, ингибитором абсорбции холестерина, таким как анионо-обменная смола, фибратами, средством, снижающим уровень триглицеридов, таким как ниацин, или другим средством, снижающим уровень холестерина, таким как ингибитор ACAT. Соединения по настоящему изобретению отличаются тем, что аминогруппу, замещенную гетероциклом, содержащим заместитель(заместители), как определено выше, вводят в 4 положение тетрагидрохинолинового скелета, в результате чего такие соединения демонстрируют превосходную активность ингибирования CETP и обладают улучшенной биодоступностью. И из таких соединений предпочтительными являются соединения, содержащие карбоксильную группу в концевом положении соотетствующих заместителей R1-R11, особенно те, которые содержат карбоксильную группу в концевом положении групп R1 и/или R5, или R1 и/или R11. Соединение (I) по настоящему изобретению можно получить следующими способами. Способ 1. Соединение (I) по настоящему изобретению можно получить конденсацией соединения формулы где символы имеют такое же значение, как определено выше, с соединением формулы (III)R10-R4-Z1 (III) 1 где Z представляет собой удаляемую группу, а другие символы имеют такое же значение, как определено выше. Конденсацию можно осуществить в присутствии основания в подходящем растворителе. Удаляемая группа включает атом галогена, включая атом хлора, атом брома, атом иода, и замещенную сульфонилоксигруппу, включая метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, триф-9 011670 торметансульфонилоксигруппу. В качесте основания можно использовать традиционно используемое основание и предпочтительно можно использовать, например, гидрид щелочного металла, включающий гидрид натрия, гидрид калия; гидроксид щелочного металла, включающий гидроксид натрия, гидроксид калия; гидроксид щелочноземельного металла, включающий гидроксид бария; алкоксид щелочного металла, включающий метоксид натрия, этоксид натрия, этоксид калия, трет-бутоксид калия; карбонат щелочного металла, включающий карбонат натрия, карбонат калия, карбонат цезия; бикарбонат щелочного металла, включающий бикарбонат натрия, бикарбонат калия; амины, включающие триэтиламин, диизопропилэтиламин, метилпиперидин, диметиланилин, 1,8-диазабицикло[5.4.0]ундецен, 1,4-диазабицикло[2.2.2]октан, 1,5-диазабицикло[4.3.0]нонен; пиридины, включающие пиридин, диметиламинопиридин. Любой растворитель, который не препятствует осуществлению реакции, может быть предпочтительным для использования, и такой растворитель включает, например, углеводороды, включающие пентан, гексан; ароматические углеводороды, включающие бензол, толуол, нитробензол; галогенированные углеводороды, включающие дихлорметан, хлороформ; простые эфиры, включающие диэтиловый эфир,тетрагидрофуран; амиды, включающие диметилформамид, N-метилпирролидон, 1,3-диметилимидазолидин-2-он; сульфоксиды, включающие диметилсульфоксид; спирты, включающие метанол,этанол; сложные эфиры, включающие этилацетат, бутилацетат; кетоны, включающие ацетон, метил этил кетон; нитрилы, включающие ацетонитрил; воду или смесь таких растворителей. Реакцию осуществляют в условиях от охлаждения до нагревания, предпочтительно от -78 до 200C,более предпочтительно от -30 до 100C. Способ 2. Из соединений формулы (I-A), соединение формулы (I-b) где символы имеют такое же значение, как определено выше, можно получить путем(а) цианирования соединения формулы (IV) где символы имеют такое же значение, как определено выше, с получением соединения формулы (V) где символы имеют такое же значение, как определено выше,(b) взаимодействия соединения (V) с гидроксиламином или его солью с получением соединения формулы (VI) где символы имеют такое же значение, как определено выше,(с) алканоилирования соединения (VI) с получением соединения формулы (VII) где символы имеют такое же значение, как определено выше, и затем(d) циклизации соединения (VII) при помощи основания. Цианирование в способе (а) можно осуществить путем взаимодействия галогенированного цианогенового соединения в присутствии основания в подходящем растворителе. Цианогенбромид является предпочтительным в качестве галогенированного цианогенового соединения. В качесте основания можно использовать традиционно используемое основание и предпочтительно можно использовать карбонат щелочного металла, включающий карбонат калия, или бикарбонат щелочного металла, включающий бикарбонат натрия. Можно использовать любой растворитель, который не препятствует осуществлению реакции и растворитель, указанный в способе 1, может быть предпочтительным для использования. Реакцию с гидроксиламином в способе (b) можно осуществить в присутствии основания в подходящем растворителе. Третичные алкиламины, включающие триэтиламин, диизопропилэтиламин и т.п., могут быть предпочтительными для использования в качестве основания. Можно использовать любой растворитель, который не препятствует осуществлению реакции и растворитель, указанный в способе 1, может быть предпочтительным для использования. Алканоилирование в способе (с) можно осуществить с использованием алканоилгалогенида в присутствии основания в подходящем растворителе. В качесте основания можно использовать традиционно используемое основание и предпочтительно можно использовать амины, включающие триэтиламин или диизопропилэтиламин, или пиридины, включающие пиридин, 4-диметиламинопиридин. Можно использовать любой растворитель, который не препятствует осуществлению реакции, и растворитель, указанный в способе 1, может быть предпочтительным для использования. Для циклизации в способе (d) в качесте основания можно использовать традиционно используемое основание и предпочтительно можно использовать амины, включающие триэтиламин или диизопропилэтиламин; пиридины, включающие пиридин, 4-диметиламинопиридин; или алкоксид щелочного металла,включающий метоксид натрия. Можно использовать любой растворитель, который не препятствует осуществлению реакции, и растворитель, указанный в способе 1, может быть предпочтительным для использования. Кроме того, циклизацию после алканоилирования можно также осуществить in situ. Реакцию осуществляют в условиях от охлаждения до нагревания, предпочтительно при температуре от -50 до 100C, более предпочтительно от 0 до 50C. Способ 3. Из соединений формулы (I-A) соединение формулы (I-c) где символы имеют такое же значение, как определено выше, можно получить путем взаимодействия соединения формулы (V)- 11011670 где символы имеют такое же значение, как определено выше, с 3-бутен-1-олом с получением соединения формулы (VIII) где символы имеют такое же значение, как определено выше, с последующей циклизацией полученного соединения в присутствии иода, N-иодсукцинимида или т.п. Реакцию с 3-бутен-1-олом можно осуществить в присутствии основания в подходящем растворителе. Можно использовать любое основание, которое не препятствует осуществлению реакции, и основание, указанное в способе 1, может быть предпочтительным для использования. Можно использовать любой растворитель, который не препятствует осуществлению реакции, и растворитель, указанный в способе 1, может быть предпочтительным для использования. В способе циклизации можно использовать любой растворитель, который не препятствует осуществлению реакции, и растворитель, указанный в способе 1 может быть предпочтительным для использования. Реакцию осуществляют в условиях от охлаждения до нагревания, предпочтительно при температуре от -50 до 100C, более предпочтительно от 0 до 50C. Способ 4. Соединение формулы (I-А) также можно получить следующими способами с использованием соединения формулы (IX) где X10 представляет собой атом водорода, атом галогена или гидроксигруппу, а другие символы имеют такое же значение, как определено выше. В каждом из указанных ниже способов (A)-(K), если не указано иное, основание, указанное в способе 1, может быть предпочтительным для использования в качестве основания. Кроме того, в каждом из указанных ниже способов (A)-(K) в качестве кислоты можно использовать любую традиционно используемую кислоту и, если не указано иное, предпочтительной для использования может быть минеральная кислота, включающая хлористо-водородную кислоту, азотную кислоту,серную кислоту; органическая кислота, представленная сульфоновыми кислотами (например, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторметансульфоновая кислота и т.п.). Кроме того, в каждом из указанных ниже способов (A)-(K), можно использовать любой растворитель, который не препятствует осуществлению реакции, и, конкретно, растворитель, указанный в способе 1, может быть предпочтительным для использования. Удаляемая группа включает атом галогена, включая атом хлора, атом брома, атом иода, и замещенную сульфонилоксигруппу, включающую метансульфонилоксигруппу и трифторметансульфонилоксигруппу, толуолсульфонилоксигруппу.(А) Соединение, где кольцо А представляет собой тетразолильную группу и R11 представляет собой алкильную группу, содержащую от 3 до 10 атомов углерода, или замещенную алкильную группу, можно получить путем алкилирования соединения формулы (IX), где кольцо А представляет собой тетразолильную группу и X10 представляет собой атом водорода. Алкилирование можно осуществить путем взаимодействия исходного соединения с соединением формулыR11A-Z2 11A где R представляет собой алкильную группу, содержащую от 3 до 10 атомов углерода, или замещенную алкильную группу, и Z2 относится к удаляемой группе, в подходящем растворителе в присутствии или в отсутствие основания, или путем взаимодействия с соединением формулыR11A-OH где символы имеют значение, определенное выше, в подходящем растворителе в присутствии фосфинов и эфиров азодикарбоновых кислот.- 12011670 Реакция более благоприятно протекает, когда добавляют каталитическое количество иодида щелочного металла (например, иодид калия и т.п.). Предпочтительно можно использовать как фосфины, так и эфиры азодикарбоновых кислот, которые обычно используют в реакции Мицунобу. Фосфины включают, например, трифенилфосфин, трибутилфосфин и т.п., и эфиры азодикарбоновых кислот включают диэтилазодикарбоксилат, диизопропилазодиформиат и т.п.(B) Соединение, где кольцо А представляет собой 2-оксодигидропиримидинильную группу и R11 представляет собой алкильную группу, содержащую от 3 до 10 атомов углерода, или замещенную алкильную группу, можно получить путем алкилирования соединения формулы (IX), где кольцо А представляет собой 2-гидроксипиримидинильную группу и X10 представляет собой атом водорода, при помощи соединения формулыR11A-Z2 где символы имеют такое же значение, как определено выше. Реакцию можно осуществлять таким же способом, как указано в (А).(C) Соединение, где R11 представляет собой необязательно замещенную аминогруппу или группу формулы где символы имеют такое же значение, как определено выше, можно получить путем взаимодействия соединения формулы (IX), где X представляет собой атом галогена, с соответствующим амином или соединением формулы где символы имеют такое же значение, как определено выше. Реакцию можно осуществлять в присутствии или в отсутствие основания и в присутствии или в отсутствие палладиевого катализатора в подходящем растворителе. В качестве палладиевого катализатора можно использовать традиционно используемый палладиевый катализатор, включающий ацетат палладия, татракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий, дихлорбис(трифенилфосфин)палладий, дихлорбис(три-о-толилфосфин)палладий, ацетат бис(трифенилфосфин)палладия или т.п. В качестве основания предпочтительным для использования может быть гидроксид щелочного металла, включающий гидроксид натрия, гидроксид калия; гидроксид щелочно-земельного металла, включающий гидроксид бария; алкоксид щелочного металла, включающий метоксид натрия, этоксид натрия,этоксид калия, трет-бутоксид калия; карбонат щелочного металла, включающий карбонат натрия, карбонат калия, карбонат цезия; бикарбонат щелочного металла, включающий бикарбонат натрия, бикарбонат калия; фосфат щелочного металла, включающий фосфат калия; амины, включающие триэтиламин, диизопропилэтиламин, метилпиперидин, дициклогексилметиламин; и пиридины, включающие пиридин, 4 диметиламинопиридин. Кроме того, в эту реакцию можно добавлять фосфины. В качестве фосфинов предпочтительными для использования могут быть трифенилфосфин, трибутилфосфин, тетрафторборат три-третбутилфосфония, 1,3-бис(дифенилфосфино)пропан, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 1,1'бис(дифенилфосфино)ферроцен, 2-(ди-трет-бутилфосфино)бифенил, 2-дициклогексилфосфино-2'-(N,Nдиметиламино)бифенил, 2-(дициклогексилфосфино)бифенил и т.п.(D) Соединение, где R11 представляет собой необязательно замещенную аминогруппу, можно получить путем сочетания соединения формулы (IX), где X10 представляет собой атом галогена, с соединением формулы(R20)3Sn-NR21R22 20 где R представляет собой алкильную группу и NR21R22 представляет собой необязательно замещенную аминогруппу. Реакцию сочетания можно осуществить в присутствии палладиевого катализатора, в присутствии или в отсутствие основания, в подходящем растворителе. Палладиевые катализаторы, основания и фосфины, указанные в (С), можно использовать таким же способом, как указано в (С) выше.(E) Соединение, где R11 представляет собой цианогруппу, можно получить путем цианирования соединения формулы (IX), где X10 представляет собой атом галогена. Цианирование можно осуществить путем взаимодействия исходного соединения с цианидом металла, включающим цианид натрия, цианид калия или цианид цинка, в присутствии палладиевого ката- 13011670 лизатора, в подходящем растворителе. Палладиевый катализатор, такой как описан в (С), может быть предпочтительным для использования.(F) Соединение, где R11 представляет собой необязательно замещенную алкоксикарбонильную группу, можно получить путем взаимодействия соединения формулы (IX), где X10 представляет собой атом галогена, с соответствующим соединением алкилового спирта в атмосфере моноксида углерода, с использованием палладиевого катализатора, в присутствии основания, в подходящем растворителе. Палладиевый катализатор и основание, такие как описано в (С), могут быть предпочтительными для использования. Кроме того, более предпочтительно, когда реакцию осуществляют при добавлении лиганда, и фосфины, указанные в (С), могут быть предпочтительными для использования в качестве лиганда.(G) Соединение, где R11 представляет собой необязательно замещенную алкенильную группу, можно получить путем сочетания соединения формулы (IX), где X10 представляет собой атом галогена, с соответствующим алкеном. Реакцию сочетания можно осуществить в присутствии палладиевого катализатора, в присутствии или в отсутствие основания, в подходящем растворителе. Палладиевый катализатор, такой как описан в (С), может быть предпочтительным для использования. Основание, такое как указано в (С), может быть предпочтительным для использования, и можно также использовать карбонат серебра. Кроме того, более предпочтительно, когда реакцию осуществляют при добавлении лиганда, и фосфины, указанные в (С), могут быть предпочтительными для использования в качестве лиганда.(H) Соединение, где R11 представляет собой алкоксигруппу, содержащую от 3 до 10 атомов углерода, или замещенную алкоксигруппу, можно получить путем алкоксилирования соединения формулы(IX), где X10 представляет собой атом галогена. Алкоксилирование можно осуществить путем необязательного добавления катализатора на основе меди для взаимодействия исходного соединения с соответствующим спиртом в подходящем растворителе или без растворителя, в присутствии основания. Основание, такое как указано в (С), в частности карбонат цезия, может быть предпочтительным для использования. Катализатор на основе меди, включая иодид меди, бромид меди, хлорид меди, ацетат меди, трифторметансульфонат меди и т.п., может быть предпочтительным для использования. Кроме того, реакция более благоприятно протекает, когда добавляют 1,10-фенантролин, 2 аминопиридин или т.п.(I) Соединение, где R11 представляет собой необязательно замещенную гетероциклическую группу,можно получить путем сочетания соединения формулы (IX), где X10 представляет собой атом галогена, с соответствующими гетероциклическими бороновыми кислотами или соответствующими эфирами гетероциклических бороновых кислот. Сочетание можно осуществить в присутствии палладиевого катализатора и в присутствии или в отсутствие основания, в подходящем растворителе. Реакцию можно осуществлять таким же способом, как указано в (С).(J) Соединение, где R11 представляет собой алкоксикарбонилалкилсульфонильную группу, можно получить путем взаимодействия соединения формулы (IX), где X10 представляет собой атом галогена, с солью щелочного металла и алкоксикарбонилалкилсульфиновой кислоты. Соль щелочного металла и алкоксикарбонилалкилсульфиновой кислоты можно получить в соответствии со способом, описанным, например, в Baskin et al., Tetrahedron Lett., 43, 8479 (2002). Кроме того, реакцию можно осуществлять в присутствии катализатора на основе меди, в подходящем растворителе в соответствии со способом, описанным в указанной литературе. Можно использовать катализатор на основе меди, такой как описан в (H), и, в частности, иодид меди может быть предпочтительным для использования.(K) Соединение, где R11 представляет собой группу формулы где символы имеют такое же значение, как определено выше, можно получить конденсацией соединения,где R11 представляет собой гидроксигруппу, с соединением формулы где X11 представляет собой О, SO, SO2 или NRP (RP представляет собой защитную группу), и q представляет собой целое число, имеющее значение от 1 до 4, и если это необходимо, с удалением защитной группы для аминогруппы.- 14011670 В качестве защитной группы можно использовать традиционно используемую защитную группу,включая бензилоксикарбонильную группу, трет-бутоксикарбонильную группу и т.п. Реакцию можно осуществлять в подходящем растворителе в присутствии фосфинов и эфиров азодикарбоновых кислот. Реакцию можно осуществлять таким же способом, как способ 4-(A). Удаление защитной группы можно осуществить традиционным способом, включающим каталитическое восстановление, кислотную обработку и т.п., в зависимости от типа защитной группы. Реакции (А)-(K) для преобразований R11 также можно использовать для преобразования таким же способом других заместителей (R1, R2, R3, R4, R5, R6, R7, R8, R9 или R10), как это является подходящим. Кроме того, заместитель(заместители) соединения (I) по настоящему изобретению могут быть преобразованы в другие заместители, охватываемые соединением (I), в соответствии со следующими способами, как это является подходящим. В каждом из следующих способов в качестве основания можно использовать традиционно используемое основание, и, если не указано иное, основание, указанное в способе 1, может быть предпочтительным для использования. Кроме того, в каждом из следующих способов в качестве кислоты можно использовать традиционно используемую кислоту, и, если не указано иное, предпочтительными для использования могут быть минеральная кислота, включающая хлористо-водородную кислоту, азотную кислоту, серную кислоту,или органическая кислота, представленная сульфоновыми кислотами (например, метансульфоновая кислота, п-толуолсульфоновая кислота, трифторметансульфоновая кислота) или карбоновыми кислотами(например, уксусная кислота, трифторуксусная кислота). Кроме того, в каждом из следующих способов можно использовать любой растворитель, который не препятствует осуществлению реакции, и в качестве такого растворителя растворитель, указанный в способе 1, может быть предпочтительным для использования. Удаляемая группа включает атом галогена, включая атом хлора, атом брома, атом иода, и замещенную сульфонилоксигруппу, включающую метансульфонилоксигруппу, трифторметансульфонилоксигруппу и толуолсульфонилоксигруппу. Кроме того, в каждом из следующих способов "насыщенная или ненасыщенная моноциклическая или бициклическая гетероциклическая группа, содержащая от одного до четырех гетероатомов, независимо выбранных из атома кислорода, атома серы и атома азота," в R5 просто указана как "гетероциклическая группа".(1) Соединение, где R5 представляет собой гетероциклическую группу, замещенную необязательно замещенной аминогруппой или группой формулы где символы имеют такое же значение, как определено выше, можно получить путем взаимодействия соединения (I), где R5 представляет собой гетероциклическую группу, замещенную необязательно замещенной алкилсульфонилоксигруппой, с соответствующим амином или соединением формулы где символы имеют такое же значение, как определено выше, в присутствии палладиевого катализатора и в присутствии или в отсутствие основания, в подходящем растворителе или без растворителя. Реакцию можно осуществлять таким же способом, как способ 4-(C).(2) Соединение, где R5 представляет собой гетероциклическую группу, замещенную необязательно замещенной аминогруппой или группой формулы где символы имеют такое же значение, как определено выше, также можно получить путем взаимодействия соединения, где R5 представляет собой гетероциклическую группу, замещенную атомом галогена или необязательно замещенной алкилсульфонилоксигруппой, с соответствующим амином или соединением формулы где символы имеют такое же значение, как определено выше. Реакцию можно осуществлять при необязательном добавлении катализатора на основе меди, в присутствии или в отсутствие основания, в подходящем растворителе. В качестве катализатора на основе меди предпочтительными для использования могут быть иодид меди, бромид меди, хлорид меди, ацетат меди, трифторметансульфонат меди и т.п. Основание, такое как указано в способе 4-(C), может быть предпочтительным для использования. Кроме того, реакция более благоприятно протекает, когда добавляют N,N'-диметилэтилендиамин,1,10-фенантролин, этиленгликоль, фенилфенол и т.п.(3) Соединение, где R5 представляет собой гетероциклическую группу, замещенную необязательно замещенной алкилтиогруппой, можно получить путем взаимодействия соединения, где R5 представляет собой гетероциклическую группу, замещенную атомом галогена или необязательно замещенной алкилсульфонилоксигруппой, с соответствующим алкилтиолом. Реакцию можно осуществлять таким же способом, как описано выше в способе 4-(H), и для облегчения прохождения реакции можно добавить 1,10-фенантролин или этиленгликоль.(4) Соединение, где R5 представляет собой гетероциклическую группу, замещенную необязательно замещенной гетероциклической группой, можно получить путем сочетания соединения, где R5 представляет собой гетероциклическую группу, замещенную атомом галогена или необязательно замещенной алкилсульфонилоксигруппой, с соответствующим гетероциклическим соединением алкилолова. Реакцию можно осуществлять таким же способом, как способ 4-(D).(5) Соединение, где R5 представляет собой гетероциклическую группу, замещенную алкоксигруппой или алкоксифенилалкоксигруппой, можно получить путем взаимодействия соединения, где R5 представляет собой гетероциклическую группу, замещенную алкилсульфонильной группой, с соответствующим алкоксидом щелочного металла в подходящем растворителе. Соответствующий алкоксид щелочного металла можно получить обработкой соответствующего соединения алкилового спирта гидридом щелочного металла или щелочным метлаллом в указанном растворителе.(6) Соединение, содержащее аминоалкильную группу в качестве заместителя в R5, можно получить путем каталитического восстановления соединения, содержащего цианогруппу или цианоалкильную группу в качестве заместителя в R5. Каталитическое восстановление можно осуществить с использованием катализатора в атмосфере водорода, в подходящем растворителе, в соответствии с традиционным способом. Катализатор включает палладиевый катализатор, включающий палладий на углероде, никелевый катализатор, включающий никель Ренея, платиновый катализатор, включающий платину на углероде, и т.п.(7) Соединение, содержащее необязательно замещенную моно- или диалкилсульфамоиламиноалкильную группу в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего аминоалкильную группу в качестве заместителя в R5, с соответствующим галогенированным моно- или диалкилсульфамоилом. Реакцию можно осуществлять в подходящем растворителе в присутствии основания.(8) Соединение, содержащее необязательно замещенную моноалкилкарбамоиламиноалкильную группу в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего аминоалкильную группу в качестве заместителя в R5, с соответствующим алкилизоцианатом в подходящем растворителе. где R12 представляет собой алкильную группу, а другие символы имеют значение, определенное выше, в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего группу формулы- 16011670 где символы имеют значение, определенное выше, в качестве заместителя в R5, с соответствующим алкилизоцианатом (R12NCO). Реакцию можно осуществить таким же способом, как указано в (8).(10) Соединение, содержащее необязательно замещенную моно- или диалкилкарбамоиламиноалкильную группу в качестве заместителя в R5, можно получить конденсацией соединения, содержащего аминоалкильную группу в качестве заместителя в R5, с необязательно замещенным моно- или диалкиламином, используя агент карбонилирования, в подходящем растворителе, в присутствии или в отсутствие основания. Можно использовать традиционный агент карбонилирования, такой как карбонилдиимидазол, фосген, трифосген и т.п.(11) Соединение, содержащее морфолинилкарбониламиногруппу в качестве заместителя в R5, можно получить конденсацией соединения, содержащего аминогруппу в качестве заместителя в R5, с морфолином, используя агент карбонилирования, в подходящем растворителе. Реакцию можно осуществить таким же способом, как указано в (10). где X12 представляет собой О или NH в качестве заместителя в R5, можно получить обработкой соединения, содержащего группу формулыH-X12-CH2-CONH-,где символы имеют такое же значение, как определено выше, в качестве заместителя в R5, агентом карбонилирования в подходящем растворителе. Реакцию можно осуществлять таким же способом, как указано в (10).(13) Соединение, содержащее необязательно замещенную карбамоильную группу в качестве заместителя в R5, можно получить конденсацией соединения, содержащего карбоксильную группу в качестве заместителя в R5, с желаемым амином. Конденсацию можно осуществить, используя агент конденсации в подходящем растворителе. Традиционно используемый агент конденсации, такой как дициклогексилкарбодиимид, 1-этил-3-(3 диметиламинопропил)карбодиимид, карбонилдиимидазол и т.п., может быть предпочтительным для использования. Кроме того, более предпочтительно, когда конденсацию осуществляют при добавлении активирующего агента, включающего 1-гидроксибензотриазол, 1-гидроксисукцинимид и т.п. где символы имеют такое же значение, как определено выше, в качестве заместителя в R5, можно получить конденсацией соединения, содержащего карбоксильную группу в качестве заместителя в R5, с соединением формулы где символы имеют такое же значение, как определено выше. Реакцию можно осуществить таким же способом, как указано в (13).(15) Соединение, содержащее тетразолильную группу в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего цианогруппу в качестве заместителя в R5, с азидом щелочного металла в присутствии кислоты в подходящем растворителе. Азид щелочного металла включает азид натрия, азид лития и т.п. В качестве кислоты предпочтительной для использования может быть амониевая соль галогенированного водорода, включая хлорид аммония.(16) Соединение, содержащее необязательно замещенную алкилтетразолильную группу в качестве заместителя в R5, можно получить путем алкилирования соединения, содержащего тетразолильную группу в качестве заместителя в R5. Алкилирование можно осуществить таким же способом, как способ 4-(A).(17) Соединение, содержащее необязательно замещенную аминогруппу или группу формулы где символы имеют такое же значение, как определено выше, в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего атом галогена или необязательно замещенную алкилсульфонилоксигруппу в качестве заместителя в R5, с соответствующим амином или соединением формулы где символы имеют такое же значение, как определено выше. Предпочтительно реакцию можно осуществить в присутствии или в отсутствие основания, в подходящем растворителе.(18) Соединение, содержащее необязательно замещенную алкиламиногруппу или группу формулы где R13 представляет собой алкильную группу, необязательно замещенную гидроксигруппой, алкоксикарбонильной группой, морфолинильной группой или фенильной группой, и n имеет значение, определенное выше, в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего аминогруппу или группу формулы где символы имеют такое же значение, как определено выше, в качестве заместителя в R5, с соответствующим алкилгалогенидом или соответствующим алкиловым эфиром сульфоновой кислоты. Предпочтительными для использования могут быть алкиловый эфир сульфоновой кислоты, включающий эфир метансульфоновой кислоты, эфир толуолсульфоновой кислоты, эфир трифторметансульфоновой кислоты и т.п. Предпочтительно реакцию осуществляют в присутствии или в отсутствие основания, в подходящем растворителе. где X13 представляет собой О или NH, а другие символы имеют значение, определенное выше, в качестве заместителя в R5, можно получить путем циклизации соединения, содержащего группу формулы:Z3- (CH2)n-X13-CH2-CONH-,3 где Z представляет собой удаляемую группу, а другие символы имеют значение, определенное выше, в качестве заместителя в R5. Предпочтительно реакцию осуществляют в присутствии или в отсутствие основания, в подходящем растворителе.(20) Соединение, содержащее карбоксильную группу в качестве заместителя в R5, можно получить путем гидролиза соединения, содержащего алкоксикарбонильную группу в качестве заместителя в R5. Гидролиз можно осуществить обработкой исходного соединения основанием или кислотой в подходящем растворителе в соответствии с традиционным способом. В качестве основания предпочтительным для использования может быть гидроксид щелочного металла.(21) Соединение, содержащее карбоксильную группу в качестве заместителя в R5, можно получить путем гидролиза соединения, содержащего цианогруппу в качестве заместителя в R5. Гидролиз можно осуществить обработкой исходного соединения кислотой в подходящем растворителе.(22) Соединение, содержащее карбамоильную группу в качестве заместителя в R5, можно получить путем гидролиза соединения, содержащего цианогруппу в качестве заместителя в R5. Гидролиз можно осуществить обработкой исходного соединения кислотой в подходящем растворителе.(23) Соединение, содержащее карбоксиалкильную группу в качестве заместителя в R5, также можно получить путем каталитического восстановления соединения, содержащего карбоксиалкенильную группу, бензилоксикарбонилалкенильную группу или бензилоксикарбонилалкильную группу в качестве заместителя в R5. Каталитическое восстановление можно осуществить таким же способом, как указано в (6).(24) Соединение, содержащее гидроксигруппу в качестве заместителя в R5, можно получить путем гидролиза соединения, где R5 содержит алканоилоксигруппу. Гидролиз можно осуществить таким же способом, как указано в (20).(25) Соединение, содержащее сульфин (SO) или сульфоксид (SO2) в заместителе в R5, можно получить путем окисления соединения, содержащего S в заместителе в R5 (например, соединения, содержащего тиоморфолинильную группу или алкилтиоалкильную группу в качестве заместителя в R5). Окисление можно осуществить обработкой исходного соединения окислителем в подходящем растворителе. Пероксиды, такие как перекись водорода, м-хлорпербензойная кислота, ацетилгидропероксид и т.п.,могут быть предпочтительными для использования в качестве окислителя.(26) Соединение, содержащее N-оксид в заместителе в R5, можно получить путем окисления соединения, содержащего N в заместителе в R5 (например, соединения, содержащего пиридильную группу в качестве заместителя в R5). Окисление можно осуществить таким же способом, как указано в (25).(27) Соединение, содержащее 1,2-дигидроксиалкильную группу в качестве заместителя в R5, можно получить обработкой соединения, содержащего алкильную группу, замещенную моно- или диалкилдиоксоланильной группой, в качестве заместителя в R5, кислотой в подходящем растворителе. Предпочтительно в качестве кислоты можно также использовать сильнокислотную смолу, помимо тех, которые описаны выше.(28) Соединение, содержащее алкильную группу, замещенную гидроксигруппой, и необязательно замещенную алкоксигруппу в качестве заместителей в R5, можно получить путем взаимодействия соединения, содержащего оксиранилалкильную группу в качестве заместителя в R5, с солью щелочного металла и соответствующего спирта в подходящем растворителе. Соль щелочного металла и спирта включает литиевую соль, натриевую соль, калиевую соль и т.п.(29) Соединение, содержащее алкильную группу, замещенную гидроксигруппой и аминогруппой,или алкильную группу, замещенную гидроксигруппой и необязательно замещенной моно- или диалкиламиногруппой, в качестве заместителей в R5, можно получить путем взаимодействия соединения, содержащего оксиранилалкильную группу в качестве заместителя в R5, с аммиаком или соответствующими моно- или диалкиламинами в подходящем растворителе.(30) Соединение, содержащее гидроксикарбамимидоильную группу в качестве заместителя в R5,можно получить путем взаимодействия соединения, содержащего цианогруппу в качестве заместителя вR5, с гидроксиламином или его солью в подходящем растворителе. Такой способ можно осуществить таким же путем, как описано выше в способе 2-(b).(31) Соединение, содержащее оксодигидрооксадиазолильную группу в качестве заместителя в R5,можно получить путем взаимодействия соединения, содержащего гидроксикарбамимидоильную группу в качестве заместителя в R5, с агентом карбонилирования в подходящем растворителе, в присутствии или в отсутствие основания. Можно использовать такой же агент карбонилирования, как описанные в (10).(32) Соединение, содержащее сульфогруппу в качестве заместителя в R5, можно получить путем гидролиза соединения, содержащего алкоксикарбонилалкилсульфонильную группу в качестве заместителя в R5. Гидролиз можно осуществить таким же способом, как указано в (20).(33) Соединение, содержащее сульфамоильную группу в качестве заместителя в R5, можно получить конденсацией соединения, содержащего сульфогруппу в качестве заместителя в R5, с желаемым амином. Конденсацию можно осуществить обработкой соединения, содержащего сульфогруппу в качестве заместителя в R5, агентом галогенирования в подходящем растворителе, с последующим взаимодействием полученного соединения с желаемым амином, в присутствии или в отсутствие основания. Можно использовать традиционный агент галогенирования, включающий тионилгалид, оксигалид фосфора или т.п.(34) Соединение, содержащее гидроксиалкильную группу в качестве заместителя в R5, можно получить путем восстановления соединения, содержащего карбоксиалкильную группу в качестве заместителя в R5, или путем преобразования карбоксильной группы в ангидрид кислоты или сложный эфир и восстановления полученного соединения. Способ преобразования в ангидрид кислоты можно осуществить путем взаимодействия исходного соединения с галогенированным алкилформиатом в подходящем растворителе, в присутствии основания. Способ преобразования в сложный эфир можно осуществить путем взаимодействия исходного со- 19011670 единения со спиртом в присутствии агента конденсации, в подходящем растворителе. Этот способ можно осуществить таким же способом, как указано в (33), за исключением того, что вместо амина используют желаемый спирт. Восстановление можно осуществить обработкой полученного соединения восстановителем в подходящем растворителе. В качестве восстановителя предпочтительными для использования могут быть борогидриды (борогидрид натрия и т.п.), гидриды алюминия (литийалюминийгидрид, диизобутилалюминийгидрид и т.п.).(35) Соединение, где R10 представляет собой ароматическую группу, замещенную цианогруппой,которая необязательно содержит от одного до трех гетероатомов, независимо выбранных из атома кислорода, атома серы и атома азота (далее указана как "ароматическая группа"), можно получить путем цианирования соединения, где R10 представляет собой ароматическую группу, замещенную атомом галогена. Цианирование можно осуществить таким же способом, как способ 4-(E).(36) Соединение, где R1 представляет собой атом водорода, можно получить путем кислотной обработки или восстановления соединения, где R1 представляет собой трет-бутоксикарбонильную группу или бензилоксикарбонильную группу. Кислотную обработку можно осуществить таким же способом, как указано в (27), и восстановление можно осуществить таким же способом, как указано в (23).(37) Соединение, где R1 представляет собой необязательно замещенную алкоксикарбонильную группу, или необязательно замещенную карбамоильную группу, можно получить путем взаимодействия соединения, где R1 представляет собой атом водорода, с агентом карбонилирования, или желаемым спиртом, или желаемым амином, в подходящем растворителе. Реакцию можно осуществлять таким же способом, как указано в (10).(38) Соединение, содержащее аминогруппу в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего карбоксильную группу в качестве заместителя в R5, в условиях перегруппировки Куртиуса (Curtius). Реакцию перегруппировки Куртиуса можно осуществить, используя традиционный агент азидирования (например, дифенилфосфорилазид), в подходящем растворителе, в присутствии основания. Реакцию также можно осуществить путем добавления спирта с получением соединения, содержащего необязательно замещенную алкоксикарбониламиногруппу в качестве заместителя в R5, с последующим удалением алкоксикарбонильной группы. Удаление алкоксикарбонильной группы можно осуществить традиционным способом, таким как кислотная обработка или восстановление, в зависимости от типа алкоксикарбонильной группы, которую нужно удалить. Кислотную обработку можно осуществить таким же способом, как указано в (27), и восстановление можно осуществить таким же способом, как указано в (23).(39) Соединение, содержащее гидроксигруппу в качестве заместителя в R5, можно получить путем каталитического восстановления соединения, содержащего бензилоксигруппу в качестве заместителя вR5. Восстановление можно осуществить таким же способом, как указано в (23).(40) Соединение, содержащее оксогруппу в качестве заместителя в R5, можно получить путем окисления соединения, содержащего гидроксигруппу в качестве заместителя в R5. Окисление можно осуществить путем использования окислителя в подходящем растворителе. В качестве окислителя можно использовать традиционно используемый окислитель, такой как комплекс хромат-пиридин, хлорхромат пиридиния, дихромат пиридиния, реагент Dess-Martin (1,1,1 трис(ацетокси)-1,1-дигидро-1,2-бензиодоксол-3-(1H)-он), диметилсульфоксид и т.п.(41) Соединение, содержащее необязательно замещенную алкоксигруппу в качестве заместителя вR5, можно получить путем алкилирования соединения, содержащего гидроксигруппу в качестве заместителя в R5. Алкилирование можно осуществить, используя соответствующее соединение, таким же способом,как способ 4-(А).(42) Соединение, содержащее необязательно замещенную алканоиламиногруппу в качестве заместителя в R5, можно получить конденсацией соединения, содержащего аминогруппу в качестве заместителя в R5, с соответствующей карбоновой кислотой или реакционноспособным производным. Конденсацию с соответствующей карбоновой кислотой предпочтительно осуществляют в подходящем растворителе в присутствии агента конденсации. Реакцию можно осуществлять таким же способом, как указано в (13). Кроме того, конденсацию с реакционноспособным производным соответствующей карбоновой кислоты можно осуществить в подходящем растворителе или без растворителя, в присутствии или в отсутствие основания. Реакционноспособное производное включает галогенид кислоты, ангидрид кислоты, активированный сложный эфир, активированный амид и т.п. где R14 представляет собой алканоильную группу, необязательно замещенную гидроксигруппой или алкоксигруппой, и n имеет значение, определенное выше, в качестве заместителя в R5, можно получить конденсацией соединения, содержащего группу формулы где символы имеют такое же значение, как определено выше, в качестве заместителя в R5, с соответствующей карбоновой кислотой или ее реакционноспособным производным. Реакцию можно осуществлять таким же способом, как указано в (42).(44) Соединение, содержащее малеимидную группу в качестве заместителя в R5, можно получить путем взаимодействия соединения, содержащего аминогруппу в качестве заместителя в R5, с малеиновым ангидридом. Реакцию можно осуществлять в подходящем растворителе.(45) Соединение, содержащее алкильную группу, замещенную пиридильной группой и гидроксигруппой в качестве заместителей в R5, можно получить путем взаимодействия соединения, содержащего в качестве заместителя в R5 алкильную группу, замещенную пиридильной группой, в которой атом азота является окисленным, с трифторуксусным ангидридом. Реакцию можно осуществлять в подходящем растворителе.(46) Соединение, содержащее атом галогена в качестве заместителя в R5, можно получить обработкой соединения, содержащего гидроксигруппу в качестве заместителя в R5, агентом галогенирования. В качестве агента галогенирования предпочтительным для использования может быть традиционно используемый агент галогенирования, включающий тионилхлорид, оксихлорид фосфора, а также тетрагалогенид углерода (например, тетрахлорид углерода, тетрабромид углерода и т.п.), и фосфины (например, трифенилфосфин, тритолилфосфин, триэтилфосфин и т.п.).(47) Соединение, содержащее цианоалкильную группу в качестве заместителя в R5, можно получить путем восстановления соединения, содержащего цианоалкенильную группу в качестве заместителя в R5. Восстановление можно осуществить обработкой исходного соединения восстановителем или путем каталитического восстановления в подходящем растворителе. Можно использовать любой восстановитель, при условии, что он восстанавливает только двойную связь, не влияя при этом на цианогруппу. Например, предпочтительным для использования может быть натрий бис(2-метоксиэтокси)алюминийгидрид в присутствии бромида меди. Каталитическое восстановление можно осуществить таким же способом, как указано в (23).(48) Соединение, содержащее гидроксиалкильную группу в качестве заместителя в R5, можно получить путем восстановления соединения, содержащего формильную группу в качестве заместителя в R5. Восстановление можно осуществить обработкой исходного соединения восстановителем в подходящем растворителе. Реакцию можно осуществлять таким же способом, как способ восстановления, описанный в (34).(49) Соединение, где R7 представляет собой гидроксигруппу, можно получить путем деметилирования соединения, где R7 представляет собой метоксигруппу. Деметилирование можно осуществить обработкой исходного соединения агентом деметилирования в подходящем растворителе. В качестве агента деметилирования можно использовать традиционно используемый агент, включающий триметилсилилиодид, бромистый водород/уксусная кислота, трибромид бора, концентрированная серная кислота и т.п.(50) Соединение, где R7 представляет собой необязательно замещенную алкоксигруппу, можно получить путем алкилирования соединения, где R7 представляет собой гидроксигруппу. Алкилирование можно осуществить таким же способом, как способ 4-(А).(51) Соединение, где R7 представляет собой необязательно замещенную алкилсульфонилоксигруппу, можно получить путем алкилсульфонилирования соединения, где R7 представляет собой гидроксигруппу. Алкилсульфонилирование можно осуществить путем взаимодействия соответствующего алкилсульфонилгалогенида или соответствующего алкилсульфонового ангидрида в подходящем растворителе,в присутствии или в отсутствие основания.(52) Соединение, где R7 представляет собой цианогруппу, можно получить путем цианирования соединения, где R7 представляет собой необязательно замещенную алкилсульфонилоксигруппу. Цианирование можно осуществить таким же способом, как способ 4-(E).(53) Соединение, где R7 представляет собой аминоалкильную группу, можно получить путем восстановления соединения, где R7 представляет собой цианогруппу.- 21011670 Восстановление можно осуществить таким же способом, как указано в (6).(54) Соединение, где R7 представляет собой алкильную группу, можно получить путем алкилирования соединения, где R7 представляет собой необязательно замещенную алкилсульфонилоксигруппу. Алкилирование можно осуществить путем взаимодействия соединений алкилалюминия в присутствии палладиевого катализатора, катализатора на основе серебра и катализатора на основе меди, в подходящем растворителе. Предпочтительными для использования могут быть тетракис(трифенилфосфин)палладий в качестве палладиевого катализатора, карбонат серебра в качестве катализатора на основе серебра, хлорид меди (I) в качестве катализатора на основе меди.(55) Соединение, содержащее имидазолинильную группу или оксазолинильную группу в качестве заместителя в R5, можно получить путем (i) взаимодействия соединения, содержащего цианогруппу в качестве заместителя в R5, с желаемым спиртом, в присутствии кислоты в подходящем растворителе или без растворителя, с получением соединения, содержащего алкоксикарбонимидоильную группу в качестве заместителя в R5, и (ii) взаимодействия соединения, содержащего алкоксикарбонимидоильную группу в качестве заместителя в R5, с 2-аминоэтанолом или этилендиамином в подходящем растворителе или без растворителя.(56) Соединение, содержащее карбоксильную группу в качестве заместителя в R1, можно получить путем (i) окисления соединения, содержащего гидроксиалкильную группу в качестве заместителя в R1,таким же способом, как указано в (40), с получением соединения, содержащего оксогруппу в качестве заместителя в R1, и (ii) окисления соединения, содержащего оксогруппу в качестве заместителя в R1. Окисление на второй стадии можно осуществить с использованием окислителя в подходящем растворителе. В качестве окислителя предпочтительным для использования может быть хлорит натрия, оксид серебра(I), периодат натрия и т.п.(57) Соединение, содержащее карбоксильную группу в качестве заместителя в R1, можно непосредственно получить путем окисления соединения, содержащего гидроксиалкильную группу в качестве заместителя в R1. Окисление можно осуществить с использованием в качестве окислителя реагента Джонса (Jones),перманганата калия и т.п.(58) Соединение, где R1 представляет собой атом водорода, можно получить обработкой соединения, где R1 представляет собой этоксикарбонильную группу, силилгалогенидами или основанием. В качестве силилгалогенида предпочтительным для использования может быть триметилсилилиодид. В качестве основания предпочтительным для использования может быть гидроксид натрия. В каждом способе получения соединения формулы (I), которые описаны выше, когда необходима защита функциональной группы, содержащейся в любом соединении, такую защиту можно осуществить традиционным способом ad libitum. Общие указания, касающиеся защитных групп и их использования,приведены в Greene, Protective Groups in Organic Synthesis, John Wiley and Sons, New York, 1991. Когда аминогруппа защищена бензилоксикарбонильной группой, такую защитную группу можно удалить путем каталитического восстановления в атмосфере водорода в подходящем растворителе. Когда гидроксигруппа защищена бензильной группой, такую защитную группу также можно удалить путем каталитического восстановления таким же способом, как указано выше. Когда аминогруппа защищена трет-бутоксикарбонильной группой, такую защитную группу можно удалить обработкой исходного соединения кислотой (например, хлористоводородной кислотой, трифторуксусной кислотой, толуолсульфоновой кислотой, и т.п.) в подходящем растворителе. Когда гидроксигруппа защищена тетрагидропиранильной группой, такую защитную группу также можно удалить обработкой исходного соединения кислотой таким же способом, как указано выше. Реакции (1) - (58) для преобразования R1, R5, R7 или R10 также можно использовать для преобразования таким же способом другого заместителя в соединении (I) по настоящему изобретению, если это является подходящим. Исходное соединение (II) является новым соединением, и его можно получить конденсацией соединения формулы (X) где символы имеют такое же значение, как определено выше, с соединением формулы (XI)R5-Z4 (XI) 4 где Z представляет собой удаляемую группу и R5 имеет такое же значение, как определено выше. В качестве удаляемой группы, предпочтительно, используют атом галогена, включающий атом хлора, атом брома, атом иода, и замещенную сульфонилоксигруппу, включающую метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, трифторметансульфонилоксигруппу.- 22011670 Реакцию можно осуществлять в подходящем растворителе (например, 1,4-диоксан, диметилформамид, 1,3-диметилимидазолидинон и т.п.), в присутствии или в отсутствие основания (например, диизопропилэтиламин и т.п.), в условиях от комнатной температуры до нагревания. Реакцию можно также осуществить путем добавления палладиевого катализатора (например,трис(дибензилиденацетон)дипалладий) и фосфина [например, трифенилфосфин, трибутилфосфин или 2(ди-трет-бутилфосфино)бифенил] при комнатной температуре, в присутствии основания (например,трет-бутоксид натрия), если это желательно. Соединение формулы (X) можно получить в соответствии со способом, описанным в WO 00/17165 или US 6313142. Альтернативно, соединение (X) можно получить в соответствии со следующей схемой: где R15 представляет собой защитную группу для аминогруппы, а другие символы имеют такое же значение, как определено выше. В качестве защитной группы для аминогруппы можно использовать традиционную защитную группу, включая бензилоксикарбонильную группу. Кроме того, оптически активное соединение (X) можно получить путем защиты аминогруппы оптически активной защитной группой для аминогруппы(например, оптически активной -замещенной бензилоксикарбонильной группой, содержащей хиральный центр в положении бензила, такой как -метилбензилоксикарбонильная группа), разделения диастереомеров в способе получения соединения (XII) или соединения (XIII) и удаления такой защитной группы. Соединение формулы (XV) можно получить путем взаимодействия бензотриазола, соединения формулы (XVI) и соединения формулы (XVII) в подходящем растворителе (например, толуоле) при комнатной температуре. Соединение формулы (XIII) можно получить путем взаимодействия соединения формулы (XIV) с соединением формулы (XV) в присутствии кислотного катализатора (например, органическая кислота,включающая п-толуолсульфоновую кислоту, уксусную кислоту, метансульфоновую кислоту или кислоту Льюиса, включающую комплекс трифторид бора-диэтиловый эфир, тетрахлорид титана, хлорид алюминия), в подходящем растворителе (например, толуол, тетрагидрофуран, метиленхлорид и т.п.), в условиях нагревания или при комнатной температуре (например, от 0 до 150C, предпочтительно от 25 до 120C). Соединение формулы (XII) можно получить путем алканоилирования, алкоксикарбонилирования,алкилирования и т.п. соединения формулы (XIII), как это является подходящим. Соединение формулы (X) можно получить путем удаления защитной группы для аминогруппы в соединении формулы (XII). Удаление такой защитной группы можно осуществить традиционным способом, включающим кислотную обработку, обработку основанием, восстановление и т.п. в зависимости от типа защитной группы. Когда используют бензилоксикарбонильную группу или -замещенную бензилоксикарбонильную группу, такие группы можно удалить путем каталитического восстановления в подходящем растворителе (например, этаноле, метаноле, тетрагидрофуране, уксусной кислоте и т.п.) в атмосфере водорода. Удаление защитной группы для аминогруппы в соединении формулы (XIII) можно осуществить таким же способом, как удаление защитной группы для аминогруппы в соединении формулы(XII). Когда в качестве защитной группы для аминогруппы используют оптически активную защитную группу, такую как -замещенная бензилоксикарбонильная группа, разделение диастереомера можно осуществить традиционным способом, таким как перекристаллизация или колоночная хроматография. Соединение формулы (XIII) также можно получить путем взаимодействия соединения формулы Эту реакцию можно осуществить таким же способом, как реакцию соединения формулы (XIV) с соединением формулы (XV). Кроме того, соответствующие заместители R1, R5, R6, R7, R8 и R9 могут быть преобразованы в желаемый заместитель в соответствии с одним из способов, включающих способ 4-(А)- (K) и (1)-(58). Соединение формулы (IV) можно получить конденсацией соединения формулы (X) с соединением формулы (III)R10-R4-Z1 (III) где символы имеют такое же значение, как определено выше. Конденсацию можно осуществить таким же способом, как описанно в WO 00/17165 или в способе 1 выше. Соединение формулы (IX) можно получить конденсацией соединения формулы (IV) с соединением формулы где Z5 представляет собой удаляемую группу, а другие символы имеют такое же значение, как определено выше. В качестве удаляемой группы предпочтительными для использования могут быть атомы галогена,включающие атом хлора, атом брома, атом иода; замещенная сульфонилоксигруппа, включающая метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, трифторметансульфонилоксигруппу. Конденсацию можно осуществить таким же способом, как указано для соединения (X) с соединением (XI). Кроме того, соединение формулы (IX), где кольцо А представляет собой тетразолильную группу иX10 представляет собой атом водорода, можно получить путем взаимодействия соединения формулы (V) с алкилазидом металла. Реакцию можно осуществлять таким же способом, как описано выше в (15). Кроме того, соединение формулы (IX), где X10 представляет собой гидроксильную группу, можно получить путем (i) взаимодействия соединения, где X10 представляет собой атом галогена, с соединением дибора или борана с получением соединения, где X10 представляет собой эфиры бороновой кислоты, и(ii) взаимодействия соединения, где X10 представляет собой эфиры бороновой кислоты, с пероксидами. Предпочтительными для использования в качестве пероксидов могут быть раствор перекиси водорода, м-хлорпербензойная кислота или OXONE (изготовитель DuPont). Многие из исходных веществ и реагентов для получения указанного выше соединения формулы I либо являются коммерчески доступными или описанными в литературе, либо их можно легко получить способом, описанным в литературе или широко используемым в органическом синтезе. Как используется в настоящем описании, "3,4-дигидро-2 Н-хинолин" представляет такую же структуру, что и "1,2,3,4-тетрагидрохинолин". Эксперимент В данном эксперименте испытывали ингибиторную активность соединений по настоящему изобретению против CETP. Получение микроэмульсии акцептора. Смешивали раствор 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина (3,5 мг), холестерилолеата(3 мг) и триолеина (0,7 мг) в хлороформе и липидные частицы сушили на воздухе в атмосфере газообразного азота для удаления растворителя. Затем добавляли 1,4-диоксан (0,25 мл) и смесь перемешивали для растворения. Полученный раствор липидов (0,2 мл) медленно вводили под поверхность буферного раствора трис-физиологический солевой раствор-ЭДТУ(TSE) [10 мМ трис/HCl (рН 7,4), 0,15 М NaCl,2 мМ ЭДТУ] (10 мл) при помощи шприца Гамильтона (Hamilton), используя при этом обработку ультразвуком на ледяной бане. После обработки ультразвуком на ледяной бане в течение 1 ч раствор хранили при 4C. Получение микроэмульсии донора. Смешивали раствор egg PC (фосфатидилхолин) (0,33 мг) и BODIPY-CE (0,62 мг) в хлороформе. После удаления растворителя путем сушки на воздухе липидных частиц в атмосфере газообразного азота добавляли буферный раствор TSE (3 мл) и раствор подвергали обработке ультразвуком на ледяной бане. Этот раствор фильтровали для стерилизации через фильтр 0,22 мкм и хранили при 4C. Ингибиторная активность против CETP in vitro. Испытываемый раствор получали, используя диметилсульфоксид в качестве растворителя. Плазму,взятую у здорового добровольца, разбавляли до 0,64% при помощи буфера TSE и к полученному раствору плазмы (187 мкл) добавляли испытываемый раствор (3 мкл) или только растворитель с последующей- 24011670 инкубацией при 37C в течение 24 ч. После добавления буферного раствора TSE (10 мкл), содержащего 5% микроэмульсии донора и 5% микроэмульсии акцептора, смесь инкубировали при 37C в течение 3 ч. До и после инкубации измеряли интенсивность флуоресценции при длине волны возбуждения 550 нм/длине волны испускания 600 нм. Активность CETP определяли как разницу между значениями, полученными при измерении до инкубации и после инкубации. Уменьшение разницы в образце определяли как показатель ингибирования активности CETP. ИК 50 для каждого образца рассчитывали из показателя ингибирования активности CETP. Результаты. Примеры Более подробно настоящее изобретение иллюстрируется при помощи примеров и ссылочных примеров, но настоящее изобретение нельзя рассматривать как ограничивающееся ими. В примерах соединения, имеющие структуру формулы(1) Этиловый эфир (2R,4S)-4-амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (3 г) и 5-бром-2-хлорпиримидин (3,7 г) растворяют в N,N-диметилформамиде (30 мл) и смесь перемешивают при 150C в течение 5 ч. Реакционный раствор охлаждают до комнатной температуры и затем добавляют насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 8:14:1) с получением этилового эфира (2R,4S)-4-(5-бромпиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (2,2 г). MS (m/z): 473/475 [М+Н]+.(2) Этиловый эфир (2R,4S)-4-(5-бромпиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро 2 Н-хинолин-1-карбоновой кислоты (2,2 г) растворяют в N,N-диметилформамиде (20 мл) и к полученной смеси добавляют гидрид натрия (62,7%, 223 мг) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 мин. К смеси добавляют при охлаждении льдом 3,5 бис(трифторметил)бензилбромид (1,3 мл) и смесь перемешивают при комнатной температуре в течение одного часа. К смеси добавляют насыщенный солевой раствор и этилацетат и органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 10:1) с получением этилового эфира (2R,4S)-4[3,5-бис(трифторметил)бензил]-(5-бромпиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро 2 Н-хинолин-1-карбоновой кислоты (2,75 г). MS (m/z): 699/701 [М+Н]+.(18 мкл) растворяют в толуоле (1 мл) и смесь перемешивают при комнатной температуре в атмосфере азота в течение 60 ч. К реакционному раствору добавляют уксусную кислоту и затем добавляют воду и этилацетат. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 19:13:2) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(морфолин-4 ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (40 мг) . MS (m/z): 706 [М+Н]+. Примеры 2-6. Соответствующие исходные соединения обрабатывают таким же способом, как в примере 1-(3), с получением соединений, перечисленных в табл. 1. Пример 7. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(тиоморфолин-4-ил)пиримидин-2 ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (75 мг) растворяют в хлороформе (3 мл) и к полученной смеси добавляют м-хлорпербензойную кислоту (25 мг) и смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют воду и хлороформ и органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; хлороформ:ацетон = 10:1) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(1-оксотиоморфолин-4-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (34 мг). MS (m/z): 738 [М+Н]+. Пример 8. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-бромпиримидин-2-ил)амино-2-этил 6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (250 мг) и дихлорбис(три-отолилфосфин)палладий (5,9 мг) растворяют в толуоле (2 мл) и смесь нагревают при 100C в атмосфере азота. К реакционному раствору добавляют (диметиламино)триметилолово (118 мг) и смесь перемешивают в течение 2 ч. Смеси дают охладиться до комнатной температуры и реакционный раствор концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (NHсиликагель; гексан:этилацетат = 5:1) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-диметиламинопиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (18 мг). MS (m/z): 664 [М+Н]+. Пример 9.(1) Этиловый эфир (2R,4S)-4-амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (600 мг) и 2-хлор-5-пропилпиримидин (1,5 г) растворяют в 1,3-диметилимидазолидиноне (10 мл) и смесь перемешивают при 135C в течение 72 ч. Реакционный раствор охлаждают до комнатной температуры и затем добавляют воду и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 6:14:1) с получением этилового эфира (2R,4S)-2-этил-4-(5-пропилпиримидин-2-ил)амино-6-трифторметил-3,4-дигидро-2 Нхинолин-1-карбоновой кислоты (250 мг). MS (m/z): 437 [М+Н]+.(2) Этиловый эфир (2R,4S)-2-этил-4-(5-пропилпиримидин-2-ил)амино-6-трифторметил-3,4-дигидро- 26011670 2 Н-хинолин-1-карбоновой кислоты (240 мг) и 3,5-бис(трифторметил)бензилбромид (337 мг) растворяют в N,N-диметилформамиде (3 мл) и к полученной смеси добавляют гидрид натрия (62,7%, 32 мг) при комнатной температуре и смесь перемешивают при этой температуре в течение 2 ч. К реакционному раствору добавляют уксусную кислоту и затем добавляют воду и этилацетат. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 49:17:3) с получением этилового эфира (2R,4S)4-[3,5-бис(трифторметил)бензил]-(5-пропилпиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (130 мг). MS (m/z): 663 [М+Н]+. Пример 10. К этиловому эфиру (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-бромпиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (1 г) добавляют N,N-диметилформамид (10 мл), татракис(трифенилфосфин)палладий (каталитическое количество) и цианид цинка(176 мг) и смесь перемешивают при 110C в атмосфере азота в течение 4 ч. Реакционный раствор охлаждают до комнатной температуры и затем добавляют насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 10:14:1) с получением этилового эфира (2R,4S)-4-[3,5 бис(трифторметил)бензил]-(5-цианопиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Нхинолин-1-карбоновой кислоты (760 мг). MS (m/z): 646 [М+Н]+. Пример 11. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-цианопиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (200 мг) растворяют в этаноле (3 мл) и к полученной смеси добавляют каталитическое количество никеля Ренея и смесь перемешивают при комнатной температуре в течение ночи в атмосфере водорода. Катализатор удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией(силикагель; гексан:этилацетат = 1:1) с получением этилового эфира (2R,4S)-4-(5-аминометилпиримидин-2-ил)-[3,5-бис(трифторметил)бензил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1 карбоновой кислоты (142 мг). MS (m/z): 650 [М+Н]+. Пример 12. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-аминометилпиримидин-2-ил)амино 2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (92 мг) и избыточное количество триэтиламина растворяют в метиленхлориде (2 мл) и к полученной смеси добавляют избыточное количество N,N-диметилсульфамоилхлорида при охлаждении льдом. Смесь перемешивают при комнатной температуре в течение 2 ч и к реакционному раствору добавляют насыщенный солевой раствор и этилацетат. Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 4:167:33) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(N,N-диметилсульфамоил) аминометилпиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (54 мг). MS (m/z): 757 [М+Н]+. Пример 13. Уксусную кислоту (88 мкл) растворяют в толуоле (3 мл) и добавляют к триэтиламин (236 мкл) и дифенилфосфорилазиду (466 мкл). Смесь перемешивают при 70C в течение 1,5 ч. К реакционному раствору добавляют этиловый эфир (2R,4S)-4-(5-аминометилпиримидин-2-ил)-[3,5-бис(трифторметил) бензил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (100 мг) и смесь перемешивают при этой температуре в течение 4 ч. Смеси дают охладиться до комнатной температуры и к реакционному раствору добавляют насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией(NH-силикагель; гексан:этилацетат = 1:2) с получением этилового эфира (2R,4S)-4-([3,5-бис(трифторметил)бензил]-5-[(3-метилуреидо)метил]пиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро 2 Н-хинолин-1-карбоновой кислоты (63 мг). MS (m/z): 707 [М+Н]+. Пример 14. 4-(2-Аминоэтил)морфолин (100 мг) растворяют в тетрагидрофуране (3 мл) и к полученной смеси добавляют N,N'-карбонилдиимидазол (125 мг) и смесь перемешивают при 70 С в течение одного часа. К реакционному раствору добавляют этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5 аминометилпиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (100 мг) и смесь перемешивают при этой температуре в течение 4 ч. Смеси дают охладиться до комнатной температуры и добавляют к ней насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией(NH-силикагель; этилацетат) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]- 27011670[5-[3-(2-морфолин-4-илэтил)уреидометил]пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро 2 Н-хинолин-1-карбоновой кислоты (118 мг). MS (m/z): 806 [М+Н]+. Пример 15. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-бромпиримидин-2-l)амино-2-этил-6 трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (300 мг), ацетат палладия (12 мг), 1,1'бис(дифенилфосфино)ферроцен (55 мг), бензиловый спирт (970 мг) и триэтиламин (625 мкл) растворяют в N,N-диметилформамиде (1 мл) и смесь перемешивают при комнатной температуре в атмосфере оксида углерода в течение 3 мин. Затем смесь нагревают при 90C и перемешивают в течение ночи. Реакционный раствор охлаждают до комнатной температуры и затем добавляют насыщенный водный раствор гидрокарбоната натрия и этилацетат. Органический слой промывают насыщенным солевым раствором,сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 24:13:1) с получением этилового эфира (2R,4S)-4-(5-бензилоксикарбонилпиримидин-2-ил)-[3,5-бис(трифторметил)бензил]амино-2-этил 6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (250 мг). MS (m/z): 755 [М+Н]+. Пример 16. Этиловый эфир (2R,4S)-4-(5-бензилоксикарбонилпиримидин-2-ил)-[3,5-бис(трифторметил)бензил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (220 мг) растворяют в смеси метанола (2 мл) и тетрагидрофурана (6 мл) и к полученной смеси добавляют 10% палладий на углероде (100 мг) и смесь перемешивают при комнатной температуре в атмосфере водорода в течение 30 мин. Катализатор (10% палладий на углероде) удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; этилацетат) с получением этилового эфира(2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5 карбоксипиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (178 мг). MS (m/z): 665 [М+Н]+. Пример 17. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-карбоксипиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (100 мг) и избыточное количество гидрата 1-гидроксибензотриазола растворяют в N,N-диметилформамиде (5 мл) и к полученной смеси добавляют избыточное количество гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида и смесь перемешивают при комнатной температуре в течение 10 мин. К реакционному раствору добавляют трет-бутиловый эфир глицина (гидрохлорид) (50 мг) и избыточное количество триэтиламина и смесь перемешивают при комнатной температуре в течение 10 мин. К реакционному раствору добавляют водный раствор лимонной кислоты и этилацетат и органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 9:11:1) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-трет-бутоксикарбонилметилкарбамоилпиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1 карбоновой кислоты. Затем к смеси добавляют при комнатной температуре 4 н. раствор хлористоводородной кислоты в 1,4-диоксане (2 мл) и смесь перемешивают в течение ночи. Реакционный раствор концентрируют при пониженном давлении и концентрированный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 1:1 хлороформ:метанол = 19:1) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-карбоксиметилкарбамоилпиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (13 мг). MS (m/z): 722 [М+Н]+. Пример 18.(1) Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-бромпиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (300 мг), бензиловый эфир акриловой кислоты (125 мг), трис(дибензилиденацетон)дипалладий (12 мг), диизопропилэтиламин (90 мкл),тетрафторборат три-трет-бутилфосфония (7,5 мг) растворяют в 1,4-диоксане (3,5 мл) и смесь перемешивают в атмосфере азота при комнатной температуре в течение 3 дней. К реакционному раствору добавляют водный раствор лимонной кислоты и этилацетат и органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 97:313:7) с получением этилового эфира (2R,4S)-4-[5-(2 бензилоксикарбонилвинил)пиримидин-2-ил]-[3,5-бис(трифторметил)бензил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (186 мг). MS (m/z): 781 [М+Н]+.(2) Этиловый эфир (2R,4S)-4-[5-(2-бензилоксикарбонилвинил)пиримидин-2-ил]-[3,5-бис(трифторметил)бензил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (180 мг) растворяют в смеси метанола (5 мл) и тетрагидрофурана (10 мл) и к полученной смеси добавляют 10% палладий на углероде (300 мг). Смесь перемешивают при комнатной температуре в атмосфере водорода в течение 3 ч. Катализатор удаляют фильтрованием и фильтрат концентрируют при пониженном давлении с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-карбоксиэтил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты(40 мг). MS (m/z): 693 [М+Н]+. Пример 19. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-цианопиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (880 мг), азид натрия (886 мг) и хлорид аммония (729 мг) растворяют в N,N-диметилформамиде (5 мл) и смесь перемешивают при 100C в течение 4 ч. Смеси дают охладиться до комнатной температуры и добавляют к ней воду и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении с получением этилового эфира (2R,4S)-4-[3,5 бис(трифторметил)бензил]-[5-(тетразол-5-ил)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (920 мг). MS (m/z): 689 [М+Н]+. Пример 20. Этиловый эфир(2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(тетразол-5-ил)пиримидин-2 ил]амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (150 мг), карбонат калия (60 мг) и избыточное количество метилиодида растворяют в N,N-диметилформамиде (2 мл) и смесь перемешивают при 50C в течение 4 ч. Смеси дают охладиться до комнатной температуры и добавляют к ней воду и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 9:14:1) с получением этилового эфира(2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(2-метил-2H-тетразол-5-ил)пиримидин-2-ил]амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (107 мг). MS (m/z): 703 [М+Н]+. Примеры 21-22. Соответствующие исходные соединения обрабатывают таким же способом, как в примере 20, с получением соединений, перечисленных в табл. 2. Пример 23. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-[5-(тетразол-5-ил)пиримидин-2-ил] амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (127 мг), 4-(2-гидроксиэтил)морфолин (35 мкл) и трифенилфосфин (76 мг) растворяют в тетрагидрофуране (3 мл) и к полученной смеси добавляют по каплям при охлаждении льдом 40% раствор диэтилового эфира азодикарбоновой кислоты в толуоле (113 мкл) и смесь перемешивают при комнатной температуре в течение 4 ч. К реакционному раствору добавляют воду и этилацетат и органический слой промывают насыщенным солевым раствором, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (NH-силикагель; гексан:этилацетат = 9:167:33) с получением этилового эфира (2R,4S)-4-([3,5-бис(трифторметил)бензил]-5-[2-(2-морфолин-4-илэтил)-2 Нтетразол-5-ил]пиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (136 мг). MS (m/z): 802 [М+Н]+. Пример 24.(4,0 мл) и затем добавляют иодид натрия (857 мг), иодид меди (27 мг) и транс-N,N'-диметилциклогексан 1,2-диамин (43 мг) и смесь перемешивают при 110C в атмосфере азота в течение ночи. Смеси дают охладиться до комнатной температуры и к полученной смеси добавляют разбавленный водный раствор аммиака и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток- 29011670 очищают колоночной хроматографией (силикагель; гексан:этилацетат = 97:370:30) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-иодпиримидин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (969 мг). MS (m/z): 747 [M+H]+.(2) К этиловому эфиру (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-иодпиримидин-2-ил)амино-2 этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (200 мг) добавляют 2 метоксиэтанол (1,0 мл), карбонат цезия (350 мг), иодид меди (23 мг) и 1,10-фенантролин (44 мг) и смесь перемешивают при 110C в течение 4 дней. Смеси дают охладиться до комнатной температуры и к полученной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 10:1, иNH-силикагель; гексан:этилацетат = 10:1) с получением этилового эфира (2R,4S)-4-[3,5 бис(трифторметил)бензил]-[5-(2-метоксиэтокси)пиримидин-2-ил]амино-2-этил-6-трифторметил-3,4 дигидро-2 Н-хинолин-1-карбоновой кислоты (90 мг, MS (m/z): 695 [М+Н]+) и 2-метоксиэтилового эфира(1) Этиловый эфир (2R,4S)-4-амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (1 г), 6-хлорникотинонитрил (1,76 г), диизопропилэтиламин (804 мкл) растворяют в N,Nдиметилформамиде (15 мл) и смесь перемешивают при 100C в течение ночи. Реакционный раствор охлаждают до комнатной температуры и затем добавляют водный раствор лимонной кислоты и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; хлороформ:гексан:этилацетат = 5:5:1) с получением этилового эфира (2R,4S)-4-(5 цианопиридин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (800 мг). MS (m/z): 419 [М+Н]+.N,N-диметилформамиде (9 мл) и к полученной смеси при комнатной температуре добавляют гидрид натрия (62,7%, 108 мг) и смесь затем перемешивают в течение 15 минут. К реакционному раствору добавляют уксусную кислоту и затем добавляют насыщенный солевой раствор и простой эфир. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан: этилацетат = 19:117:8) с получением этилового эфира (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5 цианопиридин-2-ил)амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (700 мг). MS (m/z): 645 [М+Н]+. Пример 26. Этиловый эфир (2R,4S)-4-[3,5-бис(трифторметил)бензил]-(5-цианопиридин-2-ил)амино-2-этил-6 трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (127 мг), азид натрия (300 мг) и хлорид аммония (300 мг) растворяют в N,N-диметилформамиде (5 мл) и смесь перемешивают при 95 С в течение ночи. Смеси дают охладиться до комнатной температуры и добавляют к ней воду и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении с получением этилового эфира (2R,4S)-4-[3,5 бис(трифторметил)бензил]-[5-(тетразол-5-ил)пиридин-2-ил]амино-2-этил-6-трифторметил-3,4-дигидро 2 Н-хинолин-1-карбоновой кислоты (128 мг). MS (m/z): 688 [М+Н]+. Пример 27.(1) Этиловый эфир (2R,4S)-4-амино-2-этил-6-трифторметил-3,4-дигидро-2 Н-хинолин-1-карбоновой кислоты (1,5 г) и 2-хлор-5-нитропиридин (3,795 г) растворяют в 1,3-диметилимидазолидиноне (25 мл) и смесь перемешивают при 140C в течение 74 ч. Реакционный раствор охлаждают до комнатной температуры и затем добавляют воду и этилацетат. Органический слой промывают насыщенным солевым раствором, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; хлороформгексан:этилацетат = 3:1) с получением этилового эфираN,N-диметилформамиде (10 мл) и к полученной смеси добавляют при комнатной температуре гидрид натрия (62,7%, 171 мг) и смесь перемешивают в течение 15 мин. К реакционному раствору добавляют уксусную кислоту и затем добавляют воду и этилацетат. Органический слой снова промывают водой и органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией (силикагель; гексан:этилацетат = 49:113:7) с полу- 30
МПК / Метки
МПК: A61K 31/47, C07D 401/14, C07D 401/04, A61K 31/4545, A61P 3/06, A61K 31/444, C07D 491/04, A61K 31/4439
Метки: тетрагидрохинолиновые, способ, производные, получения
Код ссылки
<a href="https://eas.patents.su/30-11670-tetragidrohinolinovye-proizvodnye-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Тетрагидрохинолиновые производные и способ их получения</a>
Предыдущий патент: Антитела против m-csf
Следующий патент: Замещенные производные арила и гетероарила в качестве модуляторов метаболизма и для профилактики и лечения связанных с ним расстройств
Случайный патент: Способ повышения адаптивности организма к физическим нагрузкам


































