Производные октагидро-6, 10-диоксо-6н-пиридазино [1,2-а] [1,2] диазепин-1-карбоновой кислоты, способ их получения и их применение для получения терапевтически активных соединений
Номер патента: 3280
Опубликовано: 24.04.2003
Авторы: Ларкин Джон Патрик, Крок Вероник, Колладан Колетт, Руссель Патрик
Формула / Реферат
1. Соединения общей формулы (I)
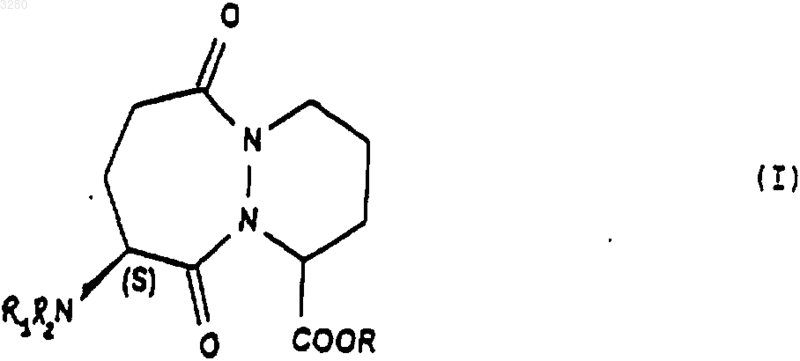
имеющие конфигурацию SR или находящиеся в виде смеси SR+SS, в формуле которых R представляет собой атом водорода, радикал алкил, содержащий от 1 до 4 атомов углерода, a R1 и R2 означают H или защитную группу аминофункции.
2. Соединения по п.1, в которых аминогруппа защищена в форме фталимида, формулы (IA1)
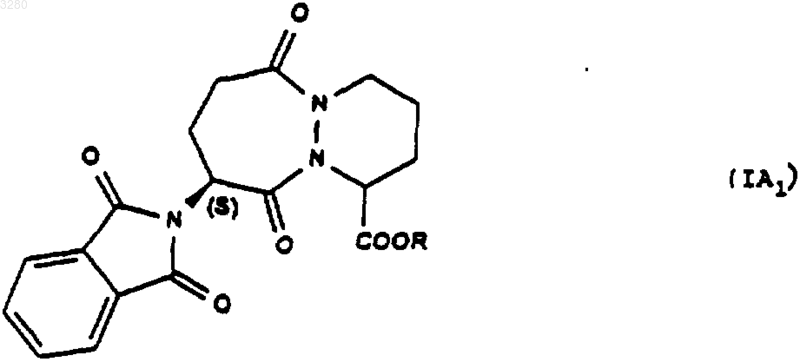
имеющие конфигурацию SR или находящиеся в виде смеси SR+SS.
3. Соединения формулы (I) согласно любому из пп.1-2, в которой R представляет собой метил.
4. Рацемическая смесь соединений формулы (I), описанной в п.1, состоящая из
метил-(1S-цис)-9-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-октагидро-6,10-диоксо-6H-пиридазино[1,2-a][1,2]диазепин-1-карбоксилата и
метил-(1R-транс)-9-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-октагидро-6,10-диоксо-6H-пиридазино[1,2-a][1,2]диазепин-1-карбоксилата.
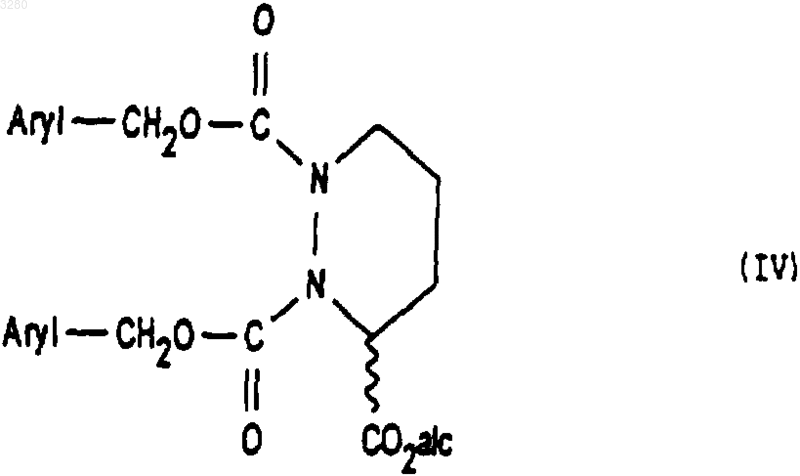
5. Способ получения соединений формулы (I), описанной в одном из предыдущих пунктов, отличающийся тем, что соединение формулы (II)

в которой alc представляет собой радикал алкил, содержащий 1-4 атомов углерода, a Hal представляет собой атом галогена, подвергают действию соединения формулы (III)

в которой Aryl представляет собой радикал фенил,
с получением соединения формулы (IV)
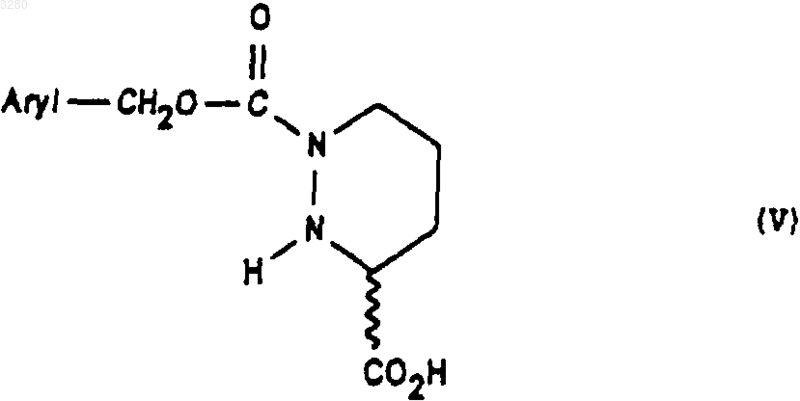
которое обрабатывают агентом основного характера для получения соединения формулы (V)
которое при необходимости подвергают действию алкилирующего агента с получением соединения формулы (VI)
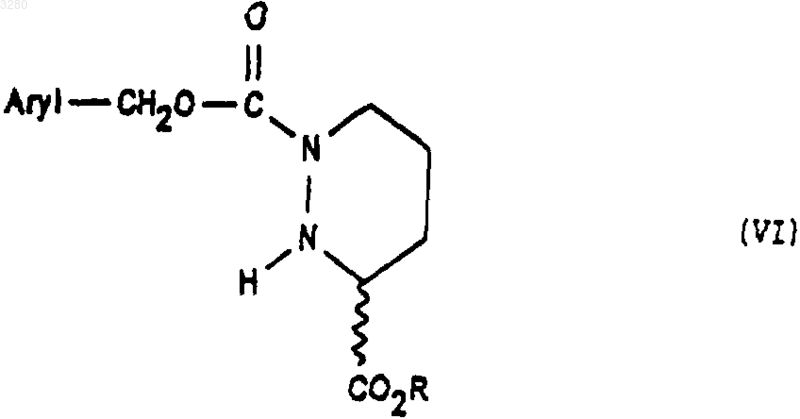
которое подвергают действию соединения формулы (VII)
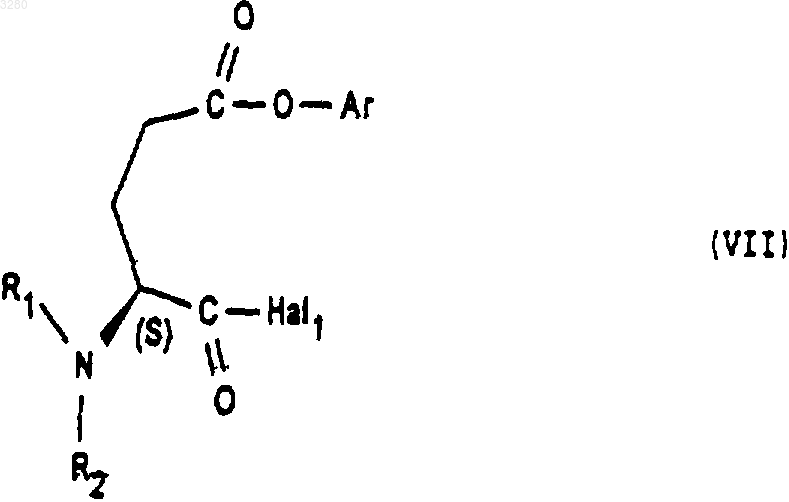
в которой Hal1 представляет собой атом галогена, Аr представляет собой радикал бензил, a R1 и R2 имеют значение, указанное в п.2,
для получения соединения формулы (VIII)
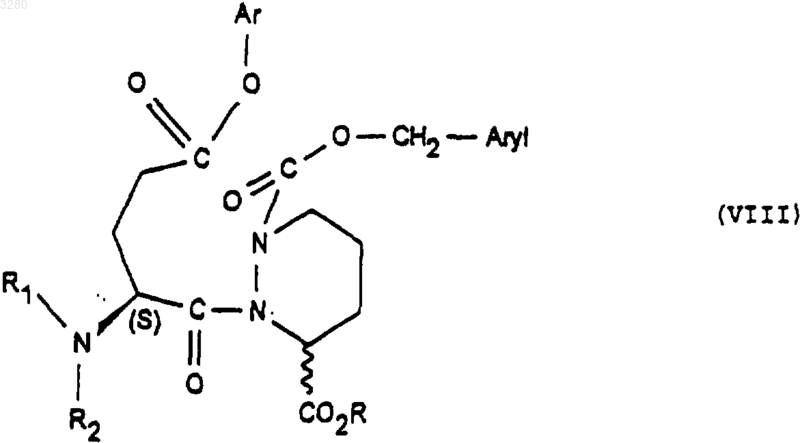
имеющего конфигурацию SR или находящегося в виде смеси SR+SS, которое обрабатывают гидрирующим агентом с получением соединения формулы (IX)
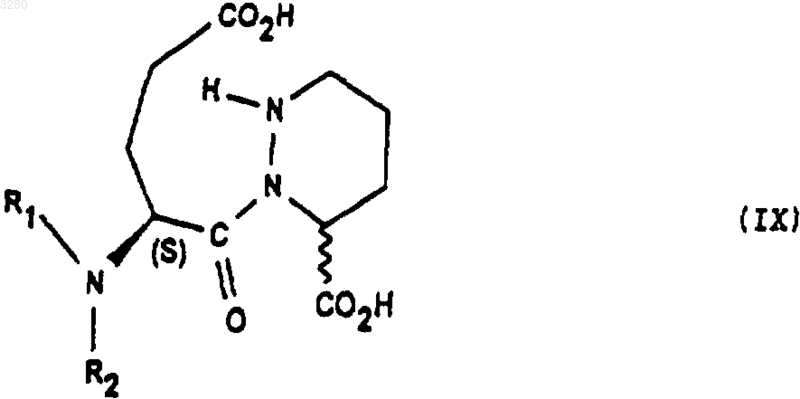
имеющего конфигурацию SR или находящегося в виде смеси SR+SS, которое обрабатывают агентом конденсации до получения соответствующего соединения формулы (IA1), затем, при необходимости, высвобождают аминофункцию с получением соединения формулы (I), в котором аминофункция является свободной.
6. Применение соединений формулы (IV), описанной в п.5, в качестве промежуточных продуктов.
7. Применение соединений формулы (VIII), описанной в п.5, в качестве промежуточных продуктов.
8. Применение соединений формулы (IX), описанной в п.5, в качестве промежуточных продуктов.
9. Применение соединений формулы (I), описанных в одном из пп.1-4, конфигурации SR или в виде смеси SS+SR для получения соединений формулы (Iopt)
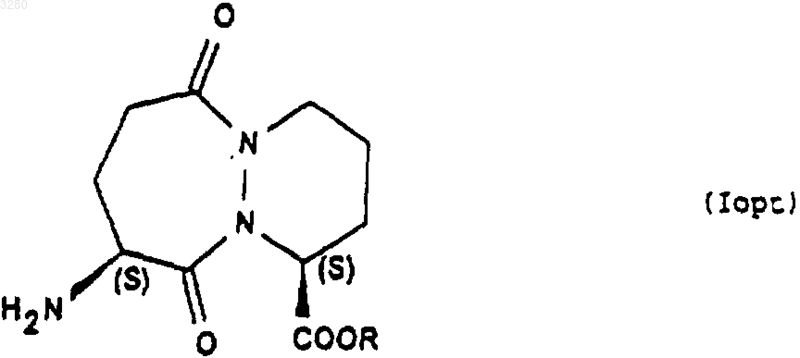
конфигурации SS, в которой аминная функция свободна или защищена, a R имеет значение, указанное в п.1, путем обработки соединения формулы (I) агентом дерацемизации асимметричного атома углерода, находящегося на шестичленном цикле.
10. Применение соединений формулы (IA1), описанной в пп.2-4, для получения соединений формулы (IAopt)
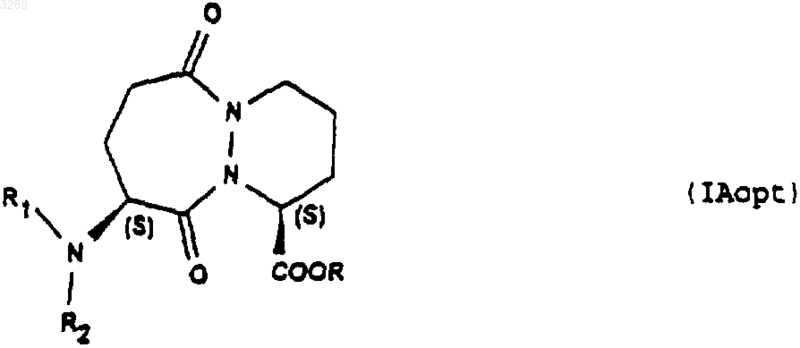
конфигурации SS, в которой R имеет значение, указанное в п.1, R1 и R2 вместе образуют фталимидную группу.
11. Применение согласно п.9 или 10, отличающееся тем, что R представляет собой радикал метил.
12. Применение согласно п.9 или 11, отличающееся тем, что аминофункция защищена в виде группы фталимидо.
13. Применение согласно любому из пп.9-12, отличающееся тем, что указанный агент дерацемизации представляет собой основание.
14. Применение согласно п.13, отличающееся тем, что указанным основанием является сильное основание, такое как алкоголят щелочного металла, алкоголят щелочно-земельного металла или литийсодержащий амин.
15. Применение по любому из пп.10-14, отличающееся тем, что исходным продуктом является рацемическая смесь согласно п.4, а получаемый продукт является метил-(1S-цис)-9-(1,3-дигидро-1,3-диоксо-2H-изоиндол-2-ил)-3,4,7,8,9,10-гексагидро-6,10-диоксо-6H-пиридазино[1,2-a][1,2]диазепин-1-карбоксилатом.
Текст
1 Предлагаемое изобретение относится к новым производным октагидро-6,10-диоксо-6 Нпиридазино[1,2-а][1,2]диазепин-1-карбоновой кислоты, к способу их получения и к их применению для получения терапевтически активных соединений. В патентах и в заявках на патент, таких какUS 4512924, WO 9323403, US 5723602, WO 9722619, US 5656627 и WO 9533751, описаны производные 9-амино-октагидро-6,10-диоксо 6 Н-пиридазо[1,2-а][1,2]диазепин-1-карбоновой кислоты, в которых аминная группа может быть защищена в форме фталимида, конфигурации 1S, 9S, используемые в качестве исходных соединений для получения продуктов, пригодных в качестве лекарственных средств. Получение диастереоизомера SS осуществляется методами выделения, в частности, методами кристаллизации или хроматографии, на стадии, предшествующей стадии циклизации. Объектом настоящего изобретения являются соединения общей формулы (I) имеющие конфигурацию SR или находящиеся в виде смеси SR+SS, в формуле которых R представляет собой атом водорода, алкильный радикал, содержащий до 4 атомов углерода, R1 и R2 означают Н или защитную группу аминофункции. Радикал R представляет собой, например,атом водорода, радикалы метил, этил, пропил,изопропил, н-бутил, изобутил или трет-бутил. Если функция защищена, то защита осуществлена способами, известными для защиты аминов. Более конкретно, настоящее изобретение относится к соединениям формулы (IA1), в которых аминогруппа защищена в форме фталимида имеющим конфигурацию SR или находящимся в виде смеси SR+SS, а R имеет указанное выше значение. Настоящее изобретение относится, например, к соединениям формулы (I), в которой R является метилом, имеющим конфигурацию SR или находящимся в виде смеси SR+SS. Настоящее изобретение относится также к способу получения соединений формулы (I),заключающемуся в том, что соединение формулы (II) в котором alc представляет собой алкил, содержащий до 4 атомов углерода, a Hal представляет собой атом галогена, подвергают взаимодействию с соединением формулы (III) в которой Aryl представляет собой радикал фенил, и получают соединения формулы (IV) которое обрабатывают агентом основного характера с получением соединения формулы (V) которое, при необходимости, подвергают действию алкилирующего агента с получением соединения формулы (VI) в которой Hal1 означает атом галогена, а Аr является бензилом, причем R1 и R2 имеют вышеуказанные значения, с получением соединения формулы (VIII) имеющего конфигурацию SR или находящегося в виде смеси SR+SS, которое подвергают дейст 3 вию гидрирующего агента для получения соединения формулы (IX) имеющего конфигурацию SR или находящегося в виде смеси SR+SS, которое подвергают действию агента конденсации с получением соответствующего соединения формулы (IA1), затем при желании высвобождают аминную функцию и получают соединение формулы (I), в котором аминная функция находится в свободном виде. В предпочтительном варианте осуществления данного изобретенияHal и Hal1 представляют собой атом хлора,реакция между соединениями формул (II) и (III) протекает в присутствии основания, например, в присутствии карбоната щелочного металла, такого как карбонат калия,агент основного характера, которым обрабатывают соединение формулы (IV), является гидроксидом натрия или калия,алкилирующий агент, которым обрабатывают соединение формулы (V), является спиртом, например, метанолом,конденсация между соединениями (VI) и(VII) осуществляется в присутствии основания,такого как пиридин, триэтиламин, диизопропиламин,гидрирующим агентом является, например,водород в присутствии палладия на угле, дигидроксида палладия в присутствии талька, родия в присутствии гидроксида алюминия, рутения на угле или в присутствии никеля Ренея,циклизацию осуществляют в присутствииSOCl2 или РСl5 или активированных сложных эфиров или в присутствии дегидратирующих агентов, таких как пара-толуолсульфоновая кислота,снятие защитной группы аминофункции может быть осуществлено с помощью гидразина. Соединения формул (IV), (VII), (VIII) и(IX), получаемые в ходе осуществления предлагаемого способа, являются новыми и являются объектом настоящего изобретения. В частности, изобретение относится к продуктам, способ получения которых описан ниже в экспериментальной части и которые представлены в виде рацемической смеси. Предлагаемое изобретение относится также к применению соединения формулы (I) в виде SR+SS или в форме SR, которое состоит в том, что его подвергают действию агента дерацемизации асимметричного атома углерода,находящегося на шестичленном цикле с получением оптически активного соединения формулы (Iopt): в форме SS, в которой аминофункция является свободной или защищенной, a R сохраняет указанное выше значение. Более конкретно, настоящее изобретение относится к применению вышеописанных соединений формулы (IA) для получения оптически активных соединений формулы (lAopt) в форме SS, в которой R имеет указанное выше значение, a R1 и R2 вместе образуют фталимидную группу. Еще более конкретно, изобретение относится к применению соединений, когда R представляет собой метил, а также к применению соединений, в которых аминофункция является защищенной в форме фталимидо. Изобретение, в частности, относится к применению, в котором агент дерацемизации представляет собой основание, более конкретно,сильное основание, такое как алкоголят щелочного или щелочно-земельного элемента, такое как метилат натрия или калия, трет-бутилат натрия или калия, литийсодержащий амин, например, литий диизопропиламид и др. Настоящее изобретение, в частности, относится к применению, описанному в экспериментальной части для получения: метил-(1S-цис)-9-(1,3-дигидро-1,3-диоксо 2 Н-изоиндол-2-ил)-3,4,7,8,9,10-гексагидро-6,10 диоксо-6 Н-пиридазино[1,2-а][1,2]диазепин-1 карбоксилата. Соединение формулы (I) конфигурации SS,в котором R является трет-бутилом, а амин защищен в форме фталимидо, известно в уровне техники и описано, например, в патенте ЕР 94095. Это соединение является промежуточным соединением в синтезе продуктов, имеющих терапевтически полезные свойства. Соединения формулы (I) могут быть полезны для синтеза лекарственных средств, описанных в вышеуказанном патенте. Ниже приведены примеры осуществления предлагаемого изобретения. Пример 1. Метил-(1S-цис)-9-(1,3-дигидро 1,3-диоксо-2 Н-изоиндол-2-ил)-октагидро-6,10 диоксо-6 Н-пиридазино[1,2-а][1,2]диазепин-1 карбоксилат и метил-(1R-транс)-9-(1,3-дигидро 1,3-диоксо-2 Н-изоиндол-2-ил)-октагидро-6,10 диоксо-6 Н-пиридазино[1,2-а][1,2]диазепин-1 карбоксилат а) Получение 2,5-дибромпентановой кислоты 5 Вводят 39 мл брома в смесь 106 г 5 бромпентановой кислоты и 1 мл трибромида фосфора. Реакционную смесь нагревают при температуре 70-80 С в течение 16,5 ч, после чего реакционную смесь доводят до 100 С в течение 15 мин и охлаждают до окружающей температуры. В результате получают 147 г целевого продукта. б) Получение этилового эфира 2,5 дибромпентановой кислоты Вводят 24,37 г оксалилхлорида в смесь,содержащую 50 г соединения, полученного на предыдущей стадии а) 15 капель диметилформамида и 300 мл метиленхлорида. Полученную реакционную смесь поддерживают в условиях перемешивания при комнатной температуре до полного завершения реакции, после чего реакционную смесь охлаждают до 10 С и добавляют 50 мл этилового спирта. Перемешивают смесь в течение 30 мин при 10 С, охлаждают до комнатной температуры и подвергают перемешиванию в течение 3 ч при комнатной температуре. Полученную смесь высушивают и получают целевой продукт. в) Получение бис(фенилметил)-1,2-гидразиндикарбоксилата В атмосфере азота помещают 1,5 л метанола и 25 г 80%-ого моногидрата гидразина. Полученную смесь охлаждают до 0 С, а затем при 0 С добавляют 75 г бензилхлорформиата, а затем снова вводят 75 г бензилхлорформиата одновременно с раствором 93 г карбоната натрия в 1100 мл деминерализованной воды. Полученную реакционную смесь выдерживают в течение 1 ч при 0 С, осушают и промывают смесью 100 мл метанола и 100 мл воды, затем промывают 500 мл воды при 0 С. Полученный продукт сушат и получают 107,6 г целевого продукта. г) Получение 3-этил-1,2-бис(фенилметил)(S)-тетрагидро-1,2,3-пиридазинтрикарбоксилата и 3-этил-1,2-бис(фенилметил) (R)-тетрагидро 1,2,3-пиридазинтрикарбоксилата При температуре 20-25 С вводят суспензию 12,1 г соединения этил-2,5-дибромпентаноата и 50 см 3 диглима в суспензию, содержащую 10,42 г соединения бис(фенилметил)1,2-гидразиндикарбоксилата, 65 мл диглима и 8,26 г карбоната калия. Полученную суспензию нагревают при 90 С и выдерживают при перемешивании 48 ч. Далее суспензию охлаждают до 20 С и выливают в раствор, содержащий 50 мл 2 н. соляной кислоты и 150 мл смеси воды и льда. Производят экстракцию этилацетатом, промывают водой и сушат. Продукт фильтруют, ополаскивают этилацетатом и сушат. Осуществляют хроматографию на двуокиси кремния (элю-ирование гептаном 40, AcOEt 20) полученного продукта и получают 10,71 г целевого продукта. д) Получение 1-(фенилметил)-(S)-тетрагидро-1,3(2 Н)-пиридазиндикарбоксилата и 1 003280(фенилметил)-(R)-тетрагидро-1,3(2 Н)-пиридазиндикарбоксилата Вводят раствор, содержащий 23,25 г продукта, полученного на предыдущей стадии г) и 80 мл этанола, в 338 мл раствора гидроксида натрия в этаноле из расчета 40 г на литр. После перемешивания в течение 5 ч 30 мин добавляют 57 мл 2 н. едкого натра, после чего перемешивают реакционную смесь в течение 30 ч. Добавляют 141 мл 2 н. соляной кислоты. Перегоняют 260 мл реакционной смеси при давлении 80-90 миллибар. Затем экстрагируют дихлорметаном,добавляют 20 мл этанола и промывают смесью воды с 1 н-нормальным раствором едкого натра. Водные фазы экстрагируют дихлорметаном,после чего водные фазы объединяют, перемешивают и подкисляют добавкой 135 мл 2 н. раствора соляной кислоты. Далее смесь экстрагируют дихлорметаном, промывают водой, сушат,фильтруют и промывают хлористым метиленом. Полученную массу концентрируют и сушат,после чего добавляют 146 мл простого изопропилового эфира, перемешивают при 20 С в течение 1 ч, фильтруют, промывают, концентрируют и сушат. Получают 11,41 г целевого продукта. е) Получение 3-метил-1-(фенилметил)-(S)тетрагидро-1,3(2 Н)-пиридазиндикарбоксилата и 3 метил-1-(фенилметил)-(R)-тетрагидро-1,3(2 Н)-пиридазиндикарбоксилата Добавляют 220 мл метанола и дегидратированную паратолуолсульфоновую кислоту(полученную из моногидрата паратолуолсульфоновой кислоты и 12 мл дихлорметана) к 11,05 г продукта, полученного на предыдущей стадии д). Полученную суспензию перемешивают в течение 15 ч, после чего нагревают до 65 С и продолжают перемешивание в течение 6 ч 30 мин. Суспензию охлаждают до 5 С и добавляют 5,5 мл 10%-ного раствора бикарбоната натрия. Суспензию концентрируют при пониженном давлении, обрабатывают смесью 100 мл дихлорметана и 100 мл воды. Смесь перемешивают, декантируют, промывают органическую фазу, экстрагируют дихлорметаном, сушат,фильтруют и концентрируют. Получают 11,39 г целевого продукта. ж) Получение 3-метил-1-(фенилметил)[3S-[2(R), 3R-2-[2-(1,3-дигидро-1,3-диоксо 2 Н-изоиндол-2-ил)-1,5-диоксо-5-(фенилметокси)пентил]тетрагидро-1,3(2 Н)-пиридазиндикарбоксилата и 3-метил-1-(фенилметил)-[3R[2(S), 3R-2-[2-(1,3-дигидро-1,3-диоксо-2 Низоиндол-2-ил)-1,5-диоксо-5-(фенилметокси)пентил]тетрагидро-1,3(2 Н)-пиридазиндикарбоксилата В течение 1 ч при температуре, близкой к 4 С, вводят раствор, содержащий 11,01 г продукта, полученного на предыдущей стадии е) и 50 мл дихлорметана в растворе, содержащем 19,88 г фенилметил-(S)-гамма-(хлоркарбонил)1,3-дигидро-1,3-диоксо-2 Н-изоиндол-2-бутано 7 ата и 100 мл дихлорметана. Смесь перемешивают в течение 30 мин при 4 С и вливают в течение полутора часов раствор 4,15 мл пиридина в 25 мл дихлорметана. Полученную смесь перемешивают в течение 15 ч, медленно доводя ее до окружающей температуры. Смесь концентрируют при пониженном давлении, обрабатывают с помощью 200 мл этилацетата, промывают насыщенным раствором кислого карбоната натрия, перемешивают в течение получаса, декан тируют, промывают насыщенным раствором кислого карбоната натрия, перемешивают и вновь декантируют. Промывают раствором, содержащим 5 мл нормального раствора соляной кислоты и 25 мл воды, затем промывают насыщенным водным раствором хлористого натрия и сушат. Полученную массу экстрагируют этилацетатом, концентрируют и сушат. Получают 25,2 г целевого продукта. з) Получение [6S-[1(R),6R-1,3-дигидро 1,3-диоксо-гамма-6-(метоксикарбонил)тетрагидро-1(2 Н)-пиридазинил]карбонил]2 Н-изоиндол-2-бутановой кислоты и [6R[1(S),6R-1,3-дигидро-1,3-диоксо-гамма-6(меток-сикарбонил)тетрагидро-1(2 Н)-пиридазинил]карбонил]-2 Н-изоиндол-2-бутановой кислоты В аппарат, содержащий водород, вводят 20,23 г продукта, полученного на предыдущей стадии ж), 250 мл тетрагидрофурана (ТГФ) и 3,03 г 10%-ного палладия на угле. Поток водорода пропускают в течение 3 ч и снова добавляют 3,03 г катализатора. Продолжают гидрирование в течение 22 ч, после чего реакционную массу фильтруют, промывают тетрагидрофураном и выпаривают. Затем добавляют 25 мл изопропанола, концентрируют, отгоняют ТГФ и добавляют 15 мл изопропанола. Получают суспензию, к которой добавляют 100 мл простого изопропилового эфира. Полученную суспензию подвергают перемешиванию в атмосфере азота в течение 2 ч, центрифугируют и промывают простым изопропиловым эфиром, содержащим 5% изопропанола. Полученную массу центрифугируют, сушат и получают 9,5 г целевого продукта. и) Получение метил-(1S-цис)-9-(1,3 дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)октагидро-6,10-диоксо-6 Н-пиридазино [1,2-а][1,2]диазепин-1-карбоксилата и метил-(1R-транс)-9-(1,3-дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)октагидро-6,10-диоксо 6 Н-пиридазино[1,2-а][1,2]диазепин-1-карбоксилата При температуре 5 С добавляют раствор,содержащий 1 мл хлористого тионила и 40 мл хлористого метилена в смесь, содержащую 4,038 г продукта, полученного на предыдущей стадии, 40 мл дихлорметана и 0,4 мл диметилформамида. Полученную смесь перемешивают в течение 3,5 ч, после чего температуру повышают до 20 С, перемешивают в течение полутора 8 часов и концентрируют. К смеси добавляют раствор, содержащий 0,15 мл хлористого тионила и 5 мл хлористого метилена. Полученную реакционную смесь выдерживают при условиях перемешивания в течение 16 ч при температуре 20 С. Смесь охлаждают до 5 С и вводят в нее 27 мл водного насыщенного раствора кислого карбоната натрия, после чего продолжают перемешивание в течение получаса. Смесь декантируют и промывают раствором, содержащим 10 мл бикарбоната натрия и 40 мл деминерализованной воды. Полученную массу перемешивают в течение 3 мин, декантируют, экстрагируют водные фазы хлористым метиленом, сушат, фильтруют, промывают хлористым метиленом и концентрируют при пониженном давлении. Получают 3,85 г целевого продукта. Применение метил-(1S-цис)-9-(1,3-дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)октагидро 6,10-диоксо-6 Н-пиридазино[1,2-а][1,2]диазепин 1-карбоксилата При температуре -45/-48 С в течение 1,5 ч вводят раствор,содержащий 0,029 г трет.бутилата калия и 0,3 мл диметилформамида в смесь, содержащую 0,194 гпродукта примера 1, 1,5 мл диметилформамида и 0,75 мл трет.бутанола. Полученную смесь перемешивают в течение 1 ч, затем охлаждают до температуры -50 С и вводят 0,4 г хлористого аммония в форме порошка. Смесь перемешивают в течение 10 мин при температуре -45 С, дважды последовательно добавляют по 1 мл 20%-ного хлористого аммония, подвергая смесь перемешиванию в течение 10 мин после каждой добавки. Затем добавляют 2 мл деминерализованной воды, экстрагируют этилацетатом, промывают деминерализованной водой, декантируют, концентрируют и сушат. Получают 0,166 г целевого продукта D=-75,3 (1% в метаноле). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) имеющие конфигурацию SR или находящиеся в виде смеси SR+SS, в формуле которых R представляет собой атом водорода, радикал алкил,содержащий от 1 до 4 атомов углерода, a R1 и R2 означают Н или защитную группу аминофункции. 2. Соединения по п.1, в которых аминогруппа защищена в форме фталимида, формулы имеющие конфигурацию SR или находящиеся в виде смеси SR+SS. 3. Соединения формулы (I) согласно любому из пп.1-2, в которой R представляет собой метил. 4. Рацемическая смесь соединений формулы (I), описанной в п.1, состоящая из метил-(1S-цис)-9-(1,3-дигидро-1,3-диоксо 2 Н-изоиндол-2-ил)-октагидро-6,10-диоксо-6 Нпиридазино[1,2-а][1,2]диазепин-1-карбоксилата и метил-(1R-транс)-9-(1,3-дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)-октагидро-6,10-диоксо 6 Н-пиридазино[1,2-а][1,2]диазепин-1-карбоксилата. 5. Способ получения соединений формулы(I), описанной в одном из предыдущих пунктов,отличающийся тем, что соединение формулы в которой alc представляет собой радикал алкил,содержащий 1-4 атомов углерода, a Hal представляет собой атом галогена, подвергают действию соединения формулы (III) в которой Aryl представляет собой радикал фенил с получением соединения формулы (IV) которое обрабатывают агентом основного характера для получения соединения формулы (V) которое при необходимости подвергают действию алкилирующего агента с получением соединения формулы (VI) которое подвергают действию соединения формулы (VII) в которой Hal1 представляет собой атом галогена, Аr представляет собой радикал бензил, a R1 и R2 имеют значение, указанное в п.2,для получения соединения формулы (VIII) имеющего конфигурацию SR или находящегося в виде смеси SR+SS, которое обрабатывают гидрирующим агентом с получением соединения формулы (IX) имеющего конфигурацию SR или находящегося в виде смеси SR+SS, которое обрабатывают агентом конденсации до получения соответствующего соединения формулы (IA1), затем, при необходимости, высвобождают аминофункцию с получением соединения формулы (I), в котором аминофункция является свободной. 6. Применение соединений формулы (IV),описанной в п.5, в качестве промежуточных продуктов. 7. Применение соединений формулы (VIII),описанной в п.5, в качестве промежуточных продуктов. 8. Применение соединений формулы (IX),описанной в п.5, в качестве промежуточных продуктов. 9. Применение соединений формулы (I),описанных в одном из пп.1-4, конфигурации SR или в виде смеси SS+SR для получения соединений формулы (Iopt) конфигурации SS, в которой аминная функция свободна или защищена, a R имеет значение,указанное в п.1, путем обработки соединения формулы (I) агентом дерацемизации асимметричного атома углерода, находящегося на шестичленном цикле. 10. Применение соединений формулы(IA1), описанной в пп.2-4, для получения соединений формулы (IAopt) конфигурации SS, в которой R имеет значение,указанное в п.1, R1 и R2 вместе образуют фталимидную группу. 11. Применение согласно п.9 или 10, отличающееся тем, что R представляет собой радикал метил. 12 12. Применение согласно п.9 или 11, отличающееся тем, что аминофункция защищена в виде группы фталимидо. 13. Применение согласно любому из пп.912, отличающееся тем, что указанный агент дерацемизации представляет собой основание. 14. Применение согласно п.13, отличающееся тем, что указанным основанием является сильное основание, такое как алкоголят щелочного металла, алкоголят щелочно-земельного металла или литийсодержащий амин. 15. Применение по любому из пп.10-14, отличающееся тем, что исходным продуктом является рацемическая смесь согласно п.4, а получаемый продукт является метил-(1S-цис)-9-(1,3 дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)-3,4,7,8,9,10-гексагидро-6,10-диоксо-6 Н-пиридазино[1,2-а][1,2]диазепин-1-карбоксилатом.
МПК / Метки
МПК: C07D 487/04
Метки: 10-диоксо-6н-пиридазино, способ, производные, применение, терапевтически, кислоты, октагидро-6, активных, 1,2-а, соединений, 1,2, диазепин-1-карбоновой, получения
Код ссылки
<a href="https://eas.patents.su/7-3280-proizvodnye-oktagidro-6-10-diokso-6n-piridazino-12-a-12-diazepin-1-karbonovojj-kisloty-sposob-ih-polucheniya-i-ih-primenenie-dlya-polucheniya-terapevticheski-aktivnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Производные октагидро-6, 10-диоксо-6н-пиридазино [1,2-а] [1,2] диазепин-1-карбоновой кислоты, способ их получения и их применение для получения терапевтически активных соединений</a>
Следующий патент: 6-(2-гало-4-алкоксифенил)триазолпиримидины с фунгицидным действием
Случайный патент: Модульная упаковочная система











