Малеат 6-амино-2-{[(1s)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8н-пурин-8-она
Номер патента: 21048
Опубликовано: 31.03.2015
Авторы: Лукас Аманда, Гиббон Роберт Херманн, Хермитидж Стивен Эндрю
Формула / Реферат
1. Соединение, представляющее собой 6-амино-2-{[(1S)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он
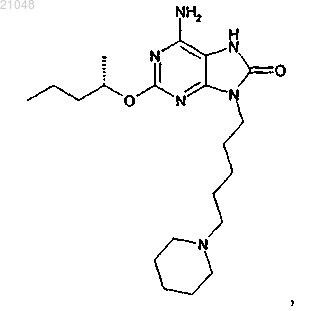
в форме малеатной соли.
2. Применение соединения по п.1 в качестве TLR7 активирующего агента.
3. Применение соединения по п.1 в лечении заболевания или состояния, при котором желательно повышение образования IFN-α, где указанное заболевание или состояние выбрано из аллергического заболевания и воспалительного состояния, инфекционного заболевания и рака.
4. Применение соединения по п.1 в лечении аллергического ринита.
5. Применение соединения по п.1 в лечении астмы.
6. Применение соединения по п.1 для изготовления иммуногенной композиции, содержащей антиген.
7. Применение соединения по п.1 для изготовления вакцинной композиции, содержащей антиген.
8. Применение соединения по п.1 для изготовления лекарственного средства для лечения заболевания или состояния, при котором желательно повышение образования IFN-α, где указанное заболевание или состояние выбрано из аллергического заболевания и воспалительного состояния, инфекционного заболевания и рака.
9. Применение соединения по п.1 для изготовления лекарственного средства для лечения аллергического ринита.
10. Применение соединения по п.1 для изготовления лекарственного средства для лечения астмы.
11. Способ лечения заболевания или состояния, при котором желательно повышение образования IFN-α и где указанное заболевание или состояние выбрано из аллергического заболевания, воспалительного состояния, инфекционного заболевания и рака, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1.
12. Способ лечения аллергического ринита, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1.
13. Способ лечения астмы, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1.
14. Фармацевтическая композиция, обладающая TLR7-активирующей активностью, содержащая соединение по п.1 и один или более фармацевтически приемлемых разбавителей или носителей.
Текст
в форме малеатной соли, может быть полезным в лечении различных расстройств, например в лечении аллергических заболеваний и других воспалительных заболеваний, например аллергического ринита и астмы, в лечении инфекционных заболеваний и рака и может быть также полезным в качестве вакцинных адъювантов. Предшествующий уровень техники Настоящее изобретение относится к соединениям, к способам их получения, к композициям, содержащим их, к их применению в лечении различных расстройств, в частности аллергических заболеваний и других воспалительных заболеваний, например аллергического ринита и астмы, инфекционных заболеваний, рака, и в качестве вакцинных адъювантов. Позвоночные животные постоянно находятся под угрозой заражения микроорганизмами, и у них развились механизмы иммунной защиты для уничтожения инфекционных патогенов. У млекопитающих эта иммунная система включает две ветви: врожденный иммунитет и приобретенный иммунитет. В первую очередь защиту организма обеспечивает врожденная иммунная система, опосредованная макрофагами и дендритными клетками. Приобретенный иммунитет задействован в уничтожении патогенов на поздней стадии инфицирования, а также обеспечивает формирование иммунологической памяти. Приобретенный иммунитет является высокоспецифическим благодаря обширному репертуару лимфоцитов с антиген-специфическими рецепторами, которые подверглись генной перестройке. Врожденный иммунный ответ первоначально считался неспецифическим, но теперь известно, что врожденная иммунная система способна распознавать различные патогены как чужие. Врожденная иммунная система распознает микробы через ограниченное число кодируемых в зародышевых клетках образраспознающих рецепторов (Pattern-Recognition Receptors (PRR, которые имеют целый ряд важных характеристик.Toll-подобные рецепторы (TLR) представляют собой семейство из десяти образраспознающих рецепторов, описанных у человека. TLR экспрессируются преимущественно врожденными иммунными клетками, где их роль заключается в контролировании окружения по признакам инфекции и, при активации, в мобилизации защитных механизмов, нацеленных на уничтожение проникающих патогенов. Ранние врожденные иммунные реакции, запускаемые TLR, ограничивают распространение инфекции, а провоспалительные цитокины и хемокины, которые они индуцируют, приводят к рекрутингу и активации антиген-презентирующих клеток, В-клеток и Т-клеток. TLR могут модулировать характер адаптивных иммунных реакций, обеспечивая соответствующую защиту через активацию дендритных клеток и высвобождение цитокинов (Akira S. et al., Nat. Immunol., 2001: 2, 675-680). Профиль реакции, наблюдаемой в ответ на разные агонисты TLR, зависит от типа активируемых клеток.TLR7 является членом подгруппы TLR (TLR3, TLR7, TLR8 и TLR9), локализованных в эндосомальном компартменте клеток, которые способны обнаруживать чужеродные нуклеиновые кислоты.TLR7 играет ключевую роль в противовирусной защите посредством распознавания онРНК (однонитевой РНК) (Diebold S.S. et al., Science, 2004: 303, 1529-1531 и Lund J. M. et al., PNAS, 2004: 101, 55985603). TLR7 имеет ограниченный профиль экспрессии у человека и экспрессируется преимущественно В-клетками и плазмацитоидными дендритными клетками (pDC) и в меньшей степени моноцитами. Плазмацитоидные DC представляют собой уникальную популяцию лимфоидных дендритных клеток(0,2-0,8% мононуклеарных клеток периферической крови (РВМС, которые являются первичными клетками, продуцирующими интерферон типа I, секретирующими высокие уровни интерферона альфа (IFN) и интерферона бета (IFN) в ответ на вирусные инфекции (Liu Y-J, Annu. Rev. Immunol., 2005: 23, 275306). Аллергические заболевания ассоциированы с Th2-смещенной иммунной реакцией на аллергены.Th2-реакции связаны с повышенными уровнями IgE (иммуноглобулин Е), который, воздействуя на тучные клетки, стимулирует гиперчувствительность к аллергенам и, в результате, вызывает симптомы, например, аллергического ринита. У здоровых индивидуумов иммунная реакция на аллергены в большей степени сбалансирована со смешанной Th2/Th1- и регуляторной Т-клеточной реакцией. Было показано,что лиганды TLR7 снижают высвобождение Th2 цитокина и повышают высвобождение Th1 цитокина invitro и ослабляют воспалительные реакции Th2-типа в моделях аллергического легкого in vivo (Fili L. etal., J. All. Clin. Immunol., 2006: 118, 511-517; Moisan J. et al., Am. J. Physiol. Lung Cell Mol. Physiol., 2006: 290, L987-995; Tao et al., Chin. Med. J., 2006: 119, 640-648). Таким образом, лиганды TLR7 обладают потенциалом восстановления баланса иммунного ответа у индивидуумов, страдающих аллергией, и модифицирования заболевания. Центральное место в формировании эффективного врожденного иммунного ответа у млекопитающих занимают механизмы, которые вызывают индуцирование интерферонов и других цитокинов, которые воздействуют на клетки, вызывая целый ряд эффектов. Эти эффекты могут включать активацию экспрессии генов противоинфекционного иммунитета, активацию презентации антигена в клетках для запуска сильного антигенспецифического иммунитета и промотирование фагоцитоза в фагоцитарных клетках. Интерферон впервые был описан как вещество, которое может защищать клетки от вирусной инфекции (IsaacsLindemann, J. Virus Interference. Proc. R. Soc. Lon. Ser. B. Biol. Sci. 1957: 147, 258-267). У человека интерфероны типа I представляют собой семейство родственных белков, кодируемых генами на хромосоме 9, кодирующими по меньшей мере 13 изоформ интерферона альфа (IFN) и одну изоформу интерферона бета (IFN). Рекомбинантный IFN был первым разрешенным биологическим терапевтиче-1 021048 ским средством и стал важным терапевтическим средством в лечении вирусных инфекций и рака. Помимо прямой противовирусной активности на клетках интерфероны, как известно, являются сильнодействующими модуляторами иммунной реакции, воздействуя на клетки иммунной системы. В качестве приоритетной терапии заболевания, вызванного вирусом гепатита С (HCV), комбинации интерферонов могут обладать высокой эффективностью в снижении вирусной нагрузки и у некоторых субъектов в устранении вирусной репликации. Однако у многих пациентов нет устойчивой реакции на вирус, и у этих пациентов вирусная нагрузка не контролируется. Дополнительно терапия инъецируемым интерфероном может быть связана с целым рядом нежелательных вредных эффектов, которые, как известно, влияют на соблюдение пациентом режима и схемы лечения (Dudley T., et al., Gut, 2006: 55(9),1362-3). Введение соединения, имеющего небольшую молекулу, которое способно стимулировать врожденную иммунную реакцию, включая активацию интерферонов типа I и других цитокинов, может стать важной стратегией для лечения или предупреждения заболеваний у человека, включая вирусные инфекции. Этот тип иммуномодулирующей стратегии имеет потенциал для идентификации соединений, которые могут быть полезными не только при инфекционных заболеваниях, но и при раке (Krieg., Curr. Oncol. Rep., 2004: 6(2), 88-95), аллергических заболеваниях (Moisan J. et al., Am. J. Physiol. Lung Cell Mol.Physiol., 2006: 290, L987-995), других воспалительных состояний, таких как болезнь раздраженного кишечника (Rakoff-Nahoum S., Cell., 2004, 23, 118(2): 229-41), и в качестве вакцинных адъювантов (Persinget al., Trends Microbiol. 2002: 10 (10 Suppl), S32-7). На животных моделях имиквимод продемонстрировал адъювантную активность как местно (AdamsS. et al., J. Immunol., 2008, 181:776-84; Johnston D. et al., Vaccine, 2006, 24:1958-65), так и системно (Fransen F. et al., Infect. Immun., 2007, 75:5939-46). Было также показано, что резиквимод и другие родственные агонисты TLR7/8 проявляют адъювантную активность (Ma R. et al., Biochem. Biophys. Res. Commun.,2007, 361:537-42; Wille-Reece U. et al., Proc. Natl. Acad. Sci. USA, 2005, 102:15190-4; Wille-Reece U. et al.,US2006045885 A1). Механизмы, которые приводят к индуцированию интерферонов типа I, выяснены только отчасти. Один механизм, который может приводить к индуцированию интерферона во многих типах клеток,представляет собой распознавание двунитевой вирусной РНК РНК-геликазами RIG-I и MDA5. Этот механизм считается первичным механизмом индуцирования интерферонов при инфицировании клеток вирусом Сендай. В основе дополнительных механизмов индуцирования интерферонов лежат события TLRзависимой сигнализации. У человека плазмацитоидные дендритные клетки (pDC) являются профессиональными интерферон-продуцирующими клетками, способными создавать большое количество интерферонов в ответ на, например, вирусную инфекцию. Показано, что эти pDC экспрессируют преимущественно TLR7 и TLR9, и стимуляция этих рецепторов вирусной РНК или ДНК соответственно может индуцировать экспрессию интерферона альфа. Были описаны олигонуклеотидные агонисты TLR7 и TLR9 и имеющие небольшую молекулу агонисты TLR7 на основе пурина, которые могут индуцировать интерферон альфа из этих типов клеток у животных и у человека (Takeda K. et al., Annu. Rev. Immunol., 2003: 21, 335-76). Агонисты TLR7 включают имидазохинолиновые соединения, такие как имиквимод и резиквимод, аналоги оксоаденина, а также нуклеозидные аналоги, такие как локсорибин и 7-тиа-8-оксогуанозин, которые, как давно известно, индуцируют интерферон альфа. В публикации международной патентной заявки WO 2008/114008 (AstraZeneca AB/Dainippon Sumitomo Pharma Co. Ltd.) раскрыты 9-замещенные-8-оксоадениновые соединения в модуляторов TLR7. Остается неясным, как пуриноподобные соединения, имеющие небольшую молекулу, могут индуцировать интерфероны типа I и другие цитокины, поскольку молекулярные мишени этих известных индукторов не идентифицированы. Тем не менее была разработана стратегия анализа для определения характеристик имеющих небольшую молекулу индукторов человеческого интерферона IFN (независимо от механизма), которая основана на стимуляции соединениями первичных клеток донора-человека, и которая описана в данном документе. Краткое описание изобретения Было показано, что соединение 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]7,9-дигидро-8H-пурин-8-он, раскрытое в международной заявкеРСТ/ЕР 2009/060265, опубликованной как WO 2010/018133, является индуктором человеческого интерферона и может обладать улучшенным профилем по сравнению с известными индукторами человеческого интерферона, например может обладать повышенной активностью и может проявлять повышенную селективность к IFN относительноTNF. Ожидается, что 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро 8H-пурин-8-он в форме малеатной соли будет более удобен в приготовлении лекарственного средства,и/или в обработке, и/или в обращении. Например, чистота 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она может быть повышена за счет образования и/или перекристаллизации малеатной соли, и/или его стабильность может быть выше по сравнению со свобод-2 021048 ным основанием. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Hпурин-8-он, который индуцирует человеческий интерферон, может быть полезен в лечении различных расстройств, например в лечении аллергических заболеваний и других воспалительных состояний, например аллергического ринита и астмы, в лечении инфекционных заболеваний и рака, и может быть также полезен в качестве вакцинного адъюванта. Ожидается, что 6-амино-2-[(1S)-1-метилбутил]окси 9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли будет обладать соответствующими фармакологическими свойствами. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он является сильнодействующими иммуномодулятором, и, соответственно, следует соблюдать осторожность при его применении. Краткое изложение сущности изобретения В первом аспекте предложено соединение, представляющее собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он: в форме малеатной соли. Предложен также 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро 8H-пурин-8-он в форме малеатной соли, в которой соотношение малеатного аниона и 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она составляет 1:1. В качестве следующего аспекта изобретения предложено также соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, для применения в терапии. Предложено также соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, для применения в лечении аллергических заболеваний и других воспалительных состояний, инфекционных заболеваний и рака. Предложено также соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, для применения в лечении аллергического ринита. Предложено также соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, для применения в лечении астмы. Предложен также вакцинный адъювант, содержащий соединение, представляющее собой 6-амино 2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли. Предложена также иммуногенная композиция, содержащая антиген или антигенную композицию и соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]7,9-дигидро-8H-пурин-8-он в форме малеатной соли. Предложена также вакцинная композиция, содержащая антиген или антигенную композицию и соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]7,9-дигидро-8H-пурин-8-он в форме малеатной соли. Предложен также способ лечения или предупреждения заболевания, включающий введение субъекту-человеку, страдающему заболеванием или восприимчивому к заболеванию, иммуногенной композиции, содержащей антиген или антигенную композицию и соединение, представляющее собой 6-амино-2[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли. Предложен также способ лечения или предупреждения заболевания, включающий введение субъекту-человеку, страдающему заболеванием или восприимчивому к заболеванию, вакцинной композиции,содержащей антиген или антигенную композицию и соединение, представляющее собой 6-амино-2[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли. Предложено также применение соединения, представляющего собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли,-3 021048 для изготовления иммуногенной композиции, содержащей антиген или антигенную композицию, для лечения или предупреждения заболевания. Предложено также применение соединения, представляющего собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли,для изготовления вакцинной композиции, содержащей антиген или антигенную композицию, для лечения или предупреждения заболевания. Предложено также применение соединения, представляющего собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли,для изготовления лекарственного средства для лечения аллергических заболеваний и других воспалительных состояний, инфекционных заболеваний и рака. Предложено также применение соединения, представляющего собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли,для изготовления лекарственного средства для лечения аллергического ринита. Предложено также применение соединения, представляющего собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли,для изготовления лекарственного средства для лечения астмы. Предложен также способ лечения аллергических заболеваний и других воспалительных состояний,инфекционных заболеваний и рака, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, представляющего собой 6-амино-2[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли. Предложен также способ лечения аллергического ринита, включающий введение субъектучеловеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, представляющего собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Hпурин-8-он в форме малеатной соли. Предложен также способ лечения астмы, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, представляющего собой 6 амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли. В еще одном аспекте данного изобретения предложена комбинация, содержащая соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Hпурин-8-он в форме малеатной соли, вместе с по меньшей мере одним другим терапевтически активным агентом. Предложена также фармацевтическая композиция, содержащая соединение, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, и один или более фармацевтически приемлемых разбавителей или носителей. Предложен также способ приготовления фармацевтической композиции, включающий смешивание соединения,представляющего собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, с одним или более фармацевтически приемлемыми разбавителями или носителями. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он и его соли могут быть получены по методике, описанной в предварительной заявке на патент США 61/087777 и в международной заявкеРСТ/ЕР 2009/060265, опубликованной как WO2 010/018133, которые включены в данное описание посредством ссылки. Подробное описание изобретения Очевидно, что многие органические соединения могут образовывать комплексы с растворителями,в которых их подвергали взаимодействию или из которых их осаждали или кристаллизовали. Эти комплексы известны как "сольваты". Например, комплекс с водой известен как "гидрат". Растворители с высокими точками кипения и/или растворители с высокой склонностью образовывать водородные связи,такие как вода, этанол, изопропиловый спирт и N-метилпирролидинон, могут быть использованы для образования сольватов. Методы идентификации сольватов включают, но ими не ограничены, ЯМР(ядерный магнитный резонанс) и микроанализы. Сольваты 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в форме малеатной соли входят в объем данного изобретения. Должно быть понятно, что 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9 дигидро-8H-пурин-8-он будет присутствовать прежде всего в форме S-изомера, но может содержать небольшие количества, например менее 5% или менее 3% и предпочтительно менее 1% или предпочтительно менее 0,5% R-изомера. Должно быть понятно, что малеатные соли этих смесей входят в объем настоящего изобретения. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может существовать в таутомерных формах. Следует иметь в виду, что настоящее изобретение охватывает все таутомеры 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-4 021048 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в форме малеатной соли, будь то индивидуальные таутомеры или их смеси. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может существовать в кристаллической или аморфной форме. К тому же, некоторые кристаллические формы 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9 дигидро-8H-пурин-8-она в форме малеатной соли могут существовать в виде полиморфов, которые входят в объем настоящего изобретения. Самая термодинамически стабильная полиморфная форма или формы представляют особый интерес. Полиморфные формы 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9 дигидро-8H-пурин-8-она в форме малеатной соли могут быть охарактеризованы и дифференцированы с использованием ряда стандартных аналитических методов, включая, без ограничения, дифракцию рентгеновских лучей на порошке (ДРЛП), инфракрасную спектроскопию (ИК), рамановскую спектроскопию,дифференциальную сканирующую калориметрию (ДСК), термогравиметрический анализ (ТГА) и твердотельный ядерный магнитный резонанс (ттЯМР). Из вышеуказанного должно быть ясно, что в объем изобретения входят сольваты, гидраты, изомеры и полиморфные формы 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро 8H-пурин-8-она в форме малеатной соли. Примеры болезненных состояний, при которых 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может оказывать потенциально благотворные эффекты, включают аллергические заболевания и другие воспалительные состояния,например аллергический ринит и астму, инфекционные заболевания и рак. 6-Амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли можно применять также в качестве вакцинного адъюванта. В качестве модулятора иммунного ответа 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть полезен в лечении и/или предупреждении иммуно-опосредованных расстройств, включая, без ограничения, воспалительные или аллергические заболевания, такие как астма, аллергический ринит и риноконъюнктивит,пищевая аллергия, состояния легочной гиперчувствительности, эозинофильный пневмонит, состояния гиперчувствительности замедленного типа, атеросклероз, панкреатит, гастрит, колит, остеоартрит, псориаз, саркоидоз, легочный фиброз, респираторный дистресс-синдром, бронхит, хроническое обструктивное заболевание легких, синусит, муковисцидоз, старческий кератоз, кожная дисплазия, хроническая крапивница, экзема и все типы дерматита. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также полезен в лечении и/или предупреждении реакций на респираторные инфекции, включая, без ограничения, вирусные обострения дыхательных путей и тонзилит. 6 Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также полезен в лечении и/или предупреждении аутоиммунных заболеваний, включая, без ограничения, ревматоидный артрит, псориатический артрит, системную красную волчанку, болезнь Шегрена, анкилозирующий спондилит, склеродерму, дерматомиозит, диабет, отторжение трансплантата, включая заболевание "трансплантат против хозяина", воспалительные заболевания кишечника, включая, без ограничения, болезнь Крона и язвенный колит. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также полезен в лечении инфекционных заболеваний, включая, без ограничения, заболевания, вызываемые вирусами гепатита (например вирусом гепатита В, вирусом гепатита С), вирусом иммунодефицита человека, вирусами папилломы, вирусами герпеса, респираторными вирусами (например вирусами гриппа, респираторным синцитиальным вирусом, риновирусом, метапневмовирусом, вирусом парагриппа, SARS (тяжелый острый респираторный синдром и вирусом лихорадки Западного Нила. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро 8H-пурин-8-он в форме малеатной соли может быть также полезен в лечении микробиологических инфекций, вызываемых, например, бактериями, грибами или простейшими. Эти инфекции включают, но ими не ограничены, туберкулез, бактериальную пневмонию, аспергиллез, гистоплазмоз, кандидоз, пневмоцитоз, лепру, хламидии, криптококковое заболевание, криптоспоридоз, токсоплазмоз, лейшманию,малярию и трипаносомоз. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также полезен в лечении различных видов рака, в частности в лечении видов рака, которые, как известно, реагируют на иммунотерапию, включая, без ограничения, почечноклеточную карциному, рак легкого, рак молочной железы, колоректальный рак, рак мочевого пузыря,меланому, лейкемию, лимфому и рак яичника. Специалистам будет понятно, что в данном описании ссылки на лечение или терапию в зависимости от состояния могут распространяться на профилактику, также как и на лечение установленных состояний. Как указано в данном описании, 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил) пен-5 021048 тил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть полезен в качестве терапевтического агента. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть приготовлен в форме для введения любым удобным путем. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть приготовлен, например, в форме для перорального, местного, ингаляционного, интраназального, трансбуккального, парентерального (например внутривенного, подкожного,интрадермального или внутримышечного) или ректального введения. В одном аспекте 6-амино-2-[(1S)1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли приготовлен в форме для перорального введения. В еще одном аспекте 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли приготовлен в форме для местного введения, например интраназального или ингаляционного введения. Таблетки и капсулы для перорального введения могут содержать традиционные эксципиенты, такие как связывающие агенты, например сироп, аравийскую камедь, желатин, сорбит, трагакант, растительный клей из крахмала, целлюлозу или поливинилпирролидон; наполнители, например лактозу, микрокристаллическую целлюлозу, сахар, маисовый крахмал, фосфат кальция или сорбит; смазывающие вещества, например стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например картофельный крахмал, натрийкроскармелозу или крахмал-гликолят натрия; или смачивающие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой способами, общеизвестными в данной области. Пероральные жидкие препараты могут быть в форме, например, водных или масляных суспензий,растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбит сироп, метилцеллюлозу, глюкозный/сахарный сироп, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, стеарат алюминия в виде геля или гидрогенизированные пищевые жиры; эмульгирующие агенты,например лецитин, моноолеат сорбитана или аравийскую камедь; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, масляные эфиры, пропиленгликоль или этиловый спирт; или консерванты, например метил- или пропилпарагидроксибензоат или сорбиновую кислоту. Препараты могут также содержать буферные соли, корригирующие, окрашивающие и/или подслащивающие агенты (например маннит), если это целесообразно. Композиции для интраназального введения включают водные композиции, которые вводят в нос каплями или нагнетанием под давлением. Подходящие композиции содержат воду в качестве разбавителя или носителя для этой цели. Композиции для введения в легкое или нос могут содержать один или более эксципиентов, например один или более суспендирующих агентов, один или более консервантов,один или более поверхностно-активных веществ, один или более агентов, регулирующих тоничность,один или более сорастворителей, и могут содержать компоненты, регулирующие pH композиции, например буферную систему. Дополнительно композиции могут содержать другие эксципиенты, такие как антиоксиданты, например метабисульфит натрия, и агенты, маскирующие вкус. Композиции можно также вводить в нос или другие области дыхательных путей распылением. 6-Амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дитидро-8H-пурин-8-он в форме малеатной соли может иметь достаточную растворимость и стабильность для предоставления в виде композиции водного интраназального раствора. Интраназальные композиции могут обеспечивать доставку 6-амино-2-[(1S)-1-метилбутил]окси-9[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли во все участки носовых пазух (ткань-мишень), а также могут давать возможность активным соединениям оставаться в контакте с тканью-мишенью в течение длительных периодов времени. Подходящим для пациента режимом введения дозы интраназальной композиции может быть медленная ингаляция через нос после очистки носовой полости. Во время ингаляции композицию можно вводить в одну ноздрю, зажимая рукой другую. Эту процедуру затем можно повторить в отношении другой ноздри. Обычно вышеуказанным способом можно вводить по одному или двум впрыскиваниям в каждую ноздрю один, два или три раза в сутки, в идеале один раз в сутки. Особый интерес представляют интраназальные композиции, подходящие для введения один раз в сутки. Суспендирующий(ие) агент(ы), если он(и) включен(ы) в состав, в типичных случаях будет(ут) присутствовать в количестве от 0,1 до 5% (мас./мас.), например от 1,5 до 2,4% (мас./мас.), в расчете на общую массу композиции. Примеры фармацевтически приемлемых суспендирующих агентов включают,но ими не ограничены, Avicel (микрокристаллическая целлюлоза и натрийкарбоксиметилцеллюлоза),натрийкарбоксиметилцеллюлозу, вигум, трагакант, бентонит, метилцеллюлозу, ксантановую камедь,карбопол и полиэтиленгликоли. Композиции для введения в легкое или нос могут содержать один или более эксципиентов и могут быть защищены от заражения микробами или грибами и от их размножения путем включения в состав одного или более консервантов. Примеры фармацевтически приемлемых противомикробных агентов или консервантов включают, но ими не ограничены, четвертичные аммониевые соединения (например, хлорид бензалкония, хлорид бензетония, цетримид, хлорид цетилпиридиния, хлорид лауралкония и хлорид миристилпиколиния), ртутьсодержащие агенты (например, нитрат фенилртути, ацетат фенилртути и тимеросал), спиртовые агенты (например, хлорбутанол, фенилэтиловый спирт и бензиловый спирт), антибактериальные эфиры (например, эфиры пара-гидроксибензойной кислоты), хелатирующие агенты, такие как динатриевая соль этилендиаминтетрауксусной кислоты (EDTA), и другие противомикробные агенты, такие как хлоргексидин, хлоркрезол, сорбиновая кислота и ее соли (такие как сорбат калия) и полимиксин. Примеры фармацевтически приемлемых противогрибковых агентов или консервантов включают, но ими не ограничены, бензоат натрия, сорбиновую кислоту, пропионат натрия, метилпарабен, этилпарабен, пропилпарабен и бутилпарабен. Консервант(ы), если он(и) включен(ы) в состав, может(гут) присутствовать в количестве от 0,001 до 1% (мас./мас.), например от 0,015 до 0,5% (мас./мас.), в расчете на общую массу композиции. Композиции (например те, в которых по меньшей мере одно соединение находится в суспензии) могут содержать один или более поверхностно-активных веществ для облегчения растворения частиц лекарственного средства в водной фазе композиции. Например, используемое количество поверхностноактивного вещества представляет собой количество, которое не будет вызывать пенообразование во время смешивания. Примеры фармацевтически приемлемых поверхностно-активных веществ включают жирные спирты, сложные эфиры и простые эфиры, такие как полиоксиэтилен(20)сорбитана моноолеат(Polysorbate 80), простые эфиры макрогола и полоксамеры. Поверхностно-активное вещество может присутствовать в количестве от примерно 0,01 до 10% (мас./мас.), например от 0,01 до 0,75% (мас./мас.),например примерно 0,5% (мас./мас.), в расчете на общую массу композиции. Один или более агентов, регулирующих тоничность, могут быть включены в состав композиции для достижения тоничности с жидкостями организма, например жидкостями носовой полости, и, соответственно, для снижения степени раздражения. Примеры фармацевтически приемлемых агентов, регулирующих тоничность, включают, но ими не ограничены, хлорид натрия, декстрозу, ксилит, хлорид кальция, глюкозу, глицерин и сорбит. Агент, регулирующий тоничность, если он присутствует, может присутствовать в количестве от 0,1 до 10% (мас./мас.), например от 4,5 до 5,5% (мас./мас.), например примерно 5,0% (мас./мас.), в расчете на общую массу композиции. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть забуферен путем добавления подходящих буферных агентов, таких как цитрат натрия, лимонная кислота, трометамол, фосфаты, такие как динатрийфосфат (например додекагидрат, гептагидрат, дигидрат и безводные формы), или фосфат натрия и их смеси. Буферный агент, если он присутствует, может присутствовать в количестве от 0,1 до 5% (мас./мас.),например от 1 до 3% (мас./мас.), в расчете на общую массу композиции. Примеры агентов, маскирующих вкус, включают сукралозу, сахарозу, сахарин или его соль, фруктозу, декстрозу, глицерин, кукурузный сироп, аспартам, ацесульфам-К, ксилит, сорбит, эритритол, глицирризинат аммония, тауматин, неотам, маннит, ментол, эвкалиптовое масло, камфару, натуральный корригирующий агент, искусственный корригирующий агент и их комбинации. Один или более сорастворителей могут быть включены в состав композиции для повышения растворимости лекарственного(ых) соединения(ий) и/или других эксципиентов. Примеры фармацевтически приемлемых сорастворителей включают, но ими не ограничены, пропиленгликоль, дипропиленгликоль,этиленгликоль, глицерин, этанол, полиэтиленгликоли (например PEG300 или PEG400) и метанол. В одном воплощении сорастворитель представляет собой пропиленгликоль. Сорастворитель(и), если он(и) присутствует(ют), может(гут) присутствовать в количестве от 0,05 до 30% (мас./мас.), например от 1 до 25% (мас./мас.), например от 1 до 10% (мас./мас.), в расчете на общую массу композиции. Композиции для ингаляционного введения включают водные, органические или водноорганические смеси, сухие порошковые или кристаллические композиции, которые вводят в дыхательные пути с помощью нагнетателя или ингалятора, например с помощью ингалятора с резервуаром, содержащим сухой порошок, однодозовых сухих порошковых ингаляторов, дозирующих многодозовых сухих порошковых ингаляторов, назальных ингаляторов или аэрозольных ингаляторов, небулайзеров или инсуффляторов. Подходящие композиции содержат воду в качестве разбавителя или носителя для этой цели и могут быть представлены с традиционными эксципиентами, такими как буферные агенты,агенты, модифицирующие тоничность, и т.п. Водные композиции можно также вводить в нос и другие отделы дыхательных путей распылением. Такие композиции могут представлять собой водные растворы или суспензии или аэрозоли, доставляемые из упаковок под давлением, таких как дозирующий ингалятор, с использованием подходящего сжиженного пропеллента. Композиции для местного введения в нос (например, для лечения ринита) или в легкое включают аэрозольные композиции и водные композиции, доставляемые в полости носа с помощью нагнетателя. Композиции, которые не нагнетают под давлением и пригодны для местного введения в носовую полость, представляют особый интерес. Подходящие композиции содержат воду в качестве разбавителя или носителя для этой цели. Водные композиции для введения в легкое или нос могут быть приготовле-7 021048 ны с традиционными эксципиентами, такими буферные агенты, агенты, модифицирующие тоничность, и т.п. Водные композиции можно также вводить в нос распылением. Для доставки жидкой композиции в полости носа обычно может быть использован жидкостной дозатор. Жидкая композиция может быть водной или неводной, но обычно водной. Такой жидкостной дозатор может иметь дозирующее сопло или дозирующую насадку, через которое(ую) отмеренная доза жидкой композиции дозируется при нажатии пользователем на нагнетательный механизм жидкостного дозатора. Такие жидкостные дозаторы, как правило, снабжены резервуаром для многократных отмериваемых доз жидкой композиции, причем дозы дозируются при последовательных срабатываниях насоса. Дозирующее сопло или насадка могут иметь конфигурацию, подходящую для введения в полость носа. Жидкостной дозатор вышеупомянутого типа описан и проиллюстрирован в публикации международной патентной заявки WO 2005/044354 (Glaxo Group Limited). Дозатор имеет корпус, который содержит выпускающее жидкость устройство с нагнетательным насосом, установленным на контейнере, в котором находится жидкая композиция. Корпус имеет по меньшей мере один приводимый в действие пальцами боковой рычаг, который двигается внутрь относительно корпуса, перемещая контейнер вверх в корпусе посредством эксцентрика, заставляя насос сжимать и нагнетать отмеренную дозу композиции из ствола насоса через назальное сопло корпуса. В одном воплощении жидкостной дозатор представляет собой дозатор общего типа, проиллюстрированный на фиг. 30-40 в WO 2005/044354. Водные композиции,содержащие 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли, можно также доставлять с помощью насоса, как описано в публикации международной патентной заявки WO 2007/138084 (Glaxo Group Limited), например как описано в этом документе со ссылкой на фиг. 22-46, или как описано в заявке на патент Великобритании GB 0723418.0 (Glaxo Group Limited), например как описано в этом документе со ссылкой на фиг. 7-32. Насос может приводиться в действие пусковым механизмом, как изображено на фиг. 1-6 в GB 0723418.0. Сухие порошковые композиции для местной доставки в легкое ингаляцией могут находиться, например, в капсулах и картриджах, например из желатина, или в блистерах, например из ламинированной алюминиевой фольги, для использования в ингаляторе или инсуффляторе. Композиции в форме порошковых смесей обычно содержат порошковую смесь для ингаляции малеатной соли 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она и подходящей порошковой основы (вещества, являющегося носителем/разбавителем/эксципиентом), такой как моно-, ди- или полисахариды (например лактоза или крахмал). Помимо лекарственного средства и носителя сухие порошковые композиции могут также содержать дополнительный эксципиент (например третий агент, такой как сложный эфир сахара, например октаацетат целлобиозы, стеарат кальция или стеарат магния). В одном из воплощений композиция, подходящая для введения ингаляцией, может быть заключена во множестве герметичных дозовых контейнеров, которыми снабжена(ы) упаковка(и) лекарственного средства, вставленная(ые) внутрь подходящего ингаляционного устройства. Контейнеры могут быть разрываемыми, открываемыми путем снятия предохранительной пленки или иным образом вскрываемыми последовательно, и дозы сухой порошковой композиции могут быть введены ингаляцией из наконечника ингаляционного устройства, как известно в данной области. Упаковка лекарственного средства может принимать ряд различных форм, например форму диска или длинной полоски. Репрезентативными ингаляционными устройствами являются устройства DISKHALER и DISKUS, продаваемые фирмойGlaxoSmithKline. Сухая порошковая ингалируемая композиция может находиться в виде объемной массы в резервуаре в ингаляционном устройстве, которое снабжено дозирующим механизмом для отмеривания дозы композиции из резервуара в ингаляционный канал, откуда отмеренную дозу пациент может вдыхать из наконечника устройства. Примерами имеющихся в продаже устройств этого типа являются TURBUHALER (AstraZeneca), TWISTHALER (Schering) и CLICKHALER (Innovata.) Еще один способ доставки сухой порошковой ингалируемой композиции предназначен для отмеренных доз, которые находятся в капсулах (одна доза на капсулу), которые загружают в ингаляционное устройство, и обычно это делает пациент, когда это требуется. Устройство имеет средства для разрывания, прокалывания или иного открытия капсулы, чтобы доза могла поступить в легкие пациента, когда он вдыхает через наконечник устройства. В качестве примеров таких устройств, имеющихся в продаже,могут быть упомянуты ROTAHALER (GlaxoSmithKline) и HANDIHALER (Boehringer Ingelheim.). Аэрозольные композиции под давлением, подходящие для ингаляции, могут представлять собой либо суспензию, либо раствор и могут содержать 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли и подходящий пропеллент,такой как фторуглерод или водородсодержащий хлорфторуглерод или их смеси, в частности гидрофторалканы, особенно 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафтор-н-пропан или их смесь. Аэрозольная композиция возможно может содержать дополнительные эксципиенты композиции, общеизвестные в данной области, такие как поверхностно-активные вещества, например олеиновую кислоту, лецитин или олигомолочную кислоту или их производные, раскрытые, например, в WO 94/21229 и WO 98/34596(Minnesota Mining и Manufacturing Company), и сорастворители, например этанол. Композиции под давлением обычно находятся в закрытом баллончике (например, в алюминиевом баллончике) с клапаном(например дозирующим клапаном) и соответствующим пусковым механизмом с наконечником. Мази, кремы и гели могут быть приготовлены, например, с использованием водной или масляной основы с добавлением подходящего загущающего и/или гелеобразующего агента и/или растворителей. Такие основы могут включать, например, воду и/или масло, такое как вазелиновое масло или растительное масло, такое как арахисовое масло или касторовое масло, или растворитель, такой как полиэтиленгликоль. Загущающие агенты и гелеобразующие агенты, которые могут быть использованы в соответствии с природой основы, включают мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли, ланолин, пчелиный воск, производные карбоксиполиметилена и целлюлозы и/или глицерилмоностеарат и/или неионные эмульгирующие агенты. Лосьоны могут быть приготовлены с использованием водной или масляной основы и обычно будут содержать один или более эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов или загущающих агентов. Порошки для наружного применения могут быть приготовлены с использованием любой подходящей порошковой основы, например талька, лактозы или крахмала. Капли могут быть приготовлены с использованием водной или неводной основы, содержащей также один или более диспергирующих агентов, солюбилизирующих агентов, суспендирующих агентов или консервантов. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли могут быть, например, приготовлены для трансдермальной доставки путем включения в композицию пластыря или в другие устройства (например устройства со сжатым газом), которые доставляют активный компонент в кожу. Для трансбуккального введения композиции могут быть приготовлены в форме таблетки или облатки, изготовленной общепринятым способом. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также приготовлен в форме суппозиториев, содержащих, например,традиционные суппозиторные основы, такие как масло какао или другие глицериды. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также приготовлен для парентерального введения болюсной инъекцией или непрерывной инфузией и может быть представлен в стандартной лекарственной форме, например в ампулах, флаконах, инфузионных системах небольшого объема или предварительно заполненных шприцах, или в многодозовых контейнерах с добавлением консерванта. Композиции могут быть приготовлены в таких формах, как растворы, суспензии или эмульсии в водных или неводных носителях, и могут содержать рецептурные агенты, такие как антиоксиданты, буферные агенты, противомикробные агенты и/или агенты, регулирующие тоничность. Альтернативно, перед применением активный ингредиент может находиться в форме порошка для разведения подходящим носителем, например стерильной апирогенной водой. Сухая твердая форма может быть приготовлена путем асептического заполнения индивидуальных стерильных контейнеров стерильным порошком или путем асептического заполнения каждого контейнера стерильным раствором и сублимационной сушки. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также включен в составы вакцин в качестве адъюванта для модулирования их активности. Такие композиции могут содержать антитело(а) или фрагмент(ы) антител(а) или антигенный компонент, включая, без ограничения, белок, ДНК, живые или мертвые бактерии и/или вирусы или вирусоподобные частицы, вместе с одним или более компонентами с адъювантной активностью, включая, без ограничения, соли алюминия, масляные и водные эмульсии, белки температурного шока, препараты и производные липида А, гликолипиды, другие агонисты TLR, такие как CpG ДНК или подобные агенты, цитокины, такие как GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор) или IL-12 (интерлейкин 12) или подобные агенты. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли можно использовать сам по себе или в комбинации с другими терапевтическими агентами. 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8 он в форме малеатной соли и другой(ие) фармацевтически активный(е) агент(ы) можно вводить вместе или по отдельности, и при введении по отдельности введение можно проводить одновременно или последовательно в любом порядке. Количества 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в форме малеатной соли и другого(их) фармацевтически активного(ых) агента(ов) и относительные моменты времени введения выбирают так, чтобы достигался желаемый совместный терапевтический эффект. Введение комбинации 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в форме малеатной соли с другими терапевтическими агентами может быть совместным в единой фармацевтической композиции,содержащей оба соединения, или в отдельных фармацевтических композициях, каждая из которых содержит одно из соединений. Альтернативно, комбинацию можно вводить по отдельности последовательно, когда один терапевтический агент вводят первым, а другой - вторым или наоборот. Такое после-9 021048 довательное введение может быть близким по времени или удаленным по времени. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть использован в комбинации с одним или более агентами, полезными в предупреждении или лечении вирусных инфекций. Примеры таких агентов включают, без ограничения,ингибиторы полимеразы, раскрытые, например, в WO 2004/037818-А 1, а также в WO 2004/037818 и WO 2006/045613; JTK-003, JTK-019, NM-283, HCV-796, R-803, R1728, R1626, а также раскрытые в WO 2006/018725, WO 2004/074270, WO 2003/095441, US 2005/0176701, WO 2006/020082, WO 2005/080388,WO 2004/064925, WO 2004/065367, WO 2003/007945, WO 02/04425, WO 2005/014543, WO 2003/000254,EP 1065213, WO 01/47883, WO 2002/057287, WO 2002/057245, и подобные агенты; ингибиторы репликации, такие как ацикловир, фамцикловир, ганцикловир, цидофовир, ламивудин и подобные агенты; ингибиторы протеаз, например ингибиторы HIV-протеазы саквинавир, ритонавир, индинавир, нелфинавир,ампренавир, фосампренавир, бреканавир, атазанавир, трипанавир, палинавир, лазинавир и ингибиторыHCV-протеазы BILN2061, VX-950, SCH503034 и подобные агенты; нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы, такие как зидовудин, диданозин, ламивудин, залцитабин, абакавир,ставидин, адефовир, адефовир дипивоксил, фозивудин, тодоксил, эмтрицитабин, аловудин, амдоксовир,элвуцитабин и подобные агенты; ненуклеозидные ингибиторы обратной транскриптазы (включая агент,обладающий антиоксидантной активностью, такой как иммунокал, олтипраз и т.д.), такие как невипарин,делавирдин, эфавиренц, ловирид, иммунокал, олтипраз, каправирин, ТМС-278, ТМС-125, этравирин и подобные агенты; ингибиторы проникания, такие как энфувиртид (Т-20), Т-1249, PRO-542, PRO-140,TNX-355, BMS-806, 5-Helix и подобные агенты; ингибиторы интегразы, такие как L-870,180 и подобные агенты; ингибиторы почкования, такие как РА-344 и РА-457 и подобные агенты; ингибиторы хемокиновых рецепторов, такие как викривирок (Sch-C), Sch-D, ТАК 779, маравирок (UK-427,857), TAK449, а также те, которые раскрыты в WO 02/74769, WO 2004/054974, WO 2004/055012, WO 2004/055010, WO 2004/055016, WO 2004/055011 и WO 2004/054581, и подобные агенты; ингибиторы нейраминидазы, такие как CS-8958, занамивир, оселтамивир, перамивир и подобные агенты; блокаторы ионных каналов,такие как амантадин или римантадин и подобные агенты; и интерферирующая РНК и антисмысловые олигонуклеотиды и такие как ISIS-14803 и подобные агенты; противовирусные агенты с неустановленным механизмом действия, раскрытые, например, в WO 2005/105761, WO 2003/085375, WO 2006/122011,рибавирин и подобные агенты. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9 дигидро-8H-пурин-8-он в форме малеатной соли может быть также использован в комбинации с одним или более другими агентами, которые могут быть полезны в предупреждении или лечении вирусных инфекций, например в иммунных терапиях (например интерферон или другие цитокины/хемокины, модуляторы рецепторов цитокинов/хемокинов, агонисты или антагонисты цитокинов и подобные агенты); и терапевтические вакцины, антифибротические агенты, противовоспалительные агенты, такие как кортикостероиды или нестероидные противовоспалительные агенты (NSAID) и подобные агенты. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть использован в комбинации с одним или более другими агентами, которые могут быть полезны в предупреждении или лечении аллергического заболевания, воспалительного заболевания, аутоиммунного заболевания, например с антигенными иммунотерапевтическими средствами, антигистаминными средствами, стероидами, NSAID, бронходилататорами (например бета 2 агонистами, адренергическими агонистами, антихолинергическими агентами, теофиллином), метотрексатом, модуляторами лейкотриенов и подобными агентами; моноклональными антительными терапевтически средствами, такими как анти-IgE, анти-TNF, анти-IL-5, анти-IL-6, анти-IL-12, анти-IL-1 и подобными агентами; рецепторными терапевтическими средствами, например энтанерсептом и подобными агентами; антигенными неспецифическими иммунотерапевтическими средствами (например интерфероном или другими модуляторами цитокинов/хемокинов, цитокин/хемокиновых рецепторов, агонистами или антагонистами цитокинов, агонистами TLR и подобными агентами). 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть использован в комбинации с одним или более другими агентами, которые могут быть полезными в предупреждении или лечении рака, например химиотерапевтическими средствами, такими как алкилирующие агенты, ингибиторы топоизомеразы, антиметаболиты, антимитотические агенты, ингибиторы киназ и подобные агенты; моноклональными антительными терапевтическими средствами, такими как трастузумаб, гемтузумаб и другие подобные агенты; и гормональными терапевтическими агентами, такими как тамоксифен, госерелин и подобные агенты. Фармацевтические композиции по изобретению также могут быть использованы сами по себе или в комбинации по меньшей мере с одним другим терапевтическим агентом, применяемым в других терапевтических областях, например при желудочно-кишечных заболеваниях. Композиции по изобретению могут быть также использованы в комбинации с генной заместительной терапией. В еще одном аспекте изобретения предложена комбинация, содержащая 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли вместе с по меньшей мере одним другим терапевтически активным агентом. Вышеупомянутые комбинации для удобства могут быть предоставлены для применения в форме фармацевтической композиции, и, соответственно, фармацевтические композиции, содержащие комбинацию, как она определена выше, вместе по меньшей мере с одним фармацевтически приемлемым разбавителем или носителем составляют еще один аспект изобретения. Терапевтически эффективное количество малеатной соли 6-амино-2-[(1S)-1-метилбутил]окси-9[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она будет зависеть от целого ряда факторов. Например, вид, возраст и масса тела реципиента, точное состояние, требующее лечения, и его тяжесть, природа композиции и путь введения являются факторами, которые необходимо учитывать. Терапевтически эффективное количество окончательно будет определять лечащий врач. Тем не менее, эффективное количество малеатной соли 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9 дигидро-8H-пурин-8-она для лечения людей в болезненном состоянии будет составлять, как правило, от 0,0001 до 100 мг/кг массы тела реципиента в сутки. Обычно эффективное количество будет составлять от 0,001 до 10 мг/кг массы тела в сутки. Так, для взрослого человека с массой тела 70 кг реальное количество в сутки будет составлять обычно от 7 до 700 мг. Для интраназального и ингаляционного путей введения типичные дозы для взрослого человека с массой тела 70 кг будут составлять от 1 мкг до 1 мг в сутки. Это количество можно вводить в однократной суточной дозе или в многократных (например двух, трех,четырех, пяти или более) субдозах в течение суток, так чтобы суммарная суточная доза была той же. Подходящие дозировки должны соответствовать дозировкам для лечения других состояний, упомянутых здесь. 6-Амино-2-(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли можно также вводить с любой подходящей частотой, например 1-7 раз в неделю. Точный режим дозировки будет зависеть от таких факторов, как терапевтическое показание, возраст и состояние пациента, а также выбранный конкретный путь введения. Фармацевтические композиции могут быть представлены в стандартных лекарственных формах,содержащих предопределенное количество активного ингредиента на стандартную дозу. Такие стандартные дозы могут содержать, например, от 0,5 мг до 1 г малеатной соли 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в зависимости от состояния, которое лечат, пути введения и возраста, массы тела и состояния пациента. Предпочтительными композициями в стандартной лекарственной форме являются композиции, содержащие суточную дозу или субдозу, как указано выше, или ее соответствующую долю, активного ингредиента. Такие фармацевтические композиции могут быть получены способами, известными в области фармации. Таким образом, предложена также фармацевтическая композиция, содержащая 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли и один или более фармацевтически приемлемых разбавителей или носителей. Возможно фармацевтическая композиция может дополнительно содержать по меньшей мере один другой терапевтически активный агент. Предложен также способ приготовления такой фармацевтической композиции, включающий смешивание 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли с одним или более фармацевтически приемлемыми разбавителями или носителями. Предложен также способ получения малеатной соли 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она, включающий взаимодействие 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она с источником малеатного аниона (например с малеиновой кислотой, например в подходящем растворителе) с получением 6-амино 2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в форме малеатной соли. В одном из аспектов данный способ дает соотношение 1:1 малеатный анион:6-амино-2-[(1S)1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть получен по методологии, описанной здесь ниже. Сокращения Приведенный ниже список дает определения некоторых сокращений, использованных в данном описании. Разумеется, этот список не является исчерпывающим, но значение тех сокращений, которые не определены в данном списке, будут очевидны специалистам в данной области.DMSO - диметилсульфоксид ВЭЖХ - высокоэффективная жидкостная хроматография МНАП ВЭЖХ - масс-направленная автоматизированная препаративная ВЭЖХ с обращенными фазами на колонке C18 с использованием градиента двух растворителей и анализа фракций методом массспектроскопии с электрораспылительной ионизацией ТФЭ - твердофазная экстракция мин - минуты освобождали от легких компонентов - удаление растворителя при пониженном давленииBSA - N,O-бис(триметилсилил)ацетамид СРМЕ - циклопентилметиловый эфир ТВМЕ - трет-бутил-метиловый эфирDCM - дихлорметан Способ синтеза для получения 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]7,9-дигидро-8H-пурин-8-она и его малеатных солей представлен на схеме 1. Схема 1 Типичные реакционные условия для каждой стадии синтеза на схеме 1 приведены ниже: А Дигидропиран/пара-толуолсульфоновая кислота, например 50C в течение 3-6 ч. А 1 Дигидропиран/пара-толуолсульфоновая кислота, например 50C в течение 1 ч, затем аммиак/изопропанол, например 60C в течение 4 ч, затем добавление воды и охлаждение до температуры окружающей среды в течение 12-18 ч. А 2 BSA в ацетонитриле, дефлегмация, охлаждение до 0C, затем ацетат тетрагидропирана в ацетонитриле, нагревание до 10C, затем водный раствор гидрокарбоната натрия. В Аммиак/изопропанол, например 50C в течение 5 ч, затем температура окружающей среды в течение 12-18 ч, затем 50C в течение 9 ч.- 12021048 С Для Z = О, RA = C1-6 алкил: RAONa/бутанол/диметоксиэтан, например 93-110C в течение 12-18 ч. С 1 N-бромсукцинимид в дихлорметане, например 0-5C в течение 30 мин, затем температура окружающей среды в течение 0,5-1 ч, затем, например, метоксид натрия/метанол в атмосфере азота/6070C/12-18 ч, затем TFA/метанол, например температура окружающей среды в течение 18-65 ч.D N-бромсукцинимид в дихлорметане, например 0-5C в течение 30 мин, затем температура окружающей среды в течение 36-48 ч или N-бромсукцинимид в хлороформе при 5C в течение 4-6 ч. Е Метоксид натрия/метанол, например температура дефлегмации в течение 4-6 ч.F TFA/метанол, например температура окружающей среды в течение 18-65 ч, или TFA/метанол, например температура окружающей среды в течение 70-74 ч.G Карбонат калия/DMF, затем 50C в течение 1-1,5 ч, затем добавление (VI), перемешивание в течение 40 мин, затем добавление (IV)/триэтиламина, затем температура окружающей среды в течение 18 ч.G1 Карбонат калия/DMF, затем 50C в атмосфере азота в течение 30 мин, затем температура окружающей среды, добавление (VI), перемешивание в течение 20 ч.G2 Растворение в DMF с N,N'-диизопропилэтиламином, затем 50C в течение 48 ч, затем добавление еще (VI), затем еще 50C в течение 48 ч. Н Хлористый водород/метанол, затем температура окружающей среды в течение 18 ч. Соединения формул (IV), (VI), (XIA), (XII), (XIII), (XIV) и (XV) либо известны в литературе, либо коммерчески доступны, например от Sigma-Aldrich, UK, либо могут быть получены способами, аналогичными способам, описанным, например, в стандартных руководствах по методологии синтеза, таких как J. March, Advanced Organic Chemistry, 6th Edition (2007), WileyBlackwell, или Comprehensive OrganicSynthesis (Trost B.M. и Fleming I., (Eds.), Pergamon Press, 1991), каждое из которых включено в данное описание посредством ссылки как относящееся к таким способам. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли может быть также обычно получен в результате взаимодействия 6-амино-2-[(1S)1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она с источником малеатного аниона в подходящем растворителе, например изопропиловом спирте. Подходящим источником малеатного аниона является малеиновая кислота или соли малеиновой кислоты. Примеры других защитных групп, которые могут быть использованы в путях синтеза, описанных здесь, и способы их удаления можно найти в Т. W. Greene "Protective Groups in Organic Synthesis", 4thEdition, J. Wiley и Sons, 2006, который включен в данное описание посредством ссылки как относящийся к таким способам. Для любых описанных выше реакций или способов могут быть использованы обычные методы нагревания и охлаждения, например использование масляных бань с регулируемой температурой или нагревательных плиток с регулируемой температурой и бань лед/соль или бань лед/ацетон соответственно. Могут быть использованы общепринятые методы выделения, например экстракция из водных или неводных растворителей или в водные или неводные растворители. Могут быть использованы общепринятые методы сушки органических растворителей, растворов или экстрактов, такие как встряхивание с безводным сульфатом магния или безводным сульфатом натрия, или пропускание через гидрофобную фритту. Общепринятые методы очистки, например кристаллизация и хроматография, например хроматография на диоксиде кремния или хроматография с обращенными фазами, могут быть использованы, если это требуется. Кристаллизация может быть осуществлена с использованием обычных растворителей,таких как этилацетат, метанол, этанол или бутанол или их водные смеси. Понятно, что конкретные времена и температуры реакций обычно могут быть определены методами мониторинга протекания реакций, например методами тонкослойной хроматографии и ЖХ-МС (жидкостная хроматография/массспектрометрия). Если целесообразным является получение индивидуальных изомерных форм, то 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он может быть получен в виде индивидуальных изомеров с использованием общепринятых методик, таких как фракционная кристаллизация диастереоизомерных производных или хиральная высокоэффективная жидкостная хроматография(хиральная ВЭЖХ). Абсолютная стереохимия соединений может быть определена общепринятыми методами, такими как рентгеновская кристаллография. Общие подробности экспериментов Соединения названы с использованием программного обеспечения для присвоения химических названий ACD/Name PRO 6.02 от Advanced Chemistry Developments Inc., Toronto, Ontario, M5H2 л 3, Canada. Подробности экспериментов в отношении систем B-D для ЖХ-МС следующие: Система В. Колонка: 30 мм 4,6 мм в.д. (внутренний диаметр), 3,5 мкм Sunfire C18 Скорость потока: 3 мл/мин Температура: 30C Детектирование в УФ-диапазоне: от 210 до 350 нм Масс-спектр: снимали на масс-спектрометре в режиме электрораспылительной ионизации с попеременной регистрацией положительных и отрицательных ионов Система С. Колонка: 50 мм 2,1 мм в.д., 1,7 мкм Acquity UPLC ВЕН C18 Скорость потока: 1 мл/мин Температура: 40C Детектирование в УФ-диапазоне: от 210 до 350 нм Масс-спектр: снимали на масс-спектрометре в режиме электрораспылительной ионизации с попеременной регистрацией положительных и отрицательных ионов Система D. Колонка: 50 мм 4,6 мм в.д., 3,5 мкм XBridge C18 Скорость потока: 3 мл/мин Температура: 30C Детектирование в УФ-диапазоне: от 210 до 350 нм Масс-спектр: снимали на масс-спектрометре в режиме электрораспылительной ионизации с попеременной регистрацией положительных и отрицательных ионов Хроматографическую очистку обычно осуществляли с использованием предварительно упакованных силикагелевых картриджей. Flashmaster II представляет собой автоматизированную многопользовательскую флэш-хроматографическую систему, доступную от Argonaut Technologies Ltd, в которой используются одноразовые нормальнофазовые картриджи для твердофазной экстракции (ТФЭ) (от 2 до 100 г). Эта система обеспечивает четвертичное оперативное смешивание растворителей для осуществления градиентных методов. Образцы ставятся в очередь с использованием многофункционального программного обеспечения открытого доступа, которое управляет растворителями, скоростями потоков, профилем градиента и условиями сбора. Система снабжена УФ-детектором Knauer с переменной длиной волны и двумя коллекторами фракций Gilson FC204, обеспечивающими автоматизированную отсечку пиков, сбор и отслеживание данных. Удаление растворителей с использованием потока азота проводили при 30-40C на продувочной системе GreenHouse Blowdown, доступной от Radleys Discovery Technologies Saffron Walden, Essex, CB11 3AZ, UK. 1H ЯМР спектры снимали либо в CDCl3, либо в DMSO-d6 на спектрометре либо Bruker DPX 400,либо Bruker Avance DRX, либо Varian Unity 400, каждый из которых работает при 400 МГц. В качестве внутреннего стандарта использовали либо тетраметилсилан, либо остаточный протонированный растворитель при 7,25 м.д. (миллионные доли) для CDCl3 или 2,50 м.д. для DMSO-d6. Масс-направленную автоматизированную препаративную (МНАП) ВЭЖХ выполняли в условиях,приведенных ниже. В результате детектирования в УФ-диапазоне регистрировали усредненный сигнал длины волны от 210 до 350 нм, и масс-спектры снимали на масс-спектрометре в режиме электрораспылительной ионизации с попеременной регистрацией положительных и отрицательных ионов. Метод А. Метод А осуществляли на колонке XBridge C18 (типично 150 мм 19 мм в.д., диаметр частиц наполнителя 5 мкм) при температуре окружающей среды. Используемыми растворителями были: А = 10 мМ водный бикарбонат аммония, доведенный до pH 10 раствором аммиака. В = ацетонитрил. Промежуточные соединения. Промежуточное соединение 1. 2,6-Дихлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин(260 мл), затем лара-толуолсульфоновую кислоту (0,253 г). Эту смесь нагревали до 50C и затем добавляли 3,4-дигидро-2H-пиран (16,8 г) (коммерчески доступен, например, от Aldrich). Реакционную смесь затем нагревали при 50C в течение 4 ч. Реакционную смесь упаривали в вакууме с получением указанного в заголовке соединения в виде желтого твердого вещества (36,9 г). 1 Н ЯМР (CDCl3): 8,35 (1 Н, s), 5,77 (1 Н, dd), 4,20 (1 Н, m), 3,79 (1 Н, m), 2,20-1,65 (6 Н, m). Промежуточное соединение 1 А. Уксусную кислоту (1,2 л, 1 экв.) и пара-толуолсульфонат пиридиния (530 г, 0,1 экв.) растворяли в дихлорметане (6 л). Раствор охлаждали до 0C. Осторожно загружали раствор дигидропирана (2,52 л,1,35 экв.) в дихлорметане (2,5 л) в течение по меньшей мере 15 мин, поддерживая температуру ниже 5C. Сразу после окончания добавления раствор нагревали до 20C и энергично перемешивали в течение ночи. Загружали воду (5,0 л) и полученную двухфазную смесь энергично перемешивали, а затем водный слой удаляли. Органическую фазу затем промывали насыщенным раствором бикарбоната натрия (5,0 л) и сушили над сульфатом магния. Высушенные органические фазы концентрировали на роторном испарителе, снижая давление до 20 мбар при 50C для обеспечения удаления DCM и избытка дигидропирана. Продукт получили в виде бесцветной/светло-желтой жидкости (2,61 кг, выход 95% от теоретического). Промежуточное соединение 2. 2-Хлор-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-6-амин 2,6-Дихлор-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин (36,9 г) (например, полученный как промежуточное соединение 1) нагревали с 2 М раствором аммиака в изопропаноле (250 мл) при 50C в течение 5 ч. После выдерживания при температуре окружающей среды в течение ночи дополнительное количество 2 М раствора аммиака в изопропаноле (100 мл) добавляли для диспергирования образовавшегося осадка,и реакционную смесь нагревали в течение еще 9 ч до завершения реакции. В реакционную смесь добавляли воду (70 мл) и желтое твердое вещество отфильтровывали. Это твердое вещество промывали смесью изопропиловый спирт:вода (5:1 (об./об.), 60 мл) и затем сушили на воздухе под разрежением с получением первой порции. После выдержки в течение ночи фильтрат снова фильтровали с выделением осадка, и обе порции твердого вещества сушили в вакууме. Первая порция была чистой, а вещество второй порции имело очень незначительное количество примесей (выделенный широкий сигнал 3,5 м.д. не виден в первой порции), но в остальном был идентичен. Первая порция твердого вещества 28,4 г, вторая порция твердого вещества 3,42 г. 1 Н ЯМР (CDCl3): 8,01 (1 Н, s), 5,98 (2 Н, уширенный s), 5,70 (1 Н, dd), 4,16 (1 Н, m), 3,78 (1 Н, m), 2,151,60 (6 Н, перекрывающийся m). Промежуточное соединение 2 (альтернативный способ). 2-Хлор-9-(тетрагидро-2 Н-пиран-2-ил)-9Hпурин-6-амин К раствору 2,6-дихлорпурина (25 г) (коммерчески доступен, например, от Aldrich) в сухом этилацетате (200 мл) добавляли моногидрат пара-толуолсульфоновой кислоты (235 мг) (коммерчески доступен,например, от Aldrich). Эту реакционную смесь нагревали до 50C и одной порцией добавляли 3,4 дигидро-2 Н-пиран (18,1 мл) (коммерчески доступен, например, от Aldrich). Реакционную смесь перемешивали при 50C в течение 1 ч и растворитель удаляли при пониженном давлении. В результате получили желтое твердое вещество. Суспензию этого твердого вещества (36 г) в 2,0 М растворе аммиака в изопропаноле (460 мл) нагревали в атмосфере азота при 60C в течение 4 ч с подсоединенным конденсатором. Реакционную смесь вливали в воду (50 мл) и оставляли охлаждаться в течение ночи. Осадок отфильтровывали и сушили на роторном испарителе (60C) в течение 30 мин с получением указанного в заголовке соединения в виде не совсем белого твердого вещества, 31 г (93%, 2 стадии). МС (масс-спектрометрия): вычислено для (C10H12ClN5O)+ = 254, 256 МС: найдено (электрораспыление): (М)+ = 254, 256 (3:1) 1 Н ЯМР CD3)2SO):8,43 (1 Н, s), 7,82 (2 Н, s), 5,55 (1 Н, dd), 4,00 (1 Н, гл), 3,69 (1 Н, m), 2,21 (1 Н, m),1,95 (2 Н, m), 1,74 (1 Н, m), 1,56 (2 Н, m). Промежуточное соединение 3. 2-Фтор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-аминN,O-бис(триметилсилил)ацетамид (975 мл, 3,988 моль) добавляли к перемешиваемой суспензии 2 фтор-1H-пурин-6-амина (200 г, 1,306 ммоль) (коммерчески доступен, например, от AlliedSignal) в безводном ацетонитриле (4 л) в контролируемом лабораторном реакторе на 10 л и полученную смесь нагревали до температуры дефлегмации и выдерживали при этой температуре в течение 2 ч. Циркуляционное устройство затем перепрограммировали и реакционную смесь охлаждали до 0C. Затем медленно через капельную воронку добавляли раствор тетрагидропиранилацетата (его получение описано в TetrahedronLetters, 2006, 47(27), 4741, а также описано как промежуточное соединение 1 А) (282 г, 1,959 моль) в безводном ацетонитриле (500 мл) и затем по каплям через капельную воронку добавляли триметилсилилтрифторметансульфонат (283 мл, 1,567 моль). Никакой значительной экзотермии не наблюдалось. Температуру циркуляционного устройства устанавливали на 10C и поддерживали перемешивание еще в течение 1 ч. Смесь затем гасили добавлением 1 М раствора карбоната натрия (4 л). Наблюдалось образование твердого осадка. Осуществляли проверку pH, который должен быть щелочным. В суспензию (1 л) добавляли дополнительное количество воды, и при стоянии слои разделились, причем водный слой содержал значительное количество твердых неорганических веществ. Большую часть водного слоя и неорганических твердых веществ отделяли. Органический слой, который все еще содержал значительное количество неорганических веществ, охлаждали до 0C при перемешивании для способствования дополнительному осаждению. Твердое вещество собирали фильтрованием и фильтр промывали очень хорошо водой, а затем сушили в вакууме при 40C в течение ночи с получением указанного в заголовке соединения в виде твердого вещества кремового цвета (152,8 г). ЖХ-МС (Система D): tRET = 1,71 мин; МН+ = 238. Промежуточное соединение 4. 2-[(1S)-1-Метилбутил]окси-9-(тетрагидро-2H-пиран-2-ил)-9 Нпурин-6-амин Метод А. трет-Бутоксид натрия (48,5 г, 505 ммоль) добавляли порциями к (S)-2-пентанолу (185 мл) (коммерчески доступен, например, от Julich Chiral Solutions) при комнатной температуре, перемешивали до гомогенного состояния (внимание: реакция является экзотермической). Добавляли 2-хлор-9-(тетрагидро-2Hпиран-2-ил)-9 Н-пурин-6-амин (32 г, 126 ммоль) (например, полученный как промежуточное соединение 2), реакционную смесь нагревали при 70C в течение 72 ч. Реакционную смесь охлаждали до комнатной температуры и распределяли между этилацетатом (500 мл) и водой (500 мл). Органическую фазу промывали насыщенным раствором хлорида натрия (100 мл), сушили (MgSO4), фильтровали и упаривали. Остаток растирали с диэтиловым эфиром и твердое вещество отфильтровывали. Осадок снова промывали диэтиловым эфиром, и фильтраты объединяли и упаривали. Неочищенное вещество (приблизительно 30 г) растворяли в смеси DMSO:метанол (1:1) и очищали хроматографией на колонке с обращенными фазами (C18) (330 г), используя градиент 25-65% ацетонитрил (+ 0,1%TFA)-вода(+ 0,1%TFA) за 8 колоночных объемов, и фракции немедленно нейтрализовали насыщенным водным раствором карбоната натрия. Соответствующие фракции объединяли и распределяли между дихлорметаном и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу сушили пропусканием через гидрофобную фритту,фильтровали и упаривали с получением указанного в заголовке соединения в виде бледно-кремовой пены (14,97 г). ЖХ-МС (Система В): tRET = 2,21 мин; МН+ 306. Метод В. трет-Бутоксид натрия (206 г, 2,144 моль) добавляли к (S)-2-пентанолу (720 мл, 6,58 моль) (коммерчески доступен, например, от Julich Chiral Solutions) в круглодонной колбе на 2 л. Эту смесь перемешивали при 50C до тех пор, пока весь трет-бутоксид натрия не растворился. 2-Фтор-9-(тетрагидро-2Hпиран-2-ил)-9H-пурин-6-амин (например, полученный как промежуточное соединение 3) (130 г, 548 ммоль) затем добавляли порциями в течение 5 мин. Через 3 ч ЖХ-МС анализ показал полное расходование исходного вещества и смесь вливали в лед/воду (3 л), а затем экстрагировали метил-трет-бутиловым эфиром. Это привело к образованию эмульсии и смесь фильтровали через Celite, и органическую фазу отделяли. Водный слой затем обрабатывали твердым NaCl и затем снова экстрагировали метил-третбутиловым эфиром. Органические экстракты объединяли и промывали рассолом, сушили над сульфатом магния, фильтровали и затем упаривали с получением указанного в заголовке соединения в виде бледнокоричневой смолы (158,59 г). ЖХ-МС (Система D): tRET = 2,65 мин; МН+ 306. Промежуточное соединение 5. 8-Бром-2-[(1S)-1-метилбутил]окси-9-(тетрагидро-2 Н-пиран-2-ил)9 Н-пурин-6-аминN-Бромсукцинимид (12,16 г, 68,3 ммоль) добавляли порциями в течение 5 мин к перемешиваемому раствору 2-[(1S)-1-метилбутил]окси-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-6-амина (14,9 г, 48,8 ммоль) (например, промежуточное соединение 4) в хлороформе (80 мл) при температуре ниже 5C в атмосфере азота. Реакционную смесь перемешивали при температуре ниже 5C в течение 5 ч, затем промывали насыщенным раствором гидрокарбоната натрия (80 мл), затем водой (80 мл). Пену растворяли в дихлорметане (50 мл) и промывали водой (50 мл), затем рассолом (50 мл). Объединенные водные фазы промывали дихлорметаном (50 мл). Объединенные органические слои сушили пропусканием через гидрофобную фритту и растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде оранжевой пены (18,5 г). ЖХ-МС (Система D): tRET = 3,06 мин; МН+ 384/386. Промежуточное соединение 5 (альтернативный способ). 8-Бром-2-[1S)-1-метилбутил]окси-9(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-аминDCM (10,5 л) до образования желтого/оранжевого раствора, который охлаждали до 0C. NБромсукцинимид (922 г, 1,5 экв.) загружали 3 равными порциями с интервалом 20 мин и полученную реакционную смесь перемешивали при 0-5C в течение 4 ч. Реакционную смесь затем гасили добавлением раствора 500 г пентагидрата тиосульфата натрия 5,0 л воды. Полученную двухфазную смесь тщатель- 17021048 но перемешивали при 20C и затем фазы разделяли. Органические фазы снова промывали раствором 500 г пентагидрата тиосульфата натрия 5,0 л воды, затем 500 г дикалийфосфата в 5,0 л воды и в конце 5,0 л воды. Органическую фазу сушили над сульфатом магния (822 г) и упаривали на роторном испарителе до прекращения пенообразования. Затем производили замену растворителя в смеси на метанол путем неоднократного добавления и удаления метанола до тех пор, пока DCM не был удален (что подтверждено ЯМР). Продукт получили в виде красно-коричневой смолы, содержащей захваченный растворитель (1,28 кг, скорректировано с учетом растворителя, выход 96% от теоретического выход). Промежуточное соединение 6. 2-[(1S)-1-Метилбутил]окси-8-(метилокси)-9-(тетрагидро-2 Нпиран-2-ил)-9H-пурин-6-амин(например,промежуточное соединение 5) (7,1 г, 18,48 ммоль) растворяли в безводном метаноле (70 мл) и по каплям в атмосфере азота добавляли раствор метоксида натрия (25%) в метаноле (8 мл). Раствор нагревали до дефлегмации при 90C в течение 4 ч в атмосфере азота. Добавляли дополнительное количество метоксида натрия в метаноле (25% раствор, 3 мл) и реакционную смесь перемешивали при 60C в течение еще 16 ч. Добавляли дополнительную порцию метоксида натрия в метаноле (25% раствор, 5 мл) и реакционную смесь перемешивали при 90C в течение еще 7 ч. Растворитель удаляли на роторном испарителе и неочищенный продукт распределяли между этилацетатом (75 мл) и насыщенным раствором хлорида аммония (75 мл). Органический слой промывали рассолом (75 мл). Растворитель удаляли на роторном испарителе с получением указанного в заголовке соединения в виде бледно-оранжевой пены (6 г). ЖХ-МС (Система С): tRET =1,14 мин; МН+ 336, 337. Промежуточное соединение 7. 2-([(1S)-1-Метилбутил]окси)-8-(метилокси)-9H-пурин-6-амин, трифторацетатная соль 2-[(1S)-1-Метилбутил]окси-8-(метилокси)-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-6-амин (6 г,17,89 ммоль) (например, промежуточное соединение 6) растворяли в метаноле (50 мл). По каплям добавляли трифторуксусную кислоту (20,67 мл, 268 ммоль) и смесь перемешивали при 20C в течение 72 ч в атмосфере азота. Растворитель удаляли в вакууме и полученное твердое вещество промывали этилацетатом и фильтровали. Фильтрат освобождали от легких компонентов и остаток промывали этилацетатом. Объединенные твердые остатки сушили в вакуумном шкафу в течение 2 ч с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (5,3 г). ЖХ-МС (Система С): tRET = 0,76 мин; МН+ 252, 253. Промежуточное соединение 7 (альтернативный способ). 2-[(1S)-1-Метилбутил]окси-8(метилокси)-9 Н-пурин-6-амин, трифторацетатная соль 8-Бром-2-[(1S)-1-метилбутил]окси-9-(тетрагидро-2 Н-пиран-2-ил)-9H-пурин-6-амин(MeTHF) (11,4 л) и добавляли 25% метоксид натрия в метаноле (2,65 л, 3,5 экв.). Полученную реакционную смесь нагревали до 65 +/-5C в течение 3 ч. По окончании реакции смесь охлаждали до комнатной температуры и промывали 20% мас./об. раствором хлорида аммония (26,3 л) и рассолом (6,3 л). Органическую фазу сушили над MgSO4 (1,8 кг) и фильтровали, промывая MeTHF (6,3 л). Объединенные органические фазы упаривали до 6,3 л вакуумной дистилляцией. Добавляли МеОН (2,5 л) и TFA (1,26 л, 5 экв.) и смесь нагревали до 60C в течение 1,5 ч. Добавляли циклопентил-метиловый эфир (СРМЕ) (6,3 л) и смесь уменьшали в объеме до 6,3 л вакуумной дистилляцией. Снова добавляли СРМЕ (6,3 л) и реакционную смесь концентрировали до 6,3 л, при этом твердое вещество выпадало в осадок. Суспензию охлаждали до 10C, затем выдерживали в течение 30 мин. Продукт фильтровали и промывали ТВМЕ (2 3,8 л) и сушили в вакууме при 40C с получением белого твердого вещества (886 г, выход 74% от теоретического). Промежуточное соединение 8. 9-(5-Хлорпентил)-2-[(1S)-1-метилбутил]окси-8-(метилокси)-9 Нпурин-6-амин Трифторацетатную соль 2-[(1S)-1-метилбутил]окси-8-(метилокси)-9H-пурин-6-амина (600 мг,1,642 ммоль) (например, полученную как промежуточное соединение 7) и карбонат калия (567 мг, 4,11 ммоль) перемешивали при 60C в DMF (10 мл) в течение 1 ч в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, добавляли 1-бром-5-хлорпентан (коммерчески доступен, например,от Aldrich) (0,216 мл, 1,642 ммоль) и триэтиламин (0,343 мл, 2,464 ммоль) и эту смесь перемешивали при 20C в атмосфере азота в течение 16 ч. Смесь затем разбавляли водой (10 мл) и рассолом (10 мл) и экстрагировали дихлорметаном (210 мл). Объединенные органические экстракты упаривали, остаток растворяли в дихлорметане и очищали колоночной хроматографией с использованием Flashmaster II (аминопропильный картридж 70 г) с градиентом 0-100% этилацетата в циклогексане за 40 мин. Соответствующие фракции объединяли и упаривали в вакууме с получением указанного в заголовке соединения в виде желтой смолы (430 мг). ЖХ-МС (Система D): tRET = 4,15 мин; МН+ = 356, 358. Промежуточное соединение 8 (альтернативный способ, в виде соли с серной кислотой). 9-(5 Хлорпентил)-2[(1S)-1-метилбутил]окси-8-(метилокси)-9 Н-пурин-6-амин, соль с серной кислотой Гидроксид натрия (2 М, 2,52 л, 2,3 экв.) добавляли к раствору трифторацетатной соли 2-[(1S)-1 метилбутил]окси-8-(метилокси)-9 Н-пурин-6-амина (800 г, 1,0 экв.) в NMP (3,08 л). Добавляли 1-бром-5 хлорпентан (432 мл, 1,5 экв.). Реакционную смесь нагревали до 50C в течение 6 ч. Реакционную смесь охлаждали до 20-25C . Добавляли этилацетат (8,0 л), затем воду (1,6 л). После перемешивания в течение 10 мин фазы разделяли и органическую фазу затем промывали водой (1,6 л). Этилацетатную фазу дополнительно разбавляли этилацетатом (4,0 л) и нагревали до 50C. Добавляли по каплям серную кислоту(117 мл, 1 экв.). Реакционную смесь охлаждали до 10C в течение 1,5 ч и выдерживали в течение получаса. Продукт выделяли фильтрованием в виде белого твердого вещества, промывали на фильтре этилацетатом (2,4 л) и сушили при пониженном давлении при 40C (570 г, выход 57% от теоретического). Промежуточное соединение 9. 2-[(1S)-1-Метилбутил]окси-8-(метилокси)-9-[5-(1-пиперидинил)пентил]-9 Н-пурин-6-амин 9-(5-Хлорпентил)-2-[(1S)-1-метилбутил]окси-8-(метилокси)-9 Н-пурин-6-амин (например, полученный как промежуточное соединение 8) (80 мг, 0,225 ммоль), триэтиламин (0,031 мл, 0,225 ммоль) и пиперидин (0,045 мл, 0,45 ммоль) суспендировали в DMF (3 мл) и смесь нагревали до 70C в течение 18 ч. Растворитель удаляли, и остаток распределяли между дихлорметаном (4 мл) и насыщенным раствором бикарбоната натрия (4 мл). Водную фазу снова экстрагировали дихлорметаном, и объединенные органические экстракты концентрировали, и остаток растворяли в смеси 1:1 метанол:DMSO (1 мл) и очищалиMDAP (Метод А). Фракции, содержащие продукт, объединяли и упаривали в потоке азота с получением указанного в заголовке соединения (47,2 мг). ЖХ-МС (Система D ): tRET = 3,11 мин; МН+ = 405. Примеры Сравнительный пример 1. 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9 дигидро-8H-пурин-8-он Раствор хлористого водорода в диоксане (4 М, 0,71 мл) добавляли к раствору 2-[(1S)-1 метилбутил]окси-8-(метилокси)-9-[5-(1-пиперидинил)пентил]-9 Н-пурин-6-амина (например, полученного как промежуточное соединение 9) (0,046 г, 0,126 ммоль) в метаноле (3 мл). Полученную смесь оставляли стоять в течение ночи при комнатной температуре и затем продували азотом. Остаток растворяли в метаноле и наносили на аминопропильный ТФЭ картридж 2 г (предварительно кондиционированный метанолом), элюировали метанолом и полученный раствор продували азотом с получением указанного в заголовке соединения в виде желтого твердого вещества (40,97 мг). ЖХ-МС (Система D): tRET = 2,70 мин; МН+ = 391. Аналогичным образом полученный образец (1,7 г) подвергали перекристаллизации из этилацетата(приблизительно 50 мл). Кристаллы собирали, промывали ледяным этилацетатом (15 мл) и сушили в вакууме при 50C в течение 3 ч с получением указанного в заголовке соединения в виде кремового кристаллического твердого вещества (1,33 г). Точка начала плавления (ДСК): 207,4C (см. фиг. 2). ДРЛП: (см. фиг. 1 и табл. 1). Сравнительный пример 1. (альтернативный способ). 6-Амино-2-[(1S)-1-метилбутил]окси)-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он 9-(5-Хлорпентил)-2-[(1S)-1-метилбутил]окси-8-(метилокси)-9H-пурин-6-амин, соль с серной кислотой (254 г, 1,0 экв.) растворяли в DMSO (1,27 л) и пиперидине (280 мл, 5 экв.). Реакционную смесь нагревали до 703C в течение 15,5 ч. Реакционную смесь охлаждали до 203C. Добавляли толуол (2,5 л), затем воду (1,25 л). После перемешивания в течение 10 мин фазы разделяли и верхнюю толуольную фазу промывали водой (0,5 л). Добавляли раствор соляной кислоты (2,24 моль) в воде (1,5 л). Смесь перемешивали в течение 10 мин и затем фазы разделяли и оставляли нижнюю (водную) фазу. Этот водный раствор нагревали до 503C в течение 17 ч и затем охлаждали до 203C. Водный раствор гидроксида натрия (2 М, приблизительно 840 мл) добавляли по каплям до тех пор, пока pH раствора не достигало значения 10-11. Полученную суспензию охлаждали до 103C, выдерживали в течение еще 30 мин, затем фильтровали. Осадок на фильтре промывали водой (7,6 л) и продукт сушили при пониженном давлении при 60 С, продувая азотом, до постоянной массы (207 г, 95% от теор.). Полиморфизм Дифракцию рентгеновских лучей на порошке (ДРЛП) и дифференциальную сканирующую калориметрию(ДСК) 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Hпурин-8-она выполняли в соответствии со описанными ниже методами. ДРЛП Данные ДРЛП получали на порошковом дифрактометре PANalytical X'Pert Pro с детектором X'Celerator. Условия получения данных были следующие: излучение: Сu K, напряжение генератора: 40 кВ,ток генератора: 45 мА, начальный угол: 2,0 2, конечный угол: 40,0 2, шаг: 0,01672; время на шаг: 31,750 с. Образец подготавливали, размещая несколько миллиграммов образца на кремниевой пластине(нулевой фон) в виде тонкого слоя порошка. Положения характерных пиков и вычисленные межплоскостные расстояния d приведены в табл. 1. Они были вычислены из исходных данных с использованием программы Highscore. Экспериментальная погрешность в положениях пиков составляет приблизительно 0,12. Относительные интенсивности пиков будут варьировать в зависимости от предпочтительной ориентации. Таблица 1. Положения характерных пиков ДРЛП для твердотельной формы 1 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она Репрезентативная ДРЛП дифрактограмма 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она представлена на фиг. 1. ДСК ДСК-термограмму получали с использованием калориметра ТА Instruments. Образец отвешивали в алюминиевую кювету, сверху на кювету помещали крышку и слегка загибали кромку, не закрывая кювету герметично. Эксперимент проводили при скорости нагревания 10Cмин-1. Репрезентативная ДСК-термограмма 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он представлена на фиг. 2. Пример 2. 6-Амино-2-[(1S)-1-метилбутил]окси)-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Hпурин-8-он, малеатная соль(полученный например, как описано в сравнительном примере 1) (0,384 г, 0,98 ммоль) растворяли в изопропиловом спирте (4,6 мл, 12 об.) и нагревали до 40C. Добавляли малеиновую кислоту (0,114 г, 0,98 ммоль). Получили прозрачный раствор. Во время охлаждения до комнатной температуры происходило осаждение. Суспензию фильтровали, промывая изопропиловым спиртом (5 мл) и сушили при пониженном давлении при 40C до постоянной массы. 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил) пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли (0,305 г, 61% от теор.) был получен в виде белого твердого вещества. 1 Н ЯМР подтверждает соотношение 1:1 малеиновая кислота:6-амино-2-[(1S)-1-метилбутил]окси 9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он. 1 Н ЯМР (400 МГц, DMSO-d6)м.д., 9,85 (1 Н,s, (CH2)3NHCO), 8,85 (1 Н, br s, NH+), 6,39 (2H, s, NH2), 6,02 (2H, s, HO2C(CH)2), 5,00 (1H, m, J = 6,2 Гц,СН 3 СН), 3,68 (2H, t, J = 6,8, Гц NCH2), 3,40 (2H, m, NCH2), 2,98 (2H, m, J = 8,1 Гц NCH2), 2,82 (2H, brs,NCH2), 1,85-1,24 (16H, m, 8CH2), 1,21 (3H, d, J = 6,1 Гц, CHCH3), 0,89 (3H, t, J = 7,3 Гц, CH2CH3), 2,5(растворитель (DMSO. Получение 2. Раствор 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин 8-она (полученного, например, как описано в сравнительном примере 1) (1,46 г, 3,74 ммоль) в изопропиловом спирте (14,6 мл, 10 об.) осветляли (фильтровали при комнатной температуре через картридж Bon- 21021048dElut) и затем нагревали до приблизительно 50 С. Добавляли раствор малеиновой кислоты (0,434 г, 3,74 ммоль) в изопропиловом спирте (2,9 мл, 2 об.). В полученный раствор затем вносили затравку и охлаждали до 45C. Дополнительно добавляли затравку. Полученную суспензию охлаждали до комнатной температуры и выдерживали в течение ночи (приблизительно 16 ч), затем охлаждали в бане лед/вода в течение 30 мин. Суспензию фильтровали, промывая изопропиловым спиртом (4,5 мл, 3 об., и затем 3 мл,2 об.). Продукт сушили при пониженном давлении при 40C до постоянной массы с получением 6 амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил) пентил]-7,9-дигидро-8H-пурин-8-она, малеатной соли (1,305 г, 69% от теор.). Анализ ДРЛП (фиг. 3) показал, что этот образец является кристаллическим. Биологические данные Соединение сравнительного примера 1 тестировали на биологическую активность in vitro в соответствии с описанными ниже анализами или подобными анализами. Анализ на индуцирование интерферона- с использованием криоконсервированных человеческих мононуклеарных клеток периферической крови (РВМС) Подготовка соединения Соединение сравнительного примера 1 растворяли в DMSO. Готовили последовательные 2-кратные разведения в DMSO и по 0,25 мкл дозировали в 384-луночные прозрачные полипропиленовые планшетыGreiner. Получение РВМС Образцы крови до 200 мл брали у здоровых доноров-людей. Цельную кровь в объемах 25 мл наносили на 15 мл Ficoll в градиенте плотности в пробирках Leucosep и центрифугировали при 1000 g в течение 20 мин. Клетки из слоя между плазмой и Histopaque осторожно извлекали и промывали дважды PBS(забуференный фосфатами физиологический раствор) (центрифугировали при 400 g в течение 5 мин для сбора). Конечный осадок ресуспендировали в среде для замораживания (90% сыворотки, инактивированной нагреванием, 10% DMSO) до концентрации клеток 4107 клеток/мл. Ресуспендированные клетки затем криоконсервировали (замораживали) в морозильной камере с контролируемой скоростью и хранили при -140C в течение вплоть до 4 месяцев. Инкубация и анализ на интерферон Непосредственно перед анализом виалы с криоконсервированными (замороженными) РВМС быстро оттаивали в водяной бане при 37C . Готовили разведение 1:10 клеток в трипановом синем и анализировали. РВМС затем разводили в ростовой среде [RPMI 1640, содержащая 10% фетальной телячьей сыворотки (Invitrogen), пенициллин + стрептавидин (Gibco, каталожный 25030-024, 1:50), L-глутамин 2 мМ и рекомбинантный человеческий IFN-гамма 1000 ед./мл (Preprotech, каталожный 300-02)] до плотности 1106 клеток/мл, и 50 мкл/лунку вносили в 384-луночные прозрачные полипропиленовые планшеты Greiner, содержащие 0,25 мкл DMSO или тестируемое соединение в 0,25 мкл DMSO. Высшая конечная концентрация соединения обычно составляла 50 мкМ или 5 мкМ (для получения кривой для высокоактивных соединений). Планшеты инкубировали в течение 24 ч при 37C в атмосфере с 5% СО 2. Мультиизоформный иммуноанализ использовали для определения количества IFN- в супернатантах РВМС. Кроличье поликлональное антитело против человеческого IFN- (каталожный 31101,Stratech Scientific) разводили в соотношении 1:10000 в буфере для анализа (среда RPMI 1640, содержащая 10% фетальной телячьей сыворотки, Invitrogen) и добавляли по 20 мкл в каждую лунку 384 луночного планшета MSD (Meso-Scale Discovery) Single Small Spot GAR (покрытого козьими антикроличьими антителами). Планшет инкубировали в течение 1 ч при комнатной температуре при энергичном встряхивании. После трех промывок PBS в каждую лунку планшета добавляли по 20 мкл клеточного супернатанта. Планшет затем инкубировали в течение 1 ч при комнатной температуре при энергичном встряхивании. Пару моноклональных антител к IFN- (каталожные 21100 и 21112, StratechScientific) метили сульфо-TAG (MSD), разводили в соотношении 1:1000 в буфере для анализа и по 20 мкл добавляли в каждую лунку планшета. Планшет дополнительно инкубировали в течение 1 ч при комнатной температуре при энергичном встряхивании. После трех промывок PBS в каждую лунку добавляли по 30 мкл 2 Т буфера (MSD) и планшет считывали на планшет-ридере MSD Sector 6000. Данные приводили к внутренним контролям для планшетов 1 мкМ резиквимод (n=16) и DMSO(n=16). Значения рЕС 50 получали путем аппроксимации 4-параметрической кривой с использованиемIRLS в ActivityBase, из 11 точек для последовательных двукратных разведений тестируемых соединений. Результаты Было показано, что соединение сравнительного примера 1 имеет среднее значение pEC508,3 Анализ на индуцирование интерферона- и TNF- с использованием свежих человеческих моно нуклеарных клеток периферической крови (РВМС) Подготовка соединений. Соединение сравнительного примера 1 растворяли и последовательно разводили в DMSO до получения 100 требуемого диапазона концентраций с использованием Biomek 2000. 1 мкл тестируемого соединения переносили в 96-луночные планшеты для культуры ткани с использованием Biomek FX. Ка- 22021048 ждое соединение анализировали в двух повторах для каждого донора. Каждый планшет содержал серию разведений агониста TLR7/8 резиквимода в качестве стандарта, и колонка 11 содержала 1 мкл 200 мкМ резиквимода (давая 2 мкМ конечную концентрацию, которую использовали для определения приблизительного максимального ответа на резиквимод). Получение РВМС Образцы крови, взятые у двух доноров-людей, собирали в гепарин натрия (10 ед./мл). Объемы по 25 мл цельной крови наносили на 15 мл Histopaque в пробирках Leucosep, которые центрифугировали при 800 g в течение 20 мин, и слой между плазмой и Histopaque осторожно извлекали. Собранные клетки центрифугировали при 2500 об/мин в течение 10 мин и осадок после центрифугирования ресуспендировали в 10 мл среды (RPMI 1640 (низкий уровень эндотоксинов), дополненная 10% об./об. фетальной телячьей сыворотки (FCS, низкий уровень эндотоксинов), 100 ед./мл пенициллина г, 100 мкг/мл стрептомицина, 10 мм L-глутамина и 1 ненезаменимых аминокислот). Разведение клеток 1:20 готовили с использованием трипанового синего, и клетки подсчитывали с использованием гемоцитометра. РВМС разводили до получения конечной концентрации 2106 на мл, и 100 мкл этой клеточной суспензии добавляли в лунки, содержащие 1 мкл разведенного тестируемого соединения. Инкубация и анализы на интерферон- и TNF Препараты клеток инкубировали в течение 24 ч (37C , 95% воздуха, 5% CO2), после чего образец супернатанта извлекали с использованием Biomek FX и анализировали на IFN- и на TNF- с использованием электрохемилюминисцентного анализа на платформе MSD (Mesoscale Discovery). Анализ на IFN проводили аналогично анализу, описанному выше. Анализ на TNF- проводили в соответствии с инструкциями к набору (каталожныйК 111 ВНВ). Высвободившийся цитокин выражали в процентах от контрольного 2 мкМ резиквимода (колонка 11). Этот процент наносили на график зависимости от концентрации соединения и pEC50 для ответной реакции определяли путем аппроксимации нелинейной кривой методом наименьших квадратов. ДляIFN- ответов обычно выбирали 4-параметрическую логистическую модель. Для TNF ответов, если получали четкий максимальный ответ (т.е. если наблюдали четко определенное плато в ответе), затем обычно использовали 4-параметрическую модель. Если высшая асимптота кривой не была четко определенной, то затем аппроксимацию кривой обычно ограничивали до максимального ответа 100% (т.е. до ответа на 2 мкМ резиквимод) или до ответа самой высокой протестированной концентрации, если этот ответ был больше, чем ответ на резиквимод. Некоторые кривые имели колоколообразную форму для одного или обоих цитокинов, и данные по цитокинам на наклоне колоколообразной кривой ответа (т.е. концентрации выше концентраций, дающих максимальный ответ) обычно исключали из аппроксимации,обычно с исключением концентрации непосредственно выше максимального ответа. Аппроксимация кривой, таким образом, концентрировалась на восходящей кривой доза-ответ. Результаты Соединение сравнительного примера 1 продемонстрировало среднее значение pEC50 в отношении индуцирования IFN- и TNF-9 и 6,5 соответственно. Анализ аллерген-запускаемых цитокинов с использованием свежих человеческих мононуклеарных клеток периферической крови (РВМС) атопических добровольцев Был разработан анализ на основе совместной культуры мононуклеарных клеток периферической крови (РВМС) атопических доноров-людей с аллергеном и тестируемыми соединениями. После 5-6 суток культивирования клеточные супернатанты анализировали в отношении ряда цитокинов. Подготовка соединения. Соединение сравнительного примера 1 растворяли в DMSO, затем последовательно разводили в ростовой среде (среда RPMI 1640, дополненная 100 ед./мл пенициллина г, 100 мкг/мл стрептомицина, 10 мм L-глутамина) с получением 4 требуемого диапазона концентраций в присутствии 0,04% DMSO. Каждое соединение анализировали в трех повторах при всех концентрациях. Получение РВМС. Дефибринированную кровь человека, взятую у добровольцев с аллергией на тимофеевку луговую,центрифугировали при 2500 об/мин в течение 15 мин. Верхний слой сыворотки собирали и инактивировали нагреванием при 56C в течение 30 мин (инактивированная нагреванием аутологичная сыворотка). Нижний слой клеток ресуспендировали в 50 мл PBS (+Ca +Mg), 25 мл разведенной крови наносили на 20 мл Lymphoprep в 50 мл пробирках, затем центрифугировали при 2500 об/мин в течение 20 мин при комнатной температуре. Слой между сывороткой и Lymphoprep осторожно извлекали. Собранные клетки промывали PBS и ресуспендировали при 4106 клеток на мл в ростовой среде с инактивированной нагреванием аутологичной сывороткой. РВМС засевали при 0,4106 клеток/лунку в 96-луночные планшеты с плоским дном в присутствии 10 мкг/мл антигена тимофеевки луговой (Alk Abello) и тестируемых соединений в соответствующих концентрациях в общем объеме 200 мкл. Инкубация и анализы на цитокины Планшеты инкубировали при 37C в атмосфере с 5% CO2 в течение вплоть до 6 суток. Клеточную среду из каждой лунки собирали и хранили при -20C до анализа. Цитокины и хемокины в супернатантах детектировали с использованием планшетов Meso Scale Discovery 10 Spot в отношении TH1/Th2 цитокинов человека. В вышеуказанном анализе данные отдельных исследований с РВМС от по меньшей мере двух доноров с аллергией показали, что соединение сравнительного примера 1 снижает продуцирование Th2 цитокинов IL-5 и IL-13 дозозависимым образом, причем 50%-ное снижение наблюдается при 0,04 мкМ по сравнению с аллергенным контролем. Соединение сравнительного примера 1 было также протестировано в отношении биологической активности in vivo в описанной ниже модели. Анализ на индуцирование интерферона- после интраназального введения дозы у мыши Соединение сравнительного примера 1 растворяли в 0,2% Tween 80 в физиологическом растворе и вводили интраназально (5 мкл в сумме в обе ноздри) самкам мышей BALB/c (n=6) под общей анестезией. Животных умерщвляли через 2 ч после введения дозы, брали терминальный образец крови и уровни интерферона- измеряли в ELISA-анализе. В этой модели соединение сравнительного примера 1 продемонстрировало средние уровни интерферона- в сыворотке крови 21029 пг/мл. Интерферон- не был обнаружен у контрольных животных,которым вводили носитель. Тестирование на стабильность 6-Амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в форме малеатной соли не продемонстрировало значительного разложения в условиях, указанных в руководствах по качеству Quality Guidelines Q1A(R2) (Тестирование стабильности новых лекарственных веществ и продуктов) и Q1B (Тестирование светостойкости новых лекарственных веществ и продуктов),сформулированных Международной конференцией по гармонизации технических требований к регистрации фармацевтических продуктов для человека (International Conference for Harmonisation of Technical 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 в форме малеатной соли. 2. Применение соединения по п.1 в качестве TLR7 активирующего агента. 3. Применение соединения по п.1 в лечении заболевания или состояния, при котором желательно повышение образования IFN-, где указанное заболевание или состояние выбрано из аллергического заболевания и воспалительного состояния, инфекционного заболевания и рака. 4. Применение соединения по п.1 в лечении аллергического ринита. 5. Применение соединения по п.1 в лечении астмы. 6. Применение соединения по п.1 для изготовления иммуногенной композиции, содержащей антиген. 7. Применение соединения по п.1 для изготовления вакцинной композиции, содержащей антиген. 8. Применение соединения по п.1 для изготовления лекарственного средства для лечения заболевания или состояния, при котором желательно повышение образования IFN-, где указанное заболевание или состояние выбрано из аллергического заболевания и воспалительного состояния, инфекционного заболевания и рака. 9. Применение соединения по п.1 для изготовления лекарственного средства для лечения аллергического ринита. 10. Применение соединения по п.1 для изготовления лекарственного средства для лечения астмы. 11. Способ лечения заболевания или состояния, при котором желательно повышение образованияIFN- и где указанное заболевание или состояние выбрано из аллергического заболевания, воспалитель- 24021048 ного состояния, инфекционного заболевания и рака, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1. 12. Способ лечения аллергического ринита, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1. 13. Способ лечения астмы, включающий введение субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1. 14. Фармацевтическая композиция, обладающая TLR7-активирующей активностью, содержащая соединение по п.1 и один или более фармацевтически приемлемых разбавителей или носителей.
МПК / Метки
МПК: A61K 31/522, A61P 29/00, C07D 473/18, A61P 35/00, A61P 37/08, A61P 11/06, A61P 31/00
Метки: 6-амино-2-{[(1s)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8н-пурин-8-она, малеат
Код ссылки
<a href="https://eas.patents.su/27-21048-maleat-6-amino-2-1s-1-metilbutiloksi-9-5-1-piperidinilpentil-79-digidro-8n-purin-8-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Малеат 6-амино-2-{[(1s)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8н-пурин-8-она</a>
Предыдущий патент: Замещенные производные триазола и имидазола в качестве модуляторов гамма-секретазы
Следующий патент: Способ получения кристаллической формы i ривастигмина гидротартрата
Случайный патент: Способ производства пищевого продукта












