Замещенные эфиры 4-{3-[6-амино-9-(3,4-дигидрокситетрагидрофуран-2-ил)-9н-пурин-2-ил]-проп-2-инил}пиперидин-1-карбоновых кислот и их применение
Номер патента: 19244
Опубликовано: 28.02.2014
Авторы: Шмидтманн Франк, Томпсон Роберт, Боглхоул Энтони, Ригер Джейсон
Формула / Реферат
1. Соединение формулы I, или его стереоизомер, или его фармацевтически приемлемая соль
отличающееся тем, что
R1 и R2 независимо выбраны из Н и алкила С1-3;
Z2 независимо выбран из F, алкила C1-4, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN, (CH2)aCO2R3 и (CH2)aCONR3R3;
R3 независимо выбран из H и алкила C1-6;
R4 выбран из CH2OR и C(O)NRR;
каждый R независимо выбран из Н, алкила С1-4, циклобутила и (СН2)a-циклопропила;
а выбран из 0, 1 и 2 и
q выбран из 1, 2 и 3.
2. Соединение по п.1, где
R1 и R2 - Н;
Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;
R3 независимо выбран из Н и алкила C1-2;
R4 - C(O)NRR;
каждый R независимо выбран из Н, алкила C1-4, циклопропила, циклобутила и -СН2-циклопропила и
q=1.
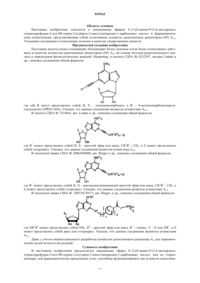
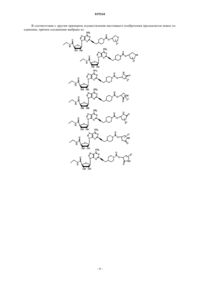
3. Соединение по п.1, выбранное из
4. Соединение формулы II, или его стереоизомер, или его фармацевтически приемлемая соль
отличающееся тем, что
R1 и R2 независимо выбраны из Н и алкила С1-3;
Z выбран из циклопропила, циклобутила, циклопентила, тетрагидрофуранила, азетидин-2-онила, пирролидинила и пирролидин-2-онила;
Z замещен 0-2 группами Z2;
Z2 независимо выбран из F, алкила C1-4, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN, (CH2)aCO2R3 и (CH2)aCONR3R3;
R3 независимо выбран из Н и алкила C1-6;
R4 выбран из CH2OR и C(O)NRR;
каждый R независимо выбран из Н, алкила C1-4, циклобутила и (СН2)a-циклопропила;
а выбран из 0, 1 и 2.
5. Соединение по п.4, где
R1 и R2 - H;
Z замещен 0-1 группами Z2;
Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;
R3 независимо выбран из Н и алкила C1-2;
R4 - C(O)NRR и
каждый R независимо выбран из Н, алкила С1-4, циклопропила, циклобутила и -СН2-циклопропила.
6. Соединение по п.4, выбранное из
7. Соединение по п.4, выбранное из
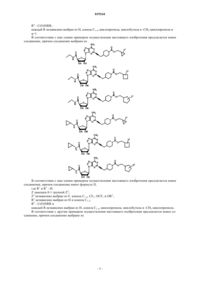
8. Соединение по п.4, выбранное из
9. Соединение по п.4, выбранное из
10. Соединение по п.4, выбранное из
11. Соединение формулы III, или его стереоизомер, или его фармацевтически приемлемая соль
отличающееся тем, что
R1 и R2 независимо выбраны из Н и алкила С1-3;
Z1 выбран из тетрагидрофуранила, азетидин-2-онила, пирролидинила и пирролидин-2-онила;
Z1 замещен 0-2 группами Z2;
Z2 независимо выбран из F, алкила С1-4, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN, (CH2)aCO2R3 и (CH2)aCONR3R3;
R3 независимо выбран из Н и алкила С1-6;
R4 выбран из CH2OR и C(O)NRR;
каждый R независимо выбран из Н, алкила C1-4, циклобутила и (СН2)a-циклопропила;
а выбран из 0, 1 и 2 и
q выбран из 1, 2 и 3.
12. Соединение по п.11, где
R1 и R2 - Н;
Z1 замещен 0-1 группами Z2;
Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;
R3 независимо выбран из Н и алкила C1-2;
R4 - C(O)NRR;
каждый R независимо выбран из Н, алкила С1-4, циклопропила, циклобутила и -СН2-циклопропила;
q = 0.
13. Соединение по п.11, где
R1 и R2 - Н;
Z1 замещен 0-1 группами Z2;
Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;
R3 независимо выбран из Н и алкила C1-2;
R4 - C(O)NRR;
каждый R независимо выбран из Н, алкила С1-4, циклопропила, циклобутила и -СН2-циклопропила;
q = l.
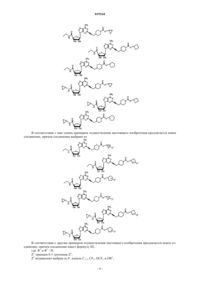
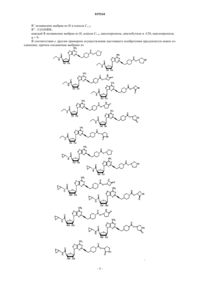
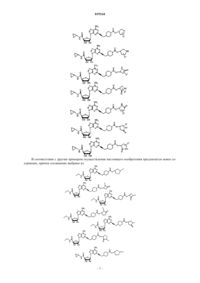
14. Соединение по п.11, выбранное из
15. Соединение по п.11, выбранное из
16. Соединение по п.11, выбранное из
17. Применение соединения по любому из пп.1-16 в лечении воспалительного состояния.
18. Фармацевтическая композиция для применения в лечении воспалительного состояния, включающая соединение по любому из пп.1, 4 и 8 и фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п.18, где воспалительное состояние связано с (а) аутоиммунной стимуляцией (аутоиммунным заболеванием), такой как красная волчанка, рассеянный склероз, бесплодие, связанное с эндометриозом, сахарный диабет 1 типа, в том числе разрушение островков Лангерганса, приводящее к диабету, а также воспалительные следствия диабета, включая трофические язвы на ногах, болезнь Крона, неспецифический язвенный колит, воспалительная болезнь кишечника, остеопороз и ревматоидный артрит; (b) аллергическими заболеваниями, такими как астма, сенная лихорадка, ринит, реакция на сумах ядоносный, весенний конъюнктивит и другие состояния, опосредованные эозинофилами; (с) кожными заболеваниями, такими как псориаз, контактный дерматит, экзема, инфекционные кожные язвы, заживление открытых ран, целлюлит; (d) инфекционными заболеваниями, включающими сепсис, септический шок, энцефалит, инфекционный артрит, эндотоксический шок, грамотрицательный септический шок, эндотоксиновая лихорадка, сибирская язва, чума, туляремия, лихорадка эбола, опоясывающий лишай, токсический шок, церебральная малярия, бактериальный менингит, синдром острой дыхательной недостаточности (ОДН), хроническая обструктивная болезнь легких (ХОБЛ), болезнь Лайма, ВИЧ инфицирование (репликация ВИЧ, усиленная ФНО α, ингибирование активности обратной транскриптазы ФНО α); (е) болезненным истощением: кахексия вследствие рака или ВИЧ; (f) трансплантацией органов, тканей или клеток (например, костного мозга, роговицы, почек, легких, печени, сердца, кожи, островков Лангерганса), включая отторжение трансплантата и реакцию "трансплантат против хозяина"; (g) неблагоприятным воздействием лекарственной терапии, в том числе вредным воздействием терапии амфотерицином В, вредным воздействием иммуносупрессивной терапии, например терапии интерлейкином 1, вредным воздействием препаратов ОКТ3, контрастных красителей, антибиотиков; вредным воздействием препаратов ГМ-КСФ, вредным воздействием циклоспорина, а также вредным воздействием аминогликозидов, вызванными иммуносупрессией стоматитом и мукозитом; (h) сердечно-сосудистыми состояниями, включающими расстройства кровообращения, вызванные либо усиленные воспалительной реакцией, такие как ишемия, атеросклероз, заболевание периферических сосудов, рестеноз после ангиопластики, воспалительная аневризма аорты, васкулит, нарушение мозгового кровообращения, травма спинного мозга, застойная сердечная недостаточность, геморрагический шок, ишемия/реперфузия, вазоспазм при субарахноидальном кровоизлиянии, вазоспазм при остром нарушении мозгового кровообращения, плеврит, перикардит и сердечно-сосудистые осложнения диабета; (i) диализом, в том числе перикардитом вследствие перитонеального диализа; (j) подагрой и (k) термическим ожогом или химическим ожогом кислотой, щелочью.
20. Применение соединения по любому из пп.1-16 для получения лекарственного средства для лечения заболевания млекопитающих, где заболевание включает воспалительное состояние.
21. Применение по п.20, где воспалительное состояние связано с (а) аутоиммунной стимуляцией (аутоиммунным заболеванием), такой как красная волчанка, рассеянный склероз, бесплодие, связанное с эндометриозом, сахарный диабет 1 типа, в том числе разрушение островков Лангерганса, приводящее к диабету, а также воспалительные следствия диабета, включая трофические язвы на ногах, болезнь Крона, неспецифический язвенный колит, воспалительная болезнь кишечника, остеопороз и ревматоидный артрит; (b) аллергическими заболеваниями, такими как астма, сенная лихорадка, ринит, реакция на сумах ядоносный, весенний конъюнктивит и другие состояния, опосредованные эозинофилами; (с) кожными заболеваниями, такими как псориаз, контактный дерматит, экзема, инфекционные кожные язвы, заживление открытых ран, целлюлит; (d) инфекционными заболеваниями, включающими сепсис, септический шок, энцефалит, инфекционный артрит, эндотоксический шок, грамотрицательный септический шок, эндотоксиновая лихорадка, сибирская язва, чума, туляремия, лихорадка эбола, опоясывающий лишай, токсический шок, церебральная малярия, бактериальный менингит, синдром острой дыхательной недостаточности (ОДН), хроническая обструктивная болезнь легких (ХОБЛ), болезнь Лайма, ВИЧ инфицирование (репликация ВИЧ, усиленная ФНО α, ингибирование активности обратной транскриптазы ФНО α); (е) болезненным истощением: кахексия вследствие рака или ВИЧ; (f) трансплантацией органов, тканей или клеток (например, костного мозга, роговицы, почек, легких, печени, сердца, кожи, островков Лангерганса), включая отторжение трансплантата и реакцию "трансплантат против хозяина"; (g) неблагоприятным воздействием лекарственной терапии, в том числе вредным воздействием терапии амфотерицином В, вредным воздействием иммуносупрессивной терапии, например терапии интерлейкином 1, вредным воздействием препаратов ОКТ3, контрастных красителей, антибиотиков; вредным воздействием препаратов ГМ-КСФ, вредным воздействием циклоспорина, а также вредным воздействием аминогликозидов, вызванными иммуносупрессией стоматитом и мукозитом; (h) сердечно-сосудистыми состояниями, включающими расстройства кровообращения, вызванные либо усиленные воспалительной реакцией, такие как ишемия, атеросклероз, заболевание периферических сосудов, рестеноз после ангиопластики, воспалительная аневризма аорты, васкулит, нарушение мозгового кровообращения, травма спинного мозга, застойная сердечная недостаточность, геморрагический шок, ишемия/реперфузия, вазоспазм при субарахноидальном кровоизлиянии, вазоспазм при остром нарушении мозгового кровообращения, плеврит, перикардит и сердечно-сосудистые осложнения диабета; (i) диализом, в том числе перикардитом вследствие перитонеального диализа; (j) подагрой и (k) термическим ожогом или химическим ожогом кислотой, щелочью.
Текст
В настоящем изобретении предлагаются замещенные эфиры 4-3-[6-амино-9-(3,4 дигидрокситетрагидрофуран-2-ил)-9 Н-пурин-2-ил]-проп-2-инилпиперидин-1-карбоновых кислот и фармацевтические композиции, их содержащие, как селективные агонисты аденозиновых рецепторов (АР) A2A. Указанные соединения и композиции применимы как лекарственные вещества.(71)(73) Заявитель и патентовладелец: ТРОВИС ФАРМАСЬЮТИКЛЗ ЭлЭлСи (US) Область техники Настоящее изобретение относится к замещенным эфирам 4-3-[6-амино-9-(3,4-дигидрокситетрагидрофуран-2-ил)-9 Н-пурин-2-ил]проп-2-инилпиперидин-1-карбоновых кислот и фармацевтическим композициям, представляющим собой селективные агонисты аденозиновых рецепторов (АР) A2A. Указанные соединения и композиции полезны в качестве лекарственных веществ. Предпосылки создания изобретения Постоянно ведется поиск соединений, обладающих более сильным и/или более селективным действием в качестве агонистов аденозиновых рецепторов (АР) A2A на основе методов радиолигандного анализа и определения физиологических реакций. Например, в патенте США 6232297, авторы Linden и др., описаны соединения общей формулы где оба R могут представлять собой Н, X - этиламинокарбонил, a R1 - 4-метоксикарбонилциклогексилметил (DWH-146e). Указано, что данные соединения являются агонистами A2A. В патенте США 7214665, авт. Linden и др., описаны соединения общей формулы где R7 может представлять собой Н, X - простой эфир или амид, CR1R2 - СН 2, a Z может представлять собой гетероцикл. Указано, что данные соединения являются агонистами A2A. В патентной заявке США 2006/004088, авт. Rieger и др., описаны соединения общей формулы где R7 может представлять собой Н, X - циклоалкилзамещенный простой эфир или амид, CR1R2 - СН 2, aZ может представлять собой гетероцикл. Указано, что данные соединения являются агонистами A2A. В патентной заявке США . 2007/0270373, авт. Rieger, и др., описаны соединения общей формулы где NR1R2 может представлять собой NH2, R4 - простой эфир или амид, R5 - этинил, Y - О или NR1, a Z может представлять собой арил или гетероарил. Указано, что данные соединения являются агонистамиA2A. Даже с учетом вышеизложенного разработка агонистов аденозинового рецептора A2 для терапевтических целей остается актуальной. Сущность изобретения В настоящем изобретении предлагаются замещенные эфиры 4-3-[6-амино-9-(3,4-дигидрокситетрагидрофуран-2-ил)-9 Н-пурин-2-ил]-проп-2-инилпиперидин-1-карбоновых кислот, или их стереоизомеры, или фармацевтически приемлемые соли, способные функционировать как агонисты аденозино-1 019244 вых рецепторов A2A. В настоящем изобретении предлагаются также фармацевтические композиции, содержащие соединение в соответствии с настоящим изобретением, или его стереоизомер, или фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым наполнителем. В настоящем изобретении предлагаются новые способы лечения и диагностики с использованием соединений и композиций согласно настоящему изобретению. В настоящем изобретении также предлагается применение нового соединения согласно настоящему изобретению для получения лекарственного препарата для лечения патологических состояний или симптомов у млекопитающего, связанных с рецептором A2A, для которых агонистическое действие в отношении рецептора оказывает терапевтическое действие. Перечисленные, а также другие аспекты настоящего изобретения основаны на исследовании описанных в настоящем документе замещенных эфиров 4-3-[6-амино-9-(3,4-дигидрокситетрагидрофуран-2 ил)-9 Н-пурин-2-ил]-проп-2-инилпиперидин-1-карбоновых кислот. Подробное описание изобретения Согласно настоящему изобретению предлагаются новые замещенные эфиры 4-3-[6-амино-9-(3,4 дигидрокситетрагидрофуран-2-ил)-9 Н-пурин-2-ил]-проп-2-инилпиперидин-1-карбоновых кислот, являющиеся агонистами аденозинового рецептора A2A, и способы применения данных соединений в методах лечения заболеваний и состояний связанных с рецептором A2A, для которых агонистическое действие в отношении рецептора оказывает терапевтическое действие. Данные соединения применимы, например,для лечения воспалительных процессов в тканях млекопитающих либо для лечения серповидноклеточной анемии. Воспалительные процессы в тканях могут быть связаны с патологическими агентами либо могут быть следствием физической, химической или термической травмы, а также травмы, вызванной медицинским вмешательством, например трансплантацией органов, тканей или клеток, ангиопластикой(чрескожная транслуминарная коронарная ангиопластика - РСТА), либо воспалением вследствие ишемии/реперфузии или пересадки. Соединения в соответствии с настоящим изобретением можно применять в сочетании с другим противовоспалительным лечением или с антипатогенными препаратами. В соответствии с одним из примеров осуществления настоящего изобретения предлагается новое соединение формулы I, II или III, или его стереоизомер, или его фармацевтически приемлемая соль где R1 и R2 независимо выбраны из Н и алкила С 1-3;Z2 независимо выбран из F, алкила C1-4, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN,(CH2)aCO2R3 и (CH2)aCONR3R3;R3 независимо выбраны из Н и алкила С 1-6;R4 выбран из CH2OR и C(O)NRR; каждый R независимо выбран из Н, алкила C1-4, циклобутила и (СН 2)a-циклопропила; а выбран из 0, 1 или 2 иq выбран из 1, 2 и 3. В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение имеет формулу I,R1 и R2 - Н;Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;R3 независимо выбран из Н и алкила С 1-2;R4 - C(O)NRR; каждый R независимо выбран из Н, алкила С 1-4, циклопропила, циклобутила и -СН 2-циклопропила иq=1. В соответствии с еще одним примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с еще одним примером осуществления настоящего изобретения предлагается новое соединение, причем соединение имеет формулу II,где R1 и R2 - Н;Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;R3 независимо выбран из Н и алкила С 1-2;R4 - C(O)NRR и каждый R независимо выбран из Н, алкила С 1-4, циклопропила, циклобутила и -СН 2-циклопропила. В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с еще одним примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение имеет формулу III,где R1 и R2 - Н;Z2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;R3 независимо выбран из Н и алкила С 1-2;R4 - C(O)NRR; каждый R независимо выбран из Н, алкила С 1-4, циклопропила, циклобутила и -СН 2-циклопропила;q = 0. В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из-5 019244 В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение имеет формулу III,где R1 и R2 - Н;Z2 независимо выбран из F, алкила С 1-2, CF3, OCF3 и OR3;R3 независимо выбран из Н и алкила С 1-2;R4 - C(O)NRR; каждый R независимо выбран из Н, алкила C1-4, циклопропила, циклобутила и -СН 2-циклопропила;q=1. В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из В соответствии с другим примером осуществления настоящего изобретения предлагается новое соединение, причем соединение выбрано из Согласно изобретению предлагается новое соединение для применения в качестве терапевтического средства в медицине, предпочтительно для применения при лечении воспалений или для защиты тканей млекопитающих от воспаления, например воспалительной реакции, к примеру, вследствие аллергии,ишемии/реперфузии, а также применение соединения согласно настоящему изобретению для получения лекарственного препарата для лечения воспалительной реакции, вызванной патологическим состоянием или симптомом у млекопитающего, связанным с воспалением. Предполагается, что настоящее изобретение включает все изотопы атомов, входящих в состав соединений. Изотопами являются атомы, имеющие одинаковый атомный номер, но различную атомную массу. В порядке примера и без ограничения к изотопам водорода относятся тритий и дейтерий. Изотопами углерода являются С-13 и С-14. К изобретению относится также применение указанных соединений хотя бы с одним противовоспалительным веществом. Примером такого вещества может служить ингибитор фосфодиэстеразы 4-го типа, при этом их комбинация может использоваться для синергетического снижения воспалительной реакции, опосредованной лейкоцитами. В соответствии с настоящим изобретением предлагается также фармацевтическая композиция, содержащая эффективное количество соединения согласно настоящему изобретению или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым разбавителем или носителем и не обязательно в комбинации с противовоспалительным веществом. Композиция может быть изготовлена в виде единичной лекарственной формы. Носителем может быть жидкий носитель. Композиция может быть приспособлена для перорального, внутривенного, глазного, парэнтерального, аэрозольного и трансдермального введения. Композиции согласно настоящему изобретению могут далее содержать ингибитор фосфодиэстеразы 4-го типа либо иное противовоспалительное вещество (например, отличное от ингибитора фосфодиэстеразы). Ингибитор фосфодиэстеразы 4-го типа может представлять собой, например, ролипрам, циломиласт или рофлумиласт. Кроме того, согласно изобретению предлагается терапевтический способ лечения патологического состояния или симптома у млекопитающих, связанного с активностью аденозиновых рецепторов A2A, где желательно агонистическое действие в отношении рецептора, включающий введение в организм млекопитающего, нуждающегося в такой терапии, эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли. Считается, что активация аденозиновых рецепторов A2A подавляет воспаление за счет воздействия на нейтрофилы, тучные клетки, моноциты/макрофаги, тромбоциты, Т-клетки и/или эозинофилы. Ингибирование указанных клеток воспалительного инфильтрата приводит к защите ткани после ее повреждения. Кроме того, согласно настоящему изобретению предлагается терапевтический способ лечения биологических заболеваний, включающий введение эффективного количества подходящего антибиотика,противогрибкового или противовирусного средства в сочетании с агонистом аденозинового рецептораA2A. Если антипатогенное средство неизвестно, то возможно применение только агониста A2A для уменьшения воспаления, связанного с инфицированием устойчивыми к антибиотикам бактериями или определенными видами вирусов, например возбудителем тяжелого острого респираторного синдрома(SARS) и Эбола. Способ может также включать (не обязательно) введение ингибитора фосфодиэстеразы- 11019244 4-го типа. Агонист аденозиновых рецепторов A2A способен осуществить дополнительную терапию при лечении таких состояний, как воспаление, вызванное сепсисом, например уремический синдром у человека, при введении совместно с антибиотиком в терапии заболеваний, вызванных бактериологическим оружием, таких как сибирская язва, туляремия, кишечная палочка, чума и прочее. Согласно настоящему изобретению предлагается также дополнительная терапия при лечении летальных бактериальных, грибковых и вирусных инфекций, таких как сибирская язва, туляремия, эшерихия и чума, включающая введение антибактериального препарата, противогрибкового или противовирусного средства в сочетании с селективными агонистами аденозиновых рецепторов A2A. Настоящее изобретение предлагает терапевтический способ лечения биологических заболеваний,вызывающих воспаление, в качестве единственного средства либо в сочетании с лекарством, устраняющим заболевание. К таковым относятся бактерии в сочетании с антибиотиком, в том числе, но без ограничения бактерии - возбудители сибирской язвы, туляремии, чумы, болезни Лайма и сибирской язвы. Также сюда относятся вирусы, в том числе, но без ограничения, респираторно-синцитиальный вирус(RSV), возбудитель тяжелого острого респираторного синдрома (SARS), вирус гриппа или Эбола, совместно с антивирусной терапией или без нее. Сюда относятся и дрожжевые и грибковые инфекции совместно с противодрожжевыми и противогрибковыми средствами. Антибактериальный препарат, противогрибковое или противовирусное средство можно вводить совместно (например, одновременно) с агонистом аденозиновых рецепторов A2A, либо их можно вводить или одновременно, или в виде смеси, а также последовательно. При последовательном введении агонист аденозиновых рецепторов A2A можно вводить до другого препарата, за несколько минут, либо в течение 48 ч после введения другого препарата. Предпочтительно введение агониста аденозиновых рецепторовA2A происходит в пределах приблизительно 24 ч, более предпочтительно в течение приблизительно 12 ч. Способ согласно данному изобретению может также быть полезен для лечения больных сепсисом,тяжелым сепсисом, и он потенциально полезен при наличии системной воспалительной реакции помимо септического шока. Агонисты аденозиновых рецепторов A2A оказывают множественное противовоспалительное действие на ранней стадии воспалительного каскада, и таким образом короткий курс таких агонистов может оказать благоприятное действие при тяжелых, опасных для жизни инфекциях и воспалительных нарушениях у человека, например при вдыхаемой сибирской язве, туляремии, эшерихии и чуме. Противовоспалительное действие агонистов рецепторов A2A было обнаружено in vivo на экспериментальных моделях менингита, перитонита и артрита. Потенциально летальный синдром бактериального сепсиса является все более частой проблемой отделений неотложной помощи. Возрастает частота развития сепсиса и септического шока, которые в настоящее время находятся на 11 месте как причина смерти в США. По современным оценкам, ежегодно в США регистрируется около 900000 новых случаев сепсиса (около 60% грамотрицательных), причем общий коэффициент смертности составляет 35%. Более того, по данным недавних клинических испытаний процент смертности составляет 25%, и только 10% пациентов умирает от своего основного заболевания. Развитие септического шока ежегодно регистрируется в приблизительно 200000 случаях, соответствующий коэффициент смертности составляет 46% (92000 смертей). Расходы на медицинское обслуживание, связанные с сепсисом, ежегодно составляют 5-10 млрд долларов США. По многим оценкам, сепсис является наиболее распространенной причиной смерти среди больных, госпитализированных в отделения несердечной неотложной помощи. Септический синдром является чрезвычайно важной проблемой общественного здравоохранения. Ожидается, что агонисты АР A2A могут служить в качестве нового уникального метода дополнительной терапии для снижения заболеваемости и смертности. Вероятно, такое лечение способно улучшить прогноз при системной сибирской язве, туляремии, эшерихии и чуме. Агонисты аденозиновых рецепторов A2A согласно данному изобретению могут ингибировать активацию нейтрофилов, макрофагов и Т-клеток и, таким образом, уменьшать воспаление, вызванное бактериальными и вирусными инфекциями. Соединения в сочетании с антибиотиками или противовирусными средствами способны предотвратить или снизить смертность, вызванную сепсисом или гемолитическим уремическим синдромом или иными воспалительными состояниями. Воздействие агонистов A2A усиливается добавкой ингибиторов фосфодиэстеразы 4-го типа, таких как ролипрам. В соответствии с настоящим изобретением также предлагается соединение согласно настоящему изобретению для применения в медицинской терапии (например, для применения в качестве вспомогательного средства при лечении потенциально летальных бактериальных инфекций, таких как сибирская язва, туляремия, эшерихия, чума или других бактериальных и вирусных инфекций, а также при лечении системных интоксикаций, вызванных бактериальными и/или вирусными инфекциями, а также применение соединения согласно настоящему изобретению для получения лекарственного препарата, уменьшающего воспаление, вызванное бактериями или вирусами, либо лечения таковых у млекопитающего,например у человека. Соединения согласно данному изобретению также полезны для лечения системных интоксикаций, причем бактериальные или вирусные агенты вызывают воспаление либо непосредственно, либо в результате терапии, например, антибиотиками или противовирусными средствами. Сепсис является тяжелым заболеванием, вызванным тотальным инфицированием кровотока бакте- 12019244 риями или вирусами, продуцирующими токсины. Инфекция, которая может проявляться как воспаление,может быть вызвана бактериальными или вирусными возбудителями либо непосредственно, либо как результат терапии, т.е. гибелью возбудителя вследствие лечения антибактериальными или противовирусными средствами. Сепсис можно рассматривать также, как ответ организма на инфекцию. Инфекция может быть вызвана микроорганизмами либо "микробами" (обычно бактериями) и захватывать весь организм либо ограничиваться определенным участком организма (например, зубной абсцесс) или может распространяться в организме с током крови (что часто называется "септицемия" или "заражение крови"). Системную интоксикацию или воспалительный шок частоназывают септическим шоком; бактериемическим шоком; эндотоксическим шоком; септицемическим шоком или тепловым шоком. Септический шок - это тяжелое аномальное состояние, возникающее при понижении кровяного давления и кровотока вследствие тотальной инфекции. При этом жизненно важные органы, например мозг, сердце и почки, могут не функционировать должным образом или отказать. Септический шок обычно возникает у больных наиболее старшего и наиболее младшего возраста. Кроме того, он возникает при наличии основного заболевания. Септический шок могут вызвать любые бактерии, а также грибы или вирусы. Токсины, выделяемые бактериями, грибами или вирусами, могут непосредственно вызвать повреждение тканей, а также могут привести к понижению артериального давления и/или нарушению работы органов. Токсины могут стать причиной бурной воспалительной реакции в организме, что тоже способствует развитию септического шока. В другом аспекте настоящего изобретения предлагается способ лечения тяжелого острого респираторного синдрома (SARS), включающий введение в организм млекопитающего, нуждающегося в этом,эффективного противовоспалительного количества агонистов аденозинового рецептора A2A, необязательно совместно с ингибитором фосфодиэстеразы 4-го типа, таким как ролипрам. В соответствии с настоящим изобретением предлагаются также способы лечения серповидноклеточной анемии введением агонистов A2A, описанных в настоящем документе, в организм объекта, страдающего серповидноклеточной анемией. В настоящем изобретении предлагаются соединения и способы их применения для выявления и оценки тяжести стеноза артерии у млекопитающего, например человека или домашнего животного. Предпочтительно соединения согласно изобретению применяются в качестве фармакологических препаратов, вызывающих стресс (стрессоров), которые используются в фармакологических методах визуализации при нагрузке для выявления наличия и оценки тяжести заболевания коронарной артерии. Определенные соединения данного изобретения, которые могут служить в качестве препаратов, вызывающих стресс, являются эффективными и селективными при воздействии на аденозиновые рецепторы A2A, при этом они обладают кратковременным действием, т.е. быстро удаляются из организма после визуализации. Таким образом, настоящее изобретение предлагает способ обнаружения наличия и оценки тяжести стеноза коронарной артерии у млекопитающего, например у человека, включающий: (1) введение некоторого количества одного или нескольких соединений согласно настоящему изобретению и (2) проведение процедуры обнаружения и/или определения тяжести указанного стеноза коронарной артерии у указанного млекопитающего. Согласно настоящему изобретению предлагается соединение настоящего изобретения для применения в медицинских диагностических процедурах, предпочтительно при выявлении наличия и оценке тяжести стеноза коронарной артерии у человека. Согласно настоящему изобретению предлагается применение соединения настоящего изобретения для получения фармакологического сосудорасширяющего средства для использования в клинических методах визуализации перфузии для диагностики и оценки степени заболевания коронарной артерии. Предпочтительными методами визуализации перфузии является планарная и однофотонная эмиссионная компьютерная томография (ОФЭКТ), сцинтиграфическое исследование, позитронная эмиссионная томография (ПЭТ), ядерно-магнитно-резонансная (ЯМР) томография, магнитно-резонансная томография (МРТ), перфузионная контрастная эхокардиография, цифровая субтракционная ангиография (ЦСА) и ультраскоростная рентгеновская компьютерная томография(CINE CT). В настоящем изобретении предлагается также фармацевтическая композиция, включающая эффективное количество соединения согласно настоящему изобретению или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым разбавителем или носителем. Предпочтительно композиция находится в виде единичной лекарственной формы и может быть приспособлена для парэнтерального применения, например внутривенного вливания. Если не указано иное, использованы следующие определения. Млекопитающее или объект подразумевает человека, лошадь, свинью, семейство псовых и кошачьих. Термин "замещенный" означает, что любой атом водорода или несколько таких атомов при обозначенном атоме заменен(ы) объектом, выбранным из указанной группы, при условии, что обычная валентность обозначенного атома не превышена и что замещение приводит к устойчивому соединению. Если заместителем является кетогруппа (т.е. =O), то замещено два атома водорода при данном атоме. Кетогруппа не может быть заместителем в ароматическом фрагменте, галоген - фтор, хлор, бром или йод.- 13019244 Термин "алкил" подразумевает как линейные, так и разветвленные алкильные группы; но упоминание индивидуальной группы, например "пропил", относится только к радикалу с прямой цепью, а разветвленный изомер, т.е. "изопропил", должен быть назван отдельно. Конкретно, алкил C1-6 включает метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, 3-пентил, неопентил, гексил и аналогичные группы с любым видом разветвления. Конкретные предпочтительные значения, перечисленные ниже для радикалов, заместителей и интервалов, приведены только для иллюстрации, не исключают другие заданные значения или иные значения в рамках заданных интервалов для радикалов и заместителей."Лечение" означает воздействие на болезненное состояние млекопитающего и включает: (а) предотвращение появления болезненного состояния в организме млекопитающего, в частности, когда указанное млекопитающее имеет предрасположенность к развитию такого состояния, но его наличие не диагностировано; (b) сдерживание болезненного состояния, например остановку его развития; и/или (с) облегчение тяжести болезненного состояния, например, за счет его регрессии до достижения желаемого предела. К понятию лечение также относится уменьшение интенсивности симптомов заболевания (например, уменьшение боли или дискомфорта), причем такое уменьшение интенсивности симптомов может воздействовать, но может и не воздействовать непосредственно на заболевание (например, причину,передачу, проявление и т.д.). В настоящем описании термин "в сочетании с" относится к совместному введению препарата против отторжения и агониста аденозиновых рецепторов A2A. Совместное введение препарата и агониста аденозиновых рецепторов A2A подразумевает либо их одновременное введение в виде смеси, либо последовательное введение. Последовательное введение агонистов аденозиновых рецепторов A2A подразумевает их введение до другого препарата за несколько минут либо за период до 48 ч. Агонисты аденозиновых рецепторов A2A можно вводить и после другого препарата. Предпочтительно введение агонистов аденозиновых рецепторов A2A осуществляется в течение периода около 24 ч, более предпочтительно около 12 ч. Соединения согласно настоящему изобретению, как правило, названы по правилам номенклатуры ИЮПАК или CAS. Применяются сокращения, хорошо известные рядовым специалистам в данной области (например, Ph - фенил, Me - метил, Et -этил, ч - час или часы и к.т. - комнатная температура). Для специалистов в данной области будет очевидным, что соединения согласно настоящему изобретению содержат более одного хирального центра, т.е. могут быть выделены в оптически активной форме или в виде рацематов. Предпочтительно рибозидный фрагмент в соединениях настоящего изобретения является производным D-рибозы. Некоторые соединения могут проявлять полиморфизм. Следует учитывать, что настоящее изобретение охватывает все рацемические, оптически активные, полиморфные или стереоизомерные формы соединения настоящего изобретения, а также их смеси, которые обладают описанными здесь полезными свойствами, причем способы получения оптически активных форм известны в данной области (например, расщепление рацемата путем кристаллизации или ферментативным методом, синтез из оптически активных исходных веществ, асимметрический синтез, хроматографическое разделение на хиральной неподвижной фазе) и определение аденозин-агонистической активности с помощью методов испытаний, описанных в настоящем документе, или других аналогичных методов испытаний, хорошо известных в данной области. К воспалительным реакциям, которые можно лечить (включая профилактическое лечение) действием соединения настоящего изобретения, необязательно, с ингибитором фосфодиэстеразы 4-го типа, относятся воспаления, вызванные: (а) аутоиммунной стимуляцией (аутоиммунные заболевания), такие как красная волчанка, рассеянный склероз, бесплодие, связанное с эндометриозом, сахарный диабет 1 типа, в том числе разрушение островков Лангерганса, приводящее к диабету, а также воспалительные следствия диабета, включая трофические язвы на ногах, болезнь Крона, неспецифический язвенный колит, воспалительная болезнь кишечника, остеопороз и ревматоидный артрит; (b) аллергические заболевания, такие как астма, сенная лихорадка, ринит, реакция на сумах ядоносный, весенний конъюнктивит и другие состояния, опосредованные эозинофилами; (с) кожные заболевания такие как псориаз, контактный дерматит, экзема, инфекционные кожные язвы, заживление открытых ран, целлюлит; (d) инфекционные заболевания, включающие сепсис, септический шок, энцефалит, инфекционный артрит, эндотоксический шок, грамотрицательный септический шок, эндотоксиновая лихорадка, сибирская язва, чума, туляремия,эбола, опоясывающий лишай, токсический шок, церебральная малярия, бактериальный менингит, синдром острой дыхательной недостаточности (ОДН), хроническая обструктивная болезнь легких (ХОБЛ),болезнь Лайма, ВИЧ-инфицирование (репликация ВИЧ, усиленная ФНО , ингибирование активности обратной транскриптазы ФНО ); (е) болезненное истощение: кахексия вследствие рака или ВИЧ; (f) трансплантация органов, тканей или клеток (например, костного мозга, роговицы, почек, легких, печени,сердца, кожи, островков Лангерганса), включая отторжение трансплантата и реакцию "трансплантат против хозяина"; (g) неблагоприятное воздействие лекарственной терапии, в том числе вредное воздействие терапии амфотерицином В, вредное воздействие иммуносупрессивной терапии, например терапия интерлейкином 1, вредное воздействие препаратов ОКТЗ, контрастных красителей, антибиотиков; вредное- 14019244 воздействие препаратов ГМ-КСФ, вредное воздействие циклоспорина, а также вредное воздействие препаратов аминогликозида, вызванные иммуносупрессией стоматит и мукозит; (h) сердечно-сосудистые состояния, включающие расстройства кровообращения, вызванные либо усиленные воспалительной реакцией, такие как ишемия, атеросклероз, заболевание периферических сосудов, рестеноз после ангиопластики, воспалительная аневризма аорты, васкулит, нарушение мозгового кровообращения, травма спинного мозга, застойная сердечная недостаточность, геморрагический шок, ишемия/реперфузия, вазоспазм при субарахноидальном кровоизлиянии, вазоспазм при остром нарушении мозгового кровообращения,плеврит, перикардит и сердечно-сосудистые осложнения диабета; (i) диализ, в том числе перикардит вследствие перитонеального диализа; (j) подагра и (k) химический или термический ожог кислотой, щелочью и т.д. Дополнительные заболевания включают заболевания лошадей, такие как воспаление копыта и хромота в результате падения. Особый интерес представляет эффективное применение данных соединений для снижения воспалительных реакций, если ишемия/реперфузия вызвана ангиопластикой или тромболизом. Также особый интерес представляет эффективное применение данных соединений для снижения воспалительных реакций, вызванных трансплантацией органов, тканей или клеток, т.е. трансплантацией аллогенной или ксеногенной ткани в организм млекопитающего реципиента, аутоиммунным заболеванием, а также воспалительных состояний, вызванных патологиями кровообращения, и, кроме того, их лечением, включая ангиопластику, установку стента, шунтирование или имплантацию. Неожиданно было обнаружено, что введение одного или нескольких соединений настоящего изобретения эффективно после начала воспалительной реакции, например после того, как патология или травма, вызывающая воспалительную реакцию, уже возникла. Ткани или клетки, содержащие связанные с лигандами активные центры рецепторов, могут служить для измерения селективности испытуемых соединений по отношению к специфическим подтипам рецептора, количества биологически активного соединения в крови и других физиологических жидкостях, либо они могут служить как инструмент для выявления потенциальных терапевтических агентов для лечения заболеваний и состояний, связанных с активацией центров рецепторов, путем контактирования указанных агентов с указанными комплексами лиганд-рецептор и измерения степени вытеснения лиганда и/или связывания агента либо клеточного ответа на воздействие указанного агента (например, накопление цАМФ). В данном описании использованы следующие сокращения: К специфическим ингибиторам фосфодиэстеразы 4-го типа, применимым в рамках данного изобретения, относятся рацемические и оптически активные 4-(полиакоксифенил)-2-пирролидоны, раскрытые и описанные в патенте США 4193926. Примером соответствующего ингибитора фосфодиэстеразы 4-го типа является ролипрам. В настоящем изобретении далее предлагаются фармацевтические композиции, включающие соединение настоящего изобретения в сочетании с одним или более представителем, выбранным из группы,состоящей из: (а) ингибиторов биосинтеза лейкотриенов, ингибиторов 5-липоксигеназы (5-ЛО) и антагонистов белка, активирующего 5-липоксигеназу (FLAP), выбранных из группы, включающей зилейтон;MK-591, MK-886 и BAY1005; (b) антагонисты рецепторов лейкотриенов LTB4, LTC4, LTD4 и LTE4,выбранные из группы, включающей производное фенотиазин-3-она L-651,392; амидиновое производноеCGS-25019c; производное бензоксазоламина - онтазоласт; производное бензолкарбоксимидамида BIIL 284/260; соединение зафирлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст (MK-679), RG-12525,Ro-245913, иралукаст (CGP 45715 А) и BAY7195; (d) ингибиторы 5-липоксигеназы (5-LO); и антагонисты белка, активирующего 5-липоксигеназу (FLAP); (e) двойные ингибиторы 5-липоксигеназы (5-LO) и антагонисты фактора активации тромбоцитов (ФАТ); (f) теофиллин и аминофиллин (g) ингибиторы ЦОГ-1 (NSAID); и моноксид азота NSAID; (h) селективный ингибитор ЦОГ-2 рофекоксиб; (i) вдыхаемые глюкокортикоиды со сниженными системными побочными эффектами, выбранные из группы, состоящей из преднизона, преднизолона, флунизолида, триамцинолон ацетонида, беклометазон дипропионата,будезонида, флутиказон пропионата и мометазон фуроата; (j) антагонисты фактора активации тромбоцитов (ФАТ); (k) моноклональные антитела, активные против эндогенных воспалительных образований; (l) препараты против фактора некроза опухоли (ФНО), выбранные из группы, состоящей из этанерсепта,инфликсимаба и D2E7; (m) ингибиторы адгезии молекул, включающие антагонисты VLA-4; (n) иммунодепрессивные препараты, выбранные из группы, состоящей из циклоспорина, азатиоприна и метотрексата; или (о) средства против подагры, выбранные из группы, состоящей из колхицинов. Примерами фармацевтически приемлемых солей являются соли присоединения карбоновых кислот,образованные кислотами с фармацевтически приемлемыми анионами, такими как тозилат, метансульфонат, малат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, -кетоглутарат и глицерофосфат. Возможно образование и неорганических солей, в том числе гидрохлоридов, сульфатов,нитратов, бикарбонатов и карбонатов. Фармацевтически приемлемые соли можно получить по стандартным методикам, хорошо известным в данной области, например взаимодействием соединения с достаточной основностью, например,амина, с подходящей кислотой, содержащей физиологически приемлемый анион. Можно получать и соли щелочных металлов (натрия, калия или лития) или щелочно-земельных металлов (например, кальция) с карбоновыми кислотами. Соединения согласно настоящему изобретению можно смешивать с другими компонентами для получения фармацевтических композиций и вводить в организм млекопитающего, например человека, в виде различных форм, в зависимости от выбранного пути введения, который может быть пероральным или парэнтеральным, внутривенным, внутримышечным, местным или подкожным. Таким образом, настоящие соединения пригодны для систематического введения, например, перорально в сочетании с фармацевтически приемлемой основой, такими как инертный разбавитель или усвояемый пищевой носитель. Они могут быть заключены в мягкую или твердую желатиновую капсулу,сформованы в таблетки либо могут быть включены непосредственно в пищевой рацион пациента. Для перорального терапевтического введения активное соединение можно сочетать с одним или несколькими наполнителями и применять в виде таблеток для проглатывания, таблеток для рассасывания, пастилок,капсул, эликсиров, суспензий, сиропов, пластинок и т.п. Такие композиции и препараты должны содержать не менее 0,1% активного вещества. Содержание композиций и препаратов, разумеется, может меняться, для удобства находясь обычно в интервале от приблизительно 2 до приблизительно 60 мас.% данной единичной лекарственной формы. Количество активного вещества в такой терапевтически полезной композиции должно обеспечивать прием эффективной дозы. Таблетки, пастилки, драже, капсулы и т.п. могут содержать связующие вещества, такие как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; наполнитель, например фосфат дикальция; разрушающий агент, например кукурузный крахмал, картофельный крахмал, альгиновую кислоту и т.п.; смазывающее вещество, например стеарат магния; и подсластитель, например сахарозу,фруктозу, лактозу или аспартам, или ароматизатор, например перечную мяту, винтергреневое масло или вишневый ароматизатор. Если единичной лекарственной формой является капсула, то помимо указанных выше материалов, она может содержать жидкий носитель, например растительное масло или полиэтиленгликоль. Другие материалы могут присутствовать в качестве оболочки или модифицируя иным образом физический вид твердой единичной лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты оболочной из желатина, воска, шеллака, сахара и т.п. Сироп или эликсир могут содержать активное вещество, а также сахарозу или фруктозу в качестве подсластителя, метил- и пропилпарабены как стабилизаторы, краситель и ароматизатор, например, с ароматом вишни или апельсина. Разумеется любой материал, входящий в состав любой единичной лекарственной формы, должен быть фармацевтически приемлемым и в основном нетоксичным в тех количествах, в которых употребляется. Помимо этого, активное вещество может входить в состав препаратов или устройств с замедленным высвобождением.- 17019244 Введение активного вещества может осуществляться внутривенно или внутрибрюшинно за счет инфузии или инъекции. Растворы активного вещества или его солей могут быть приготовлены в воде,необязательно в смеси с нетоксичным поверхностно-активным веществом. Дисперсии можно готовить в глицерине, жидком полиэтиленгликоле, триацетине и их смесях, а также в масле. При обычных условиях хранения и применения данные препараты содержат стабилизатор для предотвращения роста микроорганизмов. Фармацевтические лекарственные формы, пригодные для инъекций или инфузий, могут представлять собой стерильные водные растворы, или дисперсии, или стерильные порошки, включающие активный ингредиент и приспособленные для моментального приготовления стерильного раствора или дисперсии для инъекции или инфузии, необязательно инкапсулированные в липосомах. Во всех случаях конечная лекарственная форма должна быть стерильной, жидкой и устойчивой в условиях получения и хранения. Жидкий носитель или основа может представлять собой растворитель или жидкую дисперсную среду, в том числе, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), растительное масло, нетоксичные глицериловые эфиры или их приемлемые смеси. Необходимую текучесть можно поддерживать, например, за счет образования липосом, обеспечивая заданный размер частиц в случае дисперсий или используя поверхностно-активные вещества. Воздействия микроорганизмов можно избежать за счет применения антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тиомерсала и т.п. Во многих случаях предпочтительно включение изотонических агентов, например сахаров, буфера или хлорида натрия. Замедленное всасывание композиции для инъекций может быть достигнуто за счет добавления агентов, замедляющих всасывание, например моностеарата алюминия или желатина. Стерильные растворы для инъекций готовят введением активного вещества в заданное количество нужного растворителя с прочими ингредиентами, перечисленными выше, в зависимости от необходимости, с последующей стерилизаций фильтрованием. В случае стерильных порошков предпочтительными способами приготовления стерильных растворов для инъекций являются вакуумная сушка и лиофилизация, в результате которых образуется порошок активного ингредиента, включающий любой другой компонент, который присутствовал в исходном растворе, стерилизованном фильтрацией. Для местного введения настоящие соединения пригодны в чистом виде, если это жидкости. Однако в общем случае желательно их нанесение на кожу в форме композиций или составов в сочетании с дерматологически приемлемым носителем, который может быть твердым веществом, жидкостью или входить в дерматологический пластырь. Подходящими твердыми носителями могут быть тонкоизмельчнные вещества, например тальк,глина, микрокристаллическая целлюлоза, кремнезм, глинозм и т.п. К подходящим жидким носителям относится вода, спирты или гликоли или смеси вода-спирт/гликоль, в которых данные соединения растворимы или могут быть диспергированы на эффективном уровне, необязательно с помощью нетоксичных поверхностно-активных веществ. Для оптимизации свойств для конкретной области применения можно добавлять адъюванты, например душистые вещества, и дополнительные противомикробные средства. Полученные жидкие композиции можно применять в гигроскопических прокладках, для пропитки бандажей и других перевязочных материалов или распылять на пораженный участок с помощью флаконов с насосом или аэрозольных баллончиков. С жидкими носителями допускается применение загустителей, таких как синтетические полимеры,жирные кислоты, соли и эфиры жирных кислот, жирные спирты, модифицированная целлюлоза или модифицированные минеральные материалы для образования паст, гелей, мазей, мыл и т.п. для нанесения непосредственно на кожу. Примеры соответствующих дерматологических композиций, пригодных для нанесения соединений согласно настоящему изобретению на кожу, раскрыты в работе Jacquet et al. (патент США 4608392),Geria (патент США 4992478), Smith et al. (патент США 4559157) и Wortzman (патент США 4820508). Для определения оптимальных дозировок соединений настоящего изобретения сравнивают их активность in vitro и активность in vivo на животных моделях. Способы экстраполяции дозировок, эффективных для мышей и других животных, на людей известны в данной области; например, см. патент США 4938949. Оптимальная дозировка ингибиторов фосфодиэстеразы 4-го типа известна в данной области. Например, см. патент США 5877180, кол. 12. В общем случае концентрация соединений согласно настоящему изобретению в жидкой композиции, такой как лосьон, составляет около 0,1-25 мас.%. Предпочтительно около 0,5-10 мас.%. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, составляет около 0,1-5 мас.%,предпочтительно около 0,5-2,5 мас.%. Количество соединения или его активной соли или производного, необходимое для его применения в лечении, различается не только в зависимости от конкретной выбранной соли, но также в зависимости от пути введения, природы заболевания, а также возраста и состояния пациента и определяется лечащим врачом или врачом-клиницистом. Однако в общем случае подходящая доза находится в интервале от около 0,5 до около 100 мкг/кг,- 18019244 например от около 10 до около 75 мкг/кг массы тела за 1 сутки, от 3 до около 50 мкг/кг массы тела пациента в сутки, предпочтительно в интервале от 6 до 90 мкг/кг/сутки, наиболее предпочтительно в интервале от 15 до 60 мкг/кг/сутки. Соединение удобно вводить в виде единичной лекарственной формы, например, содержащей 51000 мкг, удобнее 10-750 мкг, наиболее удобно 50-500 мкг активного ингредиента на 1 единичную лекарственную форму. В идеальном случае активный ингредиент вводят в количестве, обеспечивающем пиковую концентрацию активного вещества в плазме от около 0,1 до около 10 нМ, предпочтительно около 0,2-10 нМ,наиболее предпочтительно от около 0,5 до около 5 нМ. Это может быть достигнуто, например, при внутривенной инъекции раствора с концентрацией активного ингредиента 0,05-5%, не обязательно в физиологическом растворе, либо при пероральном приеме пилюли, содержащей около 1-100 мкг активного ингредиента. Желательный уровень вещества в крови может быть обеспечен за счет непрерывной инфузии до достижения около 0,01-5,0 мкг/кг/ч или при интермиттирующей инфузии около 0,4-15 мкг/кг активного ингредиента. Желаемую дозу удобно ввести однократно или в виде нескольких порций через определенные промежутки времени, например за два, три, четыре или более раза в сутки. Порции можно далее дополнительно разделить, например, на несколько частей для произвольных интервалов приема; например для многократных ингаляций из инсуффлятора или внесения большого количества капель в глаза. Например,желательно вводить настоящие композиции внутривенно в течение длительного периода времени после повреждения, давшего начало воспалению. Способность данного соединения согласно изобретению выступать в качестве агониста аденозиновых рецепторов A2A можно определить на фармакологических моделях, которые хорошо известны в данной области либо на основании приведенных ниже испытаний. Настоящие соединения и содержащие их композиции вводят в качестве фармакологических стрессоров при любой из нескольких неинвазивных диагностических методик для измерения характеристик перфузии миокарда. Например, внутривенное введение аденозина может сочетаться с перфузионной сцинтиграфией миокарда с таллием-201 для оценки тяжести ишемии миокарда. В этом случае вместо таллия-201 может быть использован любой из нескольких различных радиофармацевтических препаратов (например, радиофармацевтические препараты, меченные технецием-99m (т.е. Тс-99m-сестамиби,Тс-99m-тебороксим), радиофармацевтические препараты, меченные йодом-123, например I-123-IPPA илиBMIPP, рубидий-82, азот-13 и т.д.). Аналогично одно из заявленных соединений можно вводить в качестве фармакологического стрессора при радиоизотопной вентрикулографии для оценки тяжести дисфункции сократимости миокарда. В этом случае радиоизотопная вентрикулография может представлять собой исследование первого прохождения или равновесную вентрикулографию правого и/или левого желудочка. Аналогично соединение согласно настоящему изобретению можно вводить как фармакологический стрессор при эхокардиографии для оценки наличия аномалий кинетики стенок. Аналогично активное вещество можно вводить в качестве фармакологического стрессора при инвазивном измерении коронарного кровотока, например, с помощью внутрисердечного катетера для оценки функционального состояния стенозированных коронарных сосудов. Предлагается также способ диагностики аномалий перфузии миокарда у млекопитающих, включающий: (а) парэнтеральное введение в организм названного млекопитающего соединения или композиции, описанных выше; и (b) проведение процедуры обнаружения стеноза коронарной артерии у указанного млекопитающего, определение тяжести стеноза коронарной артерии или и то, и другое. Дисфункция миокарда может представлять собой, например, заболевание коронарной артерии, дисфункцию желудочков и различие в кровотоке между неповрежденными коронарными сосудами и/или стенозированными коронарными сосудами. Способы обнаружения наличия и оценки тяжести заболевания коронарной артерии включают, например, визуализацию перфузии миокарда с радиофармацевтическим препаратом, визуализация функций желудочков, либо методы измерения скорости коронарного кровотока. Методами визуализации перфузии миокарда с радиофармацевтическим препаратом относятся, например, планарная сцинтиграфия, однофотонная эмиссионная компьютерная томография (ОФЭКТ), позитронная эмиссионная томография (ПЭТ), ядерно-магнитно-резонансная (ЯМР) томография, перфузионная контрастная эхокардиография, цифровая субтракционная ангиография (ЦСА) и ультраскоростная рентгеновская компьютерная томография (CINE CT). Радиофармацевтический препарат может быть использован в процессах визуализации перфузии миокарда, причем радиофармацевтический препарат может представлять собой, например, радиоактивный изотоп, выбранный из группы, состоящей из таллия-201, технеция-99m,азота-13, рубидия-82, йода-123 и кислорода-15. Если способ визуализации перфузии миокарда с радиофармацевтическим препаратом представляет собой сцинтиграфию, радиофармацевтический препарат может быть таллием-201. Метод визуализации функций желудочков может, например, представлять собой эхокардиографию, контрастную вентрикулографию или радионуклидную вентрикулографию. Метод измерения скорости коронарного кровотока может, например, представлять измерение допплеровским детектором, цифровую субтракционную ангиографию и радионуклидные способы визуализации. Указанные методы диагностики могут включать следующие стадии: (а) введение в организм человека путем- 19019244 внутривенной инфузии или болюсной инъекции соединения или композиции, описанных выше, в количестве, достаточном для расширения коронарной артерии; (b) введение радиофармацевтического препарата таллия-201 или технеция-99m в организм человека и (с) проведение сцинтиграфического исследования для обнаружения наличия и оценки тяжести заболевания коронарной артерии. Радиофармацевтическим препаратом может быть, например, Тс-99m-сестамиби. Обычно метод включает введение одного или нескольких соединений согласно настоящему изобретению путем внутривенной инфузии в количестве, эффективном для расширения коронарной артерии (приблизительно 0,25-500 мкг/кг/мин, предпочтительно 1-250 мкг/кг/мин). Однако в случае инвазивного исследования может требоваться внутрикоронарное введение препарата в составе болюса в дозах 0,5-50 мкг. Предпочтительные способы предполагают использование соединения согласно настоящему изобретению в качестве замены физической нагрузки при визуализации перфузии миокарда для выявления наличия и оценки тяжести заболевания коронарной артерии у человека, причем визуализация перфузии миокарда осуществляется одним из нескольких методов, включающих радионуклидную визуализацию перфузии миокарда с помощью планарной сцинтиграфии или однофотонной эмиссионной компьютерной томографии (ОФЭКТ), позитронной эмиссионной томографии (ПЭТ), ядерно-магнитно-резонансной(ЯМР) томографии, перфузионной контрастной эхокардиографии, цифровой субтракционной ангиографии (ЦСА) или ультраскоростной рентгеновской компьютерной томографии (CINE CT). Предлагается также способ, предполагающий применение соединения согласно настоящему изобретению в качестве замены физической нагрузки при визуализации для выявления наличия и/или оценки тяжести ишемической дисфункции желудочков у человека, причем ишемическую дисфункцию желудочков оценивают одним из методов визуализации, включающих эхокардиографию, контрастную вентрикулографию или радионуклидную вентрикулографию. Дисфункция миокарда может представлять собой заболевание коронарной артерии, дисфункцию желудочков и различие в кровотоке между неповрежденными коронарными сосудами и/или стенозированными коронарными сосудами и т.п. Предлагается также способ, включающий применение соединения согласно настоящему изобретению в качестве агента, вызывающего гиперемию, в сочетании со средствами измерения скорости коронарного кровотока для оценки сосудорасширяющей возможности (резервной емкости) коронарных артерий человека, причем скорость коронарного кровотока измеряют одним из методов, включающих измерение допплеровским датчиком и цифровую субтракционную ангиографию. Более подробно изобретение описано в нижеследующих примерах, которые приведены для его иллюстрации, но не предназначены для ограничения области его применения. Примеры Спектры протонного магнитного резонанса (ПМР) регистрировали на спектрометре Varian Gemini 2000 (или аналогичном) с рабочей частотой 300 МГц. Химические сдвиги выражены в м.д. (миллионные доли) по отношению к тетраметилсилану. При описании спектров s=синглет, d=дублет, t=триплет,q=квартет и m=мультиплет. Масс-спектры записывали на приборе Finnigan LCQ Advantage. Аналитическую ВЭЖХ проводили на колонках Shimazdu LC10 или LC20 Systemtimes (150 мм), как описано ниже. Препаративную ВЭЖХ проводили на колонке Shimadzu Discovery HPLC с неподвижной фазой Shim-packVP-ODS C18 (20100 мм) при комнатной температуре. Соединения элюировали со скоростью 30 мл/мин градиентом 20-80% воды (с добавкой 0,1% ТФУ) в метаноле в течение 15 мин при УФ-обнаружении на длине волны 254 нм с помощью настраиваемого детектора SPD10A VP. Для всех приведенных конечных соединений чистота по данным ВЭЖХ составляла 98%. Флеш-хроматографию проводили на Silicyle 60Agel (230-400 меш) или на хроматографических колонках для многократного использования и в системе отRT Scientific, Manchester N.H. Все реакции проводили в атмосфере азота в высушенной над пламенем посуде, если не указано иначе. Пример 1. Циклобутиловый эфир 4-3-[6-амино-9-(5-циклопропилакарбамоил-3,4-дигидрокситетрагидрофуран-2-ил)-9 Н-пурин-2-ил]-проп-2-инилпиперидин-1-карбоновой кислоты К трифосгену (0,34 экв.) при перемешивании в ТГФ при 0 С в инертной атмосфере медленно прибавляли спирт (1,0 экв.) и диметиланилин (1,1 экв.) в виде раствора в сухом ТГФ. Через 10 мин реакционную смесь нагревали до комнатной температуры и перемешивали еще 3 ч. Добавляли сухой CH2Cl2 и смесь медленно выливали в раствор N-гидроксисукцинамида (1,3 экв.) в сухом CH2Cl2 при 0 С. Реакционную смесь медленно нагревали до комнатной температуры и продолжали перемешивание до утра. К смеси добавляли воду, перемешивали еще 3 ч и добавляли EtOAc. Органический слой трижды промывали водой, один раз насыщенным раствором NaCl, сушили MgSO4 и упаривали. Полученное масло (которое может представлять собой смесь карбоната и симметричного ангидрида) без очистки использовали Производное пиперидина (0,75 экв.) растворяли в сухом ТГФ и медленно прибавляли ТЭА (избыток) при комнатной температуре в инертной атмосфере. К карбонату (1,0 экв.) приливали ТГФ, затем полученную смесь прибавляли по каплям к раствору пиперидина. Смесь перемешивали 24 ч и упаривали перед нанесением на хроматографическую колонку с силикагелем (с градиентом, начиная со 100% гексана до 80% CH2Cl2 в гексане). Полученное масло (выход 60%) хранили при 4 С до дальнейшего использования. Йодпроизводное (1,0 экв.) растворяли в смеси ДМФА:MeCN:ТЭА (5:5:1) (все растворители были тщательно дегазированы) и перемешивали при комнатной температуре в инертной атмосфере. Добавляли палладиевый катализатор (5 мол.%) и йодид меди(I) (1,05 экв.), а затем производное алкина (4,0 экв.). Полученный темный раствор перемешивали до утра, затем упаривали перед нанесением на хроматографическую колонку (элюирование градиентом от 100% CH2Cl2 до 10% МеОН в CH2Cl2). Образовавшееся масло очищали препаративной ВЭЖХ, получая грязно-белый твердый продукт (выход 30%). ПМР (ДМСО)8.56 (с, 1 Н), 8.30 (с, 1 Н), 7.52 (с, 2 Н), 5.97 (д, 1 Н, J=6.6), 5.67 (д.д, 2 Н, J=21.3, 4.8),4.84 (к, 1 Н, J=5.9), 4,64 (к, 1 Н, J=4.8), 4.30 (д, 1 Н, J=2.1), 4.21 (м, 1H), 4.00 (д, 2 Н, J=12.9), 3.12 (м, 1 Н),2.719 (м, 4 Н), 2.430 (д, 2 Н, J=6.3), 2.272 (м, 2 Н), 2.00 (м, 2 Н), 1.77 (м, 2 Н), 1.56 (м, 2 Н), 1.207 (м, 2 Н), 0.68 К раствору N-циклопропил-2-йодкарбоксамидоаденозина (0,101 г, 0,226 ммоль) прибавляли тетрагидрофуран-3-ил-4-(проп-2-инил)пиперидин-1-карбоксилат (1,620 г, 6,83 ммоль) согласно общей методике С-2-сочетания, приведенной в примере 1: выход 54 мг, 43%. Масс-спектр низкого разрешения (ионизация электрораспылением) (М+Н+) 556.3. ВЭЖХ, комн. темп. = 6,0 мин. Пример 3. К раствору N-циклопропил-2-йодкарбоксамидоаденозина (0,100 г, 0,224 ммоль) прибавляли тетрагидро-2H-пиран-4-ил-4-(проп-2-инил)пиперидин-1-карбоксилат (3,290 г, 13,09 ммоль) согласно общей методике С-2-сочетания, приведенной в примере 1, выход 41 мг, 32%. Масс-спектр низкого разрешения(ионизация электрораспылением (М+Н+) 570.3. ВЭЖХ комн. темп. = 6,5 мин. Приготовление клеточных культур и мембран. Клетки Sf9 культивировали в среде Грейса с добавлением 10% эмбриональной бычьей сыворотки,2,5 мкг/мл амфотерицина В и 50 мкг/мл гентамицина в атмосфере 50% N2/50% О 2. Вирусное инфицирование осуществляли при плотности 2,5106 клеток/мл при множественности заражения, равной 2, для каждого вируса. Инфицированные клетки собирали через 3 суток после инфицирования и дважды промывали в буфере PBS (рН буфера 6.3). Далее клетки повторно суспендировали в буфере для лизиса (20 мМ HEPES рН 7,5, 150 мМ NaCl, 3 мМ MgCl2, 1 мМ -меркаптоэтанола (ВМЕ), 5 мкг/мл лейпептина, 5 мкг/мл пепстатина А, 1 мкг/мл апротинина и 0,1 мМ PMSF) и мгновенно замораживали для хранения при-80 С. Клетки размораживали на льду, доводили до общего объема 30 мл буфером для лизиса и разрушали при кавитации под действием N2 (600 psi в течение 20 мин). Для удаления нелизированных клеток проводили низкоскоростное центрифугирование (1000g, 10 мин), а затем - высокоскоростное центрифугирование (17000g, 30 мин). Осадок после второго центрифугирования гомогенизировали в буфере, содержащем 20 мМ HEPES рН 8, 100 мМ NaCl, 1% глицерина, 2 мкг/мл лейпептина, 2 мкг/мл пепстатина А, 2 мкг/мл апротинина, 0,1 мМ PMSF и 10 мкМ GDP в небольшом стеклянном гомогенизаторе с последующим пропусканием через иглу 26 gauge. Отбирали аликвоты и мембраны мгновенно замораживали в жидком N2 и хранили при -80 С. Мембраны клеток, стабильно экспрессирующих АР A1 человека (клетки СНО K1) или АР А 3 человека (клетки HEK 293), готовили, как описано в литературе (Robeva et al., 1996). Анализы радиолигандного связывания. Радиолигандное связывание с рекомбинантными рецепторами A2A человека в мембранах клеток Sf9 проводили либо с меченым агонистом 125I-APE (Luthin et al.,1995), либо меченым антагонистом 125I-ZM241385 (125I-ZM). Для обнаружения высокого сродства, чувствительного к GTPS состояния АР A1 и А 3, мы применяли агонист 125I-ABA (Linden et al., 1985; Linden etal., 1993). Опыты по связыванию повторяли трижды с 5 мкг (A2A) или 25 мкг (A1 и A3) мембранного белка и с общим объемом 0,1 мл буфера НЕ (20 мМ HEPES и 1 мМ ЭДТА) с 1 ед./мл аденозиндеаминазы и 5 мМ MgCl2 в присутствии или в отсутствие 50 мкМ GTPS. Мембраны инкубировали с радиолигандами при комнатной температуре в течение 3 ч (для агонистов) или 2 ч (для антагонистов) на 96-луночных фильтровальных планшетах GF/C Millipore Multiscreen и прекращали испытание быстрой фильтрацией на коллекторе клеток (Brandel, Gaithersburg, MD) с последующей четырехкратной промывкой по 150 мкл ледяным 10 мМ Трис-HCl, рН 7.4, 10 мМ MgCl2 в течение 30 с. Неспецифическое связывание определяли в присутствии 50 мкМ NECA. Анализ конкурентного связывания проводили, как описано (Robeva et al.,1996) с помощью 0,5-1 нМ 125I-APE, 125I-ZM241385 или 125I-АВА. Мы обнаружили, что в некоторых случаях важно заменять наконечник пипетки после каждого серийного разведения для предотвращения перехода на наконечник активных гидрофобных соединений. Величины Ki для конкурентного связывания соединений с одним и тем же центром определяли на основе величин IC50 с поправкой на расходование радиолиганда и конкурирующего соединения, как описано ранее (Linden, 1982).of an Efficient Generic Protein Purification Procedure. Biochem Pharmacol 51: 545-555. Хемилюминесцентные методы. Усиленная люминолом хемилюминесценция - показатель окислительной активности нейтрофилов - зависит как от продукции супероксида, так и от мобилизации в гранулах лизосомального фермента миелопероксидазы. Свет излучают неустойчивые кислородсодержащие частицы с высокой энергией, такие как хлорноватистая кислота и синглетный кислород, которые генерируются активированными нейтрофилами. Очищенные человеческие нейтрофилы (2106/мл), суспендированные в солевом растворе Хенкса,содержащем 0,1% человеческого сывороточного альбумина (HSA), аденозиндеаминазы (1 ед./мл) и ролипрам (100 нМ) инкубировали (37 С) на водяной бане 15 мин в присутствии или в отсутствие rhФНО(10 ед./мл) после инкубирования аликвоты по 100 л ПМН переносили в лунки (96-луночные планшеты для культивирования тканей с белыми стенками и прозрачным дном Costar 3670; 2 лунки /условия), содержащие 50 л HSA и люминол (конечная концентрация 100 М) в присутствии или в отсутствие агониста аденозина (конечная концентрация агониста 0,01-1000 нМ). Планшет инкубировали 5 мин (37 С), затем в каждую лунку добавляли хемотактический пептид fMLP (50 л в HSA; конечная концентрация 1 М). Максимальную хемилюминесценцию измеряли с помощью счетчика Victor 1420 Multilabel Counter в режиме хемилюминесценции с помощью программ Wallac Workstation. Данные по хемилюминесцент- 22019244 ным пикам приведены в процентах по отношению к активности в отсутствие агониста аденозина. Величину ЕС 50 определяли по программам PRISM. Все соединения испытывали с ПМН от трех разных доноров. Влияние агонистов A2A на окислительную активность нейтрофилов. Для опыта использовали коммерческие f-met-leu-phe (fMLP), люминол, супероксиддисмутазу, цитохром С, фибриноген, аденозиндеаминазу и трипановый синий (Sigma Chemical). Раствор фиколл-гипак приобретали в компании ICN(Aurora, ОН), Cardinal Scientific (Santa Fe, NM) и Accurate Chemicals and Scientific (Westerbury, NY). Эндотоксин (липополисахарид; E. coli K235) - в компании List Biologicals (Campbell, CA). Солевой раствор Хенкса (HBSS) и набор для анализа LAL (водного лизата амебоцитов) - в компании BioWittaker (Walkersville, MD). Человеческий сывороточный альбумин (HSA) - в компании Cutter Biological (Elkhart, IN). Рекомбинантный человеческий фактор некроза опухоли- являлся продукцией компании DianipponPharmaceutical Co. Ltd. (Осака, Япония). ZM241385 (4-(2-[7-амино-2-(2-фурил)[1,2,4]триазоло[2,3 а][1,3,5]триазин-5-ил-амино]этил)фенол) был предоставлен в дар компанией Simon Poucher, Zeneca Pharmaceuticals, Чешир, Великобритания. Исходные растворы (1 мМ и 10 мМ в ДМСО) готовили и хранили при -20 С. Приготовление человеческих нейтрофилов. Очищенные нейтрофилы (98% нейтрофилов и 95% жизнеспособных по исключению трипанового синего), содержащие 1 тромбоцита на 5 нейтрофилов и 50 пг/мл эндотоксина (анализ лизата амебоцитов мечехвоста), получали из нормальной гепаринизированной (10 ед./мл) венозной крови с помощью одностадийного метода разделения с раствором фиколлгипак (A. Ferrante et al., J. Immunol. Meth 36, 109 (1980. Выделение кислородсодержащих частиц с воспалительной активностью из примированных и стимулированных нейтрофилов человека. Хемилюминесценция. Усиленная люминолом хемилюминесценция - показатель окислительной активности нейтрофилов - зависит как от продукции супероксида, так и от мобилизации в гранулах лизосомального фермента миелопероксидазы. Свет излучает неустойчивые кислородсодержащие частицы с высокой энергией, такие как хлорноватистая кислота и синглетный кислород, которые генерируются активированными нейтрофилами. Очищенные нейтрофилы (5-10105/мл) инкубировали в солевом растворе Хенкса, содержащем 0,1% человеческого сывороточного альбумина (1 мл), с испытуемым агонистом A2A в присутствии или в отсутствие ролипрама, а также в присутствии или в отсутствие фактора некроза опухоли- (1 ед./мл) в течение 30 мин при 37 С при встряхивании на водяной бане. Далее хемилюминесценцию, усиленную люминолом(Crono-log Corp., Havertown, PA) при 37 С в течение 2-4 мин. Данные по хемилюминесценции регистрировали как относительную высоту пика испускаемого света (= высоту кривой) в сравнении с образцами,содержащими фактор некроза опухоли- и не содержащими агониста и ролипрама. Все публикации, патенты и патентные документы включены в данный документ посредством ссылки, как если бы каждый их них был отдельно включен посредством ссылки. В описании изобретения приведены различные специфические и предпочтительные осуществления и методики. Тем не менее,следует иметь в виду, что, не выходя за пределы сущности и области изобретения, можно провести его различные модификации и вариации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I, или его стереоизомер, или его фармацевтически приемлемая сольR1 и R2 независимо выбраны из Н и алкила С 1-3;Z2 независимо выбран из F, алкила C1-4, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN,(CH2)aCO2R3 и (CH2)aCONR3R3;R3 независимо выбран из H и алкила C1-6;R4 выбран из CH2OR и C(O)NRR; каждый R независимо выбран из Н, алкила С 1-4, циклобутила и (СН 2)a-циклопропила; а выбран из 0, 1 и 2 иZ2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;R3 независимо выбран из Н и алкила C1-2;R4 - C(O)NRR; каждый R независимо выбран из Н, алкила C1-4, циклопропила, циклобутила и -СН 2-циклопропила и 4. Соединение формулы II, или его стереоизомер, или его фармацевтически приемлемая сольR1 и R2 независимо выбраны из Н и алкила С 1-3;Z2 независимо выбран из F, алкила C1-4, CF3, OCF3, (CH2)aOR3, (CH2)aNR3R3, NO2, (CH2)aCN,(CH2)aCO2R3 и (CH2)aCONR3R3;R3 независимо выбран из Н и алкила C1-6;- 24019244 каждый R независимо выбран из Н, алкила C1-4, циклобутила и (СН 2)a-циклопропила; а выбран из 0, 1 и 2. 5. Соединение по п.4, гдеZ2 независимо выбран из F, алкила C1-2, CF3, OCF3 и OR3;R3 независимо выбран из Н и алкила C1-2;R4 - C(O)NRR и каждый R независимо выбран из Н, алкила С 1-4, циклопропила, циклобутила и -СН 2-циклопропила. 6. Соединение по п.4, выбранное из 11. Соединение формулы III, или его стереоизомер, или его фармацевтически приемлемая соль
МПК / Метки
МПК: A01N 43/90, A61K 31/52
Метки: применение, замещенные, кислот, 4-{3-[6-амино-9-(3,4-дигидрокситетрагидрофуран-2-ил)-9н-пурин-2-ил]-проп-2-инил}пиперидин-1-карбоновых, эфиры
Код ссылки
<a href="https://eas.patents.su/30-19244-zameshhennye-efiry-4-3-6-amino-9-34-digidroksitetragidrofuran-2-il-9n-purin-2-il-prop-2-inilpiperidin-1-karbonovyh-kislot-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные эфиры 4-{3-[6-амино-9-(3,4-дигидрокситетрагидрофуран-2-ил)-9н-пурин-2-ил]-проп-2-инил}пиперидин-1-карбоновых кислот и их применение</a>
Предыдущий патент: Инсектицидные соединения
Следующий патент: Уплотнительное средство, узел герметизации и способ производства
Случайный патент: Средство для повышения октанового числа бензинового автомобильного топлива