Производные 3,3а,8,12b-тетрагидро-2н-дибензо[3,4:6,7]циклогепта[1,2-b]фурана
Номер патента: 12628
Опубликовано: 30.10.2009
Авторы: Андрес-Хиль Хосе Игнасио, Мегенс Антониус Адрианус Хендрикус Петрус, Фернандес-Гадеа Франсиско Хавьер, Трабанко-Суарес Андрес Авелино, Сид-Нуньес Хосе Мария
Формула / Реферат
1. Соединение формулы (I)
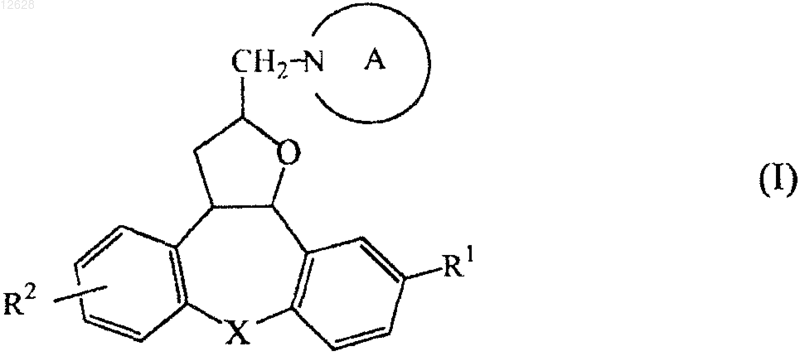
его фармацевтически приемлемая аддитивная соль с кислотой или основанием, стереохимически изомерная форма, N-оксидная форма и четвертичная аммониевая соль, где
R1 представляет собой водород, галоген или С1-6алкилокси;
R2 представляет собой водород или циано; и
а) X представляет собой О;
А представляет собой радикал формулы (а-1), (а-2) или (а-3)
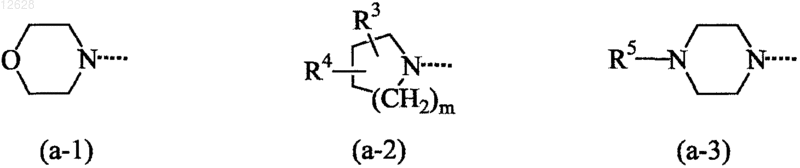
где m представляет собой целое число, равное 0, 1, 2 или 3;
R3 и R4, каждый независимо, представляют собой водород, C1-6алкил или арил; и
R5 представляет собой водород; C1-6алкил; C1-6алкилкарбонил; C1-6алкилкарбонилоксиалкил; C1-6алкилоксикарбонил; арил или С1-6алкил, замещенный одним или несколькими заместителями, выбранными из гидроксильной группы, C1-6алкилокси, C1-6алкилкарбонилокси и арила; или
b) X представляет собой СН2;
А представляет собой радикал формулы (а-2) или (а-3), представленной выше,
где m представляет собой целое число, равное 0, 1, 2 или 3;
R3 и R4, каждый независимо, представляют собой водород или C1-6алкил;
R5 представляет собой водород; С2-6алкил; C1-6алкилкарбонил; C1-6алкилкарбонилоксиалкил; C1-6алкилоксикарбонил или С1-6алкил, замещенный одним или несколькими заместителями, выбранными из гидроксильной группы и арила, при условии, что 2-гидроксиэтил исключен из числа заместителей; и
арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидроксильной группы, С1-6алкила и галогенметила.
2. Соединение по п.1, где
R1 представляет собой галоген;
R2 представляет собой водород;
арил представляет собой фенил или фенил, замещенный галогеном или галогенметилом.
3. Соединение по любому из пп.1 или 2, где
X представляет собой О;
А представляет собой радикал формулы (а-1), (а-2) или (а-3), представленных выше, где
m представляет собой целое число, равное 1 или 2;
R3 и R4, каждый независимо, представляют собой водород или арил;
R5 представляет собой C1-6алкил или C1-6алкил, замещенный гидроксильным заместителем.
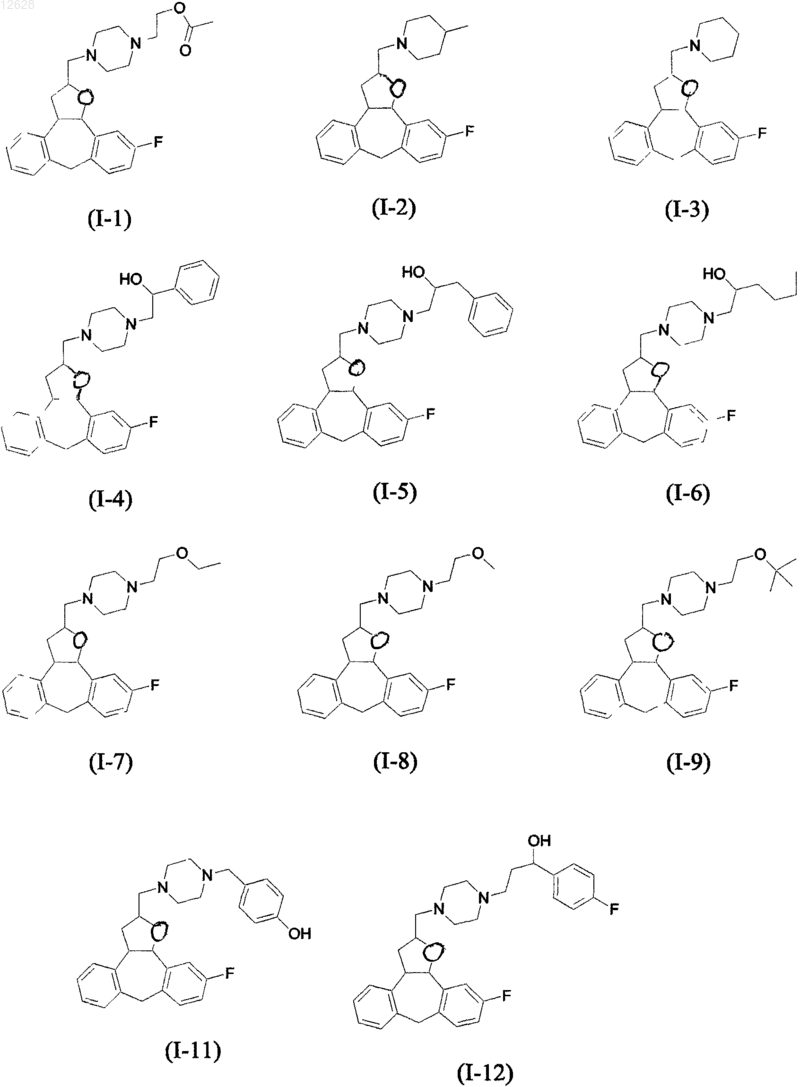
4. Соединение по п.1, где соединение имеет одну из следующих структурных формул с (I-1) по (I-12), представленных ниже:
5. Соединение по любому из пп.1-4, где соль представляет собой трифторацетат, оксалат или манделат.
6. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
7. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения как профилактического, так и терапевтического или того и другого состояний, опосредуемых 5-HT2 и/или D2 рецептором.
8. Применение соединения по п.7 для получения лекарственного средства для лечения и/или предупреждения расстройств центральной нервной системы, таких как состояние страха, биполярные расстройства, расстройства сна и сексуальные расстройства, психоз, пограничный психоз, шизофрения, мигрень, расстройство личности или обсессивно-компульсивные расстройства, социальные фобии или приступы панического страха, органические психические расстройства, психические расстройства у детей, агрессия, расстройства памяти и ориентации у пожилых людей, наркомания, ожирение, булимия и аналогичные расстройства.
9. Применение соединения по п.8 для получения лекарственного средства для лечения и/или предупреждения состояния страха, психоза, шизофрении, мигрени и привыкания к злоупотреблению лекарственными средствами.
10. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения согласно любому из пп.1-5 в качестве активного ингредиента.
11. Способ получения композиции по п.10, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивается с терапевтически эффективным количеством соединения по любому из пп.1-5.
12. Способ получения соединений формулы (I) по п.1, включающий алкилирование промежуточного соединения формулы (II) промежуточным соединением формулы (III)
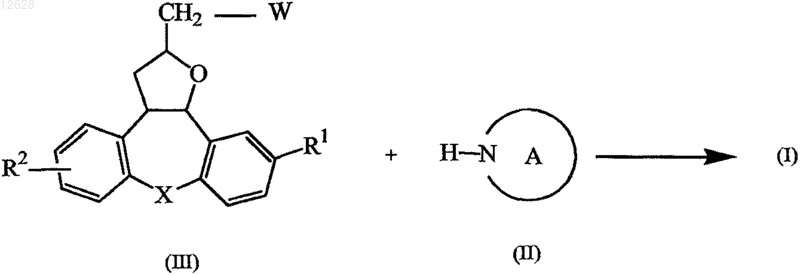
где R1, R2, X и циклический фрагмент А принимают значения, определенные в п.1, и W представляет собой подходящую удаляемую группу, такую как галоген или органическая сульфонильная группа.
Текст
012628 Область техники, к которой относится изобретение Настоящее изобретение относится к новым замещенным тетрациклическим производным тетрагидрофурана, содержащим в боковой цепи циклическую аминогруппу и обладающим сродством связывания в отношении серотониновых рецепторов, в частности 5-HT2A и 5-HT2C рецепторов, и в отношении допаминовых рецепторов, в частности допаминовых D2 рецепторов, к фармацевтическим композициям,включающим соединения согласно настоящему изобретению, их применению в качестве лекарственных средств, в частности для профилактики и/или лечения ряда психических и неврологических расстройств,в частности некоторых психотических, сердечно-сосудистых и гастрокинетических расстройств, и к способам получения указанных соединений. Уровень техники В заявке WO 97/38991, опубликованной 23 октября 1997 г. (Janssen Pharmaceutica N.V.), описаны замещенные тетрациклические производные тетрагидрофурана, которые могут применяться в качестве терапевтических средств для лечения или профилактики расстройств ЦНС, сердечно-сосудистых расстройств или желудочно-кишечных расстройств. В частности, соединения показали сродство к серотониновым 5-HT2A и 5-HT2C рецепторам. В заявке WO 99/19317, опубликованной 22 апреля 1999 г. (Janssen Pharmaceutica N.V.), описываются замещенные тетрациклические производные тетрагидрофурана со специфическим галогеновым замещением на дибензоазепиновом, дибензоксазепиновом, дибензотиепиновом или дибензосуберановом цикле. Соединения могут применяться для лечения или профилактики расстройств ЦНС, сердечнососудистых расстройств или желудочно-кишечных расстройств и показали более быстрое действие по сравнению с соединениями, описанными в WO 97/38 991. В заявке WO 03/048146, опубликованной 12 июня 2003 г. (Janssen Pharmaceutica N.V.), и заявке WO 03/048147, опубликованной 12 июня 2003 г. (Janssen Pharmaceutica N.V.), описаны способы получения каждого из четырех транс-диастереоизомеров, соответственно цис-конденсированных 3,3a,8,12bтетрагидро-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фурановых производных в стереохимически чистой форме из единственного энантиомерно чистого предшественника. Соединения, описанные в WO 03/048146, проявили сродство в отношении 5-HT2 рецепторов, в частности в отношении 5-HT2A и 5-HT2C рецепторов. Соединения, описанные в WO 03/048147, проявили сродство в отношении 5-HT2A, 5-HT2C и 5-HT7 рецепторов, H1-рецепторов (pIC50=7,15-7,89), D2 и/или D3 рецепторов и к транспортерам обратного захвата норепинефрина (pIC50=6,03-7,34). Соединения, описанные в двух последних публикациях, не содержат в боковой цепи группу циклического амина. В заявке WO 03/040122, опубликованной 15 мая 2003 г. (Janssen Pharmaceutica N.V.), описываются манделатные соли соединения согласно WO 97/38991 и WO 99/19317. Неожиданно было установлено,что указанные соли являются более стабильными при повышенной температуре и повышенной относительной влажности, чем соединения, описанные в WO 97/38991 и WO 99/19317. Описание изобретения 3 адача, на решение которой направлено настоящее изобретение, состоит в разработке новых аналогов тетрациклических тетрагидрофурановых производных, описанных в WO 97/39001 и WO 99/19317,которые обладают улучшенным фармакологическим профилем по сравнению с соединениями, описанными в указанных WO публикациях. Поставленная задача решена с помощью новых соединений, формулы (I) их фармацевтически приемлемых аддитивных солей с кислотой или основанием, стереохимически изомерных форм, N-оксидных форм и четвертичных аммониевых солей, гдеR2 представляет собой водород или циано; и а) X представляет собой O; и А представляет собой радикал формулы (а-1), (а-2) или (а-3) где m представляет собой целое число, равное 0, 1, 2 или 3;R3 и R4, каждый независимо, представляет собой водород, C1-6 алкил или арил иR5 представляет собой водород; C1-6 алкил; C1-6 алкилкарбонил; C1-6 алкилкарбонилоксиалкил; C1-6 ал-1 012628 килоксикарбонил; арил; или C1-6 алкил, замещенный одним или несколькими заместителями, выбранными из гидроксильной группы, C1-6 алкилокси, C1-6 алкилкарбонилокси и арила; илиb) X представляет собой СН 2; и А представляет собой радикал формулы (а-2) или (а-3), представленных выше, гдеm представляет собой целое число, равное 0, 1, 2 или 3;R3 и R4, каждый независимо, представляет собой водород или C1-6 алкил иR5 представляет собой водород; С 2-6 алкил; C1-6 алкилкарбонил; C1-6 алкилкарбонилоксиалкил; C1-6 алкилоксикарбонил; или C1-6 алкил, замещенный одним или несколькими заместителями, выбранными из гидроксильной группы и арила, при условии, что 2-гидроксиэтил исключен из числа заместителей; и арил представляет собой фенил; или фенил, замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидроксильной группы, С 1-6 алкила и галогенметила. Соединения согласно настоящему изобретению структурно характеризуются присутствием в боковой цепи циклического амина в положении 2. Было установлено, что присутствие такой боковой цепи обеспечивает соединения, которые обладают сильным сродством по отношению к D2 рецептору, активностью, не характерной для соединений указанных выше WO заявок WO 97/38991 и WO 99/19317, что делает соединения согласно настоящему изобретению особенно подходящими для применения при лечении психозов, таких как мания, возбуждение, агрессия и положительные симптомы шизофрении. В отличие от вышеуказанных соединения согласно настоящему изобретению не проявляют сколько-нибудь значительной ингибирующей активности в отношении обратного захвата соединений, транспортирующих норэпинефрин (norepinephrine transporter reuptake - NET), которая показывает, что они не обладают полезной антидепрессантной активностью. Отсутствие такой антидепрессантной активности может иметь преимущество при выборе соединения для определенного терапевтического профиля, в особенности, когда соединения дополнительно обладают сродством в отношении 5-HT2A и 5-HT2C рецепторов. Такой профиль активности соединения согласно настоящему изобретения не был показан и не выдвигался в качестве гипотезы в указанных выше WO публикациях. Точнее, настоящее изобретение относится к соединению общей формулы (I), его фармацевтически приемлемой аддитивной соли с кислотой или основанием, стереохимически изомерной форме, Nоксидной форме и четвертичной аммониевой соли, гдеR2 представляет собой водород; арил представляет собой фенил или фенил, замещенный галогеном или галогенметилом. Точнее, настоящее изобретение относится к соединению формулы (I), его фармацевтически приемлемой аддитивной соли с кислотой или основанием, стереохимически изомерной форме, N-оксидной форме и четвертичной аммониевой соли, гдеX представляет собой О или S; А представляет собой радикал формулы (а-1), (а-2) или (а-3), представленных выше, гдеm представляет собой целое число, равное 1 или 2;R3 и R4, каждый, независимо, представляет собой водород или арил иR5 представляет собой C1-6 алкил или C1-6 алкил, замещенный гидроксильным заместителем. Особенно предпочтительные соединения согласно настоящему изобретению включают основные соединения 5, 12, 17, 27, 28, 29, 34, 35, 36, 39, 44 и 46, описанные в изобретении, в частности представленные в табл. 1 ниже, и их фармацевтически приемлемые аддитивные соли с кислотой или основанием, стереохимически изомерные формы, N-оксидные формы и четвертичные аммониевые соли. Точнее, оно относится к соединениям одной из следующих структурных формул с (I-1) по (I-12), представленных ниже, их фармацевтически приемлемым аддитивным солям с кислотой или основанием, стереохимически изомерным формам, N-оксидным формам и четвертичным аммониевым солям: Подробное описание изобретения В рамках настоящего изобретения термин алкил относится к одновалентному прямому или разветвленному насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода, или,если это особо оговорено, содержащему от 2 до 6 атомов углерода, такому как, например, метил, этил,пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил, гексил; кроме того, термин алкил определяет одновалентный циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, такой как, например, циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Определение алкил включает также, за исключением особо оговоренных случаев, алкильный радикал,который является необязательно замещенным одним или несколькими радикалами, такими как фенил,галоген, циано, оксогруппа, гидроксильная группа, формил и аминогруппа, например, гидроксиалкил, в частности, гидроксиметил и гидроксиэтил, и полигалогеналкил, в частности, дифторметил и трифторметил. В описании настоящего изобретения термин галоген представляет собой общее родовое название фтора, хлора, брома и йода. В описании настоящего изобретения термин соединение(я) согласно настоящему изобретению означает соединение(я), соответствующее(ие) формуле (I), его (их) фармацевтически приемлемую(ые) аддитивную(ые) соль(и) с кислотой или основанием, стереохимически изомерную(ые) форму(ы), Nоксидную(ые) форму(ы) и четвертичную(ые) аммониевую(ые) соль(и). Определение фармацевтически приемлемые соли включает терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Указанные соли могут быть получены обработкой основной формы соединений формулы (I) подходящими кислотами, например неорганическими кислотами, такими как галогенисто-водородная кислота, в частности соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, такими как, например, уксусная кислота, гидроксиуксусная кислота,трифторуксусная кислота, пропановая кислота, молочная кислота, пирувиновая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, миндальная кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая-3 012628 кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламиновая кислота, салициловая кислота, п-аминосалициловая кислота, памоиновая кислота и миндальная кислота. Предпочтительными солями являются соли, полученные из трифторуксусной кислоты (.C2HF3O2,трифторацетат), щавелевой кислоты (.С 2 Н 2 О 2, оксалат) и миндальной кислоты (.C6H5C2O3H3, манделат). Указанные солевые формы могут снова превращаться в свободные формы обработкой подходящим основанием. Термин аддитивная соль, когда применяется в настоящем изобретении, включает также сольваты,которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются,например, гидраты и алкоголяты. Подразумевается, что термин N-оксидные формы соединений согласно формуле (I) включает соединения формулы (I), в которых один или несколько атомов азота окислен(ы) до так называемого Nоксида, в частности такие N-оксиды, в которых один или несколько атомов третичного азота (в частности, в которых атомы третичного азота содержат R1 и R2 заместители) являются N-окисленными. ТакиеN-оксиды могут быть легко получены специалистом без какой бы то ни было квалификации изобретателя, и они представляют собой очевидные альтернативы соединений согласно формуле (I), поскольку эти соединения являются их метаболитами, которые образуются в результате окисления в организме человека после поглощения. Как известно, окисление обычно является первой стадией метаболизма лекарственного средства (Textbook of Organic Medicinal и Pharmaceutical Chemistry, 1977, pages 70-75). Известно также, что вместо самого соединения в организм человека может вводиться его метаболит, что приводит к таким же значительным эффектам. Соединения согласно настоящему изобретению содержат по меньшей мере один атом азота, который способен подвергаться окислению (фрагмент третичного амина). Поэтому высока вероятность того,что N-оксиды образуются в процессе их метаболизма в организме человека. Соединения формулы (I) могут превращаться в соответствующие N-оксидные формы в соответствии с известными в данной области техники методиками превращения трехвалентного азота в его Nоксидную форму. Указанная реакция N-окисления обычно может проводиться взаимодействием исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, такие как пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать надкислоты, например надбензойную кислоту или галогензамещенную надбензойную кислоту, например 3-хлорнадбензойную кислоту, алкановые надкислоты, например надуксусную кислоту, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и т.п.,углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Термин четвертичная аммониевая соль соединения согласно формуле (I) определяет соединение,которое может быть получено взаимодействием между основным атомом азота соединения согласно формуле (I) и подходящим соединением, способным образовывать четвертичную соль, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, в частности метилйодид и бензилйодид. Могут применяться также другие реагенты с легко удаляемыми группами, такие как, например, алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-птолуолсульфонаты. Четвертичная аммониевая соль содержит по меньшей мере один положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают ионы хлора, брома, йода,трифторацетатный и ацетатный ионы. Изобретение включает также производное соединение (обычно называемое пролекарством) фармакологически активного соединения согласно настоящему изобретению, в частности согласно формуле(I), которое подвергается разложению in vivo с получением соединения согласно настоящему изобретению. Пролекарства обычно (но не всегда) обладают меньшим сродством по отношению к целевому рецептору, чем соединения, которые образуются в результате их разложения. Пролекарства особенно полезны, когда целевое соединение обладает химическими или физическими свойствами, которые затрудняют его введение или делают его неэффективным. Например, целевое соединение может обладать очень плохой растворимостью, оно может плохо переноситься в эпителии слизистой оболочки или может иметь нежелательно короткий период полураспада в плазме. Дополнительное обсуждение свойств пролекарств можно найти в публикациях Stella, V.J. et al.,"Prodrugs", Drug Delivery Systems, 1985, pp. 112-176; Drugs, 1985,29, pp. 455-473. Пролекарственная форма фармакологически активного соединения согласно настоящему изобретению обычно будет представлять собой соединение согласно формуле (I), его фармацевтически приемлемую аддитивную соль с кислотой или основанием, N-оксидную форму или четвертичную аммониевую соль, содержащую кислотную группу, которая является этерифицированной или амидированной. Такие этерифицированные кислотные группы включают группы формулы -COORX, где RX представляет собойC1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил, фенил или бензил и Rz представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединение согласно настоящему изобретению, содержащее аминогруппу, может взаимодействовать с кетоном или альдегидом, таким как формальдегид, с получением основания Манниха. Данное основание будет подвергаться гидролизу в водном растворе в соответствии с реакцией, кинетика которой описывается уравнением первого порядка. Термин стереохимически изомерные формы, упомянутый выше, определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). 3a исключением особо оговоренных или особо указанных случаев, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. То есть стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-,либо транс-конфигурацию. Соединения, содержащие двойные связи, могут также иметь Е- или Zстереохимию на указанной двойной связи. Несомненно подразумевается, что стереохимически изомерные формы соединений формулы (I) включены в область настоящего изобретения. В соответствии с CAS-номенклатурой, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, дескриптор R или S относится (исходя из правила Cahn-IngoldPrelog) к хиральному центру низшего порядкового номера. R и S, каждый, означают оптически чистые стереогенные центры с неопределенной абсолютной конфигурацией. Если используются символыи: заместитель высшего приоритета на асимметрическом атоме углерода в циклической системе цикла низшего порядкового номера всегда принудительно находится в а-положении срединной плоскости,определенной циклической системой. Положение заместителя высшего приоритета на другом асимметрическом атоме углерода в циклической системе (атом водорода в соединениях согласно формуле (I относительно положения наиболее приоритетного заместителя на указанном атоме обозначается как ,если он находится по одну сторону относительно срединной плоскости, определенной циклической системой, или как , если он находится по другую сторону относительно срединной плоскости, определенной циклической системой. В структуре настоящего изобретения подразумевается, что соединение согласно изобретению, по существу, включает все изотопные комбинации его химических элементов. В структуре настоящего изобретения термин химический элемент, в особенности, когда относится к соединению согласно формуле (I), включает все изотопы и смеси изотопов данного элемента, существующие в природе или полученные синтетическим способом, как с существующим в природе относительным содержанием изотопов,так и в изотопно обогащенной форме. В частности, когда данный термин упоминается в отношении водорода, подразумевается, что он относится к 1 Н, 2 Н, 3 Н и их смесям; когда данный термин упоминается в отношении углерода, подразумевается, что он относится к 11 С, 12 С, 13 С, 14 С и их смесям; когда данный термин упоминается в отношении азота, подразумевается, что он относится к 13N, 14N, 15N и их смесям; когда данный термин упоминается в отношении кислорода, подразумевается, что он относится к 14 О, 15 О,16 О, 17 О, 18 О и их смесям; и когда данный термин упоминается в отношении фтора, подразумевается, что он относится к 18F, 19F и их смесям. Таким образом, соединение согласно настоящему изобретению, по существу, включает соединение с одним или несколькими изотопами одного или нескольких элементов и их смеси, включая радиоактивное соединение, также называемое соединением, меченным изотопом, в котором один или несколько нерадиоактивных атомов были заменены одним из радиоактивных изотопов. Термин меченное изотопом соединение означает любое соединение согласно формуле (I), его фармацевтически приемлемую аддитивную соль с кислотой или с основанием, N-оксидную форму или четвертичную аммониевую соль,которая содержит по меньшей мере один радиоактивный атом. Например, соединение может быть мечено позитроном или гамма-излучающими радиоактивными изотопами. Для методов, в которых используется радиолигандное связывание (анализ мембранного рецептора), атомами выбора, подлежащими замене, являются 3 Н-атом и 125I-атом. Наиболее часто применяемыми для визуализации позитронизлучающими радиоактивными изотопами являются 11C, 18F, 15O и 13N, которые получают на ускорителе и период полураспада которых составляет 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада этих радиоактивных изотопов являются слишком короткими, они подходят для применения только в институтах, которые располагают ускорителем для их производства, что ограничивает их применение. Наиболее широко используемыми из них являются 18F, 99mTc, 201Tl и 123I. Работа с такими радиоактивными изотопами, их получение, выделение и введение в молекулу известны специалистам в данной области техники.-5 012628 В частности, радиоактивный атом выбирается из группы, включающей атомы водорода, углерода,азота, серы, кислорода и галогена. Предпочтительно радиоактивный атом выбирается из группы, включающей атомы водорода, углерода и галогена. Точнее, радиоактивный изотоп выбирается из группы, включающей 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I,75 76Br, Br, 77Br и 82Br. Предпочтительно, радиоактивный изотоп выбирается из группы, включающей 3 Н,11C и 18F. Нумерация атомов в тетрациклической кольцевой системе, присутствующей в соединениях формулы (I), которая соответствует номенклатуре Chemical Abstracts, представлена на формуле, приведенной ниже. Соединения формулы (I) в своей химической структуре содержат, по меньшей мере, три стереогенных центра, а именно атомы углерода в положениях 2, 3a и 12b. Указанные асимметричные центры и любые другие асимметричные центры, которые могут присутствовать, обозначены символами R и S. Соединения формулы (I), которые получают способами, описанными ниже, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут разделяться в соответствии с известными методиками разделения. Рацемические соединения формулы (I) могут подвергаться превращению в соответствующие диастереомерные солевые формы посредством взаимодействия с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделяются, например, селективной или фракционной кристаллизацией, а энантиомеры выделяются из них с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы могут быть получены также из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ при условии, что реакция протекает стереоспецифически. Предпочтительно, если необходимо получить специфический стереоизомер, указанное соединение должно синтезироваться стереоспецифическими способами получения. В таких способах будут преимущественно применяться энантиомерно чистые исходные вещества. Фармакология Соединения согласно настоящему изобретению проявили сродство к 2-HT2 рецепторам, в частности, 5-HT2A и 5-HT2C рецепторам (номенклатура описана в публикации D. Ноуег, "Serotonin (5-HT) inneurologic and psychiatric disorders", ed. by M.D. Ferrari, published by the Boerhaave Commission of the University of Leiden, 1994) и сродство в отношении D2 рецептора. Антагонистические свойства представленных соединений в отношении серотонина могут быть продемонстрированы их ингибирующим действием в 5-гидрокситриптофановом тесте на крысах, который описан в "публикации Drug Dev. Res., 13, 237244 (1988). Соединения согласно настоящему изобретению обладают также подходящими физикохимическими свойствами. Например, они являются химически стабильными соединениями. Ввиду способности блокировать 5-HT2, в частности блокировать. 5-HT2A и 5-HT2C рецепторы, а также D2 рецептор, соединения согласно изобретению могут применяться в качестве терапевтического лекарственного средства, в частности для профилактики и терапевтического лечения состояний, опосредованных любым из этих рецепторов. Таким образом, изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли с кислотой или основанием, стереохимически изомерной форме, Nоксидной форме и четвертичной аммониевой соли для применения в качестве лекарственного средства. Изобретение относится также к применению соединения согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли с кислотой или основанием, стереохимически изомерной формы, N-оксидной формы и четвертичной аммониевой соли для получения лекарственного средства для лечения, в том числе для профилактики или терапевтического лечения или для обеих этих целей, состояний, опосредованных 5-HT2 и/или D2 рецепторами. Ввиду таких фармакологических и физико-химических свойств соединения формулы (I) применимы в качестве терапевтических средств для лечения или предупреждения расстройств центральной нервной системы, таких как состояние страха, биполярные расстройства, расстройства сна и сексуальные расстройства, психоз, пограничный психоз, шизофрения, мигрень, расстройство личности или обсессивно-компульсивные расстройства, социальные фобии или приступы панического страха, органические психические расстройства, психические расстройства у детей, такие как ADHD, агрессия, расстройства памяти и ориентации у пожилых людей, наркомания, ожирение, булимия и аналогичные расстройства. В-6 012628 частности, представленные соединения могут применяться в качестве анксиолитических средств, противопсихотических средств, противошизофренических средств, противомигрениевых средств и в качестве средств, обладающих способностью устранять привыкание к злоупотреблению лекарственными средствами. Соединения формулы (I) могут также применяться в качестве терапевтических средств для лечения нарушения моторики. Может быть полезно применять представленные соединения в сочетании с классическими терапевтическими средствами для таких расстройств. Соединения формулы (I) также могут использоваться для лечения или профилактики повреждения нервной системы, вызванного травмой, инсультом, нейродегенеративными заболеваниями и т.п.; сердечно-сосудистых расстройств, таких как повышенное кровяное давление, тромбоз, инсульт и т.п.; и желудочно-кишечных расстройств, таких как нарушение моторики желудочно-кишечной системы и т.п. Следовательно, ввиду описанных выше применений соединений формулы (I) настоящее изобретение предоставляет также способ лечения теплокровных животных, страдающих такими заболеваниями,причем указанный способ включает систематическое введение терапевтического количества соединения формулы (I), эффективного при лечении перечисленных выше расстройств, в частности, при лечении состояния страха, психоза, мигрени и привыкания к злоупотреблению лекарственными средствами. Таким образом, настоящее изобретение относится также к применению соединений формулы (I),определенных выше, в качестве лекарственного средства; в частности, соединения формулы (I) могут применяться для получения лекарственного средства для лечения состояния страха, психоза, мигрени и привыкания к злоупотреблению лекарственными средствами. Квалифицированные специалисты в области лечения таких заболеваний могли бы определить суточное терапевтически эффективное количество в результате испытаний, представленных далее. Суточное терапевтически эффективное количество должно находиться в интервале от примерно 0,01 мг/кг массы тела до примерно 10 мг/кг массы тела, более предпочтительно от примерно 0,05 до примерно 1 мг/кг массы тела. Изобретение также относится к фармацевтической композиции, включающей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения согласно изобретению, в частности соединение формулы (I), его фармацевтически приемлемую аддитивную соль с кислотой или основанием, стереохимически изомерную форму, N-оксидную форму или четвертичную аммониевую соль. Для облегчения введения рассматриваемые соединения могут быть введены в различные фармацевтические формы. Соединения согласно настоящему изобретению, в частности соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли с кислотой или основанием, стереохимически изомерные формы, N-оксидные формы и четвертичные аммониевые соли или любая подгруппа или сочетание таких подгрупп и форм могут вводиться в различные фармацевтические формы для введения. В качестве подходящих композиций могут быть перечислены все композиции, обычно применяемые для систематического введения лекарственных форм. Для получения фармацевтических композиций согласно настоящему изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента объединяется в тонко измельченной смеси с фармацевтически приемлемым носителем, который может принимать самые различные формы в зависимости от формы препарата, желательной для введения. Такие фармацевтические композиции желательно представляют собой стандартную лекарственную форму, подходящую, в частности, для введения перорально,ректально, чрескожно, в виде парентеральной инъекции или ингаляцией. Например, при получении композиций в лекарственной форме для перорального введения может применяться любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, вещества, улучшающие скольжение,связующие вещества, дезинтеграторы и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря легкости введения таблетки и капсулы представляют собой наиболее удобные стандартные лекарственные формы для перорального введения, в которых, очевидно, применяются твердые фармацевтические носители. В композициях для парентерального введения носитель обычно будет включать стерильную воду, по меньшей мере, в большей части, хотя могут вводиться и другие ингредиенты, например, для повышения растворимости. Могут быть получены, например, растворы для инъекций, в которых носитель включает раствор соли (физиологический раствор), раствор глюкозы или смесь раствора соли и раствора глюкозы. Растворы для инъекций, содержащие соединения формулы (I), могут вводиться в масляный препарат для пролонгированного действия. Подходящими маслами для этой цели являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические сложные глицериновые эфиры жирных кислот с длинной цепью и их смеси с другими маслами. Кроме того, могут быть получены суспензии для инъекций, в которых могут использоваться подходящие жидкие носители, суспендирующие добавки и т.д. Они включают также препараты твердой формы, которые предназначены для превращения в препараты жидкой формы непосредственно перед применением. В композициях, подходящих для чрескожного введения, носитель необязательно включает добавку-7 012628 для повышения пенетрации и/или подходящий смачивающий агент, необязательно в сочетании с небольшими количествами подходящей добавки любой природы, которые не оказывают значительного неблагоприятного воздействия на кожу. Указанные добавки могут способствовать введению в кожу и/или могут быть полезными для получения желательных композиций. Эти композиции могут вводиться различными способами, например, в виде чрескожной заплаты, в виде пятна или в виде мази. Аддитивные соли с кислотой или основанием соединений формулы (I) благодаря повышенной растворимости в воде по сравнению с соответствующей основной или кислотной формой являются более подходящими для получения водных композиций. Особенно предпочтительно использовать указанные выше фармацевтические композиции в виде стандартной лекарственной формы для облегчения введения и однородности дозировки. Термин стандартная лекарственная форма, когда используется в настоящем изобретении, относится к физически дискретным частицам, подходящим в качестве единичных доз, каждая из которых содержит предопределенное количество активного ингредиента, которое, как предварительно определено, обеспечивает желательный терапевтический эффект, в сочетании с нужным фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с зарубками или таблетки,покрытые оболочкой), капсулы, пилюли, порошки, расфасованные в пакетики, облатки, суппозитории,растворы или суспензии для инъекций и т.п., и их многослойные сегрегации. Поскольку соединения согласно настоящему изобретению представляют собой высокоактивные соединения, которые могут вводиться перорально, фармацевтические композиции для перорального введения, включающие указанные соединения, являются особенно предпочтительными. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях могут предпочтительно применяться -, - или -циклодекстрины или их производные, в частности гидроксиалкилзамещенные циклодекстрины, например 2-гидроксипропилциклодекстрин. Кроме того, растворимость и/или стабильность соединений согласно изобретению в фармацевтических композициях могут повышать сорастворители, такие как спирты. Получение. Соединения формулы (I) обычно могут быть получены N-алкилированием промежуточного соединения формулы (I) промежуточным соединением формулы (III), где W представляет собой подходящую удаляемую группу, такую как галоген, например бром, или органическую сульфонильную группу, такую как п-толуолсульфонил. В промежуточных соединениях (II) и (III) R1, R2, X и циклический фрагмент А принимают значения, которые определены для соединений формулы (I). Указанное N-алкилирование может удобно проводиться в инертном растворителе, таком как, например, метанол, этанол, тетрагидрофуран, метилизобутилкетон, N,N-диметилформамид, диметилсульфоксид или ацетонитрил и, необязательно, в присутствии подходящего основания, такого как оксид кальция. Перемешивание и повышение температуры, например, до температуры кипения растворителя, могут повышать скорость реакции. Альтернативно, указанное N-алкилирование может также осуществляться с использованием методики, описанной в публикации Monkovic et al., J. Med. Chem. (1973), 16(4), p. 403-407, которая включает применение реакционной емкости повышенного давления. Соединения формулы (I) могут также превращаться друг в друга в соответствии с известными в данной области техники реакциями трансформации, например:(a) соединение формулы (I), где R5 представляет собой C1-6 алкил, замещенный гидроксильной группой, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собойC1-6 алкил, замещенный C1-6 алкоксильной группой, обработкой органическим сульфонилгалогенидом,таким как метансульфонилхлорид, например, в присутствии основания, такого как триэтиламин, обычно в растворителе, таком как дихлорметан, с получением соответствующего промежуточного соединения, в котором R5 представляет собой C1-6 алкил, замещенный органической сульфонилоксигруппой, которая затем подвергается обработке метил-C1-6 алканоатом, обычно в подходящем растворителе, таком как этанол;(b) соединение формулы (I), где R5 представляет собой C1-6 алкил, замещенный гидроксильной группой, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собой C1-6 алкил, замещенный C1-6 алкилкарбонилоксигруппой, ацилированием подходящим ацилирующим агентом, например ацилгалогенидом, таким как ацилхлорид, например, в присутствии основания,-8 012628 такого как триэтиламин, обычно в растворителе, таком как дихлорметан;(c) соединение формулы (I), где R5 представляет собой водород, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собой C1-6 алкилкарбонил, ацилированием подходящим ацилирующим агентом, например ацилгалогенидом, таким как ацилхлорид, например, в присутствии основания, такого как триэтиламин, обычно в растворителе, таком как дихлорметан;(d) соединение формулы (I), где R5 представляет собой водород, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собой С 2 алкил, замещенный гидроксильной группой и арилом в положении 2, обработкой подходящим арилэпоксидом в подходящем растворителе,например пропаноле;(e) соединение формулы (I), где R5 представляет собой C1-6 алкил, замещенный гидроксильной группой, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собойC1-6 алкил, замещенный C1-6 алкоксигруппой, обработкой органическим сульфонилгалогенидом, таким как метансульфонилхлорид, например, в присутствии основания, такого как триэтиламин, обычно в растворителе, таком как дихлорметан, с получением соответствующего промежуточного соединения, в которомR5 представляет собой C1-6 алкил, замещенный органической сульфонилоксигруппой, которая затем подвергается обработке алкилоксисоединением металла, например алкоголятом натрия, обычно в подходящем растворителе, таком как метанол;(f) соединение формулы (I), где R5 представляет собой водород, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собой C1-6 алкил, необязательно замещенный арилом, обработкой C1-6 алкил-(необязательно замещенный арилом)-альдегидом в присутствии цианоборгидрида натрия, нанесенного на полимерную подложку (PS-CNBH4Na), и сульфоновой кислоты, нанесенной на полимерную подложку (PS-SO3H) в смеси ТГФ/уксусная кислота и CHCl2 и ТФУК;(g) соединение формулы (I), где R5 представляет собой водород, может превращаться в соответствующее соединение формулы (I), в котором R5 представляет собой C1-6 алкил, замещенный арилом и гидроксильной группой, обработкой арилкарбонилалкилгалогенидом, таким как 2-арилкарбонилэтилгалогенид, например хлоридом, с получением соответствующего промежуточного соединения, в котором R5 представляет собой С 1-6 алкил, замещенный арилкарбонилом, которое затем подвергается восстановлению, например, боргидридом, натрия, обычно в растворителе, таком как этанол, с получением целевого соединения формулы (I); или(h) соединение формулы (I), где R2 представляет собой галоген (например, йод), может превращаться в соответствующее соединение формулы (I), в котором R2 представляет собой цианогруппу, обработкой цианидом, например цианидом цинка, в присутствии палладиевого соединения, такого как Pd(PPh3)4,в подходящем растворителе, например N,N-диметилформамиде. Промежуточные соединения, упомянутые выше, либо являются коммерчески доступными, либо могут быть получены в соответствии с известными в данной области техники методиками. Например,промежуточные соединения формулы (III) могут быть получены в соответствии с методикой, описанной в публикации Monkovic et al., J., Med. Chem. (1973), 16(4), p. 403-407. Альтернативно, промежуточные соединения формулы (III), которые представлены формулой (III-а),также могут быть получены взаимодействием эпоксидного производного формулы (IV) с реактивом Гриньяра формулы (V), где подходящим значением X является галоген, с получением, таким образом,промежуточного соединения формулы (VI), которое может далее подвергаться циклизации в соответствии с известными в данной области техники способами, например, описанными в публикации Monkovic Эпоксиды формулы (IV) могут быть получены с использованием известных в данной области техники методик, таких как эпоксидирование промежуточного соединения формулы (VII), подходящим пероксидом, таким как м-хлорнадбензойная кислота. Стереохимически чистые изомерные формы соединений формулы (I) могут быть получены с помощью известных в данной области техники методик. Диастереомеры могут разделяться физическими способами, такими как селективная кристаллизация, и хроматографическими методами, например противоточным распределением, жидкостной хроматографией и т.п. Экспериментальная часть Далее в описании аббревиатура ДМФА означает N,N-диметилформамид, аббревиатура ДХМ означает дихлорметан, Et3N означает триэтиламин, EtOAc означает этилацетат, EtOH означает этанол, МеОН означает метанол и ТГФ означает тетрагидрофуран. А. Получение промежуточных соединений. Пример А 1.a) Получение промежуточного соединения 1.[2R-(2 а,3a, 12b)] (описанный в WO 03/048146) (0,0114 моль) и 1-пиперазинэтанол (0,0342 моль) подвергают облучению в СВЧ (мощность: 500 Вт; 150 С; 15 мин). 3 атем полученную смесь разбавляютEtOAc. Органический раствор промывают водой, сушат, фильтруют и растворитель выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на открытой короткой колонке (силикагель, элюирование: ДХМ/МеОН 97/3). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 2,5 г промежуточного соединения 1 в виде масла оранжевого цвета, которое используют на следующей стадии без дополнительной очистки.b) Получение промежуточного соединения 2. Метансульфонилхлорид (0,00225 моль) добавляют к раствору промежуточного соединения 1(0,0015 моль) в Et3N (0,42 мл) и сухом ДХМ (10 мл), перемешивают при 0 С. Реакционную смесь перемешивают в течение 16 ч при комнатной температуре. К смеси добавляют воду и полученную смесь перемешивают. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на короткой открытой колонке (силикагель, элюирование: ДХМ/МеОН 98/8). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 0,390 г промежуточного соединения 2. Пример А 2. Получение промежуточного соединения 3. Раствор трифенилфосфина (0,02032 моль) в ТГФ (100 мл) перемешивают при 0 С в атмосфере N2,затем добавляют бис(1-метилэтил)диазодикарбоксилат (0,01992 моль) и полученную суспензию перемешивают в течение 30 мин. К смеси по каплям добавляют раствор цис-8-фтор-10,11-дигидро-11-(2 пропенил)дибензо[b,f]тиепин-10-ола (описан в J. Med. Chem. 2005, 48, 1709) (0,01016 моль) и 4 нитробензойной кислоты (0,02032 моль) в ТГФ и затем реакционную смесь медленно нагревают до ком- 10012628 натной температуры и перемешивают при указанной температуре в течение 16 ч. Растворитель выпаривают и остаток очищают колоночной хроматографией (элюирование: EtOAc/гептан 1/9). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 3,96 г (89%) промежуточного соединения 3. Получение промежуточного соединения 4. Смесь промежуточного соединения 3 (0,0121 моль) и гидроксида лития (0,0127 моль) в ТГФ и воде перемешивают в течение 16 ч при комнатной температуре, после чего растворитель выпаривают. Полученный остаток растворяют в ДХМ и промывают водой и насыщенным раствором соли, затем органический слой сушат и растворитель выпаривают, получая 3,96 г (бесцветное масло) промежуточного соединения 4, которое используют на следующей стадии без дополнительной очистки. Получение промежуточного соединения 5. Промежуточное соединение 4 (0,00387 моль) растворяют в хлороформе (120 мл) при комнатной температуре и смесь перемешивают при 0 С в течение 3 мин, затем небольшими порциями добавляют трибромид пиридиния (0,0039 моль). Смесь выдерживают в течение 10 мин при 0 С, затем охлаждающую баню удаляют и реакционную смесь перемешивают в течение 1 ч. Добавляют воду и фракции разделяют. Органический слой сушат (Na2SO4) и растворитель выпаривают (вакуум). (1 Н-ЯМР: смесь диастереоизомеров 73/27 в положении С 2). Остаток очищают радиальной хроматографией (элюирование: смесь гептан/ДХМ). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 1,00 г (бесцветное масло, транс-конденсированный изомер) промежуточного соединения 5. Пример A3. Получение промежуточного соединения 6. Смесь 4-метил-(11-фтор-3,3a,8,12b-тетрагидро-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-илметил)бензилсульфоната [2R-(2,3a,12b)] (описан в WO 03/048146) (0,023 моль), пиперазина (0,23 моль) и оксида кальция (2,3 моль) в ТГФ перемешивают в течение 16 ч при 140 С (температура масляной бани) в реакторе Парра, затем реакционную смесь охлаждают до комнатной температуры. Твердый осадок отфильтровывают и фильтрат упаривают. Остаток переносят в EtOAc и дважды промывают водой. Органический слой сушат (Na2SO4), фильтруют и растворитель выпаривают (вакуум), получая промежуточное соединение 6 в виде масла коричневого цвета. Пример А 4. Получение промежуточного соединения 7. Смесь промежуточного соединения 6 (0,00284 моль), 3-хлор-1-(4-фторфенил)-1-пропанона (0,00568 моль) и карбоната калия (0,0057 моль) в ацетонитриле (q.s.) подвергают облучению в СВЧ при 250 С в- 11012628 течение 20 мин. Раствор концентрируют при пониженном давлении, остаток растворяют в ДХМ, промывают водой и насыщенным раствором соли, затем сушат. Растворитель выпаривают и остаток очищают колоночной хроматографией на открытой короткой колонке (силикагель, элюирование: ДХМ/МеОН 98/2). Фракции, содержащие продукт, собирают и растворитель выпаривают. Часть полученного остатка(1,2 г, 84%) превращают в этандиоатную соль (1:1) обработкой щавелевой кислотой в диэтилэфире. Образующийся осадок отфильтровывают, промывают охлажденным диэтиловым эфиром и сушат, получая 0,032 г промежуточного соединения 7. Пример А 5. а) Получение промежуточного соединения 8. Смесь промежуточного соединения 4 (0,033 моль) и бис(пиридин)тетрафторбората йода (0,033 моль) в ДХМ (200 мл) перемешивают в течение 1 ч при комнатной температуре. Реакционную смесь промывают насыщенным водным раствором Na2S2O3, 2N HCl, водой и насыщенным раствором соли, затем органический слой сушат, фильтруют и растворитель выпаривают, получая 4,375 г (32%) промежуточного соединения 8, которое используют на следующей стадии без дополнительной очистки.b) Получение промежуточного соединения 9. Смесь промежуточного соединения 8 (0,0106 моль), бис(пиридин)тетрафторбората йода (0,0117 моль) и трифторметансульфоновой кислоты (0,0212 моль) в ДХМ (50 мл) перемешивают в течение 1 ч при комнатной температуре в атмосфере N2. Реакционную смесь промывают Na2S2O3 (250 мл) и насыщенным раствором соли (250 мл). Органический слой отделяют, сушат (Na2SO4), фильтруют и растворитель выпаривают. Остаток (масло) очищают колоночной хроматографией на короткой открытой колонке (силикагель, элюирование: гептан/EtOAc 9/1). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 3,9 г (68%) промежуточного соединения 9. с) Получение промежуточного соединения 10. Смесь промежуточного соединения 9 (0,0024 моль), 1-пиперазинэтанола (0,0024 моль) и оксида кальция (2 г) в ТГФ (20 мл) перемешивают в течение 16 ч при 120 С в реакторе Парра. После охлаждения до комнатной температуры полученную суспензию фильтруют через целит. Фильтрат упаривают при пониженном давлении. Полученный остаток снова растворяют в ДХМ. Органический раствор промывают водным раствором NaHCO3, водой, насыщенным раствором соли, затем отделяют, сушат (Na2SO4),фильтруют и растворитель выпаривают. Остаток (масло) очищают колоночной хроматографией на короткой открытой колонке (силикагель). Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 0,876 г промежуточного соединения 10, которое используют на следующей стадии без дополнительной очистки.- 12012628 В. Получение целевых соединений. Пример В 1. Получение целевого соединения 12.(0,00228 моль) и оксида кальция (0,00228 моль) в ацетонитриле (q.s.) выдерживают в герметичной пробирке при 100 С в течение 3 дней, затем суспензию фильтруют и фильтрат упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на короткой открытой колонке (силикагель,элюирование: ДХМ/МеОН 98,5/1,5). Фракции, содержащие продукт, собирают и растворитель выпаривают. Остаток превращают в этандиоатную соль и полученную соль собирают, получая 0,164 г (98%) целевого соединения 12. Пример В 2. Получение целевых соединений 34. Смесь промежуточного соединения 2 (0,00019 моль) и этоксида натрия (0,0019 моль) в EtOH (10 мл) перемешивают в СВЧ-печи при 100 С в течение 20 мин. Добавляют воду. Смесь концентрируют. Добавляют ДХМ и смесь встряхивают. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на короткой открытой колонке (силикагель, элюирование: ДХМ/МеОН 98/2). Целевые фракции собирают и растворитель выпаривают. Остаток превращают в оксалатную соль, получая 0,128 г целевого соединения 34. Пример B3. Получение целевого соединения 39. Смесь промежуточного соединения 5 (0,003 моль) 1-пиперазинэтанола (0,03 моль) и оксида кальция(0,03 моль) в ТГФ (20 мл) нагревают при 140 С в течение 10 ч в реакторе под давлением, затем фильтруют через декалит. Фильтрат упаривают при пониженном давлении. Остаток растворяют в EtOAc, промывают водой и насыщенным раствором соли и сушат. Органическую фракцию очищают высокоэффективной жидкостной хроматографией (силикагель, элюирование: ДХМ/(MeOH/NH3) 99/1). Целевые фракции собирают и растворитель выпаривают. Остаток (0,045 г) превращают в оксалатную соль, получая 0,047 г целевого соединения 39. Пример В 4. Получение целевых соединений 5. Смесь 1-пиперазинэтанола, 2-(4-11-фтор-3,3a,8,12b-тетрагидро-2 Н-дибензо[3,4:6,7]циклогепта[1,2b]фуран-2-ил]метил)пиперазин-1-ил)этанола [2R-(2 а,3a,12b)] (0,000504 моль) (описан в WO 99/19317),ацетилхлорида (0,000605 моль) и Et3N (0,00101 моль) в ДХМ (10 мл) перемешивают при комнатной температуре в течение 16 ч, затем реакционную смесь промывают водой, сушат и растворитель выпаривают. Остаток очищают колоночной хроматографией на короткой открытой колонке (силикагель, элюирование: ДХМ/МеОН 98/2). Фракции, содержащие продукт, собирают и растворитель выпаривают. Остаток превращают в соль этандионовой кислоты (1:1). Осадок отфильтровывают и сушат, получая 0,187 г целе- 13012628 вого соединения 5. Пример В 5. Получение целевых соединений 22. Хлорид 2-метилпропаноила (1,1 экв.) и Et3N (2 экв.) при перемешивании при комнатной температуре добавляют к раствору промежуточного соединения 6 (0,000567 моль, 1 экв.) в ДХМ (3 мл). Реакционную смесь перемешивают в течение 6 ч при комнатной температуре. Полистирол-трисамин (1 экв.) добавляют к взятому в избытке 2-метилпропаноилхлориду и перемешивают в течение 1 ч. 3 атем смолу отфильтровывают и фильтрат упаривают в вакууме. Остаток очищают колоночной хроматографией на короткой открытой колонке (силикагель). Фракции, содержащие продукт, собирают и растворитель выпаривают. Остаток, представляющий собой свободное основание, растворяют в диэтиловом эфире и превращают в соль этандионовой кислоты (1:1). Осадок отфильтровывают и сушат, получая 0,04742 г целевого соединения 22. Пример В 6. Получение целевых соединений 27. Смесь промежуточного соединения 6 (0,000567 моль) и фенилоксирана (2 экв.) в 2-пропаноле (20 мл) перемешивают в течение ночи при 130 С (температура масляной бани). Реакционную смесь охлаждают до комнатной температуры. Растворитель выпаривают. Остаток очищают ВЭЖХ. Фракции, содержащие продукт, собирают и растворитель выпаривают, получая 0,05628 г соединения в виде свободного основания. Остаток в форме свободного основания растворяют в диэтиловом эфире и превращают в соль этандионовой кислоты (1:1). Осадок отфильтровывают и сушат, получая целевое соединение 27. Пример В 7. Получение целевых соединений 35. Смесь промежуточного соединения 2 (0,00021 моль), NaOMe/MeOH (3 мл) и МеОН (10 мл) смешивают и нагревают в течение 15 мин при 90 С в СВЧ-печи (500 Вт), затем реакционную смесь гасят водой и дважды экстрагируют ДХМ. Органические экстракты объединяют, сушат и растворитель выпаривают(вакуум). Остаток очищают колоночной хроматографией на короткой открытой колонке. Фракции, содержащие продукт, собирают и растворитель выпаривают. Остаток обрабатывают щавелевой кислотой в диэтиловом эфире и продукт превращают в этандиоатную соль (1:2). Образующийся осадок собирают и сушат, получая целевое соединение 35. Пример В 8. Получение целевых соединений 40. Смесь промежуточного соединения 6 (0,085 г, 0,2414 ммоль) и 2-метилпропаналя (1,5 экв., 0,3621 ммоль) добавляют в смесь ТГФ/уксусная кислота (4 мл/0,2 мл). К полученному раствору добавляют бо- 14012628 рогидрид натрия на полимерном носителе (2,5 экв.). Реакционную смесь встряхивают в течение 20 ч при комнатной температуре. Твердые вещества отфильтровывают и летучие вещества выпаривают в вакууме. Остаток, полученный таким образом, переносят в МеОН (4 мл) и добавляют SO3H на полимерном носителе (1,5 экв.). Смесь встряхивают при комнатной температуре в течение 20 часов. Смолу отфильтровывают и промывают дважды МеОН и дважды ДХМ. К смоле добавляют насыщенный раствор NH3 в метаноле и встряхивают в течение 5 ч. Смолу отфильтровывают и раствор упаривают, получая соответствующий продукт в виде чистого свободного основания. Свободное основание обрабатывают раствором трифторуксусной кислоты в ДХМ, получая целевое соединение 40. Пример В 9. Получение целевого соединения 46. Смесь промежуточного соединения 7 (0,00030 мл) и тетрагидроборида натрия (0,003 моль) в EtOH(5 мл) перемешивают в течение 10 ч при комнатной температуре, затем реакционную смесь распределяют между водой и ДХМ. Водный слой экстрагируют несколько раз ДХМ; органические слои объединяют, экстрагируют насыщенным раствором соли, сушат (Na2SO4) и отфильтровывают. Растворитель выпаривают при пониженном давлении и остаток превращают в этандиоатную соль (1:1). Образующийся осадок отфильтровывают, промывают и сушат, получая 0,110 г целевого соединения 46. Пример В 10. Получение целевых соединений 49. Смесь промежуточного соединения 10 (0,0016 моль), цианида цинка (0,0010 моль) и тетракис(трифенилфосфин)палладия (0,00017 моль) в ДХМ (10 мл, предварительно деоксигенированный) перемешивают при комнатной температуре, затем нагревают до 120 С (от 0 до 120 С в течение 5 мин) и выдерживают в течение 15 мин в СВЧ-печи. Смесь фильтруют и органический растворитель (ДМФА) выпаривают. Остаток очищают радиальной хроматографией, фракции, содержащие продукт, собирают и растворитель выпаривают, получая целевое соединение 49. Все полученные целевые соединения представляют собой смеси изомерных форм, за исключением особо оговоренных случаев. В табл. 1 представлены целевые соединения формулы (I), которые получены в соответствии с одним из описанных выше примеров. В табл. 2 представлены данные ЖХМС для выбранных целевых соединений. Аналитические данные. Данные ЖХМС, представленные в табл. 2, были получены в соответствии со следующим методом. ВЭЖХ градиент подают с помощью HP 1100 (Aligent), устанавливая нагреватель колонки на 40 С. Поток из колонки пропускают через детектор фотодиодной матрицы (PDA) и затем разделяют на светорассеивающем детекторе (ELSD) и на времяпролетном масс-спектрометре (Waters-Micromass) с источником электрораспылительной ионизации, работающим одновременно в режиме положительной и отрицательной ионизации. ВЭЖХ с обращенной фазой проводят на XDB-C18 картридже (3,5 мкм, 4,630 мм, Agilent) с объемной скоростью потока 1 мл/мин. Три подвижные фазы (подвижная фаза А: 0,5 г/л, раствор ацетата аммо- 19012628 ния, подвижная фаза В: ацетонитрил; подвижная фаза С: метанол) используют для создания градиентного состояния от 80% А, 10% В, 10% С; 50% В и 50% С на 6,0 мин до 100% В на 6,5 мин, выдерживают до 7,0 мин и снова уравновешивают с 80% А, 10% В и 10% С на 7,6 мин, сохраняя данное состояние до 9,0 мин. Используемый объем впрыска составляет 5 мкл. Масс-спектр высокого разрешения получают сканированием от 100 до 750 в течение 1 с при времени срабатывания 1 с. Напряжение капиллярной иглы равно 3 кВ, и регулятор температуры устанавливают на 140 С. В качестве газа аэрозольного аппарата используют азот. Напряжение конического сопла составляет 30 В как для положительного, так и для отрицательного режима ионизации. Лейцинэнкефалин используют в качестве контроля для фиксированного распыления. Считывание данных проводят на системе Waters-Micromass MassLunx-Openlynx. Данные спектроскопического анализа целевых соединений согласно настоящему изобретению приведены ниже в табл. 2; символ - в соответствующей колонке означает, что значение не определено. Исходная пиковая масса соответствует массе свободного основания +Н+. Таблица 2 С. Фармакологические данные. Пример С.1. Сродство связывания в отношении 5-HT2A и 5-HT2C рецепторов in vitro. Взаимодействие соединений формулы (I) с 5-HT2A и 5-HT2C рецепторами оценивают в опытах радиолигандного связывания in vitro. Обычно радиолиганд низкой концентрации с высоким сродством к связыванию рецептора выдерживают с образцом препарата ткани, обогащенной конкретным рецептором(от 1 до 5 мг ткани) в буферной среде (от 0,2 до 5 мл). В процессе инкубирования радиолиганды связываются с рецептором. Когда достигается равновесие связывания, радиоактивность связанного рецептора отделяют от несвязанной радиоактивности и подсчитывают активность рецепторного связывания. Взаимодействие опытных соединений с рецепторами оценивают в опытах конкурентного связывания. Опытное соединение в различных концентрациях добавляют к инкубационной смеси, содержащей препарат ткани и радиолиганд. Связывание радиолиганда будет ингибироваться опытным соединением пропорционально его сродству к связыванию и его концентрации. Сродство соединения к 5-HT2 рецепторам определяют посредством исследования радиолигандного связывания, проводимого (а) с клонированным 5-HT2A рецептором человека, экспрессированным в L929 клетках, с использованием [125I] R91150 в качестве радиолиганда, и (b) с клонированным 5-HT2C рецептором человека, экспрессированным в СНО клетках, с использованием [3 Н]месулергина в качестве радиолиганда. Пример С.2. Сродство к связыванию D21 рецептора человека in vitro. 3 амороженные мембраны CHO клеток человека, трансфектированные допанин-D2 рецептором, быстро гомогенизируют с использованием гомогенизатора Ultra-Turrax T25 и разбавляют опытным Tris-HCl буфером, содержащим NaCl, CaCl2, MgCl2, KCl (50, 120, 2, 1 и 5 мМ соответственно, значение pH доводят до 7,7 с помощью HCl) до подходящей концентрации белка, оптимизированной для специфического и неспецифического связывания. Радиолигандный [3 Н]спиперон (NEN, специфическая активность 70Ci/ммоль) разбавляют опытным буфером до концентрации 2 нмоль/л. После этого приготовленный радиолиганд (50 мкл) вместе либо с 50 мкл 10% ДМСО в качестве контроля, Butaclamol (целевая концентрация 10-6 моль/л), либо опытным соединением инкубируют (30 мин, 37 С) с 400 мкл полученного мембранного раствора. Мембрансвязанную активность фильтруют через харвестер Packard Filtermane в микропланшеты GF/B Unifilter и промывают ледяным Tris-HCl буфером (50 мМ; pH 7,7; 60,5 мл). Фильтрам дают возможность высохнуть перед добавлением сцинтилляционной жидкости и считывают их с использованием сцинтилляционного счетчика Topcounter. Специфическое связывание и конкурентное связывание, выраженные в процентах, вычисляют с использованием программного обеспечения S-Plus (Insightful). Результаты представлены в табл. 3 ниже в виде значений pIC50 для соответствующих соединений. Сравнительные данные. Данные табл. 4, представленной ниже, показывают, что сродство к D2 рецептору двух соединений согласно настоящему изобретению значительно превосходит сродство ближайшего аналога, описанного в указанной выше публикации WO 99/19317. Значения, приведенные в указанной таблице, представляют собой pIC50, которые были определены в соответствии с методикой, описанной выше для определения сродства к D2.- 22012628 Таблица 4 Сравнение данных in vitro двух соединений согласно изобретению с соответствующим аналогом предшествующего уровняD. Сравнительные примеры. Термин активный ингредиент (а.и.), используемый в приведенных далее примерах, относится к соединению формулы (I), его фармацевтически приемлемой аддитивной соли с кислотой или основанием, стереохимически изомерной форме, N-оксиду и четвертичной аммониевой соли. Пример D.1. Раствор для перорального введения. Метил-4-гидроксибензоат (9 г) и пропил-4-гидроксибензоат (1 г) растворяют в кипящей очищенной воде (4 л). В 3 л полученного раствора растворяют сначала 2,3-дигидроксибутандионовую кислоту (10 г) и затем а.и. (20 г). Последний раствор объединяют с оставшейся частью первого раствора и к полученной смеси добавляют 1,2,3-пропанетриол (12 л) и 70% раствор сорбита (3 л). Сахарин натрия (40 г) растворяют в воде (500 мл) и к полученному раствору добавляют малиновую эссенцию (2 мл) и эссенцию крыжовника (2 мл). Последний раствор объединяют с первым, к полученному раствору объемом 20 л добавляют воду q.s., получая раствор для перорального введения, содержащий 5 мл активного ингредиента на полную чайную ложку (5 мг). Полученный раствор помещают в подходящие контейнеры. Пример D.2. Таблетки, покрытые пленкой. Смесь а.и. (100 г), лактозы (570 г) и крахмала (200 г) тщательно смешивают и затем увлажняют раствором додецилсульфата натрия (5 г) и поливинилпирролидона (10 г) в воде. Влажную порошкообразную смесь просеивают, сушат и снова просеивают. 3 атем добавляют микрокристаллическую целлюлозу(100 г) и гидрогенизированное растительное масло (15 г). Полученную смесь тщательно перемешивают и прессуют в таблетки, получая 10000 таблеток, каждая из которых содержит 10 мг активного ингредиента. Покрытие. К раствору метилцеллюлозы (10 г) в денатурированном этаноле (75 мл) добавляют раствор этилцеллюлозы (5 г) в дихлорметане (150 мл). 3 атем добавляют дихлорметан (75 мл) и 1,2,3-пропантриол (2,5 мл). Полиэтиленгликоль (10 г) плавят и растворяют в дихлорметане (75 мл). Последний раствор добавляют к первому и затем добавляют октадеканоат магния (2,5 г), поливинилпирролидон (5 г), концентрированную суспензию красителя (30 мл) и полученную смесь гомогенизируют. Ядра таблеток покрывают полученной таким образом смесью в аппарате для получения покрытия. Пример D.3. Раствор для инъекций. Метил-4-гидроксибензоат (1,8 г) и пропил-4-гидроксибензоат (0,2 г) растворяют в кипящей воде(500 мл) для инъекции. После охлаждения примерно до 50 С при перемешивании добавляют молочную кислоту (4 г), пропиленгликоль (0,05 г) и а.и. (4 г). Раствор охлаждают до комнатной температуры и добавляют воду для инъекции q.s. до 1000 мл, получая раствор, содержащий 4 мг/мл а.и. Раствор стерилизуют фильтрованием и помещают в стерильные контейнеры. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его фармацевтически приемлемая аддитивная соль с кислотой или основанием, стереохимически изомерная форма, N-оксидная форма и четвертичная аммониевая соль, гдеR2 представляет собой водород или циано; и а) X представляет собой О; А представляет собой радикал формулы (а-1), (а-2) или (а-3) где m представляет собой целое число, равное 0, 1, 2 или 3;R5 представляет собой водород; C1-6 алкил; C1-6 алкилкарбонил; C1-6 алкилкарбонилоксиалкил; C1-6 алкилоксикарбонил; арил или С 1-6 алкил, замещенный одним или несколькими заместителями, выбранными из гидроксильной группы, C1-6 алкилокси, C1-6 алкилкарбонилокси и арила; илиb) X представляет собой СН 2; А представляет собой радикал формулы (а-2) или (а-3), представленной выше,где m представляет собой целое число, равное 0, 1, 2 или 3;R3 и R4, каждый независимо, представляют собой водород или C1-6 алкил;R5 представляет собой водород; С 2-6 алкил; C1-6 алкилкарбонил; C1-6 алкилкарбонилоксиалкил; C1-6 алкилоксикарбонил или С 1-6 алкил, замещенный одним или несколькими заместителями, выбранными из гидроксильной группы и арила, при условии, что 2-гидроксиэтил исключен из числа заместителей; и арил представляет собой фенил или фенил, замещенный 1, 2 или 3 заместителями, выбранными из галогена, гидроксильной группы, С 1-6 алкила и галогенметила. 2. Соединение по п.1, гдеR2 представляет собой водород; арил представляет собой фенил или фенил, замещенный галогеном или галогенметилом. 3. Соединение по любому из пп.1 или 2, гдеX представляет собой О; А представляет собой радикал формулы (а-1), (а-2) или (а-3), представленных выше, гдеm представляет собой целое число, равное 1 или 2;R3 и R4, каждый независимо, представляют собой водород или арил;R5 представляет собой C1-6 алкил или C1-6 алкил, замещенный гидроксильным заместителем. 4. Соединение по п.1, где соединение имеет одну из следующих структурных формул с (I-1) по (I12), представленных ниже: 5. Соединение по любому из пп.1-4, где соль представляет собой трифторацетат, оксалат или манделат. 6. Применение соединения по любому из пп.1-5 в качестве лекарственного средства. 7. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения как профилактического, так и терапевтического или того и другого состояний, опосредуемых 5-HT2 и/или D2 рецептором. 8. Применение соединения по п.7 для получения лекарственного средства для лечения и/или предупреждения расстройств центральной нервной системы, таких как состояние страха, биполярные расстройства, расстройства сна и сексуальные расстройства, психоз, пограничный психоз, шизофрения,мигрень, расстройство личности или обсессивно-компульсивные расстройства, социальные фобии или приступы панического страха, органические психические расстройства, психические расстройства у детей, агрессия, расстройства памяти и ориентации у пожилых людей, наркомания, ожирение, булимия и аналогичные расстройства. 9. Применение соединения по п.8 для получения лекарственного средства для лечения и/или предупреждения состояния страха, психоза, шизофрении, мигрени и привыкания к злоупотреблению лекарственными средствами. 10. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения согласно любому из пп.1-5 в качестве активного ингредиента. 11. Способ получения композиции по п.10, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивается с терапевтически эффективным количеством соединения по любому из пп.1-5. 12. Способ получения соединений формулы (I) по п.1, включающий алкилирование промежуточного соединения формулы (II) промежуточным соединением формулы (III) где R1, R2, X и циклический фрагмент А принимают значения, определенные в п.1, и W представляет собой подходящую удаляемую группу, такую как галоген или органическая сульфонильная группа.
МПК / Метки
МПК: C07D 493/04, C07D 405/06, C07D 495/04
Метки: производные, 3,3а,8,12b-тетрагидро-2н-дибензо[3,4:6,7]циклогепта[1,2-b]фурана
Код ссылки
<a href="https://eas.patents.su/27-12628-proizvodnye-33a812b-tetragidro-2n-dibenzo3467ciklogepta12-bfurana.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3,3а,8,12b-тетрагидро-2н-дибензо[3,4:6,7]циклогепта[1,2-b]фурана</a>
Предыдущий патент: N-(4-пиридил)метилсульфонамиды для борьбы с членистоногими вредителями
Следующий патент: Регулирование роста растений
Случайный патент: Гранулированная агрохимическая композиция и способ ее получения












