Способ получения 3-(4-пиперидинил)-2,3,4,5-тетрагидро-1,3- бензодиазепин-2(1н)-она
Номер патента: 11260
Опубликовано: 27.02.2009
Авторы: Хеймрот Хейделоре, Зойка Райнер, Гутшера Лудвиг, Крюгер Томас, Прёлль Армин, Бирк Норберт, Ралль Вернер, Шнаубельт Юрген
Формула / Реферат
1. Способ получения соединения формулы
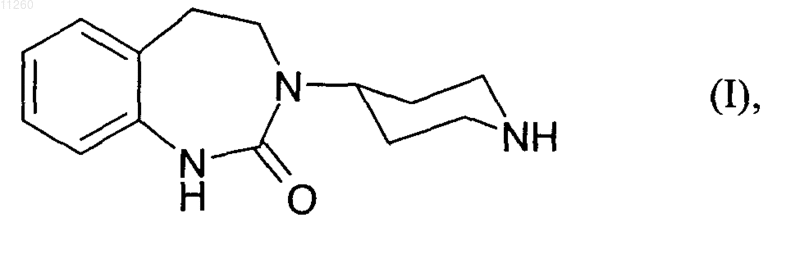
отличающийся тем, что
(а) в присутствии агентов конденсации 2-нитрофенилуксусную кислоту подвергают взаимодействию с 4-амино-N-фенилметилпиперидином,
(б) карбонильную группу полученного 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамида переводят за счет добавления соответствующего восстановителя в метиленовую группу,
(в) полученный промежуточный N-[2-(2-нитрофенил)этил]-1-(фенилметил)-4-аминопиперидин после восстановления нитрогруппы в присутствии никеля Ренея в качестве катализатора подвергают циклизации за счет добавления агентов конденсации с получением 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1Н)-она и
(г) 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1H)-он за счет отщепления бензильной защитной группы переводят в соединение формулы (I).
2. Способ по п.1, отличающийся тем, что на стадии (а) 4-амино-N-фенилметилпиперидин добавляют в виде раствора и полученный продукт этой реакции выкристаллизовывают разбавлением водой.
3. Способ по п.1, отличающийся тем, что на стадии (б) 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамид растворяют в полярном апротонном органическом растворителе и реакцию восстановления проводят при температуре в интервале от 20 до 70шC, необязательно при добавлении кислоты Льюиса, иной кислоты или галогена.
4. Способ по п.1, отличающийся тем, что на стадии (в) исходное соединение предварительно добавляют в диметилформамид, добавляют катализатор в виде водной суспензии и затем гидрируют при температуре в интервале от 20 до 60шC и избыточном давлении водорода максимум 3 бара.
5. Способ по п.1, отличающийся тем, что на стадии (г) исходное вещество растворяют в полярном растворителе и после добавления агента гидрирования гидрируют в рассчитанном на работу под давлением реакторе при температуре в интервале от 40 до 80шC и избыточном давлении водорода максимум 3 бара.
6. Способ по п.1, отличающийся тем, что полученный на стадии (б) промежуточный N-[2-(2-нитрофенил)этил]-1-(фенилметил)-4-аминопиперидин осаждают за счет добавления водного раствора сильной кислоты и выделяют в виде соли.
7. Способ по п.4, отличающийся тем, что полученный 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1H)-он осаждают путем разбавления водой и спиртом.
Текст
011260 Настоящее изобретение относится к способу получения 3-(4-пиперидинил)-2,3,4,5-тетрагидро-1,3 бензодиазепин-2(1 Н)-она формулы представляющего собой структурный фрагмент CGRP-антагонистов (от англ. "calcitonin gene related protein", протеин, связанный с геном кальцитонина), которые могут применяться прежде всего для терапии мигрени путем их приема внутрь. Примеры соединений со свойствами CGRP-антагонистов, содержащих в качестве их структурного фрагмента соединение формулы (I), описаны в PCT/EP97/04862, PCT/EP00/02004, PCT/EP00/13236,PCT/EP03/02417, PCT/EP03/11762 и РСТ/ЕР 03/11763. В качестве исходного вещества для получения соединения формулы I может использоваться 2 нитрофенилуксусная кислота. На первой стадии эту кислоту подвергают взаимодействию с эквимолярным раствором 4-амино-N-фенилметилпиперидина в присутствии по меньшей мере одного эквивалента,предпочтительно 1,1-1,5 эквивалента, особенно предпочтительно 1,1 эквивалента, агента конденсации,такого как карбонилдиимидазол, карбонилдитриазол, н-пропанфосфоновый ангидрид, дициклогексилкарбодиимид, тионилхлорид, ТБТУ [тетрафтороборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония] или 1-этил-3-(3'-диметиламинопропил)карбодиимид, с получением 2-нитро-N-[1-(фенилметил)4-пиперидинил]фенилацетамида. Пригодными для проведения указанной реакции растворителями являются полярные апротонные растворители, такие как тетрагидрофуран, диметоксиэтан, толуол, диметилформамид или N-метилпирролидинон. Продукт можно выкристаллизовывать, например, разбавлением реакционной смеси водой и после отделения кристаллов путем фильтрации или центрифугирования подвергать их сушке. На следующей основной стадии 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамид сначала растворяют в полярном апротонном органическом растворителе, таком, например, как тетрагидрофуран или диметоксиэтан, после чего карбонильную группу добавлением по меньшей мере одного эквивалента, предпочтительно 2,0-4,0 эквивалентов, соответствующего восстановителя переводят в метиленовую группу. В качестве восстановителя при этом можно использовать, например,боран, борогидрид лития или борогидрид натрия, необязательно при добавлении по меньшей мере 0,5 эквивалента, предпочтительно 2,0-4,0 эквивалентов, кислоты Льюиса, иной кислоты или галогена,например, при добавлении серной кислоты, хлортриметилсилана или йода. Реакцию восстановления можно проводить при температуре в интервале от 20 до 70C, предпочтительно от 60 до 70C. Затем нитрогруппу полученного таким путем промежуточного N-[2-(2-нитрофенил)этил]-1(фенилметил)-4-аминопиперидина гидрируют в присутствии никеля Ренея в качестве катализатора. Для такого гидрирования исходное вещество добавляют в диметилформамид, а затем добавляют катализатор в виде водной суспензии. Подобное гидрирование предпочтительно проводить при температуре в интервале от 20 до 60C и избыточном давлении водорода максимум 3 бара. После отфильтровывания катализатора продукт гидрирования можно концентрировать за счет отгонки растворителя. После этого проводят реакцию циклизации, для чего полученный описанным выше путем сырой продукт добавляют к суспензии по меньшей мере одного эквивалента, предпочтительно 1,1-1,75 эквивалента, особенно предпочтительно 1,1 эквивалента, агента конденсации, такого, например, как карбонилдиимидазол или карбонилдитриазол. В качестве растворителей при этом можно использовать полярные апротонные растворители, такие как тетрагидрофуран, этилацетат, 2-метилтетрагидрофуран, диметилформамид или Nметилпирролидинон. Полученный таким путем 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро 1,3-бензодиазепин-2(1H)-он можно осаждать, например, за счет разбавления водой и спиртом, таким как метанол, этанол или изопропанол, предпочтительно метанол, и после отделения выпавшего в осадок вещества путем фильтрации или центрифугирования подвергать его сушке. При необходимости промежуточный N-[2-(2-нитрофенил)этил]-1-(фенилметил)-4-аминопиперидин можно осаждать за счет добавления по меньшей мере 2 эквивалентов водного раствора сильной кислоты и выделять в виде соли. В качестве примеров пригодных для использования в этих целях кислот можно назвать соляную кислоту, бромисто-водородную кислоту или серную кислоту, прежде всего соляную кислоту, при применении которой получают дигидрохлорид. С этой целью реакционную смесь охлаждают до комнатной температуры и смешивают с соответствующим спиртом, таким, например, как метанол, этанол или изопропанол, предпочтительно метанол. После добавления некоторого избытка водной кислоты смесь повторно нагревают с обратным холодильником и затем вновь охлаждают. Далее смесь подщелачивают водным раствором соответствующего основания, например, гидроксида лития, гидроксида натрия, аммиака или гидроксида калия, и после разделения фаз органическую фазу смешивают с избытком водной кислоты, что сопровождается выкристаллизовыванием требуемой соли. Полученный продукт можно затем отделять путем фильтрации или центрифугирования и подвергать сушке. На третьей стадии отщепляют бензильную защитную группу 3-[1-(фенилметил)-4-пиперидинил]2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1 Н)-она. С этой целью исходное вещество растворяют в полярном растворителе, таком, например, как метанол, этанол, вода, ацетон, тетрагидрофуран, диметилформа-1 011260 мид или пропанол, и гидрируют в рассчитанном на работу под давлением реакторе. В качестве агента гидрирования можно использовать, например, Pd/C или Pd(OH)2. Такое гидрирование предпочтительно проводить при температуре в интервале от 40 до 80C и избыточном давлении водорода максимум 3 бара. После отфильтровывания катализатора полученный в качестве продукта гидрирования 3-(4 пиперидинил)-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1H)-он формулы (I) можно кристаллизовать за счет выпаривания растворителя и последующего добавления ацетона или воды и затем отфильтровывать и сушить. Экспериментальная часть. Пример 1. 2-Нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамид(66,24 моль, 1,0 экв.) 2-нитрофенилуксусной кислоты, растворенной в 24 л тетрагидрофурана Питающую емкость промывают 9 л тетрагидрофурана и реакционную смесь перемешивают в течение 30 мин (сопровождается выделением газообразного СО 2). Затем для удаления избыточного СО 2 дважды вакуумируют до остаточного давления 300 мбар. К раствору при 20C добавляют 12,61 кг (66,24 моль, 1,0 экв.) 4-амино-N-фенилметилпиперидина в 6 л тетрагидрофурана (экзотермическая реакция). После этого реакционную смесь перемешивают еще в течение 2 ч при 20C. Далее добавляют 144 л воды, вводя в раствор после добавления 1/4 от всего количества используемой воды 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамид в качестве затравки. Полученную суспензию охлаждают до температуры 0-5C и для полноты кристаллизации перемешивание продолжают еще в течение 1 ч. Затем продукт отделяют центрифугированием, промывают холодной смесью из 160 л воды и 9 л тетрагидрофурана и сушат в сушильной камере в токе инертного газа при 45C. Выход: 18,21 кг (77,8% от теории). Химическая чистота согласно ЖХВР (жидкостная хроматография высокого разрешения): 99,8%. Пример 2. Дигидрохлорид N-[2-(2-нитрофенил)этил]-1-(фенилметил)-4-аминопиперидина 10,00 кг (28,29 моль, 1,0 экв.) 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамида из примера 1 предварительно добавляют в 60 л тетрагидрофурана и нагревают до 60C. Затем в течение 15 мин при температуре 60-65C добавляют 11,06 кг (101,84 моль, 3,6 экв.) хлортриметилсилана и 14,79 кг(67,90 моль, 2,4 экв.) 10%-ного раствора борогидрида лития в ТГФ (реакция сопровождается выделением газа). Далее реакционную смесь перемешивают в течение 4 ч, затем охлаждают до 20C и смешивают с 7 л метанола. После добавления 14,80 кг (121,65 моль, 4,3 экв.) 30%-ной технической соляной кислоты смесь в течение 2,5 ч перемешивают при нагревании с обратным холодильником, после чего охлаждают до 20C и значение pH устанавливают на 9,2 добавлением 8,38 кг (104,67 моль, 3,7 экв.) 50%-ного раствора технического гидроксида натрия. Водную фазу отделяют, а органическую фазу смешивают с 6,89 кг (56,58 моль, 2,0 экв.) 30%-ной технической соляной кислоты (pH 1,5) и в течение 1 ч перемешивают при нагревании с обратным холодильником. Полученную суспензию в течение 3 ч охлаждают до 0C. Для полноты кристаллизации суспензию перемешивают в течение 1 ч при 0C. После этого продукт отделяют центрифугированием, промывают 20 л тетрагидрофурана и сушат в сушильной камере в токе инертного газа при 50C. Выход: 7,78 кг (66,7% от теории). Химическая чистота согласно ЖХВР: 99,3%. Пример 3. 3-[1-(Фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1H)-OH 10,00 кг (24,25 моль, 1,0 экв.) дигидрохлорида N-[2-(2-нитрофенил)этил]-1-(фенилметил)-4 аминопиперидина из примера 2 предварительно добавляют в толуол и воду, взятые порциями по 30 л. Затем добавляют 5,82 кг (72,75 моль, 3,0 экв.) 50%-ного раствора технического гидроксида натрия и двухфазную смесь в течение 1 ч перемешивают при 50C. Водную фазу отделяют, а органическую фазу промывают 12 л воды и после этого концентрируют в вакууме. Остаток смешивают с 50 л метанола. Часть используемого метанола отгоняют. Остающийся раствор гидрируют в присутствии 860 г никеля-2 011260 Ренея при 50C. Катализатор отфильтровывают и продукт гидрирования промывают 16 л метанола. Растворитель отгоняют и остаток смешивают с 30 л тетрагидрофурана. Половину используемого тетрагидрофурана отгоняют и оставшийся раствор в течение 1,5 ч дозируют при 20C в суспензию из 6,88 кг(42,44 моль, 1,75 экв.) 1,1-карбонилдиимидазола в 15 л тетрагидрофурана. Далее в течение 1,5 ч перемешивают при этой температуре. Затем добавляют 20 л воды, вводят затравку и добавляют еще 17 л воды. Полученную суспензию охлаждают до 0C. Для полноты кристаллизации суспензию перемешивают в течение 1,5 ч при 0C. В завершение продукт отделяют путем центрифугирования, промывают 30 л воды и сушат в сушильной камере в токе инертного газа при 45 С. Выход: 6,38 кг (78,4% от теории). Химическая чистота согласно ЖХВР: 98,5%. Пример 4. 3-[1-(Фенилметил)-4-пиперидинил 1-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1 Н)-он 17,00 кг (48,10 моль, 1,0 экв.) 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамида из примера 1 суспендируют в 170 л диметилового эфира этиленгликоля и охлаждают до температуры 0-5C. При этой температуре сначала порциями добавляют 7,28 кг (192,40 моль, 4,0 экв.) борогидрида натрия, а затем раствор 9,91 кг (101,01 моль, 2,1 экв.) технической серной кислоты в 17 л диметилового эфира этиленгликоля. После этого промывают 6,8 л диметилового эфира этиленгликоля. Далее реакционную смесь в течение 1 ч нагревают до 70C и в течение 4 ч перемешивают при этой температуре. После охлаждения до 55 С добавляют раствор из 29 л воды и 11,69 кг (96,20 моль, 2,0 экв.) 30%-ной технической соляной кислоты. После добавления этой кислоты промывают 5 л воды. Перемешивание продолжают еще в течение 1,5 ч при 70C. Затем реакционную смесь охлаждают до 20C и смешивают с 30,0 кг (375,18 моль,7,8 экв.) 50%-ного раствора технического гидроксида натрия и 17 л воды. После разделения фаз органическую фазу концентрируют в вакууме до образования маслянистого остатка, который смешивают с 43 л диметилформамида. Полученный описанным выше путем раствор сливают из реактора в соответствующую емкость и из нее подают в реактор гидрирования. 1,35 кг суспензии никеля Ренея в качестве катализатора, которую предварительно трижды смешивали с диметилформамидом, используемым порциями по 3 л, и разделяли декантацией, суспендируют в 3 л диметилформамида и подвергают вакуум-фильтрации. Затем смесь гидрируют при давлении 3 бара и внутренней температуре 50C до полного прекращения поглощения водорода. После этого катализатор отфильтровывают и продукт гидрирования промывают 17 л диметилформамида. Затем в вакууме отгоняют по меньшей мере 46 л растворителя. Если содержание воды в дистилляте после отгонки этого количества превышает 1%, то отгонку следует продолжать до достижения требуемого показателя. 8,58 кг (52,91 моль, 1,1 экв.) 1,1-карбонилдиимидазола предварительно загружают в реактор и смешивают с 32 л диметилформамида. Затем при температуре 20C в течение 2 ч добавляют раствор для гидрирования (с предыдущей стадии реакции). После 30-минутного перемешивания проверяют полноту химического превращения. Затем нагревают до 50C и в течение 35 мин добавляют смесь из 34 л метанола и 136 л воды. Для полноты кристаллизации при 50C дополнительно добавляют еще 34 л воды, после чего суспензию в течение 1 ч охлаждают до 10C и в течение 30 мин перемешивают при этой температуре. В завершение осадок отделяют путем центрифугирования, промывают 85 л воды и сушат при 50C в сушильной камере. Выход: 12,73 кг (78,9% от теории). Химическая чистота согласно ЖХВР: 96,0%. Пример 5. 3-(4-Пиперидинил)-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1H)-он 10,00 кг (29,81 моль, 1,0 экв.) 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро-1,3 бензодиазепин-2(1 Н)-она из примера 3 растворяют в 100 л метанола, смешивают с 1,00 кг 10%-ного Pd/C и гидрируют в рассчитанном на работу под давлением реакторе при температуре 70C и давлении 3 бара. По завершении поглощения водорода катализатор отфильтровывают и продукт гидрирования промывают 30 л метанола. Фильтрат концентрируют в вакууме и остаток суспендируют в 100 л ацетона. После этого суспензию нагревают с обратным холодильником, перемешивают в течение 15 мин также при нагревании с обратным холодильником и затем при нормальном давлении отгоняют половину ацетона. После отгонки ацетона смесь охлаждают до 0C и перемешивание продолжают еще в течение 1 ч. В завершение продукт отделяют вакуум-фильтрацией, промывают 20 л ацетона и сушат при 50C. Выход: 6,17 кг (84,3% от теории). Химическая чистота согласно ЖХВР: 99,8%.-3 011260 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы(а) в присутствии агентов конденсации 2-нитрофенилуксусную кислоту подвергают взаимодействию с 4-амино-N-фенилметилпиперидином,(б) карбонильную группу полученного 2-нитро-N-[1-(фенилметил)-4-пиперидинил]фенилацетамида переводят за счет добавления соответствующего восстановителя в метиленовую группу,(в) полученный промежуточный N-[2-(2-нитрофенил)этил]-1-(фенилметил)-4-аминопиперидин после восстановления нитрогруппы в присутствии никеля Ренея в качестве катализатора подвергают циклизации за счет добавления агентов конденсации с получением 3-[1-(фенилметил)-4-пиперидинил]2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1 Н)-она и(г) 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1H)-он за счет отщепления бензильной защитной группы переводят в соединение формулы (I). 2. Способ по п.1, отличающийся тем, что на стадии (а) 4-амино-N-фенилметилпиперидин добавляют в виде раствора и полученный продукт этой реакции выкристаллизовывают разбавлением водой. 3. Способ по п.1, отличающийся тем, что на стадии (б) 2-нитро-N-[1-(фенилметил)-4 пиперидинил]фенилацетамид растворяют в полярном апротонном органическом растворителе и реакцию восстановления проводят при температуре в интервале от 20 до 70C, необязательно при добавлении кислоты Льюиса, иной кислоты или галогена. 4. Способ по п.1, отличающийся тем, что на стадии (в) исходное соединение предварительно добавляют в диметилформамид, добавляют катализатор в виде водной суспензии и затем гидрируют при температуре в интервале от 20 до 60C и избыточном давлении водорода максимум 3 бара. 5. Способ по п.1, отличающийся тем, что на стадии (г) исходное вещество растворяют в полярном растворителе и после добавления агента гидрирования гидрируют в рассчитанном на работу под давлением реакторе при температуре в интервале от 40 до 80C и избыточном давлении водорода максимум 3 бара. 6. Способ по п.1, отличающийся тем, что полученный на стадии (б) промежуточный N-[2-(2 нитрофенил)этил]-1-(фенилметил)-4-аминопиперидин осаждают за счет добавления водного раствора сильной кислоты и выделяют в виде соли. 7. Способ по п.4, отличающийся тем, что полученный 3-[1-(фенилметил)-4-пиперидинил]-2,3,4,5 тетрагидро-1,3-бензодиазепин-2(1H)-он осаждают путем разбавления водой и спиртом.
МПК / Метки
МПК: C07D 243/04
Метки: 3-(4-пиперидинил)-2,3,4,5-тетрагидро-1,3, бензодиазепин-2(1н)-она, способ, получения
Код ссылки
<a href="https://eas.patents.su/5-11260-sposob-polucheniya-3-4-piperidinil-2345-tetragidro-13-benzodiazepin-21n-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 3-(4-пиперидинил)-2,3,4,5-тетрагидро-1,3- бензодиазепин-2(1н)-она</a>
Предыдущий патент: Способ производства железорудных агломератов с использованием связующего, содержащего силикат натрия
Следующий патент: Гликопротеин клеточной поверхности
Случайный патент: Усовершенствования в распределенном оптоволоконном считывании









