Циклоалкандионовые производные с нейропротективной активностью
Номер патента: 9280
Опубликовано: 28.12.2007
Авторы: Дель Рио Самбрана Хоакин, Лопес Родригес Мария Лус, Бенаму Салама Беллинда, Марко Мартинес Изабель, Фречилья Мансо Диана
Формула / Реферат
1. Соединение формулы I
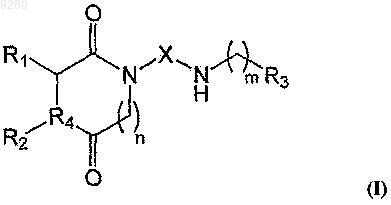
одна из его стереохимически изомерных форм, гидрат, сольват или его фармацевтически приемлемая соль, где
R1 и R2 представляют собой Н или представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; если R4=S, тогда R1 представляет собой Н и R2 отсутствует;
R4 выбран из группы, состоящей из N и S;
n является целым числом от 0 до 1;
X выбран из группы, состоящей из С2-С10алкилена, С2-С10алкенилена и -CH2-Y-СН2-; где Y представляет собой фенил;
m является целым числом от 1 до 2;
R3 выбран из группы, состоящей из хроман-2-ила, 2-хинолила и -О-фенила, где ароматическое кольцо хроманильного остатка, хинолильного или фенильного остатка необязательно замещено с помощью одной или большего числа групп, выбранных из C1-С6алкокси, C1-С6алкила, галогена, C2-С6алкенила, галоген(C1-С6)алкила, галоген(С1-С6)алкокси, фенила, фенил(C1-С6)алкила, фенокси, C1-С6алкилкарбонила, фенилкарбонила, фенил(C1-С6)алкилкарбонила, C1-С6алкоксикарбонила, фенил(С1-С6)алкоксикарбонила, C1-С6алкилкарбониламино, гидрокси, циано, нитро, амино, N-(C1-С6)алкиламино, N,N-(C1-С6)диалкиламино, карбокси, сульфо, сульфамоила, сульфониламино, (C1-С6)алкиламиносульфонила или (C1-С6)алкилсульфониламино; или когда фенильное кольцо замещено с помощью двух соседних остатков, которые вместе с фенильным кольцом, к которому они присоединены, образуют тетрагидронафтил; где каждый алкил необязательно замещен с помощью гидрокси или амино;
при условии, что соединение не является 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазолом, 3-[4-[(хроман-2-ил)метиламино]бутил]-2,4-диоксотиазолидином, 3-[5-[(хроман-2-ил)метиламино]пентил]-2,4-диоксотиазолидином, 3-[6-[(хроман-2-ил)метиламино]гексил]-2,4-диоксотиазолидином, 2-[4-[2-(фенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазолом или 3-[4-[2-(фенокси)этиламино]бутил]-2,4-диоксотиазолидином и 3-[3-[(хроман-2-ил)метиламино]пропил]-2,4-диоксоимидазолидином.
2. Соединение по п.1, в котором R3 выбран из группы, состоящей из хроман-2-ила, 2-хинолила и -О-фенила, где фенильный остаток необязательно замещен с помощью группы, выбранной из C1-С6алкокси, C1-С6алкила или галогена.
3. Соединение по п.1 или 2, в котором m имеет значение 1 и R3 представляет собой хроман-2-ил.
4. Соединение по п.3, в котором R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; и R4 представляет собой N.
5. Соединение по любому из пп.3, 4, где X выбран из группы, состоящей из С2-С10алкилена, (E)-2-бутенилена, 3-метилбензилена или 4-метилбензилена.
6. Соединение по п.3, в котором R1 представляет собой Н, R2 отсутствует и R4 представляет собой S.
7. Соединение по п.6, в котором n имеет значение 0 и X представляет собой С2-С10алкилен.
8. Соединение по п.1 или 2, в котором m=2 и R3 представляет собой -О-фенил, где фенильный остаток является необязательно замещенным с помощью одной или большего числа групп, выбранных из C1-С6алкокси, C1-С6алкила, галогена, С2-С6алкенила, галоген(C1-С6)алкила, галоген(C1-С6)алкокси, фенила, фенил(C1-С6)алкила, фенокси, C1-С6алкилкарбонила, фенилкарбонила, фенил(C1-С6)алкилкарбонила, C1-С6алкоксикарбонила, фенил(C1-С6)алкоксикарбонила, C1-С6алкилкарбониламино, гидрокси, циано, нитро, амино, N,N-(C1-С6)алкиламино, N,N-(C1-С6)диалкиламино, карбокси, сульфо, сульфамоила, сульфониламино, (С1-С6)алкиламиносульфонила или (C1-С6)алкилсульфониламино; или где фенильное кольцо является замещенным с помощью двух соседних остатков, которые вместе с фенильным кольцом, к которому они присоединены, образуют тетрагидронафтил.
9. Соединение по п.8, в котором фенильная группа является необязательно замещенной с помощью одной или большего числа групп, выбранных из фенила, C1-С6алкоксикарбонила, C1-С6алкилкарбониламино, C1-С6алкокси, C1-С6алкила, галоген(С1-С6)алкила или галогена, или где фенильная группа является замещенной с помощью двух соседних остатков, которые вместе с фенильной группой, к которой они присоединены, образуют тетрагидронафтил.
10. Соединение по п.9, в котором фенильный остаток является необязательно замещенным с помощью одной или большего числа групп, выбранных из метокси, этокси, пропокси, изопропокси, этила, пропила, изопропила, бромида, трифторметила, метиламида или этоксикарбонила.
11. Соединение по любому из пп.8-10, где фенильная группа является замещенной в орто- и/или мета-положении.
12. Соединение по любому из пп.8-11, где R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; и R4 представляет собой N.
13. Соединение по любому из пп.8-12, где n имеет значение 0 и X представляет собой С2-С10алкилен.
14. Соединение по любому из пп.8-11, где R1 представляет собой Н, R2 отсутствует и R4 представляет собой S.
15. Соединение по п.14, отличающееся тем, что n имеет значение 0 и X представляет собой С2-С10алкилен.
16. Соединение по п.1 или 2, отличающееся тем, что m имеет значение 1 и R3 представляет собой 2-хинолил.
17. Соединение по п.16, отличающееся тем, что R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; R4 представляет собой N.
18. Соединение по любому из пп.16, 17, где n имеет значение 0 и X представляет собой С2-С10алкилен.
19. Соединение по п.1, в котором соединение выбрано из
(a) 2-[4-[(хроман-2(R)-ил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(b) 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3-диоксопергидроимидазо[1,5-а]пиридина;
(c) 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]пиразина;
(d) 2-[5-[(хроман-2-ил)метиламино]пентил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(e) 2-[6-[(хроман-2-ил)метиламино]гексил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(f) 2-[3-[(хроман-2-ил)метиламино]пропил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(g) 3-[8-[(хроман-2-ил)метиламино]октил]-2,4-диоксотиазолидина;
(h) 2-[4-[(хроман-2(S)-ил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(i) 2-[8-[(хроман-2-ил)метиламино]октил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(j) 2-[3-[[(хроман-2-ил)метиламино]метил]бензил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(k) 2-[4-[[(хроман-2-ил)метиламино]метил]бензил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(l) (E)-2-[4-[(хроман-2-ил)метиламино]бут-2-этил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(m) 2-[4-[2-(о-метоксифенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(n) 2-[4-[2-(м-метоксифенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(o) 2-[4-[2-(о-бромфенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(p) 2-[4-[2-(м-бромфенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(q) 2-[4-[2-(о-этилфенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(r) 2-[4-[2-(м-этилфенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(s) 2-[4-[2-(о-изопропилфенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(t) 2-[4-[(2-хинолил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(u) 2-[4-[2-(о-этоксифенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(v) 2-[4-[2-(о-изопропоксифенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(w) 2-[4-[2-[м-(трифторметил)фенокси]этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(x) 2-[4-[2-(1,1'-бифенил-2-илокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(y) 2-[4-[2-[о-(ацетиламино)фенокси]этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(z) 2-[4-[2-[м-(ацетиламино)фенокси]этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(aa) 2-[4-[2-[о-(этоксикарбонил)фенокси]этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(bb) 2-[4-[2-(5,6,7,8-тетрагидронафт-1-илокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(cc) 2-[4-[2-(2,3-диметилфенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазола;
(dd) 2-[4-[(хроман-2-ил)метиламино]бутил]-1,4-диоксопергидропиридо[1,2-с]пиразина;
(ee) (Z)-2-[4-[(хроман-2-ил)метиламино]бут-2-этил]-1,4-диоксопергидропирроло[1,2-с]имидазола;
(ff) 3-[4-[2-(о-этоксифенокси)этиламино]бутил]-2,4-диоксотиазолидина;
(gg) 3-[6-[2-(о-этоксифенокси)этиламино]гексил]-2,4-диоксотиазолидина;
(hh) 3-[8-[2-(о-этоксифенокси)этиламино]октил]-2,4-диоксотиазолидина;
(ii) 2-[4-[2-(о-этоксифенокси)этил амино]бутил]-1,3-диоксопергидроимидазо[1,5-а]пиридина;
(jj) 2-[6-[2-(о-этоксифенокси)этиламино]гексил]-1,3-диоксопергидроимидазо[1,5-а]пиридина;
(kk) 2-[4-[(2-хинолил)метиламино]бутил]-1,3-диоксопергидроимидазо[1,5-а]пиридина;
(ll) 2-[6-[(2-хинолил)метиламино]гексил]-1,3-диоксопергидроимидазо[1,5-а]пиридина;
фармацевтически приемлемой соли, гидрата, сольвата или одной из их стереохимически изомерных форм.
20. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-19 и фармацевтически приемлемые носители.
21. Применение соединения по любому из пп.1-19, за исключением 3-[3-[(хроман-2-ил)метиламино]пропил]-2,4-диоксоимидазолидинона, для получения лекарственного средства для лечения и/или профилактики болезни Паркинсона, поражения головного мозга, вызванного тромбофлебическим инсультом или черепно-мозговой травмой, депрессии, мигрени, боли, психоза, расстройства настроения, агрессивных нарушений или заболевания мочевыделительного тракта.
Текст
009280 Область техники, к которой относится изобретение Настоящее изобретение относится к производным циклоалкандионов, без исключения замещенным с помощью хроман-2-ильного, 2-хинолильного или -О-фенильного остатка, которые представляют собой модуляторы-агонисты подкласса серотониновых (5-гидрокситриптамин, 5-НТ) 5-HT1A рецепторов, к их стереохимическим изомерам и к их применению в получении лекарственного средства для лечения патологических состояний, для которых показан агонист-модулятор этих рецепторов. Уровень техникиPCT/ES03/00394 раскрывает циклоалкандионовые производные общей формулы 1 аm имеет значение от 0 до 2;PCT/ES03/00394 описывает тесты по радиолигандному замещению для определения in vitro сродства и избирательности по отношению к церебральным рецепторам 5-НТ 1A некоторых из возможных соединений, представленных формулой Маркуша (1 а), в то время как их функциональную особенность(агонист/антагонист) определяют путем изучения их воздействия на аденилатциклазу в HeLa клетках,трансфицированных человеческим рецептором 5-HT1A, измеряя ингибирующее воздействие на стимуляцию фермента, индуцированного форсколином, для следующих соединений:(a) 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-c]имидазол,(b) 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3-диоксопергидроимидазо[1,5-b]тиазол,(c) 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3-диоксопергидроимидазо[1,5-c]тиазол,(d) 3-[4-[(хроман-2-ил)метиламино]бутил]-2,4-диоксотиазолидин,(e) 2-[4-[2-(фенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазол. Для этих соединений (a, b, c, d, e) с целью определения функциональных характеристик in vivo про-1 009280 водят тесты по количественной оценке гипотермии, связанной со стимуляцией рецептора. Более того,нейропротективный эффект оценивают на экспериментальных моделях in vitro, используя первичные культуры крысиного гиппокампа, подвергнутые депривации сывороткой (соединения a, d и e), токсической концентрацией глутамата (соединение a) или инкубированием в условиях гипоксии и отсутствия глюкозы (соединение a). С другой стороны, определение нейропротективного воздействия in vivo оценивают как на быстротечной глобальной модели ишемии у грызунов (соединения a и e), так и на долговременной фокальной модели ишемии на крысах (соединение a).WO 99/29687 демонстрирует соединение 73, которое входит в настоящую формулу I. Сущность изобретения Настоящее изобретение относится к группе циклоалкандионовых производных, которые без исключения замещены с помощью хроман-2-ильного остатка, 2-хинолильного остатка или -О-фенильного остатка. В обширных исследованиях изобретатели неожиданно идентифицировали класс соединений,имеющих высокое сродство к рецептору 5-HT1A и обладающих замечательными нейропротективными свойствами. Сродство in vitro к рецептору 5-HT1A продемонстрировано с помощью тестов по радиолигандному замещению. Аналогично, было охарактеризовано их сродство по отношению к серотонергическим рецепторам 5-НТ 2A, 5-НТ 3, 5-НТ 4 и 5-НТ 7, 5-HT-транспортеру, адренергическому рецептору 1 и допаминергическому рецептору D2. Функциональная характеристика (агонист/антагонист) новых лигандов была изучена путем определения ингибирования стимулирующего эффекта форсколина на аденилатциклазу и изучения, кроме того, in vivo характера новых соединений, как агонистов 5-НТ 1A, с помощью анализа на гипотермию. Тем же самым способом in vitro для соединений настоящего изобретения была показана нейропротективная активность на первичных культурах крысиного гиппокампа, учитывая те модели гибели нейронов (депривация трофическими факторами и депривация кислородом и глюкозой), в которых серотонергические 5-HT1A агонисты более эффективны. Защитный эффект был также изучен при церебральном инфаркте, вызванном постоянной окклюзией в срединной мозговой артерии у крыс. В соответствии с первым аспектом настоящего изобретения оно относится к соединениям общей формулы I их стереохимически изомерным формам, гидратам, сольватам и их фармацевтически приемлемым солям,где R1 и R2 представляют собой Н или связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; если R4=S, тогда R1 представляет собой Н и R2 отсутствует;n является целым числом от 0 до 1;m является целым числом от 1 до 2;R3 выбран из группы, состоящей из хроман-2-ила, 2-хинолила и -О-фенила, где ароматическое кольцо хроманильного остатка, хинолильный или фенильный остаток является необязательно замещенным с помощью одной или большего числа групп, выбранных из C1-С 6 алкокси, C1-С 6 алкила, галогена,С 2-С 6 алкенила, галоген(С 1-С 6)алкила, галоген(С 1-С 6)алкокси, фенила, фенил(С 1-С 6)алкила, фенокси, С 1 С 6 алкилкарбонила, фенилкарбонила, фенил(С 1-С 6)алкилкарбонила, C1-С 6 алкоксикарбонила, фенил(С 1 С 6)алкоксикарбонила, C1-С 6 алкилкарбониламино, гидрокси, циано, нитро, амино, N-(С 1-С 6)алкиламино,N,N-(С 1-С 6)диалкиламино, карбокси, сульфо, сульфамоила, сульфониламино, (С 1-С 6)алкиламиносульфонила или (С 1-С 6)алкилсульфониламино; или когда фенильное кольцо замещено с помощью двух соседних остатков, которые вместе с фенильным кольцом, к которому они присоединены, образуют тетрагидронафтил; где каждый алкил необязательно замещен с помощью гидрокси или амино; при условии, что соединение не является 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3 диоксопергидропирроло[1,2-с]имидазолом, 3-[4-[(хроман-2-ил)метиламино]бутил]-2,4-диоксотиазолидином, 3-[5-[(хроман-2-ил)метиламино]пентил]-2,4-диоксотиазолидином, 3-[6-[(хроман-2-ил)метиламино]гексил]-2,4-диоксотиазолидином,2-[4-[2-(фенокси)этиламино]бутил]-1,3-диоксопергидропирроло[1,2 с]имидазолом,3-[4-[2-(фенокси)этиламино]бутил]-2,4-диоксотиазолидином или 3-[3-[(хроман-2 ил)метиламино]пропил]-2,4-диоксоимидазолидином. В предпочтительном воплощении R3 предпочтительно выбирают из группы, состоящей из хроман 2-ила, 2-хинолила и -О-фенила, где фенильный остаток необязательно замещен с помощью группы, вы-2 009280 бранной из C1-С 6 алкокси, C1-С 6 алкила или галогена. Настоящее изобретение включает три основных воплощения:(1) m имеет значение 1 и R3 является необязательно замещенным хроман-2-илом,(2) m имеет значение 2 и R3 является необязательно замещенным О-фенилом,(3) m имеет значение 1 и R3 является необязательно замещенным 2-хинолилом. В соответствии с первым основным предпочтительным воплощением настоящего изобретения m имеет значение 1 и R3 представляет собой хроман-2-ил, фенильное кольцо которого является незамещенным или замещенным с помощью одной или большего числа групп, выбранных из C1-С 6 алкокси, C1 С 6 алкила, галогена, С 2-С 6 алкенила, галоген(С 1-С 6)алкила, галоген(С 1-С 6)алкокси, фенила, фенил(С 1 С 6)алкила, фенокси, C1-С 6 алкилкарбонила, фенилкарбонила, фенил(С 1-С 6)алкилкарбонила, C1 С 6 алкоксикарбонила, фенил(С 1-С 6)алкоксикарбонила, C1-С 6 алкилкарбониламино, гидрокси, циано, нитро, амино, N-(С 1-С 6)алкиламино, N,N-(С 1-С 6)диалкиламино, карбокси, сульфо, сульфамоила, сульфониламино, (С 1-С 6)алкиламиносульфонила или (С 1-С 6)алкилсульфониламино; где каждый алкил необязательно замещен с помощью гидрокси или амино. R3 предпочтительно является незамещенным хроман-2 илом. Если иное конкретно не упомянуто, термин "хроман-2-ил" относится к незамещенному хроман-2 ильному остатку. В соответствии с первым воплощением указанного первого предпочтительного основного воплощения изобретения R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо и R4 представляет собой N. Те соединения, в которых m имеет значение 1 и R3 представляет собой хроман-2-ил, R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5 или 6-членное кольцо; R4 представляет собой N; и X выбран из группы, состоящей из С 2-С 10 алкилена,(Е)-2-бутенилена, 3-метилбензилена или 4-метилбензилена, которые являются предпочтительными. Во втором воплощении указанного первого предпочтительного основного воплощения настоящего изобретения R1 представляет собой Н; R2 отсутствует; R4 представляет собой S; m имеет значение 1; R3 представляет собой хроман-2-ил; и X выбран из группы, состоящей из С 2-С 10 алкилена, С 2-С 10 алкенилена,или -CH2-Y-CH2-, где Y представляет собой фенил. В одном воплощении n предпочтительно равен 0. В более предпочтительном воплощении настоящего изобретения оно обеспечивает соединения формулы (I), где R1 представляет собой Н; R2 отсутствует; R4 представляет собой S; m имеет значение 1;R3 представляет собой хроман-2-ил; и X представляет собой С 2-С 10 алкилен. В одном воплощении n предпочтительно равен 0. Второе предпочтительное основное воплощение изобретения относится к соединениям, где m имеет значение 2 и R3 представляет собой -О-фенил, необязательно замещен с помощью одной или большего числа групп, выбранных из C1-С 6 алкокси, C1-С 6 алкила, галогена, С 2-С 6 алкенила, галоген(С 1-С 6)алкила,галоген(С 1-С 6)алкокси, фенила, фенил(С 1-С 6)алкила, фенокси, C1-С 6 алкилкарбонила, фенилкарбонила,фенил(С 1-С 6)алкилкарбонила, C1-С 6 алкоксикарбонила, фенил(С 1-С 6)алкоксикарбонила, C1-С 6 алкилкарбониламино, гидрокси, циано, нитро, амино, N-(С 1-С 6)алкиламино, N,N-(С 1-С 6)диалкиламино, карбокси,сульфо, сульфамоила, сульфониламино, (C1-С 6)алкиламиносульфонила или (С 1-С 6)алкилсульфониламино; или где фенильное кольцо замещено с помощью двух соседних остатков, которые вместе с фенильным кольцом, к которому они присоединены, образуют тетрагидронафтил; где каждый алкил необязательно замещен с помощью гидрокси или амино. В соответствии с более предпочтительным воплощении второго основного воплощения изобретения оно относится к соединениям формулы (I), где m=2 и R3 представляет собой -О-фенил, где фенильное кольцо замещено с помощью одной или большего числа групп, выбранных из фенила, C1 С 6 алкоксикарбонила, С 1-С 6 алкилкарбониламино, C1-С 6 алкокси, C1-С 6 алкила, галоген(С 1-С 6)алкила или галогена, или где фенильная группа замещена с помощью двух соседних остатков, которые вместе с фенильной группой, к которой они присоединены, образуют тетрагидронафтил. В другом предпочтительном воплощении m=2 и R3 представляет собой -О-фенил, где фенильное кольцо замещено с помощью одной или большего числа групп, выбранных из C1-С 6 алкокси, С 1-С 6 алкила или галогена. Более предпочтительными соединениями являются те, в которых фенильный остаток необязательно замещен с помощью одной или большего числа групп, выбранных из метокси, этокси, пропокси, изопропокси, этила, пропила, изопропила, бромида, трифторметила, метиламида или этоксикарбонила. Особенно предпочтительными являются те соединения, в которых фенильный остаток замещен в орто- и/или мета-положении. В соответствии с предпочтительным воплощением указанного второго предпочтительного воплощения изобретения R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; и R4 представляет собой N. Особенно предпочтительными являются те соединения, в которых R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5-членное кольцо; R4 представляет собой N; n имеет значение 0; X представляет собой С 2-С 10 алкилен; m имеет значение 2; R3-3 009280 представляет собой -О-фенил, необязательно замещенный с помощью одной или большего числа групп,выбранных из фенила, C1-С 6 алкоксикарбонила, C1-С 6 алкилкарбониламино, C1-С 6 алкокси, C1-С 6 алкила,галоген(С 1-С 6)алкила или галогена, или где фенильная группа замещена с помощью двух соседних остатков, которые вместе с фенильной группой, к которой они присоединены, образуют тетрагидронафтил. В более конкретном воплощении R3 представляет собой О-фенил, замещенный группой, выбранной из C1-С 6 алкокси, C1-С 6 алкила или галогена. В другом предпочтительном воплощении указанного второго предпочтительного основного воплощения изобретения R1 представляет собой Н, R2 отсутствует и R4 представляет собой S. В особенности те, в которых X представляет собой С 2-С 10 алкилен и n имеет значение 0. В соответствии с третьим основным воплощением настоящего изобретения оно относится к соединениям формулы (I), где m имеет значение 1 и R3 представляет собой 2-хинолил, ароматическое кольцо которого является незамещенным или замещенным с помощью одной или большего числа групп, выбранных из C1-С 6 алкокси, C1-С 6 алкила, галогена, С 2-С 6 алкенила, галоген(С 1-С 6)алкила, галоген(С 1 С 6)алкокси, фенила, фенил(С 1-С 6)алкила, фенокси, C1-С 6 алкилкарбонила, фенилкарбонила, фенил(С 1 С 6)алкилкарбонила, C1-С 6 алкоксикарбонила, фенил(С 1-С 6)алкоксикарбонила, C1-C6 алкилкарбониламино,гидрокси, циано, нитро, амино, N-(С 1-С 6)алкиламино, N,N-(C1-C6)диалкиламино, карбокси, сульфо,сульфамоила, сульфониламино, (C1-С 6)алкиламиносульфонила или (С 1-С 6)алкилсульфониламино; где каждый алкил необязательно замещен с помощью гидрокси или амино. R3 предпочтительно представляет собой незамещенный 2-хинолил. Если иное конкретно не упомянуто, термин "2-хинолил" относится к незамещенному хинолильному остатку. В предпочтительном воплощении указанного третьего предпочтительного основного воплощения изобретения R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; и R4 представляет собой N. Те соединения, в которых n имеет значение 0 и X представляет собой С 2-С 10 алкилен, являются особенно предпочтительными. В контексте настоящего изобретения термин "алкил" относится к насыщенной, линейной или разветвленной углеводородной цепи. "Алкильная"-группа может быть незамещенной или замещенной. "Алкил" является предпочтительно незамещенным. Если "алкильная" группа (также как часть, например,фенилалкила, алкилкарбонила или алкокси) является замещенной, заместители предпочтительно являются гидроксилом или аминогруппой. Если иное конкретно не упомянуто, термин "алкил" относится к незамещенной углеводородной цепи. В контексте настоящего изобретения термин "С 2-С 10 алкил" относится к насыщенной, линейной или разветвленной углеводородной цепи, которая содержат от 2 до 10 атомов углерода. Термин "С 2 С 10 алкенил" относится к линейной или разветвленной углеводородной цепи, которая содержит от 2 до 10 атомов углерода и которая имеет по крайней мере одну двойную связь. Термин "C1-С 6 алкил" относится к насыщенной, линейной или разветвленной углеводородной цепи,которая содержат от 1 до 6 атомов углерода. Термин " галоген", как используется в настоящем описании, состоит из фтора, хлора, брома и йода. Термин "галоген(С 1-С 6)алкил" относится к "C1-C6 алкилу", как определено выше, который является замещенным по крайней мере одним атомом галогена. Он включает в качестве предпочтительных воплощений дифторметил и трифторметил. Термин "(С 1-С 6)алкокси" относится к группе -О-(С 1-С 6)алкила. Термин "галоген(С 1-С 6)алкокси" относится к группе "C1-С 6 алкокси", как определено выше, которая замещена по крайней мере одним атомом галогена. Она включает в качестве предпочтительных воплощений группы дифторметокси и трифторметокси. Термин "модулятор" рецептора 5-HT1A, как используют в настоящем изобретении, включает полные и частичные агонисты, так же как антагонисты серотонинового рецептора 5-HT1A. Предпочтительными являются "агонисты", т.е. соединения, по крайней мере, с частичной агонистической активностью по отношению к рецептору 5-HT1A. Соединения настоящего изобретения могут включать энантиомеры в зависимости от их асимметрии или диастереоизомеры. Также является возможным стереоизомерия, по отношению к двойным связям,таким образом, в некоторых случаях молекула может существовать как (Е)-изомер или (Z)-изомер. Каждый из различно возможных энантиомеров, диастереоизомеров или изомеров, по отношению к двойным связям и их смеси, их рацематы и оптически чистые формы включены в границы настоящего изобретения. Оптически чистые изомеры могут быть получены, используя хиральный синтез или хиральные реагенты, или разделение, используя обычные способы. Определение "стереохимически изомерные формы", как используют в настоящем описании, определяет все возможные изомерные формы, в которых соединения формулы (I) могут присутствовать. Если иное не упомянуто или не обозначено, химическое название соединений определяет смесь всех возможных стереохимически изомерных форм, указанных смесей, содержащих все диастереоизомеры и энантиомеры основной молекулярной структуры.-4 009280 Как используется в дальнейшем в настоящем описании, определение соединений формулы (I) включает их фармацевтически приемлемые кислотно-аддитивные соли и все стереоизомерные формы. Фармацевтически приемлемые кислотно-аддитивные соли, ранее упомянутые в настоящем описании, включают основно-аддитивные соли, которые могут быть легко получены обработкой основной формы соединений формулы (I) соответствующими неорганическими кислотами, такими как соляная или бромисто-водородная кислоты, серная, азотная, фосфорная кислота и аналогичными кислотами; или органическими кислотами, такими как, например, уксусная, гликолевая, пропионовая, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, оксиянтарная, винная, лимонная,метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, парааминосалициловая, пальмовая кислоты и аналогами. С другой стороны, указанные формы кислотно-аддитивных солей могут превращаться в свободные основные формы после обработки подходящим основанием. Определение кислоты "аддитивная соль" включает аморфные, так же как кристаллические соли и также включает гидраты и формы в ассоциации с растворителем, которые могут образовывать соединения формулы (I). Примерами указанных форм являются гидраты, алкоголяты и аналоги. В области настоящего изобретения предпочтительны физиологически приемлемые соли. Общий способ получения соединений настоящего изобретения. Раствор 1,3 ммоль соответствующего галогенированного производного, растворенный в 5 мл сухого ацетонитрила, добавляют по каплям в 2,0 ммоль соответствующего алкиламина, растворенного в 2 мл сухого ацетонитрила. Реакционную смесь нагревают до температуры 60 С при перемешивании в течение 4-6 ч (ТСХ). После охлаждения растворитель удаляют при пониженном давлении, остаток растворяют в хлористом метилене (25 мл) и промывают водным раствором 20% карбоната калия. Затем органическую фазу сушат над безводным Na2SO4 и растворитель удаляют при пониженном давлении. Полученное масло очищают с помощью хроматографии на колонке с силикагелем в подходящей смеси растворителей,получая конечный продукт в виде свободного основания. Соединение преобразуют в его гидрохлорид и очищают с помощью перекристаллизации. Конечные продукты структурно охарактеризовывают с помощью ИК, ЯМР спектров и количественного элементного анализа. Для более легкой обработки, когда конечный продукт не является кристаллическим, его преобразуют в фармацевтически приемлемую соль, полученную из неорганической или органической кислоты. Предпочтительными соединениями по настоящему изобретению являются(ll) 2-[6-[(2-хинолил)метиламино]гексил]-1,3-диоксопергидроимидазо[1,5-а]пиридин; их стереохимически изомерные формы, гидраты, сольваты и их фармацевтически приемлемые соли. Гибель клеток, вызванная депривацией кислородом и глюкозой в первичных культурах гиппокампальных нейронов крыс, является моделью, имеющей значительно большее сходство с инсультом головного мозга, чем гибель клетки, вызванная депривацией сывороткой в культуральной среде. Тогда как в последней модели клеточная гибель апоптотической природы происходит из-за удаления трофических факторов из среды, депривация кислорода и глюкозы вызывает гибель со схожими чертами с таковой,какая имеет место при ишемическом инсульте. В соответствии с прогнозной ценностью этих исследований in vitro, соединение заявки PCT/ES03/00394 проявляет только лишь защитное действие от инфаркта головного мозга, вызванного постоянной окклюзией средней мозговой артерии, у крыс в дозе 2 мг/кг. С другой стороны, как отмечено далее в описании данного изобретения, раскрытое здесь соединение (e),обладающее нейропротективным действием, равным (-)-BAYx3702 и приблизительно в четыре раза большим, чем у соединения (a) предыдущего документа в отношении смерти из-за аноксии, значительно снижает объем инфаркта коры в такой же модели фокальной ишемии на крысах при значительно более низкой суммарной дозе, 0,04 мг/кг, сходной с эффективной дозой (-)-BAYx3702 на этой модели. Принимая во внимание их сродство к рецепторам 5-HT1A и их нейропротективное действие, соединения формулы (I) или 3-[3-[(хроман-2-ил)метиламино]пропил]-2,4-диоксоимидазолин применимы в лечении и/или профилактике патологических состояний, при которых показаны модуляторы рецепторов 5HT1A и особенно агонисты, такие как, например, лечение и/или профилактика поражения головного мозга, вызванного тромбоэмболическим инсультом или травматическим повреждением головного мозга, так же как и лечение и/или профилактика болезни Паркинсона, депрессии, включая в особенности эндогенную большую депрессию, мигрень, боль, психоз, такой как, например, шизофрения; расстройства настроения, такие как тревожные расстройства (например, обсессивно-компульсивные расстройства, генерализованная тревожность) и агрессивные расстройства (включая смешанные агрессивнотревожные/депрессивные расстройства); заболевания мочевыделительного тракта, в частности, недержание мочи, например стрессовое недержание мочи. Следовательно, согласно второму аспекту настоящего изобретения оно относится к фармацевтической композиции, которая состоит из терапевтически эффективного количества любого из соединений формулы (I) и фармацевтически приемлемого носителя. Третий аспект настоящего изобретения относится к применению соединений формулы (I) или 3-[3[(хроман-2-ил)метиламино]пропил]-2,4-диоксоимидазолин в производстве лекарственных средств для лечения и/или профилактики болезни Паркинсона, поражения головного мозга, вызванного тромбоэмболическим инсультом или травматическим повреждением мозга, депрессии, мигрени и/или боли, психоза(например, шизофрении); расстройств настроения, таких как тревожные расстройства (например, обсессивно-компульсивные расстройства, генерализованная тревожность) и агрессивные расстройства (включая смешанные агрессивно-тревожные/депрессивные расстройства); заболеваний мочевыделительного тракта (например, недержания мочи). Данный третий аспект может альтернативно быть сформулирован как способ лечения заболеваний,упомянутых выше, у человека, включающий введение человеку, нуждающемуся в лечении, эффективного количества фармацевтического препарата по приведенному описанию. Для удобства введения соединения настоящего изобретения могут быть изготовлены в различных фармацевтических формах. Как подходящие композиции, возможно упоминание всех композиций,обычно используемых в препаратах, вводимых системно или местно и наружно. Для изготовления фармацевтических композиций данного изобретения терапевтически эффективное количество конкретного соединения, необязательно в форме кислотно-аддитивной соли в качестве активного ингредиента, комбинируют в однородной смеси с фармацевтически приемлемым носителем, который может иметь широкое разнообразие форм, в зависимости от желаемой лекарственной формы, которую вводят. Эти фармацевтические композиции желательно находятся в форме подходящей унифицированной дозы, предпочтительно для перорального или ректального введения или парентеральной инъекции. Например, при изготовлении композиций в форме для приема внутрь любой из традиционных фармацевтически приемлемых носителей может быть использован, такой как, например, водно-буферные и/или изотонические водные растворы, гликоли, масла, спирты и аналоги в случае жидких препаратов для приема внутрь, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как-6 009280 крахмалы, сахара, каолин, умягчители, лиганды, дезинтеграторы и аналоги в случае порошков, пилюль,капсул и таблеток. Благодаря простоте их введения таблетки и капсулы представляют собой наиболее предпочтительные лекарственные формы для приема внутрь, в которых применяются твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере,большей частью, хотя другие компоненты могут быть включены, например, для лучшей растворимости. Растворы для инъекций, например, могут быть изготовлены с носителем в виде физиологического раствора, раствора глюкозы или их смеси. Также при необходимости соединения настоящего изобретения могут вводиться чрескожно. Настоящее изобретение проиллюстрировано следующими неограничивающими примерами. Примеры Пример 1. 2-[4-[(Хроман-2(R)-ил)метиламино]бутил]-1,3-диоксопергидропирроло[1,2-с]имидазол,(диастереоизомеры) (а).(м, 1 Н, Н 8 ес), 2,76 (т, 2 Н, J=7,1 Гц, CH2NH), 2,81-2,86 (м, 1H, Н 5 ах), 3,06 (уширенный с, 1 Н, NH), 3,48 (т,2 Н, J=7,3 Гц, NCH2), 3,72 (дд, 1 Н, J=11,9, 4,3 Гц, Н 8 а), 4,14-4,19 (м, 3 Н, CH2Ar, Н 5 ес), 7,46 (д, 1H, J=8,5 Гц,Н 3'), 7,49-7,55 (м, 1 Н, Н 6'), 7,68-7,74 (м, 1H, Н 7'), 7,81 (дд, 1 Н, J=8,2, 1,1 Гц, Н 5'), 8,06 (д, J=8,5 Гц, 1H, Н 4'),8,13 (д, 1 Н, J=8,4 Гц,Н 8'). 13 С-ЯМР (CDCl3, ): 22,7, 24,9, 26,3, 26,6, 27,8, 28,0, 29,0 (-(СН 2)4-, С 6, С 7, С 8), 38,4 (NCH2), 39,2 (С 5),49,2 (CH2NH), 54,6 (CH2Ar), 57,2 (С 8 а), 120,3 (С 3'), 126,2 (С 6'), 127,3, 127,5 (С 5', С 8'), 128,9, 129,6 (С 4', С 7'),136,7 (С 4'а), 147,5 (С 8'а), 154,5 (С 2'), 158,2 (С 3), 173,2 (C1). Вычислено для С 23H30N4O22HCl3/2H2O: С 55,87; Н 7,13; N 11,33. Найдено: С 55,77; Н 7,09; N 10,77. Пример 39. Исследования радиолигандного связывания. Сродство in vitro соединений настоящего изобретения к церебральным рецепторам 5-HT1A, 5-HT2A,5-НТ 3, 5-НТ 4, 5-НТ 7, 1 и D2 оценивают с помощью исследований радиолигандного связывания. Используют следующие специфические лиганды и ткани: 5-HT1 А рецепторы, [3H]-8-OH-DPAT, кора головного мозга крыс; 5-НТ 2 А рецепторы, [3 Н]кетансерин, кора головного мозга крыс; 5-НТ 3 рецепторы, [3H]LY 278584, кора головного мозга крыс; 5-НТ 4 рецепторы, [3H]GR 113808, полосатое тело мозга крыс; 5-НТ 7 рецепторы, [3 Н]-5-СТ, гипоталамус крыс; 1 рецепторы, [3 Н]празозин, кора головного мозга крыс;D2 рецепторы, [3 Н]спиперон, полосатое тело мозга крыс. Соединение BAYx3702 было выбрано в качестве стандартного лиганда 5-HT1A, так же как и его левовращающий изомер (-)-BAYx3702. Для всех исследований связывания рецепторов используют самцов крыс линии Sprague-Dawley(Rattus norvegicus albinus), массой 180-200 г, которых умерщвляют путем декапитации, с последующим быстрым извлечением головного мозга и его препарированием. Ткани хранят при -80 С для последующего использования и гомогенизируют с помощью гомогенизатора Polytron РТ-10. Мембранные суспензии центрифугируют в приборе Beckman J2-HS. Связанные радиоактивные лиганды отделяют от свободных путем вакуумной фильтрации с использованием фильтров Whatman GF/C, дважды отмытых 4 мл соответствующего буфера. Добавляют 4 мл сцинтилляционной жидкости (EcoLite) и измеряют радиоактивность, связанную с мембранами, посредством жидкостной сцинтилляционной спектроскопии. Рецептор 5-HT1A Исследования связывания выполняют по модифицированной методике, ранее описанной Clark et al.(J. Med. Chem., 1990, 33, 633), как это приведено ниже. Кору головного мозга гомогенизируют в 10 объемах ледяного Tris буфера (50 мМ Tris-HCl, рН 7,7 при 25 С) и центрифугируют при 28000 g в течение 15 мин. Осадок мембран дважды отмывают путем ресуспендирования и центрифугирования. После второго отмывания ресуспендированный осадок инкубируют при 37 С в течение 10 мин. Затем мембраны собирают центрифугированием и конечный осадок ресуспендируют в буфере (50 мМ Tris-HCl, 5 мМ MgSO4 и 0,5 мМ EDTA; рН 7,4 при 37 С). Порции конечной суспензии мембран по 100 мкл (около 1 мг белка) инкубируют при 37 С в течение 15 мин с 0,6 нМ [3H]-8-OH-DPAT (133 Ci/ммоль), в присутствии или в отсутствие изучаемого препарата, в конечном объеме 1,1 мл буфера исследования (50 мМ Tris-HCl, 10 нМ клонидина, 30 нМ празозина, рН 7,4 при 37 С). Неспецифическое связывание определяют с помощью 10 мкМ 5-НТ. Рецептор 5-НТ 2 А Исследования связывания выполняют по модифицированной методике, ранее описанной Titeler etal. (Biochem. Pharmacol., 1987, 36, 3265), как это приведено ниже. Лобную кору гомогенизируют в 60 объемах ледяного буфера (50 мМ Tris-HCl, 0,5 мМ Na2EDTA, 10 мМ MgSO4, рН 7,4 при 25 С), и центрифугируют при 30000 g в течение 15 мин при 4 С. Осадок мембран отмывают посредством ресуспендирования и центрифугирования. После второго отмывания ресуспендированный осадок инкубируют при 37 С в течение 10 мин. Мембраны затем собирают центрифугированием и конечный осадок ресуспендируют в 10 объемах буфера исследования (50 мМ Tris-HCl, 0,5 мМ Na2EDTA, 10 мМ MgSO4, 0,1% аскор- 19009280 биновой кислоты, 10 мкМ паргилина, рН 7,4 при 25 С). Порции конечной суспензии мембран по 100 мкл(около 5 мг/мл белка) инкубируют при 37 С в течение 15 мин с 0,4 нМ [3 Н]кетансерина, в присутствии или в отсутствие изучаемого препарата, в конечном объеме 2 мл буфера исследования. Неспецифическое связывание определяют с помощью 1 мкМ цинансерина. Рецептор 5-НТ 3 Исследования связывания выполняют по модифицированной методике, ранее описанной Wong et al.(Eur. J. Pharmacol, 1989, 166, 107), как это приведено ниже. Кору головного мозга гомогенизируют в 9 объемах 0,32 М ледяной сахарозы и центрифугируют при 1000 g в течение 10 мин при 4 С. Супернатант центрифугируют при 17000 g в течение 20 мин при 4 С. Осадок мембран отмывают дважды посредством ресуспендирования в 60 объемах 50 мМ ледяного Tris-HCl буфера (рН 7,4 при 25 С) и центрифугирования при 48000 g в течение 10 мин при 4 С. После второго отмывания ресуспендированный осадок инкубируют при 37 С в течение 10 мин и центрифугируют при 48000 g в течение 10 мин при 4 С. Мембраны ресуспендируют в 2,75 объемах буфера исследования (50 мМ Tris-HCl, 10 мкМ паргилина, 0,6 мМ аскорбиновой кислоты и 5 мМ CaCl2, рН 7,4 при 25 С). Порции конечной суспензии мембран по 100 мкл (около 2 мг/мл белка) инкубируют при 25 С в течение 30 мин с 0,7 нМ [3H]LY 278584, в присутствии или в отсутствие изучаемого препарата, в конечном объеме 2 мл буфера исследования. Неспецифическое связывание определяют с помощью 10 мкМ 5-НТ. Рецептор 5-НТ 4 Исследования связывания выполняют по модифицированной методике, ранее описанной Grossmanet al. (Br. J. Pharmacol., 1993, 109, 618), как это приведено ниже. Полосатое тело гомогенизируют в 15 объемах 50 нМ ледяного HEPES буфера (рН 7,4 при 4 С) и центрифугируют при 48000 g в течение 10 мин. Осадок ресуспендируют в 20 объемах буфера исследования (50 мМ HEPES, рН 7,4 при 25 С). Порции конечной суспензии мембран по 100 мкл (около 5 мг/мл белка) инкубируют при 37 С в течение 30 мин с 0,1 нМ [3H]GR 113808, в присутствии или в отсутствие изучаемого препарата, в конечном объеме 1 мл буфера исследования. Неспецифическое связывание определяют с помощью 30 мкМ 5-НТ. Рецептор 5-НТ 7 Исследования связывания выполняют по модифицированной методике, ранее описанной Aguirre etal. (Eur. J. Pharmacol, 1998, 346, 181), как это приведено ниже. Гипоталамус гомогенизируют в 5 мл ледяного Tris буфера (50 мМ Tris-HCl, рН 7,4 при 25 С) и центрифугируют при 48000 g в течение 10 мин. Осадок мембран отмывают посредством ресуспендирования и центрифугирования, затем ресуспендированный осадок инкубируют при 37 С в течение 10 мин. Затем мембраны собирают центрифугированием и конечный осадок ресуспендируют в 100 объемах 50 мМ ледяного буфера (Tris-HCl, 4 мМ CaCl2, 1 мг/мл аскорбиновой кислоты, 0,01 мМ паргилина и 3 мкМ пиндолола) в условиях рН 7,4 при 25 С. Порции конечной суспензии мембран по 400 мкл инкубируют при 23 С в течение 120 мин с 0,5 нМ [3 Н]-5-СТ(88 Ci/ммоль), в присутствии или в отсутствие нескольких концентраций изучаемого препарата, в конечном объеме 0,5 мл буфера исследования (Tris-HCl, 4 мМ CaCl2, 1 мг/мл аскорбиновой кислоты, 0,01 мМ паргилина и 3 мкМ пиндолола). Неспецифическое связывание определяют с помощью 10 мкМ 5-НТ. Рецептор 1 Исследования связывания выполняют по модифицированной методике, ранее описанной Ambrosioet al. (Neurosci. Lett, 1984, 49, 193), как это приведено ниже. Кору головного мозга гомогенизируют в 20 объемах ледяного буфера (50 мМ Tris-HCl, 10 мМ MgCl2, pH 7,4 при 25 С) и центрифугируют при 30000g в течение 15 мин. Осадок отмывают дважды посредством ресуспендирования и центрифугирования. Конечный осадок ресуспендируют в таком же буфере. Порции конечной суспензии мембран (около 250 мкг белка) инкубируют при 25 С в течение 30 мин с 0,2 нМ [3 Н]празозина (23 Ci/ммоль), в присутствии или в отсутствие шести концентраций изучаемого препарата, в конечном объеме 2 мл буфера. Неспецифическое связывание определяют с помощью 10 мкМ фентоламина. Рецептор D2 Исследования связывания выполняют по модифицированной методике, ранее описанной Leysen etal. (Biochem. Pharmacol., 1978, 27, 307), как это приведено ниже. Полосатое тело гомогенизируют в 50 мМ Tris-HCl (pH 7,7 при 25 С) и центрифугируют при 48000 g в течение 10 мин. Осадок ресуспендируют и центрифугируют, как перед этим. Конечный осадок ресуспендируют в 50 мМ Tris-HCl (pH 7,7 при 25 С), содержащей 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 1 мМ MgCl2 и 0,1% аскорбиновой кислоты. Порции конечной суспензии мембран (125-150 мг белка) инкубируют при 25 С в течение 60 мин с 0,8 нМ [3 Н]раклоприда (77 Ci/ммоль), в присутствии или в отсутствие шести концентраций исследуемого соединения, в конечном объеме 1,1 мл буфера исследования (рН 7,4 при 25 С). Неспецифическое связывание определяют с помощью 1 мкМ (+)-бутакламола. Во всех исследованиях связывание исследуемого препарата, неспецифическое, общее и радиолигандное определяют троекратно. Инкубацию останавливают быстрой вакуумной фильтрацией через фильтры Whatman GF/B, предварительно обработанные в 0,05% полиэтиленимине с помощью клеточного харвестера Brandel. Фильтры затем отмывают в буфере исследования, высушивают и помещают в полиэтиленовые пробирки, в которые добавляют 4 мл сцинтилляционного коктейля (Aquasol). Радиоактивность, связанную с фильтрами, измеряют посредством жидкостной сцинтилляционной спектрометрии.- 20009280 Данные анализируют с помощью итеративной методики построения кривой по точкам (программа Prism,Graph Pad), которая выдает значения IC50, и r2 для тестируемых соединений, значения Ki подсчитаны с помощью уравнения Cheng-Prusoff. Концентрации белка в коре головного мозга крыс и полосатом теле мозга крыс определяли по методу Лоури, используя альбумин бычьей сыворотки в качестве стандарта. Результаты. Все тестируемые соединения демонстрируют высокое сродство к рецептору 5-HT1A со значениямиKi от 0,5 до приблизительно 100 нМ. Большинство соединений связываются с рецептором 5-HT1A со сродством менее 30 нМ. Также большинство соединений проявляют высокую избирательность в отношении рецепторов 5-HT1A по сравнению с 5-НТ 2 А, 5-НТ 3, 5-НТ 4 и дофаминовыми рецепторами. Пример 40. Функциональная характеристика. Клеточная культура и определение уровня цАМФ после стимуляции фермента аденилатциклазы форсколином. Клетки линии HeLa, трансфицированные человеческим рецептором 5-HT1A (клетки НА 6), выращивают в 75 мл колбах, содержащих 20 мл среды Игла в модификации Дульбекко (DMEM) с добавлением 10% фетальной телячьей сыворотки, 500 единиц пенициллина и 500 мкг стрептомицина/мл (P/S) и 0,3 мг/мл генетицина. За 48 ч до эксперимента клетки высевают до плотности 75103 клеток в 1,5 мл средыDMEM-P/S-фетальная телячья сыворотка-генетицин на 12 многолуночных плашках. В день эксперимента клетки обрабатывают 0,5 мМ 1-метил-3-изобутилксантина (IBMX), 10 мкМ форсколина и носитель и/или различные концентрации исследуемых соединений в 5% СО 2 инкубаторе при 37 С. Через 10 мин обработку останавливают и клетки лизируют в 65% растворе этанола в течение 2 ч, затем этанол собирают и выпаривают при 55 С, оставляя осадок с цАМФ. Образцы анализируют с помощью коммерческого набора для радиоиммунного анализа (РИА) ([3 Н]сАМР assay system, cod. TRK 432; Amersham). Белок измеряют по методике Bradford. Изотермы конкурентного связывания анализируют при помощи итеративной методики построения кривой по точкам (программа Origin 7,0), которая выдает значения ЕС 50 для тестируемых соединений. Эксперимент показывает, что тестируемые соединения значительно подавляют образование цАМФ в клетках HeLa, большинство соединений действует как полные, а некоторые как частичные агонисты. Определение ректальной температуры у мышей. Агонисты рецепторов 5-HT1A,такие как, например, 8-OH-DPAT, снижают температуру тела у грызунов. Это действие на мышах, по-видимому, обусловлено активацией соматодендритических рецепторов (De Vry, Psychopharmacology 1995, 121, 1) поскольку применение в течение двух недель ингибитора триптофангидроксилазы, такого как парахлорфенилаланин, или повреждение селективным нейротоксином серотонинергических нейронов, таким как 5,7-дигидрокситриптамин (5,7-DHT), полностью блокирует гипотермическое действие на мышей. В тесте, проведенном с соединениями настоящего изобретения, изучали группу из 8-10 мышей, на которых опробовали по меньшей мере 4 дозы исследуемых соединений. Животных содержат в среде с контролируемой температурой и освещением (251 С, освещение с 8.00 до 20.00). Потребление пищи и воды не ограничивают. Все эксперименты производят между 9.00 и 14.00. Тест состоит из введения зонда на 1,5 см в прямую кишку животного в течение 40 с для измерения базальной температуры, что принималось за нулевую временную отметку эксперимента. Непосредственно после указанного тестируемые соединения вводят подкожно (п/к) и измеряют ректальную температуру через разные промежутки времени: 15, 30, 60, 120 и 240 мин. Эксперимент показывает, что тестируемые соединения являются агонистами 5-НТ 1 А, поскольку вводят минимальную эффективную дозу и получают гипотермическое действие. Пример 41. Нейропротективные исследования in vitro. Нейротоксичность, вызванная гипоксией/гипогликемией. Определяют способность предотвращать нейротоксичность, вызванную гипоксией/гипогликемией в первичных культурах гиппокампа крыс (Е 18). Для приготовления культур препарируют мозг плода, отделяя мозговые оболочки, гиппокамп диспергируют в среде Neurobasal с добавлением В-27. После центрифугирования при 700 g осадок механически редиспергируют. Плотность клеточной суспензии измеряют и аликвоты забирают в культуру на чашки Петри, предварительно обработанные полилизином, используя ту же среду. Культуру содержат в инкубаторе при 37 С в атмосфере 95% воздух/5% СО 2. Через 10 дней чашки переносят в не содержащую глюкозу среду, в камеру, где их содержат 2 ч в атмосфере 95% N2/5% СО 2. Перед развитием гипоксии исследуемые соединения добавляют через разные промежутки времени в различных концентрациях. Нейротоксичность, обусловленная депривацией трофических факторов. Предотвращение клеточной гибели с чертами апоптоза, которая происходит после содержания гиппокампальных культур в бессывороточной среде в течение 48 ч (Koh et al., Science, 1995, 268, 573), также было изучено. В этом случае сначала применяют среду Игла (DMEM), модифицированную 10% телячьей сывороткой, а спустя 10 дней культуры переносят в среду DMEM, лишенную телячьей сыворотки. В обоих случаях производят измерение митохондриальной дегидрогеназы на 3-(4,5-диметилтиазол 2-ил)-2,5-дифенилтетразолий-бромиде (МТТ) с последующим колориметрическим исследованием фор- 21009280 мазана, которое позволяет определить индекс выживания клеток (Nonaka et al., Proc. Natl. Acad. Sci. USA,1998, 95, 2642), рассматриваемого как индекс токсичности. Полученные результаты приведены в нижеследующей таблице. Таблица 1 Пример 42. Нейропротективное исследование in vivo. Модель фокулярной ишемии у крыс. Внутрипросветная окклюзия срединной мозговой артерии (СМА) у крыс выполняют по ранее описанной методике (Justicia et al., J Cereb. Blood Flow Metab., 1999, 19, 128), как это приведено ниже. Крыс обезболивают галотаном, поддерживая их температуру на уровне 37,5 С с помощью электроодеяла, соединенного с ректальным зондом, и катетеризируют левую бедренную артерию для отслеживания артериального давления. Выделяют правую сонную артерию, перекрывают экстракраниальные ветви, и затупленный полиамидный жгут вводят через наружную сонную артерию до уровня отхождения срединной мозговой артерии (СМА). Выбранные соединения вводят внутривенно. Через 24 ч после ишемического повреждения крысам дают эфирный наркоз, перфузируют физиологическим раствором, а затем декапитируют, извлекают головной мозг, который подвергают коронарным срезам с шагом 1,5 мм. Срезы затем инкубируют в 4% трифенилтетразолий-хлориде (ТТС), который взаимодействует с интактными митохондриальными ферментами с появлением красного окрашивания, которое контрастирует с бледностью зоны инфаркта, позволяя видеть последнюю, а затем содержат в 10% растворе формалина. Объем инфаркта мозга (в мм 3) подсчитывают путем измерения (с помощью анализатора изображений) пораженной зоны в области коры мозга, кровоснабжаемой СМА, и в полосатом теле, умножая средние полученные значения в каждом срезе на его толщину. Внутривенная инфузия 40 мкг/кг соединения (e) в течение 4 ч значительно снижает объем инфаркта мозга у крыс после внутрипросветной окклюзии СМА. Протективный эффект наблюдается в коре, но не в подкорковых структурах и не вызывает изменения артериального давления. В табл. 2 приведены значения объема инфаркта при введении физиологического раствора, стандартного соединения -BAYx3702 и соединения (E). Таблица 2 одна из его стереохимически изомерных форм, гидрат, сольват или его фармацевтически приемлемая соль, гдеR1 и R2 представляют собой Н или представляют собой связанные вместе метиленовые группы, об- 22009280 разующие с гетероциклическим кольцом 5- или 6-членное кольцо; если R4=S, тогда R1 представляет собой Н и R2 отсутствует;n является целым числом от 0 до 1;m является целым числом от 1 до 2;R3 выбран из группы, состоящей из хроман-2-ила, 2-хинолила и -О-фенила, где ароматическое кольцо хроманильного остатка, хинолильного или фенильного остатка необязательно замещено с помощью одной или большего числа групп, выбранных из C1-С 6 алкокси, C1-С 6 алкила, галогена, C2 С 6 алкенила, галоген(C1-С 6)алкила, галоген(С 1-С 6)алкокси, фенила, фенил(C1-С 6)алкила, фенокси, C1 С 6 алкилкарбонила, фенилкарбонила, фенил(C1-С 6)алкилкарбонила, C1-С 6 алкоксикарбонила, фенил(С 1 С 6)алкоксикарбонила, C1-С 6 алкилкарбониламино, гидрокси, циано, нитро, амино, N-(C1-С 6)алкиламино,N,N-(C1-С 6)диалкиламино,карбокси,сульфо,сульфамоила,сульфониламино,(C1 С 6)алкиламиносульфонила или (C1-С 6)алкилсульфониламино; или когда фенильное кольцо замещено с помощью двух соседних остатков, которые вместе с фенильным кольцом, к которому они присоединены,образуют тетрагидронафтил; где каждый алкил необязательно замещен с помощью гидрокси или амино; при условии, что соединение не является 2-[4-[(хроман-2-ил)метиламино]бутил]-1,3 диоксопергидропирроло[1,2-с]имидазолом,3-[4-[(хроман-2-ил)метиламино]бутил]-2,4 диоксотиазолидином, 3-[5-[(хроман-2-ил)метиламино]пентил]-2,4-диоксотиазолидином, 3-[6-[(хроман-2 ил)метиламино]гексил]-2,4-диоксотиазолидином,2-[4-[2-(фенокси)этиламино]бутил]-1,3 диоксопергидропирроло[1,2-с]имидазолом или 3-[4-[2-(фенокси)этиламино]бутил]-2,4 диоксотиазолидином и 3-[3-[(хроман-2-ил)метиламино]пропил]-2,4-диоксоимидазолидином. 2. Соединение по п.1, в котором R3 выбран из группы, состоящей из хроман-2-ила, 2-хинолила и -Офенила, где фенильный остаток необязательно замещен с помощью группы, выбранной из C1-С 6 алкокси,C1-С 6 алкила или галогена. 3. Соединение по п.1 или 2, в котором m имеет значение 1 и R3 представляет собой хроман-2-ил. 4. Соединение по п.3, в котором R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; и R4 представляет собой N. 5. Соединение по любому из пп.3, 4, где X выбран из группы, состоящей из С 2-С 10 алкилена, (E)-2 бутенилена, 3-метилбензилена или 4-метилбензилена. 6. Соединение по п.3, в котором R1 представляет собой Н, R2 отсутствует и R4 представляет собой S. 7. Соединение по п.6, в котором n имеет значение 0 и X представляет собой С 2-С 10 алкилен. 8. Соединение по п.1 или 2, в котором m=2 и R3 представляет собой -О-фенил, где фенильный остаток является необязательно замещенным с помощью одной или большего числа групп, выбранных из C1 С 6 алкокси, C1-С 6 алкила, галогена, С 2-С 6 алкенила, галоген(C1-С 6)алкила, галоген(C1-С 6)алкокси, фенила,фенил(C1-С 6)алкила, фенокси, C1-С 6 алкилкарбонила, фенилкарбонила, фенил(C1-С 6)алкилкарбонила, C1 С 6 алкоксикарбонила, фенил(C1-С 6)алкоксикарбонила, C1-С 6 алкилкарбониламино, гидрокси, циано, нитро, амино, N,N-(C1-С 6)алкиламино, N,N-(C1-С 6)диалкиламино, карбокси, сульфо, сульфамоила, сульфониламино, (С 1-С 6)алкиламиносульфонила или (C1-С 6)алкилсульфониламино; или где фенильное кольцо является замещенным с помощью двух соседних остатков, которые вместе с фенильным кольцом, к которому они присоединены, образуют тетрагидронафтил. 9. Соединение по п.8, в котором фенильная группа является необязательно замещенной с помощью одной или большего числа групп, выбранных из фенила, C1-С 6 алкоксикарбонила, C1 С 6 алкилкарбониламино, C1-С 6 алкокси, C1-С 6 алкила, галоген(С 1-С 6)алкила или галогена, или где фенильная группа является замещенной с помощью двух соседних остатков, которые вместе с фенильной группой, к которой они присоединены, образуют тетрагидронафтил. 10. Соединение по п.9, в котором фенильный остаток является необязательно замещенным с помощью одной или большего числа групп, выбранных из метокси, этокси, пропокси, изопропокси, этила,пропила, изопропила, бромида, трифторметила, метиламида или этоксикарбонила. 11. Соединение по любому из пп.8-10, где фенильная группа является замещенной в орто- и/или мета-положении. 12. Соединение по любому из пп.8-11, где R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; и R4 представляет собой N. 13. Соединение по любому из пп.8-12, где n имеет значение 0 и X представляет собой С 2 С 10 алкилен. 14. Соединение по любому из пп.8-11, где R1 представляет собой Н, R2 отсутствует и R4 представляет собой S. 15. Соединение по п.14, отличающееся тем, что n имеет значение 0 и X представляет собой С 2 С 10 алкилен. 16. Соединение по п.1 или 2, отличающееся тем, что m имеет значение 1 и R3 представляет собой 2 хинолил.- 23009280 17. Соединение по п.16, отличающееся тем, что R1 и R2 представляют собой связанные вместе метиленовые группы, образующие с гетероциклическим кольцом 5- или 6-членное кольцо; R4 представляет собой N. 18. Соединение по любому из пп.16, 17, где n имеет значение 0 и X представляет собой С 2 С 10 алкилен. 19. Соединение по п.1, в котором соединение выбрано из(ll) 2-[6-[(2-хинолил)метиламино]гексил]-1,3-диоксопергидроимидазо[1,5-а]пиридина; фармацевтически приемлемой соли, гидрата, сольвата или одной из их стереохимически изомерных форм. 20. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-19 и фармацевтически приемлемые носители. 21. Применение соединения по любому из пп.1-19, за исключением 3-[3-[(хроман-2 ил)метиламино]пропил]-2,4-диоксоимидазолидинона, для получения лекарственного средства для лечения и/или профилактики болезни Паркинсона, поражения головного мозга, вызванного тромбофлебическим инсультом или черепно-мозговой травмой, депрессии, мигрени, боли, психоза, расстройства настроения, агрессивных нарушений или заболевания мочевыделительного тракта.
МПК / Метки
МПК: C07D 487/04, A61K 31/4188, C07D 417/12, A61K 31/427, C07D 277/34, C07D 417/04
Метки: нейропротективной, активностью, производные, циклоалкандионовые
Код ссылки
<a href="https://eas.patents.su/25-9280-cikloalkandionovye-proizvodnye-s-nejjroprotektivnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Циклоалкандионовые производные с нейропротективной активностью</a>
Предыдущий патент: Применение лютеинизирующего гормона человека, в том числе в сочетании с фолликулостимулирующим гормоном, для содействия имплантации и/или снижения частоты выкидышей
Следующий патент: Фармацевтические и косметические композиции, содержащие ароматические альдегиды, содержащие оксигруппу
Случайный патент: Способ выщелачивания сульфидных минералов












