Способ выщелачивания сульфидных минералов
Формула / Реферат
1. Способ выщелачивания сульфидных минералов при атмосферных условиях, отличающийся тем, что выщелачивание сульфидного минерала является сульфатным, и подлежащий выщелачиванию сульфид приводят в контакт с серосодержащей солью, которая является менее электрохимически активной, чем сульфид или его компонент, либо перед выщелачиванием, или при начале выщелачивания, и выполняют измерение импеданса минерала, предназначенного для выщелачивания, при различных значениях его электрохимического потенциала для определения зависимости указанного импеданса от указанного потенциала, и проводят выщелачивание при значениях электрохимического потенциала, которые согласно указанной зависимости соответствуют меньшим значениям импеданса.
2. Способ по п.1, отличающийся тем, что сульфид, предназначенный для выщелачивания, приводят в контакт с раствором соли сульфида, которая является менее электрохимически активной, чем сульфид или его компонент.
3. Способ по п.1 или 2, отличающийся тем, что сульфидный минерал обрабатывают солью Cun+.
4. Способ по п.3, отличающийся тем, что соль меди представляет собой сульфат меди.
5. Способ по любому из пп.1-4, отличающийся тем, что сульфидный минерал представляет собой халькопирит.
6. Способ по любому из пп.1-4, отличающийся тем, что сульфид, подлежащий выщелачиванию, представляет собой, по меньшей мере, сульфид никеля, цинка и кобальта.
7. Способ по любому из пп.1-6, отличающийся тем, что обработка сульфида, подлежащего выщелачиванию, менее электрохимически активной сульфидной солью происходит в суспензионном реакторе.
8. Способ по любому из пп.1-6, отличающийся тем, что обработка сульфида, подлежащего выщелачиванию, менее электрохимически активной сульфидной солью происходит на ленте конвейера.
9. Способ по любому из пп.1-8, отличающийся тем, что драгоценные металлы, такие как золото, которые растворяются во время сульфидной обработки, извлекают из раствора.
10. Способ по любому из пп.1-9, отличающийся тем, что электрохимический потенциал поверхности сульфида металла измеряют во время выщелачивания при помощи минерального электрода.
11. Способ по любому из пп.1-10, отличающийся тем, что перед выщелачиванием сульфид, предназначенный для выщелачивания, исследуют при различных температурах, значениях рН и содержании реагентов, и что различные вариации подлежат измерению сопротивления и емкости в зависимости от потенциала.
12. Способ по п.11, отличающийся тем, что выщелачивание сульфида металла регулируют таким образом, чтобы оно протекало в установленном предпочтительном рабочем диапазоне, при помощи измерений сопротивления и емкости.
13. Способ по любому из пп.1-12, отличающийся тем, что реагент, используемый для регулирования выщелачивания, представляет собой по меньшей мере один из элементов, которые образуют комплексные соединения с серой.
14. Способ по п.13, отличающийся тем, что используемый реагент представляет собой по меньшей мере один из следующих элементов: тиосульфат-ион, политионат-ион или сульфид-ион, такой как тиомочевина.
15. Способ по любому из пп.1-14, отличающийся тем, что для регулирования выщелачивания используют по меньшей мере одно из следующего: диоксид серы, сульфит, управляемое давление кислорода, бактерии, углерод, какой-либо другой элемент, который оказывает каталитическое воздействие на реакции серы и сульфидов.
16. Способ по любому из пп.1-15, отличающийся тем, что железо, содержащееся в сульфидном минерале, осаждают в ходе выщелачивания в виде оксида.
17. Способ по любому из пп.1-16, отличающийся тем, что серу, содержащуюся в сульфидном минерале, осаждают в ходе выщелачивания в виде элементной серы.
18. Способ по любому из пп.1-17, отличающийся тем, что по меньшей мере часть нерастворимого остатка от выщелачивания возвращают на выщелачивание.
19. Способ по любому из пп.1-18, отличающийся тем, что раствор, полученный после выщелачивания сульфидного минерала, направляют на жидкостно-жидкостную экстракцию и электролиз с получением чистого металла.
20. Способ по любому из пп.1-18, отличающийся тем, что раствор, полученный после выщелачивания сульфидного минерала, подвергают химическому превращению, и полученный сульфид металла направляют на гидрометаллургическую переработку с получением чистого металла.
21. Способ по любому из пп.1-18, отличающийся тем, что раствор, полученный после выщелачивания сульфидного минерала, подвергают химическому превращению и полученный сульфид металла направляют на пирометаллургическую переработку с получением чистого металла.
Текст
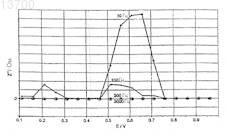
013700 Данное изобретение относится к способу сульфатного выщелачивания сульфидных минералов, таких как руда, содержащая халькопирит CuFeS2, при атмосферных условиях. Для выщелачивания сульфидов металлов благоприятно, чтобы подлежащий выщелачиванию сульфид перед выщелачиванием или в начале выщелачивания был обработан сульфидной солью, которая являлась бы менее электрохимически активной, чем этот сульфид или компоненты, которые он включает. Выщелачивание сульфидных и сульфидного типа минералов изучали в течение нескольких десятилетий. Специальные способы прямого выщелачивания разработаны для сульфидов цинка и никеля, как и способ для халькоцита Cu2S, однако, халькопирит CuFeS2 является одним из наиболее трудных для выщелачивания сульфидов металлов. Для выщелачивания халькопирита было разработано несколько способов, которые можно приблизительно разделить на три разные группы, а именно: так называемые хлоридные способы; способы, основанные на действии бактерий или их использующие; и сульфатные способы выщелачивания при повышенном давлении и температуре. В хлоридных способах выщелачивание халькопирита преимущественно осуществляют при помощи двухвалентной меди и трехвалентного железа, так что в результате выщелачивания образуются растворимые хлориды металлов, элементная сера и оксиды железа. Из второстепенных минералов минералы типа CuxS-, (Zn,Fe)S-, PbS- и Fe1-xS хорошо растворимы, однако, как правило, растворимость FeS2 ограничена. Одним из типичных, основанных на хлоридах способов выщелачивания является процессCLEAR, который описан, например, в патентах США 3879272 и 4545972. Образующийся раствор хлорида меди направляют на стадию извлечения металла, которая, по меньшей мере, включает электролиз. Одним из примеров способов, выполняемых с помощью бактерий, является способ, разработанныйMintek, который описан, например, в патенте США 6277341. В этом способе халькопирит выщелачивают с применением сульфата железа(III) и потенциал поверхности халькопирита регулируют до эмпирически определенного интервала 350-450 мВ относительно насыщенного каломельного электрода. Кроме потенциала поверхности регулируемыми параметрами являются температура выщелачивания (35-80 С), рН раствора и размер частиц, до которого размолот халькопирит. Образующийся раствор сульфата меди направляют на экстрагирование и электролиз, чтобы извлечь металлическую медь. Согласно публикацииWO 01/31072, медь из халькопирита выщелачивают с помощью биовыщелачивания, при котором стадия выщелачивания включает в себя растворенные кислород и диоксид углерода, подлежащие выщелачиванию сульфиды и микроорганизмы. Выщелачивание халькопирита при повышенном давлении описано, например, в патенте США 3957602. На первой стадии халькопирит выщелачивают с применением раствора сульфата меди с целью образования нерастворимого сульфида меди (дигенита Cu1,8S, халькоцита, ковеллита CuS), растворимого сульфата железа и серной кислоты. На второй стадии выщелачивания сульфид меди приводят во взаимодействие с кислородом в присутствии катиона, образующего ярозит, что приводит к образованию раствора сульфата меди и нерастворимого ярозита. Недостаток способа состоит в том, что почти весь сульфид халькопирита окисляется до серной кислоты вместо того, чтобы его можно было извлечь в виде элементной серы. Несмотря на то, что описанные выше исследования способов выщелачивания халькопирита проводили в течение десятилетий, ни один из них не привел к производству в промышленном масштабе. При внимательном изучении оказывается, что минерал халькопирит не является минералом, представляемым формулой CuFeS2, на самом деле соотношения Cu-Fe-S в нем могут значительно варьироваться. Кроме того, как правило, халькопирит содержит микроэлементы, и самое большее их число может составлять до двадцати элементов, обычно, до уровня 3%. Поскольку подлежащая выщелачиванию гранула CuFeS2 размером, например, 20 мкм содержит порядка 40000 атомов (ионов), понятно, что в действительности выщелачивание CuFeS2, то есть растворение минеральной структуры, представляет собой далеко не только перенос разного числа ионов меди, железа и серы (Cu2+, Fe2+, Cu+, Fe3+, S2-) в отдаление друг от друга. Кроме того, в ходе измельчения минерала и/или выщелачивания на поверхности минерала халькопирита легко может возникать обогащенный серой слой, который отталкивает воду и окислители в ней и препятствует выщелачиванию. В концентрате с подлежащим выщелачиванию халькопиритом обычно присутствуют другие минералы, которые содержат, например, мышьяк, сурьму, висмут, свинец, селен, теллур и олово, наряду с золотом и серебром. При выщелачивании минералы этих элементов также растворяются, и эти элементы могут осаждаться на поверхности растворяющегося CuFeS2 и еще более препятствовать выщелачиванию. В худшем случае, сильная пассивация халькопирита может произойти меньше чем через одну минуту после начала выщелачивания. Если физико-химические способы выщелачивания нельзя контролировать в реальном времени, то способ выщелачивания может перестать действовать или окажется серьезно нарушен, причем невозможно будет определить причину этого. Как описано выше, существует множество факторов, приводящих к пассивации при проведении выщелачивания халькопирита, и поэтому особенно необходимо, чтобы растворение минерала можно было контролировать с помощью надежных параметров, которые описывают состояние выщелачивания. Разумеется, то, как происходит выщелачивание, контролируют и регулируют при помощи измерений рН,-1 013700 температуры и окислительно-восстановительного Pt-потенциала. Это, однако, не всегда создает достаточную картину состояния выщелачивания. Цель данного изобретения заключается в том, чтобы устранить недостатки предшествующих способов и получить усовершенствованный способ сульфатного выщелачивания сульфидов металлов. Для выщелачивания сульфидов металлов целесообразно, чтобы подлежащий выщелачиванию сульфид до или в начале выщелачивания вступал в контакт с солью сульфида, менее электрохимически активной по сравнению с этим сульфидом или содержащимся в нем компонентом. Так, например, халькопирит, содержащий руду, можно обработать солью Cun+. Когда подлежащий выщелачиванию минерал представляет собой сульфид цинка, никеля или кобальта, то образующаяся соль менее электрохимически активного сульфида в этом случае также представляет собой соль меди. Существенные признаки изобретения станут очевидны из прилагаемой формулы изобретения. В этом способе также целесообразно повторно использовать по меньшей мере часть остатка раствора в выщелачивании. В ходе выщелачивания измеряют электрохимический потенциал поверхности сульфида металла как изменение сопротивления и емкости, в дополнение к обычным контролируемым параметрам, таким образом, чтобы благоприятные условия выщелачивания для сульфидных минералов можно было определить и отрегулировать. В описании способа согласно изобретению мы говорим, преимущественно, о выщелачивании халькопирита, потому что он известен как наиболее трудный для выщелачивания сульфидный минерал, не содержащий железа, особенно при сульфатном выщелачивании. Однако способ согласно изобретению может быть приспособлен для выщелачивания других сульфидов металлов. Изобретение описано далее ниже со ссылкой на прилагаемое графическое изображение на фиг. 1,которое описывает изменение сопротивления поверхности Cu-Fe-S в зависимости от электрохимического потенциала, измеренного при нескольких разных частотах. Рабочий электрод, применяемый для измерения потенциала, представляет собой минеральный электрод. Как сказано выше, выщелачивание сульфида металла замедляется, например, осаждением железа на поверхностях растворяемых гранул. В то же самое время на этих поверхностях образуются обогащенные серой водоотталкивающие слои, и драгоценные металлы и силикаты в сульфидном минерале могут цементироваться на этих поверхностях. Кроме того, проблемы создает восстановление кислорода и перенос электронов. Устранение осаждения железа на поверхности сульфида металла можно осуществить путем приведения подлежащего выщелачиванию сульфида в контакт с раствором такого типа, который содержал бы сульфидную соль, являющуюся менее электрохимически активной, чем рассматриваемый сульфид или компоненты, которые он содержит. После этого проводят регулируемое выщелачивание слоя, содержащего сульфиды (CuxS, NixS), менее электрохимически активные, чем оставшиеся на поверхности минералов. CuxS представляет собой преимущественно минерал юрлит Cu1,96S или дигенит Cu2S. Испытания выявили, что особенно в сульфатных растворах возможности выщелачивания легко могут пострадать с самого начала, даже до выщелачивания. Применительно к халькопириту это означает, что тонкий слой реакционноспособных веществ, таких как железо, сурьма и т.д., обогащенный серой, появляется на поверхности CuFeS2 перед выщелачиванием или в начале выщелачивания. Эффективно его удалить очень трудно, если не невозможно. Обрабатывая CuFeS2 или подобный ему сульфид, особенно в соответствии с представленным здесь способом, в управляемых условиях, с помощью солевого раствора, образующего менее электрохимически активный сульфид, например, на конвейерной ленте или в суспензионном реакторе, можно избежать блокировки сульфидных поверхностей перед выщелачиванием, обеспечивая тем самым абсолютную эффективность последующего выщелачивания. MexS, который образуется на поверхности, выщелачивается согласно нашему способу таким образом, что структура поверхности сохраняет форму MexS. Добавление комплексообразователей, а также в этом случае образование in situ становится причиной растворения поверхностных сульфидов типа MexS и при значительно более низких потенциалах. При этих потенциалах скорость растворения MexS зависит не только от концентраций рассматриваемых комплексов, но также, прежде всего, от скорости перемешивания и регенерации затронутых здесь комплексов. При работе на опытно-промышленной установке, 5 т/ч по сульфидному материалу, было обнаружено, что по представленному здесь способу, в лучшем случае, большая часть серы в растворимых сульфидах может высвобождаться с растворяющихся поверхностей в виде отдельных частиц. Поскольку в условиях выщелачивания по нашему способу серосодержащие вещества, образующие комплексы с золотом,состоящие, главным образом, из растворимых сульфидов, постоянно присутствуют при рН менее 2, то естественно, что драгоценные металлы также растворяются и получаются в нашем способе как сопутствующие продукты, в частности золото и серебро. Для целей извлечения, однако, было выгодно удалить золото, особенно при выщелачивании, так, чтобы поддерживать уровень Au в растворе низким, менее 2-5 мг/л в зависимости от случая. Когда золото удаляют в промежуток времени между выщелачиваниями,улучшаются кинетические условия дальнейшего растворения золота. Условия проведения способа регулируют при помощи потенциала, специфичного для данного ми-2 013700 нерала, и регулировкой рН и анализом полного сопротивления. Для этого регулирования применяют кислород, воздух, "инструменты" формирования тиосоединений, такие как сульфиты, бактерии, их добавки, катализаторы, такие как никель и кобальт, и т.д. Таким путем поддерживается максимальная скорость выщелачивания и в то же время предотвращают пассивацию поверхности минерала. Одним из практичных способов регулирования выщелачивания сульфидного минерала является использование минерального электрода. При работе таким способом можно непрерывно отслеживать и регулировать не только конкретный окислительно-восстановительный уровень каждого минерала в одной и той же суспензии, но можно также непрерывно наблюдать структуру поверхности и свойства каждого минерала в отношении успешного растворения. Разумеется, помимо этих измерений, также применяют измерение и регулирование обычных параметров, такие как измерение рН, температуры и концентрации различных элементов. Согласно этому способу анализ импенданса осуществляют измерением сопротивления (R) и емкости (С) подлежащего растворению минерала в зависимости от электрохимического потенциала этого минерала. Измерение сопротивления показывает изменение сопротивления поверхности минерала при использовании различных частот. Так же, как для сопротивления, данные измерений можно получить для емкости поверхности при различных частотах. Как оказалось, эти данные вместе дают информацию о структуре поверхности и угле смачивания непосредственно из условий суспендирования. Если это требуется, то поведение различных минералов в различных точках реактора выщелачивания, массу при кучном выщелачивании или в ином соответствующем месте можно регулировать, например, в зависимости от скорости перемешивания. Для растворения минерала выгодно, чтобы сопротивление было как можно ниже, а емкость как можно выше. Высокая емкость означает, что поверхность минерала гидрофильная и не имеет покрытий,причиняющих ущерб выщелачиванию. Сопротивление и емкость можно получить в одном и том же замере. Прилагаемое графическое представление на чертеже показывает, что, например, при выщелачивании халькопирита интервал низкого сопротивления находится между (+300) - (+450) мВ относительноAg/AgCl. Испытания были проведены с несколькими различными частотами (10, 100, 300 и 3000 Гц), и испытания, проведенные с меньшими частотами, в частности, показывают, что в указанном выше интервале сопротивление является низким. График также показывает, что снижение или увеличение крепости выщелачивания приводит к затруднению выщелачивания. Сопротивление вверх от интервала выщелачивания +750 мВ также является низким, но требующаяся крепость выщелачивания уже настолько велика,что работа в этом интервале экономически нецелесообразна. Кроме того, выщелачивание при высоком потенциале ведет к окислению всех сульфидов в минерале до серной кислоты. Одно из преимуществ способа состоит в том, что он выщелачивает сульфиды так, чтобы сера, содержащаяся в сульфидах, извлекалась в виде элементной серы, избегая, тем самым, образования серной кислоты. Способ согласно изобретению используют, чтобы изучить каждый сульфидный минерал при различных условиях, то есть используя различные температуры, различные величины рН, разные концентрации реагентов и проводя измерения сопротивления и емкости для этих различных вариантов в зависимости от потенциала. При этом можно найти для каждого минерала подходящий "коридор выщелачивания" или "окно", т.е. рабочую область, которая наиболее благоприятна для названного минерала. На основании измерений было доказано, что многие переменные вызывают многочисленные эффекты. Так некоторые реагенты, используемые для регулирования выщелачивания, такие как SO2, или содержащиеся в минералах элементы, которые действуют как катализаторы, такие как кобальт, никель, серебро, железо или сурьма, вызывают разные эффекты при различных концентрациях. Тот факт, что реагенты вызывают разные эффекты, когда условия изменяются, вероятно является следствием образования новых поверхностных фаз, таких как (Cu, Ni, Fe)xS на поверхности растворяющегося минерала, или же следствием сложных взаимозависимостей разных элементов. По способу согласно изобретению, однако, теперь поведение различных сульфидных минералов можно отслеживать в условиях реального времени, минерал за минералом. Таким образом, например, можно сформулировать правильные условия, например, для выщелачивания халькопирита и можно предотвратить попадание выщелачивания в интервал, создающий угрозу разрушения. Подходящие реагенты, такие как элементы, образующие серосодержащие комплексы, используют,чтобы проводить выщелачивание в правильном интервале. Эти элементы представляют собой тиосульфатные ионы, политионатные ионы или разного рода сульфидные ионы, такие как соединения типа тиомочевины, в малых концентрациях, как правило, 10-50 мг/л. При определении подходящего интервала выщелачивания для каждого минерала, желательно проводить описанные выше измерения заранее, прямо из суспензии с различными реагентами при различных концентрациях, а также варьируя величины температуры и рН, и таким способом формулируют подходящий интервал выщелачивания для каждого минерала. Диоксид серы, сульфиты, управляемое давление кислорода, бактерии, углерод или другие элементы с каталитическим воздействием на реакции серы и сульфидов можно использовать для управления выщелачиванием.-3 013700 Целесообразно производить выщелачивание сульфидов металлов, в частности сульфидов меди, никеля, цинка и кобальта, в интервале рН, при котором железо во время выщелачивания может осаждаться прямо в форме оксида. Обычно это означает FeOOH и Fe2O3. Однако, чтобы регулировать сульфатный баланс, целесообразно осадить часть всего железа в виде ярозита, для чего выщелачивание проводят при соответствующих величинах рН. Целесообразно вернуть по меньшей мере часть остатка после выщелачивания на стадию выщелачивания, чтобы стабилизировать окислительно-восстановительные уровни,образовывать ядро осаждающихся фаз и управлять химизмом комплексов. Очистку раствора после выщелачивания проводят с применением минералов, образующих сульфиды или селениды, с такими как минералы системы Fe-S или MnS, которые являются более электрохимически активными, чем элемент, подлежащий извлечению. Выходящий из способа выщелачивания минерала раствор сульфата, который содержит ценные металлы, обычно направляют на жидкость-жидкостную экстракцию и электролиз, чтобы получить металлический продукт. Другая альтернатива состоит в том, чтобы осуществлять конверсию полученного в результате сульфатного раствора, который содержит ценный металл. При конверсии сульфатный раствор направляют на стадию конверсии, которая происходит при температуре между 90-200 С и на которой сульфатный раствор обрабатывают, например, халькопиритом, после чего получают концентрат CuxS. Полученный сульфидный концентрат направляют либо на гидро-, либо на пирометаллургическую переработку. Конверсия описана, например, в публикации WO 2005/007902. Способ согласно изобретению можно комбинировать с различными способами выщелачивания сульфидного минерала с помощью бактерий или с биовыщелачиванием. Согласно предшествующему уровню техники важно знать, какие виды бактерий подходят для выщелачивания данного сульфида. Однако, мы обнаружили, что дело не в определенных видах бактерий, а скорее в том, как популяция данных бактерий может создавать активное пространство и соответствующую структуру на поверхности растворяющегося сульфида. Во время биовыщелачивания халькопирита и также пентландита (Ni,Fe)9S8 мы установили, что это означает поверхность, обедненную по сере, которая даже не обогащена по железу. Это происходит из-за воздействия упомянутых выше комплексов на основе серы. При измерениях это проявилось в виде очень малого сопротивления реакции (R) и одновременно в высокой гидрофильности(что соответствует С, т.е. величине емкости) в определенных интервалах величины окислительновосстановительного потенциала минерала. Поэтому эффект, достигаемый бактериями, также достигается в способе согласно этому изобретению описанными "неорганическими" средствами, отдельно или вместе с применением бактерий. Изобретение далее описано при помощи нижеприведенных примеров. Примеры Пример 1 (сравнительный пример). Концентрат халькопирита измельчили в шаровой мельнице до крупности 80% - 37 мкм. Его выщелачивали путем сульфатного выщелачивания с помощью кислорода при температуре 97-101 С. Величину рН установили между 1,5-1,7, а содержание Fe2+ + Fe3+ находилось в интервале 15-28 г/л. Выход меди в раствор составил 36,5% после 20 ч и 68,3% после 50 ч, причем окислительно-восстановительный потенциал был в диапазоне (+505) - (+565) мВ относительно насыщенного каломельного электрода. Пример 2. Твердое вещество, измельченное, как в примере 1, выщелачивали при температуре в интервале 97101 С с применением кислорода при двух разных значениях рН, где первое значение было между 1,5-1,7,а второе было между 2,1-2,35. В обоих испытаниях к исходному раствору в качестве менее химически активной соли сульфида добавили 10 г/л меди в виде сульфата меди. На ранней стадии в более кислотном растворе было 24 г/л растворенного Fe2+ и 30 г/л зародышей ярозита, причем в растворе с более высоким рН зародышами служили 75 г/л FeOOH и Fe2O3. Оба раствора содержали в качестве примеси 140 мг/л хлорида. Кроме того, раствор содержал 400 мг/л тиосульфата и 10 г/л порошкового угля в качестве регулирующих реагентов. В обоих испытаниях выщелачивание началось с использования следующих типичных реакций:CuFeS2 + (Cu2+, Cu+)CuxS + Fe2+ +В обоих испытаниях кислород и диоксид серы вводили в раствор в наиболее благоприятном рабочем интервале, который был определен в предварительных электрохимических тестах с применением минеральных электродов и при анализе сопротивления, чтобы определить сопротивление и емкость халькопирита в зависимости от окислительно-восстановительного потенциала. Таким образом удалось определить, что предпочтительный окислительно-восстановительный потенциал был на несколько десятков милливольт меньше, чем тот, что использовали в испытании 1. В то же время испытания доказали, что в этом случае халькопирит в большой степени растворялся сквозь среду CuxS поверхностной фазы, образовавшейся на поверхности минерала. В качестве условий опыта выбрали потенциал халькопирита (+365) - (+475) мВ относительно насыщенного каломельного электрода и (+385) - (+ 435) мВ относительно насыщенного каломельного электрода при соответствующих величинах рН 1,5-1,7 и 2,1-2,35.-4 013700 В испытании с более низкой величиной рН использовали такое же перемешивание, как в примере 1,а с более высокой величиной рН перемешивание осуществляли с помощью статического смесителя и потока. Результаты испытаний, что касается выхода выщелачивания меди, были следующими: Выход золота при выщелачивании в верхнем по рН интервале выщелачивания был свыше 90% благодаря образованию S-O-Au комплексов. Пример 3. Кучное выщелачивание проводили с кусковым халькопиритом. Руду пирита, которая содержала 0,57% меди в виде халькопирита с размером частиц менее 12 мм, выщелачивали в сульфатном растворе с помощью бактерий. Куча была образована из слоев, представляющих собой четырехметровые кучи. Новую руду и старый остаток после выщелачивания перемешивали в руду, предназначенную для выщелачивания, при массовом соотношении 3:1. Новую руду обрабатывали путем выщелачивания серной кислотой-сульфатом меди перед перемешиванием и получением кучи. Кучное выщелачивание халькопирита в куче регулировали тем, что поддерживали в куче условия в пределах интервала растворимости, который определяли путем измерения сопротивления и емкости минерального электрода. Регулирование осуществляли с помощью подачи воздуха, добавления сульфита и замеров и стадий, обычно входящих в кучное выщелачивание, таких как регулирование рН и температуры и добавление бактерий. Это означало, что окислительную способность надо было значительно ограничить по сравнению с диапазоном, обычно используемым при кучном выщелачивании порфиритных медных руд, составляющим (+565) - (+665) мВ относительно насыщенного каломельного электрода, до диапазона (+300) - (+470) мВ. В результате выщелачивания 74,5% меди извлекли за восемь месяцев, а в целом 83,9% меди, содержавшейся в куче, извлекли за 12 месяцев. Превосходное извлечение было результатом того, что оказалось возможным предотвратить осаждение железа на поверхность халькопирита, и поэтому поверхность оставалась активной. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ выщелачивания сульфидных минералов при атмосферных условиях, отличающийся тем,что выщелачивание сульфидного минерала является сульфатным, и подлежащий выщелачиванию сульфид приводят в контакт с серосодержащей солью, которая является менее электрохимически активной,чем сульфид или его компонент, либо перед выщелачиванием, или при начале выщелачивания, и выполняют измерение импеданса минерала, предназначенного для выщелачивания, при различных значениях его электрохимического потенциала для определения зависимости указанного импеданса от указанного потенциала, и проводят выщелачивание при значениях электрохимического потенциала, которые согласно указанной зависимости соответствуют меньшим значениям импеданса. 2. Способ по п.1, отличающийся тем, что сульфид, предназначенный для выщелачивания, приводят в контакт с раствором соли сульфида, которая является менее электрохимически активной, чем сульфид или его компонент. 3. Способ по п.1 или 2, отличающийся тем, что сульфидный минерал обрабатывают солью Cun+. 4. Способ по п.3, отличающийся тем, что соль меди представляет собой сульфат меди. 5. Способ по любому из пп.1-4, отличающийся тем, что сульфидный минерал представляет собой халькопирит. 6. Способ по любому из пп.1-4, отличающийся тем, что сульфид, подлежащий выщелачиванию,представляет собой, по меньшей мере, сульфид никеля, цинка и кобальта. 7. Способ по любому из пп.1-6, отличающийся тем, что обработка сульфида, подлежащего выщелачиванию, менее электрохимически активной сульфидной солью происходит в суспензионном реакторе. 8. Способ по любому из пп.1-6, отличающийся тем, что обработка сульфида, подлежащего выщелачиванию, менее электрохимически активной сульфидной солью происходит на ленте конвейера. 9. Способ по любому из пп.1-8, отличающийся тем, что драгоценные металлы, такие как золото, которые растворяются во время сульфидной обработки, извлекают из раствора. 10. Способ по любому из пп.1-9, отличающийся тем, что электрохимический потенциал поверхности сульфида металла измеряют во время выщелачивания при помощи минерального электрода. 11. Способ по любому из пп.1-10, отличающийся тем, что перед выщелачиванием сульфид, предназначенный для выщелачивания, исследуют при различных температурах, значениях рН и содержании реагентов, и что различные вариации подлежат измерению сопротивления и емкости в зависимости от потенциала. 12. Способ по п.11, отличающийся тем, что выщелачивание сульфида металла регулируют таким-5 013700 образом, чтобы оно протекало в установленном предпочтительном рабочем диапазоне, при помощи измерений сопротивления и емкости. 13. Способ по любому из пп.1-12, отличающийся тем, что реагент, используемый для регулирования выщелачивания, представляет собой по меньшей мере один из элементов, которые образуют комплексные соединения с серой. 14. Способ по п.13, отличающийся тем, что используемый реагент представляет собой по меньшей мере один из следующих элементов: тиосульфат-ион, политионат-ион или сульфид-ион, такой как тиомочевина. 15. Способ по любому из пп.1-14, отличающийся тем, что для регулирования выщелачивания используют по меньшей мере одно из следующего: диоксид серы, сульфит, управляемое давление кислорода, бактерии, углерод, какой-либо другой элемент, который оказывает каталитическое воздействие на реакции серы и сульфидов. 16. Способ по любому из пп.1-15, отличающийся тем, что железо, содержащееся в сульфидном минерале, осаждают в ходе выщелачивания в виде оксида. 17. Способ по любому из пп.1-16, отличающийся тем, что серу, содержащуюся в сульфидном минерале, осаждают в ходе выщелачивания в виде элементной серы. 18. Способ по любому из пп.1-17, отличающийся тем, что по меньшей мере часть нерастворимого остатка от выщелачивания возвращают на выщелачивание. 19. Способ по любому из пп.1-18, отличающийся тем, что раствор, полученный после выщелачивания сульфидного минерала, направляют на жидкостно-жидкостную экстракцию и электролиз с получением чистого металла. 20. Способ по любому из пп.1-18, отличающийся тем, что раствор, полученный после выщелачивания сульфидного минерала, подвергают химическому превращению, и полученный сульфид металла направляют на гидрометаллургическую переработку с получением чистого металла. 21. Способ по любому из пп.1-18, отличающийся тем, что раствор, полученный после выщелачивания сульфидного минерала, подвергают химическому превращению и полученный сульфид металла направляют на пирометаллургическую переработку с получением чистого металла.
МПК / Метки
МПК: C22B 23/00, C22B 3/08, C22B 19/20, C22B 15/00
Метки: способ, минералов, выщелачивания, сульфидных
Код ссылки
<a href="https://eas.patents.su/7-13700-sposob-vyshhelachivaniya-sulfidnyh-mineralov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ выщелачивания сульфидных минералов</a>











