Трициклические ингибиторы поли(adp-рибозо) полимераз
Номер патента: 4989
Опубликовано: 28.10.2004
Авторы: Веббер Стивен Эвен, Тикхе Джайашри, Канан-Кох Стейси С., Торесен Ларс Хенрик
Формула / Реферат
1. Соединение общей формулы (I), обладающее способностью ингибировать поли(ADP-рибозо)полимеразу (ПАРП)
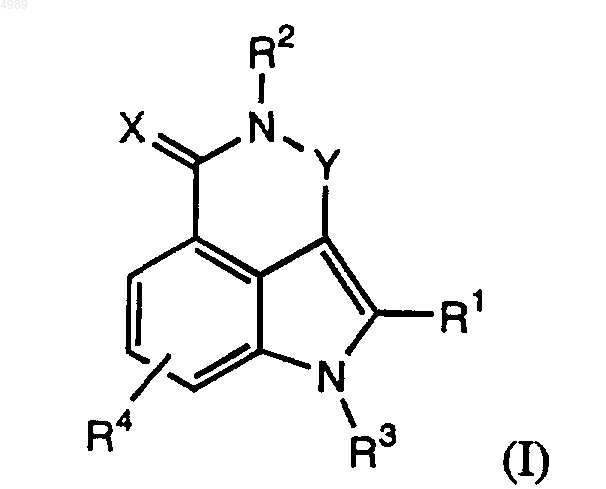
где R1 = галоген; цианогруппа; возможно замещенная (C1-C10)-алкильная, (C2-C10)-алкенильная, (C2-C10)-алкинильная, (C3-C18-циклоалкильная, гетероциклоалкильная из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильная или гетероарильная группа с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S; или -C(O)-R10, где R10 представлен H; возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S, причем указанные замещенные группы замещены гидрокси, галогеном, оксо, арилом, ацилом, сульфонилом, меркапто, нитро, алкилтио, алкокси, циклоалкилом, гетероциклоалкилом, арилом, гетероарилом, карбокси, амино, карбамоилом, арилокси, гетероарилокси, арилтио или гетероарилтио; или
OR10 или NR100R110, где R100 и R110, каждый независимо, представлен H или возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, арильной с ароматическим кольцом из 4-18 атомов углерода или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S, причем указанные замещенные группы замещены гидрокси, галогеном, оксо, арилом, ацилом, сульфонилом, меркапто, нитро, алкилтио, алкокси, циклоалкилом, гетероциклоалкилом, арилом, гетероарилом, карбокси, амино, карбамоилом, арилокси, гетероарилокси, арилтио или гетероарилтио;
R2 = H или (C1-C10)-алкил;
R3 = H или (C1-C10)-алкил;
R4 = H, галоген или (C1-C10)-алкил;
X = O или S;
Y = (CR5 R6)(CR7R8)n или N=C(R5), где n = 0 или 1;
R5 и R6, каждый независимо, представлен H или возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O, или S; или -C(O)-R10, где R10 представлен H; возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S, причем указанные замещенные группы замещены гидрокси, галогеном, оксо, арилом, ацилом, сульфонилом, меркапто, нитро, алкилтио, алкокси, циклоалкилом, гетероциклоалкилом, арилом, гетероарилом, карбокси, амино, карбамоилом, арилокси, гетероарилокси, арилтио или гетероарилтио; и
R7 и R8, каждый независимо, представлен H, возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильная или гетероарильная группа с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S; или -C(O)-R10, где R10 представлен H; возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S, причем указанные замещенные группы замещены гидрокси, галогеном, оксо, арилом, ацилом, сульфонилом, меркапто, нитро, алкилтио, алкокси, циклоалкилом, гетероциклоалкилом, арилом, гетероарилом, карбокси, амино, карбамоилом, арилокси, гетероарилокси, арилтио или гетероарилтио;
где в случае, когда R4, R5, R6 и R7 каждый представлен H, R8 не является незамещенным фенилом;
или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват этого соединения.
2. Соединение, по п.1, выбранное из группы, состоящей из

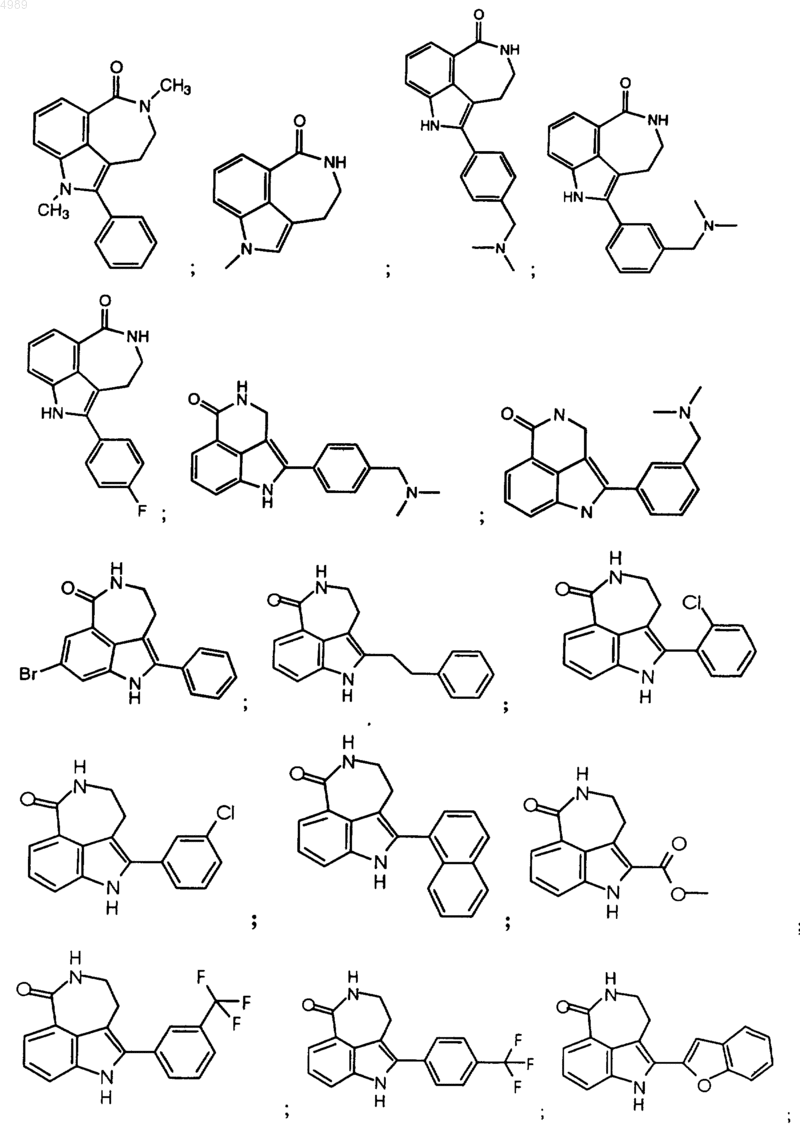
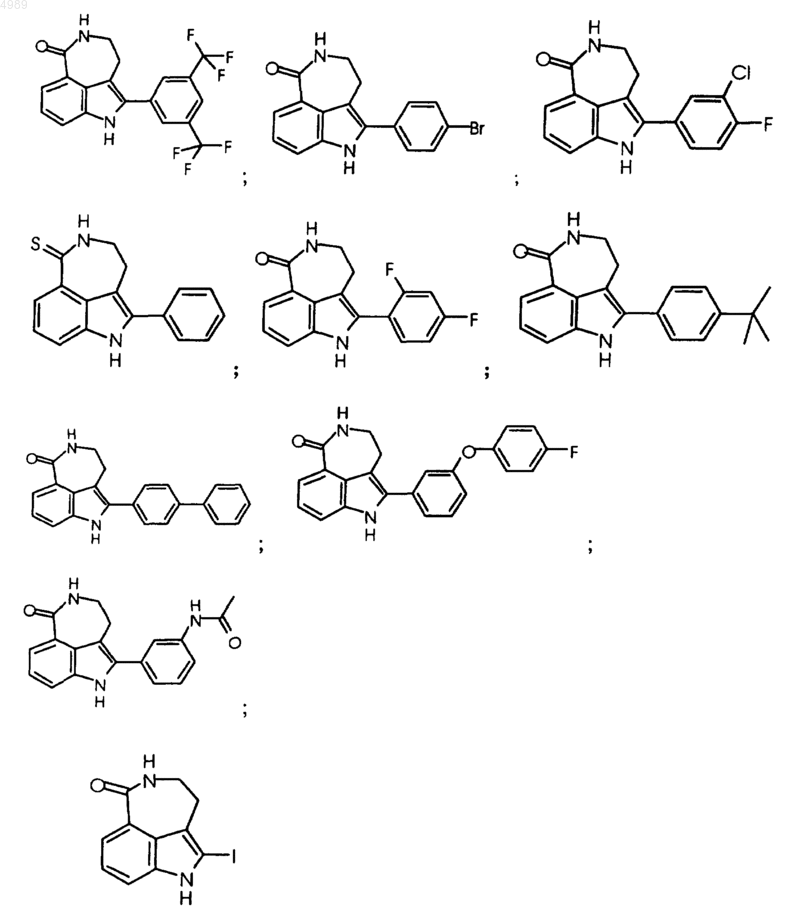
или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват.
3. Соединение по п.1, выбранное из группы, состоящей из

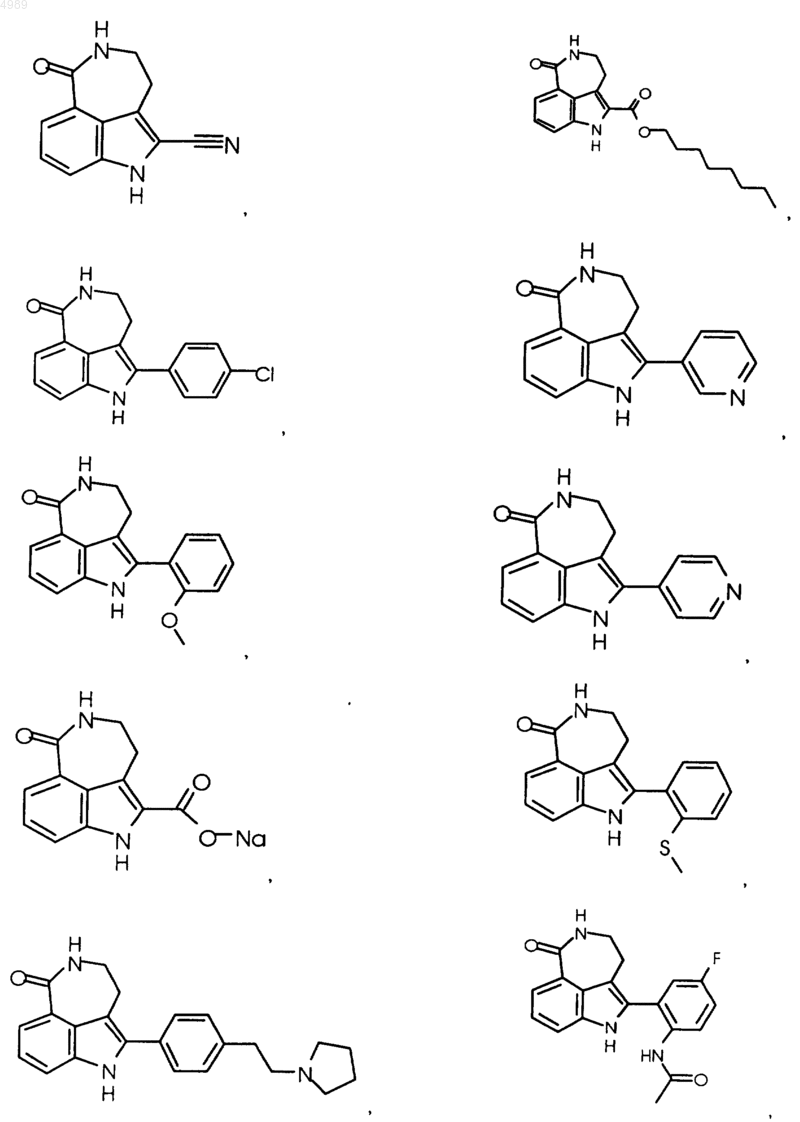
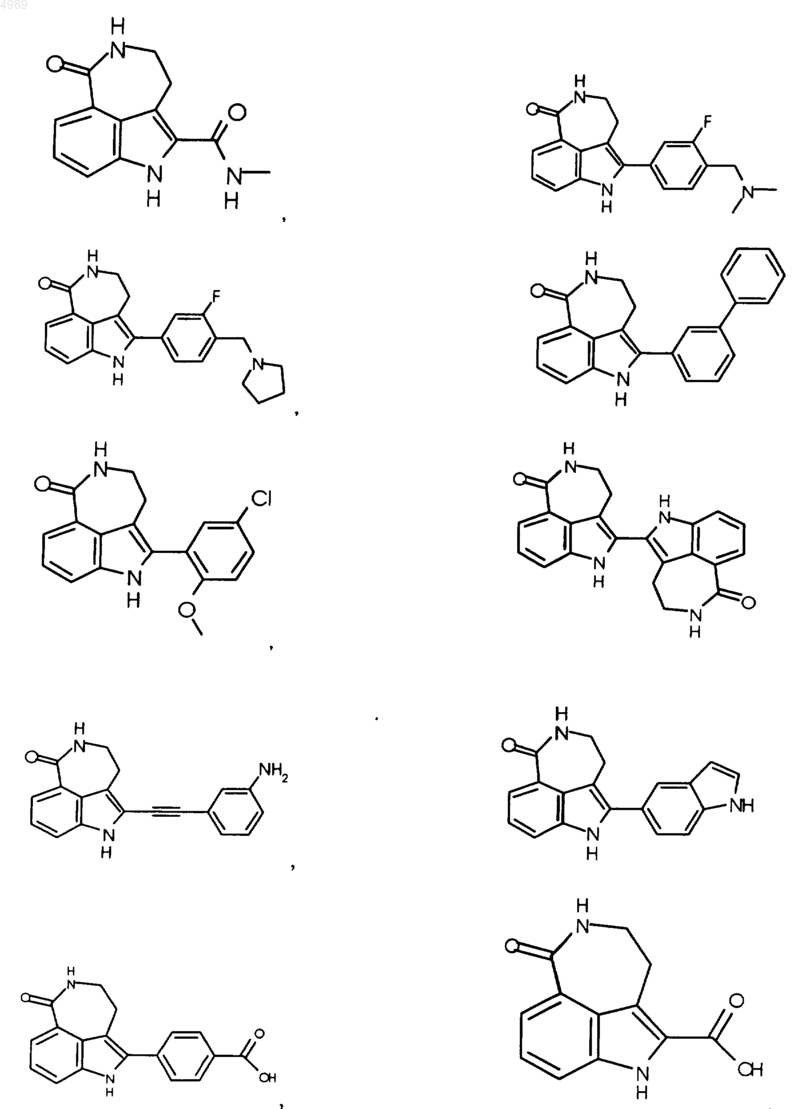
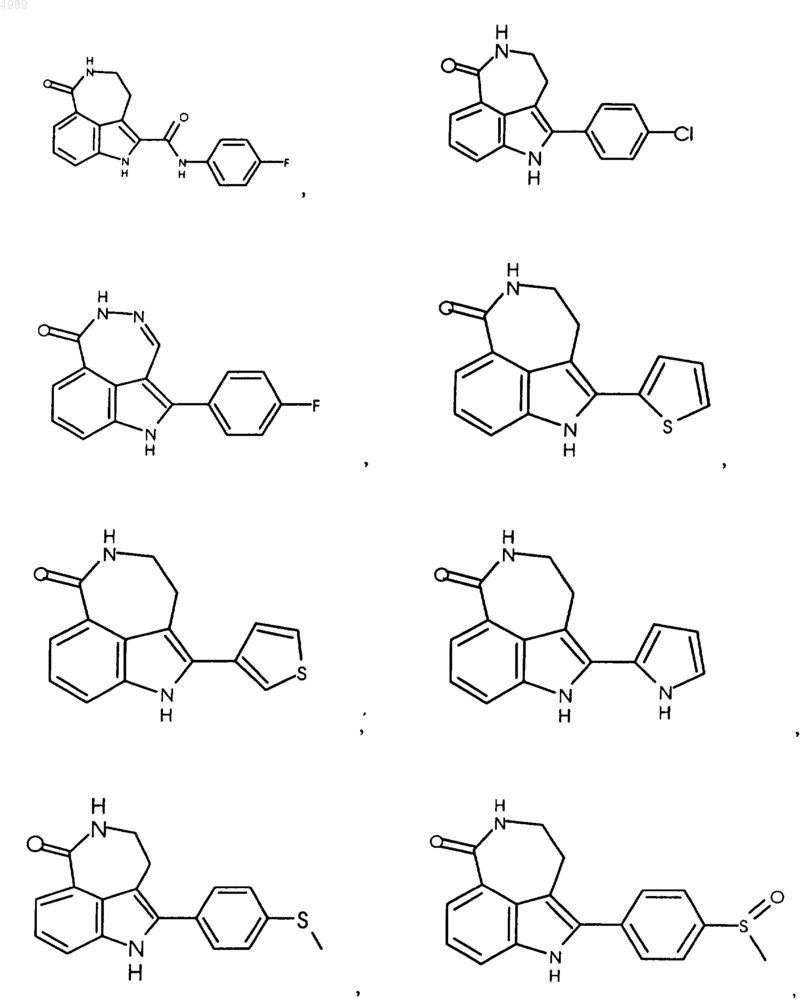
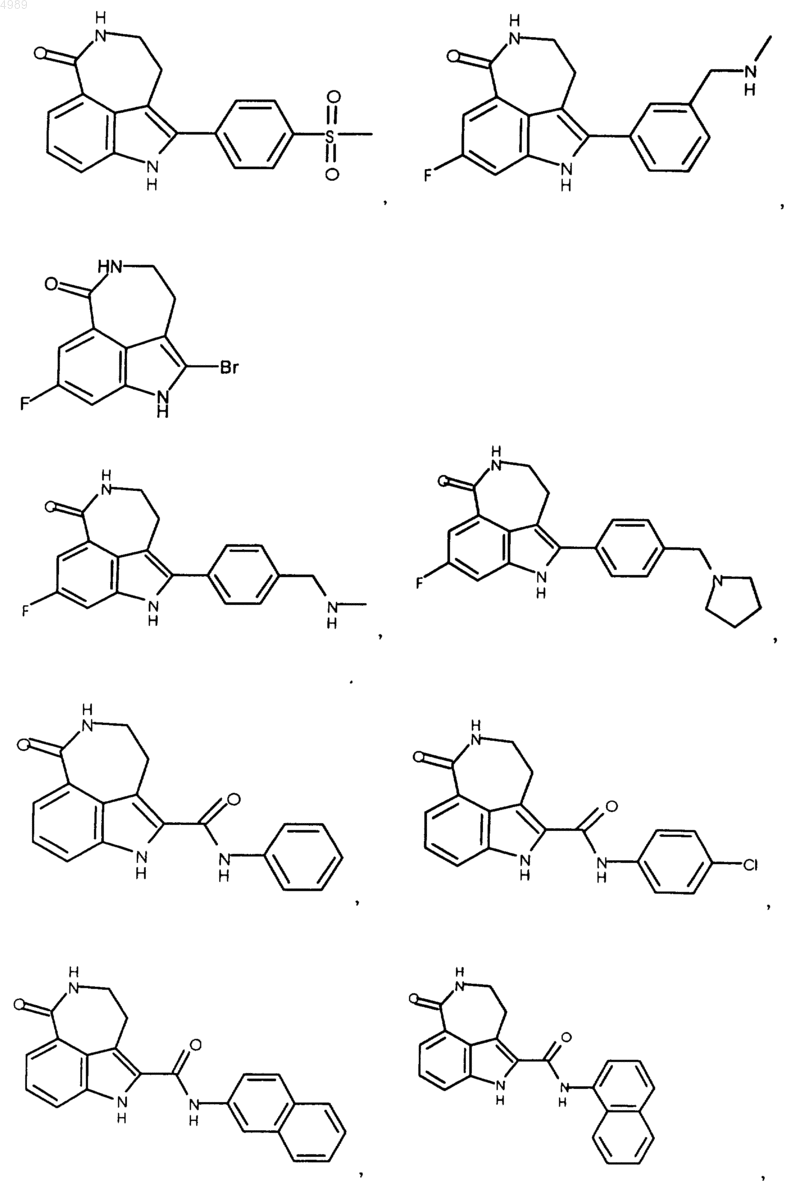
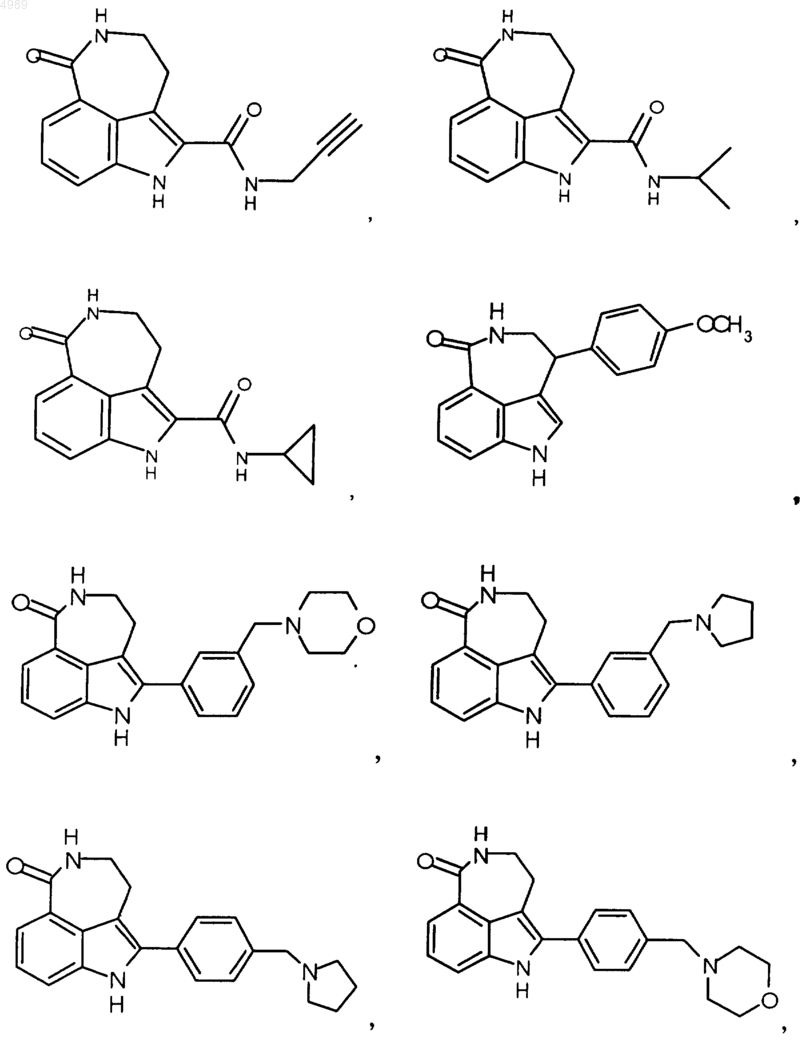
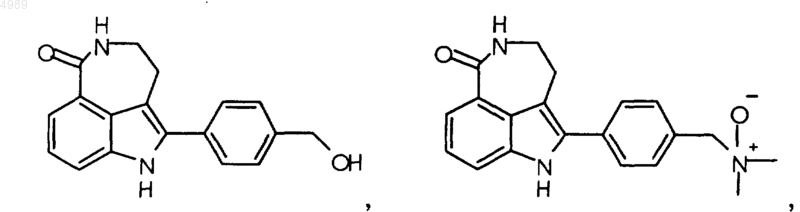
или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват.
4. Соединение по пп.1-3 или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват, имеющее константу ингибирования (Ki) ПАРП 100 мкМ или менее в пробе ингибирования фермента.
5. Соединение по пп.1-3 или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват, величина потенциирования цитотоксичности которого соответствует PF50 не менее 1 в пробе потенцирования цитотоксичности.
6. Фармацевтическая композиция, содержащая
(a) эффективное количество агента, ингибирующего ПАРП и представляющего собой соединение по любому из пп.1-3 или его фармацевтически приемлемую соль, пролекарство, активный метаболит или сольват; и
(b) фармацевтически приемлемый носитель для указанного агента ингибирования ПАРП.
7. Способ ингибирования активности ПАРП, включающий контактирование фермента с эффективным количеством соединения, его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата по любому из пп.1-3 или композиции по п.6.
8. Способ по п.7, в котором фермент представлен поли(ADP-рибозо)полимеразой или танкиразой.
9. Способ ингибирования активности ПАРП в ткани млекопитающего путем введения млекопитающему терапевтически эффективного количество соединения, его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата по любому из пп.1-3 или композиции по п.6.
10. Соединение формулы (II), обладающее способностью ингибировать ПАРП
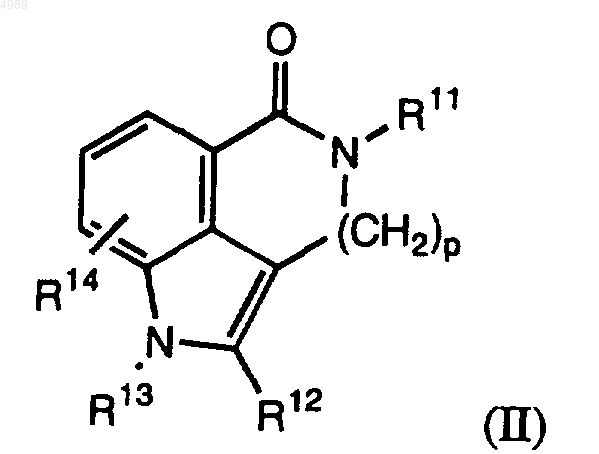
где p = 2;
R11 = H или (C1-C10)-алкил;
R12 представлен галогеном или возможно замещенной (C4-C18)-арильной, (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной или ацильной группой -C(O)-R10, где R10 представлен H; возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S; или OR100 или NR100R110, где R100 и R110, каждый независимо, представлены H или возможно замещенной (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O или S; причем указанные замещенные группы замещены гидрокси, галогеном, оксо, арилом, ацилом, сульфонилом, меркапто, нитро, алкилтио, алкокси, циклоалкилом, гетероциклоалкилом, арилом, гетероарилом, карбокси, амино, карбамоилом, арилокси, гетероарилокси, арилтио или гетероарилтио;
R13 = H или (C1-C10)-алкил и
R14 = H или галоген;
или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват этого соединения.
11. Фармацевтическая композиция, содержащая
(a) эффективное количество агента, ингибирующего ПАРП и представляющего собой соединение по п.10 или его фармацевтически приемлемую соль, пролекарство, активный метаболит или сольват; и
(b) фармацевтически приемлемый носитель для указанного ингибирующего агента.
12. Способ ингибирования активности ПАРП, включающий контактирование фермента с эффективным количеством соединения, его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата по п.10 или композиции по п.11.
13. Способ по п.12, в котором ПАРП представлена поли(ADP-рибозо)полимеразой или танкиразой.
14. Способ ингибирования активности ПАРП в ткани млекопитающего путем введения млекопитающему терапевтически эффективного количества соединения, его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата по п.10 или композиции по п.11.
15. Соединение формулы (III), обладающее способностью ингибировать ПАРП
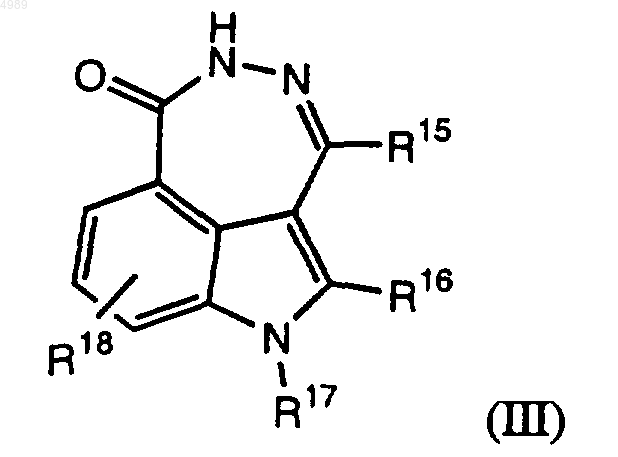
где R15 представлен H, галогеном или (C1-C10)-алкильной, (C2-C10)-алкенильной, (C2-C10)-алкинильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой, не замещенной или замещенной одним или несколькими заместителями, выбранными из галогена, гидроксильной, нитро-, амино- и (C1-C10)-алкильной или (C4-C18)-арильной групп, замещенных или не замещенных одним или несколькими заместителями, выбранными из галогена, гидроксильной, нитро- и аминогрупп;
R16 представлен галогеном; цианогруппой; или (C1-C10)-алкильной, (C2-C10)-алкенильной, (C3-C18)-циклоалкильной, гетероциклоалкильной из 3-18 атомов, в которой содержится от 1 до 5 атомов N, O или S, (C4-C18)-арильной или гетероарильной группой с ароматическим кольцом из 4-18 атомов, содержащим от 1 до 5 атомов N, O, или S, не замещенной или замещенной одним или несколькими заместителями, выбранными из галогена, гидроксильной, нитро-, амино- и (C1-C10)-алкильной и (C4-C18)-арильной групп, не замещенных или замещенных одним или несколькими заместителями, выбранными из галогена, гидроксильной, нитро- и аминогрупп;
R17 = H или (C1-C10)-алкил и
R18 = H, галоген или (C1-C10)-алкил;
где R15, R17 и RI8 не все представлены H.
16. Фармацевтическая композиция, содержащая
(a) эффективное количество агента, ингибирующего ПАРП и представляющего собой соединение по п.15 или его фармацевтически приемлемую соль, пролекарство, активный метаболит или сольват; и
(b) фармацевтически приемлемый носитель для указанного ингибирующего агента.
17. Способ ингибирования активности ПАРП, включающий контактирование фермента с эффективным количеством соединения, его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата по п.15 или композиции по п.16.
18. Способ по п.17, в котором ПАРП представлена поли(ADP-рибозо)полимеразой или танкиразой.
19. Способ ингибирования активности ПАРП в ткани млекопитающего путем введения млекопитающему терапевтически эффективного количество соединения, его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата по п.15 или композиции по п.16.
Текст
1 Настоящая заявка подается с приоритетом по предварительной заявке 60/115431, поданной 11 января 1999 г., которая полностью введена в состав этой заявки в качестве ссылки. Область техники, к которой относится изобретение Изобретение относится к соединениям, ингибирующим поли(АDР-рибозо)полимеразы,задерживая, таким образом, репарирование повреждения цепей ДНК, а также к способам получения таких соединений. Изобретение также относится к применению таких соединений в фармацевтических препаратах и для терапевтического лечения для потенцирования противораковой терапии, а также ингибирования нейротоксичности после удара, травмы головы и нейродегенеративных заболеваний. Уровень техники Поли(АDР-рибозо)полимеразы(ПАРП) представляют собой ядерные ферменты, которые находятся в эукариотных клетках, катализируют передачу единиц ADP-рибозы от никотинамидного адениндинуклеотида (NAD+) к белкам - ядерным акцепторам и отвечают за образование линейных и разветвленных гомоADP-рибозополимеров с белковыми связями. Активация ПАРП и последующее образование поли(АDР-рибозы) может индуцироваться разрывами цепей ДНК при воздействии химиотерапии, ионизирующей радиации, свободных бескиcлородных радикалов, или окисла азота(NO). Поскольку этот процесс переноса клеточной ADP-рибозы связан с репарированием разрывов цепей ДНК в ответ на повреждение ДНК,вызванное радиационной терапией или химиотерапией, он может вносить вклад в сопротивляемость, которая часто развивается при различных видах противораковой терапии. В связи с этим ингибирование ПАРП может задержать репарирование межклеточной ДНК и усилить противоопухолевое действие раковой терапии. В действительности, данные in vitro и in vivo показывают, что многие ингибиторы ПАРП потенцируют воздействие ионизирующей радиации или цитотоксических препаратов, таких как средства метилирования ДНК. Поэтому ингибиторы ферментов ПАРП полезны в качестве средства противораковой терапии. Кроме того, было показано, что ингибирование ПАРП вызывает сопротивляемость травме мозга после удара (Endres et al., "Ischemic Brain(-Ribose)Polymerase" (Ишемическая травма мозга смягчается поли(АDР-рибозо)полимеразами)(1997); Zhang, "PARP Inhibition Results in Substantial Neuroprotection in Cerebral Ischemia" (Результаты ингибирования ПАРП при существенной нейрозащите при церебральной ишемии)nities, Sept. 18-24, 1998, Las Vegas, Nevada). Считается, что активация ПАРП повреждением ДНК играет роль в гибели клеток после удара,травмы головы и нейродегенеративных заболеваний. ДНК повреждается избыточными количествами вырабатываемого NO, когда активируется фермент NO-синтетазы в результате ряда событий, вызванных выделением нейропередающего глютамата из деполяризованных нервных окончаний (Cosi et al., "Poly(ADPRibose)Polymerase Revisited: A New Role for an(Снова о поли(АDРрибозо)полимеразе: Новая роль старого фермента. Участие ПАРП в нейродегенерации и роль ингибиторов ПАРП в качестве средств нейрозащиты) Ann. N.Y. Acad. Sci., 366-379). Считается, что гибель клеток происходит в результате истощения энергии по мере потребления NAD+ реакцией ПАРП, катализируемой ферментом. Поэтому ингибиторы фермента ПАРП являются полезными ингибиторами нейротоксичности после удара, травмы головы и нейродегенеративных заболеваний. Далее, ингибирование ПАРП должно быть полезным подходом при лечении процессов или заболеваний, связанных с клеточным старением,например, старением кожи, когда ПАРП выступает в качестве сигнализатора повреждения ДНК. См., например, патент США 5589483, в котором описан способ продления жизни и способности быстрого размножения клеток, при котором вводят терапевтическое количество ингибитора ПАРП в клетки при условиях ингибирования активности ПАРП. При этом ингибиторы фермента ПАРП оказываются полезными при лечении старения кожи. В другом случае ингибирование ПАРП исследуется на клиническом уровне при предотвращении развития инсулинозависимого сахарного диабета в чувствительных пациентах (Saldeen et al., "Nicotinamide-induced apoptosis inof poly(ADP-ribose)polymerase" (Вызванный никотинамидом апоптоз в продуцирующих инсулин клетках в связи с расщеплением поли(АDРрибозо)полимераз) Mol. Cellular Endocrinol.(1998), 139:99-107). В связи с этим ингибиторы ПАРП должны быть полезны в терапии профилактики диабетов. Ингибирование ПАРП также является одним из подходов при лечении воспалительных процессов, таких как артриты (Szabo et al.,"Protective effect of an inhibitor of poly(ADPribose)synthetase in collagen-induced arthritis"Development by Inhibition of Poly(ADPribose)Synthetase" (Защита от травмирования фибробласта, вызванного пероксинитритом и от развития артрита ингибированием поли(АDРрибозо)синтетазы) Proc. Natl. Acad. Sci. USA(1998), 95(7):3867-72). Таким образом, ингибиторы ПАРП полезны при лечении воспалительных процессов. Ингибирование ПАРП полезно при защите от ишемии миокарда и при реперфузионной травме (Zingarelli et al., "Protection against myocardial ischemia and reperfusion injury by 3aminobenzamide, an inhibitor of poly (ADPribose)synthetase," (Защита от ишемии миокарда и реперфузионной травмы с помощью 3 аминбензамида - ингибитора поли(АDР-рибозо) синтетазы) Cardiovascular Research (1997),36:205-215). Таким образом, ингибиторы ПАРП полезны при лечении сердечно-сосудистых заболеваний. Семейство ферментов ПАРП обширно. Недавно было показано, что танкиразы, связанные с теломерным белком TRF-1, отрицательным регулятором поддержания длины теломера,имеют каталитический домен, поразительно гомологичный ПАРП, а также было показано,что они обладают активностью ПАРП in vitro. Было высказано предположение, что функции теломеров в клетках человека регулируют поли(АDР-рибоз)илирование. Ингибиторы ПАРП полезны в качестве средств изучения этой функции. Далее, вследствие регулирования активности теломераз со стороны танкиразы, ингибиторы ПАРП должны быть полезны в качестве средств регулирования продолжительности жизни клетки, например, для применения в противораковой терапии с целью сокращения жизни бессмертных опухолевых клеток либо при терапии против старения, поскольку считается,что длина теломеров связана со старением клеток. Известны конкурентные ингибиторы ПАРП. Например, Banasik et al. ("Specific Inhibitors of Poly(ADP-Ribose)Synthetase and(1992) 267: 1569-1575) изучал активность ингибирования ПАРП у 132 соединений, самыми сильными из которых являются 4-амино-1,8 нафталимид,6(5H)-фенантридон,2-нитро 6(5H)-фенантридон и 1,5-диоксихинолин. Griffinet al. сообщали об активности ингибирования ПАРП у ряда бензамидных соединений (патент США 5756510; см. также "Novel Potent Inhibitors of the DNA Repair Enzyme poly (ADPribose)polymerase,"(Новые мощные ингибиторы фермента репарирования ДНК - поли(АDРрибозо)полимеразы (ПАРП Anti-Cancer Drug 4 зинона (международная заявкаWO 98/33802). Suto et al. сообщали об ингибировании ПАРП рядом дигидроизохинолиновых соединений ("Dihydroisoquinolines: The Design andPoly(ADP-ribose)Polymerase" (Дигидроизохинолины: проектирование и синтез новых рядов мощных ингибиторов поли(АDР-рибозо)полимеразы) Anti-Cancer Drug Design (1991), 7:107117). Griffin et al. сообщали о других ингибиторах ПАРП класса хиназолина ("ResistanceModifying Agents. 5. Synthesis and Biological(Средства изменения сопротивляемости. 5. Синтез и биологические свойства хиназолиновых ингибиторов фермента репарирования ДНК поли(АDР-рибозо)полимеразы (ПАРП" J. Med.Chem., ASAP Article 10.1021/jm980273t S00222623(98)00273-8; Web Release Date: December 1,1998). Вместе с тем, все еще существует необходимость в низкомолекулярных соединениях,являющихся мощными ингибиторами ПАРП, в особенности таких, которые обладают физикохимическими свойствами, подходящими для фармацевтического применения. Сущность изобретения Цель изобретения заключается в создании соединений, действующих в качестве мощных ингибиторов поли(АDР-рибозо)трансферазы(ПАРП) и полезных в терапии, в частности, при лечении раковых заболеваний и при смягчении воздействия удара, травмы головы и нейродегенеративных заболеваний. В качестве средства лечения раковых заболеваний предлагаемые соединения можно применять в сочетании с цитотоксическими средствами, повреждающими ДНК, например, с топотеканом, иринотеканом или темозоломидом и(или) с облучением. В частности, изобретение обеспечивает получение соединений общей формулы (I) где R1 = Н,галоген,цианогруппа,возможно замещенная алкильная, алкенильная, алкинильная, циклоалкильная, гетероциклоалкильная, арильная или гетероарильная группа (например, не замещенная или замещенная одним или несколькими заместителями, выбранными из галогена, гидроксильной группы,нитро и амино-, алкоксильных, алкильных и арильных групп, не замещенных или замещенных одним или несколькими заместителями, 5 выбранными из галогена, гидроксильной, нитро,карбоксильной групп и возможно замещенных амино- и эфирной группами (например Оарил; или-C(O)-R10, где R10 представлен Н; возможно замещенной алкильной, алкенильной, алкинильной, циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группой (например, не замещенной или замещенной одним или несколькими заместителями, выбранными из галогена, гидроксильной группы, нитро, амино- и алкильных и арильных групп, не замещенных или замещенных одним из несколькими заместителями, выбранными из галогена, гидроксильной группы, нитро и аминогрупп); илиOR100 или NR100R110, где R100 и R110, каждый независимо, представлен Н или возможно замещенной алкильной, алкенильной, алкинильной,циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группой (например, не замещенной или замещенной одним или несколькими заместителями, выбранными из алкильной, алкенильной, алкинильной, циклоалкильной, гетероциклоалкильной, арильной или гетероарильной групп, не замещенных или замещенных одним нескольким заместителями выбранными из галогена, гидроксильной группы, нитро, амино- и алкильной и арильной групп, не замещенных или замещенных одним из нескольким заместителями выбранными из галогена, гидроксильной группы, нитро и возможно замещенных аминогрупп);R5 и R6, каждый независимо, представлен Н или возможно замещенной алкильной, алкенильной, алкинильной, циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группой (например, не замещенной или замещенной одним или несколькими заместителями, выбранными из галогена, гидроксильной группы, нитро, амино- и низшей алкильной,низшей алкоксильной, или арильной групп, не замещенных или замещенных одним или несколькими заместителями, выбранными из галогена, гидроксильной, нитро и аминогруппы); иR7 и R8, каждый независимо, представлен Н или возможно замещенной алкильной, алкенильной, алкинильной, циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группой (например, не замещенной или замещенной одним или несколькими заместителями, выбранными из галогена, гидроксильной группы, нитро, амино- и низшей алкильной,низшей алкоксильной, и арильной групп, не замещенных или замещенных одним или несколькими заместителями, выбранными из галогена, гидроксильной, нитро и аминогруппы); 6 где в случае, когда R1, R4, R5, R6 и R7 каждый представлен Н, R8 не является незамещенным фенилом. Изобретение также направлено на получение фармацевтически приемлемых солей, пролекарств, активных метаболитов и сольватов указанных соединений. Предпочтительные соединения формулы (I) включают такие, в которых R2 и R3, каждый независимо, выбран из Н и метила. В предпочтительном варианте осуществления предлагаемые соединения включают соединения общей формулы (II)R12 = водород или возможно замещенная арильная, алкильная, алкенильная, алкинильная или ацильная группа -C(O)-R10, как определено выше;R14 - Н или галоген,а также фармацевтически приемлемые соли,пролекарства, активные метаболиты и сольваты указанных соединений. В предпочтительных соединениях формулы (II) R11 и R13, каждый независимо, выбраны из Н и метила. Более предпочтительно изобретение направлено на получение соединений формулы (II), где R11 и R13 каждый представлен Н, a R12 возможно замещен арилом, а также фармацевтически приемлемых солей, пролекарств и активных метаболитов и сольватов указанных соединений. В другом предпочтительном варианте осуществления изобретения в соединениях формулы (II) R11 и R13 каждый представлен Н, a R12 представлен водородом или возможно замещенным арилом. В другом предпочтительном варианте осуществления изобретения предлагаемое соединение включает указанные ниже соединения общей формулы (III), а также их фармацевтически приемлемые соли, пролекарства, активные метаболиты и сольваты где R15 = Н, галоген или алкильная, алкенильная, алкинильная, циклоалкильная, гетероциклоалкильная, арильная, или гетероарильная группа, не замещенная или замещенная одним или несколькими заместителями, выбранными 7 из галогена, гидроксильной группы, нитро-,амино- и алкильной и арильной групп, не замещенных или замещенных одним или несколькими заместителями, выбранными из галогена,гидроксильной группы, нитро и аминогруппы;R16 = H, галоген, циан- или алкильная, алкенильная, алкинильная, циклоалкильная, гетероциклоалкильная, арильная или гетероалкильная группа, не замещенная или замещенная одним или несколькими заместителями, выбранными из галогена, гидроксильной группы, нитро-, амино- и алкильной и арильной групп, не замещенных или замещенных одним или несколькими заместителями, выбранными и галогена, гидроксильной группы, нитро- и аминогруппы;R18 = Н, галоген или алкил; где R15, R16, R17 и R18 не все представлены Н. В предпочтительных соединениях формулы (III) R15 представлен замещенным фенилом или (СН 2)q арилом, где q = 1 или 2. В других предпочтительных соединениях формулы (III) R16 представлен замещенным или незамещенным арилом. Изобретение также направлено на создание способа ингибирования активности ферментов ПАРП, при котором осуществляют контакт фермента с эффективным количеством соединения формулы (I), (II) или (III) или его фармацевтически приемлемой солью, пролекарством,активным метаболитом или сольватом. Предлагаемые соединения представляют собой мощные ингибиторы ПАРП и предпочтительно имеют активность ингибирования ПАРП, соответствующую Ki 100 мкМ и менее в пробе ингибирования фермента ПАРП. Изобретение также направлено на разработку способа потенцирования цитотоксичности цитотоксического препарата или ионизирующей радиации, при котором обеспечивают контакт клеток с действующим количеством соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата в сочетании с цитотоксическим препаратом или ионизирующей радиацией. Предлагаемые соединения предпочтительно имеют активность потенцирования цитотоксичности, соответствующую PF50, по меньшей мере 1 в пробе на потенцирование цитотоксичности. Изобретение также направлено на создание фармацевтических композиций, содержащих действующее ингибирующее ПАРП количество соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата. Изобретение также направлено на разработку терапевтического вмешательства, необходимого в состоянии болезни или травмы, когда активность ПАРП вредна пациенту, при этом методы лечения заключаются в ингибировании 8 активности ферментов ПАРП в соответствующей ткани пациента путем введения соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата. При одном из таких предлагаемых способов терапевтического вмешательства эффективность цитотоксического препарата или радиационной терапии, вводимых млекопитающему в ходе лечения, улучшается путем введения пациенту, например, млекопитающему, нуждающемуся в лечении, действующего ингибирующего ПАРП количества соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата в связи с применением цитотоксического препарата или радиационной терапии. Другой предлагаемый способ терапевтического вмешательства заключается в задерживании наступления старения клеток, связанного со старением кожи человека, при котором вводят в фибробластные клетки человека действующее ингибирующее ПАРП количество соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата. Еще один предлагаемый способ терапевтического вмешательства представляет собой способ снижения нейротоксичности после удара, травмы головы и нейродегенеративного заболевания млекопитающего путем введения действующего количества соединения формулы(I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата. Предлагаемые соединения обеспечивают терапевтический подход к лечению воспалительных процессов, при котором вводят действующее количество соединения формулы (I),(II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата пациенту, нуждающемуся в лечении. Еще один предлагаемый способ терапевтического вмешательства представляет собой способ сердечно-сосудистой терапии для защиты от ишемии миокарда и реперфузионной травмы у млекопитающих, при котором вводят млекопитающему действующее количество соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата. Далее изобретение направлено на создание способа синтеза трициклических соединений формулы (I), при котором превращают 4 карбоалкоксииндол (IV) в промежуточный 3 замещенный-4-карбоалкоксииндол, встраивая,таким образом, необходимые атомы углерода кольца, с замещением концевых групп одним атомом азота. В третьем положении на этом этапе можно встроить дополнительные функциональные группы, такие как формильная или ацильная. Нитрогруппа восстанавливается до амина и циклизируется на 4-карбоалкоксильной группе с получением трициклического гетероцикла. Методы синтеза далее могут включать получение производных на N-1 и С-2. Промежуточные продукты 3-формил или 3-ацил можно превратить в азотосодержащие промежуточные соединения или в трициклические индолы с N-N связями, такие как соединения формулы (III). Подробное описание изобретения и предпочтительные варианты осуществления Ингибиторы ПАРП. В соответствии с принятыми обозначенияиспользуется в структурных ми символ формулах в данном описании для обозначения связи, представляющей собой место прикрепления части или заместителя к структуре ядра или основной цепи. В соответствии с другим обозначением в некоторых структурных формулах в данном описании не изображаются в явном виде атомы углерода и связанные с ними атомы водорода, например,представляет метильную группу, представляет этильную представляет циклопентильную группу,группу и т.п. Используемый здесь термин "алкил" означает разветвленную или линейную (прямоцепную) группу парафинового углеводорода (насыщенную алифатическую группу), имеющую 1-10 атомов углерода в своей цепи, которую в общем случае можно представить формулой СkН 2k+1, где k - целое число от 1 до 10. Примеры алкильных групп включают метил, этил, nпропил, изопропил, n-бутил, изобутил, t-бутил,пентил, n-пентил, изопентил, неопентил и гексил, а также их простые алифатические изомеры. "Низший алкил" означает алкильную группу, имеющую от 1 до 4 атомов углерода в своей цепи. Термин "алкенил" означает разветвленную или линейную олефиновую углеводородную группу (ненасыщенную алифатическую группу,имеющую одну или несколько двойных связей),содержащую от 2 до 10 атомов углерода в своей цепи. Примеры алкенилов включают этенил, 1 пропенил, 2-пропенил, 1-бутенил, 2-бутенил,изобутенил и различные изомерные пентенилы и гексенилы (включая цис- и транс-изомеры). Термин "алкинил" означает разветвленную или линейную углеводородную группу, имеющую одну или несколько тройных углеродуглеродных связей и имеющую от 2 до 10 ато 10 мов углерода в своей цепи. Примеры алкинилов включают этинил, пропинил, 1-бутинил, 2 бутинил и 1-метил-2-бутинил. Термин "карбоцикл" относится к насыщенной, частично насыщенной, ненасыщенной или ароматической моноциклической или к конденсированной или неконденсированной полициклической кольцевой структуре, имеющей только углеродные атомы кольца (без гетероатомов, т.е. не углеродных кольцевых атомов). Примеры карбоциклов включают циклоалкильные, арильные и циклоалкил-арильные группы. Термин "гетероцикл" относится к насыщенной, частично насыщенной, ненасыщенной или ароматической моноциклической или к слитой или неслитой полициклической кольцевой структуре, имеющей один или несколько гетероатомов, выбранных из N, О и S. Примеры гетероциклов включают гетероциклоалкильные,гетероарильные и гетероциклоалкил-гетероарильные группы."Циклоалкильная группа" означает неароматическую одновалентную моноциклическую или слитую полициклическую кольцевую структуру, имеющую всего от 3 до 18 атомов углерода (но не гетероатомов). Примеры циклоалкилов включают циклопропильную, циклобутильную, циклопентильную, циклогексильную,циклогептильную, адамантильную, фенантренильную и подобные группы."Гетероциклоалкильная группа" обозначает неароматическую одновалентную моноциклическую или слитую полициклическую кольцевую структуру, имеющую всего от 3 до 18 кольцевых атомов, включая от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы. Примеры гетероциклоалкильной группы включают пирролидинил, тетрагидрофурил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, азиридинил и подобные группы. Термин "арил" означает ароматическую моноциклическую или слитую полициклическую кольцевую структуру, имеющую всего от 4 до 18, предпочтительно от 6 до 18 кольцевых атомов углерода (без гетероатомов). Примеры арильных групп включают фенил, нафтил, антраценил и подобные."Гетероарильная группа" означает ароматическую одновалентную моноциклическую или слитую полициклическую кольцевую структуру, имеющую от 4 до 18, предпочтительно от 5 до 18 атомов кольца, включая от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы. Примеры гетероарильных групп включают пирролил, тиенил, оксазолил, пиразолил, тиазолил, фурил, пиридинил, пиразинил,триазолил, тетразолил, индолил, хинолинил,хиноксалинил и т.п. Термин "возможно замещенная" означает,что указанная группа является незамещенной или замещенной одним или несколькими под 11 ходящими заместителями, если явно не указаны возможные заместители, при этом в противном случае этот термин означает, что данная группа не замещена или замещена указанными заместителями. При отсутствии других указаний (например, указания, что данная группа не замещена) различные указанные выше группы могут быть в общем виде незамещенными или замещенными (т.е. они могут быть замещены) одним или несколькими подходящими заместителями. Термин "заместитель" или "подходящий заместитель" означает любой заместитель для группы, который может быть опознан или просто выбран специалистом, например, путем стандартных проб на фармацевтическую пригодность. Примерами подходящих заместителей являются гидроксильная группа, галогены (F,Сl, I или Вr), оксо-, алкильная, ацильная, сульфонильная, меркапто-, нитро, алкилтио-, алкоксильная, циклоалкильная, гетероциклоалкильная, арильная, гетероарильная, карбоксильная,амино-(первичная, вторичная или третичная),карбамоильная, арилокси-, гетероарилокси-,арилтио-, гетероарилтио- и подобные группы(например, иллюстрируемые приведенными здесь примерами соединений). Из приведенных ниже примеров соединений можно судить о подходящих заместителях. Предпочтительные возможные заместители для алкильных и арильных групп в предлагаемых соединениях включают галогены и арильные группы. Особо предпочтительны для замещенных алкильных групп перфторзамещенные алкилы. Особенно предпочтительные возможные заместители для арильных составляющих включают галоген, низший алкил, -ОН,-NO2, -CN, -СО 2 Н, О-низший алкил, арил, -Оарил, арил-низший алкил, -СО 2 СН 3, -CONH2.-OCH2CONH2, -NH2, -SO2NH2, -OCHF2, -CF3,-OCF3 и т.п. Арильные составляющие могут также замещаться двумя заместителями, образующими мостик, например, -О-(СН 2)z-О-, где z целое число = 1, 2 или 3."Пролекарство" означает соединение, которое превращается в указанное фармацевтически активное соединение при физиологических условиях или сольволизом либо метаболическим путем."Активный метаболит" означает фармакологически активный продукт, образуемый метаболизмом указанного соединения в организме."Сольват" означает фармацевтически приемлемую сольватную форму указанного соединения, которая сохраняет биологическую эффективность такого соединения. Примеры сольватов включают предлагаемые соединения в сочетании с водой, изопропиловым спиртом,этиловым спиртом, метиловым спиртом, ДМСО,этилацетатом, уксусной кислотой или этаноламином. 12 эффективность свободно-кислотной или основной формы указанного соединения и является фармацевтически пригодной. Примеры фармацевтически приемлемых солей включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты,моногидрогенфосфаты,дигидрогенфосфаты,метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты,каприлаты, акрилаты, форматы, изобутираты,капроаты, гептаноаты, пропиолаты, оксалаты,малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоат, гексин-1,6 диоат, бензоаты, хлорбензоаты, метилбензоаты,динитробензоаты, оксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -оксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты. Если предлагаемое соединение является основанием, необходимую соль можно приготовить любым подходящим известным способом,выключая обработку свободного основания: неорганической кислотой, например, соляной кислотой, бромистой кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и т.п.; либо органической кислотой, например,уксусной кислотой, малеиновой кислотой, янтарной кислотой, миндальной кислотой, фумаровой кислотой, малоновой кислотой, пировиноградной кислотой, щавелевой кислотой, гликолевой кислотой, салициловой кислотой, пиранозидиловой кислотой, такой как глюкуроновой кислотой или галактуроновой кислотой; оксикислотой, такой как лимонной кислотой или винной кислотой; аминокислотой, например аспарагиновой кислотой или глютаминовой кислотой; ароматической кислотой, например бензойной кислотой или коричной кислотой; сульфоновой кислотой, например р-толуолсульфоновой кислотой или этансульфоновой кислотой и т.п. Если предлагаемое соединение является кислотой, необходимую соль можно получить любым походящим известным способом, включая обработку свободной кислоты неорганическим или органическим основанием, например,амином (первичным, вторичным или третичным), щелочным металлом или гидроксидом щелочно-земельного металла и т.п. Примеры подходящих солей включают органические соли, полученные на основе аминокислоты, такой как глициновая и аргининовая; аммиака; первичных, вторичных и третичных аминов; циклических аминов, таких как пиперидин, морфолин и пиперазин; а также неорганические соли,полученные на основе натрия, кальция, калия,магния, марганца, железа, меди, цинка, алюминия и лития. 13 Если соединения, соли или сольваты являются твердыми веществами, специалистам понятно, что предлагаемые соединения, соли или сольваты могут существовать в различных кристаллических или полиморфных формах,которые все входят в объем настоящего изобретения и конкретных формул. В некоторых случаях предлагаемые соединения будут иметь хиральные центры. При наличии хиральных центров предлагаемые соединения могут существовать в виде отдельных стереоизомеров, рацематов и(или) смесей энантиомеров и(или) диастереомеров. Все такие отдельные стереоизомеры, рацематы и их смеси подпадают под широкий объем общих структурных формул (при отсутствии других указаний). Однако предпочтительно предлагаемые соединения используются в существенно оптически чистом виде (как понимают специалисты в данной области, оптически чистое соединение это - энантиометрически чистое соединение). Предпочтительно предлагаемые соединения состоят по меньшей мере на 90% из необходимого отдельного изомера (энантиомерный избыток [е.е.] 80%), более предпочтительно по меньшей мере на 95% (90% е.е.), еще более предпочтительно по меньшей мере на 97,5%(95% е.е.) и наиболее предпочтительно по меньшей мере на 99% (98% е.е.). В некоторых случаях соединения могут находиться в таутометрическом виде. В таких случаях предполагается, что оба таутомера охватываются структурными формулами. Изобретение относится к следующим ингибирующим ПАРП средствам: соединения формулы где R1, R2, R3, R4, X и Y определены выше; и к их фармацевтически приемлемым солям, пролекарствам, активным метаболитам и сольватам. В предпочтительном варианте осуществления эти средства представлены соединениями формулы(I), где R2 и R3, каждый независимо, Н или метил, а также их фармацевтически приемлемыми солями, пролекарствами, активными метаболитами и сольватами. Более предпочтительно эти средства представлены соединениями формулы (II) или (III) где переменные указаны выше, или их фармацевтически приемлемыми солями, пролекарст 004989 14 вами, активными метаболитами и сольватами. В предпочтительных вариантах осуществления по формулам (II) и (III), R11, R13 и R17, каждый независимо, представлен Н или метилом. В предпочтительном варианте осуществления предлагаемые средства представляют собой соединения формулы (II) и фармацевтически приемлемые соли, пролекарства, активные метаболиты и сольваты, где R11 и R13 каждый представлены Н, a R12 возможно замещен арильной группой. В другом предпочтительном варианте осуществления предлагаемые средства представляют собой соединения формулы (III) и фармацевтически приемлемые соли, пролекарства, активные метаболиты и сольваты, где R17 представлен Н или метилом, a R15 возможно замещен арилом или алкилом. В других предпочтительных вариантах осуществления R16 - замещенный или незамещенный арил, a R15 - водород. В других предпочтительных вариантах осуществления R16 - Н, a R15 - замещенный или незамещенный арил или алкил. Предпочтительные предлагаемые соединения включают Фармацевтические способы и композиции Изобретение также относится к способу ингибирования активности ферментов ПАРП,заключающемуся во введении фермента в контакт с эффективным количеством соединения формулы (I) или его фармацевтически приемлемой солью, пролекарством, активным метаболитом или сольватом. Например, активность ПАРП может ингибироваться в тканях млекопитающих введением соединения формулы (I) или его фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата. Кроме указанных выше соединений, приведенные ниже соединения также оказались эффективными для ингибирования активности ферментов ПАРП"Лечить" и "лечение" означает смягчение или облегчение состояния травмы или заболевания млекопитающего, например человека,путем воздействия ингибированием активности ПАРП, например потенцированием противораковой терапии или ингибированием нейротоксичности после удара, травмы головы и нейродегенеративных заболеваний. Виды лечения включают (а) профилактику у млекопитающих,в частности, при обнаружении предрасположенности млекопитающих к состоянию болезни, но до ее диагностирования; (b) ингибирование болезненного состояния; (с) и(или) полное 20 или частичное облегчение болезненного состояния. Один из способов лечения заключается в повышении эффективности цитотоксического препарата или радиационной терапии, проводимой для млекопитающего в ходе терапевтического лечения, при котором вводят млекопитающему действующее количество средства(соединения, фармацевтически приемлемой соли, пролекарства, активного метаболита или сольвата) в связи с введением цитотоксического препарата (например, топотекана или иринотекана) или радиационной терапией. Средства ингибирования ПАРП могут также успешно применяться в способе снижения нейротоксичности после удара, травмы головы и нейродегенеративных заболеваний у млекопитающих путем введения млекопитающему предлагаемого средства. Предлагаемые средства ингибирования ПАРП можно также использовать в способе задерживания начала старения клеток в связи со старением кожи у человека, при котором вводят в фибробластные клетки человека действующее ингибирующее ПАРП количество средства. Эти средства можно также использовать в способе предотвращения развития инсулинозависимого сахарного диабета у чувствительных пациентов,при котором вводят терапевтически действующее количество средства. Кроме того, эти средства можно применять в способе лечения воспалительного процесса у млекопитающего, при котором вводят терапевтически эффективное количество средства млекопитающему. Далее,эти средства можно использовать в способе лечения сердечно-сосудистого заболевания у млекопитающего, при котором млекопитающему вводят терапевтически эффективные количества ингибирующего ПАРП средства. При появлении новых знаний о терапевтической роли ингибиторов ПАРП станут очевидны другие применения предлагаемых средств ингибирования ПАРП. Активность предлагаемых соединений в качестве ингибиторов активности ПАРП можно измерять любым подходящим известным способом, включая пробы in vivo и in vitro. Примером подходящей пробы для измерений активности является описанная здесь проба ингибирования ферментов ПАРП. Введение соединений формулы (I) и их фармацевтически приемлемых солей, пролекарств, активных метаболитов или сольватов можно производить любыми принятыми в данной области доступными способами введения. Примеры подходящих способов введения включают пероральное, назальное, парентеральное,наружное, накожное и ректальное введение. Предпочтительным является пероральное и внутривенное введение. Предлагаемое соединение формулы (I) или его фармацевтически приемлемая соль, пролекарство, активный метаболит или сольват мож 21 но вводить в виде фармацевтической композиции в любой лекарственной форме, известной специалистам и считающейся подходящей. Подходящие лекарственные формы включают твердую, пластичную, жидкую или лиофилизированную, например таблетки, порошки, капсулы, свечи, суспензии, липосомы и аэрозоли. Предлагаемые фармацевтические композиции могут также включать подходящие наполнители, разбавители, носители, а также прочие фармацевтически активные средства (включая средства ингибирования) в зависимости от предполагаемого применения. Приемлемые способы приготовления подходящих лекарственных форм фармацевтических композиций известны или могут быть установлены стандартным путем специалистами в данной области. Например, фармацевтические препараты можно приготовлять обычными методами фармацевтической химии, включающими операции смешивания, гранулирования и прессования, необходимого для выработки таблеток, либо смешивания, наполнения и растворения ингредиентов по потребности для получения необходимого продукта для перорального, парентерального, вагинального, носового,бронхиального, глазного, ушного и(или) ректального введения. В фармацевтических композициях можно использовать твердые или жидкие фармацевтически приемлемые носители, разбавители, носители распыления или наполнители. Примеры твердых носителей включают крахмал, лактозу,двуводный сульфат кальция, каолин, сахарозу,тальк, желатин, пектин, акацию, стеарат магния и стеариновую кислоту. Примеры жидких носителей включают сироп, арахисовое масло, оливковое масло, физиологический раствор и воду. Носитель или разбавитель может содержать подходящий материал пролонгированного действия, например моностеарат глицерила или дистеарат глицерила отдельно или с воском. При использовании жидкого носителя препарат может быть в виде сиропа, микстуры, эмульсии,мягкой желатиновой капсулы, стерильной жидкости для инъекции (например, раствора) или в виде водной или неводной суспензии. Доза фармацевтической композиции содержит, по меньшей мере, терапевтически эффективное количество средства ингибирования ПАРП (т.е. соединения формулы (I), (II) или (III) или его фармацевтически приемлемой соли,пролекарства, активного метаболита или сольвата) и предпочтительно содержит одну или несколько единиц фармацевтической дозы. Выбранная доза может вводиться млекопитающему, например человеку, нуждающемуся в лечении заболевания, ослабляемого ингибированием активности ПАРП, любым подходящим известным способом введения дозы, включая наружное, например в виде мази или крема; пероральное; ректальное, например в виде свечи; парен 004989 22 теральное путем инъекции или непрерывной инфузией вагинально, через нос, бронхиально,через ухо или через глаз."Терапевтически эффективное количество" означает количество средства, которое при введении нуждающемуся в нем млекопитающему достаточно для проведения лечения травмы или заболевания, ослабляемого ингибированием активности ПАРП, например, для потенцирования противораковой терапии и ингибирования нейротоксичности после удара, травмы головы и нейродегенеративных заболеваний. Количество данного предлагаемого соединения, которое будет терапевтически эффективным, зависит от таких факторов, как конкретное соединение,заболевание и его тяжесть, особенности нуждающегося в нем млекопитающего, при этом такие количества определяются специалистами по стандартной методике. Очевидно, что фактические дозировки средств ингибирования ПАРП, применяемые в предлагаемых фармацевтических композициях,будут выбираться в соответствии с конкретно применяемым комплексом, в зависимости от состава композиции, способа введения и конкретного места, а также от пациента и заболевания. Оптимальные дозировки для данного комплекса условий могут определяться специалистами с помощью обычных проб для определения дозировки. Например, для перорального введения применяемая доза может составлять от примерно 0,001 до примерно 1000 мг на 1 кг веса тела, при этом курсы лечения повторяются с необходимой периодичностью. Способы синтеза. Изобретение также относится к способам синтеза средств ингибирования ПАРП с применением таких процессов, которые приведены для выбранных в качестве примера предлагаемых соединений. В приведенных ниже примерах структуры соединений подтверждены одной из следующих методик: cпектроскопия протонного магнитного резонанса, ИК-спектроскопия,элементарный микроанализ,масс-спектрометрия, тонкослойная хроматография, жидкостная хроматография высокого разрешения и точка плавления. Спектры спектроскопии протонного магнитного резонанса (1 Н NMR) определяли с помощью спектрометра 300-МГц Tech-Mag, Bruker Avance 300DPX или Bruker Avance 500 DRX,работающего с полем 300 или 500 МГц. Химические сдвиги приведены в частях на миллион(ррm, ) вниз от внутреннего стандарта - тетраметилсилана. В качестве варианта спектры 1HNMR привязывали к сигналам остаточного протонного растворители следующим образом: СНСl3 = 7,26 ррm; ДМСО = 2,49 ррm; C6HD5 = 7,15 ррm. Кратности максимумов обозначены следующим образом: s = синглет; d = дуплет; dd 23 Константы связи приведены в герцах (Гц). Спектры ИК-поглощения (IR) получены с помощью спектрометра Perkin-Elmer серии 1600 или спектрометра FTIR Midac Corporation. Элементарный микроанализ производился компанией Atlantic Microlab Inc. (Норкросс, штат Георгия) или компанией Galbraith Laboratories(Нэшвиль, штат Теннеси), при этом результаты по элементам получены с точностью 0,4% от теоретических величин. Хроматография с флешколонкой (флеш-хроматография) проводилась с применением силикагеля 60 (Merck, арт. 9385). Аналитическую тонкослойную хроматографию(TLC) проводили на листах с покрытием Silica 60 F254 (Merck, арт. 5719). Точки плавления (mр) определяли в приборе Меl.Tеmр, при этом они даны без поправок. Все реакции проводили в изолированных мембранами колбах при небольшом избыточном давлении аргона, если иначе не оговорено. Все покупные растворители были реактивного качества или лучше и использовались в состоянии поставки. Здесь используются следующие сокращения: Et2O (диэтиловый эфир); ДМФ (N,Nдиметилформамид); ДМСО (диметилсульфоксид); МеОН (метиловый спирт); EtOH (этиловый спирт); EtOAc (этилацетат); ТГФ (тетрагидрофуран); Ас (ацетил); Me (метил); Et (этил) иPh (фенил). Описанные ниже общие регламенты реакций можно использовать для приготовления предлагаемых соединений. Общая схема синтеза 1 На схеме 1 4-карбометоксииндол А формилируют или ацилируют при различных условиях Vilsmeier или Friedel-Crafts с получением В, где R23 = СНО или COR24. 4-Карбометоксииндол А служит субстратом для реакции 1,4 присоединения для получения промежуточного нитроэтила В, где R23 = CHR25CH2NO2. Проме 004989C, который затем каталитически восстанавливают до производной аминоалкила D. Промежуточный нитроэтил В в некоторых случаях превращают непосредственно в D восстановлением(когда R23 = CHR25CH2NO2). Соединение D самопроизвольно циклизируется в трициклические лактамы Е (n = 2) и ЕЕ. При помещении промежуточного продукта D в основные условия также получают трициклические лактамы Е и ЕЕ. Соединение Е может быть подвергнуто Nалкилированию с образованием N-алкилированного Е или галогенированию с получением F. Промежуточный продукт F можно преобразовать посредством катализируемой металлом реакции (обычно с палладием в качестве катализатора) в ряд различных замещенных трициклических лактамов Г, где R29 = арил, алкил, алкенил или алкинил. Г может далее модифицироваться у R22, R29 и R30. Ацилзамещенные соединения формулы J(например, соединение 42) могут быть получены реакцией с СО и соответствующим спиртом с катализатором Pd/C. Эфиры J далее можно превратить в другие ацильные производные гидролизом до свободной кислоты, с последующей активацией до -C(O)-Lv, где Lv - отщепляемая группа, стандартными методиками (например, March, Advanced Organic Chemistry:Reactions, Mechanisms, and Structure, 4th edition,August 1992, John WileySons, New York,ISBN 0471601802), и, например, конверсией до амидов или других ацильных производных реакциями, известными в технике. В качестве варианта эфиры J можно непосредственно конвертировать в амиды реакциями аминолиза, например, реакцией с первичными или вторичными аминами, например, диметиламином или пирролидином. Общая схема синтеза 2 25 Общая схема синтеза 3 На схеме 3 М, где Lv включает, например,I, Вr или трифталат, связывается с замещенным алкином Т с помощью палладиево-медных катализаторов (см., например, Sonogashira, К., Tohda, Y., Hagihara, N. Tetrahedron Lett. 1975, 50,4467-4470, которая вводится в качестве ссылки). Промежуточный продукт N можно циклизировать с палладиевым катализатором (см., например, Arcadi, A., Cacchu, S., Marinellito, F. Tetrahedron Lett. 1989, 30, 2581-2584, которая вводится в качестве ссылки) с получением Р, который далее модифицируют, как описано в схеме 1 для промежуточного продукта ВВ. Примеры Далее изобретение поясняется со ссылками на приведенные ниже конкретные примеры. При отсутствии других указаний все проценты и части даны по весу, а все температуры - градусах Цельсия. Пример А. 3,4-Дигидропирроло[4,3,2de]изохинолин-5-(1H)-он (1). Соединение 1 готовят, как указано ниже по методике, описанной Demerson et al., J. Med(9,85 г, 50,5 ммоль) и диметилацеталь диметилформамида (20,1 мл, 151 ммоль) в ДМФ (53 мл) нагревают при 130 С в течение 8 ч. Раствор концентрируют в глубоковакуумном ротационном испарителе с получением бензоатинамина в виде вязкого темно-красного маслянистого вещества, 12,2 г (выход 97%). 1 Н NMR (ДМСО-d6)2,83 (s, 6H), 3,85 (s,3 Н), 5,42 (d, 1H, J = 13,6 Гц), 6,41 (d, 1H, J = 13,6 Гц), 7,25 (t, 1H, J = 7,9 Гц), 7,76 (d, 1H, J = 7,9 Гц), 7,88 (d, 1H, J = 7,9 Гц). Раствор бензоатинамина (12,2 г, 48,4 ммоль) в толуоле (200 мл) обрабатывают 10% палладия на углероде (2,7 г), и смесь гидрогенизируют под давлением водорода 50 фн/кв.д изб. при комнатной температуре в течение 1,5 ч. Далее смесь фильтруют через пакет Celite, и третий пакет промывают EtOAc. Необработанный продукт очищают флеш-хроматографией (3:1 26 гексан:ЕtOАс) с получением метилиндол-4 карбоксилата в виде желтого твердого вещества,6,89 г (81%). Т.пл. 68-70 С; 1 Н NMR (ДМСО-d6)3,95 (s, 3H), 7,02 (s,1H), 7,25 (t, 1H, J = 7,6 Гц), 7,60 (s, 1H), 7,75 (d,1H, J = 7,6 Гц), 7,80 (d, 1H, J = 7,6 Гц), 11,54 (bs,1H).(eq при комнатной температуре (rt). Оранжевый раствор нагревают при 50 С в течение 1 ч. Реакционный раствор вливают в ледяной водный (aq.) NaOAc (1 г в 2 мл), водный раствор доводят до рН = 8 1 М NaOH и экстрагируют ЕtOАс (10 мл х 3). Органический раствор промывают водой и рассолом, высушивают(5,04 г, 61,4 ммоль), Н 2 О (25 мл) и МеОН (25 мл) перемешивают в течение 1 ч при 50 С. В это время смесь охлаждают до комнатной температуры и сгущают в вакууме для удаления МеОН. Добавляют 50 мл Н 2 О и отфильтровывают твердое вещество и промывают его дополнительным количеством Н 2 О. Чистое белое вещество сушат в вакууме при 40 С (2,57 г, 95%). 1(d) промежуточный продукт L - гидрохлорид метил 3-аминометилиндол-4-карбоксилат. В раствор оксима промежуточного продукта K (2,4 г, 11 ммоль) в 130 мл МеОН вводят осушенный газ НСl. Вводят 0,2 г 10% Pd/C в атмосфере аргона. С помощью трехходового крана систему откачивают под вакуумом. Вводят газообразный водород через баллон, и реакционную смесь энергично перемешивают в течение 4 ч. Далее баллон снимают и снова вводят аргон. Смесь фильтруют и сгущают с получением твердого вещества, приобретающего лиловый цвет. Твердое вещество промывают Et2O,защищая от воздуха и света, и помещают под вакуум при комнатной температуре. Лиловое твердое вещество (2,5 г, 96%) используют без дальнейшей очистки. 1 Н NMR (ДМСО-d6)3,89 (s, 3 Н), 4,31 (m,2 Н), 7,23 (t, 1H, J = 7,7 Гц), 7,68 (d, 1H, J = 2,6[4,3,2-de]изохинолин-5-(1H)-он. Раствор промежуточного продукта L (2,4 г,10,0 ммоль) в 24 мл абсолютного EtOH вводят в раствор NaOMe в метиловом спирте (0,45 г Na,24 мл безводного МеОН). После перемешивания при комнатной температуре в течение 1,5 ч смесь сгущают в вакууме с получением осадка. Во время перемешивания к осадку добавляют ледяную Н 2 О (75 мл), и твердое вещество отфильтровывают и промывают холодной H2 О (50 мл). После сушки в вакуумной печи при 40 С получают 1,51 г (87%) аналитически чистого соединения 1 в виде бежевого раствора. 1 Н NMR (ДМСО-d6)4,78 (s, 2H), 7,14 (t,1H, J = 7,7 Гц), 7,18 (s, 1H), 7,30 (d, 1H, J = 7,0 Гц), 7,44 (d, 1H, J = 8,1 Гц), 7,59 (s, 1H), 11,13 Взвесь соединения 1 (0,086 г, 0,5 ммоль) в 40 мл CH2Cl2 обрабатывают 90% пиридинум трибромида (0,267 г, 0,75 ммоль) при 0 С. Реакционную смесь перемешивают при 0 С в течение 30 мин. Раствор удаляют в вакууме и к остатку приливают ледяную воду. Полученную взвесь энергично перемешивают при 0 С в течение 30 мин, а затем фильтруют с получением 0,068 г (54%) коричневого твердого вещества,используемого на следующем этапе без дальнейшей очистки. ИК (KВr) 3172, 1655, 1606,1441, 1367, 1292, 755 см-1; 1 Н NMR (ДМСO-d6)4,61 (s, 2H), 7,17 (t,1H, J = 6,0 Гц), 7,32 (d, 1H, J = 6,0 Гц), 7,39 (d,1H, J = 6,0 Гц), 7,71 (s, 1H), 11,92 (s, 1H); LRMS К взвеси продукта 2 (0,1065 г, 0,424 ммоль) в 20 мл толуола/10 мл EtOH добавляют фенилбороновую кислоту (0,08 г, 0,636 ммоль),Na2CO3 (0,113 г, 1,06 ммоль), растворенные в минимальном количестве воды, LiCl (0,054 г,1,27 ммоль) и тетракис(трифенилфосфин)палла 004989 28 дий (0) (24,5 мг, 21,0 мкмоль). Реакционную смесь кипятят с обратным холодильником в течение 16 ч. Растворитель удаляют в вакууме, а остаток собирают в ЕtOАс и промывают насыщенным водным раствором NаНСО 3, Н 2 О и рассолом. Органический слой сушат над Na2SO4 и сгущают с получением желтого твердого вещества, которое очищают флеш-хроматографией с элюированием с градиентом 20% ЕtOАс в гексанах и получают 0,098 г смеси 3 в виде желтого твердого вещества. Т.пл. 215-218 С (dec); 1 К взвеси соединения 2 в 30 мл толуола/15 мл ЕtOН добавляют 4-формилбензолбороновую кислоту (0,457 г, 3,05 ммоль), Nа 2 СО 3 (0,538 г,5,08 ммоль), растворенные в минимальном количестве воды, LiCl (0,258 г, 6,09 ммоль) и тетракис(трифенилфосфин)палладий (0) (0,117 г,0,102 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 48 ч. Растворитель удаляют в вакууме, а остаток собирают вEtOAc и промывают насыщенным водным раствором NaHCO3, H2O и рассолом. Органический слой сушат над MgSO4 и сгущают с получением желтого твердого вещества, которое очищают флеш-хроматографией с элюированием с градиентом 60-80% ЕtOАс в СНСl3 и получают 0,370 г смеси 4 и 5. Ацеталь 5 превращают в альдегид 4 с помощью 5 мл МеОН/3 мл Н 2 О и каталитического количества концентрированной H2SO4. 4: ИК (KВr) 1694, 1653, 1601, 1261, 821,746 см-1; 1 Н NMR (ДМСО-d6)5,09 (s, 2H), 7,26 (t,1H, J = 6,0 Гц), 7,36 (d, 1H, J = 6,0 Гц), 7,50 (d,1H, J = 6,0 Гц), 7,85 (d, 2 Н, J = 9,0 Гц), 7,91 (s,1 Н), 8,02 (d, 2 Н, J = 9,0 Гц), 10,01 (s, 1H), 11,86 К раствору 2 М (CH3)2NH в МеОН (0,81 мл,1,61 ммоль) добавляют 5N НС 1 МеОН (0,11 мл,0,536 ммоль), затем взвесь альдегида 4 (0,074 г,0,268 ммоль) в 3 мл МеОН и NaBH3CN (0,017 г,0,268 ммоль). Полученную суспензию перемешивают в течение 72 ч при комнатной температуре. Приливают концентрированную НСl до рН менее 2 и удаляют МеОН в вакууме. Остаток собирают в Н 2 О и экстрагируют EtOAc. Водный раствор доводят примерно до рН 9 твердымKОН и экстрагируют EtOAc. Органический слой высушивают над MgSO4 и сгущают с получением твердого желтого вещества, которое очищают флеш-хроматографией с силикагелем с элюированием с градиентом 3% МеОН в СНСl3 до 10% МеОН/NН 3 в СНСl3, получая 0,023 г оранжевого твердого вещества.(0,267 г, 6,67 ммоль) добавляют к раствору соединения 1 (0,50 г, 2,9 ммоль) в 7 мл ДМФ при 0 С. Реакционную смесь перемешивают при 0 С в течение 30 мин, а затем добавляют иодметан(0,18 мл, 2,9 ммоль) при 0 С. Реакционную смесь оставляют согреваться при комнатной температуре и перемешивают в течение 1,5 ч. Растворитель удаляют в вакууме, а остаток собирают в ЕtOАс и промывают Н 2 О и рассолом. Органический слой высушивают над MgSO4 и сгущают с получением коричневого твердого вещества, которое очищают флеш-хроматографией с силикагелем с элюированием с градиентом 0-1% МеОН в СНСl3, получая 0,270 г (50%) вещества 7 и 0,104 г (18%) вещества 7 а, оба - в виде твердого вещества желтого цвета. 7: ИК (KВr) 3205, 1658, 1610, 1475, 1302,1280, 817 см-1; 1 Соединение 9 получают из бромида 8 по методике, аналогичной описанной выше для получения соединения 4. ИК (KВr) 1699, 1662, 1601, 1466, 1292,1226 см-1; Сначала получают соединение М, как описано ниже. Раствор метил индол-4-карбоксилата(3,28 г, 18,7 ммоль) и нитроэтилацетата (2,99 г,22,5 ммоль) в ксилоле (23 мл) обрабатывают 4-tбутилкатехолом (22 мг) и нагревают с обратным холодильником в течение 3,5 ч. Раствор оставляют для остывания до комнатной температуры и удаляют растворитель при пониженном давлении. Остаток очищают флеш-хроматографиейHRMS (М+Н) расчет для C12H12N2O4+H: 249,0875, найдено: 249,0870. Промежуточный продукт М (1,12 г, 4,53 ммоль) растворяют в МеОН (70 мл) при слабом нагревании. Приливают водную 2 М НСl (70 мл). Добавляют по частям при энергичном перемешивании 7,0 г цинковой пыли, а затем полученную смесь нагревают с обратным холодильником в течение 30 мин. Горячую реакционную смесь фильтруют, фильтрат обрабатывают водным 2 М NaOH (85 мл), а полученную смесь фильтруют через воронку Бюхнера с фильтровальной бумагой. Фильтровальный осадок промывают МеОН. МеОН удаляют при пониженном давлении, и водную смесь экстрагируют ЕtOАс (2 х 100 мл). Органический раствор промывают водой и рассолом, высушивают над(Na2SO4), фильтруют и сгущают. Необработанный продукт кристаллизуют СН 2 Сl2/МеОН с получением трицикла в виде желтого твердого вещества, 611 мг (73%). Т.пл. 234-236 С; 1CH2Cl2 (30 мл) и ТГФ (30 мл) обрабатывают пиридиниум трибромидом (0,534 г, 1,67 ммоль) при 0 С. Оранжевый раствор перемешивают 10 мин, а затем оставляют согреваться до окружающей температуры и перемешивают еще в течение одного часа. Приливают воду (30 мл), а затем удаляют органический растворитель в вакууме. Водный раствор доводят до рН = 8-9 1 М NaOH и экстрагируют CH2Cl2 (3 х 30 мл). Органический раствор промывают водой и рассолом, сушат (Na2SO4), фильтруют и сгущают. Необработанный продукт перекристаллизуют(СН 2 Сl2/МеОН) и получают трициклический бромид в виде желтого твердого вещества, 305 мг (81%). Т.пл. 204-206 С (dec); 1 Трициклический бромид 11 (0,2 г, 0,75 ммоль) в толуоле (20 мл) и ЕtOН (10 мл) обрабатывают твердым Na2CO3 (0,199 г, 1,88 ммоль),LiCl (0,095 г, 2,25 ммоль), фенилбороновой кислотой (0,138 г, 1,13 ммоль), и водой (0,50 мл). Раствор дегазируют и добавляют тетракис (трифенилфосфин) палладий(0) (43 мг, 5 мол.%). Раствор нагревают с обратным холодильником в течение 5 ч, а затем остужают до комнатной температуры и разбавляют водой (20 мл). Водный слой доводят до рН = 7-8 насыщенным водным раствором K2 СО 3 и экстрагируютEtOAc (20 мл х 3). Органический раствор промывают водой и рассолом, высушивают(Na2SO4), фильтруют и сгущают. Необработанный продукт перекристаллизуют (СН 2 Сl2/ МеОН/гексаны) с получением трициклического 2-фенила в виде бледно-желтого твердого вещества, 183 мг (93%). Т.пл. 249-255 С (dec); 1(0,25 мл). Раствор дегазируют и добавляют тетракис(трифенилфосфин)палладий (0) (10 мг, 5 мол.%). Раствор нагревают с обратным холодильником в течение 13 ч, а затем остужают до окружающей температуры и разбавляют водой(10 мл). Водный слой доводят до рН = 7-8 насыщенным водным раствором K2 СО 3 и экстрагируют ЕtOАс (10 мл х 3). Органический раствор далее промывают водой и рассолом, высушивают (Na2SO4), фильтруют и сгущают. Необработанный продукт перекристаллизуют(МеОН/ТГФ), получая трициклический 2-(рметоксифенил) в виде белого твердого вещества, 47,4 мг (89%). Т.пл. 143-148 С (dec); Трициклический бромид 11 (27 мг, 0,10 ммоль) в 1,4-диоксане (1,0 мл) обрабатывают твердым K2 СО 3 (41 мг, 0,30 ммоль), mнитрофенилбороновой кислотой (34 мг, 0,20 ммоль) и водой (0,25 мл). Раствор дегазируют и добавляют тетракис(трифенилфосфин)палладий(0) (12 мг, 10 мол.%). Раствор нагревают при 100 С в течение 1 ч, а затем охлаждают до окружающей температуры и разбавляют водой (2 мл). Водный слой доводят до рН = 7-8 насыщенным водным раствором K2 СО 3 и экстрагируют EtOAc (5 мл х 3). Органический раствор промывают водой и рассолом, высушивают(Na2SO4), фильтруют и сгущают. Необработанный продукт очищают флеш-хроматографией(3-5% МеОН в СНСl3) с получением продукта 14 в виде желтого твердого вещества, 26,3 мг По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (381 мг, 1,44 ммоль) и 3 формилбензолбороновую кислоту (345 мг, 2,16 ммоль), получая 2-(3-формилфенил)-3,4,5,6 тетрагидро-1 Н-азепино[5,4,3-сd]индол-6-он 15,346 мг (83%) в виде бежевого твердого вещества.(br t, 1H), 7,94 (s, 1H), 9,88 (s, 1H), 11,50 (br s,1H). Соединение 16 выделяют в виде побочного продукта восстановительного аминирования соединения 15 с диметиламином и цианборогидридом натрия,и перекристаллизуют Трициклический бромид 11 (58,6 мг, 0,22 ммоль) в ДМФ (1 мл) дегазируют и обрабатывают трибутил(фенилэтинил)оловом (95,2 мг,0,24 ммоль) и тетракис(трифенилфосфин)палладием (0) (13 мг, 2 мол.%). Вводят один кристалл 2,6-ди-t-бутил-4-метилфенола и нагревают раствор при 60 С в течение 10 ч. Ввиду присутствия исходного материала раствор нагревают при 100 С еще 2 ч. Реакционную смесь остужают до окружающей температуры и разбавляют водой (2 мл) и экстрагируют ЕtOАс (5 мл х 3). Органический раствор промывают водой и рассолом, высушивают (Na2SO4), фильтруют и сгущают. Необработанный продукт очищают радиальной хроматографией (2 мм SiO2; 3% МеОН в CH2Cl2) и получают соединение 17 в виде белого твердого вещества (34,8 мг, 55%). Т.пл. 255-256 С (dec); 1(DMPU) охлаждают в бане из воды со льдом и обрабатывают капельно суспензией NaH (0,45 ммоль) в ТГФ (0,5 мл). Желтую смесь оставляют для перемешивания при 0 С на 10 мин, а затем обрабатывают капельно раствором 1 М иодметана в ТГФ (0,22 мл, 0,22 ммоль). Далее смесь оставляют для согревания до окружающей температуры и перемешивают 30 мин. Реакцию прекращают при 0 С насыщенным водным раствором NH4Cl и экстрагируют ЕtOАс (5 мл х 3). Органический раствор промывают водой и рассолом, высушивают (Na2SO4), фильтруют и сгущают. Необработанный продукт очищают радиальной хроматографией (2 ммSiO2; 1-5% МеОН в CH2Cl2) с получением продукта 18 в виде белого твердого вещества, 44,9 мг (81%). Т.пл. 254-256 С (dec); 1 Н NMR (ДМСО-d6)2,88 (m, 2H), 3,40H2O) С, Н, N. Соединение 18 а 1,5-диметил-2-фенил 3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-6 он выделяют в качестве продукта малого выхода. Т.пл. 175-177 С; 1 Н NMR (ДМСО-d6)2,91 (m, 2 Н), 3,19 (s,3 Н), 3,65 (m, 2 Н), 3,75 (s, 3 Н), 7,34 (t, 2 Н, J = 7,8 Гц), 7,58 (m, 5 Н), 7,72 (d, 1H, J = 7,8 Гц), 7,79 (d,1H, J = 7,8 Гц); Анализ: (C19H18N2O0,5 H2O) С,Н, N. Пример Р. 1-N-метил-3,4,5,6-тетрагидро 1 Н-азепино[5,4,3-сd]индол-6-он (19). Раствор метилиндол-4-карбоксилата (402 мг, 2,30 ммоль ) в ДМФ (5 мл) охлаждают в бане из воды со льдом и обрабатывают NaH (100 мг, 2,5 ммоль, 60% в минеральном масле). Полученный желтый раствор перемешивают при 0 С в течение 30 мин, а затем добавляют по каплям раствор MeI (482 мг, 212 мкл, 3,4 ммоль) в ДМФ (3,5 мл). Раствор оставляют для согревания до окружающей температуры. Реакцию останавливают при 0 С насыщенным водным раствором NH4Cl и экстрагируют ЕtOАс (10 мл х 3). Далее органический раствор промывают водой и рассолом, высушивают (Na2SO4), фильтруют и сгущают с получением метил (N-метил) индол-4-карбоксилата в виде желтой маслянистой жидкости, 430 мг (99%). N-метилкарбоксииндол превращают в N-метил-[5,6,7]трициклоиндол по методике, аналогичной описанной для соединения (10), с получением 1-N 004989 36 метил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-сd] индол-6-она в виде глянцевитого белого твердого вещества, 256 мг (54%, после перекристаллизации (СН 2 Сl2/МеOН/гексаны. Т.пл. 194195 С; 1 По методике, аналогичной описанной выше для получения метил-3-(нитроэтил)индол-4 карбоксилата D, метилиндол-4-карбоксилат (85 мг, 0,49 ммоль) и нитростирол (80 мг, 0,54 ммоль) нагревают при 160 С в запаянной пробирке 12 ч. Продукт выделяют хроматографией на силикагеле в виде коричневого масла, 132 мг(83%). Промежуточный нитроалкан восстанавливают и циклизируют, как описано с получением(rас)-3-фенил-3,4,5,6-тетрагидро-1 Назепино[5,4,3-сd]индол-6-она в виде белого твердого вещества, 51,4 мг (48%, после хроматографии и перекристаллизации). Т.пл. 201203 С; 1 Н NMR (300 МГц, d6-ДМCO)3,73 (m,2 Н), 4,42 (m, 1 Н), 7,28 (br m, 8H), 7,64 (d, 1H, J = 7,9 Гц), 7,77 (d, 1H, J = 7,9 Гц), 11,32 (br s, 1H); По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (100 мг, 0,54 ммоль) и 4 фторбензолбороновую кислоту (79 мг, 0,57 ммоль) с получением 2-(4-фторфенол)-3,4,5,6 тетрагидро-1 Н-азепино[5,4,3-сd]индол-6-она,107 мг (99%) в виде бледно-желтого твердого вещества. 1 Н NMR (300 МГц, d6-ДМСО)3,04 (m,2 Н), 3,38 (m, 2 Н), 7.22 (арр t, 1 Н, J = 7,7 Гц), 7,39 Раствор соединения 12 (2-фенил-3,4,5,6 тетрагидро-1 Н-азепино[5,4,3-cd]индoл-6-oн) (22 мг, 0,08 ммоль) в СН 2 Сl2 (1 мл) и ТГФ (1 мл) обрабатывают пиридиниум трибромидом (29 мг,0,09 ммоль). Раствор перемешивают 3 ч при комнатной температуре, а затем разбавляют водой (2 мл) и доводят водный слой до рН = 910 1 М NaOH. Смесь экстрагируют CH2Cl2 (3x5 мл). Органический раствор промывают водой и рассолом, высушивают (Na2SO4), фильтруют и сгущают. Необработанный продукт очищают радиальной хроматографией (1 мм силикагеля; 1% МеОН в СНСl3) с получением 8-бромосоединения, 12,8 мг (47%) в виде бледно-желтого твердого вещества. 1 Н NMR (300 МГц, d6-ДМСО)3,06 (m,2 Н), 3,39 (m, 2 Н), 7,43 (арр t, 1H, J = 7,4 Гц), 7,55 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (168 мг, 0,63 ммоль) с 4 формилбензолбороновой кислотой (142 мг, 0,95 ммоль) с получением 2-(4-формилфенил)3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-сd]индол-6 она, 141 мг (77%) в виде желтого твердого вещества. Т.пл. 238-240 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)3,12 (m,2 Н), 3,42 (m, 2H), 7,28 (t, 1H, J = 7,6 Гц), 7,59 (d,1H, J = 7,6 Гц), 7,62 (d, 1H, J = 7,6 Гц), 7,88 (d of 38 в МеОН, 6,41 ммоль). Раствор охлаждают баней из воды со льдом и обрабатывают капельно цианборогидрида натрия (74 мг, 1,18 ммоль) и хлорида цинка (80 мг, 0,59 ммоль) в МеОН (10 мл). Полученный раствор доводят до рН = 6-7 раствором 2 М НСl в метиловом спирте. После перемешивания в течение 30 мин реакцию прекращают концентрированной НСl (0,2 мл) и удаляют метиловый спирт выпариванием. Остаток разбавляют водой (30 мл). Раствор доводят до рН = 10-11 KОН (s) и экстрагируют СН 2 Сl2(30 мл х 3). Органический раствор затем промывают водой и рассолом, высушивают (Nа 2SО 4) фильтруют и сгущают. Необработанный продукт кристаллизуют (СH2 Сl2/МеОН/гексаны) с получением 2-(4-(N,N-диметиламино)метилфенил)-3,4,5,6-тетрагидро-1H-азепино[5,4,3-cd] индол-6-она, 245 мг (72%) в виде кремового твердого вещества. Т.пл. 226-229 С (dec); 1 Альдегидное соединение 15 (346 мг, 1,19 ммоль) в МеОН (40 мл) обрабатывают диметиламином (раствор 2 М в МеОН, 7,16 ммоль). Раствор охлаждают в бане из воды со льдом и обрабатывают капельно раствором цианборогидрида натрия (82 мг, 1,31 ммоль) и хлорида цинка (89 мг, 0,66 ммоль) в МеОН (10 мл). Полученный раствор доводят до рН = 6-7 раствором 2 М НСl в метиловом спирте. После перемешивания в течение 30 мин реакцию прекращают концентрированной НСl (0,2 мл) и удаляют метиловый спирт выпариванием. Остаток разбавляют водой (30 мл). Раствор доводят до рН = 10-11 KОН (s) и экстрагируют СН 2 Сl2 (30 мл х 3). Органический раствор промывают водой и рассолом, высушивают (Nа 2SО 4) фильтруют и сгущают. Необработанный продукт кристаллизуют (СН 2 Сl2/МеОН/гексаны) с получением 2-(3-(N,N-диметиламино)метилфенил)3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индoл-6oнa, 332 мг (87%) в виде глянцевитых желтых кристаллов. Т.пл. 222-225 С; 1 Н NMR (300 МГц, d6-ДМСО)2,20 (s,6 Н), 3,06 (m, 2 Н), 3,40 (m, 2 Н), 3,50 (s, 2 Н), 7,21(0,08 мл, 0,380 ммоль), затем суспензию альдегида (0,055 г, 0,188 ммоль) в 3 мл МеОН и добавляют NaBH3CN (0,012 г, 0,188 ммоль). Полученную суспензию перемешивают 24 ч при комнатной температуре. Приливают концентрированную НСl до рН менее 2, а затем удаляют МеОН в вакууме. Остаток собирают в Н 2 О и экстрагируют EtOAc. Водный раствор доводят до примерно рН 9 твердым (s) KОН и экстрагируют ЕtOАс. Органический слой высушивают над MgSO4 и сгущают с получением желтого твердого вещества, которое очищают флешхроматографией с силикагелем, элюированием с градиентом СНСl3 до 10% MeOH/NH3 в СНСl3 с получением 0,024 г в виде желтого твердого вещества. 1 Н NMR (ДМСО-d6) 2,18 (s, 6H), 3,45 (s,2H), 5,03 (s, 2 Н), 7,20-7,30 (m, 2 Н), 7,35 (d, 1 Н, J Раствор промежуточного продукта J (3 формилкарбоксииндол (246 мг, 1,21 ммоль в МеОН (10 мл) и АсОН (0,1 мл) обрабатывают гидразингидратом (176 мг, 3,5 ммоль) и нагревают раствор с обратным холодильником в течение 30 мин. Раствор охлаждают в бане с водой и льдом и собирают осажденное твердое вещество фильтрацией с получением 1,5 дигидро[1,2]диазепино[4,5,6-сd]индол-6-она,168 мг (75%) в виде ярко-желтого твердого вещества. Т.пл. 335-336 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)7,11 (t, 1H,J = 7,8 Гц), 7,44 (m, 3 Н), 7,56 (d, 1H, J = 2,7 Гц),10,09 (s, 1H), 11,74 (br s, 1H); Анализ: Раствор метилиндол-4-карбоксилата (40 мг, 0,23 ммоль) в дихлорэтане (2 мл) обрабатывают бензоилхлоридом (0,69 ммоль) при комнатной температуре. Оранжевый раствор охлаждают баней из воды со льдом и обрабатывают хлоридом алюминия (0,69 ммоль). Темнооранжевый раствор нагревают до комнатной температуры более 1 ч, затем выливают в ледяной водной раствор 2 М НСl. Этот водный раствор доводят до рН = 9-10 KОН (s) и экстрагируют СН 2 Сl2 (10 мл х 3). Органический раствор промывают водой и рассолом, высушивают(Na2SO4), фильтруют и сгущают. Необработанный продукт очищают радиальной хроматографией (1 мм силикагеля; 3% МеОН в СНСl3) с получением 3-фенацилиндол-4-карбоксилата в виде масла, 63 мг (99%). Раствор 3 фенацилкарбоксииндола (60 мг, 0,25 ммоль) в МеОН (5 мл) и концентрированную НСl (0,1 мл) обрабатывают гидразингидратом (36 мг, 0,73 ммоль) и нагревают раствор с обратным холодильником в течение 3 ч. Реакцию прекращают водой со льдом и доводят водный слой до рН = 10-11 КОН (s) и экстрагируют CH2Cl2 (30 мл х 3). Далее органический раствор промывают водой и рассолом, высушивают (Nа 2SО 4) фильтруют и сгущают. Необработанный продукт кристаллизуют (СН 2 Сl2/гексаны) с получением 1,5 дигидро-3-фенил[1,2]диазепино[4,5,6-cd]индол 6-она, 33 мг (51%) в виде ярко-желтого твердого вещества. Т.пл. 177-179 С; 1 Н NMR (300 МГц, d6-ДМСО)7,22 (m,2H), 7,47 (m, 3 Н), 7,58 (m, 4 Н), 10,45 (s, 1 Н),11,92 (br s, 1H); Анализ: (C10H7N3O0,75 H2O) C,H, N. Пример Y. 1,5-Дигидро-3-фенэтил[1,2] диазепино[4,5,6-сd]индол-6-он (29). Раствор метил индол-4-карбоксилата (250 мг, 1,43 ммоль) в дихлорэтане (3 мл) обрабатывают 3-фенилпропионил хлоридом (361 мг, 2,14 ммоль) при комнатной температуре. Оранжевый раствор охлаждают до 0 С и обрабатывают хлоридом алюминия (572 мг, 4,29 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, а затем вливают в ледяной водный раствор 1 М НСl. Водный раствор доводят до рН = 8 1 М NaOH и экстрагируют СН 2 Сl2 (10 мл х 3). Органический раствор промывают водой и рассолом, высушивают(3 мл) и НС 1 (0,1 мл) обрабатывают гидразингидратом (47 мг, 0,93 ммоль) и нагревают раствор с обратным холодильником 8 ч. Раствор охлаждают в бане с водой и льдом и собирают осажденное твердое вещество фильтрацией с получением 1,5-дигидро-3-фенэтил[1,2]диазепино[4,5,6-сd]индол-6-она, 60,2 мг (71%). Необработанный продукт очищают радиальной хроматографией (2 мм SiO2, 5:1 гексаны:ЕtOАс) с получением желтого твердого вещества. Т.пл. 182-183,5 С; 1 Н NMR (300 МГц, d6-ДМСО)2,80 (m,2 Н), 2,84 (m, 2 Н), 7,22 (m, 2 Н), 7,31 (m, 4 Н), 7,54 По методике, аналогичной описанной для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 3-трифторметилфенилбороновую кислоту (322 мг, 1,70 ммоль) с получением 2-(3-трифторметилфенил)1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она,300 мг (80%) в виде бледно-желтого твердого вещества. Т.пл. 212,5-213,5 С; 1 Н NMR (300 МГц, dб-ДМСО)3,08 (m,2 Н), 3,40 (m, 2 Н), 7,27 (арр t, 1H, J = 7,8 Гц), 7,60 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 4 трифторметилфенилбороновую кислоту (322 мг,1,70 ммоль) с получением 2-(4-трифторметилфенил)-1,3,4,5-тетрагидроазепино[5,4,3cd]индол-6-она, 261 мг (70%) в виде кремового твердого вещества. Т.пл. 208-209 С; 1 Н NMR (300 МГц, d6-ДМСО)3,09 (m,2 Н), 3,40 (m, 2 Н), 7,27 (арр t, 1H, J = 7,8 Гц), 7,60 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и бензо[b]фуран-2-бороновую кислоту (202 мг, 1,24 ммоль) с получением 2-бензофуран-2-ил-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 262 мг(77%) в виде желтого твердого вещества. Т.пл. 207 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)3,23 (m,2H), 3,50 (m, 2 Н), 7,31 (m, 4 Н), 7,61 (dd, 1H, J = 8,1, 0,9 Гц), 7,70 (m, 3 Н), 8,14 (br t, 1H), 11,97 (br По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 3,5-бистрифторметилфенилбороновую кислоту (202 мг,1,24 ммоль) с получением 2-(3,5-бис-трифторметилфенил)-1,3,4,5-тетрагидроазепино[5,4,3cd]индол-6-она, 70 мг (16%) в виде бледножелтого твердого вещества. Т.пл. 230 С (dec); 1 По методике, аналогичной описанной выше для соединения 12, совмещают 2-иод-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-он (85 мг,0,28 ммоль; см. ниже пример NN) и 4 бромофенилбороновую кислоту (62 мг, 0,31 ммоль) с получением 2-(4-бромофенил)-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 19 мг(20%) в виде белого твердого вещества. Т.пл. 160 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)3,04 (m,2H), 3,39 (m, 2H), 7,23 (арр t, 1H, J = 7,5 Гц), 7,56 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 3-хлор-4 фторфенилбороновую кислоту (217 мг, 1,24 ммоль) с получением 2-(3-хлор,4-фторфенил)1,3,4,5-тетрагидроазепино[5,4,3-cd]индол-6-она,217 мг (61%) в виде светло-желтого твердого вещества. Т.пл. 234-235 С; 1 Н NMR (300 МГц, d6-ДМСО)3,04 (m,2 Н), 3,39 (m, 2 Н), 7,24 (арр t, 1H, J = 7,8 Гц), 7,57 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 4-третбутилфенилбороновую кислоту (302 мг, 1,70 ммоль) с получением 2-(4-трет-бутилфенил)1,3,4,5-тетрагидроазепино[5,4,3-cd]индол-6-она,150 мг (42%) в виде белого твердого вещества. Т.пл. 243-244 С; 1 Н NMR (300 МГц, d6-ДМСО)1,33 (s,9 Н), 3,05 (m, 2 Н), 3,38 (m, 2 Н), 7,20 (арр t, 1H, J(75 мг, 0,18 ммоль) при комнатной температуре. Раствор нагревают с обратным холодильником в течение 2 ч, а затем остужают до комнатной температуры и разбавляют водой. Смесь экстрагируют ЕtOАс (3x5 мл). Органический раствор промывают водой и раствором, сушат (Na2SO4),фильтруют и сгущают. Необработанный продукт кристаллизуют (СН 2 С 12/гексаны) с получением тиоамида 34,4 мг (68%) в виде желтого твердого вещества. Т.пл. 223-226 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)3,10 (m,2H), 3,50 (m, 2 Н), 7,23 (арр t, 1 Н, J = 7,8 Гц), 7,57 2-Фенилэтинил-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-6-он (соединение 17) (37 мг, 0,13 ммоль) и оксид платины (1,5 мг, 0,05 ммоль) суспендируют в 2 мл МеОН в атмосфере аргона. Колбу промывают газообразным водородом и перемешивают полученную смесь при 24 С при давлении 1 атм водорода в течение 20 ч. Отфильтровывают катализатор и сгущают полученный раствор, получая в остатке бледножелтое кристаллическое твердое вещество. Очисткой радиальной хроматографией (5% МеОН в СНСl3) с последующей перекристаллизацией (МеОН/СНСl3/гексаны) получают 2 фенэтил-1,3,4,5-тетрагидроазепино[5,4,3-cd]индол-6-он, 14 мг (37%) в виде светло-желтого твердого вещества. Т.пл. 207-208 С; 1 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (210 мг, 0,79 ммоль) и 2 хлорфенилбороновую кислоту (136 мг, 0,87 ммоль) с получением 2-(2-хлорфенил)-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 78 мг(33%) в виде глянцевитого белого твердого вещества. Т.пл. 275 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)2,76 (m,2 Н), 3,38 (m, 2 Н), 7,23 (арр t, 1H, J = 7,8 Гц), 7,56 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (200 мг, 0,75 ммоль) и 2,4 дифторфенилбороновую кислоту (131 мг, 0,83 ммоль) с получением 2-(2,4-дифторфенил)1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она,156 мг (69%) в виде светло-желтого твердого вещества. Т.пл. 196-197 С; 1 Н NMR (300 МГц, d6-ДМСО)2,84 (m,2 Н), 3,37 (m, 2 Н), 7,25 (арр t, 1 Н, J = 7,7 Гц), 7,27 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (200 мг, 0,75 ммоль) и 3 хлорфенилбороновую кислоту (130 мг, 0,83 ммоль) с получением 2-(3-хлорфенил)-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 151 мг(m, 1H), 7,58 (m, 4 Н), 7,70 (m, 2 Н), 7,64 (m, 1 Н), По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 1 нафталинбороновую кислоту (214 мг, 1,24 ммоль) с получением 2-нафталин-1-ил-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 70 мг(20%) в виде кремового твердого вещества. Т.пл. 305 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)2,70 (m,2 Н), 3,38 (m, 2 Н), 7,25 (арр t, 1H, J = 7,5 Гц), 7,61 Совмещают 2-иод-1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-он (85 мг, 0,28 ммоль,приготовленный, как описано ниже), тетракис(трифенилфосфин)палладий (19 мг, 0,02 ммоль) и триэтиламин (52 мг, 0,51 ммоль) в смеси толуола и метилового спирта (8:2 (об.), 2 мл). Барботируют окись углерода через смесь в течение 10 мин. Далее реакцию ведут с подогревом при 85 С в закупоренной пробирке в течение 16 ч. Выпаривают растворитель и очищают оранжевую жидкость радиальной хроматографией (хлороформ до 5% метилового спирта в хлороформе). Белое твердое вещество перекристаллизуют(хлороформ/метиловый спирт/ гексаны) с получением метилового эфира 6 оксо-3,4,5,6-тетрагидро-1H-азепино[5,4,3-сd]индол-2-карбоновой кислоты, 39 мг (100%) в виде кремового твердого вещества. Т.пл. 266-267 С; 1 Н NMR (300 МГц, d6-ДМСО)3,25 (m,2 Н), 3,43 (m, 2 Н), 3,89 (s, 3 Н), 7,38 (арр t, 1H, J = 7,8 Гц), 7,61 (dd, 1H, J = 8,1, 0,9 Гц), 7,74 (dd,1H, J = 7,5, 0,9 Гц), 8,17 (br t, 1H), 11,93 (br s,1H); MS (FAB, MH+) 245; Анализ: (C13H12N2O3) С, Н, N. Пример NN. Получение 2-иод-1,3,4,5 тетрагидроазепино[5,4,3-cd]индол-6-она (43). 1,3,4,5-тетрагидроазепино[5,4,3-сd]индол 6-он (620 мг, 3,35 ммоль) суспендируют в 80 мл ТГФ/СН 2 Сl2 (1:1), а затем охлаждают в ледяной бане. Добавляют бис(трифторацетокси) иод]бензол (1,73 г, 4,02 ммоль) и иод (850 мг,3,35 ммоль) и перемешивают реакционную смесь при 0 С в течение 25 мин. Снимают с ледяной бани и перемешивают реакционную смесь еще 30 мин, согревая до комнатной температуры. Реакцию прекращают введением водного бисульфита натрия. Разделяют слои и высушивают органический слой над MgSO4,фильтруют и сгущают в вакууме, получая в остатке желтое твердое вещество. Необработанное твердое вещество очищают флеш-хроматографией (5% МеОН/СНСl3) с получением 1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она,308 мг (30%) в виде светло-желтого твердого вещества; 1 Н NMR (300 МГц, d6-ДМСО)2,79 (m,2 Н), 3,40 (m, 2 Н), 7,14 (арр t, 1H, J = 7,8 Гц), 7,46(dd, 1H, J = 7,8, 0,6 Гц), 7,64 (dd, 1H, J = 7,5, 0,9 Гц), 8,06 (br t, 1H), 11,80 (br s, 1H); MS (FAB,MH+)313. Приготавливают также следующие соединения с использованием методик, описанных в приведенных ниже примерах. р-Альдегид (150 мг, 0,52 ммоль), приготовленный, как описано для соединения 21, обрабатывают в МеОН (20 мл), как описано, метиламином (раствор 8,03 М в ЕtOН, 3,10 ммоль) и раствором цианборогидрида натрия (0,57 ммоль) и хлорида цинка (0,28 ммоль) в МеОН (2 мл) с получением после перекристаллизации 48 пино[5,4,3-сd]индол-6-она, 108 мг (68%) в виде желтого твердого вещества. Т.пл. 208-210 С; 1 Н NMR (300 МГц, d6-ДМСО)2,34 (s,3 Н), 3,05 (m, 2 Н), 3,39 (m, 2 Н), 3,77 (s, 2 Н), 7,20 По методике, аналогичной описанной выше для соединения 22, альдегид 15 (200 мг, 0,69 ммоль) в МеОН (20 мл) обрабатывают метиламином (раствор 2,0 М в ТГФ, 4,20 ммоль) и раствором цианборогидрида натрия (0,76 ммоль) и хлорида цинка (0,38 ммоль) в МеОН (1,4 мл) с получением после перекристаллизации По методике, аналогичной описанной выше для соединения 28, обрабатывают раствор метилиндол-4-карбоксилата (427 мг, 2,44 ммоль) в дихлорэтане (7 мл) ацетилхлоридом(0,5 мл) и хлоридом алюминия (130 мг). Промежуточный кетон (198 мг, 0,92 ммоль) в МеОН (5 мл) и концентрированную НCl (0,05 мл) обрабатывают, как описано, гидразингидратом (0,1 мл). Осажденный продукт собирают фильтрацией и промывают ледяным МеОН с получением 1,5-дигидро-3-метил[1,2]диазепино[4,5,6-сd]индол-6-она, 168 мг (92%) в виде ярко-желтого твердого вещества. Т.пл. 335-336 С; 1 Н NMR (300 МГц, d6-ДМСО)2,17 (s,3 Н), 7,19 (t, J = 7,8 Гц, 1H), 7,54 (m, 2H), 7,67 (d,J = 2,8 Гц, 1H), 10,12 (s, 1H), 11,90 (brs, 1H). По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (428 мг, 1,61 ммоль) и моногидрат 3-аминобензолбороновой кислоты (300 мг, 1,94 ммоль) с получением 2-(3-аминофенил)-3,4,5,6 тетрагидро-1 Н-азепино[5,4,3-сd]индол-6-она,110 мг (25%) в виде кремового твердого вещества; По методике, аналогичной описанной выше для соединения 22, обрабатывают альдегид 15 (109 мг, 0,38 ммоль) в МеОН (10 мл) пиперидином (0,19 мл, 1,9 ммоль) и раствором цианборогидрида натрия (0,57 ммоль) и хлорида цинка(0,28 ммоль) в МеОН (1,1 мл) с получением после рекристаллизации (СН 2 Сl2/гексаны)2-(3-(3 пиперидин-1-илметилфенил)-3,4,5,6-тетрагидро 1 Н-азепино[5,4,3-сd]индол-6-она, 94,1 мг (69%) в виде светло-желтого порошка. Т.пл. 235-237 С; 1 Н NMR (300 МГц, d6-ДМСО)1,41 (m,2 Н), 1,52 (m, 4 Н), 2,37 (т, 4 Н), 3,06 (m, 2 Н), 3,39 50 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 3 ацетамидфенилбороновую кислоту (304 мг, 1,70 ммоль) с получением N-[3-(6-оксо-3,4,5,6 тетрагидро-1 Н-азепино[5,4,3-сd]индол-2-ил) фенил]ацетамида, 10 мг (3%) в виде прозрачного твердого вещества. Т.пл. 300,5-302,0 С; 1 Н NMR (300 МГц, d6-ДМСО)2,09 (s,3 Н), 3,05 (m, 2H), 3,36 (m, 2H), 7,21 (арр t, J = 7,8 Гц, 1H), 7,33 (d, J = 7,5 Гц, 1 Н), 7,44 (t, J = 7,8 Гц, 1H), 7,57 (m, 2H), 7,68 (d, J = 7,5 Гц, 1 Н),7,92 (brs, 1 Н), 8,08 (br t, 1H), 10,10 (br s, 1H),11,56 (brs, 1H). MS (FAB, MH+) 320. Анализ: По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (200 мг, 0,75 ммоль) и 3-(4 фторфенокси)фенилбороновую кислоту (213 мг,0,83 ммоль) с получением 2-[3-(4-фторфенокси)фенил]-1,3,4,5-тетрагидроазепино[5,4,3cd]индол-6-она, 170 мг (60%) в виде желтого кристаллического твердого вещества. Т.пл. 240241 С; 1 Н NMR (300 МГц, d6-ДМСО)3,01 (m,2 Н), 3,38 (m, 2 Н), 6,99 (m, 2 Н), 7,21 (m, 6 Н), 7,42 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (150 мг, 0,57 ммоль) и 2-бифенил 4-бороновую кислоту (123 мг, 0,62 ммоль) с получением 2-бифенил-4-ил-1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она, 87 мг (45%) в виде бледно-желтого твердого вещества. Т.пл. 277-279 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)3,11 (m,2 Н), 3,41 (m, 2 Н), 7,23 (арр 1, J=7,8 Гц, 1 Н), 7,40 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (100 мг, 0,38 ммоль) и 4-хлор-3 трифторметилфенилбороновую кислоту (150 мг,0,45 ммоль) с получением 2-(4-хлоро-3-трифторметилфенил)-1,3,4,5-тетрагидроазепино По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль ) и 2 нафталинбороновую кислоту (214 мг, 1,24 ммоль ) с получением 2-нафталин-2-ил-1,3,4,5 тетрагидро азепино[5,4,3-сd]индол-6-она, 130 мг(256 мг, 1,00 ммоль), пинаколовый эфир двузамещенной борной кислоты (279 мг, 1,10 ммоль),1,1'-бис(дифенилфосфин)ферроцендихлорпалладий (24 мг, 0,03 ммоль) и ацетат калия (294 мг,3,00 ммоль) в пробирке Шленка. Сосуд откачивают, а затем трижды заполняют аргоном. Добавляют дегазированный ДМФ (6 мл) и перемешивают смесь при 80 С в атмосфере аргона в 52 течение 2 ч. Далее добавляют 2-бром-3,4,5,6 тетрагидроазепино[5,4,3-сd]индол-6-он (239 мг,0,90 ммоль), вторую порцию 1,1'-бис(дифенилфосфин)ферроцендихлорпалладия (24 мг, 0,03 ммоль) и карбонат натрия (2,5 мл водного раствора 2,0 М, 5,00 ммоль) и перемешивают реакционную смесь в атмосфере аргона при 80 С еще 17 ч. Далее реакционную смесь наливают в 25 мл воды и экстрагируют 25% IPA/СНСl3 (3 х 20 мл). Совмещенные органические экстракты высушивают (MgSO4) и сгущают в вакууме,получая в остатке коричневое масло. Необработанный продукт пропускают через короткую кремнеземную пробку с 25% МеОН/ СНСl3, а затем очищают радиальной хроматографией,элюируя 20% МеОН/ СНСl3. При кристаллизации из МеОН/СНСl3/гексаны получают 2-[4-(2 диэтиламиноэтил)фенил]-3,4,5,6-тетрагидроазепино[5,4,3-сd]индол-6-он, 69 мг (19%) в виде белого твердого вещества. Т.пл. 224-224,5 С По методике, аналогичной описанной в примере YY, проводят реакцию 3-бромфенилэтилового спирта (201 мг, 1,00 ммоль), пинаколового эфира двузамещенной борной кислоты(239 мг, 0,90 ммоль), второй порции 1,1'-1,1'бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и карбоната натрия (2,5 мл водного раствора 2,0 М, 5,00 ммоль) с получением 2-[3-(2-гидроксиэтил)фенил]-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 135 мг(44%) в виде кремового твердого вещества. Т.пл. 187,5-188,5 С; 1 Н NMR (300 МГц, d6-ДМСО)2,82 (t, J = 6,9 Гц, 2 Н), 3,12 (m, 2H), 3,39 (m, 2H), 3,69 (Abq,J = 7,2, 5,1 Гц, 2 Н), 4,71 (t, J = 5,1 Гц, 1 Н), 7,21 По методике, аналогичной описанной в примере YY, проводят реакцию метилового эфира 3-(2-бромфенил)пропионовой кислоты(243 мг, 1,00 ммоль), пинаколового эфира двузамещенной борной кислоты (279 мг, 1,10 ммоль),1,1'-бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и ацетата калия (294 мг, 3,00 ммоль), 2-бром-3,4,5,6 тетрагидроазепино[5,4,3-cd]индол-6-она (239 мг,0,90 ммоль), второй порции 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и карбоната натрия (2,5 мл водного раствора 2,0 М, 5,00 ммоль) с получением 3-[2(метилового эфира 3-[2-(6-оксо-3,4,5,6 тетрагидро-1 Н-азепино[5,4,3-cd]индол-2-ил) фенил]пропионовой кислоты, 92 мг (29%) в виде бежевого твердого вещества. Т.пл. 201201,5 С; 1 Н NMR (300 МГц, d6-ДМС 0)2,43 (t, J = 7,5 Гц, 2 Н), 2,68 (m, 2 Н), 2,86 (t, J = 8,1 Гц, 2 Н) 3,38 (m, 2 Н), 3,47 (s, 3 Н), 7,20 (t, J = 7,8 Гц, 1H),7,37 (m, 4 Н), 7,52 (dd, J = 7,8, 0,6 Гц, 1 Н), 7,70 По методике, аналогичной описанной в примере YY,проводят реакцию 3-(2 бромфенил)пропан-1-ола (215 мг, 1,00 ммоль),пинаколового эфира двузамещенной борной кислоты (279 мг, 1,10 ммоль), 1,1'бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и ацетата калия (294 мг,3,00 ммоль), 2-бром-3,4,5,6-тетрагидроазепино[5,4,3-сd]индол-6-она (239 мг, 0,90 ммоль), второй порции 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и карбоната натрия (2,5 мл водного раствора 2,0 М, 5,00 ммоль) с получением 2-[2-(3 гидроксипропил)фенил]-1,3,4,5-тетрагидроазепино[5,4,3-cd]индол-6-она, 127 мг (44%) в виде бежевого твердого вещества. Т.пл. 233,5234,5 С; По методике, аналогичной описанной выше для соединения YY, проводят реакцию 4 иодфенола (220 мг, 1,00 ммоль), пинаколового эфира двузамещенной борной кислоты (279 мг,1,10 ммоль),1,1'-бис(дифенилфосфино) ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и ацетата калия (294 мг, 3,00 ммоль), 2-бром 3,4,5,6-тетрагидроазепино[5,4,3-сd]индол-6-она(239 мг, 0,90 ммоль), второй порции 1,1'бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и карбоната натрия (2,5 мл водного раствора 2,0 М, 5,00 ммоль) с получением 2-(4-гидроксифенил)-1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она, 39 мг (15%) в виде бежевого твердого вещества. Т.пл. 300 С(220 мг, 1,00 ммоль), пинаколового эфира двузамещенной борной кислоты (279 мг, 1,10 ммоль),1,1-бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и ацетата калия (294 мг, 3,00 ммоль), 2-бром-3,4,5,6 тетрагидроазепино[5,4,3-сd]индол-6-она (239 мг,0,90 ммоль), второй порции 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладия (24 мг, 0,03 ммоль) и карбоната натрия (2,5 мл водного раствора 2,0 М, 5,00 ммоль) с получением 2-(2 гидроксифенил)-1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она, 40 мг (15%) в виде белого твердого вещества. Т.пл. 305 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)2,86 (m,2 Н), 3,46 (m, 2 Н), 6,92 (t, J = 7,5 Гц, 1H), 7,00 (d,J = 7,8 Гц, 1 Н), 7,16 (t, J = 7,8 Гц, 1 Н), 7,24 (m,1 Н), 7,34 (dd, J = 7,5, 1,2 Гц, 1 Н), 7,55 (d, J = 7,8 Гц, 1 Н), 7,66 (d, J = 7,5 Гц, 1 Н), 8,00 (br t, 1H),9,84 (br s, 1H), 11,20 (br s, 1H). MS (FAB, MH+): 279. Анализ: (Сl7 Н 14N2 О 20,44 СНСl3) С, Н, N. Пример ЕЕЕ. 6-Оксо-3,4,5,6-тетрагидро 1H-азепино[5,4,3-сd]индол-2-карбонитрил. По методике из JOC 1998, р. 8224, совмещают 2-иод-1,3,4,5-тетрагидроaзeпинo[5,4,3cd]индoл-6-oн (100 мг, 0,32 ммоль), цианистый натрий (31 мг, 0,64 ммоль), тетракис(трифенилфосфин)палладий (19 мг, 0,05 ммоль) и иодид меди (I) в пробирке Шленка. Сосуд откачивают и трижды заполняют аргоном. Добавляют дегазированный пропионитрил (2 мл) и перемешивают реакционную смесь при 80 С в атмосфере аргона в течение 15 ч. Затем реакционную смесь делят между водой и 25%iPrOH/CHCl3. Слои разделяют и трижды экстрагируют водный слой 25% iPrOH/CHCl3. Совместные органические слои высушивают (MgSO4) и сгущают в вакууме. Желтое твердое вещество перекристаллизуют из СН 2 Сl2/МеОН/гексаны с получением 6-оксо-3,4,5,6-тетрагидро-1 Назепино[5,4,3-cd]индол-2-карбонитрила, 38 мг(342 мг, 3,38 ммоль) и тетракис(трифенилфосфин)палладия (61 мг, 0,05 ммоль) в 20 мл смеси 1:1 n-октанола:ДМФ в закупоренной пробирке в атмосфере окиси углерода с получением октилового эфира 6-оксо-3,4,5,6-тетрагидро-1 Н 004989 56 азепино[5,4,3-cd]индoл-2-кapбoнoвoй кислоты,250 мг (58%) в виде белого твердого вещества. Т.пл. 170-171 С; 1 Н NMR (300 МГц, d6-ДМСО)0,85 (t, J = 7,2 Гц, 3 Н), 1,27 (m, 8 Н), 1,42 (m, 2 Н), 1,73 (m,2 Н), 3,25 (m, 2 Н), 3,42 (m, 2 Н), 4,30 (t, J = 6,6 Гц,3 Н), 7,38 (арр t, J = 7,5 Гц, 1 Н), 7,62 (dd, J = 8,1,0,9 Гц, 1H), 7,74 (dd, J = 7,5, 0,9 Гц, 1 Н), 8,17 (br По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 4 хлорфенилбороновую кислоту (195 мг, 1,24 ммоль) с получением 2-(4-хлорфенил)-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 223 мг(66%) в виде кремового твердого вещества. Т.пл. 250-252 С; 1 Н NMR (300 МГц, d6-ДМСО)3,04 (m,2 Н), 3,39 (m, 2 Н), 7,23 (арр t, J = 7,5 Гц, 1 Н), 7,58 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 3 пиридилбороновую кислоту (153 мг, 1,24 ммоль) с получением 2-пиридин-3-ил-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 75 мг 57 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 2 метоксифенилбороновую кислоту (189 мг, 1,24 ммоль) с получением 2-(2-метоксифенил)1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она,177 мг (53%) в виде коричневого твердого вещества. Т.пл. 254-255 С; 1 Н NMR (300 МГц, d6-ДМСО)2,81 (m,2 Н), 3,36 (m, 2 Н), 3,83 (s, 3 Н), 7,08 (арр t, J = 7,5 Гц, 1 Н), 7,17 (m, 2 Н), 7,43 (m, 2 Н), 7,54 (dd, J = 7,8, 0,6 Гц, 1 Н), 7,67 (dd, J = 7,5, 0,6 Гц, 1 Н), 8,03 По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (300 мг, 1,13 ммоль) и 4 пиридилбороновую кислоту (153 мг, 1,24 ммоль) с получением 2-пиридин-4-ил-1,3,4,5 тетрагидроазепино[5,4,3-сd]индол-6-она, 45 мг(15%) в виде бежевого твердого вещества. Т.пл. 250 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)3,13 (m,2H), 3,41 (m, 2H), 7,29 (арр t, J = 7,8 Гц, 1 Н), 7,63 При получении пиперазинамида метиловый эфир 6-оксо-3,4,5,6-тeтpaгидpo-lHaзeпинo[5,4,3-cd]индoл-2-кapбoнoвoй кислоты(100 мг, 0,41 ммоль) растворяют в 1 мл пиперазина. Желтый раствор перемешивают в аргоновой атмосфере при 110 С в течение 18 ч. Реакционную смесь делят между насыщеннымNаНСО 3 и 25% iPrOH/CHCl3. Слои разделяют и водный слой однократно экстрагируют 25%iPrOH/CHCl3. Совмещенные органические слои высушивают (MgSO4) и сгущают в вакууме с получением примерно 3 мг желтого твердого вещества. После пребывания ночью при комнатной температуре из водного слоя кристаллизуется светло-желтое твердое вещество - 80 мг(78%). Соединение определяют как натриевую соль 6-оксо-3,4,5,6-тетрагидро-1 Н-азепино По методике, аналогичной описанной выше для соединения 12, совмещают трициклический бромид (530 мг, 2,00 ммоль) и 2 тиоанизолбороновую кислоту (370 мг, 2,20 ммоль) с получением 2-(2-метилсульфанилфенил)-1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она, 264 мг (43%) в виде кремового твердого вещества. Т.пл. 271-272 С; 1 Н NMR (300 МГц, d6-ДМСО)2,39 (s,3 Н), 2,73 (m, 2 Н), 3,37 (m, 2 Н), 7,23 (m, 2 Н), 7,37 По методике, аналогичной описанной для 2-[4-(2-диэтиламиноэтил)фенил]-3,4,5,6-тетрагидроазепино[5,4,3-сd]индол-6-онаYY), совмещают трициклический бромид (198 мг, 0,75 ммоль) и 1-[2-(4-бромфенил) этил]пирролидин с получением 2-[4-(2 пирролидин-1-илэтил)фенил]-1,3,4,5-тетрагидроазепино[5,4,3-сd]индол-6-она, 160 мг (59%) в виде бежевого твердого вещества. Т.пл. 228229 С (dec); 1 По методике, аналогичной описанной для 2-[4-(2-диэтиламиноэтил)фенил]-3,4,5,6-тетрагидроазепино[5,4,3-cd]индол-6-онаYY), совмещают трициклический бромид (300 мг, 1,13 ммоль) и N-(2-бром-4-фторфенил) ацетамид (276 мг, 1,19 ммоль) с получением N[4-фтор-2-(6-оксо-3,4,5,6-тетрагидро-1 Н-азепино[5,4,3-cd]индол-2-ил)фенил]ацетамида, 83 мг(22%) в виде бежевого твердого вещества. Т.пл. 260-261 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)1,97 (s,3 Н), 2,66 (m, 2 Н), 3,33 (m, 2 Н), 7,25 (m, 3 Н), 7,56 Метиловый эфир 6-оксо-3,4,5,6-тетрагидро-1H-азепино[5,4,3-сd]индол-2-карбоновой кислоты (50 мг, 0,20 ммоль) суспендируют в 1 мл 33% раствора метиламина в метиловом спирте. Взвесь перемешивают при комнатной температуре в течение 21 ч. Затем приливают еще 2 мл 33% метиламина в метиловом спирте и перемешивают полученный раствор еще в течение 8 ч при комнатной температуре, а затем 15 ч при 30 С. Реакционную смесь сгущают в вакууме, получая в остатке желтое твердое вещество,которое кристаллизуют из ДМФ/МеОН/СНСl3 с получением 6-оксо-3,4,5,6-тетрагидро-1 Назепино[5,4,3-сd]индол-2-карбоновой кислоты,36 мг (72%) в виде желтого твердого вещества. Т.пл. 321-322 С (dec); 1 2-Фтор-4-(6-оксо-3,4,5,6-тетрагидро-1 Назепино[5,4,3-cd]индол-2-ил)бензальдегид (72 мг, 0,23 ммоль), приготовленный по стандартной двухэтапной одностадийной методике Suzuki совмещением трициклического бромида и 4-бром-2-фторбензальдегида, как описано в примере YY, растворяют в 2 мл 2,0 М диметиламина в метиловом спирте. Оранжевый раствор перемешивают при комнатной температуре в течение 10 мин. Далее реакционную смесь охлаждают до 0 С и добавляют по каплям раствор,содержащий хлорид цинка (17 мг, 0,13 ммоль) и цианборогидрид натрия (16 мг, 0,26 ммоль) в 1 мл метилового спирта. Доводят рН примерно до 3 концентрированной НСl. Реакционную смесь перемешивают в течение 1 ч по мере того, как температура постепенно поднимается до комнатной температуры. Реакционную смесь делят между СНСl3 и водой. Доводят рН водного слоя примерно до 13 твердым KОН. Слои разделяют и экстрагируют водный слой 25% iPrOH/CHCl3. Совмещенные органические слои высушивают(MgSO4), а затем сгущают в вакууме. После радиальной хроматографии (разбавление 5% МеОН/СНCl3) и кристаллизации из СН 2 Сl2/ гексаны получают 2-(4-диметиламинометил-3 фторфенил)-1,3,4,5-тетрагидроазепино[5,4,3-сd] индол-6-он, 60 мг (76%) в виде желтого твердого вещества. Т.пл. 221,5-222,5 С; 1 Н NMR (300 МГц, d6-ДМСО)2,19 (s,6 Н), 3,08 (m, 2 Н), 3,39 (m, 2 Н), 3,50 (s, 2H), 7,23 По методике, аналогичной описанной для примера YY, совмещают трициклический бромид (1,00 г, 3,77 ммоль) и 1-(4-бром-2-фторбензил)пирролидин (1,07 г, 4,19 ммоль) с получением 2-(3-фтор-4-пирролидин-1-илметилфенил)-1,3,4,5-тетрагидроазепино[5,4,3-cd]индол-6-она, 150 мг (11%) в виде бежевого твердого вещества. Т.пл. 139-140 С (dec); 1 Н NMR (300 МГц, d6-ДМСО)1,71 (m,4 Н), 2,50 (m, 4 Н, скрыто растворителем), 3,07
МПК / Метки
МПК: C07D 471/06, A61K 31/4375, A61P 35/00, C07D 487/06, C07D 519/00
Метки: ингибиторы, полимераз, поли(adp-рибозо, трициклические
Код ссылки
<a href="https://eas.patents.su/30-4989-triciklicheskie-ingibitory-poliadp-ribozo-polimeraz.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические ингибиторы поли(adp-рибозо) полимераз</a>
Предыдущий патент: Азабициклоалканы как модуляторы рецептора хемокинов ccr5
Следующий патент: Способ обработки скважин
Случайный патент: Кристаллические формы пролекарства на основе амида гемцитабина, композиции на их основе и их применение












