Производные бензофурана, их получение и применение
Номер патента: 3781
Опубликовано: 28.08.2003
Авторы: Андерсен Ким, Педерсен Хенрик, Бегесе Клаус Петер, Руланд Томас, Дансер Роберт, Роттлендер Марио
Формула / Реферат
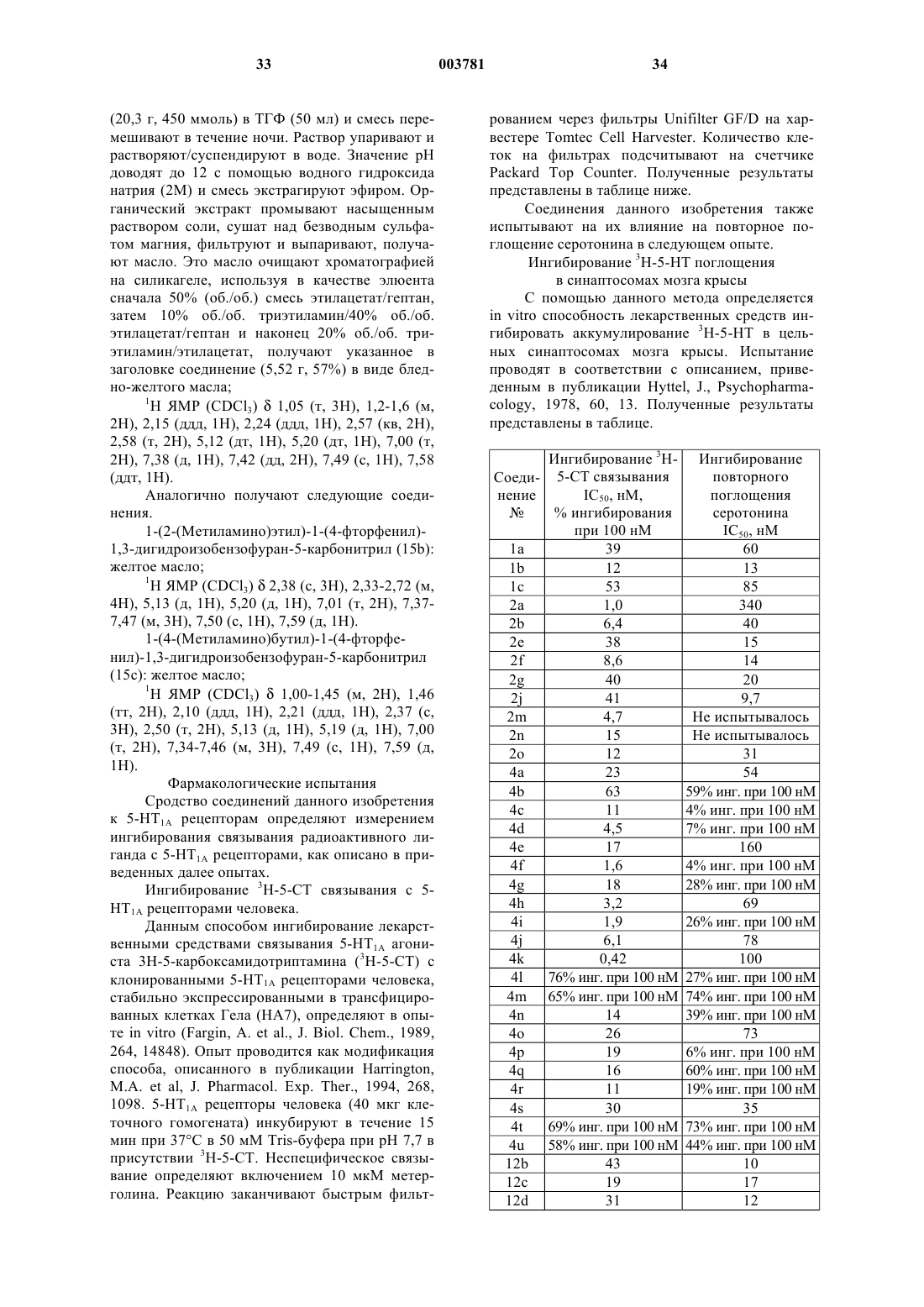
1. Изобензофуран общей формулы I

где R1 представляет собой водород, галоген, трифторметил, трифторметилсульфонилокси, C1-6-алкил, C2-6-алкенил, C2-6-алкинил, C3-8-циклоалкил, C1-6-алкокси, гидрокси, формил, ацил, амино, C1-6-алкиламино, C2-12-диалкиламино, ациламино, C1-6-алкоксикарбониламино, аминокарбониламино, C1-6-алкиламинокарбониламино, C2-12-диалкиламинокарбониламино, нитро, циано, COOH или COO-C1-6-алкил;
R2 и R3, каждый независимо, выбраны из водорода, трифторметила, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C3-8-циклоалкила и C1-6-алкоксигруппы;
n равно 1, 2, 3, 4 или 5;
m равно 0 или 1;
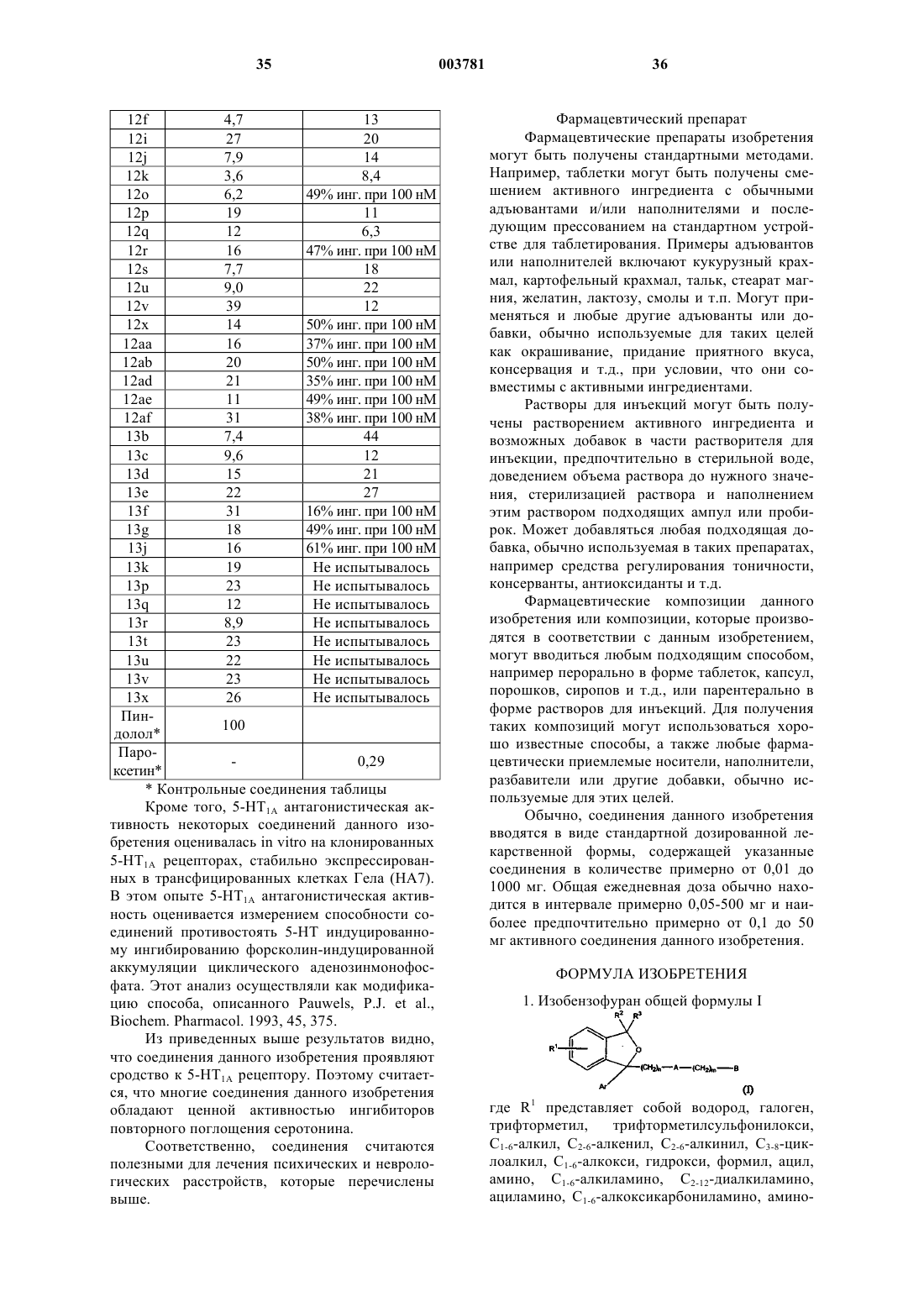
A выбран из следующих групп:
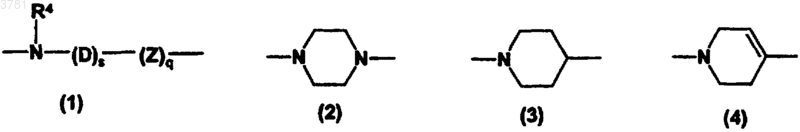
где Z представляет собой O или S;
s равно 0 или 1;
q равно 0 или 1;
R4 представляет собой водород, C1-6-алкил, C2-6-алкенил, C2-6-алкинил, C1-6-алкилaрил или C1-6-алкил-O-арил,
D представляет собой пространственную группу, выбранную из C1-6-алкилена, C2-6-алкенилена и C2-6-алкинилена с прямыми или разветвленными цепями;
B представляет собой группу, выбранную из группы формул (II), (III) и (IV)
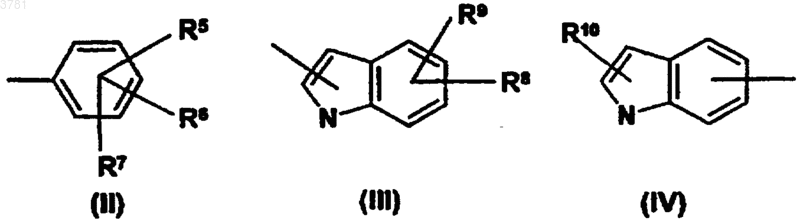
где R5, R6, R7, R8, R9 и R10, каждый независимо, выбраны из заместителей R1;
или R8 и R9 вместе образуют конденсированное 5- или 6-членное кольцо, необязательно содержащее дополнительные гетероатомы; и образующийся гетероцикл необязательно замещен заместителями, выбранными среди заместителей R1;
или две группы из R5, R6 и R7 соединены вместе с образованием -O-(CH2)p-O- мостика, где p равно 1 или 2;
Ar и арил независимо выбраны из группы, включающей фенил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, 2-пиримидил, 1-индолил, 2-индолил, 3-индолил, 1-индол-2-онил, 3-индол-2-онил, 2- или 3-бензофуранил, 2- или 3-бензотиофенил, 1-нафтил или 2-нафтил, каждый из которых необязательно замещен галогеном, C1-6-алкилом, C1-6-алкокси, C1-6-алкилтио, гидрокси, C1-6-алкилсульфонилом, циано, трифторметилом, трифторметилсульфонилокси, C3-8-циклоалкилом, C3-8-циклоалкил-C1-6-алкилом, нитро, амино, C1-6-алкиламино, C2-12-диалкиламино, ациламино или алкилендиокси;
его энантиомеры и фармацевтически приемлемая кислотно-аддитивная соль.
2. Соединение по п.1, отличающееся тем, что A представляет собой группу формулы (1).
3. Соединение по п.1, отличающееся тем, что A представляет собой группу формулы (2).
4. Соединение по п.1, отличающееся тем, что A представляет собой группу формулы (3).
5. Соединение по п.1, отличающееся тем, что A представляет собой группу формулы (4).
6. Соединение по п.2, отличающееся тем, что R4 представляет собой метил, этил, пропил, 2-пропен-1-ил, 2-фурилметил, 2-феноксиэтил.
7. Соединение по любому из пп.2-6, отличающееся тем, что q=0.
8. Соединение по любому из пп.2-6, отличающееся тем, что q=0 и Z представляет собой O.
9. Соединение по любому из пп.1-8, отличающееся тем, что B представляет собой группу формулы (II).
10. Соединение по любому из пп.1-8, отличающееся тем, что B представляет собой группу формулы (III).
11. Соединение по любому из пп.1-8, отличающееся тем, что B представляет собой группу формулы (IV).
12. Соединение по п.9, отличающееся тем, что, по меньшей мере, один из R5, R6 и R7 представляет собой метоксигруппу.
13. Соединение по п.9, отличающееся тем, что формула (II) представляет собой бензодиоксановую группу или 1,2-метилендиоксибензольную группу.
14. Соединение по п.10, отличающееся тем, что формула (III) представляет собой 3-индолил.
15. Соединение по п.14, отличающееся тем, что 3-индолил замещен в 5 положении метилом, фтором, хлором, бромом, йодом, трет-бутилом или изопропилом, или в 7 положении фтором, хлором или карбокси; или дизамещен 5,7-дифтором, 4-фтор-7-метилом или 4-хлор-7-метилом, или два заместителя вместе образуют пиридильное кольцо, конденсированное с 3-индолилом.
16. Соединение по п.11, отличающееся тем, что формула (IV) представляет собой 4-индолильную или 5-индолильную группу.
17. Соединение по любому из пп.1-16, отличающееся тем, что Ar представляет собой фенил или фенил, замещенный галогеном или CF3.
18. Соединение по п.17, отличающееся тем, что Ar представляет собой фенил, который может быть замещенным Cl или F в 4 положении или Cl или CF3 в 3 положении.
19. Соединение по любому из пп.1-18, отличающееся тем, что R1 представляет собой H, CN или F в 5 положении изобензофурановой группы.
20. Соединение по любому из пп.1-19, отличающееся тем, что R2 и R3 выбраны из водорода или метила.
21. Соединение по любому из пп.1-20, отличающееся тем, что n=2, 3 или 4.
22. Соединение по п.21, отличающееся тем, что n=3.
23. Соединение по пп.1-22, отличающееся тем, что m=0.
24. Соединение по любому из пп.1, 18, 19, 20, 21, 22 и 23, отличающееся тем, что R2 и R3 оба представляют собой водород; R1 представляет собой H, CN или F в 5 положении изобензофурановой группы и Ar представляет собой фенил, который может быть замещенным F или Cl в 4 положении, либо Cl или CF3 в 3 положении.
25. Соединение по любому из пп.1 и 24, отличающееся тем, что A представляет собой группу формулы (1); q=0; R4 представляет собой метил; D представляет собой пропилен; m=0 и B представляет собой 1,4-бензодиоксановую группу формулы (II), присоединенную в 5 положении.
26. Соединение по любому из пп.1 и 24, отличающееся тем, что А представляет собой группу формулы (1); R4 представляет собой CH3 или проп-2-ен-1-ил; n=3; D представляет собой этилен или пропилен и B представляет собой фенильную группу, в которой, по меньшей мере, одним заместителем является OMe.
27. Соединение по любому из пп.1 и 24, отличающееся тем, что A представляет собой группу формулы (1); q=0; R4 представляет собой метил, этил, пропил, 2-пропен-1-ил, 2-фурилметил или 2-феноксиэтил; D представляет собой этилен или пропилен; m=0 и B представляет собой индолильную группу формулы (III).
28. Соединение по п.27, отличающееся тем, что 3-индолильная группа замещена метилом, фтором, хлором, бромом, йодом, трет-бутилом или изопропилом в положении 5; или фтором, хлором или карбоксильной группой в 7 положении; или 5,7-дифтором, 4-фтор-7-метилом или 4-хлор-7-метилом; или два заместителя вместе образуют пиридильное кольцо, конденсированное с 3-индолильной группой.
29. Соединение по любому из пп.1 и 24, отличающееся тем, что A представляет собой группу формулы (2) и (3); n=3; m=0 и B представляет собой 4- или 5-индолильную группу формулы (IV), в которой R10 представляет собой водород; R1 представляет собой CN в 5 положении изобензофурана и Ar представляет собой 4-фторфенил.
30. Соединение по п.1, которое представляет собой
(-)-1-[3-[[4-(1,4-бензодиоксан-5-ил)бутил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(1,4-бензодиоксан-5-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрилоксалат,
1-[3-[[2-(1,4-бензодиоксан-5-ил)этил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрилоксалат,
1-[3-[[1,4-бензодиоксан-5-илметил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрилоксалат,
1-(4-фторфенил)-1-[3-[4-(2-метоксифенил)пиперазинил]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[метил[2-(2-метоксифенокси)этил]амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[метил[2-(3-метоксифенокси)этил]амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
(S)-1-[3-[[4-(1H-индол-3-ил)бутил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[4-(1H-индол-3-ил)бутил]метиламино]пропил]-1-фенил-1,3-дигидроизобензофуран,
(S)-1-[3-[[3-(1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(1H-индол-3-ил)пропил]метиламино]пропил]-1-фенил-1,3-дигидроизобензофуран,
5-[3-[[3-(1-фенил-1,3-дигидроизобензофуран-1-ил)пропил]метиламино]пропил]-1,4-бензодиоксан,
5-[3-[[3-[1-(3-хлорфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]-1,4-бензодиоксан,
5-[3-[[3-[1-(4-фторфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]-1,4-бензодиоксан,
5-[3-[[3-[1-(3-трифторметилфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]-1,4-бензодиоксан,
1-[3-[[3-(1,4-бензодиоксан-5-ил)пропил]метиламино]пропил]-1-(4-хлорфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[4-(1H-индол-4-ил)пиперазинил]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[4-(1H-индол-5-ил)пиперазинил]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[4-(1H-индол-3-ил)пиперидинил]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
5-[3-[[3-[5-фтор-1-(4-фторфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]-1,4-бензодиоксан,
1-[3-[[2-(1H-индолил-3-ил)этил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[2-(3-метоксифенил)этил]метиламино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[2-(3-метоксифенил)этил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[2-(2-метоксифенил)этил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(2,5-диметоксифенил)этил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(2,5-диметоксифенил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[2-феноксиэтил]метиламино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(1H-индолил-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[2-феноксиэтил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(2-метоксифенил)пропил]метиламино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(2-метоксифенил)пропил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(3-метоксифенил)пропил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(2-метоксифенокси)пропил]метиламино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(2-метоксифенокси)пропил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(3-метоксифенокси)пропил]метиламино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-(4-фторфенил)-1-[3-[[3-(3-метоксифенокси)пропил](проп-2-ен-1-ил)амино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[(2-бензилоксиэтил)метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[(2-бензилоксиэтил)(проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(1H-индолил-3-ил)пропил](проп-2-ен-1-ил)амино]пропил]1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(1H-индолил-3-ил)пропил](2-пропинил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(1H-индолил-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-метил-1H-индол-3-ил)этил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(7-фтор-1H-индол-3-ил)этил]метиламинo]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
5-фтор-1-[3-[[3-(5-метил-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран,
5-фтор-1-[3-[[3-(7-фтор-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран,
1-[3-[[3-(5-метил-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[3-(1H-индол-3-ил)пропил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил[2-(5-метил-1H-индол-3-ил)этил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(7-фтор-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-фтор-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[2-(5-фтор-1H-индол-3-ил)этил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[2-(7-фтор-1H-индол-3-ил)этил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-хлор-1H-индол-3-ил)этил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-хлор-1H-индол-3-ил)пропил]метиламино]пропил]-5-фтор-1-(4-фторфенил)-1,3-дигидроизобензофуран,
1-[3-[[4-(5-метил-1H-индол-3-ил)бутил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[3-(5-метил-1H-индол-3-ил)пропил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[3-(7-фтор-1H-индол-3-ил)пропил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[3-(5-фтор-1H-индол-3-ил)пропил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-хлор-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(7-хлор-1H-индол-3-ил)этил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-хлор-1H-индол-3-ил)этил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5,7-дифтор-1H-индол-3-ил)этил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[4-(5-фтор-1H-индол-3-ил)бутил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[4-(5-хлор-1H-индол-3-ил)бутил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-хлор-1H-индол-3-ил)пропил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5,7-дифтор-1H-индол-3-ил)пропил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-бром-1H-индол-3-ил)этил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-бром-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-бром-1H-индол-3-ил)этил]этиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[4-(5-бром-1H-индол-3-ил)бутил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-бром-1H-индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[2-(5-йод-1H-индол-3-ил)этил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[этил-[3-(5-йод-1H-индол-3-ил)пропил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[2-[[4-(5-хлор-1H-индол-3-ил)бутил]метиламино]этил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[2-[[4-(5-бром-1H-индол-3-ил)бутил]метиламино]этил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5,7-дифтор-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(7-хлор-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5-хлор-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5-бром-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5-метил-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5-йод-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5-трет-бутил-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[4-[[2-(5-изопропил-1H-индол-3-ил)этил]метиламино]бутил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-метил-1H-индол-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-фтор-1H-индол-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(7-фтор-1H-индол-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-фтор-1H-индол-3-ил)пропил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(7-фтор-1H-индол-3-ил)пропил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-хлор-1H-индол-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5,7-дифтор-1H-индол-3-ил)этил]пропиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-[5-(2-пропил)-1H-индол-3-ил]этил]-2-пропиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(4-фтор-7-метил-1H-индол-3-ил)пропил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(4-хлор-7-метил-1H-индол-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-хлор-1H-индол-3-ил)пропил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-пирроло[3,2-h]-1H-хинолин-3-ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(7-фтор-1H-индол-3-ил)пропил](2-фурилметил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[4-(7-карбокси-1H-индол-3-ил)бутил](проп-2-ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-[5-бром-1H-индол-3-ил]этил]пропиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(1H-индол-3-ил)пропил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-метил-1H-индол-3-ил)этил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-фтор-1H-индол-3-ил)этил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-пирроло[3,2-h]-1H-хинолин-3-ил)пропил]-2-фурилметиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-метил-1H-индол-3-ил)пропил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[3-(5-фтор-1H-индол-3-ил)пропил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5,7-дифтор-1H-индол-3-ил)этил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[4-(5-пирроло[3,2-h]-1H-хинолин-3-ил)бутил]-2-фурилметиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[2-феноксиэтил[2-[5-(2-пропил)-1H-индол-3-ил]этил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
1-[3-[[2-(5-бром-1H-индол-3-ил)этил](2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,
или его кислотно-аддитивная соль.
31. Фармацевтическая композиция, включающая соединение по пп.1-30 или его фармацевтически приемлемую кислотно-аддитивную соль и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель.
32. Применение соединения по пп.1-30 или его фармацевтически приемлемой кислотно-аддитивной соли для получения лекарственного средства для лечения расстройства или заболевания, чувствительного к действию 5-HT1A-рецепторов.
33. Применение соединения по п.32, где лекарственное средство предназначено для лечения депрессии, психоза, расстройств, связанных с состоянием страха, панического расстройства, обсессивно-компульсивного расстройства, расстройства импульсивного контроля, алкогольного злоупотребления, агрессии, ишемии, старческого слабоумия, сердечно-сосудистых расстройств и социальной фобии.
34. Способ лечения заболевания или расстройства живого организма животного, в том числе человека, которое чувствительно к действию 5-HT1A-рецепторов, включающий введение такому живому организму животного, в том числе человека, терапевтически эффективного количества соединения по пп.1-30 или его фармацевтически приемлемой кислотно-аддитивной соли.
35. Способ лечения по п.34, где расстройство или заболевание представляет собой депрессию, психоз, расстройства, связанные с состоянием страха, паническое расстройство, обсессивно-компульсивное расстройство, расстройство импульсивного контроля, алкогольное злоупотребление, агрессию, ишемию, старческое слабоумие, сердечно-сосудистые расстройства или социальную фобию.
Текст
1 Данное изобретение относится к новым производным бензофурана, обладающим сильной активностью в отношении связывания 5HT1A рецептора, фармацевтическим композициям, содержащим эти соединения, и их применению для лечения некоторых психических и неврологических расстройств. Многие из соединений данного изобретения являются также сильнейшими ингибиторами повторного поглощения серотонина и, как полагают, особенно полезны для лечения депрессии. Предпосылки изобретения Клинические исследования известных частичных агонистов 5-HT1A, таких как буспирон(gepirone), показало, что частичные агонисты SHT1A могут использоваться для лечения состояний страха, таких как генерализированное расстройство, связанное с состоянием страха, паническое расстройство и обсессивнокомпульсивное расстройство (Glitz, D.A., Pohl,R., Drugs, 1991, 41, 11). Предварительные клинические исследования показывают, что полные агонисты могут использоваться для лечения перечисленных выше расстройств, связанных с состоянием страха (Schipper, Human Psychopharm., 1991, 6, S53). Имеется также доказательство, как клиническое, так и доклиническое, подтверждающее преимущественное действие частичных агонистов 5-HT1A в лечении депрессии, а также расстройств импульсивного контроля и алкогольного злоупотребления (van Hest, Psychopharm.,1992, 107, 474; Schipper et al., Human Psychopharm., 1991, 6, S53; Cervo et al., Eur. J. Pharm.,1988, 158, 53; Glitz, D.A., Pohl, R., Drugs, 1991,41, 11; Golf et al., Int. Clin. Psychopharmacol.,1993, 8, 167-172; Ansseau et al., Human Psychopharmacol., 1993, 8, 279-283). Агонисты и частичные агонисты 5-HT1A ингибируют индуцированную изоляцией агрессию у самцов мыши, демонстрируя тем самым,что эти соединения полезны для лечения состояния агрессии (Sanchez et al., Psychopharmacology, 1993, 110, 53-59). Кроме того, агонисты 5-HT1A, как сообщалось, проявляют активность в опытах на животных, предикативную для антипсихотических эффектов (Wadenberg and Ahlenius, J. Neutral.Toxicol., 1989, 64, 3; Lowe et al., J. Med. Chem.,1991, 34, 1860; New et al., J. Med. Chem., 1989,32, 1147; Martin et al., J. Med. Chem., 1989, 32,1052), и, следовательно, могут быть использованы для лечения психических расстройств,таких как шизофрения. Проведенные ранние исследования показывают также, что 5-HT1A рецепторы важны в серотонергической модуляции галоперидол-индуцированной каталепсии 2 вызываемых традиционными антипсихотическими средствами, такими как, например, галоперидол. Агонисты 5-HT1A проявляют нейрозащитные свойства при испытании на грызунах в фокальной и общей церебральной ишемии и, следовательно, могут быть полезны для лечения состояний, связанных с ишемической болезнью(Prehn, Eur. J. Pharm., 1991, 203, 213). Были представлены фармакологические исследования, которые показали, что антагонисты 5-HT1A полезны в лечении старческого слабоумия (Bowen et al., Trends Neur. Sci., 1992, 15,84). Обзор 5-HT1A антагонистов и предполагаемые потенциальные терапевтические задачи для этих антагонистов на основе доклинических и клинических данных представлены в публикации Schechter at al., Serotonin, 1997, Vol. 2,Issue 7. В нем заявлено, что антагонисты 5-HT1A могут быть полезны для лечения шизофрении,слабоумия, связанного с болезнью Альцгеймера,и в сочетании с SSRI антидепрессантами полезны также для лечения депрессии. Испытания на животных моделях и клинические испытания показали, что агонисты 5HT1A усиливают антигипертензивное действие посредством центрального механизма (SaxenaGillis et al., J. Pharm. Exp. Ther., 1989, 248, 851). Следовательно, 5-HT1A лиганды могут быть преимущественными в лечении сердечнососудистых расстройств. Ингибиторы 5-НТ повторного поглощения являются хорошо известными антидепресантными лекарственными средствами и полезны для лечения панического состояния и социальной фобии. Действие комбинированного введения соединения, которое ингибирует повторное поглощение серотонина, и антагониста 5-HT1A рецептора было оценено в нескольких исследованиях (Innis R.B. et al., Eur. J. Pharmacol., 1987,143, р.195-204, Gartside S.E., Br. J. Pharmacol.,1995, 215, р.1064-1070, Blier, P. et al., TrendsPharmacol. Sci., 1994, 15, 220). В этих исследованиях было установлено, что антагонисты 5HT1A рецепторов должны восстанавливать начальное повреждение 5-НТ нейротрансмиссии,вызванное ингибиторами повторного поглощения серотонина, и, таким образом, давать немедленную реактивацию 5-НТ трансмиссии и более быстрое начало терапевтического действия. Подано несколько заявок на патенты, в которых патентуется комбинированное применение 5-HT1A антагониста и ингибитора повторного поглощения серотонина для лечения депрессии (см. ЕР-А 2-687472 и ЕР-А 2-714663). Таким образом, считается, что средства,действующие на 5-HT1A рецептор, и агонисты и антагонисты потенциально полезны для терапии 3 психиатрических и неврологических расстройств и поэтому являются весьма желательными. Поэтому антагонисты, обладающие при этом мощной ингибиторной активностью в отношении повторного поглощения серотонина,могут быть полезны для лечения депрессии. Краткое описание изобретения В настоящее время установлено, что некоторые соединения класса производных бензофурана с высокой степенью сродства связывают 5-HT1A рецептор. Кроме того, установлено, что многие из этих соединений обладают ингибирующей активностью в отношении повторного поглощения серотонина. Соответственно, данное изобретение относится к новым соединениям общей формулы Im равно 0 или 1; А выбран из следующих групп:D представляет собой пространственную группу, выбранную из C1-6-алкилена, С 2-6 алкенилена и С 2-6-алкинилена с прямыми или разветвленными цепями; В представляет собой группу, выбранную из группы формул (II), (III) и (IV) 4 или R8 и R9 вместе образуют конденсированное 5- или 6-членное кольцо, необязательно содержащее дополнительные гетероатомы; или две группы из R5, R6 и R7 соединены вместе с образованием -О-(СН 2)р-O-мостика, где р равно 1 или 2; Аr и aрил независимо выбраны из группы,включающей фенил, 2-тиенил, 3-тиенил, 2-фуранил, 3-фуранил, 2-пиримидил, 1-индолил, 2 индолил, 3-индолил, индол-2-он-1-ил, индол-2 он-3-ил, 2- или 3-бензофуранил, 2- или 3-бензотиофенил, 1-нафтил или 2-нафтил, каждый из которых необязательно замещен галогеном, C1-6 алкилом, C1-6-алкокси-, C1-6-алкилтио-, гидроксильной группой, C1-6-алкилсульфонилом, цианогруппой, трифторметилом, трифторметилсульфонилоксигруппой, С 3-8-циклоалкилом, С 3-8-циклоалкил-С 1-6-алкилом, нитро-, аминогруппой, C1-6-алкиламино-, С 2-12-диалкиламино-, ациламино- или алкилендиоксигруппой; их энантиомерам и их фармацевтически приемлемой кислотно-аддитивной соли. В одном воплощении изобретения А представляет собой группу формулы (1) и другие заместители принимают значения, определенные выше. В другом воплощении изобретения А представляет собой группу формулы (2) и другие заместители принимают значения, определенные выше. В третьем воплощении изобретения А представляет собой группу формулы (3) и другие заместители принимают значения, определенные выше. В четвертом воплощении изобретения А представляет собой группу формулы (4) и другие заместители принимают значения, определенные выше. Таким образом, в предпочтительном воплощении изобретения А представляет собой группу формулы (1) и R4 представляет собой метил, этил, пропил, проп-2-ен-1-ил, 2-фурилметил или 2-феноксиэтил; q=0 или А представляет собой группу формулы (1), Z представляет собой О и другие заместители принимают значения, определенные выше.Eще в одном воплощении изобретения В представляет собой группу формулы (II), предпочтительно алкоксизамещенный фенил, бензодиоксановую группу или 1,2-метилендиоксибензольную группу, и другие заместители принимают значения, определенные выше.Eще в одном воплощении изобретения В представляет собой группу формулы (III), предпочтительно 3-индолильную группу, и другие заместители принимают значения, определенные выше.Eще в одном воплощении изобретения В представляет собой группу формулы (III), предпочтительно 3-индолильную группу, а заместители R8 и R9 предпочтительно выбраны из водорода, метила, фтора, хлора, брома, йода, трет 5 бутила или изопропила в 5-положении; или фтора, хлора или карбоксильной группы в 7 положении; или 5,7-дифторо, 4-фтор-7-метила или 4-хлор-7-метила; или два заместителя вместе образуют пиридильное кольцо, конденсированное с 3-индолилом. Еще в одном воплощении изобретения В представляет собой группу формулы (IV) и другие заместители принимают значения, определенные выше. Аr предпочтительно представляет собой фенил или фенил, замещенный галогеном или СF3, наиболее предпочтительно замещенный F или Сl в 4 положении, либо Сl в 4 положении,либо Сl или СF3 в 3 положении.R1 предпочтительно представляет собой Н,CN или F в 5 положении изобензофурановой группы.R2 и R3 предпочтительно выбраны из водорода или метила.m предпочтительно равно 0. В предпочтительном воплощении изобретения n=2, 3 или 4;R2 и R3 оба представляют собой водород; 1R представляет собой Н, CN или F в 5 положении изобензофурановой группы и Аr представляет собой фенил, который может быть замещенным либо F или Сl в 4 положении, либо Сl или СF3 в 3 положении, и другие заместители принимают значения, определенные выше. В другом предпочтительном воплощении изобретения А представляет собой группу формулы (1); q=0; R4 представляет собой метил; D представляет собой пропилен; m=0; В представляет собой 1,4-бензодиоксановую группу формулы (II), присоединенную в 5 положении, и другие заместители принимают значения, определенные выше. Еще в одном предпочтительном воплощении изобретения А представляет собой группу формулы (1); R4 представляет собой СН 3 или проп-2-ен-1-ил; n=3; D представляет собой этилен или пропилен; В представляет собой фенильную группу, в которой по меньшей мере один заместитель представляет собой ОМе, и другие заместители принимают значения, определенные выше. Еще в одном воплощении изобретения А представляет собой группу формулы (1); q равно 0; R4 представляет собой метил, этил, пропил, 2-пропен-1-ил, 2-фурилметил или 2 феноксиэтил; D представляет собой этилен,пропилен или бутилен; m=0 и В представляет собой 3-индолильную группу формулы (III),другие заместители принимают значения, определенные выше. Еще в одном предпочтительном воплощении изобретения А представляет собой группу формулы (2) или (3); n=3; m=0 и В представляет собой 4- или 5-индолильную группу формулыR1 представляет собой CN в 5 положении изобензофурана, Аr представляет собой 4 фторфенил и другие заместители принимают значения, определенные выше. Изобретение относится также к фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль и, по меньшей мере, один фармацевтически приемлемый носитель или наполнитель. Еще в одном воплощении изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли для получения лекарственного средства для лечения расстройства или заболевания, чувствительного к действию 5HT1A рецепторов. В частности, изобретение относится к применению соединения согласно изобретению или его фармацевтически приемлемой кислотно-аддитивной соли для получения лекарственного средства для лечения депрессии, психоза,расстройств, связанных с состоянием страха,панического расстройства,обсессивнокомпульсивного расстройства, расстройства импульсивного контроля, алкогольного злоупотребления, агрессии, ишемии, старческого слабоумия, сердечно-сосудистых расстройств или социальной фобии. Еще в одном воплощении данное изобретение относится к способу лечения расстройства или заболевания живого организма животного,включая человека, которое чувствительно к действию 5-HT1A рецепторов, включающему введение в организм животного, включая человека, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой кислотно-аддитивной соли. Соединения изобретения обладают высоким сродством к 5-HT1A рецептору. Поэтому полагают, что соединения данного изобретения могут быть использованы для лечения депрессии, психоза, расстройств, связанных с состоянием страха, таких как генерализированное расстройство, связанное с состоянием страха, паническое расстройство, обсессивно-компульсивноое расстройство, расстройство импульсного контроля, алкогольного злоупотребления,агрессии, ишемии, старческого слабоумия, сердечно-сосудистых расстройств и социальной фобии. Считается, что благодаря сочетанию антагонизма в отношении 5-HT1A рецепторов и ингибирующего действия в отношении повторного поглощения серотонина многие из соединений данного изобретения особенно полезны в качестве лекарственных средств быстрого терапевтического действия для лечения депрессии. Соединения могут также быть использованы для лечения депрессии у пациентов, невосприимчивых к лечению с помощью антидепрессантов,доступных в настоящее время. 7 Подробное описание изобретения Некоторые соединения общей формулы I могут существовать в виде оптических изомеров, и такие оптические изомеры также охватываются данным изобретением. Термин "C1-6-алкил" относится к разветвленной или неразветвленной алкильной группе,содержащей от одного до шести атомов углерода включительно, такой как метил, этил, 1 пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2 пропил и 2-метил-1-пропил. Аналогично, термины "С 2-6-алкенил" и "С 2-6 алкинил", соответственно, обозначают такие группы, содержащие от двух до шести атомов углерода включительно. Термин "галоген" означает фтор, хлор,бром или йод. Термин "С 3-8-циклоалкил" означает моноциклический или бициклический карбоцикл,содержащий от трех до восьми С-атомов, такой как циклопропил, циклопентил, циклогексил,циклогептил или циклооктил. Термины "C1-6-алкокси-", "C1-6-алкилтио-","C1-6-алкилсульфонил" относятся к таким группам, в которых алкильная группа представляет собой C1-6-алкил, определенный выше. Термин "ацил" означает -СО-алкил, в котором алкильная группа представляет собой C1-6 алкил, определенный выше. Термин "C1-6-алкиламино-" означает -NHалкил, термин "C2-12-диалкиламино" означает-N-(алкил)2, где алкильная группа представляет собой C1-6-алкил, определенный выше. Термин "ациламино" означает -NH-ацил,где ацил представляет собой группу, определенную выше. Термин "C1-6-алкоксикарбониламино" означает алкил-O-CO-NH-, где алкильная группа представляет собой C1-6-алкил, определенный выше. Термин "C1-6-алкиламинокарбониламино-" означает алкил-NH-CO-NH-, где алкильная группа представляет собой C1-6-алкил, определенный выше. Термин "С 2-12-диалкиламинокарбониламино-" означает (алкил)2-N-СО-NН-, где алкильная группа представляет собой C1-6-алкил, определенный выше. Типичными примерами органических кислотно-аддитивных солей согласно данному изобретению являются соли малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной,глюконовой, молочной, яблочной, миндальной,циннамовой, цитраконовой, аспарагиновой,стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислот, а также 8-галотеофиллины, например 8-бромтеофиллин. Типичными примерами неорганиче 003781 8 ских кислотно-аддитивных солей согласно данному изобретению являются соли соляной, бромисто-водородной, серной, сульфаминовой,фосфорной и азотной кислот. Кислотноаддитивные соли данного изобретения предпочтительно представляют собой фармацевтически приемлемые соли нетоксичных кислот. Кроме того, соединения данного изобретения могут существовать как в несольватированной, так и в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Обычно сольватированные формы считаются эквивалентными несольватированным формам для целей данного изобретения. Некоторые соединения данного изобретения содержат хиральные центры, и такие соединения существуют в виде изомеров (например, в виде энантиомеров). Изобретение включает все такие изомеры и их любые смеси, включая рацемические смеси. Рацемические формы могут подвергаться разделению известными способами на оптические антиподы, например разделением их диастереомерных солей оптически активной кислоты, выделением оптически активного аминопроизводного при обработке основанием. Другой способ разделения рацематов на оптические антиподы основан на хроматографии на оптически активной матрице. Таким образом, рацемические соединения данного изобретения могут быть разделены на оптические антиподы, например фракционной хроматографией d- или lсолей (например, тартратов, манделатов или камфорсульфонатов). Соединения данного изобретения могут быть разделены посредством получения диастеремерных производных. Могут использоваться дополнительные способы разделения оптических изомеров, известные специалистам данной области. Такие способы включают способы, описанные в публикации J. Jaques, A. Collet, S. Wilen, "Enantiomers, Racemates and Resolutions", John Wiley andSons, New York (1981). Оптически активные соединения могут быть получены также из оптически активных исходных веществ. Соединения данного изобретения могут быть получены одним из следующих способов: а) алкилирование амина формулы где R1, R2, R3, R4, n и Аr имеют значения, определенные выше,алкилирующим агентом формулы G-(D)s(Z)q-(СН 2)m-В, где D, Z, m, s, q и В имеют значения, определенные выше, и G представляет собой подходящую уходящую группу, такую как галоген, мезилат или толизат;b) алкилирование амина формулы Н-А(СН 2)m-В, где A, m и В принимают значения,определенные выше, алкилирующим агентом формулы где R1, R2, R3, n и Аr имеют значения, определенные выше, и G представляет собой подходящую уходящую группу, такую как галоген, мезилат или тозилат; с) восстановительное алкилирование амина формулы где R1, R2, R3, R4, n, q, Ar, Z, m и В имеют значения, определенные выше, и t равно 1-5; е) высвобождение конечного продукта элиминированием Хофмана из смолы формулы где R1, R2, R3, R4, n, s, q, Ar, D, Z, m и В имеют значения, определенные выше, G имеет значения, определенные выше; HOR представляет собой гидроксизамещенную смолу, такую как сшитый гидроксиметилполистирол или смола Ванга; 10 бой диол, такой как замещенный этиленгликоль или пропиленгликоль,или полимерносвязанный диол, с гидразином формулы где R8 и R9 имеют определенные выше значения,с использованием кислот Льюиса в качестве катализатора. Алкилирование согласно способам а и b обычно проводится при кипячении реагентов с обратным холодильником или нагреванием реагентов до определенной температуры в подходящем растворителе, таком как ацетон, метилизобутилкетон, тетрагидрофуран, диоксан, этанол, 2-пропанол, этилацетат, N,N-диметилформамид, диметилсульфоксид или 1-метил-2-пирролидинон, в присутствии основания, такого как триэтиламин или карбонат калия. Амины формулы V получают путем деметилирования в соответствии с методом, описанным в публикации Bigler et al., Eur. J. Med. Chem. Chim. Ther.,1977, 12, 289-295, или с помощью методов, описанных в примерах 14 и 15. Исходные вещества,используемые в примере 14, получают в соответствии с методикой примера 9 или из доступных соединений стандартными методами. Энантиомеры 1-[3-(диметиламино)пропил]-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила, используемые в качестве исходного вещества для деметилирования, получают в соответствии с методом,описанным вeвропейской заявке ЕР 347066. Алкилирующие агенты формулы G-(D)s-(Z)q-(CH2)m-B являются коммерчески доступными, их получают методами, хорошо известными квалифицированным в данной области специалистам, или в соответствии с методиками примеров 5-8. Этил 1,4 бензодиоксан-5-карбоксилат, используемый в качестве исходного вещества в примере 5, получают методами, известными специалистам, из соответствующей карбоновой кислоты, которую получают по способу, описанному в литературе(Fuson et al., J. Org. Chem., 1948, 13, 489). Алкилирующие агенты формулы VI получают из соответствующего диметиламина (формула VI:G=N(Me)2), как описано в примере 9. Вторичные амины формулы Н-А-(СН 2)m-В являются коммерчески доступными, либо их получают известными методами или согласно способам,описанным в литературе. 1-(2-Метоксифенил) пиперазин получают в соответствии со способом публикации Pollard et al., J. Org. Chem.,1958, 23, 1333. [2-(2-Метоксифенокси)этил]метиламин и [2-(3-метоксифенокси)этил]метиламин получают согласно способам, описанным в примерах 7 и 10, с использованием в качестве исходных веществ коммерчески доступных 2 метоксифеноксиуксусной кислоты и 3-метоксифеноксиуксусной кислоты соответственно. 11 Восстановительное алкилирование согласно способам с и d соответствует стандартным способам, описанным в литературе, с использованием NaCNBH3, NaBH4 или NaBH(OAc)3 в качестве восстановителя в подходящем растворителе. Восстановление согласно способам е и f обычно проводится с применением LiAlH4, АlН 3 или диборана в инертном растворителе, таком как тетрагидрофуран, диоксан или диэтиловый эфир, при комнатной температуре или при слегка повышенной температуре. Выделение конечных продуктов путем элиминирования Хофмана в способе g обычно выполняют с помощью органического основания, такого как триэтиламин или диизопропилэтиламин, в апротонном органическом растворителе, таком как дихлорметан, толуол или N,Nдиметилформамид. Полимер формулы XII получают путем синтеза, который описан в примере 4 и состоит в следующем. Исходную акрилатную смолу (СН 2 СНС(О)OR') получают в соответствии с методиками, описанными в литературе (Brown et al., J. Am. Chem Soc., 1997, 119,3288-95), ацилированием коммерчески доступных гидрокизамещенных смол, таких как сшитый гидроксиметилполистирол или смола Ванга, акрилоилхлоридом. Вторичные амины формулы H2N-D-Z-(СН 2)m-В вводят реакцией присоединения Михаэля в органическом растворителе, таком как N,N-диметилформамид, при комнатной температуре. Используемые вторичные амины коммерчески доступны, либо их получают известными способами или способами,описанными в литературе. 3-(2-Метоксифенил)пропиламин получают в соответствии с методикой, описанной в публикации Leeson etChem. Soc., 1930, 52, 5029. Вторую видоизменяющуюся группу вводят путем алклирования с агентом формулы VI при кипячении реагентов с обратным холодильником или при выдерживании их при повышенной температуре в подходящем растворителе, таком как тетрагидрофуран, диоксан, этанол, 2-пропанол, этилацетат,N,N-диметилформамид,диметилсульфоксид или 1-метил-2-пирролидинон, в присутствии 12 растворимого основания, такого как диизопропилэтиламин или триэтиламин, или путем восстановительного алкилирования с альдегидом формулы IX согласно стандартным способам синтеза в твердой фазе, описанным в литературе, с использованием NaCNBH3, NaBH4 илиNаВН(ОАс)3 в качестве восстановителя в подходящем растворителе. Третью видоизменяющуюся группу вводят посредством реакции образования четвертичной соли с использованием алкилирующего агента формулы R4-G в органическом растворителе, таком как тетрагидрофуран, диоксан, этанол, 2-пропанол, этилацетат,N,N-диметилформамид,диметилсульфоксид или 1-метил-2-пирролидинон, при комнатной температуре с получением смол формулы XII. Получение индола согласно способу h проводят путем взаимодействия ацеталей формулы XIII с арилгидразинами формулы XIV с получением соответствующих гидразонов, которые далее подвергаются преобразованию в индолы по способу синтеза индолов по Фишеру. Всю последовательность преобразований предпочтительно выполняют в одной емкости с использованием в качестве катализаторов кислот Льюиса, предпочтительно хлорида цинка или фторида бора, или протонных кислот, предпочтительно серной кислоты или фосфорной кислоты, в подходящем растворителе, таком как уксусная кислота или этанол, при повышенной температуре. Ацетали формулы XIII получают алкилированием вторичных аминов формулы V с ацеталями формулы XV в условиях, описанных выше для способов а и b. Альтернативно ацетали формулы XIII получают алкилированием ацеталей формулы XVI алкилирующим агентом формулы VI в условиях, описанных выше для способов а и b. Ацетали формулы XVI получают взаимодействием ацеталей формулы XV с первичными аминами формулы NH2R4 в стандартных условиях. Полимерно связанные ацетали формулыXV получают взаимодействием альдегидов формулы G-B-CH2CHO с коммерчески доступным 2,2-диметил-1,3-диоксолан-4-илметоксиметилполистиролом в подходящем растворителе,таком как толуол, используя п-толуолсульфоновую кислоту в качестве катализатора, при повышенной температуре. 4-Хлорбутаналь, 5 хлорпентаналь и 6-хлоргексаналь получают способом, аналогичным описанному в публикации Normant et al., Tetrahedron, 1994, 50 (40),11665. 13 Примеры Температуры плавления определяют на аппарате Buchi SMP-20, и они не корректированы. Масс-спектры определены с помощью системы Quattro MS-MS от VG Biotech, Fisons Instruments. MS-MS систему соединяли с модульной системой ВЭЖХ HP 1050. Образец объемом 20-50 мкл (10 мкг/мл), растворенный в смеси 1% уксусной кислоты со смесью ацетонитрил/вода 1:1, вводят с помощью автоматического пробоотборника с объемной скоростью 30 мкл/мин в источник электрораспыления. Спектры получены для двух стандартных рабочих условий. Данные анализа ЖХ-МС получены на аппарате РЕ Sciex API 150EX, снабженном источником ионного распыления, и системе ЖХ ShimadzuYMC ODS-A с размером частиц 5 мкм) были линейное градиентное элюирование смесью вода/ацетонитрил/трифторуксусная кислота состава от (90:10:0,05) до (10:90:0,03) в течение 7 мин с объемной скоростью 2 мл/мин. Чистота определена интеграцией следов в ультрафиолетовом излучении (254 нм). Время удерживанияRt выражают в минутах. В одних рабочих условиях получают информацию о молекулярной массе (МН+) (21 эВ),другие используют для получения диаграмм фрагментации (70 эВ). Фон вычитают. Относительные интенсивности ионов получают из диаграммы фрагментации. Когда отсутствует интенсивность для Молекулярного иона (МН+),этот ион присутствует только при первом сочетании рабочих условий. Препаративное ЖХМС-разделение проведено на той же аппаратуре. Условиями ЖХ (50 х 20 мм YMC ODC-A с размером частиц 5 мкм) являлось линейное градиентное элюирование смесью вода/ацетонитрил/трифторуксусная кислота состава от(80:20:0,05) до (10:90:0,03) в течение 7 мин с объемной скоростью 22,7 мл/мин. Сбор фракций осуществлен с помощью масс-спектрометрического обнаружения расщепленного потока. 1H ЯМР спектры записаны при частоте 500,13 МГц на аппарате Bruker Avance DRX500 или при частоте 250,13 МГц на аппарате BrukerAC 250. В качестве растворителей использовались дейтерированные хлороформ (99,8% D) или диметилсульфоксид (99,9% D). В качестве внутреннего стандарта использовался тетраметилсилан (TMS). Значения химических сдвигов выражены в миллионных долях (ppm). Для обозначения мультиплетности ЯМР сигналов использовались следующие аббревиатуры: с=синглет, д=дублет, т=триплет, к=квартет,кви=квинтет, г=гептет, дд=двойной дублет,дт=двойной триплет, дк=двойной квартет,тт=триплет триплетов, м=мультиплет. ЯМР сигналы, соответствующие кислотным протонам,как обычно опущены. Содержание воды в кристаллических соединениях определено титрованием по Карлу Фишеру. Термин "обрабатывают 14 в соответствии со стандартными методиками" включает экстракцию указанным органическим растворителем из соответствующих водных растворов, сушку объединенных органических экстрактов (безводными MgSO4 или Na2SO4),фильтрование и упаривание растворителя в вакууме. Для колоночной хроматографии использовался силикагель Kieselgel 60 (230-400 меш в соответствии с ASTM). Пример 1. (+)-1-[3-4-(1,4-Бензодиоксан-5 ил)бутил]метиламино]пропил]-1-(4-фторфенил)1,3-дигидроизобензофуран-5-карбонитрил (1a). Смесь 5-(4-бромбутил)-1,4-бензодиоксана (1,5 г, 5,5 ммоль), (+)-1-[3-(метиламино)пропил]-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила (2,2 г, 5,5 ммоль), карбоната калия (3,0 г, 22 ммоль) и метилизобутилкетона (150 мл) кипятят с обратным холодильником в течение 16 ч. После охлаждения до комнатной температуры органическую фазу промывают водой (150 мл), растворители выпаривают в вакууме и оставшееся масло очищают колоночной хроматографией (этилацетат/гептан/триэтиламин 75:20:5), в результате,получают 2,0 г (73%) указанного в заголовке соединения в виде масла;H ЯМР (СDСl3)1,25-1,35 (м, 1 Н), 1,401,60 (м, 5 Н), 2,05-2,30 (м, 9 Н), 2,55 (т, 2 Н), 4,204,30 (м, 4 Н), 5,10-5,20 (м, 2 Н), 6,65-6,75 (м, 3 Н),7,00 (т, 2 Н), 7,35 (д, 1 Н), 7,40 (дд, 2 Н), 7,50 (с,1 Н), 7,60 (д, 1 Н); МС m/z 501 (МН+, 100), 262(27), 149(77),109(52). Аналогично получают следующие соединения.(2,0 г, 10,4 ммоль), карбоната калия (3 г, 22 ммоль) и метилизобутилкетона (200 мл) кипятят с обратным холодильником в течение 16 ч. После охлаждения до комнатной температуры органическую фазу промывают водой (200 мл),растворители упаривают в вакууме и оставшееся масло очищают колоночной хроматографией(этилацетат/гептан/триэтиламин 75:20:5). Указанное в заголовке соединение кристаллизуют из диэтилового эфира - 1,5 г (40%): т.пл. 147149 С; 1H ЯМР (ДМСО-d6)1,30-1,65 (м, 2 Н),2,10-2,30 (м, 2 Н), 2,40 (т, 2 Н), 2,50-2,70 (м, 4 Н),2,90-3,20 (м, 4 Н), 3,85 (с, 3 Н), 5,20 (м, 2 Н), 6,707,10 (м, 6 Н),7,30-7,55 (м, 4 Н), 7,60 (д, 1 Н); МС m/z, 472 (МН+, 100), 262(14), 109(19). Аналогично получают следующие соединения. 1-(4-Фторфенил)-1-[3-2-(2-метоксифенокси)этил]метиламино]пропил]-1,3-дигидроизобензофуран-5-карбонитрил (2b): (масло); 1(2g); ЖХ/МС (m/z) 425 (МН+), Rt=4,15, чистота: 99%. 5-[3-3-(1-Фенил-1,3-дигидроизобензофуран-1-ил)пропил]метиламино]пропил]-1,4-бензодиоксан (2h); ЖХ/МС (m/z) 444 (МН+), Rt=4,12, чистота: 97%. 5-[3-3-[1-(3-Хлорфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]1,4-бензодиоксан (2i); ЖХ/МС (m/z) 478 (МН+), Rt=4,45, чистота: 93%. 5-[3-3-[1-(4-Фторфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]1,4-бензодиоксан (2j); ЖХ/МС (m/z) 462 (МН+), Rt=4,21, чистота: 93%. 5-[3-3-[1-(3-Трифторметилфенил)-1,3-дигидроизобензофуран-1-ил]пропил]метиламино] пропил]-1,4-бензодиоксан (2k); ЖХ/МС (m/z) 512 (МН+), Rt=4,59, чистота: 90%. 1-[3-3-(1,4-Бензодиоксан-5-ил)пропил] метиламино]пропил]-1-(4-хлорфенил)-1,3 дигидроизобензофуран-5-карбонитрил (2l); ЖХ/МС (m/z) 503 (МН+), Rt=4,59, чистота: 99%. 1-[3-[4-(1 Н-Индол-4-ил)пиперазинил]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (2m); ЖХ/МС (m/z) 481 (МН+), Rt=5,61, чистота: 97%. 1-[3-[4-(1 Н-Индол-5-ил)пиперазинил]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (2n); ЖХ/МС (m/z) 481 (МН+), Rt=5,69, чистота: 94%. 1-[3-[4-(6-Хлор-1 Н-Индол-3-ил)пиперидинил]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (2 о); ЖХ/МС (m/z) 514 (МН+), Rt=6,38, чистота: 96%. Пример 3. 5-[3-3-[5-Фтор-1-(4-фторфенил)1,3-дигидроизобензофуран-1-ил]пропил]метиламино]пропил]-1,4-бензодиоксаноксалат (3). Раствор 3-(1,4-бензодиоксан-5-ил)пропионовой кислоты (0,8 г, 3,8 ммоль), тионилхлорида (1 мл, 13,7 ммоль) и одной капли N,Nдиметилформамида в дихлорметане (30 мл) кипятят с обратным холодильником в течение 2 ч. Легколетучие растворители упаривают в вакууме и оставшееся масло растворяют в дихлорметане (30 мл). Полученный раствор добавляют к раствору(3,0 г, 10 ммоль) и триэтиламина (10 мл) в дихлорметане (100 мл). После перемешивания в течение 16 ч легколетучие растворители выпаривают в вакууме и оставшееся масло очищают колоночной хроматографией (этилацетат/гептан 75:25), в результате получают 1,4 г неочищенного амида, который используют без дополнительной очистки. К раствору амида (1,4 г, 2,8 ммоль) в тетрагидрофуране (200 мл) добавляют алюмогидрид лития (1,0 г, 2,6 ммоль). После кипячения с обратным холодильником в течение 3 ч реакционную смесь охлаждают до 0 С и осторожно обрабатывают водой (10 мл) и 4 н водным гидроксидом натрия (1 мл). Полученную смесь фильтруют и сушат (Na2SO4). Упаривание легколетучих растворителей приводит к получению указанного в заголовке соединения в виде масла, которое осаждают в виде оксалата в ацетоне 0,9 г (19%): т.пл. 131-133 С; 1H ЯМР (ДМСО-d6)1,35-1,45 (м, 1H),1,45-1,55 (м, 1 Н), 1,75-1,80 (м, 2 Н), 2,10-2,25 (м,2 Н), 2,50-2,55 (м, 2 Н), 2,60 (с, 3 Н), 2,90 (т, 2 Н),2,95 (т, 2 Н), 4,20-4,25 (м, 4 Н), 5,10 (m, 2H), 6,656,75 (м, 3 Н), 7,10-7,15 (м, 4 Н), 7,45-7,60 (м, 3 Н); МС m/z, 480 (МН+, 100), 225(34), 109(51). Пример 4. 1-[3-2-(1 Н-Индол-3-ил)этил] метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (4 а). К суспензии сложного акрилового эфира смолы Ванга (CH2CHC(О)OR', НОR'=смола Ванга) (загрузка 1,0 ммоль/г) (300 мг, 0,30 ммоль) (получают из смолы Ванга (загрузка 1,09 ммоль/г, 200-400 меш, 1% дивинилбензол) по способу, описанному для получения акрилового эфира гидроксиметилполистирола в публикацииBrown et al., J. Am. Chem. Soc., 1997, 119, 328895) в N,N-диметилформамиде (1,5 мл) добавляют раствор 2-(1H-индолил-3-ил)этиламина (96 мг, 0,60 ммоль) в N,N-диметилформамиде (1,5 мл). После перемешивания полученной суспензии при комнатной температуре в течение 16 ч смолу выделяют фильтрованием и последовательно промывают 0,3 М диизопропилэтиламином в N,N-диметилформамиде (3 х 2,5 мл), метанолом (2 х 2,5 мл) и дихлорметаном (2 х 2,5 мл). К суспензии полученной смолы в ацетонитриле (1,5 мл) добавляют раствор 1-(3 хлорпропил)-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила (9) (473 мг, 1,5 ммоль) в ацетонитриле (1,5 мл) и диизопропилэтиламине (280 мл, 1,6 ммоль). После перемешивания полученной смеси при 75 С в течение 16 ч смолу выделяют фильтрованием. Смолу последовательно промывают ацетонитрилом(280 мл, 1,6 ммоль) и добавляют уксусный ангидрид (140 мл, 1,5 ммоль). После перемешивания полученной смеси в течение 16 ч смолу вы 003781(3 х 2,5 мл) и дихлорметаном (3 х 2,5 мл). Промежуточную смолу суспендируют вN,N-диметилформамиде (2 мл) и добавляют раствор йодметана (187 мл, 3,0 ммоль) в N,Nдиметилформамиде. После перемешивания полученной смеси в течение 16 ч при комнатной температуре смолу собирают фильтрованием и промывают N,N-диметилформамидом (3 х 2,5 мл), метанолом (3 х 2,5 мл) и дихлорметаном(3 х 2,5 мл). К полученной смоле добавляют N,Nдиметилформамид (3,0 мл) и диизопропилэтиламин (165 мл, 0,94 ммоль) и смесь перемешивают в течение 16 ч. Смолу собирают фильтрованием и промывают метанолом (2 х 2,0 мл). Фильтрат и промывные растворы собирают и растворитель выпаривают в вакууме. Оставшееся масло очищают ионообменной хроматографией с использованием 6 мл Varian SCX колонки (1225-6011). Колонку предварительно кондиционируют 10% уксусной кислотой в метаноле(3 мл) и неочищенный продукт загружают в колонку в смеси метанола и 1-метил-2 пирролидинона 2:1 (3 мл). После этого колонку промывают метанолом (18 мл) и ацетонитрилом(3 мл), продукт элюируют из колонки 4 н аммиаком в метаноле (4 мл) и последующее выпаривание растворителей в вакууме приводит к получению 13,9 мг (10%) указанного в заголовке соединения в виде масла; ЖХ/МС (m/z) 454 (МН+), Rt=6,13, чистота: 98%. Аналогично получают следующие соединения. 1-(4-Фторфенил)-1-[3-2-(3-метоксифенил)этил]метиламно]пропил]-1,3-дигидроизобензофуран-5-карбонитрил (4b); ЖХ/МС (m/z) 445 (МН+), Rt=8,58, чистота: 88%. 1-(4-Фторфенил)-1-[3-2-(3-метоксифенил)этил](проп-2-ен-1-ил)амино]пропил]-1,3 дигидроизобензофуран-5-карбонитрил (4 с); 1 20 1-[3-[(2-Бензилоксиэтил)метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (4q); ЖХ/МС (m/z) 445 (МН+), Rt=6,18, чистота: 98%. 1-[3-[(2-Бензилоксиэтил)(проп-2-ен-1-ил) амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (4r); ЖХ/МС (m/z) 471 (МН+), Rt=6,55, чистота: 97%. 1-[3-3-(1H-Индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (4s); ЖХ/МС (m/z) 468 (МН+), Rt=6,28, чистота: 80%. 1-[3-3-(1 Н-Индол-3-ил)пропил](проп-2 ен-1-ил)амино]пропил]-1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбонитрил (4t); ЖХ/МС (m/z) 494 (МН+), Rt=6,60, чистота: 82%. 1-[3-3-(1 Н-Индол-3-ил)пропил](проп-2 ин-1-ил)амино]пропил]-1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбонитрил (4u); ЖХ/МС (m/z) 492 (МН+), Rt=6,59, чистота: 73%. Пример 5. 5-Гидроксиметил-1,4-бензодиоксан (5). К суспензии алюмогидрида лития (7,0 г,0,18 моль) в сухом диэтиловом эфире (100 мл) добавляют раствор этил 1,4-бензодиоксан-5 карбоксилата (35 г, 0,17 моль) в диэтиловом эфире (100 мл). После кипячения с обратным холодильником в течение 2 ч реакционную смесь охлаждают до 0 С и осторожно обрабатывают водой (35 мл) и 4 н водным гидроксидом натрия (35 мл). Полученную смесь фильтруют и сушат (Na2SO4). Выпаривание растворителей приводит к получению 25 г (88%) соединения,указанного в заголовке, в виде кристаллического вещества: т.пл. 51-53 С; 1H ЯМР (СDСl3)2,50 (с, 1 Н), 4,20-4,3 (м,4 Н), 4,60 (с, 2 Н), 6,75-6,90 (м, 3 Н). Пример 6. 2-(1,4-Бензодиоксан-5-ил)уксусная кислота (6). К раствору 5-гидроксиметил-1,4-бензодиоксана (8,0 г, 48 ммоль) в дихлорметане (200 мл) добавляют две капли N,N-диметилформамида и тионилхлорид (5,0 мл, 68 ммоль) при комнатной температуре. После кипячения с обратным холодильником в течение 1 ч смесь охлаждают до комнатной температуры и добавляют воду (100 мл). Фазы делят, органическую фазу сушат(MgSO4) и растворители выпаривают в вакууме. Раствор оставшегося масла (8,5 г, 46 ммоль) добавляют к смеси цианида натрия (5,0 г, 102 ммоль) и N,N-диметилформамида (100 мл) при комнатной температуре. После перемешивания в течение 16 ч при комнатной температуре добавляют лед и полученную суспензию экстрагируют диэтиловым эфиром (2 х 250 мл). Объединенные органические фазы промывают насыщенным раствором хлорида кальция, сушат(Na2SO4) и растворители выпаривают в вакууме. Смесь оставшегося масла (6,0 г, 34 ммоль), этанола (200 мл), гидроксида натрия (6,0 г) и воды(6 мл) кипятят с обратным холодильником 16 ч. После выпаривания растворителей в вакууме добавляют воду (200 мл) и полученную суспензию экстрагируют диэтиловым эфиром (2 х 200 мл). Объединенные органические фазы промывают насыщенным раствором соли, сушат(м, 4 Н), 6,70-6,85 (м, 3 Н). Пример 7. 5-(2-Бромэтил)-1,4-бензодиоксан (7 а). К раствору 2-(1,4-бензодиоксан-5-ил)уксусной кислоты (6) (4,0 г, 21 ммоль) в тетрагидрофуране (200 мл) добавляют алюмогидрид лития (1,0 г, 26 ммоль). После кипячения с обратным холодильником в течение 2 ч реакционную смесь охлаждают до 0 С и осторожно обрабатывают водой (1 мл) и 4 н водным гидроксидом натрия (1 мл). Полученную смесь фильтруют и сушат (Nа 2SО 4). Выпаривание растворителей приводит к получению неочищенного промежуточного спирта (3,9 г, 21 ммоль) в виде масла,которое используют без дополнительной очистки. К раствору промежуточного спирта и тетрабромметана (8,8 г, 27 ммоль) в ацетонитриле(120 мл) добавляют небольшими порциями трифенилфосфин (6,3 г, 24,9 ммоль) при 0 С. После взаимодействия в течение дополнительных 15 мин при 0 С растворители выпаривают в вакууме и оставшееся масло очищают колоночной хроматографией (этилацетат/гептан 66:34), в результате, получают 5,5 г (99%) указанного в заголовке соединения в виде масла; 1H ЯМР (СDСl3)3,15 (т, 2 Н), 3,55 (т, 2 Н),4,20-4,35 (м, 4 Н), 6,65-6,85 (м, 3 Н). Аналогично получают следующие соединения. 5-(3-Бромпропил)-1,4-бензодиоксан (7b):(7 с) (18,0 г, 74 ммоль) при комнатной температуре добавляют к смеси диэтилмалоната (12 г,75 ммоль), трет-бутоксида калия (8,4 г, 75 ммоль), толуола (250 мл) и диметилсульфоксида(50 мл). Полученную смесь нагревают до 50 С и выдерживают при этой температуре в течение 3 ч, охлаждают до комнатной температуры и добавляют воду. Затем суспензию подкисляют концентрированной соляной кислотой и фазы делят. Органическую фазу сушат (Na2SО 4) и растворители упаривают в вакууме. Оставшееся масло растворяют в этаноле (200 мл) и 9 н водном гидроксиде натрия. После кипячения с обратным холодильником в течение 15 мин раствор перемешивают при комнатной температуре в течение 1 ч. Растворители выпаривают, оставшееся масло разбавляют водой (200 мл) и экстрагируют диэтиловым эфиром (2 х 100 мл). Водную фазу подкисляют 4 н соляной кислотой и экстрагируют этилацетатом (2 х 200 мл). Сушка объединенных органических фаз и выпаривание растворителей в вакууме приводят к получению промежуточной дикарбоновой кислоты в виде масла (5,0 г). Неочищенное масло разбавляют пиридином (10 мл), полученный раствор нагревают до 115 С и выдерживают при этой температуре в течение 1 ч. После охлаждения до комнатной температуры добавляют воду (50 мл) и водную фазу подкисляют 4 н соляной кислотой. Полученную суспензию экстрагируют диэтиловым эфиром (2 х 50 мл) и объединенные органические фазы сушат (Na2SО 4). Выпаривание растворителей в вакууме приводит к получению 3,8 г (23%) указанного в заголовке соединения в виде масла. Аналогично получают следующее соединение. 3-(1,4-Бензодиоксан-5-ил)пропионовая кислота (8b): (масло); 1(9). К смеси 1-[3-(метиламино)пропил]-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила (43 г, 138 ммоль), карбоната калия (30 г, 217 ммоль) и этанола (400 мл) при комнатной температуре добавляют этилбромацетат (20 мл,180 ммоль) и полученную смесь кипятят с обратным холодильником в течение 90 мин. После охлаждения до комнатной температуры добавляют воду (800 мл) и этилацетат (500 мл) и фазы делят. Органическую фазу промывают насыщенным раствором соли, сушат (Na2SО 4) и растворители упаривают в вакууме. Оставшееся масло (36 г, 101 ммоль) медленно добавляют при 90 С к смеси этилхлорформиата (50 мл, 523 ммоль), карбоната калия (36 г, 260) и толуола(300 мл). После кипячения с обратным холодильником в течение 1 ч полученную смесь охлаждают до комнатной температуры и растворители упаривают в вакууме. Оставшееся масло очищают колоночной хроматографией (этилацетат/гептан 1:3), в результате, получают 15 гH ЯМР (СDСl3)1,60-1,90 (м, 2 Н), 2,202,45 (м, 2 Н), 3,45-3,55 (м, 2 Н), 5,20 (м, 2 Н), 6,957,10 (т, 2 Н), 7,40-7,55 (м, 4 Н), 7,60 (д, 1 Н). Пример 10. [2-(2-Метоксифенокси)этил] метиламин (10 а). Раствор 1-(2-бромэтокси)-2-метоксибензола (7d) (7,7 г, 33 ммоль) в 33% растворе метиламина в этаноле нагревают до 80 С в запаянной трубке и выдерживают при этой температуре в течение 16 ч. После охлаждения до комнатной температуры растворители выпаривают в вакууме. К оставшемуся маслу добавляют 2 н водный раствор гидроксида натрия и полученную суспензию экстрагируют этилацетатом (2 х 250 мл). Объединенные органические фазы сушат(Na2SО 4) и растворители упаривают в вакууме, в результате получают 5,9 г (98%) указанного в заголовке соединения в виде масла: 1 Н ЯМР (СDСl3)1,85 ( уширенный с, 1 Н),2,50 (с, 3 Н), 3,00 (т, 2 Н), 3,85 (с, 3 Н), 4,10 (т,2 Н), 6,85-6,95 (м, 4 Н). Аналогично получают следующее соединение.H ЯМР (CDCl3)1,85 (уширенный с, 1 Н),2,50 (с, 3 Н), 2,95 (т, 2 Н), 3,80 (с, 3 Н), 4,05 (т,2 Н), 6,45-6,55 (м, 3 Н), 7,15 (т, 1 Н). Пример 11. 2-(4-Хлорбутил)диоксолан-4 илметоксиметилполистирол (11 а). В круглодонную колбу объемом 2 л загружают 2,2-диметилдиоксолан-4-илметоксиметилполистирол (90 г, 72 ммоль, коммерчески доступен как -1-(2,3-изопропилиден)глицеринполистирол от Calbiochem-Novabiochem, кат.01-64-0291). Добавляют толуол (900 мл), а затем п-толуолсульфокислоты моногидрат (5,0 г, 26 ммоль), сульфат натрия (25 г) и коммерчески доступный 5-хлорпентаналь (25,5 г, 211 ммоль) и смесь кипятят с обратным холодильником в течение 12 ч. Обратный холодильник заменяют аппаратом Дина-Старка и смесь кипятят еще 3 ч. После охлаждения реакционной смеси до 60 С смолу собирают фильтрованием и промывают толуолом (200 мл), смесью тетрагидрофуран/пиридин (1:1, 200 мл), смесью тетрагидрофуран/вода/пиридин (10:10:1, 200 мл), метанолом (200 мл), водой (200 мл), тетрагидрофураном (200 мл), дихлорметаном (200 мл), метанолом (3 х 200 мл) и дихлорметаном (3 х 200 мл). Смолу сушат в вакууме (55 С, 12 ч), в результате получают указанное в заголовке соединение 11 а (97 г). 24 Аналогично получают следующие соединения: 2-(3-хлорпропил)диоксолан-4-илметоксиметилполистирол (11b); 2-(5-хлорпентил)диоксолан-4-илметоксиметилполистирол (11 с). Пример 12. 1-[3-3-(1 Н-Индол-3-ил)пропил]метиламино]пропил]-1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбонитрил (4s). 2-(4-Хлорбутил)диоксолан-4-илметоксиметилполистирол (11 а) (8,0 г, 6,1 ммоль) суспендируют в сухом N,N-диметилформамиде (90 мл). Добавляют йодид натрия (3,38 г, 22,5 ммоль), затем диизопропилэтиламин (6,30 мл,36 ммоль) и 1-[3-(метиламино)пропил]-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (5,56 г, 18 ммоль). Реакционную смесь нагревают до 80 С и перемешивают при этой температуре в течение 12 ч. После охлаждения до комнатной температуры смолу собирают фильтрованием и промывают(3 х 60 мл), тетрагидрофураном (3 х 60 мл) и затем последовательно метанолом и тетрагидрофураном (каждого растворителя приблизительно по 40 мл, 5 циклов). Наконец, смолу промывают тетрагидрофураном (4 х 40 мл) и сушат в вакууме(55 С, 12 ч, 9,5 г). Аликвоту этого вещества (147 мг, 0,112 ммоль) и фенилгидразин гидрохлорид (43 мг,0,297 ммоль) смешивают в реакционной трубке. Добавляют 0,5 М раствор безводного хлорида цинка в уксусной кислоте (1,5 мл) и реакционную трубку герметично закрывают. Реакционную смесь перемешивают в течение 12 ч при 75 С. После охлаждения до комнатной температуры реакционную смесь фильтруют и отфильтрованную смолу промывают диметилсульфоксидом (1,5 мл). К объединенным фильтратам добавляют насыщенный водный раствор бикарбоната натрия (1,5 мл). Раствор загружают в колонку с твердой фазой для экстракционной хроматографии с обращенной фазой (С-18, 1 г,Varian Mega Bond Elut, Chrompack кат.220508), предварительно кондиционированную метанолом (3 мл) и водой (3 мл). Колонку промывают водой (4 мл) и продукт элюируют метанолом (4,5 мл). Полученный раствор загружают в ионообменную колонку (SCX, 1 г, Varian МедаBond Elut, Chrompack кат.220776), предварительно кондиционированную 10% раствором уксусной кислоты в метаноле (3 мл), и колонку промывают метанолом (4 мл) и ацетонитрилом(4 мл), затем элюируют 4 н раствором аммиака в метаноле (4,5 мл). Выпаривание легколетучих растворителей приводит к получению указанного в заголовке соединения (4s) в виде бесцветного масла (22 мг 42%). ЖХ/МС (m/z) 468 (МН+), Rt=4,30, чистота: 83%. Аналогично получают следующие соединения.(12 ао); ЖХ/МС (m/z) 524 (МН+), Rt=4,85, чистота: 91% 1-[4-2-(5-(2-Пропил)-1H-индол-3-ил) этил]метиламино]бутил]-1-(4-фторфенил)-1,3 дигидроизобензофуран-5-карбонитрил (12 ар); ЖХ/МС (m/z) 510 (МН+), Rt=4,72, чистота: 92%. Пример 13. 1-[3-2-(5-Метил-1 Н-индол-3 ил)этил](проп-2-ен-1-ил)амино]пропил]-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (13 а). 2-(3-Хлорпропил)-1,3-диоксолан-4-илметоксиметилполистирол (2,0 г, 1,6 ммоль) суспен 29 дируют в сухом N,N-диметилформамиде (15 мл). Добавляют йодид натрия (0,67 г, 4,5 ммоль), затем диизопропилэтиламин (1,70 мл,9,6 ммоль) и аллиламин (0,28 г, 4,8 ммоль). Реакционную смесь нагревают до 80 С и перемешивают при этой температуре в течение 12 ч. После охлаждения до комнатной температуры смолу фильтруют и промывают(20 мл). Добавляют йодид натрия (0,60 г, 4,0 ммоль), затем диизопропилэтиламин (0,48 мл,2,7 ммоль) и 1-(3-хлорпропил)-1-(4-фторфенил)1,3-дигидроизобензофуран-5-карбонитрил(0,79 г, 2,5 ммоль). Реакционную смесь перемешивают в течение 12 ч при 80 С. После охлаждения до комнатной температуры смолу фильтруют и промывают N,N-диметилформамидом(3 х 15 мл), метанолом (3 х 15 мл), тетрагидрофураном (3 х 15 мл) и затем последовательно метанолом и тетрагидрофураном (каждого по 15 мл,5 циклов). Наконец, смолу промывают тетрагидрофураном (4 х 15 мл) и сушат в вакууме(55 С, 12 ч, 2,1 г). Аликвоту этого вещества (120 мг, примерно 0,08 ммоль) и 4-метилфенилгидразина гидрохлорид (примерно 40 мг, 0,20 ммоль) смешивают в реакционной трубке. Добавляют 0,5 М раствор безводного хлорида цинка в уксусной кислоте (1,5 мл) и реакционную трубку герметично закрывают. Реакционную смесь перемешивают в течение 12 ч при 75 С. После охлаждения до комнатной температуры реакционную смесь фильтруют и смолу промывают диметилсульфоксидом (1,5 мл). К объединенным фильтратам добавляют насыщенный водный раствор бикарбоната натрия (1,5 мл). Раствор загружают в колонку хроматографии с обращенной фазой (С-18, 1 г, Varian Mega BondElut, Chrompack, кат.220508), предварительно кондиционированную метанолом (3 мл) и водой (3 мл). Колонку промывают водой (4 мл) и продукт элюируют метанолом (4,5 мл). После выпаривания легколетучих растворителей продукт очищают препаративной ВЭЖХ с обращенной фазой. Полученный раствор загружают в ионообменную колонку (SCX, 1 г, Varian Меgа Bond Elut, Chrompack номер по кат. 220776), предварительно кондиционированную 10% раствором уксусной кислоты в метаноле (3 мл) и колонку промывают метанолом (4 мл) и ацетонитрилом (4 мл), затем элюируют 4 н раствором аммиака в метаноле (4,5 мл). Выпаривание легколетучих растворителей приводит к получению указанного в заголовке соединения(13 а) в виде бесцветного масла (2 мг, 4 мкмоль,5%); 30 ЖХ/МС (m/z) 494 (МН+), Rt=4,44, чистота: 93%. Аналогично получают следующие соединения. 1-[3-2-(5-Фтор-1 Н-индол-3-ил)этил](14 а). Раствор/суспензию 1-(3-хлорпропил)-1-(4 фторфенил)-1,3-дигидроизобензофуран-5-карбонитрила (20 г, 35 ммоль, 80% чистота) и йодид натрия (285 г, 1,9 моль) в сухом ацетоне (200 мл) кипятят с обратным холодильником в течение 24 ч. Смесь упаривают и распределяют между эфиром и водой. Эфирный слой отделяют и промывают последовательно водой и насыщенным раствором соли. Органический экстракт сушат над безводным сульфатом магния,фильтруют и упаривают, в результате получают 1-(3-йодпропил)-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (25,8 г, 99%, чистота 80%) в виде густого масла; 1(д, 1 Н), 7,51 (с, 1 Н), 7,62 (дк, 1 Н). Аналогично получают следующие соединения. 1-(2-Йодэтил)-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил (14b): желтое масло; 1(12,9 г, 30 ммоль, чистота 8%) в этаноле (150 мл) порциями добавляют раствор этиламина(20,3 г, 450 ммоль) в ТГФ (50 мл) и смесь перемешивают в течение ночи. Раствор упаривают и растворяют/суспендируют в воде. Значение рН доводят до 12 с помощью водного гидроксида натрия (2 М) и смесь экстрагируют эфиром. Органический экстракт промывают насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и выпаривают, получают масло. Это масло очищают хроматографией на силикагеле, используя в качестве элюента сначала 50% (об./об.) смесь этилацетат/гептан,затем 10% об./об. триэтиламин/40% об./об. этилацетат/гептан и наконец 20% об./об. триэтиламин/этилацетат, получают указанное в заголовке соединение (5,52 г, 57%) в виде бледно-желтого масла; 1(ддт, 1 Н). Аналогично получают следующие соединения. 1-(2-(Метиламино)этил)-1-(4-фторфенил)1,3-дигидроизобензофуран-5-карбонитрил (15b): желтое масло; 1(т, 2 Н), 7,34-7,46 (м, 3 Н), 7,49 (с, 1 Н), 7,59 (д,1 Н). Фармакологические испытания Сродство соединений данного изобретения к 5-НТ 1A рецепторам определяют измерением ингибирования связывания радиоактивного лиганда с 5-HT1A рецепторами, как описано в приведенных далее опытах. Ингибирование 3 Н-5-СТ связывания с 5HT1A рецепторами человека. Данным способом ингибирование лекарственными средствами связывания 5-HT1 А агониста 3 Н-5-карбоксамидотриптамина (3 Н-5-СТ) с клонированными 5-HT1 А рецепторами человека,стабильно экспрессированными в трансфицированных клетках Гела (НА 7), определяют в опыте in vitro (Fargin, A. et al., J. Biol. Chem., 1989,264, 14848). Опыт проводится как модификация способа, описанного в публикации Harrington,M.A. et al, J. Pharmacol. Exp. Ther., 1994, 268,1098. 5-HT1A рецепторы человека (40 мкг клеточного гомогената) инкубируют в течение 15 мин при 37 С в 50 мМ Tris-буфера при рН 7,7 в присутствии 3 Н-5-СТ. Неспецифическое связывание определяют включением 10 мкМ метерголина. Реакцию заканчивают быстрым фильт 003781 34 рованием через фильтры Unifilter GF/D на харвестере Tomtec Cell Harvester. Количество клеток на фильтрах подсчитывают на счетчикеPackard Top Counter. Полученные результаты представлены в таблице ниже. Соединения данного изобретения также испытывают на их влияние на повторное поглощение серотонина в следующем опыте. Ингибирование 3H-5-HT поглощения в синаптосомах мозга крысы С помощью данного метода определяетсяin vitro способность лекарственных средств ингибировать аккумулирование 3 Н-5-НТ в цельных синаптосомах мозга крысы. Испытание проводят в соответствии с описанием, приведенным в публикации Hyttel, J., Psychopharmacology, 1978, 60, 13. Полученные результаты представлены в таблице. Ингибирование 3 НСоеди- 5-CT связывания нение Ингибирование повторного поглощения серотонинаIС 50, нМ 60 13 85 340 40 15 14 20 9,7 Не испытывалось Не испытывалось 31 54 59% инг. при 100 нМ 4% инг. при 100 нМ 7% инг. при 100 нМ 160 4% инг. при 100 нМ 28% инг. при 100 нМ 69 26% инг. при 100 нМ 78 100 27% инг. при 100 нМ 74% инг. при 100 нМ 39% инг. при 100 нМ 73 6% инг. при 100 нМ 60% инг. при 100 нМ 19% инг. при 100 нМ 35 73% инг. при 100 нМ 44% инг. при 100 нМ 10 17 12 35 12f 4,7 13 12i 27 20 12j 7,9 14 12k 3,6 8,4 12o 6,2 49% инг. при 100 нМ 12p 19 11 12q 12 6,3 12r 16 47% инг. при 100 нМ 12s 7,7 18 12u 9,0 22 12v 39 12 12x 14 50% инг. при 100 нМ 12aa 16 37% инг. при 100 нМ 12ab 20 50% инг. при 100 нМ 12ad 21 35% инг. при 100 нМ 12ae 11 49% инг. при 100 нМ 12af 31 38% инг. при 100 нМ 13b 7,4 44 13c 9,6 12 13d 15 21 13e 22 27 13f 31 16% инг. при 100 нМ 13g 18 49% инг. при 100 нМ 13j 16 61% инг. при 100 нМ 13k 19 Не испытывалось 13p 23 Не испытывалось 13q 12 Не испытывалось 13r 8,9 Не испытывалось 13t 23 Не испытывалось 13u 22 Не испытывалось 13v 23 Не испытывалось 13x 26 Не испытывалось Пин 100 долол Паро 0,29 ксетинКонтрольные соединения таблицы Кроме того, 5-HT1A антагонистическая активность некоторых соединений данного изобретения оценивалась in vitro на клонированных 5-HT1A рецепторах, стабильно экспрессированных в трансфицированных клетках Гела (НА 7). В этом опыте 5-HT1A антагонистическая активность оценивается измерением способности соединений противостоять 5-НТ индуцированному ингибированию форсколин-индуцированной аккумуляции циклического аденозинмонофосфата. Этот анализ осуществляли как модификацию способа, описанного Pauwels, P.J. et al.,Biochem. Pharmacol. 1993, 45, 375. Из приведенных выше результатов видно,что соединения данного изобретения проявляют сродство к 5-HT1A рецептору. Поэтому считается, что многие соединения данного изобретения обладают ценной активностью ингибиторов повторного поглощения серотонина. Соответственно, соединения считаются полезными для лечения психических и неврологических расстройств, которые перечислены выше. 36 Фармацевтический препарат Фармацевтические препараты изобретения могут быть получены стандартными методами. Например, таблетки могут быть получены смешением активного ингредиента с обычными адъювантами и/или наполнителями и последующим прессованием на стандартном устройстве для таблетирования. Примеры адъювантов или наполнителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, смолы и т.п. Могут применяться и любые другие адъюванты или добавки, обычно используемые для таких целей как окрашивание, придание приятного вкуса,консервация и т.д., при условии, что они совместимы с активными ингредиентами. Растворы для инъекций могут быть получены растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно в стерильной воде,доведением объема раствора до нужного значения, стерилизацией раствора и наполнением этим раствором подходящих ампул или пробирок. Может добавляться любая подходящая добавка, обычно используемая в таких препаратах,например средства регулирования тоничности,консерванты, антиоксиданты и т.д. Фармацевтические композиции данного изобретения или композиции, которые производятся в соответствии с данным изобретением,могут вводиться любым подходящим способом,например перорально в форме таблеток, капсул,порошков, сиропов и т.д., или парентерально в форме растворов для инъекций. Для получения таких композиций могут использоваться хорошо известные способы, а также любые фармацевтически приемлемые носители, наполнители,разбавители или другие добавки, обычно используемые для этих целей. Обычно, соединения данного изобретения вводятся в виде стандартной дозированной лекарственной формы, содержащей указанные соединения в количестве примерно от 0,01 до 1000 мг. Общая ежедневная доза обычно находится в интервале примерно 0,05-500 мг и наиболее предпочтительно примерно от 0,1 до 50 мг активного соединения данного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Изобензофуран общей формулы Im равно 0 или 1; А выбран из следующих групп:C1-6-алкил-О-aрил,D представляет собой пространственную группу, выбранную из C1-6-алкилена, С 2-6-алкенилена и С 2-6-алкинилена с прямыми или разветвленными цепями; В представляет собой группу, выбранную из группы формул (II), (III) и (IV) где R5, R6, R7, R8, R9 и R10, каждый независимо,выбраны из заместителей R1; или R8 и R9 вместе образуют конденсированное 5- или 6-членное кольцо, необязательно содержащее дополнительные гетероатомы; и образующийся гетероцикл необязательно замещен заместителями, выбранными среди заместителей R1; или две группы из R5, R6 и R7 соединены вместе с образованием -O-(СН 2)р-O- мостика,где р равно 1 или 2; Аr и aрил независимо выбраны из группы,включающей фенил, 2-тиенил, 3-тиенил, 2 фуранил, 3-фуранил, 2-пиримидил, 1-индолил,2-индолил, 3-индолил, 1-индол-2-онил, 3-индол 2-онил, 2- или 3-бензофуранил, 2- или 3 бензотиофенил, 1-нафтил или 2-нафтил, каждый из которых необязательно замещен галогеном,C1-6-алкилом, C1-6-алкокси, C1-6-алкилтио, гидрокси, C1-6-алкилсульфонилом, циано, трифторметилом, трифторметилсульфонилокси, С 3-8 циклоалкилом,С 3-8-циклоалкил-С 1-6-алкилом,нитро, амино, C1-6-алкиламино, C2-12-диaлкилaминo, ациламино или алкилендиокси; его энантиомеры и фармацевтически приемлемая кислотно-аддитивная соль. 2. Соединение по п.1, отличающееся тем,что А представляет собой группу формулы (1). 3. Соединение по п.1, отличающееся тем,что А представляет собой группу формулы (2). 4. Соединение по п.1, отличающееся тем,что А представляет собой группу формулы (3). 38 5. Соединение по п.1, отличающееся тем,что А представляет собой группу формулы (4). 6. Соединение по п.2, отличающееся тем,что R4 представляет собой метил, этил, пропил,2-пропен-1-ил, 2-фурилметил, 2-феноксиэтил. 7. Соединение по любому из пп.2-6, отличающееся тем, что q=0. 8. Соединение по любому из пп.2-6, отличающееся тем, что q=0 и Z представляет собой О. 9. Соединение по любому из пп.1-8, отличающееся тем, что В представляет собой группу формулы (II). 10. Соединение по любому из пп.1-8, отличающееся тем, что В представляет собой группу формулы (III). 11. Соединение по любому из пп.1-8, отличающееся тем, что В представляет собой группу формулы (IV). 12. Соединение по п.9, отличающееся тем,что, по меньшей мере, один из R5, R6 и R7 представляет собой метоксигруппу. 13. Соединение по п.9, отличающееся тем,что формула (II) представляет собой бензодиоксановую группу или 1,2-метилендиоксибензольную группу. 14. Соединение по п.10, отличающееся тем,что формула (III) представляет собой 3-индолил. 15. Соединение по п.14, отличающееся тем,что 3-индолил замещен в 5 положении метилом,фтором, хлором, бромом, йодом, трет-бутилом или изопропилом, или в 7 положении фтором,хлором или карбокси; или дизамещен 5,7 дифтором, 4-фтор-7-метилом или 4-хлор-7 метилом, или два заместителя вместе образуют пиридильное кольцо, конденсированное с 3 индолилом. 16. Соединение по п.11, отличающееся тем,что формула (IV) представляет собой 4-индолильную или 5-индолильную группу. 17. Соединение по любому из пп.1-16, отличающееся тем, что Аr представляет собой фенил или фенил, замещенный галогеном или СF3. 18. Соединение по п.17, отличающееся тем,что Аr представляет собой фенил, который может быть замещенным Сl или F в 4 положении или Сl или СF3 в 3 положении. 19. Соединение по любому из пп.1-18, отличающееся тем, что R1 представляет собой Н,CN или F в 5 положении изобензофурановой группы. 20. Соединение по любому из пп.1-19, отличающееся тем, что R2 и R3 выбраны из водорода или метила. 21. Соединение по любому из пп.1-20, отличающееся тем, что n=2, 3 или 4. 22. Соединение по п.21, отличающееся тем,что n=3. 23. Соединение по пп.1-22, отличающееся тем, что m=0. 39 24. Соединение по любому из пп.1, 18, 19,20, 21, 22 и 23, отличающееся тем, что R2 и R3 оба представляют собой водород; R1 представляет собой Н, CN или F в 5 положении изобензофурановой группы и Аr представляет собой фенил, который может быть замещенным F или Сl в 4 положении, либо Сl или СF3 в 3 положении. 25. Соединение по любому из пп.1 и 24,отличающееся тем, что А представляет собой группу формулы (1); q=0; R4 представляет собой метил; D представляет собой пропилен; m=0 и В представляет собой 1,4-бензодиоксановую группу формулы (II), присоединенную в 5 положении. 26. Соединение по любому из пп.1 и 24,отличающееся тем, что А представляет собой группу формулы (1); R4 представляет собой СН 3 или проп-2-ен-1-ил; n=3; D представляет собой этилен или пропилен и В представляет собой фенильную группу, в которой, по меньшей мере, одним заместителем является ОМе. 27. Соединение по любому из пп.1 и 24,отличающееся тем, что А представляет собой группу формулы (1); q=0; R4 представляет собой метил, этил, пропил, 2-пропен-1-ил, 2 фурилметил или 2-феноксиэтил; D представляет собой этилен или пропилен; m=0 и В представляет собой индолильную группу формулы (III). 28. Соединение по п.27, отличающееся тем,что 3-индолильная группа замещена метилом,фтором, хлором, бромом, йодом, трет-бутилом или изопропилом в положении 5; или фтором,хлором или карбоксильной группой в 7 положении; или 5,7-дифтором, 4-фтор-7-метилом или 4-хлор-7-метилом; или два заместителя вместе образуют пиридильное кольцо, конденсированное с 3-индолильной группой. 29. Соединение по любому из пп.1 и 24,отличающееся тем, что А представляет собой группу формулы (2) и (3); n=3; m=0 и В представляет собой 4- или 5-индолильную группу формулы (IV), в которой R10 представляет собой водород; R1 представляет собой CN в 5 положении изобензофурана и Аr представляет собой 4 фторфенил. 30. Соединение по п.1, которое представляет собой(2-феноксиэтил)амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,1-[3-4-(5-пирроло[3,2-h]-1 Н-хинолин-3 ил)бутил]-2-фурилметиламино]пропил]-1-(4 фторфенил)-1,3-дигидроизобензофуран-5 карбонитрил,1-[3-[2-феноксиэтил[2-[5-(2-пропил)-1Hиндол-3-ил]этил]амино]пропил]-1-(4-фторфенил)-1,3-дигидроизобензофуран-5-карбонитрил,1-[3-2-(5-бром-1 Н-индол-3-ил)этил](2 феноксиэтил)амино]пропил]-1-(4-фторфенил)1,3-дигидроизобензофуран-5-карбонитрил,или его кислотно-аддитивная соль. 31. Фармацевтическая композиция, включающая соединение по пп.1-30 или его фармацевтически приемлемую кислотно-аддитивную соль и, по меньшей мере, один фармацевтически приемлемый носитель или разбавитель. 32. Применение соединения по пп.1-30 или его фармацевтически приемлемой кислотноаддитивной соли для получения лекарственного средства для лечения расстройства или заболевания, чувствительного к действию 5-HT1A-рецепторов. 33. Применение соединения по п.32, где лекарственное средство предназначено для ле 46 чения депрессии, психоза, расстройств, связанных с состоянием страха, панического расстройства, обсессивно-компульсивного расстройства, расстройства импульсивного контроля, алкогольного злоупотребления, агрессии,ишемии, старческого слабоумия, сердечнососудистых расстройств и социальной фобии. 34. Способ лечения заболевания или расстройства живого организма животного, в том числе человека, которое чувствительно к действию 5-HT1A-рецепторов, включающий введение такому живому организму животного, в том числе человека, терапевтически эффективного количества соединения по пп.1-30 или его фармацевтически приемлемой кислотноаддитивной соли. 35. Способ лечения по п.34, где расстройство или заболевание представляет собой депрессию, психоз, расстройства, связанные с состоянием страха, паническое расстройство, обсессивно-компульсивное расстройство, расстройство импульсивного контроля, алкогольное злоупотребление, агрессию, ишемию, старческое слабоумие, сердечно-сосудистые расстройства или социальную фобию.
МПК / Метки
МПК: A61K 31/343, C07D 307/87
Метки: получение, бензофурана, применение, производные
Код ссылки
<a href="https://eas.patents.su/24-3781-proizvodnye-benzofurana-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензофурана, их получение и применение</a>
Предыдущий патент: Фенилфенантридины с ингибирующей фдэ-4 активностью
Случайный патент: Броневая защита для покрытия боковой стенки шредера для автомобилей, шредер и ротор для шредера