Модуляторы метаболизма и лечение связанных с ним расстройств
Формула / Реферат
1. Соединение, выбранное из соединений формулы (I)
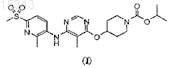
и их фармацевтически приемлемых солей, сольватов и гидратов.
2. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
3. Способ лечения связанного с метаболизмом расстройства у индивидуума, включающий введение указанному индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2.
4. Способ по п.3, в котором указанное связанное с метаболизмом расстройство выбрано из группы, состоящей из диабета I типа, диабета II типа, нарушенной глюкозотолерантности, инсулинорезистентности, гипергликемии, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии или синдрома X.
5. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является диабет II типа.
6. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является гипергликемия.
7. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является гиперлипидемия.
8. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является гипертриглицеридемия.
9. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является диабет I типа.
10. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является дислипидемия.
11. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является синдром X.
12. Способ по любому из пп.3-11, в котором указанный индивидуум представляет собой млекопитающее.
13. Способ по п.12, в котором указанное млекопитающее представляет собой человека.
14. Способ лечения ожирения у индивидуума, включающий введение указанному индивидууму, нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2.
15. Способ снижения потребления пищи индивидуумом, включающий введение указанному индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2.
16. Способ индуцирования чувства насыщения у индивидуума, включающий введение указанному индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2.
17. Способ контроля или снижения набора веса индивидуумом, включающий в себя введение указанному индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2.
18. Способ по любому из пп.15-17, в котором указанный индивидуум представляет собой млекопитающее.
19. Способ по п.18, в котором указанное млекопитающее представляет собой человека.
20. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 18,5 до примерно 45.
21. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 25 до примерно 45.
22. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 30 до примерно 45.
23. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 35 до примерно 45.
24. Применение соединения по п.1 для получения лекарственного препарата для лечения связанного с метаболизмом расстройства.
25. Применение соединения по п.1 для получения лекарственного препарата для лечения диабета I типа, диабета II типа, нарушенной глюкозотолерантности, инсулинорезистентности, гипергликемии, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии или синдрома X.
26. Применение соединения по п.1 для получения лекарственного препарата для снижения потребления пищи у индивидуума.
27. Применение соединения по п.1 для получения лекарственного препарата для индуцирования чувства насыщения у индивидуума.
28. Применение соединения по п.1 для получения лекарственного препарата для контроля или снижения набора веса у индивидуума.
29. Применение по любому из пп.26-28, в котором указанный индивидуум представляет собой млекопитающее.
30. Применение по п.29, в котором указанное млекопитающее представляет собой человека.
31. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 18,5 до примерно 45.
32. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 25 до примерно 45.
33. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 30 до примерно 45.
34. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 35 до примерно 45.
35. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 и фармацевтически приемлемого носителя.
Текст
Настоящее изобретение относится к изопропиловому эфиру 4-[6-(6-метансульфонил-2 метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, его фармацевтически приемлемым солям, сольватам и гидратам, которые являются модуляторами метаболизма глюкозы. Соответственно, соединения по настоящему изобретению пригодны для лечения связанных с метаболизмом расстройств и их осложнений, таких как диабет и ожирение. 015343 Область техники Настоящее изобретение относится к изопропиловому эфиру 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метил-пиримидин-4-илокси]пиперидин-1-карбоновой кислоты и его фармацевтически приемлемым солям, сольватам и гидратам, которые являются модуляторами метаболизма глюкозы. Соответственно, соединения по настоящему изобретению пригодны для лечения связанных с метаболизмом расстройств и их осложнений, таких как диабет и ожирение. Предпосылки изобретения Сахарный диабет является серьезной болезнью, затрагивающей более 100 миллионов людей в мире. В Соединенных Штатах диабетом больны более 12 млн человек, а каждый год регистрируется 600000 новых случаев болезни. Сахарный диабет является диагностическим термином для группы расстройств, отличающихся анормальным гомеостазом глюкозы, приводящим к повышенному содержанию сахара в крови. Существует множество типов диабета, но двумя наиболее распространенными являются диабет I типа (также называемый инсулинзависимым сахарным диабетом или ИЗСД) и диабет II типа (также называемый неинсулинзависимым сахарным диабетом или НИЗСД). Этиология разных типов диабета неодинакова; однако у людей с диабетом есть два общих признака: избыточное производство глюкозы в печени и неспособность переместить глюкозу из крови в клетки,где она становится основным питанием для организма. У людей, не имеющих диабета, перенос глюкозы из крови в клетки организма осуществляется при помощи инсулина, гормона, производимого поджелудочной железой. Однако в организме людей с диабетом инсулин или не производится, или их организм не может эффективно использовать производимый инсулин; поэтому в их организме глюкоза не переносится в клетки. Происходит накопление глюкозы в крови, и возникает состояние, называемое гипергликемией, а с течением времени это может вызвать серьезные проблемы со здоровьем. Диабет представляет собой синдром с несвязанными метаболической, сосудистой и нейропатической составляющими. Метаболический синдром, обычно отличающийся гипергликемией, включает в себя изменения углеводного, жирового и белкового метаболизма, вызванные значительно сниженной секрецией инсулина и/или неэффективным действием инсулина. В васкулярный синдром входят аномалии кровяных сосудов, которые приводят к сердечно-сосудистым, почечным осложнениям и осложнениям на сетчатке. Также частью диабетического синдрома являются аномалии в периферической и вегетативной нервной системе. От 5 до 10% людей с диабетом имеют инсулинзависимый сахарный диабет. У этих людей инсулин не вырабатывается, и поэтому для поддержания нормального уровня глюкозы они должны вводить его при помощи инъекций. ИЗСД отличатся низким или недетектируемым уровнем продукции эндогенного инсулина, вызванным разрушением -клеток поджелудочной железы, эта характеристика является наиболее точным отличием ИЗСД и НИЗСД. ИЗСД, когда-то названный юношеским диабетом, поражает молодых и пожилых людей одинаково. Приблизительно от 90 до 95% людей с диабетом имеют II тип диабета (или НИЗСД). У людей с НИЗСД инсулин продуцируется, но клетки организма резистентны к инсулину: они не отвечают правильно на гормон, так что глюкоза накапливается в крови. НИЗСД отличается относительным несоответствием между эндогенной продукцией инсулина и необходимостью в нем, что приводит к повышенному уровню глюкозы в крови. В отличие от ИЗСД при НИЗСД всегда присутствует некоторая эндогенная продукция инсулина; многие пациенты с НИЗСД имеют нормальный или даже повышенный уровень инсулина в крови, в то время как другие пациенты с НИЗСД имеют нарушенную продукцию инсулина(Rotwein, R. et al. N. Engl. J. Med. 308, 65-71 (1983. Возраст большинства людей с диагнозом НИЗСД составляет 30 лет или больше, а в половине новых случаев возраст составляет 55 лет или больше. По сравнению с белой и азиатской расами НИЗСД более распространен среди коренных жителей Северной Америки, американцев африканского происхождения, выходцев из стран Латинской Америки и испаноговорящих жителей Америки. В дополнение, начало болезни может быть незаметно или не иметь клинических проявлений, что затрудняет диагностику. Первичное патологическое изменение при НИЗСД остается неизвестным. Большинство предполагает, что начальным событием является первичная инсулинорезистентность периферических тканей. Эту точку зрения подтверждают генетические эпидемиологические исследования. Аналогичным образом,дискутируется, что нарушения секреции инсулина являются первичным нарушением при НИЗСД. Вероятно, что оба явления вносят важный вклад в развитие заболевания (Rimoin, D. L., et. al. Emery and Rimoin's Principles and Practice of Medical Genetics 3rd Ed. 1:1401-1402 (1996. Многие люди с НИЗСД ведут сидячий образ жизни и имеют ожирение: их вес составляет на 20% больше от рекомендованного веса для их роста и сложения. Кроме того, ожирение характеризуется гиперинсулинемией и инсулинорезистентностью, признаками гипертонии и атеросклероза, характерными для НИЗСД. В индустриальных обществах ожирение и диабет находятся среди наиболее часто встречающихся проблем со здоровьем. В индустриальных странах по меньшей мере треть популяции имеет избыточный-1 015343 вес. В Соединенных Штатах процент полных людей увеличился с 25% в конце 1970-х до 33% в начале 1990-х. Ожирение является одним из наиболее важных факторов риска для НИЗСД. Определения ожирения различаются между собой, но в общем считается, что субъект, вес которого по меньшей мере на 20% больше рекомендованного веса для его/ее веса и сложения, имеет ожирение. Риск развития НИЗСД утраивается у людей с 30% избыточным весом, а три четверти людей с НИЗСД имеют избыточный вес. Ожирение, которое является результатом нарушения баланса между потреблением калорий и расходом энергии, сильно коррелирует с инсулинорезистентностью и диабетом у экспериментальных животных и у людей. Однако молекулярные механизмы, вовлеченные в синдромы, связанные с ожирением/диабетом, неясны. В течение раннего развития ожирения, увеличенная секреция инсулина уравновешивает инсулинорезистентность и защищает пациентов от гипергликемии (Le Stunff, et al. Diabetes 43,696-702 (1989. Однако после нескольких десятков лет -клетки начинают хуже функционировать, и у около 20% людей из популяции с избыточным весом развивается неинсулинзависимый диабет (Pederson,P. Diab. Metab. Rev. 5, 505-509 (1989 и (Brancati, F. L., et al., Arch. Intern. Med. 159, 957-963 (1999. При том что ожирение значительно распространено в современных обществах, оно, таким образом, становится ведущим фактором риска для НИЗСД (Hill, J. O., et al., Science 280, 1371-1374 (1998. Однако факторы, которые вызывают предрасположенность части пациентов к изменению в секреции инсулина в ответ на накопление жира, остаются неизвестными. Классификацию человека, как индивидуума с избыточным весом или с ожирением, обычно проводят на основе его индекса массы тела (ИМТ), который вычисляют, разделяя вес тела (в кг) на квадрат роста (м 2). Поэтому единицей ИМТ является кг/м 2, и возможно вычислить предел ИМТ, ассоциированный с минимальной смертностью в каждые десять лет жизни. Наличие избыточного веса определяется ИМТ в пределах 25-30 кг/м 2, а ожирениеИМТ выше 30 кг/м 2 (см. таблицу ниже). У этого определения есть проблемы в том, что оно не принимает во внимание соотношение в массе тела мускулов относительно жира (жировой ткани). Для учета этого, ожирение также определяется на основе содержания жира в организме: больше 25 и 30% у мужчин и женщин, соответственно. Классификация веса по индексу массы тела (ИМТ) С увеличением ИМТ увеличивается риск смерти от различных причин, независимых от других факторов риска. Наиболее распространенными заболеваниями при ожирении являются сердечно-сосудистые заболевания (в частности, гипертензия), диабет (ожирение ускоряет развитие диабета), болезни желчного пузыря (в частности, рак) и болезни репродуктивных органов. Исследования показали, что даже небольшое уменьшение веса может соответствовать значительному снижению риска развития коронарной болезни сердца. Ожирение также существенно увеличивает риск развития сердечно-сосудистых заболеваний. Коронарная недостаточность, атероматозная болезнь и сердечная недостаточность являются первыми сердечно-сосудистыми осложнениями, вызываемыми ожирением. Предполагают, что если бы вся популяция имела идеальный вес, то риск коронарной недостаточности снизился бы на 25%, а риск сердечной недостаточности и церебрально-сосудистых расстройств на 35%. Частота возникновения коронарных болезней удвоена у субъектов младше 50 лет, вес которых на 30% превышает норму. У пациентов с диабетом продолжительность жизни меньше на 30%. После 45 лет у людей с диабетом в примерно три раза более вероятно, чем у людей без диабета, наличие выраженного заболевания сердца и до пяти раз более вероятно- инсульта. Эти данные подчеркивают внутреннее взаимодействие между факторами риска для НИЗСД и коронарной болезнью сердца, и потенциальным значением объединенного подхода для предупреждения этих состояний (Perry, I. J., et al., BMJ 310, 560-564 (1995. Диабет также вовлечен в развитие болезни почек, глазных болезней и проблем с нервной системой. Болезнь почек, также называемая нефропатией, возникает при повреждении фильтрующего механизма почек, белки попадают в мочу в избыточном количестве, и в итоге происходит отказ в работе почек. Диабет также является лидирующей причиной повреждения сетчатки на внутренней стороне глаза и увеличивает риск катаракты и глаукомы. Наконец, диабет связан с повреждением нервов, особенно в ногах и ступнях, которое нарушает способность чувствовать боль и способствует серьезным инфекциям. Все вместе, осложнения после диабета являются одной из главных причин смерти нации.-2 015343 Краткое изложение сущности изобретения Настоящее изобретение касается соединений, которые связывают и модулируют активность GPCR(рецептор, связанный с G-белком), именуемого в настоящем описании как RUP3, и их применения. Термин RUP3, используемый в настоящем описании, включает последовательности человека, найденные в базе данных GeneBank под номером доступа AY288416, природные аллельные варианты, ортологи млекопитающих и их рекомбинантные мутанты. Предпочтительный RUP3 человека для применения в скрининге и тестировании соединений по изобретению предоставлен в нуклеотидной последовательностиSeq. ID.No:1, а соответствующая аминокислотная последовательность в Seq. ID.No:2, которые можно найти в РСТ заявкеWO2005/007647. Один аспект настоящего изобретения касается соединения изопропилового эфира 4-[6-(6 метансульфонил-2-метилпиридин-3-иламино)-5-метил-пиримидин-4-илокси]пиперидин-1-карбоновой кислоты, описываемого формулой (I) и его фармацевтически приемлемых солей, сольватов и гидратов. Один аспект настоящего изобретения касается фармацевтических композиций, содержащих соединение по настоящему изобретению и фармацевтически приемлемый носитель. Один аспект настоящего изобретения касается способов лечения связанных с метаболизмом расстройств у индивидуума, включающих в себя введение нуждающемуся в таком лечении индивидууму терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции. Один аспект настоящего изобретения касается способов лечения ожирения у индивидуума, включающих в себя введение нуждающемуся в таком лечении индивидууму терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции. Один аспект настоящего изобретения касается способов снижения потребления пищи индивидуумом, включающих в себя введение нуждающемуся в этом индивидууму терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции. Один аспект настоящего изобретения касается способов индуцирования чувства насыщения у индивидуума, включающих в себя введение нуждающемуся в этом индивидууму терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции. Один аспект настоящего изобретения касается способов контроля или снижения набора веса индивидуума, включающих в себя введение нуждающемуся в этом индивидууму терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтической композиции. Один аспект настоящего изобретения касается способов модулирования RUP3-рецептора у индивидуума, включающих в себя контактирование рецептора с соединением по настоящему изобретению. В некоторых вариантах осуществления изобретения соединение является агонистом RUP3-рецептора. Некоторые варианты осуществления настоящего изобретения включают способы модулированияRUP3-рецептора для лечения связанного с метаболизмом расстройства. Некоторые варианты осуществления настоящего изобретения включают способы модулированияRUP3-рецептора у индивидуума, включающие в себя контактирование рецептора с соединением по настоящему изобретению, где модулирование RUP3-рецептора снижает потребление пищи индивидуумом. Некоторые варианты осуществления настоящего изобретения включают способы модулированияRUP3-рецептора у индивидуума, включающие в себя контактирование рецептора с соединением по настоящему изобретению, где модулирование RUP3-рецептора вызывает чувство насыщения у индивидуума. Некоторые варианты осуществления настоящего изобретения включают способы модулированияRUP3-рецептора у индивидуума, включающие в себя контактирование рецептора с соединением по настоящему изобретению, где модулирование RUP3-рецептора контролирует или снижает набор веса индивидуумом. Один аспект настоящего изобретения касается применения соединения по настоящему изобретению для получения лекарственного препарата, применяемого при лечении связанного с метаболизмом расстройства. Один аспект настоящего изобретения касается применения соединения по настоящему изобретению для получения лекарственного препарата, применяемого для снижения потребления пищи индивидуумом. Один аспект настоящего изобретения касается применения соединения по настоящему изобретению для получения лекарственного препарата, применяемого для индуцирования чувства насыщения у индивидуума.-3 015343 Один аспект настоящего изобретения касается применения соединения по настоящему изобретению для получения лекарственного препарата, применяемого для контроля или снижения набора веса индивидуума. Один аспект настоящего изобретения касается соединения по настоящему изобретению для применения в способе лечения организма человека или животного терапевтическим методом. Один аспект настоящего изобретения касается соединения по настоящему изобретению для применения в способе лечения связанного с метаболизмом расстройства организма человека или животного терапевтическим методом. В некоторых вариантах осуществления изобретения индивидуум является млекопитающим. В некоторых вариантах осуществления изобретения млекопитающим является человек. Некоторые варианты осуществления настоящего изобретения касаются случаев, в которых индекс массы тела человека составляет от примерно 18,5 до примерно 45. В некоторых вариантах осуществления изобретения индекс массы тела человека составляет от примерно 25 до примерно 45. В некоторых вариантах осуществления изобретения индекс массы тела человека составляет от примерно 30 до примерно 45. В некоторых вариантах осуществления изобретения индекс массы тела человека составляет от примерно 35 до примерно 45. В некоторых вариантах осуществления изобретения связанным с метаболизмом расстройством является диабет I типа, диабет II типа, нарушенная глюкозотолерантность, инсулинорезистентность, гипергликемия, гиперлипидемия, гипертриглицеридемия, гиперхолестеринемия, дислипидемия или синдром X. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой диабет II типа. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой гипергликемию. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой гиперлипидемию. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой гипертриглицеридемию. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой диабет I типа. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой дислипидемию. В некоторых вариантах осуществления изобретения связанное с метаболизмом расстройство представляет собой синдром X. Один аспект настоящего изобретения касается способов получения фармацевтических композиций,включающих в себя смешивание соединения по настоящему изобретению и фармацевтически приемлемого носителя. Авторы изобретения оставляют за собой право исключить одно или несколько соединений из любого варианта осуществления изобретения. Автор изобретения дополнительно оставляет за собой право исключить любое заболевание, состояние или расстройство из любого варианта осуществления изобретения. Краткое описание чертежей На фиг. 1 приведена зависимость площади под фармакокинетической кривой (AUC) от дозы при увеличении дозы для изопропилового эфира 4-[6-(6-метансульфонил-2-метил-пиридин-3-иламино)-5 метил-пиримидин-4-илокси]пиперидин-1-карбоновой кислоты (т.е. соединения формулы (I в сравнении с различными связывающими RUP3 соединениями, для подробного описания см. пример 5. Подробное описание изобретения При подробном описании изобретения использовали термины, определение которых дано ниже, если не указано иное. Агонист обозначает элемент, который взаимодействует с рецептором, таким как RUP3-рецептор,и активирует его, при этом вызывает физиологический или фармакологический ответ, характерный для этого рецептора. Например, когда элементы при связывании с рецептором активируют внутриклеточный ответ или усиливают связывание ГТФ с мембранами. Композиция обозначает материал, содержащий по меньшей мере два соединения или два компонента; неограничивающий пример фармацевтической композиции - это композиция, содержащая соединение по настоящему изобретению и фармацевтически приемлемый носитель. Контакт или контактирование обозначают объединение указанных элементов или в системе invitro, или в системе in vivo. Поэтому контактирование RUP3-рецептора с соединением по изобретению включает введение соединения по настоящему изобретению индивидууму, например человеку, имеющему RUP3-рецептор, а также, например, введение соединения по изобретению в образец, который содержит клеточный или более очищенный препарат, содержащий RUP3-рецептор. Используемый в настоящем описании термин нуждается в лечении относится к решению наблюдающего персонала (например, терапевта, медицинской сестры, дипломированной медицинской сестры и т.д. в случае людей; ветеринара в случае животных, включая млекопитающих, кроме человека), что индивидуум или животное нуждается в эффекте лечения. Это решение выносится на базе различных факторов, находящихся в компетенции специалиста, причем они включают сведения, что индивидуум нездоров или будет нездоров в результате болезни, состояния или расстройства, лечение которых может-4 015343 быть осуществлено при помощи соединений по изобретению. Термин лечение в альтернативном варианте относится также к профилактике. Поэтому, в общем термин нуждаться в лечении относится к решению наблюдающего персонала, что индивидуум уже нездоров, соответственно, соединения по настоящему изобретению используются, чтобы облегчить, ингибировать или ослабить течение болезни,состояние или расстройство. Кроме того, в альтернативном варианте фраза относится также к решению наблюдающего персонала, что индивидуум заболеет. В этом контексте, соединения по настоящему изобретению используют для защиты или профилактики. Используемый в настоящем описании термин индивидуум относится к любому животному, в одном варианте осуществления - к позвоночному, в другом варианте осуществления - к млекопитающему(как примату, так и не относящемуся к приматам), а примеры включают, но не ограничены этим, корову,лошадь, свинью, курицу, индейку, перепелку, кошку, собаку, мышь, крысу, кролика, морскую свинку,другого грызуна, обезьяну и т.п. В другом варианте осуществления изобретения индивидуум представляет собой человека, а в некоторых вариантах осуществления изобретения человек является младенцем,ребенком, подростком или взрослым. В одном варианте осуществления изобретения пациент имеет риск развития связанного с метаболизмом заболевания или расстройства. Пациенты в группе риска включают,но не ограничены этим, пациентов с наследственной историей связанного с метаболизмом заболевания или расстройства, или пациентов, по состоянию здоровья находящихся в группе риска, связанного с метаболизмом заболевания или расстройства. В другом варианте осуществления изобретения наблюдающий персонал или кто-либо, действующий под руководством наблюдающего персонала, определили, что пациент имеет связанное с метаболизмом заболевание или расстройство. Ингибировать или ингибирующий в связи с термином ответ должно означать, что присутствие соединения в отличие от его отсутствия снижает или предотвращает ответ. Используемые в настоящем описании термины модулировать или модулирующий должны относиться к увеличению или снижению количества, качества, ответа или эффекта определенной активности, функции или молекулы. Термин фармацевтическая композиция должен означать композицию, содержащую по меньшей мере одно соединение по настоящему изобретению и по меньшей мере один фармацевтически приемлемый наполнитель/носитель. Средние специалисты в данной области поймут и примут во внимание методики, подходящие для получения таких композиций. Используемый в настоящем описании термин терапевтически эффективное количество относится к количеству действующего соединения или фармацевтической композиции, которые вызывают биологический или лекарственный эффект в ткани, системе, у животного, индивидуума или человека, который наблюдается исследователем, ветеринаром, доктором медицины или другим клиницистом, который включает в себя одно или несколько из нижеследующих признаков: 1) предупреждение заболевания; например предупреждение заболевания, состояния или расстройства у индивидуума, который может иметь предрасположенность к заболеванию, состоянию или расстройству, но который еще не ощущал или у которого еще не проявлялись патологические или симптоматические признаки болезни; 2) ингибирование болезни, например ингибирование болезни, состояния или расстройства у индивидуума, который ощущает или у которого проявляются патологические или симптоматические признаки болезни, состояния или расстройства (т.е. остановка дальнейшего развития патологических и/или симптоматических признаков); и 3) ослабление болезни, например ослабление болезни, состояния или расстройства у индивидуума,который ощущает или у которого проявляются патологические или симптоматические признаки болезни,состояния или расстройства (т.е. изменение в лучшую сторону/снижение патологических и/или симптоматических признаков). Соединения по настоящему изобретению Соединение изопропиловый эфир 4-[6-(6-метансульфонил-2-метил-пиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, приведенное в формуле (I), является сильным агонистом RUP3-рецептора и способно понижать уровень глюкозы в крови в модели oGTT (в оральном глюкозотолерантном тесте). Кроме того, изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин 3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты также демонстрирует линейную фармакокинетику при увеличении дозы. Соединение изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты также проявляет улучшенные характеристики в отношении ферментов цитохромов P450. Поэтому настоящее изобретение относится к изопропиловому эфиру 4-[6-(6-метансульфонил-2 метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]-пиперидин-1-карбоновой кислоты и способам лечения связанных с RUP3-рецептором расстройств, например связанных с метаболизмом расстройств и их осложнений, таких как диабет и ожирение. Один аспект настоящего изобретения касается соединения изопропилового эфира 4-[6-(6-5 015343 метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, приведенного в формуле (I) и его фармацевтически приемлемых солей, сольватов и гидратов. Указания для лечения и способы лечения В дополнение к предыдущему эффекту применения соединений по настоящему изобретению, раскрытому в настоящем описании, соединения по изобретению применимы для лечения других заболеваний. Среди прочего, эти заболевания включают перечисленные ниже. Наиболее важной патологией при диабете II типа является нарушение инсулинового сигнального пути в тканях-мишенях инсулина (инсулинорезистентность) и неспособность клеток поджелудочной железы, продуцирующих инсулин, секретировать соответствующее количество инсулина в ответ на гипергликемию. Существующие на сегодняшний день методы лечения для последней проблемы включают ингибиторы АТФ-чувствительных калиевых каналов -клеток, в результате действия которых запускается высвобождение внутренних запасов инсулина, или введение экзогенного инсулина. Ни один из этих методов не позволяет точно нормализовать уровень глюкозы в крови, и при применении обоих методов присутствует риск развития гипогликемии. По этой причине огромный интерес привлекает разработка фармацевтических средств, действие которых зависит от глюкозы, т.е. веществ, действующих как усилители (потенциаторы) сигнала глюкозы. Физиологическая сигнальная система, функционирующая таким образом, описана подробно и включает кишечные пептиды GLP1, GIP и PACAP. Эти гормоны действуют через свои G-белок-связанные рецепторы для стимулирования продукции цАМФ в панкреатических клетках. Увеличение уровня цАМФ, по-видимому, не приводит к стимуляции высвобождения инсулина в ходе голодания или перед едой. Однако ряд биохимических мишеней цАМФ-сигнала, включая АМФчувствительный калиевый канал, потенциалзависимые калиевые каналы и механизм экзоцитоза, изменены таким образом, что секреция инсулина значительно усиливается в ответ на глюкозный стимул после еды. Соответственно, агонисты, новых, аналогично функционирующих -клеточных GPCR (G-белок связанных рецепторов), включая RUP3, также будут стимулировать высвобождение эндогенного инсулина и, соответственно, обеспечивать нормальный уровень глюкозы при диабете II типа. Также было установлено, что увеличенный, например, в результате стимуляции GLP1 уровень цАМФ усиливает пролиферацию -клеток, ингибирует смерть -клеток, и, таким образом, увеличивает массу островков (Лангерганса). Ожидается, что этот положительный эффект на количество -клеток будет благоприятен и при диабете II типа, где продуцируется недостаточное количество инсулина, и при диабете I типа, где -клетки разрушены в результате неадекватного аутоиммунного ответа. Некоторые GPCR -клеток, включая RUP3, также присутствуют в гипоталамусе, где они участвуют в модулировании чувства голода, насыщения, снижения потребления пищи, контроля или снижения веса и расхода энергии. Следовательно, при функционировании в области гипоталамуса, агонисты или обратные агонисты этих рецепторов снижают чувство голода, усиливают чувство насыщения и, таким образом, модулируют вес. Также точно установлено, что нарушения метаболизма отрицательно влияют на другие физиологические системы. Поэтому часто встречается параллельное развитие ряда болезненных состояний (например, диабета I типа, диабета II типа, неадекватной глюкозотолерантности, инсулинорезистентности, гипергликемии, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии, ожирения или сердечно-сосудистого заболевания в синдроме X) или болезней, которые очевидно возникают как вторичные после диабета (например, заболевание почек, периферическая нейропатия). Поэтому ожидается, что эффективное лечение диабетического состояния в свою очередь будет эффективно в отношении таких взаимосвязанных болезненных состояний. В некоторых вариантах осуществления настоящего изобретения связанным с метаболизмом расстройством является гиперлипидемия, диабет I типа, сахарный диабет II типа, идиопатический диабет I типа (тип Ib), латентный аутоиммунный диабет у взрослых людей (LADA), юношеский диабет II типа(EOD), юношеский атипический диабет (YOAD), диабет периода созревания у молодых людей (MODY),связанный с неправильным питанием диабет, гестационный диабет, коронарная болезнь сердца, ишемический инсульт, рестеноз после ангиопластики, заболевание периферических сосудов, перемежающаяся хромота, инфаркт миокарда (например, некроз и апоптоз), дислипидемия, липемия после приема пищи,состояния нарушенной глюкозотолерантности (IGT), состояния нарушенного уровня глюкозы натощак,метаболический ацидоз, кетоз, артрит, ожирение, остеопороз, гипертония, застойная сердечная недостаточность, гипертрофия левого желудочка, периферическая артериальная болезнь, диабетическая ретинопатия, дистрофия желтого пятна, катаракта, диабетическая нефропатия, гломерулосклероз, хроническая-6 015343 почечная недостаточность, диабетическая нейропатия, метаболический синдром, синдром X, предменструальный синдром, коронарная болезнь сердца, стенокардия, тромбоз, атеросклероз, инфаркт миокарда,транзиторный ишемический приступ, инсульт, рестеноз сосудов, гипергликемия, гиперинсулинемия,гиперлипидемия, гипертриглицеридемия, инсулинорезистентность, нарушенный метаболизм глюкозы,состояния нарушенной глюкозотолерантности, состояния нарушенного уровня глюкозы натощак, ожирение, эректильная дисфункция, заболевания кожи и соединительной ткани, образование язв на ногах и язвенный колит, нарушение функционирования эндотелия и нарушенная эластичность сосудов. Фармацевтические композиции и соли Дополнительный аспект настоящего изобретения касается фармацевтических композиций, содержащих изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4 илокси]пиперидин-1-карбоновой кислоты, формула (I), его фармацевтически приемлемую соль, сольват или гидрат и один или несколько фармацевтически приемлемых носителей. Некоторые варианты осуществления настоящего изобретения касаются фармацевтических композиций, содержащих изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1 карбоновой кислоты и фармацевтически приемлемый носитель. Некоторые варианты осуществления настоящего изобретения включают способ получения фармацевтической композиции, включающий в себя смешивание изопропилового эфира 4-[6-(6 метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя. Композиции можно получить любым подходящим способом, обычно смешивая до однородного состояния действующее соединение с жидкостями или тонко измельченными твердыми носителями, или с ними обоими в требуемом соотношении, а затем, при необходимости, придавая полученной смеси желаемую форму. Обычные эксципиенты, такие как связывающие агенты, заполнители, приемлемые увлажнители,лубриканты для таблетирования и дезинтегранты, можно использовать в таблетках и капсулах для перорального введения. Жидкие препараты для перорального введения могут представлять собой растворы,эмульсии, водные или масляные суспензии и сиропы. В качестве альтернативы препараты для перорального введения могут представлять собой сухой порошок, который перед использованием можно смешать с водой или другой подходящей жидкостью. В жидкие препараты можно вводить дополнительные добавки, такие как ресуспендирующие агенты или эмульгаторы, неводные носители (включая пищевые масла), консерванты, ароматизаторы и красители. Парентеральные дозированные формы можно получить растворением соединения по изобретению в подходящем жидком носителе и стерилизацией раствора через фильтр перед заполнением и запаиванием подходящих флакона или ампулы. Эти примеры всего лишь небольшая часть из множества известных в данной области подходящих способов получения дозированных форм. Специалистам в данной области известны методики, которые можно использовать для введения соединения по настоящему изобретению в фармацевтические композиции. В данной области, кроме упомянутых в настоящем описании, известны другие подходящие фармацевтически приемлемые носители; например, см. Remington, The Science and Practice of Pharmacy, 20th Edition, 2000, Lippincott WilliamsWilkins, (Editors: Gennaro, A. R., et al.). Хотя в качестве альтернативы возможно, что для применения в лечении соединение по изобретению можно вводить как неочищенное или очищенное химическое соединение, однако предпочтительными являются соединение или действующий ингредиент в виде фармацевтического препарата или фармацевтической композиции, дополнительно содержащих фармацевтически приемлемый носитель. Поэтому изобретение дополнительно относится к фармацевтическим композициям, содержащим соединение по изобретению или его фармацевтически приемлемую соль или производное вместе с одним или несколькими фармацевтически приемлемыми его носителями и/или профилактическими ингредиентами. Носитель (носители) должен быть приемлемым в том смысле, что он должен быть совместим с другими ингредиентами состава и не причинять вред получающему данный состав. Фармацевтические составы включают составы, подходящие для перорального, ректального, назального, местного (включая буккальное и сублингвальное), вагинального или парентерального (включая внутримышечное, подкожное и внутривенное) введения, или составы, подходящие для введения ингаляцией, инсуфляцией или посредством трансдермального пластыря. При использовании трансдермального пластыря лекарство поступает в организм с контролируемой скоростью благодаря эффективному способу представления лекарства для абсорбции с минимальной степенью его деградации. Обычно, трансдермальные пластыри включают в себя непроницаемый наружный слой, приклеивающийся при однократном нажатии материал и удаляемый защитный слой с пленкой. Средний специалист в данной области поймет и примет во внимание методики, подходящие для изготовления трансдермального пластыря с желаемой эффективностью, исходя из запросов изготовителя. Таким образом, соединения по изобретению вместе с обычным адъювантом, носителем или разбавителем можно ввести в фармацевтические составы и их стандартные лекарственные формы; и в таком виде их можно применять в виде твердых веществ, таких как таблетки или заполненные капсулы, или-7 015343 жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, гели или заполненные жидкостью капсулы, все для перорального применения; в виде суппозиториев для ректального введения; или в виде стерильных растворов для инъекций для парентерального (включая подкожное) применения. Такие фармацевтические композиции и их стандартные лекарственные формы могут включать в себя традиционные ингредиенты в обычных соотношениях, с или без дополнительных действующих соединений или активных компонентов; и такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество действующего ингредиента в соответствии с предполагаемым суточным диапазоном доз, который будет применяться. Для перорального введения фармацевтическая композиция может представлять собой, например,таблетки, капсулы, суспензии или жидкости. Предпочтительно изготавливать фармацевтическую композицию в виде единичной дозы, содержащей определенное количество действующего ингредиента. Примерами таких единичных доз являются капсулы, таблетки, порошки, гранулы или суспензии, с обычными добавками, такими как лактоза, маннит, кукурузный крахмал или картофельный крахмал; с связывающими веществами, такими как кристаллическая целлюлоза, производные целлюлозы, камедь, кукурузный крахмал или желатин; с дезинтегрантами, такими как кукурузный крахмал, картофельный крахмал или натриевая карбоксиметилцеллюлоза; и со смазками, такими как тальк или стеарат магния. Также действующий ингредиент можно вводить инъекцией как композицию, в которой, например, можно использовать физиологический раствор, декстрозу или воду в качестве фармацевтически приемлемого носителя. При использовании композиций по настоящему изобретению дозировка может варьировать в широких пределах, и как принято и известно терапевту, в каждом отдельном случае дозировка должна зависеть от индивидуальных условий. Дозировка зависит, например, от природы и тяжести заболевания, которое нужно лечить, от состояния пациента, от используемого соединения или от того, какое состояние болезни нужно лечить - острое или хроническое, или нужно провести профилактическое лечение, или от того, будут ли вводиться дополнительные действующие соединения, кроме соединений по настоящему изобретению. Например дозировки по настоящему изобретению включают, но не ограничены этим, от примерно 0,001 до примерно 5000 мг, от примерно 0,001 до примерно 2500 мг, от примерно 0,001 до примерно 1000 мг, от 0,001 до примерно 500 мг, от 0,001 до примерно 250 мг, от примерно 0,001 до 100 мг, от примерно 0,001 до примерно 50 мг и от примерно 0,001 до примерно 25 мг. Желаемую дозировку обычно можно представить в виде разовой дозы или в виде дробных доз, которые вводят через соответствующие интервалы, например, как две, три, четыре или больше дробных частей дозировки в день. Кроме того, дробную дозу можно разбить дополнительно, например, на ряд отдельных приемов с различными промежутками времени между ними. В зависимости от индивидуума и в зависимости от мнения лечащего терапевта или наблюдающего персонала может быть необходимо увеличение или снижение дозировок, описанных в настоящем документе. Требуемое для лечения количество соединения по изобретению или его фармацевтически приемлемой соли будет варьировать не только в зависимости от конкретной выбранной соли, но также и от пути введения, природы состояния, которое нужно лечить, и возраста и состояния пациента, и в конечном итоге это количество будет определять лечащий врач или клиницист по своему усмотрению. В общем,специалист понимает, как осуществить экстраполяцию данных in vivo, полученных в модельной системе,обычно, в животной модели, на другой объект, например, в отношении человека. Обычно, животные модели включают, но не ограничены этим, модель диабета у грызунов, описанную в примере 1, infra (а также другие животные модели, известные в данной области, такие как описанные Reed and Scribner вDiabetes, Obesity and Metabolism, 1, 1999, 75-86). При некоторых обстоятельствах эта экстраполяция может быть основана только на весе животного в соответствующей модели по сравнению с другим объектом, таким как млекопитающее, предпочтительно человек, однако более часто эти экстраполяции основаны не только на весе, но также включают ряд факторов. Репрезентативные факторы включают, но не ограничены этим, возраст, вес, пол, диету и медицинское состояние пациента; тяжесть заболевания; путь введения; фармакологические факторы, такие как активность, эффективность, фармакологические и токсикологические профили конкретного используемого соединения; используется ли система доставки лекарственного препарата; какое состояние болезни нужно лечитьострое или хроническое, или нужно провести профилактическое лечение; или вводятся ли в дополнение к соединениям по настоящему изобретению дополнительные действующие соединения и как часть лекарственной комбинации. Схему дозирования при лечении болезненного состояния соединениями и/или композициями этого изобретения выбирают в соответствии с приведенным выше набором факторов. Поэтому фактически применяемая схема дозирования может варьировать в широких пределах, и, следовательно, может отличаться от предпочтительной схемы дозирования, а специалисту в данной области будет ясно, что можно проводить тестирование дозировки и схемы дозирования вне этих обычных пределов и, если это целесообразно, то их можно использовать в способах по изобретению. Соединения по настоящему изобретению можно вводить в виде разнообразных пероральных и парентеральных лекарственных форм. Для специалиста в данной области будет очевидно, что следующие лекарственные формы могут содержать в качестве действующего компонента или соединение по изобре-8 015343 тению, или фармацевтически приемлемую соль соединения по изобретению. Для приготовления фармацевтических композиций из соединений по настоящему изобретению подходящий фармацевтически приемлемый носитель можно выбрать из твердого носителя, жидкого носителя или смеси обоих. Твердые формы включают порошки, таблетки, пилюли, капсулы, саше, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, которые могут также действовать в качестве разбавителей, ароматизаторов, солюбилизаторов,лубрикантов, суспендирующих агентов, связывающих веществ, консервантов, дезинтегрантов или в качестве инкапсулирующего материала. В порошках носитель представляет собой тонко измельченное твердое вещество, смешанное с тонко измельченным действующим компонентом. В таблетках действующий компонент смешан в соответствующих пропорциях с носителем, который имеет необходимую связывающую способность, а из этой смеси прессованием получены таблетки желаемой формы и размера. Порошки и таблетки могут содержать различное процентное соотношение действующего соединения. Репрезентативное количество соединения по изобретению, которое может содержаться в порошке или таблетке, составляет от 0,5 до примерно 90%; однако изготовитель будет знать, когда требуется количество, выходящее за эти пределы. Для порошков и таблеток подходящими носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, натриевая карбоксиметилцеллюлоза, легкоплавкий воск, масло какао и т.п. Подразумевается, что термин препарат включает составы действующего соединения с инкапсулирующим материалом в качестве носителя, т.е. капсулу, в которой действующий компонент с или без носителей окружен носителем, который, таким образом, ассоциирован с ним. Также включены саше и лекарственные леденцы. Таблетки, порошки, капсулы, пилюли, саше и лекарственные леденцы можно использовать в качестве твердых форм, подходящих для перорального введения. Для приготовления суппозиториев сначала растапливают легкоплавкий воск, например смесь глицеридов жирных кислот или масло какао, а потом в нем гомогенно распределяют действующий компонент, например, перемешиванием. Затем расплавленную гомогенную смесь заливают в стандартные формы, позволяют ей остыть, и, в результате этого, затвердеть. Рецептурные составы для вагинального введения могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей, содержащих в дополнение к действующему ингредиенту носители, которые подходят для применения в данной области. Жидкие формы включают растворы, суспензии и эмульсии, например водные растворы или растворы в смеси воды и пропиленгликоля. Например, парентеральные жидкие препараты для инъекций могут входить в состав как растворы в смеси воды и полиэтиленгликоля. Препараты для инъекций, например,стерильные водные или масляные суспензии для инъекций можно ввести в рецептурный состав известными способами, используя подходящие диспергирующие агенты или увлажнители, и ресуспендирующие агенты. Стерильный препарат для инъекций может также представлять собой стерильный раствор для инъекций или суспензию в нетоксичном разбавителе или растворителе, пригодном для парентерального применения, например, как раствор в 1,3-бутандиоле. Подходящими носителями и растворителями,которые можно использовать, являются вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение в качестве растворителя или среды для ресуспендирования обычно используются стерильные нелетучие масла. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. В дополнение, в препаратах для инъекций находят применение жирные кислоты, такие как олеиновая кислота. Таким образом соединения по настоящему изобретению могут входить в состав для парентерального введения (например, посредством инъекции, например, инъекции болюсом или продолжительной инфузии), и они могут быть представлены в стандартных дозах в ампулах, предварительно заполненных шприцах-тюбиках, препаратах для инфузии небольшого объема или находиться в контейнерах, содержащих множество доз с добавленным консервантом. Фармацевтические композиции могут иметь форму суспензий, растворов или эмульсий в среде масляного или водного носителя и могут содержать вспомогательные вещества, в том числе суспендирующие, стабилизирующие и/или диспергирующие агенты. В качестве альтернативы действующий ингредиент может представлять собой порошок, полученный выделением стерильного твердого вещества в асептических условиях или лиофилизацией из раствора, и перед использованием подлежащий смешиванию с подходящим носителем, например стерильной апирогенной водой. Подходящие для перорального применения водные составы можно получить, растворяя или ресуспендируя действующий компонент в воде и добавляя подходящие красители, ароматизаторы, стабилизаторы и загустители по желанию. Подходящие для перорального применения водные суспензии можно изготовить диспергированием тонко измельченного действующего компонента в воде с вязким веществом, таким как природные или синтетические каучуки, смолы, метилцеллюлоза, натриевая карбоксиметилцеллюлоза или другие хорошо известные ресуспендирующие агенты.-9 015343 Также включены твердые формы, применение которых подразумевает непосредственно перед использованием превращение их в жидкие формы для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. В дополнение к действующему компоненту эти препараты могут содержать красители, ароматизаторы, стабилизаторы, буферы, искусственные или природные подсластители, диспергирующие агенты, загустители, солюбилизаторы и т.п. Для местного введения в эпидермис соединения по изобретению могут входить в составы мазей,кремов или лосьонов, или они могут входить в состав трансдермального пластыря. Рецептурный состав мазей и кремов может быть, например, на водной или масляной основе с добавленными подходящими загустителями и/или желирующими агентами. Рецептурный состав лосьонов может быть на водной или масляной основе, а также будет в общем содержать один или несколько эмульгаторов, стабилизаторов, диспергирующих агентов, ресуспендирующих агентов, загустителей или красителей. Составы для местного введения во рту включают лекарственные леденцы, содержащие действующее вещество в ароматизированной основе, обычно из сахара и камеди или трагаканта; пастилки, содержащие действующее вещество в инертной основе, такой как желатин и глицерин, или сахароза и камедь; и ополаскиватели для рта, содержащие действующее вещество в подходящем жидком носителе. Растворы или суспензии наносят непосредственно в носовую полость при помощи стандартных средств, например, капельницей, пипеткой или аэрозолем. Составы могут быть предоставлены в разовой или многодозовой формах. В последнем случае при использовании капельницы или пипетки, разовую дозу пациент может получить, принимая соответствующий определенный объем раствора или суспензии. В случае аэрозоля, разовую дозу можно получить с помощью дозирующей насадки на аэрозольный распылитель. Введение в респираторный тракт можно осуществить при помощи аэрозольных составов, в которых действующий ингредиент представлен в упаковке под давлением с подходящим газом-распылителем. При введении соединений по настоящему изобретению или содержащих их фармацевтических композиций в виде аэрозолей, например в виде назальных аэрозолей или ингаляцией, это можно осуществить,например, используя аэрозольный распылитель, распылитель, распылитель с насосом, ингалятор, дозирующий ингалятор или ингалятор сухого порошка. Фармацевтические формы для введения соединений по настоящему изобретению как аэрозолей можно получить способами, хорошо известными специалисту в данной области. Для их получения можно использовать, например, растворы или дисперсии соединений по настоящему изобретению в воде, водно-спиртовых смесях или подходящих растворах солей с использованием обычных добавок, например бензилового спирта или других подходящих консервантов,усилителей абсорбции для увеличения биодоступности, солюбилизаторов, диспергирующих агентов и других, и, при необходимости, обычных газов-распылителей, которые, например, включают диоксид углерода, CFC, такие как дихлордифторметан, трихлорфторметан или дихлортетрафторэтан и т.п. Обычно аэрозоль также содержит поверхностно-активное вещество, такое как лецитин. Дозирование лекарственного препарата можно обеспечить с помощью дозирующего клапана. В составах, которые предусмотрены для введения в респираторный тракт, включая составы для интраназального применения, обычно соединение будет иметь маленький размер частиц, например порядка 10 мкм или меньше. Частицы такого размера можно получить методами, известными в данной области,например микронизацией. При желании можно использовать составы, адаптированные для замедленного высвобождения действующего ингредиента. В качестве альтернативы действующие ингредиенты можно предоставить в виде сухого порошка,например порошковой смеси подходящего порошкового основания, такого как лактоза, крахмал, производные крахмала, такие как гидроксипропилметилцеллюлоза и поливинилпирролидон (PVP). Обычно порошковый носитель будет образовывать гель в носовой полости. Порошковую композицию можно представить в виде единичной дозы, например, в капсулах, или картриджах, например желатиновых, или в виде блистерных упаковок, порошок из которых можно вводить с помощью ингалятора. Предпочтительно, чтобы фармацевтические препараты были в единичных формах дозировки. В таком виде препараты можно разделить на разовые дозы, содержащие соответствующее количество действующего компонента. Единичная форма дозировки может представлять собой упакованный препарат,упаковка которого содержит определенные количества препарата, такие как таблетки, капсулы и порошки в флаконах или ампулах. Также единичная форма дозировки может представлять собой капсулу, таблетку, саше или лекарственный леденец сами по себе, или она может представлять собой соответствующее число любых из них в упакованном виде. Предпочтительными композициями являются таблетки или капсулы для перорального введения и жидкости для внутривенного введения. Соединения по изобретению необязательно могут быть представлены в виде фармацевтически приемлемых солей, включая фармацевтические соли присоединения кислоты, полученные из фармацевтически приемлемых нетоксических кислот, включая неорганические и органические кислоты. Соли присоединения кислот можно получить напрямую при синтезе соединений. В качестве альтернативы, свободное основание можно растворить в подходящем растворителе, содержащем соответст- 10015343 вующую кислоту, и выделить соль выпариванием растворителя или каким-либо иным способом разделения соли и растворителя. Соединения этого изобретения могут образовывать сольваты с стандартными низкомолекулярными растворителями при использовании способов, известным опытным изготовителям. Некоторые варианты осуществления настоящего изобретения включают способ получения фармацевтической композиции для комбинированной терапии, который включает в себя смешивание по меньшей мере одного соединения по настоящему изобретению вместе по меньшей мере с одним фармацевтическим агентом, описанным в данном документе, и вместе с фармацевтически приемлемым носителем. В некоторых вариантах осуществления изобретения фармацевтические агенты выбраны из группы,состоящей из сульфонилмочевин, меглитинидов, бигуанидов, ингибиторов -глюкозидазы, агонистов пероксисомного пролифератора-активируемого рецептора(т.е., PPAR-), инсулина, аналогов инсулина,ингибиторов HMG-CoA редуктазы, лекарственных препаратов, понижающих уровень холестерина (например, фибратов, которые включают фенофибрат, безафибрат, гемфиброзил, клофибрат и т.п.; желчегонных средств, которые включают холестирамин, колестипол и т.п.; и ниацина), тромболитиков (например, аспирина и антагонистов аденозиндифосфатного рецептора, которые включают: клопидогрел,тиклопидин и т.п.), ингибиторов ангиотензин-конвертирующего фермента, антагонистов рецептора ангиотензина II и адипонектина. Следует отметить, что использование модуляторов RUP3-рецептора в качестве действующих ингредиентов в фармацевтической композиции подразумевает применение не только у людей, но также и у других млекопитающих, кроме человека. Несомненно современные успехи в области ветеринарной медицины указывают на то, что надо учитывать применение действующих агентов, таких как модуляторыRUP3-рецептора, при лечении ожирения у домашних животных (например, кошек и собак) и применение модуляторов RUP3-рецептора у других домашних животных, где проявления заболевания или расстройства не очевидны (например, у животных, которых выращивают для употребления в пищу, таких как коровы, куры, рыба и т.д.). Средний специалист легко поймет пользу таких соединений в этих направлениях. Комбинированная терапия В контексте настоящего изобретения соединение, описанное в настоящем документе, или его фармацевтическую композицию можно использовать для модулирования активности опосредуемых RUP3 рецептором заболеваний, состояний и/или расстройств, описанных в настоящем документе. Примеры модулирования активности опосредуемых RUP3-рецептором заболеваний включают лечение связанных с метаболизмом расстройств. Связанные с метаболизмом расстройства включают, но не ограничены этим, гиперлипидемию, диабет I типа, сахарный диабет II типа и ассоциированные с ними состояния,такие как, но не ограниченные этим, коронарная болезнь сердца, ишемический инсульт, рестеноз после ангиопластики, заболевание периферических сосудов, перемежающаяся хромота, инфаркт миокарда (например, некроз и апоптоз), дислипидемия, липемия после приема пищи, состояния нарушенной глюкозотолерантности (IGT), состояния нарушенного уровня глюкозы натощак, метаболический ацидоз, кетоз,артрит, ожирение, остеопороз, гипертония, застойная сердечная недостаточность, гипертрофия левого желудочка, периферическая артериальная болезнь, диабетическая ретинопатия, дистрофия желтого пятна, катаракта, диабетическая нефропатия, гломерулосклероз, хроническая почечная недостаточность,диабетическая нейропатия, метаболический синдром, синдром X, предменструальный синдром, коронарная болезнь сердца, стенокардия, тромбоз, атеросклероз, инфаркт миокарда, транзиторный ишемический приступ, инсульт, рестеноз сосудов, гипергликемия, гиперинсулинемия, гиперлипидемия, гипертриглицеридемия, инсулинорезистентность, нарушенный метаболизм глюкозы, состояния нарушенной глюкозотолерантности, состояния нарушенного уровня глюкозы натощак, ожирение, эректильная дисфункция, заболевания кожи и соединительной ткани, образование язв на ногах и язвенный колит, нарушение функционирования эндотелия и нарушенная эластичность сосудов. В некоторых вариантах осуществления изобретения связанные с метаболизмом расстройства включают диабет I типа, диабет II типа, нарушенную глюкозотолерантность, инсулинорезистентность, гипергликемию, гиперлипидемию,гипертриглицеридемию, гиперхолестеринемию, дислипидемию и синдром X. Другие примеры модулирования активности опосредуемых RUP3-рецептором заболеваний включают лечение ожирения и/или избыточного веса снижением путем снижения потребления пищи, повышения насыщения (т.е., чувства наполнения желудка), контроля набора веса, снижения веса тела и/или влияния на метаболизм таким образом, что пациент теряет вес и/или вес не изменяется. Хотя соединения по изобретению можно вводить как единственный фармацевтический агент (т.е., в монотерапии), их также можно использовать в комбинации с другими фармацевтическими агентами, (т.е. в комбинированной терапии) для лечения заболеваний/состояний/расстройств, описанных в настоящем документе. Поэтому другой аспект настоящего изобретения включает способы лечения связанного с метаболизмом расстройства, включая нарушение веса, такое как ожирение, которые включают в себя введение нуждающемуся в профилактике и/или лечении индивидууму терапевтически эффективного количества соединения по настоящему изобретению в комбинации с одним или несколькими дополнитель- 11015343 ными фармацевтическими агентами, описанными в настоящем документе. Подходящие фармацевтические агенты, которые можно использовать в комбинации с соединениями по настоящему изобретению, включают агенты против ожирения, такие как ингибиторы секреции аполипопротеина B/микросомального белка-переносчика триглицеридов (ингибиторы (аро-B/MTP, агонисты MCR-4, агонисты холецистокинина-A (CCK-A), ингибиторы обратного захвата серотонина и норэпинефрина (например, сибутрамин), симпатомиметики, агонисты 3-адренергического рецептора, допаминовые агонисты (например, бромкриптин), аналоги рецептора меланоцитстимулирующего гормона,антагонисты каннабиноид-1-рецептора [например, SR141716: N-(пиперидин-1-ил)-5-(4-хлорфенил)-1(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоксамид], антагонисты меланинконцентрирующего гормона, лептоны (OB-белки), лептиновые аналоги, агонисты лептинового рецептора, антагонисты галанина, ингибиторы липаз (такие как тетрагидролипстатин, т.е. Орлистат), аноректические средства (такие как агонист бомбезина), антагонисты нейропептида-Y, тиромиметики, дегидроэпиандростерон или его аналог, агонисты или антагонисты глюкокортикоидных рецепторов, антагонисты орексиновых рецепторов, антагонисты урокортин-связывающего белка, агонисты рецептора глюкагонподобного пептида-1,цилиарные нейротрофические факторы (такие как Axokine, доступный от Regeneron Pharmaceuticals,Inc., Tarrytown, NY и ProcterGamble Company, Cincinnati, OH), человеческие агутиродственные белки(AGRP), антагонисты рецепторов грелина, антагонисты или обратные агонисты рецептора гистамина 3,агонисты рецептора нейромедина U, норадренергические аноректические средства (например, фентермин, мазиндол и т.п.) и средства, угнетающие аппетит (например, бупропион). Другие агенты против ожирения, включая агенты, указанные infra, хорошо известны, или в свете настоящего описания будут очевидны среднему специалисту в данной области. В некоторых вариантах осуществления изобретения агенты против ожирения выбирают из группы,состоящей из орлистата, сибутрамина, бромкриптина, эфедрина, лептина и псевдоэфедрина. В другом варианте осуществления изобретения соединения по настоящему изобретению и комбинированные методы лечения вводятся в сочетании с упражнениями и/или необходимой диетой. Следует понимать, что объем комбинированной терапии соединениями по настоящему изобретению с другими агентами против ожирения, аноректическими средствами, средствами, подавляющими аппетит, и аналогичными агентами, не ограничивается перечисленными в этом описании комбинациями,а включает, в принципе, любую комбинацию с любым фармацевтическим агентом или фармацевтической композицией, пригодными для лечения индивидуумов с избыточным весом и ожирением. Следует понимать, что объем комбинированной терапии соединениями по настоящему изобретению с другими фармацевтическими агентами не ограничен перечисленными supra или infra в этом описании комбинациями, а включает, в принципе, любую комбинацию с любым фармацевтическим агентом или фармацевтической композицией, пригодными для лечения болезней, состояний или расстройств,которые связаны с расстройствами метаболизма. Некоторые варианты осуществления настоящего изобретения включают способы лечения болезни,расстройства, состояния или их осложнения, описанные в настоящем документе, которые включают введение нуждающемуся в таком лечении индивидууму терапевтически эффективного количества или дозы соединения по настоящему изобретению в комбинации с по меньшей мере одним фармацевтическим агентом, выбранным из группы, состоящей из сульфонилмочевин (например, глибурида, глипизида, глимепирида и других сульфонилмочевин, известных в данной области), меглитинидов (например, репаглинида, натеглинида и других меглитинидов, известных в данной области), бигуанидов (например, бигуаниды включают фенформин, метформин, буформин и бигуаниды, известные в данной области), ингибиторов -глюкозидазы [например, акарбозы, N-(1,3-дигидрокси-2-пропил)валиоламина (непатентованное название; воглибоза), миглитола и известных в данной области ингибиторов -глюкозидазы], агонистов пероксисомного пролифератора-активируемого рецептора(т.е. PPAR-) (например, розиглитазона, пиоглитазона, тезаглитазара, нетоглитазона, GW-409544, GW-501516 и известных в данной области агонистов PPAR-), инсулина, аналогов инсулина, ингибиторов HMG-CoA редуктазы (например, розувастатина, правастатина и его натриевой соли, симвастатина, ловастатина, аторвастатина, флувастатина, церивастатина, розувастатина, питавастатина, суперстатина от компании BMS и известных в данной области ингибиторов HMG-CoA редуктазы), лекарственных препаратов, понижающих уровень холестерина (например, фибратов, которые включают безафибрат, беклобрат, бинифибрат, циплофибрат, клинофибрат,клофибрат, клофибровую кислоту, этофибрат, фенофибрат, гемфиброзил, никофибрат, пирифибрат, ронифибрат, симфибрат, теофибрат и известные в данной области фибраты; желчегонных средств, которые включают холестирамин, колестипол и т.п.; и ниацина), тромболитиков (например, аспирина и антагонистов аденозиндифосфатного рецептора, которые включают клопидогрел, тиклопидин и т.п.), ингибиторов ангиотензин-конвертирующего фермента (например, каптоприла, эналаприла, алацеприла, делаприла, рамиприла, лизиноприла, имидаприла, беназеприла, церонаприла, цилазаприла, эналаприлата, фозиноприла, мовелтоприла, периндоприла, хинаприла, спираприла, темокаприла, трандолаприла и известных в данной области ингибиторов ангиотензин-конвертирующего фермента), антагонистов рецептора ангиотензина II [например, лосартана (и его калиевой соли)], известных в данной области антагонистов- 12015343 рецептора ангиотензина II, адипонектина, ингибиторов синтеза скваленов например, одноосновной калиевой соли(S)[бис[2,2-диметил-1-оксопропокси)метокси]фосфинил]-3-феноксибензолбутансульфоновой кислоты (BMS-188494) и ингибиторов синтеза скваленов, известных в данной области, и т.п. В некоторых вариантах осуществления изобретения способы по настоящему изобретению включают соединения по настоящему изобретению и фармацевтические агенты, которые вводят отдельно. В других вариантах осуществления изобретения соединения по настоящему изобретению и фармацевтические агенты вводят совместно. Подходящие фармацевтические агенты, которые можно использовать в сочетании с соединениями по настоящему изобретению, включают, но не ограничены этим, агонисты амилина (например, прамлинтид), стимуляторы секреции инсулина (например, агонисты GLP-1; экзендин-4; инсулинотропин(NN2211); ингибиторы дипептидилпептидазы (например, NVP-DPP-728), ингибиторы ацил-СоАхолестеринацетилтрансферазы (например, эзетимиб, эфлуцимиб и т.п.), ингибиторы абсорбции холестерина (например, эзетимиб, памакезид и т.п.), ингибиторы белка-переносчика сложных эфиров холестерина (например, CP-529414, JTT-705, CETi-1 и т.п.), ингибиторы микросомального белка-переносчика триглицеридов (например, имплитапид и т.п.), модуляторы холестерина (например, NO-1886 и т.п.), модуляторы желчных кислот (например, GT103-279 и т.п.), модуляторы инсулинового сигнального пути,такие как ингибиторы тирозиновых фосфатаз (PTPase), высокомолекулярные миметики и ингибиторы глутамин-фруктозо-6-фосфат-амидотрансферазы (GFAT), соединения, влияющие на нарушенный синтез глюкозы в печени, такие как ингибиторы глюкозо-6-фосфатазы (G6Pase), ингибиторы фруктозо-1,6 бисфосфатазы (F-1,6-BPase), ингибиторы гликогенфосфорилазы (GP), антагонисты глюкагоновых рецепторов и ингибиторы фосфоенолпируваткарбокси-киназы (PEPCK), ингибиторы пируватдегидрогеназкиназы (PDHK), усилители чувствительности к инсулину, усилители секреции инсулина, ингибиторы чувства пустоты в желудке (2-адренергические антагонисты и агонисты ретиноид-X-рецептора (RXR). По настоящему изобретению можно использовать комбинацию путем смешивания соответствующих действующих компонентов, соединения по настоящему изобретению и фармацевтического агента,или всех вместе, или независимо, с физиологически приемлемым носителем, наполнителем, связывающим агентом, разбавителем и т.д., описанными в настоящем документе выше, и путем введения смеси или смесей или перорально, или не перорально как фармацевтическую композицию. При введении соединения или смеси соединений по настоящему изобретению в качестве комбинированной терапии с другим действующим соединением, терапевтические агенты могут входить в состав как отдельные фармацевтические композиции, которые пациент принимает одновременно или в разное время, или пациент может принимать терапевтические агенты как одну композицию. Другие способы применения Другая задача настоящего изобретения относится к радиоактивно меченным соединениям, которые были бы полезными не только в методах визуализации с радиоактивными соединениями, но также и в аналитических методах, как in vitro, так и in vivo, для локализации и количественной оценки RUP3 рецептора в образцах ткани, включая образцы ткани человека, и для идентификации лигандов RUP3 рецептора при ингибировании связывания радиоактивно меченного соединения. Дальнейшей задачей этого изобретения является разработка новых методов анализа RUP3-рецептора, которые включают в себя такие радиоактивно меченные соединения. Настоящее изобретение включает в себя меченное изотопом соединение с формулой (I) и его фармацевтически приемлемую соль. Меченными изотопами или радиоактивно меченными соединениями являются соединения, идентичные соединениям, раскрытым в настоящем описании, но с учетом того,что один или несколько атомов заменены или замещены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа, обычно присутствующего в природе (т.е. встречающегося в природе). Подходящие радионуклиды, которые можно включать в соединения по настоящему изобретению, включают, но не ограничены этим, 2H (также пишется как D, обозначая дейтерий), 3H (также пишется как T, обозначая тритий), 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 18F, 35S, 36Cl, 82Br,75Br, 76Br, 77Br, 123I, 124I, 125I и 131I. Радионуклид, который включают в настоящие радиоактивно меченные соединения, будет зависеть от конкретного применения этого радиоактивно меченного соединения. Например, для in vitro мечения RUP3-рецептора и конкурентных методов анализа наиболее часто используют соединения, включающие 3H, 14C, 82Br, 125I, 131I, 35S. Для применения в методах визуализации с радиоактивными соединениями наиболее часто используют 11C, 18F, 125I, 123I, 124I, 131I, 75Br, 76Br или 77Br. Следует понимать, что радиоактивно меченное или меченное соединение представляет собой соединение по настоящему изобретению, в которое включен по меньшей мере один радионуклид; в некоторых вариантах осуществления изобретения радионуклид выбран из группы, состоящей из 3H, 14C,125 35I, S и 82Br. Некоторые меченные изотопами соединения по настоящему изобретению пригодны в методах анализа распределения соединения и/или субстрата в тканях. В некоторых вариантах осуществления изобретения в этих исследованиях пригодны изотопы 3H и 14C. Кроме того, замена на более тяжелые изотопы,такие как дейтерий (т.е. 2H), может дать некоторое преимущество при терапии, которое является резуль- 13015343 татом большей метаболической стабильности (например, увеличенное время полужизни in vivo или сниженные схемы дозировок), и, следовательно, такие соединения при некоторых обстоятельствах могут быть предпочтительны. Меченные изотопами соединения в общем можно получить при помощи следующих методик, аналогичных тем, что раскрыты в схемах supra и примерах infra, путем замещения не меченного изотопом реагента на меченный изотопом реагент. Другие пригодные способы синтеза обсуждены infra. Более того, следует понимать, что все атомы, представленные в соединениях по изобретению, могут быть или наиболее часто встречающимся изотопом таких атомов или более редким радиоактивным изотопом или нерадиоактивным изотопом. Способы синтеза для включения радиоактивных изотопов в органические соединения применимы для соединений по изобретению и известны в данной области. Эти способы синтеза можно использовать для промежуточного или для конечного соединения, например, включить радиоактивный тритий в соединения по настоящему изобретению можно следующим образом:A. Каталитическое восстановление тритиевым газом - эта методика обычно дает продукт с высокой удельной активностью и требует галогенированные или ненасыщенные исходные соединения.B. Восстановление боргидридом [3H] натрия - эта методика является достаточно недорогой и требует исходные соединения, которые содержат восстанавливаемые функциональные группы, такие как альдегиды, кетоны, лактоны, сложные эфиры и т.п.C. Восстановление алюмогидридом [3H] лития - эта методика дает продукт с практически идеальной удельной активностью. Она также требует исходные соединения, которые содержат восстанавливаемые функциональные группы, такие как альдегиды, кетоны, лактоны, сложные эфиры и т.п.D. Мечение при взаимодействии с тритиевым газом - эта методика включает взаимодействие исходных соединений, содержащих обменоспособные протоны, с тритиевым газом в присутствии соответствующего катализатора.E. N-метилирование с использованием метилиодида [3H] - эту методику обычно используют для получения O-метилированных или N-метилированных [3H] продуктов путем обработки соответствующих исходных соединений метилиодидом [3H] с высокой удельной активностью. В норме, этот способ позволяет получить более высокую удельную активность, такую как, например, около 70-90 Ки/ммоль. Радиоактивно меченное связывающее RUP3-рецептор соединение по настоящему изобретению можно использовать в скрининговом методе анализа для идентификации/оценки соединений. В общем,новое или идентифицируемое соединение (т.е. тестируемое соединение) можно оценивать по его способности снижать связывание радиоактивно меченного соединения по настоящему изобретению с RUP3 рецептором. Соответственно, способность тестируемого соединения конкурировать с радиоактивно меченным соединением по настоящему изобретению в связывании с RUP3-рецептором прямо коррелирует с его аффинностью связывания. Меченные соединения по настоящему изобретению связывают RUP3-рецептор. В одном варианте осуществления меченное соединение имеет IC50 менее чем примерно 500 мкМ, в другом варианте осуществления меченное соединение имеет IC50 менее чем примерно 100 мкМ, в еще одном варианте осуществления меченное соединение имеет IC50 менее чем примерно 10 мкМ, в еще одном варианте осуществления меченное соединение имеет IC50 менее чем примерно 1 мкМ, в еще одном варианте осуществления меченное соединение имеет IC50 менее чем примерно 0,1 мкМ, в еще одном варианте осуществления меченное соединение имеет IC50 менее чем примерно 0,01 мкМ, и в еще одном варианте осуществления меченное соединение имеет IC50 меньше примерно 0,001 мкМ. Как будет очевидно, стадии способов по настоящему изобретению не нужно проводить какое-либо определенное число раз или в какой-либо конкретной последовательности. Дополнительные задачи, преимущества и новые признаки этого изобретения будут ясны специалистам в данной области после изучения следующих ниже их примеров, которые приведены для иллюстрации изобретения и не ограничивают изобретение. Примеры Пример 1. Эффекты in vivo агониста RUP3 на глюкозный гомеостаз у крыс Основная методика - оральный глюкозотолерантный тест (oGTT) Самцов крыс Sprague Dawley (Harlan, San Diego, CA) с весом приблизительно 350-375 г не кормили в течение 16 ч и случайным образом распределяли по группам (n=6), в которых животные получали агонист RUP3 в количестве 0,3, 3 или 30 мг/кг. Крысы получали соединения перорально через зонд (per os,объем 2 мл/кг). В нулевой временной точке уровень глюкозы в крови измеряли глюкометром (Accu-ChekAdvantage, Roche Diagnostics), и крысам вводили или носитель (20% гидроксипропилциклодекстрин),или тестируемое соединение. Через 30 мин после введения тестируемого соединения повторно измеряли уровень глюкозы в крови и крысам перорально вводили декстрозу в количестве 3 г/кг. Уровень глюкозы в крови измеряли через 30, 60 и 120 мин после этого времени. Агонист RUP3, изопропиловый эфир 4-[6(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты [формула (I)], показал ингибирование амплитуды глюкозы в среднем на 38%, причем среднее значение было получено от 6 животных из группы, получавшей воздействие. Это демонстрирует, что- 14015343 агонист RUP3, изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, понижает содержание глюкозы в крови после сахарной нагрузки. Пример 2. Анализ связывания с рецептором В дополнение к описанным в данном документе способам другим средством оценки тестируемого соединения является определение аффинности связывания с RUP3-рецептором. В этом типе анализа обычно требуется радиоактивно меченный лиганд RUP3-рецептора. В отсутствие применения известных лигандов RUP3-рецептора и их радиоактивно меченных производных, соединения формулы (I) можно пометить радиоизотопом и использовать для оценки аффинности тестируемого соединения RUP3 рецептора. Радиоактивно меченное связывающее RUP3 соединение с формулой (I) можно использовать в скрининговых методах анализа для идентификации/оценки соединений. В общих чертах, новое или идентифицируемое соединение (т.е. тестируемое соединение) можно оценивать по его способности снижать связывание радиоактивно меченного соединения с формулой (I) с RUP3-рецептором. Соответственно, способность тестируемого соединения конкурировать с радиоактивно меченным соединением с формулой (I) или радиоактивно меченным лигандом RUP3 за связывание с RUP3-рецептором прямо коррелирует с аффинностью связывания тестируемого соединения с RUP3-рецептором. Протокол анализа для определения связывания с RUP3-рецептором:A. Получение RUP3-рецептора Проводили транзиентную трансфекцию клеток 293 (клеточная линия из почки человека, ATCC) 10 мкг RUP3-рецептора человека и 60 мкл Lipofectamine (на чашках с диаметром 15 см) и растили клетки на чашках в течение 24 ч (до конфлюэнтности 75%) со сменой среды, затем клетки смывали в объеме 10 мл/на чашку буфером Hepes-EDTA (20 мМ Hepes + 10 мМ EDTA, pH 7,4). Затем клетки осаждали в центрифуге Beckman Coulter в течение 20 мин на скорости 17000 об/мин (ротор JA-25.50). Далее ресуспендировали осадок в буфере 20 мМ Hepes + 1 мМ EDTA, pH 7,4, и гомогенизировали в гомогенизаторе Даунса объемом 50 мл, а затем снова центрифугировали. После удаления надосадочной жидкости осадки хранили при -80C до момента использования в анализе связывания. Для анализа связывания мембраны размораживали на льду в течение 20 мин, а затем добавляли 10 мл инкубационного буфера (20 мМHepes, 1 мМ MgCl2, 100 мМ NaCl, pH 7,4). Чтобы ресуспендировать неочищенный осадок мембран, его затем подвергали дезинтеграции вращением в емкости и гомогенизировали в гомогенизаторе BrinkmannPT-3100 Polytron в течение 15 с на скорости 6. Концентрацию белка в мембранах определяли, используя метод определения белка по Брэдфорду (от компании BRL).B. Анализ связывания Для определения общего связывания добавляли общий объем 50 мкл соответствующим образом разведенных мембран (разведенных в буфере для анализа, содержащем 50 мМ Tris HCl (pH 7,4), 10 мМMgCl2 и 1 мМ EDTA; 5-50 мкг белка) в 96-луночные полипропиленовые микротитровальные планшеты,после чего добавляли 100 мкл буфера для анализа и 50 мкл радиоактивно меченного лиганда RUP3. Для определения неспецифического связывания вместо 100 мкл буфера для анализа добавляли 50 мкл и добавляли дополнительные 50 мкл немеченного RUP3 (10 мкМ) перед добавлением 50 мкл радиоактивно меченного лиганда RUP3. Планшеты инкубировали при комнатной температуре 60-120 мин. Реакцию связывания останавливали фильтрованием анализируемых планшетов через устройства для фильтрования микропланшетов GF/C Unifilter с использование устройства Brandell для отбора проб с 96-луночных планшетов, далее промывая фильтры холодным 50 мМ Tris HCl, pH 7,4, содержащим 0,9% NaCl. Затем герметично закрывали низ фильтровальной планшеты, в каждую лунку добавляли 50 мкл Optiphase Supermix (сцинтилляционного коктейля), герметично закрывали верх планшеты, и радиоактивность в лунках планшеты измеряли в сцинтилляционном счетчике Trilux MicroBeta. Для анализа соединений методом конкурентного связывания вместо добавления 100 мкл буфера для анализа добавляли 100 мкл соответственно разведенного тестируемого соединения в соответствующие лунки с последующим добавлением 50 мкл радиоактивно меченного лиганда RUP3. С. Расчеты Вначале анализ тестируемых соединений проводили при концентрациях 1 и 0,1 мкМ, а затем в диапазоне концентраций, выбранных таким образом, чтобы средняя доза вызывала бы примерно 50% ингибирования связывания с радиоактивно меченным лигандом RUP3 (т.е. IC50). Специфическое связывание в отсутствие тестируемого соединения (Bo) составляет разницу между общим связыванием (BT) минус неспецифическое связывание (NSB), и аналогично специфическое связывание (в присутствии тестируемого соединения) (B) составляет разницу заместительного связывания (BD) минус неспецифическое связывание (NSB). IC50 определяли из кривой ингибирования, логит-лог преобразования процентного соотношения B/Bo от концентрации тестируемого соединения.Ki вычисляют из преобразования Ченга и Прустоффа:Ki=IC50/(1+[L]/KD) где [L] является концентрацией радиоактивно меченного лиганда RUP3, используемого в анализе, a KD- 15015343 является константой диссоциации радиоактивно меченного лиганда RUP3, независимо определенной при таких же условиях связывания. Пример 3. Соединения по изобретению и их синтез далее проиллюстрированы следующими примерами. Нижеследующие примеры представлены для более точного описания изобретения, однако они не ограничивают изобретение частными данными этих примеров. Описанные в настоящем документе соединения названы в соответствии с CS ChemDraw Ultra Version 7.0.1. В некоторых примерах используются тривиальные названия, причем подразумевается, что эти тривиальные названия знакомы специалистам в данной области. Химический анализ: Спектры ядерного магнитного резонанса (1H ЯМР) снимали на Varian Mercury Vx-400, оборудованном 4x ядерными автоматически переключаемыми датчиками и z-градиентом, или на Bruker Avance400, оборудованном QNP (квадратурным ядерным датчиком) или BBI (широкополосной инверсией) и zградиентом. Химический сдвиг выражали в миллионных долях (ppm), в качестве стандарта использовали остаточный сигнал растворителя. Использовали следующие сокращения: s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, sept = септет, br = уширение полосы. Облучение микроволнами проводили с использованием Emrys Synthesizer (Personal Chemistry). Тонкослойную хроматографию (TLC) проводили на силикагеле 60 F254 (Merck), препаративную тонкослойную хроматографию (prep TLC) проводили на силикагеле PK6F 60 A и пластинах 1 мм (Whatman), а колоночную хроматографию проводили на колонке с силикагелем Kieselgel 60, 0,063-0,200 мм (Merck). Растворитель удаляли под вакуумом на роторном испарителе Buchi. Для фильтрации палладия использовали Celite 545. Спектры LCMS: 1) PC: насосы HPLC: LC-10AD VP, Shimadzu Inc.; контроллер системы HPLC:Ion Spray, AB/MDS Sciex; Программное обеспечение: Masschrom 1.5.2. Пример 3.1. Получение изопропилового эфира 4-гидроксипиперидин-1-карбоновой кислоты. При перемешивании на магнитной мешалке раствор 4-гидроксипиперидина (70,3 г, 695 ммоль) иN,N-диизопропилэтиламина (105 мл, 600 ммоль) в дихлорметане (1,0 л) охлаждали до 10C под азотом. В течение 2 ч по каплям добавляли раствор изопропилхлорформиата (1,0 М в толуоле, 580 мл, 580 ммоль),при этом поддерживали температуру 10-15C. Реакционную смесь перемешивали еще 2 ч, а затем проводили экстракцию 1N HCl (1,2 л). Органический экстракт сушили над MgSO4, и растворитель удаляли при пониженном давлении, что давало целевое соединение (90,3 г, выход 83%) в виде масла бледносоломенного цвета. Расчетная масса для C9H17NO3: 187,1; экспериментальные данные: LCMS m/z = 188,2 Смесь 6-бром-2-метилпиридин-3-амина (40.0 г, 214 ммоль), метансульфината натрия (87,3 г, 855 ммоль), комплекса трифторметансульфоната меди (I) с бензолом (10,8 г, 21,4 ммоль) и N1,N2 диметилэтан-1,2-диамина (10,8 г, 21,4 ммоль) в DMSO (300 мл) нагревали при 150C в течение 4 ч, охлаждали и добавляли 100 мл H2O. Раствор темно-коричневого цвета экстрагировали этилацетатом (630 мл). Органический слой промывали 100 мл H2O, чтобы удалить DMSO. Водный слой повторно экстрагировали три раза этилацетатом. Органические слои объединяли, промывали соляным раствором, сушили над Na2SO4 и фильтровали. Фильтрат упаривали при пониженном давлении до объема примерно 200 мл,после чего образовывался твердый осадок, который собирали фильтрованием, что давало целевое соединение (24,0 г, выход 60%) в виде коричневого порошка. Расчетная масса для C7H10N2O2S: 186,1; экспериментальные данные: LCMS m/z = 187,1 (M+H+); 1 Смесь 6-бром-2-метилпиридин-3-нитропиридина (100 г, 461 ммоль) и метансульфината натрия (47,0 г, 461 ммоль) в DMSO (300 мл) перемешивали 1,5 ч при комнатной температуре. Реакционную смесь выливали в ледяную воду (1 л) и перемешивали до полного растворения льда. Ледяной раствор фильтровали и собирали осадок темно-малинового цвета. Собранный осадок растворяли в этилацетате (1 л). Раствор обрабатывали активированным углем, фильтровали через Celite. Слой Celite промывали этилацетатом, и собирали фильтрат. Удаляли растворитель из фильтрата при пониженном давлении, что давало целевое соединение (87,0 г, выход 87%) в виде желтого твердого вещества. Расчетная масса для К суспензии цинковой пыли (146 г, 2,01 моль) и водного раствора хлорида аммония (3 М, 800 мл) по каплям прибавили раствор 2-метил-6-(метилсульфонил)-3-нитропиридина (87,0 г, 401 ммоль) в этилацетате (500 мл) через капельную воронку при 0C. Смесь перемешивали при комнатной температуре в течение 17 ч и фильтровали через Celite. Затем проводили экстракцию фильтрата этилацетатом. Отделяли органическую фазу, сушили над MgSO4, фильтровали и концентрировали. Остаток перекристаллизовывали из этанола, что давало целевое соединение (34,7 г, выход 46%) в виде твердого вещества. Расчетная масса для C7H10N2O2S: 186,1; экспериментальные данные: LCMS m/z = 187,2 (M+H+). Пример 3.4. Получение изопропилового эфира 4-(6-хлор-5-метилпиримидин-4-илокси)пиперидин 1-карбоновой кислоты К раствору изопропилового эфира 4-гидроксипиперидин-1-карбоновой кислоты (29,0 г, 155 ммоль) и 4,6-дихлор-5-метилпиримидина (25,0 г, 153 ммоль) в ТГФ (250 мл) по каплям прибавили раствор третбутоксида калия в ТГФ (1 М, 154 мл, 154 ммоль) при 0C. После 45 мин неочищенную смесь экстрагировали смесью этилацетата и H2O, и органическую фазу промывали солевым раствором. Органический экстракт сушили над MgSO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле в системе гексан/этилацетат (10%15% v/v), что давало целевое соединение (15,4 г,выход 32%) в виде твердого вещества. Расчетная масса для C14H20ClN3O3: 313,1; экспериментальные данные: LCMS m/z = 314,4 (M+H+); 1H ЯМР (400 МГц, DMSO-d6)1,20 (d, J=6,32 Гц, 6H), 1,64-1,69 (m, 2H), 1,92-1,97 (m, 2H), 2,18 (s,3H), 3,33-3,39 (m, 2H), 3,59-3,65 (m, 2H), 4,79 (sept, J=6,32 Гц, 1H), 5,32-5,34 (m, 1H) , 8,50 (s, 1H) . Пример 3.5. Получение изопропилового эфира 4-[6-(6-метансульфонил-2-метилпиридин-3 иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты Смесь изопропилового эфира 4-(6-хлор-5-метилпиримидин-4-илокси)пиперидин-1-карбоновой кислоты (13,7 г, 43,6 ммоль), 6-метансульфонил-2-метилпиридин-3-иламина (8,10 г, 43,5 моль), ацетата палладия (97,7 мг, 0,435 ммоль), 2,8,9-триизобутил-2,5,8,9-тетрааза-1-фосфабицикло[3.3.3]ундекана (309 мкл, 0,870 ммоль) и трет-бутоксида натрия в (10,0 г, 104 ммоль) в диоксане (210 мл) нагревали при 90C в течение 2 ч. Реакцию останавливали H2O и экстрагировали этилацетатом. Отделяли органический слой,- 17015343 промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали. Очистку полученного остатка сначала проводили хроматографией на колонке с силикагелем в системе гексан/этилацетат(1:1, v/v), а затем перекристаллизацией из метанола, что давало целевое соединение (5,76 г, выход 29%) в виде твердого вещества белого цвета. Расчетная масса для C21H29N5O5S: 463,22; экспериментальные данные: LCMS m/z = 4 64,3 (M+H+); 1 Н ЯМР (4 00 МГц, CDCl3)1,27 (d, J = 6,32 Гц, 6H), 1,76-1,79 (m, 2H), 1,98-2,02 (m, 2H), 2,15 (s,3H), 2,65 (s, 3H), 3,19 (s, 3H), 3,37-3,44 (m, 2H), 3,77-3,79 (m, 2H), 4,94 (sept, J = 6,32 Гц, 1H), 5,34-5,36 (m,1H), 6,39 (s, 1 Н), 7,96 (d, J=8,34 Гц, 1H), 8,36 (s, 1H), 8,82 (d, J = 8,34 Гц, 1H). Пример 4. Протокол исследования зависимости активации RUP3 от концентрации тестируемого соединения в меланофорах Меланофоры культивировали по методике, описанной Potenza, М. N. и Lemer, M. R. в Pigment CellResearch, vol. 5, 372-378, 1992, трансфекцию меланофоров проводили вектором (pCMV), экспрессирующим RUP3, с помощью электропорации. После электропорации трансфецированные клетки высевали на 96-луночные культуральные планшеты для проведения анализа. Клеткам позволяли расти в течение 48 ч как для восстановления после электропорации, так и для максимального уровня экспрессии рецептора. В день проведения анализа среду над клетками заменяли бессывороточным буфером, содержащим 10 нМ мелатонин. Мелатонин действует через эндогенные Gi-связанные GPCR в меланофорах, понижая внутриклеточный уровень цАМФ. В ответ на понижение уровня цАМФ в меланофорах пигмент перемещается к центру клетки. Результатом этого процесса является значительное снижение измеряемого поглощения монослоем клеток в лунке при 600-650 нм. После 1-часовой инкубации с мелатонином в клетках происходит полная агрегация пигмента. В этот момент измеряют базовую величину поглощения. Затем к клеткам добавляют последовательные разведения тестируемых соединений, и соединения, стимулирующие RUP3, вызывают увеличение уровня внутриклеточного цАМФ. В ответ на увеличение уровня цАМФ в меланофорах происходит перемещение пигмента обратно в периферические области клеток. После одного часа, у стимулированных клеток наблюдается полностью равномерное распределение пигмента. Монослой клеток с равномерно распределенным пигментом поглощает гораздо больше света в области длин волн 600-650 нм. Измеренное увеличение поглощения по сравнению с базовой величиной позволяет количественно оценить степень стимулирования рецептора и построить кривую зависимости от концентрации (дозы) тестируемого соединения. Соединение изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, приведенное в формуле (I), является сильным агонистом RUP3-рецептора у ряда различных видов, причем величина EC50 составляет 2 нМ (человек), 8 нМ (собака), 43 нМ (мышь) и 42 нМ (крыса). Пример 5. ФК-исследование на крысах диапазона доз изопропилового эфира 4-[6-(6 метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты Животные, приготовление составов, содержащих соединение, дозировки и забор образцов крови: Самцов крыс SD (250-300 г) покупали в компании Charles River Laboratory; после прибытия животных помещали в светотемновой цикл (светлое время с 6:30 до 18:30). У животных был свободный доступ к воде, и животные получали 4 кусочка питания ежедневно (Purina Meals Rodent Diet, Product Number 5001). Составы с соединением приготавливали, как описано ниже: составы для внутривенного введения приготавливали в 20% растворе гидроксипропил-бета-циклодекстрина с концентрацией соединения 0,667 мг/мл. Составы для перорального введения приготавливали в 0,5% растворе гидроксипропилметилцеллюлозы с концентрациями соединения 0,3, 3 и 30 мг/кг. Объем дозировки для внутривенной инъекции был 3 мл/кг, а для перорального введения составлял 10 мл/кг. Для анализа каждой дозировки использовали группы из четырех крыс. Дозировка для внутривенной инъекции была 2 мг/кг, а дозировка для перорального введения составляла 3, 30 или 300 мг/кг, соответственно. Всех крыс (4 крысы в группе, содержались отдельно) не кормили ночь перед началом эксперимента. На следующее утро, крысы получали внутривенную инъекцию (в хвостовую вену) или введение через зонд соединения, начиная с 8 ч утра (для внутривенной инъекции) и 9 ч утра (для перорального введения). После этого для ФК-анализа у крыс забирали образцы крови из глазной вены через 0,085, 0,25, 0,5,1, 2, 4, 6, 8 и 24 ч (для внутривенной инъекции) или через 0,5, 1, 2, 4, 6, 8 и 24 ч (для перорального введения). Образцы крови отбирали из глазной вены в пробирки, содержащие EDTA, объем каждого образца составлял 0,25 мл. Эти образцы помещали на лед, и в течение 2 ч выделяли плазму центрифугированием при 3000 об/мин в течение 30 мин при 4C. 100 мкл плазмы помещали в коробку с 96-пробирками для ФК-анализа .- 18015343 Анализ образцов Образцы плазмы приготавливали, как описано ниже. Чтобы осадить белки, к 100 мкл плазмы добавляли 200 мкл ацетонитрила, содержащего внутренний стандарт. Образцы центрифугировали 5 мин при 3000 об/мин и надосадочную жидкость удаляли для анализа LC-MS-MS. Калибровочные стандарты и образцы контроля качества приготавливали, добавляя известный объем стандартного концентрированного раствора (в 50% метаноле в воде), непосредственно в контрольные образцы плазмы и обрабатывали аналогично исследуемым образцам плазмы. Калибровочные стандарты обычно приготавливали в диапазоне от 2,0 нг/мл до 10 мкг/мл с линейным уменьшением концентрации для количественного анализа. Эти стадии приготовления образов были автоматизированы с использованием прибора для дозирования жидкости (Tomtec Quadra 96) в 96-луночном формате. Анализ обращенно-фазовой LC-MS-MS проводили с использованием или мониторинга множественных реакций, или мониторинга заданных ионов для детекции характеристических ионов для каждого возможного лекарственного средства, а в качестве внутреннего стандарта использовали пропранолол для положительно заряженных ионов или хлорамфеникол для отрицательно заряженных ионов. Обработка данных Результаты были получены анализом без компартментализации с использованием WinNonlin Proversion 3.1, исходя из зависимости концентраций в плазме от времени для отдельных животных. Уровни соединений в плазме определяли, как было описано выше, и для перорального и внутривенного введения сравнивали площадь под кривой зависимости концентрации от времени (AUC вычисляли, используя правило трапеций до последней измеряемой концентрации, и затем экстраполировали в бесконечность),для того чтобы определить % биодоступности (%F) по следующей формуле: доза(внутривенное введение)AUC(пероральное введение)/ доза(пероральное введение)AUC(внутривенное введение). Могут присутствовать значительные расхождения данных среди отдельных животных и способов анализа, и такое расхождение подтверждается CV (коэффициентом вариации, %) , AUMC является первым статистическим моментом AUC и используется для вычисления среднего времени удержания, MRT(MRT=AUMC/AUC), которое представляет собой среднее время нахождения соединения в организме животного. Значение Cmax представляет максимальную наблюдаемую концентрацию; Tmax является временем, за которое вещество достигает максимальной концентрации; a T1/2 является расчетным конечным временем полужизни соединения в плазме при использовании наклона графика зависимости логарифма концентрации от времени, если присутствует достаточное число точек данных фазы выведения (по меньшей мере три точки в терминальной фазе, кроме Cmax). Общий клиренс, CL (CL = доза(внутривенное введение)/AUC(внутривенное введение, представляет собой объем жидкости (содержащей соединение),из которого соединение полностью удаляется в единицу времени. Объем распределения в равновесном состоянии, Vss (Vss=CLMRT), является мерой распределения лекарственного соединения из плазмы в ткани в равновесном состоянии. На фиг. 1 видно, что для агониста RUP3, изопропилового эфира 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, наблюдалась практически линейная фармакокинетика при увеличении дозы. Численные данные для каждого соединения, показанного на фиг. 1, можно найти в таблице, приведенной ниже. Зависимость площади под фармакокинетической кривой от дозы при увеличении дозы Также на фиг. 1 показаны соединение A [а именно изопропиловый эфир 4-[1-(2-фтор-4 метансульфонилфенил)-1H-пиразоло[3,4-d]пиримидин-4-илокси]пиперидин-1-карбоновой кислоты], которое описано в классе соединений, найденном в PCT/US2004/022417; соединение В [а именно, (2-фтор 4-метансульфонилфенил)-6-[1-(3-изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-илокси]-5-метилпиримидин-4-иламин], которое описано в классе соединений, найденном в PCT/US2004/022327; соединение C [а именно изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3-иламино)-5 метоксипиримидин-4-илокси]пиперидин-1-карбоновой кислоты], которое описано в классе соединений,найденном в PCT/US2006/000567; соединение D [а именно изопропиловый эфир 4-[6-(6- 19015343 метансульфонил-4-метилпиридин-3-иламино)-5-метоксипиримидин-4-илокси]пиперидин-1-карбоновой кислоты], которое описано в классе соединений, найденном в PCT/US2006/000567; соединение E, которое описано в классе соединений, найденном в PCT/US2004/001267; соединение F [а именно 6-[1-(3 изопропил-[1,2,4]оксадиазол-5-ил)пиперидин-4-илокси]-5-метоксипиримидин-4-ил-(6-метансульфонил 2-метилпиридин-3-ил)амин], которое описано в классе соединений, найденном в PCT/US2006/000567; и соединение G [а именно изопропиловый эфир 4-[5-метокси-6-(2-метил-6-[1,2,4]триазол-1-ил-пиридин-3 иламино)пиримидин-4-илокси]пиперидин-1-карбоновой кислоты], которое описано в классе соединений,найденном в PCT/US2004/022327. Хотя агонисты RUP3 могут быть полезны в качестве лекарственных средств при лечении ряда нарушений метаболизма, описанных в этом документе, соединения, проявляющие линейную фармакокинетику при увеличении дозы, такие как изопропиловый эфир 4-[6-(6-метансульфонил-2-метилпиридин-3 иламино)-5-метилпиримидин-4-илокси]пиперидин-1-карбоновой кислоты, являются особенно полезными по ряду причин. Например, соединения с линейной зависимостью воздействия от дозы имеет следующие выгоды: фармакокинетические параметры не изменяются при введение различных доз или при введении лекарственного соединения через различные пути введения или в виде разовой, или множественных доз. Менее вероятна передозировка при небольшом увеличении дозы. Эти соединения имеют лучшую всасываемость и могут иметь улучшенную пероральную биодоступность. Лекарство с нелинейной зависимостью может иметь пониженную пероральную биодоступность вследствие нескольких причин, включая приближение концентрации лекарственного средства к пределу растворимости лекарственного средства в желудочно-кишечном тракте или насыщаемую систему переноса при всасывании. В доклинической разработке лекарственного соединения эти соединения будут способны к более сильному воздействию при введении более высоких доз. Специалисты понимают, что можно осуществить различные модификации, дополнения, замены и вариации иллюстративных примеров, приведенных в этом описании, не отклоняясь от духа изобретения,и которые, поэтому, считаются входящими в объем изобретения. Все указанные выше документы, включающие, но не ограниченные эти, опубликованные статьи, и предварительные и постоянные патентные заявки полностью включены в настоящее описании посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, выбранное из соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и гидратов. 2. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 3. Способ лечения связанного с метаболизмом расстройства у индивидуума, включающий введение указанному индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2. 4. Способ по п.3, в котором указанное связанное с метаболизмом расстройство выбрано из группы,состоящей из диабета I типа, диабета II типа, нарушенной глюкозотолерантности, инсулинорезистентности, гипергликемии, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии или синдрома X. 5. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является диабетII типа. 6. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является гипергликемия. 7. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является гиперлипидемия. 8. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является гипертриглицеридемия. 9. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является диабет I типа. 10. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является дислипидемия. 11. Способ по п.3, в котором указанным связанным с метаболизмом расстройством является синдром X. 12. Способ по любому из пп.3-11, в котором указанный индивидуум представляет собой млекопи- 20015343 тающее. 13. Способ по п.12, в котором указанное млекопитающее представляет собой человека. 14. Способ лечения ожирения у индивидуума, включающий введение указанному индивидууму,нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2. 15. Способ снижения потребления пищи индивидуумом, включающий введение указанному индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2. 16. Способ индуцирования чувства насыщения у индивидуума, включающий введение указанному индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2. 17. Способ контроля или снижения набора веса индивидуумом, включающий в себя введение указанному индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или фармацевтической композиции по п.2. 18. Способ по любому из пп.15-17, в котором указанный индивидуум представляет собой млекопитающее. 19. Способ по п.18, в котором указанное млекопитающее представляет собой человека. 20. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 18,5 до примерно 45. 21. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 25 до примерно 45. 22. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 30 до примерно 45. 23. Способ по п.19, в котором индекс массы тела указанного человека составляет от примерно 35 до примерно 45. 24. Применение соединения по п.1 для получения лекарственного препарата для лечения связанного с метаболизмом расстройства. 25. Применение соединения по п.1 для получения лекарственного препарата для лечения диабета I типа, диабета II типа, нарушенной глюкозотолерантности, инсулинорезистентности, гипергликемии, гиперлипидемии, гипертриглицеридемии, гиперхолестеринемии, дислипидемии или синдрома X. 26. Применение соединения по п.1 для получения лекарственного препарата для снижения потребления пищи у индивидуума. 27. Применение соединения по п.1 для получения лекарственного препарата для индуцирования чувства насыщения у индивидуума. 28. Применение соединения по п.1 для получения лекарственного препарата для контроля или снижения набора веса у индивидуума. 29. Применение по любому из пп.26-28, в котором указанный индивидуум представляет собой млекопитающее. 30. Применение по п.29, в котором указанное млекопитающее представляет собой человека. 31. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 18,5 до примерно 45. 32. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 25 до примерно 45. 33. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 30 до примерно 45. 34. Применение по п.30, в котором индекс массы тела указанного человека составляет от примерно 35 до примерно 45. 35. Способ получения фармацевтической композиции, включающий смешивание соединения по п.1 и фармацевтически приемлемого носителя.
МПК / Метки
МПК: A61K 31/506, C07D 401/14, A61P 3/00
Метки: лечение, расстройств, ним, связанных, модуляторы, метаболизма
Код ссылки
<a href="https://eas.patents.su/23-15343-modulyatory-metabolizma-i-lechenie-svyazannyh-s-nim-rasstrojjstv.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы метаболизма и лечение связанных с ним расстройств</a>
Предыдущий патент: Способы лечения аутоиммунных заболеваний с использованием слитой молекулы taci-ig
Следующий патент: Бензофуро- и бензотиенопиримидиновые модуляторы гистаминового рецептора н4
Случайный патент: Производные индола для лечения заболеваний цнс












