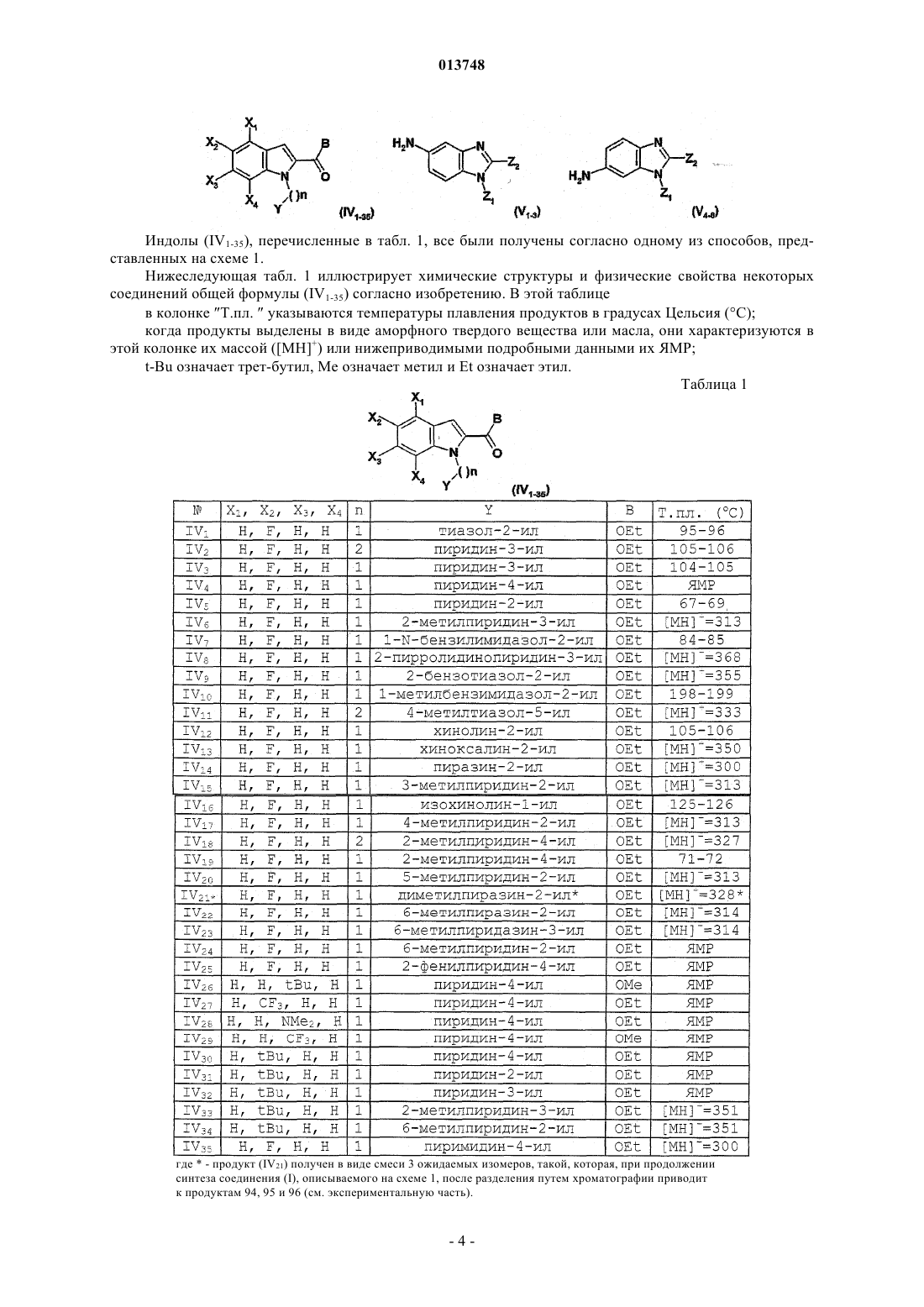
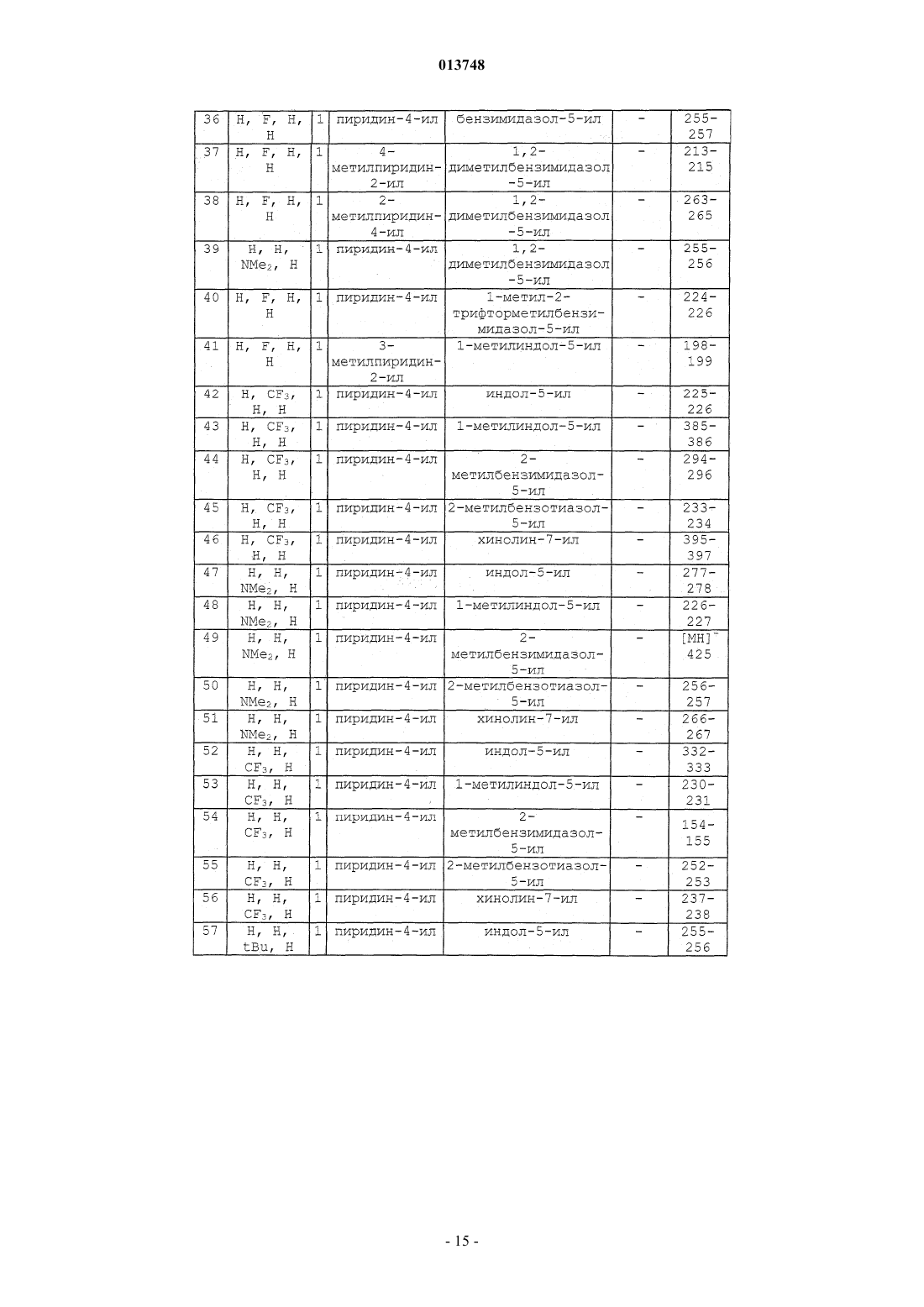
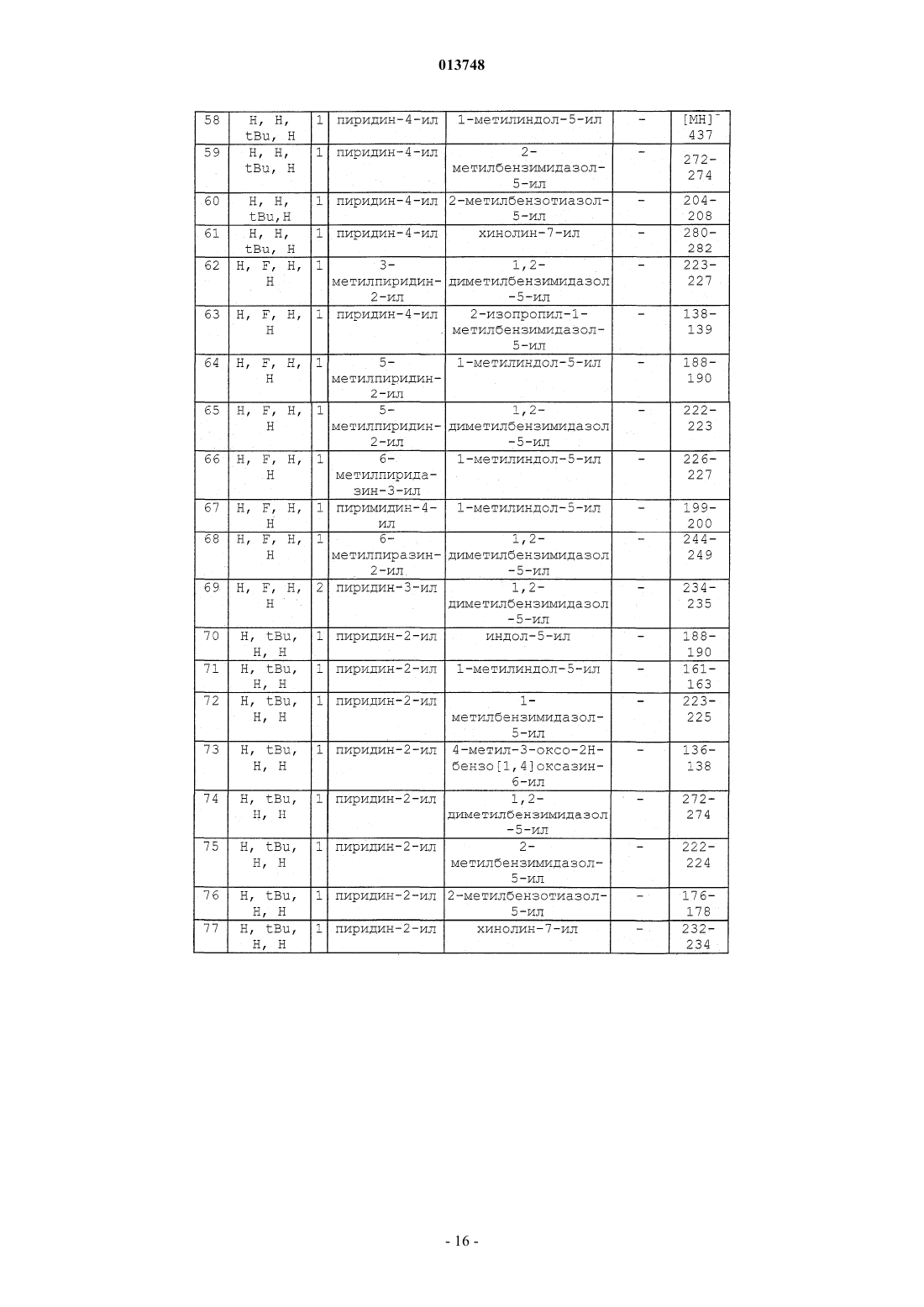
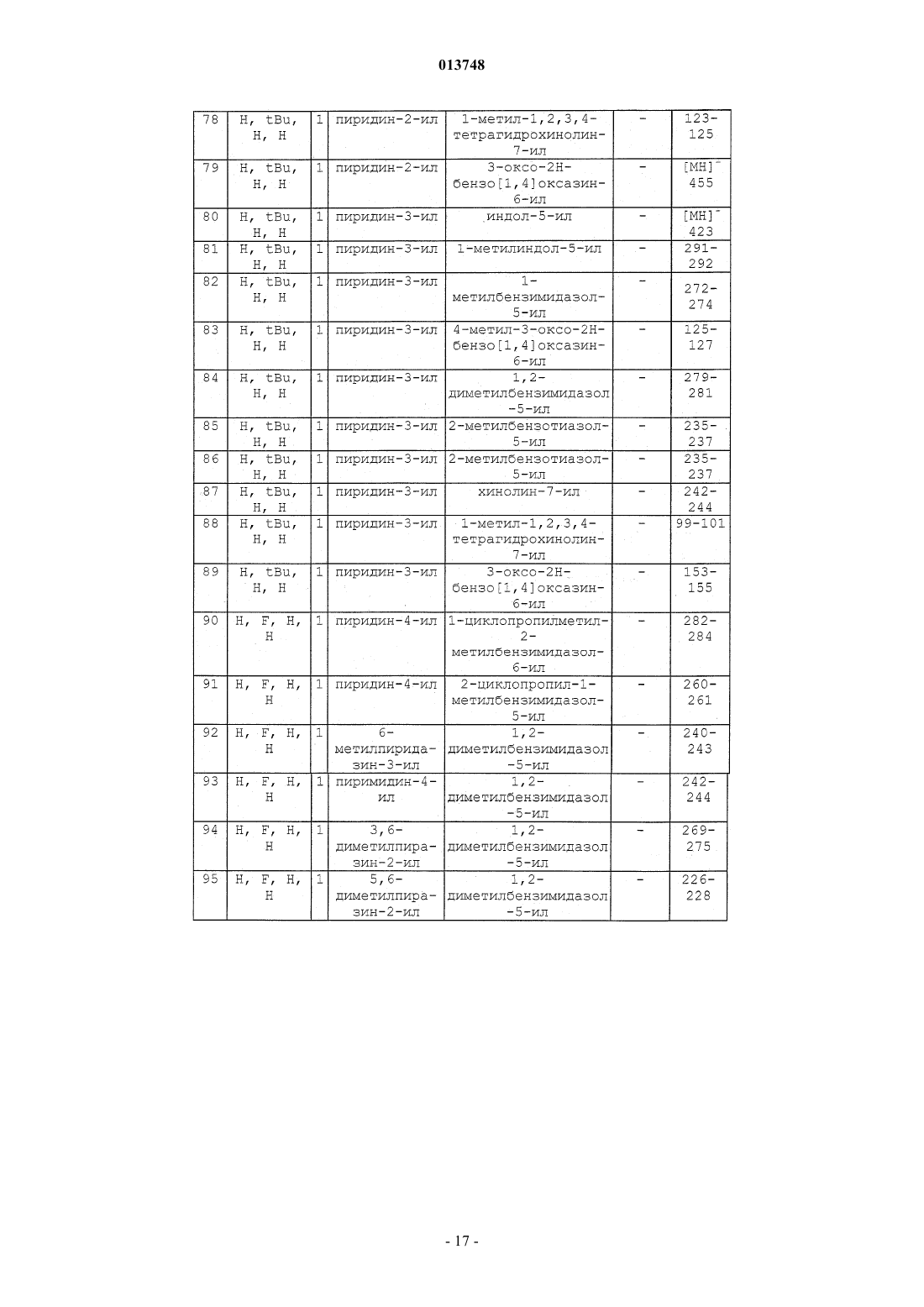
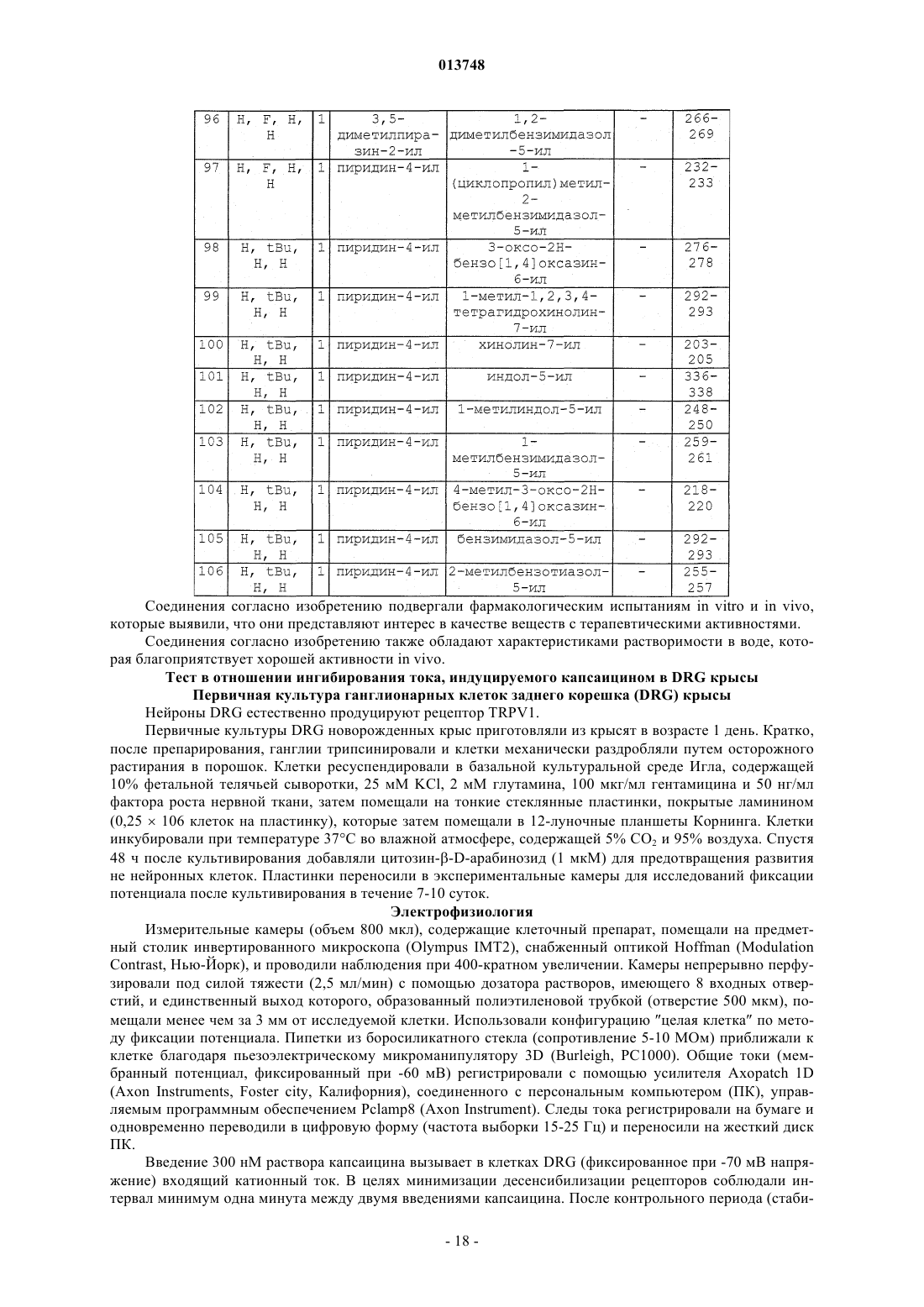
Производные n-(гетероарил)-1-гетероарилалкил-1н-индол-2-карбоксамидов, их получение и их применение в терапии
Формула / Реферат
1. Соединение, отвечающее формуле (I)
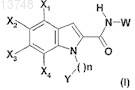
в которой X1, X2, Х3, Х4 означают, независимо друг от друга, Н, F, CF3, N(CH3)2или tBu;
W означает группу, выбранную из бензимидазолила, индолила, хинолила, тетрагидрохинолила, бензотиазолила или бензоксазинила; причем эти группы могут быть замещены 1 или 2 раза группами, выбранными из (C1-С6)алкила, С3-циклоалкила и оксо, которые сами могут быть замещены С3-циклоалкилом;
n равно 1, 2 или 3;
Y означает группу, выбранную из пиридила, имидазолила, бензимидазолила, тиазолила, хинолила, изохинолила, фурила, хиноксалинила, пиридазинила, пиразинила или пиримидинила; причем эти группы могут быть замещены 1 или 2 раза группами, выбранными из (C1-С6)алкила, (C1-С6)фторалкила, бензила, морфолинила;
в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата.
2. Соединение формулы (I) по п.1, отличающееся тем, что n равно 1 или 2;
в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата.
3. Способ получения соединения формулы (I) по п.1, отличающийся тем, что соединение общей формулы (IV)

в которой X1, Х2, Х3, Х4, Y и n имеют значения, как указанные в случае общей формулы (I) по п.1, и В означает (C1-С6)алкоксил, вводят во взаимодействие с амидом соединения общей формулы (V)
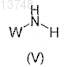
в которой W имеет значение, как указанное в случае общей формулы (I) по п.1,
при температуре кипения с обратным холодильником растворителя, причем амид соединения общей формулы (V) получают путем предварительного воздействия триметилалюминия на амины общей формулы (V).
4. Соединение формулы (IV), выбираемое среди следующих соединений:
этил-5-фтор-1-[(тиазол-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(пиридин-3-ил)этил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(пиридин-3-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(пиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(пиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(2-метилпиридин-3-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(1-N-бензилимидазол-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(2-пирролидинопиридин-3-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(бензотиазол-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(1-метилбензимидазол-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(4-метилтиазол-5-ил)этил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(хинолин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(хиноксалин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(пиразин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(3-метилпиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(изохинолин-1-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(4-метилпиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(2-метилпиридин-4-ил)этил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(2-метилпиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(5-метилпиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(диметилпиразин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(6-метилпиразин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(6-метилпиридазин-3-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(6-метилпиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(2-фенилпиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
метил-6-трет-бутил-1-[(пиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-трифторметил-1-[(пиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
этил-6-N-диметиламино-1-[(пиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
метил-6-трифторметил-1-[(пиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-трет-бутил-1-[(пиридин-4-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-трет-бутил-1-[(пиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-трет-бутил-1-[(пиридин-3-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-трет-бутил-1-[(2-метилпиридин-3-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-трет-бутил-1-[(6-метилпиридин-2-ил)метил]-1Н-индол-2-карбоксилат;
этил-5-фтор-1-[(пиримидин-4-ил)метил]-1Н-индол-2-карбоксилат;
в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата.
5. Соединение формулы (V), выбираемое среди следующих соединений:
5-амино-1-(циклопропил)метил-2-метил-1Н-бензимидазол;
5-амино-2-циклопропил-1-метил-1Н-бензимидазол;
5-амино-2-изопропил-1-метил-1Н-бензимидазол;
6-амино-1-(циклопропил)метил-2-метил-1Н-бензимидазол;
6-амино-2-циклопропил-1-метил-1Н-бензимидазол;
6-амино-2-изопропил-1-метил-1Н-бензимидазол;
в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата.
6. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1 или 2, или фармацевтически приемлемую соль, или гидрат, или сольват соединения формулы (I).
7. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1 или 2 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
8. Применение соединения формулы (I) по любому из пп.1 или 2 для получения лекарственного средства, предназначенного для профилактики или лечения патологий, в которых участвуют рецепторы типа TRPV1.
9. Применение соединения формулы (I) по п.8 для получения лекарственного средства, предназначенного для профилактики или лечения боли, воспаления, урологических нарушений, гинекологических нарушений, желудочно-кишечных нарушений, респираторных нарушений, псориаза, зуда, дермальных ирритаций, ирритаций глаз или слизистых оболочек, герпеса, опоясывающего лишая или лечения депрессии или диабета.
Текст
013748 Объектом изобретения являются соединения, производные N-(гетероарил)-1-гетероарилалкил-1 Ниндол-2-карбоксамидов, которые обладают антагонистической активностью in vitro и in vivo по отношению к рецепторам типа TRPV1 (или VR1). Первый объект изобретения относится к соединениям, отвечающим нижеприводимой общей формуле (I). Другой объект изобретения относится к способам получения соединений общей формулы (I). Следующий объект изобретения относится к применению соединений общей формулы (I), в частности, в лекарственных средствах или в фармацевтических композициях. Соединения согласно изобретению отвечают общей формуле (I) в которой X1, X2, Х 3, Х 4 означают, независимо друг от друга, Н, F, CF3, N(CH3)2 или tBu;W означает группу, выбранную из бензимидазолила, индолила, хинолила, тетрагидрохинолила,бензотиазолила или бензоксазинила; причем эти группы могут быть замещены 1 или 2 раза группами,выбранными из (C1-С 6)алкила, С 3-циклоалкила и оксо, которые сами могут быть замещены С 3-циклоалкилом;Y означает группу, выбранную из пиридила, имидазолила, тиазолила, хинолила, изохинолила, фурила, хиноксалинила, пиридазинила, пиразинила или пиримидинила; причем эти группы могут быть замещены 1 или 2 раза группами, выбранными из (C1-С 6)алкила, (C1-C6)фторалкила, бензила, морфолинила. Среди соединений общей формулы (I), являющихся объектами настоящего изобретения, первая подгруппа соединений образована соединениями, в которых Х 2 отличается от атома водорода. Среди соединений общей формулы (I), являющихся объектами настоящего изобретения, вторая подгруппа соединений образована соединениями, в которых n равно 1 или 2. Среди соединений общей формулы (I), являющихся объектами настоящего изобретения, третья подгруппа соединений образована соединениями, в которых W означает бензимидазолил, причем атом или атомы углерода и/или азота вышеуказанной группы W, возможно, замещены, как указано в случае общей формулы (I);Y означает пиридинил, возможно замещенный, как указано в случае общей формулы (I). Соединения, в которых одновременно X1, Х 2, Х 3, Х 4, W, n и Y являются такими, как определенные в вышеуказанных подгруппах соединений, образуют четвертую подгруппу. В рамках настоящего изобретения под (Ct-Cz), где t и z имеют значения 1-7, понимают углеродную цепь, которая может включать от t до z атомов углерода, например (C1-С 3)углеродная цепь, которая может включать 1-3 атома углерода; под термином алкил понимают линейную или разветвленную насыщенную алифатическую группу; в качестве примеров можно назвать метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил,пентил и т.д.; под термином циклоалкил понимают циклическую углеродную группу; в качестве примеров можно назвать циклопропил, циклобутил, циклопентил, циклогексил и т.д.; под термином фторалкил понимают алкильную группу, один или несколько атомов водорода которой замещены атомом фтора; под термином тиоалкил понимают радикал -S-алкил, где алкил имеет вышеуказанное значение; под термином арил понимают циклическую ароматическую группу, включающую 6-10 атомов углерода; в качестве примеров арильных групп можно назвать фенил или нафтил; под термином гетероарил понимают 5-10-членную циклическую ароматическую группу, содержащую 1-4 гетероатома, выбираемых среди О, S или N; в качестве примера можно назвать имидазолил,тиазолил, оксазолил, фуранил, тиофенил, оксадиазолил, тетразолил, пиридинил, пиразинил, пиримидинил, пиридазинил, индолил, бензофуранил, бензотиофенил, бензоксазолил, бензимидазолил, индазолил,бензотиазолил, изобензотиазолил, бензотриазолил, хинолинил, изохинолинил, хиноксалинил; под термином гетероцикл понимают 5-7-членную насыщенную, частично ненасыщенную или ароматическую циклическую группу, включающую от одного до трех гетероатомов, выбираемых среди О, S или N; под атомом галогена понимают фтор, хлор, бром или иод; оксо означает =O; тио означает =S.-1 013748 Соединения формулы (I) могут включать один или несколько асимметрических атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая туда рацемические смеси, составляют часть изобретения. Соединения формулы (I) могут существовать в форме основания или аддитивных солей с кислотами. Такие аддитивные соли составляют часть изобретения. Эти соли преимущественно получают с фармацевтически приемлемыми кислотами, однако соли с другими кислотами, пригодные, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. Соединения общей формулы (I) могут находиться в форме гидратов или сольватов, а именно в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения. В нижеследующем контексте под термином удаляемая группа понимают группу, которая может быть легко отщеплена от молекулы за счет разрыва гетеролитической связи, с удалением электронной пары. Эта группа также может быть легко заменена другой группой, например, во время реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксильная группа, такая как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат и т.д. Примеры удаляемых групп, а также ссылки на их получение представлены в книге J. March Advances in OrganicChemistry, 5-е изд., Wiley Interscience, 2001. Согласно изобретению соединения общей формулы (I) можно получать согласно способу, проиллюстрированному на нижеприводимой схеме 1. Схема 1 Согласно схеме 1 соединения общей формулы (IV) могут быть получены путем введения во взаимодействие соединения общей формулы (II), в которой X1, X2, Х 3, Х 4 имеют значения, как указанные в случае общей формулы (I), и В означает (C1-С 6)алкоксил с соединением общей формулы (III), в которойY и n имеют указанные в случае общей формулы (I) значения и GP означает удаляемую группу или GP означает гидроксильную группу. Соединения общей формулы (II) коммерчески доступны или их получают согласно многочисленным способам, описанным в литературе (например, D. Knittel, Synthesis, 2, 186 (1985); Т.М. Williams, J.Med. Chem., 36(9), 1291 (1993); заявка на патент Японии JP 2001151771 A2). Когда соединение общей формулы (III) является таким, что n равно 1, 2 или 3 и GP означает удаляемую группу, такую как атом хлора, брома или иода, реакция может быть осуществлена в присутствии основания, такого как гидрид натрия или карбонат калия, в полярном растворителе, таком как диметилформамид, диметилсульфоксид или ацетон (n=1: Kolasa Т., Bioorg. Med. Chem., 5(3), 507 (1997); n=2:Abramovitch R. , Synth., Commun., 25(l), 1 (1995. Когда соединение общей формулы (III) является таким, что n равно 1, 2 или 3 и GP означает гидроксильную группу, соединения общей формулы (IV) могут быть получены путем введения во взаимодействие соединения общей формулы (II) с соединением общей формулы (III) в присутствии фосфина, такого как, например, трифенилфосфин, и реагента, такого как, например, диэтилазодикарбоксилат, в виде раствора в растворителе, таком как дихлорметан или тетрагидрофуран (О. Mitsonobu, Synthesis, 1-28(1981. Соединение общей формулы (I) затем получают путем введения во взаимодействие соединения общей формулы (IV), такого как полученное выше, с амидом соединения общей формулы (V), в которой W имеет указанное в случае общей формулы (I) значение, при температуре кипения с обратным холодильником растворителя, такого как толуол. Амид соединения общей формулы (V) получают путем предварительного воздействия триметилалюминия на амины общей формулы (V). Соединения общих формул (I), (II) и (IV), в которых X1, Х 2, Х 3 и/или Х 4 означают цианогруппу или арил, могут быть получены путем реакции связывания, катализируемой металлом, таким как палладий,осуществляемой при использовании соединений соответствующих общих формул (I), (II) и (IV), в которых X1, Х 2, Х 3 и/или Х 4 означают удаляемую группу, например бром, согласно способам, которые описаны в литературе или которые известны специалисту в данной области. Соединения общих формул (I), (II) и (IV), в которых X1, Х 2, Х 3 и/или Х 4 означают группуC(O)NR1R2, могут быть получены из соединений соответствующих общих формул (I), (II) и (IV), в которых X1, X2, Х 3 и/или Х 4 означают цианогруппу, согласно способам, которые описаны в литературе или которые известны специалисту в данной области. Соединения общих формул (I), (II) и (IV), в которых X1, Х 2, Х 3 и/или Х 4 означают группу -S(О)алкил или -S(О)2-алкил, могут быть получены путем окисления соединений соответствующих общих формул (I), (II) и (IV), в которых X1, X2, Х 3 и/или Х 4 означают (C1-C6)тиоалкильную группу, согласно способам, которые описаны в литературе или которые известны специалисту в данной области. Соединения общих формул (I), (II) и (IV), в которых X1, X2, Х 3 и/или Х 4 означают группу NR1R2,NR3COR4 или NR3SO2R5, могут быть получены из соединений соответствующих общих формул (I), (II) и(IV), в которых X1, X2, Х 3 и/или Х 4 означают нитрогруппу, например, путем восстановления, затем ацилирования или сульфонилирования согласно способам, которые описаны в литературе или которые известны специалисту в данной области. Соединения общих формул (I), (II) и (IV), в которых X1, X2, Х 3 и/или Х 4 означают группу NR1R2,NR3COR4 или NR3SO2R5, могут быть получены из соединений соответствующих общих формул (I), (II) и(IV), в которых X1, X2, Х 3 и/или Х 4 означают, например, атом брома, путем реакции связывания, соответственно, с амином, амидом или сульфонамидом в присутствии основания, фосфина и катализатора на основе палладия согласно способам, которые описаны в литературе или которые известны специалисту в данной области. Соединения общих формул (I), (II) и (IV), в которых X1, Х 2, Х 3 и/или Х 4 означают группу SO2NR1R2,могут быть получены способом, аналогичным таковому, описанному в Pharmazie, 45, 346 (1990), или согласно способам, которые описаны в литературе или которые известны специалисту в данной области. Соединения общей формулы (I), в которой R7 означает атом водорода, могут быть получены из соединений общей формулы (I), в которой, например, R7 означает фенилметил, путем гидрирования, катализируемого, например, палладием, или любыми способами, которые описаны в литературе или которые известны специалисту в данной области. В вышеприведенном контексте соединения формулы (III) являются коммерчески доступными, описываемыми в литературе (Carling R.W. и др., J. Med. Chem., (47), 1807-1822 (2004) или Russel M.G.N. и др., J. Med. Chem., (48), 1367-1383 (2005, или доступными путем получения при использовании способов, известных специалисту в данной области. Соединения (V) и другие реагенты, когда способ их получения не описан, являются коммерчески доступными или описываемыми в литературе (например, WO 03049702, WO 03068749). Объектом изобретения согласно другому из его аспектов являются также соединения формулы(IV1-35) или (V1-6). Эти соединения пригодны в качестве промежуточных продуктов синтеза соединений формулы (I) и, вообще говоря, при получении предназначенных для терапии соединений. Индолы (IV1-35), перечисленные в табл. 1, все были получены согласно одному из способов, представленных на схеме 1. Нижеследующая табл. 1 иллюстрирует химические структуры и физические свойства некоторых соединений общей формулы (IV1-35) согласно изобретению. В этой таблице в колонке Т.пл.указываются температуры плавления продуктов в градусах Цельсия (С); когда продукты выделены в виде аморфного твердого вещества или масла, они характеризуются в этой колонке их массой ([МН]+) или нижеприводимыми подробными данными их ЯМР; где- продукт (IV21) получен в виде смеси 3 ожидаемых изомеров, такой, которая, при продолжении синтеза соединения (I), описываемого на схеме 1, после разделения путем хроматографии приводит к продуктам 94, 95 и 96 (см. экспериментальную часть).-4 013748 Ниже представлены данные ЯМР некоторых соединений табл. 1: СоединениеIV4: 1 Н-ЯМР (CDCl3),(м.д.): 1,3 (т, 3 Н); 4,2 (кв, 2 Н); 5,79 (с, 2 Н); 6,82 (д, 2 Н); 7,07(с, 1 Н); 7,99 (д, 1 Н); 8,08 (с, 1 Н); 8,45 (дхд, 2 Н). СоединениеIV30: 1 Н-ЯМР (CDCl3),(м.д.): 1,41 (м, 12 Н); 4,35 (кв, 2 Н); 5,81 (с, 2 Н); 6,97 (д, 2 Н); 7,21 (д, 1 Н); 7,45 (м, 2 Н); 7,74 (м, 1 Н); 8,54 (д, 2 Н). СоединениеIV31: 1 Н-ЯМР (ДМСО-d6),(м.д.): 1,25 (т, 3 Н); 1,32 (с, 9 Н); 4,25 (кв, 2 Н); 5,88 (с,2 Н); 6,79 (д, 1 Н); 7,22 (м, 1 Н); 7,32 (с, 1 Н); 7,4 (м, 2 Н); 7,65 (м, 2 Н); 8,46 (м, 1 Н). СоединениеIV32: 1 Н-ЯМР (ДМСО-d6),(м.д.): 1,28 (т, 3 Н); 1,32 (с, 9 Н); 4,29 (кв, 2 Н); 5,85 (с,2 Н); 7,27 (м, 1 Н); 7,35 (м, 2 Н); 7,48 (м, 2 Н); 7,65 (д, 1 Н); 8,36 (д, 1 Н); 8,41 (д, 1 Н). Амины (V1-6) могут быть получены согласно пути синтеза, представленного на схеме 2. На этой схеме Z1 и Z2 означают, каждый, независимо друг от друга, (C1-C6)алкил, (С 3-С 7)циклоалкил или (С 3-С 7)циклоалкил-(C1-C3)алкилен. Циклизация с использованием 4-нитро-1,2-фенилендиамина (VI) и реагента, такого как карбоновая кислота формулы Z2-CO2H, в которой Z2 означает (C1-C6)алкил, (С 3-С 7)циклоалкил или (С 3-С 7)циклоалкил-(C1-C3)алкилен, позволяет получать бензимидазол (VII). Он затем может быть замещен группой Z1 путем введения во взаимодействие с соединением формулы Z1-GP, где GP имеет указанное в случае схемы 1 значение и Z1 означает (C1-С 6)алкил, (С 3-С 7)циклоалкил или (С 3-С 7)циклоалкил-(C1-C3)алкилен,например, в присутствии основания, такого как гидрид натрия, в растворителе, как тетрагидрофуран. Получаемую смесь бензимидазолов (VIII) затем превращают в амины (V1-6) путем восстановления, например путем каталитического гидрирования в присутствии катализатора, такого как палладий-на-угле,или согласно любому другому способу восстановления нитрогруппы до аминогруппы, известному специалисту в данной области. Схема 2-5 013748 Амины (V1-6) перечислены в табл. 2 а и 2b. Описание способа получения одного из этих аминов подробно указано в экспериментальной части. Таблица 2 а В следующих примерах описывается получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими объема охраны изобретения и служат только для иллюстрации настоящего изобретения. Номера приводимых в примерах соединений соответствуют таковым, указанным в табл. 3. Элементные микроанализы, анализы LC-MS (жидкостная хроматография в сочетании с масс-спектрометрией), ИК-спектры или ЯМР-спектры подтверждают структуры полученных соединений. Пример 1 (соединение 3). Гидрохлорид (1:1) N-(1-метил-1 Н-индол-5-ил)-5-фтор-1-[(пиридин-4 ил)метил]-1 Н-индол-2-карбоксамида. 1.1. Этил-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат. Добавляют по каплям раствор 1 г (4,73 ммоль) этил-5-фтор-1 Н-индол-2-карбоксилата к перемешиваемой при температуре 0 С и в атмосфере аргона суспензии 0,38 г (9,45 ммоль) 60%-ного гидрида натрия в 10 мл диметилформамида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 30 мин при температуре 20 С. Реакционную смесь охлаждают и несколькими порциями добавляют 1,24 г (4,2 ммоль) 4-бромметилпиридингидробромида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 30 мин при температуре 20 С. Реакционную смесь снова охлаждают до температуры 0 С и добавляют дополнительные 0,38 г (9,45 ммоль) 60%-ного гидрида натрия в 10 мл диметилформамида. После выдерживания в течение 30 мин при температуре 0 С несколькими порциями добавляют 1,24 г (4,2 ммоль) 4-бромметилпиридингидробромида. Реакционную смесь затем перемешивают в течение 20 ч при температуре 20 С. Спустя это время смесь выливают в раствор из 100 мл воды со льдом и 100 мл диэтилового эфира. Органическую фазу отделяют, а водную фазу снова экстрагируют с помощью 100 мл диэтилового эфира. Органические фазы объединяют, промывают с помощью 50 мл воды, затем сушат над сульфатом натрия, отфильтровывают, затем концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-ацетон). Получают 0,65 г ожидаемого продукта в виде масла, используемого таким, какой есть, при продолжении синтеза. 1.2. Гидрохлорид (1:1) N-(1-метил-1 Н-индол-5-ил)-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2 карбоксамида (соединение 3). В атмосфере аргона к раствору 0,18 г (1,21 ммоль) 5-амино-1-метил-1 Н-индола (I.T. Forbes, J. Med.Chem., 36(8), 1104 (1993 в 10 мл безводного толуола добавляют 1,26 мл триметилалюминия (2 М раствор в толуоле). Спустя 15 мин добавляют 0,3 г (1,01 ммоль) этил-5-фтор-1-[(пиридин-4-ил)метил]-1 Ниндол-2-карбоксилата, полученного на стадии 1.1. Кипятят с обратным холодильником в течение 4 ч,затем реакционную среду перемешивают при комнатной температуре в течение ночи. Выливают ее на лед и экстрагируют два раза по 30 мл дихлорметана. Органические фазы объединяют, промывают с помощью 50 мл воды, затем сушат над сульфатом натрия, отфильтровывают, затем концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-ацетон). Получают 0,35 г твердого вещества, которое высушивают при пониженном давлении.-6 013748 Температура плавления (основание): 204-205 С. Полученное твердое вещество обрабатывают с помощью 30 мл дихлорметана и добавляют 0,26 мл 4 н. раствора хлороводорода в диоксане. Раствор концентрируют при пониженном давлении и полученный остаток перекристаллизовывают из смеси изопропанола и метанола. Таким образом, получают 0,33 г ожидаемого продукта в виде гидрохлорида. Температура плавления (1 HCl): 258-260 С. 1(м, 2 Н); 7,52 (м, 5 Н); 7,9 (с, 1 Н); 8,7 (д, 2 Н). Пример 2 (соединение 4). Гидрохлорид (2:1) N-(1-метил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(пиридин-3-ил)метил]-1 Н-индол-2-карбоксамида. 2.1. Этил-5-фтор-1-[(пиридин-3-ил)метил]-1 Н-индол-2-карбоксилат. Добавляют по каплям раствор 1 г (4,73 ммоль) этил-5-фтор-1 Н-индол-2-карбоксилата к перемешиваемой при температуре 0 С и в атмосфере аргона суспензии 0,38 г (9,45 ммоль) 60%-ного гидрида натрия в 10 мл диметилформамида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 30 мин при температуре 20 С. Реакционную смесь охлаждают и несколькими порциями добавляют 1,24 г (4,8 ммоль) 3-бромметилпиридингидробромида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 30 мин при температуре 20 С. Реакционную смесь снова охлаждают до температуры 0 С и добавляют дополнительные 0,38 г (9,45 ммоль) 60%-ного гидрида натрия в 10 мл диметилформамида. После выдерживания в течение 30 мин при температуре 0 С, несколькими порциями добавляют 1,24 г (4,8 ммоль) 3-бромметилпиридингидробромида. Реакционную смесь затем перемешивают в течение 58 ч при температуре 20 С. Смесь затем выливают в раствор из 100 мл воды со льдом и 100 мл диэтилового эфира. Органическую фазу отделяют, а водную фазу снова экстрагируют с помощью 100 мл диэтилового эфира. Органические фазы объединяют, промывают с помощью 50 мл воды, затем сушат над сульфатом натрия, отфильтровывают, затем концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-ацетон). Получают 0,5 г ожидаемого продукта в виде твердого вещества, используемого таким, какое есть, при продолжении синтеза. Т.пл.=104-105 С. 2.2. Гидрохлорид (2:1) N-(1-метил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(пиридин-3-ил)метил]-1 Ниндол-2-карбоксамида (соединение 4). В атмосфере аргона к раствору 0,414 г (2,82 ммоль) 5-амино-1-метил-1 Н-бензимидазола в 10 мл безводного толуола добавляют 4,1 мл триметилалюминия (2 М раствор в толуоле). Спустя 15 мин добавляют 0,7 г (2,35 ммоль) этил-5-фтор-1-[(пиридин-3-ил)метил]-1 Н-индол-2-карбоксилата, полученного на стадии 2.1. Кипятят с обратным холодильником в течение 4 ч, затем реакционную среду перемешивают при комнатной температуре в течение ночи. Выливают ее на 100 г льда и 50 мл дихлорметана. Получают суспензию, которую отфильтровывают и промывают водой и диэтиловым эфиром. Остаток очищают препаративной хроматографией на глиноземе (элюент: дихлорметан-метанол). Получают 0,36 г твердого вещества, которое высушивают при пониженном давлении. Полученное твердое вещество обрабатывают с помощью 30 мл дихлорметана и добавляют 0,55 мл 4 н. раствора хлороводорода в диоксане. Раствор концентрируют при пониженном давлении и полученный остаток перекристаллизовывают из смеси изопропанола и метанола. Таким образом, получают 0,36 г ожидаемого продукта в виде гидрохлорида. Температура плавления (2 HCl): 268-270 С. 1 Н-ЯМР (ДМСО-D6),(м.д.): 4,03 (с, 3 Н); 6 (с, 2 Н); 7,18 (дхд, 1 Н); 7,56 (дхд, 1 Н); 7,68 (м, 2 Н); 7,9(м, 4 Н); 8,41 (с, 1 Н); 8,69 (м, 2 Н); 9,59 (с, 1 Н). Пример 3 (соединение 6). Гидрохлорид (2:1) N-(1,2-диметил-1 Н-бензимидазол-5-ил)-5-трет-бутил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксамида. 3.1. Этил-5-трет-бутил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат. Добавляют по каплям раствор 1 г (4,08 ммоль) этил-5-трет-бутил-1 Н-индол-2-карбоксилата к перемешиваемой при температуре 0 С и в атмосфере аргона суспензии 0,33 г (8,15 ммоль) 60%-ного гидрида натрия в 10 мл диметилформамида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 30 мин при температуре 20 С. Реакционную смесь охлаждают и несколькими порциями добавляют 1,06 г (4,08 ммоль) 4-бромметилпиридингидробромида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 30 мин при температуре 20 С. Реакционную смесь снова охлаждают до температуры 0 С и добавляют дополнительные 0,33 г (8,15 ммоль) 60%-ного гидрида натрия в 10 мл диметилформамида. После выдерживания в течение 30 мин при температуре 0 С несколькими порциями добавляют 1,06 г (4,08 ммоль) 4-бромметилпиридингидробромида. Реакционную смесь затем перемешивают в течение 20 ч при температуре 20 С. Спустя это время, смесь выливают в раствор из 100 мл воды со льдом и 70 мл диэтилового эфира. Органическую фазу отделяют, а водную фазу снова экстрагируют с помощью 50 мл диэтилового эфира. Органические фазы объединяют, промывают с помощью 50 мл воды,затем сушат над сульфатом натрия, отфильтровывают, затем концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-ацетон). Получают 0,7 г ожи-7 013748 даемого продукта в виде масла, используемого таким, какой есть, при продолжении синтеза. 3.2. Гидрохлорид (2:1) N-(1,2-диметил-1 Н-бензимидазол-5-ил)-5-трет-бутил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксамида(соединение 6). В атмосфере аргона к раствору 0,24 г (1,43 ммоль) 5-амино-1,2-диметил-1 Н-бензимидазола(WO 2002059110) в 20 мл безводного толуола добавляют 0,9 мл триметилалюминия (2 М раствор в толуоле). Спустя 15 мин добавляют 0,4 г (1,19 ммоль) этил-5-трет-бутил-1-[(пиридин-4-ил)метил]-1 Ниндол-2-карбоксилата, полученного на стадии 3.1. Кипятят с обратным холодильником в течение 4 ч,затем реакционную среду перемешивают при комнатной температуре в течение ночи. Выливают ее на 150 г льда и 70 мл дихлорметана. Отделяют водную фазу, которую экстрагируют два раза по 30 мл дихлорметана. Органические фазы объединяют, промывают с помощью 50 мл воды, затем сушат над сульфатом натрия, отфильтровывают, затем концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-метанол). Получают 0,4 г твердого вещества, которое высушивают при пониженном давлении. Температура плавления (основание): 270-272 С. Полученное твердое вещество обрабатывают с помощью 30 мл смеси 9:1 дихлорметана и метанола и добавляют 0,5 мл 4 н. раствора хлороводорода в диоксане. Раствор концентрируют при пониженном давлении и полученный остаток перекристаллизовывают из смеси этанола и воды. Таким образом, получают 0,22 г ожидаемого продукта в виде гидрохлорида. Температура плавления (2 HCl): 295-300 С. 1 Н-ЯМР (ДМСО-D6),(м.д.): 1,31 (с, 9 Н), 2,79 (с, 3 Н), 3,89 (с, 3 Н); 6,08 (с, 2 Н); 7,42 (м, 4.Н); 7,8 (м,4 Н); 8,3 (с, 1 Н); 8,7 (д, 2 Н); 10,9 (с, 1 Н обмениваемый). Пример 4 (соединение 7). Гидрохлорид (2:1) N-(1,2-диметил-1 Н-бензимидазол-5-ил)-5-фтор-1[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксамида (соединение 7). В атмосфере аргона к раствору 0,27 г (1,61 ммоль) 5-амино-1,2-диметил-1 Н-бензимидазола(WO 02059110) в 20 мл безводного толуола добавляют 1 мл триметилалюминия (2 М раствор в толуоле). Спустя 15 мин добавляют 0,4 г (1,34 ммоль) этил-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2 карбоксилата, полученного на первой стадии примера 1. Кипятят с обратным холодильником в течение 3 ч, затем реакционную среду перемешивают при комнатной температуре в течение ночи. Выливают ее на лед и экстрагируют два раза по 30 мл дихлорметана. Органические фазы объединяют, промывают с помощью 50 мл воды, затем сушат над сульфатом натрия, отфильтровывают, затем концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-ацетон). Получают 0,46 г твердого вещества, которое высушивают при пониженном давлении. Температура плавления (основание): 249-250 С. Полученное твердое вещество обрабатывают с помощью 30 мл дихлорметана и добавляют 0,26 мл 4 н. раствора хлороводорода в диоксане. Раствор концентрируют при пониженном давлении и полученное твердое вещество перекристаллизовывают из смеси изопропанола и метанола. Таким образом, получают 0,33 г ожидаемого продукта в виде гидрохлорида. Температура плавления (2 HCl): 285-287 С. 1 Н-ЯМР (ДМСО-D6),(м.д.): 2,8 (с, 3 Н), 3,87 (с, 3 Н); 6,1 (с, 2 Н); 7,16 (дхд, 1 Н); 7,51 (м, 4 Н); 7,75 (с,1 Н); 7,85 (д, 2 Н); 8,3 (с, 1 Н); 8,75 (д, 2 Н). Пример 5 (соединение 11). N-(1-Метил-1 Н-индол-5-ил)-5-фтор-1-[(пиридин-3-ил)этил]-1 Ниндол-2-карбоксамид. 5.1. Этил-5-фтор-1-[(пиридин-3-ил)этил]-1 Н-индол-2-карбоксилат. Добавляют по каплям раствор 0,365 г (1,44 ммоль) 1,1'-(азодикарбонил)дипиперидина в 10 мл тетрагидрофурана к раствору 0,2 г (0,97 ммоль) этил-5-фтор-1 Н-индол-2-карбоксилата, 0,178 г (1,45 ммоль) 2-(пиридин-3-ил)этанола и 0,36 мл (1,44 ммоль) трибутилфосфина в 30 мл тетрагидрофурана. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем концентрируют при пониженном давлении и обрабатывают с помощью 50 мл циклогексана. Суспензию после этого отфильтровывают и фильтрат хроматографируют на колонке с диоксидом кремния (элюент: дихлорметан-метанол). Получают 0,125 г ожидаемого продукта. 5.2. N-(1-Метил-1 Н-индол-5-ил)-5-фтор-1-[(пиридин-3-ил)этил]-1 Н-индол-2-карбоксамид (соединение 11). В атмосфере аргона и при температуре 0 С к раствору 0,7 г (0,478 ммоль) 5-амино-1-метил-1 Ниндола (I.T. Forbes, J. Med. Chem., 36(8), 1104 (1993 в 5 мл безводного толуола добавляют 0,54 мл триметилалюминия (2 М раствор в толуоле). Спустя 15 мин добавляют 0,125 г (0,4 ммоль) этил-5-фтор-1[(пиридин-3 ил)этил]-1 Н-индол-2-карбоксилата, полученного на стадии 5.1. Кипятят с обратным холодильником в течение 5 ч, затем реакционную среду перемешивают при комнатной температуре в течение ночи. Выливают ее на 50 г льда, 10 мл 1 н. соляной кислоты и 30 мл этилацетата. Органическую фазу отделяют и добавляют 15 мл 1 н. раствора гидроксида натрия к водной фазе, которую экстрагируют с помощью дополнительных 30 мл этилацетата. Органические фазы объединяют, промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении.-8 013748 Полученный остаток обрабатывают с помощью 15 мл диизопропилового эфира и нерастворимую часть отфильтровывают, затем высушивают при пониженном давлении. Таким образом, выделяют 50 мг ожидаемого продукта в виде твердого вещества. Температура плавления (основание): 188-189 С. 1 Н-ЯМР (ДМСО-D6),(м.д.): 3,19 (т, 2 Н); 3,85 (с, 3 Н); 4,85 (т, 2 Н); 6,49(д, 1 Н); 6,92 (с, 1 Н); 7,1 (м,3 Н); 7,29 (м, 4 Н); 7,49 (дхт, 1 Н); 7,75 (м, 1 Н); 7,9 (с, 1 Н); 8,21 (д, 1 Н); 8,4 (д, 1 Н). Пример 6 (соединение 94, 95 и 96).N-(1,2-Диметил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(3,5-диметилпиразин-2-ил)метил]-1 Н-индол-2 карбоксамид (соединение 96). 6.1. (Хлорметил)диметилпиразин (смесь 3 изомеров). Добавляют в течение 1 ч, 7,6 г (32,74 ммоль) трихлоризоциануровой кислоты к доведенному до температуры кипения с обратным холодильником раствору 10 г триметилпиразина (81,85 ммоль) в 820 мл дихлорэтана. Реакционную смесь кипятят с обратным холодильником в течение 6 ч, затем охлаждают до температуры 20 С, перемешивают в течение дополнительных 12 ч и фильтруют. Фильтрат концентрируют при пониженном давлении, обрабатывают с помощью 200 мл диэтилового эфира, снова отфильтровывают, затем концентрируют при пониженном давлении. Получают 9,6 г метилдиметилпиразинхлорида в виде смеси, которую используют такой, какая есть, на следующей стадии. 6.2. Этил-5-фтор-1-[(диметилпиразин-2-ил)метил]-1 Н-индол-2-карбоксилат (смесь соединений IV21). Добавляют по каплям раствор 5 г (24,13 ммоль) этил-5-фтор-1 Н-индол-2-карбоксилата к перемешиваемой при температуре 0 С и в атмосфере аргона суспензии 1,45 г (36,2 ммоль) 60%-ного гидрида натрия в 200 мл диметилформамида. Смесь перемешивают в течение 30 мин при температуре 0 С, затем в течение 1 ч при температуре 20 С. После этого несколькими порциями добавляют 9,45 г (60,33 ммоль) смеси метилдиметилпиразинхлоридов, полученной на предыдущей стадии. Смесь перемешивают в течение 2 ч при температуре 20 С, затем добавляют 200 мл воды и 200 мл этилацетата. Органическую фазу отделяют, а водную фазу повторно экстрагируют с помощью 100 мл этилацетата. Органические фазы объединяют, промывают 2 раза по 50 мл воды, 50 мл водного насыщенного раствора хлорида натрия,затем сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией (элюент: дихлорметан-этилацетат). Получают 1,1 г смеси трех ожидаемых изомеров (IV21), используемой такой, какая есть, при продолжении синтеза. 6.3. N-(1,2-Диметил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(3,6-диметилпиразин-2-ил)метил]-1 Н-индол 2-карбоксамид (соединение 94).(WO 02059110) в 20 мл безводного толуола добавляют 2,57 мл триметилалюминия (2 М раствор в толуоле). Спустя 15 мин добавляют 1,05 г (3,21 ммоль) этил-5-фтор-1-[(диметилпиразин-2-ил)метил]-1 Ниндол-2-карбоксилата, полученного на предыдущей стадии. Кипятят с обратным холодильником в течение 4 ч, затем реакционную среду перемешивают при комнатной температуре в течение ночи. Выливают ее на лед и экстрагируют два раза по 100 мл этилацетата. Органические фазы объединяют, промывают последовательно с помощью 50 мл воды и 50 мл водного насыщенного раствора хлорида натрия, после чего сушат над сульфатом магния, отфильтровывают и концентрируют при пониженном давлении. Остаток очищают препаративной хроматографией ВЭЖХ (элюенты: этанол-гептан-триэтиламин). Выделяют 0,59 г изомера 94 в виде твердого вещества; температура плавления: 269-275 С; 1[МН]+=314. 10.2. N-(1,2-Диметил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(6-метилпиразин-2-ил)метил]-1 Н-индол-2 карбоксамид (соединение 68). По методике, аналогичной таковой, описанной в примере 6.3, исходя из 0,38 г этил-5-фтор-1-[(6 метилпиразин-2-ил)метил]-1 Н-индол-2-карбоксилата (соединениеIV22), получают 0,28 г N-(1,2 диметил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(6-метилпиразин-2-ил)метил]-1 Н-индол-2-карбоксамида (соединение 68). Температура плавления: 244-249 С; 1 Н-ЯМР (ДМСО-D6),(м.д.): 2,39 (с, 3 Н); 2,49 (с, 3 Н); 3,69 (с, 3 Н); 5,91 (с, 2 Н); 7,08 (м, 1 Н); 7,42 (м,5 Н); 7,9 (с, 1 Н); 7,99 (с, 1 Н); 8,36 (с, 1 Н). Пример 11 (соединение 24). N-(1,2-Диметил-1 Н-бензимидазол-5-ил)-5-трифторметил-1-[(пири- 10013748 дин-4-ил)метил]-1 Н-индол-2-карбоксамид (соединение 24). 11.1. Этил-5-трифторметил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат (соединениеIV27). Добавляют по каплям раствор 1,47 г (5,83 ммоль) 1,1'-(азодикарбонил)дипиперидина в 50 мл толуола к раствору 1 г (3,89 ммоль) этил-5-трифторметил-1 Н-индол-2-карбоксилата, 0,63 г (5,83 ммоль) 4-пиридилкарбинола и 1,46 мл (5,83 ммоль) трибутилфосфина в 50 мл толуола. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем концентрируют при пониженном давлении и хроматографируют на колонке с диоксидом кремния (элюент: дихлорметан-метанол). Получают 1,05 г ожидаемого продукта. 1 Н-ЯМР (ДМСО-D6),(м.д.): 1,27 (т, 3 Н); 4,29 (кв, 2 Н); 5,95 (с, 2 Н); 6,93 (д, 2 Н); 7,58 (с, 1 Н); 7,61(дхд, 1 Н); 7,80 (д, 1 Н); 8,22 (с, 1 Н); 8,45 (дхд, 2 Н). 11.2. N-(1,2-Диметил-1 Н-бензимидазол-5-ил)-5-трифторметил-1-[(пиридин-4-ил)метил]-1 Н-индол 2-карбоксамид (соединение 24). По методике, аналогичной таковой, описанной в примере 6.3, исходя из 0,5 г этил-5-трифторметил 1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилата (соединениеIV27), получают 0,65 г N-(1,2-диметил-1 Н-бензимидазол-5-ил)-5-трифторметил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксамида (соединение 24). Температура плавления: 250-251 С; 1 Н-ЯМР (ДМСО-D6),(м.д.): 2,49 (с, 3 Н); 3,69 (с, 3 Н); 5,95 (с, 2 Н); 6,98 (д, 1 Н); 7,49 (м, 4 Н); 7,69 (д,1 Н); 7,9 (с, 1 Н); 7,99 (с, 1 Н); 8,19 (с, 1 Н); 8,42 (д, 2 Н). Пример 12 (соединение 91). N-(2-Циклопропил-1-метил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксамид (соединение 91). 12.1. 2-Циклопропил-5-нитро-1 Н-бензимидазол. По аналогии с описанным способом (WO 96/04270), раствор 5 г (32,65 ммоль) 4-нитро-1,2 фенилендиамина в 77 мл (0,979 моль) циклопропанкарбоновой кислоты перемешивают при температуре кипения с обратным холодильником в течение 14 ч. Реакционную смесь затем концентрируют при пониженном давлении, потом обрабатывают с помощью 150 мл этилацетата и 100 мл раствора гидрокарбоната натрия. Органическую фазу промывают с помощью 100 мл воды, затем 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния, затем концентрируют при пониженном давлении. Получают 6,5 г масла каштанового цвета, которое используют таким, какое есть, на следующей стадии. 12.2. 2-Циклопропил-1-метил-5-нитро-1 Н-бензимидазол и 2-циклопропил-1-метил-6-нитро-1 Н-бензимидазол. К перемешиваемой в атмосфере аргона и при комнатной температуре суспензии 2,6 г гидрида натрия (63,98 ммоль) в 150 мл тетрагидрофурана добавляют по каплям раствор 6,5 г (32 ммоль) 2-циклопропил-5-нитро-1 Н-бензимидазола, полученного на предыдущей стадии, в 20 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 3 ч при температуре 20 С, затем добавляют 2,2 мл(35,2 ммоль) метилиодида. Перемешивание продолжают в течение дополнительных 48 ч. Реакционную смесь затем концентрируют при пониженном давлении, после чего прямо хроматографируют при использовании колонки с диоксидом кремния (элюент: дихлорметан-метанол). Получают, таким образом,4,5 г ожидаемой смеси изомеров в виде твердого вещества, которое используют таким, какое есть, на следующей стадии. 12.3. 2-Циклопропил-1-метил-5-амино-1 Н-бензимидазол (соединениеV2) и 2-циклопролил-1 метил-6-амино-1 Н-бензимидазол (соединениеV5). К перемешиваемой при температуре 20 С суспензии 0,3 г 10%-ного палладия-на-угле в 50 мл этанола добавляют 15 г формиата аммония (0,236 моль). С этим первым реактором соединяют второй, где при температуре 20 С интенсивно перемешивают суспензию 4,5 г (20,7 ммоль) смеси 2-циклопропил-1 метил-5-нитро-1 Н-бензимидазола и 2-циклопропил-1-метил-6-нитро-1 Н-бензимидазола, полученной на предыдущей стадии, и 0,4 г 10%-ного палладия-на-угле в 130 мл этанола. После перемешивания в течение 48 ч при температуре 20 С, 15 г (0,236 моль) формиата аммония,0,3 г 10%-ного палладия-на-угле и 50 мл этанола добавляют к смеси, которую перемешивают в течение дополнительных 24 ч, после чего фильтруют через слой целита и концентрируют при пониженном давлении, получая 4 г масла, которое очищают с помощью ВЭЖХ. Выделяют 1,1 г продукта V2, [МН]+=188; 1- 11013748 12.4. N-(2-Циклодропил-1-метил-1 Н-бензимидазол-5-ил)-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2 карбоксамид (соединение 91). 1,26 мл 2 н. раствора триметилалюминия в толуоле добавляют по каплям к перемешиваемому при температуре 0 С и в атмосфере аргона раствору 0,376 г (2,01 ммоль) 2-циклопропил-1-метил-5-амино 1 Н-бензимидазола (V2) в 70 мл толуола. Смесь затем в течение 15 мин выдерживают при температуре 50 С, после чего охлаждают и несколькими порциями добавляют 0,5 г (1,68 ммоль) этил-5-фтор-1[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилата, полученного на стадии 1.1. Смесь перемешивают в течение 14 ч при кипячении с обратным холодильником, затем охлаждают. Добавляют 15 мл воды, затем 25 мл 1 н. раствора соляной кислоты. Значение рН полученного раствора доводят до величины 8 путем добавления концентрированного раствора гидроксида натрия. Отфильтровывают твердое вещество, которое обрабатывают с помощью 200 мл этилацетата и 100 мл воды. Органическую фазу отделяют, сушат над сульфатом магния, концентрируют при пониженном давлении, затем хроматографируют (элюенты: дихлорметан-метанол), получая 0,3 г ожидаемого продукта 91. Температура плавления=260-261 С; 1 Н-ЯМР (ДМСО-D6),(м.д.): 1 (м, 4 Н); 2,19 (м, 1 Н); 3,82 (с, 3 Н); 5,9 (с, 2 Н); 7,02 (д, 2 Н); 7,12 (тхд,1 Н); 7,47 (м, 5 Н); 7,82 (д, 1 Н); 8,42 (д, 2 Н). В нижеследующей табл. 3 представлены химические структуры и физические свойства некоторых соединений общей формулы (I) согласно изобретению. В этой таблице в колонке Т.пл.указываются температуры плавления продуктов в градусах Цельсия (С); в колонке соль/основание знак - означает соединение в форме свободного основания, тогда какHCl означает соединение в виде гидрохлорида и указанное в скобках соотношение означает соотношение (кислота:основание); Соединения согласно изобретению подвергали фармакологическим испытаниям in vitro и in vivo,которые выявили, что они представляют интерес в качестве веществ с терапевтическими активностями. Соединения согласно изобретению также обладают характеристиками растворимости в воде, которая благоприятствует хорошей активности in vivo. Тест в отношении ингибирования тока, индуцируемого капсаицином в DRG крысы Первичная культура ганглионарных клеток заднего корешка (DRG) крысы Нейроны DRG естественно продуцируют рецептор TRPV1. Первичные культуры DRG новорожденных крыс приготовляли из крысят в возрасте 1 день. Кратко,после препарирования, ганглии трипсинировали и клетки механически раздробляли путем осторожного растирания в порошок. Клетки ресуспендировали в базальной культуральной среде Игла, содержащей 10% фетальной телячьей сыворотки, 25 мМ KCl, 2 мМ глутамина, 100 мкг/мл гентамицина и 50 нг/мл фактора роста нервной ткани, затем помещали на тонкие стеклянные пластинки, покрытые ламинином(0,25106 клеток на пластинку), которые затем помещали в 12-луночные планшеты Корнинга. Клетки инкубировали при температуре 37 С во влажной атмосфере, содержащей 5% CO2 и 95% воздуха. Спустя 48 ч после культивирования добавляли цитозинD-арабинозид (1 мкМ) для предотвращения развития не нейронных клеток. Пластинки переносили в экспериментальные камеры для исследований фиксации потенциала после культивирования в течение 7-10 суток. Электрофизиология Измерительные камеры (объем 800 мкл), содержащие клеточный препарат, помещали на предметный столик инвертированного микроскопа (Olympus IMT2), снабженный оптикой Hoffman (ModulationContrast, Нью-Йорк), и проводили наблюдения при 400-кратном увеличении. Камеры непрерывно перфузировали под силой тяжести (2,5 мл/мин) с помощью дозатора растворов, имеющего 8 входных отверстий, и единственный выход которого, образованный полиэтиленовой трубкой (отверстие 500 мкм), помещали менее чем за 3 мм от исследуемой клетки. Использовали конфигурацию целая клетка по методу фиксации потенциала. Пипетки из боросиликатного стекла (сопротивление 5-10 МОм) приближали к клетке благодаря пьезоэлектрическому микроманипулятору 3D (Burleigh, PC1000). Общие токи (мембранный потенциал, фиксированный при -60 мВ) регистрировали с помощью усилителя Axopatch 1D(Axon Instruments, Foster city, Калифорния), соединенного с персональным компьютером (ПК), управляемым программным обеспечением Pclamp8 (Axon Instrument). Следы тока регистрировали на бумаге и одновременно переводили в цифровую форму (частота выборки 15-25 Гц) и переносили на жесткий диск ПК. Введение 300 нМ раствора капсаицина вызывает в клетках DRG (фиксированное при -70 мВ напряжение) входящий катионный ток. В целях минимизации десенсибилизации рецепторов соблюдали интервал минимум одна минута между двумя введениями капсаицина. После контрольного периода (стаби- 18013748 лизация ответа на один капсаицин) тестируемые соединения вводили индивидуально в заданной концентрации (концентрация 10 или 0,1 нМ) в течение продолжительности 4-5 мин, во время которых осуществляли несколько тестов капсаицин-соединение (достижение максимального ингибирования). Результаты выражали в % ингибирования контрольного ответа на капсаицин. Проценты ингибирования ответа на капсаицин (300 нМ) составляли от 20 до 100% для наиболее активных соединений согласно изобретению, тестируемых в концентрации от 10 до 0,1 нМ (см. пример табл. 4). Соединения согласно изобретению, следовательно, являются эффективными антагонистами in vitro в отношении рецепторов типа TRPV1. Таблица 4 Тест в отношении роговичного раздражения мыши Раздражающий характер капсаицина легко заметен на уровне роговицы, так как этот орган представляет собой один из наиболее пронизанных волокнами С. В данном контексте согласно предварительным экспериментам нанесение очень незначительного количества капсаицина (2 мкл при концентрации 160 мкМ) на поверхность роговицы животного вызывает некоторое количество стереотипных поведений, связанных с раздражением и которые легко регистрировать. Из них следует назвать: моргание глаза, трение глаза, осуществляемое передней гомолатеральной лапой, трение морды двумя передними лапами, чесание морды задней гомолатеральной лапой. Продолжительность этих поведений не превышает 2 мин наблюдения, и животное тогда снова приобретает свою нормальную активность. Его внешний вид, кроме того, также нормальный. Мышь не забивается в угол с взъерошенными волосками и не проявляет каких-либо заметных симптомов страдания. Можно сделать вывод, что продолжительность воздействия капсаицина в этих дозах менее 2 мин. Краткое изложение методологии Принципом серии экспериментов является определение, могут ли соединения согласно изобретению влиять на поведенческий ответ, вызываемый данным количеством капсаицина. Капсаицин сначала разводили до концентрации 25 мМ в ДМСО и для его конечного использования разводили в 10%-ном Твин 80 в физиологической сыворотке. Из контрольных исследований следует, что в этих условиях растворитель не оказывает никакого эффекта. На практике тестируемый продукт вводили перорально и в срок (время предварительной обработки: t), который зависит от фармакокинетических данных, животному закапывают в глаз 2 мкл 160 мкМ раствора капсаицина, приготовленного как указано выше. Во время наблюдения в течение 2 мин после закапывания зарегистрировано некоторое число трений инстиллированного глаза гомолатеральной задней лапой. В случае данного животного процент защиты рассчитывали следующим образом: Р=100-число наблюдаемых чесаний/среднее число чесаний обработанной растворителем группы)100). Этот процент защиты усредняли для каждой группы животных (n=число животных, тестируемых с помощью соединения согласно изобретению). Оцененные проценты защиты, в случае этой модели, для наиболее активных соединений согласно изобретению, используемых в дозе 1 мг/кг (перорально), составляли от 20 до 100% (см. некоторые примеры в табл. 5) Таблица 5 Результаты этих испытаний показывают, что наиболее активные соединения согласно изобретению блокируют эффекты, индуцируемые стимуляцией рецепторов TRPV1. Следовательно, соединения согласно изобретению могут быть использованы для получения лекарственных средств, в частности для получения лекарственного средства, предназначенного для предотвращения или лечения патологий, в которых принимают активное участие рецепторы типа TRPV1. Таким образом, согласно другому из его аспектов объектом изобретения являются лекарственные средства, которые включают соединение формулы (I), или его фармацевтически приемлемую соль, или гидрат, или сольват вышеуказанного соединения. Эти лекарственные средства находят свое применение в терапии, в частности в профилактике и/или лечении боли и воспаления; хронической, невропатической (травматической, диабетической, метаболической, инфекционной, токсической, индуцированной противораковым лечением или гиатрогенной),(остео)артритной, ревматической боли; фибромиалгий, боли в спине, связанной с раковым заболеванием боли, невралгии лицевого нерва, головной боли, мигрени, зубной боли, ожога, солнечного удара, укуса или укола, постгерпетической невралгии, мышечной боли, нервной (центральной и/или периферической) компрессии, травм спинного мозга и/или головного мозга, ишемии (спинного мозга и/или головного моз- 19013748 га), нейродегенерации, геморрагических васкулярных нарушений (спинного мозга и/или головного мозга), боли после инсульта. Соединения согласно изобретению могут быть использованы для получения лекарственного средства, предназначенного для профилактики и/или лечения урологических нарушений, таких как гиперактивность мочевого пузыря, нестабильность мочевого пузыря, недержание, неотложное мочеиспускание,недержание мочи, цистит, почечная колика, тазовая гиперчувствительность и тазовая боль. Соединения согласно изобретению могут быть использованы для получения лекарственного средства, предназначенного для профилактики и/или лечения гинекологических нарушений, таких как вульводиния, боли, связанные с сальпингитами, дисменореями. Эти продукты также можно использовать для получения лекарственного средства, предназначенного для профилактики и/или лечения желудочно-кишечных нарушений, таких как нарушение гастроэзофагического рефлекса, язва желудка, язва двенадцатиперстной кишки, функциональная диспепсия, колит, IBS, болезнь Крона, панкреатит, эзофагит, печеночная колика. Продукты согласно настоящему изобретению также могут быть пригодны для профилактики и/или лечения респираторных нарушений, таких как астма, кашель, хроническое обструктивное заболевание легких, бронхоконстрикция и воспалительные нарушения. Эти продукты также могут быть использованы для профилактики и/или лечения псориаза, зуда, дермальных ирритаций, ирритаций глаз или слизистых оболочек, герпеса, опоясывающего лишая. Соединения согласно изобретению также могут быть использованы для получения лекарственного средства, предназначенного для лечения депрессии. Соединения согласно изобретению также могут быть использованы для получения лекарственного средства, предназначенного для лечения диабета. Согласно другому из его аспектов настоящее изобретение относится к фармацевтическим композициям, включающим в качестве действующего начала соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемой соли, гидрата или сольвата вышеуказанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Вышеуказанные эксципиенты выбирают в зависимости от фармацевтической формы и желаемого способа введения среди обычных эксципиентов, которые известны специалисту в данной области. В фармацевтических композициях согласно настоящему изобретению для перорального, подъязычного, подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, интраназального, трансдермального или ректального введений действующее начало вышеприведенной формулы (I) или его возможная(ый) соль, сольват или гидрат может быть введено в стандартной лекарственной форме в смеси с классическими фармацевтическими эксципиентами животным и людям для профилактики или лечения нарушений или заболеваний, указанных выше. Соответствующие стандартные лекарственные формы включают формы для перорального пути введения, такие как таблетки, мягкие и твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для подъязычного, буккального, интратрахеального, внутриглазного,интраназального введения, путем ингаляции, формы для топического, чрескожного, подкожного, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для топического нанесения соединения согласно изобретению можно использовать в кремах, гелях, мазях или лосьонах. В качестве примера стандартная лекарственная форма соединения согласно изобретению в виде таблетки может включать следующие ингредиенты, мг: соединение согласно изобретению 50,0, маннит 223,75, натриевая кроскармеллоза 6,0, кукурузный крахмал 15,0, гидроксипропилметилцеллюлоза 2,25,стеарат магния 3,0. Вышеуказанные стандартные лекарственные формы для возможности ежедневного введения 0,001-30 мг действующего начала на кг массы тела в зависимости от галеновой формы. Могут встречаться особые случаи, где применимы более высокие или более незначительные дозы; такие дозы не выходят за рамки изобретения. Согласно обычной практике дозу, соответствующую каждому пациенту, определяет врач в зависимости от способа введения, массы тела и ответной реакции вышеуказанного пациента. Настоящее изобретение согласно другому из его аспектов также относится к способу лечения вышеуказанных патологий, который включает введение пациенту эффективной дозы соединения согласно изобретению, или одной(го) из его фармацевтически приемлемых солей, или гидратов, или сольватов. в которой X1, X2, Х 3, Х 4 означают, независимо друг от друга, Н, F, CF3, N(CH3)2 или tBu;W означает группу, выбранную из бензимидазолила, индолила, хинолила, тетрагидрохинолила,бензотиазолила или бензоксазинила; причем эти группы могут быть замещены 1 или 2 раза группами,выбранными из (C1-С 6)алкила, С 3-циклоалкила и оксо, которые сами могут быть замещены С 3-циклоалкилом;Y означает группу, выбранную из пиридила, имидазолила, бензимидазолила, тиазолила, хинолила,изохинолила, фурила, хиноксалинила, пиридазинила, пиразинила или пиримидинила; причем эти группы могут быть замещены 1 или 2 раза группами, выбранными из (C1-С 6)алкила, (C1-С 6)фторалкила, бензила,морфолинила; в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата. 2. Соединение формулы (I) по п.1, отличающееся тем, что n равно 1 или 2; в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата. 3. Способ получения соединения формулы (I) по п.1, отличающийся тем, что соединение общей формулы (IV) в которой X1, Х 2, Х 3, Х 4, Y и n имеют значения, как указанные в случае общей формулы (I) по п.1, и В означает (C1-С 6)алкоксил, вводят во взаимодействие с амидом соединения общей формулы (V) в которой W имеет значение, как указанное в случае общей формулы (I) по п.1,при температуре кипения с обратным холодильником растворителя, причем амид соединения общей формулы (V) получают путем предварительного воздействия триметилалюминия на амины общей формулы (V). 4. Соединение формулы (IV), выбираемое среди следующих соединений: этил-5-фтор-1-[(тиазол-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(пиридин-3-ил)этил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(пиридин-3-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(пиридин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(2-метилпиридин-3-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(1-N-бензилимидазол-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(2-пирролидинопиридин-3-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(бензотиазол-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(1-метилбензимидазол-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(4-метилтиазол-5-ил)этил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(хинолин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(хиноксалин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(пиразин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(3-метилпиридин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(изохинолин-1-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(4-метилпиридин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(2-метилпиридин-4-ил)этил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(2-метилпиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(5-метилпиридин-2-ил)метил]-1 Н-индол-2-карбоксилат;- 21013748 этил-5-фтор-1-[(диметилпиразин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(6-метилпиразин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(6-метилпиридазин-3-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(6-метилпиридин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(2-фенилпиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; метил-6-трет-бутил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-трифторметил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; этил-6-N-диметиламино-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; метил-6-трифторметил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-трет-бутил-1-[(пиридин-4-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-трет-бутил-1-[(пиридин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-трет-бутил-1-[(пиридин-3-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-трет-бутил-1-[(2-метилпиридин-3-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-трет-бутил-1-[(6-метилпиридин-2-ил)метил]-1 Н-индол-2-карбоксилат; этил-5-фтор-1-[(пиримидин-4-ил)метил]-1 Н-индол-2-карбоксилат; в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата. 5. Соединение формулы (V), выбираемое среди следующих соединений: 5-амино-1-(циклопропил)метил-2-метил-1 Н-бензимидазол; 5-амино-2-циклопропил-1-метил-1 Н-бензимидазол; 5-амино-2-изопропил-1-метил-1 Н-бензимидазол; 6-амино-1-(циклопропил)метил-2-метил-1 Н-бензимидазол; 6-амино-2-циклопропил-1-метил-1 Н-бензимидазол; 6-амино-2-изопропил-1-метил-1 Н-бензимидазол; в форме основания или аддитивной соли с кислотой, а также в форме гидрата или сольвата. 6. Лекарственное средство, отличающееся тем, что оно включает соединение формулы (I) по любому из пп.1 или 2, или фармацевтически приемлемую соль, или гидрат, или сольват соединения формулы(I). 7. Фармацевтическая композиция, отличающаяся тем, что она включает соединение формулы (I) по любому из пп.1 или 2 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. 8. Применение соединения формулы (I) по любому из пп.1 или 2 для получения лекарственного средства, предназначенного для профилактики или лечения патологий, в которых участвуют рецепторы типа TRPV1. 9. Применение соединения формулы (I) по п.8 для получения лекарственного средства, предназначенного для профилактики или лечения боли, воспаления, урологических нарушений, гинекологических нарушений, желудочно-кишечных нарушений, респираторных нарушений, псориаза, зуда, дермальных ирритаций, ирритаций глаз или слизистых оболочек, герпеса, опоясывающего лишая или лечения депрессии или диабета.
МПК / Метки
МПК: C07D 403/14, A61P 17/00, A61K 31/4439, A61K 31/444, C07D 417/14, A61K 31/4178, C07D 413/14, A61K 31/427, C07D 401/14, A61K 31/4184, A61K 31/4709
Метки: n-(гетероарил)-1-гетероарилалкил-1н-индол-2-карбоксамидов, производные, получение, терапии, применение
Код ссылки
<a href="https://eas.patents.su/23-13748-proizvodnye-n-geteroaril-1-geteroarilalkil-1n-indol-2-karboksamidov-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные n-(гетероарил)-1-гетероарилалкил-1н-индол-2-карбоксамидов, их получение и их применение в терапии</a>
Предыдущий патент: Производные n-(арилалкил)-1н-пирролопиридин-2-карбоксамидов, их получение и их применение в терапии
Следующий патент: Фунгицидные и биорегуляторные смеси
Случайный патент: Терапевтические комбинации, включающие в себя амлодипин и аторвастатин