Замещенные нафтилиндольные производные в качестве ингибиторов ингибитора активатора плазминогена типа 1 (pai-1)
Номер патента: 9696
Опубликовано: 28.02.2008
Авторы: Гандерсен Эрик Гаулд, Мэйер Скотт Кристиан, Крэндэлл Дэвид Лерой, Элокдах Хассан Махмуд
Формула / Реферат
1. Соединение формулы I
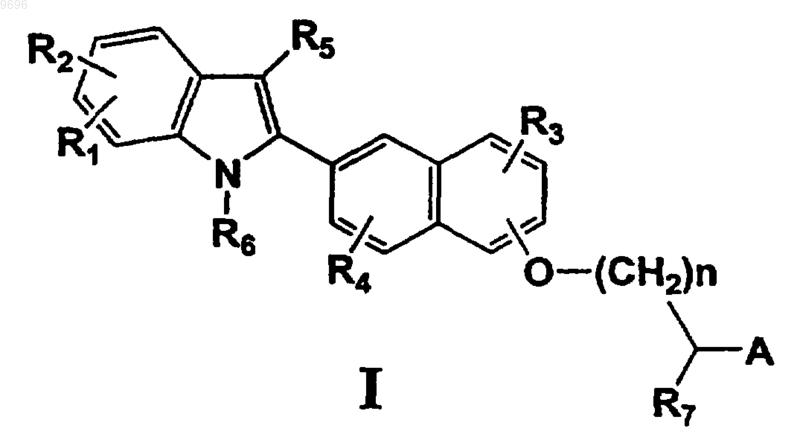
где R1, R2, каждый независимо, представляют собой водород, алкил, содержащий 1-3 атома углерода;
R3 и R4, каждый независимо, представляют собой водород, алкил, содержащий 1-3 атома углерода, или галоген;
R5 представляет собой водород, алкил, содержащий 1-6 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алканоил, содержащий 1-6 атомов углерода, или бензил, необязательно замещенный алкилом, содержащим 1-4 атома углерода, или перфторалкилом, содержащим 1-3 атома углерода;
R7 представляет собой водород, алкил, содержащий 1-6 атомов углерода;
n представляет собой целое число, имеющее значение 0-6;
А представляет собой СООН или имитирующее кислоту соединение, выбранное из тетразола, SO3H, РО3Н, тетроновой кислоты или группы формул
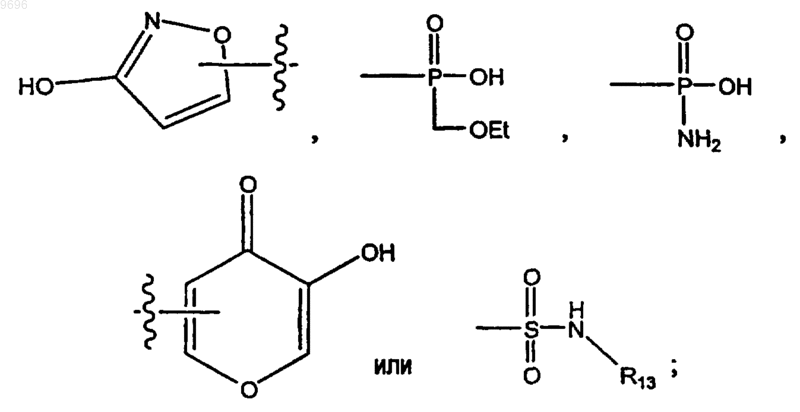
где R13 представляет собой C1-С6алкил, С2-С6алкенил, С3-С6циклоалкил, -СН2-(С3-С6циклоалкил), С3-С6
циклоалкенил, -СН2-(С3-С6циклоалкенил), необязательно замещенную арильную или гетероарильную группу или необязательно замещенный C1-С6 алкиларил или C1-С6алкилгетероарил;
или его фармацевтически приемлемая соль или сложный эфир.
2. Соединение по п.1 формулы

где R1, R2, R3, R4, R5, R6, R7, A, n определены в п.1,
или его фармацевтически приемлемая соль или сложный эфир.
3. Соединение по п.1 или 2, где R4 представляет собой водород или алкил, содержащий 1-3 атома углерода.
4. Соединение по любому из пп.1-3, где R1 представляет собой водород.
5. Соединение по любому из пп.1-4, где R2 представляет собой водород.
6. Соединение по любому из пп.1-5, где R3 представляет собой бром.
7. Соединение по любому из пп.1-6, где R3 представляет собой водород.
8. Соединение по любому из пп.1-7, где R4 представляет собой водород.
9. Соединение по любому из пп.1-8, где R5 представляет собой пентил.
10. Соединение по любому из пп.1-9, где R6 выбирают из группы, включающей бензил, метил, ацил, (2-трифторметил)бензил и (4-трет-бутил)бензил.
11. Соединение по любому из пп.1-10, где R7 представляет собой водород.
12. Соединение по любому из пп.1-11, где n=0.
13. Соединение по любому из пп.1-12, где А представляет собой СО2Н или тетразол.
14. Соединение по п.1 формулы

где R1 представляет собой водород или алкил, содержащий 1-3 атома углерода;
R2 представляет собой водород, алкил, содержащий 1-3 атома углерода, или галоген;
R3 представляет собой водород, алкил, содержащий 1-3 атома углерода, или галоген;
R4 представляет собой водород, алкил, содержащий 1-6 атомов углерода;
R5 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алканоил, содержащий 1-6 атомов углерода, или бензил, необязательно замещенный 1-3 группами, независимо выбранными из алкила, содержащего 1-4 атома углерода, или перфторалкила, содержащего 1-3 атома углерода;
А представляет собой СООН или имитирующее кислоту соединение;
или его фармацевтически приемлемая соль или сложный эфир.
15. Соединение по п.1, представляющее собой 1-бензил-3-пентил-2[6-(1Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемую соль.
16. Соединение по п.1, представляющее собой 6-(1-бензил-3-пентил-1Н-индол-2-ил)-1-бром-2-нафтил 1Н-тетразол-5-илметиловый эфир или 1-бензил-2-[5-бром-6-(1Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1Н-индол или его фармацевтически приемлемую соль.
17. Соединение по п.1, представляющее собой 1-метил-3-пентил-2-[6-(1Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемую соль.
18. Соединение по п.1, представляющее собой 2-[5-бром-6-(1Н-тетразол-5-илметокси)-2-нафтил]-1-метил-3-пентил-1Н-индол или 1-бром-6-(1-метил-3-пентил-1Н-индол-2-ил)-2-нафтил 1Н-тетразол-5-илметиловый эфир или его фармацевтически приемлемую соль.
19. Соединение по п.1, представляющее собой 1-ацетил-3-пентил-2-[6-(1Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемую соль.
20. Соединение по п.1, представляющее собой 1-ацетил-2-[5-бром-6-(1Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1Н-индол или его фармацевтически приемлемую соль.
21. Соединение по п.1, представляющее собой 3-пентил-2-[6-(1Н-тетразол-5-илметокси)-2-нафтил]-1-[2-(трифторметил)бензил]-1H-индол или его фармацевтически приемлемую соль.
22. Соединение по п.1, представляющее собой 2-[5-бром-6-(1Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]-1H-индол или его фармацевтически приемлемую соль.
23. Соединение по п.1, представляющее собой 1-(4-трет-бутилбензил)3-пентил-2-[6-(1Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемую соль.
24. Соединение по п.1, представляющее собой 2-[5-бром-6-(1Н-тетразол-5-илметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1Н-индол или его фармацевтически приемлемую соль.
25. Соединение по п.1, представляющее собой {[1-бром-6-(1-метил-3-пентил-1Н-индол-2-ил)-2-нафтил]окси}уксусную кислоту или ее фармацевтически приемлемую соль.
26. Соединение по п.1 или 2, где R6 представляет собой бензил, необязательно замещенный алкилом, содержащим 1-3 атома углерода.
27. Соединение по п.1 или 2, где имитирующее кислоту соединение представляет собой тетразол.
28. Соединение по п.14, где R5 представляет собой бензил, необязательно замещенный алкилом, содержащим 1-3 атома углерода.
29. Соединение по п.14, где имитирующее кислоту соединение представляет собой тетразол.
30. Способ лечения тромбоза или фибринолитического нарушения у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества соединения по пп.1-29.
31. Способ по п.30, где тромбоз или фибринолитическое нарушение связано с образованием атеросклеротических бляшек, венозным или артериальным тромбозом, ишемией миокарда, фибрилляцией предсердия, глубоким тромбофлефитом, синдромами коагуляции, фиброзом легких, церебральным тромбозом, тромбоэмболическими осложнениями при хирургическом вмешательстве или окклюзией периферических артерий.
32. Фармацевтическая композиция, включающая фармацевтически эффективное количество соединения по пп.1-29 или его фармацевтически приемлемой соли или сложного эфира и фармацевтически приемлемый эксципиент или носитель.
33. Применение соединения по любому из пп.1-29 в качестве лекарственного средства.
34. Применение соединения по любому из пп.1-29 для получения лекарственного средства для лечения тромбоза или фибринолитического нарушения у млекопитающего.
35. Способ получения соединения формулы
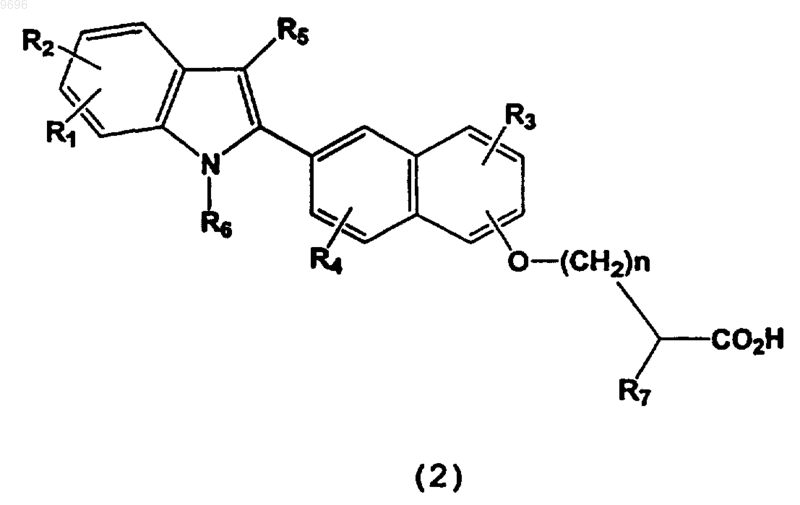
где R1, R2, R3, R4, R5, R6, R7 и n определены в п.1,
или его фармацевтически приемлемой соли или сложного эфира, включающий:
a) гидролиз соединения формулы
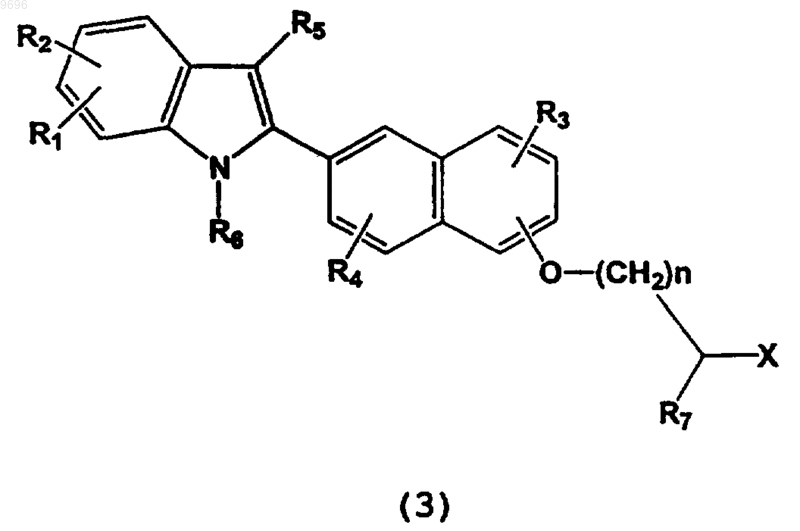
где X представляет собой CN, СОгалоген, COOR12, CONR13R14, где R12 выбран из C1-С6 алкила, СО(С1-С6
алкила), бензила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С6алкила, C1-С6алкокси, фенила, галогена, трифторметила и трифторметокси; и фенила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С6алкила, C1-С6
алкокси, фенила, галогена, трифторметила и трифторметокси;
R13 и R14 независимо выбраны из C1-С6алкила, C1-С6алкокси, водорода, СО(С1-С6алкила), бензила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С6алкила, C1-С6алкокси, фенила, галогена, трифторметила и трифторметокси; и фенила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С6алкила, C1-С6алкокси, фенила, галогена, трифторметила и трифторметокси; и при необходимости
(b) преобразование соединения формулы (2) в его фармацевтически приемлемый сложный эфир или основно-аддитивную соль; если необходимо:
(c) разделение рацемической смеси соединений формулы (2) для выделения энантиомера соединения формулы (2) или его фармацевтически приемлемой соли или сложного эфира.
36. Способ получения соединения формулы
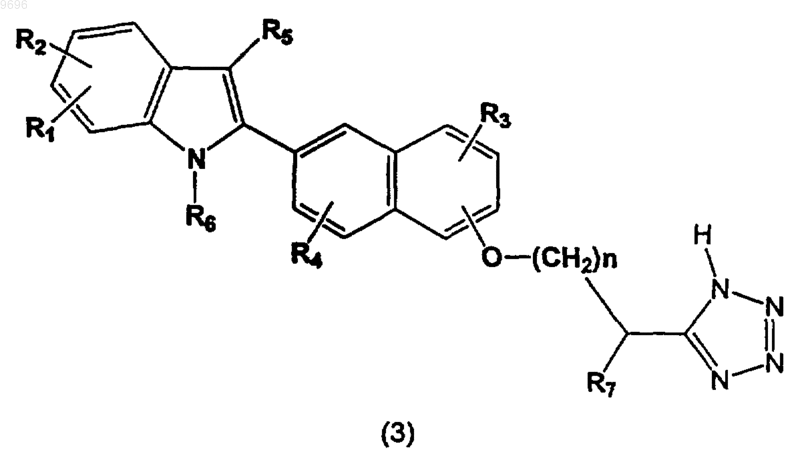
где R1, R2, R3, R4, R5, R6, R7 и n определены в п.1,
или его фармацевтически приемлемой соли, включающий:
a) взаимодействие соединения формулы
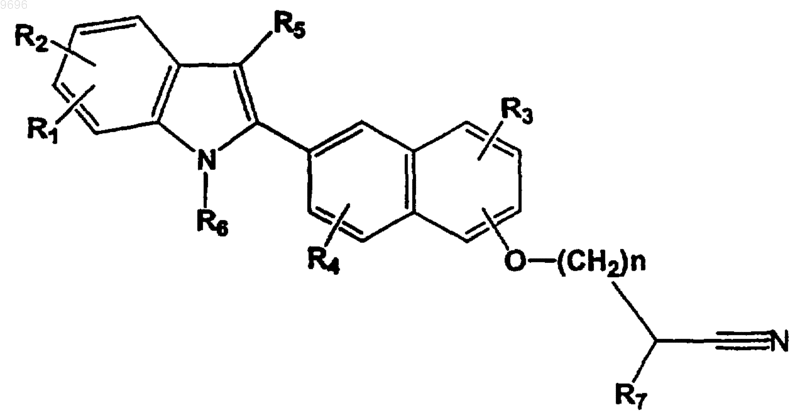
с азидом; если необходимо:
(b) преобразование соединения формулы (3) в его фармацевтически приемлемую основно-аддитивную соль; если необходимо:
(c) разделение рацемической смеси соединений формулы (3) для выделения энантиомера соединения формулы (3) или его фармацевтически приемлемой соли.
Текст
009696 Данное изобретение относится к композиции и применению замещенных нафтилиндольных производных в качестве ингибиторов ингибитора-1 активатора плазминогена (PAI-1) и в качестве терапевтических композиций для лечения состояний, связанных с фибринолитическими нарушениями, такими как глубокий тромбофлебит и коронарное заболевание сердца, и фиброзом легких, а также к способам их получения. Ингибитор-1 активатора плазминогена (PAI-1) является основным регуляторным компонентом системы плазминогена-плазмина. PAI-1 является основным физиологическим ингибитором как активатора плазминогена тканевого типа (tPA), так и активатора плазминогена урокиназного типа (uPA). Повышенные уровни содержания в плазме PAI-1 связывали с проявлениями тромбоза, как было показано в экспериментах с использованием животных (Krishnamurti, Blood, 69, 798 (1987); Reilly, Arteriosclerosis andThrombosis, 11, 1276 (1991); Carmeliet, Journal of Clinical Investigation, 92, 2756 (1993 и в клинических исследованиях (Rocha, Fibrinolysis, 8, 294, 1994; Aznar, Haemostasis 24, 243 (1994. Активность PAI-1 по нейтрализации антител промотирует эндогенный тромболиз и реперфузию (Biemond, Circulation, 91, 1175(1995); Levi, Circulation 85, 305, (1992. Повышенные уровни PAI-1 также связаны с заболеваниями женщин, такими как синдром поликистоза яичников (Nordt, Journal of Clinical Endocrinology and Metabolism, 85,4, 1563 (2000 и остеопороз, вызванный дефицитом эстрогена (Daci, Journal of Bone and Mineral Research,15, 8, 1510 (2000. Следовательно, вещества, ингибирующие PAI-1, были бы полезны для лечения состояний, связанных с фибринолитическим нарушением, таким как глубокий тромбофлебит, коронарное заболевание сердца, эмболия легких, синдром поликистоза яичников и т.д.WO 98/08818 раскрывает замещенные индолы и бензимидазолы формул I, II и III, являющиеся химическими ингибиторами различных фосфолипазных ферментов (такие, как PLA2), полезные для лечения воспаления.WO 96/21656 раскрывает соединения формулы I, полезные для лечения или профилактики ожирения, рака молочной железы, остеопороза, эндометриоза, сердечно-сосудистых заболеваний и заболеваний предстательной железы. Кроме того, данное изобретение может быть использовано для различных целей. ЕР 0655439 (Eli Lilly and Company) относится к 5,6 конденсированным бициклическим соединениям, включая индолы, бензофураны и бензотиофены, соответствующие общей формуле I, в качестве ингибиторов агрегации тромбоцитов.I в качестве агонистов эстрогена, полезных для лечения синдромов и заболеваний, вызванных дефицитом эстрогена.WO 94/26738 и ЕР 0512570 (Fujisawa Pharmaceutical Co., Ltd.) раскрывает получение замещенных индолов, бензофуранов и бензотиофенов (формула I), обладающих ингибиторной активностью против АСАТ (фермент холестеринацилтрансфераза), которые полезны для профилактики и/или лечения гиперхолестеринемии, гиперлипидемии, атеросклероза или вызванных ими заболеваний.I, полезные в качестве антагонистов ангиотензина II для лечения гипертензии. ЕР 0416609 раскрывает индол-, бензофуран- и бензотиофенсодержащие соединения (формула I),ингибирующие липоксигеназу, а также пролекарства этих соединений, содержащие метаболически отщепляемые группы. Настоящее изобретение включает соединения формулы In представляет собой целое число, имеющее значение 0-6; А представляет собой СООН или имитирующее кислоту соединение, такое как тетразол, SO3H,РО 3 Н, тетроновая кислота или группы формул где R13 представляет собой С 1-С 6 алкил, С 2-С 6 алкенил, С 3-С 6 циклоалкил, -СН 2-(С 3-С 6 циклоалкил), -СН 2(С 3-С 6 циклоалкил), -С 3-С 6 циклоалкенил, -СН 2-(С 3-С 6 циклоалкенил), необязательно замещенную арильную или гетероарильную группу или необязательно замещенный С 1-С 6 алкиларил или С 1-С 6 алкилгетероарил, где арильная и гетероарильная группы и их необязательные заместители определены ниже; или их фармацевтически приемлемые соли или сложные эфиры. Как используется в данном описании, алкил включает алкильные группы как с прямой, так и с разветвленной цепью, а галоген включает бром, хлор, фтор и иод. Сложноэфирные формы соединений по настоящему изобретению включают фармацевтически приемлемые сложноэфирные формы, известные в области техники для кислотных групп формулы I, указанной выше. Такие сложные эфиры включают сложные алкиловые эфиры с прямой цепью, содержащие 1-6 атомов углерода, или алкильные группы с разветвленной цепью, содержащие 3-6 атомов углерода, включающие метиловые, этиловые, пропиловые, бутиловые, 2-метилпропиловые и 1,1-диметилэтиловые сложные эфиры. Другие неограничивающие примеры сложных эфиров, используемых в настоящем изобретении, включают сложные эфиры, в которых А представляет собой карбоновую кислоту и сложноэфирная форма имеет формулу -COOR9, где R9 выбран из формул где R9, R10, R11 и R12 независимо выбраны из водорода, алкила, содержащего 1-10 атомов углерода, арила,содержащего 6-12 атомов углерода, арилалкила, содержащего 6-12 атомов углерода, гетероарила или алкилгетероарила, где гетероарильное кольцо связано алкильной цепью, содержащей 1-6 атомов углерода. Из предпочтительных сложноэфирных форм соединения по настоящему изобретению включают, но не ограничиваются ими, С 1-С 6 алкиловые эфиры, С 3-С 6 алкиловые эфиры с разветвленной цепью, бензиловые эфиры и т.д. Кислотные имитаторы, или миметики, включенные в кислотные группы по настоящему изобретению, как указано в определении А выше, в частности, включают фармацевтически полезные имитаторы карбоновых кислот, или миметики, известные из уровня техники, такие как описанные в R. Silverman,The Organic Chemistry of Drug design and Drug Action, Academic Press (1992), содержание которого включено в данное описание посредством ссылки. Неограничивающие примеры таких кислотных миметиков включают, например, тетразол, SO3H, РО 3 Н, тетроновую кислоту и т.д. или группы формул где R13 представляет собой C1-С 6 алкил, С 2-С 6 алкенил, С 3-С 6 циклоалкил, -СН 2-(С 3-С 6 циклоалкил), -СН 2(С 3-С 6 циклоалкил), -С 3-С 6 циклоалкенил, -СН 2-(С 3-С 6 циклоалкенил), необязательно замещенную арильную или гетероарильную группу или необязательно замещенный C1-C6 алкиларил или С 1-С 6 алкилгетероарил, где арильная и гетероарильная группы и их необязательные заместители определены ниже. Как используется в данном описании, термин "алкил" относится к алифатической углеводородной цепи и включает линейные и разветвленные цепи, например, из 1-6 атомов углерода, такие как метил,этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил,-3 009696 н-гексил и изогексил. Галоген, галогенид или гало- относится к иоду, брому, хлору и фтору. Как используется в данном описании, термин "арил" относится к ненасыщенной ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо (например, фенил) или несколько конденсированных (слитых) колец (например, нафтил или антрил). Предпочтительные арильные группы включают фенил, нафтил и т.п. Как используется в данном описании, термин "гетероарил" относится к моноциклической или бициклической ароматической группе из 1-9 атомов углерода и 1-4 гетероатомов, независимо выбранных из кислорода, азота и серы в пределах по меньшей мере одного кольца(если имеется больше чем одно кольцо). Такие гетероарильные группы могут иметь одно-единственное кольцо, например пиридильная, пирролильная или фурильная группы, или несколько конденсированных колец, например индолильная, индолизинильная, бензофуранильная или бензотиенильная группы. Предпочтительные гетероарилы включают пиридил, пирролил и фурил. Должно быть понятно, что определения арила и гетероарила также относятся и к таким частям любой ароильной или гетероароильной групп,которые описаны ниже. Если нет иного ограничения при определении арильных или гетероарильных групп в данном описании, такие группы являются необязательно замещенными 1-5 заместителями, независимо выбранными из группы, включающей ацилкокси, гидрокси, ацил, формил, алкил, содержащий 1-6 атомов углерода,алкокси, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, алкинил, содержащий 2-6 атомов углерода, замещенный алкил, замещенный алкокси, замещенный алкенил, замещенный алкинил, амино, амино, замещенный одной или двумя алкильными группами, содержащими 1-6 атомов углерода, аминоацил, ациламино, азидо, циано, галоген, нитро, тиоалкокси, содержащий 1-6 атомов углерода, замещенный тиолакокси, содержащий 1-6 атомов углерода, и тригалогенметил. Заместители на указанных выше алкильных, алкенильных, алкинильных, тиолалкокси и алкоксигруппах включают атомы галогенов, CN, ОН и аминогруппы. Предпочтительными заместителями на арильных группах по данному изобретению являются алкил, алкокси, галоген, циано, нитро, тригалогенметил и тиоалкокси. Фармацевтически приемлемые соли соединений по настоящему изобретению, содержащие основную группу, такую как амино- или алкиламиногруппа, могут быть образованы из органических или неорганических кислот, например уксусной, пропионовой, молочной, лимонной, винной, янтарной, фумаровой, малеиновой, малоновой, миндальной, яблочной, фталевой, хлористо-водородной, бромистоводородной, фосфорной, азотной, серной, метансульфоновой, нафталинсульфоновой, бензолсульфоновой, толуолсульфоновой, камфорсульфоновой и подобных известных приемлемых кислот. Соли также могут быть образованы из органических и неорганических оснований, предпочтительно соли щелочных металлов, например натрия, лития или калия. Другие полезные солевые формы соединений по изобретению включают соли, образованные с фармацевтически приемлемыми органическими или неорганическими основаниями, известными из уровня техники. Формы солей, полученных с использованием неорганических оснований, включают гидроксиды, карбонаты или бикарбонаты терапевтически приемлемых щелочных металлов или щелочноземельных металлов, таких как натрий, калий, магний, кальций и т.п. Приемлемые органические основания включают амины, такие как бензиламин, моно-, ди- и триалкиламины, предпочтительно такие, которые содержат алкильные группы из 1-6 атомов углерода, более предпочтительно 1-3 атомов углерода,такие как метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, моно-, ди- и триэтаноламин. Также полезными являются алкилендиамины, содержащие до 6 атомов углерода, такие как гексаметилендиамин; циклические насыщенные или ненасыщенные основания, содержащие до 6 атомов углерода, включающие пирролидин, пиперидин, морфолин, пиперазин и их N-алкильные и N-гидроксиалкильные производные, такие как N-метилморфолин и N-(2-гидроксиэтил)пиперидин, или пиридин. Также могут быть образованы четвертичные соли, такие как метилтриэтанольные или триметилмоноэтанольные формы, и циклические формы солей аммония, такие как формы солей N-метилпиридиния,N-метил-N-(2-гидроксиэтил)морфолиния, N,N-диметилморфолиния, N-метил-N-(2-гидроксиэтил)морфолиния или N,N-диметилпиперидиния. Такие формы солей могут быть получены с использованием кислотного(ых) соединения(ий) формулы I и методов, известных из уровня техники. Соединения по данному изобретению могут содержать асимметрический атом углерода или сульфоксидную группу, и некоторые из соединений по данному изобретению могут содержать один или несколько асимметрических центров, и, таким образом, могут быть образованы оптические изомеры и диастереомеры. Хотя на формуле I не показана стереохимия, настоящее изобретение включает такие оптические изомеры и диастереомеры; так же, как и рацемические смеси и разделенные, энантиомерно чистые R и S стереоизомеры; так же, как и другие смеси R и S стереоизомеров и их фармацевтически приемлемые соли. Также должно быть понятно, что могут существовать таутомеры заявленных соединений. Объем притязаний настоящей заявки, в том что касается указанных в заголовке соединений или их промежуточных соединений, должен охватывать оба из таутомеров, так же, как и их смеси. Соединения по настоящему изобретению являются ингибиторами ингибитора серинпротеазы PAI-1,и поэтому они полезны для лечения или профилактики тех процессов, в которых происходит продуцирование и/или действие PAI-1. Так, соединения по настоящему изобретению полезны для лечения или профилактики инсулиннезависимых типов сахарного диабета и сердечно-сосудистых заболеваний, вызван-4 009696 ных таким состоянием, и для профилактики проявлений тромбоза, связанных с заболеванием коронарной артерии и сердечно-сосудистыми заболеваниями. Эти соединения также полезны для ингибирования процесса(ов) заболевания, включающего тромболитическое и протромбозное состояния, которые включают, но не ограничиваются этим, образование атеросклеротических бляшек, венозный и артериальный тромбоз, ишемию миокарда, фибрилляцию предсердия, глубокий тробофлебит, синдромы коагуляции,легочный тромбоз, церебральный тромбоз, тромбоэмболические осложнения при хирургическом вмешательстве (таком, как вправление суставов) и окклюзию периферических артерий. Эти соединения также полезны для лечения удара, связанного с или являющегося результатом фибрилляции предсердий. Соединения по настоящему изобретению также могут быть полезны для лечения заболеваний, связанных с накоплением внеклеточного матрикса, включающих, но не ограничивающихся этим, фиброз почек, хроническое обструктивное заболевание легких, реноваскулярное заболевание и отторжение трансплантата органов. Соединения по настоящему изобретению также могут быть полезны для лечения злокачественных заболеваний и заболеваний, связанных с неоангиогенезом (таких, как диабетическая ретинопатия). Соединения по настоящему изобретению также можно использовать в связи с процессами или процедурами, включающими поддержание раскрытого состояния кровеносных сосудов, включая сосудистую хирургию, сосудистый трансплантат и стент, имплантацию и трансплантацию органов, тканей и клеток. Соединения по настоящему изобретению также могут быть полезны для лечения болезни Альцгеймера. Этот способ также можно охарактеризовать как ингибирование активатора плазминогена при помощиPAI-1 у млекопитающего, в частности человека, страдающего или подверженного болезни Альцгеймера. Этот способ также можно охарактеризовать как способ повышения или нормализации уровней концентрации плазмина у млекопитающего, в частности, страдающего или подверженного болезни Альцгеймера. Соединения по настоящему изобретению также можно использовать для лечения миелофиброза с миелоидной метаплазией путем регулирования гиперплазии стромальных клеток и увеличения белков внеклеточного матрикса. Соединения по настоящему изобретению также можно использовать в сочетании с содержащей ингибитор протеазы высокоактивной антиретровирусной терапией (HAART) для лечения заболеваний, являющихся результатом фибринолитического нарушения и гиперкоагуляции у ВИЧ-инфицированных пациентов, принимающих такое лечение. Соединения по настоящему изобретению можно использовать для лечения диабетической ретинопатии и почечного диализа, связанного с нефропатией. Соединения по настоящему изобретению можно использовать для лечения рака, септисемии, ожирения, резистентности к инсулину, пролиферативных заболеваний, таких как псориаз, улучшающий коагуляцию гомеостаз, сердечно-сосудистых заболеваний, микрососудистых заболеваний, гипертонии, деменции, остеопороза, артрита, астмы, сердечной недостаточности, аритмии, стенокардии и в качестве гормонозаместительного средства, для лечения, профилактики или реверсии развития атеросклероза,болезни Альцгеймера, остеопороза, остеопении; уменьшения воспалительных маркеров, уменьшения Среактивного белка или для профилактики или лечения сосудистого воспаления начальной стадии, удара,деменции, коронарного заболевания сердца, первичной и вторичной профилактики инфаркта миокарда,стабильной или нестабильной стенокардии, первичной профилактики коронарных явлений, вторичной профилактики сердечно-сосудистых явлений, заболевания периферических сосудов, заболевания периферических артерий, острого сосудистого синдрома, снижения риска подвергнуться процедуре реваскуляризации миокарда, микрососудистых заболеваний, таких как нефропатия, нейропатия, ретинопатия и нефротический синдром, гипертонии, диабета типа 1 и 2 и связанных с этим заболеваний, гипергликемии, гиперинсулинемии, злокачественных изменений, предзлокачественных изменений, злокачественных поражений желудочно-кишечного тракта, липосарком и эпителиальных опухолей и/или для улучшения функции эндотелия и всех форм сердечно-сосудистых заболеваний. Соединения по настоящему изобретению можно использовать для местного нанесения при лечении ран для предотвращения образования рубцов. Соединения по настоящему изобретению также можно использовать для лечения воспалительных заболеваний, септического шока и повреждения сосудов, связанных с инфекциями, и для лечения крови и продуктов крови, используемых при диализе, хранении крови в жидкой фазе, особенно ex vivo агрегации тромбоцитов. Соединения по настоящему изобретению также можно добавлять к человеческой плазме в процессе химического анализа крови в больничных установках для определения фибринолитической способности. Соединения по настоящему изобретению также можно использовать в комбинации с протромболитическими, фибринолитическими средствами и антикоагулянтами. Настоящее изобретение, кроме того, включает способы лечения, профилактики, улучшения или ингибирования каждого из указанных заболеваний у млекопитающего, предпочтительно человека, при этом каждый такой способ(ы) включает введение млекопитающему, нуждающемуся в таком лечении, профилактике, улучшении или ингибировании, фармацевтически или терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли или сложного эфира. Еще в одном аспекте настоящее изобретение относится к соединению по изобретению для использования в качестве лекарственного средства.-5 009696 В следующем аспекте настоящее изобретение относится к использованию соединения по изобретению для получения лекарственного средства для лечения тромбоза или фибринолитического нарушения у млекопитающего. В следующем аспекте настоящее изобретение относится к способам получения соединения формулы где R, R1, R2, R3, R4, R5, R6, R7 и n определены выше, или его фармацевтически приемлемой соли или сложного эфира, включающим: где X представляет собой CN, СОгалоген, COOR12, CONR13R14, где R12 выбран из C1-С 6 алкила, СО(С 1 С 6 алкила), бензила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила, C1-С 6 алкокси, фенила, галогена, трифторметила и трифторметокси, и фенила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-C6 алкила,С 1-С 6 алкокси, фенила, галогена, трифторметила и трифторметокси;R13 и R14 независимо выбраны из C1-С 6 алкила, C1-С 6 алкокси, галогена, CO(C1-C6 алкила), бензила,необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила,С 1-С 6 алкокси, фенила, галогена, трифторметила и трифторметокси; и фенила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила, C1-С 6 алкокси, фенила,галогена, трифторметила и трифторметокси; или(b) преобразование соединения формулы (2) в его фармацевтически приемлемый сложный эфир или основно-аддитивную соль; или(c) разделение рацемической смеси соединений формулы (2) для выделения энантиомера соединения формулы (2) или его фармацевтически приемлемой соли или сложного эфира. В следующем аспекте настоящее изобретение относится к способам получения соединения формулы где R, R1, R2, R3, R4, R5, R6 и n определены выше, или его фармацевтически приемлемой соли, включающим:(b) преобразование соединения формулы (2) в его фармацевтически приемлемую основноаддитивную соль; или(c) разделение рацемической смеси соединений формулы (3) для выделения энантиомера соединения формулы (3) или его фармацевтически приемлемой соли. Соединения по настоящему изобретению также можно использовать для лечения рака, включающего, но не ограничивающегося этим, рак молочной железы, рак яичников, и в качестве контрастного вещества для идентификации метастазирующих раковых заболеваний. Должно быть понятно, что фармацевтически или терапевтически эффективное количество соединения в данном описании относится к количеству рассматриваемого соединения, которое способно, по существу, ингибировать ингибитор серинпротеазы PAI-1 у млекопитающего, нуждающегося в этом, в значительной степени для обеспечения желаемого улучшения рассматриваемого состояния или обеспечения достаточного ингибирования ингибитора серинпротеазы PAI-1 для предотвращения, ингибирования или ограничения появления физиологической основы для рассматриваемого заболевания или состояния. В предпочтительном варианте осуществления настоящего изобретения R4 представляет собой водород,алкил, содержащий 1-6 атомов углерода, перфторалкил, содержащий 1-6 атомов углерода, арил, замещенный R8, алканоил, содержащий 1-6 атомов углерода, или ароил, необязательно замещенный 1-3 группами, независимо выбранными из R8. Еще в одном предпочтительном варианте воплощения настоящего изобретения R1 представляет собой водород. Еще в одном предпочтительном варианте воплощения настоящего изобретения R2 представляет собой водород. Еще в одном предпочтительном варианте воплощения настоящего изобретения R3 представляет собой бром или водород. Еще в одном предпочтительном варианте воплощения настоящего изобретения R4 представляет собой водород. Еще в одном предпочтительном варианте воплощения настоящего изобретения R5 представляет собой пентил. Еще в одном предпочтительном варианте воплощения настоящего изобретения R6 выбран из бензила, метила, ацила, (2-трифторметил)бензила и (4-трет-бутил)бензила. Еще в одном предпочтительном варианте воплощения настоящего изобретения R7 представляет собой водород. Еще в одном предпочтительном варианте воплощения настоящего изобретения n=0. Еще в одном предпочтительном варианте воплощения настоящего изобретения А представляет собой СО 2 Н или тетразол. Одной подгруппой соединений по настоящему изобретению являются соединения формулы I где R1, R2, R3, R4, R5, R6, А, n и R8 определены выше, или их фармацевтически приемлемые соли. Еще одной подгруппой предпочтительных соединений по настоящему изобретению являются соединения формулы IR5 представляет собой водород, алкил, содержащий 1-6 атомов углерода; А представляет собой СООН или тетразол;-7 009696 или их фармацевтически приемлемые формы солей или сложных эфиров. Из особенно предпочтительных соединений по настоящему изобретению можно указать следующие: 1-бензил-3-фенил-2[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемая соль; 6-(1-бензил-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил-1 Н-тетразол-5-илметиловый эфир или 1 бензил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1 Н-индол или его фармацевтически приемлемая соль; 1-метил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемая соль; 2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-метил-3-пентил-1 Н-индол или 1-бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил 1 Н-тетразол-5-илметиловый эфир или его фармацевтически приемлемая соль; 1-ацетил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемая соль; 1-ацетил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1 Н-индол или его фармацевтически приемлемая соль; 3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-[2-(трифторметил)бензил]-1H-индол или его фармацевтически приемлемая соль; 2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]-1H-индол или его фармацевтически приемлемая соль; 1-(4-трет-бутилбензил)3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1 Н-индол или его фармацевтически приемлемая соль; 2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1 Н-индол или его фармацевтически приемлемая соль;[1-бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиуксусная кислота или ее фармацевтически приемлемая соль. Настоящее изобретение описывает композицию и применение замещенных нафтилиндольных производных формулы I где R1, R2, R3, R4 независимо представляют собой одну или несколько групп, выбранных из водорода,алкила, циклоалкила, алканоила, галогена, гидрокси, арила, замещенного арила, перфторалкила, алкокси,амино, алкиламино, диалкиламино, перфторалкокси;n является целым числом, имеющим значение 0-6; А представляет собой СООН или имитирующее кислоту соединение, такое как тетразол, SO3H,PO3H2, тетроновая кислота и т.д. Соединения по настоящему изобретению, например, можно получить в соответствии со следующими схемами реакций или их модификацией с использованием легкодоступных исходных веществ, реагентов и традиционных методов синтеза. Также возможны варианты таких стадий способа, которые сами по себе хорошо известны и которые может осуществить химик, занимающийся получением лекарственных средств. В приведенных ниже схемах реакций R1, R2, R3, R4, R5, R6 и R7 выбраны из групп, которые определены выше. На схеме I метоксинафтальдегиды (1) преобразовывают в кетоны (2) в две стадии. В первой части используют химию Гриньяра для получения промежуточного спирта, который преобразовывают в кетон путем окисления, включающего РСС или MnO2. Соединения 2 затем используют в синтезе индолов по методу Фишера для образования структур нафтилиндольного ядра (3) с использованием либо арилгидразина, либо N-арилгидразона. В случае, когда используют гидразон, в индольный каркас можно включать различные замещения; гидразоны могут быть получены с использованием недавно описанной процедуры в JACS, S. Wafaw; B.H. Yang; S.L. Buchwald. JACS, 121, 1999, 10251-10263. В этом месте стратегия син-8 009696 теза предполагает выбор одного из двух возможных путей: А и/или В. На пути А нафтилиндолы 3 подвергают N-алкилированию (R6X равно алкилгалогениду, такому как метилиодид) или N-ацилированиюR6)2O равно ангидриду, такому как уксусный ангидрид) с получением промежуточных соединений, таких как соединения 4. Эти соединения подвергают деметилированию при помощи трибромида бора с получением нафтолов 5. Соединения 5 подвергают О-алкилированию с использованием различных алкилгалогенидов и карбоната цезия в ацетоне с получением соединений 8, являющихся предшественниками целевых кислот 9. Группа Z соединений 8 является кислотным предшественником, таким как эфир или нитрил карбоновой кислоты, которые могут быть преобразованы в карбоновые кислоты или тетразолы (9),соответственно, путем гидролиза или образования тетразола. Альтернативный путь к кислотам 9, включающий путь В, также исходит из нафтилиндолов 3. Эти индолы сначала деметилируют при помощи трибромида бора с получением нафтолов 6. Соединения 6 подвергают О-алкилированию с использованием различных алкилгалогенидов и карбоната цезия в ацетоне с получением индолов 7. Эти соединения подвергают N-алкилированию или N-ацилированию, как на пути А, также с получением соединений-предшественников 8. На этом этапе группы Z преобразовывают в кислоты соединений 9, как описано выше. Схема I-9 009696 Настоящее изобретение обеспечивает композиции, включающие замещенные нафтилиндольные соединения (I), либо отдельно, либо в сочетании с эксципиентами (т.е. фармацевтически приемлемыми веществами, не обладающими фармакологическим действием). Такие композиции предназначены для лечения состояний, являющихся результатом фибринолитического нарушения, такого как глубокий тромбофлебит и коронарное заболевание сердца, фиброз легких и т.д. Конкретная используемая доза зависит от различных факторов, включающих хозяина, либо в ветеринарии, либо в медицине человека, природу и тяжесть подлежащего лечению состояния, пути введения и от конкретного используемого активного вещества. Соединения можно вводить любым традиционным путем, в частности парентерально, предпочтительно перорально в форме таблеток или капсул. Вводимые соединения могут быть в свободной форме или в форме фармацевтически приемлемой соли, как подходяще, для их применения в качестве фармацевтических средств, в частности для применения для профилактики или лечения атеросклероза и его осложнений (стенокардии, инфаркта миокарда, аритмии, сердечной недостаточности, почечной недостаточности, удара, окклюзии периферических артерий и связанных с эти болезненных состояний). Такие меры замедлят прогрессирование болезненного состояния и будут способствовать естественному обращению процесса в обратном направлении. Любой известный из уровня техники носитель можно использовать для получения фармацевтических композиций. В таких композициях носитель может быть твердым, жидким или смесью твердого вещества и жидкости. Твердые композиции включают порошки, таблетки и капсулы. Твердый носитель может представлять собой одно или несколько веществ, которые могут также действовать как отдушка,краситель, смазывающее вещество, стабилизатор, суспендирующий агент, связующее вещество или разрыхлитель для таблеток. В порошках носитель является тонкоизмельченным твердым веществом, которое находится в смеси с тонкоизмельченным активным ингредиентом. В таблетках активный ингредиент смешан с носителем, имеющим необходимые связывающие свойства, в подходящих пропорциях и спрессован в желаемые форму и размер. Подходящими твердыми носителями являются карбонат магния,стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза,гидроксиметилцеллюлоза, натрийкарбоксиметилцеллюлоза, низкоплавкий воск, масло какао и т.п. С соединениями по настоящему изобретению можно также использовать инкапсулирующие вещества, и термин "композиция" предусматривает включение активного ингредиента в сочетании с инкапсулирующим материалом в виде лекарственного препарата с или без других носителей. Также для доставки противоатеросклеротического лекарственного средства по настоящему изобретению можно использовать саше. Стерильные жидкие композиции включают растворы, суспензии, эмульсии, сиропы и эликсиры. Соединения по настоящему изобретению могут быть растворены или суспендированы в фармацевтически приемлемом носителе, таком как стерильная вода, стерильный органический растворитель или их смесь. Предпочтительно жидкий носитель является подходящим для парентеральной инъекции. Когда соединения являются достаточно растворимыми, их можно растворять непосредственно в нормальном физиологическом растворе с или без использования подходящих органических растворителей, таких как пропиленгликоль или полиэтиленгликоль. Если желательно, дисперсии тонкоизмельченных соединений можно получать в водном растворе крахмала или натрийкарбоксиметилцеллюлозы или в подходящем масле, таком как арахисовое масло. Жидкие фармацевтические композиции, представляющие собой стерильные растворы или суспензии, можно применять для внутримышечного, внутрибрюшинного или подкожного введения путем инъекции. Во многих случаях жидкую форму композиции можно использовать вместо предпочтительного перорального способа введения твердой композиции. Предпочтительно получение дозированной лекарственной формы соединений для стандартных схем введения. Таким образом, композиция может быть легко подразделена на более мелкие дозы по назначению врача. Например, дозированные лекарственные формы могут быть в форме упаковок порошка, пузырьках или ампулах и предпочтительно в форме капсул или таблеток. Активное соединение,присутствующее в этих дозированных лекарственных формах композиции, может присутствовать в количестве от около 1 до около 15 гили больше для одноразового или нескольких ежедневных приемов в соответствии с конкретной потребностью пациента. Суточная доза активного соединения варьирует в зависимости от пути введения, размеров, возраста и пола пациента, тяжести заболевания и ответной реакции на лечение, отслеживаемой по результатам анализов крови, и скорости выздоровления пациента. Начиная схему приема с минимальной ежедневной дозы около 1 г, можно использовать показатели уровня в крови PAI-1 и анализ облегчения симптомов у пациента для определения, необходимо или нет увеличение дозы. На основании данных, представленных ниже, предполагаемая суточная доза как для применения в медицине, так и в ветеринарии составляет от около 25 до 200 мг/кг в сутки и более обычно от около 50 до около 100 мг/кг в сутки. Способность соединений по настоящему изобретению ингибировать ингибитор-1 активатора плазминогена была установлена в следующих экспериментальных процедурах. Первичный скрининг на ингибирование PAI-1 Испытываемые соединения растворяют в ДМСО при конечной концентрации 10 мМ, затем разводят 100 Х в физиологическом буфере. Анализ ингибирования начинают добавлением испытываемого соединения (конечная концентрация 1-100 мкМ, максимальная концентрация ДМСО 0,2%) в рН 6,6 буфере,- 10009696 содержащем 140 нМ ингибитора-1 рекомбинантного активатора плазминогена человека (PAI-1; MolecularInnovations, Royal Oak, MI). После инкубации в течение 1 ч при комнатной температуре добавляют 70 нМ рекомбинантного активатора тканевого плазминогена человека (tPA) и комбинацию испытываемого соединения, PAI-1 и tPA инкубируют в течение еще 30 мин. После второй инкубации добавляютSpectrozyme-tPA (American Diagnostica, Grrenwich, CT), хромогенный субстрат для tPA, и поглощение считывают при 405 нм на 0 и 60 мин. Относительное ингибирование PAI-1 равно остаточной активностиtPA в присутствии испытываемого соединения и PAI-1. Контрольные обработки включают полное ингибирование tPA при помощи PAI-1 при используемом молярном соотношении (2:1) и отсутствие какоголибо эффекта испытываемого соединения только на tPA. Анализ для определения ИК 50 ингибирования PAI-1 Этот анализ основан на взаимодействии между tPA и активным PAI-1, не разлагаемым под действием SDS. Планшеты для анализа сначала покрывают человеческим tPA (10 мкг/мл). Испытываемые соединения растворяют в ДМСО при концентрации 10 мМ, затем разбавляют физиологическим буфером(рН 7,5) до конечной концентрации 1-50 мкМ. Испытываемые соединения инкубируют с человеческимPAI-1 (50 нг/мл) в течение 15 мин при комнатной температуре. Покрытые tPA планшеты промывают раствором 0,05% Tween 20 и 0,1% BSA, затем планшеты блокируют раствором 3% BSA. Аликвоты раствора тестируемое соединение/PAI-1 затем добавляют к покрытым tPA планшетам, инкубируют при комнатной температуре в течение 1 ч и промывают. Связанный на планшете активный PAI-1 анализируют, добавляя аликвоту, при разведении 1:1000, 33 В 8 моноклонального антитела против человеческого PAI-1 и инкубируя планшет при комнатной температуре в течение 1 ч (Molecular Innovations, Royal Oak, MI). Планшет снова промывают и добавляют раствор конъюгата козлиного антимышиного IgG-щелочной фосфатазы при разведении 1:50000 в козлиной сыворотке. Планшет инкубируют в течение 30 мин при комнатной температуре, промывают и добавляют раствор субстрата щелочной фосфатазы. Планшет инкубируют в течение 45 мин при комнатной температуре, проявление цвета определяют при OD405 нм. Количественные значения активного PAI-1, связавшегося с tPA при различных концентрациях испытываемого соединения, используют для определения ИК 50. Результаты анализируют с использованием логарифмического уравнения. Чувствительность анализа составляет 5 нг/мл человеческого PAI-1, как определено по стандартной кривой в диапазоне 0-100 нг/мл. Соединения по настоящему изобретению, ингибирующие ингибитор-1 активатора плазминогена,обобщенно представлены в таблице ниже. ИК 50 определяли при помощи анализа антител, описанного выше. ИК 50 определяли при помощи модификации первичного скрининга для ингибирования PAI-1. Экспериментальные примеры Ниже описано получение репрезентативных соединений по настоящему изобретению. Пример 1. 1-Бензил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол. Стадия 1. 1-(6-Метокси-2-нафтил)гептан-1-ол. В трехгорлую колбу, снабженную сверху мешалкой, капельной воронкой и термометром, добавляли 6-метокси-2-нафтальдегид (70,760 г, 380 ммоль) и Et2O (1400 мл). Перемешиваемую суспензию в атмосфере N2 охлаждали на ледяной бане с последующим медленным добавлением гексилмагнийбромида(228 мл 2 М раствора в Et2O) в течение 1 ч. Температуру поддерживали ниже 12 С. После добавления реакционную смесь перемешивали 3 ч при комнатной температуре, затем охлаждали на ледяной бане и медленно гасили водой/насыщенным водным раствором NH4Cl (250 мл). После гашения реакции ледяную баню удаляли и смесь перемешивали в течение получаса, затем разбавляли H2O (750 мл) для растворения всех твердых частиц. Слои разделяли и водный слой экстрагировали при помощи Et2O (3200 мл). Объединенные органические слои промывали водой (3200 мл) и насыщенным солевым раствором(2200 мл), сушили над Na2SO4, фильтровали, испаряли влагу на роторном испарителе и сушили в вакууме с получением желаемого продукта не совсем белого цвета (101,1 г, 371,2 ммоль, 98%) с т.пл. 7174 С. 15 г неочищенного спирта перекристаллизовывали из гексана с получением желаемого продукта в виде белого твердого вещества (11,7 г) с т.пл. 71-73 С. 1 Н ЯМР (DMSO-d6)0,82 (т, J=6,7 Гц, 3 Н), 1,15-1,38 (м, 8 Н), 1,58-1,71 (м, 2 Н) 3,85 (с, 3 Н), 4,58-4,64(1000 мл) в атмосфере N2 добавляли хлорхромат пиридиния (120,02 г, 556,74 ммоль). Реакционную смесь перемешивали в течение 3 ч и затем выливали на колонку с оксидом алюминия (2000 г, basic Brockmanactivity, 60-325 меш). Колонку элюировали CH2Cl2. Продукт собирали, испаряли влагу на роторном испарителе и сушили в вакууме с получением желаемого продукта в виде белого твердого вещества (81,5 г,301,44 ммоль, 81%) с т.пл. 69-72 С. 177 мг неочищенного кетона перекристаллизовывали из метанола с получением желаемого продукта в виде белого твердого вещества (105 мг), т.пл. 70-72 С. 1 Н ЯМР (DMSO-d6)0,86 (м, 3 Н), 1,25-1,40 (м, 6 Н), 1,60-1,70 (м, 2 Н), 3,07 (т, J=7,3 Гц, 2 Н), 3,90 (с,3 Н), 7,24 (д, J=9 Гц, 1 Н), 7,39 (с, 1 Н), 7,87 (д, J=8,7 Гц, 1 Н), 7,93 (д, J=8,7 Гц, 1 Н), 8,02 (д, J=8,9, 1 Н), 8,58(2000 мл) в атмосфере N2 добавляли фенилгидразин (35,857 г, 331,58 ммоль) и моногидрат п-толуолсульфокислоты (120,41 г, 633,02 ммоль). Реакционную смесь кипятили с обратным холодильником. Нагревание давало гомогенный раствор. (Модификация этой реакции Фишера синтеза индолов для введения различных замещений на индольное кольцо использует N-арилгидразон вместо аридгидразина - подробности получения гидразона в JACS, S. Wagaw; B.H. Yang; S.L. Buchwald. JACS, 121, 1999, 10251-10263.) После кипячения с обратным холодильником в течение 92 ч нагревание прекращали и реакционную смесь охлаждали и сушили на роторном испарителе до получения остатка. Остаток распределяли междуEtOAc (1700 мл) и 1 н. HCl (500 мл). Слои встряхивали, разделяли и органический слой промывали 1 н.HCl (2300 мл), насыщенным водным раствором NaHCO3 (3250 мл), H2O (3250 мл), насыщенным солевым раствором (2250 мл), сушили над Na2SO4, фильтровали, удаляли влагу на роторном испарителе и сушили в вакууме с получением темного вязкого масла (106,2 г). Остаток растирали с гексаном с получением не совсем белого твердого вещества, которое собирали, промывали и сушили в вакууме с получением не совсем белого твердого продукта (95,5 г, 279,21 ммоль, 93%) с разл. при 93-96 С. 400 мг неочищенного индола перекристаллизовывали из гексана с получением продукта в виде белого твердого вещества (298 мг), т.пл. 95-97 С. 1 Н ЯМР (DMSO-d6)0,82 (т, J=7,0 Гц, 3 Н), 1,31 (м, 4 Н), 1,66 (м, 2 Н), 2,89 (т, J=7,6 Гц, 2 Н), 3,90 (с,3 Н), 6,98-7,02 (м, 1 Н), 7,07-7,10 (м, 1 Н), 7,21 (дд, J=2,4, 8,9 Гц, 1 Н), 7,34-7,37 (м, 2 Н), 7,54 (д, J=7,94 Гц,1 Н), 7,73 (дд, J=l,5, 8,6 Гц, 1 Н), 7,88 (д, J=9,00 Гц, 1 Н), 7,93 (д, J=8,55 Гц, 1 Н), 8,03 (с, 1 Н), 11,17 (с, 1 Н); ИК (твердое вещество) 3350, 2960, 2920, 2840, 1600, 1200, 740 см-1; масс-спектр [ESI], m/z 344 (М+Н)+. Анал. рассчитано для C24H25NO: С, 83,93; Н, 7,34; N, 4,08; найдено: С, 83,59; Н, 7,51; N, 3,86. Стадия 4. 1-Бензил-2-(6-метокси-2-нафтил)-3-пентил-1 Н-индол. К перемешиваемому раствору 2-(6-метокси-2-нафтил)-3-пентил-1 Н-индола (95,5 г, 278,04 ммоль) в сухом ДМФА (1000 мл) в атмосфере N2 при 0 С (ледяная баня) добавляли по порциям в течение 20 мин трет-бутоксид калия (32,762 г, 291,95 ммоль). После добавления бутоксида реакционную смесь перемешивали в течение 20 мин с последующим добавлением бензилбромида (50,110 г, 291,95 ммоль) одной порцией. Через 10 мин баню удаляли. Реакционную смесь перемешивали в течение 5 ч и затем гасили водой/конц. НОАс (0,05 экв., 13,902 ммоль, 0,8 мл) и перемешивали в течение ночи. Реакционную смесь сушили на роторном испарителе до получения остатка, который распределяли между EtOAc (2 л) и 0,1 н.HCl (600 мл). Слои разделяли и органический слой промывали 0,1 н. HCl (2250 мл), H2O (1250 мл) и насыщенным солевым раствором (2250 мл), сушили над Na2SO4, фильтровали, удаляли влагу на роторном испарителе и сушили с получением коричневого вязкого остатка (123,5 г). Остаток растворяли в гексане и обрабатывали флэш-хроматографией на силикагеле (2000 г). Колонку элюировали 1% EtOAc/гек- 12009696 саном. Продукт собирали, фильтровали, удаляли влагу на роторном испарителе и сушили в вакууме с получением продукта в виде вязкого желтого масла (109,3 г, 252 ммоль, 91%). 300 мг желтого масла подвергали дальнейшей очистке препаративной хроматографией на пластинках. Пластинки элюировали 15% этилацетатом/гексаном. Продукт собирали, фильтровали, удаляли влагу на роторном испарителе и сушили в вакууме при комнатной температуре с получением желаемого продукта в виде воскообразного твердого вещества белого цвета, т.пл. 76-80 С. 1 Н ЯМР (DMSO-d6)0,72 (т, J=6,9 Гц, 3 Н), 1,10-1,20 (м, 4 Н), 1,51-1,60 (м, 2 Н), 2,67 (т, J=7,5 Гц,2 Н), 3,89 (с, 3 Н), 5,30 (с, 2 Н), 6,81 (д, J=7,0 Гц, 2 Н), 7,04-7,22 (м, 6 Н), 7,34 (д, J=7,9 Гц, 1 Н), 7,36 (д, J=2,3 Гц,1 Н), 7,41 (дд, J=1,4, 8,4 Гц, 1 Н), 7,60 (д, J=7,3 Гц, 1 Н), 7,80-7,84 (м, 2 Н), 7,87 (д, J=8,4 Гц, 1 Н); ИК (твердое вещество) 2910, 1605, 1460, 1200 и 740 см-1; масс-спектр [ESI], m/z 434 (М+Н)+. Анал. рассчитано для C31H31NO: С, 85,87; Н, 7,21; N, 3,23; найдено: С, 85,43; Н, 7,31; N, 3,14. Стадия 5. 6-(1-Бензил-3-пентил-1 Н-индол-2-ил)-2-нафтол. К перемешиваемому раствору 1-бензил-2-(6-метокси-2-нафтил)-3-пентил-1 Н-индола (109,0 г, 251 ммоль) в CH2Cl2 (1000 мл) в атмосфере N2 при -78 С добавляли по каплям в течение 1,5 ч BBr3 (1 М в CH2Cl2, 302 мл). После добавления реакционную смесь нагревали до 0 С и перемешивали в течение 2,5 ч с последующим нагреванием до комнатной температуры. После 5 ч протекания реакции реакционную смесь охлаждали до 0 С и гасили водой (250 мл). Смесь перемешивали в течение ночи и сушили на роторном испарителе до получения остатка. Остаток распределяли между EtOAc (1500 мл) и H2O (500 мл). Слои встряхивали,разделяли и органический слой промывали H2O (2250 мл), насыщенным солевым раствором (2250 мл),сушили над Na2SO4, фильтровали, удаляли влагу на роторном испарителе и сушили в вакууме с получением черного вязкого клейкого вещества (114 г). Остаток растворяли в CHCl3 и обрабатывали флэшхроматографией на силикагеле (2000 г). Колонку элюировали гексаном и 8% EtOAc/гексаном. Продукт собирали, фильтровали, удаляли влагу на роторном испарителе и остаток растирали с гексаном, затем сушили с получением продукта в виде не совсем белого твердого вещества (89,2 г, 213 ммоль, 85%) с т.пл. 96-100 С. 400 мг сырого твердого вещества перекристаллизовывали из гексана с получением желаемого продукта в виде не совсем белого твердого вещества (311 мг), т.пл. 97-100 С. 1 Н ЯМР (DMSO-d6)0,73 (т, J=6,7 Гц, 3 Н), 1,10-1,20 (м, 4 Н), 1,51-1,60 (м, 2 Н), 2,67 (т, J=7,3 Гц,3 Н), 5,29 (с, 2 Н), 6,82 (д, J=7,2 Гц, 2 Н), 7,04-7,20 (м, 7 Н), 7,30-7,35 (м, 2 Н), 7,59 (д, J=7,8 Гц, 1H), 7,73-7,78(м, 3 Н); ИК (твердое вещество) 3380, 2920, 1610, 1200, 740 см-1; масс-спектр [ES], m/z 420 (М+Н)+. Анал. рассчитано для C30H29NO: С, 85,88; Н, 6,97; N, 3,34; найдено: С, 85,85; Н, 7,10; N, 3,20. Стадия 6. [6-(1-Бензил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. К раствору 6-(1-бензил-3-пентил-1 Н-индол-2-ил)-2-нафтола (19,245 г, 45,868 ммоль) в ацетоне (200 мл) в атмосфере N2 при комнатной температуре добавляли Cs2CO3 (16,439 г, 50,455 ммоль) с последующим добавлением бромацетонитрила (6,052 г, 50,455 ммоль). После перемешивания в течение 4,5 ч реакционную смесь сушили на роторном испарителе до получения остатка. Остаток распределяли между EtOAc(350 мл) и H2O (150 мл). Слои встряхивали, разделяли и органический слой промывали H2O (280 мл),насыщенным солевым раствором (280 мл), сушили над Na2SO4, фильтровали, удаляли влагу на роторном испарителе и сушили в с получением вязкого коричневого масла (20,664 г). Остаток забирали вCHCl3 и обрабатывали флэш-хроматографией на силикагеле (435 г). Колонку элюировали гексаном и 8%EtOAc/гексаном. Продукт собирали, фильтровали, удаляли влагу на роторном испарителе и остаток растирали с гексаном, затем сушили с получением продукта в виде белого твердого вещества (18,78 г, 40,95 ммоль,89%) с т.пл. 111-113 С. 400 мг сырого продукта перекристаллизовывали из МеОН с получением желаемого продукта в виде белого твердого вещества (0,362 мг), т.пл. 109-112 С. 1 Н ЯМР (DMSO-d6)0,72 (т, J=6, 9 Гц, 3 Н), 1,10-1,20 (м, 4 Н), 1,52-1,59 (м, 2 Н), 2,68 (т, J=7,5 Гц,2 Н), 5,31 (с, 4 Н), 6,81 (д, J=7,2 Гц, 2 Н), 7,05-7,19 (м, 5 Н), 7,31 (дд, J=2,6, 9,0 Гц, 1 Н), 7,36 (д, J=8,1 Гц,1 Н), 7,47 (дд, J=1,4, 8,2 Гц, 1 Н), 7,56 (д, J=2,4 Гц, 1 Н), 7,6 (д, J=7,6 Гц, 1 Н), 7,88-7,94 (м, 3 Н); ИК (твердое вещество) 2940, 1610, 1460 и 1200 см-1; масс-спектр [ESI], m/z 459 (М+Н)+. Анал. рассчитано для C32H30N2O: С, 83,81; Н, 6,59; N, 6,11; найдено: С, 83,93; Н, 6,60; N, 6,05. Стадия 7. 1-Бензил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол. К перемешиваемому раствору [6-(1-бензил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила(50,737 г, 948,54 ммоль). Реакционную смесь нагревали при температуре между 95-100 С в течение 1,33 ч,затем охлаждали. Реакционную смесь сушили на роторном испарителе до получения остатка и остаток распределяли между EtOAc (2000 мл) и 1 н. HCl (600 мл). Слои встряхивали, разделяли и органический слой промывали 1 н. HCl (2300 мл), H2O (3300 мл) и насыщенным солевым раствором (2300 мл), сушили над Na2SO4, фильтровали, удаляли влагу на роторном испарителе и растирали с гексаном с получением не совсем белого твердого вещества (97,5 г). Продукт очищали при помощи кипячения с обратным холодильником твердого вещества в диэтиловом эфире (2000 мл), концентрировали до примерно 1 л и охлаждали. Твердое вещество собирали и сушили в вакууме с получением продукта в виде белого твердого вещества (77,4 г, 154,3 ммоль, 81%) с разл. при 111-114 С. 1 Н ЯМР (DMSO-d6)0,72 (т, J=6,9 Гц, 3 Н) 1,10-1,20 (м, 4 Н), 1,50-1,60 (м, 2 Н), 2,67 (т, J=7,8 Гц, 2 Н),- 13009696 5,30 (с, 2 Н), 5,62 (с, 2 Н), 6,81 (д, J=7,3 Гц, 2 Н), 7,02-7,20 (м, 5 Н), 7,30 (дд, J=2,4, 9,0 Гц, 1 Н), 7,35 (д, J=7,9 Гц,1 Н), 7,44 (дд, J=1,5, 8,2 Гц, 1 Н), 7,55 (д, J=2,3 Гц, 1 Н), 7,60 (д, J=7,6 Гц, 1 Н), 7,84-7,90 (м, 3 Н) 16,9 (с, 1 Н); ИК (твердое вещество) 2920, 2850, 1610, 1390, 1200, 860 и 750 см 1; масс-спектр [ESI], m/z 502 (М+Н)+. Анал. рассчитано для C32H31N5O: С, 76,62; Н, 6,23; N, 13,96; найдено: С, 76,43; Н, 6,12; N, 14,19. Пример 2. 6-(1-Бензил-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил 1 Н-тетразол-5-илметиловый эфир или 1-бензил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1 Н-индол. Стадия 1. 2-(6-Гидрокси-2-нафтил)-3-пентил-1 Н-индол. К перемешиваемому раствору 2-(6-метокси-2-нафтил)-3-пентил-1 Н-индола (0,915 г, 2,66 ммоль) вCH2Cl2 (30 мл), охлажденному до -78 С, добавляли по каплям BBr3 (9,86 мл, раствор 1,0 М в СН 2 С 12,9,86 ммоль). Реакционную смесь перемешивали при этой температуре в течение 0,5 ч и затем нагревали в течение 2 ч до комнатной температуры. Реакционную смесь гасили МеОН (5 мл) с последующим разбавлением H2O (20 мл) и EtOAc (200 мл). Органический слой промывали насыщенным солевым раствором(20 мл) и затем сушили (Na2SO4). После концентрирования остаток очищали с использованием аппарата очистки Biotage Flash 40 (градиент 10-20% EtOAc:петролейный эфир) с получением продукта (0,677 г,77%) в виде пенообразного твердого вещества. 1 Н ЯМР (DMSO-d6)0,83 (т, J=7,3 Гц, 3 Н), 1,23-1,42 (м, 4 Н), 1,58-1,76 (м, 2 Н), 2,89 (т, J=8,2 Гц,2 Н), 7,00 (т, J=8,2 Гц, 1 Н), 7,06-7,19 (м, 3 Н), 7,35 (д, J=8,2 Гц, 1 Н), 7,53 (д, J=8,2, 1 Н), 7,67 (д, J=9,1 Гц,1 Н), 7,74-7,88 (м, 2 Н), 7,98 (с, 1 Н), 9,83 (с, 1 Н), 11,14 (с, 1 Н); масс-спектр [(+) ESI], m/z 330 (М+Н)+ и [(-)ESI], m/z 328 (М-Н)-. Стадия 2. 2-(5-Бром-6-гидрокси-2-нафтил)-3-пентил-1 Н-индол. К перемешиваемому раствору 2-(6-метокси-2-нафтил)-3-пентил-1 Н-индола (1,27 г, 3,85 ммоль) в НОАс (25 мл), при 0 С добавляли KOAc (0,453 г, 4,62 ммоль). Реакционную смесь перемешивали при этой температуре в течение 10 мин и затем по каплям в течение 10 мин добавляли раствор Br2 (0,218 мл,4,24 ммоль) в НОАс (5 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 4 ч. Затем реакционную смесь разбавляли H2O (50 мл) и экстрагировали EtOAc (200 мл). Органический слой промывали насыщенным солевым раствором (20 мл) и затем сушили (Na2SO4). После концентрирования остаток очищали с использованием аппарата очистки Biotage Flash 40 (градиент 1030% EtOAc:петролейный эфир) с получением продукта (0,782 г, 50%) в виде твердого вещества (неразделяемая смесь моно- и дибромзамещенных аналогов, которую разделяли на следующей стадии). Монобромзамещенное соединение: масс-спектр [(-) ESI], m/z 406/408 (М-Н)- и дибромзамещенный аналог: масс-спектр [(-) ESI], m/z 486 (М-Н)-. Стадия 3. [1-Бром-6-(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил и [1-бром-6-(5-бром 3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. К перемешиваемому раствору 2-(5-бром-6-гидрокси-2-нафтил)-3-пентил-1 Н-индола (0,740 г, 1,81 ммоль) в ацетоне (20 мл) при комнатной температуре добавляли Cs2CO3 (1,30 г, 3,98 ммоль) с последующим добавлением бромацетонитрила (1,39 мл, 1,99 ммоль). Реакционную смесь перемешивали при этой температуре в течение 6 ч и затем разбавляли EtOAc (200 мл). Органический слой промывали H2O (20 мл), насыщенным солевым раствором (20 мл) и затем сушили (Na2SO4). После концентрирования остаток очищали с использованием аппарата очистки Biotage Flash 40 (20% EtOAc:петролейный эфир) с получением продукта (0,315 г, 39%) в виде твердого пенообразного вещества, а также его дибромзамещенного аналога (0,141 г, 15%). Монобромзамещенное соединение: 1H ЯМР (DMSO-d6)0,82 (т, J=7,3 Гц, 3 Н), 1,22-1,42 (м, 4 Н),1,60-1,74 (м, 2 Н), 2,93 (т, J=8,2 Гц, 2 Н), 5,46 (с, 2 Н), 7,02 (т, J=7,3 Гц, 1 Н), 7,13 (т, J=7,3 Гц, 1 Н), 7,39 (д,J=8,2 Гц, 1 Н), 7,58 (д, J=8,2 Гц, 1 Н), 7,67 (д, J=9,1 Гц, 1 Н), 7,97 (д, J=9,1 Гц, 1 Н), 8,10-8,28 (м, 3 Н), 11,31(0,135 г, 0,257 ммоль) в ТГФ (5 мл) при 0 С добавляли KOt-Bu (0,32 г, 0,283 ммоль) с последующим добавлением BnBr (0,019 мл, 0,308 ммоль). Реакционную смесь нагревали до комнатной температуры и оставляли перемешиваться на 24 ч. По истечении этого времени реакционную смесь гасили 1 н. HCl (2 мл). Полученный раствор разбавляли EtOAc (100 мл). Органический слой промывали 1 н. HCl (10 мл), насыщенным водным раствором NaHCO3 (10 мл) и насыщенным солевым раствором (10 мл) и затем сушили(MgSO4). После концентрирования остаток очищали препаративной хроматографией на пластинах (20%- 14009696 или 1-бензил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1 Н-индол. К перемешиваемому раствору [6-(1-бензил-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил]оксиацетонитрила (0,101 г, 0,188 ммоль) в ДМФА (7 мл) при комнатной температуре добавляли NaN3 (0,061 г,0,940 ммоль) с последующим добавлением NH4Cl (0,050 г, 0,940 ммоль). Реакционную смесь нагревали в течение 2 ч до 100 С. По истечении этого времени смесь концентрировали и разбавляли 2 н. HCl (5 мл). Эту смесь перемешивали при комнатной температуре и затем экстрагировали EtOAc (100 мл). Органический слой промывали 2 н. HCl (10 мл) и насыщенным солевым раствором (10 мл) и затем сушили(MgSO4). Полученный раствор концентрировали с получением продукта (0,065 г, 60%) в виде желтой пены, т.пл.70 С (разл.). 1 Н ЯМР (DMSO-d6)0,72 (т, J=6,9 Гц, 3 Н), 1,09-1,20 (м, 4 Н), 1,50-1,59 (м, 2 Н), 2,68 (т, J=7,3 Гц,2 Н), 5,32 (с, 2 Н), 5,71 (с, 2 Н), 6,77-6,81 (м, 2 Н), 7,07 (т, J=7,6 Гц, 1 Н), 7,10-7,18 (м, 4 Н), 7,38 (д, J=8,1 Гц,1 Н), 7,58-7,64 (м, 2 Н), 7,70 (д, J=9,0 Гц, 1 Н), 7,97 (с, 1 Н), 8,03 (д, J=9,2 Гц, 1 Н), 8,15 (д, J=8,9 Гц, 1 Н),15,90-17,70 (ушир. с, 1 Н); ИК (чистый) 3030, 2950, 2925, 2855, 1600, 1565, 1495, 1475, 1465, 1455, 1405,1330, 1270, 1745, 1195, 1145, 1050, 1030, 1020, 975, 920, 895, 830, 800, 740, 700 и 675 см-1; масс-спектр [(-)ESI], m/z 578 (М-Н)-. Анал. рассчитано для C32H30BrN5O1,5H2O: С, 63,26; Н, 5,47; N, 11,53; найдено: С, 63,16; Н, 5,11; N, 11,33. Пример 3. 1-Метил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол. Стадия 1. [6-(3-Пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,633 г, 84%), исходя из 2(6-гидрокси-2-нафтил)-3-пентил-1 Н-индола, используя процедуру стадии 3 примера 2. 1 Н ЯМР (DMSO-d6)0,83 (т, J=7,5 Гц, 3 Н), 1,24-1,42 (м, 4 Н), 1,60-1,75 (м, 2 Н), 2,93 (т, J=8,4 Гц,2 Н), 5,33 (с, 2 Н), 7,02 (т, J=8,4 Гц, 1 Н), 7,11 (т, J=8,4 Гц, 1 Н), 7,28-7,41 (м, 2 Н), 7,52-7,62 (м, 2 Н), 7,80 (д,J=9,3 Гц, 1 Н), 7,99 (д, J=9,3 Гц, 2 Н), 8,13 (с, 1 Н), 11,23 (с, 1 Н); масс-спектр [(-) ESI], m/z 367 (М-Н)-. Стадия 2. [6-(1-Метил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,412 г, 83%), исходя из [6(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя MeI и процедуру стадии 4 примера 2. 1 Н ЯМР (DMSO-d6)0,74 (т, J=7,5, Гц, 3 Н), 1,07-1,27 (м, 4 Н), 1,47-1,65 (м, 2 Н), 2,68 (т, J=8,3 Гц,2 Н), 3,59 (с, 3 Н), 5,34 (с, 2 Н), 7,08 (т, J=8,3 Гц, 1 Н), 7,19 (т, J=8,3 Гц, 1 Н), 7,34 (дд, J=1,5, 9,0 Гц, 1 Н), 7,48(д, J=9,0 Гц, 1 Н), 7,53-7,66 (м, 3 Н), 7,92-8,08 (м, 3 Н); масс-спектр [(+) ESI], m/z 383 (М+Н)+. Стадия 3. 1-Метил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол. Указанное в заголовке соединение получали в виде твердого вещества рыжевато-коричневого цвета(0,311 г, 74%), исходя из [6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл. 120-122 С. 1 Н ЯМР (DMSO-d6)0,73 (т, J=6,9 Гц, 3 Н), 1,09-1,24 (м, 4 Н), 1,48-1,60 (м, 2 Н), 2,66 (т, J=7,2 Гц,2 Н), 3,58 (с, 3 Н), 5,65 (с, 2 Н), 7,06 (т, J=7,6 Гц, 1 Н), 7,18 (т, J=7,4 Гц, 1 Н), 7,33 (дд, J=2,5, 8,9 Гц, 1 Н), 7,45(д, J=8,1 Гц, 1 Н), 7,51-7,62 (м, 3 Н), 7,91-8,01 (м, 3 Н), 15,08-17,10 (ушир. с, 1 Н); ИК (чистый) 3130, 3040,2950, 2930, 2890, 2860, 2795, 1625, 1605, 1565, 1500, 1485, 1470, 1440, 1430, 1390, 1360, 1340, 1325, 1265,1230, 1220, 1200, 1170, 1135, 1100, 1045, 1035, 1015, 965, 930, 905, 845, 830, 785, 740, 705 и 680 см-1; массспектр [(+) APCI], m/z 426 (М+Н)+. Анал. рассчитано для C26H27N5O: С, 73,39; Н, 6,40; N, 16,46; найдено: С, 73,08; Н, 6,57; N, 16,45. Пример 4. 2-[5-Бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-метил-3-пентил-1 Н-индол или 1 бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил 1 Н-тетразол-5-илметиловый эфир. Стадия 1. [6-(1-Метил-3-пентил-1 Н-индол-2-ил)-1 Н-бром-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества светло-рыжевато-коричневого цвета (0,111 г, 69%), исходя из [1-бром-6-(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила,используя MeI и процедуру стадии 4 примера 2. 1 Н ЯМР (DMSO-d6)0,73 (т, J=7,4 Гц, 3 Н), 1,08-1,26 (м, 4 Н), 1,47-1,62 (м, 2 Н), 2,69 (т, J=8,2 Гц,2 Н), 3,61 (с, 3 Н), 5,48 (с, 2 Н), 7,09 (т, J=7,4 Гц, 1 Н); 7,21 (т, J=7,4 Гц, 1 Н), 7,49 (д, J=8,2 Гц, 1 Н), 7,61 (д,J=8,2 Гц, 1 Н), 7,68-7,80 (т, 2 Н), 8,08 (с, 1 Н), 8,22 (д, J=8,9 Гц, 1 Н), 8,27 (д, J=8,9 Гц, 1 Н); масс-спектр [(+)ESI], m/z 461/463 (М+Н)+. Стадия 2. 2-[5-Бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-метил-3-пентил-1 Н-индол или 1 бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил 1 Н-тетразол-5-илметиловый эфир. Указанное в заголовке соединение получали в виде твердого вещества светло-коричневого цветаN, 12,83. Пример 5. 1-Ацетил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол. Стадия 1. [6-(1-Ацетил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. К перемешиваемому раствору [6-(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила (0,300 г,0,814 ммоль) в Ас 2 О (3 мл, 3,18 ммоль) при комнатной температуре добавляли каталитическое количество CSA (0,019 г, 0,0814 ммоль). Реакционную смесь нагревали до 70 С в течение 18 ч, и анализ ТСХ показал, что реакция наполовину завершена. Добавляли еще 19 мг CSA и выдерживали при 70 С еще 24 ч. По истечении этого времени реакционную смесь гасили 1 н. HCl (2 мл). Полученный раствор экстрагировали EtOAc (100 мл). Органический слой промывали 1 н. HCl (10 мл), насыщенным водным растворомNaHCO3 (10 мл) и насыщенным солевым раствором (10 мл), затем сушили (MgSO4). После концентрирования остаток очищали с использованием аппарата очистки Biotage Flash 40 (градиент 10-20%EtOAc:петролейный эфир) с получением продукта (0,164 г, 49%) в виде твердого вещества. 1 Н ЯМР (DMSO-d6)0,73 (т, J=7,2 Гц, 3 Н), 1,03-1,23 (м, 4 Н), 1,47-1,61 (м, 2 Н), 1,92 (с, 3 Н), 3,243,42 (м, 2 Н), 5,34 (с, 2 Н), 7,27-7,43 (м, 3 Н), 7,52-7,70 (м, 3 Н), 7,94-8,08 (м, 3 Н), 8,33 (д, J=8,8 Гц, 1 Н); масс-спектр [(+) ESI], m/z 411 (М+Н)+, 433 (M+Na)+. Стадия 2. 1-Ацетил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1H-индол. Указанное в заголовке соединение получали в виде твердого желтого пенообразного вещества(0,097 г, 56%) из [6-(1-ацетил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл.95 С (разл.). 1 Н ЯМР (DMSO-d6)0,71 (т, J=7,0 Гц, 3 Н), 1,08-1,19 (м, 4 Н), 1,47-1,56 (м, 2 Н), 1,90 (с, 3 Н), 2,51 (т,J=7,6 Гц, 2 Н), 5,55 (с, 2 Н), 7,29-7,38 (м, 3 Н), 7,52 (дд, J=1,5, 8,4 Гц, 1 Н), 7,60 (д, J=2,1 Гц, 1 Н), 7,63 (д,J=7,2 Гц, 1 Н), 7,92-7,98 (м, 3 Н), 8,31 (д, J=7,8 Гц, 1 Н), 14,75-17,75 (ушир. с, 1 Н); ИК (чистый) 3050, 2955,2925, 2860, 1695, 1630, 1610, 1575, 1500, 1475, 1455, 1370, 1335, 1305, 1265, 1240, 1200, 1170, 1155, 1130,1100, 1060, 1025, 950, 920, 900, 865, 810, 750, 700 и 675 см-1; масс-спектр [(+) ESI], m/z 454 (М+Н)+. Анал. рассчитано для C27H27N5O22,0H2O: С, 66,24; Н, 6,38; N, 14,30; найдено: С, 65,85; Н, 5,76; N, 13,53. Пример 6. 1-Ацетил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1 Н-индол. Стадия 1. [6-(1-Ацетил-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,093 г, 31%) из [1-бром-6(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя процедуру стадии 1 примера 5. 1 Н ЯМР (DMSO-d6)0,72 (т, J=7,2 Гц, 3 Н), 1,07-1,21 (т, 4 Н), 1,48-1,59 (т, 2 Н), 1,97 (с, 3 Н), 2,42-2,57ESI], m/z 489/491 (М+Н)+, 511/513 (M+Na)+. Стадия 2. 1-Ацетил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1 Н-индол. Указанное в заголовке соединение получали в виде светло-желтой пены (0,028 г, 29%) из [6-(1 ацетил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл.79 С (разл.). 1 Н ЯМР (DMSO-d6)0,71 (т, J=7,0 Гц, 3 Н), 1,08-1,18 (т, 4 Н), 1,48-1,56 (т, 2 Н), 1,95 (с, 3 Н), 2,48-2,56(т, 2 Н), 5,73 (с, 2 Н), 7,32 (тд, J=1,1, 7,5 Гц, 1 Н), 7,37 (тд, J=1,2, 7,3 Гц, 1 Н), 7,65 (д, J=7,8 Гц, 1 Н), 7,70 (дд,J=1,7, 8,7 Гц, 1 Н), 7,74 (д, J=9,0 Гц, 1 Н), 8,08 (д, J=1,5 Гц, 1 Н), 8,12 (д, J=9,0 Гц, 1 Н), 8,20 (д, J=8,7 Гц,1 Н), 8,30 (д, J=7,8 Гц, 1 Н), 14,75-17,75 (ушир. с, 1 Н); ИК (чистый) 3140, 3050, 2950, 2920, 2860, 2630,1695, 1630, 1600, 1570, 1475, 1450, 1370, 1340, 1300, 1270, 1245, 1205, 1195, 1140, 1095, 1045, 1020, 980,915, 900, 875, 830, 805, 750, 700 и 670 см-1; масс-спектр [(+) ESI], m/z 532/534 (М+Н)+. Анал. рассчитано для C27H26BrN5O21,0H2O: С, 58,92; Н, 5,13; N, 12,72; найдено: С, 58,74; Н, 4,76; N, 12,21. Пример 7. 3-Пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-[2-(трифторметил)бензил]-1 Н-индол. Стадия 1. [6-(3-Пентил-1-[2-(трифторметил)бензил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,147 г, 34%) из [6-(3 пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя 2-трифторметилбензилбромид и процедуру стадии 4 примера 2. 1 Н ЯМР (DMSO-d6)0,72 (т, J=7,8 Гц, 3 Н), 1,08-1,29 (м, 4 Н), 1,51-1,67 (м, 2 Н), 2,71 (т, J=8,6 Гц,2 Н), 5,29 (с, 2 Н), 5,47 (с, 2 Н), 6,37 (д, J=8,6 Гц, 1 Н), 7,08-7,21 (м, 2 Н), 7,23-7,32 (м, 2 Н), 7,35-7,45 (м, 2 Н),7,48 (т, J=7,8 Гц, 1 Н), 7,53 (д, J=1,7 Гц, 1 Н), 7,63-7,75 (м, 2 Н), 7,83-7,92 (м, 3 Н); масс-спектр [(+) ESI], m/z 527 (М+Н)+. Стадия 2. 3-Пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-[2-(трифторметил)бензил]-1 Н-индол. Указанное в заголовке соединение получали в виде твердого светло-коричневато-рыжего вещества(0,097 г, 66%) из [6-(3-пентил-1-[2-(трифторметил)бензил]-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл.100 С (разл.). 1 Н ЯМР (DMSO-d6)0,73 (т, J=7,0 Гц, 3 Н), 1,11-1,27 (м, 4 Н), 1,53-1,63 (м, 2 Н), 2,70 (т, J=7,5 Гц,2 Н), 5,46 (с, 2 Н), 5,60 (с, 2 Н), 6,36 (д, J=7,8 Гц, 1 Н), 7,09-7,17 (м, 2 Н), 7,24 (д, J=7,5 Гц, 1 Н), 7,28 (дд,J=2,4, 9,0 Гц, 1 Н), 7,34-7,40 (м, 2 Н), 7,46 (т, J=7,6 Гц, 1 Н), 7,52 (д, J=2,3 Гц, 1 Н), 7,64 (д, J=7,6 Гц, 1 Н),7,67 (д, J=6,9 Гц, 1 Н), 7,79-7,85 (м, 3 Н), 16,15-17,50 (ушир. с, 1 Н); ИК (чистый) 3040, 2950, 2930, 2860,- 16009696 1630, 1605, 1570, 1480, 1460, 1445, 1390, 1340, 1310, 1255, 1230, 1205, 1165, 1120, 1060, 1035, 930, 900,865, 805, 775, 745, 725 и 660 см-1; масс-спектр [(-) ESI], m/z 568 (М-Н)-. Анал. рассчитано для C33C30F3N5O0,5H2O: С, 68,50; Н, 5,40; N, 12,10; найдено: С, 68,63; Н, 5,34; N, 11,87. Пример 8. 2-[5-Бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]1 Н-индол. Стадия 1. [6-(3-Пентил-1-[2-(трифторметил)бензил]-1 Н-индол-2-ил)-1-бром-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,053 г, 14%) из [1-бром-6(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя 2-трифторметилбензилбромид и процедуру стадии 4 примера 2. 1 Н ЯМР (DMSO-d6)0,72 (т, J=7,0 Гц, 3 Н), 1,11-1,22 (м, 4 Н), 1,54-1,62 (м, 2 Н), 2,71 (т, J=7,4 Гц,2 Н), 5,42 (с, 2 Н), 5,48 (с, 2 Н), 6,34 (д, J=7,9 Гц, 1 Н), 7,11-7,20 (м, 2 Н), 7,28 (д, J=7,8 Гц, 1 Н), 7,37 (т, J=7,8 Гц,1 Н), 7,45 (т, J=7,8 Гц, 1 Н), 7,57 (дд, J=1,7, 8,9 Гц, 1 Н), 7,63-7,68 (м, 2 Н), 7,69 (д, J=7,2 Гц, 1 Н), 7,95 (д,J=1,2 Гц, 1 Н), 8,03 (д, J=9,2 Гц, 1 Н), 8,12 (д, J=8,7 Гц, 1 Н). Стадия 2. 2-[5-Бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]1 Н-индол. Указанное в заголовке соединение получали в виде желтой пены (0,013 г, 25%) из [6-(3-пентил-1[2-(трифторметил)бензил]-1 Н-индол-2-ил)-1-бром-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл.85 С (разл.). 1 Н ЯМР (DMSO-d6)0,73 (т, J=6,9 Гц, 3 Н), 1,10-1,23 (м, 4 Н), 1,54-1,62 (м, 2 Н), 2,70 (т, J=7,33 Гц,2 Н), 5,47 (с, 2 Н), 5,70 (с, 2 Н), 6,34 (д, J=7,8 Гц, 1 Н), 7,11-7,18 (м, 2 Н), 7,27 (д, J=7,6 Гц, 1 Н), 7,37 (т, J=7,5 Гц,1 Н), 7,45 (т, J=7,6 Гц, 1 Н), 7,54 (дд, J=1,5, 8,7 Гц, 1 Н), 7,63 (д, J=7,6 Гц, 1 Н), 7,65-7,70 (м, 2 Н), 7,91 (д,J=1,4 Гц, 1 Н), 7,97 (д, J=9,0 Гц, 1 Н), 8,08 (д, J=8,7 Гц, 1 Н), 15,75-17,85 (ушир. с, 1 Н); ИК (чистый) 3050,2950, 2920, 2855, 1600, 1565, 1475, 1460, 1415, 1355, 1335, 1310, 1270, 1245, 1195,1160, 1115, 1075, 1060,1035, 970, 925, 895, 830, 795, 770, 740 и 650 см-1; масс-спектр [(+) ESI], m/z 648 (М+Н)+ и [(-) ESI], m/z 646 (М-Н)-. Анал. рассчитано для C33H29BrF3N5O3,3H2O: С, 55,99; Н, 5,07; N, 9,89; найдено: С, 56,14; Н, 4,36; N, 9,44. Пример 9. 1-(4-трет-Бутилбензил)-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1 Н-индол. Стадия 1. [6-(1-[4-трет-Бутилбензил]-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,191 г, 46%) из [6-(3 пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя 4-трет-бутилбензилбромид и процедуру стадии 4 примера 2. 1 Н ЯМР (DMSO-d6)0,73 (т, J=7,4 Гц, 3 Н), 1,08-1,27 (м, 4 Н), 1,17 (с, 9 Н), 1,48-1,65 (м, 2 Н), 2,69 (т,J=8,1 Гц, 2 Н), 5,29 (с, 2 Н), 5,52 (с, 2 Н), 6,78 (д, J=8,1 Гц, 2 Н), 7,05-7,14 (м, 2 Н), 7,18 (д, J=8,1 Гц, 2 Н), 7,32(дд, J=1,4, 9,9 Гц, 1 Н), 7,38 (д, J=7,4, 1 Н), 7,53 (д, J=8,5 Гц, 1 Н), 7,58-7,67 (м, 2 Н), 7,90-8,00 (м, 3 Н); массспектр [(+) ESI], m/z 515 (М+Н)+, 537 (M+Na)+ и [(-) ESI], m/z 513 (М-Н)-. Стадия 2. 1-(4-трет-Бутилбензил)-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1 Н-индол. Указанное в заголовке соединение получали в виде желтой твердой пены (0,144 г, 73%) из [6-(1-[4 трет-бутилбензил]-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл.95 С (разл.). 1 Н ЯМР (DMSO-d6)0,73 (т, J=6,7 Гц, 3 Н), 1,12-1,20 (м, 4 Н), 1,16 (с, 9 Н), 1,52-1,58 (м, 2 Н), 2,67 (т,J=7,5 Гц, 2 Н), 5,26 (с, 2 Н), 5,60 (т, 2 Н), 6,76 (д, J=8,2 Гц, 2 Н), 7,05 (т, J=7,5 Гц, 1 Н), 7,10 (т, J=7,8 Гц, 1 Н),7,17 (д, J=8,2 Гц, 2 Н), 7,30 (дд, J=2,3, 9,0 Гц, 1 Н), 7,35 (д, J=7,9 Гц, 1 Н), 7,47 (дд, J=1,2, 8,6 Гц, 1 Н), 7,56(М-Н)-. Анал. рассчитано для C36H39N5O0,75H2O: С, 75,69; Н, 7,15; N, 12,26; найдено: С, 75,84; Н, 6,92; N, 12,30. Пример 10. 2-[5-Бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1 Ниндол. Стадия 1. [6-(1-[4-трет-Бутилбензил]-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил]оксиацетонитрил. Указанное в заголовке соединение получали в виде твердого вещества (0,070 г, 19%), исходя из [1 бром-6-(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиацетонитрила, используя 4-трет-бутилбензилбромид и процедуру стадии 4 примера 2. 1 Н ЯМР (DMSO-d6)0,73 (т, J=7,3 Гц, 3 Н), 1,06-1,30 (м, 4 Н), 1,15 (с, 9 Н), 1,48-1,63 (м, 2 Н), 2,69 (т,J=8,4 Гц, 1 Н), 5,31 (с, 2 Н), 5,47 (с, 2 Н), 6,74 (д, J=8,4 Гц, 2 Н), 7,05-7,17 (м, 3 Н), 7,17 (д, J=8,4 Гц, 2 Н), 7,42(д, J=8,7 Гц, 1 Н), 7,66 (д, J=8,0 Гц, 1 Н), 7,70 (д, J=9,1 Гц, 2 Н), 8,05 (с, 1 Н), 8,13 (д, J=8,0 Гц, 1 Н), 8,23 (д,J=8,0 Гц, 1 Н); масс-спектр [(+) ESI], m/z 593/595 (М+H)+. Стадия 2. 2-[5-Бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1 Н-индол. Указанное в заголовке соединение получали в виде желтой пены (0,042 г, 56%), исходя из [6-(1-[4 трет-бутилбензил]-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил]оксиацетонитрила, используя процедуру стадии 5 примера 2; т.пл.90 С (разл.).N, 10,29. Пример 11. [1-Бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиуксусная кислота. Стадия 1. Метиловый эфир [1-бром-6-(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиуксусной кислоты. Указанное в заголовке соединение получали в виде твердого вещества (0,410 г, 58%) из 2-(5-бром-6 гидрокси-2-нафтил)-3-пентил-1 Н-индола, используя метилбромацетат и процедуру стадии 3 примера 2. 1 Н ЯМР (DMSO-d6)0,82 (т, J=7,0 Гц, 3 Н), 1,27-1,39 (м, 4 Н), 1,64-1,74 (м, 2 Н), 2,93 (т, J=7,3 Гц,2 Н), 3,73 (с, 3 Н), 5,12 (с, 2 Н), 7,02 (т, J=7,5 Гц, 1 Н), 7,12 (т, J=7,0 Гц, 1 Н), 7,38 (д, J=8,0 Гц, 1 Н), 7,48 (д,J=9,2 Гц, 1 Н), 7,57 (д, J=7,9 Гц, 1 Н), 7,93 (д, J=7,9 Гц, 1 Н), 8,03 (д, J=9,0 Гц, 1 Н), 8,14 (д, J=1,6 Гц, 1 Н),8,22 (д, J=8,9 Гц, 1 Н), 11,26 (с, 1 Н); масс-спектр [(+) ESI], m/z 480/482 (М+Н)+ и [(-) ESI], m/z 478/480 (М-Н)-. Стадия 2. [1-Бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиуксусная кислота. К перемешиваемому раствору метилового эфира [1-бром-6-(3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиуксусной кислоты (0,410 г, 0,853 ммоль) в ТГФ (20 мл) при 0 С добавляли KOt-Bu (0,105 г, 0,938 ммоль) с последующим добавлением MeI (0,064 мл, 1,02 ммоль). Реакционную смесь нагревали до комнатной температуры и оставляли перемешиваться на 1 ч. Анализ ТСХ и МС-анализ показали, что весь исходный материал был израсходован, однако, из-за гидролиза в этих щелочных условиях были образованы две полярные кислоты (одна N-Me и одна N-H). После концентрирования остаток поглощали в ДМФА (20 мл). Добавляли NaH (0,075 г, 60 мас.%, 1,88 ммоль) с последующим добавлением избыточного количестваMeI для преобразования всего промежуточного вещества в одну кислоту (N-Me). Через 1 ч реакционную смесь концентрировали, затем разбавляли EtOAc (200 мл) и 1 н. HCl (20 мл). Органический слой промывалиH2O (20 мл) и насыщенным солевым раствором (20 мл), затем сушили (Na2SO4). После концентрирования остаток очищали препаративной хроматографией на пластинках (10% MeOH:CHCl3) с получением продукта (0,232 г, 57%) в виде желтовато-оранжевого твердого пенообразного вещества, т.пл.73 С (разл.). 1 Н ЯМР (DMSO-d6)0,73 (т, J=7,0 Гц, 3 Н), 1,11-1,20 (м, 4 Н), 1,50-1,58 (м, 2 Н), 2,66 (т, J=7,3 Гц,2 Н), 3,58 (с, 3 Н), 4,93 (с, 2 Н), 7,07 (т, J=7,6 Гц, 1 Н), 7,19 (т, J=7,1 Гц, 1 Н), 7,42-7,48 (м, 2 Н), 7,58 (д, J=7,9 Гц,1 Н), 7,68 (дд, J=1,7, 8,7 Гц, 1 Н), 7,99 (с, 1 Н), 8,04 (д, J=9,0 Гц, 1 Н), 8,21 (д, J=8,7 Гц, 1 Н), 11,95-14,75n представляет собой целое число, имеющее значение 0-6; А представляет собой СООН или имитирующее кислоту соединение, выбранное из тетразола,SO3H, РО 3 Н, тетроновой кислоты или группы формул где R13 представляет собой C1-С 6 алкил, С 2-С 6 алкенил, С 3-С 6 циклоалкил, -СН 2-(С 3-С 6 циклоалкил), С 3-С 6 циклоалкенил, -СН 2-(С 3-С 6 циклоалкенил), необязательно замещенную арильную или гетероарильную группу или необязательно замещенный C1-С 6 алкиларил или C1-С 6 алкилгетероарил; или его фармацевтически приемлемая соль или сложный эфир. 2. Соединение по п.1 формулы где R1, R2, R3, R4, R5, R6, R7, A, n определены в п.1,или его фармацевтически приемлемая соль или сложный эфир. 3. Соединение по п.1 или 2, где R4 представляет собой водород или алкил, содержащий 1-3 атома углерода. 4. Соединение по любому из пп.1-3, где R1 представляет собой водород. 5. Соединение по любому из пп.1-4, где R2 представляет собой водород. 6. Соединение по любому из пп.1-5, где R3 представляет собой бром. 7. Соединение по любому из пп.1-6, где R3 представляет собой водород. 8. Соединение по любому из пп.1-7, где R4 представляет собой водород. 9. Соединение по любому из пп.1-8, где R5 представляет собой пентил. 10. Соединение по любому из пп.1-9, где R6 выбирают из группы, включающей бензил, метил, ацил,(2-трифторметил)бензил и (4-трет-бутил)бензил. 11. Соединение по любому из пп.1-10, где R7 представляет собой водород. 12. Соединение по любому из пп.1-11, где n=0. 13. Соединение по любому из пп.1-12, где А представляет собой СО 2 Н или тетразол. 14. Соединение по п.1 формулы где R1 представляет собой водород или алкил, содержащий 1-3 атома углерода;R5 представляет собой водород, алкил, содержащий 1-6 атомов углерода, алканоил, содержащий 1-6 атомов углерода, или бензил, необязательно замещенный 1-3 группами, независимо выбранными из алкила, содержащего 1-4 атома углерода, или перфторалкила, содержащего 1-3 атома углерода; А представляет собой СООН или имитирующее кислоту соединение; или его фармацевтически приемлемая соль или сложный эфир. 15. Соединение по п.1, представляющее собой 1-бензил-3-пентил-2[6-(1 Н-тетразол-5-илметокси)-2 нафтил]-1H-индол или его фармацевтически приемлемую соль. 16. Соединение по п.1, представляющее собой 6-(1-бензил-3-пентил-1 Н-индол-2-ил)-1-бром-2-нафтил 1 Н-тетразол-5-илметиловый эфир или 1-бензил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3 пентил-1 Н-индол или его фармацевтически приемлемую соль. 17. Соединение по п.1, представляющее собой 1-метил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2 нафтил]-1H-индол или его фармацевтически приемлемую соль.- 19009696 18. Соединение по п.1, представляющее собой 2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1 метил-3-пентил-1 Н-индол или 1-бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил 1 Н-тетразол-5-илметиловый эфир или его фармацевтически приемлемую соль. 19. Соединение по п.1, представляющее собой 1-ацетил-3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2 нафтил]-1H-индол или его фармацевтически приемлемую соль. 20. Соединение по п.1, представляющее собой 1-ацетил-2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2 нафтил]-3-пентил-1 Н-индол или его фармацевтически приемлемую соль. 21. Соединение по п.1, представляющее собой 3-пентил-2-[6-(1 Н-тетразол-5-илметокси)-2-нафтил]1-[2-(трифторметил)бензил]-1H-индол или его фармацевтически приемлемую соль. 22. Соединение по п.1, представляющее собой 2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-3 пентил-1-[2-(трифторметил)бензил]-1H-индол или его фармацевтически приемлемую соль. 23. Соединение по п.1, представляющее собой 1-(4-трет-бутилбензил)3-пентил-2-[6-(1 Н-тетразол-5 илметокси)-2-нафтил]-1H-индол или его фармацевтически приемлемую соль. 24. Соединение по п.1, представляющее собой 2-[5-бром-6-(1 Н-тетразол-5-илметокси)-2-нафтил]-1(4-трет-бутилбензил)-3-пентил-1 Н-индол или его фармацевтически приемлемую соль. 25. Соединение по п.1, представляющее собой [1-бром-6-(1-метил-3-пентил-1 Н-индол-2-ил)-2-нафтил]оксиуксусную кислоту или ее фармацевтически приемлемую соль. 26. Соединение по п.1 или 2, где R6 представляет собой бензил, необязательно замещенный алкилом, содержащим 1-3 атома углерода. 27. Соединение по п.1 или 2, где имитирующее кислоту соединение представляет собой тетразол. 28. Соединение по п.14, где R5 представляет собой бензил, необязательно замещенный алкилом, содержащим 1-3 атома углерода. 29. Соединение по п.14, где имитирующее кислоту соединение представляет собой тетразол. 30. Способ лечения тромбоза или фибринолитического нарушения у млекопитающего, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества соединения по пп.1-29. 31. Способ по п.30, где тромбоз или фибринолитическое нарушение связано с образованием атеросклеротических бляшек, венозным или артериальным тромбозом, ишемией миокарда, фибрилляцией предсердия, глубоким тромбофлефитом, синдромами коагуляции, фиброзом легких, церебральным тромбозом, тромбоэмболическими осложнениями при хирургическом вмешательстве или окклюзией периферических артерий. 32. Фармацевтическая композиция, включающая фармацевтически эффективное количество соединения по пп.1-29 или его фармацевтически приемлемой соли или сложного эфира и фармацевтически приемлемый эксципиент или носитель. 33. Применение соединения по любому из пп.1-29 в качестве лекарственного средства. 34. Применение соединения по любому из пп.1-29 для получения лекарственного средства для лечения тромбоза или фибринолитического нарушения у млекопитающего. 35. Способ получения соединения формулы где R1, R2, R3, R4, R5, R6, R7 и n определены в п.1,или его фармацевтически приемлемой соли или сложного эфира, включающий:- 20009696 где X представляет собой CN, СОгалоген, COOR12, CONR13R14, где R12 выбран из C1-С 6 алкила, СО(С 1-С 6 алкила), бензила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила, C1-С 6 алкокси, фенила, галогена, трифторметила и трифторметокси; и фенила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила, C1-С 6 алкокси, фенила, галогена, трифторметила и трифторметокси;R13 и R14 независимо выбраны из C1-С 6 алкила, C1-С 6 алкокси, водорода, СО(С 1-С 6 алкила), бензила,необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила,C1-С 6 алкокси, фенила, галогена, трифторметила и трифторметокси; и фенила, необязательно замещенного одной или несколькими группами, независимо выбранными из C1-С 6 алкила, C1-С 6 алкокси, фенила,галогена, трифторметила и трифторметокси; и при необходимости(b) преобразование соединения формулы (2) в его фармацевтически приемлемый сложный эфир или основно-аддитивную соль; если необходимо:(c) разделение рацемической смеси соединений формулы (2) для выделения энантиомера соединения формулы (2) или его фармацевтически приемлемой соли или сложного эфира. 36. Способ получения соединения формулы где R1, R2, R3, R4, R5, R6, R7 и n определены в п.1,или его фармацевтически приемлемой соли, включающий:(b) преобразование соединения формулы (3) в его фармацевтически приемлемую основно-аддитивную соль; если необходимо:(c) разделение рацемической смеси соединений формулы (3) для выделения энантиомера соединения формулы (3) или его фармацевтически приемлемой соли.
МПК / Метки
МПК: C07D 209/12, A61P 7/02, C07D 403/12, A61K 31/40
Метки: плазминогена, pai-1, нафтилиндольные, производные, ингибитора, качестве, замещенные, активатора, типа, ингибиторов
Код ссылки
<a href="https://eas.patents.su/22-9696-zameshhennye-naftilindolnye-proizvodnye-v-kachestve-ingibitorov-ingibitora-aktivatora-plazminogena-tipa-1-pai-1.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные нафтилиндольные производные в качестве ингибиторов ингибитора активатора плазминогена типа 1 (pai-1)</a>
Предыдущий патент: Гранулы, содержащие гидрохлорид венлафаксина
Следующий патент: Замещенные соединения бензо [e][1,4]оксазино[3,2-g]изоиндола и фармацевтические композиции, которые их содержат
Случайный патент: Способ получения доцетаксела












