Способ получения доцетаксела
Номер патента: 1405
Опубликовано: 26.02.2001
Авторы: Свинделл Чарльз С., Чандер Мадхави С., Систи Николас Дж.
Формула / Реферат
1. Способ получения доцетаксела, включающий стадии:
(а) сложной этерификации С7, С10-дикарбобензилокси 10-деацетилбаккатина III формулы
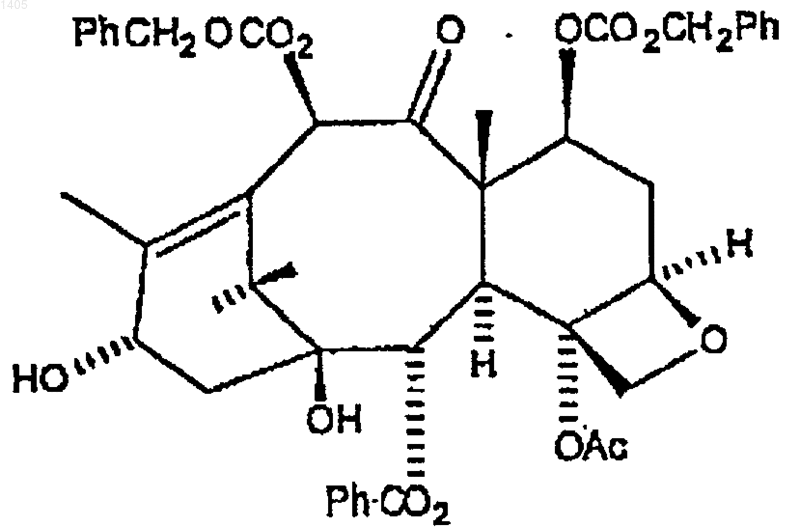
боковой цепью карбобензилокси-С2'-защищенного 3-фенилизосерина формулы
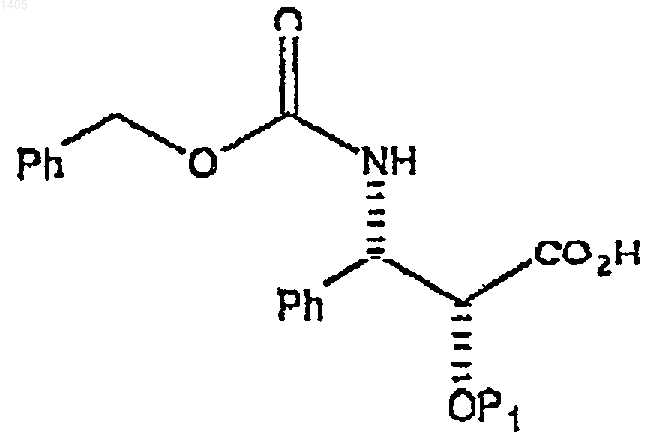
с образованием первого промежуточного соединения формулы
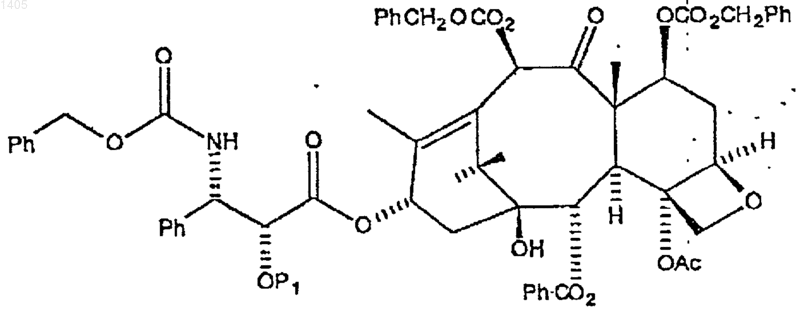
в которой P1 представляет гидрируемую защитную группу бензильного типа;
(b) замещение С7, С10-карбобензилоксигрупп водородом и замещение карбобензилоксигруппы при С3' азоте трет-бутоксикарбонилом с образованием второго промежуточного соединения формулы
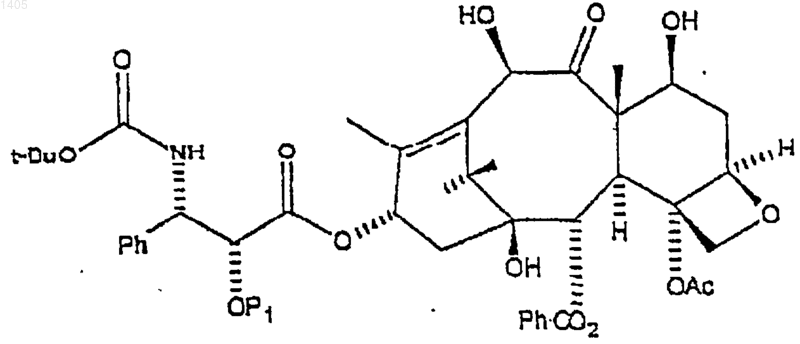
в которой P1 представляет гидрируемую защитную группу бензильного типа; и
(с) снятие защиты со второго промежуточного соединения с помощью замещения P1 водородом с получением доцетаксела.
2. Способ по п.1, в котором P1 выбран из группы, состоящей из бензилоксиметила и бензила.
3. Способ по п.1, в котором во время стадии сложной этерификации на каждый эквивалент С7, С10 дикарбобензилокси-10-деацетилбаккатина III используют шесть эквивалентов боковой цепи N-карбобензилокси-C2'- защищенного 3-фенилизосерина.
4. Способ по п.1, в котором на стадии сложной этерификации боковую цепь N-карбобензилокси С2'-защищённого 3-фенилизосерина и С7,С10-дикарбобензилокси 10-деацетилбаккатин III растворяют в толуоле с образованием первого раствора, после чего к первому раствору добавляют диметиламинопиридин и диалкилкарбодиимид с получением второго раствора, содержащего первое промежуточное соединение.
5. Способ по п.4, в котором диалкилкарбодиимид находится в равной пропорции по отношению к N-карбобензилокси С2' -защищённому 3-фенилизосерину.
6. Способ по п.4, в котором стадию этерификации проводят при температуре 60-80шС в течение 1-5 ч.
7. Способ по п.6, в котором ко второму раствору добавляют диэтиловый эфир с получением третьего раствора, который затем охлаждают до 0шС.
8. Способ по п.1, в котором стадию замещения С7,С10-карбобензилоксигрупп водородом и замещения карбобензилоксигруппы при С3' азоте трет-бутоксикарбонилом проводят сначала с получением амина, после чего присоединяют трет-бутоксикарбонильную группу к С3' азоту, получая второе промежуточное соединение.
9. Способ по п.8, в котором стадию замещения С7,С10-карбобензилоксигрупп водородом и замещения карбобензилоксигруппы при С3' азоте трет-бутоксикарбонилом проводят с помощью получения первой смеси.
10. Способ по п.9, в котором первую смесь гидрируют в течение, по крайней мере, 24 ч.
11. Способ по п.8, в котором стадию присоединения трет-бутоксикарбонильной группы к С3' азоту проводят путём добавления амина в тетрагидрофуран.
12. Способ по п.11, в котором к амину и тетрагидрофурану добавляют третичное аминовое основание.
13. Способ по п.11, в котором к амину и тетрагидрофурану добавляют ди-трет-бутилдикарбонат с образованием второй смеси.
14. Способ по п.13, в котором вторую смесь перемешивают в течение примерно двадцати четырёх часов и упаривают в вакууме, повторно растворяют в этилацетате, промывают водой и рассолом, получая органическую фазу, которую затем отделяют и хроматографируют с использованием смеси этилацетат:гексан, получая элюент, содержащий второе промежуточное соединение в очищенной форме.
15. Способ по п.14, в котором элюент упаривают в вакууме до остатка, который затем перекристаллизуют, получая второе промежуточное соединение в очищенной форме.
Текст
1 Данная заявка является частичным продолжением нашей более ранней заявки, S.N. 08/609,083, поданной 29 февраля 1996 г. Область изобретения Данное изобретение в общем относится к синтезу доцетаксела из предшествующих соединений. Более конкретно, данное изобретение касается синтеза доцетаксела с использованием защищенного подходящим образом 10-деацетил Баккатина III, который этерифицирует кислотой с подходящим образом защищенной боковой цепью с получением промежуточного соединения, которое затем может подвергаться снятию защиты, ацилироваться и дополнительно подвергаться снятию защиты для получения доцетаксела. Предпосылки изобретения Известно, что различные производные таксана проявляют противоопухолевую активность. Благодаря этой активности таксаны привлекли повышенное внимание научной и медицинской общественности. Первичным среди них является соединение, называемое "паклитаксел", на которое в литературе также ссылаются, как на "таксол". Паклитаксел был одобрен для химиотерапии некоторых различных видов опухолей, и клинические испытания указывают на то, что паклитаксел предлагает широкую область сильной антилейкемической активности и активности, проявляющейся в ингибировании опухолей. Паклитаксел является природным таксановым дитерпеноидом, который найден в некоторых видах тисса (род Тахасеае). К сожалению,концентрация этого соединения является очень низкой. Этот вид вечнозеленого растения также является медленно растущим. Для получения одного килограмма паклитаксела (даже хотя кора тиссовых деревьев обычно обнаруживает наибольшую концентрацию паклитаксела) требуется приблизительно 16000 фунтов (7248 кг) коры. Таким образом, длительность получения паклитаксела путем выделения делает этот метод получения непривлекательным. В то время как в тиссовых деревьях паклитаксел содержится в крайне низких концентрациях, существуют различные другие таксановые соединения, такие как Баккатин III, цефаломанин, 10-деацетилбаккатин III и др., которые также могут экстрагироваться из коры тисса. Некоторые из этих таксановых соединений экстрагируются более легко и с более высоким выходом. Действительно, 10-деацетилбаккатин III в относительно высокой концентрации может экстрагироваться из листьев тисса как возобновляемого источника. Среди различных таксановых соединений,которые, как было найдено, проявляют противоопухолевую активность, есть соединение известное как "доцетаксел". Это соединение также продается фирмой Rhone-Poulenc Sante под тор 001405 2 говой маркой TAXOTERE. Доцетаксел имеет следующую формулу Как видно из этой формулы, доцетаксел подобен паклитакселу за исключением включения трет-бутоксикарбонильной (трет-ВОС) группы у азота в С 3' положении изосериновой боковой цепи и свободной гидроксигруппы в С 10 положении. О некоторых возможных синтезах доцетаксела и родственных соединений сообщалось в "Journal of Organic Chemistry": 51,46, (1986); 55, 1957, (1990); 56, 1681, (1991); 56,6939, (1991); 57, 4320, (1992); 57, 6387, (1992); и 58, 255, (1993). Для того чтобы успешно синтезировать доцетаксел, необходим удобный доступ к хиральной нерацемической боковой цепи и обильный природный источник готового к использованию Баккатина III, а также эффективные средства их соединения друг с другом. Однако этерификация боковой цепи скелетом Баккатина III затруднена вследствие экранирования С 13 гидроксила в Баккатине III, расположенного внутри вогнутой области полусферического таксанового скелета. Данная трудность синтеза характерна как для синтеза доцетаксела,так и для синтеза паклитаксела. Один способ полусинтеза паклитаксела раскрывается в находящейся совместно на рассмотрении патентной заявке S.N. 08/483,081. В этой заявке паклитаксел синтезируется из С 7 ТЭС защищенного Баккатина III с боковой цепью (2R,3S)-3-фенилизосеринового А-кольца,защищенной бензилом с С 2'-гидроксилом, защищенным N-карбаматом с гидрируемой защитной группой бензильного типа, такой как бензилоксиметильная (ВОМ) защитная группа в С 2' положении боковой цепи. После конденсации С 7 ТЭС защищенного Баккатина III и боковой цепи соединение может подвергаться подходящим образом снятию защитных групп, ацилироваться и далее подвергаться снятию защиты, давая паклитаксел. Хотя существующие способы синтеза доцетаксела имеют определенные заслуги, существует все еще потребность в улучшенных химических процессах, которые могут давать данное противораковое соединение. Настоящее изобретение направлено на такую процедуру,использующую боковую цепь (2R,3S)-3 фенилизосеринового А-кольца, защищенную бензилом с гидроксилом, защищенным Nкарбаматом, описанную в находящейся совместно на рассмотрении более ранней заявке тех же авторов. 3 Сущность изобретения Цель настоящего изобретения - предоставить новый, полезный и эффективный способ присоединения защищенной боковой цепи Акольца к скелету защищенного Баккатина III,который затем может превращаться в доцетаксел. Целью настоящего изобретения является также предоставление способа получения доцетаксела, который потенциально способен достичь по масштабу промышленного внедрения. Согласно настоящему изобретению доцетаксел получают из нового и полезного химического соединения, имеющего формулу Формула 1 Данное соединение получают ацилированием 10-деацетилбаккатина III, по меньшей мере, 1,5 эквивалентами н-бутиллития и, по меньшей мере, 1,5 эквивалентами бензилхлорформиата и тетрагидрофурана. В соответствии с настоящим изобретением доцетаксел получают с помощью взаимодействия С 7, С 10-дикарбобензилокси-10-деацетилбаккатина III с боковой цепью изосерина, имеющего общую формулуP1 = гидрируемая защитная группа бензильного типа с последующим снятием защиты с продукта сочетания в С 7 и С 10 и С 3' азоте. Затем азот боковой цепи ацилируют для введения трет-бутоксикарбонильной группы (третВОС) в С 3' азот боковой цепи. После этого снимают подходящим образом защиту для удаления защитной группы при С 2' и получают доцетаксел. Предпочтительно способ получения С 7,С 10-дикарбобензилоксибаккатина III достигается растворением 10-деацетилбаккатина III в тетрагидрофуране с образованием раствора, после чего добавляют, по меньшей мере, 1,5 эквивалента, предпочтительно 2 эквивалента нбутиллития с образованием первой смеси, и после этого к первой смеси добавляют, по меньшей мере, 1,5 эквивалента, предпочтительно 2 эквивалента бензилхлороформа с образованием второй смеси. Вторая смесь может гаситься раствором хлорида аммония и затем концентрироваться до остатка. Данный остаток может затем растворяться в органическом растворителе, не смешиваемом с водой, с образованием раствора 4 остатка, после чего раствор остатка промывается водой и затем рассолом с образованием органического слоя. Органический слой может затем удаляться, сушиться и перекристаллизовываться или хроматографироваться предпочтительно смесью этилацетат/гексан. По предпочтительной методике реакции осуществляют при пониженной температуре-20 С или ниже. Температура раствора 10 деацетилбаккатина III понижается до температуры предпочтительно около -78 С. Затем по каплям к этому раствору добавляют нбутиллитий в гексане с образованием первой смеси. Первую смесь перемешивают при пониженной температуре в течение приблизительно 5 мин. Затем к первой смеси при пониженной температуре добавляют бензилхлорформиат с образованием второй смеси, и вторую смесь перемешивают в течение приблизительно 1 ч при температуре не более 0 С. Эти и другие цели настоящего изобретения станут более понятными после рассмотрения последующего подробного описания примеров воплощения изобретения. Подробное описание примеров воплощения изобретения В широком смысле настоящее открытие относится к химическому процессу эффективного получения доцетаксела с использованием С 7, С 10-ди-CBZ-10-деацетилбаккатина III в качестве полезного промежуточного продукта в получении доцетаксела. С 7, С 10-ди-CBZ-10-деацетилбаккатин III этерифицируют 3-фенилизосериновой кислотой, в имеющей гидрируемую бензильную защитную группу при С 2'С 13-гидроксиле Баккатина III. Общий процесс,описанный здесь, включает получение С 7, С 10 ди-CBZ-10-деацетилбаккатина III, получение подходящим образом защищенной 3-фенилизосериновой кислоты, имеющей гидрируемую защитную группу бензильного типа при С 2',конденсацию этих двух соединений и последующее снятие защиты, ацилирование при С 3' азоте для присоединения трет-бутоксикарбонильной группы с последующим дополнительным снятием защиты с получением доцетаксела. А. Получение С 7, С 10 дикарбобензокси 10-деацетилбаккатина III С 7, С 10-ди-CBZ-10-деацетилбаккатина III Реакция I 10-деацетилбаккатин III растворяют в безводном THF (ТГФ т.е. тетрагидрофуране) и охлаждают в атмосфере азота до температуры менее -20 С, но предпочтительно до -78 С. По каплям добавляют н-бутиллитий (1,6 М в гекса 5 не), и раствор перемешивают при пониженной температуре в течение приблизительно 5 мин. Необходимо добавить, по меньшей мере, 1,5 эквивалента н-бутиллития, чтобы получить значительный выход продукта, однако, предпочитается 2 эквивалента. Затем по каплям добавляют бензилхлорформиат (снова для получения значительного выхода необходимо, по меньшей мере, 1,5 эквивалента бензилхлорформиата,предпочтительно 2 эквивалента), и смесь перемешивают на протяжении периода в 1 ч, в течение которого смеси дают возможность подогреться до температуры не более чем 0 С. Затем смесь гасят холодным насыщенным хлоридом аммония для устранения избытка н-бутиллития и ацетилхлорида, и смесь концентрируют в вакууме. Остаток помещают в этилацетат, один раз промывают водой, затем рассолом, чтобы удалить ненужные соли. Затем органический слой может подвергаться сушке и концентрироваться в вакууме, а остаток перекристаллизовывают или хроматографируют на колонке со смесью этилацетат/гексан с получением С 7, С 10 ди-CBZ-10-деацетилбаккатина III в виде белого твердого вещества с общим выходом более 80%. В. Получение боковой цепи 3-фенилизосерина Получение боковой цепи (2R, 3S) этилового эфира N-CBZ-О-защищенного 3-фенилизосерина, где С 2'-гидроксигруппа защищена гидрируемой защитной группой бензильного типа (формула 2), может быть достигнуто из исходного соединения этилового эфира (2R, 3S) 3-фенилизосерина с помощью следующих двух реакций. Первой реакцией является Реакция II В данном случае этиловый эфир (2R,3S) 3 фенилизосерина альтернативно растворяют либо в равных частях смеси диэтиловый эфир:вода, либо в равных частях смеси метилтрет-бутиловый эфир:вода, и раствор охлаждают до 0 С. Затем к раствору добавляют карбонат натрия и по каплям в течение приблизительно 5 мин добавляют бензилхлорформиат. Полученную смесь перемешивают при 0 С около 1 ч. После часа перемешивания раствор выливают в воду и экстрагируют метиленхлоридом или этилацетатом, по желанию. Органический слой отделяют, сушат и концентрируют в вакууме до остатка. Затем остаток перекристаллизовывают из смеси этилацетат/гексан с получением этилового эфираN-CBZ-3 фенилизосерина. Данное промежуточное соединение затем защищают гидрируемой защитной группой бензильного типа несколькими путями. Например, 001405 6 один из путей получения защищенной боковой цепи заключается в следующем Реакция III В данном случае гидрируемой защитной группой бензильного типа является бензилоксиметил (ВОМ). Для получения данного соединения этиловый эфир N-CBZ-3-фенилизосерина растворяют в безводном ТГФ в атмосфере азота и охлаждают до пониженной температуры, такой как -40 С или -78 С, например, в ванне сухой лед/ацетон. Затем по каплям добавляют агент алкиллитий, такой как н-бутиллитий, хотя желательно, чтобы алкиллитиевый агент был с алкилом с прямой цепью. В любом случае реакция наилучшим образом проводится при температуре не более 0 С. Получаемую смесь перемешивают около 10 мин. Затем по каплям в течение около 5 мин добавляют бензилоксиметил хлорид (ВОМ-Сl), и смесь перемешивают приблизительно от 2 до 5 ч при пониженной температуре. После этого раствор подогревают до 0 С и гасят водой, чтобы удалить избыток нбутиллития. Полученную смесь концентрируют в вакууме до остатка, и данный остаток помещают в этилацетат, промывают водой и рассолом, чтобы удалить ненужные соли. Затем органический слой может сушиться и перегоняться в вакууме, а остаток перекристаллизовывают из смеси этилацетат/гексан или хроматографируют с использованием смеси этилацетат/гексан, получая этиловый эфир N-CBZ-C2'-ВОМ 3 фенилизосерина. Еще один путь получения этилового эфираN-CBZ-C2'-ОВОМ 3-фенилоксиизосерина достигается растворением этилового эфира N-CBZ(2R,3S)-3-фенилизосерина в безводном метиленхлориде. После этого добавляют третичное аминовое основание, такое как диизопропилэтиланин, наряду с ВОМ-Сl, и смесь нагревают с обратным холодильником в течение 24 ч. Хотя данный способ дает этиловый эфир N-CBZ-C2'ВОМ-3-фенилизосерина, реакция протекает более медленно, чем по способу, описанному выше, однако, он может быть более предпочтительным из-за более высокого выхода. В этом случае соединение не очищают, а осуществляют последующие стадии процесса с сырой формой. В каждом случае полученный этиловый эфирN-CBZ-C2'-ОВОМ-(2R,3S)-3-фенилизосерина, либо в очищенном виде по первому пути, либо в сырой форме по второму пути, может просто превращаться в соответствующую кислоту по реакции 7 Реакция IV Защищенный этиловый эфир растворяют в смеси этанол/вода (соотношение 8:1). К раствору добавляют гидроокись лития (или другой подходящий щелочной гидроксид), и полученную смесь перемешивают приблизительно 3 ч для омыления соединения. Затем смесь подкисляют (1 н. соляной кислотой) и экстрагируют этилацетатом. Полученный органический слой отделяют, сушат и концентрируют под вакуумом. Остаточную кислоту затем отделяют для использования без дальнейшей очистки. Это дает желаемый N-CBZ-C2'-OBOM-(2R,3S)-3 фенилизосерин. Когда этиловый эфир N-CBZ-С 2'-ОВОМ 3-фенилизосерина используют в сыром виде и превращают в N-CBZ-С 2'-ОВОМ-(2R,3S)-3 фенилизосерин, необходимо в дальнейшем очистить конечный продукт. Эту очистку осуществляют путем растворения продукта в толуоле,затем по каплям добавляют один эквивалент дициклогексиламина, и получаемый раствор перемешивают в течение получаса. Затем смесь концентрируют в вакууме, и полученный остаток перекристаллизовывают из смеси этилацетат/гексан с получением дициклогексиламиновой соли N-CBZ-С 2'-ОВОМ-(2R,3S)-3-фенилизосерина. Затем очищенный N-CBZ-С 2'ОВОМ-(2R,3S)-3-фенилизосерин выделяют путем растворения данной дициклогексиламиновой соли в метиленхлориде или другом галогенированном растворителе с последующей промывкой метиленхлоридом с несколькими порциями 1 н. НСl. Органический слой затем промывают несколькими порциями воды для удаления гидрохлорида дициклогексиламина. Далее его промывают одной порцией насыщенного солевого раствора и перегоняют в вакууме,получая желаемую кислоту. Сам бензил является еще одним примером гидрируемой защитной группы бензильного типа, который может использоваться вместо ВОМ. Этиловый эфир N-CBZ-2'-бензил-3 фенилизосерина получают, как описано выше(2R,3S)-3-фенилизосерина растворяют в безводном ТГФ в атмосфере азота и охлаждают до пониженной температуры, такой как -40 С или-78 С, например, в ванне из смеси сухой лед/ацетон, затем по каплям добавляют алкиллитиевый реагент, такой как н-бутиллитий, хотя желательно, чтобы алкиллитиевый реагент был с алкилом с прямой цепью. Получаемую смесь перемешивают около 10 мин. Затем по каплям в 8 течение приблизительно 5 мин добавляют бензилбромид (ВnВr), и смесь перемешивают приблизительно в течение 2-5 ч при пониженной температуре. После этого раствор подогревают до 0 С и гасят водой для разрушения избытка нбутиллития. Полученную смесь концентрируют под вакуумом до остатка, и данный остаток помещают в этилацетат и промывают водой для удаления литийбромидной соли, затем следует промывка рассолом. Органический слой сушат и концентрируют под вакуумом, а остаток перекристаллизовывают из смеси этилацетат/гексан или хроматографируют с использованием смеси этилацетат/гексан с получением этилового эфира N-CBZ-2'-бензил-3-фенилизосерина. Этиловый эфир N-CBZ-2'-бензил-3-фенилизосерина альтернативно может быть получен по реакции Реакция VI К перемешиваемому раствору NaH в безводном ТГФ в атмосфере азота в течение 5 мин добавляют этиловый эфирN-CBZ-3 фенилизосерина, растворенный в ДМФ. Затем смесь перемешивают при 0 С в течение получаса. Затем по каплям на протяжении 5 мин добавляют бензилбромид (1,1 эквивалента) и перемешивают еще два часа. Затем смесь гасят водой для разложения избытка гидрида натрия. После этого добавляют либо диэтиловый эфир,либо метил-трет-бутиловый эфир. Затем органический слой промывают четырьмя порциями воды для удаления ДМФ и бромида натрия. Далее смесь промывают рассолом, сушат и концентрируют под вакуумом с получением этилового эфираN-CBZ-C2'-бензил-3-фенилизосерина, который потом легко можно превратить в N-CBZ-C2'-бeнзил-3-фенилизосерин с помощью процесса, описанного выше (РеакцияIV). В этом случае вместо бензилоксиметила(ВОМ) С 2' защитной группой является бензил. С. Этерификация защищенного Баккатина III боковой цепью Этерификация С 7,С 10-ди-CBZ-10 диацетилбаккатина III боковой цепью N-CBZС 2'-защищенного 3-фенилизосерина (где С 2' гидроксил защищен любой гидрируемой группой бензильного типа) достигается как показано ниже. Предпочтительной гидрируемой бензильной группой является ВОМ (бензилоксиметил).(1 эквивалент) формулы 1 и кислотную боковую цепь (6 эквивалентов) формулы 2 растворяют в толуоле. К данной смеси добавляют 4 диметиламинопиридин (ДМАП) и диизопропилкарбодиимид (6 эквивалентов), и получаемую смесь нагревают примерно при 60-80 С в течение 1-5 ч. Следует, однако, отметить, что другие диалкилкарбодиимиды могут заменять диизопропилкарбодиимид, причем одним из примеров является дициклогексилкарбодиимид. Затем раствору дают охлаждаться до комнатной температуры, и затем добавляют равный объем диэтилового эфира. Получающийся раствор охлаждают до 0 С и выдерживают при этой температуре в течение 24 ч. На этой стадии кристаллизуется главным образом примесь мочевины. По истечении 24 ч раствор фильтруют,и остаток прополаскивают либо этиловым эфиром, либо метил-трет-бутиловым эфиром. Объединенные органические фазы промывают соляной кислотой (5%), водой и наконец рассолом. Органическую фазу отделяют, сушат и концентрируют под вакуумом. Затем получаемый остаток растворяют в смеси этилацетат/гексан и элюируют на силикагеле. Элюент затем концентрируют под вакуумом с получением желаемого C3'NCBZ-C2'-OBOM-C7, С 10 ди-CBZ-10-диаце-тилбаккатина III формулыD. Снятие защиты и обработка ди-третбутилдикарбонатом и снятие защиты с образованием доцетаксела Следующая реакция удаляет CBZ защитные группы в С 7 и С 10 и С 3' азоте боковой цепи(ВОМ используется здесь в качестве примера С 2' гидрируемой защитной группы бензильного типа) Реакция VIII Продукт формулы 3 растворяют в смеси изопропанол/этилацетат, к которой добавляют катализатор Pearlman'a. Полученную смесь гидрируют при 1 атм водорода в течение, по меньшей мере, 24 ч. После этого смесь фильтруют через диатомовую землю и концентрируют под вакуумом до остатка, получая в результате амин, который используют без дальнейшей очистки. На следующей стадии трет-ВОС группа может присоединяться к N-C3' боковой цепи в соответствии со следующей реакцией Реакция IX Амин помещают в безводный ТГФ, а для ускорения реакции может добавляться третичное аминовое основание с последующим добавлением ди-трет-бутилди-карбоната. Смесь перемешивают в течение 24 ч, а затем концентрируют под вакуумом и повторно растворяют в этилацетате. Органическую фазу затем промывают водой и рассолом. Затем полученную органическую фазу отделяют, сушат и концентрируют под вакуумом с получением сырого С 2'ОВОМ доцетаксела. На этой стадии необходимо очищать сырой С 2'-ОВОМ доцетаксел. Это можно осуществить с помощью хроматографии на колонке и/или перекристаллизации из смеси этилацетат/гексан. Предпочтительным является проведение хроматографии на колонке со смесью этилацетат/гексан с получением элюента,который концентрируют в вакууме с образованием остатка, с последующей перекристаллизацией остатка из смеси этилацетат/гексан с получением С 2'-ОВОМ доцетаксела по существу в чистом виде. Бензилоксиметильную защитную группу удаляют следующим образом Реакция Х Очищенный С 2'-ОВОМ доцетаксел растворяют в изопропаноле и добавляют катализатор Pearlman'a. Затем смесь гидрируют либо при 1 атм. водорода, либо при 40 фунт/дюйм 2 (2,812 кг/кв.см) водорода в течение, по меньшей мере,24 ч. Затем смесь фильтруют через диатомовую землю и концентрируют под вакуумом с получением сырого доцетаксела. В тех случаях, когда С 2' положение в боковой цепи защищено группой O-Вn, сырой доцетаксел можно получить по методу, описанному в литературе (Kanazawa, A., Denis J.N. and Green, A.E. J. Org.Chem., 59, 1238 (1994. Настоящее изобретение было описано с определенной степенью подробности, направленной на примерное осуществление данного изобретения. Следует понимать, что хотя настоящее изобретение определяется последующей формулой изобретения, в приведенных примерах воплощения настоящего изобретения могут производиться модификации или изменения без отступления от описанных концепций изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения доцетаксела, включающий стадии с образованием первого промежуточного соединения формулы в которой P1 представляет гидрируемую защитную группу бензильного типа;(b) замещение С 7,С 10 карбобензилоксигрупп водородом и замещение карбобензилоксигруппы при С 3' азоте третбутоксикарбонилом с образованием второго промежуточного соединения формулы в которой P1 представляет гидрируемую защитную группу бензильного типа; и(с) снятие защиты со второго промежуточного соединения с помощью замещения P1 водородом с получением доцетаксела. 2. Способ по п.1, в котором P1 выбран из группы, состоящей из бензилоксиметила и бензила. 3. Способ по п.1, в котором во время стадии сложной этерификации на каждый эквивалент С 7, С 10-дикарбобензилокси-10-деацетилбаккатина III используют шесть эквивалентов боковой цепиN-карбобензилокси-C2'защищенного 3-фенилизосерина. 4. Способ по п.1, в котором на стадии сложной этерификации боковую цепь Nкарбобензилокси С 2'-защищнного 3 12 фенилизосерина и С 7, С 10-дикарбобензилокси 10-деацетилбаккатин III растворяют в толуоле с образованием первого раствора, после чего к первому раствору добавляют диметиламинопиридин и диалкилкарбодиимид с получением второго раствора, содержащего первое промежуточное соединение. 5. Способ по п.4, в котором диалкилкарбодиимид находится в равной пропорции по отношению кN-карбобензилокси С 2'защищнному 3-фенилизосерину. 6. Способ по п.4, в котором стадию этерификации проводят при температуре 60-80 С в течение 1-5 ч. 7. Способ по п.6, в котором ко второму раствору добавляют диэтиловый эфир с получением третьего раствора, который затем охлаждают до 0 С. 8. Способ по п.1, в котором стадию замещения С 7, С 10-карбобензилоксигрупп водородом и замещения карбобензилоксигруппы при С 3' азоте трет-бутоксикарбонилом проводят сначала с получением амина, после чего присоединяют трет-бутоксикарбонильную группу к С 3' азоту, получая второе промежуточное соединение. 9. Способ по п.8, в котором стадию замещения С 7, С 10-карбобензилоксигрупп водородом и замещения карбобензилоксигруппы при С 3' азоте трет-бутоксикарбонилом проводят с помощью получения первой смеси. 10. Способ по п.9, в котором первую смесь гидрируют в течение, по крайней мере, 24 ч. 11. Способ по п.8, в котором стадию присоединения трет-бутоксикарбонильной группы к С 3' азоту проводят путм добавления амина в тетрагидрофуран. 12. Способ по п.11, в котором к амину и тетрагидрофурану добавляют третичное аминовое основание. 13. Способ по п.11, в котором к амину и тетрагидрофурану добавляют ди-третбутилдикарбонат с образованием второй смеси. 14. Способ по п.13, в котором вторую смесь перемешивают в течение примерно 24 ч и упаривают в вакууме, повторно растворяют в этилацетате, промывают водой и рассолом, получая органическую фазу, которую затем отделяют и хроматографируют с использованием смеси этилацетат:гексан, получая элюент, содержащий второе промежуточное соединение в очищенной форме. 15. Способ по п.14, в котором элюент упаривают в вакууме до остатка, который затем перекристаллизуют, получая второе промежуточное соединение в очищенной форме.
МПК / Метки
МПК: C07D 305/14
Метки: способ, доцетаксела, получения
Код ссылки
<a href="https://eas.patents.su/7-1405-sposob-polucheniya-docetaksela.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения доцетаксела</a>
Предыдущий патент: Производные ациклических нуклеозидов.
Следующий патент: Фармацевтическая композиция на водной основе и способ нанесения лекарственного препарата
Случайный патент: Получение наноразмерных материалов











