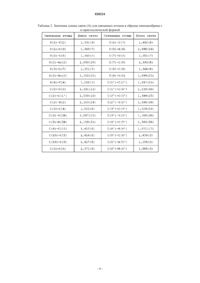
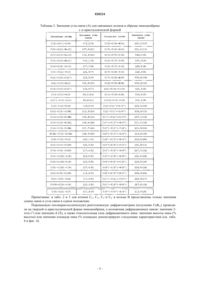
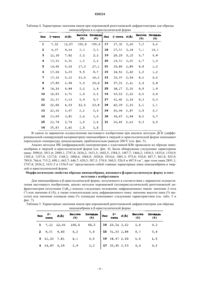
Два типа кристаллической структуры пиноцембрина, их приготовление и применение для производства фармацевтических композиций
Номер патента: 20224
Опубликовано: 30.09.2014
Авторы: Ян Чжихун, Ду Гуаньхуа, Лв Ян, Тун Юаньфэн, Чан Ин, Ван Кэ, Гао Мэй, У Сун
Формула / Реферат
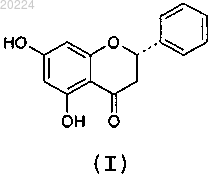
1. α-Кристаллическая форма пиноцембрина формулы (I)
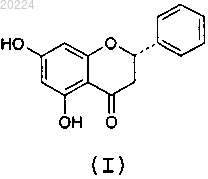
характеризующаяся тем, что имеет моноклинную симметрию монокристалла, пространственную группу P21/c и значения параметров кристаллической ячейки: а=5,189 Å, b=24,149 Å, с=10,472 Å, α=90°, β=102,31° и γ=90°.
2. α-Кристаллическая форма пиноцембрина формулы (I) по п.1
характеризующаяся тем, что при анализе рентгеновской порошковой (поликристаллической) дифракцией (излучение CuKα) показывает следующие характеристики:
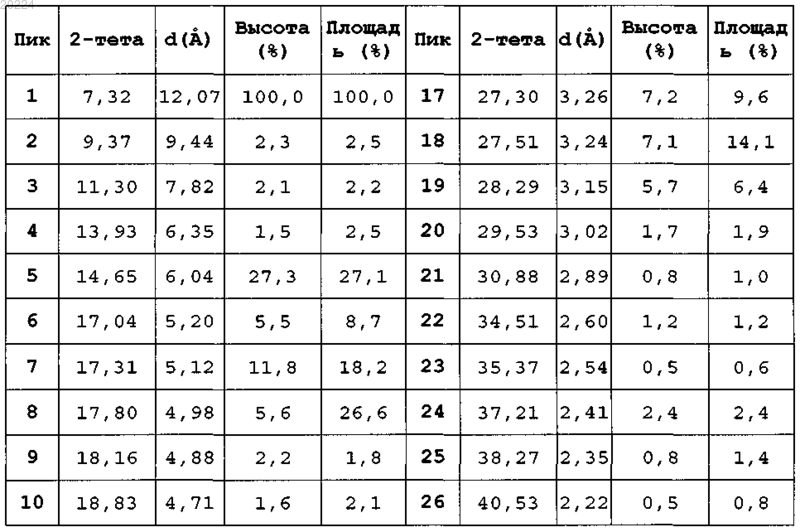
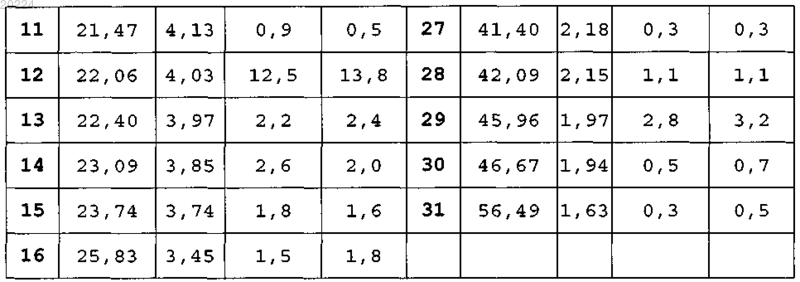
3. α-Кристаллическая форма пиноцембрина по любому из пп.1 и 2, характеризующаяся тем, что переходная температура декалесценции на траектории ДСК составляет приблизительно 206°С.
4. α-Кристаллическая форма пиноцембрина по любому из пп.1 и 2, характеризующая тем, что ее спектр инфракрасного поглощения показывает следующие пики: 3090,6; 3011,6; 2889,1; 2747,4; 2636,2; 1631,5; 1602,5; 1584,3; 1487,7; 1466,2; 1454,5; 1435,6; 1354,9; 1302,4; 1257,0; 1217,0; 1168,2; 1088,6; 1064,9; 1028,0; 1014,6; 1001,3; 975,8; 918,0; 887,7; 861,8; 825,9; 789,9; 766,4; 715,2; 698,1; 663,7; 646,7; 620,3; 587,3; 574,9; 560,5; 526,9 и 487,9 см-1, при этом пики 2891,1; 2747,4; 2636,2; 1631,5 и 1354,9 см-1 представляют собой главные характерные пики α-кристаллической формы пиноцембрина.
5. β-Кристаллическая форма пиноцембрина формулы (I)
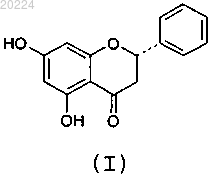
характеризующаяся тем, что при анализе рентгеновской порошковой (поликристаллической) дифракцией (излучение CuKα) показывает следующие характеристики:
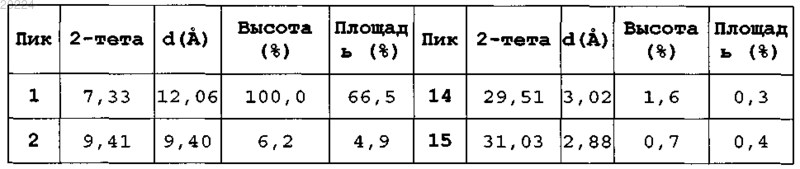
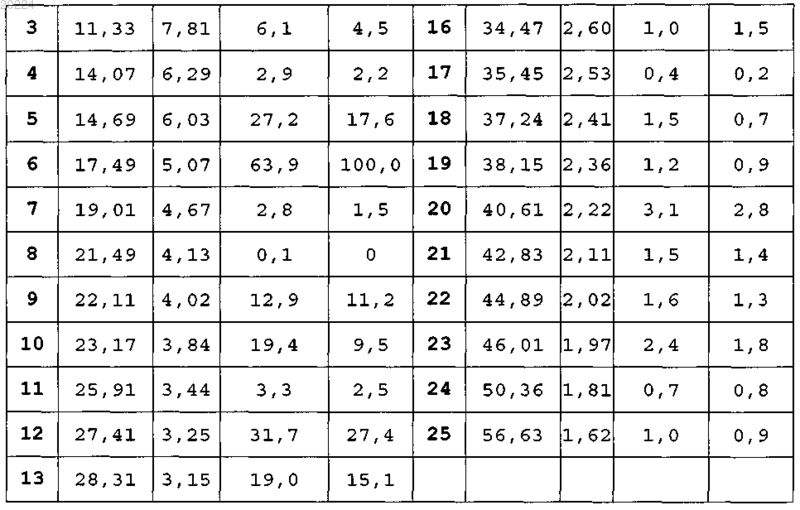
6. β-Кристаллическая форма пиноцембрина по п.5, характеризующаяся тем, что переходная температура декалесценции на траектории ДСК составляет приблизительно 204°С.
7. β-Кристаллическая форма пиноцембрина по п.5, характеризующая тем, что ее спектр инфракрасного поглощения показывает следующие пики: 3090,8; 2890,0; 2748,9; 2638,3; 1633,5; 1602,9; 1585,0; 1487,9; 1466,1; 1454,3; 1344,4; 1302,7; 1216,7; 1168,2; 1088,4; 1065,5; 1028,8; 1014,3; 1001,5; 975,8; 917,8; 888,2; 861,8; 826,6; 789,1; 766,6; 741,1; 715,4; 698,0; 663,7; 646,0; 620,5; 587,9; 574,8; 560,9; 527,2 и 488,4 см-1, при этом пики 2890,0; 2748,9; 2638,3; 1633,5 и 1344,4 см-1 представляют собой главные характерные пики β-кристаллической формы пиноцембрина.
8. Смешанная кристаллическая форма пиноцембрина, состоящая из α-кристаллической формы и β-кристаллической формы пиноцембрина в любой пропорции.
9. Кристаллическая форма пиноцембрина по любому из предшествующих пунктов, характеризующаяся тем, что указанная кристаллическая форма не содержит кристаллизационной воды или других кристаллических растворителей.
10. Активный фармацевтический ингредиент, включающий кристаллическую форму пиноцембрина по пп.1, 2, 5 или 8 в качестве активного ингредиента, при этом указанный активный фармацевтический ингредиент применяют для производства лекарственного средства для лечения заболеваний, связанных с церебральной ишемией, или лекарственного средства для предупреждения заболеваний, связанных с церебральной ишемией, посредством защиты функции нейроваскулярного аппарата.
11. Активный фармацевтический ингредиент по п.10, основанный на твердой кристаллической форме пиноцембрина, ежедневная доза которого варьируется от 5 до 250 мг.
12. Фармацевтическая композиция, содержащая терапевтически эффективное количество кристаллической формы пиноцембрина по любому из пп.1, 2, 5 и 8, в комбинации с одним или более фармацевтически приемлемыми носителями.
13. Фармацевтическая дозированная форма, содержащая активный фармацевтический ингредиент по п.10 или 11, или композиция по п.12, характеризующаяся тем, что дозированная форма представляет собой таблетку, капсулу, пилюлю, инъекцию, препарат с замедленным высвобождением или препарат с контролируемым высвобождением.
14. Применение кристаллической формы пиноцембрина по пп.1, 2, 5 или 8 в производстве лекарственного средства для лечения заболеваний, связанных с церебральной ишемией, или лекарственного средства для предупреждения заболеваний, связанных с церебральной ишемией, посредством защиты функции нейроваскулярного аппарата.
15. Способ приготовления α-кристаллической формы пиноцембрина, включающий следующие этапы:
(1) полное растворение образца в растворителе, выбранном из группы, состоящей из метанола, этанола, хлороформа, ацетона, этилацетата, н-бутанола, изопропанола, ацетонитрила, ТГФ, диоксана, 95% этанола, ледяной уксусной кислоты, муравьиной кислоты, эфира, дихлорметана, толуола, бензола, н-гексана, циклогексана, ДМФА, петролейного эфира, аммиака, н-пропанола или их смеси, затем:
(а) помещение смеси в условия окружающей среды с температурой 4-50°С и относительной влажностью 10-75% для рекристаллизации в течение 1-60 дней или
(b) добавление воды для образования осадка с последующим получением кристаллической формы пиноцембрина посредством фильтрации при пониженном давлении, лиофилизации или холодного распыления.
16. Способ приготовления β-кристаллической формы пиноцембрина, включающий следующие этапы:
использование α-кристаллической формы пиноцембрина в качестве материала, затем
получение β-кристаллической формы пиноцембрина через переход одного кристалла в другой кристалл при размалывании.
17. Способ приготовления β-кристаллической формы пиноцембрина, включающий следующие этапы:
использование α-кристаллической формы пиноцембрина в качестве материала, затем
получение β-кристаллической формы пиноцембрина через полное растворение материала в растворителе (пиридине или ДМСО), добавление воды для образования осадка и проведение фильтрации при пониженном давлении, лиофилизацию или холодное распыление.
Текст
ДВА ТИПА КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ ПИНОЦЕМБРИНА, ИХ ПРИГОТОВЛЕНИЕ И ПРИМЕНЕНИЕ ДЛЯ ПРОИЗВОДСТВА ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЙ Две кристаллические формы пиноцембрина формулы (I):и , их приготовление и их применение для производства фармацевтических композиций. Между ними существует различие по биологической доступности. Они применяются для лечения и предупреждения церебральных ишемических заболеваний вследствие защитного воздействия на нейроваскулярный аппарат и повышения уровня лекарственного средства в крови in vivo.(71)(73) Заявитель и патентовладелец: СиЭсПиСи ЧЖУНЦИ ФАРМАСЬЮТИКАЛ ТЕКНОЛОДЖИ (ШИЦЗЯЧЖУАН) КО., ЛТД.; ИНСТИТЬЮТ ОФ МАТЕРИЯ МЕДИКА, ЧАЙНИЗ ЭКЕДЕМИ ОФ МЕДИКАЛ САЙЕНСЕЗ (CN) Область техники, к которой относится изобретение Настоящее изобретение относится к двум кристаллическим формам соединения пиноцембрин и к активным фармацевтическим ингредиентам, фармацевтическим композициям и дозированным формам,содержащим две кристаллические формы пиноцембрина, к их применению для производства фармацевтических композиций и для лечения заболеваний, а также к способу приготовления двух кристаллических форм пиноцембрина. Уровень техники изобретения Пиноцембрин (химическое название: 5,7-дигидрокси-2-фенил-4-хроманон) представляет собой флавоновое соединение, широко распространенное в природе. Его химическая структура, представленная ниже существует в виде 1-изомера, d-изомера, смеси, обогащенной 1-изомером или d-изомером, и рацемата. Предыдущие фармакологические эксперименты показали, что пиноцембрин обладает сильной бактериостатической противовирусной и противогрибковой активностью. Например, пиноцембрином богат мед, который в Китае считается традиционным продуктом питания для охраны здоровья. Содержащаяся в меде d-глюкоза при регулярном употреблении в пищу не только безвредна для зубов, но также способна стерилизовать полость рта, например, облегчая язвы в полости рта и ускоряя заживление ран. Китайский патент CN 1695608A, озаглавленный Use of pinocembrin for manufacture of pharmaceutical compositions for preventing and treating diseases related to nerve cell injury [1] раскрывает применение пиноцембрина в производстве фармацевтических композиций для предупреждения и лечения заболеваний, связанных с ишемией головного мозга, последствиями ишемии головного мозга, повреждением и функциональным изменением нервных клеток. Описание изобретения Авторы настоящего изобретения неожиданно обнаружили, что пиноцембрин имеет две кристаллические формы,и , и разработали их приготовление. Авторы настоящего изобретения также обнаружили, что между двумя кристаллическими формами имеются существенные различия по степени усвоения организмом, при этом степень усвоения -кристаллической формы превышает степень усвоения кристаллической формы, например, степень усвоения -кристаллической формы может превысить степень усвоения -кристаллической формы в 2 раза или более. Их биологическая активность в медикаментозной терапии различна вследствие различной концентрации лекарственных средств в крови. Один из вариантов осуществления настоящего изобретения предлагает пиноцембрин в кристаллической форме, в -кристаллической форме или в смеси -кристаллической формы и кристаллической формы в разных пропорциях. Предпочтительно, чтобы разные кристаллические формы и их смеси не содержали кристаллизационной воды или других органических растворителей. Один из вариантов осуществления настоящего изобретения предлагает способ приготовления пиноцембрина в -кристаллической форме, в -кристаллической форме или в смеси -кристаллической формы и -кристаллической формы в разных пропорциях. Один из вариантов осуществления настоящего изобретения предлагает фармацевтическую композицию, включающую пиноцембрин в чистой -кристаллической форме, в чистой -кристаллической форме или в смеси -кристаллической формы и -кристаллической формы в разных пропорциях. Фармацевтическая композиция также может включать один или более фармацевтически приемлемых носителей. В отношении фармацевтически приемлемых носителей не существует ограничений при том условии, что они пригодны для лекарственных составов и не оказывают существенного влияния на биологические эффекты разных кристаллических форм пиноцембрина по настоящему изобретению. Один из вариантов осуществления настоящего изобретения относится к дозированным формам,включающим пиноцембрин в твердых кристаллических формах. В отношении специфических дозированных форм не существует ограничений. Например, они могут представлять собой таблетки, капсулы,пилюли, инъекции, препараты с замедленным высвобождением, препараты с контролируемым высвобождением и т.п. В одном из вариантов осуществления настоящее изобретение предлагает пиноцембрин в твердых кристаллических формах, включая -кристаллическую форму, -кристаллическую форму или смесь кристаллической формы и -кристаллической формы в разных пропорциях, что позволяет использовать различное усвоение этих форм в лечебных целях. Один из вариантов осуществления настоящего изобретения относится к применению пиноцембрина в -кристаллической форме, в -кристаллической форме или в смеси -кристаллической формы и кристаллической формы в разных пропорциях при производстве лекарственного средства для лечения заболеваний, связанных с церебральной ишемией или лекарственного средства для предупреждения за-1 020224 болеваний, связанных с церебральной ишемией, при этом действие указанного лекарственного средства основано на защите функции нейроваскулярного аппарата. Один из вариантов осуществления настоящего изобретения предлагает применение пиноцембрина для защиты функции нейроваскулярного аппарата при лечении заболеваний, связанных с церебральной ишемией, а также для улучшения концентрации в крови в организме вследствие эффекта кристаллической формы. Морфологические свойства образца пиноцембрина, имеющего -кристаллическую форму в соответствии с изобретением Для образца пиноцембрина с -кристаллической формой, полученного в соответствии с вариантом осуществления настоящего изобретения, рентгеноструктурный анализ показал симметрию моноклинной кристаллической системы, пространственная группа которой представляла собой P21/c, а кристаллографическая ячейка имела следующие значения параметров: а=5,189, b=24,149, с=10,472, =90,=102,31 и =90. Фиг. 1 представляет собой иллюстрацию, показывающую относительную конфигурацию молекулы,фиг. 2 представляет собой иллюстрацию, показывающую структуру молекулы в стереоскопической проекции, а фиг. 3 представляет собой иллюстрацию, показывающую укладку элементарных ячеек молекулы вдоль оси. Табл. 1 показывает параметры атомных координат и факторы эквивалентной температуры. Табл. 2 показывает значения длины связи для связанных атомов. Табл. 3 показывает значения угла связи для связанных атомов. Поскольку некоторые атомы углерода в кольце В принимают состояние неупорядоченной ориентации, четыре атома С 2', С 3', C5' и С 6' занимают два положения с плотностью занятости 0,5 соответственно. Формула 1: относительная конфигурация молекулы пиноцембрина с -кристаллической формой Таблица 1. Параметры атомных координат (относительных координат) образца пиноцембрина с Таблица 2. Значения длины связи (А) для связанных атомов в образце пиноцембрина с Таблица 3. Значения угла связи (А) для связанных атомов в образце пиноцембрина с -кристаллической формой Примечание: в табл. 2 и 3 для атомов С 2', С 3', C5' и С 6' в кольце В представлены только значения длины связи и угла связи в одном положении. Порошковую (поликристаллическую) рентгеновскую дифрактометрию (излучение CuK) проводили на твердой -кристаллической форме пиноцембрина, а положения дифракционных пиков: значение 2 тетаили значение d , а также относительная сила дифракционного пика: значение высоты пика (% высоты) или значение площади пика (% площади) демонстрируют следующие характеристики (см. табл. 4 и фиг. 4). Таблица 4. Характерные значения пиков при порошковой рентгеновской дифрактометрии для образца пиноцембрина в -кристаллической форме В одном из вариантов осуществления настоящего изобретения при анализе методом ДСК (дифференциальной сканирующей калориметрии) пиноцембрин в твердой -кристаллической форме показывает переходную температуру декалесценции, приблизительно равную 206 С (см. фиг. 5). Анализ методом ИК (инфракрасной) спектрометрии с пластинкой KBr проводили на образце пиноцембрина в твердой -кристаллической форме (см. фиг. 6). Были обнаружены следующие характерные пики: 3090,6; 3011,6; 2889,1; 2747,4; 2636,2; 1631,5; 1602,5; 1584,3; 1487,7; 1466,2; 1454,5; 1435,6; 1354,9; 1302,4; 1257,0; 1217,0; 1168,2; 1088,6; 1064,9; 1028,0; 1014,6; 1001,3; 975,8; 918,0; 887,7; 861,8; 825,9; 789,9; 766,4; 715,2; 698,1; 663,7; 646,7; 620,3; 587,3; 574,9; 560,5; 526,9 и 487,9 см-1, при этом пики 2891,1; 2747,4; 2636,2; 1631,5 и 1354,9 см-1 представляли собой главные характерные пики пиноцембрина в твердой -кристаллической форме. Морфологические свойства образца пиноцембрина, имеющего -кристаллическую форму в соответствии с изобретением Для пиноцембрина в -кристаллической форме, полученного в соответствии с вариантом осуществления настоящего изобретения, анализ методом порошковой (поликристаллической) рентгеновской дифрактометрии (излучение CuK) показал следующее положение дифракционных пиков: значение 2-тета или значение d , a также относительная сила дифракционного пика: значение высоты пика (% высоты) или значение площади пика (% площади) показывают следующие характеристики (см. табл. 5 и фиг. 7). Таблица 5. Характерные значения пиков при порошковой рентгеновской дифрактометрии для образца пиноцембрина в -кристаллической форме В одном из вариантов осуществления настоящего изобретения при анализе методом ДСК пиноцембрин в твердой -кристаллической форме показывает переходную температуру декалесценции, приблизительно равную 204 С (см. фиг. 8). Анализ методом ИК-спектрометрии с пластинкой KBr проводили на образце пиноцембрина в твердой -кристаллической форме в соответствии с вариантом осуществления настоящего изобретения (см. фиг. 9). Были обнаружены следующие характерные пики: 3090,8; 2890,0; 2748,9; 2638,3; 1633,5; 1602,9; 1585,0; 1487,9; 1466,1; 1454,3; 1344,4; 1302,7; 1216,7; 1168,2; 1088,4; 1065,5; 1028,8; 1014,3; 1001,5; 975,8; 917,8; 888,2; 861,8; 826,6; 789,1; 766,6; 741,1; 715,4; 698,0; 663,7; 646,0; 620,5; 587,9; 574,8; 560,9; 527,2 и 488,4 см-1, при этом пики 2890,0; 2748,9; 2638,3; 1633,5 и 1344,4 см-1 представляли собой главные характерные пики пиноцембрина в твердой -кристаллической форме. Способ приготовления образца пиноцембрина в -кристаллической форме в соответствии с вариантом осуществления настоящего изобретения(1) Полное растворение образца в растворителе, выбранном из группы, состоящей из метанола, этанола, хлороформа, ацетона, этилацетата, н-бутанола, изопропанола, ацетонитрила, ТГФ (тетрагидрофурана), диоксана, 95% этанола, ледяной уксусной кислоты, муравьиной кислоты, эфира, дихлорметана,толуола, бензола, н-гексана, циклогексана, ДМФА (диметилформамида), петролейного эфира, аммиака,н-пропанола или их смеси, затем:(a) помещение смеси в условия окружающей среды с температурой 4-50 С и относительной влажностью 10-75% для рекристаллизации в течение 1-60 дней или(b) добавление воды для образования осадка с последующим получением кристаллической формы пиноцембрина посредством фильтрации при пониженном давлении, лиофилизации или холодного распыления. Способ приготовления образца пиноцембрина в -кристаллической форме в соответствии с вариантом осуществления настоящего изобретения Использование в качестве материала образца пиноцембрина в твердой -кристаллической форме,затем получение -кристаллической формы пиноцембрина через:(a) переход одного кристалла в другой кристалл при размалывании или(b) полное растворение материала в растворителе (пиридине или ДМСО [диметилсульфоксиде]),добавление воды для образования осадка и проведение фильтрации при пониженном давлении, лиофилизацию или холодное распыление. Фармакодинамические характеристики образца пиноцембрина В соответствии с настоящим изобретением пиноцембрин в чистой -кристаллической форме, в чистой -кристаллической форме или в смеси -кристаллической и -кристаллической форм в любой пропорции проявляет лечебный эффект при заболеваниях, связанных с церебральной ишемией, или профилактический эффект в отношении заболеваний, связанных с церебральной ишемией, защищая функцию нейроваскулярного аппарата. В соответствии с настоящим изобретением существует различие в биологической доступности между чистой -кристаллической формой и чистой -кристаллической формой. При пероральном введении биологическая доступность -кристаллической формы более чем в 2 раза превышает биологическую доступность -кристаллической формы. Применительно к смеси двух кристаллических форм в любой пропорции ее биологическая доступность может варьироваться в зависимости от содержания -кристаллической формы. Дозировка и характеристики препаратов Для фармацевтической композиции или препарата, содержащих пиноцембрин в чистой кристаллической форме, в чистой -кристаллической форме или в их смеси в любой пропорции, в соот-7 020224 ветствии с вариантом осуществления настоящего изобретения, ежедневная доза составляет 5-250 мг, исходя из твердых кристаллических форм пиноцембрина. Препараты включают таблетки, капсулы, пилюли, инъекции, препараты с замедленным высвобождением, препараты с контролируемым высвобождением и т.п. Краткое описание чертежей Фиг. 1 представляет собой иллюстрацию, показывающую относительную конфигурацию молекулы. Фиг. 2 представляет собой иллюстрацию, показывающую структуры молекулы в стереоскопической проекции. Фиг. 3 представляет собой иллюстрацию, показывающую укладку элементарных ячеек молекулы(вдоль оси). Фиг. 4 представляет собой картину рентгеновской дифракции для образца пиноцембрина в кристаллической форме. Фиг. 5 представляет собой траекторию ДСК для образца -кристаллической формы пиноцембрина. Фиг. 6 представляет собой спектр инфракрасного поглощения для образца -кристаллической формы пиноцембрина. Фиг. 7 представляет собой картину рентгеновской дифракции для образца пиноцембрина в кристаллической форме. Фиг. 8 представляет собой траекторию ДСК для образца -кристаллической формы пиноцембрина. Фиг. 9 представляет собой спектр инфракрасного поглощения для образца -кристаллической формы пиноцембрина. Подробное описание изобретения Следующие показательные примеры представлены для лучшего описания настоящего изобретения,однако следует понимать, что настоящее изобретение не ограничивается этими примерами. Инструменты и условия испытаний для следующих примеров 1. Рентгеновский анализ монокристаллов: Инструмент: Двумерный обнаружитель (дифрактометр) MAC DIP-2030 К Условия испытания: напряжение на лампе: 50 KB, ток в лампе: 80 мА, -сканирование, МоК, 250,0,диапазон сканирования: 0-180, угол поворота: 6, шаг: 6, скорость сканирования: 1,8 в минуту. 2. Порошковый рентгеноструктурный анализ: Инструмент: Порошковый рентгеновский дифрактометр Rigaku D/max 2550 Условия испытания: напряжение: 40KV, сила тока: 150 мА, скорость сканирования: 8 в минуту 3. Анализ методом ДСК Тип инструмента: Дифференциальный сканирующий калориметр Seiko Instruments Inc. Условия испытания: продувочный газ: N2, скорость нагревания: 10 С в минуту Температурный диапазон: 25-250 С 4. Спектр инфракрасного поглощения Инструмент: спектрометр Nicolet FT-IR IMPACT 400 Условия испытания: Пластинка KBr 5. Анализ методом ВЭЖХ (высокоэффективной жидкостной хроматографии) Инструмент: Жидкостный хроматограф высокого разрешения SHIMADZU LC-10Avp, детектор на диодной матрице SPD-M10Avp, система обработки данных хроматографии CLASS-VP; колонка: Alltch C18 (5 мк,1504,6 мм); Условия испытания: температура колонки: комнатная температура; длина волны: 290 нм; подвижная фаза: метанол/забуференный фосфатом физиологический раствор, рН 3,0 (64/36); скорость потока: 1,0 мл/мин; объем впрыскивания: 20 мкл; концентрация впрыскивания: 500,0 мкг/мл. Препарат 1: Синтез образца пиноцембрина В реактор для гидрогенизации объемом 1000 мл добавляли 5 г (19,7 ммоль) 5,7-дигидроксифлавона,650 мл обезвоженного этанола и 1,5 г 10% палладиевого катализатора на углеродном носителе. Реакцию проводили под давлением водорода 0,13 МПа в течение 4 ч при 40 С. По окончании реакции палладиевый катализатор на углеродном носителе отфильтровывали. Фильтрат концентрировали, а затем сепарировали и очищали колоночной хроматографией (элюирование смесью метанол:этилацетат:петролейный эфир в соотношении 2:10:100 (объем:объем:объем под вакуумом. Растворитель выпаривали досуха,получая 3,9 г белого аморфного твердого порошка (чистота: 98,6% при определении методом ВЭЖХ) с выходом 52%[2]. Приготовление образца пиноцембрина в -кристаллической форме Пример 1. Способ 1 приготовления образца пиноцембрина в -кристаллической форме 5 г образца пиноцембрина добавляли к 20 мл 95% этанола, нагревали до полного растворения, а затем охлаждали до комнатной температуры и давали отстояться в течение 24 ч. В осадок выпадало белое твердое вещество, которое отфильтровывали и высушивали. В результате получали 4,5 г белого кристаллического вещества (чистота: 98,8% при определении методом ВЭЖХ) с выходом 90%. Полученное кристаллическое вещество анализировали методом рентгеновской дифракции на монокристалле. Этот анализ показал моноклинную симметрию, пространственная группа представляла собойP21/c, а значения параметров кристаллической ячейки были следующими: а=5,189 , b=24,149 ,с=10,472 , =90, =102,31 и =90. Полученное кристаллическое вещество анализировали методом порошковой (поликристаллической) рентгеновской дифракции (излучение CuK). Характерные значения пиков при анализе расположения пиков дифракции: значение 2-тетаили значение d , а также относительная сила дифракционного пика: значения высоты пика (% высоты) или значения площади пика (% площади) показаны в табл. 4, а полученная траектория показана на фиг. 4. На полученном кристаллическом веществе проводили анализ методом ДСК, при этом переходная температура декалесценции составила 206 С. На полученном кристаллическом веществе проводили инфракрасный спектральный анализ с пластиной KBr, при этом были выявлены следующие характерные пики: 3090,6; 3011,6; 2889,1; 2747,4; 2636,2; 1631,5; 1602,5; 1584,3; 1487,7; 1466,2; 1454,5; 1435,6; 1354,9; 1302,4; 1257,0; 1217,0; 1168,2; 1088,6; 1064,9; 1028,0; 1014,6; 1001,3; 975,8; 918,0; 887,7; 861,8; 825,9; 789,9; 766,4; 715,2; 698,1; 663,7; 646,7; 620,3; 587,3; 574,9; 560,5; 526,9 и 487,9 см-1. Приведенные выше данные спектрального анализа показали, что полученная в настоящем примере кристаллическая форма представляет собой -кристаллическую форму. Примеры 2-10. Способы приготовления образца пиноцембрина в -кристаллической форме 2-10 Со ссылкой на способ приготовления из примера 1 при использовании в качестве растворителя этилацетата, хлороформа, ацетона, ацетонитрила, ТГФ, эфира, бензола, циклогексана или ДМФ был получен пиноцембрин в виде белого кристаллического вещества. Результаты экспериментов показаны в табл. 6. Полученное кристаллическое вещество анализировали методами рентгеновской дифракции, ДСК и ИКспектрометрии, и результаты этих анализов показали, что полученная кристаллическая форма пиноцембрина представляет собой его -кристаллическую форму. Таблица 6. Результаты приготовления образцов пиноцембрина в -кристаллической форме Пример 11. Способ 11 приготовления образца пиноцембрина в -кристаллической форме Образец пиноцембрина весом 5 г растворяли в 100 мл смеси 95% этанола и ацетона (95% этанол:ацетон=1:1) до полного растворения при комнатной температуре, затем добавляли 100 мл воды при перемешивании, в результате чего образовывался белый осадок. Осадок отфильтровывали под сниженным давлением и высушивали, получая 4,00 г белого кристаллического вещества (чистота: 98,7%) с выходом 80,0%. Полученную кристаллическую форму анализировали методами рентгеновской дифракции,ДСК и ИК-спектрометрии, а результаты анализов показали, что полученная кристаллическая форма пиноцембрина представляет собой его -кристаллическую форму. Примеры 12-16. Способы приготовления образца пиноцембрина в -кристаллической форме 12-16 Со ссылкой на способ приготовления из примера 1 при использовании в качестве растворителей смеси изопропанола и ТГФ (изопропанол:ТГФ=2:1), смеси ацетонитрила и ДМФ (ацетонитрил:ДМФ=4:1), смеси метанола и ацетона (метанол:ацетон=3:2), смеси этанола и ацетонитрила (этанол:ацетонитрил=1:1) и смеси этанола, ацетона и ледяной уксусной кислоты (этанол:ацетон:ледяная ук-9 020224 сусная кислота=2:1:0,1) был получен пиноцембрин в виде белого кристаллического вещества. Результаты экспериментов показаны в табл. 7. Полученное кристаллическое вещество анализировали методами рентгеновской дифракции, ДСК и ИК-спектрометрии, а результаты анализов показали, что полученная кристаллическая форма пиноцембрина представляет собой его -кристаллическую форму. Таблица 7. Результаты анализа образцов пиноцембрина в -кристаллической форме Приготовление образца пиноцембрина в -кристаллической форме Пример 17. Способ 1 приготовления образца пиноцембрина в -кристаллической форме Образец кристаллического пиноцембрина весом 10 г помещали в ступку и равномерно измельчали в одном направлении в течение 1 ч при комнатной температуре, получая белое кристаллическое вещество, отличающееся от исходной кристаллической формы. Полученное кристаллическое вещество анализировали методом порошковой (поликристаллической) рентгеновской дифракции (излучение CuK). Характерные значения пиков при анализе расположения пиков дифракции: значение 2-тетаили значение d , а также относительная сила дифракционного пика: значения высоты пика (% высоты) или значения площади пика (% площади) показаны в табл. 5, а полученная траектория показана на фиг. 7. На полученном кристаллическом веществе проводили анализ методом ДСК, при этом переходная температура декалесценции составила 204 С, как это показано на траектории ДСК. На полученном кристаллическом веществе проводили инфракрасный спектральный анализ с пластиной KBr, при этом были выявлены следующие характерные пики: 3090,8; 2890,0; 2748,9; 2638,3; 1633,5; 1602,9; 1585,0; 1487,9; 1466,1; 1454,3; 1344,4; 1302,7; 1216,7; 1168,2; 1088,4; 1065,5; 1028,8; 1014,3; 1001,5; 975,8; 917,8; 888,2; 861,8; 826,6; 789,1; 766,6; 741,1; 715,4; 698,0; 663,7; 646,0; 620,5; 587,9; 574,8; 560,9; 527,2 и 488,4 см-1. Приведенные выше данные спектрального анализа показали, что полученная в настоящем примере кристаллическая форма представляла собой -кристаллическую форму. Пример 18. Способ 2 приготовления пиноцембрина в -кристаллической форме Образец пиноцембрина весом 5 г растворяли при комнатной температуре в 75 мл ДМСО, затем добавляли при перемешивании 150 мл воды, в результате чего образовывался белый осадок. Осадок отфильтровывали и высушивали, получая 4,2 г белого кристаллического вещества (чистота: 98,8% при определении методом ВЭЖХ) с выходом 84,0%. Полученное кристаллическое вещество анализировали методами рентгеновской дифракции, ДСК и ИК-спектрометрии, а результаты анализов показали, что полученная кристаллическая форма пиноцембрина представляет собой его -кристаллическую форму. Пример 19. Способ 3 приготовления образца пиноцембрина в -кристаллической форме За исключением применения пиридина в качестве растворителя был использован тот же способ приготовления, что и в примере 18, что позволило получить 8,8 г белого кристаллического вещества (чистота: 98,6% при определении методом ВЭЖХ) с выходом 88,0%. Полученное кристаллическое вещество анализировали методами рентгеновской дифракции, ДСК и ИК-спектрометрии, а результаты анализов показали, что полученная кристаллическая форма пиноцембрина представляет собой его кристаллическую форму. Пример 20. Способ приготовления образца пиноцембрина в виде смеси -кристаллической формы и -кристаллической формы в соотношении 1:1 Образцы пиноцембрина в -кристаллической и -кристаллической форме по 10 г, соответственно,взвешивали и помещали в герметически закрывающийся сосуд. Сосуд закрывали и встряхивали для равномерного перемешивания твердых компонентов. В результате был получен образец смеси - и кристаллической формы в соотношении 1:1. Составление препарата Пример 21. Способ 1 приготовления комбинированного фармацевтического препарата (таблетки) Образцы пиноцембрина в виде чистой -кристаллической формы, чистой -кристаллической формы или твердой смеси кристаллических форм (:=1:1) смешивали с наполнителями в разных соотношениях, получая твердое вещество, представляющее собой смесь фармацевтически активных ингредиентов. Были приготовлены таблетки, содержащие от 5 до 60 мг активных ингредиентов. Рецептурный состав таблеток приведен в табл. 8. Таблица 8. Приготовление комбинированных таблеток пиноцембрина Более подробно способ приготовления был следующим: равномерное перемешивание наполнителей с пиноцембрином, затем добавление соответствующего количества 1% раствора натрийгидроксиметилцеллюлозы для получения пастообразной массы. Пастообразную массу продавливали через решето для получения гранул. Влажные гранулы высушивали и просеивали. Затем добавляли стеарат магния и порошок талька, равномерно перемешивали компоненты и получали конечный продукт посредством таблетирования. Пример 22. Способ 2 приготовления комбинированного фармацевтического препарата (капсулы) Образцы пиноцембрина в виде чистой -кристаллической формы, чистой -кристаллической формы или твердой смеси кристаллических форм (:=1:1 или 1:3) смешивали с наполнителями в разных соотношениях, получая твердое вещество, представляющее собой смесь фармацевтически активных ингредиентов. Были приготовлены капсулы, содержащие от 5 до 60 мг активных ингредиентов. Рецептурный состав капсул приведен в табл. 9. Таблица 9. Приготовление комбинированных капсул с пиноцембрином Более подробно, способ приготовления был следующим: пиноцембрин равномерно перемешивали с наполнителями,затем добавляли соответствующее количество 1% раствора натрийгидроксиметилцеллюлозы для получения гранул, влажные гранулы высушивали и просеивали. Затем добавляли стеарат магния, равномерно перемешивали компоненты и получали конечный продукт, наполняя смесью пустые капсулы. В альтернативном варианте (без гранулирования) конечный продукт получали, непосредственно заполняя пустые капсулы пиноцембрином и наполнителями с последующим равномерным перемешиванием компонентов и просеиванием. Пример 23. Способ 3 приготовления комбинированного фармацевтического препарата (раствора для инъекций и сублимированного порошка для инъекций) Пиноцембрин в виде чистой -кристаллической формы, чистой -кристаллической формы или твердой смеси (+) кристаллических форм (:=1:1) смешивали с наполнителями в разных соотношениях, получая твердое вещество, представляющее собой смесь фармацевтически активных ингредиентов. Затем получали составы для инъекций, содержащие от 5 до 60 мг активных ингредиентов на ампулу. Рецептурный состав инъекционных препаратов приведен в табл. 10. Таблица 10. Приготовление комбинированных инъекционных составов с пиноцембрином Формула 1: Приготовление раствора пиноцембрина для инъекций(1) К 400 мл дистиллированной воды добавляли 40 г гидроксипропилциклодекстрина и растворяли при перемешивании;(2) К 20 мл этанола добавляли 1 г пиноцембрина и растворяли, затем полученный раствор добавляли в вышеупомянутый раствор гидроксипропилциклодекстрина;(3) Смешанный раствор продолжали перемешивать магнитной мешалкой в течение 20 мин при 4050 С. Когда раствор становился светлым и прозрачным, в него добавляли 0,5 г активированного угля. Затем смесь нагревали до 80 С при перемешивании и выдерживали при этой температуре в течение 15 мин, после чего уголь отфильтровывали. Фильтрат разливали в ампулы (по 4 мл в каждую). Раствор пиноцембрина для инъекций получали после стерилизации при 121 С в течение 15 мин. Формула 2: Приготовление сублимированного порошка пиноцембрина для инъекций(1) В стерильной комнате делали навеску 40 г гидроксипропилциклодекстрина и растворяли ее в воде, получая 150 мл раствора. Добавляли 0,1 г активированного угля и смесь нагревали в течение 15 мин до легкого кипения, после чего уголь отфильтровывали.(2) К 20 мл обезвоженного этанола добавляли 1 г пиноцембрина, затем полученный раствор добавляли в вышеупомянутый раствор гидроксипропилциклодекстрина;(3) Смесь перемешивали магнитной мешалкой в течение 20 мин при 40-50 С. Когда раствор становился светлым и прозрачным, получали в виде раствора аддукт пиноцембрина с гидроксипропил-циклодекстрином;(4) К раствору аддукта добавляли воду до объема 200 мл. Смесь пропускали через фильтрующую мембрану с размером пор 0,22 мкм. Фильтрат разливали в пузырьки объемом 10 мл (2 мл на пузырек) и помещали в сублимационную камеру для сублимационной сушки. После герметичного закрытия пузырьков пробками получали стерильный порошок для инъекций. Формула 3: Приготовление раствора пиноцембрина на хлористом натрии для вливаний(1) К 200 мл дистиллированной воды добавляли 20 г гидроксипропилциклодекстрина и растворяли при перемешивании; Затем добавляли 0,5 г активированного угля. Смесь нагревали до 80 С при перемешивании и выдерживали при этой температуре в течение 15 мин, после чего уголь отфильтровывали.(2) Навеску пиноцембрина в количестве 1 г растворяли в 20 мл обезвоженного этанола, затем полученный раствор выливали в вышеупомянутый раствор гидроксипропилциклодекстрина;(3) Смесь перемешивали магнитной мешалкой в течение 20 мин при 40-50 С. Когда раствор становился светлым и прозрачным, получали в виде раствора аддукт пиноцембрина с гидроксипропил-циклодекстрином;(4) К раствору аддукта добавляли воду до объема 800 мл. После добавления 90 г хлористого натрия для инъекций рН раствора подгоняли до 8-9 и разбавляли водой до объема 10000 мл. Затем добавляли 10 г активированного угля и перемешивали в течение 20 мин.(5) После удаления угля раствор разливали порциями по 100 мл на бутылочку. Конечный продукт получали после стерилизации при 121 С в течение 30 мин. Формула 4: Приготовление раствора пиноцембрина на декстрозе для вливаний(1) 20 г гидроксипропилциклодекстрина добавляли к 200 мл дистиллированной воды и растворяли при перемешивании. Затем добавляли 0,5 г активированного угля. Смесь нагревали до 80 С при перемешивании и выдерживали при этой температуре в течение 15 мин, после чего уголь отфильтровывали;(2) 1 г пиноцембрина растворяли в 20 мл обезвоженного этанола, затем полученный раствор выливали в вышеупомянутый раствор гидроксипропилциклодекстрина;(3) Смесь перемешивали магнитной мешалкой в течение 20 мин при 40-50 С. Когда раствор становился светлым и прозрачным, получали в виде раствора аддукт пиноцембрина с гидроксипропил-циклодекстрином;(4) К раствору аддукта добавляли воду до объема 800 мл. После добавления 500 г глюкозы для инъекций рН раствора подгоняли до 8-9 и разбавляли водой до объема 10000 мл. Затем добавляли 10 г активированного угля и перемешивали в течение 20 мин.(5) После удаления угля раствор разливали порциями по 100 мл на бутылочку. Конечный продукт получали после стерилизации при 121 С в течение 30 мин. Пример 24: Характеристики всасывания in vivo и концентрации в крови для твердого активного ингредиента пиноцембрина в - и -кристаллической форме Выборку из 18 крыс линии SD с равным соотношением животных по полу и с весом тела 230-250 г случайным образом разделили на 3 группы по 6 крыс в каждой и с равным соотношением по полу. После 10-часового голодания, но при неограниченном потреблении воды, животным вводили в желудок в дозе 50 мг/кг активный ингредиент пиноцембрина в виде твердого порошка, представлявшего собой кристаллическую форму, -кристаллическую форму или смесь кристаллических форм (+) в соотношении 1:1. После этого в разных точках времени у животных брали образцы крови и определяли в них содержание пиноцембрина. Результаты показали, что для разных кристаллических форм пиноцембрина при одинаковой пероральной дозировке концентрация в крови и время достижения максимальной концентрации различались, при этом концентрация -кристаллической формы была явно меньше концентрации -кристаллической формы. Таблица 11. Концентрация в крови в разное время у крыс, которым перорально вводили пиноцембрин в разных кристаллических формах (определение методом ВЭЖХ, значение площади пика) Примечание: Представленные в таблице значения концентрации в крови представляют собой средние величины для каждой группы животных. Ссылки 1. Китайский патент: публикация под номером CN 1695608A 2. Cheng Yonghao, etc. synthesis of 5,7-dihydricflavanone, chemical reagents, 2006, 28(7): 437 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. -Кристаллическая форма пиноцембрина формулы (I) характеризующаяся тем, что имеет моноклинную симметрию монокристалла, пространственную группу P21/c и значения параметров кристаллической ячейки: а=5,189 , b=24,149 , с=10,472 , =90,=102,31 и =90. 2. -Кристаллическая форма пиноцембрина формулы (I) по п.1 характеризующаяся тем, что при анализе рентгеновской порошковой (поликристаллической) дифракцией (излучение CuK) показывает следующие характеристики: 3. -Кристаллическая форма пиноцембрина по любому из пп.1 и 2, характеризующаяся тем, что переходная температура декалесценции на траектории ДСК составляет приблизительно 206 С. 4. -Кристаллическая форма пиноцембрина по любому из пп.1 и 2, характеризующая тем, что ее спектр инфракрасного поглощения показывает следующие пики: 3090,6; 3011,6; 2889,1; 2747,4; 2636,2; 1631,5; 1602,5; 1584,3; 1487,7; 1466,2; 1454,5; 1435,6; 1354,9; 1302,4; 1257,0; 1217,0; 1168,2; 1088,6; 1064,9; 1028,0; 1014,6; 1001,3; 975,8; 918,0; 887,7; 861,8; 825,9; 789,9; 766,4; 715,2; 698,1; 663,7; 646,7; 620,3; 587,3; 574,9; 560,5; 526,9 и 487,9 см-1, при этом пики 2891,1; 2747,4; 2636,2; 1631,5 и 1354,9 см-1 представляют собой главные характерные пики -кристаллической формы пиноцембрина. 5. -Кристаллическая форма пиноцембрина формулы (I) характеризующаяся тем, что при анализе рентгеновской порошковой (поликристаллической) дифракцией (излучение CuK) показывает следующие характеристики: 6. -Кристаллическая форма пиноцембрина по п.5, характеризующаяся тем, что переходная температура декалесценции на траектории ДСК составляет приблизительно 204 С. 7. -Кристаллическая форма пиноцембрина по п.5, характеризующая тем, что ее спектр инфракрасного поглощения показывает следующие пики: 3090,8; 2890,0; 2748,9; 2638,3; 1633,5; 1602,9; 1585,0; 1487,9; 1466,1; 1454,3; 1344,4; 1302,7; 1216,7; 1168,2; 1088,4; 1065,5; 1028,8; 1014,3; 1001,5; 975,8; 917,8; 888,2; 861,8; 826,6; 789,1; 766,6; 741,1; 715,4; 698,0; 663,7; 646,0; 620,5; 587,9; 574,8; 560,9; 527,2 и 488,4 см-1, при этом пики 2890,0; 2748,9; 2638,3; 1633,5 и 1344,4 см-1 представляют собой главные характерные пики -кристаллической формы пиноцембрина. 8. Смешанная кристаллическая форма пиноцембрина, состоящая из -кристаллической формы и кристаллической формы пиноцембрина в любой пропорции. 9. Кристаллическая форма пиноцембрина по любому из предшествующих пунктов, характеризующаяся тем, что указанная кристаллическая форма не содержит кристаллизационной воды или других кристаллических растворителей. 10. Активный фармацевтический ингредиент, включающий кристаллическую форму пиноцембрина по пп.1, 2, 5 или 8 в качестве активного ингредиента, при этом указанный активный фармацевтический ингредиент применяют для производства лекарственного средства для лечения заболеваний, связанных с церебральной ишемией, или лекарственного средства для предупреждения заболеваний, связанных с церебральной ишемией, посредством защиты функции нейроваскулярного аппарата. 11. Активный фармацевтический ингредиент по п.10, основанный на твердой кристаллической форме пиноцембрина, ежедневная доза которого варьируется от 5 до 250 мг. 12. Фармацевтическая композиция, содержащая терапевтически эффективное количество кристаллической формы пиноцембрина по любому из пп.1, 2, 5 и 8, в комбинации с одним или более фармацевтически приемлемыми носителями. 13. Фармацевтическая дозированная форма, содержащая активный фармацевтический ингредиент по п.10 или 11, или композиция по п.12, характеризующаяся тем, что дозированная форма представляет собой таблетку, капсулу, пилюлю, инъекцию, препарат с замедленным высвобождением или препарат с контролируемым высвобождением. 14. Применение кристаллической формы пиноцембрина по пп.1, 2, 5 или 8 в производстве лекарственного средства для лечения заболеваний, связанных с церебральной ишемией, или лекарственного средства для предупреждения заболеваний, связанных с церебральной ишемией, посредством защиты функции нейроваскулярного аппарата. 15. Способ приготовления -кристаллической формы пиноцембрина, включающий следующие этапы:(1) полное растворение образца в растворителе, выбранном из группы, состоящей из метанола, эта- 15020224(а) помещение смеси в условия окружающей среды с температурой 4-50 С и относительной влажностью 10-75% для рекристаллизации в течение 1-60 дней или(b) добавление воды для образования осадка с последующим получением кристаллической формы пиноцембрина посредством фильтрации при пониженном давлении, лиофилизации или холодного распыления. 16. Способ приготовления -кристаллической формы пиноцембрина, включающий следующие этапы: использование -кристаллической формы пиноцембрина в качестве материала, затем получение -кристаллической формы пиноцембрина через переход одного кристалла в другой кристалл при размалывании. 17. Способ приготовления -кристаллической формы пиноцембрина, включающий следующие этапы: использование -кристаллической формы пиноцембрина в качестве материала, затем получение -кристаллической формы пиноцембрина через полное растворение материала в растворителе (пиридине или ДМСО), добавление воды для образования осадка и проведение фильтрации при пониженном давлении, лиофилизацию или холодное распыление.
МПК / Метки
МПК: C07D 311/32, A61K 31/353, A61P 9/10, C07D 311/22
Метки: типа, композиций, структуры, пиноцембрина, фармацевтических, два, производства, кристаллической, применение, приготовление
Код ссылки
<a href="https://eas.patents.su/20-20224-dva-tipa-kristallicheskojj-struktury-pinocembrina-ih-prigotovlenie-i-primenenie-dlya-proizvodstva-farmacevticheskih-kompozicijj.html" rel="bookmark" title="База патентов Евразийского Союза">Два типа кристаллической структуры пиноцембрина, их приготовление и применение для производства фармацевтических композиций</a>
Предыдущий патент: Композиция для контроля запыленности и ограничения повторного поглощения влаги
Следующий патент: Керамическая масса
Случайный патент: Сварочная машина для сварки рельсов пути