Штаммы бактерий enterococcus и streptococcus, продуцирующие бактериоцины, и способы применения бактериоцинов и штаммов
Номер патента: 17730
Опубликовано: 28.02.2013
Авторы: Левчук Владимир, Светоч Эдуард, Стерн Норман, Перелыгин Владимир, Мицевич Ирина, Мицевич Евгений, Лайн Джон, Ерусланов Борис
Формула / Реферат
1. Выделенный бактериоцин, имеющий аминокислотную последовательность SEQ ID NO: 2.
2. Терапевтическая композиция, содержащая:
(а) по меньшей мере один выделенный бактериоцин, продуцируемый штаммом Enterococcus faecium NRRL В-30746, или штаммом Streptococcus cricetus NRRL B-30745, или их совместной культурой, в количестве, эффективном для снижения уровней колонизации по меньшей мере одной бактерией-мишенью; и
(б) пригодный терапевтический носитель,
причем указанные бактериоцины имеют аминокислотные последовательности SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
3. Терапевтический корм для животных, содержащий:
(а) по меньшей мере один выделенный бактериоцин, продуцируемый штаммом Enterococcus faecium NRRL В-30746, или штаммом Streptococcus cricetus NRRL B-30745, или их совместной культурой, в количестве, эффективном для снижения уровней колонизации по меньшей мере одной бактерией-мишенью; и
(б) терапевтический носитель,
причем указанные бактериоцины имеют аминокислотные последовательности SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
4. Способ снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животного, включающий введение животному терапевтической композиции по п.2 в количестве, эффективном для снижения уровней колонизации по меньшей мере одной бактерией-мишенью.
5. Выделенный штамм бактерий Lactococcus lactis NRRL B-30744, повышающий уровень продуцирования бактериоцинов штаммами-продуцентами Streptococcus cricetus NRRL B-30745 и Enterococcus faecium NRRL B-30746.
6. Способ повышения продуцирования бактериоцинов бактериями Streptococcus cricetus NRRL B-30745 и Enterococcus faecium NRRL B-30746, включающий:
(а) добавление бактериоцин-усиливающего количества бактериального штамма Lactococcus lactis NRRL В-30744 в культуру указанных бактериоцин-продуцирующих бактерий с образованием совместной культуры и
(б) культивирование указанной совместной культуры примерно при 37°С.
7. Способ получения бактериоцина или смеси бактериоцинов, имеющих SEQ ID NO: 1 и SEQ ID NO: 2, включающий:
(а) совместное культивирование бактериоцин-продуцирующих бактерий Streptococcus cricetus NRRL B-30745 и Enterococcus faecium NRRL B-30746 с индукторной бактерией Lactococcus lactis NRRL В-30744;
(б) сбор указанной культуральной среды и клеток посредством центрифугирования с получением супернатанта и клеточного осадка;
(в) выделение бактериоцина из указанного бактериоцин-содержащего супернатанта гидрофобной хроматографией;
(г) инкубирование указанного клеточного осадка со стадии (б) в буфере для элюирования;
(д) разделение указанного клеточного осадка и указанного буфера посредством центрифугирования;
(е) выделение бактериоцина из указанного буфера посредством ионообменной хроматографии.
8. Способ по п.7, где в указанной ионообменной хроматографии используют колонку Superose SP FF.
Текст
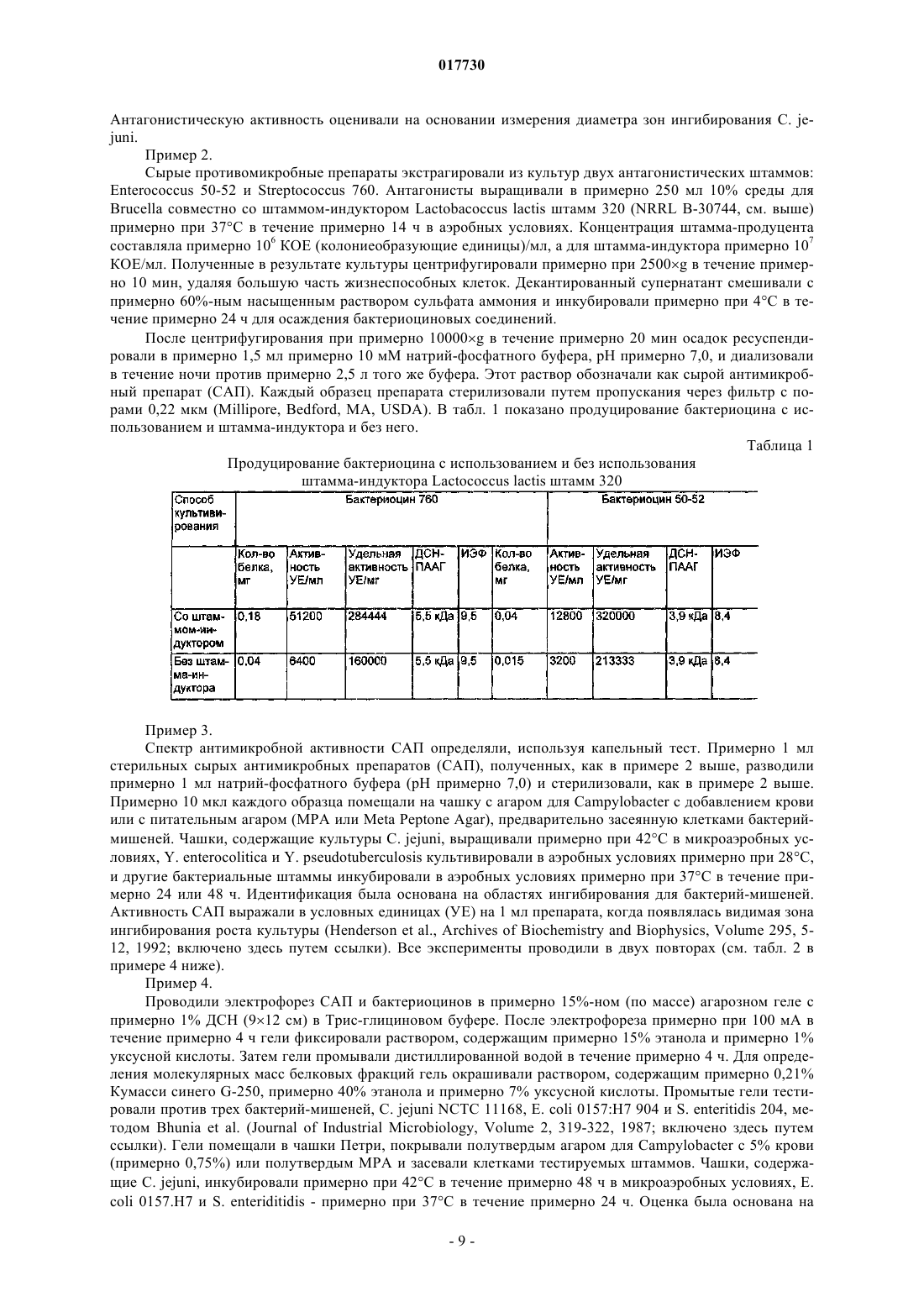
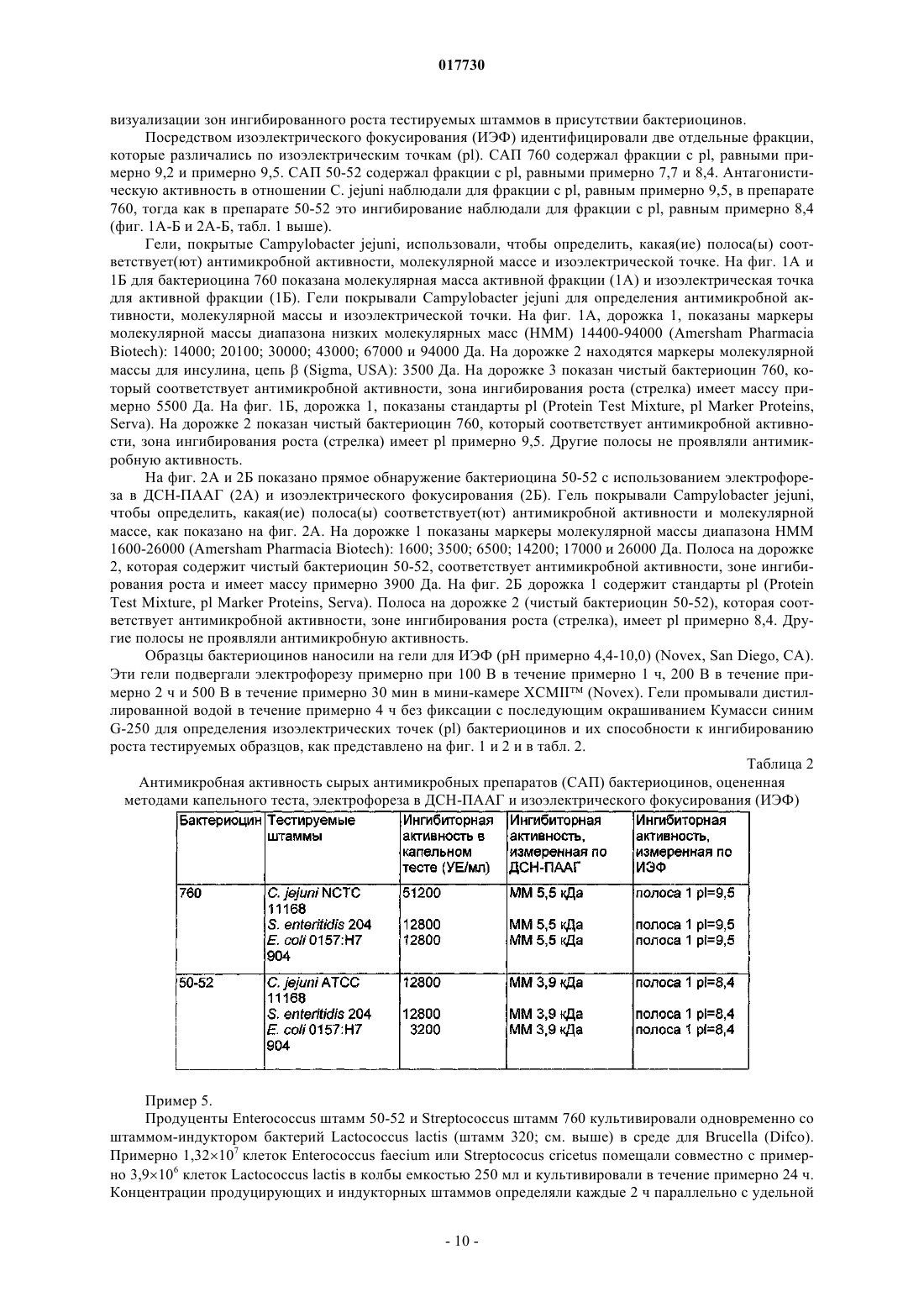
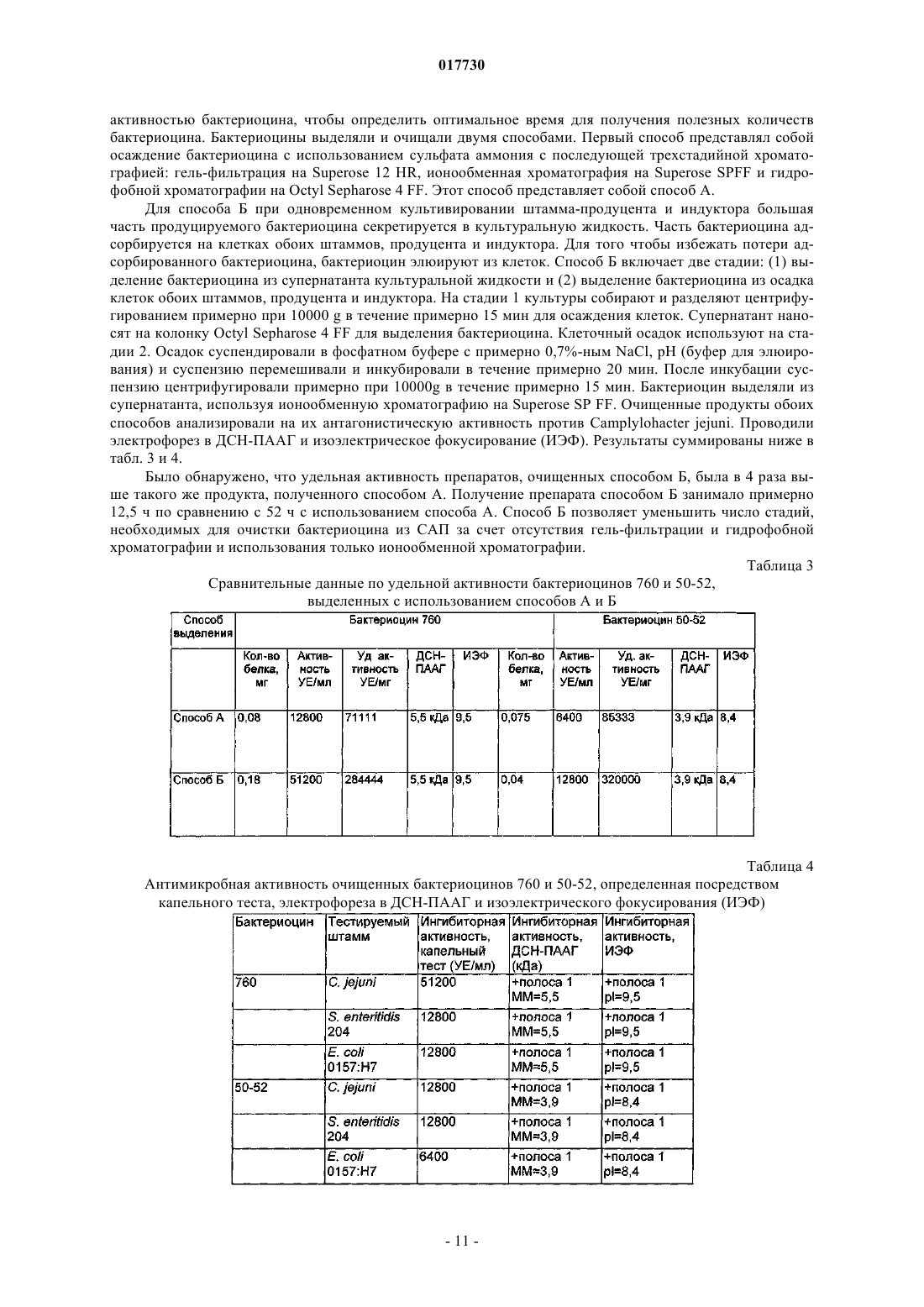
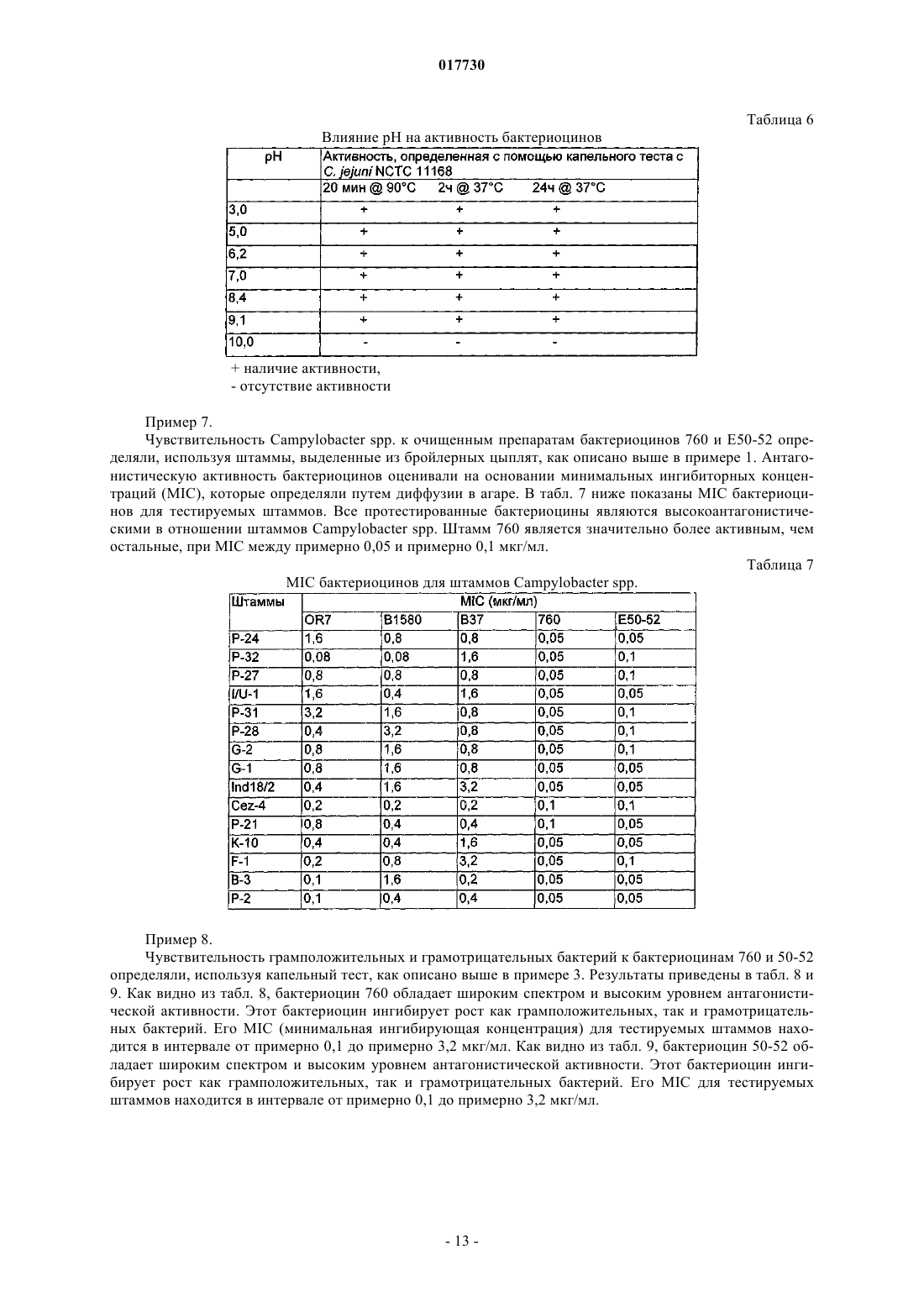
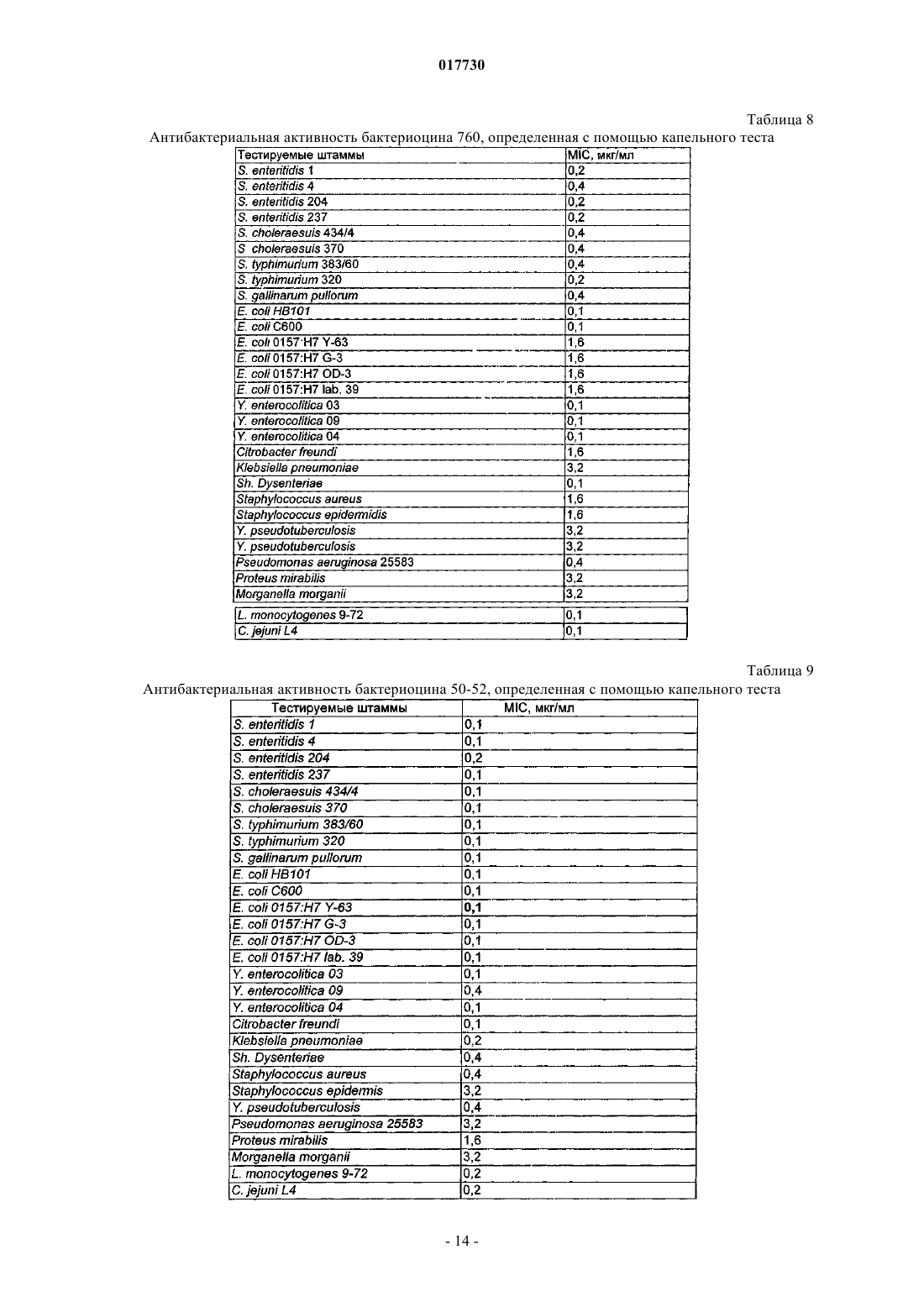
ШТАММЫ БАКТЕРИЙ ENTEROCOCCUS И STREPTOCOCCUS, ПРОДУЦИРУЮЩИЕ БАКТЕРИОЦИНЫ, И СПОСОБЫ ПРИМЕНЕНИЯ БАКТЕРИОЦИНОВ И ШТАММОВ Изобретение относится к бактериоцинам, продуцируемым новыми штаммами Enterococcus илиStreptococcus. Бактериоцины применяют для снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животных, в частности у домашней птицы.(71)(73) Заявитель и патентовладелец: ДЕ ЮНАЙТЕД СТЭЙТС ОФ АМЕРИКА ЭЗ РЕПРЕЗЕНТИД БАЙ ДЕ СЕКРЕТЭРИ ОФ АГРИКАЛЧЭ(US); ГОСУДАРСТВЕННЫЙ НАУЧНЫЙ ЦЕНТР ПРИКЛАДНОЙ МИКРОБИОЛОГИИ И БИОТЕХНОЛОГИИ (RU) 017730 Предшествующий уровень техники Область изобретения Данное изобретение относится к борьбе с заболеванием у животных, в частности у домашней птицы, посредством применения новых штаммов Enterococcus или Streptococcus, продуцирующих бактериоцины, и/или новых бактериоцинов, продуцируемых этими штаммами. Оно также относится к новым бактериоцинам, аминокислотным последовательностям новых бактериоцинов, к штаммам Enterococcus илиStreptococcus, продуцирующим эти новые бактериоцины, и к штаммам-индукторам Lactococcus. Кроме того, изобретение относится к терапевтическим композициям, содержащим новые бактериоцины и/или штаммы Enterococcus или Streptococcus, продуцирующие их, и к применениям этих терапевтических композиций. Описание релевантного уровня техники Потребление неправильно приготовленных продуктов из домашней птицы привело в результате к кишечным заболеваниям человека. Давно известно, что возбудителями таких заболеваний являются Salmonella spp., a позже вовлеченность в них также была признана для Campylobacter spp., в частности Campylobacter jejuni. Оба микроорганизма могут колонизировать желудочно-кишечный тракт домашней птицы без каких-либо вредных эффектов на птицу, и хотя некоторые колонизированные птицы могут быть выявлены, бессимптомные носители могут свободно распространять микроорганизмы в процессе производства и переработки, приводя в результате к дальнейшему заражению как живых птиц, так и тушек. Домашняя птица служит в качестве первичного резервуара для Salmonella и Campylobacter в пищевых ресурсах (Jones et al., Journal of Food Protection, Volume 54, No. 7, 502-507, July, 1991). Предотвращение колонизации у живой домашней птицы в процессе производственного выращивания может ослабить проблему заражения домашней птицы. Ряд факторов вносит вклад в колонизацию и постоянное присутствие бактерий в пищеварительном тракте животных. Обширный обзор этих факторов сделан Savage (Progress in Food and Nutrition Science,Volume 7, 65-74, 1983). В число таких факторов включены: (1) кислотность желудка (Gilliland, Journal ofFood Production, Volume 42,164-167, 1979); (2) соли желчных кислот (SharpeMattick, Milchwissenschaft,Volume 12, 348-349, 1967; Floch et al., American Journal of Clinical Nutrition, Volume 25,1418-1426, 1972;Food Protection, Volume 40, 820-823, 1977; Hugdahl et al., Infection and Immunity, Volume 56, 1560-1566,1988); (3) перистальтика; (4) пищеварительные ферменты (Marmur, Journal of Molecular Biology, Volume 3, 208-218, 1961); (5) иммунный ответ и (6) собственные микроорганизмы и антибактериальные соединения, которые они продуцируют. Первые четыре фактора зависят от фенотипа хозяина и могут не являться поддающимися практическому контролю переменными. Иммунный ответ в желудочно-кишечном(ЖК) тракте непросто модулировать. Факторы, включающие собственные микроорганизмы и их метаболиты, являются зависимыми от нормальной флоры ЖК тракта. Одним из потенциальных способов борьбы с колонизацией Campylobacter и/или Salmonella является способ с использованием конкурентного исключения (КИ). Nurmi и Rantala (Nature, Volume 241, 210211, 1973) продемонстрирован эффективный контроль инфекции Salmonella путем принудительного скармливания бактерий из кишечных материалов здоровой домашней птицы цыплятам, микрофлора которых еще не установилась, против колонизации Salmonella. Введение неопределенных КИ препаратов цыплятам ускоряет "созревание" кишечной флоры у только что вылупившихся цыплят и обеспечивает замену естественного процесса передачи микрофлоры от взрослой курицы к ее потомству. Результаты лабораторных и полевых исследований обеспечивают данные о преимуществах борьбы с Campylobacter посредством введения нормальной микрофлоры цыплятам; имеются сообщения о сниженной частоте стад, инфицированных Campylobacter (Mulder and Bolder, IN: Colonization Control of human bacterial enteropathogens in poultry; L.C. Blankenship (ed.), Academic Press, San Diego, Calif., 359-363, 1991), и сниженных уровнях Campylobacter jejuni (С. jejuni) в фекалиях колонизированных птиц (Stern, Poultry Science, Volume 73, 402-407, 1994).Schoeni и Wong (Appl. Environ. Microbiol., Volume 60, 1191-1197, 1994) сообщали о значимом снижении колонизации бройлеров С. jejuni посредством применения углеводных пищевых добавок вместе с тремя идентифицированными антагонистами: Citrobacter diversus 22, Klebsiella pneumoniae 23 и Escherichia coli 25. Также имеются данные о значимом снижении С. jejuni в кишечных пробах от инфицированных бройлеров после обработки выделенными из домашней птицы культурами Lactobacillus acidophilus и Streptococcus faecium (Morishita et al., Avian Diseases, Volume 41, 850-855,1997).Snoeyenbos et al. (патент США 4335107, июнь 1982) разработана методика конкурентного исключения (КИ) микрофлоры для предупреждения колонизации Salmonella путем лиофилизации посевов фекалий и анаэробного культивирования этого препарата. Mikola et al. (патент США 4657762, апрель 1987) использовали кишечное фекальное содержимое и содержимое слепой кишки в качестве источника КИ микрофлоры для предупреждения колонизации Salmonella. Stern et al. (патент США 5451400, сентябрь 1995, и патент США 6241335, апрель 2001) раскрыта слизистая КИ композиция для защиты домашней птицы и домашнего скота против колонизации Salmonella и Campylobacter, где муциновый слой предварительно промытой слепой кишки соскабливают, и эти соскобы, выдержанные в среде без кисло-1 017730 рода, культивируют в анаэробных условиях. Nisbet et al. (патент США 5478557, декабрь 1996) раскрыт конкретный пробиотик, который может быть получен от ряда домашних животных, получаемый путем непрерывного культивирования периодической культуры, полученной непосредственно из посевов фекалий, содержимого слепой кишки и/или толстого кишечника взрослого целевого животного. Микроорганизмы продуцируют ряд соединений, которые проявляют антибактериальные свойства. Одна группа этих соединений, бактериоцины, состоит из бактерицидных белков с механизмом действия,подобным ионофорным антибиотикам. Бактериоцины часто активны против видов, которые являются близкородственными продуценту. Их широкая распространенность в бактериальных видах, выделенных из сложных сообществ микроорганизмов, таких как кишечный тракт, ротовая или другие эпителиальные поверхности, позволяет предположить, что бактериоцины могут играть регуляторную роль в отношении динамики популяции внутри бактериальных экосистем. Бактериоцины определены как соединения, продуцируемые бактериями, имеющие биологически активную белковую группировку и обладающие бактерицидным действием (Tagg et al., Bacteriological Reviews, Volume 40, 722-256, 1976). Другие характеристики могут включать: (1) узкий спектр ингибиторной активности, сконцентрированной на близкородственных видах; (2) присоединение к специфичным клеточным рецепторам и (3) генетические детерминанты продуцирования бактериоцинов плазмидного происхождения и иммунитет клетки-хозяина к бактериоцину. Не полностью определенные антагонистические вещества называют "бактериоциноподобными веществами". Некоторые бактериоцины, эффективные против грамположительных бактерий в противоположность грамотрицательным бактериям, обладают более широким спектром активности. Предложено, чтобы термин бактериоцин при его использовании для описания ингибиторных агентов, продуцируемых грамположительными бактериями, соответствовал следующим минимальным критериям: (1) представлял собой пептид и (2) обладал бактерицидной активностью (Tagg et al., см. выше). Молочно-кислые бактерии относятся к числу важнейших пробиотических микроорганизмов. Они являются грамположительными, неспорообразующими, отрицательными по каталазе организмами без цитохромов. Они являются анаэробными, но аэротолерантными, требовательными к питательным средам, кислототолерантными, и конечным продуктом ферментации сахара при их культивировании является молочная кислота. Бактерии, продуцирующие молочную кислоту, включают виды Lactobacillus, видыBifidobacterium, Enterococcus faecalis, Enterococcus faecium, Lactococcus lactic, Streptococcus cricetus, Leuconostoc mesenteroides, Pediococcus acidilactici, Sporolactobacillus inulinus, Streptococcus thermophilus и т.д. Эти виды представляют особый интерес в отношении широкой распространенности бактериоцинов внутри этой группы, а также имеют широкое применение в промышленном производстве кисломолочных продуктов, в пищевой и мясоперерабатывающей промышленности. Их роль в консервировании и вкусовых качествах пищевых продуктов хорошо документирована. Большинство бактериоцинов, продуцируемых этой группой, активно только против других молочно-кислых бактерий, но некоторые проявляют антибактериальную активность по отношению к филогенетически более отдаленным грамположительным бактериям и в определенных условиях по отношению к грамотрицательным бактериям.Lactobacilli интенсивно исследовались в отношении продуцирования ими антагонистов. Они включают хорошо охарактеризованные бактериоцины (DeKlerk, Nature, Volume 214, 609, 1967; Upreti andAgents Chemother., Volume 45, 1808-1815, 1983: Joerger and Klaenhammer, Journal of Bacteriology, Volume 167, 439-446, 1986), потенциальные бактериоциноподобные вещества (Vincent et al., Journal of Bacteriol.,Volume 78, 479, 1959) и другие антагонисты, не обязательно родственные бактериоцинам (Vakil and Shahani, Bacteriology, Proc. 9, 1965; Hamdan and Mikolajcik, Journal of Antibiotics, Volume 8, 631-636, 1974;Klaenhammer (FEMS, Microbiol. Rev., Volume 12, 39-86, 1993) классифицировал бактериоцины молочно-кислых бактерий, известные к настоящему времени, на четыре основные группы. Группа I: лантибиотики, которые представляют собой небольшие пептиды размером менее 5 кДа,содержащие необычные аминокислоты лантионин и -метиллантионин. Они представляют особый интерес, поскольку обладают очень широким спектром активности относительно других бактериоцинов. Примеры включают низин, низин Z, карноцин U 149, лактицин 481 и лактоцин 5. Группа II: небольшие пептиды, не содержащие лантионин: гетерогенная группа небольших пептидов размером менее 10 кДа. Эта группа включает пептиды, активные против Listeria spp. Группа III: небольшие термолабильные белки размером более 30 кДа. Примером является гельветицин. Группа IV: сложные бактериоцины - белки, содержащие дополнительные группировки, такие как липиды и углеводы.Raczek (заявка на патент США US 2002/0176910, опубликованная 28 ноября 2002 г.) раскрыл применение композиции, которая содержит живые или убитые микроорганизмы, которые секретируют бактериоцины, либо сами бактериоцины, либо их комбинации, для использования с кормами для сельскохозяйственного домашнего скота. Различные виды энтерококков и стрептококков, продуцирующие бактериоцины, и их бактериоцины-2 017730 описаны в уровне техники. Однако в настоящем изобретении предложены новые композиции, содержащие по меньшей мере один новый штамм Enterococcus или Streptococcus и/или по меньшей мере один новый бактериоцин, продуцируемый этими новыми штаммами; способ применения штамма и/или бактериоцина, новые штаммы, аминокислотные последовательности для новых бактериоцинов и способы применения, все из которых отличны от штаммов, бактериоцинов и способов применения из родственного уровня техники. Краткое изложение сущности изобретения Таким образом, задачей настоящего изобретения является предложение по меньшей мере одного нового штамма Enterococcus или Streptococcus, который продуцирует новые бактериоцины. В задачу настоящего изобретения также входило предложение нового штамма Streptococcuscricetus, имеющего идентификационные характеристики NRRL В-30745. В задачу настоящего изобретения также входило предложение нового штамма Enterococcus faecium,имеющего идентификационные характеристики NRRL B-30746. В задачу настоящего изобретения также входило предложение новых бактериоцинов, продуцируемых новыми штаммами Enterococcus или Streptococcus. В задачу настоящего изобретения также входило предложение нового бактериоцина 50-52, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 1. В задачу настоящего изобретения также входило предложение нового бактериоцина 760, имеющего аминокислотную последовательность, представленную в SEQ ID NO: 2. В задачу настоящего изобретения также входило предложение способа, по меньшей мере, снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животных путем введения животному терапевтической композиции, содержащей по меньшей мере один новый штамм Enterococcus илиStreptococcus, который продуцирует новый бактериоцин, по меньшей мере один новый бактериоцин,продуцируемый новым штаммом Enterococcus или Streptococcus, или комбинацию новых штаммов и/или новых бактериоцинов. В задачу настоящего изобретения также входило предложение способа, по меньшей мере, снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животных путем введения животному терапевтической композиции, содержащей новый штамм Enterococcus, имеющий идентификационные характеристики NRRL с депозитарным номером В-30746, новый штамм Streptococcus, обладающий идентификационными характеристиками NRRLВ-30745, и их смеси. В задачу настоящего изобретения также входило предложение способа, по меньшей мере, снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животных путем введения животному терапевтической композиции, содержащей новый бактериоцин 50-52, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 1. В задачу настоящего изобретения также входило предложение способа по меньшей мере снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животных путем введения животному терапевтической композиции, содержащей новый бактериоцин 760, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 2. В задачу настоящего изобретения также входило предложение способа, по меньшей мере, снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животных путем введения животному терапевтической композиции, содержащей бактериоцин, продуцируемый новым штаммом Enterococcus, имеющим идентификационные характеристики NRRL В-30746, новым штаммом Streptococcus,имеющим идентификационные характеристики NRRL В-30745, и их смеси. В задачу настоящего изобретения также входило предложение штамма-индуктора Lactococcus, который повышает продуцирование бактериоцинов штаммами-продуцентами. В задачу настоящего изобретения также входило предложение штамма-индуктора Lactococcuslactis, имеющего идентификационные характеристики NRRL B-30744. В задачу настоящего изобретения также входило предложение способа повышения продуцирования бактериоцинов штаммами-продуцентами, где штаммы-продуценты культивируют совместно со штаммом-индуктором Lactococcus. В задачу настоящего изобретения также входило предложение способа повышения продуцирования бактериоцинов штаммами-продуцентами, где указанные штаммы-продуценты культивируют совместно со штаммом Lactococcus, имеющим идентификационные характеристики NRRL B-30744. В задачу настоящего изобретения также входило предложение способа очистки бактериоцинов, который включает сбор культуральной жидкости и клеток в виде отдельных образцов, выделение бактериоцина, который адсорбирован на клеточной поверхности штамма-продуцента и штамма-индуктора,посредством элюирования фосфатным буфером, содержащим хлорид натрия, с последующей одностадийной ионообменной хроматографией, выделение бактериоцина из культуральной жидкости посредством гидрофобной хроматографии. Другие признаки и преимущества изобретения должны стать очевидными на основании приведенного ниже описания.Streptococcus cricetus, обозначенный NRRL В-30745 (штамм 760); Enterococcus faecium, обозначенный NRRL B-30746 (штамм 50-52) и Lactococcus lactis, обозначенный NRRL B-30744 (штамм 320), депонированы в соответствии с условиями Будапештского договора 3 мая 2004 г. в патентной коллекции культур Департамента сельского хозяйства и сельскохозяйственных исследований при Министерстве земледелия США (Национальный Центр по исследованиям сельскохозяйственной утилизации (NationalCenter for Agricultural Utilization Research), 1815 N. University Street, Peoria, Illinois 61604). Краткое описание графических материалов Фиг. 1 А-1 Б представляют собой фотографии, показывающие прямое обнаружение бактериоцина 760 после электрофореза в ДСН-ПААГ (1 А) и изоэлектрического фокусирования (1 Б); фиг. 2 А и 2 Б представляют собой фотографии, показывающие прямое обнаружение бактериоцина 50-52 после электрофореза в ДСН-ПААГ (2 А) и изоэлектрического фокусирования (2 Б). Подробное описание изобретения Значимость кишечных инфекций у людей имеет возрастающее признание. Взаимосвязь заражения домашней птицы и инфекции у человека четко зарегистрирована. Способность уменьшить вред для здоровья посредством вмешательств на птицеобрабатывающих предприятиях также хорошо известна. В процессе производства и переработки бройлеров фекальные материалы, содержащие патогены, переносятся на мясо и сохраняются в помещениях для переработки пищевых продуктов. Метаболиты конкурирующих организмов могут вносить вклад в борьбу с такими патогенами, какCampylobacter jejuni и Salmonella. Новые антагонистические штаммы были выделены с поверхностей слизистой оболочки слепой кишки и зоба бройлеров. Нативными компонентами охарактеризованных антагонистов являются низкомолекулярные пептиды, бактериоцины, которые обладают широким спектром антагонистической активности. В настоящем изобретении предложены новый штамм Enterococcus, новый штамм Streptococcus, новый штамм Lactococcus, новые бактериоцины, аминокислотные последовательности указанных бактериоцинов, терапевтические композиции, содержащие новые бактериоцины и/или штаммы, продуцирующие их, и способы применения этих новых терапевтических композиций. В настоящем изобретении также предложен способ продуцирования и очистки новых бактериоцинов.Enterococcus faecium, NRRL В-30746, является факультативным аэробом, представляющим собой грамположительные кокки, и способен к росту при примерно 37 С. Этот штамм растет на питательном агаре или на агаре для подсчета колоний, образуя края неправильной формы. Колонии имеют диаметр примерно 2 мм после микроаэрофильного культивирования в течение примерно 24 ч при примерно 37 С.Streptococcus cricetus, NRRL В-30745, является факультативным аэробом, представляющим собой грамположительные кокки, и способен к росту примерно при 37 С. Этот штамм растет на питательном агаре или на агаре для подсчета колоний, образуя края правильной формы. Колонии имеют диаметр примерно 1 мм после микроаэрофильного культивирования в течение примерно 24 ч при примерно 37 С. Скрининг выделенных штаммов Enterococcus и Streptococcus на продуцирование бактериоциновой активности проводят на питательном агаре, засеянном различными целевыми бактериями-мишенями. Другие тестируемые штаммы культивируют в аэробных условиях примерно при 37 С в течение примерно 18-24 ч. Yersinia enterocolitica и Y. pseudotuberculosis культивируют примерно при 28 С в аэробных условиях в течение примерно 18-24 ч. Тесты на активность против Campylobacter jejuni проводят на агаре для Campylobacter, засеянном С. jejuni, содержащем примерно 5% лаковой крови. Использование крови соответствует пределам компетенции обычных специалистов в данной области техники и включает, например, овец, лошадей и т.д. Тесты на активность против Campylobacter jejuni проводят в микроаэробных условиях с примерно 5% О 2, примерно 10% СО 2 и примерно 85% N2 в течение примерно 24-48 ч при примерно 42 С. Примерно 0,1 мл антагонистических бактерий, суспендированных в нормальном физиологическом растворе, высевают на МРС агар (агар De Man, Rogosa, Sharpe) и инкубируют в течение примерно 24-48 ч. Кубики МРС агара примерно 0,5 см 3 вырезают и переносят на агар для Brucella или Campylobacter с добавлением лаковой крови, примерно 10 мкг/мл рифампицина, примерно 2,4 ед./мл полимиксина и засевают примерно 107 клеток Campylobacter jejuni. Чашки инкубируют при примерно 42 С в течение примерно 24-48 ч в микроаэробных условиях. Активность оценивают путем измерения зон ингибирования роста. Изоляты, выявленные как антагонистические, оценивают на продуцирование бактериоцина. Сырые антимикробные препараты (САП) готовят путем осаждения сульфатом аммония из культур антагонистических штаммов, выращенных в примерно 10%-ной среде для Brucella вместе с усиливающим продуцирование бактериоцина количеством Lactobacillus lactis (штамм 320; NRRL В-30744), используемым в качестве индуктора, при примерно 37 С в течение примерно 14 ч в аэробных условиях. Усиливающее продуцирование бактериоцина, количество индуктора определяют как количество индукторных бактерий,необходимое, по меньшей мере, для усиления продуцирования бактериоцина штаммом-продуцентом по сравнению со штаммом-продуцентом, культивируемым без штамма-индуктора. Примером соотношения концентрации штамма-индуктора к штамму-продуценту в совместной культуре является примерно 10:1(индуктор: продуцент). Затем культуры центрифугируют при примерно 2500g в течение примерно 10 мин. Антагонистические пептиды выделяют из супернатанта посредством комбинации осаждения сульфатом аммония, гель-фильтрации с использованием Superose 12 HR, катионообменной хроматографии с использованием Sepharose SP FF. При совместном культивировании секретируемые бактериоцины могут адсорбироваться на клеточной поверхности клеток как продуцента, так и индуктора. Для сбора бактериоцина клеточный осадок со стадии центрифугирования смешивают с буфером для элюирования, который готовят из фосфатного буфера с примерно 0,7% NaCl, рН примерно 8,0. Эту суспензию перемешивают и инкубируют в течение примерно 20 мин, после чего центрифугируют при примерно 10000 g в течение примерно 15 мин. Бактериоцин выделяют из супернатанта посредством ионообменной хроматографии на Superose SP FF. Молекулярные массы пептидов определяют с помощью электрофореза в ДСНПААГ (электрофорез в полиакриламидном геле с додецилсульфатом натрия), pl пептидов определяют с помощью изоэлектрического фокусирования. Аминокислотные последовательности определяют с помощью расщепления по Эдману, используя, например, автоматический секвенатор 491 cLC (Applied Biosystems, Inc.). Для целей настоящего изобретения термин "пептид" означает соединение по меньшей мере из двух или более аминокислот или аминокислотных аналогов. Аминокислоты или аминокислотные аналоги могут быть соединены пептидными связями. В другом воплощении аминокислоты могут быть соединены другими связями, например сложноэфирными, эфирными и т.д. Пептиды могут находиться в любой структурной конфигурации, включая линейные, разветвленные или циклические конфигурации. Как используют здесь, термин "аминокислоты" относится либо к природным, либо к синтетическим аминокислотам, включая как D, так и L оптические изомеры, и к аминокислотным аналогам. Производные и аналоги пептидов по настоящему изобретению включают, но не ограничены ими,те, которые содержат в качестве первичной аминокислотной последовательности всю аминокислотную последовательность пептида или ее часть, включая измененные последовательности, в которых функционально эквивалентные аминокислотные остатки заменены остатками в пределах последовательности,приводящими в результате к консервативной аминокислотной замене. Например, один или более чем один аминокислотный остаток в пределах последовательности может быть заменен другой аминокислотой подобной полярности, которая действует в качестве функционального эквивалента, приводя в результате к молчащей замене. Замены аминокислот в пределах последовательности могут быть выбраны из других членов того класса, к которому принадлежит эта аминокислота. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин,валин, пролин, фенилаланин, триптофан и метионин. Аминокислотами, содержащими ароматические кольцевые структуры, являются фенилаланин, триптофан и тирозин. Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные(кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Полагают, что такие изменения существенным образом не влияют на среднюю молекулярную массу, определенную с помощью электрофореза в полиакриламидном геле или изоэлектрической точки. Неконсервативные аминокислотные замены могут быть также введены для замены на аминокислоту с особенно предпочтительным свойством. Например, Cys можно вводить в потенциальный сайт для образования дисульфидных мостиков с другим Cys. Pro можно вводить в связи с его особенно плоской структурой. Пептиды по настоящему изобретению можно синтезировать химическим путем. Синтетические пептиды могут быть получены с использованием хорошо известных методик твердофазной, жидкофазной или пептидной конденсации, либо любой их комбинации, и они могут включать природные и/или синтетические аминокислоты. Аминокислоты, используемые для пептидного синтеза, могут представлять собой стандартную Вос(N-аминозащищенную N-трет-бутоксикарбонилом)аминокислоту на полимерном носителе при использовании стандартных протоколов удаления защиты, нейтрализации, сочетания и отмывки оригинальной твердофазной методики Merrifield (J. Am. Chem. Soc., Volume 85, 21492154, 1963), либо лабильную к основанию N-аминозащищенную 9-флуоренилметоксикарбонилом(Fmoc) аминокислоту (Carpino and Han, J. Org. Chem., Volume 37, 3403-3409, 1972). Кроме того, способ по настоящему изобретению можно использовать с другими N-защитными группами, которые знакомы специалистам в данной области техники. Твердофазный пептидный синтез можно осуществлять с помощью методик в пределах обычной компетенции специалистов в данной области техники (см., например,Stewart and Young, Solid Phase Synthesis, Second Edition, Pierce Chemical Co., Rockford, 111, 1984; Fieldsand Noble, Int. J. Pept. Protein Res., Volume 35, 161-214, 1990), либо путем использования автоматических синтезаторов. В соответствии с настоящим изобретением пептиды и/или новые бактериальные штаммы можно вводить в терапевтически приемлемом носителе местным путем, парентеральным путем, через слизистую оболочку, например перорально, назально, ректально или чрескожно. Пептиды по настоящему изобретению могут быть модифицированы при необходимости для повышения способности пептида к про-5 017730 никновению через клеточные мембраны, например путем повышения гидрофобной природы пептида,введения пептида в носитель в виде конъюгата, такого как лиганд к специфичному рецептору и т.д. В настоящем изобретении также предложена конъюгация нацеливающей молекулы с пептидом по изобретению. Нацеливающие молекулы для целей настоящего изобретения означают молекулу, которая при введении in vivo локализуется в желаемом положении или положениях. В различных воплощениях настоящего изобретения нацеливающая молекула может представлять собой пептид или белок, антитело,пектин, углевод или стероид. Нацеливающая молекула может представлять собой пептидный лиганд рецептора на клетке-мишени или антитело, такое как моноклональное антитело. Для облегчения сшивания антитело может быть редуцировано до двух гетеродимеров тяжелой и легкой цепи, либо фрагмент F(ab')2 может быть редуцирован и сшит с пептидом посредством восстановленного сульфгидрила. В другом аспекте настоящего изобретения предложены терапевтические композиции. Эти композиции могут быть предназначены для перорального, назального, легочного введения, инъекции и т.д. Терапевтические композиции включают эффективные количества по меньшей мере одного бактериоцина по настоящему изобретению и их производных и/или по меньшей мере одного нового штамма, по меньшей мере, для снижения уровней колонизации по меньшей мере одной бактерией-мишенью в сочетании с приемлемыми разбавителями, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями. Разбавители могут включать буферы, такие как, например, Трис-HCl, ацетат, фосфат; вспомогательные вещества могут включать, например, детергенты и солюбилизирующие агенты, такие как Твин 80, полисорбат 80 и т.д.; антиоксиданты включают, например, аскорбиновую кислоту, метабисульфит натрия и т.д.; консерванты могут включать, например, тимерсол, бензиловый спирт и т.д.; и наполнители, такие как лактоза, маннит и т.д. Терапевтическая композиция по настоящему изобретению может быть включена в дисперсные препараты полимерных соединений, таких как поливинилпирролидон, полимер молочной кислоты, полигликолевая кислота и т.д., или в липосомы. Липосомная инкапсуляция включает инкапсуляцию различными полимерами. Широкий ряд полимерных носителей можно использовать для содержания и/или доставки одного или более чем одного из терапевтических агентов, обсужденных выше, включая, например,как биоразлагаемые, так и небиоразлагаемые композиции. Репрезентативные примеры биоразлагаемых композиций включают альбумин, коллаген, желатин, гиалуроновую кислоту, крахмал, целлюлозу (метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу,ацетатфталат целлюлозы, ацетатсукцинат целлюлозы, фталат гидроксипропилметилцеллюлозы), казеин,декстраны, полисахариды, фибриноген, поли(D,L-лактид), поли(D,L-лактид-когликолид), поли(гликолид), поли(гидроксибутират), поли(алкилкарбонат) и поли(ортоэфиры), полиэфиры, полимеры гидроксивалериановой кислоты, полидиоксанон, поли(этилентерефталат), полимеры яблочной кислоты,полимеры тартроновой кислоты, полиангидриды, полифосфазены, полиаминокислоты и их сополимерыRelease 4: 155-0180, 1986). Репрезентативные примеры небиоразлагаемых полимеров включают сополимеры поли(этиленвинилацетат) (EVA), силиконовый каучук, акриловые полимеры (полиакриловую кислоту, полиметилакриловую кислоту, полиметилметакрилат, полиалкилцианоакрилат), полиэтилен, полипропилен, полиамиды (нейлон 6,6), полиуретан, поли(сложный эфир-уретаны), поли(простой эфир-уретаны), поли(сложный эфир-мочевина), полиэфиры (поли(этиленоксид), поли(пропиленоксид), полимеры Pluronic и поли(тетраметиленгликоль, силиконовые каучуки и виниловые полимеры, такие как поливинилпирролидон, поли(виниловый спирт), поли(винилацетатфталат). Могут быть также разработаны полимеры,которые являются либо анионными (например, альгинат, каррагенин, карбоксиметилцеллюлоза и поли(акриловая кислота, либо катионными (например, хитозан, поли-L-лизин, полиэтиленимин и поли(аллиламин (см. в общем Dunn et al., J. Applied Polymer Sci. 50: 353-365, 1993; Cascone et al., J. Materials Sci.: Materials in Medicine 5: 770-774, 1994; Shiraishi et al., Biol. Pharm. Bull. 16(11): 1164-1168, 1993;Thacharodi and Rao, Int'l J. Pharm. 120: 115-118, 1995; Miyazaki et al., Int'l J. Pharm. 118: 257-263, 1995). Полимерным носителям может быть придан ряд форм с желаемыми характеристиками высвобождения и/или с конкретными желаемыми свойствами. Например, могут быть созданы полимерные носители для высвобождения терапевтического агента под воздействием специфичного запускающего события,такого как рН (см., например, Heller et al., "Chemically Self-Regulated Drug Delivery Systems," in Polymersal., J. Controlled Release 33: 223-229,1995; Wu and Lee, Pharm. Res. 10(10): 1544-1547, 1993; Serres et al.,Pharm. Res. 13(2): 196-201, 1996; Peppas, "Fundamentals of pH- and Temperature-Sensitive Delivery Systems," in Gurny et al. (eds.), Pulsatile Drug Delivery, Wissenschaftliche Verlagsgesellschaft GmbH, Stuttgart,1993, pp. 41-55; Doelker, "Cellulose Derivatives," 1993, in Peppas and Langer (eds.), Biopolymers I, SpringerVerlag, Berlin). Репрезентативные примеры рН-чувствительных полимеров включают поли(акриловую кислоту) и ее производные (включая, например, гомополимеры, такие как поли(аминокарбоновая кисло-6 017730 та); поли(акриловая кислота); поли(метилакриловая кислота), сополимеры таких гомополимеров и сополимеры поли(акриловой кислоты) и акрилмономеров, таких как обсужденные выше. Другие рНчувствительные полимеры включают полисахариды, такие как ацетатфталат целлюлозы; фталат гидроксипропилметилцеллюлозы; ацетатсукцинат гидроксипропилметилцеллюлозы; ацетаттримеллилат целлюлозы и хитозан. Другие рН-чувствительные полимеры включают любую смесь рН-чувствительного полимера и водорастворимого полимера. Подобным же образом могут быть получены полимерные носители, которые чувствительны к температуре (см., например, Chen et al., "Novel Hydrogels of a Temperature-Sensitive Pluronic Grafted to aPolymers and Hydrogels in Therapeutics and Diagnostics", in Third International Symposium on Recent Advances in Drug Delivery Systems, Salt Lake City, Utah, Feb. 24-27, 1987, pp. 297-305; Gutowska et al., J. Controlled Release 22: 95-104, 1992; Palasis and Gehrke, J. Controlled Release 18: 1-12, 1992; Paavola et al.,Pharm. Res. 12(12): 1997-2002, 1995). Репрезентативные примеры терможелируемых полимеров и их температура желирования (LCST(нижняя критическая температура растворения, С включают гомополимеры, такие как поли(N-метилN-н-пропилакриламид), 19,8; поли(N-н-пропилакриламид), 21,5; поли(N-метил-N-изопропилакриламид),22,3; поли(N-н-пропилметакриламид),28,0; поли(N-изопропилакриламид),30,9; поли(N,Nдиэтилакриламид), 32,0; поли(N-изопропилметакриламид), 44,0; поли(N-циклопропилакриламид), 45,5; поли(N-этилметакриламид), 50,0; поли(N-метил-N-этилакриламид), 56,0; поли(N-циклопропилметакриламид), 59,0; поли(N-этилакриламид), 72,0. Кроме того, терможелирующиеся полимеры могут быть изготовлены путем получения сополимеров из мономеров из числа вышеописанных либо путем объединения таких гомополимеров с другими водорастворимыми полимерами, такими как акриловые мономеры (например, акриловая кислота и ее производные, такие как метилакриловая кислота, акрилат и его производные, такие как бутилметакрилат, акриламид и N-н-бутилакриламид). Другие репрезентативные примеры терможелирующихся полимеров включают эфирные производные целлюлозы, такие как гидроксипропилцеллюлоза, 41 С; метилцеллюлоза, 55 С; гидроксипропилметилцеллюлоза, 66 С и этилгидроксиэтилцеллюлоза, а также Pluronic, такие как F-127, 10-15 С; L-122, 19 С; L-92, 26 С; L-81, 20 С и L-61,24 С. С помощью полимерных носителей по настоящему изобретению может быть получено большое разнообразие форм, включая, например, устройства палочкообразной формы, гранулы, пеллеты или капсулы (см., например, Goodell et al., Am. J. Hosp. Pharm. 43: 1454-1461, 1986; Langer et al., "Controlled release of macromolecules from polymers", in Biomedical Polymers, Polymeric Materials and Pharmaceuticals forSci. 69: 265-270, 1980; Brown et al., J. Pharm. Sci. 72: 1181-1185, 1983; и Bawa et al., J. Controlled Release 1:259-267, 1985). Терапевтические агенты могут быть включены путем заключения в матрицы полимера, присоединены посредством ковалентных связей или инкапсулированы в микрокапсулы. В некоторых предпочтительных воплощениях изобретения предложены терапевтические композиции в некапсулярных препаратах, таких как микросферы (в диапазоне от нанометров до микрометров по размеру), пасты и волокна различного размера, пленки и спреи. В другом аспекте настоящего изобретения предложена терапевтическая композиция и корм для жи-7 017730 вотных. Терапевтическая композиция по настоящему изобретению может быть инкапсулирована с использованием полимерного носителя, как описано выше, а затем добавлена в корм любыми известными способами введения ее в корм, такими как, например, механическое перемешивание, распыление и т.д. Терапевтическая композиция включает, например, количество по меньшей мере одного бактериоцина,эффективное, по меньшей мере, для снижения уровней колонизации по меньшей мере одной бактериеймишенью у животного, такое как, например, примерно 0,5 г бактериоцина(ов)/100 г, примерно 1,25 г полимерного носителя, такого как поливинилпирролидон/100 г, и примерно 8,6% разбавителя, такого как вода/100 г, смешанные с любым гранулярным компонентом, который является усвояемым, таким как,например, молотое кукурузное зерно; молотое зерно, такое как, например, овес, пшеница, гречка; измельченные плоды, такие как, например, груши и т.д. Затем терапевтическую композицию добавляют в любой тип корма для животных в количествах, эффективных, по меньшей мере, для снижения уровней колонизации по меньшей мере одной бактерией-мишенью, например, при отношениях бактериоцина к корму от примерно 1:10 до примерно 1:100. Для целей настоящего изобретения примеры корма для животных включают фураж, силос, сушеный фураж, корни, клубни, сочные фрукты, зерно, семена и отработанный солод, мезга, пивные дрожжи, остатки после перегонки, отходы мукомольного производства,побочные продукты производства сахара, производства крахмала или масла и различные пищевые отходы. Продукт может быть добавлен в корм животных, используемый для разведения крупного рогатого скота, домашней птицы, кроликов, свиней или овец и т.д. Он может быть смешан с другими пищевыми добавками для данного исходного корма. Приведенные ниже примеры предназначены только для дополнительной иллюстрации изобретения и не предназначены для ограничения объема изобретения, который определен формулой изобретения. Пример 1. Два новых антагонистических штамма, Enterococcus faecium штамм 50-52 (NRRL В-30746) и Streptococcus cricetus штамм 760 (NRRL В-30745), были выделены с поверхности слизистой оболочки примерно 1,0 г слепой кишки бройлеров, которую суспендировали в примерно 10 мл стерильного 0,85%ного (мас./об.) физиологического раствора (нормального физиологического раствора) и нагревали примерно при 80 С в течение примерно 15 мин. Примерно 0,10 мл суспензий примерно 1:50 и 1:2500 высевали распылением либо на агар для подсчета колоний, либо на агар MRS. Чашки инкубировали примерно при 37 С в течение примерно 24 ч в микроаэробных условиях. Колонии с различной морфологией рассевали штрихом на агаре MRS. Эти культуры инкубировали в микроаэробных условиях в течение примерно 24 ч примерно при 37 С. Штамм 760 выращивали примерно при 37 С в течение примерно 24 ч на агаре MRS. Этот штамм является факультативным аэробом с грамположительными кокками и способен к росту между примерно 37 и 45 С. Этот штамм растет на питательном агаре или на агаре для подсчета колоний, образуя округлые слабовыпуклые сероватые колонии правильной формы с волнистыми краями, которые имеют диаметр примерно 2 мм после аэробной инкубации примерно при 37 С в течение примерно 24 ч. Биохимические свойства штамма 760 определяли с помощью системы APJ 50 CLH (Bio-Merieux, France). Этот штамм расщепляет лактозу, маннит, рибозу, салицин, сорбит, трегалозу, арабинозу и мелибиозу. Он слабо гидролизует раффинозу и инулин и не гидролизует аргинин и эскулин. Он не способен к - и гемолизу. Он не растет в присутствии примерно 6,5% хлорида натрия. Этот штамм является отрицательным по каталазе. Штамм 50-52 выращивали на агаре MRS примерно при 37 С в течение примерно 24 ч. Этот штамм является факультативным аэробом с грамположительными кокками, способен расти на питательном агаре или на агаре для подсчета колоний, образуя округлые слабовыпуклые сероватые колонии неправильной формы с волнистыми краями, которые имеют диаметр примерно 1 мм после аэробной инкубации примерно при 37 С в течение примерно 24 ч. Биохимические свойства штамма 50-52 определяли с помощью системы тестирования EN-Coccus. Этот штамм расщепляет аргинин, арабинозу и маннит и не гидролизует сорбозу, сорбит, мелибиозу, раффинозу и метицитозу. Он растет в присутствии примерно 6,5% хлорида натрия. Бактерии-мишени для оценки антагонистической активности штаммов 50-52 и 760 включали изоляты Campylobacter jejuni (С. jejuni) NCTC 11168, S. enteritidis и E. coli 0157:H7. Культуры С. jejuni выращивали на агаре для Brucella или на агаре для Campylobacter, содержащем примерно 5% частично гемолизированной крови, примерно при 42 С в течение примерно 24-48 ч в микроаэробных условиях с примерно 5% О 2, примерно 10% CO2 и примерно 85% N2. Другие штаммы культивировали на питательном агаре примерно при 37 С в течение примерно 24 ч. Оценивали антагонистическую активность изолятов против Campyiobacter. Примерно 0,2 мл суспензий в нормальном физиологическом растворе высевали на агар MRS и инкубировали примерно при 37 С в течение примерно 24 ч. Вырезали кубики агара MRS объемом примерно 0,5 см 3 и переносили на агар для Brucelia или агар для Campylobacter с добавлением примерно 5-10% частично гемолизироваиной крови, примерно 10 мкг/мл рифампицина и примерно 2,5 ед./мл полимиксина и инокулировали примерно 107 клеток Campylobacter jejuni на чашку. Чашки инкубировали примерно при 42 С в течение примерно 24-48 ч в микроаэробных условиях, как описано выше.-8 017730 Антагонистическую активность оценивали на основании измерения диаметра зон ингибирования С. jejuni. Пример 2. Сырые противомикробные препараты экстрагировали из культур двух антагонистических штаммов:Brucella совместно со штаммом-индуктором Lactobacoccus lactis штамм 320 (NRRL В-30744, см. выше) примерно при 37 С в течение примерно 14 ч в аэробных условиях. Концентрация штамма-продуцента составляла примерно 106 КОЕ (колониеобразующие единицы)/мл, а для штамма-индуктора примерно 107 КОЕ/мл. Полученные в результате культуры центрифугировали примерно при 2500g в течение примерно 10 мин, удаляя большую часть жизнеспособных клеток. Декантированный супернатант смешивали с примерно 60%-ным насыщенным раствором сульфата аммония и инкубировали примерно при 4 С в течение примерно 24 ч для осаждения бактериоциновых соединений. После центрифугирования при примерно 10000g в течение примерно 20 мин осадок ресуспендировали в примерно 1,5 мл примерно 10 мМ натрий-фосфатного буфера, рН примерно 7,0, и диализовали в течение ночи против примерно 2,5 л того же буфера. Этот раствор обозначали как сырой антимикробный препарат (САП). Каждый образец препарата стерилизовали путем пропускания через фильтр с порами 0,22 мкм (Millipore, Bedford, MA, USDA). В табл. 1 показано продуцирование бактериоцина с использованием и штамма-индуктора и без него. Таблица 1 Продуцирование бактериоцина с использованием и без использования штамма-индуктора Lactococcus lactis штамм 320 Пример 3. Спектр антимикробной активности САП определяли, используя капельный тест. Примерно 1 мл стерильных сырых антимикробных препаратов (САП), полученных, как в примере 2 выше, разводили примерно 1 мл натрий-фосфатного буфера (рН примерно 7,0) и стерилизовали, как в примере 2 выше. Примерно 10 мкл каждого образца помещали на чашку с агаром для Campylobacter с добавлением крови или с питательным агаром (МРА или Meta Peptone Agar), предварительно засеянную клетками бактериймишеней. Чашки, содержащие культуры С. jejuni, выращивали примерно при 42 С в микроаэробных условиях, Y. enterocolitica и Y. pseudotuberculosis культивировали в аэробных условиях примерно при 28 С,и другие бактериальные штаммы инкубировали в аэробных условиях примерно при 37 С в течение примерно 24 или 48 ч. Идентификация была основана на областях ингибирования для бактерий-мишеней. Активность САП выражали в условных единицах (УЕ) на 1 мл препарата, когда появлялась видимая зона ингибирования роста культуры (Henderson et al., Archives of Biochemistry and Biophysics, Volume 295, 512, 1992; включено здесь путем ссылки). Все эксперименты проводили в двух повторах (см. табл. 2 в примере 4 ниже). Пример 4. Проводили электрофорез САП и бактериоцинов в примерно 15%-ном (по массе) агарозном геле с примерно 1% ДСН (912 см) в Трис-глициновом буфере. После электрофореза примерно при 100 мА в течение примерно 4 ч гели фиксировали раствором, содержащим примерно 15% этанола и примерно 1% уксусной кислоты. Затем гели промывали дистиллированной водой в течение примерно 4 ч. Для определения молекулярных масс белковых фракций гель окрашивали раствором, содержащим примерно 0,21% Кумасси синего G-250, примерно 40% этанола и примерно 7% уксусной кислоты. Промытые гели тестировали против трех бактерий-мишеней, С. jejuni NCTC 11168, Е. coli 0157:Н 7 904 и S. enteritidis 204, методом Bhunia et al. (Journal of Industrial Microbiology, Volume 2, 319-322, 1987; включено здесь путем ссылки). Гели помещали в чашки Петри, покрывали полутвердым агаром для Campylobacter с 5% крови(примерно 0,75%) или полутвердым МРА и засевали клетками тестируемых штаммов. Чашки, содержащие С. jejuni, инкубировали примерно при 42 С в течение примерно 48 ч в микроаэробных условиях, Е.coli 0157.H7 и S. enteriditidis - примерно при 37 С в течение примерно 24 ч. Оценка была основана на-9 017730 визуализации зон ингибированного роста тестируемых штаммов в присутствии бактериоцинов. Посредством изоэлектрического фокусирования (ИЭФ) идентифицировали две отдельные фракции,которые различались по изоэлектрическим точкам (pl). САП 760 содержал фракции с pl, равными примерно 9,2 и примерно 9,5. САП 50-52 содержал фракции с pl, равными примерно 7,7 и 8,4. Антагонистическую активность в отношении С. jejuni наблюдали для фракции с pl, равным примерно 9,5, в препарате 760, тогда как в препарате 50-52 это ингибирование наблюдали для фракции с pl, равным примерно 8,4(фиг. 1 А-Б и 2 А-Б, табл. 1 выше). Гели, покрытые Campylobacter jejuni, использовали, чтобы определить, какая(ие) полоса(ы) соответствует(ют) антимикробной активности, молекулярной массе и изоэлектрической точке. На фиг. 1 А и 1 Б для бактериоцина 760 показана молекулярная масса активной фракции (1 А) и изоэлектрическая точка для активной фракции (1 Б). Гели покрывали Campylobacter jejuni для определения антимикробной активности, молекулярной массы и изоэлектрической точки. На фиг. 1 А, дорожка 1, показаны маркеры молекулярной массы диапазона низких молекулярных масс (НММ) 14400-94000 (Amersham PharmaciaBiotech): 14000; 20100; 30000; 43000; 67000 и 94000 Да. На дорожке 2 находятся маркеры молекулярной массы для инсулина, цепь(Sigma, USA): 3500 Да. На дорожке 3 показан чистый бактериоцин 760, который соответствует антимикробной активности, зона ингибирования роста (стрелка) имеет массу примерно 5500 Да. На фиг. 1 Б, дорожка 1, показаны стандарты pl (Protein Test Mixture, pl Marker Proteins,Serva). На дорожке 2 показан чистый бактериоцин 760, который соответствует антимикробной активности, зона ингибирования роста (стрелка) имеет pl примерно 9,5. Другие полосы не проявляли антимикробную активность. На фиг. 2 А и 2 Б показано прямое обнаружение бактериоцина 50-52 с использованием электрофореза в ДСН-ПААГ (2 А) и изоэлектрического фокусирования (2 Б). Гель покрывали Campylobacter jejuni,чтобы определить, какая(ие) полоса(ы) соответствует(ют) антимикробной активности и молекулярной массе, как показано на фиг. 2 А. На дорожке 1 показаны маркеры молекулярной массы диапазона НММ 1600-26000 (Amersham Pharmacia Biotech): 1600; 3500; 6500; 14200; 17000 и 26000 Да. Полоса на дорожке 2, которая содержит чистый бактериоцин 50-52, соответствует антимикробной активности, зоне ингибирования роста и имеет массу примерно 3900 Да. На фиг. 2 Б дорожка 1 содержит стандарты pl (ProteinTest Mixture, pl Marker Proteins, Serva). Полоса на дорожке 2 (чистый бактериоцин 50-52), которая соответствует антимикробной активности, зоне ингибирования роста (стрелка), имеет pl примерно 8,4. Другие полосы не проявляли антимикробную активность. Образцы бактериоцинов наносили на гели для ИЭФ (рН примерно 4,4-10,0) (Novex, San Diego, CA). Эти гели подвергали электрофорезу примерно при 100 В в течение примерно 1 ч, 200 В в течение примерно 2 ч и 500 В в течение примерно 30 мин в мини-камере XCMII (Novex). Гели промывали дистиллированной водой в течение примерно 4 ч без фиксации с последующим окрашиванием Кумасси синимG-250 для определения изоэлектрических точек (pl) бактериоцинов и их способности к ингибированию роста тестируемых образцов, как представлено на фиг. 1 и 2 и в табл. 2. Таблица 2 Антимикробная активность сырых антимикробных препаратов (САП) бактериоцинов, оцененная методами капельного теста, электрофореза в ДСН-ПААГ и изоэлектрического фокусирования (ИЭФ) Пример 5. Продуценты Enterococcus штамм 50-52 и Streptococcus штамм 760 культивировали одновременно со штаммом-индуктором бактерий Lactococcus lactis (штамм 320; см. выше) в среде для Brucella (Difco). Примерно 1,32107 клеток Enterococcus faecium или Streptococus cricetus помещали совместно с примерно 3,9106 клеток Lactococcus lactis в колбы емкостью 250 мл и культивировали в течение примерно 24 ч. Концентрации продуцирующих и индукторных штаммов определяли каждые 2 ч параллельно с удельной- 10017730 активностью бактериоцина, чтобы определить оптимальное время для получения полезных количеств бактериоцина. Бактериоцины выделяли и очищали двумя способами. Первый способ представлял собой осаждение бактериоцина с использованием сульфата аммония с последующей трехстадийной хроматографией: гель-фильтрация на Superose 12 HR, ионообменная хроматография на Superose SPFF и гидрофобной хроматографии на Octyl Sepharose 4 FF. Этот способ представляет собой способ А. Для способа Б при одновременном культивировании штамма-продуцента и индуктора большая часть продуцируемого бактериоцина секретируется в культуральную жидкость. Часть бактериоцина адсорбируется на клетках обоих штаммов, продуцента и индуктора. Для того чтобы избежать потери адсорбированного бактериоцина, бактериоцин элюируют из клеток. Способ Б включает две стадии: (1) выделение бактериоцина из супернатанта культуральной жидкости и (2) выделение бактериоцина из осадка клеток обоих штаммов, продуцента и индуктора. На стадии 1 культуры собирают и разделяют центрифугированием примерно при 10000 g в течение примерно 15 мин для осаждения клеток. Супернатант наносят на колонку Octyl Sepharose 4 FF для выделения бактериоцина. Клеточный осадок используют на стадии 2. Осадок суспендировали в фосфатном буфере с примерно 0,7%-ным NaCl, pH (буфер для элюирования) и суспензию перемешивали и инкубировали в течение примерно 20 мин. После инкубации суспензию центрифугировали примерно при 10000g в течение примерно 15 мин. Бактериоцин выделяли из супернатанта, используя ионообменную хроматографию на Superose SP FF. Очищенные продукты обоих способов анализировали на их антагонистическую активность против Camplylohacter jejuni. Проводили электрофорез в ДСН-ПААГ и изоэлектрическое фокусирование (ИЭФ). Результаты суммированы ниже в табл. 3 и 4. Было обнаружено, что удельная активность препаратов, очищенных способом Б, была в 4 раза выше такого же продукта, полученного способом А. Получение препарата способом Б занимало примерно 12,5 ч по сравнению с 52 ч с использованием способа А. Способ Б позволяет уменьшить число стадий,необходимых для очистки бактериоцина из САП за счет отсутствия гель-фильтрации и гидрофобной хроматографии и использования только ионообменной хроматографии. Таблица 3 Сравнительные данные по удельной активности бактериоцинов 760 и 50-52,выделенных с использованием способов А и Б Таблица 4 Антимикробная активность очищенных бактериоцинов 760 и 50-52, определенная посредством капельного теста, электрофореза в ДСН-ПААГ и изоэлектрического фокусирования (ИЭФ)- 11017730 Аминокислотные последовательности очищенных бактериоцинов определяли с помощью расщепления по Эдману, используя автоматический секвенатор 491 cLC (Applied Biosystems, USA). Бактериоцины гидролизовали в примерно 6 М HCl под вакуумом при примерно 110 С в течение примерно 72 ч. Молекулярные массы бактериоцинов 50-52 и 760 определяли с помощью масс-спектрометрии, используяVoyager-DERP (Perkin-Elmer, USA). Систему MALDI-TOF, систему время-пролетной массспектрометрии с ионизацией методом лазерной десорбции из матрицы, использовали вместе с матрицей,2-цианогидроксикоричной кислотой. Аминокислотные последовательности представляли собой 50-52: TTKNYGNGVCNSVNWCQCGNVWASCNLATGCAAWLCKLA SEQ ID NO: 1 760: NRWYCNSAAGGVGGAAVCGLAGYVGEAKENIAGEVRKGWGMAGGFTHNKA CKS SEQ IDNO: 2 Рассчитанные молекулярные массы пептидов составляли примерно 3,9 кДа для бактериоцина 50-52 и примерно 5,5 кДа для бактериоцина 760. Анализ с помощью MALDI-TOF выявил следующие молекулярные массы: примерно 3932 Да для бактериоцина 50-52 и примерно 5362 Да для бактериоцина 760. Пример 6. Определяли влияние ферментов, температуры и рН на активность бактериоцина. Примерно 10 мл одного из приведенных ниже ферментов переносили в пробирки, содержащие примерно 20 мл бактериоцинов: -химотрипсин - примерно 100 мг/мл, протеиназа K - примерно 200 мг/мл, папаин - примерно 60 мг/мл, лизозим - примерно 750 мг/мл и липаза - примерно 100 мг/мл (все ферменты от фирмы SigmaAldrich Corp., St. Louis МО). После примерно трехчасового периода инкубации примерно при 37 С смесь бактериоцина и фермента анализировали на антимикробную активность, используя капельный тест, как в примере 3. Необработанные бактериоцины служили в качестве положительных контролей. Для исследования термостабильности бактериоцинов образец примерно 2 мг/мл кипятили в водяной бане в течение примерно 15 мин, охлаждали и оценивали на антимикробную активность. Примерно 2 мг/мл бактериоцина использовали для оценки эффекта рН. Примерно 2 мл стерильных растворов, примерно 10 мМ NaOH или примерно 10 мМ HCl добавляли к образцам для тестирования рН от примерно 3 до примерно 10. Образцы инкубировали примерно при 37 С в течение примерно 2 и 24 ч и примерно при 90 С в течение примерно 20 мин. Образцы доводили до рН примерно 7,2 добавлением примерно 4 мМ стерильного фосфатного буфера и анализировали на антимикробную активность, используя капельный тест, как описано выше в примере 3. Бактериоцины 50-52 и 760 потеряли свою антимикробную активность после обработки химотрипсином, протеиназой K и папаином, но сохранили ее при обработке лизозимом, липазой или при нагревании примерно до 90 С (табл. 5). Они были стабильны при различных значениях рН в интервале от примерно 3,0 до примерно 9,0, но становились неактивными примерно при рН 10 (табл. 5 и 6). Таблица 5 Влияние ферментов и температуры на антимикробную активность бактериоцинов активность определяли с помощью капельного теста с С. jejuniNCTC 11168 в качестве индикаторного штамма,+ наличие активности,- отсутствие активности после обработки ферментами или воздействия температуры.- 12017730 Таблица 6 Влияние рН на активность бактериоцинов+ наличие активности,- отсутствие активности Пример 7. Чувствительность Campylobacter spp. к очищенным препаратам бактериоцинов 760 и Е 50-52 определяли, используя штаммы, выделенные из бройлерных цыплят, как описано выше в примере 1. Антагонистическую активность бактериоцинов оценивали на основании минимальных ингибиторных концентраций (MIC), которые определяли путем диффузии в агаре. В табл. 7 ниже показаны MIC бактериоцинов для тестируемых штаммов. Все протестированные бактериоцины являются высокоантагонистическими в отношении штаммов Campylobacter spp. Штамм 760 является значительно более активным, чем остальные, при MIC между примерно 0,05 и примерно 0,1 мкг/мл. Таблица 7MIC бактериоцинов для штаммов Campylobacter spp. Пример 8. Чувствительность грамположительных и грамотрицательных бактерий к бактериоцинам 760 и 50-52 определяли, используя капельный тест, как описано выше в примере 3. Результаты приведены в табл. 8 и 9. Как видно из табл. 8, бактериоцин 760 обладает широким спектром и высоким уровнем антагонистической активности. Этот бактериоцин ингибирует рост как грамположительных, так и грамотрицательных бактерий. Его MIC (минимальная ингибирующая концентрация) для тестируемых штаммов находится в интервале от примерно 0,1 до примерно 3,2 мкг/мл. Как видно из табл. 9, бактериоцин 50-52 обладает широким спектром и высоким уровнем антагонистической активности. Этот бактериоцин ингибирует рост как грамположительных, так и грамотрицательных бактерий. Его MIC для тестируемых штаммов находится в интервале от примерно 0,1 до примерно 3,2 мкг/мл.- 13017730 Таблица 8 Антибактериальная активность бактериоцина 760, определенная с помощью капельного теста Таблица 9 Антибактериальная активность бактериоцина 50-52, определенная с помощью капельного теста- 14017730 Пример 9. Минимальные ингибиторные концентрации (MIC) бактериоцинов 760 и 50-52 и метициллина определяли с помощью капельного теста. Различные концентрации очищенных бактериоцинов (мкг/мл) в объеме 10 мкл добавляли к культурам Staphylococcus aureus, Staphylococcus epidermidis, Pseudomonasaeruginosa и Helicobacter pylori. Культуры инкубировали в течение примерно 24 ч примерно при 37 С в аэробных условиях для всех, кроме Helicobacter pylori, которую инкубировали в микроаэробных условиях. Результаты представлены ниже в табл. 10. Таблица 10 Приведенное выше подробное описание дано в целях иллюстрации. Такие подробности предназначены исключительно для этой цели, и специалисты в данной области техники могут производить вариации без отклонения от сущности и объема изобретения. Перечень последовательностей- 15017730 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный бактериоцин, имеющий аминокислотную последовательность SEQ ID NO: 2. 2. Терапевтическая композиция, содержащая:(а) по меньшей мере один выделенный бактериоцин, продуцируемый штаммом Enterococcus faecium NRRL В-30746, или штаммом Streptococcus cricetus NRRL B-30745, или их совместной культурой, в количестве, эффективном для снижения уровней колонизации по меньшей мере одной бактериеймишенью; и(б) пригодный терапевтический носитель,причем указанные бактериоцины имеют аминокислотные последовательности SEQ ID NO: 1 и SEQID NO: 2 соответственно. 3. Терапевтический корм для животных, содержащий:(а) по меньшей мере один выделенный бактериоцин, продуцируемый штаммом Enterococcus faecium NRRL В-30746, или штаммом Streptococcus cricetus NRRL B-30745, или их совместной культурой, в количестве, эффективном для снижения уровней колонизации по меньшей мере одной бактериеймишенью; и(б) терапевтический носитель,причем указанные бактериоцины имеют аминокислотные последовательности SEQ ID NO: 1 и SEQID NO: 2 соответственно. 4. Способ снижения уровней колонизации по меньшей мере одной бактерией-мишенью у животного, включающий введение животному терапевтической композиции по п.2 в количестве, эффективном для снижения уровней колонизации по меньшей мере одной бактерией-мишенью. 5. Выделенный штамм бактерий Lactococcus lactis NRRL B-30744, повышающий уровень продуцирования бактериоцинов штаммами-продуцентами Streptococcus cricetus NRRL B-30745 и Enterococcusfaecium NRRL B-30746. 6. Способ повышения продуцирования бактериоцинов бактериями Streptococcus cricetus NRRL B30745 и Enterococcus faecium NRRL B-30746, включающий:(а) добавление бактериоцин-усиливающего количества бактериального штамма Lactococcus lactisNRRL В-30744 в культуру указанных бактериоцин-продуцирующих бактерий с образованием совместной культуры и(б) культивирование указанной совместной культуры примерно при 37 С. 7. Способ получения бактериоцина или смеси бактериоцинов, имеющих SEQ ID NO: 1 и SEQ ID(б) сбор указанной культуральной среды и клеток посредством центрифугирования с получением супернатанта и клеточного осадка;(в) выделение бактериоцина из указанного бактериоцин-содержащего супернатанта гидрофобной хроматографией;(г) инкубирование указанного клеточного осадка со стадии (б) в буфере для элюирования;(д) разделение указанного клеточного осадка и указанного буфера посредством центрифугирования;(е) выделение бактериоцина из указанного буфера посредством ионообменной хроматографии. 8. Способ по п.7, где в указанной ионообменной хроматографии используют колонку Superose SP FF.
МПК / Метки
МПК: A61K 38/16, C07K 14/195, C07K 14/335, C12N 1/20, A61K 38/17
Метки: streptococcus, продуцирующие, бактерий, бактериоцинов, штаммов, enterococcus, бактериоцины, штаммы, применения, способы
Код ссылки
<a href="https://eas.patents.su/18-17730-shtammy-bakterijj-enterococcus-i-streptococcus-produciruyushhie-bakteriociny-i-sposoby-primeneniya-bakteriocinov-i-shtammov.html" rel="bookmark" title="База патентов Евразийского Союза">Штаммы бактерий enterococcus и streptococcus, продуцирующие бактериоцины, и способы применения бактериоцинов и штаммов</a>
Предыдущий патент: Каталитический компонент, включающий три мостиковых бис-инденильных металлоценовых компонента
Следующий патент: Устройство генерации данных, способ генерации данных и базовая станция
Случайный патент: Производные изоксазола и их применение в качестве потенциирующих средств для метаботропных глутаматных рецепторов