Производные изоксазола и их применение в качестве потенциирующих средств для метаботропных глутаматных рецепторов
Номер патента: 18412
Опубликовано: 30.07.2013
Авторы: Эмпфилд Джеймс, Хантер Анджела М., Фолмер Джеймс, Тронер Скотт, Кассиола Джозеф
Формула / Реферат
1. Соединение формулы I
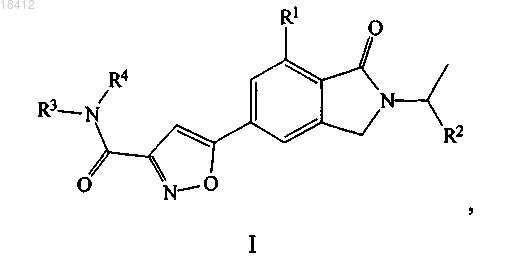
где R1 выбран из C1-3алкила или галогена;
R2 выбран из C1-3алкила, C1-3галогеноалкила или C3-6циклоалкила;
R3 и R4, в каждом случае независимо, выбраны из водорода, C1-3алкила, C1-3гидроксиалкила или C3-6 карбоциклила или R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолина, пирролидина или пиперазина;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R2 представляет собой трифторметил или циклопропил, формулы II
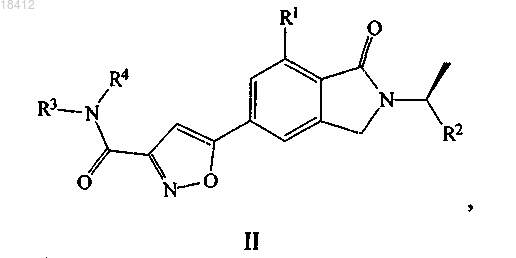
где R1 выбран из метила или хлора;
R3 и R4, в каждом случае независимо, выбраны из водорода, метила, изопропила, 2-гидроксиэтила, циклопентила или циклогексила или R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолина, пирролидина или пиперазина.
3. Соединение формулы I по п.1, где R2 представляет собой метил.
4. Соединение формулы I по п.1,
где R1 и R2 представляют собой метил;
R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолина иди пирролидина.
5. Соединение формулы II по п.2,
где R1 представляет собой хлор;
R2 представляет собой трифторметил или циклопропил;
R3 и R4, в каждом случае независимо, выбраны из водорода, метила или изопропила.
6. Соединение формулы II по п.2,
где R1 выбран из метила или хлора;
R2 выбран из трифторметила или циклопропила;
R3 представляет собой водород или метил и
R4 выбран из водорода, метила, циклопентила или циклогексила.
7. Соединение по п.1, выбранное из
5-(7-хлор-2-((S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндолин-5-ил)-N-метилизоксазол-3-карбоксамида;
5-(7-хлор-2-((S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндолин-5-ил)-N,N-диметилизоксазол-3-карбоксамида;
амида 5-[7-хлор-2-((S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
амида 5-[2-((S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
диметиламида 5-(2-изопропил-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)изоксазол-3-карбоновой кислоты;
метиламида 5-[2-((S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
амида 5-[7-хлор-2-((S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1Н-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
диметиламида 5-[2-((S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
7-хлор-2-изопропил-5-[3-(пирролидин-1-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол-1-она;
(2-гидроксиэтил)метиламида 5-(7-хлор-2-изопропил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)изоксазол-3-карбоновой кислоты;
диметиламида 5-[7-метил-1-оксо-2-((S)-2,2,2-трифтор-1-метилэтил)-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
изопропилметиламида 5-[2-((S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
(2-гидроксиэтил)метиламида 5-[2-((S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
циклопентиламида 5-(7-хлор-2-изопропил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)изоксазол-3-карбоновой кислоты;
7-хлор-2-изопропил-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол-1-она;
2-((S)-1-циклопропилэтил)-7-метил-5-[3-(пиперазин-1-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол-1-она;
диметиламида 5-[7-хлор-1-оксо-2-((S)-2,2,2-трифтор-1-метилэтил)-2,3-дигидро-1Н-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
изопропилметиламида 5-[7-хлор-2-((S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты;
(2-гидроксиэтил)метиламида 5-[7-хлор-2-((S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты или
7-хлор-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2-((S)-2,2,2-трифтор-1-метилэтил)-2,3-дигидроизоиндол-1-она.
8. Соединение по любому из пп.1-7 в форме фармацевтически приемлемой соли.
9. Способ получения соединения по любому из пп.1-8, включающий
превращение 4-броманилина в соответствующий нитрил в условиях реакции Сандмейера (Sandmeyer);
превращение нитрила в амид гидролизом в присутствии основания;
диазотирование амида и затем гидролиз нитросерной кислотой с получением бензойной кислоты;
защита бензойной кислоты в виде метилового эфира;
монобромирование бензильной метильной группы N-бромсукцинимидом с использованием бензоилпероксида в качестве инициатора радикалов с получением метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты;
циклизация метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты в 4-бромизоиндолон с использованием амина;
взаимодействие 4-бромизоиндолона в условиях Сонагашира (Sonagashira) с защищенным ацетиленом;
снятие защиты с ацетилена с использованием основания;
взаимодействие незащищенного ацетилена с этил-2-хлор-2-(гидроксиимино)ацетатом с получением изоксазолового сложного эфира и
гидролиз этого сложного эфира до кислоты и амидирование изобутилхлорформиатом и N-метилморфолином и соответствующим амином для получения амида формулы I.
10. Способ получения соединения по любому из пп.1-8, включающий
превращение 4-броманилина в соответствующий нитрил в условиях реакции Сандмейера (Sandmeyer);
превращение нитрила в амид гидролизом в присутствии основания;
диазотирование амида и затем гидролиз нитросерной кислотой с получением бензойной кислоты;
защита бензойной кислоты в виде метилового эфира;
монобромирование бензильной метальной группы N-бромсукцинимидом с использованием бензоилпероксида в качестве инициатора радикалов с получением метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты;
циклизация метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты в 4-бромизоиндолон с использованием амина;
взаимодействие 4-бромизоиндолона в условиях Сонагашира (Sonagashira) с защищенным ацетиленом;
снятие защиты с ацетилена с использованием основания;
взаимодействие незащищенного ацетилена с этил-2-хлор-2-(гидроксиимино)ацетатом с получением изоксазолового сложного эфира и
получение амида формулы I из изоксазолового сложного эфира путем взаимодействия с амином и нагревания.
11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 и по меньшей мере один фармацевтически приемлемый носитель или эксципиент.
12. Применение соединения по любому из пп.1-8 в качестве лекарственного средства, обладающего активностью модулятора метаботропных глутаматных рецепторов.
13. Применение соединения по любому из пп.1-8 в изготовлении лекарственного средства для лечения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией.
14. Применение по п.13, где нарушение представляет собой шизофрению.
15. Способ лечения или предупреждения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией, у животного, нуждающегося в таком лечении, включающий стадию введения указанному животному терапевтически эффективного количества соединения по любому из пп.1-8.
16. Способ лечения или предупреждения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией, у животного, нуждающегося в таком лечении, включающий стадию введения указанному животному терапевтически эффективного количества фармацевтической композиции по п.11.
17. Способ по п.15 или 16, где нарушение представляет собой шизофрению.
Текст
ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПОТЕНЦИИРУЮЩИХ СРЕДСТВ ДЛЯ МЕТАБОТРОПНЫХ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ Область изобретения Настоящее изобретение относится к производным изоксазола, которые функционируют как потенциирующие средства для глутаматных рецепторов, способам их получения, фармацевтическим композициям, которые их содержат, и их применению в лечении. Предшествующий уровень техники Метаботропные глутаматные рецепторы (mGluR) составляют семейство рецепторов, сопряженных с ГТФ-связывающими белками (G-белками), которые активируются глутаматом и играют важную роль в синаптической активности в центральной нервной системе, включая ее пластичность, развитие и нейродегенерацию. Активация mGluR в интактных нейронах млекопитающего вызывает один или более чем один из следующих ответов: активация фосфолипазы С; увеличение гидролиза фосфоинозитида (PI); высвобождение внутриклеточного кальция; активация фосфолипазы D; активация или ингибирование аденилциклазы; увеличение или снижение образования циклического аденозинмонофосфата (цАМФ); активация гуанилциклазы; увеличение образования циклического гуанозинмонофосфата (цГМФ); активация фосфолипазы А 2; увеличение высвобождения арахидоновой кислоты и увеличение или снижение активности потенциал- и лигандзависимых ионных каналов (Schoepp et al., 1993, Trends Pharmacol. Sci., 14:13;Schoepp, 1994, Neurochem. Int., 24:439; Pin et al., 1995, Neuropharmacology. 34:1; BordiUgolini, 1999,Prog. Neurobiol. 59:55). Идентифицированы восемь подтипов mGluR, которые разделены на три группы на основании сходства первичных последовательностей, связей с грансдукцией сигналов и фармакологических профилей. Группа I включает в себя mGluR1 и mGluR5, которые активируют фосфолипазу С и генерирование внутриклеточного кальциевого сигнала. В группе II (mGluR2 и mGluR3) и группе III (mGluR4, mGluR6,mGluR7 и mGluR8) mGluR опосредуют ингибирование активности аденилциклазы и уровней циклического АМФ. Обзор см. в Pin et al., 1999, Eur. J. Pharmacol., 375:277-294. Активность семейства mGluR-рецепторов принимает участие во множестве нормальных процессов в ЦНС млекопитающего и представляет собой важную цель соединений для лечения множества разных неврологических и психиатрических нарушений. Активация mGluR требуется для индукции долговременного потенциирования в гиппокампе и долговременной депрессии в мозжечке (Bashir et al., 1993, Nature, 363:347; Bortolotto et al., 1994, Nature, 368:740; Aiba et al., 1994, Cell, 79:365; Aiba et al., 1994, Cell,79:377). Также продемонстрирована роль активации mGluR в ноцицепции и анальгезии (Meller et al.,1993, Neuroreport, 4: 879; BordiUgolini, 1999. Brain Res., 871:223). Кроме того, предполагают, что активация mGluR играет модуляторную роль во множестве разных других нормальных процессов, в том числе в синаптической передаче, развитии нервной системы, апоптозной гибели нейронов, синаптической пластичности, пространственного обучения, обонятельной памяти, центральном контроле сердечной активности, пробуждении, моторном контроле и контроле вестибуло-окулярного рефлекса (Nakanishi,1994, Neuron, 13:1031; Pin et al., 1995, Neuropharmacology., supra; Knopfel et al., 1995, J. Med. Chem.,38:1417). Последние достижения в выяснении нейрофизиологических ролей mGluR утвердили эти рецепторы в качестве перспективных целей лекарственных средств в лечении острых и хронических неврологических и психиатрических нарушений и нарушений, представляющих собой хроническую и острую боль. По причине физиологического и патофизиологического значения mGluR имеется необходимость в новых лекарственных средствах и соединениях, которые могут модулировать функцию mGluR. Описание изобретения Авторы изобретения идентифицировали класс соединений, которые модулируют функцию mGluR. В одной из форм в этом изобретении предложено соединение формулы I или его фармацевтически приемлемые соль, гидрат, сольват или энантиомер. Таким образом, в одном из воплощений в настоящем изобретении предложено соединение, представляющее собой соединение формулы I В конкретном аспекте в этом воплощении предложены соединения формулы I где R2 представляет собой трифторметил или циклопропил, по существу, свободные от других энантиомеров,R1 выбран из метила или хлоро;R3 и R4, в каждом случае независимо, выбраны из водорода, метила, изопромила. 2-гидроксиэтила,циклопентила, циклогексила, пиперидинила или пиразолила, или R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолино, пирролидинила или пиперазинила. В другом конкретном аспекте в этом воплощении предложены соединения формулы I, гдеR3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолино или пирролидинила. В еще одном конкретном аспекте в этом воплощении предложены соединения формулы II, по существу, свободные от других энантиомеров, гдеR2 представляет собой трифторметил или циклопропил;R3 и R4, в каждом случае независимо, выбраны из водорода, метила или изопропила. В другом аспекте в этом воплощении предложены соединения формулы II, по существу, свободные от других энантиомеров, гдеR1 выбран из метила или хлоро;R2 выбран из трифторметила или циклопропила;R3 представляет собой водород или метил иR4 выбран из водорода, метила, циклопентила или циклогексила. В частности, в этом воплощении предложены следующие соединения, описанные здесь в примерах: 5-(7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндолин-5-ил)-N-метилизоксазол 3-карбоксамид; 5-(7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндолин-5-ил)-N,N-диметилизоксазол-3-карбоксамид; амид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3 карбоновой кислоты; амид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3 карбоновой кислоты; диметиламид 5-(2-изопропил-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)изоксазол-3-карбоновой кислоты; метиламид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол 3-карбоновой кислоты; амид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3 карбоновой кислоты; диметиламид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты; 7-хлор-2-изопропил-5-[3-(пирролидин-1-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол-1-он;(2-гидроксиэтил)метиламид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол 5-ил]изоксазол-3-карбоновой кислоты; 7-хлор-2-S)-1-циклопропилэтил)-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол-1-он и 7-хлор-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2-S)-2,2,2-трифтор-1-метилэтил)-2.3-дигидроизоиндол-1-он. Также предложены способы получения соединений формулы I или формулы II. Дополнительно предложены фармацевтические композиции, содержащие соединение формулы I или формулы II вместе с фармацевтически приемлемым носителем или эксципиентом. В еще одном воплощении предложен способ лечения или предупреждения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией, у животного, нуждающегося в таком лечении. Этот способ включает стадию введения животному терапевтически эффективного количества соединения формулы I или формулы II или фармацевтической композиции, содержащей такое количество. В этом изобретении также предложено применение соединения формулы I или II или его фармацевтически приемлемых соли или сольвата в изготовлении лекарственного средства для лечения указанных здесь состояний. Далее в этом изобретении предложено соединение формулы I или II или его фармацевтически приемлемые соль или сольват для применения в терапии. Соединения, описанные здесь, проявляют активность как модуляторы метаботропных глутаматных рецепторов и, более конкретно, проявляют активность как средства потенциирования для mGluR2 рецептора. Предполагают, что эти соединения будут полезными в терапии в качестве фармацевтических средств, в частности для лечения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией. Определения Если в этом описании не указано иное, номенклатура, используемая в этом описании, обычно следует примерам и правилам, установленным в Nomenclature of Organic Chemistry, Sections A, B, C, D, E, F и H, Pergamon Press, Oxford, 1979, включено сюда посредством ссылки на примеры названий химических структур и правила наименования химических структур. Возможно, название соединения может быть образовано при использовании программы химического наименования: ACD/ChemSketch, Версия 5.09/сентябрь 2001, Advanced Chemistry Development, Inc., Toronto, Canada. Термин "C1-3 алкил" при использовании здесь означает имеющий прямую или разветвленную цепь или циклический углеводородный радикал, имеющий от одного до грех атомов углерода, и включает в себя метил, этил, пропил, изопропил и циклопропил. Термин "C1-3 галогеноалкоксил" при использовании здесь означает имеющий прямую или разветвленную цепь радикал алкокси, имеющий от одного до трех атомов углерода и по меньшей мере один заместитель, представляющий собой галогено, и включает в себя фторметоксил, трифторметоксил, фторэтоксил, трифторпропилоксил, фторизопропилокси и тому подобные. Термин "галогено" при использовании здесь означает галоген и включает в себя фторо, хлоро, бромо, йодо, как радиоактивные, так и нерадиоактивные формы. Символ А при использовании здесь означает нагревание или приложение тепла. Термин "фармацевтически приемлемая соль" означает либо соль присоединения кислоты, либо соль присоединения основания, которая является совместимой с введением пациентам."Фармацевтически приемлемая соль присоединения кислоты" представляет собой любую нетоксичную соль присоединения органической или неорганической кислоты и соединения формулы I. Примеры неорганических кислот, которые образуют подходящие соли, включают хлористо-водородную,-3 018412 бромисто-водородную, серную и фосфорную кислоту и кислые соли металла, такие как двузамещенный ортофосфат натрия и однозамещенный сульфат калия. Примеры органических кислот, которые образуют подходящие соли, включают моно-, ди- и трикарбоновые кислоты. Примерами таких кислот являются,например, уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная, коричная, салициловая, 2-феноксибензойная, паратолуолсульфоновая кислота и другие сульфоновые кислоты, такие как метансульфоновая кислота и 2-гидроксиэтансульфоновая кислота. Если это химически возможно, можно образовывать моно- или дикислые соли, и такие соли могут существовать либо в гидратированной или сольватированной, либо в существенно безводной форме. В общем, соли присоединения кислоты к этим соединениям являются более хорошо растворимыми в воде и различных гидрофильных органических растворителях и обычно демонстрируют более высокие точки плавления при сравнении с их формами, представляющими собой свободное основание. Другие соли, например оксалаты, можно использовать, например, при выделении соединений формулы I для лабораторного применения или для последующего превращения в фармацевтически приемлемую соль присоединения кислоты."Сольват" означает соединение формулы I или фармацевтически приемлемую соль соединения формулы I, где молекулы подходящего растворителя включены в состав кристаллической решетки. Подходящий растворитель является физиологически переносимым в дозе введения в виде сольвата. Примеры подходящих растворителей представляют собой этанол, воду и тому подобные. Когда растворителем является вода, молекулу называют гидратом. Термин "стереоизомеры" представляет собой общий термин для всех изомеров индивидуальной молекулы, которые различаются только ориентацией их атомов в пространстве. Он включает в себя зеркальные изомеры (энантиомеры), геометрические (цис/транс) изомеры и изомеры соединений с более чем одним хиральным центром, которые не представляют собой зеркальные образы друг друга (диастереомеры). Термин "лечить" или "лечение" означает облегчение симптомов, удаление причин симптомов либо временное, либо постоянное, или предупреждение или замедление появления симптомов указанного нарушения или состояния. Термин "терапевтически эффективное количество" означает количество соединения, которое является эффективным в лечении указанного нарушения или состояния. Термин "фармацевтически приемлемый носитель" означает нетоксичный растворитель, диспергирующий агент, эксципиент, адъювант или другое вещество, которое смешано с активным ингредиентом для того, чтобы сделать возможным образование фармацевтической композиции, то есть, лекарственной формы, которую можно вводить пациенту. Один пример такого носителя представляет собой фармацевтически приемлемое масло, в типичных случаях используемое для парентерального введения. В объем этого изобретения входят фармацевтически приемлемые соль, гидрат, сольват или их комбинация каждого упомянутого воплощения. Оптически активные формы соединения по этому изобретению можно получать, например, хиральным хроматографическим разделением рацемата, синтезом из оптически активных исходных веществ или асимметрическим синтезом. Специалисту в данной области техники будет понятно, что определенные соединения по настоящему изобретению могут существовать в сольватированной, например, гидратированной, а также в несольватированной форме. Также будет понятно, что настоящее изобретение охватывает все такие сольватированные формы соединений формулы I или формулы II. В объем этого изобретения также входят соли соединений формулы I или формулы II. Фармацевтически приемлемые соли соединений по настоящему изобретению обычно получают при использовании стандартных способов, хорошо известных в данной области. В одном из воплощений настоящего изобретения соединение формулы I или формулы II можно превращать в их фармацевтически приемлемые соль или сольват, такой как гидрохлорид, гидробромид,фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат или паратолуолсульфонат. Способы получения соединений Соединения формулы I можно обычно получать проиллюстрированными здесь синтетическими способами. Выбор конкретных структурных признаков и/или заместителей может влиять на выбор одного процесса вместо другого и может влиять на условия, в которых осуществляют способ. В пределах этих общих указаний описанные здесь способы можно использовать для получения примеров соединений по этому изобретению. Если не указано иное, переменные в описанных схемах и способах имеют те же определения, которое приведены здесь для формул I и II. Во избежание сомнений,в общем, когда упомянута формула I, надо понимать, что этим охвачены соединения формулы II. Таким образом, обычный специалист в данной области должен понимать, что другие соединения формулы I можно получать вариациями и добавлениями, адаптирующими один или более чем один раскрытый здесь способ. Это изобретение дополнительно проиллюстрировано здесь примерами, которые описывают не-4 018412 сколько воплощений этого изобретения. Схема синтеза и синтетические способы, представленные примерами 1 и 2, приведены для иллюстрации и не должны быть поняты как ограничивающие это изобретение. Специалистам должно быть ясно, что способами, аналогичными описанным, можно легко получать другие, чем проиллюстрированные, соединения. Общие способы Исходные вещества имеются в продаже или раскрыты в литературе. 1 Н- и 13 С-ЯМР спектры записывали на спектрометрах Bruker 300, или Bruker DPX400, или Varian+400, работающих для 1H-ЯМР при 300, 400 и 500 МГц соответственно, при использовании сигнала отTMS или остаточного растворителя в качестве опорного в дейтерированном хлороформе в качестве растворителя, если не указано иное. Все указанные химические сдвиги представлены в м.д. на -шкале, а тонкое расщепление сигналов указано так, как оно появляется при регистрации (s: синглет, br s: широкий синглет, d: дублет, t: триплет, q: квартет, m: мультиплет). Результаты разделения аналитической жидкостной хроматографией в линии с последующим детектированием масс-спектров записывали на жидкостном хроматографе/масс-спектрометре Waters, состоящем из Alliance 2795 (жидкостная хроматография) и единственного квадрупольного масс-спектрометраZQ. Масс-спектрометр был снабжен элекрораспылительным источником ионов, работающим в режиме положительных и/или отрицательных ионов. Вольтаж ионного распыления был 3 кВ, и массспектрометр проводил сканирование от m/z 100-700 за время 0,8 с. К колонке, X-Terr MS, Waters, C8,2,150 мм, 3,5 мм, прилагали линейный градиент от 5 до 100% ацетонитрила в 10 мМ ацетате аммония(водном) или в от 0,05 до 0,1%-ной муравьиной кислоте (водной). Очистку продуктов осуществляли при использовании картриджей Silicycle SilicaFlash (номер по каталогу FLH-R10030B) на автоматической системе флэш-хроматографии ISCO или флэш-хроматографией на заполненных кремнеземом стеклянных колонках. Микроволновое нагревание осуществляли в однорежимной микроволновой ячейке Emrys Optimizer,продуцирующей непрерывное облучение при 2450 МГц (Personal Chemistry AB, Uppsala, Sweden). Условия ВЭЖХ для жидкостной хроматографии/масс-спектрометрии. Способ А. Колонка: Waters Acquity UPLC BEH-C18, 1,7 мкм, 2,1 мм ВД 50 мм; поток: 1,0 мл/мин. Градиент: 95% А до 95% В в течение 0,9 мин, удерживание 0,3 мин, постепенное снижение до 95% А за 0,1 мин, градиент стандартный линейный, где А = 2% ацетонитрила в воде с 0,1% муравьиной кислоты,В = 2% воды в ацетонитриле с 0,05% муравьиной кислоты. Детектирование в УФ диодной матрице при 210-400 нм. Способ В. Колонка: Agilent Zorbax SB-C8, 5 мкм, 2,1 мм ВД 50 мм; поток 1,4 мл/мин. Градиент: 95% А до 90% В в течение 3 мин, удерживание 1 мин, постепенное снижение до 95% А за 1 мин и удерживание 1 мин, градиент стандартный линейный, где А = 2% ацетонитрила в воде с 0,1% муравьиной кислоты, В = 2% воды в ацетонитриле с 0,05% муравьиной кислоты. Детектирование в УФ диодной матрице при 210-400 нм. Приборы, способы и условия, описанные здесь, приведены для иллюстрации, и их не надо понимать как ограничивающие это изобретение. Специалисты в данной области должны понимать, что другие приборы и способы можно использовать для осуществления описанных измерений или разделений. Синтетические способы Схема 1 иллюстрирует репрезентативный синтез метилового эфира 6-замещенной 4-бром-2 бромметилбензойной кислоты из имеющихся в продаже предшественников, где соответствующие стадии взаимодействия включают в себя следующее: (a) NaNO2, водный HCl; (б) NaCN, CuCN и HCl; (в) NaOH;(г) нитрозосерная кислота; (д) MeI и K2CO3; (е) NBS и (PhCO2)2. Вкратце, 4-броманилин можно диазотировать в условиях реакции Сандмейера (Sandmeyer) с последующим превращением в нитрил с использованием цианида натрия и цианида меди. Нитрил можно затем гидролизовать до амида щелочным гидролизом. Амид можно затем гидролизовать нитрозосерной кислотой с получением бензойной кислоты, которую можно превратить в метиловый эфир в стандартных условиях. Бензильную метильную группу можно монобромировать N-бромсукцинимидом с использованием бензоилпероксида в качестве инициатора радикалов с получением желаемого метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты. Схема 1 Метиловый эфир 6-замещенной 4-бром-2-бромметилбензойной кислоты можно циклизовать в изоиндолон амином или хиральным амином, если желательным является хиральное соединение, (ж)CH3CHR2NH2, K2CO3, В(ОН)3, как показано на схеме 2. Схема 2 Соединение формулы I (или формулы II) можно получить из изоиндолона серией стадий взаимодействий, как показано на схеме 3, следующим образом: (з) Pd(BnCN)2Cl2, TMS- , Cu(ОАс)2, PPh3 в диизопропиламине при слабом нагревании в течение 2 ч; (и) KOH, EtOH/H2O, 1 ч при комнатной температуре (к.т.); (к) этил-2-хлор-2-(гидроксиимино)ацетат, KHCO3, ЕА/H2O, 16 ч при к.т. и (л) NaOH,МеОН/H2O, 1 ч при к.т., с последующим (м) IBCF, NMM, R3R4NH в THF при -20C. Вкратце, 4-бромизоиндолон можно приводить во взаимодействие в условиях Сонагашира (Sonagashira) с защищенным ацетиленом. Снятием защиты с ацетилена с использованием основания с последующим взаимодействием с этил-2-хлор-2-(гидроксиимино)ацетатом можно получить изоксазоловый сложный эфир. Наконец, гидролиз этого сложного эфира до кислоты и амидирование с использованием изобутилхлорформиата, Nметилморфолина и соответствующего амина позволит получить желаемый амид. Альтернативно, амид можно получить через изоксазоловый сложный эфир непосредственно на стадии (н) взаимодействием с амином R3R4NH в этаноле и нагреванием. Схема 3 Раствор этил-5-(7-хлор-2-S)-1-циклопропилэтил)-1-оксоизоиндолин-5-ил)изоксазол-3-карбоксилата (29,59 г, 78,94 ммоль) в этаноле (500 мл) обрабатывали 33%-ным этанольным раствором диметиламина (352 мл, 1973,6 ммоль). Получившийся светло-зеленый раствор осторожно нагревали приблизительно 3 ч при достаточном нагревании для поддержания прозрачности раствора (приблизительно 50C). Эту реакционную смесь охлаждали до комнатной температуры и летучие вещества удаляли при пони-6 018412 женном давлении. Вещество очищали флэш-хроматографией на силикагеле при элюции градиентом от 0 до 50% этилацетата в метиленхлориде с получением желаемого соединения. Выделенный продукт затем подвергали дополнительной стадии очистки кристаллизацией в этаноле. 5-(7-Хлор-2-S)-1 циклопропилэтил)-1-оксоизоиндолин-5-ил)-N,N-диметилизоксазол-3-карбоксамид (34,88 г, 93,30 ммоль) собирали приблизительно в 350 мл этанола и нагревали до 70-80C, пока не растворяли весь продукт. Раствор быстро фильтровали через среднюю стеклообразную фритту, снова нагревали до 70-80C и фильтровали через бумажный фильтр (Whatman1). Фильтрат снова нагревали до 70-80C для обеспечения прозрачности раствора и давали ему медленно охлаждаться до комнатной температуры (конечный объем растворителя был 450 мл). После отстаивания в течение ночи образовывались мелкие кристаллы продукта, указанного в заголовке. Смесь охлаждали в холодильнике в течение дополнительных 2 ч. Кристаллы выделяли фильтрованием, промывали холодным этанолом и сушили под высоким вакуумом при комнатной температуре с получением белых мелких игловидных кристаллов (27,21 г, 78%). Т. пл. 143,5C. 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 0.21-0.32 (m, 1H), 0.35-0.50 (m, 2H), 0.53-0.67 (m, 1H), 1.16 (dd,1H), 1.30 (d, 3H), 3.06 (s, 3H), 3.14 (s, 3H), 3.59 (dd, 1H), 4.62 (s, 2H), 7.50 (s, 1H), 8.06 (s, 1 Н), 8.11 (s, 1 Н). Масс-спектрометрия при электрораспылительной ионизации (MS-ESI), m/z = 374 (М+Н). ВЭЖХ способ В: 0,70 мин. Промежуточные соединения получали следующим образом. а) Этил-5-(7-хлор-2-S)-1-циклопропилэтил)-1-оксоизоиндолин-5-ил)изоксазол-3-карбоксилат. 7-Хлор-2-S)-1-циклопропилэтил)-5-этинилизоиндолин-1-он (28,66 г, 110,35 ммоль) и бикарбонат калия (110,0 г, 1103,45 ммоль) растворяли в растворе, состоящем из 1200 мл этилацетата и 400 мл воды. К этому раствору добавляли этил-2-хлор-2-(гидроксиимино)ацетат (66,9 г, 441,38 ммоль). Добавляли при комнатной температуре этил-2-хлор-2-(гидроксиимино)ацетат в виде раствора в 160 мл этилацетата шприцевым насосом при скорости 5 мл/ч. После добавления этил-2-хлор-2 (гидроксиимино)ацетата давали этой реакционной смеси перемешиваться при комнатной температуре в течение дополнительных 12 ч. Этилацетатный слой экстрагировали в делительной воронке, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Вещество очищали флэш-хроматографией на силикагеле при элюции градиентом от 0 до 25% этилацетата в гексане с получением соединения, указанного в заголовке, в виде белого твердого вещества (17,05 г, 41,2%). 1MS ESI, m/z = 375 (М+Н). ВЭЖХ способ В: 0,82 мин. б) 7-Хлор-2-S)-1-циклопропилэтил)-5-этинилизоиндолин-1-он. Растворяли 7-хлор-2-S)-1-циклопропилэтил)-5-(2-(триметилсилил)этинил)изоиндолин-1-он (40,88 г, 123,17 ммоль) в 250 мл этанола и перемешивали при комнатной температуре. К реакционной смеси добавляли раствор гидроксида калия (0,10 г, 1,85 ммоль) в 20 мл воды. Реакционная смесь немедленно становилась черной, и ей давали перемешиваться в течение 90 мин при комнатной температуре. Летучие вещества удаляли при пониженном давлении и продукт очищали флэш-хроматографией на силикагеле при элюции градиентом от 0 до 40% этилацетата в гексане. Это дало желаемый продукт в виде светлокоричневого твердого вещества (20,75 г, 69,7%). 1MS ESI m/z = 260 (М+Н). ВЭЖХ способ В: 0,80 мин. в) 7-Хлор-2-S)-1-циклопропилэтил)-5-(2-(триметилсилил)этинил)изоиндолин-1-он. 5-Бром-7-хлор-2-S)-1-циклопропилэтил)изоиндолин-1-он (5,0 г, 15,89 ммоль) помещали в трехгорлую колбу, снабженную внутренней термопарой, и растворяли в 150 мл дегазированного диизопропиламина. К этому раствору добавляли ацетат меди(II) (0,14 г, 0,79 ммоль), трифенилфосфин (0,417 г,1,59 ммоль) и бис(бензонитрил)дихлорпалладий(II) (0,30 г, 0,79 ммоль). Наконец, добавляли этинилтриметилсилан (4,84 мл, 34,96 ммоль) по каплям в течение 20 мин. После завершения добавления силана реакционную смесь нагревали до 65C и поддерживали эту температуру, пока исходное вещество не было израсходовано (мониторинг жидкостной хроматографией/масс-спектрометрией). Этой реакционной смеси давали охладиться до комнатной температуры и летучие вещества удаляли при пониженном давлении. Вещество затем фильтровали через стеклообразную фритту, и оставшиеся на фритте твердые вещества промывали диэтиловым эфиром. Летучие вещества снова удаляли при пониженном давлении и концентрированный остаток очищали флэш-хроматографией на силикагеле при элюции градиентом от 0 до 40% этилацетата в гексане. Это позволило получить соединение, указанное в заголовке, в виде светлокоричневого твердого вещества (4,90 г, 93%). 1 Этил-5-(7-хлор-2-S)-1-циклопропилэтил)-1-оксоизоиндолин-5-ил)изоксазол-3-карбоксилат (4,00 г,10,67 ммоль) помещали в 200-мл сосуд под давлением с последующим добавлением этанола (20 мл) и 33%-ного этанольного раствора метиламина (57,2 мл, 320,16 ммоль). Раствор нагревали до 55C и поддерживали эту температуру в течение 10 мин и затем охлаждали до комнатной температуры. Образовавшийся осадок собирали фильтрованием и сушили в течение ночи при 40C в вакуумной камере. Оставшийся этанол удаляли из выделенного продукта растворением твердого вещества в минимальном количестве метиленхлорида при последующем удалении летучих веществ при пониженном давлении с получением соединения, указанного в заголовке (3,46 г, 90%), т. пл. 212,3C. 1H-ЯМР (300 МГц, CDCl3)м.д. 0.28-0.46 (m, 3H), 0.54-0.64 (m, 1H), 0.90-1.02 (m, 1H), 1.30 (d, 3H),2.98 (d, 3H), 3.64-3.80 (m, 1H), 4.35-4.57 (m, 2H), 6.76 (d, 1H), 7.00 (s, 1H), 7.69 (s, 1H), 7.75 (s, 1H). Масс-спектрометрия при химической ионизации при атмосферном давлении (MS APCI), m/z = 360(М+Н). ВЭЖХ способ В: 2,19 мин. Соединения примеров от 3 до 21, проиллюстрированные в табл. 1, синтезировали в соответствии со способами, описанными здесь, с использованием подходящих промежуточных соединений. Пример 3. Амид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 4. Амид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 5. Диметиламид 5-(2-изопропил-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)изоксазол 3-карбоновой кислоты. Пример 6. Метиламид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5 ил]изоксазол-3-карбоновой кислоты. Пример 7. Амид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 8. Диметиламид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1H-изоиндол-5 ил]изоксазол-3-карбоновой кислоты. Пример 9. 7-Хлор-2-изопропил-5-[3-(пирролидин-1-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол-1-он. Пример 10. (2-Гидроксиэтил)метиламид 5-(7-хлор-2-изопропил-1-оксо-2,3-дигидро-1H-изоиндол-5 ил)изоксазол-3-карбоновой кислоты. Пример 11. Диметиламид 5-[7-метил-1-оксо-2-S)-2,2,2-трифтор-1-метилэтил)-2,3-дигидро-1Hизоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 12. Изопропилметиламид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро-1Hизоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 13. (2-Гидроксиэтил)метиламид 5-[2-S)-1-циклопропилэтил)-7-метил-1-оксо-2,3-дигидро 1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 14. Циклопентиламид 5-(7-хлор-2-изопропил-1-оксо-2,3-дигидро-1H-изоиндол-5-ил)изоксазол-3-карбоновой кислоты. Пример 15. 7-Хлор-2-изопропил-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2,3-дигидроизоиндол 1-он. Пример 16. 2-S)-1-Циклопропилэтил)-7-метил-5-[3-(пиперазин-1-карбонил)изоксазол-5-ил]-2,3 дигидроизоиндол-1-он. Пример 17. Диметиламид 5-[7-хлор-1-оксо-2-S)-2,2,2-трифтор-1-метилэтил)-2,3-дигидро-1Hизоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 18. Изопропилметиламид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1Hизоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 19. (2-Гидроксиэтил)метиламид 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро 1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты. Пример 20. 7-Хлор-2-S)-1-циклопропилэтил)-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2,3 дигидроизоиндол-1-он. Пример 21. 7-Хлор-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2-S)-2,2,2-трифтор-1-метилэтил)2,3-дигидроизоиндол-1-он. Мол. масса: рассчитанная молекулярная масса. М+Н: измеренная масса. ВУ: время удерживания в ВЭЖХ, мин. Способ А использовали для примера 1 и способ В для примеров 2-21 включительно. Фармацевтические композиции Описанные здесь соединения обычно можно изготавливать в виде фармацевтической композиции,содержащей соединение формулы I или его фармацевтически приемлемые соль или сольват вместе с фармацевтически приемлемыми носителем или эксципиентом. Фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Твердые препараты включают в себя, без ограничения, порошки, таблетки, диспергируемые гранулы, капсулы, облатки и суппозитории. Твердый носитель может представлять собой одно или более чем одно вещество, которое может также действовать как разбавитель, ароматизатор, стабилизатор, смазывающее вещество, суспендирующий агент, связующий агент или разрыхлитель. Твердый носитель может также быть инкапсулирующим веществом. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным соединением, представляющим собой активный компонент. В таблетках активный компонент смешан с носителем, имеющим необходимые связующие свойства, в подходящих пропорциях и спрессован в желаемую форму и размер. Для получения композиции в виде суппозитория низкоплавкий воск, такой как смесь глицеридов жирных кислот и масла какао, сначала расплавляют и активный ингредиент диспергируют в нем, например, перемешиванием. Расплавленную гомогенную смесь затем вливают в форму подходящего размера и дают ей остыть и затвердеть. Подходящие носители включают, без ограничения, карбонат магния, стеарат магния, тальк, лактозу, сахар, пектин, декстрин, крахмал, трагакант, метилцеллюлозу, натрий карбоксиметилцеллюлозу, низкоплавкий воск, масло какао и тому подобное. Термин композиция также включает препарат активного компонента с инкапсулирующим веществом в качестве носителя, обеспечивающего капсулу, в которой активный компонент (с другими носителями или без них) окружен носителем, который, таким образом, находится в ассоциации с ним. Аналогичным образом сюда включены облатки. Таблетки, порошки, облатки и капсулы можно получать в качестве твердых лекарственных форм,подходящих для перорального введения. Жидкие композиции включают растворы, суспензии и эмульсии. Например, стерильные растворы активных соединений в воде или водном пропиленгликоле могут представлять собой жидкие препараты,подходящие для парентерального введения. Жидкие композиции можно также готовить в виде раствора в водном растворе полиэтиленгликоля. Водные растворы для перорального введения можно получать растворением активного компонента в воде и добавлением подходящих красителей, ароматизаторов, стабилизаторов и загустителей, как желательно. Водные суспензии для перорального применения можно получать диспергированием тонкоизмельченного активного компонента в воде вместе с вязким веществом, таким как природные и синтетические камеди, смолы, метилцеллюлоза, натрий карбоксиметилцеллюлоза и другие суспендирующие агенты, известные в области фармацевтических препаратов. Примеры композиции, предназначенной для перорального применения, могут содержать один или более чем один краситель, подсластитель, ароматизатор и/или консервант. В зависимости от способа введения фармацевтическая композиция должна включать в себя от около 0,05 до около 99 мас.%, более конкретно от около 0,10 до 50 мас.% соединения по этому изобретению,причем все проценты по массе основаны на суммарной массе композиции. Терапевтически эффективное количество для практического использования настоящего изобретения может быть определено обычным специалистом в данной области с использованием известных критериев, включая возраст, массу тела и ответную реакцию индивидуального пациента, интерпретируемых в контексте заболевания, которое лечат или предупреждают. Медицинские применения Соединения, описанные здесь, проявляют активность как модуляторы метаботропных глутаматных рецепторов и, более конкретно, проявляют активность как потенциирующие средства для mGluR2 рецептора. Предполагают, что эти соединения будут полезными в терапии в качестве фармацевтических средств, в частности для лечения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией, у животного и, конкретно, у человека. Более конкретно, неврологические и психиатрические нарушения включают, без ограничения, такие нарушения, как церебральный дефицит вследствие операции по шунтированию и трансплантации сердца, инсульта, церебральной ишемии, травмы спинного мозга, травмы головы, перинатальной гипоксии, остановки сердца, гипогликемического нейронального повреждения, деменцию (включая СПИДиндуцированную деменцию), болезнь Альцгеймера, хорею Хантингтона, амиотрофический боковой склероз, повреждение глаз, ретинопатию, когнитивные нарушения, идиопатическую и ятрогенную болезни Паркинсона, мышечные спазмы и нарушения, ассоциированные с мышечной спастичностыо, в том числе треморы, эпилепсию, конвульсии, церебральные дефициты, вторичные по отношению к длительному эпилептическому припадку, мигрень (включая головную боль при мигрени), недержание мочи, толерантность к веществам, синдром отмены вещества (включая такие вещества как опиаты, никотин, табачные продукты, спирт, бензодиазепины, кокаин, успокаивающие средства, снотворные средства и т.д.),психоз, шизофрению, тревогу (включая генерализованную тревогу, паническое расстройство, социальную фобию, обсессивно-компульсивное расстройство и посттравматический стресс (PTSD, расстройства настроения (включая депрессию, манию, биполярные расстройства), нарушения циркадного ритма(включая последствия смены часовых поясов и сменной работы), невралгию тройничного нерва, потерю слуха, звон в ушах, макулярную дегенерацию глаз, рвоту, отек мозга, боль (включая острые и хронические болевые состояния, сильную боль, неустранимую боль, нейропатическую боль, воспалительную боль и посттравматическую боль), позднюю дискинезию, расстройства сна (в том числе нарколепсию),синдром дефицита внимания с гиперактивностью и нарушение поведения. Таким образом, в этом изобретении предложено применение любого соединения формулы I или его фармацевтически приемлемых соли или сольвата для изготовления лекарственного средства для лечения любого состояния, упомянутого выше. Дополнительно в этом изобретении предложен способ лечения субъекта, страдающего любым состоянием, упомянутым выше, при котором эффективное количество соединения формулы I или его фармацевтически приемлемых соли или сольвата вводят пациенту, нуждающемуся в таком лечении. В этом изобретении также предложено соединение формулы I или его фармацевтически приемлемые соль или сольват, как определено здесь выше, для применения в терапии. В контексте настоящего описания термин "терапия" также включает "профилактику", если нет конкретных указаний на иное. Термин "терапевтический" и "терапевтически" следует понимать соответственно. Термин "терапия" в контексте настоящего изобретения дополнительно охватывает введение эффективного количества соединения по настоящему изобретению либо для смягчения уже существующего заболевания, острого или хронического, либо для смягчения рекуррентного состояния. Это определение также охватывает профилактические терапии для предупреждения рекуррентных состояний и продолжение терапии хронических нарушений. При использовании для терапии теплокровного животного, такого как человек, соединения по настоящему изобретению можно вводить в форме общепринятых фармацевтических композиций любым способом, включая пероральный, внутримышечный, подкожный, местный, интраназальный, внутрибрюшинный, внутрь грудной клетки, внутривенный, эпидуральный, в мозговые оболочки, внутрь мозговых желудочков и инъекцию в суставы. В предпочтительных воплощениях этого изобретения способ введения представляет собой пероральный, внутривенный или внутримышечный. Дозировка будет зависеть от пути введения, тяжести заболевания, возраста и массы тела пациента и других факторов, обычно учитываемых лечащим врачом, который определяет индивидуальный режим и уровень дозировки для конкретного пациента. Как упомянуто выше, описанные здесь соединения можно предоставлять или доставлять в форме,подходящей для перорального применения, например в таблетке, лепешке, твердой и мягкой капсуле,водном растворе, масляном растворе, эмульсии и суспензии. Альтернативно, соединения можно приготавливать для местного введения, например в виде крема, мази, геля, спрея или водного раствора, масляного раствора, эмульсии или суспензии. Описанные здесь соединения можно также предоставлять в форме, которая является подходящей для введения в нос, например, в виде интраназального спрея, капель в нос или сухого порошка. Соединения можно вводить во влагалище или прямую кишку в форме суппозитория. Описанные здесь соединения также можно вводить парентерально, например внутривенной, внутрипузырной, подкожной или внутримышечной инъекцией или инфузией. Соединения можно вводить инсуффляцией (например, в виде тонкоизмельченного порошка). Соединения можно также вводить через кожу или сублингвально. Кроме применения в терапевтической медицине, соединения формулы I или их соли являются полезными в качестве фармакологических средств в разработке и стандартизации тест-систем in vitro и invivo для оценки эффектов ингибиторов активности, связанной с mGluR, у лабораторных животных как части поисков новых терапевтических агентов. К числу таких животных относятся, например, кошки,собаки, кролики, обезьяны, крысы и мыши. Соединение формулы I или его фармацевтически приемлемые соль, сольват или гидролизуемый invivo сложный эфир или фармацевтическую композицию или препарат, содержащий соединение формулы I, можно вводить одновременно, совместно, последовательно или отдельно с другим фармацевтически активным соединением или соединениями, выбранными из следующих:(2) атипичные антипсихотические средства, в том числе, например, кветиапин и его фармацевтически активные изомер(ы) и метаболит(ы);(6) терапевтические средства против болезни Альцгеймера, в том числе, например, донепезил, мемантин, такрин и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(7) терапевтические средства против болезни Паркинсона, в том числе, например, депренил, L-допа,Реквип, Мирапекс, ингибиторы моноаминоксидазы В (МАОВ), такие как селегин и разагилин, ингибиторы катехол-о-метилтрансферазы (comP), такие как Тасмар, ингибиторы А-2, ингибиторы обратного захвата дофамина, антагонисты N-метил-D-аспартата (NMDA), никотиновые агонисты, дофаминовые агонисты и ингибиторы нейрональной синтазы оксида азота и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(8) терапевтические средства против мигрени, в том числе, например, алмотриптан, амантадин,бромкриптин, буталбитал, каберголин, дихлоралфеназон, элетриптан, фроватриптан, лисурид, наратриптан, перголид, прамипексол, ризатриптан, ропинирол, суматриптан, золмитриптан, зомитриптан и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(9) терапевтические средства против инсульта, в том числе, например, абциксимаб, активаза, NXY059, цитиколин, кробенетин, десмотеплаза, репинотан, траксопродил и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(10) терапевтические средства против недержания мочи, в том числе, например, дарафенацин, фалвоксат, оксибутинин, пропиверин, робалзотан, солифенацин, толтеродин и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(11) терапевтические средства против невропатической боли, в том числе, например, габапентин,лидодерм, прегабалин и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(12) терапевтические средства против ноцицептивной боли, такие как целекоксиб, эторикоксиб, лумиракоксиб, рофекоксиб, вальдекоксиб, диклофенак, локсопрофен, напроксен, парацетамол и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(13) терапевтические средства против бессонницы, в том числе, например, аллобарбитал, алонимид,амобарбитал, бензоктамин, бутабарбитал, капурид, хлорал, клоперидон, клоретат, декскламол, этхлорвинол, этомидат, глутетимид, галазепам, гидроксизин, меклоквалон, мелатонин, мефобарбитал, метаквалон,мидафлур, низобамат, пентобарбитал, фенобарбитал, пропофол, ролетамид, триклофос, секобарбитал,залеплон, золпидем и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы), или(14) нормотимики, в том числе, например, карбамазепин, дивалпроекс, габапентин, ламотригин, литий, оланзапин, кветиапин, вальпроат, вальпроевая кислота, верапамил и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы). В таких комбинированных продуктах используют соединение по этому изобретению в пределах описанного здесь диапазона дозировки и другие фармацевтически активные соединения или соединения в пределах одобренных диапазонов дозировки и/или в дозировке, описанной в ссылке на публикацию. Биологические анализы Фармакологические свойства соединений по этому изобретению можно анализировать с использованием стандартных анализов функциональной активности. Примеры анализов глутаматных рецепторов хорошо известны в данной области, как описано, например, в Aramori et al., 1992, Neuron, 8:757; Tanabeet al., 1992, Neuron, 8:169; Miller et al., 1995, J. Neuroscience, 15:6103; Balazs, et al., 1997, J. Neurochemistry,1997,69:151. Методология, описанная в этих публикациях, включена сюда ссылкой. Удобным является то, что соединения по этому изобретению можно изучать при использовании анализа, который измеряет мобилизацию внутриклеточного кальция [Ca+]i в клетках, экспрессирующих mGluR2. Активность hERG оценивали с использованием способа, описанного в Bridgland-Taylor, M.H., et al.,J. Pharm. Tox. Methods 54 (2006) 189-199. Растворимость определяли в фосфатном буфере при рН 7,4 после уравновешивания в течение 24 ч при 25C и для количественного анализа использовали ВЭЖХ-УФ и ЖХ-МСМС. Для функциональной оценки активации mGluR2-рецептора использовали анализ связывания [35S]GTP S. Активность соединений как аллостерических активаторов человеческого mGluR2-рецептора измеряли с использованием анализа связывания [35S]-GTP S с мембранами, полученными из клеток СНО(яичника китайского хомячка), которые стабильно экспрессировали человеческий mGluR2. Анализ основан на принципе, что агонисты связываются с рецепторами, сопряженными с G-белком, стимулируя обмен GDP-GTP на G-белке. Поскольку [35S]-GTP S является негидролизуемым аналогом GTP, его можно использовать для получения индекса обмена GDP-GTP и, таким образом, активации рецептора. Поэтому анализ связывания GTP S дает количественную меру активации рецептора. Мембраны получали из клеток СНО, стабильно трансфецированных человеческим mGluR2. Мембраны (30 мкг белка) инкубировали с тестируемым соединением (от 3 нМ до 300 мкМ) в течение 15 мин при комнатной температуре перед добавлением 1 мкМ глутамата и инкубировали в течение 30 мин при 30C в 500 мкл буфера для анализа (20 мМ FIEPES, 100 мМ NaCl, 10 мМ MgCl2), содержащего 30 мкМGDP и 0,1 нМ [35S]-GTP S (1250 Ки/ммоль). Взаимодействия осуществляли в трех параллелях в 2-мл полипропиленовых 96-луночных планшетах. Взаимодействия прекращали вакуумным фильтрованием с использованием 96-луночного коллектора Packard и фильтровальных микропланшетов Unifilter-96 GF/B. Фильтровальные планшеты промывали 4 раза с использованием 1,5 мл ледяного промывочного буфера(10 мМ натрий-фосфатный буфер, рН 7,4). Фильтровальные планшеты сушили и в каждую лунку добавляли 35 мкл сцинтилляционной жидкости (Microscint 20). Количество связанной радиоактивности определяли считыванием планшетов в Packard TopCount. Данные анализировали с использованием GraphPadPrism, и величины EC50 и Емакс (относительно максимального эффекта глутамата) вычисляли, используя нелинейную регрессию. Как проиллюстрировано ниже в табл. 2, в общем, описанные здесь соединения имеют благоприятную растворимость и низкую способность активировать ионный канал hERG и были высокоактивными в описанных здесь анализах активности модулятора mGluR2, имея показанные ниже величины ЕС 50. Таблица 2R3 и R4, в каждом случае независимо, выбраны из водорода, C1-3 алкила, C1-3 гидроксиалкила или C3-6 карбоциклила или R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолина, пирролидина или пиперазина; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где R2 представляет собой трифторметил или циклопропил, формулы II где R1 выбран из метила или хлора;R3 и R4, в каждом случае независимо, выбраны из водорода, метила, изопропила, 2-гидроксиэтила,циклопентила или циклогексила или R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолина, пирролидина или пиперазина. 3. Соединение формулы I по п.1, где R2 представляет собой метил. 4. Соединение формулы I по п.1,где R1 и R2 представляют собой метил;R3 и R4 вместе с азотом, к которому они присоединены, образуют циклическую группировку, выбранную из морфолина иди пирролидина. 5. Соединение формулы II по п.2,где R1 представляет собой хлор;R2 представляет собой трифторметил или циклопропил;R3 и R4, в каждом случае независимо, выбраны из водорода, метила или изопропила. 6. Соединение формулы II по п.2,где R1 выбран из метила или хлора;R2 выбран из трифторметила или циклопропила;R3 представляет собой водород или метил и(2-гидроксиэтил)метиламида 5-[7-хлор-2-S)-1-циклопропилэтил)-1-оксо-2,3-дигидро-1H-изоиндол-5-ил]изоксазол-3-карбоновой кислоты или 7-хлор-5-[3-(морфолин-4-карбонил)изоксазол-5-ил]-2-S)-2,2,2-трифтор-1-метилэтил)-2,3 дигидроизоиндол-1-она. 8. Соединение по любому из пп.1-7 в форме фармацевтически приемлемой соли. 9. Способ получения соединения по любому из пп.1-8, включающий превращение 4-броманилина в соответствующий нитрил в условиях реакции Сандмейера (Sandmeyer); превращение нитрила в амид гидролизом в присутствии основания; диазотирование амида и затем гидролиз нитросерной кислотой с получением бензойной кислоты; защита бензойной кислоты в виде метилового эфира; монобромирование бензильной метильной группы N-бромсукцинимидом с использованием бензоилпероксида в качестве инициатора радикалов с получением метилового эфира 6-замещенной 4-бром-2 бромметилбензойной кислоты; циклизация метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты в 4 бромизоиндолон с использованием амина; взаимодействие 4-бромизоиндолона в условиях Сонагашира (Sonagashira) с защищенным ацетиленом; снятие защиты с ацетилена с использованием основания; взаимодействие незащищенного ацетилена с этил-2-хлор-2-(гидроксиимино)ацетатом с получением изоксазолового сложного эфира и гидролиз этого сложного эфира до кислоты и амидирование изобутилхлорформиатом и Nметилморфолином и соответствующим амином для получения амида формулы I. 10. Способ получения соединения по любому из пп.1-8, включающий превращение 4-броманилина в соответствующий нитрил в условиях реакции Сандмейера (Sandmeyer); превращение нитрила в амид гидролизом в присутствии основания; диазотирование амида и затем гидролиз нитросерной кислотой с получением бензойной кислоты; защита бензойной кислоты в виде метилового эфира; монобромирование бензильной метальной группы N-бромсукцинимидом с использованием бензоилпероксида в качестве инициатора радикалов с получением метилового эфира 6-замещенной 4-бром-2 бромметилбензойной кислоты; циклизация метилового эфира 6-замещенной 4-бром-2-бромметилбензойной кислоты в 4 бромизоиндолон с использованием амина; взаимодействие 4-бромизоиндолона в условиях Сонагашира (Sonagashira) с защищенным ацетиленом; снятие защиты с ацетилена с использованием основания; взаимодействие незащищенного ацетилена с этил-2-хлор-2-(гидроксиимино)ацетатом с получением изоксазолового сложного эфира и получение амида формулы I из изоксазолового сложного эфира путем взаимодействия с амином и нагревания. 11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 и по меньшей мере один фармацевтически приемлемый носитель или эксципиент. 12. Применение соединения по любому из пп.1-8 в качестве лекарственного средства, обладающего активностью модулятора метаботропных глутаматных рецепторов. 13. Применение соединения по любому из пп.1-8 в изготовлении лекарственного средства для лечения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией. 14. Применение по п.13, где нарушение представляет собой шизофрению. 15. Способ лечения или предупреждения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией, у животного, нуждающегося в таком лечении, включающий стадию введения указанному животному терапевтически эффективного количества соединения по любому из пп.1-8. 16. Способ лечения или предупреждения неврологических и психиатрических нарушений, ассоциированных с глутаматной дисфункцией, у животного, нуждающегося в таком лечении, включающий стадию введения указанному животному терапевтически эффективного количества фармацевтической композиции по п.11. 17. Способ по п.15 или 16, где нарушение представляет собой шизофрению. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/422, A61P 25/00, C07D 209/46, C07D 413/10
Метки: качестве, рецепторов, применение, производные, средств, изоксазола, потенциирующих, метаботропных, глутаматных
Код ссылки
<a href="https://eas.patents.su/17-18412-proizvodnye-izoksazola-i-ih-primenenie-v-kachestve-potenciiruyushhih-sredstv-dlya-metabotropnyh-glutamatnyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные изоксазола и их применение в качестве потенциирующих средств для метаботропных глутаматных рецепторов</a>
Предыдущий патент: Способ получения сверхвысокомолекулярного полиэтилена
Следующий патент: Фармацевтические композиции на основе катехоламиновых производных и их применение
Случайный патент: Светлая магнитная типографская краска для глубокой печати












