Сокристаллы l-пролина и лимонной кислоты (2s,3r,4r,5s,6r)-2-(3-((5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(гидроксиметил)тетрагидро-2h-пиран-3,4,5-триола
Формула / Реферат
1. Сокристалл L-пролина и соединения формулы (I-Х)
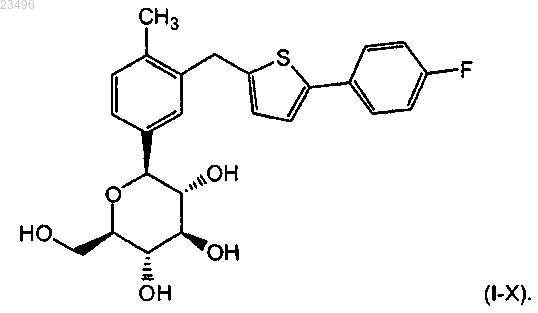
характеризующийся следующими пиками на порошковой рентгенодифрактограмме при следующих значениях угла °2θ: 3,74, 9,50, 10,98, 17,78, 18,62, 21,94, 23,43 и 26,82.
2. Сокристалл L-пролина по п.1, точка плавления которого равна 188°C по результатам измерения методом ДСК.
3. Сокристалл лимонной кислоты и соединения формулы (I-Х)
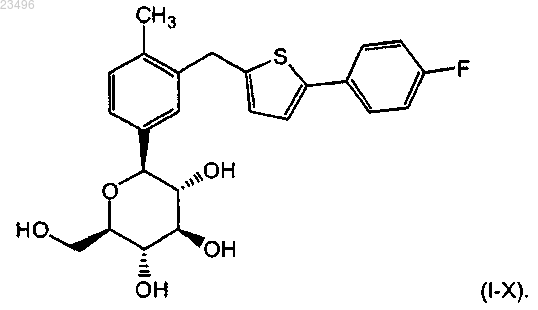
характеризующийся следующими пиками на порошковой рентгенодифрактограмме при следующих значениях угла °2θ: 4,2, 9,16, 12,39, 16,54, 17,69, 19,70, 23,63 и 25,66.
4. Сокристалл лимонной кислоты по п.3, точка плавления которого равна приблизительно 156°C по результатам измерения методом ДСК.
Текст
(2S,3R,4R,5S,6R)-2-(3-5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(гидроксиметил) тетрагидро-2 Н-пиран-3,4,5-триола, фармацевтическим композициям, содержащим указанные сокристаллы и их использованию для лечения заболеваний, связанных с нарушением обмена глюкозы, например сахарного диабета 2 типа и синдрома X.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Отсылки на родственные заявки Данная заявка истребует приоритет предварительной заявки на патент США 61/483887, поданной 9 мая 2011 г., которая полностью включена в настоящий документ путем ссылки. Область применения изобретения Настоящее изобретение относится к сокристаллам L-пролина и лимонной кислоты с(2S,3R,4R,5S,6R)-2-(3-5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(гидроксиметил)тетрагидро-2 Н-пиран-3,4,5-триолом, фармацевтическим композициям, содержащим указанные сокристаллы, и их использованию для лечения заболеваний, связанных с нарушением обмена глюкозы, например, сахарного диабета 2 типа и синдрома X. Предпосылки создания изобретения Сахарный диабет - медицинский термин, обозначающий повышенный уровень глюкозы в крови. У людей, страдающих диабетом, не вырабатывается или вырабатывается недостаточно инсулина, или отсутствует реакция на инсулин, в результате чего в крови накапливается глюкоза. Наиболее распространенной формой диабета является диабет 2 типа, также называемый сахарным диабетом взрослых или инсулиннезависимым диабетом (NIDDM), с которым связано 90% случаев диабета у взрослых. Однако по мере того, как ожирение и лишний вес начинает встречаться у людей более молодого возраста, диабет 2 типа все чаще преобладает у детей и подростков. Термином "диабет" также могут называться: гестационный диабет, диабет 1 типа и аутоиммунный диабет, называемый ювенильным диабетом, а также диабет типа 1 1/2, также называемый латентным аутоиммунным диабетом взрослых (LADA). Диабет может возникать вследствие неправильного питания или недостатка физической активности (например, сидячего образа жизни), генетических мутаций, повреждения поджелудочной железы, воздействия лекарств(например, препаратов против СПИДа), химических веществ (например, стероидов) или вследствие заболевания (например, муковисцидоза, синдрома Дауна, синдрома Кушинга). Существуют два редких генетических дефекта, приводящих к диабету, которые называются диабетом взрослого типа у молодых(MODY-диабет) и атипичный сахарный диабет (ADM). Сахарный диабет 2 типа (инсулиннезависимый сахарный диабет, или NIDDM) представляет собой метаболическое заболевание, связанное с нарушением регуляции метаболизма глюкозы и устойчивостью к действию инсулина, вызывающее долгосрочные осложнения, затрагивающие глаза, почки, нервы и кровеносные сосуды. Сахарный диабет 2 типа, как правило, развивается во взрослом состоянии (в середине жизни или позднее) и описывается либо как неспособность организма производить достаточное количество инсулина (патология секреции инсулина), либо как неспособность эффективно использовать инсулин (резистентность органов и тканей-мишеней к инсулину). Более конкретно, больные сахарным диабетом 2 типа имеют относительную инсулиновую недостаточность. То есть у таких больных уровень инсулина в плазме крови является нормальным или высоким в абсолютных значениях, но более низким,чем прогнозируемый на основании текущего содержания глюкозы в плазме. Сахарный диабет 2 типа характеризуется следующими клиническими признаками и симптомами: постоянно повышенная концентрация глюкозы в плазме или гипергликемия; полиурия; полидипсия и/или полифагия; хронические микрососудистые осложнения, например, ретинопатия, нефропатия и невропания; и макрососудистые осложнения, например, гиперлипидемия и гипертензия, которые могут привести к слепоте, конечной стадии почечного заболевания, ампутации конечности и инфаркту миокарда. Синдром X, также называемый синдромом резистентности к инсулину (IRS), метаболическим синдромом или метаболическим синдромом X, представляет собой заболевание, являющееся фактором риска развития сахарного диабета 2 типа и сердечно-сосудистых заболеваний, включая непереносимость глюкозы, гиперинсулинемию, устойчивость к инсулину, гипертриглицеридемию, гипертонию и ожирение. Диагностика сахарного диабета 2 типа включает оценку симптомов и измерение содержания глюкозы в моче и крови. Для точной постановки диагноза необходимо определить содержание глюкозы в крови. Более конкретно, стандартным подходом является определение содержания глюкозы в крови натощак. Однако более точным методом, чем определение содержания глюкозы в крови натощак, является оральный глюкозо-толерантный тест (ОГТТ). При сахарном диабете 2 типа наблюдается нарушение толерантности к перорально вводимой глюкозе (НТГ). Таким образом, ОГТТ может помочь в диагностике сахарного диабета 2 типа, хотя обычно в нем нет необходимости (EMANCIPATOR К, Am J Clin Pathol 1999 Nov; pp665-674, Vol. 112 (5) :665-74; Type 2 Diabetes Mellitus, Decision Resources Inc., March 2000). ОГТТ позволяет оценить секреторную функцию бета-клеток поджелудочной железы и чувствительность к инсулину, что помогает диагностировать сахарный диабет 2 типа и оценить тяжесть или прогресс болезни (например, CAUMO, A., et al., J Clin Endocrinol Metab, 2000, pp 4396-4402, Vol. 85(11. Конкретнее, ОГТТ чрезвычайно удобен для определения степени гипергликемии у больных, имеющих несколько пограничных значений концентрации глюкозы в крови натощак, у которых диабет не диагностирован. Кроме того, ОГТТ удобен при обследовании больных с симптомами сахарного диабета 2 типа, у которых необходимо точно установить или отвергнуть возможный диагноз патологии углеводного обмена. Таким образом, нарушение толерантности к глюкозе диагностируется у больных, у которых натощак уровень глюкозы в крови меньше уровня, который требуется для диагностики сахарного диабета 2 типа, но у которых ответ на уровень глюкозы в плазме при ОГТТ находится между показателями здоровых и больных диабетом людей. Нарушение толерантности к глюкозе считается преддиабетным состоянием, поэтому нарушенная толерантность к глюкозе (выявленная при ОГТТ) является надежным прогностическим признаком развития сахарного диабета 2 типа (HAFFNER, Diabet Med 1997 Aug; S.M 14 Suppl 3:S12-8). Сахарный диабет 2 типа является прогрессирующим заболеванием, связанным со снижением функции поджелудочной железы и/или других процессов, зависящих от инсулина, усугубляющееся повышенным уровнем глюкозы в плазме крови. Таким образом, сахарный диабет 2 типа, как правило, имеет длительную преддиабетическую фазу, и в ходе этой фазы различные патофизиологические механизмы могут вызывать патологическую гипергликемию и нарушение толерантности к глюкозе, например, нарушение утилизации глюкозы и эффективности ее использования, нарушение действия инсулина и/или его образования (GOLDBERG, Med Clin North Am 1998 Jul; B. pp805-821, Vol. 82(4. Преддиабетическое состояние с непереносимостью глюкозы, также может быть связано с предрасположенностью к ожирению в области живота, резистентностью к инсулину, гиперлипидемией и повышенным артериальным давлением, то есть синдромом X (GROOP L., et al., Am J Hypertens, 1997 Sep;10(9Pt 2):172S-180S; HAFFNER, S.M., J Diabetes Complications, 1997 Mar-Apr; pp69-76, vol. 11(2); BECKNIELSEN H., et al., Diabet Med, 1996 Sep;13(9 Suppl 6):S78-84). Таким образом, нарушение углеводного обмена играет главную роль в патогенезе сахарного диабета 2 типа и в нарушении толерантности к глюкозе (DIUNNEEN S.F., Diabet Med 1997 Aug; F. 14 Suppl 3:S19-24). Фактически существует целый спектр состояний, от нарушения толерантности к глюкозе и патологического уровня глюкозы в крови натощак до выраженного сахарного диабета 2 типа В(RAMLO-HALSTED et al, Prim Care 1999 Dec; A. Pp. 771-789, vol. 26(4. Раннее начало лечения при повышенном риске развития сахарного диабета 2 типа, направленное на снижение патологической гипергликемии или улучшение толерантности к глюкозе, позволяет предотвратить или замедлить прогресс развития сахарного диабета 2 типа и связанных осложнений, и/или синдрома X. Таким образом, путем эффективного лечения, направленного на нормализацию сниженной толерантности к глюкозе и/или повышенной концентрации глюкозы в крови, можно предотвратить или замедлить прогресс развития сахарного диабета 2 типа или синдрома X. При стандартном лечении нарушений глюкозного обмена, включая сахарный диабет 2 типа и синдром X, основное внимание уделяется поддержанию глюкозы в крови на уровне, как можно более близком к нормальному. В терапию входит диета и физические нагрузки, а при необходимости также терапия противодиабетическими препаратами, инсулином или их сочетанием. Сахарный диабет 2 типа, который не удается контролировать с помощью диеты, лечат оральными противодиабетическими препаратами,включая, без ограничений, сульфонилмочевину (в частности, без ограничений, препараты первого поколения: хлорпропамид, толазамид, толбутамид; второго поколения: глубурид, глипизид; и третьего поколения: глипепирид, бигуанид (например, метформин), тиазолидиндионы (например, росиглитазон, пиоглитазон, тролитазон), ингибиторы альфа-глюкозидазы (например, акарбоза, миглитол), меглитиниды(например, репаглинид), прочие соединения, повышающие чувствительность к инсулину, и/или прочие препараты для лечения ожирения (например, орлистат или субутрамин). В случае синдрома X противодиабетические препараты дополнительно сочетают с фармакологическими агентами, направленными на лечение сопутствующих заболеваний (например, противогипертонические средства, гиполипидимические средства в случае гиперлипидемии). К терапевтическим средствам первой линии относятся метформин и препараты сульфонилмочевины, а также тиазолидиндионы. Монотерапия метформином является вариантом первой линии, в особенности для лечения больных диабетом 2 типа, также страдающих ожирением и/или дислипидемией. Затем при отсутствии должной реакции на метформин часто используют терапию метформином в сочетании с препаратами сульфонилмочевины, тиазолидиндионами или инсулином. Также распространенным вариантом первой линии является монотерапия сульфонилмочевиной(всеми поколениями препаратов). Еще одним вариантом первой линии является применение тиазолидиндионов. Если у больных не наблюдается должная реакция на пероральное применение монотерапии противодиабетическими препаратами, используют сочетания этих препаратов. Если контролировать уровень глюкозы при помощи одних противодиабетических препаратов не удается, используют инсулин, либо как монотерапию, либо в сочетании с пероральным введением противодиабетических средств. Такие же подходы, как вариант, в сочетании с дополнительными (например, с использованием противогипертонических средств) можно использовать для терапии синдрома X. В дополнение к противодиабетическим препаратам лечение может включать дополнительные средства против ожирения, например орлистат, ингибитор панкреатической липазы, предотвращающий расщепление и всасывание жиров; или сибутрамин, подавляющий аппетит и ингибирующий обратный захват серотонина, норэфедрина и дофамина в головном мозге. Прочие потенциальные дополнительные средства против ожирения включают, без ограничений, препараты, подавляющие аппетит за счет адренергических механизмов, например, бензфетамин, фенметразин, фентермин, диэтилпропион, мазиндол,-2 023496 сибутрамин, фенилпропаноламин или эфедрин; средства для подавления аппетита, действующие за счет серотонинергических механизмов, например, квипазин, флуоксетин, сертралин, фенфлурамин или дексфенфлурамин; средства для подавления аппетита, действующие за счет дофаминовых механизмов, например, апоморфин; средства для подавления аппетита, действующие за счет гистаминергических механизмов (например, гистаминомиметики, модуляторы H3 рецептора); средства, повышающие расход энергии, например, агонисты бета-3-адренорецепторов и стимуляторы функции разобщающего белка; лептин и миметики лептина; антагонисты Y-нейропептида; модуляторы рецептора меланокортина-1, 3 и 4; агонисты холецистокинина; миметики глюкагоноподобного пептида-1 (GLP-1) и аналоги (например,Эксендин); андрогены (например, дегидроэпиандростерон и производные, например, этиохоландион),тестостерон, анаболические стероиды (например, оксандролон) и стероидные гормоны; антагонисты рецептора галанина; цитокиновые препараты, например, цилиарный нейротрофический фактор; ингибиторы амилазы; агонисты/миметики энтеростатина; антагонисты орексина/гипокретина; антагонисты урокортина; агонисты бомбезина; модуляторы протеинкиназы А; миметики кортиколиберина; миметики кокаин- и амфетамин-регулируемого транскрипта; миметики кодируемого геном калыдитонина пептида; и ингибиторы синтазы жирных кислот. Сохраняется потребность в разработке эффективной терапии заболеваний, связанных с обменом глюкозы, таких, как повышенная концентрация глюкозы, сахарный диабет 2 типа, синдром X и т.п. Также сохраняется потребность в разработке эффективной терапии заболеваний, связанных с обменом глюкозы, также замедляющей прогрессирование и/или развитие сахарного диабета 2 типа. Изложение сущности изобретения Настоящее изобретение относится к сокристаллам L-пролина и соединения формулы (I-Х) Кроме того, настоящее изобретение относится к сокристаллам лимонной кислоты и соединения формулы (I-Х) Предпочтительно, когда сокристаллы L-пролина и лимонной кислоты с соединением формулы (I-Х) настоящего изобретения находятся в кристаллической форме. Кроме того, настоящее изобретение относится к процессам получения сокристаллов соединения формулы (I-Х), как будет подробнее описано ниже. Иллюстрацией изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и компонент, образующий сокристаллы с соединением формулы (I-Х), как описано в настоящей заявке. Иллюстрацией изобретения является фармацевтическая композиция, изготовленная путем смешивания компонентов, образующих сокристаллы с соединением формулы (I-Х), как описано в настоящей заявке, с фармацевтически приемлемым носителем. Иллюстрацией изобретения является фармацевтическая композиция, содержащая смесь сокристаллов, образующих соединение формулы(I-Х), как описано в настоящей заявке, с фармацевтически приемлемым носителем. Настоящее изобретение также относится к способам лечения и/или профилактики заболеваний, связанных с нарушением обмена глюкозы, при этом указанные методы включают введение нуждающемуся в этом пациенту кристаллических сокристаллов соединения формулы (I-Х), как описано в настоящей заявке. Краткое описание чертежей На фиг. 1 показаны спектры L-пролина (вверху), соединения формулы (I-Х) (внизу) и сокристалловL-пролина и соединения формулы (I-Х) (в середине), полученные методом порошковой рентгеновской дифракции. На фиг. 2 показан характерный спектр с выделенными пиками сокристаллов кристаллического Lпролина и соединения формулы (I-Х), полученный методом порошковой рентгеновской дифракции. На фиг. 3 показаны характерные спектры лимонной кислоты (вверху), соединения формулы (I-Х)(внизу) и сокристаллов кристаллической лимонной кислоты и соединения формулы (I-Х) (в середине),полученные методом порошковой рентгеновской дифракции. На фиг. 4 показан характерный спектр с выделенными пиками сокристаллов кристаллической лимонной кислоты и соединения формулы (I-Х) полученный методом порошковой рентгеновской дифракции. На фиг. 5 показан характерный результат дифференциальной сканирующей калориметрии сокристаллов кристаллического L-пролина и соединения формулы (I-Х). На фиг. 6 показан характерный результат дифференциальной сканирующей калориметрии сокристаллов кристаллической лимонной кислоты и соединения формулы (I-Х). Подробное описание изобретения Настоящее изобретение относится к сокристаллам соединения формулы (I-X) также известного как (2S,3R,4R,5S,6R)-2-(3-5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)6-(гидроксиметил)тетрагидро-2 Н-пиран-3,4,5-триол). Конкретнее, настоящее изобретение относится к сокристаллам L-пролина и соединения формулы (I-Х) и сокристаллам лимонной кислоты и соединения формулы (I-Х). В варианте осуществления настоящего изобретения сокристаллы L-пролина соединения формулы (I-Х) находятся в кристаллической форме. В другом варианте осуществления настоящего изобретения сокристаллы лимонной кислоты соединения формулы (I-Х) находятся в кристаллической форме. Соединение формулы (I-Х) обладает ингибирующим действием на натрийзависимый переносчик глюкозы, например, SGLT2. Соединение формулы (I-Х) может быть изготовлено по процессу, описанному Nomura, S. et al., публикация патента США, US 2005/0233988 Al, опубликовано 20 октября 2005 г,ссылка на которую приведена в настоящем документе. Кроме того, настоящее изобретение относится к способам лечения и/или профилактики заболеваний, связанных с нарушением обмена глюкозы (предпочтительно сахарного диабета 2 типа), при этом указанные методы включают введение нуждающемуся в этом пациенту сокристаллов соединения формулы (I-Х), как описано в настоящей заявке. Используемое в настоящем документе примечание обозначает наличие стереогенного центра. Если соединения в соответствии с настоящим изобретением имеют хотя бы один хиральный центр,то они могут, соответственно, существовать в форме энантиомеров. В тех случаях, когда соединения обладают двумя или более хиральными центрами, они дополнительно могут существовать в форме диастереомеров. Необходимо понимать, что все подобные изомеры и их смеси попадают в рамки настоящего изобретения. Предпочтительно, когда соединение присутствует в виде энантиомера, энантиомер присутствует с энантиомерным избытком, превышающим или равным приблизительно 8 0%, более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 90%, еще более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 95%, еще более предпочтителен энантиомерный избыток, превышающий или равный приблизительно 98%, наиболее предпочтителен энантиомерный избыток, превышающий или равный приблизительно 99%. Подобным образом, если соединение присутствует в виде диастериомера, диастериомер присутствует с избытком, превышающим или равным приблизительно 80%, предпочтительнее, когда избыток диастереомера превышает или равен приблизительно 90%, еще предпочтительнее, когда избыток диастереомера превышает или равен приблизительно 98%, и наиболее предпочтительно, когда избыток диастереомера превышает или равен 99%. Более того, некоторые из кристаллических форм этих соединений могут существовать в виде полиморфов, и в таком качестве, как подразумевается, они также попадают под действие настоящего изобретения. Кроме того, некоторые из соединений могут образовывать сольваты в соединении с водой (например, гидраты) или широко распространенными органическими растворителями, при этом предполагается, что такие сольваты также попадают под действие настоящего изобретения. Если не указано иначе, используемый в настоящем документе термин "изолированная форма" означает, что указанное соединение присутствует в форме, которая отделена от любой твердой смеси с другим соединением (соединениями), системы раствора или биологической среды. В варианте осуществления настоящего изобретения сокристаллы L-пролина и соединения формулы (I-Х) находятся в изолированной форме. В другом варианте осуществления настоящего изобретения сокристаллы лимонной кислоты и соединения формулы (I-Х) находятся в изолированной форме. В настоящей заявке, если не указано иное, термин "по существу чистая форма" означает, что молярный процент примесей в изолированной кристаллической форме менее приблизительно 5%, предпочтительно, менее приблизительно 2%, еще предпочтительнее менее приблизительно 0,5% и наиболее предпочтительно менее приблизительно 0,1%. В варианте осуществления настоящего изобретения сокристаллы L-пролина и соединения формулы (I-Х) присутствуют, по существу, в чистой форме. В другом варианте осуществления настоящего изобретения сокристаллы лимонной кислоты и соединения формулы (I-Х) присутствуют, по существу, в чистой форме. Кроме того, настоящее изобретение относится к способам лечения и профилактики (предпочтительно, предотвращения развития) заболеваний, связанных с нарушением обмена глюкозы, заключающимся во введении нуждающемуся в этом пациенту терапевтически эффективных количеств каких-либо из сокристаллов соединения формулы (I-Х), как описано в настоящей заявке. Способы настоящего изобретения направлены на лечение и/или предупреждение (в том числе замедление развития или возникновения) "нарушений обмена глюкозы". В настоящем документе термин"нарушение обмена глюкозы" будет обозначать любое заболевание, характеризующееся повышением концентрации глюкозы или развивающееся вследствие этого. К нарушениям обмена глюкозы относятся сахарный диабет, диабетическая ретинопатия, диабетическая нейропатия, диабетическая нефропатия,медленное заживление ран, резистентность к инсулину, гипергликемия, гиперинсулинемия, повышенный уровень жирных кислот в крови, повышенный уровень глицерина в крови, гиперлипидемия, ожирение,гипертриглицеридемия, синдром X, осложнения диабета, атеросклероз и гипертония. В частности, "нарушением обмена глюкозы" является сахарный диабет (сахарный диабет типа 1 и типа 2 и т.п.), осложнения диабета (такие как диабетическая ретинопатия, диабетическая нейропатия, диабетическая нефропатия), ожирение и гипергликемия после еды. В одном варианте осуществления настоящего изобретения нарушение обмена глюкозы выбирается из группы, включающей сахарный диабет, диабетическую ретинопатию, диабетическую нейропатию,диабетическую нефропатию, медленное заживление ран, резистентность к инсулину, гипергликемию,гиперинсулинемию, увеличение содержания в крови жирных кислот, гиперлипидемию, ожирение, гипертриглицеридемию, синдром X, осложнения диабета, атеросклероз и гипертонию. В другом варианте осуществления настоящего изобретения нарушение обмена глюкозы выбирается из группы, включающей следующие нарушения: сахарный диабет 1 типа, сахарный диабет 2 типа, диабетическая ретинопатия, диабетическая нейропатия, диабетическая нефропатия, ожирение и гипергликемия после еды. В другом варианте осуществления настоящего изобретения нарушение обмена глюкозы выбирается из группы, включающей следующие нарушения: сахарный диабет 1 типа, сахарный диабет 2 типа, диабетическая ретинопатия, диабетическая нейропатия, диабетическая нефропатия, ожирение и медленное заживление ран. В другом варианте осуществления настоящего изобретения нарушение обмена глюкозы выбирается из группы, включающей следующие нарушения: нарушенный контроль содержания глюкозы, сахарный диабет 2 типа, синдром X, гестационный диабет, резистентность к инсулину,гипергликемия. В другом варианте осуществления настоящего изобретения нарушение обмена глюкозы представляет собой сахарный диабет 2 типа. В другом варианте осуществления нарушение обмена глюкозы выбирается из группы, включающей следующие нарушения: повышенный уровень глюкозы, преддиабетическое состояние, нарушение толерантности к перорально введенной глюкозе, недостаточный контроль содержания глюкозы, сахарный диабет 2 типа, синдром X (также называемый метаболическим синдромом), гестационный диабет, резистентность к инсулину и гипергликемия. Лечение нарушений обмена глюкозы может включать снижение уровня глюкозы, улучшение контроля уровня глюкозы, снижение резистентности к инсулину и/или предупреждение развития расстройств, связанных с нарушением обмена глюкозы (например, предупреждение развития у пациента со сниженной толерантностью к глюкозе при пероральном введении либо с повышенным уровнем глюкозы сахарного диабета 2 типа). В настоящем документе термины "синдром X", "метаболический синдром" и "метаболический синдром X" обозначают нарушение, представляющее опасность с точки зрения развития сахарного диабета 2 типа и сердечно-сосудистых заболеваний, характеризующееся резистентностью к инсулину и гиперинсулинемией, которое может сопровождаться одним или несколькими следующими расстройствами: (a) нарушение толерантности к глюкозе, (b) сахарный диабет 2 типа, (c) дислипидемия, (d) гипертензия и (e) ожирение. Используемый в настоящем документе термин "лечение" и ему подобные включают, если не указано иначе, ведение субъекта или пациента (предпочтительно млекопитающего, более предпочтительно человека) и уход за ним с целью противостояния болезни, патологическому состоянию либо расстройству, и включает введение соединения настоящего изобретения для предупреждения возникновения симптомов или осложнений, облегчения симптомов или осложнений, либо устранения болезни, патологического состояния или расстройства. Термин "профилактика" в настоящем документе, если не указано иное, означает (a) снижение частоты одного или нескольких симптомов; (b) снижение тяжести одного или нескольких симптомов; (c) задержку или предотвращение развития дополнительных симптомов; и/или (d) задержку или предотвращение развития заболевания или состояния. Специалисту в данной области будет понятно, что в тех случаях, когда настоящее изобретение относится к способам предупреждения, субъектом, нуждающимся в этом (т.е. субъектом, нуждающимся в предупреждении), следует считать любого субъекта или пациента (предпочтительно млекопитающего,более предпочтительно - человека), который ощущает или у которого наблюдается по меньшей мере один симптом заболевания, расстройства или состояния, развитие которое необходимо предупредить. Более того, нуждающийся в предупреждении субъект может также быть субъектом (предпочтительно млекопитающим, более предпочтительно человеком), пока не проявившим никаких симптомов расстройства, болезни или патологического состояния, требующих предупреждения, но имеющим по мнению врача либо другого медицинского специалиста риск развития указанного расстройства, болезни или патологического состояния. Например, субъект может быть подвержен риску развития расстройства, заболевания или патологического состояния (и поэтому нуждаться в предупреждении или превентивном лечении) с учетом его истории болезни, включая, помимо прочего, наследственность, предрасположенность, сопутствующие расстройства или состояния, генетическую предрасположенность и тому подобное. Используемый в настоящем документе термин "субъект" обозначает животное, предпочтительно млекопитающее, более предпочтительно человека, которое являлось объектом лечения, наблюдения или эксперимента. Предпочтительно субъект перенес и/или продемонстрировал по меньшей мере один симптом болезни или расстройства для лечения и/или предупреждения. Используемый в настоящем документе термин "терапевтически эффективное количество" обозначает такое количество активного соединения или фармацевтического агента, которое вызывает биологически или медицински значимый ответ со стороны системы тканей/органов, организма животного или человека, ожидаемый исследователем, ветеринаром, врачом или иным клиницистом, и который включает облегчение симптоматики заболевания или патологического состояния, подвергшегося лечению. Оптимальные назначаемые дозы могут легко определяться специалистами и будут варьировать в зависимости, например, от способа введения, силы препарата и степени выраженности патологического состояния. Кроме того, факторы, связанные с личными особенностями конкретных пациентов, включая возраст, вес тела, особенности диеты и времени введения препарата, в результате приведут к необходимости коррекции назначенных доз препаратов. Специалисту будет очевидно, что испытания как in vivo, так и in vitro, проводимые с использованием подходящих известных и общепринятых клеточных и/или животных моделей, позволяют предположительно оценивать способность тестируемого соединения или комбинированного препарата оказывать лечебное или профилактическое действие на данное заболевание. Специалисту также будет понятно, что клинические испытания на людях, включая первичные испытания на человеке, оценку эффективности доз, испытания на группах здоровых добровольцев и/или пациентов, страдающих данным заболеванием,могут осуществляться в соответствии со способами, хорошо известными в медицинской и клинической практике. Используемый в настоящем документе термин "лекарственный препарат/композиция", как предполагается, обозначает продукт, включающий определенные ингредиенты в определенных количествах,также как любой продукт, являющийся прямым либо опосредованным результатом комбинирования таких специфических ингредиентов в специфических количествах. Чтобы представить более краткое описание, некоторые количественные выражения в настоящем документе перечисляются как диапазон от приблизительно X до приблизительно Y. Понятно, что когда указан диапазон, он не ограничен указанными верхней и нижней границами, а включает полный набор значений от приблизительно X до приблизительно Y, либо любое значение или диапазон между этими значениями. Для достижения более точного описания некоторые из используемых в настоящем документе количественных выражений не сопровождаются термином "приблизительно". Необходимо понимать, что вне зависимости от того, используется ли явно термин "приблизительно" или нет, каждое приводимое в настоящем документе количество, подразумевает действительное численное значение, а также подразумевает разумное приближение к таковому численному значению, основанное на имеющихся у специалиста знаниях, включая приближение, основанное на экспериментальных условиях и/или измерениях, имеющих отношение к таковому численному значению.Примеры соответствующих целям настоящего изобретения растворителей, оснований, температур и иных условий проведения реакции и используемых компонентов даются в подробных описаниях ниже. Специалист в данной области определит, что список указанных примеров не призван и ни в коей мере не должен восприниматься как ограничение сущности настоящего изобретения, изложенного в приведенных далее пунктах формулы изобретения. Специалисту будет понятно, что в то время как реакционная стадия, описываемая настоящим изобретением, может протекать в разнообразных растворителях или системах растворителей, упомянутая реакционная стадия также может протекать в смесях приемлемых растворителей или систем растворите-6 023496 лей. В тех случаях, когда процессы получения соединений в соответствии с данным изобретением приводят к образованию смеси стереоизомеров, эти изомеры могут быть изолированы при помощи широко известных способов, таких как препаративная хроматография. Соединения могут быть получены в форме рацематов, либо отдельные энантиомеры могут быть получены в результате энантиоспецифического синтеза или посредством разделения. Соединения могут, например, быть разделены на составляющие их энантиомеры при помощи стандартных способов, таких как формирование диастереомерных пар путем образования солей с оптически активными кислотами, как, например, (-)-ди-п-толуоил-D-виннокаменная кислота и/или (+)-ди-п-толуоил-L-виннокаменная кислота с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения могут также быть разделены с помощью образования диастереометрических эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В альтернативном осуществлении соединения могут быть разделены при помощи хиральной колонки для ВЭЖХ. Кроме того, хиральная ВЭЖХ в сравнении со стандартом может также применяться для определения процентного энантиомерного избытка (%ее). Энантиомерный избыток рассчитывается следующим образом:[(Rмoль-Sмoль)/(Rмoль+Sмoль)]100% где Rмoль и Sмoль представляют собой мольные доли R и S энантиомеров, так что Rмoль+Sмoль = 1. Альтернативно энантиомерный избыток может быть следующим образом рассчитан из величин удельного вращения искомого энантиомера и полученной смеси:ee = ([-obs]/[-max])100. Настоящее изобретение относится к сокристаллам L-пролина и соединения формулы (I-Х), предпочтительно кристаллического L-пролина и соединения формулы (I-Х). Кроме того, настоящее изобретение относится к сокристаллам лимонной кислоты и соединения формулы (I-Х), предпочтительно кристаллической лимонной кислоты и соединения формулы (I-Х). Приготовление сокристаллов кристаллического L-пролина и лимонной кислоты Сокристаллы L-пролина и лимонной кислоты и соединения (I-X) готовили как часть процесса выделения сокристаллов. Вкратце, около 15 мг соединения формулы (I-Х) добавляли в 48-луночный блок для истирания вместе с приблизительно 1 молярным эквивалентом компонента, образующего сокристаллы (L-пролина и лимонной кислоты, соответственно) и 10 мкл растворителя (выбранного из ацетона,этанола, изопропилового спирта, толуола, воды). Было проведено шесть (6) отдельных экспериментов с каждым компонентом для образования сокристаллов (5 растворителей и 1 сухая лунка). Содержимое лунок подвергали истиранию с помощью шаровой мельницы в течение 10 мин, после чего сразу анализировали методом порошковой рентгеновской дифракции. Сокристаллы кристаллического L-пролина и соединения формулы (I-Х) дополнительно приготовляли путем суспендирования соединения формулы (I-Х) (1 г) и L-пролина в ацетоне в стехиометрическом соотношении 1:1. Кроме того, дополнительно готовили сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) путем кристаллизации при определенной температуре соединения формулы (I-Х) (1 г) и лимонной кислоты в изопропиловом спирте в стехиометрическом соотношении 1:1. Физическая и химическая стабильность сокристаллов L-пролина и лимонной кислоты: Сокристаллы кристаллического L-пролина и соединения формулы (I-Х) были исследованы на физическую стабильность путем выдержки сокристаллов около 10 мин во флаконах с отогнутым бортиком для сыворотки в следующих условиях: (a) 5C, герметично закрытые; (b) 25C/60% отн. влаж., открытые;(c) 40C, герметично закрытые; (d) 40C/75% отн. влаж., открытые; (e) 60C, герметично закрытые и (f) 80C, герметично закрытые; данные стабильности учитывали через 1 день, 1 неделю, 2 недели и 4 недели. Сокристаллы кристаллического L-пролина и соединения формулы (I-Х) оставались физически стабильны до 4 недель при всех этих условиях без видимых изменений цвета. Образцы сокристаллов кристаллического L-пролина и соединения формулы (I-Х) для исследования на физическую стабильность, отбиравшиеся через 1 день, 1 неделю, 2 недели и 4 недели, дополнительно исследовали на химическую стабильность/разложение. Сокристаллы кристаллического L-пролина ,-и соединения формулы (I-Х) (10 мг) разводили смесью 50:50 воды: ацетонитрила (10 мл), а затем далее разводили в 10 раз для ВЭЖХ. Через 1 день, 1 неделю, 2 недели и 4 недели все образцы сокристаллов кристаллического L-пролина оставались химически стабильными. Не было обнаружено пиков, обусловленных продуктами разложения, и площади пиков в % оставались постоянными в каждой временной точке. Сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) были исследованы на физическую стабильность сходным образом путем выдержки сокристаллов около 10 мин во флаконах для сыворотки с отогнутым бортиком в следующих условиях: (а) 5C, герметично закрытые; (b) 25C/60% отн. влаж., открытые; (с) 40C, герметично закрытые; (d) 40C/75% отн. влаж., открытые; (е) 60C, герметично закрытые; и (f) 80C, герметично закрытые; данные стабильности учитывали через 1 день, 1 неделю, 2 недели и 4 недели. Кристаллическая лимонная кислота и сокристаллы соединения формулы (I-Х) оставались физически стабильными до 4 недель в данных условиях, хотя была отмечена некоторая степень разложения (0,3% в пересчете на площадь пиков) при хранении при 25C/60% отн. влажн., при 40C/7 5% отн. влаж. и при 60 или 80C. Образцы сокристаллов кристаллической лимонной кислоты и соединения формулы (I-Х) для исследования на физическую стабильность, отбиравшиеся через 1 день, 1 неделю, 2 недели и 4 недели, дополнительно исследовали на химическую стабильность/разложение. Сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) (10 мг) разводили смесью 50:50 воды: ацетонитрила (10 мл), а затем далее разводили в 10 раз для ВЭЖХ. Все образцы сокристаллов лимонной кислоты, хранившиеся при 5C в герметично закрытых флаконах и при 40C в герметично закрытых флаконах оставались химически стабильными через 1 день, 1 неделю, 2 недели и 4 недели. В образцах, хранившихся при 25C/60% отн. влаж. в открытых флаконах и при 60C в закрытых флаконах, были обнаружены незначительные признаки разложения; хотя чистота пиков в этих образцах оставалась на уровне 99%. Немного мелких пиков продуктов разложения также было обнаружено в образцах, хранившихся при 40C/75% отн. влаж. в открытых флаконах и при 80C в закрытых флаконах через 1, 2 и 4 недели; хотя чистота пиков этих образцов также оставалась на уровне 99%. Порошковый рентгенодифракционный анализ, ДСК, ТГА и ДСДП Сокристаллы кристаллического L-пролина и соединения формулы (I-Х) и сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) дополнительно исследовали методом порошковой рентгеновской дифракции (пРД), динамической сканирующей калориметрии (ДСК), термогравиметрического анализа (ТГА) и динамической сорбции и десорбции пара (ДСДП). пРД: порошковую рентгеновскую дифракцию проводили с помощью дифрактометра Bruker AXSD8 Discover x-ray с GADDS (система обнаружения дифракции во всей области), детектором Bruker(Cu/K 1.54056), автоматическим столиком x-y-z и коллиматором 0,5 мм. Образец в форме компактного шарика размещали на столике x-y-z. Дифрактограмму получали при обычных комнатных условиях при напряжении 40 кВ и токе 40 мА в режиме отражения при неподвижном образце. Экспозиция для каждого образца была приблизительно 1 мин. Полученная дифрактограмма подвергалась процедуре повторного построения карт пространства для компенсации геометрического подушкообразного искажения детектора зоны, а затем проводилась интеграция в диапазоне углов хи от -118,8 до -61,8 градусов и 2-тета 2,1-37 градусов с шагом 0, 02 градуса с нормировкой по бинам. В дополнение к использованию ПО Jade,дифракционные картины, полученные с помощью прибора Bruker, просматривали с помощью программного обеспечения EVA. ДСК: аликвоту образца взвешивали на герметичной алюминиевой кювете для образцов. Затем кювету загружали в дифференциальный сканирующий калориметр (Q1000, ТА Instruments) с автоматическим пробозаборником. Термограмму получали путем нагрева каждого образца со скоростью 10C/мин. с Tmin (обычно комнатная температура) до Tmax (обычно 300C) с использованием пустой герметичной алюминиевой кюветы в качестве стандарта. В качестве газа для продувки образца использовали сухой азот на скорости 50 мл/мин. Температурные переходы рассматривали и анализировали с помощью программного обеспечения для анализа, прилагающегося к инструменту. ТГА: аликвоту образца переносили в платиновый тигель для образца. Затем тигель помещали на загрузочную платформу и автоматически загружали в аппарат (термогравиметрический анализатор Q500,ТА Instruments) с использованием программы для управления. Термограммы получали путем нагрева каждого образца со скоростью 10C/мин с Tmin (обычно комнатная температура) до Tmax (обычно 300C) в потоке сухого азота со скоростью 60 мл/мин, для продувки образца и 40 мл/мин, для продувки весов. Температурные переходы (т.е. изменения веса) просматривали и анализировали с помощью программного обеспечения для анализа, прилагающегося к инструменту. ДСДП: поглощение влаги изучали с помощью инструмента DVS-1 (Surface Measurement Systems,Аллентаун, Пенсильвания). В каждом случае образец подвергали сушке от комнатной влажности до 0% относительной влажности (ОВ), а затем проводили два цикла сорбции (от 0 до 90%ОВ) и десорбции (от 90 до 0% ОВ) с шагом 10% ОВ при 25C. На каждом шаге давали некоторое время для уравновешивания образца при данном значении ОВ в % и, следовательно, стабилизации увеличившейся или уменьшившейся массы перед переходом прибора к следующей стадии метода. Свойства сокристаллов кристаллического L-пролина: Сокристаллы кристаллического L-пролина и соединения формулы (I-Х) были изучены методом порошковой рентгеновской дифракции (пРД); при этом порошковая рентгенодифрактограмма сокристаллов сравнивалась с рентгенодифрактограммой компонентов сокристаллов, конкретнее, рентгенодифрактограммой соединения формулы (I-Х) и рентгенодифрактограммой L-пролина. На фиг. 1, представленном ниже, показаны характерные рентгенодифрактограммы L-пролина В одном из вариантов осуществления настоящего изобретения сокристалл кристаллического Lпролина и соединения формулы (I-X) может быть охарактеризован его порошковой рентгенодифрактограммой, имеющей пики, перечисленные в приведенной ниже табл. 1. Таблица 1. Сокристалл кристаллического L-пролина и соединения формулы (I-Х) Предпочтительно, когда сокристалл кристаллического L-пролина и соединения формулы (I-Х) характеризуется порошковой рентгенодифрактограммой, имеющей пики с относительной интенсивностью равной или превышающей 25%, или предпочтительнее с относительной интенсивностью, равной или превышающей 40%. В другом варианте осуществления настоящего изобретения сокристаллы кристаллического Lпролина и соединения формулы (I-X) могут характеризоваться следующими пиками на порошковой рентгенодифрактограмме 2: 3,74, 9,50, 10,98, 17,78, 18,62, 21,94, 23,43 и 26,82; как показано на рентгенодифракционном спектре с выделенными пиками на фиг. 2. Сокристалл кристаллического L-пролина и соединения формулы (I-Х) был дополнительно исследован методом дифференциальной сканирующей калориметрии (ДСК) с измерением при температуре от 25 до 300C со скоростью нагрева 10C/мин, при этом была обнаружена резкая точка плавления при 188C с плечом пика при 180C. Сокристалл кристаллического L-пролина и соединения формулы (I-Х) был дополнительно изучен методом термогравиметрического анализа (ТГА) с измерением при температуре от 25 до 300C со скоростью нагрева 10C/мин; при этом было обнаружено снижение массы на 1% вплоть до температуры 180C(как полагают, за счет испарения остаточного растворителя) и последующее снижение массы на 25% при температуре до 280C, соответствующее потере 1 молярного эквивалента L-пролина. Сокристалл кристаллического L-пролина и соединения формулы (I-Х) был дополнительно исследован методом динамической сорбци и десорбции пара (ДСДП) с измерением от 0 до 90% ОВ (2 полных цикла) при 25C. Показано, что сокристалл кристаллического L-пролина и соединения формулы (I-Х) гигроскопичен, хотя вплоть до повышения относительной влажности до 40% не было отмечено увеличения массы. В промежутке с 40 до 90% ОВ масса сокристалла увеличилась на 12%, однако уменьшилась(с некоторым гистерезисом) во время фазы десорбции в цикле измерения. Исследование образцов, собранных после цикла ДСДП (при 0% ОВ), методом порошковой рентгеновской дифракции не показало необратимых изменений формы. Свойства сокристаллов кристаллической лимонной кислоты Сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) были изучены методом порошковой рентгеновской дифракции (пРД); при этом порошковая рентгенодифрактограмма сокристаллов сравнивалась с порошковой рентгенодифрактограммой компонентов сокристаллов, конкретнее, порошковой рентгенодифрактограммой соединения формулы (I-Х) и порошковой рентгенодифрактограммой лимонной кислоты. На фиг. 3, представленной ниже, показаны характерные порошковые рентгенодифрактограммы лимонной кислоты (вверху), соединения формулы (I-Х) (внизу) и сокристаллов кристаллической лимонной кислоты и соединения формулы (I-Х) (в середине). В одном из вариантов осуществления настоящего изобретения сокристалл кристаллической лимонной кислоты и соединения формулы (I-Х) может быть охарактеризован его порошковой дифрактограммой, имеющей пики, перечисленные в приведенной ниже табл. 2. Таблица 2. Сокристалл лимонной кислоты и соединения формулы (I-Х) Предпочтительно, когда сокристалл кристаллической лимонной кислоты и соединения формулы (IХ) характеризуется порошковой рентгенодифрактограммой, имеющей пики с относительной интенсивностью, равной или превышающей 5%, или предпочтительнее с относительной интенсивностью, равной или превышающей 10%. В другом варианте осуществления настоящего изобретения сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) могут характеризоваться следующими пиками на порошковой рентгенодифрактограмме 2: приблизительно 4,2, 9,16, 12,39, 16,54, 17,69, 19,70, 23,63 и 25,66; как видно на рентгенодифракционном спектре с выделенными пиками на фиг. 4. Сокристалл кристаллической лимонной кислоты и соединения формулы (I-Х) был дополнительно исследован методом дифференциальной сканирующей калориметрии (ДСК) с измерением при температуре от 25 до 300C со скоростью нагрева 10C/мин.; при этом была обнаружена одна резкая точка плавления при 156C. Сокристалл кристаллической лимонной кислоты и соединения формулы (I-Х) был дополнительно исследован методом термогравиметрического анализа (ТГА) с измерением при температуре от 25 до 300C со скоростью нагрева 10C/мин; при этом было обнаружено незначительное снижение массы на 0,38% при температуре до 155C. Полагали, что такое снижение массы было обусловлено испарением остаточного растворителя и не указывало на наличие гидратированной формы. Сокристалл кристаллической лимонной кислоты и соединения формулы (I-Х) был дополнительно исследован методом динамического поглощения и десорбции пара (ДСДП) с измерением от 0 до 90% ОВ(2 полных цикла) при 25C. Показано, что сокристаллы кристаллической лимонной кислоты и соединения формулы (I-Х) негигроскопичны, было отмечено постепенное увеличение массы на 05% при повышении отн. влажности от 0 до 80%, а после десорбции масса снова уменьшилась. Порошковый рентгенодифракционный анализ образцов, собранных после ДСДП (при 0% отн. влаж.) показал, что форма образца не изменилась. Настоящее изобретение также относится к фармацевтическим композициям, содержащим любые из сокристаллов соединения формулы (I-Х), как описано в настоящей заявке, с фармацевтически приемлемым носителем. Лекарственные препараты, содержащие в качестве активных ингредиентов одно или более соединений, описываемых настоящим изобретением, могут быть приготовлены при помощи тщательного смешивания соединения или соединений с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей. Носитель может иметь широкое разнообразие форм, в зависимости от предполагаемого способа введения (например, пероральный, парентеральный). Так, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки,консерванты, стабилизаторы, красители и тому подобные; для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы,сахара, разбавители, гранулообразующие агенты, смазки, связывающие вещества, добавки для улучшения разрушаемости таблеток и тому подобные. Твердые пероральные препараты также можно покрывать такими веществами, как сахар, или наносить кишечное покрытие, позволяющее модулировать основной участок абсорбции. Для парентерального введения носитель, как правило, состоит из стерильной воды,при этом, в целях улучшения растворимости или консервации, могут добавляться другие ингредиенты. Инъекционно вводимые суспензии или растворы также могут изготавливаться с использованием водных носителей вместе с соответствующими добавками. Для приготовления фармацевтических составов, описываемых настоящим изобретением, одно или несколько соединений, описываемых настоящим изобретением в качестве активного ингредиента, тщательно смешиваются с фармацевтическим носителем, в соответствии со стандартными фармацевтическими технологиями приготовления смесей, при этом такой носитель может иметь широкое разнообразие форм, в зависимости от лекарственной формы, требуемой для предполагаемого способа введения,например, пероральный или парентеральный, как, например, внутримышечное введение. При получении композиций для перорального введения можно использовать любое стандартное фармацевтическое средство. Так для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы,приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и тому подобные; для твердых пероральных лекарственных форм, таких как порошки,капсулы, таблетки в форме капсул и таблетки, приемлемые носители и добавки включают крахмалы,сахара, разбавители, гранулообразующие агенты, смазки, связывающие вещества, добавки для улучшения разрушаемости таблеток и тому подобные. В связи с легкостью назначения таблетки и капсулы представляют собой наиболее удобную в употреблении пероральную дозированную лекарственную форму, в которой с очевидностью используются твердые фармацевтические носители. При желании для таблеток можно применять сахарное или энтеропокрытие с применением стандартных методик. Для парентеральных лекарственных форм носитель, как правило, состоит из стерильной воды, хотя другие ингредиенты, например, в целях улучшения растворимости или консервации, могут также включаться в состав. Также могут быть изготовлены инъекционно вводимые суспензии или растворы, в этом случае могут использоваться соответствующие водные носители, суспендирующие агенты и подобные компоненты. Описываемые в настоящем документе фармацевтические составы включают, в расчете на единицу дозы, например, таблетку, капсулу, дозу порошка, чайную ложку и т.п., такое количество активного ингредиента, которое необходимо для обеспечения эффективной дозы в соответствии с описанием приведенным выше. Описанные в настоящем документе фармацевтические композиции могут включать, в расчете на единицу дозы, например, таблетку, капсулу, дозу порошка, инъекцию, суппозиторий, чайную ложку и т.п., в диапазоне от приблизительно 0,01 до приблизительно 1000 мг или в любом входящем в него диапазоне, и могут назначаться в количестве от приблизительно 0,01 до приблизительно 500 мг/кг/сутки либо в иной дозе или в диапазоне в этих пределах, предпочтительно от приблизительно 0,5 до приблизительно 100 мг/кг/сутки либо в иной дозе или в диапазоне в этих пределах. При этом, дозы могут изменяться в зависимости от нужд пациентов, тяжести подлежащего лечению состояния и используемого соединения. Применять можно как ежедневный прием, так и постпериодическое дозирование. Предпочтительно использование этих составов в виде дозированных лекарственных форм, например, в виде таблеток, пилюль, капсул, дозированных порошков, гранул, стерильных растворов или суспензий для парентерального введения, дозируемых аэрозолей или жидкостей для разбрызгивания, капель ампул, аутоинъекторов или суппозиториев; для перорального, парентерального, интраназального, сублингвального или ректального приема, либо для назначения при помощи ингаляции или вдувания. В качестве варианта, состав может быть представлен в виде лекарственной формы, назначаемой один раз в неделю или в месяц; например, нерастворимая соль активного соединения, такая как деканоат, может быть адаптирована для внутримышечной инъекции с формированием тканевого депо. Для изготовления твердых лекарственных форм, таких как таблетки, основной активный ингредиент смешивается с фармацевтическим носителем, например, обычными ингредиентами, используемыми для приготовления таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальция фосфат или камедь, и другими фармацевтическими разбавителями, например водой, с образованием твердого преформулирующего состава, содержащего гомогенную смесь соединений, описываемых настоящим изобретением, либо их фармацевтически приемлемых солей. Указание на однородность этих предварительных композиций означает, что активный ингредиент распределяется равномерно, так что композиция легко разделятся на одинаково эффективные лекарственные формы, такие как таблетки, пилюли и капсулы. Полученная твердая матричная композиция затем разделяется на дозированные формы описанного выше типа, содержащие от 0,1 до приблизительно 1000 мг или иное количество в указанных пределах активного компонента в соответствии с настоящим изобретением. На таблетки и пилюли новой композиции можно наносить покрытие или иным образом обеспечивать лекарственную форму, обеспечивающую преимущества долгосрочного действия. Например, таблетки и пилюли могут содержать внутренние и внешние компоненты дозы, причем внешние служат оболочкой для первых. Два компонента можно разделить кишечным слоем, противостоящим распаду в желудке и позволяющим провести внутренний компонент нетронутым в двенадцатиперстную кишку или задержать его вывод. Для таких кишечных слоев и покрытий можно использовать различные материалы, в том числе,ряд полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы. К жидким формам, в которых новые композиции настоящего изобретения можно вводить перорально или в виде инъекций, относятся водные растворы, соответствующим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое, кунжутное, кокосовое или арахисовое масло, а также эликсиры и аналогичные фармацевтические средства. К приемлемым диспергирующим или приостановливающим веществам для водных суспензий относятся синтетические и натуральные смолы, такие как трагакант, акация, альгинат, декстран, карбоксиметилцеллюлоза натрия, метилцеллюлоза, поливинилпирролидон и желатин. Способ лечения заболеваний, вызванных нарушениями обмена глюкозы, описываемый настоящим изобретением, может также осуществляться с использованием фармацевтической композиции, содержащей любое из описанных в настоящем документе соединений и фармацевтически приемлемый носитель. Фармацевтическая композиция может содержать от приблизительно 0,01 до приблизительно 1000 мг соединения, или любое количество в этом диапазоне; предпочтительно, от приблизительно 0,1 до приблизительно 500 мг соединения или любое количество в этом диапазоне, и может производиться в любой форме, подходящей для выбранного пути введения. Носители включают необходимые и инертные фармацевтические носители, в том числе, помимо прочего, связывающие вещества, добавки для улучшения разрушаемости таблеток, любриканты, ароматизаторы, подсластители, консерванты, красители и оболочки. Композиции для перорального введения принимают такие твердые формы, как таблетки, пилюли,каплеты, капсулы (каждый их этих видов может иметь формы для немедленного, отложенного выпуска и постоянного высвобождения), гранулы и порошки, и такие жидкие формы, как растворы, сиропы, эликсиры, эмульсии и суспензии. К пригодным для парентерального введения формам относятся стерильные растворы, эмульсии и суспензии. К преимуществам соединений настоящего изобретения относится возможность вводить их один раз в день или с разделением суточной дозы на две, три или четыре части. Кроме того, соединения настоящего изобретения можно вводить интраназально путем местного применения приемлемых интраназальных носителей или с помощью трансдермальных пластырей, хорошо знакомых большинству специалистов в этой области. При трансдермальном введении высвобождение дозы, естественно, происходит непрерывно, а не дискретно на протяжении всего режима приема препарата. Например, для перорального введения в форме таблетки или капсулы, активный компонент лекарства может комбинироваться с пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и им подобными. Более того, в случае необходимости или желания, могут использоваться соответствующие связывающие вещества; смазки, дезинтегрирующие агенты, красители могут быть включены в смесь. Подходящие связывающие вещества включают, помимо прочего, крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, подсластитель из кукурузы, природные и синтетические камеди, такие как гуммиарабик, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и им подобные соединения. Дизинтеграторы включают, помимо прочего, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и им подобные. Жидкие формы в соответствующим образом ароматизированных суспендирующем и диспергирующем агентах, таких как синтетические и природные камеди, например, трагакант, гуммиарабик, метил-целлюлоза и им подобные. Для парентерального введения желательно применять стерильные суспензии и растворы. При внутривенном введении следует использовать изотонические препараты, как правило, содержащие приемлемые консерванты. Для приготовления фармацевтических составов, описываемых настоящим изобретением, соединение формулы (I), в качестве активного ингредиента, тщательно смешивают с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей, при этом таковой носитель может иметь широкое разнообразие форм, в зависимости от лекарственной формы,требуемой для предполагаемого способа введения (например, перорального или парентерального). Соответствующие фармацевтически приемлемые носители хорошо известны специалистам. Описания некоторых из таких фармацевтически приемлемых носителей могут быть найдены в публикации The Handbook of Pharmaceutical Excipients, опубликованной Американской фармацевтической ассоциацией и Фармацевтическим обществом Великобритании. Способы приготовления фармацевтических составов/лекарственных препаратов описаны в многочисленных публикациях, таких как Pharmaceutical Dosage Forms: Tablets, Second Edition, Revised and Expanded, Volumes 1-3, edited by Lieberman et al; Pharmaceutical Dosage Forms: Parenteral Medications, Volumes 1-2, edited by Avis et al; и Pharmaceutical Dosage Forms: Disperse Systems, Volumes 1-2, edited by Lieberman et al; изданных Marcel Dekker, Inc. Сокристаллы кристаллического соединения формулы (I-Х), относящиеся к настоящему изобретению, могут вводиться в составе любой из перечисленных выше композиций и в соответствии с принятыми дозировками в случаях, когда требуется лечение заболеваний, связанных с нарушением обмена глюкозы. Суточные дозы продукта могут варьировать в широких пределах от приблизительно 0, 01 до приблизительно 1000 мг для взрослого человека в сутки, либо иметь любое значение в этом диапазоне. Для перорального введения, фармацевтические составы предпочтительно поставляются в виде таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 и 500 мг активного ингредиента, в целях симптоматической коррекции дозы у пациента, получающего лечение. Предпочтительно, чтобы сокристаллы соединения формулы (I-Х) или его фармацевтически приемлемая соль вводились в дозе от приблизительно 0,01 до приблизительно 500 мг/кг веса тела в сутки или от приблизительно 0,01 до приблизительно 200 мг/кг веса тела в сутки или в любом входящем в этот интервал количестве или диапазоне. Предпочтительно диапазон составляет от приблизительно 0,01 до приблизительно 50 мг/кг веса тела в сутки или любое входящее в этот диапазон количество или интервал,более предпочтительно - от приблизительно 0,05 до приблизительно 10 мг/кг или любое входящее в этот диапазон количество или интервал, более предпочтительно - от приблизительно 1 до приблизительно 5 мг/кг веса тела в сутки или любое входящее в этот диапазон количество или интервал. В одном варианте осуществления эффективное количество сокристаллов соединения формулы (X-I) или его фармацевтически дается в дозировке 10, 25, 50, 100, 150 или 300 мг или в любом входящем в этот диапазон количестве или интервале. Сокристаллы соединения формулы (I-Х) могут вводиться с частотой от 1 до 4 раз в сутки. Оптимальные назначаемые дозы могут легко определяться специалистами и будут варьировать в зависимости от используемого соединения, способа введения, силы препарата и степени выраженности патологического состояния. Кроме того, факторы, связанные с личными особенностями конкретных пациентов, включая возраст, вес тела, особенности диеты и времени введения препарата, в результате приведут к необходимости коррекции назначенных доз препаратов. Специалисту будет понятно, что как in vivo, так и in vitro испытания, проводимые с использованием подходящих, известных и общепринятых клеточных и/или животных моделей, позволяют предположительно оценивать способность тестируемого соединения оказывать лечебное или профилактическое действие по отношению к данному заболеванию. Специалисту также будет понятно, что клинические испытания на людях, включая первичные испытания на человеке, оценку эффективности доз, испытания на группах здоровых добровольцев и/или пациентов, страдающих данным заболеванием, могут осуществляться в соответствии со способами, хорошо известными в медицинской и клинической практике. Следующие примеры приведены, чтобы способствовать пониманию изобретения, но не предназначены и не должны восприниматься как какое-либо ограничение изобретения, изложенного в указанных далее пунктах заявки. Пример 1. Сокристалл кристаллического L-пролина соединения формулы (I-Х) Соединение формулы (I-Х) (100 мг) добавляли во флакон для мельницы Wig-L-bug вместе с Lпролином (26,30 мг) (молярное соотношение действующего и кристаллообразующего вещества 1:1,1),шариком для истирания и ацетоном (20 мкл). Образец подвергали истиранию с помощью мельницы WigL-bug в течение 10 мин. После истирания принадлежность полученного твердого вещества к сокристаллам L-пролина и соединения формулы (I-Х) подтверждали методом порошковой рентгеновской дифракции. Пример 2. Сокристалл кристаллического L-пролина соединения формулы (I-Х) Соединение формулы (I-Х) (50,18 мг) вносили в конический флакон 4 мл вместе с L-пролином(13,15 мг) (молярное соотношение действующего и кристаллообразующего вещества 1:1,1), а затем добавляли ацетон (2 мл). Закрытый флакон кратковременно нагревали с помощью аппарата для сушки струей воздуха. Белый твердый материал, быстро осаждавшийся из раствора, собирали и подтверждали его принадлежность к сокристаллам L-пролина и соединения формулы (I-Х) методом порошковой рентгеновской дифракции. Пример 3.Сокристалл лимонной кислоты и соединения формулы (I-Х) Соединение формулы (I-Х) (100 мг) добавляли во флакон для мельницы Wig-L-bug вместе с лимонной кислотой (43,83 мг) (молярное соотношение действующего и кристаллообразующего вещества 1:1,1), шариком для истирания и уксусно-изопропиловым эфиром (20 мкл). Смесь подвергали истиранию с помощью мельницы Wig-L-bug в течение 10 мин. После истирания принадлежность полученного твердого вещества к сокристаллам лимонной кислоты и соединения формулы (I-Х) подтверждали методом порошковой рентгеновской дифракции. Пример 4. Сокристалл лимонной кислоты и соединения формулы (I-Х) Соединение формулы (I-Х) (50,72 мг) добавляли в 4 мл конический флакон вместе с лимонной кислотой (21,83 мг) (молярное соотношение действующего и кристаллообразующего вещества 1:1,1), а затем вносили изопропиловый эфир уксусной кислоты (1 мл). Закрытый крышкой флакон нагревали струей теплого воздуха для полного растворения твердых материалов. Поскольку кристаллизации при охлаждении не наблюдалось, крышку открывали и давали растворителю медленно испаряться. Через 2 дня(после уменьшения объема растворителя примерно на 20%) затравочные кристаллы желаемого материала добавляли в насыщенный раствор, после чего в течение нескольких часов осаждался белый кристаллический материал. Принадлежность полученного твердого вещества к сокристаллам лимонной кислоты и соединения формулы (I-Х) подтверждали методом порошковой рентгеновской дифракции. Пример 5. Твердая лекарственная форма для внутреннего применения - пример возможного применения В качестве конкретного варианта осуществления композиции для внутреннего применения 10 мг сокристаллов кристаллического L-пролина и соединения формулы (I-Х), приготовленных как описано выше, используют для приготовления состава с достаточным количеством мелкодисперсной лактозы (до общей массы 580-590 мг) для заполнения твердой гелевой капсулы размера О. Пример 6. Твердая лекарственная форма для внутреннего применения - пример возможного применения В качестве конкретного варианта осуществления композиции для внутреннего применения 100 мг сокристаллов кристаллической лимонной кислоты и соединения формулы (I-Х), приготовленных, как описано выше, используют для приготовления состава с достаточным количеством мелкодисперсной лактозы (до общей массы 580-590 мг) для заполнения твердой гелевой капсулы размера О. При том, что приведенная выше спецификация соответствует принципам настоящего изобретения,из примеров, приведенных для иллюстрации, становится понятно, что на практике изобретение включает в себя все обычные изменения, адаптации и модификации, которые входят в рамки следующих заявок, и их эквиваленты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Сокристалл L-пролина и соединения формулы (I-Х) характеризующийся следующими пиками на порошковой рентгенодифрактограмме при следующих значениях угла 2: 3,74, 9,50, 10,98, 17,78, 18,62, 21,94, 23,43 и 26,82. 2. Сокристалл L-пролина по п.1, точка плавления которого равна 188C по результатам измерения методом ДСК. 3. Сокристалл лимонной кислоты и соединения формулы (I-Х) характеризующийся следующими пиками на порошковой рентгенодифрактограмме при следующих значениях угла 2: 4,2, 9,16, 12,39, 16,54, 17,69, 19,70, 23,63 и 25,66. 4. Сокристалл лимонной кислоты по п.3, точка плавления которого равна приблизительно 156C по результатам измерения методом ДСК.
МПК / Метки
МПК: C07D 409/10, A61K 31/70, C07H 7/04
Метки: лимонной, l-пролина, кислоты, 2s,3r,4r,5s,6r)-2-(3-((5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(гидроксиметил)тетрагидро-2h-пиран-3,4,5-триола, сокристаллы
Код ссылки
<a href="https://eas.patents.su/17-23496-sokristally-l-prolina-i-limonnojj-kisloty-2s3r4r5s6r-2-3-5-4-ftorfeniltiofen-2-ilmetil-4-metilfenil-6-gidroksimetiltetragidro-2h-piran-345-triola.html" rel="bookmark" title="База патентов Евразийского Союза">Сокристаллы l-пролина и лимонной кислоты (2s,3r,4r,5s,6r)-2-(3-((5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(гидроксиметил)тетрагидро-2h-пиран-3,4,5-триола</a>
Предыдущий патент: Самостопорящееся крепежное средство, а также крепежная система
Следующий патент: Пластинчатый каталитический продукт и способ его производства
Случайный патент: Вертикально-фрезерный копировальный станок для изготовления дубликатов ключей












