Новые циклогексилсульфоны
Номер патента: 6225
Опубликовано: 27.10.2005
Авторы: Уилльямс Брайан Джон, Черчер Ян, Харрисон Тимоти, Оукли Пол Джозеф, Уилльямс Сузанна, Керрад Соня, Шо Дункан Эдвард, Нэйдин Алан Джон, Диннелл Кевин, Тилл Мартин Ричард
Формула / Реферат
1. Соединение формулы I
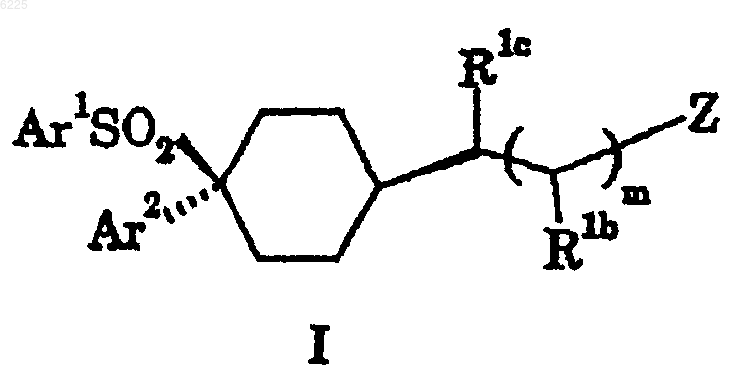
где m равно 0 или 1;
Z представляет собой CN, OR2a, CO2R2a или CON(R2a)2;
R1b представляет собой H, C1-4-алкил или OH;
R1c представляет собой H или C1-4-алкил;
Ar1 представляет собой фенил или пиридил, каждый из которых имеет 0-3 заместителя, независимо выбранных из галогена, CN, NO2, CF3, OH, OCF3, C1-4-алкокси или C1-4-алкила, который, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, CF3, OH и C1-4-алкокси;
Ar2 представляет собой фенил, который замещен галогеном в положениях 2 и 5;
R2a представляет собой H, C1-6-алкил, C3-6-циклоалкил, C3-6-циклоалкил-C1-6-алкил, C2-6-алкенил, любой из которых, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, CF3, OR2b, CO2R2b, N(R2b)2, CON(R2b)2, Ar и COAr, или R2a представляет собой Ar или две группы R2a вместе с атомом азота, к которому они взаимно присоединены, могут замкнуть N-гетероциклильную группу, имеющую 0-4 заместителя, независимо выбранных из =O, =S, галогена, C1-4-алкила, CN, NO2, CF3, OH, C1-4-алкокси, C1-4-алкоксикарбонила, CO2H, амино, C1-4-алкиламино, ди(C1-4-алкил)амино, карбамоила, Ar и COAr;
R2b представляет собой H, C1-6-алкил, C3-6-циклоалкил, C3-6-циклоалкил-C1-6-алкил, C2-6-алкенил, любой из которых, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, CF3, OH, C1-4-алкокси, C1-4-алкоксикарбонила, CO2H, амино, C1-4-алкиламино, ди(C1-4-алкил)амино, карбамоила, Ar или COAr, или R2b представляет собой Ar или две группы R2b вместе с атомом азота, к которому они взаимно присоединены, могут замкнуть N-гетероциклильную группу, имеющую 0-4 заместителя, независимо выбранных из =O, =S, галогена, C1-4-алкила, CN, NO2, CF3, OH, C1-4-алкокси, C1-4-алкоксикарбонила, CO2H, амино, C1-4-алкиламино, ди(C1-4-алкил)амино, карбамоила, Ar и COAr;
Ar представляет собой фенил или гетероарил, имеющий 0-3 заместителя, выбранных из галогена, C1-4-алкила, CN, NO2, CF3, OH, C1-4-алкокси, C1-4-алкоксикарбонила, амино, C1-4-алкиламино, ди(C1-4-алкил)амино, карбамоила, C1-4-алкилкарбамоила и ди(C1-4-алкил)карбамоила;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где Ar1 выбран из фенильных групп, замещенных в положении 4 галогеном, метилом или трифторметилом, и фенильных групп, замещенных галогеном в положениях 3 и 4.
3. Соединение по п.1 или 2, где Ar1 представляет собой 4-фторфенил или 4-трифторметилфенил и Ar2 представляет собой 2,5-дифторфенил.
4. Соединение по любому из пп.1-3, где Z представляет собой CO2R2a и R2a представляет собой H или C1-4-алкил.
5. Соединение по п.1, где m равно 1, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1b и R1c, оба, представляют собой H и Z представляет собой CO2H, или его фармацевтически приемлемая соль.
6. Соединение по п.1, где m равно 1, Ar1 представляет собой 4-трифторметилфенил, Ar2 представляет собой 2,5-дифторфенил, R1b и R1c, оба, представляют собой H и Z представляет собой CO2H, или его фармацевтически приемлемая соль.
7. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляет собой H и Z представляет собой CONH2, или его фармацевтически приемлемая соль.
8. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-трифторметилфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляют собой H и Z представляет собой CONH2, или его фармацевтически приемлемая соль.
9. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляет собой H и Z представляет собой CONHCH2CH3, или его фармацевтически приемлемая соль.
10. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляет собой H и Z представляет собой CN, или его фармацевтически приемлемая соль.
11. Фармацевтическая композиция, включающая соединение по любому из пп.1-10 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
12. Соединение по любому из пп.1-10 или его фармацевтически приемлемая соль для использования в способе лечения организма человека.
13. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли при изготовлении лекарственного средства для лечения или профилактики болезни Альцгеймера.
14. Способ лечения субъекта, страдающего болезнью Альцгеймера или предрасположенного к болезни Альцгеймера, который включает введение указанному субъекту эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой соли.
Текст
006225 Настоящее изобретение относится к новому классу соединений, их солям, содержащим их фармацевтическим композициям, способам их получения и применению в терапии организма человека. В частности, изобретение относится к новым сульфонам, которые модулируют процессинг АРР под действием -секретазы и поэтому являются полезными при лечении или профилактике болезни Альцгеймера. Болезнь Альцгеймера (AD) является наиболее преобладающей формой деменции. Хотя данная болезнь, главным образом, является заболеванием пожилых, поражающим до 10% населения в возрасте свыше 65 лет, AD поражает также значительное число более молодых пациентов с генетической предрасположенностью. AD является нейродегенеративным заболеванием, клинически характеризующимся прогрессивной потерей памяти и познавательной функции и патологически характеризующимся отложением внеклеточных белковых бляшек в кортикальных и ассоциативных областях мозга людей, страдающих таким заболеванием. Указанные бляшки в основном включают фибриллярные агрегаты амилоидного пептида (А). Роль секретаз, в том числе предполагаемой -секретазы, в процессинге амилоидного белка-предшественника (АРР) с образованием А хорошо описана в литературе, обзор литературы о ней приводится, например, в WO 01/70677. В литературе имеется относительно мало сообщений о соединениях с ингибирующей активностью в отношении -секретазы, измеряемой в анализе на клеточной основе. Обзор приведен в WO 01/70677. Многие из соответствующих соединений являются пептидами или производными пептидов. Настоящее изобретение относится к новому классу непептидных соединений, которые полезны при лечении или профилактике AD модуляцией процессинга АРР под действием предполагаемой секретазы, таким образом подавляя продуцирование А. Настоящее изобретение относится к соединению формулы IR1c представляет собой Н или C1-4-алкил; Аr1 представляет собой фенил или пиридил, каждый из которых имеет 0-3 заместителя, независимо выбранных из галогена, CN, NO2, СF3, ОН, ОСF3, C1-4-алкокси или C1-4-алкила, который, необязательно,имеет заместитель, выбранный из галогена, CN, NO2, СF3, ОН и C1-4-алкокси; Аr2 представляет собой фенил, который замещен галогеном в положениях 2 и 5;R2a представляет собой Н, C1-6-алкил, С 3-6-циклоалкил, С 3-6-циклоалкил-С 1-6-алкил, С 2-6-алкенил,любой из которых, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, СF3, OR2b,CO2R2b, N(R2b)2, CON(R2b)2, Аr и СОАr, или R2a представляет собой Аr или две группы R2a вместе с атомом азота, к которому они взаимно присоединены, могут замкнуть N-гетероциклильную группу, имеющую 0-4 заместителя, независимо выбранных из =O, =S, галогена, C1-4-алкила, CN, NO2, СF3, ОН, C1-4 алкокси, C1-4-алкоксикарбонила, СO2 Н, амино, C1-4-алкиламино, ди-(C1-4-алкил)амино, карбамоила, Аr и СОАr;R2b представляет собой Н, C1-6-алкил, С 3-6-циклоалкил, С 3-6-циклоалкил-С 1-6-алкил, С 2-6-алкенил,любой из которых, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, СF3, ОН, C1-4 алкокси, C1-4-алкоксикарбонила, СO2 Н, амино, C1-4-алкиламино, ди(C1-4-алкил)амино, карбамоила, Аr или СОАr, или R2b представляет собой Ar или две группы R211 вместе с атомом азота, к которому они взаимно присоединены, могут замкнуть N-гетероциклильную группу, имеющую 0-4 заместителя, независимо выбранных из =O, =S, галогена, C1-4-алкила, CN, NO2, СF3, ОН, C1-4-алкокси, C1-4-алкоксикарбонила, СO2 Н,амино, C1-4-алкиламино, ди(С 1-4-алкил)амино, карбамоила, Ar и СОAr;Ar представляет собой фенил или гетероарил, имеющий 0-3 заместителя, выбранных из галогена,C1-4-алкила, CN, NO2, СF3, ОН, C1-4-алкокси, C1-4-алкоксикарбонила, амино, С 1-4-алкиламино, ди(C1-4 алкил)амино, карбамоила, C1-4-алкилкарбамоила и ди(С 1-4-алкил)карбамоила; или его фармацевтически приемлемой соли. Когда в формуле I или в ее заместителе символ встречается более чем один раз, отдельные такие символы являются независимыми друг от друга, если не оговорено особо. Используемое здесь выражение C1-x-алкил, где х равно целому числу, которое больше, чем 1, относится к алкильным группам с неразветвленной и разветвленной цепью, где число атомов углерода,составляющих указанный алкил, находится в диапазоне от 1 до х. Конкретные алкильные группы включают метил, этил, н-пропил, изопропил и трет-бутил. Названия производных, таких как С 2-6-алкенил,гидрокси-С 1-6-алкил, гетероарил-С 1-6-алкил, С 2-6-алкинил и C1-6-алкокси, следует истолковывать аналогичным образом.-1 006225 Выражение С 3-6-циклоалкил, используемое здесь, относится к системе неароматических моноциклических или конденсированных бициклических углеводородных колец, включающих от 3 до 6 атомов углерода. Примеры его включают циклопропил, циклобутил, циклопетил, циклогексил и циклогексенил. Выражение С 3-6-циклоалкил-С 1-6-алкил, используемое здесь, включает циклопропилметил, циклобутилметил, циклопентилметил и циклогексилметил. Выражение N-гетероциклил, используемое здесь, означает циклическую или полициклическую систему содержащую до 10 атомов в цикле, выбранных из С, N, О и S, где ни один из составляющих систему циклов не является ароматическим и где по меньшей мере один атом цикла является азотом и связывание осуществляется через указанный атом азота цикла. Предпочтительными N-гетероциклильными группами являются моноциклические системы из 4-6 членов, такие как азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, имидазолидинил, оксазолидинил и тиазолидинил. Выражение гетероарил, используемое здесь, означает циклическую или полициклическую систему, содержащую вплоть до 10 атомов в цикле, выбранных из С, N, О и S, где по меньшей мере один их составляющих систему циклов является ароматическим и включает по меньшей мере один атом цикла,который отличается от углерода. Предпочтительными гетероарильными группами являются моноциклические системы, содержащие 5 или 6 членов, такие как пиридинильная, пиридазинильная, пиримидинильная, пиразинильная, пирролильная, фурильная, тиенильная, пиразолильная, оксазолильная, изоксазолильная, тиазолильная, изотиазолильная, имидазолильная, оксадиазолильная, триазолильная и тиадиазолильная группы. Следующие примеры гетероарильных групп включают тетразол, 1,2,4-триазин и 1,3,5 триазин. Термин галоген, используемый здесь, включает фтор, хлор, бром и иод, предпочтительными из которых являются фтор и хлор. Для применения в медицине соединения формулы I могут быть преимущественно в форме фармацевтически приемлемых солей, но другие соли могут быть полезными при получении указанных соединений или их фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли соединений настоящего изобретения включают кислотно-аддитивные соли, такие как соли, образованные хлористо-водородной, серной, метансульфоновой, фумаровой, малеиновой, янтарной, уксусной, бензойной, щавелевой, лимонной, винной, угольной или фосфорной кислотой, и, когда соединения изобретения имеют кислотную часть, соли натрия, калия, кальция или магния и соли, образованные с подходящими органическими лигандами, например, четвертичные аммониевые соли или пиридиниевые соли. Когда соединения по изобретению имеют по меньшей мере один асимметричный центр, они могут соответственно существовать в виде энантиомеров. Когда соединения по изобретению обладают двумя или более асимметричными центрами, они могут дополнительно существовать в виде диастереоизомеров. Должно быть понятно, что все такие изомеры и смеси их в любой пропорции включены в объем настоящего изобретения. Независимо от присутствия или отсутствия асимметричных центров, некоторые соединения по настоящему изобретению могут существовать в виде энантиомеров вследствие асимметрии молекулы в целом. Должно быть понятно, что в таких случаях оба энантиомера и их смеси в любой пропорции включены в объем изобретения и что структурные формулы, изображающие молекулы такого типа,должны быть представлены обоими из возможных энантиомеров, если не оговорено особо. В соединениях формулы I, Ar1 представляет собой необязательно замещенный фенил или пиридил,в частности, необязательно замещенный фенил или 3-пиридил. Ar1 предпочтительно выбран из фенильных групп, замещенных в 4-положении галогеном, метилом или трифторметилом, и фенильных групп,замещенных галогеном в положениях 3 и 4.Ar2 представляет собой предпочтительно 2,5-дифторфенил. В конкретных вариантах осуществления Ar1 представляет собой 4-хлорфенил или 4 трифторметилфенил и Ar2 представляет собой 2,5-дифторфенил.R1b в типичном случае представляет собой Н, метил или ОН, предпочтительно Н.R1c в типичном случае представляет собой Н или метил, предпочтительно Н. Когда m равно 1, R1b и R1c предпочтительно не представляют собой одновременно C1-4-алкил. Конкретные значения R2a включают Н, фенил, пиридил, С 3-6-циклоалкил (такой как циклопропил,циклобутил и циклопентил), С 3-6-циклоалкил-С 1-6-алкил (такой как циклопропилметил), С 2-6-алкенил (такой как аллил) и неразветвленный или разветвленный C1-6-алкил, который необязательно замещен СF3,Ar, OR2b, N(R2b)2, CO2R21b или CON(R2b)2. Примеры N-гетероциклильных групп, представленных N(R2a)2, включают пиперидин-1-ил (необязательно замещенный ОН, СO2 Н, СO2-C1-4-алкилом, Me или Ph), пиперазин-1-ил (необязательно замещенный Me или Ph), морфолин-4-ил, тиоморфолин-4-ил, 1,1-диоксотиоморфолин-4-ил, 2-оксоимидазолидин 1-ил, 5,5-диметил-2,2-диоксооксазолидин-3-ил, 2,5-диоксоимидазолидин-1-ил, 2-оксооксазолидин-3-ил,2-оксопиридин-1-ил и 2-оксопирролидин-1-ил.R2b в типичном случае представляет собой Н или C1-4-алкил.-2 006225 Когда Z представляет собой OR2a, R2a соответственно представляет собой Н, Ar (особенно пиридил),алкил (такой как метил, этил, пропил или бутил) или замещенный алкил (особенно, СН 2Ar, такой как бензил или пиридилметил). Когда Z представляет собой СО 2R2a, R2a соответственно представляет собой Н или алкил (такой как метил, этил, пропил или бутил). Когда Z представляет собой CON(R2a)2, группы R2a независимо представляют собой Н или необязательно замещенный алкил, циклоалкил, циклоалкилалкил или алкенил или вместе замыкают Nгетероциклильную группу. Очень возможно, что один R2a представляет собой Н и другой представляет собой Н, алкил (такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил или 1-этилпропил), алкенил (такой как аллил), циклоалкил (такой как циклопропил, циклобутил или циклопентил),циклоалкилалкил (такой как циклопропилметил) или замещенный алкил (такой как алкил, замещенныйAr, особенно, 2-пиридилэтил, 3-(имидазол-1-ил)пропил или 2-фенилэтил; или алкил, замещенный СF3,CO2R2b или CO2N(R2b)2, особенно, 2,2,2-трифторэтил, метоксикарбонилметил или карбамоилметил). В альтернативном случае, две группы R2a замыкают N-гетероциклильную группу, такую как морфолин,тиоморфолин, тиоморфолин-1,1-диоксид, 4-метилпиперазин, 4-фенилпиперазин, пиперидин, 4-гидроксипиперидин или пиперидин, который замещен в 3- или 4-положении CO2R2b и/или C1-4-алкилом, особенно 3- или 4-карбоксипиперидин, 3- или 4-этоксикарбонилпиперидин, 3-карбокси-3-метилпиперидин и 3-этоксикарбонил-3-метилпиперидин. Примеры индивидуальных соединений в соответствии с формулой I представлены в приложенном к описанию разделе примеров. Соединения формулы I обладают активностью в качестве модуляторов процессинга АРР под действием -секретазы. Изобретение относится также к фармацевтическим композициям, включающим одно или несколько соединений формулы I или их фармацевтически приемлемых солей и фармацевтически приемлемый носитель. Указанные композиции, предпочтительно, находятся в виде дозированных лекарственных форм,таких как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированные аэрозоли или жидкие спреи, капли, ампулы, чрескожные пластыри, аутоинъекторные устройства или суппозитории, для перорального, парентерального, интраназального, сублингвального или ректального введения или для введения ингаляцией или инсуффляцией. Для получения твердых композиций, таких как таблетки, главный активный ингредиент смешивают с фармацевтическим носителем, таким как общепринятые таблетирующие ингредиенты, известные специалистам в данной области,например, как описано в WO 01/70677, и смесь превращают в дозированную лекарственную форму. Типичная дозированная лекарственная форма содержит от 0,1 до 500 мг, например 1, 2, 5, 10, 25, 50, 100 или 200 мг активного ингредиента. Таблетки или пилюли новой композиции могут быть покрыты или по-другому сформованы с образованием лекарственной формы, обеспечивающей преимущество пролонгированного действия, как описано, например, в WO 01/70677. Жидкие формы, в которых новые композиции настоящего изобретения могут быть включены для введения перорально или инъекцией, включают водные растворы, подходящим образом содержащие корригент сиропы, водные или масляные суспензии и содержащие корригенты пищевые масла, как описано в WO 01/70677. Настоящее изобретение относится также к соединению формулы I или его фармацевтически приемлемой соли для применения в способе лечения организма человека. Лечение связано, предпочтительно, с состоянием, ассоциированным с отложением -амилоида. Состояние, предпочтительно, представляет собой неврологическое заболевание, имеющее ассоциированное -амилоидное отложение, такое как болезнь Альцгеймера. Настоящее изобретение далее относится к применению соединения формулы I или его фармацевтически приемлемой соли при изготовлении лекарственного средства для лечения или профилактики болезни Альцгеймера. Описан также способ лечения субъекта, страдающего болезнью Альцгеймера или склонного к болезни Альцгеймера, который включает введение указанному субъекту эффективного количества соединения в соответствии с формулой I или его фармацевтически приемлемой соли. Для лечения или профилактики болезни Альцгеймера подходящий уровень дозировки составляет приблизительно от 0,01 до 250 мг/кг в день, предпочтительно, приблизительно от 0,05 до 100 мг/кг в день и, особенно, приблизительно от 0,1 до 50 мг/кг массы тела в день. Соединения могут быть введены при режиме от 1 до 4 раз в день. В некоторых случаях, однако, может быть использована доза, находящаяся вне указанных ограничений. Соединения формулы I, в которой m равно 0 и Z представляет собой CO2R2a или CON(R2a)2, можно получить сочетанием карбоновой кислоты (1) соответственно с R2aOH или HN(R2a)2 где Ar1, Ar2, R1c и R2a имеют указанные выше значения. Может быть использован любой из стандартных способов сочетания, включая использование агентов сочетания, таких как диметиламинопиридин, гидроксибензотриазол, дициклогексилкарбодиимид,карбонилдиимидазол и тому подобное. В одном предпочтительном способе кислоту превращают в соответствующий хлорангидрид кислоты (например, обработкой оксалилхлоридом в растворе ДМФ) и подвергают взаимодействию непосредственно с нужным нуклеофилом. В другом предпочтительном способе кислоту превращают в активное эфирное производное, такое как сложный эфир пентафторфенола (например, сочетанием с фенолом в присутствии дициклогексилкарбодиимида) и указанный промежуточный продукт подвергают взаимодействию с нужным нуклеофилом. Кислоты (1) можно получить гидролизом эфиров (2), в типичном случае в щелочных условиях, таких как обработка LiOH в этанольном растворе где R2 представляет собой алкил, такой как метил или этил, и Ar1, Ar2 и R1c имеют значения, указанные выше. Сложные эфиры (2) можно получить восстановлением алкилиденпроизводных (3) с необязательным последующим алкилированием продукта (C1-4-алкил)-L, где L представляет собой уходящую группу где Ar1, Ar2 и R2 имеют такие же значения, как указано выше. Восстановление можно проводить с использованием борогидрида натрия и хлорида никеля (II) в этаноле, тогда как необязательное алкилирование можно проводить обработкой сложного эфира (2,R1c=H) сильным основанием (например, бис(триметилсилил)амидом натрия) в апротонном растворителе при низкой температуре с последующей обработкой (C1-4-алкил)-L и нагреванием до комнатной температуры. При необходимости, ненасыщенные сложные эфиры (3) могут быть гидролизованы в соответствующие кислоты и превращены в амиды взаимодействием с HN(R2a)2 перед восстановлением олефиновой связи. Ненасыщенные сложные эфиры (3) являются доступными конденсацией кетона (4) с Рh3 Р=СНСО 2R2 где Ar1, Ar2 и R2 имеют значения, указанные выше,тогда как кетоны (4) получают декарбоксилированием енолов (5), которые, в свою очередь, получают взаимодействием сульфона (6) по меньшей мере с двумя эквивалентами акрилата (7) где Ar1, Ar2 и R2 имеют значения, указанные выше. Декарбоксилирование можно выполнить нагреванием при 150 С в ДМСО в присутствии хлорида натрия и воды, тогда как взаимодействие (6) с (7) можно проводить при температуре окружающей среды в инертном растворителе, таком как ТГФ, в присутствии сильного основания, такого как трет-бутоксид калия.-4 006225 Сульфоны (6) получают окислением простых тиоэфиров Ar2-CH2-SAr1 (8), которые, в свою очередь,получают взаимодействием тиолов Ar1SH (9) с бензилпроизводными Ar2CH2-L (10), где L представляет собой уходящую группу, такую как хлорид или бромид и где Ar1 и Ar2 имеют значения, указанные выше. Взаимодействие между (9) и (10) происходит в инертном растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, тогда как окисление (8) в (6) обычно проводят мхлорпероксибензойной кислотой также в инертном растворителе, таком как дихлорметан. Соединения формулы I, в которой m равно 0 и Z представляет собой CN или OR2a, могут быть получены взаимодействием сульфонатного эфира (11), соответственно, с цианид-ионом или R2aOH где L1 представляет собой сульфонатную уходящую группу (такую как мезилат, тозилат или трифлат); иAr1, Ar2, R1c и R2a имеют значения, указанные выше. Реакцию замещения можно проводить в ДМФ при повышенной температуре, например, приблизительно при 80 С. Когда нуклеофилом является R2aOH, выгодно генерировать соответствующий анион обработкой гидридом натрия перед взаимодействием с (11). Сульфонаты (11) получают взаимодействием спиртов (12) с подходящим сульфонилхлоридом (например, в безводных условиях при низкой температуре в присутствии третичного амина). Спирты (12) сложно получить гидроборированием алкенов (13) где Ar1, Ar2 и R1c имеют значения, указанные выше. Способ в типичном случае включает взаимодействие с бораном в ТГФ при комнатной температуре с последующей обработкой щелочным пероксидом водорода и отделением требуемого цис-изомера хроматографией. Алкены (13) являются доступными из кетонов (4) конденсацией с Рh3 Р=CНR1c, где R1c имеет такие же значения, какие указаны выше. Альтернативный путь к спиртам (12), у которых R1c представляет собой Н, включает восстановление кетона (4) (например, с использованием борогидрида) в соответствующий вторичный спирт (14),превращение указанного спирта (14) в соответствующий мезилат (или эквивалентную уходящую группу), проведение нуклеофильного замещения цианидионом, гидролиз образовавшегося нитрила в соответствующую карбоновую кислоту с последующим восстановлением в первичный спирт. Гидролиз в типичном случае проводят в кислотных условиях (например, в смеси уксусной кислоты и конц. НСl при 110 С) и восстановление в удобном случае проводят последовательной обработкой изобутилхлорформиатом и борогидридом в ТГФ. Соединения формулы I, в которой m равно 1 и R1b представляет собой Н или C1-4-алкил, могут быть получены окислением спирта (12) в соответствующий альдегид или кетон и превращением его карбонильной группы способом, описанным выше в связи с превращением кетонов (4) в соединения формулыI, в которой m равно 0. Например, окисление спиртов (12), у которых R10 представляет собой Н, обеспечивает получение соответствующих циклогексанкарбоксальдегидов, которые могут быть конденсированы с Рh3 Р=СO2 Еt с получением этиловых эфиров 2-циклогексилпропеновых кислот. В свою очередь, они могут быть гидрированы в соответствующие этил-2-циклогексилпропионаты, которые, необязательно,могут быть подвергнуты алкилированию и/или гидролизу в соответствующие кислоты и/или превращены в различные амидные или альтернативные эфирные производные. Когда исходные материалы и реагенты, используемые в вышеописанных синтетических схемах, не являются сами коммерчески доступными, они могут быть получены с применением стандартных способов органического синтеза для коммерчески доступных материалов. Должно быть понятно, что многие из вышеописанных синтетических схем могут давать смеси стереоизомеров. В частности, некоторые продукты могут образовываться в виде смесей цис- и трансизомеров, у которых определенный заместитель цикла находится на той же или на противоположной стороне от кольца, как арилсульфонильная группа. Такие смеси могут быть разделены общепринятыми способами, такими как фракционная кристаллизация и препаративная хроматография.-5 006225 Некоторые соединения в соответствии с изобретением могут существовать в виде оптических изомеров вследствие присутствия одного или нескольких хиральных центров или вследствие общей асимметрии молекулы. Такие соединения могут быть получены в рацемической форме или индивидуальные энантиомеры могут быть получены либо энантиоспецифическим синтезом, либо разделением на изомеры. Новые соединения можно, например, разделить на составляющие энантиомеры стандартными способами, такими как препаративная ВЭЖХ или получение диастереомерной пары образованием соли с оптически активной кислотой, такой как (-)-ди-п-толуоил-d-винная кислота и/или (+)-ди-п-толуоил-1 винная кислота, с последующей фракционной кристаллизацией и регенерацией свободного основания. Новые соединения могут быть также разделены образованием диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хирального вспомогательного соединения. Во время выполнения любой из вышеуказанных синтетических последовательностей может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы в любой из принимающих участие молекул. Этого можно достичь при помощи общепринятых защитных групп, таких как группы, описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press,1973; and T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley and Sons, 1991. Защитные группы могут быть удалены на подходящей последующей стадии с использованием способов,известных в данной области. Подходящие способы анализа уровня активности соединений настоящего изобретения относительно -секретазы описаны в WO 01/70677 и в Biochemistry, 2000, 39(30), 8698-8704. Соединения из примеров настоящего изобретения все имеют ED50 меньше чем 10 мкМ, предпочтительно меньше чем 1 мкМ и наиболее предпочтительно меньше чем 100 нМ по меньшей мере в одном из вышеуказанных анализов. Следующие примеры иллюстрируют настоящее изобретение. Примеры Промежуточный продукт 1. 4-Хлортиофенол (3,6 г, 0,025 моль) в дихлорметане (100 мл) обрабатывают 2,5-дихлорбензилбромидом (5,17 г, 0025 моль) и триэтиламином (3,9 мл, 0,028 моль), реакционную смесь перемешивают в течение 2 ч, затем разбавляют дихлорметаном (250 мл) и промывают водой (100 мл) и насыщенным раствором соли (100 мл). Отделенный органический слой сушат (МgSO4) и выпаривают досуха. Продукт очищают пропусканием через слой диоксида кремния, элюируя смесями гексан-этилацетат. 1H ЯМР СDСl3 7,23 (4 Н, с), 6,69-6,86 (3 Н, м) и 4,04 (2 Н, с). Указанный простой тиоэфир (5,12 г, 0,018 моль) растворяют в дихлорметане (100 мл) и обрабатывают м-хлорпероксибензойной кислотой (14,3 г, 0,042 моль (50 мас./мас.% и перемешивают в течение 2 ч. Реакционную смесь затем промывают Na2S2O5 (5% раствор, 100 мл), насыщенным раствором соли (50 мл), сушат (MgSO4) и упаривают досуха. Полученный сульфон очищают на диоксиде кремния, элюируя смесями гексан-этилацетат, 3,6 г. 1H ЯМР CDCl3 7,61 (2 Н, д, J=8,6 Гц), 7,45 (2 Н, д, J=8,6 Гц), 7,13-7,08 Получают, как промежуточный продукт 1, с использованием 4-трифторметилтиофенола, продукт получен в виде твердого вещества. 1H ЯМР (360 МГц, СDCl3)7,85-7,83 (2 Н, м), 7,76-7,74 (2 Н, м), 7,157,10 (1H, м), 7,06-7,0 (1H, м), 6,92-6,86 (1H, м) и 4,46 (2 Н, с). Пример получения 1. К промежуточному продукту 1 (1 г, 3,31 ммоль) и метилакрилату (0,84 мл, 9,27 ммоль) в тетрагидрофуране (30 мл) по каплям добавляют трет-бутоксид калия (3,64 мл 1 М раствора в тетрагидрофуране,3,64 ммоль). Реакционную смесь перемешивают в течение 2 ч, разбавляют этилацетатом (100 мл) и про-6 006225 мывают водой (50 мл) и насыщенным раствором соли (50 мл). Органическую фазу отделяют, сушат(MgSO4) и упаривают досуха и продукт очищают на диоксиде кремния, элюируя смесями гексанэтилацетат (1,0 г). 1H ЯМР CDCl3 12,0 (1 Н, с), 7,41 (4 Н, с), 7,06-7,0 (2 Н, м), 6,87-6,81 (1 Н, с), 3,81 (3 Н, с),3,38 (1 Н, дд, J=3,2, 15,8 Гц), 3,02-2,92 (2 Н, м), 2,52 (1 Н, дд, J=5,7, 18,5 Гц), 2,3-2,2 (1 Н, м) и 2,2-2,1 (1H, м). Пример получения 2. Сложный эфир из примера получения 1 (1,0 г, 2,25 ммоль) в диметилсульфоксиде (10 мл) обрабатывают NaCl (0,3 г, 4,96 ммоль) и водой (0,9 мл, 4,96 ммоль) и нагревают при 150 С в течение 2 ч. Охлажденную реакционную смесь разбавляют этилацетатом (100 мл), промывают насыщенным NH4C1 (100 мл) и органическую фазу отделяют, сушат (MgSO4) и упаривают досуха. Продукт очищают на диоксиде кремния, элюируя смесями гексан-этилацетат, 0,5 г. 1H ЯМР CDCl3 7,43-7,37 (4 Н, м), 7,22-7,1 (2 Н, м),6,97-6,9 (1H, м), 3,05-2,98 (2 Н, м) и 2,61-2,53 (2 Н, м). Пример получения 3. Синтезируют по методикам примеров получения 1 и 2 с использованием промежуточного продукта 2, получая при этом продукт в виде твердого вещества (0,3 г). 1H ЯМР (360 МГц, СDCl3)7,71-7,69 (2 Н,д, J=7,5ru), 6,62-6,60 (2 Н, д, J=7,4ru), 7,22-7,11 (2 Н, м), 6,95-6,88 (1 Н, м), 3,02-2,99 (2 Н, м), 2,63-2,54 (4 Н,м) и 2,25-2,16 (2 Н, м). Пример получения 4. Этил(диэтоксифосфинил)ацетат (5,16 мл, 26 ммоль) добавляют по каплям к суспензии гидрида натрия (60% дисперсия в минеральном масле, 988 мг, 24,7 ммоль) в тетрагидрофуране (60 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. На протяжении 20 мин по каплям добавляют кетон из примера получения 2 (5 г, 13 ммоль) в тетрагидрофуране (50 мл) и смесь перемешивают при комнатной температуре в течение 18 ч. Добавляют воду и смесь экстрагируют этилацетатом. Объединенные органические фракции промывают водой, сушат (MgSO4) и растворитель выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле при элюировании смесью изогексан:EtOAc (85:15), получая при этом продукт в виде белого твердого вещества (5,2 г, 88%). 1 Кетон из примера получения 2 (0,1 г, 0,26 ммоль) в метаноле (2 мл) обрабатывают NaBH4 (0,098 г,0,26 ммоль) и перемешивают в течение 1 ч. Реакционную смесь гасят НСl (1 н, 10 мл), разбавляют этилацетатом (20 мл), затем органическую фазу отделяют, сушат (MgSO4) и упаривают досуха. Цис- и транспродукты очищают на диоксиде кремния, элюируя смесями гексан-этилацетат. транс-Циклогексанол из примера получения 5 (2,7 г, 6,9 ммоль) и триэтиламин (1,45 мл, 10,3 ммоль) в дихлорметане (50 мл) обрабатывают метансульфонилхлоридом (0,645 мл, 8,9 ммоль) при -30 С. Спустя 30 мин смесь промывают водой (20 мл), 10% водной лимонной кислотой (20 мл) и насыщенным водным гидрокарбонатом натрия (50 мл), сушат (MgSO4) и выпаривают досуха. Твердое вещество растирают с эфиром, получая при этом мезилат (2,6 г). 1H ЯМР (CDCl3) 7,40-7,37 (4 Н, м), 7,12-7,07 (2 Н, м),6,92-6,83 (1 Н, м), 4,78-4,65 (1 Н, м), 2,96 (3H, с), 2,88-2,52 (2 Н, м), 2,29-2,21 (4 Н, м) и 1,59-1,47 (2 Н, м). Пример получения 7. транс-Мезилат из примера получения 6 (103 мг, 0,22 ммоль) растворяют в толуоле (20 мл) и добавляют к предварительно подвергнутому азеотропной перегонке образцу цианида тетрабутиламмония (354 мг, 1,32 ммоль) и смесь нагревают до 70 С на протяжении 18 ч и затем охлаждают до комнатной температуры. Раствор разбавляют водой (10 мл) и промывают этилацетатом (2 х 50 мл). Органическую фазу промывают насыщенным раствором соли (10 мл), сушат (МgSO4) и выпаривают. Полученное прозрачное масло очищают колоночной хроматографией на силикагеле при элюировании 10-20% этилацетатом в гексанах, получая при этом цианид. 1H ЯМР (СDCl3) 7,42-7,36 (4 Н, с), 7,10-7,05 (2 Н, м), 6,89-6,84 (1 Н, м),2,88-2,86 (1 Н, м), 2,76-2,72 (2 Н, м), 2,52-2,45 (1 Н, м), 2,12-2,07 (1 Н, м) и 1,56-1,49 (1 Н, м). Пример получения 8. Цианид из примера получения 7 (143 мг, 0,36 ммоль) растворяют/суспендируют в смеси ледяной уксусной кислоты (10 мл) и конц. НСl (6 мл) и нагревают при 110 С в течение 15 ч. Смесь охлаждают,разбавляют этилацетатом и промывают водой (х 3), сушат (MgSO4) и упаривают досуха. Данный неочищенный остаток (153 мг) очищают препаративной ТСХ (5% метанол в смеси дихлорметан/1% уксусная кислота). 1 Н ЯМР (СDСl3) 7,38-7,35 (4 Н, с), 7,08-7,06 (2 Н, м), 6,90-6,84 (1 Н, м), 2,65-2,58 (2 Н, м), 2,382,33 (3H, м) и 1,76-1,49 (4 Н, м). Пример получения 9. Цианид из примера получения 8 (50 мг, 0,12 ммоль) растворяют в смеси тетрагидрофурана (4,5 мл) и воды (0,5 мл) и перемешивают при 20 С. Смесь обрабатывают пероксидом водорода (20 мл, 0,6 ммоль) и затем гидроксидом лития (6 мл, 0,25 ммоль) в течение 2 ч. Добавляют пероксид водорода (20 мл, 0,6 ммоль) и затем гидроксид лития (6 мг, 0,25 ммоль) и смесь перемешивают при комнатной температуре в течение 72 ч. Смесь охлаждают, разбавляют этилацетатом и промывают водой (х 2) и насыщ. бисульфитом натрия, сушат (MgSO4) и упаривают досуха. Данный неочищенный остаток (51 мг) очищают препаративной ТСХ (20% этилацетат в гексанах). 1H ЯМР (СDCl3) 7,37 (4 Н, с), 7,10-7,02 (2 Н, м), 6,90-6,84 (1 Н,м), 5,57 (2 Н, тир. с), 2,54-2,48 (3H, м), 2,43-2,39 (1 Н, м), 2,19-2,15 (2 Н, м) и 1,62-1,50 (3H, м). Пример 1. Борогидрид натрия(313 мг, 8,23 ммоль) добавляют к смеси ненасыщенного сложного эфира из примера получения 4 (3,74 г, 8,23 ммоль) и хлорида никеля (II) (2,67 г, 20,6 ммоль) в этаноле (100 мл).-8 006225 Смесь перемешивают при комнатной температуре в течение 20 мин, затем добавляют воду (100 мл). Смесь фильтруют через Hyflo, промывают этанолом и этилацетатом. Растворитель выпаривают при пониженном давлении и остаток распределяют между этилацетатом и водой. Органический слой отделяют, сушат (МgSO4) и растворитель выпаривают при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с элюированием смесью изогексан:ЕtOАс (85:15), получая при этом быстрее движущийся цис-изомер в виде масла (1,36 г, 36%), 1H ЯМР (400 МГц, СDCl3)7,37-7,30 (4 Н, м), 7,09-7,00 (2 Н, м), 6,86-6,79 (1 Н, м), 4,14 (2 Н, кв, J=7,1 Гц),2,47 (2 Н, д, J=7,6 Гц), 2,46-2,38 (2 Н, м), 2,19-2,14 (1 Н, м), 1,76-1,71 (2 Н, м), 1,57-1,48 (4 Н, м), 1,27 (3H, т,J=7,1 Гц); а также медленнее движущийся транс-изомер в виде масла (200 мг, 5,3%). Пример 2.(1,33 г, 2,91 ммоль) в этаноле (40 мл). Смесь дегазируют и перемешивают при комнатной температуре в атмосфере газообразного азота в течение 5 ч. Смесь выливают в водную хлористо-водородную кислоту(1 М) и экстрагируют этилацетатом. Органический экстракт сушат (MgSO4) и растворитель выпаривают при пониженном давлении, получая при этом белое твердое вещество, которое затем кристаллизуют изIPA, получая при этом продукт в виде белого твердого вещества (950 мг, 76%). 1H ЯМР (400 МГц,СD3OD)7,51-7,49 (2 Н, м), 7,40-7,37 (2 Н, м), 7,19-7,10 (2 Н, м), 7,00-6,94 (1 Н, м), 2,51-2,35 (6 Н, м), 2,132,10 (1 Н, м), 1,78-1,74 (2 Н, м), 1,57-1,50 (2 Н, м). Пример 3. Кислоту из примера 2 (50 мг, 0,117 ммоль), морфолин (30 мкл, 0,351 ммоль), 1 гидроксибензотриазол (24 мг, 0,176 ммоль) и триэтиламин (65 мкл, 0,468 ммоль) перемешивают в тетрагидрофуране при комнатной температуре в атмосфере газообразного азота в течение 10 мин. К смеси добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (45 мг, 0,234 ммоль) и смесь перемешивают в течение 24 ч. Смесь выливают в водный гидроксид натрия (1 М) и экстрагируют этилацетатом. Органический экстракт сушат (MgSO4) и растворитель выпаривают при пониженном давлении. Остаток очищают колоночной флэш-хроматографией на силикагеле с элюированием от 5 до 10% метанолом в дихлорметане, получая при этом продукт в виде белой пены (50 мг, 86%). 1H ЯМР (400 МГц,CD3OD)7,50 (2 Н, д, J=8,6 Гц), 7,37 (2 Н, д, J=8,6 Гц), 7,19-7,09 (2 Н, м), 7,00-6,93 (1 Н, м), 3,69-3,63 (4 Н,м), 3,59-3,56 (4 Н, м), 2,55 (2 Н, д, J=7,4 Гц), 2,47-2,39 (4 Н, м), 2,16-2,07 (1 Н, м), 1,78-1,74 (2 Н, м), 1,58-1,51(2 Н, м). m/z (ES+) (М+1) 498+500. Примеры 4-15. Следующие соединения получают способом примера 3 с использованием подходящего амина вместо морфолина. Соединения указанных примеров получают следующим способом с использованием подходящего свободного основания амина или соли амина с предшествующей нейтрализацией. К перемешиваемой суспензии цис-4-(4-хлорбензолсульфонил)-4-(2,5-дихлорфенил) циклогексануксусной кислоты (пример 2, 0,15 г, 0,35 ммоль) в дихлорметане (5 мл) добавляют оксалилхлорид (0,05 мл, 0,57 ммоль) и диметилформамид (1 капля). Спустя 30 мин раствор выпаривают до небольшого объема и к раствору остатка в дихлорметане (5 мл) добавляют нужный амин (1,75 ммоль). После перемешивания раствора в течение 20 мин растворитель удаляют в вакууме и остаток очищают хроматографией на силикагеле, элюируя с повышающимися концентрациями этилацетата в изогексане (25%, 50%). Фракции,содержащие продукт, выпаривают, получая при этом амид. Хроматографическую очистку проводят на силикагеле с использованием, где это необходимо, подходящих концентраций этилацетата в изогексане,этилацетата или метанола в этилацетате. К раствору цис-амида из примера получения 9 (46 мг) и пиридина (0,053 мл) в тетрагидрофуране (1 мл) добавляют трифторуксусный ангидрид (0,056 мл). Раствор перемешивают при комнатной температуре в течение 2 ч при добавлении 0,5 М НСl (водный) и этилацетата. Органическую фазу сушат (MgSO4),упаривают до небольшого объема и очищают хроматографией на силикагеле при элюировании смесью изогексан:этилацетат (5:1), получая при этом нужный продукт в виде бесцветного твердого вещества. 1H ЯМР (360 МГц, CDCl3)1,61-1,70 (2 Н, м), 1,86-1,94 (2 Н, м), 2,03-2,10 (1 Н, м), 2,42-2,45 (4 Н, м), 2,51 (2 Н,д, J=8,0 Гц), 6,8 (1 Н, м), 7,02-7,09 (2 Н, м), 7,30 (2 Н, д, J=8,6 Гц), 7,36 (2 Н, д, J=8,7 Гц). Пример 34. Кислоту из примера получения 8 (153 мг) растворяют в безводном ТГФ (10 мл) и охлаждают до 0 С в атмосфере азота. Добавляют триэтиламин (61 мкл, 0,43 ммоль) и изобутилхлорформиат (57 мкл, 43 ммоль) и смесь перемешивают при 0 С в течение одного часа. Осадок, который образуется, удаляют фильтрованием и промывают дополнительно 5 мл безводного ТГФ. Объединенные слои ТГФ снова охлаждают до 0 С и добавляют борогидрид натрия (70 мг, 1,84 ммоль) в виде раствора в воде (2 мл) (вскипание). После перемешивания в течение 30 мин при 0 С реакционную смесь разбавляют этилацетатом,промывают раствором хлорида аммония, раствором бикарбоната натрия и насыщенным раствором соли,затем сушат (MgSO4) и упаривают досуха. Остаток очищают колоночной хроматографией с элюированием смесью этилацетат:гексан (1:3), получая при этом нужный спирт (75 мг). 1H ЯМР (СDСl3) 7,39-7,31 Стадия (1). К раствору кислоты из примера 2 (1 г) в DCM (50 мл) и этилацетате (30 мл) добавляют пентафторфенол (1,5 экв.) и DCC (1,5 экв.) и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь выпаривают в вакууме, растворяют в этилацетате и фильтруют. Фильтрат выпаривают в вакууме, получая при этом сложный эфир пентафторфенола с достаточной чистотой для использования в последующих реакциях. Стадия (2). К сложному эфиру пентафторфенола, полученному в стадии (1) (155 мг, 0,25 ммоль) и растворенному в ДМФ (3 мл), в атмосфере азота добавляют гидрохлорид метилового эфира глицина (125 мг, 1,0 ммоль) и триэтиламин (0,15 мл). Спустя 2 ч реакционную смесь разбавляют водой, экстрагируют этилацетатом (х 3), промывают водой, насыщенным раствором соли, сушат (МgSO4), фильтруют и упаривают. Очищают колоночной флэш-хроматографией (от смеси 1:1 изогексан/этилацетат до смеси 9:1 этилацетат/метанол), получая при этом белое твердое вещество (55 мг). 1H ЯМР (СDCl3)1,08-1,16 (1 Н, м), 1,301,37 (1 Н, м), 1,67-1,71 (1 Н, м), 1,75-1,79 (2 Н, м), 1,91-1,95 (1 Н, м), 2,20-2,26 (1 Н, м), 2,41 (4 Н, д, J=7,8 Гц),3,77 (3H, с), 4,05 (2 Н, д, J=5,1 Гц), 6,19 (1 Н, шир.), 6,79-6,85 (1H, м), 7,00-7,07 (2 Н, м), 7,30-7,37 (4 Н, м). Пример 36. Эфир глицина, полученный в примере 35 (50 мг, 0,1 ммоль), помещенный в герметизированную трубку и растворенный в 2 М растворе аммиака в метаноле (3 мл), нагревают до 50 С в течение 3 ч. После охлаждения до комнатной температуры реакционную смесь концентрируют и очищают растиранием с эфиром, получая при этом белое твердое вещество (28 мг). МС(ЕI+): 485 (МН+). Пример 37. Спирт примера 34 (4 г, 10 ммоль) растворяют в дихлорметане (280 мл) и обрабатывают периодинаном Десса-Мартина (4,66 г, 11 ммоль) и смесь перемешивают в течение 45 мин перед добавлением насыщенного водного бисульфита натрия (100 мл) и спустя 5 мин смесь разделяют и органическую фазу промывают насыщенным водным бикарбонатом натрия (100 мл), сушат (МgSO4) и упаривают досуха. Неочищенный остаток (4 г) растворяют в безводном дихлорметане (100 мл) и обрабатывают метилтрифенилфосфиноацетатом (4,7 г, 14 ммоль), перемешивают при комнатной температуре в течение 16 ч. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле с элюированием 10-20% этилацетатом в гексанах, получая при этом продукт. 1H ЯМР (CDCl3) 7,37-7,36 (4 Н, м), 7,107,02 (3H, м), 6,78-6,83 (1 Н, м), 5,91 (1 Н, д, J=16 Гц), 3,77 (3H, с), 2,55-2,45 (3H, м), 2,40-2,38 (2 Н, м), 1,951,90 (2 Н, м) и 1,65-1,52 (2 Н, м). Пример 38.- 12006225 Алкен из примера 37 (3,6 г, 9 ммоль) растворяют в этилацетате (350 мл) . Колбу дегазируют и затем добавляют 10% палладий на угле (400 мг) и смесь перемешивают в атмосфере водорода в течение 45 мин. Раствор фильтруют через целит и упаривают. Полученное прозрачное масло очищают препаративной ТСХ, элюируя 5% этилацетатом в гексанах. Полученное масло затем дополнительно очищают колоночной хроматографией на силикагеле с элюированием 5-10% этилацетатом в гексане, получая при этом продукт. 1H ЯМР (CDCl3) 7,37-7,34 (4 Н, м), 7,08-7,00 (2 Н, м), 6,85-6,81 (1 Н, м), 3,67 (3H, с), 2,45-2,39 (4 Н,м), 2,33 (2 Н, т, J=8,4ru), 1,81 (2 Н, кв, J=8,4 Гц), 1,72-1,68 (2 Н, м) и 1,60-1,43 (3H, м). Пример 39. Сложный эфир примера 38 (104 мг, 0,23 ммоль) растворяют в смеси этанола (10 мл) и воды (3 мл) и перемешивают при 20 С. Колбу дегазируют и затем добавляют гидроксид лития (27 мг, 1,15 ммоль). Смесь перемешивают в течение 3 ч при комнатной температуре. Затем добавляют 1 н. хлористоводородную кислоту и смесь промывают этилацетатом (2 х 50 мл). Органическую фазу промывают насыщенным раствором соли (50 мл), сушат (МgSO4) и упаривают. Полученное масло затем дополнительно очищают препаративной ТСХ с элюированием этилацетатом, получая при этом кислоту. 1H ЯМР (СDCl3) 7,37-7,30 (4 Н, м), 7,09-6,99 (2 Н, м), 6,85-6,79 (1 Н, м), 2,42-2,36 (6 Н, м), 1,85-1,79 (2 Н, м), 1,73-1,69 (2 Н,м), 1,63-1,58 (1H, м) и 1,53-1,45 (2 Н, м). Пример 40. Кислоту из примера 39 (52 мг, 0,118 ммоль) в дихлорметане (2 мл) обрабатывают оксалилхлоридом(88 мкл, 2 М раствор в дихлорметане, 0,176 ммоль). Добавляют каплю N,N-диметилформамида и раствор оставляют при перемешивании в течение 2 ч. После указанного времени растворитель удаляют в вакууме и остаток снова растворяют в дихлорметане (1 мл). Данный раствор по каплям добавляют к раствору аммиака в метаноле (2 М, 2 мл). Реакционную смесь упаривают в вакууме и остаток хроматографируют на диоксиде кремния, элюируя 80% этилацетатом в гексанах. Образовавшееся вещество очищают дополнительно препаративной ТСХ с элюированием 100% этилацетатом с последующей перекристаллизацией из горячего гексана, получая при этом продукт (7,4 мг, 14%). 1H ЯМР (360 МГц, СDCl3) 1,45-1,53 (2 Н, м),1,57-1,65 (1H, шир.), 1,70-1,75 (2 Н, м), 1,78-1,84 (2 Н, м), 2,32 (2 Н, т, J=15,3 Гц), 2,38-2,44 (4 Н, шир), 2,95-78 С, обрабатывают бис(триметилсилил)амидом натрия (2,20 мл, 1 М раствор в тетрагидрофуране, 2,20 ммоль) и перемешивают при нагревании до комнатной температуры на протяжении 2 ч. Затем к смеси при -20 С добавляют метилиодид (457 мкл, 7,36 ммоль) и перемешивание продолжают, опять нагревая до комнатной температуры в течение 2 ч. Реакционную смесь гасят ледяной уксусной кислотой (132 мкл,2,20 ммоль), разбавляют хлоридом аммония (50%, водн., 80 мл) и экстрагируют этилацетатом (3 х 100 мл). Объединенные органические слои затем промывают раствором соли (насыщ., 200 мл), сушат(MgSO4) и упаривают в вакууме, получая при этом неочищенный продукт (670 мг). Данное вещество хроматографируют на диоксиде кремния при элюировании 8% этилацетатом в гексанах, получая при этом продукт (272 мг, 40%). 1H ЯМР (400 МГц, СDCl3) 1,16 (3H, д, J=6,9 Гц), 1,28 (3H, т, J=7,1 Гц), 1,45 Получают из кетона примера получения 3 по методикам примера получения 4 и примеров 1 и 2. 1H ЯМР (360 МГц, СDСl3), 1,52-1,61 (2 Н, м), 1,76-1,81 (2 Н, м), 2,20-2,26 (1 Н, м), 2,39 (2 Н, д, J=7,6 Гц), 2,402,50 (4 Н, м), 5,37 (1 Н, шир.), 5,51 (1 Н, шир.), 6,75-6,83 (1 Н, м), 7,01-7,08 (2 Н, м), 7,51 (2 Н, д, J=8,3 Гц) и 7,64 (2 Н, д, J=8,3 Гц). Пример 43. Получают из кислоты примера 42 по методике примера 35 с использованием аммиака во второй стадии. МС МН+ 462(463). Пример 44. Получают из кетона примера получения 3 по методикам примеров получения 5-8 и примеров 34, 37,38 и 39. 1 Н ЯМР (360 МГц, СDСl3)10,1 (1H, м), 7,64 (2 Н, д, J=8,3 Гц), 7,53 (2 Н, д, J=8,3 Гц), 7,09-7,00Ar1 представляет собой фенил или пиридил, каждый из которых имеет 0-3 заместителя, независимо выбранных из галогена, CN, NO2, СF3, ОН, ОСF3, C1-4-алкокси или C1-4-алкила, который, необязательно,имеет заместитель, выбранный из галогена, CN, NO2, СF3, ОН и C1-4-алкокси;Ar2 представляет собой фенил, который замещен галогеном в положениях 2 и 5;R2a представляет собой Н, C1-6-алкил, С 3-6-циклоалкил, С 3-6-циклоалкил-С 1-6-алкил, С 2-6-алкенил,любой из которых, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, СF3, OR2b,CO2R2b, N(R2b)2, CON(R2b)2, Ar и СОAr, или R2a представляет собой Ar или две группы R2a вместе с атомом азота, к которому они взаимно присоединены, могут замкнуть N-гетероциклильную группу, имеющую 0-4 заместителя, независимо выбранных из =O, =S, галогена, C1-4-алкила, CN, NO2, СF3, ОН, C1-4 алкокси, C1-4-алкоксикарбонила, СO2 Н, амино, C1-4-алкиламино, ди(С 1-4-алкил)амино, карбамоила, Ar и СОAr;R2b представляет собой Н, C1-6-алкил, С 3-6-циклоалкил, С 3-6-циклоалкил-С 1-6-алкил, С 2-6-алкенил,любой из которых, необязательно, имеет заместитель, выбранный из галогена, CN, NO2, СF3, ОН, C1-4 алкокси, C1-4-алкоксикарбонила, СO2 Н, амино, C1-4-алкиламино, ди(С 1-4-алкил)амино, карбамоила, Ar или СОAr, или R2b представляет собой Ar или две группы R2b вместе с атомом азота, к которому они взаимно присоединены, могут замкнуть N-гетероциклильную группу, имеющую 0-4 заместителя, независимо вы- 14006225 бранных из =O, =S, галогена, C1-4-алкила, CN, NO2, СF3, ОН, C1-4-алкокси, C1-4-алкоксикарбонила, CO2H,амино, C1-4-алкиламино, ди(C1-4-алкил)амино, карбамоила, Ar и СОAr;Ar представляет собой фенил или гетероарил, имеющий 0-3 заместителя, выбранных из галогена,C1-4-алкила, CN, NO2, СF3, ОН, C1-4-алкокси, C1-4-алкоксикарбонила, амино, C1-4-алкиламино, ди(C1-4 алкил)амино, карбамоила, C1-4-алкилкарбамоила и ди(С 1-4-алкил)карбамоила; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где Ar1 выбран из фенильных групп, замещенных в положении 4 галогеном,метилом или трифторметилом, и фенильных групп, замещенных галогеном в положениях 3 и 4. 3. Соединение по п.1 или 2, где Ar1 представляет собой 4-фторфенил или 4-трифторметилфенил и 2Ar представляет собой 2,5-дифторфенил. 4. Соединение по любому из пп.1-3, где Z представляет собой CO2R2a и R2a представляет собой Н или C1-4-алкил. 5. Соединение по п.1, где m равно 1, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1b и R1c, оба, представляют собой Н и Z представляет собой СO2 Н, или его фармацевтически приемлемая соль. 6. Соединение по п.1, где m равно 1, Ar1 представляет собой 4-трифторметилфенил, Ar2 представляет собой 2,5-дифторфенил, R1b и R1c, оба, представляют собой Н и Z представляет собой СO2 Н, или его фармацевтически приемлемая соль. 7. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляет собой Н и Z представляет собой CONH2, или его фармацевтически приемлемая соль. 8. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-трифторметилфенил, Ar2 представляет собой 2,5-дифторфенил, R1 с представляют собой Н и Z представляет собой CONH2, или его фармацевтически приемлемая соль. 9. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляет собой Н и Z представляет собой СОNНСН 2 СН 3, или его фармацевтически приемлемая соль. 10. Соединение по п.1, где m равно 0, Ar1 представляет собой 4-хлорфенил, Ar2 представляет собой 2,5-дифторфенил, R1c представляет собой Н и Z представляет собой CN, или его фармацевтически приемлемая соль. 11. Фармацевтическая композиция, включающая соединение по любому из пп.1-10 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. 12. Соединение по любому из пп.1-10 или его фармацевтически приемлемая соль для использования в способе лечения организма человека. 13. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли при изготовлении лекарственного средства для лечения или профилактики болезни Альцгеймера. 14. Способ лечения субъекта, страдающего болезнью Альцгеймера или предрасположенного к болезни Альцгеймера, который включает введение указанному субъекту эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой соли.
МПК / Метки
МПК: C07D 213/40, A61P 25/28, A61K 31/10, C07C 317/20
Метки: новые, циклогексилсульфоны
Код ссылки
<a href="https://eas.patents.su/16-6225-novye-ciklogeksilsulfony.html" rel="bookmark" title="База патентов Евразийского Союза">Новые циклогексилсульфоны</a>
Предыдущий патент: Эргономические органы управления в хирургической системе освещения
Следующий патент: Антинеопластические комбинации












