Новые производные аналогов камптотецина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 3206
Опубликовано: 27.02.2003
Авторы: Атасси Ганем, Отефей Патрик, Пьер Алан, Лявьей Жильбер, Симетьер Бернар, Хикмен Джон
Формула / Реферат
1. Соединения формулы (I)

где n равно 0, 1 или 2,
R1, R2, R3, R4 и R5 выбраны, каждый независимо, из атома водорода, атома галогена, алкильной группы, алкоксигруппы и группы (CH2)p-NRaRb, где р равно целому числу от 0 до 6, и Ra и Rb вместе с несущим их атомом азота образуют пирролильную, пиперидинильную или пиперазинильную группу, причем каждая из этих циклических групп может быть необязательно замещенной,
или две смежные группы R2, R3, R4 и R5 вместе с несущими их углеродными атомами образуют группу -O-(CH2)t-O, где t представляет целое число от 1 до 3 включительно,
R60, R70n, R80 и R90, кaждый независимо, представляет атом водорода, гидроксигруппу или алкоксигруппу,
R61, R71n, R81 и R91, кaждый независимо, представляет атом водорода или алкильную группу, или две геминальные группы (R60 и R61) и/или (R70n и R71n), и/или (R80 и R81), и/или (R90 и R91) вместе образуют оксогруппу или группу -O-(CH2)t-O, где t представляет целое число от 1 до 3 включительно, при условии, что не все R60, R61, R70n, R71n, R80, R81, R90 и R91 представляют атом водорода, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием, при условии, что
термин "алкил" означает неразветвленную или разветвленную цепь, имеющую от 1 до 6 углеродных атомов,
термин "алкенил" означает неразветвленную или разветвленную цепь, имеющую от 2 до 6 углеродных атомов и содержащую от 1 до 3 двойных связей,
термин "алкинил" означает неразветвленную или разветвленную цепь, имеющую от 2 до 6 углеродных атомов и содержащую от 1 до 3 тройных связей,
термин "алкокси" означает неразветвленный или разветвленный алкилоксильный радикал, содержащий от 1 до 6 углеродных атомов,
термин "ацил" означает неразветвленный или разветвленный алкилкарбонильный радикал, содержащий от 1 до 6 углеродных атомов,
термин "фенил" означает фенильную или нафтильную группу,
выражение "замещенный" при использовании в связи с арильными или арилалкильными группами означает, что группы, о которых идет речь, являются замещенными одним или несколькими атомами галогена и/или группами алкил, алкокси, гидрокси, циано, нитро и/или амино (необязательно замещенными одной или двумя алкильными группами),
выражение "замещенный" при использовании в связи с пирролильными, пиперидинильными или пиперазинильными группами означает, что группы, о которых идет речь, являются замещенными одной или несколькими группами алкил, алкокси, арил, арилалкил, арилокси и/или арилоксиалкил.
2. Соединения формулы (I) по п.1, в которых n=0, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
3. Соединения формулы (I) по п.1, в которых n=1, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
4. Соединения формулы (I) по п.1, в которых n=2, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
5. Соединения формулы (I) по п.1, в которых R60 представляет гидроксигруппу и R61 представляет алкильную группу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
6. Соединения формулы (I) по п.1, в которых R80 и R81 вместе образуют оксогруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой (ым) кислотой или основанием.
7. Соединения формулы (I) по п.1, в которых R90 и R91 вместе образуют оксогруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
8. Соединения формулы (I) по п.1, в которых R80 с R81 и R90 с R91 вместе образуют две оксогруппы, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
9. Соединения формулы (I) по п.1, в которых R1 представляет атом водорода, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
10. Соединения формулы (I) по п.1, в которых R2, R3, R4 и R5 выбраны из атома водорода, атома галогена, алкильной группы и алкоксигруппы, или две из этих групп, когда они связаны сдвумя смежными атомами углерода, вместе образуют метилендиокси- или этилендиоксигруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
11. Соединения формулы (I) по п.1, в которых каждый из R1, R2 и R5 представляет атом водорода, R3 и R4 выбраны из атома водорода, атома галогена, алкильной группы и алкоксигруппы, или вместе образуют метилендиоксигруппу, R60, R70n, R80 и R90, кaждый независимо, представляет атом водорода, гидроксигруппу или алкоксигруппу и R61, R71n, R81 и R91, кaждый независимо от других, представляет атом водорода или алкильную группу, или две геминальные группы (R60 и R61) и/или (R70nи R71n), и/или (R80 и R81), и/или (R90 и R91) вместе образуют оксогруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
12. Соединение формулы (I) по п.1, которое представляет собой 3-хлор-7-этил-7-гидрокси-2-метил-9,12-дигидро-7H-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион.
13. Соединение формулы (I) по п.1, которое представляет собой 2,3-дифтор-7-этил-7-гидрокси-9,12-дигидро-7H-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион.
14. Способ получения соединений формулы (I), отличающийся тем, что в качестве исходного материала используют соединение формулы (II)
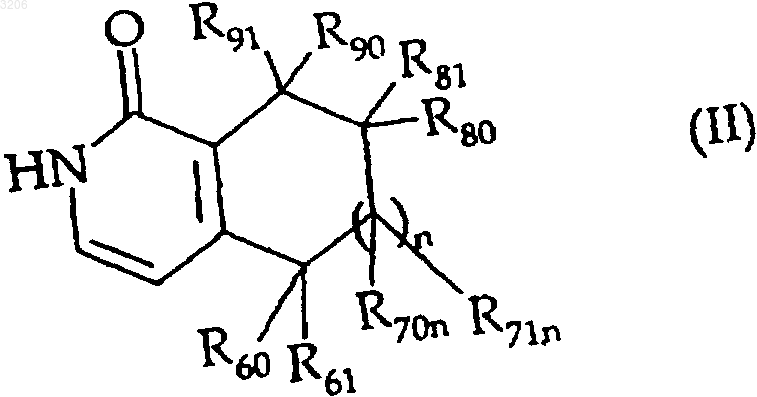
где n, R60, R61, R70n, R71n, R80, R81, R90 и R91 - такие, как определенные для формулы (I),
которое конденсируют в щелочной среде с соединением формулы (III)
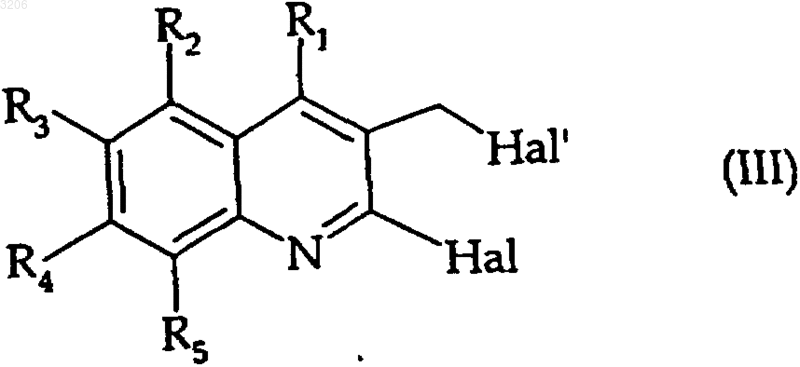
где R1, R2, R3, R4 и R5 - такие, как определенные для формулы (I), и Hal и Наl', каждый независимо от других, представляет атом галогена,
или с соединением формулы (III')
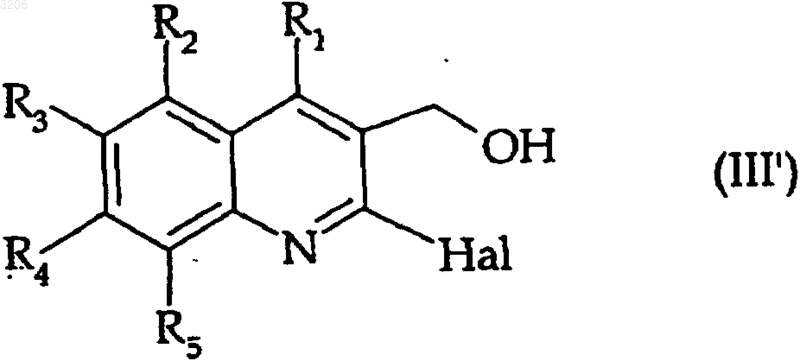
где R1, R2, R3, R4, R5 и Hal - такие, как определенные выше,
с получением соединения формулы (IV)
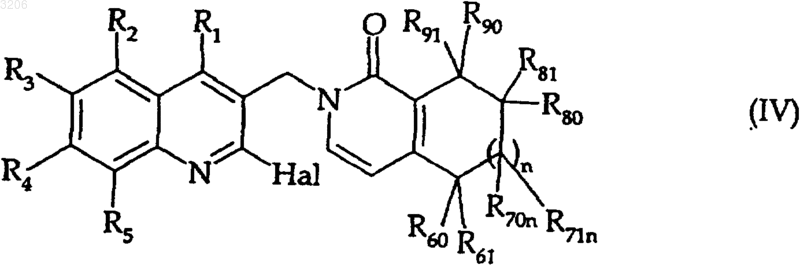
где R1, R2, R3, R4, R5, n, R60, R61, R70n, R71n, R80, R81, R90, R91 и Hal - такие, как определенные выше,
которое (соединение (IV)) подвергают реакции внутримолекулярной циклизации, катализируемой соединением палладия, с получением соединения формулы (I),
при условии, что с целью упрощения вышеописанного процесса, реакционноспособные группы, присутствующие в R60, R61, R70n, R71n, R80, R81, R90, R91, могут быть защищены обычными защитными группами и в подходящий момент освобождены от защиты, что гидроксигруппы в тех же самых положениях могут быть окислены традиционными химическими методами до оксогрупп и, наоборот, оксогруппы в тех же самых положениях могут быть восстановлены традиционными восстановителями в любой подходящий момент синтеза и что, когда две из указанных групп вместе образуют связь, последняя может быть введена в любой момент, который специалист в данной области химии посчитает подходящим для облегчения синтеза,
которые (соединения формулы (I))
могут быть при необходимости очищены в соответствии с традиционными методами очистки,
могут быть при необходимости разделены на их стереоизомеры традиционными способами разделения,
могут быть при необходимости преобразованы в аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием.
15. Способ получения по п.14, отличающийся тем, что используют вещество формулы (II')
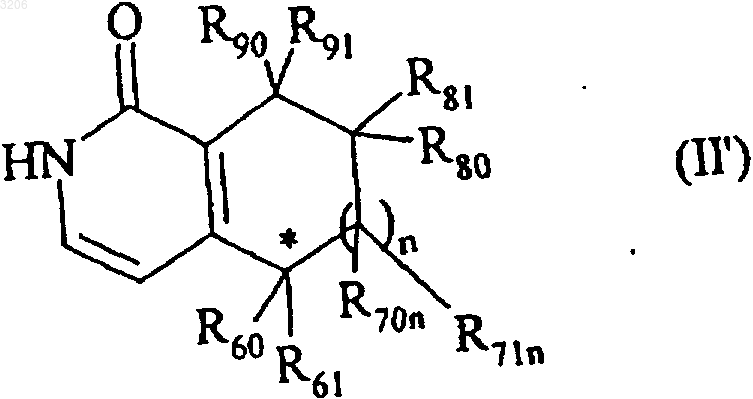
где n, R60, R61, R70n, R71n, R80, R81, R90 и R91 - такие, как определенные для формулы (I), и * означает, что углеродный атом, несущий группы R60, R61, имеет фиксированную конфигурацию (R) или (S),
чтобы получить соединение формулы (I')
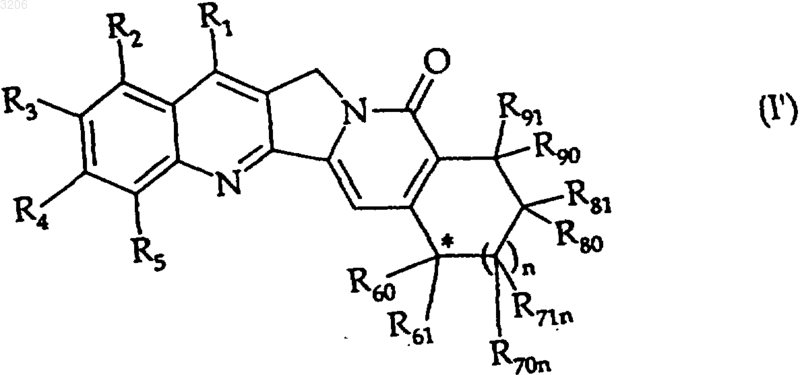
где R1, R2, R3, R4, R5, R60, R61, R70n, R71n, R80, R81, R90 и R91 - такие, как определенные для формулы (I), и * означает, что конфигурация углеродного атома фиксированная.
16. Фармацевтическая композиция, содержащая в качестве активного компонента, по крайней мере, одно соединение по любому из пп.1-13 в отдельности или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми наполнителями или носителями.
17. Фармацевтическая композиция по п.16, содержащая, по крайней мере, один активный компонент по любому из пп.1-13, для применения в изготовлении лекарственных средств для лечения раковых заболеваний.
Текст
1 Настоящее изобретение относится к новым производным аналогов камптотецина, к способу их получения и к содержащим их фармацевтическим композициям. Камптотецин, алкалоид, извлеченный изCamptotheca accuminata, является противоопухолевым средством, имеющим широкий спектр действия. Его нерастворимый характер обусловил в течение длительного времени направленный поиск нерастворимых солей соединения,токсичность которых является, как оказалось,основной помехой. Проводилось много других исследований с целью получения структурных аналогов и устранения затруднения, заключающегося в отсутствии растворимости природной молекулы (J. Med. Chem., 1991, 34, 98; Chem.Pharm. Bull., 1991, 39, 3183). Осуществленные изменения относятся, в основном, к кольцам А и В. Результаты различных исследований также показали значение кольца Е и, в частности, лактоновой функциональной группы. Действительно, последняя, наравне с открытой гидроксикислотной формой, является, по-видимому,наиболее активной формой, имеющей меньшие нежелательные эффекты (Cancer Res., 1989, 49,1465; там же, 1989, 49, 5077). Были сделаны попытки модифицировать это кольцо, в частности атом кислорода в кольце заменяли атомом азота или серы, но в каждом случае имело место снижение фармакологической активности, что подтверждало важность лактона (J. Med. Chem.,1989, 32, 715). Настоящее изобретение относится к структурным аналогам камптотецина, кольцо Е которого было модифицировано. Они характеризуются заменой лактоновой функциональной группы этого кольца на циклическую кетоновую функциональную группу (кислород в кольце был заменен углеродным атомом). Полученные соединения имеют новую структуру и, что неожиданно, обладают значительной цитотоксичностью. Поэтому их можно применять для изготовления лекарственных средств для лечения рака. Настоящее изобретение относится к соединениям формулы (I) 2 сиалкильной группы, алкоксикарбонильной группы, ацилоксигруппы, карбоксигруппы, нитрогруппы, цианогруппы, аминокарбонильной группы (необязательно замещенной по атому азота одной или двумя алкильными группами) и групп (CH2)p-NRaRb и -O-С(О)-N-RaRb, где р представляет целое число от 0 до 6 и Ra и Rb,каждый независимо, представляет атом водорода, алкильнуго группу, (С 3-С 11)циклоалкильную группу, (С 3-С 11)циклоалкилалкильную группу, ацильную группу, необязательно замещенную арильную группу или необязательно замещенную арилалкильную группу, или Ra иRb вместе с несущим их атомом азота образуют пирролильную, пиперидинильную или пиперазинильную группу, причем каждая из этих циклических групп может быть необязательно замещенной, или две смежные группы R2, R3, R4 иR5 вместе с несущими их углеродными атомами образуют группу -O-(CH2)t-O, где t представляет целое число от 1 до 3 включительно,R60, R70n, R80 и R90, каждый независимо,представляет атом водорода, гидроксигруппу,алкоксигруппу или группу О-(СО)-X или О(СО)-NXW, где Х и W, каждый независимо,представляет алкильную группу, алкенильную группу, алкинильную группу, (С 3-С 11)циклоалкильную группу, (С 3-С 11)циклоалкилалкильную группу, необязательно замещенную арильную группу или необязательно замещенную арилалкильную группу,R61, R71n, R81 и R91, каждый независимо,представляет атом водорода, алкильную группу,алкенильную группу или алкинильную группу или взятые попарно у смежных углеродных атомов вместе образуют связь или оксирановую группу или две геминальные группы (R60 и R61) и/или (R70n и R71n), и/или (R80 и R81), и/или (R90 иR91) вместе образуют оксогруппу или группу-О-(CH2)t1-O, где t1 представляет целое число от 1 до 3 включительно, при условии, что не всеR60, R61, R70n, R71n, R80, R81, R90 и R91 представляют атом водорода, их энантиомерам, диастереоизомерам и их аддитивным солям с фармацевтически приемлемой(ым) кислотой или основанием, причем понятно, что: термин алкил означает неразветвленную или разветвленную цепь, имеющую от 1 до 6 углеродных атомов,термин алкенил означает неразветвленную или разветвленную цепь, имеющую от 2 до 6 углеродных атомов и содержащую от 1 до 3 двойных связей,термин алкинил означает неразветвленную или разветвленную цепь, имеющую от 2 до 6 углеродных атомов и содержащую от 1 до 3 тройных связей,термин алкокси означает неразветвленный или разветвленный алкилоксильный радикал, содержащий от 1 до 6 углеродных атомов, 3 термин ацил означает неразветвленный или разветвленный алкилкарбонильный радикал, содержащий от 1 до 6 углеродных атомов,термин фенил означает фенильную или нафтильную группу,выражение замещенный при использовании в связи с арильными или арилалкильными группами означает, что группы, о которых идет речь, являются замещенными одним или несколькими атомами галогена и/или группами алкил, алкокси, гидрокси, циано, нитро и/или амино (необязательно замещенными одной или двумя алкильными группами),выражение замещенный при использовании в связи с пирролильными, пиперидинильными или пиперазинильными группами означает, что группы, о которых идет речь, являются замещенными одной или несколькими группами алкил, алкокси, арил, арилалкил, арилокси и/или арилоксиалкил. Преимущественно настоящее изобретение относится к соединениям формулы (I), в которых R60 представляет гидроксигруппу и R61 представляет алкильную группу (например,этил). Другое преимущественное осуществление настоящего изобретения относится к соединениям формулы (I), в которых R80 и R81 вместе образуют оксогруппу или R90 с R91 вместе образуют оксогруппу, или R80 и R81 и R90 с R91 вместе образуют две оксогруппы. Предпочтительными соединениями формулы (I), являются те, в которых R1 представляет атом водорода. Другими предпочтительными соединениями формулы (I) являются те, в которых R2, R3,R4 и R5 выбраны из атома водорода, атома галогена, алкильной группы и алкоксигруппы или две из этих групп, когда они связаны с двумя смежными атомами углерода, вместе образуют метилендиоксиили этилендиоксигруппу(предпочтительно метилендиокси). Из указанных соединений предпочтение отдается тем, в которых каждый из R2 и R5 представляет атом водорода. Особенно выгодный аспект настоящего изобретения относится к соединениям формулы(I), в которых каждый из R1, R2 и R5 представляет атом водорода, R3 и R4 выбраны из атома водорода, атома галогена, алкильной группы и алкоксигруппы или вместе образуют метилендиоксигруппу, R60, R70n, R80 и R90, каждый независимо, представляет атом водорода, гидроксигруппу или алкоксигруппу и R61, R71n, R81 и R91,каждый независимо от других, представляет атом водорода или алкильную группу или взятые попарно у смежных углеродных атомов вместе образуют связь или оксирановую группу или две геминальные группы (R60 и R61), и/или 4 Настоящее изобретение относится также к способу получения соединений формулы (I),отличающемуся тем, что в качестве исходного материала используют соединение формулы (II) где n, R60, R61, R70n, R71n, R80, R81 R90 и R91 - такие, как определены для формулы (I), которое конденсируют в щелочной среде с соединением формулы (III) где R1, R2, R3, R4 и R5 - такие, как определены для формулы (I), и Hal и Наl', каждый независимо от других, представляет атом галогена,или при условиях реакции Мицунобу с соединением формулы (III') где R1, R2, R3, R4, R5 n, R60, R61, R70n, R71n, R80,R81, R90, R91 и Hal - такие, как определены выше,которое (соединение (IV подвергают реакции внутримолекулярной циклизации типа Heck,катализируемой соединением палладия, с получением соединения формулы (I),следует учесть в целях упрощения вышеописанного процесса, что реакционноспособные группы, присутствующие в R60, R61, R70n, R71n,R80, R81, R90, R91, могут быть защищены обычными защитными группами и в подходящий момент освобождены от защиты, что гидроксигруппы в тех же самых положениях могут быть окислены традиционными химическими методами до оксогрупп и наоборот, оксогруппы в тех же самых положениях могут быть восстановлены традиционными восстановителями в любой подходящий момент синтеза и что, когда две из указанных групп вместе образуют связь, последняя может быть введена в любой момент, который специалист в данной области химии посчитает подходящим для облегчения синтеза, которые (соединения формулы (I 5 могут быть при необходимости очищены в соответствии с традиционными методами очистки,могут быть при необходимости разделены на их стереоизомеры традиционными способами разделения,могут быть при необходимости преобразованы в аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. Вещества формул (II) и (III) являются коммерческими продуктами или могут быть получены известными методами или с использованием традиционных реакций органической химии. Для иллюстрации можно упомянуть способы, описанные в J. Am. Chem. Soc., 1992,37, 10971. В частности, можно получить вещество формулы (II') где n, R60, R61, R70n, R71n, R80, R81, R90 и R91 - такие, как определены для формулы (I), иозначает, что углеродный атом, несущий группы R60,R61, имеет фиксированную конфигурацию (R) или (S), чтобы получить так, как описано выше,соединение формулы (I') где R1, R2, R3, R4, R5, R60, R61, R70n, R71n, R80, R81,R90 и R91 - такие, как определены для формулы(I), иозначает, что конфигурация углеродного атома фиксированная. Из фармацевтических композиций по настоящему изобретению следует упомянуть, в частности, те, которые пригодны для перорального, парентерального или назального введения: таблетки или драже, подъязычные таблетки, желатиновые капсулы, пастилки, суппозитории, кремы, мази, накожные гели и т.д. Применяемые дозы изменяют в соответствии с возрастом и массой пациента, характера и тяжести расстройства и способа введения, который может быть пероральным, назальным, ректальным или парентеральным. Обычно единичная доза находится в диапазоне 0,1-500 мг для лечения при 1-3 введениях за 24 ч. Следующие далее примеры иллюстрируют настоящее изобретение и ни в коей мере не ограничивают его. Используемые исходные материалы являются известными продуктами или их получают известными методами. 6 Структуры соединений, описанных в примерах и получениях, были определены обычными спектрофотометрическими методами (инфракрасный, ЯМР, масс-спектрометрия и так далее). Получение А. 7-Гидрокси-2,5,6,7-тетрагидро-1 Н-циклопента[с]пиридин-1-он. Стадия 1. 4-(1-Этоксивинил)-2-фтор-3 пиридинкарбальдегид. Смешивают последовательно 8 г (31,9 ммоль) 2-фтор-4-иод-3-пиридинкарбальдегида(2%-й молярный) в 280 мл диоксана. Реакционную смесь нагревают с обратным холодильником, пока исходный материал не исчезнет полностью. После возврата до комнатной температуры добавляют к реакционной смеси раствор фторида калия. В течение 10 мин производят интенсивное перемешивание, чтобы вызвать осаждение трибутилоловоиодида, который затем отфильтровывают, фильтрат вливают в раствор хлорида натрия. Водную фазу экстрагируют 3 раза дихлорметаном и затем органические фазы объединяют, сушат над сульфатом магния,концентрируют и очищают путем хроматографии на колонке с диоксидом кремния, используя в качестве элюента смесь дихлорметан:циклогексан (95:5), с получением указанного в заголовке продукта. Стадия 2. 7-Гидрокси-6,7-дигидро-1 Нциклопента[с]пиридин-1,5(2 Н)-дион. Смесь 770 г (3,93 ммоль) соединения, описанного на предшествующей стадии, в 51 мл(102,1 ммоль) 2 н. соляной кислоты нагревают с обратным холодильником при воздушном охлаждении в течение 2 ч, охлаждают и затем концентрируют. Полученный остаток промывают в ацетоне, фильтруют и затем перекристаллизовывают из изопропанола с получением указанного в заголовке продукта. Температура плавления: 200 С (изопропанол). Получение В. 5-Этил-5,7-дигидрокси 2,5,6,7-тетрагидро-1 Н-циклопента[с]пиридин-1 он. Стадия 1. 1-Фтор-7-гидрокси-6,7-дигидро 5 Н-циклопента[с]пиридин-5-он. Применяют способ, идентичный описанному в получении А, стадия 1, используя смесь дихлорметан:метанол в качестве элюента в ходе очистки. Полученный остаток перемешивают при комнатной температуре в течение 3 ч в растворе, состоящем из 16 мл трифторуксусной кислоты, 90 мл ацетонитрила и 35 мл воды. Затем реакционную смесь нейтрализуют водным раствором K2CO3 и экстрагируют 3 раза дихлорметаном. Объединенные органические фазы сушат над сульфатом магния, фильтруют,концентрируют и очищают путем хроматографии на колонке с диоксидом кремния (элюент: 7 смесь дихлорметан:метанол (99,5:0,5) с получением указанного в заголовке соединения. Стадия 2. 5,7-дигидрокси-5-этил-1-фтор 6,7-дигидро-1 Н-циклопента[с]пиридин. К раствору 350 мг (2,1 ммоль) соединения,описанного на предшествующей стадии, в 60 мл эфира добавляют по каплям при -30 С 1,6 мл(4,7 ммоль) 3 М раствора этилмагнийбромида в эфире. Реакционную смесь перемешивают при-30 С в течение 3 ч и затем гидролизуют насыщенным раствором хлорида аммония. Органическую фазу декантируют и водную фазу экстрагируют 3 раза этилацетатом, после чего объединенные органические фазы сушат над сульфатом магния, фильтруют, концентрируют и очищают путем хроматографии на колонке с диоксидом кремния (элюент: смесь дихлорметан:ацетон (95:5 с получением указанного в заголовке продукта. Стадия 3. 5-Этил-5,7-дигидрокси-2,5,6,7 тетрагидро-1 Н-циклопента[с]пиридин-1-он. Указанный в заголовке продукт получают в соответствии с процессом, описанным на стадии 2 получения А, используя в качестве исходного материала соединение, описанное на предшествующей стадии. Получение С. 5-Этил-5,6-дигидрокси 2,5,6,7-тетрагидро-1 Н-циклопента[с]пиридин-1 он. К раствору 2 г описанного в получении F продукта (9,65 ммоль) в 20 мл метанола добавляют при комнатной температуре 0,5 г боргидрида натрия (13,20 ммоль). После перемешивания в течение 30 мин при комнатной температуре добавляют 20 мл насыщенного водного раствора гидрокарбоната натрия. Смесь экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют в вакууме с получением указанного в заголовке продукта. Получение D. 5-Этил-5-(метоксиметокси)2,5-дигидро-1 Н-циклопента[с]пиридин-1,6,7 трион. К раствору 3 г (10,6 ммоль) соединения,полученного на стадии 3 получения F, в 130 мл диоксана добавляют раствор 2,35 г (21,2 ммоль) оксида селена в 3 мл воды. Реакционную смесь нагревают при 60 С в течение 48 ч. Реакционную смесь фильтруют, фильтрат концентрируют в вакууме и остаток растворяют в этилацетате. Путем отфильтровывания осадка получают указанный в заголовке продукт. Получение Е. 5-Этил-5-гидрокси-5,6 дигидро-1 Н-циклопента[с]пиридин-1,7(2 Н)дион. Стадия 1. 5-Этил-1-фтор-5-гидрокси 1,2,5,6-тетрагидро-7 Н-циклопента[с]пиридин-7 он. К перемешиваемому при 0 С раствору 3 г(15,2 ммоль) соединения, полученного на стадии 2 получения В, в смеси дихлорметан:ацетон 8 целита, 4 молекулярное сито и затем небольшими порциями 3,6 г (16,7 ммоль) пиридинийхлорхромата. Реакционную смесь перемешивают при комнатной температуре в течение 20 ч и фильтруют, твердое вещество промывают 3 раза 50 мл смеси дихлорметан:ацетон (50:50, об./об.) каждый раз и фильтрат концентрируют в вакууме. Полученный остаток очищают путем хроматографии на диоксиде кремния (элюент: смесь дихлорметан:ацетон, 85:15) с получением указанного в заголовке продукта. Стадия 2. 5-Этил-5-гидрокси-5,6-дигидро 1 Н-циклопента[с]пиридин-1,7(2 Н)-дион. Суспензию 3,5 г (17,7 ммоль) соединения,полученного на предшествующей стадии, в 360 мл 1 н. соляной кислоты нагревают при 80 С в течение 1 ч. Реакционную смесь концентрируют в вакууме. Твердый остаток перемешивают в эфире и осадок отфильтровывают и высушивают с получением указанного в заголовке продукта. Получение F. 5-Этил-5-гидроксиспиро(описанного в J.O.C., 1993, 58, стр.7832) в 100 мл ТГФ добавляют по каплям 6,9 мл (11 ммоль) 1,6 М раствора бутиллития в гексане. Затем реакционную смесь перемешивают 10 мин при-78 С, после чего добавляют раствор 1,5 г (12,9 ммоль) метил 2-оксобутирата в 20 мл ТГФ. Реакционную смесь перемешивают 10 мин при-78 С и затем гидролизуют смесью вода:ТГФ. Водную фазу декантируют и затем экстрагируют 3 раза 50 мл метилацетата каждый раз. Объединенные органические фазы сушат, концентрируют и очищают путем хроматографии на диоксиде кремния (элюент:смесь дихлорметан:ацетон, 95:5) с получением указанного в заголовке продукта. Стадия 2. Метил 2-(2-фтор-3-метил-4 пиридинил)-2-метоксиметоксибутаноат. К перемешиваемому при 0 С раствору 2 г(8,8 ммоль) соединения, описанного на предшествующей стадии, в 60 мл ТГФ добавляют небольшими порциями 260 мг (8,8 ммоль) 80%-й суспензии гидрида натрия в минеральном масле. По окончании добавления смесь перемешивают при комнатной температуре до тех пор, пока не прекратится выделение газа. Добавляют по каплям раствор 0,94 г (11,6 ммоль) хлорметилметилового эфира в 10 мл ТГФ и смесь перемешивают при комнатной температуре 2 ч, гидролизуют 2 н. соляной кислотой и декантируют. Водную фазу экстрагируют дихлорметаном и объединенные органические фазы сушат над сульфатом магния и концентрируют. Указанный в заголовке продукт получают путем хроматогра 9 фии остатка на диоксиде кремния (элюент: смесь дихлорметан: ацетон, 95:5). Стадия 3. 5-Этил-1-фтор-5-(метоксиметокси)-5,7-дигидро-6 Н-циклопента[с]пиридин-6-он. К перемешиваемому при 0 С раствору 9 г(88,5 ммоль) диизопропиламина в 160 мл ТГФ добавляют 55 мл (88,5 ммоль) 1,6 М раствора бутиллития в гексане. Смесь перемешивают полчаса при 0 С, после чего добавляют по каплям при указанной температуре 15,8 г (88,5 ммоль) гексаметилфосфорамида. Смесь опять перемешивают при 0 С в течение получаса, после чего добавляют по каплям раствор 5,3 г(19,5 ммоль) соединения, полученного на предшествующей стадии, в 40 мл ТГФ. Реакционную смесь перемешивают 1 ч при комнатной температуре и затем гидролизуют водой. Водную фазу экстрагируют этилацетатом, органическую фазу промывают 2 н. раствором соляной кислоты и затем насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Полученный остаток очищают путем хроматографии на диоксиде кремния (элюент: смесь дихлорметан:ацетон, 95:5) с получением указанного в заголовке продукта. Стадия 4. 5-Этил-5-гидрокси-5,7-дигидро 1 Н-циклопента[с]пиридин-1,6(2 Н)-дион. Суспензию 1 г (4,18 ммоль) соединения,полученного на предшествующей стадии, в 40 мл 3 н. соляной кислоты нагревают с обратным холодильником в течение 1 ч. Смесь концентрируют, полученный остаток растворяют в эфире и декантируют и после добавления ацетонитрила полученное твердое вещество отфильтровывают и промывают эфиром с получением целевого продукта. Стадия 5. 5-Этил-6-[2-(1,3-диоксолан)ил]5-гидрокси-5,7-дигидро-1 Н-циклопента[с]пиридин-1(2 Н)-он. Суспензию 2,5 г (13 ммоль) соединения,полученного на предшествующей стадии, 15 мл этиленгликоля и 40 мг паратолуолсульфоновой кислоты в 40 мл толуола нагревают с обратным холодильником в течение 4 ч. Смесь концентрируют в вакууме, черный остаток растворяют в этилацетате и полученный белый осадок отфильтровывают с получением указанного в заголовке продукта. Получение G. 5-Этил-5-гидрокси-2,5,7,8 тетрагидро-1,6-изохинолиндион. Стадия 1. 3-(1,3-Диоксолан-2-ил)-2-фтор-4 иодпиридин. В трехгорлой колбе, снабженной аппаратом Дина-Старка, нагревают с обратным холодильником смесь 5,1 г (20,3 ммоль) 2-фтор-4 иод-3-пиридинкарбальдегида, 1,4 г (22,3 ммоль) этан-1,2-диола и 50 мг паратолуолсульфоновой кислоты в 100 мл толуола. После накопления теоретического количества воды реакционную смесь охлаждают до комнатной температуры,промывают насыщенным раствором гидрокарбоната натрия и сушат над сульфатом магния. 10 Целевой продукт получают путем концентрирования. Стадия 2. Метил 2-[3-(1,3-диоксолан-2-ил)2-фтор-4-пиридинил]-2-гидроксибутаноат. К перемешиваемому при -78 С в атмосфере азота раствору 3,1 г (11 ммоль) 3-(1,3 диоксолан-2-ил)-2-фтор-4-иодпиридина в 100 мл ТГФ добавляют по каплям 6,9 мл (11 ммоль) 1,6 М раствора бутиллития в гексане. Затем реакционную смесь перемешивают 10 мин при-78 С, после чего добавляют по каплям раствор 15 г (13 ммоль) метил 2-оксобутирата в 20 мл ТГФ. Смесь перемешивают 3 ч при -78 С, гидролизуют смесью вода-ТГФ и декантируют. Водную фазу экстрагируют 3 раза 50 мл этилацетата каждый раз и объединенные органические фазы сушат над сульфатом магния и затем концентрируют. Целевой продукт получают очисткой остатка путем хроматографии на диоксиде кремния (элюент: смесь дихлорметанацетон, 95/5). Стадия 3. Метил 2-(бензилокси)-2-[3-(1,3 диоксолан-2-ил)-2-фтор-4-пиридинил]бутаноат. Раствор 14,8 г (51,8 ммоль) соединения,полученного на предшествующей стадии, в 100 мл ДМФ добавляют по каплям к перемешиваемой при 0 С суспензии 2 г (76,4 ммоль) 80%-го гидрида натрия в 100 мл ДМФ. По окончании добавления смесь перемешивают 1/2 ч, после чего добавляют при указанной температуре последовательно 0,15 г тетрабутиламмонийиодида и затем 9,8 г (57,1 ммоль) бензилбромида, растворенного в 50 мл ДМФ. Смесь перемешивают 2 ч при 0 С, вливают в охлажденную льдом воду и экстрагируют этилацетатом и органическую фазу промывают водой и затем сушат над сульфатом магния и концентрируют. Целевой продукт получают путем очистки остатка на силикагеле (элюент: смесь дихлорметан-ацетон,95/5). Стадия 4. Метил 2-(бензилокси)-2-[3-(3 диметоксиметил)-2-фтор-4-пиридинил]бутаноат. Раствор 3,4 г (9 ммоль) сложного эфира,полученного на предшествующей стадии, и 0,1 г паратолуолсульфоновой кислоты в 250 мл метанола перемешивают при комнатной температуре 24 ч. Концентрируют растворитель. Неочищенный остаток растворяют в этилацетате и органическую фазу нейтрализуют насыщенным раствором гидрокарбоната натрия, промывают водой и сушат над сульфатом магния. Целевой продукт получают путем концентрирования. Стадия 5. Метил 2-(бензилокси)-2-(2-фтор 3-формил-4-пиридинил)бутаноат. Раствор 20,3 г (0,178 ммоль) трифторуксусной кислоты в 20 мл воды добавляют к раствору 3,3 г (8,75 ммоль) сложного эфира, полученного на предшествующей стадии, в 60 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и декантируют. Водную фазу экстрагируют ди 11 хлорметаном и объединенные органические фазы промывают раствором гидрокарбоната натрия и затем рассолом и сушат над сульфатом магния. Целевой продукт получают путем концентрирования. Стадия 6. Метил 3-4-[1-(бензилокси)-1(метоксикарбонил)пропил]-2-фтор-3-пиридинил-2-акрилат. Смесь 21 г (63,3 ммоль) продукта, полученного на предшествующей стадии, и 22,3 г(63,3 ммоль) карбоксиметилентрифенилфосфорана в 1 л толуола нагревают с обратным холодильником в течение 2 ч 30 мин. После охлаждения до комнатной температуры удаляют растворитель путем выпаривания, остаток кристаллизуют из эфира, кристаллы отфильтровывают и фильтрат концентрируют в вакууме. Остаток очищают путем хроматографии на силикагеле(элюент: смесь дихлорметан-ацетон, от 100/0 до 96/4) с получением целевого продукта. Стадия 7. Метил 2-(бензилокси)-2-2 фтор-3-[2-(метоксикарбонил)этил]-4-пиридинилбутаноат. К перемешиваемому при 0 С раствору 16,3 г (42 ммоль) соединения, полученного на предшествующей стадии, в 900 мл метанола добавляют 2,5 г (10,5 ммоль) хлорида кобальта. Реакционную смесь перемешивают при 0 С в течение 10 мин и затем добавляют небольшими порциями 3,2 г (84 ммоль) борогидрида натрия. Затем смесь концентрируют в вакууме, остаток растворяют в этилацетате и органическую фазу промывают водой, сушат над сульфатом магния,фильтруют через Целит и концентрируют с получением целевого продукта. Стадия 8. Метил 2-(бензилокси)-2-[3-(3 метокси-3-оксопропил)-2-oкco-1,2-дигидро-4 пиридинил]бутаноат. К раствору 5 г (12,83 ммоль) соединения,полученного на предшествующей стадии, в 80 мл диоксана прибавляют 257 мл нормального раствора соляной кислоты. Затем реакционную смесь нагревают с обратным холодильником в течение 1 ч 30 мин. После возврата к комнатной температуре смесь концентрируют в вакууме и остаток очищают путем хроматографии на силикагеле (элюент: смесь дихлорметан-метанол,97/3) с получением целевого продукта. Стадия 9. Метил 5-(бензилокси)-5-этил-6 гидрокси-1-оксо-1,2,5,8-тетрагидро-7-изохинолинкарбоксилат. К перемешиваемой при 0 С суспензии 0,8 г (26,7 ммоль) 80%-го гидрида натрия в 50 мл ТГФ добавляют по каплям 200 мл раствора 4,7 г(12,1 ммоль) соединения, полученного на предшествующей стадии, в ТГФ. Затем смесь перемешивают 15 мин при 0 С, 15 мин при комнатной температуре и затем 1 ч при нагревании с обратным холодильником, после чего гидролизуют при 0 С с нормальным раствором соляной кислоты до тех пор, пока рН не станет нейтральным. Водную фазу экстрагируют дихлор 003206 12 метаном. Органическую фазу промывают водой,сушат над сульфатом магния и концентрируют с получением целевого продукта. Стадия 10. 5-(Бензилокси)-5-этил-7,8 дигидро-1,6(2H,5 Н)-изохинолиндион. Суспензию 16,1 г (45,3 ммоль) соединения,полученного на предшествующей стадии, в 60 мл нормального раствора гидроксида калия нагревают с обратным холодильником в течение 30 мин. Реакционную смесь нейтрализуют при 0 С путем добавления по каплям 2 н. раствора соляной кислоты и затем экстрагируют дихлорметаном. Органическую фазу фильтруют, сушат над сульфатом магния и концентрируют. Целевой продукт получают после очистки путем хроматографии остатка на силикагеле (элюент: смесь дихлорметан-метанол, от 100/0 до 96/4). Стадия 11. 5-Этил-5-гидpoкcи-7,8-дигидро 1,6(2 Н,5 Н)-изохинолиндион. Раствор 7,9 г (26,56 ммоль) соединения,полученного на предшествующей стадии, в 800 мл метанола перемешивают при атмосферном давлении и комнатной температуре под средой водорода в присутствии 0,8 г 10%-го палладия на углероде. После абсорбции теоретического количества водорода (приблизительно 3 ч 30 мин) катализатор удаляют путем фильтрования,фильтрат концентрируют и целевой продукт получают путем кристаллизации остатка из эфира. Получение Н. 5-Этил-5-гидрокси-7 метокси-2,5,6,7-тетрагидро-1 Н-циклопента[с] пиридин-1-он. Суспензию 2,2 г (11,95 ммоль) соединения,полученного на стадии 2 получения В, в 220 мл 1 н. соляной кислоты нагревают при 80 С в течение 1 ч 30 мин. Реакционную смесь концентрируют и остаток очищают путем хроматографии на силикагеле (элюент: смесь дихлорметанметанол, 95/5) с получением целевого продукта. Получение I. (5S)-5-Этил-5-гидрокси-5,7 дигидро-1 Н-циклопента[с]пиридин-1,6-(2 Н)дион. Стадия 1. 3-(3-Аллил-2-фтор-4-пиридинил)-3-пентанол. К раствору 11,4 г (43,3 ммоль) 3-аллил-2 фтор-4-иодпиридина (полученного способом,описанным в J.O.C., 1993, 58, стр. 7832) в 250 мл ТГФ добавляют при -75 С 27 мл (43,3 ммоль) 1,6 М раствора бутиллития в гексане. После 30 мин перемешивания при -75 С, добавляют по каплям раствор 4,6 мл 3-пентанона в 100 мл ТГФ. Реакционную смесь перемешивают 6 ч при -75 С. После возврата к комнатной температуре смесь гидролизуют с 100 мл воды и экстрагируют этилацетатом. Органическую фазу сушат, концентрируют и очищают путем хроматографии на диоксиде кремния (элюент: смесь циклогексан-этилацетат, 8/2) с получением целевого продукта. Стадия 2. 3-Аллил-4-(1-этил-1-пропенил)2-фторпиридин. 13 К раствору 1,4 г (6,3 ммоль) соединения,полученного на предшествующей стадии, в 50 мл дихлорметана добавляют 17,6 мл (126 ммоль) триэтиламина. Снижают температуру до 0 С и добавляют 2,3 мл (31,5 ммоль) тионилхлорида в 20 мл дихлорметана. После 5 минутного перемешивания при комнатной температуре реакционную смесь вливают в 70 мл воды и затем экстрагируют дихлорметаном. Органическую фазу сушат, концентрируют и очищают путем хроматографии на диоксиде кремния (элюент: смесь циклогексан-этилацетат, 9/1) с получением целевого продукта. Стадия 3. 5-Этил-1-фтор-7 Н-циклопента[с]пиридин. Смесь 1 г (4,87 ммоль) соединения, полученного на предшествующей стадии, и 200 мг(0,24 ммоль) бис(трициклогексилфосфин)бензилидендихлорида рутения(IV) растворяют в 20 мл толуола. Раствор перемешивают при комнатной температуре 15 ч и затем фильтруют. Фильтрат концентрируют и затем очищают путем хроматографии на диоксиде кремния (элюент: смесь циклогексан-этилацетат, 8/2) с получением целевого продукта. Стадия 4. (5S)-5-Этил-1-фтор-6,7-дигидро 5 Н-циклопента[с]пиридин-5,6-диол. К раствору 80 мг (0,01 ммоль) (DHQD)2Pyr в 50 мл трет-бутилового спирта добавляют последовательно 50 мл дистиллированной воды,9 г (27,3 ммоль) феррицианида калия, 3,6 г (28 ммоль) карбоната калия, 10 мг (0,03 ммоль) дигидрата осмата калия и 0,85 г (8,9 ммоль) метансульфонамида. После 3-минутного перемешивания при комнатной температуре смесь охлаждают до 0 С и добавляют раствор 1,4 г (8,6 ммоль) соединения, полученного на предшествующей стадии, в 5 мл трет-бутилового спирта. Реакционную смесь перемешивают 2 дня при 0 С. Смесь экстрагируют этилацетатом и органические фазы сушат, концентрируют и очищают путем хроматографии на диоксиде кремния (элюент: смесь циклогексан-этилацетат, 5/5) с получением целевого продукта. Стадия 5. (5S)-5-Этил-1-фтор-5-гидрокси 5,7-дигидро-6 Н-циклопента[с]пиридин-6-он. К смеси 1,1 г (5,5 ммоль) соединения, полученного на предшествующей стадии, и 0,48 мл (5,5 ммоль) оксалилхлорида в 100 мл дихлорметана добавляют при -78 С 0,82 мл диметилсульфоксида. После 20 мин выдержки при-78 С добавляют 4 мл (28,4 ммоль) триэтиламина и смесь перемешивают 15 мин при низкой температуре и возвращают к комнатной температуре. Реакционную смесь гидролизуют с 100 мл воды и экстрагируют дихлорметаном. Органическую фазу промывают 1%-м водным раствором соляной кислоты и затем насыщенным водным раствором гидрокарбоната натрия. Высушивание и концентрирование дают указанный в заголовке продукт. 14 Стадия 6. (5S)-5-Этил-5-гидрокси-5,7 дигидро-1 Н-циклопента[с]пиридин-1,6(2 Н)дион. Указанный в заголовке продукт получают так, как описано на стадии 4 получения F, с использованием в качестве исходного материала соединения, полученного на предшествующей стадии. ПолучениеJ. 5-Этил-5-гидрокси-5,8 дигидро-1-изохинолинон. Стадия 1. 1-(3-Аллил-2-фтор-4-пиридинил)-1-пропанол. Указанный в заголовке продукт получают в соответствии с процессом, описанным в стадии 1 получения I, заменив 3-пентанон на пропанол. Стадия 2. 1-(3-Аллил-2-фтор-4-пиридинил)-1-пропанон. К раствору 0,5 г (2,56 ммоль) соединения,полученного на предшествующей стадии, в 25 мл дихлорметана добавляют при 0 С 0,5 г цеолита, 0,2 г 4 молекулярного сита и 0,58 г (2,69 ммоль) хлорхромата пиридиния. После возврата к комнатной температуре смесь перемешивают 15 ч и фильтруют. Фильтрат концентрируют и очищают путем хроматографии на диоксиде кремния (элюент: смесь дихлорметан:ацетон,97:3) с получением целевого продукта. Стадия 3. 3-(3-Аллил-2-фтор-4-пиридинил)-1-пентен-3-ол. К раствору 0,32 г (1,66 ммоль) соединения,полученного на предшествующей стадии, в 10 мл ТГФ добавляют при 0 С 2,1 мл 1 М раствора винилмагнийбромида в ТГФ. После 45 минутного перемешивания при 0 С смесь гидролизуют с 1 М раствором соляной кислоты и экстрагируют эфиром. Органические фазы промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом магния и концентрируют. Остаток очищают путем хроматографии на силикагеле (элюент: смесь дихлорметан-ацетон, 95/5) с получением целевого продукта. Стадия 4. 5-Этил-1-фтор-5,8-дигидро-5 изохинолинол. Целевой продукт получают в соответствии с процессом, описанным в стадии 3 получения I,с использованием соединения, полученного на предшествующей стадии, в качестве исходного материала. Стадия 5. 5-Этил-5-гидрокси-5,8-дигидро 1-(2 Н)-изохинолинон. К раствору 0,5 г (2,59 ммоль) продукта,полученного на предшествующей стадии, в 25 мл трет-бутанола добавляют 5 г (45 ммоль) трет-бутилата калия. После 16-часового перемешивания при нагревании с обратным холодильником реакционную смесь охлаждают, гидролизуют 50 мл воды и подкисляют 2 М раствором соляной кислоты. Полученный осадок отфильтровывают и высушивают с получением целевого продукта. 15 Получение К. 5-Этил-5-гидрокси-5,8 дигидро-1,6,7-(2 Н)-изохинолинтрион. Стадия 1. 5-Этил-5,6,7-тригидрокси 5,6,7,8-тетрагидро-1-(2 Н)-изохинолинон. К раствору 2 г (10,4 ммоль) соединения,описанного в получении J, в смеси 70 мл диоксана и 30 мл воды добавляют при комнатной температуре 4 мл 2,5%-го раствора тетроксида осмия в трет-бутаноле и затем 1,5 г N-оксида Nметилморфолина (12,8 ммоль). После перемешивания в течение ночи при комнатной температуре, смесь экстрагируют этилацетатом и органические фазы сушат и концентрируют с получением целевого продукта. Стадия 2. 5-Этил-5-гидрокси-5,8-дигидро 1,6,7-(2 Н)-изохинолинтрион. К смеси 1 г (4,44 ммоль) соединения, полученного на предшествующей стадии, и 0,78 мл (8,88 ммоль) оксалилхлорида в 100 мл диоксана добавляют при -78 С 1,30 мл диметилсульфоксида (18,2 ммоль). После 30 мин выдерживания при -78 С добавляют 6 мл (42,6 ммоль) триэтиламина. После 15 мин выдерживания при -78 С смесь возвращают к комнатной температуре. Реакционную смесь гидролизуют 100 мл воды и экстрагируют этилацетатом. Органическую фазу промывают 1 н. раствором соляной кислоты и затем насыщенным водным раствором гидрокарбоната натрия. Высушивание и концентрирование дают целевой продукт. Получение L. 7-Этил-7-гидрокси-2,4,7,7aтетрагидроксирено-[2,3-g]изохинолин-3(1 аН)он. К раствору 1 г (5,2 ммоль) продукта, описанного в получении J, в 100 мл диоксана добавляют при 0 С 1,17 г (6,8 ммоль) мхлорбензойной кислоты. После перемешивания в течение 1 ч при комнатной температуре, раствор разбавляют 100 мл этилацетата и промывают насыщенным водным раствором гидрокарбоната натрия. Сушка над сульфатом магния и удаление растворителя путем выпаривания дают целевой продукт. Получение М. 5-Этил-5-гидрокси-2,5,6,9 тетрагидро-1 Н-циклогепта[с]пиридин-1-он. Целевой продукт получают в соответствии с процессом, описанным в получении J, заменяя винилмагнийбромид на стадии 3 аллилмагнийбромидом. Получение N. 5-Этил-5-гидрокси-5,6,8,9 тетрагидро-1 Н-циклогепта[с]пиридин-1,7(2 Н)дион. Стадия 1. (2-Фтор-4-иод-3-пиридинил) метанол. К раствору 4 г (16 ммоль) 2-фтор-4-иод-3 пиридинкарбальдегида (описанного в J.O.C.,1993, 58, стр. 7832) в 100 мл тетрагидрофурана добавляют 0,72 г (19,2 ммоль) борогидрида натрия. Смесь перемешивают при комнатной температуре в течение 4 ч и затем гидролизуют. Реакционную смесь экстрагируют этил 003206 16 ацетатом. Органические фазы сушат и концентрируют с получением целевого продукта. Стадия 2. 2-Фтор-4-иод-3-[(2-метоксиэтокси)метил]пиридин. Раствор 2,1 г (16,8 ммоль) хлорметокси-2 метоксиэтана в 10 мл дихлорметана и затем раствор 2,2 г (16,8 ммоль) этилдиизопропиламина и 180 мг (1,4 ммоль) 4-диметиламинопиридина в 10 мл дихлорметана последовательно добавляют к раствору 3,5 г (14 ммоль) соединения, полученного на предшествующей стадии, в 20 мл дихлорметана. Смесь перемешивают 18 ч и затем гидролизуют. Смесь экстрагируют дихлорметаном и органическую фазу промывают насыщенным водным раствором хлорида натрия,пока он не станет нейтральным, сушат и концентрируют с получением целевого продукта. Стадия 3. 1-2-Фтор-3-[(2-метоксиэтокси) метил]-4-пиридинил-1-пропанол. Целевой продукт получают в соответствии с процессом, описанным в стадии 2 полученияG, используя соединение, полученное на предшествующей стадии, в качестве исходного материала и пропиональдегид в качестве электрофильного агента. Стадия 4. 1-2-Фтор-3-[(2-метоксиэтокси) метил]-4-пиридинил-1-пропанон. Целевой продукт получают в соответствии с процессом, описанным в стадии 1 получения Е, используя соединение, полученное на предшествующей стадии, в качестве исходного материала. Стадия 5. Метил 3-2-фтор-3-[(2-метоксиэтокси)метил]-4-пиридинил-3-гидроксипентаноат. Раствор 3 г (10,2 ммоль) соединения, полученного на предшествующей стадии, и 5,1 г (33 ммоль) метилбромацетата в 40 мл ТГФ добавляют по капле при нагревании с обратным холодильником к суспензии в 5 мл ТГФ 2,16 г (33 ммоль) цинка, предварительно активированного путем обработки 6 М соляной кислотой, с обеспечением при этом кипения с обратным холодильником. По окончании добавления смесь перемешивают при нагревании с обратным холодильником в течение 1 ч и затем охлаждают и гидролизуют с насыщенным водным раствором хлорида аммония. После экстрагирования эфиром органическую фазу сушат, концентрируют и очищают путем хроматографии на диоксиде кремния (элюент:смесь дихлорметан-ацетон,95/5) с получением целевого продукта. Стадия 6. Метил 3-[2-фтор-3-(гидроксиметил)-4-пиридинил]-3-гидроксипентаноат. Раствор 3,5 г (10,1 ммоль) соединения, полученного на предшествующей стадии, в 20 мл ТГФ и 20 мл 2 н. НСl перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь декантируют, водную фазу экстрагируют этилацетатом, объединенные органические фазы промывают до обеспечения нейтральности насыщенным водным раствором хлорида натрия и 17 сушат над сульфатом магния и затем, удалив растворители путем выпаривания, получают целевой продукт. Стадия 7. Метил 3-(2-фтор-3-формил-4 пиридинил]-3-гидроксипентаноат. К раствору 3 г (11,6 ммоль) соединения,полученного на предшествующей стадии, в 50 мл дихлорметана добавляют 1,2 г (13,9 ммоль) диоксида марганца. После 2-часового перемешивания при комнатной температуре, реакционную смесь фильтруют через целит и фильтрат концентрируют с получением целевого продукта. Стадия 8. Метил 3-[4-(1-этил-1-гидрокси 3-метокси-3-оксопропил)-2-фтор-3-пиридинил]2-акрилат. Целевой, продукт получают в соответствии с процессом, описанным в стадии 6 полученияG, используя соединение, полученное на предшествующей стадии, в качестве исходного материала. Стадия 9. Метил 3-[2-фтор-3-(3-метокси-3 оксопропил)-4-пиридинил]-3-гидроксипентаноат. Целевой продукт получают в соответствии с процессом, описанным в стадии 7 полученияG, используя соединение, полученное на предшествующей стадии, в качестве исходного материала. Стадия 10. Метил 3-[2-фтор-3-(3-метокси 3-оксопропил)-2-оксо-1,2-дигидро-4-пиридинил]-3-триметилсилилоксипентаноат. Раствор 2,7 мл (15 ммоль) триметилсилилтрифлата в 5 мл метиленхлорида добавляют по каплям при 0 С к раствору 3,1 г (10 ммоль) соединения, полученного на предшествующей стадии, и 3 г (30 ммоль) триэтиламина в 20 мл метиленхлорида. Реакционную смесь перемешивают 2 ч при 0 С и затем гидролизуют 20 мл воды. Органическую фазу декантируют и сушат над сульфатом магния. Целевой продукт получают путем удаления растворителей с помощью выпаривания. Стадия 11. Метил 5-этил-1-фтор-7-оксо-5 триметилсиланилокси-6,7,8,9-тетрагидро-5 Нциклогепта[с]пиридин-8-карбоксилат. Целевой продукт получают в соответствии с процессом, описанным в стадии 9 полученияG, используя соединение, полученное на предшествующей стадии, в качестве исходного материала. Стадия 12. 5-Этил-5-гидрокси-5,6,8,9 тетрагидро-1 Н-циклогепта[с]пиридин-1,7(2 Н)дион. Суспензию 1,7 г (5 ммоль) соединения, полученного на предшествующей стадии, в 20 мл нормального раствора гидроксида калия нагревают с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, подкисляют добавлением 40 мл 6 н. раствора соляной кислоты и перемешивают при комнатной температуре в течение 30 мин и 18 затем при 80 С в течение 1 ч. После охлаждения смесь экстрагируют метиленхлоридом. Органическую фазу сушат над сульфатом магния и концентрируют с получением целевого соединения. Получение О. 5-Этил-5-гидрокси-2,5,6,8 тетрагидро-1,7-изохинолиндион. К раствору 1 г (4,8 ммоль) продукта, описанного в получении L, в 100 мл диоксана добавляют при -78 С 2 мл комплекса (16,7 ммоль) трифторида бора с диэтиловым эфиром. После возврата к комнатной температуре смесь перемешивают 20 ч и затем вливают в смесь этилацетат-вода. Органические фазы сушат над сульфатом магния. Удаление растворителей путем выпаривания дает целевой продукт. Пример 1. 9-Гидрокси-9,12-дигидро-7 Нциклопента[6,7]-индолизино[1,2-b]хинолин 7,10(8 Н)-дион. Стадия а. 2-[(2-Бром-3-хинолинил)метил]7-гидрокси-6,7-дигидро-1 Н-циклопента[с]пиридин-1,5 (2 Н)-дион. К перемешиваемому при 0 С раствору 0,6 ммоль (100 мг) соединения, полученного в получении А, в 20 мл смеси ДМЭ-ДМФ (16/4(об./об. добавляют 0,6 ммоль (18 мг) NaH в виде 80%-й дисперсии в минеральном масле. Смесь перемешивают при 0 С в течение 10 мин,после чего добавляют при указанной температуре 2,4 ммоль (210 мг) LiBr. После возврата к комнатной температуре реакционную смесь перемешивают 1/4 ч и затем добавляют 0,66 ммоль(200 мг) 2-бром-3-бромметилхинолина. Далее реакционную смесь нагревают при 80 С в течение 20 ч и затем после возврата к комнатной температуре вливают ее в большой избыток воды. Образовавшийся осадок отфильтровывают и промывают эфиром с получением целевого продукта. Стадия b. 9-Гидрокси-9,12-дигидро-7 Нциклопента[6,7]-индолизино[1,2-b]хинолин 7,10(8H)-дион. Под инертной средой смешивают последовательно 0,98 ммоль (380 мг) соединения, полученного на предшествующей стадии, 3,2 ммоль(319 мг) ацетата калия, 1,57 ммоль (505 мг) тетрабутиламмонийбромида и 17 ммоль (38 мг) ацетата палладия в 45 мл ацетонитрила. Затем смесь нагревают с обратным холодильником в течение 4 ч, после чего, пока она горячая,фильтруют. Остаток промывают горячим раствором дихлорметана и метанола. Фильтрат концентрируют и очищают путем хроматографии на диоксиде кремния (элюент: смесь дихлорметан-метанол, 98/2) с получением целевого продукта. Масс-спектр: ЖХ-МС: m/z: 305 (MH+); 287 19 Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении В. Пример 3. 7-Этил-7,8-дигидрокси-7,12 дигидро-10 Н-циклопента-[6,7]индолизино[1,2b]хинолин-10-он. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении С. Пример 4. 7-Этил-7-гидрокси-7 Н-циклопента-[6,7]индолизино-[1,2-b]хинолин-8,9,10(12 Н)-трион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении D. Пример 5. 7-Этил-7-гидpoкcи-7H-циклопeнтa-[6,7]индолизино-[1,2-b]хинолин-9,10(8H,12 Н)-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении Е. Пример 6 а. 7-Этил-7-гидрокси-8-[2-(1,3 диоксолан)ил]-9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-10-он. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении F. Масс-спектр: (МН+) m/z = 377 Пример 6b. 7-Этил-7-гидрокси-9,12 дигидро-7 Н-циклопента[6,7]индолизино[1,2-b] хинолин-8,10-дион. Раствор 1 г (2,66 ммоль) соединения, полученного в примере 6 а, в 10 мл трифторуксусной кислоты и 1 мл воды нагревают при 80 С в течение 2 ч. Смесь концентрируют в вакууме, остаток вливают в 20 мл воды и осадок отфильтровывают, высушивают и растворяют в горячем спирте. Целевой продукт получают путем отфильтровывания и высушивания нерастворимого продукта. Масс-спектр: (МН+) m/z = 333 Соединения примеров 9, 10, 11, 12, 13, 14 и 15 получали таким же образом. Пример 7. 7-Этил-7-гидрокси-10,13-дигидробензо[6,7]индолизино[1,2-b]хинолин-8,11(7 Н,9 Н)-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении G. Масс-спектр: (МН+) m/z = 347 Пример 8. 7-Этил-7-гидрокси-9-метокси 7,8,9,12-тетрагидро-10 Н-циклопента[6,7]индолизино[1,2-b]хинолин-10-он. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя 20 в качестве исходного материала соединение,описанное в получении Н. Масс-спектр: (МН+) m/z = 349 Пример 9. 3-Хлор-7-этил-7-гидрокси-2 метил-9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3 бромметил-7-хлор-6-метилхинолин. Масс-спектр: (МН+) m/z = 381 Пример 10. 2,3-Диметил-7-этил-7 гидрокси-9,12-дигидро-7 Н-циклопента[6,7] индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3-бромметил-6,7-диметилхинолин. Масс-спектр: (МН+) m/z = 361 Пример 11. 7-Этил-7-гидрокси-2,3 метилендиокси-9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3-бромметил-6,7-метилендиоксихинолин. Маcc-спектр: (МН+) m/z = 377 Пример 12. 2,3-Дифтор-7-этил-7-гидрокси 9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3-бромметил-6,7-дифторхинолин. Масс-спектр: (МН+) m/z = 369 Пример 13. 2-Хлор-7-этил-7-гидрокси 9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3-бромметил-6-хлорхинолин. Масс-спектр: (МН+) m/z = 367 Пример 14. 7-Этил-7-гидрокси-2-метокси 9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3-бромметил-6-метоксихинолин. 21 Масс-спектр: (MH+) m/z = 363 Пример 15. 2-Xлop-7-этил-7-гидpoкcи-3 мeтил-9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 6 (6 а + 6b),используя в качестве исходного материала соединение, описанное в получении F, и заменяя 2-бром-3-бромметилхинолин на 2-бром-3-бромметил-6-хлор-7-метилхинолин. Пример 16. (7S)-7-Этил-7-гидрокси-9,12 дигидро-7 Н-циклопента[6,7]индолизино[1,2-b] хинолин-8,10-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении I. Пример 17. 7-Этил-7-гидрокси-10,13 дигидробензо[6,7]индолизино[1,2-b]хинолин 11(7 Н)-он. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении J. Пример 18. 7-Этил-7-гидрокси-10,13 дигидробензо[6,7]индолизино[1,2-b]хинолин 8,9,11(7 Н)-трион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении К. Пример 19. 2-Этил-2-гидрокси-1 а,10,13,13 а-тетрагидро[1]бенаоксирено[3',4':6,7]индолизино[1,2-b]хинолин-12(2 Н)-он. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении L. Пример 20. 7-Этил-7-гидрокси-7,8,10,13 тетрагидробензо[6,7]индолизино[1,2-b]хинолин 9,11-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении О. Пример 21. 7-Этил-7-гидрокси-7,8,11,14 тетрагидро-12 Н-циклогепта[6,7]индолизино[1,2b]хинолин-12-он. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении М. Пример 22. 7-Этил-7-гидрокси-11,14 дигидро-7 Н-циклогепта[6,7]индолизино[1,2-b] хинолин-9,12(8 Н,10 Н)-дион. Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении N. Пример 23. 2,3-Дифтор-7-этил-7-гидрокси 10,13-дигидробензо[6,7]индолизино[1,2-b]хинолин-8,11(7 Н,9 Н)-дион. 22 Целевой продукт получают в соответствии с процессом, описанным в примере 1, используя в качестве исходного материала соединение,описанное в получении G, и заменяя 2-бром-3 бромэтилхинолин на 2-бром-3-бромметил-6,7 дифторхинолин. Масс-спектр: (МН+) m/z = 383 Фармакологическое исследование Пример А. Активность in vitro. Использовали in vitro клетки L1210 мышиного лейкоза. Клетки культивируют в комплектной питательной среде RPMI 1640, содержащей 10% сыворотку плодного теленка, 2 мМ глутамин, 50 ЕД/мл пенициллина, 50 мкг/мл стрептомицина и 10 мМ Hepes, pH 7,4. Клетки распределяют по микропластинкам и подвергают воздействию цитотоксических соединений в течение 4 двойных сроков, т.е. 48 ч (L1210). Затем определяют число жизнеспособных клеток путем колориметрического анализа, Microculture Tetrazolium Assay (J. Carmichael et al.,Cancer Res., 47, 936-942, (1987. Результаты выражают в виде IC50, что представляет собой цитотоксическую концентрацию, которая обеспечивает ингибирование разрастания обработанных клеток на 50%. Как кажется, соединения по настоящему изобретению являются мощными цитотоксическими средствами, значения IC50 которых значительно ниже чем 10-6 М. Пример В. Фармацевтическая композиция. Состав для изготовления 1000 таблеток,содержащих дозу 10 мг Соединение примера 5 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)(CH2)p-NRaRb, где р равно целому числу от 0 до 6, и Ra и Rb вместе с несущим их атомом азота образуют пирролильную, пиперидинильную или пиперазинильную группу, причем каждая из этих циклических групп может быть необязательно замещенной, 23 или две смежные группы R2, R3, R4 и R5 вместе с несущими их углеродными атомами образуют группу -O-(СН 2)t-O, где t представляет целое число от 1 до 3 включительно,R60, R70n, R80 и R90, кaждый независимо,представляет атом водорода, гидроксигруппу или алкоксигруппу,R61, R71n, R81 и R91, кaждый независимо,представляет атом водорода или алкильную группу, или две геминальные группы (R60 и R61) и/или (R70n и R71n), и/или (R80 и R81), и/или (R90 иR91) вместе образуют оксогруппу или группу О-(СН 2)t-О, где t представляет целое число от 1 до 3 включительно, при условии, что не все R60,R61, R70n, R71n, R80, R81, R90 и R91 представляют атом водорода, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием, при условии, что термин "алкил" означает неразветвленную или разветвленную цепь, имеющую от 1 до 6 углеродных атомов,термин "алкенил" означает неразветвленную или разветвленную цепь, имеющую от 2 до 6 углеродных атомов и содержащую от 1 до 3 двойных связей,термин "алкинил" означает неразветвленную или разветвленную цепь, имеющую от 2 до 6 углеродных атомов и содержащую от 1 до 3 тройных связей,термин "алкокси" означает неразветвленный или разветвленный алкилоксильный радикал, содержащий от 1 до 6 углеродных атомов,термин "ацил" означает неразветвленный или разветвленный алкилкарбонильный радикал, содержащий от 1 до 6 углеродных атомов,термин "фенил" означает фенильную или нафтильную группу,выражение "замещенный" при использовании в связи с арильными или арилалкильными группами означает, что группы, о которых идет речь, являются замещенными одним или несколькими атомами галогена и/или группами алкил, алкокси, гидрокси, циано, нитро и/или амино (необязательно замещенными одной или двумя алкильными группами),выражение "замещенный" при использовании в связи с пирролильными, пиперидинильными или пиперазинильными группами означает, что группы, о которых идет речь, являются замещенными одной или несколькими группами алкил, алкокси, арил, арилалкил, арилокси и/или арилоксиалкил. 2. Соединения формулы (I) по п.1, в которых n=0, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 3. Соединения формулы (I) по п.1, в которых n=1, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 24 4. Соединения формулы (I) по п.1, в которых n=2, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 5. Соединения формулы (I) по п.1, в которых R60 представляет гидроксигруппу и R61 представляет алкильную группу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 6. Соединения формулы (I) по п.1, в которых R80 и R81 вместе образуют оксогруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой (ым) кислотой или основанием. 7. Соединения формулы (I) по п.1, в которых R90 и R91 вместе образуют оксогруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 8. Соединения формулы (I) по п.1, в которых R80 с R81 и R90 с R91 вместе образуют две оксогруппы, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 9. Соединения формулы (I) по п.1, в которых R1 представляет атом водорода, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 10. Соединения формулы (I) по п.1, в которых R2, R3, R4 и R5 выбраны из атома водорода,атома галогена, алкильной группы и алкоксигруппы, или две из этих групп, когда они связаны с двумя смежными атомами углерода, вместе образуют метилендиокси- или этилендиоксигруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 11. Соединения формулы (I) по п.1, в которых каждый из R1, R2 и R5 представляет атом водорода, R3 и R4 выбраны из атома водорода,атома галогена, алкильной группы и алкоксигруппы, или вместе образуют метилендиоксигруппу, R60, R70n, R80 и R90, кaждый независимо,представляет атом водорода, гидроксигруппу или алкоксигруппу и R61, R71n, R81 и R91, кaждый независимо от других, представляет атом водорода или алкильную группу, или две геминальные группы (R60 и R61) и/или (R70nи R71n), и/или(R80 и R81), и/или (R90 и R91) вместе образуют оксогруппу, их энантиомеры, диастереоизомеры и их аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 12. Соединение формулы (I) по п.1, которое представляет собой 3-хлор-7-этил-7 гидрокси-2-метил-9,12-дигидро-7 Н-циклопента[6,7]индолизино[1,2-b]хинолин-8,10-дион. 13. Соединение формулы (I) по п.1, которое представляет собой 2,3-дифтор-7-этил-7 гидрокси-9,12-дигидро-7 Н-циклопента[6,7] индолизино[1,2-b]хинолин-8,10-дион. 14. Способ получения соединений формулы (I), отличающийся тем, что в качестве исходного материала используют соединение формулы (II) где n, R60, R61, R70n, R71n, R80, R81, R90 и R91 - такие, как определенные для формулы (I),которое конденсируют в щелочной среде с соединением формулы (III) 26 две из указанных групп вместе образуют связь,последняя может быть введена в любой момент,который специалист в данной области химии посчитает подходящим для облегчения синтеза,которые (соединения формулы (I могут быть при необходимости очищены в соответствии с традиционными методами очистки,могут быть при необходимости разделены на их стереоизомеры традиционными способами разделения,могут быть при необходимости преобразованы в аддитивные соли с фармацевтически приемлемой(ым) кислотой или основанием. 15. Способ получения по п.14, отличающийся тем, что используют вещество формулы где R1, R2, R3, R4 и R5 - такие, как определенные для формулы (I), и Hal и Наl', каждый независимо от других, представляет атом галогена,или с соединением формулы (III') где R1, R2, R3, R4, R5 и Hal - такие, как определенные выше,с получением соединения формулы (IV) где R1, R2, R3, R4, R5, n, R60, R61, R70n, R71n, R80,R81, R90, R91 и Hal - такие, как определенные выше,которое (соединение (IV подвергают реакции внутримолекулярной циклизации, катализируемой соединением палладия, с получением соединения формулы (I),при условии, что с целью упрощения вышеописанного процесса, реакционноспособные группы, присутствующие в R60, R61, R70n, R71n,R80, R81, R90, R91, могут быть защищены обычными защитными группами и в подходящий момент освобождены от защиты, что гидроксигруппы в тех же самых положениях могут быть окислены традиционными химическими методами до оксогрупп и, наоборот, оксогруппы в тех же самых положениях могут быть восстановлены традиционными восстановителями в любой подходящий момент синтеза и что, когда где n, R60, R61, R70n, R71n, R80, R81, R90 и R91 - такие, как определенные для формулы (I), иозначает, что углеродный атом, несущий группы(R) или (S),чтобы получить соединение формулы (I') где R1, R2, R3, R4, R5, R60, R61, R70n, R71n, R80, R81,R90 и R91 - такие, как определенные для формулы (I), иозначает, что конфигурация углеродного атома фиксированная. 16. Фармацевтическая композиция, содержащая в качестве активного компонента, по крайней мере, одно соединение по любому из пп.1-13 в отдельности или в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми наполнителями или носителями. 17. Фармацевтическая композиция по п.16,содержащая, по крайней мере, один активный компонент по любому из пп.1-13, для применения в изготовлении лекарственных средств для лечения раковых заболеваний.
МПК / Метки
МПК: A61P 35/00, A61K 31/437, C07D 471/04
Метки: аналогов, композиции, новые, способ, производные, содержащие, камптотецина, получения, фармацевтические
Код ссылки
<a href="https://eas.patents.su/14-3206-novye-proizvodnye-analogov-kamptotecina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные аналогов камптотецина, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Кристаллические формы (r)-(+)-(n)[[3-[1-бензоил-3-(3,4-дихлорфенил) пиперидин-3-ил]проп-1-ил]-4-фенилпиперидин-4-ил]-n-метилацетамида (осанетана) и способ их получения
Следующий патент: Синергические фунгицидные композиции
Случайный патент: Способ очистки рельсовых желобов и устройство для его осуществления












