Производные дистамицина, способ их получения и применение в качестве противоопухолевых агентов
Номер патента: 2273
Опубликовано: 28.02.2002
Авторы: Берия Итало, Коцци Паоло, Песенти Энрико, Джерони Мария Кристина, Кальдарелли Марина
Формула / Реферат
1. Соединение, которое представляет собой производное дистамицина формулы (I)
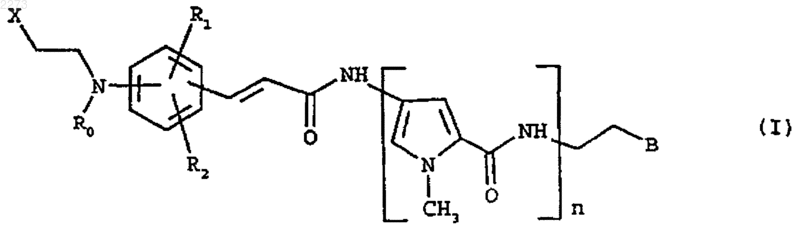
где
n равен 2, 3 или 4;
R0 представляет С1-С4-алкил или C1-С3-галогеналкил;
R1 и R2, которые могут быть одинаковыми или различными, выбирают, каждый, из водорода, C1-C4-алкила, необязательно замещенного одним или несколькими атомами фтора, и C1-C4-алкокси;
Х представляет атом галогена;
В выбирают из групп следующих формул:
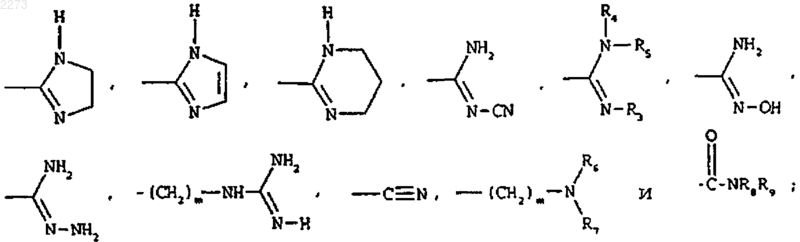
где R3, R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или различными, представляют каждый водород или C1-C4-алкил и m равен 0, 1 или 2;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
n равен 3;
Х представляет хлор или бром;
R0 представляет этил, пропил, 2-хлорэтил, когда Х представляет хлор, или 2-бромэтил, когда Х представляет бром;
R1 и R2, которые могут быть одинаковыми или различными, представляют, каждый, водород, -СН3, -ОСН3 или -СF3;
В выбирают из групп следующих формул:
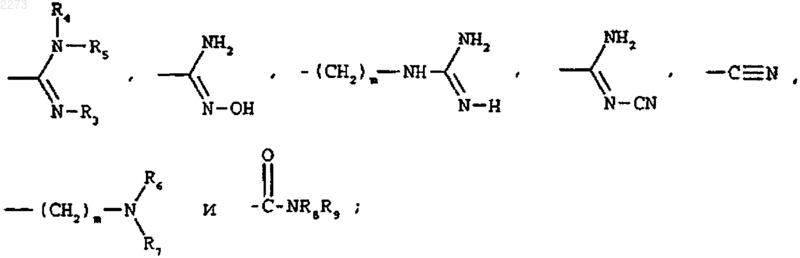
где R3, R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или различными, представляют, каждый, водород или метил и m равен 0 или 1.
3. Соединение по п.1, выбранное из группы, включающей
3-[1-метил-4-[1-метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин;
3-[1-метил-4-[1-метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидин;
3-[1-метил-4-[1-метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N,N'-диметиламидин;
3-[1-метил-4-[1-метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим;
3-[1-метил-4-[1-метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидин;
2-[1-метил-4-[1-метил-4-[1-метил-4-[4-N,N-биc(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]этилгуанидин;
3-[1-метил-4-[1-метил-4-[1-метил-4-[4-N-этил-N-(2-хлорэтил)-аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин;
3-[1-метил-4-[1-метил-4-[1-метил-4-[3-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин,
и их фармацевтически приемлемые соли.
4. Способ получения соединения по п.1, который включает,
при условии что В не является группой формулы
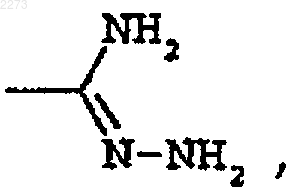
взаимодействие соединения формулы
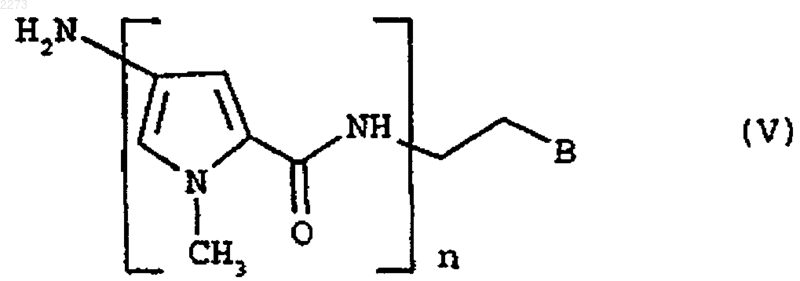
где n равен 2, 3 или 4; В выбирают из группы формулы
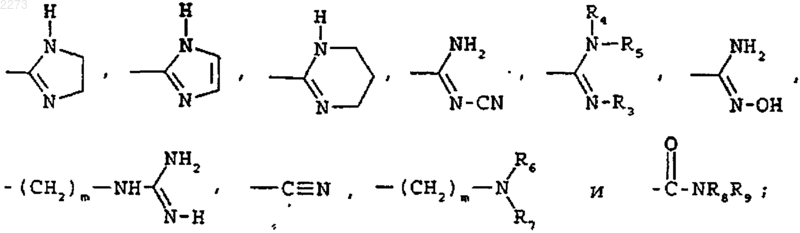
где R3, R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или различными, представляют, каждый, водород или C1-C4-алкил и m равен 0, 1 или 2;
с соединением формулы
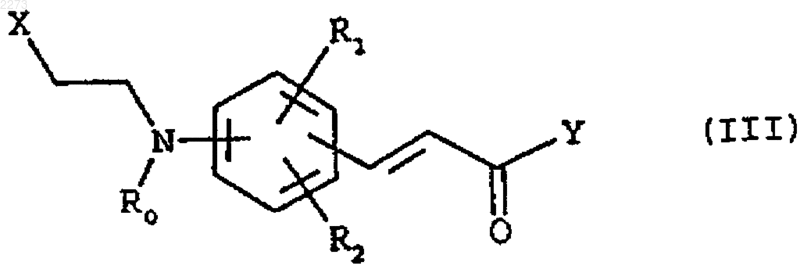
где
R0 представляет C1-C4-алкил или C1-C3-галогеналкил;
R1 и R2, которые могут быть одинаковыми или различными, представляют, каждый, водород, C1-C4-алкил, необязательно замещенный одним или несколькими атомами фтора, или C1-C4-алкокси;
Х представляет атом галогена и
Y представляет гидрокси или уходящую группу;
с получением соответствующего соединения формулы (I).
5. Применение соединения по п.1 в качестве терапевтического агента для лечения человека или животного.
6. Применение по п.5 соединения по п.1 в качестве противоопухолевого агента.
7. Применение соединения по п.1 для производства лекарственного средства, используемого в способе лечения рака.
8. Фармацевтическая композиция, включающая в качестве действующего начала соединение по п.1 в сочетании с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями.
Текст
Настоящее изобретение относится к новым алкилированным противоопухолевым агентам,относящимся к новому антибиотику дистамицину А который принадлежит к семейству пирроламидиновых антибиотиков и, как описывается,взаимодействует обратимо и селективно с АТДНК-последовательностями, препятствуя как репликации, так и транскрипции [Nature, 203,1064 (1964); FEBS Letters, 7 (1970) 90; Prog. Nucleic Acids Res. Mol. Biol., 15, 285 (1975)]. В патенте Германии А-1795539 описывается получение производных дистамицина, у которых формильная группа дистамицина заменена на водород или кислотный остаток органической C1-C4-алифатической кислоты или циклопентилпропионовой кислоты. В Европейском патенте В-246868 описываются аналоги дистамицина, у которых формильная группа дистамицина замещена ароматическими, алициклическими или гетероциклическими фрагментами, содержащими группы алкильного типа. Установлено, что новый класс производных дистамицина, где формильная группа дистамицина необязательно замещена алкил-и/или алкоксизaмещенным циннамоильным фрагментом, имеющим в качестве группы алкильного типаN-(галоген)алкил-N-галоген-этиламиногруппу, проявляют ценные биологические свойства. В соответствии с этим, настоящее изобретение относится к новым производным дистамицина формулы (I), способу их получения,содержащим их фармацевтическим композициям и их использованию в терапии, в частности, в качестве противоопухолевых средств. Следовательно, предметом настоящего изобретения являются соединения формулыR1 и R2 выбирают, каждый независимо, из водорода, С 1-С 4-алкила, необязательно замещенного одним или несколькими атомами фтора, и С 1-С 4-алкокси; Х представляет атом галогена; В выбирают из где R3, R4, R5, R6, R7, R8 и R9 представляют, каждый независимо, водород или С 1-С 4-алкил и m равно 0, 1 или 2, или их фармацевтически приемлемые соли. Настоящее изобретение включает также все возможные изомеры, охватываемые формулой (I), как в отдельности, так и в смеси, а также метаболиты и фармацевтически приемлемые биопредшественники (иначе известные как пролекарства) соединений формулы (I). Алкил- и алкоксигруппы могут иметь разветвленные или неразветвленные цепи. С 1-С 4 Алкильная группа представляет, предпочтительно, метил или этил, С 1-С 4-алкоксигруппа представляет, предпочтительно, метокси или этокси, тогда как C1-С 3-галогеналкильная группа представляет, предпочтительно, 2-хлорэтил. Когда С 1-С 4-алкильная группа замещена одним или несколькими атомами фтора, она предпочтительно представляет С 1-С 4-перфторалкильную группу, например, -СF3. В фенильном кольце циннамоильный фрагмент и N-(галоген)алкил-N-галогенэтиламиногруппа находится, предпочтительно, в мета- или пара-положении относительно друг к другу. Что касается групп R1 и R2, они могут быть в любом из свободных положений фенильного кольца. В первом предпочтительном примере осуществления изобретения R1 представляет водород и R2 представляет водород, С 1-С 4 алкил, необязательно замещенный одним или несколькими атомами фтора, или С 1-С 4-алкокси; во втором предпочтительном осуществлении оба R1 и R2, каждый независимо, представляют С 1-С 4-алкил, необязательно замещенный одним или несколькими атомами фтора, или С 1-С 4 алкокси. Особенно предпочтительная величинаn равна 3; Х представляет, предпочтительно,хлор или бром. R3, R4, R5, R6, R7, R8 и R9 представляют, каждый независимо, предпочтительно, водород, метил или этил, тогда как R0 представляет, предпочтительно, метил, этил, пропил,2-хлорэтил или 2-бромэтил. Фармацевтически приемлемые соли соединений формулы (I) представляют их соли с фармацевтически приемлемыми либо неорганическими, либо органическими кислотами. Примерами неорганических кислот являются хлористо-водородная, бромисто-водородная, серная и азотная кислота; примерами органических кислот являются уксусная, пропионовая, янтарная,малоновая, лимонная, винная, метансульфоновая и п-толуолсульфоновая кислота. 3 Предпочтительным классом соединений по настоящему изобретению является класс соединений формулы (I), гдеn равно 3; Х представляет хлор или бром; где R3, R4, R5, R6, R7, R8 и R9 представляют, каждый независимо, водород или метил и m равно 0 или 1; или их фармацевтически приемлемых солей. Примерами конкретных заявленных соединений, особенно в форме солей, предпочтительно с хлористо-водородной кислотой, являются следующие соединения: 1) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; 2) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-Nметиламидин; 3) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-бромэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; 4) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N,N'диметиламидин; 5) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим; 6) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидин; 7) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионитрил; 8) 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамид; 35) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3 метил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидин; 36) 2-[1-метил-4-[1-метил-4-[1-метил-4-[3 метил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]этилгуанидин; 37) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3 метокси-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; 38) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3 метокси-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидин; 39) 2-[1-метил-4-[1-метил-4-[1-метил-4-[3 метокси-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]этилгуанидин; 40) 3-[1-метил-4-[1-метил-4-[1-метил-4[3,5-диметил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пропионамидин; 41) 3-[1-метил-4-[1-метил-4-[1-метил-4[3,5-диметил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пропион-N-метиламидин; 42) 2-[1-метил-4-[1-метил-4-[1-метил-4[3,5-диметил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] этилгуанидин; 43) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; 44) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-Nметиламидин; 45) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3N,N-бис(2-бромэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; и 46) 3-[1-метил-4-[1-метил-4-[1-метил-4-[3N-этил-N-(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин. Соединения формулы (I) и их соли можно получить по одному из следующих способов (а) и (b), которые предусматривают:(а) когда В не является группой формулы и затем необязательно с H2NR3, получая соединение формулы (I), имеющее В формулыR1 и R2 выбирают, каждый независимо, из водорода, С 1-С 4-алкила, необязательно замещенного одним или несколькими атомами фтора, и С 1-С 4-алкокси; Х представляет атом галогена; иY представляет гидрокси или уходящую группу; получая соединение формулы(vii) янтарным ангидридом, получая соединение формулы (I), имеющее В формулы(viii) водой в щелочной среде, получая соединение формулы (I), имеющее В формулы и затем с водой в щелочной среде, получая соединение формулы (I), имеющее В формулы(b) когда В не является группой формулы(ii) H2N-CH2-CHO, получая соединение формулы (I), имеющее В формулыR1 и R2 выбирают, каждый независимо, из водорода, С 1-С 4-алкила, необязательно замещенного одним или несколькими атомами фтора, и С 1-С 4-алкокси; Х представляет атом галогена; иY представляет гидрокси или уходящую группу; получая соответствующее соединение формулы (I). В формуле (III) Y представляет гидрокси или уходящую группу, выбранную, например,из хлора, 2,4,5-трихлорфенокси, 2,4-динитрофенокси, сукцинимидо-N-окси, имидазолильной группы и тому подобного. Взаимодействие соединения формулы (II)(способ (а или формулы (V) (способ (b с соединением формулы (III) можно проводить по известным способам, например, способам, описанным в Европейском патенте В-246868. Взаимодействие между соединением формулы (II) или формулы (V) и соединением формулы (III), где Y представляет гидрокси, проводят, предпочтительно, при молярном отношении(II):(III) или (V):(III) от 1:1 до 1:2, в органическом растворителе, таком как, например, диметилсульфоксид, гексаметилфосфотриамид, диметилацетамид, диметилформамид, этанол, бензол или пиридин, в присутствии органического или неорганического основания, такого как,например, триэтиламин, диизопропилэтиламин или карбонат или бикарбонат натрия или калия,и конденсирующего агента, такого как, например, N-этил-N'-(3-диметиламинопропил)карбодиимид, N,N'-дициклогексилкарбодиимид или гидрат 1-гидроксибензотриазола. Температура реакции может варьировать от около -10 С до около 100 С и время реакции может быть от около 1 до около 24 ч. Взаимодействие между соединением формулы (II) или формулы (V) и соединением формулы (III), где Y представляет уходящую группу, как определено выше, можно проводить при молярном отношении (II):(III) или (V):(III) от 1:1 до 1:2, в органическом растворителе, таком как, например, диметилформамид, диоксан, пиридин, тетрагидрофуран или их смеси с водой,необязательно, в присутствии органического основания, например, N,N'-диизопропилэтиламина, триэтиламина, или неорганического основания, например, бикарбоната натрия или калия, при температуре от около 0 С до около 100 С и в течение времени, изменяемого от около 2 ч до около 48 ч. Взаимодействие между соединением формулы (IV) и одним из реагентов, как описано в пунктах (i), (ii), (iii), (iv), (v), (vi) или (ix), можно проводить по известным способам, например,способам, описанным в патенте США 4766142,Chem. Revs. 1961, 155; J. Med. Chem. 1984, 27,849-857; Chem. Revs. 1970, 151; and "The Chemistry of Amidines and Imidates", edited by S. Patai,John WileySons, N.Y. (1975). Взаимодействие соединения формулы (iv) с янтарным ангидридом (см. приведенный выше пункт (vii предпочтительно проводят при молярном отношении (IV):янтарный ангидрид от 1:1 до 1:3 в органическом растворителе, таком как, например, диметилсульфоксид, диметил 002273 10 формамид, в присутствии органического или неорганического основания, такого как, например, триэтиламин, диизопропилэтиламин, карбонат натрия или калия и тому подобное. Температуру реакции можно варьировать от около 25 С до около 100 С и время реакции может быть от около 1 ч до около 12 ч. Взаимодействие с водой в щелочной среде(см. указанные выше пункты (viii) и (ix можно проводить по известным способам, обычно используемым для щелочного гидролиза, например, обработкой субстрата избытком гидроксида натрия или калия, растворенного в воде или в смеси воды с органическим растворителем, например, диоксаном, тетрагидрофураном или ацетонитрилом, при температуре от около 50 С до около 100 С, в течение времени, изменяемого от около 2 ч до около 48 ч. Соединения формулы (II) являются новыми соединениями, или их можно получить известными способами из известных соединений; см., например, Arcamone et al. Gazzetta Chim.Ital. 97, 1097 (1967). Соединения формулы (III) также являются новыми соединениями, или их можно получить, исходя из известных соединений посредством реакций, хорошо известных в органической химии: см., например, J. Med.(1982), J. Org. Chem. 26, 4996 (1961), J. Heterocyclic Chem. 32, 1063 (1995), Synth. Commun. 24,3129-3134 (1994). Соединения формулы (V) являются новыми соединениями, или их можно получить известными способами (см., например, Tetrahedron(i) гидролитическим деформилированием в основной или кислотной среде соединений формулы(ii) восстановлением по известным способам нитрогруппы соединений формулы 11 можно, в свою очередь, получить, исходя из аналогов дистамицина формулы с использованием таких же реагентов, как описано во второй стадии способа (а). Соединения формулы (VII) можно получить где n и Y такие, как определено выше, взаимодействием с соединением формулы где В выбирают из реакцией Пиннера соединения формулы с подходящим соединением амина, как определено в указанном выше пункте (i), (ii), (iii) или(vi). Соединения формул (VIII), (IX) (X) и (XI) являются новыми соединениями, или их можно получить известными способами (см., например,Tetrahedron, 34, 2389-2391; J. Org. Chem., 46,3492-3497, 1981). Образование соли соединения формулы (I),а также получение свободного соединения, исходя из соли, можно проводить известными,стандартными способами. Хорошо известные методики, такие как,например, фракционная кристаллизация или хроматография, можно также применять для разделения смеси изомеров формулы (I) на отдельные (индивидуальные) изомеры. Соединения формулы (I) можно очищать общепринятыми методиками, такими как, например, колоночная хроматография на силикагеле или оксиде алюминия и/или перекристаллизация из органического растворителя, такого как, например, низший алифатический спирт,например, метиловый, этиловый или изопропиловый спирт, или диметилформамид. 12 Фармакология Соединения формулы (I) по настоящему изобретению можно использовать в качестве противоопухолевых средств. В частности, они проявляют цитостатические свойства по отношению к опухолевым клеткам, так что их можно использовать для ингибирования роста различных опухолей у млекопитающих, включая людей, таких как, например, карциномы, например, карцинома молочной железы, карцинома легких, карцинома мочевого пузыря, карцинома ободочной кишки, опухоли яичников и внутриматочные опухоли. Другими неоплазиями, в которых соединения настоящего изобретения могут найти применение, являются, например, саркомы, например, саркомы мягких тканей и костей, и гематологические злокачественные заболевания, такие как, например, лейкемии. Противоопухолевую активность in vitro оценивали путем изучения цитотоксичности,проводимого на мышиных клетках лейкемииL1210. Клетки получали из опухолей in vivo и адаптировали в клеточной культуре. Клетки использовали до десятого пересева. Цитотоксичность определяли путем подсчета выживших клеток после 48 ч обработки. Процент роста клеток в обработанных культурах сравнивали с процентом роста клеток контролей. Величины IC50 (концентрация, ингибирующая 50% клеточного роста относительно контролей) вычисляли, исходя из зависимости доза-реакция. Соединения изобретения испытывали также in vivo на мышиной лейкемии L1210 и на мышиной ретикулосаркоме М 5076, обнаруживая очень хорошую противоопухолевую активность по следующей методике. Мышиную лейкемию L1210 поддерживалиin vivo путем внутривенной серийной трансплантации. Для экспериментов 105 клеток инъецировали внутрибрюшинно самкам мышейCD2F1, полученным от Charles River Italy. В начале экспериментов животные имели возраст от 8 до 10 недель. Соединения вводили внутривенно через сутки после инъекций опухолевых клеток. Ретикулосаркому М 5076 поддерживали invivo путем внутримышечной серийной трансплантации. Для экспериментов 5 х 105 клеток инъецировали внутримышечно самкам мышей С 57 В 16, полученным от Charles River Italy. В начале экспериментов животные имели возраст от 8 до 10 недель. Соединения вводили внутривенно на 3, 7 и 11 день после инъекций опухоли. Вычисляли время выживания мышей и рост опухоли и активность выражали в виде параметров Т/С% и Т.I.%. среднее время выживания обработанной группы Т/С=х 100; среднее время выживания необработанной группыT.I. = % ингибирования роста опухоли относительно контроля; Тох: число мышей, которые погибали из-за токсичности. Определение Тох проводили, когда мыши погибали до того, как наблюдали значительную потерю массы тела и/или уменьшение размера селезенки и/или печени у контрольных и/или обработанных мышей. По методикам, описанным выше, представительное соединение, а именно, 3-[1-метил-4[1-метил-4-[1-метил-4-[4-N,N-биc(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропионамидин (внутренний код(О.Д.) 6,25 мг/кг активность, выраженная в виде Т/С%, составила 267 (Тох=0/10) на мышиной лейкемии L1210. Соединения изобретения можно вводить млекопитающим, включая людей, обычными методами, например, парентерально, например,внутривенной инъекцией или инфузией, внутримышечно, подкожно, местно или перорально. Дозировка зависит от возраста, массы и состояния пациента и пути введения. Например, подходящая доза для введения взрослым людям может простираться от около 0,1 до около 150200 мг, вводимая 1-4 раза в день. Другим предметом настоящего изобретения являются фармацевтические композиции,содержащие соединение формулы (I) в качестве действующего начала в сочетании с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями. Фармацевтические композиции настоящего изобретения обычно получают общепринятыми способами и вводят в фармацевтически подходящей форме. Например, растворы для внутривенной инъекции или инфузии могут содержать в качестве носителя, например, стерильную воду или, что предпочтительно, они могут быть в форме стерильных водных изотонических солевых растворов. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например, стерильную воду,оливковое масло, этилолеат, гликоли, например,пропиленгликоль, и, при желании, подходящее количество гидрохлорида лидокаина. В формах для местного применения, например, кремах, лосьонах или пастах для использования при дерматологическом лечении,активный ингредиент можно смешать с общепринятыми маслянистыми или эмульгирующими наполнителями. Твердые пероральные формы, например,таблетки и капсулы, могут содержать вместе с активным соединением разбавители, например,лактозу, декстрозу, сахарозу, целлюлозу, куку 002273 14 рузный крахмал и картофельный крахмал; смазывающие вещества, например, диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция, и/или полиэтиленгликоли; связывающие агенты, например, крахмалы, аравийские камеди, желатин, метилцеллюлозу, карбоксиметилцеллюлозу, поливинилпирролидон; дезагрегирующие агенты, например, крахмал, альгиновую кислоту, альгинаты, натриевую соль гликолята крахмала; вспенивающие смеси; красители; подслащивающие средства; смачивающие агенты, например, лецитин, полисорбаты,лаурилсульфаты и, в общем, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтической готовой препаративной форме. Такой фармацевтический препарат можно изготовить известными методиками, например, при помощи способов смешивания, гранулирования, таблетирования, покрытия сахаром или покрытия пленкой. Еще одним предметом настоящего изобретения являются соединения формулы (I) для использования в способе терапевтического лечения человека или животного. Кроме того, настоящее изобретение предлагает способ лечения опухолей и вирусных инфекций у пациента, который предусматривает введение этому пациенту композиции изобретения. Еще одним предметом настоящего изобретения является комбинированный способ лечения рака или облегчения состояния млекопитающих, включая людей, страдающих раком,причем этот способ предусматривает введение соединения формулы (I) или его фармацевтически приемлемой соли и дополнительного противоопухолевого средства в достаточно близкое время и в количествах, достаточных для возникновения терапевтически полезного эффекта. Настоящее изобретение предлагает также композиции, содержащие соединение формулы(I) или его фармацевтически приемлемую соль и дополнительное противоопухолевое средство, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в противораковой терапии. Подразумевается, что термин "противоопухолевое средство" включает как одно противоопухолевое лекарственное средство, так и"коктейли", т.е. смесь таких лекарственных средств в соответствии с клинической практикой. Противоопухолевые средства, которые могут быть приготовлены в виде препаративной формы с соединением формулы (I) или вводиться в комбинированном способе лечения, включают доксорубицин, дауномицин, эпирубицин,идарубицин, этопозид, фторурацил, мелфалан,циклофосфамид,4-деметоксидаунорубицин,блеомицин, винбластин и митомицин или их смеси. 15 Следующие примеры приводятся для иллюстрации изобретения, не ограничивая при этом его объем. Пример 1. Гидрохлорид 3-[1-метил-4-[1 метил-4-[1-метил-4-[4-N-этил-N-(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидина. Стадия I. Промежуточный этил N-этил-4 аминоциннамат. К раствору 5 г этил 4-аминоциннамата в 100 мл метанола добавляли 0,1 мл ацетальдегида, 1,256 г цианборгидрида натрия и 2,15 мл 23%-ной хлористоводородной кислоты. Раствор перемешивали при комнатной температуре в течение одного дня, затем растворитель выпаривали в вакууме и сырой остаток очищали флэш-хроматографией (н-гексан/ этилацетат, 9/1), получая 2,1 г промежуточного продукта в виде желтого твердого вещества.Hz, 3H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие промежуточные продукты: этил 3-метил-N-метил-4 -аминоциннамат; этил 3,5-диметил-N-метил-4-аминоциннамат; этил 3-метокси-N-метил-4-аминоциннамат; этил 3-метил-N-этил-4-аминоциннамат; этил 3,5-диметил-N-этил-4-аминоциннамат; этил 3-метокси-N-этил-4-аминоциннамат; этил 3-метил-N-пропил-4-аминоциннамат; этил 3,5-диметил-N-пропил-4-аминоциннамат; этил 3-метокси-N-пропил-4-аминоциннамат; этил N-пропил-4-аминоциннамат; этил N-метил-4-аминоциннамат; и этил N-этил-3-аминоциннамат. Стадия II. Промежуточная N-этил-N-(2 хлорэтил)-4-аминокоричная кислота. К раствору 2 г промежуточного продукта,полученного из стадии I, в 40 мл метанола добавляли 2,65 мл хлорацетальдегида (40% в воде), 430 мг цианборгидрида натрия и 1 мл 23%ной хлористо-водородной кислоты. Раствор перемешивали при комнатной температуре в течение четырех часов, затем растворитель выпаривали в вакууме и сырой остаток очищали флэш-хроматографией (нгексан/этилацетат, 9/1), получая 2 г этил N-этил 4-аминоциннамата в виде желтого масла, которое растворяли в 20 мл 37%-ной хлористоводородной кислоты и кипятили с обратным холодильником в течение двух часов. Смесь экстрагировали этилацетатом (3 х 100 мл), объединенные органические экстракты промывали водой(20 мл), сушили на сульфате натрия и концентрировали в вакууме, получая 1,8 г промежу 002273 16 точного продукта в виде желтого твердого вещества.PMR (CDCl3) : 7,70 (d, J=15,8 Hz, 1H),7,42 (m, 2H), 6,65 (m, 2H), 6,22 (d, J=15,8 Hz,1H), 3,61 (m, 4H), 3,45 (q, J=7,1 Hz, 2H), 1,19 (t,J=7,1 Hz, 2H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты: 3-метил-N-метил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3,5-диметил-N-метил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3-метокси-N-метил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3-метил-N-этил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3,5-диметил-N-этил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3-метокси-N-этил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3-метил-N-пропил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3,5-диметил-N-пропил-N-(2-хлорэтил)-4 аминокоричную кислоту; 3-метокси-N-пропил-N-(2-хлорэтил)-4 аминокоричную кислоту;N-этил-N-(2-хлорэтил)-3-аминокоричную кислоту. Стадия III. Целевое соединение. Раствор 200 г промежуточного продукта,полученного из стадии II, 162 мг дициклогексилкарбодиимида и 106 мг гидрата 1-гидроксибензотриазола в 10 мл ДМФ перемешивали при 70 С в течение четырех часов, охлаждали до комнатной температуры и затем добавляли 310 мг дигидрохлорида 3-[1-метил-4-[1-метил-4[1-метил-4-аминопиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пропионамидина (получен, как описано в J.Med. Chem. 32, 774-778, 1989) и 118 мг бикарбоната калия. Смесь перемешивали при комнатной температуре в течение 3 ч, растворитель выпаривали в вакууме и сырой остаток очищали флэшхроматографией (метиленхлорид/метанол, 8/2),получая 180 мг целевого соединения в виде желтого твердого продукта.J=1.7 Hz. 1H), 6.73 (m, 2H), 6.50 (d, J=15.6 Hz,1H), 3.85 (s, 3H), 3.84 (s, 3 Н), 3.80 (s, 3 Н), 3.803.30 (m, 8 Н), 2.60 (m, 2H), 1.10 (t, J=7.0 Hz, 3 Н). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты. Гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидина. 18 пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамид; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидина; и гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидина. Пример 2. Гидрохлорид 3-[1-метил-4-[1 метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропион-N-метиламидина. Стадия I. Промежуточный дигидрохлорид 3-[1-метил-4-[1-метил-4-[1-метил-4-аминопиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пропил-N-метиламидина. Раствор 2 г дистамицина А в 50 мл ДМФ обрабатывали 0,38 мл 80%-ного гидрохлорида метиламина. Через 8 ч добавляли дополнительные 0,25 эквивалента 80%-ного гидрохлорида метиламина. Раствор выпаривали досуха и сырой остаток очищали флэш-хроматографией(метиленхлорид/метанол, 8/2), получая 1,5 г гидрохлорида 3-[1-метил-4-[1-метил-4-[1-метил 4-формамидопиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропилN-метиламидина, который растворяли в 40 мл метанола, и добавляли 5 мл 2N хлористоводородной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение двух дней, растворитель выпаривали в вакууме и твердый остаток суспендировали в 200 мл этилацетата, получая после фильтрования 1,4 г промежуточного продукта.(s, 3H), 3.60-3.40 (m, 2H), 2.80 (d, J=6 Hz, 3H),2.61 (m, 2H). Стадия II. Целевое соединение. Раствор 213 мг 4-N,N-бис(2-хлорэтил) аминокоричной кислоты, 152 мг дициклогексилкарбодиимида и 100 мг гидрата 1 гидроксибензотриазола в 15 мл ДМФ перемешивали при 70 С в течение четырех часов, охлаждали до комнатной температуры и затем добавляли 200 мг промежуточного продукта,полученного со стадии I, и 148 мг бикарбоната калия. Смесь перемешивали при комнатной температуре в течение 3 ч, растворитель выпаривали в вакууме и сырой остаток очищали флэш 19 хроматографией (метиленхлорид/метанол, 8/2),получая 100 мг целевого соединения в виде желтого твердого продукта.(d, J=1.8 Hz, 1H), 6.93 (d, J=1.8 Hz, 1H), 6.80 (m,2 Н), 6.55 (d, J=15.7 Hz, 1H), 3.90-3.70 (m, 8H),3.85 (s, 3 Н), 3.80 (s, 3 Н), 3.76 (s, 3 Н), 3.50 (m,2 Н), 2.78 (s, 3 Н), 2.61 (t, J=6.7 Hz, 2H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты: гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метил-4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пиррол-2-карбоксаидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3,5-диметил-4-N,N-бис(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метокси-4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-метил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метокси-4-N-этил-N-(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3,5-диметил-4-N-этил-N-(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-пропил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина; и 20 гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]-N,Nдиметилпропиламина. Пример 3. Гидрохлорид 3-[1-метил-4-[1 метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропион-N,N'-диметиламидина. Стадия I. Промежуточный дигидрохлорид 3-[1-метил-4-[1-метил-4-[1-метил-4-аминопиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пропил-N,N'-диметиламидина. Раствор 1,5 г дистамицина А в 40 мл ДМФ нагревали при 80 С и обрабатывали 4 мл 80%ного гидрохлорида метиламина. Через 4 ч добавляли дополнительные 5 эквивалентов (4 мл) 80%-ного гидрохлорида метиламина. Раствор выпаривали досуха и сырой остаток очищали флэш-хроматографией (метиленхлорид/метанол,8/2), получая 1,2 г гидрохлорида 3-[1-метил-4[1-метил-4-[1-метил-4-формамидопиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пиррол 2-карбоксамидо]пропил-N,N'-диметиламидина,который растворяли в 40 мл метанола и добавляли 5 мл 2N раствора хлористо-водородной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение двух дней,растворитель выпаривали в вакууме и твердый остаток суспендировали в 200 мл этилацетата,получая после фильтрования 1,4 г промежуточного продукта.(d, J=6 Hz, 3H), 2.80 (d, J=6 Hz, 3H), 2.72 (m,2H). Стадия II. Целевое соединение. Раствор 140 мг 4-N,N-бис(2-хлорэтил) аминокоричной кислоты, 100 мг дициклогексилкарбодиимида и 65 мг гидрата 1-гидроксибензотриазола в 15 мл ДМФ перемешивали при 80 С в течение четырех часов, охлаждали до комнатной температуры и затем добавляли 180 мг промежуточного продукта, полученного со стадии I, и 128 мг бикарбоната калия. Смесь перемешивали при комнатной температуре в течение 3 ч, растворитель выпаривали в вакууме и сырой остаток очищали флэшхроматографией (метиленхлорид/метанол, 8/2),получая 100 мг целевого соединения в виде желтого твердого продукта.PMR (DMSO-d6) : 10.03 (s, 1H), 9.95 (s,1H), 9.93 (s, 1H), 9.40 (b.s., 1H), 8.55 (b.s., 1H),8.29 (t, J=5.8 Hz, 1H), 7.44 (m, 2 Н), 7.39 (d,J=15.7 Hz, 1H), 7.28 (d, J=1.8 Hz, 1H), 7.23 (d,J=1.8 Hz, 1H), 7.19 (d, J=1.8 Hz, 1H), 7.06 (d,J=1.8 Hz, 1H), 6.94 (d, J=1.8 Hz, 1H), 6.93 (d,J=1.8 Hz, 1H), 6.80 (m, 2H), 6.54 (d, J=15.7 Hz,1H), 3.90-3.60 (m, 8H), 3.85 (s. 3H), 3.84 (s, 3H),3.80 (s, 3H), 3.45 (m, 2H), 3.01 (s, 3H), 2.78 (s,3H), 2.72 (t, J=6.7 Hz, 2H). Аналогичной методикой и с использованием подходящего исходного материала можно получить следующий продукт: гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN,N'-диметиламидина. Пример 4. 3-[1-Метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидин. Стадия I. Промежуточный гидрохлорид 3[1-метил-4-[1-метил-4-[1-метил-4-аминопиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидина. К раствору 324 мг цианамида в 20 мл ДМФ добавляли 186 мг гидрида натрия. Смесь перемешивали при комнатной температуре в течение 30 мин, и затем добавляли к раствору 1 г дистамицина А в 10 мл ДМФ. Раствор перемешивали при комнатной температуре в течение двух часов, затем добавляли уксусную кислоту до достижения рН=7. Растворитель удаляли при пониженном давлении и сырой остаток очищали флэш-хроматографией(метиленхлорид/метанол: 9/1), получая 900 мг 3-[1-метил-4-[1-метил 4-[1-метил-4-формамидопиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидина, который растворяли в 50 мл метанола и добавляли 5 мл 2 N хлористо-водородной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение двух дней,растворитель выпаривали в вакууме и твердый остаток суспендировали в 200 мл этилацетата,получая после фильтрования 600 мг промежуточного продукта. 22 бензотриазола в 15 мл ДМФ перемешивали при 80 С в течение четырех часов, охлаждали до комнатной температуры и затем добавляли 110 мг промежуточного продукта, полученного со стадии I, и 40 мг бикарбоната калия. Смесь перемешивали при комнатной температуре в течение 3 ч, растворитель выпаривали в вакууме и сырой остаток очищали флэшхроматографией (метиленхлорид/метанол, 8/2),получая 90 мг целевого соединения в виде желтого твердого продукта.(d, J=1.7 Hz, 1H), 6.81 (m, 2H), 6.53 (d, J=15.8 Hz,1H), 3.90-3.70 (m, 8H), 3.86 (s, 3H), 3.85 (s, 3H),3.81 (s, 3H), 3.45 (b.s., 2H), 2.60 (b.s., 2H). Пример 5. 3-[1-Метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим. Раствор 180 мг гидрохлорида 3-[1-метил-4[1-метил-4-[1-метил-4-[4-N,N-бис(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропионамидина (получен, как описано в примере 1) в 20 мл ДМФ нагревали до 80 С и обрабатывали 0,48 мл 1 М гидроксиламина в ДМФ. Через 30 мин добавляли дополнительный 1 эквивалент 1 М гидроксиламина в ДМФ. Раствор выпаривали досуха и сырой остаток очищали флэш-хроматографией (метиленхлорид/метанол, 9/1), получая 90 мг целевого соединения в виде белого твердого продукта.(d, J=1.7 Hz, 1H), 6.89 (d, J=1.7 Hz, 1H), 6.80 (m,2H), 6.53 (d, J=15.6 Hz, 1H), 3.90-3.70 (m, 8H),3.87 (s, 3H), 3.84 (s, 3H), 3.81 (s, 3H), 3.40 (m,2H), 2.36 (m, 2H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующий продукт: 3-[1-метил-4-[1-метил-4-[1-метил-4-[4-Nэтил-N-(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим. Пример 6. Гидрохлорид 2-[1-метил-4-[1 метил-4-[1-метил-4-[4-N,N-биc(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]этилгуанидина. 23 Стадия I. Промежуточный дигидрохлорид 2-аминоэтилгуанидина. Раствор коммерческого N-BOC-этилендиамина (1 г) в сухом этаноле (100 мл) и гидроиодид 2-метил-тиопсевдомочевины (1,5 г) кипятили с обратным холодильником в течение 8 ч. Растворитель удаляли при пониженном давлении и сырой остаток очищали флэш-хроматографией (метиленхлорид/метанол, 9/1), получая 1,5 г гидроиодида N-BOC-2-аминоэтилгуанидина в виде желтого масла, которое растворяли в 5N растворе хлористо-водородной кислоты в метаноле (20 мл) и перемешивали при комнатной температуре в течение 3 ч. Белый осадок собирали, промывали сухим этанолом,получая 700 мг промежуточного продукта.(385 мг) перемешивали при 70 С в течение 4 ч. Раствор, полученный после фильтрования, выпаривали в вакууме и остаток очищали флэшхроматографией (метиленхлорид/метанол, 8/2),получая 800 мг гидрохлорида 2-[1-метил-4-[1 метил-4-[1-метил-4-нитропиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]этилгуанидина, который растворяли в метаноле (100 мл), добавляли 1N раствор хлористо-водородной кислоты (2 мл) и восстанавливали над Pd катализатором (10% на угле) в атмосфере водорода (3,515 атм, 50 пси) в аппарате Парра. Раствор, полученный после отделения катализатора фильтрованием, выпаривали в вакууме и твердый остаток промывали сухим этанолом, получая 750 мг промежуточного продукта в виде коричневого порошка.(m, 4H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты: 24 гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-аминопиррол-2-карбоксамидо]пиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидина; дигидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-аминопиррол-2-карбоксамидо]пиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидина; дигидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-аминопиррол-2-карбоксамидо]пиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N,N'-диметиламидина; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионитрил и дигидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]-N,Nдиметилпропиламина. Стадия III. Целевое соединение. Раствор 95 мг 4-N,N-бис(2-хлорэтил)аминокоричной кислоты, 65 мг дициклогексилкарбодиимида и 45 мг гидрата 1-гидроксибензотриазола в 15 мл ДМФ перемешивали при 80 С в течение четырех часов, охлаждали до комнатной температуры и затем добавляли 168 мг промежуточного продукта, полученного со стадии II, и 40 мг бикарбоната калия. Смесь перемешивали при комнатной температуре в течение 3 ч, растворитель выпаривали в вакууме и сырой остаток очищали флэшхроматографией (метиленхлорид/метанол, 8/2),получая 100 мг целевого соединения в виде желтого твердого продукта.PMR (DMSO-d6) : 10.04 (s, 1H), 9.96 (s,1H), 9.94 (s, 1H), 8.14 (t, J=5.7Hz, 1H), 7.76 (b.s.,1H), 7.42 (m, 2H), 7.40-7.10 (b.s., 4H), 7.39 (d,J=15.7 Hz, 1H), 7.28 (d, J=1.7 Hz, 1H), 7.24 (d,J=1.7 Hz, 1H), 7.19 (d, J=1.7 Hz, 1H), 7.06 (d,J=1.7 Hz, 1H), 6.91 (d, J=1.7 Hz, 1H), 6.87 (d,J=1.7 Hz, 1H), 6.80 (m, 2H), 6.55 (d, J=15.7 Hz,1H), 3.85 (s, 3H), 3.84 (s, 3H), 3.81 (s, 3H), 3.803.60 (m, 8H), 3.40 (m, 2H), 3.30 (m, 2H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты: гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидина; 26 карбоксамидо]пиррол-2-карбоксамидо]-N,Nдиметилпропиламина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]-N,Nдиметилпропиламина; и гидробромид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-N,N-бис(2-бромэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидина. Пример 7. 3-[1-Метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим. Стадия I. Промежуточный гидрохлорид 3[1-метил-4-[1-метил-4-[1-метил-4-аминопиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксима. 1,2 г 3-[1-Метил-4-[1-метил-4-[1-метил-4 нитропиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионитрила (получен, как описано в J. Med. Chem. 22,1296-1301, 1979) суспендировали в сухом этаноле и раствор насыщали сухим хлоридом водорода. Через 24 ч растворитель выпаривали при комнатной температуре в вакууме и остаток обрабатывали двумя эквивалентами раствора гидроксиламина в сухом этаноле. Через 24 ч растворитель выпаривали при комнатной температуре в вакууме и остаток очищали флэшхроматографией, получая 500 мг 3-[1-метил-4[1-метил-4-[1-метил-4-нитропиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксима, который растворяли в смеси метанол-диоксан-10% хлористоводородная кислота (4:1:1) и восстанавливали над Pd катализатором (10% на угле) в атмосфере водорода (3,515 атм, 50 пси) в аппарате Парра. Раствор, полученный после отделения катализатора фильтрованием, выпаривали в вакууме и твердый остаток суспендировали в сухом этаноле и фильтровали, получая 500 мг промежуточного продукта.(d, J=1.7 Hz, 1H), 7.10 (d, J=1.7 Hz, 1H), 6.93 (d,J=1.7 Hz, 1H), 3.89 (s, 3H), 3.86 (s, 3 Н), 3,82 (b.s.,7H), 3.50 (m, 2H), 2.72 (m, 2H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты: гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-аминопиррол-2-карбоксамидо]пиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидина; дигидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-аминопиррол-2-карбоксамидо]пиррол 27 2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидина; и дигидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-аминопиррол-2-карбоксамидо]пиррол 2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N,N'-диметиламидина; Стадия II. Целевое соединение. Раствор 200 мг 4-N,N-бис(2-хлорэтил) аминокоричной кислоты, 162 мг дициклогексилкарбодиимида и 106 мг гидрата 1-гидроксибензотриазола в 10 мл ДМФ перемешивали при 70 С в течение четырех часов, охлаждали до комнатной температуры и затем добавляли 310 мг промежуточного продукта, полученного со стадии I, и 118 мг бикарбоната калия. Смесь перемешивали при комнатной температуре в течение 3 ч, растворитель выпаривали в вакууме и сырой остаток очищали флэшхроматографией (метиленхлорид/метанол, 8/2),получая 180 мг целевого соединения в виде желтого твердого продукта.(d, J=1.7 Hz, 1H), 6.89 (d, J=1.7 Hz, 1H), 6.80 (m,2H), 6.53 (d, J=15.6 Hz, 1H), 3.90-3.70 (m, 8H),3.87 (s, 3H), 3.84 (s, 3H), 3.81 (s, 3H), 3.40 (m,2H), 2.36 (m, 2H). Аналогичной методикой и с использованием подходящих исходных материалов можно получить следующие продукты: гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионамидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN,N'-диметиламидина; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидин; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метил-4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3,5-диметил-4-N,N-бис(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбокса 002273 28 мидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метокси-4-N,N-бис(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN,N'-диметиламидина; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4-Nэтил-N-(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[4-N-метил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метил-4-N-этил-N-(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-метокси-4-N-этил-N-(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пропионамидина; гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3,5-диметил-4-N-этил-N-(2-хлорэтил) аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидина; и гидрохлорид 3-[1-метил-4-[1-метил-4-[1 метил-4-[3-N,N-биc(2-хлорэтил)аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2 карбоксамидо]пиррол-2-карбоксамидо]пропионN-метиламидина. Пример 8. Таблетки, каждая из которых весит 0,250 г и содержит 50 мг активного вещества, получают следующим образом: Композиция для 10000 таблеток Гидрохлорид 3-[1-метил-4-[1-метил-4-[1-метил-4[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пропионамидина Лактоза Кукурузный крахмал Тальк порошкообразный Стеарат магния аминоциннамоиламидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидина, лактозу и половину количества кукурузного крахмала, смесь затем принудительно пропускали через сито с размером ячеек 0,5 мм. Кукурузный крахмал (10 г) суспендировали в теплой воде (90 мл) и получаемую пасту использовали для грануляции порошка. Гранулят сушили, измельчали на сите с размером ячеек 1,4 мм, затем добавляли остальное количество крахмала, тальк и стеарат магния, осторожно смешивали и обрабатывали для превращения в таблетки. Пример 9. Капсулы, каждая из которых была рассчитана на дозу в 0,200 г и содержала 20 мг активного вещества, получают следующим образом: Композиция для 500 капсул Гидрохлорид 3-[1-метил-4-[1-метил-4-[1-метил-4[4-N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо] пиррол-2-карбоксамидо]пропионамидина Лактоза Кукурузный крахмал Стеарат магния где R3, R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или различными, представляют каждый водород или C1-C4-алкил и m равен 0, 1 или 2; или его фармацевтически приемлемая соль. 2. Соединение по п.1, гдеn равен 3; Х представляет хлор или бром;R1 и R2, которые могут быть одинаковыми или различными, представляют, каждый, водород, -СН 3, -ОСН 3 или -СF3; В выбирают из групп следующих формул: Готовую препаративную форму капсулируют в виде твердых желатиновых капсул, состоящих из двух частей, и дозируют по 0,200 г на каждую капсулу. Пример 10. Внутримышечная инъекция 25 мг/мл. Инъецируемую фармацевтическую композицию получают путем растворения 25 г гидрохлорида 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидина в стерильном пропиленгликоле (1000 мл) и запаивания ампул на 1-5 мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, которое представляет собой производное дистамицина формулы (I)R1 и R2, которые могут быть одинаковыми или различными, выбирают, каждый, из водорода, C1-C4-алкила, необязательно замещенного одним или несколькими атомами фтора, и C1C4-алкокси; Х представляет атом галогена; В выбирают из групп следующих формул: где R3, R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или различными, представляют, каждый, водород или метил и m равен 0 или 1. 3. Соединение по п.1, выбранное из группы, включающей 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N-метиламидин; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропион-N,N'диметиламидин; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидоксим; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионцианамидин; 2-[1-метил-4-[1-метил-4-[1-метил-4-[4N,N-биc(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]этилгуанидин; 3-[1-метил-4-[1-метил-4-[1-метил-4-[4-Nэтил-N-(2-хлорэтил)-аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин; 3-[1-метил-4-[1-метил-4-[1-метил-4-[3N,N-бис(2-хлорэтил)аминоциннамоиламидо] пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пиррол-2-карбоксамидо]пропионамидин,и их фармацевтически приемлемые соли. 4. Способ получения соединения по п.1,который включает,при условии что В не является группой формулы где n равен 2, 3 или 4; В выбирают из группы формулы где R3, R4, R5, R6, R7, R8 и R9, которые могут быть одинаковыми или различными, представляют, каждый, водород или C1-C4-алкил и m равен 0, 1 или 2; с соединением формулыR1 и R2, которые могут быть одинаковыми или различными, представляют, каждый, водород, C1-C4-алкил, необязательно замещенный одним или несколькими атомами фтора, или C1C4-алкокси; Х представляет атом галогена иY представляет гидрокси или уходящую группу; с получением соответствующего соединения формулы (I). 5. Применение соединения по п.1 в качестве терапевтического агента для лечения человека или животного. 6. Применение по п.5 соединения по п.1 в качестве противоопухолевого агента. 7. Применение соединения по п.1 для производства лекарственного средства, используемого в способе лечения рака. 8. Фармацевтическая композиция, включающая в качестве действующего начала соединение по п.1 в сочетании с одним или несколькими фармацевтически приемлемыми носителями и/или разбавителями.
МПК / Метки
МПК: C07D 207/34, A61K 31/40, A61P 35/00
Метки: качестве, агентов, применение, получения, производные, способ, дистамицина, противоопухолевых
Код ссылки
<a href="https://eas.patents.su/17-2273-proizvodnye-distamicina-sposob-ih-polucheniya-i-primenenie-v-kachestve-protivoopuholevyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные дистамицина, способ их получения и применение в качестве противоопухолевых агентов</a>
Предыдущий патент: Производные замешенных индазолов, их применение в качестве ингибиторов фосфодиэстеразы (фдэ) типа iv и продукции фактора некроза опухолей (фно)
Следующий патент: Призводные замещенного индазола и их применение в качестве ингибиторов фосфодиэстеразы (фдэ) типа iv и фактора некроза опухоли (фно)
Случайный патент: Бифенил- и нафтилфенилпроизводные гидроксамовой кислоты












