Новые ацилгуанидиновые производные в качестве ингибиторов резорбции костной ткани и антагонистов витронектиновых рецепторов
Номер патента: 2921
Опубликовано: 31.10.2002
Авторы: Брайполь Герхард, Гейдек Томас, Бодари Сара Кэтрин, Катбертсон Роберт Эндрю, Гурве Жан-Франсуа, Феррара Наполиэйн, Шойнеманн Карл-Хайнц, Пейман Ануширван, Макдауэлл Роберт, Карниато Дени, Кнолле Йохен
Формула / Реферат
1. Соединение формулы I
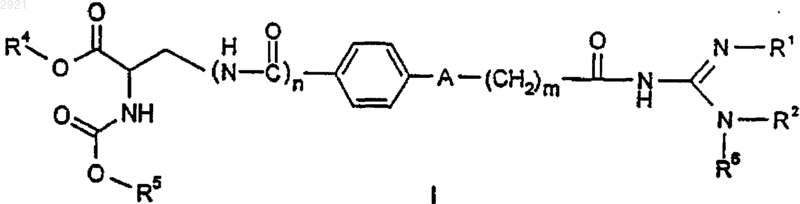
где радикалы R1 и R2 вместе представляют насыщенную или ненасыщенную двухвалентную (С2-С3)-алкиленовую группу;
R4 представляет собой водород или (C1-C6)-алкил;
R5 представляет собой фенил или бензил;
R6 представляет собой водород;
А представляет собой СН2 или О;
m равно 1, 2 или 3;
n равно 0 или 1;
во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства.
2. Соединение формулы I по п.1, где R5 представляет собой бензил, во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства.
3. Соединение формулы I по любому из пп.1-2,
где R4 представляет собой водород или (C1-C4)-алкил;
R5 представляет собой бензил;
А представляет собой СН2;
m равно 1;
n равно 1,
во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства.
4. Соединение формулы I по любому из пп.1-2,
где R4 представляет собой водород или (C1-C4)-алкил;
R5 представляет собой бензил;
А представляет собой кислород;
m равно 1;
n равно 1,
во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства.
5. Соединение формулы I по любому из пп.1-2,
где R4 представляет собой водород или (C1-C4)-алкил;
R5 представляет собой бензил;
А представляет собой кислород;
m равно 3;
n равно 0,
во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства.
6. Соединение формулы I по любому из пп.1-2,
где R4 представляет собой водород;
R5 представляет собой бензил;
А представляет собой кислород;
m равно 3;
n равно 0,
во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства.
7. (2S)-2-Бензилоксикарбониламино-3-(4-(3-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пропилокси)фенил)-пропионовая кислота, или ее физиологически переносимые соли, или пролекарства.
8. (2S)-2-Бензилоксикарбониламино-3-(4-(2-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)этил)бензоиламино)-пропионовая кислота, или ее физиологически переносимые соли, или пролекарства.
9. (2S)-2-Бензилоксикарбониламино-3-(4-((1,4,5,6-тетрагидропиримидин-2-илкарбамоил)метилокси)бензоиламино)-пропионовая кислота, или ее физиологически переносимые, соли или пролекарства.
10. (2S)-2-Бензилоксикарбониламино-3-(4-(3-(4,5-дигидро-1Н-имидазол-2-илкарбамоил)пропилокси)фенил)-пропионовая кислота, или ее физиологически переносимые соли, или пролекарства.
11. Способ получения соединения формулы I, охарактеризованного в любом из пп.1-10, заключающийся в том, что карбоновую кислоту или производное карбоновой кислоты формулы III
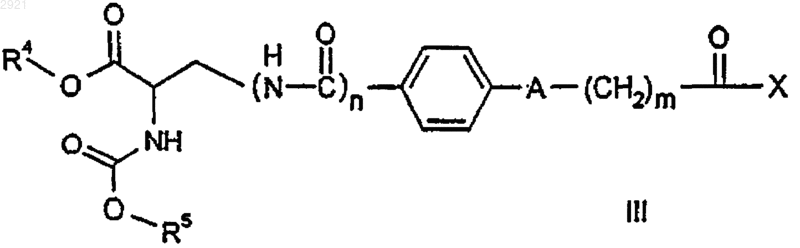
где R4, R5, А, n и m имеют значения, указанные в пп.1-10, или, альтернативно, функциональные группы могут присутствовать в виде предшественников или в защищенной форме, Х представляет собой нуклеофильно замещаемую удаляемую группу, подвергают взаимодействию с гуанидином или производным гуанидина формулы IV
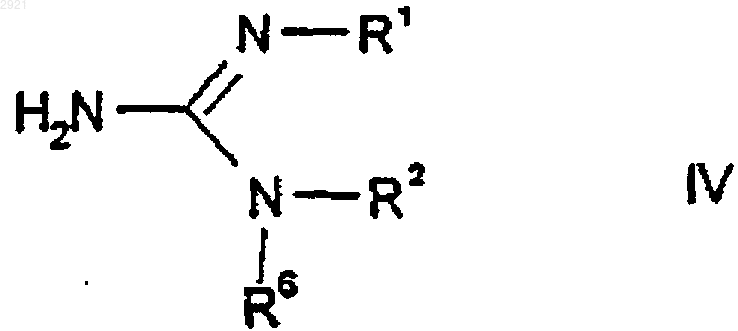
где R1, R2 и R6 имеют значения, указанные в пп.1-10, или, альтернативно, функциональные группы могут присутствовать в виде предшественников или в защищенной форме.
12. Фармацевтический препарат, включающий, по крайней мере, одно соединение формулы I, охарактеризованное в любом из пп.1-10, и/или его физиологически переносимые соли, и/или его пролекарства вместе с фармацевтически инертным носителем.
13. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве фармацевтического препарата.
14. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой, соли и/или его пролекарства в качестве антагониста витронектинового рецептора.
15. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой, соли и/или его пролекарства в качестве ингибитора резорбции костной ткани или для лечения или профилактики остеопороза.
16. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве ингибитора опухолевого роста и метастазирования опухоли.
17. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве противовоспалительного препарата или для лечения или профилактики сердечно-сосудистых заболеваний, рестеноза, артериосклероза, нефропатий и ретинопатий.
Текст
1 Настоящее изобретение относится к ацилгуанидиновым производным формулы I где R1, R2, R4, R5, R6, A, m и n имеют значения,указанные ниже, их физиологически переносимым солям и их пролекарствам. Соединения формулы I являются ценными фармацевтически активными соединениями. Данные соединения являются антагонистами витронектиновых рецепторов и ингибиторами резорбции костной ткани остеокластами, и применимы, например,для терапии и профилактики заболеваний, вызванных, по крайней мере, частично, нежелательной активностью резорбции костной ткани,например, остеопороза. Настоящее изобретение также относится к способам получения соединений формулы I, их применению, в частности,в качестве фармацевтически активных ингредиентов, и фармацевтическим препаратам, содержащим данные соединения. Костная ткань человека подвержена постоянному процессу динамичного обновления, состоящему из резорбции и образования костной ткани. Данные процессы контролируются специализированными для данных целей типами клеток. Резорбция костной ткани основана на разрушении костного матрикса остеокластами. В основе большинства заболеваний костной системы лежит нарушение равновесия между образованием и резорбцией костной ткани. Остеопороз является заболеванием, характеризующимся уменьшением костной массы и увеличением хрупкости кости, выражающейся в повышении риска возникновения переломов. Остеопороз является результатом недостаточности образования новой костной ткани относительно резорбции костной ткани в ходе процесса обновления кости. Традиционные способы лечения остеопороза включают, например, введение бисфосфонатов, эстрогенов, эстрогена/прогестерона (гормональная заместительная терапия, или HRT),агонистов/антагонистов эстрогена (селективных модуляторов эстрогеновых рецепторов, илиSERM), кальцитонина, аналогов витамина D,паратгормона, стимуляторов секреции гормона роста или фторида натрия (Jardine et al., AnnualReports in Medicinal Chemistry 1996, 31, 211). Активные остеокласты представляют собой полиядерные клетки диаметром до 400 мкм,которые удаляют костный матрикс. Активные остеокласты прикрепляются к поверхности костного матрикса и секретируют протеолитические ферменты и кислоты в так называемую зону контакта, участок между их клеточной мембраной и матриксом кости. Кислая среда и протеазы вызывают деструкцию костной ткани. 2 Соединения формулы I ингибируют резорбцию кости остеокластами. Исследования показали, что прикрепление остеокластов в костной ткани контролируется интегриновыми рецепторами, расположенными на клеточной поверхности остеокластов. Интегрины представляют собой надсемейство рецепторов, кроме того включающее рецептор фибриногена IIb3 тромбоцитов и рецептор витронектина V3. Витронектиновый рецептор V3,экспрессирующийся на мембране остеокласта,контролирует процесс прикрепления в костной ткани и резорбцию кости, таким образом способствуя развитию остеопороза. Рецептор V3 в данном случае связывается с белками костного матрикса, такими как остеопротеин, костный сиалопротеин и тромбоспонтин, которые содержат трипептидный мотив Arg-Gly-Asp (илиHorton c сотрудниками описали RGDбелки и антитела к витронектиновому рецептору (23 С 6), которые ингибируют разрушение зуба остеокластами и миграцию остеокластовCell Biol. 1990, 111, 1713, Sato и др. описали эхистатин, белок яда змеи, в качестве белкового ингибитора резорбции кости в клеточной культуре и ингибитора адгезии остеокластов в костной ткани. Ficher и др. (Endocrinology 1993, 132,1411) удалось показать на крысах, что эхистатин также ингибирует резорбцию костной ткани invivo. Далее было установлено, что витронектиновый рецептор V3 клеток гладких мышц сосудов человека в аорте стимулирует миграцию данных клеток в неоинтиму, что в конечном итоге ведет к атеросклерозу и рестенозу после ангиопластики (Brown et al., Cardiovascular Res. 1994, 28, 1815). Yue и др. (Pharmacology Reviewsand Communications 1998, 10, 9-18) показали ингибирование образования в неоинтиме с помощью антагонистов рецепторов V3.Brooks и др. (Cell 1994, 79, 1157) установили, что антитела против рецепторов V3 или антагонисты рецепторов V3 могут способствовать уменьшению размеров опухолей, индуцируя апоптоз в клетках сосудов в ходе ангиогенеза. Витронектиновый рецептор V3 также вовлечен в развитие множества других типов злокачественных опухолей, и экспрессируется в малигнизированных клетках меланомы (Englemen et al., Annual Reports in Medicinal Chemistry 1996, 31, 191). Инвазивность меланомы коррелирует с данной избыточной экспрессиейScience 1996, 91, 639). Carron и др. (Cancer Res. 1998, 58, 1930) описали ингибирование роста опухоли и ингибирование кальциноза опухолевой ткани с помощью антагониста рецептораCheresh и др. (Science 1995, 270, 1500) описали антитела к рецепторам V3 или антагонисты рецепторов V3, которые ингибируютbFGF-индуцированный процесс ангиогенеза в глазу крысы, т.е. свойство, которое может иметь терапевтическое применение при лечении ретинопатий. Воздействуя на витронектиновый рецептор или взаимодействия, в которых он участвует,представляется возможным воздействовать на различные стадии заболевания, для лечения и профилактики которых имеется необходимость в подходящих фармацевтически активных ингредиентов. В патентной заявке WO-A-94/12181 описываются замещенные ароматические системы,и в WO-A-94/08577 описываются замещенные гетероциклы, которые применяли в качестве антагонистов фибриногеновых рецепторов и ингибиторов агрегации тромбоцитов. В заявках ЕР-А-528586 и ЕР-А-528587 описаны аминоалкилзамещенные и гетероциклилзамещенные производные фенилаланина. В заявке WO-A95/32710 описаны производные арила в качестве ингибиторов резорбции костной ткани остеокластами. В заявке WO-A-96/00574 описаны бензодиазепины, и в заявке WO-A-96/00730 описаны матрицы антагонистов фибриногеновых рецепторов, в частности, бензодиазепины,которые присоединены к азотсодержащему пятичленному кольцу, в качестве антагонистов витронектиновых рецепторов. В заявке WO-A97/21726 описаны вещества, способствующие образованию костной ткани, которые относятся к различным классам соединений, среди которых имеются производные тирозина, содержащие незамещенную гуанидиновую группу. Далее исследователи показали, что ацилгуанидины формулы I являются, в частности, сильными ингибиторами витронектинового рецептора и резорбции костной ткани остеокластами. Настоящее изобретение относится к соединениям формулы I где радикалы R1 и R2 вместе представляют насыщенную или ненасыщенную двухвалентнуюR4 представляет собой водород или (C1C6)алкил;R5 представляет собой фенил или бензил;n равно 0 или 1; во всех его стереоизомерных формах и их смесях в любых соотношениях и его физиологически переносимые соли и его пролекарства. 4 Оптически активные атомы углерода, содержащиеся в соединениях формулы I, могут независимо друг от друга иметь R-конфигурацию или S-конфигурацию. Конфигурации различных центров могут быть одинаковыми или различными. Соединения формулы I могут существовать в виде чистых энантиомеров или чистых диастереомеров, или в виде смесей энантиомеров, например в виде рацематов, или в виде смесей диастереомеров. Настоящее изобретение относится как к чистым энантиомерам и смесям энантиомеров, например рацематам,так и диастереомерам и смесям диастереомеров. Изобретение охватывает смеси двух или более стереоизомеров формулы I и все соотношения стереоизомеров в смесях. Соединения формулыI могут необязательно существовать в виде Еизомеров или Z-изомеров. Изобретение охватывает как чистые Е-изомеры и чистые Z-изомеры,так и смеси E/Z-изомеров во всех соотношениях. Изобретение также включает в себя все таутомерные формы соединений формулы I. Например, кроме формы, изображенной в виде формулы I, рассматривается форма, в которой ацилгуанидиновая часть присутствует в виде CO-N=C(NHR1) -NR2R6 группы, и все формы,которые отличаются различными положениями подвижных атомов водорода. Диастереомеры,включающие E/Z-изомеры, могут быть разделены на отдельные изомеры, например, с помощью хроматографии. Рацематы могут быть разделены на два энантиомера с помощью стандартных методов, например, хроматографии на хиральных фазах или разрешения. Стереохимически идентичные соединения также можно получить, используя стереохимически идентичные исходные соединения или с помощью стереоселективных реакций. Физиологически переносимые соли соединений формулы I являются нетоксичными физиологически приемлемыми, в частности, фармацевтически применимыми солями. Такие соли соединений формулы I, которые содержат кислотные группы, например, карбоксильные группы, представляют собой соли щелочных металлов или соли щелочно-земельных металлов, такие как, например, соли натрия, соли калия, соли магния и соли кальция, и также соли с физиологически переносимыми четвертичными ионами азота, кислотно-аддитивные соли аммония и соли физиологически переносимыми органическими аминами, такими как, например,триэтиламин, этаноламин или трис-(2-гидроксиэтил)амин. Соединения формулы I, содержащие основные группы, образуют кислотно-аддитивные соли, например, с неорганическими кислотами, такими как соляная кислота, серная кислота или фосфорная кислота или с органическими карбоновыми кислотами и сульфоновыми кислотами, такими как уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, 5 метансульфоновая кислота или п-толуолсульфоновая кислота. Соединения формулы I,содержащие основную группу и кислотную группу, например гуанидиновую группу и карбоксильную группу, могут существовать в виде цвиттерионов (бетаионов), которые также охватываются настоящим изобретением. Физиологически переносимым анионом Q-,который содержится в соединениях формулы I,когда R4 представлен алкильным радикалом,который замещен положительно заряженной аммониевой группой, в частности является моновалентный анион или эквивалентный поливалентный анион нетоксичной физиологически приемлемой, и также, в частности фармацевтически применимой неорганической или органической кислоты, например, анион или эквивалент аниона одной из вышеуказанных кислот,подходящих для образования кислотноаддитивных солей. Таким образом, анионом Qможет служить, например, один из анионов (или эквивалент аниона) хлорид, сульфат, фосфат,ацетат, цитрат, бензоат, малеат, фумарат, тартрат, метансульфонат или п-толуолсульфонат. Соли соединений формулы I могут быть получены с помощью обычных способов, известных специалистам в данной области, например, с помощью взаимодействия соединения формулы I с неорганической или органической кислотой или основанием в растворе или диспергирующей фазе, или из других солей с помощью замены катиона или замены аниона. Настоящее изобретение также включает в себя все соли соединений формулы I, которые из-за низкой физиологической переносимости не могут непосредственно быть применимы фармацевтически, но пригодны для проведения других химических модификаций соединений формулы I или в качестве исходных продуктов для получения физиологически переносимых солей. Настоящее изобретение, кроме того, охватывает все сольваты соединений формулы I,например, гидраты или продукты присоединения спиртов, а также производные соединений формулы I, например сложные эфиры и другие пролекарства и другие физиологически переносимые производные, также как и активные метаболиты соединений формулы I. Изобретение относится, в частности. к пролекарствам соединений формулы I, которые могут быть преобразованы в соединения формулы I в физиологических условиях. Подходящие пролекарства соединений формулы I, т.е. химически модифицированные производные соединений формулы I,имеющие усовершенствованные желаемым образом свойства, хорошо известны специалистам в данной области. Более подробная информация относительно данных пролекарств содержится,например, в Fleisher et al., Advanced Drug Delivery Reviews 19 (1996) 115-130; Design of Prodrugs, H. Bundgaard, Ed., Eisevier, 1985; H. Bundgaard, Drugs of the Future 16 (1991) 443; Sauler etet al., Pharmaceutical Res. 10 (1993) 1350. Особенно подходящими пролекарствами для соединений формулы I являются сложноэфирные пролекарства, например, (C1-C4)алкильные эфиры карбоновых кислот, в частности с СООНгруппой, которая присутствует в случае, если радикалом R4 в группе COOR4 является водород, а также ацильные пролекарства и карбаматные пролекарства с ацилируемыми азотсодержащими группами, такими как аминогруппы и особенно гуанидиновая группа. В ацильных пролекарствах или карбаматных пролекарствах один или более раз, например дважды, атом водорода, расположенный у атома азота в данных группах, замещен ацильной группой или карбаматной группой. Подходящими ацильными группами и карбаматными группами для ацильных пролекарств или карбаматных пролекарств являются, например, группы R10-CO- и R11O-CO-,где R10 может быть водородом, (C1-C18)алкилом,(С 3-С 14)циклоалкилом, (С 3-С 14)циклоалкил(C1C8)алкилом, (C5-C14)арилом, в которых от 1 до 5 углеродных атомов могут быть замещены гетероатомами, такими как N, О, S, или (C5-C14)арил(C1-C8)алкилом, в котором от 1 до 5 углеродных атомов в арильной последовательности могут быть замещены гетероатомами, такими как N,О, S, a R11 имеет значения, указанные для R10,кроме водорода. В соединение формулы I R5 предпочтительно представляет собой бензил. Предпочтительными являются соединения формулы I, гдеR4 представляет собой водород или (C1-C4) алкил;R5 представляет собой бензил; А представляет собой СН 2;n равно 1,во всех его стереоизомерных формах и их смесях в любых соотношениях и его физиологически переносимые соли и его пролекарства. Более предпочтительными соединениями формулы I являются такие, гдеR4 представляет собой водород или (C1C4)-алкил;n равно 1,во всех его стереоизомерных формах и их смесях в любых соотношениях и его физиологически переносимые соли и его пролекарства. Особенно предпочтительны соединения формулы I, гдеR4 представляет собой водород или (C1-C4) алкил;n равно 0, 7 во всех его стереоизомерных формах и их смесях в любых соотношениях и его физиологически переносимые соли и его пролекарства. Особенно предпочтительны также соединения формулы I, гдеn равно 0,во всех его стереоизомерных формах и их смесях в любых соотношениях и его физиологически переносимые соли и его пролекарства. Конкретными примерами особенно предпочтительных соединений являются следующие:(2S)-2-бензилоксикарбониламино-3-(4-(3(4,5-дигидро-1 Н-имидазол-2-илкарбамоил)пропилокси)фенил)пропионовая кислота,или их физиологически переносимые соли, или пролекарства. Предпочтительными соединениями формулы I кроме того являются такие, в которых углеродный атом, с которым связаны две группы R4O-CO- и R5OCO-NH-, находятся в Sконфигурации. Настоящее изобретение также относится к способам получения соединений, изображенных формулой I. Соединения могут быть получены,например, в ходе конвергентного синтеза с помощью соединения двух или более фрагментов,которые могут быть получены при обратном синтезе из соединения формулы I. При получении соединений формулы I обычно может быть удобным или необходимым в ходе синтеза ввести функциональные группы, которые могут привести к нежелательным реакциям или побочным реакциям на соответствующей стадии синтеза в виде предшественников, которые позже переводятся в желаемые функциональные группы, или временно блокировать функциональные группы с помощью стратегии защитных групп, подходящей для целей синтеза, которая хорошо известна специалистам в данной области (Green and Wuts, Protective Groups inOrganics Sinthesis, Wiley, 1991). Таким образом, соединения формулы I могут быть получены, например, присоединением известным per se способом карбоновой кислоты или производного карбоновой кислоты формулы III в которой R4, R5, А, n и m имеют значения, указанные для формулы I, или, наоборот, функциональные группы могут присутствовать в виде предшественников, которые затем преобразуют в группы, присутствующие в соединениях формулы I, или функциональные группы находятся в защищенной форме, и в которой Х предстaвляет собой удаляемую группу, нуклеофильно замещаемую гуанидином или производным гуанидина формулы IV в которой R1, R2 и R6 имеют значения, указанные для формулы I, или, наоборот, функциональные группы могут присутствовать в виде предшественников, которые затем переводят в группы, присутствующие в соединениях формулы I, или функциональные группы находятся в защищенной форме. Группа СОХ в формуле III, предпочтительно является карбоксильной группой СООН или активированным производным карбоновой кислоты. X, например, представляет собой гидрокси или галоген, в частности хлор или бром,алкокси, предпочтительно метокси или этокси,арилокси, например, фенокси, пентафторфенокси, фенилтио, метилтио, 2-пиридилтио или радикал азотного гетероцикла, связанного через атом азота, в частности азол, такой как, например, 1-имидазолил. X, кроме того, может представлять собой, например, C1-C4)-алкил)-OСО-O- или толуолсульфонилокси и активированное производное кислоты, таким образом,может быть смешанным ангидридом. Если Х является гидроксилом, т.е. если гуанидин формулы IV подвергают взаимодействию с карбоновой кислотой, то карбоновую кислоту целесообразно сначала активировать. Активация может быть проведена, например, с помощью дициклогексилкарбодиимида (DCCl) или с помощью тетрафторбората О-циано(этоксикарбонил)метилен)амино)-1,1,3,3-тетраметилурония или других активирующих агентов, обычных в белковой химии (TOTU; KnigGiralt, Andreu), Escom, Leiden 1991, p. 143). Помимо свободных гуанидинов формулыIV соли гуанидина также могут использоваться в реакции с соединениями формулы III, из которых свободные гуанидины затем получают insitu или в отдельной стадии с помощью основания. Взаимодействие активированного производного карбоновой кислоты формулы III с гуанидином (производным) формулы IV, предпочтительно, проводят, по существу, известным 9 способом в протонном или апротонном полярном, но инертном, органическом растворителе. В данном случае метанол, изопропанол, третбутанол диметилформамид или тетрагидрофуран при температуре от 0 С до температуры кипения данных растворителей является достоверно подходящими, например, при взаимодействии метиловых сложных эфиров (Х=метокси) или этиловых сложных эфиров (Х=этокси) с гуанидинами. Взаимодействие соединений типа СОХ со свободными гуанидинами, предпочтительно, проводят в апротонных инертных растворителях, таких как диметилформамид, тетрагидрофуран, диметоксиэтан или диоксан, если подходит добавление основания, такого как,например, трет-бутоксид калия или метоксид натрия. Однако в качестве растворителя также может применяться вода при взаимодействии соединений формулы III с гуанидинами, например, при использовании основания, такого как,гидроксид натрия. Если Х является хлором, реакцию удобно проводить с добавлением акцептора кислоты, например добавленного основания или в присутствии избытка гуанидина (производного) для связывания образующейся галогенводородной кислоты. Реакционную смесь обрабатывает, и, если требуется продукт реакции далее очищают с помощью обычных методов, хорошо известных специалистам в данной области. Защитные группы, необязательно присутствующие в продуктах, полученных из соединений формулы III и IV, затем удаляют обычными способами, например трет-бутилэфирные группы переводят в карбоксильные группы с помощью трифторуксусной кислоты, бензильные группы удаляют с помощью гидрирования или флуоренилметоксикарбонильные группы удаляют с помощью вторичных аминов, и дальнейшие реакции проводятся обычными способами, например, реакциями ацилирования. Если необходимо, далее преобразование в физиологически переносимые соли или пролекарства может проводится с помощью известных способов. Исходные соединения формулы III и IV,которые, подвергают связыванию с получением ацилгуанидиновых производных формулы I,являются коммерчески доступными или могут быть получены способами, аналогичными описанным в литературе. Получение исходных соединений формулы III проиллюстрировано с помощью примера в следующих схемах, настоящее изобретение не ограничено данными синтезами и данными исходными соединениями. Для специалистов в данной области не может возникнуть каких-либо проблем при проведении модификаций описанных синтезов, которые необходимы для получения других соединений, согласно настоящему изобретению. Таким образом, карбоксибензальдегид формулы V может взаимодействовать, напри 002921 10 мер, в присутствии пиридина или пиперидина, с солью эфира малоновой кислоты формулы VI, с получением производного коричной кислоты формулы VII, которое после гидрогенизации,например, в присутствии палладия на угле, дает соединение формулы VIII, и активация карбоксильной группы может проводиться конденсированием с производным 2,3-диаминопропионовой кислоты формулы IX, с получением соединения формулы Х (схема 1). Конденсация может проводиться, например, в присутствииTOTU или другого обычного активирующего агента карбоновых кислот. В формуле Х радикал Z является бензилоксикарбонильной группой, но вместо радикала Z у атома азота могут присутствовать другие группы, которые также только временно защищают амино во 2-ом положении или которые также могут присутствовать в соединениях формулы I, согласно изобретению, и могут оставаться в молекуле. Кроме того, вместо трет-бутилового эфира могут присутствовать другие эфиры, которые также только временно защищают кислотную группу или которые могут присутствовать в соединениях формулы I, согласно изобретению, и могут оставаться в молекуле. Соединения, аналогичные соединению формулы VII могут быть получены с помощью других способов для преобразования карбонильной группы в алкен, например, с помощью реакции Виттига. Схема 1 п-Гидроксибензойная кислота формулы XI может быть конденсирована с производным 2,3 диаминопропионовой кислоты формулы IX, с получением соединения формулы XII, вышеуказанные объяснения применимы для соединения формулы IX и конденсации. Соединение формулы XII может быть алкилировано с помощью производного галогенкарбоновой кислоты в стандартных условиях, например, эфиром бромуксусной кислоты формулы XIII, с получением соединения формулы XIV (схема 2). п-Аминобензойная кислота и п-меркаптобензойная кислота могут соответственно участвовать в реакции. Тирозиновое производное, изображенное формулой XV, может быть алкилировано в стандартных условиях производными галогенкарбоновой кислоты, например эфиром броммасляной кислоты формулы XVI, с получением соединения формулы XVII (схема 3). В формулеXV Z представляет собой бензилоксикарбонильную группу, но вместо Z могут присутствовать другие группы у атома азота, которые также только временно защищают амино или которые могут присутствовать в соединениях формулы I согласно изобретению, и могут оставаться в молекуле. Также, вмсто трет-бутилового эфира могут присутствовать другие эфиры, которые также только временно защищают кислотную группу или которые могут присутствовать в соединениях формулы I, согласно изобретению, и могут оставаться в молекуле. Аналоги соединений формулы XVII могут быть получены в соответствии или аналогично вышеуказанным способам получения. Схема 3 Соединения формул X, XIV и XVII являются примерами формулы III, в которой Х представляет собой метокси или этокси. Данные соединения и аналогичные соединения, которые получают вышеописанными синтезами содержащими группу, которая активирована производной карбоновой кислоты, могут напрямую взаимодействовать с соединениями формулыIV. Соединения, полученные в вышеуказанных синтезах, однако, также сначала могут быть 12 преобразованы в стандартных условиях с помощью расщепления метильноэфирной группы или этильноэфирной группы или другой эфирной группы, присутствующей в положении согласно соединениям формул X, XIV и XVII, в соответствующие карбоновые кислоты, которые затем взаимодействуют с гуанидинами формулыXIV после активации in situ, например, с помощью TOTU или DCCI, или после перевода в активированную производную карбоновой кислоты. Если в качестве активированных производных кислоты необходимо получить, например, хлориды карбоновых кислот (формулы III,Х=Сl), это можно осуществить, например, с помощью тионилхлорида. Если необходимо получить, например, метиловые эфиры (Х=метокси) из карбоновых кислот, это может быть выполнено с помощью обработки газообразным хлороводородом в метаноле. Другие активированные производные кислот могут быть получены,по существу, известным способом из хлоридов карбоновых кислот или непосредственно из карбоновых кислот, на которых они основаны(Х=1 имидазолил), с помощью обработки кислот карбонилдиимидазолом (cf. Staab, Angew. Chem.Int. Ed. Engl. 1, 351-367 (1962 или смешанные ангидриды, например, реакцией эфиров хлормуравьиной кислоты, такими как этилхлорформиат, или с тозилхлоридом в присутствии аминов, таких как триэтиламин, в инертном растворителе. Ряд подходящих методов для получения активированных производных карбоновых кислот подробно описан в литературном источнике в J. March, Advanced Organic Chemistry, ThirdEdition, John WileySons, 1985, p. 350. Соединения формулы I являются ценными фармацевтическими активными веществами,которые могут применяться, например, для лечения и профилактики заболеваний костей, опухолевых заболеваний или сердечно-сосудистых заболеваний. Соединения формулы I, их физиологически переносимые соли и их пролекарства могут вводиться животным, предпочтительно млекопитающим, и человеку в качестве фармацевтических препаратов для лечения или профилактики. Они могут вводиться отдельно, в смесях одного с другим и в виде фармацевтических препаратов, которые допускают энтеральное или парентеральное введение и которые содержат дополнительно к обычным фармацевтически инертным носителям и/или добавкам эффективную дозу, по крайней мере, одного соединения формулы I, и/или их физиологически переносимые соли, и/или их пролекарства в качестве активной составляющей. Настоящее изобретение, следовательно,также относится к соединениям формулы I,и/или физиологически переносимым солям,и/или их пролекарствам, применяемым в качестве фармацевтических препаратов, к использованию соединений формулы I, и/или физиоло 13 гически переносимых солей, и/или их пролекарств для получения фармацевтических препаратов для лечения и профилактики вышеуказанных и нижеуказанных заболеваний, например,для лечения и профилактики заболеваний костей или опухолевых заболеваний, и также к применению соединений формулы I, и/или физиологически переносимых солей, и/или их пролекарств для лечения и профилактики данных заболеваний. Настоящее изобретение также относится к фармацевтическим препаратам, которые содержат эффективное количество, по крайней мере, одного соединения формулы I,и/или их физиологически переносимые соли,и/или их пролекарства вместе с обычным фармацевтически инертным носителем. Фармацевтические препараты могут вводиться перорально, например, в виде пилюль,таблеток, таблеток в глазури, таблеток в оболочке, гранул, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Однако введение может проводиться ректально, например, в виде суппозиториев, или парентерально, например внутривенно, внутримышечно или подкожно, в виде инъекционных растворов или инфузионных растворов, микрокапсул, имплантатов и капиляров, чрескожно или местно, например в виде мазей, растворов или настоек или другими путями, например в виде аэрозольных или назальных спреев. Фармацевтические препараты согласно изобретению получают известным per se способом, причем одно или несколько фармацевтически инертных неорганических и/или органических носителей используют в сочетании с соединением (соединениями) формулы I и/или его(их) физиологически переносимыми солями и/или его(их) пролекарствами. Для получения пилюль, таблеток, таблеток в оболочке и твердых желатиновых капсул можно применять,например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или е соли и т.д. Основами для мягких желатиновых капсул и суппозиториев являются, например, жиры, воск, полутвердые и жидкие многоатомные спирты, натуральные или искусственные масла и т.д. Подходящими носителями для получения растворов, например инъекционных растворов, эмульсий или сиропов, являются,например, вода, спирты, глицерин, многоатомные спирты, сахара, инвертированный сахар,глюкоза, растительные масла и т.д. Подходящими носителями для микрокапсул, имплантатов и капиляров являются, например, сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические препараты обычно содержат приблизительно от 0,5 до 90% по массе вещества (веществ) формулы I, и/или его(их) физиологически переносимых солей, и/или его(их) пролекарств. Количество активного вещества (веществ) формулы I, и/или его(их) физиологиче 002921 14 ски переносимых солей, и/или его(их) пролекарств в фармацевтических препаратов обычно составляет от 0,2 до 500 мг, предпочтительно от 1 до 200 мг. В дополнение к активным веществам и основам фармацевтические препараты могут, кроме того, содержать одну или несколько добавок,таких как, например, наполнители, дезинтеграторы, связующие вещества, смазки, смачивающие агенты, стабилизаторы, эмульгаторы, защитные вещества, подсластители, красители,корригенты или ароматизаторы, загустители,разбавители, буферные вещества, а также растворители или солюбилизаторы, или агенты для достижения депонирующего эффекта, и также соли для поддержания осмотического давления,материалы для оболочки или антиоксиданты. Они также могут содержать два или несколько соединений формулы I, и/или их физиологически переносимые соли, и/или их пролекарства. Более того, дополнительно, по крайней мере,одному соединению формулы I, и/или его физиологически переносимым солям, и/или его пролекарствам, они также могут содержать одно или более терапевтически или профилактически активные составляющие. Соединения формулы I представляют собой антагонисты витронектинового рецептора и обладают способностью, например, ингибировать присоединение остеокластов к поверхности костной ткани и, следовательно, резорбцию костной ткани остеокластами. Действие соединений формулы I можно продемонстрировать,например, в эксперименте, в котором установлено ингибирование связывания витронектина клетками, содержащими витронектиновый рецептор. Подробности подобного эксперимента приведены ниже. В качестве антогонистов витронектинового рецептора соединения формулыI, и их физиологически переносимые соли, и их пролекарства в основном являются подходящими для лечения и профилактики заболеваний,которые основаны на взаимодействии между витронектиновыми рецепторами и их лигандами в процессах взаимодействия клетка-клетка или процессах взаимодействия клетка-матрикс и которые могут быть вызваны ингибированием взаимодействий данного типа, или для их предупреждения, ослабления или лечения требуется ингибирование взаимодействий данного типа. Как разъяснялось вначале, подобные взаимодействия, например, играют роль в резорбции костной ткани, в ангиогенезе или в пролиферации клеток гладких мышц сосудов. Соединения формулы I и их физиологически переносимые соли и их пролекарства, следовательно, являются пригодными, например, для ослабления или лечения заболеваний, которые вызваны, по крайней мере частично, нежелательным увеличением резорбции костной ткани, ангиогенезом или пролиферацией клеток гладких мышц сосудов. 15 Костными заболеваниями, для лечения и предупреждения которых могут применяться соединения формулы I согласно изобретению,являются остеопороз, гиперкальциемия, остеопения, например, вызванная метастазами, нарушения зубной ткани, гиперпаратироидизм, околосуставные эрозии при ревматоидном артрите и болезнь Педжета. Кроме того, соединения формулы I могут применяться для ослабления,избегания или лечения костных расстройств,которые вызваны глюкокортикоидной, стероидной или кортикостероидной терапией или недостатком половых гормонов (гормона). Все данные нарушения характеризуются потерей костной массы, которая основана на нарушении равновесия между образованием костной ткани и разрушением кости и на которую можно воздействовать благоприятным образом с помощью ингибирования резорбции костной ткани остеокластами. Соединения формулы I и их физиологически переносимые соли и их пролекарства также могут быть использованы благоприятным образом в качестве ингибитора резорбции костной ткани, например, в терапии или профилактике остеопороза в сочетании с традиционным лечением остеопороза, например, в сочетании с бисфосфонатами, эстрогенами, эстрогеном/прогестероном, агонистами/антагонистами эстрогена, кальцитонином, аналогами витамина D, паратгормоном, стимуляторами секреции гормона роста и фторидом натрия. Введение соединений формулы I, и/или их физиологически переносимых солей, и/или их пролекарств и других активных компонентов эффективно при лечении или профилактике остеопороза соединениями,подобными описанным выше, может проводиться одновременно или последовательно в любом порядке и вместе или отдельно. Для применения при лечении или профилактике в подобном сочетании соединения формулы I,и/или их физиологически переносимые соли,и/или их пролекарства и одно или более другие активные компоненты, подобные описанным выше, могут находиться вместе в отдельном фармацевтическом препарате, например, в таблетках или гранулах, или могут находиться в двух или более отдельных фармацевтических препаратов, которые могут содержаться в одной упаковке или в двух или более отдельных упаковках. Применение соединений формулы I и/или их физиологически переносимых солей и/или их пролекарств в подобной комбинационной терапии или профилактике и их применение для получения фармацевтических препаратов для подобной комбинационной терапии или профилактики также охватываются настоящим изобретением. Более того, изобретение относится к фармацевтическим препаратам, которые содержат эффективные количества, по крайней мере, одного соединения формулы I, и/или его физиологически устойчивой соли, и/или его пролекарства вместе, по крайней мере, с одним 16 другим активным веществом, эффективным при лечении или профилактике остеопороза или при ингибировании резорбции костной ткани, подобно описанным выше, одновременно с обычной фармацевтически безопасной основой. Приведенные выше разъяснения относительно фармацевтических препаратов соответственно применимы к подобным фармацевтическим комбинациям препаратов. Помимо применения в качестве ингибиторов резорбции костной ткани остеокластами,соединения формулы I и их физиологически переносимые соли и их пролекарства применяют в качестве ингибиторов опухолевого роста и метастазирования опухоли, противовоспалительных веществ, для лечения или профилактики сердечно-сосудистых заболеваний, таких как артериосклероз или рестеноз, или для лечения или профилактики нефропатий или ретинопатий, таких как например диабетическая ретинопатия. Примеры традиционной терапии злокачественных опухолей даны в Bertino (Editor),Encyclopedia of Cancer, Academic Press, 1997. Все указанные выше утверждения, относящиеся к применению соединений формулы I в сочетании с традиционной терапией остеопороза относительно, например, возможных способов ведения и фармацевтических комбинаций препаратов, соответственно применимы к использованию соединений формулы I в сочетании с традиционной терапией злокачественных опухолей. При применении соединений формулы I доза может изменяться в широком диапaзоне и,как обычно, в каждом отдельном случае доза соответствует индивидуальным состояниям. Доза зависит, например, от применяемого соединения, которое может быть уже физиологически активно или может являться пролекарством, которое сначала активируется в ходе метаболизме, или от природы и тяжести подвергаемого лечению заболевания, или от активности стадии заболевания или проведения профилактики. В случае перорального введения суточная доза составляет, в основном, от 0,01 до 100 мкг/кг, предпочтительно от 0,1 до 50 мкг/кг,особенно от 0,1 до 5 мкг/кг, например от 0,3 до 0,5 мкг/кг для достижения эффективных результатов у взрослого человека массой около 75 кг(в каждом случае 1 мг на 1 кг веса организма) . Также в случае внутривенного введения суточная доза составляет, в основном, приблизительно от 0,01 до 100 мкг/кг, предпочтительно от 0,05 до 10 мкг/кг (в каждом случае 1 мг на 1 кг веса организма). Суточная доза может быть разделена, в частности в случае введения относительно больших количеств, на несколько, например 2, 3 или 4 отдельных введений. В зависимости от индивидуальных условий доза может быть меньше или больше указанной суточной дозы. 17 Помимо применения в качестве фармацевтически активных ингредиентов соединения формулы I так же могут использоваться в качестве переносчиков или носителей активных веществ для того, чтобы транспорт активного вещества производился специфически к месту воздействия (= нацеливание лекарственного средства; см., например. Targeted Drug Delivery,R.C. Juliano, Handbook of Experimental Phamacology, Vol. 100, Ed. Born, G. V. R. et al., SpringerVerlag). Подлежащие транспорту активные ингредиенты в частности являются такими, которые могут применяться для лечения выше указанных заболеваний. Соединения формулы I и их соли, более того, могут использоваться с диагностическими целями, например, при диагностике in vitro клеточных или тканевых образцов, и в качестве вспомогательных соединений при биохимических исследованиях, в которых требуется блокирование витронектинового рецептора или влияние на взаимодействия типа клетка-клетка или клетка-матрикс. Кроме того, они могут применяться в качестве промежуточных соединений для получения других соединений, в частности других фармацевтически активных веществ, которые возможно получить из соединений формулы I, например, модификацией или введением заместителей или функциональных групп. Примеры Продукты идентифицировали с помощью масс-спектрометра (MS) или ЯМР-спектрометра. Соединения, которые были выделены с помощью хроматографии, используя элюент,содержащий, например, уксусную кислоту или трифторуксусную кислоту, затем были высушены вымораживанием, или в которых на последней стадии синтеза применяли, например, трифторуксусную кислоту для удаления третбутильной защитной группы, еще остающейся в некоторых случаях в зависимости от условий проведением высушивания вымораживания кислоты, содержащейся в элюенте или последней стадии синтеза, и были получены частично или полностью в виде соли применяемой кислоты,например в виде соли уксусной кислоты или соли трифторуксусной кислоты. Пример 1. 18 и 3,9 г (0,02 моль) этил-4-бромбутирата в 60 мл ацетона. После охлаждения реакционной смеси растворитель удаляли в вакууме. Остаток разделяли между этилацетатом и водой (1/1). После разделения фаз органическую фазу промывали дважды с помощью воды и насыщали раствором хлорида натрия, высушивали в сульфате натрия и концентрировали в вакууме. Неочищенный маслянистый продукт очищали тонкослойной хроматографией на силикагеле (дихлорметан/ацетонитрил 25/1). Выход: 9,4 г (97%) вязкого масла.Rf=0,36 (силикагель, дихлорметан/метанол 99/1). б) трет-Бутил(2S)-2-бензилоксикарбониламино-3-(4-(3-(1,4,5,6-тетрагидропиримидин-2 илкарбамоил)пропилокси)фенил)пропионат. 6,72 г (0,06 моль) трет-Бутоксида калия добавляли в раствор содержащий 8,13 г (0,06 моль) 1-амино-1,4,5,6-тетрагидропиримидингидрохлорида в 100 мл абсолютного диметилформамида. После перемешивания при комнатной температуре в течение 30 мин 1+2 7,2 г(0,015 моль) трет-бутил(2S)-2-бензилоксикарбониламино-3-(4-(3-этоксикарбонилпропилокси) фенил)пропионата добавляли к данному раствору, и полученный раствор перемешивали при комнатной температуре в течение 12 ч. После удаления растворителя в вакууме остаток обрабатывали 300 мл этилацетата и 100 мл воды, и выделяли органическую фазу, промывали дважды насыщенным раствором хлорида натрия,высушивали сульфатом натрия и концентрировали. Полученный таким образом неочищенный продукт сразу же подвергали хроматографии на силикагеле (дихлорметан/метанол/ледяная уксусная кислота 100/5/1). Получали 5,4 г (60,6%) аморфного продукта. с) (2S)-Бензилоксикарбониламино-3-(4-(3(1,4,5,6-тетрагидропиримидин-2-илкарбамоил) пропилокси)фенил)пропионовая кислота. 5,4 г (0,009 моль) соли уксусной кислоты трет-Бутил(2S)-2-бензилоксикарбониламино-3(4-(3-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пропилокси)фенил)пропионата уксусной кислоты растворяли в 20 мл трифторуксусной кислоты/воды (95/5), и раствор перемешивали при комнатной температуре в течение 30 мин. Затем реакционную смесь концентрировали в вакууме. Остаток растворяли в воде и раствор высушивали вымораживанием. Выход 5,2 г 19 а) 4-(2-Метоксикарбонилвинил)бензойная кислота. 18,74 г (0,12 моль) Монометилмалоната калия суспендировали в 18 мл пиридина. К 0,85 г (0,01 моль) пиперидина при комнатной температуре при перемешивании добавляли 15,01 г(0,1 моль) 4-карбоксибензальдегида. Смесь нагревали до завершения выделения СО 2 (около 2 ч), затем добавляли дополнительно 60 мл пиридина и смесь перемешивали при нагревании дополнительно еще 1 ч. Реакционную смесь обрабатывали при перемешивании 500 мл льда и 110 мл концентрированной соляной кислоты. После завершения добавления смесь перемешивали еще 20 мин и продукт фильтровали с помощью отсасывания, промывали водой и перекристаллизовывали в изопропаноле. Выход: 12,85 г (62%). 1Rt=18,05 мин. б) 4-(2-Метоксикарбонилэтил)бензойная кислота. 8 г (38,8 ммоль) 4-(2-Метоксикарбонилвинил)бензойной кислоты суспендировали в 250 мл диоксана и гидрировали в течение 7 ч при комнатной температуре над Pd/C (10% концентрация) при 1 бар водорода. Смесь фильтровали и удаляли растворитель в вакууме. Выход: 8,05 г 20 карбониламинопропионата растворяли в 3 мл диметилформамида и обрабатывали 557 мг (1,7 ммоль)тетрафторобората О-циано(этоксикарбонил)метилиден)амино-1,1,3,3-тетраметилурония тетрафлуоробората (TOTU) и 204 мг (1,7 ммоль) диизопропилэтиламина и смесь перемешивали в течение 7 ч при комнатной температуре при рН 7-8. Растворитель удаляли в вакууме,остаток растворяли в этилацетате и раствор промывали трижды раствором KHSO4 и раствором NaHCO3 до нейтральной рН. Органическую фазу выделяли, высушивали и удаляли растворитель перегонкой в вакууме. Выход: 770 мгMS (ES+): m/e=485,2 (М+Н+, 100%). д) трет-Бутил-(2S)-2-бензилоксикарбониламино-3-(4-(2-(1,4,5,6-тетрагидропиримидин-2 илкарбамоил)этил)бензоиламино)пропионат. 1,25 г (9,2 ммоль) гидрохлорида 2-амино 1,4,5,6-тетрагидропиримидина и 1,03 г (9,2 ммоль) трет-бутоксида калия растворяли в 3 мл абсолютного диметилформамида и перемешивали 30 мин при комнатной температуре. Далее 740 мг (1,53 ммоль) трет-бутил-(2S)-2-бензилоксикарбониламино-3-(4-(2-метоксикарбонилэтил)бензоиламино)пропионата добавляли в 1 мл диметилформамида и смесь перемешивали при комнатной температуре в течение 4 ч. Значение рН, равное 4, устанавливали с помощью ледяной уксусной кислоты, растворитель удаляли в вакууме и остаток подвергали хроматографии на силикагеле, используя смесь дихлорметан/метанол/ледяная уксусная кислота/водаe) (2S)-2-Бензилоксикарбониламино-3-(4(2-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)этил)бензоиламино)пропионовая кислота. 019 мг (0,34 ммоль) трет-Бутил(2S)-2 бензилоксикарбониламино-3-(4-(2-(1,4,5,6 тетрагидропиримидин-2-илкарбамоил)этил) бензоиламино)пропионата растворяли в 5 мл 95% концентрированной трифторуксусной кислоты и перемешивали при комнатной температуре в течение 1 ч. Трифторуксусную кислоту удаляли дистилляцией в вакууме и испаряли с толуолом, остаток растворяли в ледяной уксусной кислоте, разбавляли водой и высушивали вымораживанием. Выход: 170 мг (100%). 21 а) Бензил-4-(метоксикарбонилметилокси) бензоат. 4,5 г (0,02 моль) Бензил-п-гидроксибензоата суспендировали в 60 мл ацетона вместе с 9,7 г (0,03 моль) карбоната цезия и обрабатывали 2,3 мл (0,025 моль) этилбромацетата. Далее смесь нагревали до завершения реакции. Для отделения реакционный раствор фильтровали через слой, удаляющий взвешенные примеси, и фильтрат концентрировали досуха. Остаток обрабатывали с этилацетатом, и смесь промывали три раза 10% раствором лимонной кислоты и насыщенным раствором хлорида натрия. Органическую фазу обезвоживали сульфатом натрия, фильтровали и концентрировали. Остаток перекристаллизовывали из раствора диизопропиловый эфир/гептан. Выход: 5,5 г. б) 4-(Метоксикарбонилметилокси)бензойная кислота. 5 г бензил-4-(Метоксикарбонилметилокси) бензоата растворяли в метанол/этилацетате и гидрировали в присутствии 600 мг катализатора(Pd/C, 10% концентрации). После продувки инертным газом катализатор удаляли фильтрацией и фильтрат концентрировали в вакууме. Остаток растирали со смесью диизопропиловый эфир/гептан (9/1) и выделяли фильтрованием в вакууме. Выход 3,3 г. с) трет-Бутил(2S)-2-(бензилоксикарбониламино)-3-(4-(метоксикарбонилметилокси)бензоиламино)пропионат. 420 мг (0,002 моль) 4-(Метоксикарбонилметилокси)бензойной кислоты, 270 мг (0,002 моль) 1-гидроксибензотриазола и 588 мг (0,002 моль) трет-бутил(2S)-3-амино-2-бензилоксикарбониламинопропионата растворяли в 5 мл диметилформамида. Раствор охлаждали до 0 С, обрабатывали 453 мг (0,0022 моль) N,N'дициклогексилкарбодиимида и затем перемешивали при 0 С в течение 10 мин при комнатной температуре в течение 2 ч. Для выделения удаляли мочевину фильтрованием и фильтрат концентрировали досуха. Чистое соединение получали с помощью хроматографии неочищенного продукта на силикагеле (дихлорметан/ацетонитрил 20/1). Выход: 820 мг. д) трет-Бутил-(2S)-2-(бензилоксикарбониламино)-3-(4-1,4,5,6-тетрагидропиримидин 2-илкарбамоил)метилокси)бензоиламино)пропионат. 438 мг трет-Бутил-(2S)-2-(бензилоксикарбониламино)-3-(4-(метоксикарбонилметилокси)бензоиламино)пропионата, 606 мг третбутоксида калия и 732 мг 2-амино-1,4,5,6 тетрагидропиримидина растворяли в 10 мл абсолютного диметилформамида, раствор перемешивали при комнатной температуре в течение 14 ч, и затем концентрировали досуха в вакууме. Остаток растворяли в этилацетате и раствор экстрагировали добавлением воды. Органическую фазу обезвоживали и концентрировали в 22 вакууме, неочищенный продукт подвергали очистке хроматографией на силикагеле (дихлорметан/метанол 100/7,5). Выход: 370 мг.e) (2S)-2-(Бензилоксикарбониламино)-3-(41,4,5,6-тетрагидропиримидин-2-илкарбамоил) метилокси)бензоиламино)пропионовая кислота. 87 мг трет-Бутилового эфира, полученного на стадии д) перемешивали при комнатной температуре в течение 15 мин в 2 мл 95% трифторуксусной кислоты. После концентрирования в вакууме смесь растирали с эфиром и остаток выделяли фильтрованием и обезвоживали. Выход: 79 мг. 23,88 г (0,04 моль) cоединения из примера 1 (в виде соли трифторуксусной кислоты) суспендировали в 400 мл изопропанола. К данной суспензии добавляли при -15 С в атмосфере инертного газа предварительно приготовленный раствор тионилхлорида в изопропаноле (для приготовления данного раствора тионилхлорид был добавлен при температуре от -10 до -15 С и в атмосфере инертного газа в течение пяти минут к 160 мл изопропанола и смесь была перемешана при -10 С дополнительно 20 мин). После завершения добавления температуру повышали в течение 30 мин до комнатной температуры. Далее чистый раствор нагревали до 60 С при перемешивании в течение 7 ч. Перемешивание продолжали в течение ночи без нагревания. При ТСХ контроле проводимую реакцию завершали. Растворители удаляли с помощью роторной дистилляции в вакууме. Остаток суспендировали в 100 мл изопропанола и изопропанол удаляли в вакууме. Выделенный твердый остаток растирали с диэтилэфиром и отделяли вакуумным фильтрованием. Необработанный продукт суспендировали в 120 мл изопропанола,нагревали в колбе с обратным холодильником с 2,4 г угля и фильтровали. После охлаждения,бесцветный продукт отделяли фильтрацией. Выход: 16,2 г не совсем белого твердого остатка. 0,14 мл (1,15 экв) Тионилхлорида добавляли при -10 С к этанолу и перемешивали в течение 10 мин при данной температуре. Далее 1 г(1,66 ммоль) соединения из примера 1 добавляли в виде суспензии в 10 мл этанола. При перемешивании смесь нагревали до комнатной температуры и перемешивали дополнительно в течении 5 ч. Раствор, который тем временем становился прозрачным, выпаривали в вакууме,остаток растворяли в воде и после фильтрации подвергали лиофилизации. Выход: 0,85 г бесцветного аморфного твердого вещества. а) трет-Бутил-(2S)-2-бензилоксикарбониламино-3-(4-(3-(4,5-дигидро-1 Н-имидазол-2 илкарбамоил)пропилокси) фенил)пропионат. 340 мг 4,5-Дигидро-1 Н-имидазол-2-иламина, 13,6 мг имидазола 26,8 мг йодида лития добавляли в раствор 970 мг трет-бутил-(2S)-2 бензилоксикарбониламино-3-(4-(3-этоксикарбонилпропилокси)фенил)пропионата (пример 1 а) в 5 мл абсолютного диметилформамида. Раствор перемешивали при 40 С в течении 4 ч, добавляли дополнительно 170 мг 4,5-дигидро-1 Нимидазол-2-иламина и раствор перемешивали при 55 С в течении 3 ч. После удаления растворителя в вакууме остаток обрабатывали этилацетатом, фильтровали, экстрагировали добавлением 10% водного раствора КНСО 3, обезвоживали над МgSO4, фильтровали, концентрировали в вакууме и осаждали диизопропиловым эфиром. Неочищенный продукт очищали с помощью хроматографии на силикагеле (дихлорметан/метанол/ледяная уксусная кислота 90/10/1). Получали 250 мг аморфного продукта. 24 б) (2S)-2-Бензилоксикарбониламино-3-(4(3-(4,5-дигидро-1 Н-имидазол-2-илкарбамоил) пропилокси)фенил)пропионовая кислота. 200 мг трет-Бутил(2S)-2-бензилоксикарбониламино-3-(4-(3-(4,5-дигидро-1 Н-имидазол 2-илкарбамоил)пропокси)фенил)пропионата растворяли в 5 мл смеси трифторацетоуксусная кислота/вода (95/5) и раствор перемешивали при комнатной температуре в течение 15 мин. Реакционную смесь далее концентрировали в вакууме. Остаток растворяли в воде и раствор обезвоживали вымораживанием. Выход: 100%.MS (ES+): m/e=469,2 (М+H+, 100%). Фармакологическое тестирование Ингибирование резорбции костной ткани соединениями согласно изобретению может быть определено, например, с помощью теста остеокластной резорбции (PIT ASSAY), аналогичного, например, описанному в заявке WOA-95/32710. Ингибиторное действие соединений согласно изобретению, направленное против витронектинового рецептора V3, может быть определено, например, как описано ниже. Тест для определения ингибирования связывания клеток 293 с витронектином человека(Vn/293 клеточный тест). 1. Выделение витронектина человека. Витронектин человека выделяли из плазмы человека и очищали с помощью аффинной хроматографии согласно способу Yatohyo et al., CellStructure and Function, 1988, 23, 281-292. 2. Клеточный тест. Клетки 293 эмбриональной почечноклеточной линии человека, которые котрансфицировали последовательностью ДНК субъединицV и 3 витронектинового рецептора V3, отбирали по высокому уровню экспрессии (500,000V3 рецепторов/клетку) с помощью FACS метода. Отобранные клетки инкубировали и снова сортировали с помощью FACS для того, чтобы получить стабильную клеточную линию (15 D) с уровнем экспрессии 1,000,000 копий V3 на клетку. 96-луночную плашку Linbro с тканевой культурой с плоским дном инкубировали в течение ночи при 4 С с витронектином человека(0,01 мг/мл, 0,05 мл/лунку) в фосфатносолевом буферном растворе (PBS) и затем блокировали 0,5% BSA (бычий сывороточный альбумин). Готовили растворы тестируемых веществ с концентрацией от 10-10 моль/л до 2 х 10-10 моль/л в среде DMEM, содержащей глюкозу, и 0,05 мл/лунку раствора добавляли в плашку в каждом случае. Клетки, экспрессирующие высокий уровень витронектинового рецептора V3 (например 15 D), суспендировали в среде DMEM,содержащей глюкозу, и доводили содержание клеток в суспензии до 25,000 клеток/0,05 мл среды. 0,05 мл данной клеточной суспензии добавляли в каждую лунку и плашку инкубирова 25 ли при 37 С в течение 90 мин. Плашку промывали три раза подогретым PBS для удаления не связавшихся клеток. Связавшиеся клетки лизировали цитратным буфером (25 мМ, рН 5,0),который содержал 0,25% тритона Х-100. Далее добавляли гексоамидазный субстрат пнитрофенил-N-ацетилD-глюкозамид и плашку инкубировали при 37 С в течение 90 мин. Реакцию останавливали глицин (50 мМ)/EDTA(5 мМ) буфером (рН 10,4) и измеряли поглощение в каждой лунке при 405-650 нм. Данные анализировали согласно обычным методам. Были получены следующие результаты: Соединение где радикалы R1 и R2 вместе представляют насыщенную или ненасыщенную двухвалентнуюR4 представляет собой водород или (C1C6)алкил;R5 представляет собой фенил или бензил;R6 представляет собой водород; А представляет собой СН 2 или О;n равно 0 или 1; во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства. 2. Соединение формулы I по п.1, где R5 представляет собой бензил, во всех его стереоизомерных формах, и их смесях в любых соотношениях, и его физиологически переносимые соли и его пролекарства. 3. Соединение формулы I по любому из пп.1-2, гдеR4 представляет собой водород или (C1C4)алкил;R5 представляет собой бензил; А представляет собой СН 2;n равно 1,во всех его стереоизомерных формах,и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства. 4. Соединение формулы I по любому из пп.1-2, где R4 представляет собой водород илиn равно 1,во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства. 5. Соединение формулы I по любому из пп.1-2, гдеR4 представляет собой водород или (C1C4)-алкил;n равно 0,во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства. 6. Соединение формулы I по любому из пп.1-2, гдеn равно 0,во всех его стереоизомерных формах и их смесях в любых соотношениях, и его физиологически переносимые соли, и его пролекарства. 7. (2S)-2-Бензилоксикарбониламино-3-(4(3-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)пропилокси)фенил)пропионовая кислота,или ее физиологически переносимые соли, или пролекарства. 8. (2S)-2-Бензилоксикарбониламино-3-(4(2-(1,4,5,6-тетрагидропиримидин-2-илкарбамоил)этил)бензоиламино)пропионовая кислота,или ее физиологически переносимые соли, или пролекарства. 9. (2S)-2-Бензилоксикарбониламино-3-(41,4,5,6-тетрагидропиримидин-2-илкарбамоил) метилокси)бензоиламино)пропионовая кислота,или ее физиологически переносимые соли, или пролекарства. 10. (2S)-2-Бензилоксикарбониламино-3-(4(3-(4,5-дигидро-1 Н-имидазол-2-илкарбамоил) пропилокси)фенил)пропионовая кислота, или ее физиологически переносимые соли, или пролекарства. 11. Способ получения соединения формулы I, охарактеризованного в любом из пп.1-10,заключающийся в том, что карбоновую кислоту или производное карбоновой кислоты формулы где R4, R5, А, n и m имеют значения, указанные в пп.1-10, или, альтернативно, функциональные группы могут присутствовать в виде предшественников или в защищенной форме, Х представляет собой нуклеофильно замещаемую удаляемую группу, подвергают взаимодействию с гуанидином или производным гуанидина формулы IV где R1, R2 и R6 имеют значения, указанные в пп.1-10, или, альтернативно, функциональные группы могут присутствовать в виде предшественников или в защищенной форме. 12. Фармацевтический препарат, включающий, по крайней мере, одно соединение формулы I, охарактеризованное в любом из пп.1-10, и/или его физиологически переносимые соли, и/или его пролекарства вместе с фармацевтически инертным носителем. 13. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве фармацевтического препарата. 14. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически 28 переносимой соли, и/или его пролекарства в качестве антагониста витронектинового рецептора. 15. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве ингибитора резорбции костной ткани или для лечения или профилактики остеопороза. 16. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве ингибитора опухолевого роста и метастазирования опухоли. 17. Применение соединения формулы I по любому из пп.1-10, и/или его физиологически переносимой соли, и/или его пролекарства в качестве противовоспалительного препарата или для лечения или профилактики сердечнососудистых заболеваний, рестеноза, артериосклероза, нефропатий и ретинопатий.
МПК / Метки
МПК: A61K 31/505, C07D 239/16, A61P 19/10, C07C 279/22
Метки: ацилгуанидиновые, качестве, резорбции, новые, ткани, производные, витронектиновых, костной, ингибиторов, рецепторов, антагонистов
Код ссылки
<a href="https://eas.patents.su/15-2921-novye-acilguanidinovye-proizvodnye-v-kachestve-ingibitorov-rezorbcii-kostnojj-tkani-i-antagonistov-vitronektinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые ацилгуанидиновые производные в качестве ингибиторов резорбции костной ткани и антагонистов витронектиновых рецепторов</a>
Предыдущий патент: Фармацевтические композиции на основе тизоксанида и нитазоксанида
Следующий патент: Твердые смеси 3-изопропил-2,1,3-бензотиадиазин-4-он-2,2-диоксида или его солей
Случайный патент: Производные 1h-имидазо[4,5-c]хинолинона



















