Фармацевтические композиции на основе тизоксанида и нитазоксанида
Формула / Реферат
1. Фармацевтическая композиция, содержащая в качестве активного агента, по крайней мере, одно соединение, выбранное из группы, состоящей из соединения формулы I

и соединения формулы II
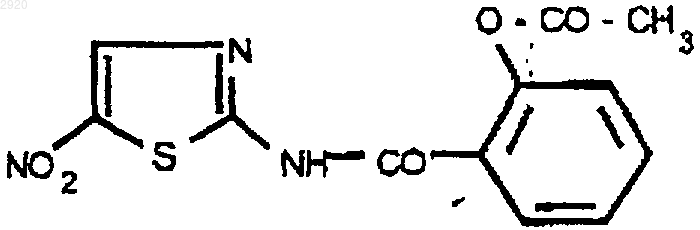
и фармацевтически приемлемую кислоту в количестве, улучшающем ее стабильность.
2. Композиция по п.1, в которой фармацевтически приемлемая кислота выбрана из группы, состоящей из лимонной, глутаминовой, янтарной, этансульфокислоты, уксусной, винной, аскорбиновой, метансульфокислоты, фумаровой, адипиновой, яблочной кислот и их смесей.
3. Композиция по п.2, отличающаяся тем, что она представляет собой твердую лекарственную форму и активные частицы гранулированы в присутствии гранулирующего агента для образования гранулированных активных твердых частиц.
4. Композиция по п.2, представляющая собой суспензию твердых частиц, по меньшей мере, одного из соединений формулы I и формулы II в жидкости.
5. Композиция по п.4, в которой жидкостью является вода.
6. Композиция по п.4, в которой упомянутая суспензия имеет рН от 2 до 6.
7. Композиция по п.4, в которой упомянутая суспензия имеет рН от 3 до 5.
8. Композиция по п.2, представляющая собой пасту, содержащую твердые частицы, по меньшей мере, одного из соединений формулы I и формулы II, увлажняющий агент и загуститель.
Текст
1 Область техники Настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного агента, по крайней мере, одно вещество, выбранное из группы, состоящей из соединений формулы I и, по меньшей мере, одну фармацевтически приемлемую кислоту, стабилизирующую эти композиции. Эти фармацевтические композиции особенно полезны для лечения условно-патогенных инфекций у больных с нарушенной или подавленной иммунной системой и для лечения трематодных инфекций. Описание уровня техники Существует необходимость разработки способов лечения ряда паразитических и бактериальных инфекций у больных с нарушенной иммунной системой (больных СПИДом, раковых больных, престарелых, пожилых, пациентов с трансплантатами органов, принимавших иммуносупрессивные препараты). Другая сфера касается трематодных инфекций, особенно в тропическом климате. Следовательно, существует необходимость создания фармацевтической композиции, которая бы была переносима пациентами даже с нарушенной иммунной системой и которая была бы стабильной при хранении даже в тропических средах. Более конкретно, Toxoplasma gondii является простейшим, которое наиболее часто вызывает латентную инфекцию центральной нервной системы во всем мире. Многие здоровые люди инфицированы этим паразитом, но обычно иммунная система держит организм под контролем. Т. gondii является наиболее распространенным условно-патогенным микроорганизмом головного мозга больных СПИДом. В настоящее время токсоплазмоз становится все более серьезной проблемой не только из-за СПИДа, но и из-за все более широкого использования иммуносупрессивных препаратов (например, среди пациентов с трансплантатами органов). Токсоплазмоз обычно лечат комбинацией пириметамина и сульфадиазина. Хотя эти препараты являются эффективными, они не уничтожают кисты паразитов, поэтому лечение пролонгируют в поддерживающей дозе. Токсичность препарата вызывает необходимость в прерывании его приема, особенно у иммуносупрессивных пациентов, что приводит к рецидиву заболевания. Согласно статистике смертность составляет 70% у иммунодефицитных пациентов и средняя продолжительность жизни - около 4 месяцев. 2 Криптоспоридиоз вызывается микроскопическим простейшим паразитом Cryptosporidiumparvum. У людей с нормальными иммунными функциями диарея, вызванная С. parvum, может быть интенсивной и длительной, но может прекратиться без лечения. У больных СПИДом криптоспоридиозная диарея часто угрожает их жизни. Было подсчитано, что 15-20% больных СПИДом страдает от этих состояний. До сих пор нет достаточно эффективной и одобренной терапии криптоспоридиоза. Наиболее часто определяемым патогеном у больных СПИДом является Enterocytozoonbieneusi, паразит-микроспоридия, который был обнаружен примерно у четверти пациентов. Сейчас оказывается, что этот крошечный паразит может быть причиной большого количества необъяснимых причин малабсорбции, диареи и атрофии у больных СПИДом. До сих пор не известно эффективного способа его лечения. Некоторые другие виды микроспоридий поражают ВИЧ-инфицированных, такие какEncephalitozoon hellem и cuniculi и новые виды,названные Septata intestinalis. Согласно недавним публикациям распространяющиеся инфекции, вызываемые микроспоридиями, приобретают большое значение. Инфекция, вызываемая паразитом Isosporabelli, клинически неотличима от криптоспоридиоза. Наиболее распространенная в тропических странах, в США I. belli зарегистрирована менее чем у 1% пациентов, хотя фактическая заболеваемость значительно выше.Pneumocystis carinii обычно классифицируют как простейший паразит; некоторые исследования показали, что может существовать грибок, с которым он может делить определенные генетические последовательности. Р. carinii обычно инфицирует легкие (пневмоцистная пневмония Pneumocystis Carinii Pneumonia(PCP. Сообщалось, что терапия была успешной примерно у 40-60% пациентов, но были проблемы с токсичностью препаратов, особенно у пациентов с нарушенной иммунной системой. Среди многих серьезных проявлений инфекции вируса иммунодефицита человека (ВИЧ) у детей PCP выделяется из-за частой заболеваемости, особого возрастного состава и частой смертности. PCP является наиболее общей серьезной условно-патогенной инфекцией у детей с ВИЧ инфекцией; подсчитано, что заболеваемость PCP среди ВИЧ-инфицированных младенцев, не получавших профилактического лечения, составляет, по крайней мере, 12% на 1 году жизни. Многие дети умирают сразу после развития PCP. Комплекс Mycobacterium Avium (МАК) относится к инфекциям семейства очень похожих микроорганизмов - Mycobacterium avium и М. intracellulare. Когда МАК встречается у людей без поражений иммунной системы, он обычно протекает в форме инфекций респира 3 торного тракта. У ВИЧ-инфицированных пациентов МАК часто является рассеянным (рассеянный МАК или РМАК), и может быть поражена система почти любого органа. Согласно недавним исследованиям у 43% пациентов, выживших в течение 2 лет после постановки диагноза СПИД, были обнаружены МАК бактерии. До сих пор не было предложено стандартных методов терапии рассеянного МАК. Обычно назначают комбинации препаратов и в случае успеха требуется продолжение лечения в течение жизни. Таким образом, существует настоятельная потребность в более эффективном лечении. ВИЧ-инфицированные особенно чувствительны к инфекции Mycobacterium tuberculosis,в результате которой ускоряется развитие заболевания. Внелегочный туберкулез редко встречается у не инфицированных ВИЧ людей, но он часто поражает ВИЧ-инфицированных. Центр контроля заболеваемости выпустил руководство по лечению туберкулеза, которое направлено на лечение все более распространяющегося туберкулеза, имеющего мультилекарственную резистентность (MDR-TB). Смертность среди больных СПИДом с MDR-TB очень высока (примерно 80%), причем значительно ускоряется развитие болезни. Следовательно, существует настоятельная потребность создания способа лечения этих инфекций, широко распространенных и опасных для человека и животных. Также существует необходимость в препарате широкого действия для облегчения лечения трематодных инфекций. В настоящее время необходимо диагностировать трематодный патоген и затем назначать специальную медикаментозную терапию этой трематоды. Во многих слаборазвитых странах нет оборудования для диагностики определенных трематод. Благодаря созданию препарата широкого действия отпадет необходимость диагностики.Schistosoma mansoni, шистосома, является возбудителем шистосомоза, второго по распространению тропического паразитического заболевания людей (после малярии) и наиболее значительной трематодной инфекцией у людей.Schistosoma haematobium - другой важный вид инфекции. Более 200 миллионов людей страдают от шистосомоза во всем мире, в том числе несколько сотен тысяч в США.Fasciola hepatica, простая печеночная двуустка, первоначально является возбудителем заболевания у овец, однако, человек является факультативным хозяином этого паразита. Паразит пытается выжить при наличии сильного иммунного ответа хозяина. Для лечения был предложен битионол, но он не был одобрен для применения в США. Таким образом, существует необходимость в фармацевтической композиции, которая была бы стабильной при хранении даже в тропиче 002920 4 ских средах и обладала бы широким спектром действия против трематод. Сущность изобретения Настоящее изобретение решает проблему недостаточной стабильности суспензии тизоксанида и нитазоксанида благодаря включению в ее состав кислоты и созданию кислой среды, в результате чего улучшается стабильность суспензии при хранении даже в тропических средах. При исследованиях животных и при клинических испытаниях у людей было обнаружено, что эффективность лечения с использованием соединений формул I и II зависит от стабильности этих соединений. Также было обнаружено, что эффективность лечения с использованием соединений формул I и II зависит от размеров частиц активного компонента препарата. Описанные фармацевтические композиции пригодны для лечения трематодных инфекций у человека и животных, возбудителями которых являются Schistosoma mansoni, Schistosoma haematobium,Schistosoma mekongi, Schistosoma japonicum,Schistosoma intercalatum; Fasciola, такие как FasciolaDicrocoelium dendriticum, Heterophyes heterophyes и Metagonimus yokogawa. Эти фармацевтические композиции также эффективны для лечения условно-патогенных инфекций у пациентов с нарушенной иммунной системой, возбудителями которых являютсяtuberculosis, Mycobacterium avium intracellulare,Pneumocystis carinii, Toxoplasma gondii. Фармацевтическая композиция может быть в форме, приемлемой для орального применения, такой как твердая лекарственная форма, жидкая суспензия или паста. Краткое описание рисунков Для лучшего понимания природы и объектов настоящего изобретения приводим следующее описание и чертежи. Фиг. 1 показывает процент снижения уровня инфекции и жизнеспособность клеток хозяина при применении нитазоксанида против Е. intestinalis. Фиг. 2 показывает процент снижения уровня инфекции и жизнеспособность клеток хозяина при применении нитазоксанида против V. соrnеае. Фиг. 3 показывает процент снижения уровня инфекции и жизнеспособность клеток хозяина при применении альбендазола против Е. intestinalis. Фиг. 4 показывает процент замедления и жизнеспособность клеток хозяина при применении альбендазола против V. соrnеае. На фиг. 5 и 6 изображен график зависимости значений средней оптической плотности(OD), полученных для каждой культуры T. gondii,от концентрации препарата в культуре. На фиг. 7 представлена схема, основанная на испытаниях эффективности нитазоксанида 5 против микобактерий, выращенных в жидком бульоне. Фиг. 8 показывает процент активных частиц, имеющих размер менеемкм. Подробное описание изобретения Фармацевтические композиции по настоящему изобретению содержат в качестве активного агента, по меньшей мере, одно соединение, выбранное из группы, состоящей из дезацетилнитазоксанида формулы I и, по меньшей мере, одну фармацевтически приемлемую кислоту, стабилизирующую эти композиции. Нитазоксанид (NTZ), соединение формулы I,является родовым названием 2-(ацетолилокси)N-(5-нитро-2-тиазолил)бензамида, соединения,которое впервые синтезировали Россигнол и Кавиер в 1975 г. 2 мг нитазоксанида можно растворить в 1 мл диметилсульфоксида (ДМСО). Нитазоксанид легко поглощается орально. До сих пор не было показано, что соединения формул I и/или II могут быть широко эффективны против трематодных инфекций либо что они не являются особо токсичными и переносятся даже пациентами с нарушенной иммунной системой. Получение и применение нитазоксанида раскрыто в патенте США 3950351, а также в публикациях автора настоящего изобретения. Дезацетилнитазоксанид, соединение формулы I,которое иногда называют тизоксанидом или dNTZ, является метаболитом нитазоксанида. В публикации WO 95/28393 автор настоящего изобретения изложил способ производства чистого соединения формулы II, а также применение композиции, содержащей смесь соединений формул I и II. Фармацевтически приемлемыми кислотами, которые используются для приготовления композиций по настоящему изобретению, могут быть следующие: лимонная, глутаминовая, янтарная, этансульфокислота, уксусная, винная,аскорбиновая, метансульфокислота, фумаровая,адипиновая, яблочная и их смеси. Лимонная кислота является очень подходящей. Присутствие кислот улучшает стабильность активного агента или агентов. Отношение веса фармацевтически приемлемой кислоты к весу активного твердого агента предпочтительней составляет от 0,01 до 0,5,более предпочтительно от 0,03 до 0,2. Предпочтительней, чтобы количество кислоты было достаточно для поддержания рН между 2 и 6, 002920 6 более предпочтительно между 3 и 5, наиболее предпочтительно между 3,5 и 4,5. Методика приготовления и предпочтительные примеры твердых и жидких лекарственных форм фармацевтической композиции раскрыты в публикации WО 95/28393 и здесь не приводятся. Эти композиции предпочтительней содержат увлажняющий агент и, возможно,производное крахмала, такие, как описано в патенте США 5 578 621, содержание которых здесь не приводится. Увлажняющий агент, как описано в патенте США 5 578 621, играет роль диспергирующего агента. Такие фармацевтические композиции либо в твердой, либо в жидкой форме, а также в виде паст или мазей могут содержать дополнительные активные агенты, такие как антибиотики,противовирусные агенты или ингибиторы протонного всасывания. Хотя это не является предпочтительным, такие фармацевтические композиции также могут содержать активные твердые частицы соединения формулы I и/или соединения формулы II размером более 200 мкм. Эти композиции могут содержать инертные наполнители, известные для приготовления форм, пригодных для орального применения. Предпочтительней для того, чтобы получить наилучшую эффективность против широкого спектра паразитов, бактерий, грибов и вирусов, активный агент или агенты, используемые в твердой форме или в виде суспензии, являются преимущественно смесью твердых частиц соединений формул I и II, имеющих размеры менее 200 мкм, причем весовое содержание соединения формулы I по отношению к весу соединений формулы I и формулы II составляет от 0,5 до 20%, предпочтительней от 0,5 до 10%. Коэффициент распределения активных твердых частиц составляет от 0,8 до 2, предпочтительней от 1,1 до 1,9, более предпочтительно более 1,5,причем этот коэффициент распределения рассчитывают по формулеF90%=(90%-10%)/90%+10%)/2),где F90% - коэффициент распределения при 90%; 90% - максимальный размер частиц во фракции частиц, соответствующей 90% указанных активных твердых частиц и 10% - максимальный размер частиц во фракции частиц, соответствующей 10% указанных активных твердых частиц. Активный агент или агенты, используемые в твердой форме или в виде суспензии, являются преимущественно смесью твердых частиц соединений формул I и II. Эти твердые частицы гранулируют, используя смесь, содержащую активные твердые частицы и, по крайней мере,один гранулирующий агент. Примеры гранулирующего агента: поливинилпирролидон, вода,спирт, сахароза, гидроксицеллюлоза и их смеси. Предпочтительней в процессе гранулирования 7 добавляют, по крайней мере, одну фармацевтически приемлемую кислоту. Изобретение относится к твердым лекарственным формам, содержащим композицию изобретения, таким как таблетки, рассасывающиеся таблетки, таблетки в оболочке, матриксы и т.д. Лекарственная форма изобретения содержит, например,твердые активные частицы, имеющие размеры менее 200 мкм, причем менее 10% частиц имеют размеры более 100 мкм, менее 50% частиц имеют размеры более 50 мкм и менее 10% частиц имеют размеры менее 5 мкм, средний размер частиц составляет от 20 до 50 мкм; по крайней мере, один гранулирующий агент; по крайней мере, один увлажняющий агент; по крайней мере, одно производное крахмала; и по крайней мере, одну фармацевтически приемлемую кислоту, которую добавляют предпочтительней во время грануляции. Жидкая лекарственная форма изобретения,такая как суспензия, содержит, например,в качестве активного агента твердые частицы, содержащие соединения формул I и/илиII, имеющие размеры менее 200 мкм, причем менее 10% частиц имеют размеры более 100 мкм,менее 50% частиц имеют размеры более 50 мкм и менее 10% частиц имеют размеры менее 5 мкм; по крайней мере, один гранулирующий агент; по крайней мере, один увлажняющий агент; по крайней мере, одну фармацевтически приемлемую кислоту, причем рН суспензии составляет от 2 до 6, предпочтительней от 3 до 5,более предпочтительно от 3,5 до 4,5; по крайней мере, один загуститель, например ксантановую смолу, гуаровую смолу, кристаллическую целлюлозу, смолу карруба, карбоксиметилцеллюлозу или их смесь. Пасты или мази изобретения для орального применения содержат, например,в качестве активного агента твердые частицы, содержащие соединения формул I и/илиII, имеющие размеры менее 200 мкм, причем менее 10% частиц имеют размеры более 100 мкм,менее 50% частиц имеют размеры более 50 мкм и менее 10% частиц имеют размеры менее 5 мкм; по крайней мере, один увлажняющий агент; по крайней мере, одну фармацевтически приемлемую кислоту, причем рН суспензии составляет от 2 до 6, предпочтительней, от 3 до 5,более предпочтительно, от 3,5 до 4,5; по крайней мере, один загуститель, например ксантановую смолу, гуаровую смолу, кристаллическую целлюлозу, смолу карруба, карбоксиметилцеллюлозу или их смесь. Пасты или мази изобретения для местного или интравагинального нанесения содержат,например,в качестве активного агента твердые частицы, содержащие соединения формул I и/илиII, имеющие размеры менее 200 мкм, причем ме 002920 8 нее 10% частиц имеют размеры более 100 мкм,менее 50% частиц имеют размеры более 50 мкм и менее 10% частиц имеют размеры менее 5 мкм; по крайней мере, один увлажняющий агент; по крайней мере, одну фармацевтически приемлемую кислоту, причем рН суспензии составляет от 2 до 6, предпочтительней от 3 до 5,более предпочтительно от 3,5 до 4,5; цетиловый спирт, и/или производные глицерида, и/или пропиленгликоль; по крайней мере, один загуститель, например ксантановую смолу, гуаровую смолу, кристаллическую целлюлозу, смолу карруба, карбоксиметилцеллюлозу или их смесь. Описание приготовления фармацевтических композиций Сухое чистое соединение формулы I и сухое чистое соединение формулы II измельчали и сортировали по размеру частиц с помощью сита. После измельчения частицы соединений формулы I и формулы II и их смесей имели распределение по размерам, показанное на фиг. 8. Фиг. 8 показывает процент частиц, имеющих размеры менеемкм. Из данных на этой фигуре видно, что менее 10 вес.% частиц имеют размеры менее примерно 5 мкм; менее 10 вес.% частиц имеют размеры более примерно 70 мкм; средний размер частиц составляет примерно 40 мкм; коэффициент распределения составляет около 1,73, причем этот коэффициент распределения рассчитывают по формулеF90%= (90%-10%)/90%+10%)/2),где F90% - коэффициент распределения при 90%; 90% - максимальный размер частиц во фракции частиц, соответствующей 90% указанных активных твердых частиц и 10% - максимальный размер частиц во фракции частиц, соответствующей 10% указанных активных твердых частиц. Предпочтительные примеры таких композиций показаны в следующих таблицах. Таблица 1 Пример композиции рассасывающихся таблеток для орального применения, содержащей соединения формулы II и формулы I в качестве активных агентов Нитазоксанид (99%)+ 200 мг дезацетилнитазоксанид (1%) 116 мг Микрокристаллическая целлюлоза Авицел рН 102 (продается FMC-USA) 25 мг Кросповидон 3 мг Стеарат магния 5 мг Коллоидный диоксид кремния 10 мг Лимонная кислота Клубничный ароматизатор 877720(продается Robertet) 10 мг Сахаринат натрия 2 мг 9 Таблица 2 Пример композиции таблеток в оболочке для орального применения, содержащей соединения формулы II и формулы I в качестве активных агентов Нитазоксанид 500 мг Кукурузный крахмал 60 мг Прежелатинизированный кукурузный крахмал 70 мг Стеарат магния 3 мг Гидроксипропилметилцеллюлоза 5 мг Сахароза 20 мг Натриевый крахмал гликолят 30 мг Лимонная кислота 25 мг Тальк 8 мг Стеарат магния 7 мг Оболочка: горячий раствор сахара или обволакивающую пленку напыляли на таблетки или гранулы, содержащие 500 мг активного агента. Таблица 3 Пример водной суспензии для орального применения, содержащей соединения формулы II и формулы I в качестве активных агентов рH суспензии около 4,1 Нитазоксанид (98%)+ дезацетилнитазоксанид (2%) 2 г Дистиллированная вода 100 мл Бензоат натрия 0,2 г Сахароза 30,5 г Ксантановая смола 0,2 г Микрокристаллическая целлюлоза и натрий карбоксиметилцеллюлоза 0,8 г Авицел RС-591 (продается FMC-USA) Лимонная кислота 0,2 г Дигидрированный цитрат натрия 50 мг Клубничный ароматизатор 877720(продается Robertet) 125 мг Красный краситель 33 D и С 1 мг 10 Таблица 4 Пример пасты для орального применения,содержащей соединения формулы II и формулы I в качестве активных агентов Нитазоксанид (98%)+ 500 мг дезацетилнитазоксадид (2%) 10 г Минеральное масло 1 г Желтый сахар Микрокристаллическая целлюлоза и натрий карбоксиметилцеллюлоза 0,8 г Авицел RC-591 (продается FMC-USA) Лимонная кислота 0,2 г Таблица 5 Пример пасты или мази для интравагинального или местного нанесения, содержащей соединения формулы II и формулы I в качестве активных агентов Нитазоксанид (98%)+ дезадетилнитазоксанид (2%) 8 г Кремафор А 6 2 г Кремафор А 25 1,5 г Минеральное масло 7 г Лувитол ЕНО 7 г Моноэфир глицерина 4 г Цетиловый спирт 3 г Симетикон 0,5 г Гермабен II 1 г Пропиленгликоль 3,5 г Дистиллированная вода 62,5 г Лимонная кислота 3,0 г Фармацевтические композиции изобретения являются композициями, обладающими широким спектром действия на паразитов, бактерии, грибы и вирусы, особенно при оральном применении. Эффективность и безопасность фармацевтических композиций, описанных выше, была наилучшей у людей и животных. В частности, клинические испытания показали, что описанные фармацевтические композиции были значительно более эффективны, чем аналогичные композиции с активным соединением, имеющим размеры частиц в диапазоне от 170 до 520 мкм (средний размер частиц=352 мкм), даже в том случае, если эти частицы больших размеров вводились пациентам в дозах, больших в 3 раза, и в течение больших периодов времени. В табл. 6 приведены примеры показателей эффективности лечения. Таблица 6 Сравнение результатов клинических испытаний с использованием соединений формулы I и формулы II,имеющих размеры частиц в диапазоне от 170 до 520 мкм (средний размер частиц=352 мкм),с результатами, полученными с использованием соединений формулы I и формулы II,имеющих размеры частиц в диапазоне от 5 до 200 мкм (средний размер частиц=34 мкм) Соединение формулы I (98%)+соединение формулы II (2%) Размеры частиц от 5 до 200 мкм Размеры частиц от 170 до 520 мкм Доза=от 15 до 50 мг/кг в день в течение Доза=15 мг/кг в день в течение 3 дней от 3 до 7 дней Количество выздоровлений/общее коли- Количество выздоровлений/общее количество пациентов=показатель эффектив- чество пациентов=показатель эффективности лечения, % ности лечения, % ПаразитTrichuris trichiura 7/48=15% 58/79=73% Для каждого из паразитов, указанных в табл. 6,соответствующий показатель эффективности лечения был значительно выше у пациентов, которых лечили активными частицами, имеющими размеры от 5 до 200 мкм, чем у пациентов, которых лечили активными частицами, имеющими размеры от 170 до 520 мкм, со статистическим значением для каждого случая р 0,02 (с использованием стандартного X2 теста). Это происходило даже в случаях, когда дозы частиц больших размеров были больше в 3 раза при большей продолжительности лечения по сравнению с дозами и продолжительностью приема фармацевтических композиций с активным агентом, имеющим размеры частиц менее 200 мкм. У обеих групп пациентов не наблюдалось серьезных побочных эффектов. Аналогичные результаты были получены в экспериментах с животными. В дополнение, побочные реакции, наблюдавшиеся у собак после орального применения одной дозы в количестве 50 мг/кг соединения формулы I и соединения формулы II, не были отмечены при интенсивных экспериментах на животных, принимавших соединения формулы I и соединения формулы II, имеющие размеры частиц в диапазоне от 5 до 200 мкм (в среднем 10 мкм), даже в случаях, когда такая же или большая доза вводилась ежедневно в течение 90 дней или более. Более того, указанные композиции были стабильны (даже при температурах до 40 С и относительной влажности 65% в течение 6 месяцев или, в случае жидких водных суспензий, при таких условиях в течение 3 месяцев), что подтверждает тот факт,что активные ингредиенты не разлагаются и композиции сохраняют свою эффективность в течение такого периода времени после их приготовления, какой необходим для медицинских целей и торговли. В следующих примерах показана эффективность фармацевтических композиций. Пример 1. Cryptosporidium parvum. В предварительных клинических испытаниях 30 пациентов с диагнозом СПИД, страдающих криптоспоридиозной диареей, принимали орально нитазоксанид от 500 до 2000 мг ежедневно. Если диарея продолжалась, эти пациенты дополнительно принимали нитазоксанид в течение еще 4 недель в дозе до 2000 мг ежедневно. 28 пациентов получали лечение в течение 2 или более недель, у 16 из них можно было оценить терапевтический ответ на 8-ой неделе лечения. Из этой последней группы у 12 человек наблюдалось 50%-е или более уменьшение ежедневной частоты дефекации, у 10 пациентов было отмечено уменьшение или отсутствие паразитов в стуле, причем у четверых организмы не определялись. Для 6 пациентов лечение оказалось полезным как точки зрения клинического, так и паразитологического ответа. У пациентов, которые получали более высокие ежедневные дозы в течение более длительного времени, была большая вероятность положительного ответа. Изучение действия нитазоксанида на криптоспоридиозную диарею у пациентов с диагнозом СПИД показало уменьшение количества дефекаций у пациентов, принимающих ежедневно 500, 1000, 1500 или 2000 мг лекарства. У участников эксперимента было отмечено среднее значение CD4+ - 42 клетки/мм 3 (диапазон 0303 клетки/мм 3), среднее значение дефекаций 6,7 ежедневно в среднем в течение 15 месяцев,ооцисты Cryptosporidium parvum в стуле и не отмечено других видимых патогенов. Почти у всех пациентов терапия азитромицином или паромомицином не дала положительных результатов. Через 23 недели у 9-13 пациентов наблюдался полный клинический ответ (от одной до трех преимущественно сформированных дефекаций), у 4-13 пациентов наблюдался частичный клинический ответ (по крайней мере, 50%-е уменьшение ежедневных дефекаций или изме 13 нение консистенции стула - по крайней мере,75% сформированного стула). К окончанию испытаний у 8-11 пациентов наблюдалось отсутствие паразитов, а еще у троих - существенное уменьшение уровня ооцист. Наблюдалась тенденция улучшения ответа при ежедневных дозах в 1000 мг или выше и при более длительной терапии. У двух пациентов наблюдались повреждения кожи в виде крапивницы, более 90% пациентов придерживались специальной диеты в течение более 4 недель. Пример 2. Cryptosporidium parvum. Данные о дозах in vitro. Нитазоксанид растворяли в стерильном диметисульфоксиде (ДМСО) и тестировали против интактных ооцист С. parvum, инфицировавших монослои клеток, при концентрациях 100,10, 1 и 0,1 мкг/мл. Второе испытание проводили с тестированным нитазоксанидом при дополнительных концентрациях 20, 2, 0,2 и 0,02 мкг/мл. Эти концентрации получали последовательными разбавлениями средой DMEM до получения конечной концентрации ДМСО 0,5%. Контрольная среда также содержала ДМСО в концентрации 0,5%. В эксперименте использовали культуру клеток MDBKF5D2, выращенную в 7 мм лунках, и Cryptosporidium parvum: GCH1 ооцисты,5 х 104 на лунку, в эксперименте сравнивали активность паромомицина (положительный контроль) и нитазоксанида (экспериментальное лекарство). Материалы включали иммунную анти-Cryptosporidium parvum спорозоитную кроличью сыворотку (0,1%) и козье антикроличье антитело, меченное флюоресцеином (1%). Испытания токсичности. 200 мкл среды, содержащей нитазоксанид в концентрациях 100, 10, 1 и 0,1 мкг/мл, и соответствующие контрольные пробы помещали в 2 лунки на пластину с 96 лунками, содержащими конфлюентные монослои клеток MDBKF5D2,причем 2 лунки не содержали монослоев. Лекарство инкубировали на монослоях при 37 С в атмосфере 8% СO2. Через 24 ч (опыт 1) и 48 ч(опыт 2) в каждую лунку добавляли MTS (раствор Овена (Owen и PMS в концентрациях 333 мкг/мл и 25 мкМ соответственно. Пластину снова помещали в инкубатор и выдерживали в темноте в течение 2 ч. Через 2 ч 100 мкл каждого супернатанта переносили в новую микролитровую пробирку и проводили иммуноферментный твердофазный анализ при 490 нм. Результаты записывали и анализировали. Токсичность в процентах рассчитывали следующим образом: разность средней оптической плотности (OD) супернатантов с лекарством и средней оптической плотности (OD) супернатантов контрольной среды (без лекарства) делили на OD контрольной среды и умножали на 100. 14 Испытание интактных ооцист C. parvum. 5 х 104 ооцист C.parvum на лунку инкубировали с нитазоксанидом (100, 20, 10,2, 1, 0,2, 0,1 и 0,02 мкг/мл) при 37 С (8% CO2) на конфлюентных монослоях клеток MDBKF5D2. Уровень инфекции в каждой лунке определяли и анализировали иммунофлюоресцентным методом через 24 и 48 ч. Снижение уровня инфекции в процентах рассчитывали следующим образом: разность среднего числа паразитов/10 полей в контрольной среде (без лекарства) и среднего числа паразитов/10 полей в лунках с лекарством делили на число паразитов в контрольной среде и умножали на 100. Результаты. Опыт 1: 24 часа. Соединение Инфицированная cреда Паромомицин Влияние нитазоксанида на интактные ооцисты C. parvum. В опыте 1 нитазоксанид в концентрациях 10, 1 и 0,1 привел к снижению уровня паразитов на 94,4, 77,2 и 51,8% соответственно и к уровню токсичности клеток до 65,1, 8,3 и 19,3% соответственно. Хотя при 10 мкг/мл имело место почти полное угнетение инфекции, была очевидна высокая степень токсичности. При 1 мкг/мл нитазоксанида снижение уровня инфекции и токсичность клеток была лучше по сравнению с паромомицином при концентрации 2 мг/мл(снижение уровня инфекции на 77,2% и токсичность до 8,3% для нитазоксанида при 1 мкг/мл и снижение уровня инфекции на 51% и токсичность до 23,8% для паромомицина при 2 мг/мл). В опыте 2 лекарство модифицировали для получения лучшего распределения доз с минимальной токсичностью. Соответственно культу 15 ры выдерживали в течение 48 ч вместо 24 ч опыта 1. Инкубация в течение 48 ч показала более высокую относительную токсичность, что видно из опытов с паромомицином в обоих опытах. Концентрация нитазоксанида 20 мкг/мл была слишком токсична за 48 ч инкубации, хотя монослои клеток оказались интактными. Возможно, что высокая токсичность, которая влияет на функцию клеток, также воздействует и на развитие инфекции паразитов. При концентрации нитазоксанида 2 мкг/мл наблюдалось значительное снижение уровня инфекции паразитов при относительно низкой клеточной токсичности. Дополнительные разведения также привели к значительному снижению уровня инфекции и низкой токсичности. При концентрации лекарства 2 мкг/мг умеренная клеточная токсичность и снижение уровня инфекции на 94,90% показали, что нитазоксанид при концентрации 2 мкг/мл превосходит паромомицин с концентрацией 2 мг/мл по влиянию на инфекцию C. parvum in vitro (различие в концентрациях в 1000 раз). Пример 3. Cryptosporidium parvum. Данные о дозах in vitro и хранении. Маточные растворы нитазоксанида и дезацетилнитазоксанида (NTZ и NTZdes) тестировали против интактных ооцист Cryptosporidiumparvum, эксцистированные спорозоиты инфицировали монослои клеток при концентрациях 10,1, 0,1 и 0,01 мкг/мл. Каждое соединение растворяли в 100%-ном диметилсульфоксиде (ДМСО) и разбавляли до нужных концентраций стерильным ДМСО. Каждая концентрация нитазоксанида и контрольная среда содержала ДМСО в постоянной концентрации 0,025%. В эксперименте использовали культуру клеток MDBKF5D2, выращенную в 7 мм лунках, и Cryptosporidium parvum: GCH1 ооцисты, 5 х 104 на лунку, в эксперименте сравнивали активность паромомицина (положительный контроль) и нитазоксанида (экспериментальное лекарство). Материалы включали иммунную антиCryptosporidium parvum спорозоитную кроличью сыворотку (0,1%) и козье антикроличье антитело, меченное флюоресцеином (1%). Испытания токсичности. Результаты. Испытание ооцист С. parvum (48 ч). Лекарство Концентрация Паразит Водная среда 0 681,58 Паромомицин 2000 115,75 Среда 0,025% ДМСО 0 628,50 10 11,75 1 39,67 16 200 мкл среды, содержащей раствор нитазоксанида в концентрациях, указанных выше, и соответствующие контрольные пробы помещали в 2 лунки на пластину с 96 лунками, содержащими конфлюентные монослои клетокMDBKF5D2, причем 2 лунки не содержали монослоев. Лекарство инкубировали на монослоях при 37 С (8% СО 2). Через 48 ч в каждую лунку добавляли MTS (раствор Овена (Owen и PMS в концентрациях 333 мкг/мл и 25 мкМ соответственно. Пластину снова помещали в инкубатор и выдерживали в темноте в течение 2 ч. Через 2 ч 100 мкл каждого супернатанта переносили в новую микролитровую пробирку и проводили иммуноферментный твердофазный анализ при 490 нм. Результаты записывали и анализировали. Токсичность в процентах рассчитывали следующим образом: разность средней оптической плотности (OD) супернатантов с лекарством и средней оптической плотности (OD) супернатантов контрольной среды (без лекарства) делили на OD контрольной среды и умножали на 100. Цитотоксичность оценивали в баллах следующим образом: 0,5% токсичность=0, 6-25% токсичность=1, 26-50% токсичность=2, 51-75% токсичность=3, 76-100% токсичность=4. В качестве стандарта за приемлемый уровень токсичности принимали токсичность 0 или 1 балл. Токсичность 2, 3 и 4 балла считали высокой по отношению к монослою клеток. Испытание интактных ооцист С. parvum. 5 х 104 ооцист С. parvum на лунку инкубировали с указанными концентрациями нитазоксанида при 37 С (8% СО 2) на конфлюентных монослоях клеток MDBKF5D2. Уровень инфекции в каждой лунке определяли и анализировали на компьютере иммунофлюоресцентным методом через 48 ч. Снижение уровня инфекции в процентах рассчитывали следующим образом: разность среднего числа паразитов в поле зрения в контрольной среде (без лекарства) и среднего числа паразитов в поле зрения в лунках с лекарством делили на число паразитов в контрольной среде и умножали на 100. 81,27 4 10 13,75 6,66 0,337 0,005 97,81 4,97 0 1 39,92 13,49 1,710 0,033 93,65 Новый NTZdes 16,29 1 0,1 649,86 152,19 1,506 0,119 0 4,36 0 0,01 749,33 139,49 1,721 0,144 0 Концентрация - мкг/мл; Паразит - среднее число паразитов в поле зрения (анализировали 12 полей); % сниж. - процент снижения уровня инфекции; % токс. - процент токсического действия лекарства на клетки. Приведенные данные свидетельствуют о том, что активность NTZdes, снижающая уровень инфекции, имеет значение, близкое значению активности NTZ из примера 2. Как нитазоксанид, так и дезацетилнитазоксанид были одинаково эффективны in vitro против C. parvum при испытаниях этих соединений в параллельных опытах; для концентраций 10 и 1 мкг/мл были получены значения процента снижения уровня инфекции 98 и 94% для каждого соединения соответственно. Для нитазоксанида концентрация 1 мкг/мл была минимальной концентрацией, дающей процент снижения уровня инфекции более 90%, в то время как 50%-е снижение уровня инфекции достигалось при более низких концентрациях нитазоксанида,а именно 0,2, 0,1 и 0,02 мкг/мл. При таких же условиях эксперимента паромомицин, который использовался в качестве контрольного вещества, был в 2000 раз менее эффективен, при концентрации 2000 мкг/мл процент снижения уровня инфекции составил от 51 до 83%. Пример 4. Е. Intestinalis and V. cornea. 2RK-13 клетки (линия почечных клеток кролика) помещали на пластины с 24 лунками с концентрацией 2,6 х 105 клеток на лунку (1,0 мл среды; RPMI 1640, 2 мМ L-глутамина и 5% инактивированной нагреванием эмбриональной бычьей сыворотки). Пластины инкубировали при 37 С в инкубаторе с СО 2 в течение ночи, за это время лунки были конфлюентны (с одним удвоением,которое оценивается как 5 х 105 клеток на лунку). Организмы Septata intestinalis (полученные из культуры ткани) добавляли к клеткам-хозяевам в соотношении 3:1 в расчете на клетки-хозяева или 15 х 106 организмов на лунку. В результате было инфицировано примерно 50% клеток-хозяев. Лекарства растворяли в ДМСО, воде или метаноле (в зависимости от растворимости) для получения маточных растворов с концентрацией 1,0 мг/мл, которые хранили при -70 С. Маточные растворы разбавляли средой тканевой культуры. Каждое разведение тестировали в 3 лунках. Среду меняли каждые 3-4 дня (среда содержала свежеразбавленные лекарства). На 6-й день (после добавления паразитов и лекарств) клетки проверяли на токсичность. Контрольные клетки с лекарством, но без паразитов, испытывали на конфлюентность, морфологию клеток и наличие мертвых или подвижных клеток. Клетки, инкубированные только с паразитами, испытывали для подтверждения инфекционности паразитов (а именно, на присутствие паразитоносных вакуолей). В клетках инкубировали паразитов и определяли токсичность лекарств на клетки-хозяева и относительное количество паразитоносных вакуолей (высокое, среднее или низкое). На 10-й день к культуре в лунках добавляли по 100 мкл 10%-го SDS (додецилсульфат натрия) (0,5% конечная концентрация) для разрушения клеточных мембран и высвобождения микроспоридий. Общее количество паразитов в каждой лунке определяли путем подсчета в аликвоте на гемоцитометре. Результаты представляли в процентах снижения уровня токсичности (относительно инфицированных клеток без лекарства). Результаты представлены на фиг. 1-4. Пример 5. Toxoplasma gondii. Нитазоксанид и дезацетилнитазоксанид тестировали против паразитов, а более конкретно,RH штамм Toxoplasma gondii поддерживался последовательными пассажами у мышей. В клеточные культуры MRC5 фибробласт (Bio-Merieux,Франция), выращенные на пластинах с 96 лунками, высевали Toxoplasma gondii. 200 свежесобранных тахизоитов добавляли в каждую лунку с культурой, кроме 8 контрольных лунок (отрицательный контроль). Через 4 ч инкубации к культуре были добавлены растворы лекарств. Нитазоксанид и дезацетилнитазоксанид тестировали в диапазоне концентраций от 8 х 10-4 до 40 мг/мл. Лекарства сначала растворяли в ДМСО с концентрацией 2 мг/мл и затем проводили последовательные разбавления культурной средой. Выпадения осадка не наблюдали. Растворы лекарств добавляли в культуры (8 лунок для каждого разведения), затем пластины с культурой инкубировали в течение 72 ч. Затем культуры фиксировали холодным метанолом. Оценку роста Т. gondii проводили иммуноферментным твердофазным анализом с использованием меченного пероксидазой кроличьего антиToxoplasma gondii антитела. Значения оптической плотности регистрировали для каждой лунки. Результаты представлены в виде графика зависимости оптической плотности для каждой лунки с культурой от концентрации лекарства в культуре. Статистический анализ заключался в регрессионном анализе с доверительной областью 95% и определении кривых доза-ответ из значений оптической плотности для каждого лекарства. Одну пластину окрашивали Giemsa для оценки цитопатического эффекта в культурах. Проводили три отдельных опыта. В каждом опыте использовали две пластины с культурами для каждого соединения, на каждой пла 19 стине для каждой концентрации лекарства использовали по 8 лунок. Результаты. В трех сериях опытов были получены сходные результаты. Графическое представление этих результатов одного опыта для каждого лекарства отражено на фиг. 5 а, b, с и 6 а, b, с. Нитазоксанид (фиг. 5 а, b, с). Для диапазона концентраций от 10-4 до 0,3 мг/л не было обнаружено снижения уровня инфекции. Значительное снижение было отмечено для концентрации 0,6 мг/л и полное прекращение роста Toxoplasma gondii при концентрации 2,5 мг/л. Однако заметная токсичность была отмечена на монослое клеток при концентрации 2,5 мг/л. Микроскопический анализ монослоя показал,что нитазоксанид при концентрации 1,25 мг/л вызвал цитопатический эффект на зараженных клетках с увеличением количества паразитоносных вакуолей и уменьшением количества внутриклеточных паразитов. С помощью регрессионного анализа была рассчитана концентрация 50%-го снижения уровня инфекции, которая составила 1,2 мг/л. Дезацетилнитазоксанид (фиг. 6 a, b, с). Аналогичные результаты были получены для дезацетилнитазоксанида: отсутствие эффекта при концентрациях от 10-4 до 0,3 мг/л, снижение уровня инфекции для концентрации 0,6 мг/л и заметная токсичность при концентрации 2,5 мг/л. Концентрация 50%-го снижения уровня инфекции составила 1,2 мг/л. Полученные результаты были воспроизведены в трех отдельных опытах, оценку влияния лекарства на снижение уровня инфекции проводили на одинаковых культурах для каждой концентрации лекарства. Как для NTZ, так и для NTZdes наблюдали заметное замедление роста Toxoplasma gondii при концентрации примерно 1,2 мг/л с деформацией паразитоносных вакуолей, но без заметного изменения самих паразитов. Эти результаты показывают, что данные лекарства обладают хорошей активностью противT. gondii и что на основании полученного значения концентрации 1 мг/л для сыворотки или тканей можно ожидать терапевтического эффекта in vivo. Пример 6. Mycobacteria. Было обнаружено, что нитазоксанид обладает антимикробной активностью против туберкулезной палочки. В следующей таблице представлены результаты опытов по определению минимальной ингибирующей концентрации (МИК) нитазоксанида и тизоксанида против Mycobacterium intracellulare с помощью методики с растворами агара. Результаты были основаны на нескольких опытах,каждый из которых проводился в течение 3 недель с использованием методики с растворами Middlebrook агара. Полученные результаты показали, что МИК нитазоксанида против Mycobacteria составляет 2 мкг/мл, а МИК тизоксанида - 4 мкг/мл. В опытах использовали стандартный штамм Myco 002920bacterium intracellulare от АТСС и стандартную методику с растворами агара. МИК нитазоксанида и тизоксанида для Mycobacterium intracellulare МИК Нитазоксанид 2 мкг/мл Тизоксанид 4 мкг/мл МИК определяли стандартной методикой с растворами агара в течение 3 недель с использованием агара Middlebrook 7H11. В опытах использовали стандартный штамм М. intracellulare АТСС 13950. На фиг. 7 представлены результаты, полученные из опытов по испытанию эффективности нитазоксанида против микобактерий, выращенных в жидком бульоне. Для определения роста через 4 ч проводили MTS колориметрические испытания. Этот метод предпочтительнее, чем 3-х недельная методика с растворами агара. Как видно из данных на фиг. 7, после добавления нитазоксанида через 72 ч после инициации роста культуры наблюдался немедленный эффект на рост по сравнению с ростом в контрольной среде. Доза нитазоксанида 3 мкг/мл останавливала рост в течение 24 ч, затем наблюдался медленный рост в течение следующих 2 дней. Доза 50 мкг/мл оказывала полное бактериостатическое действие на культуру в течение 144 ч. Пример 7. Cryptosporidium parvum. Действие нитазоксанида проверяли противRomark Laboratories, L.C. в Тампе, штат Флорида. Общая доза для человека (1 г в день в течение 7 дней, т.е. 7 г) была изменена для мышей согласно Пагету и Барнсу (Paget and Barnes). Доза для человека была умножена на 0,0026 для мышей (весом примерно 20 г) для получения общего количества лекарства, необходимого для приема утром и вечером в течение 7 дней. Каждая мышь получала 2,6 мг в день (7000 мг х 0,0026/7). Дозы вводились в рот с помощью пластикового шприца с иглой с круглым концом. Двадцать мышей (возраст 2 дня) были инфицированы путем орального применения 100000 ооцист Cryptosporidium parvum, полученных от инфицированных телят. Перед введением ооцисты концентрировали раствором сахара способом, описанным FayerEllis. Ежедневно брали и анализировали ректальные мазки от каждой мыши, используя модифицированную методику окрашивания Niehl-Neelsen, описанную Graczyk и др. Ооцисты появлялись в фекалиях через 2 дня после орального инфицирования животных. На 3-й день после инфицирования 10 мышей получали по 1,3 мг нитазоксанида утром и вечером в течение 7 дней, 10 других мышей использовались как контрольные без лечения. Ректальные мазки брали ежедневно в течение 7 дней лечения и в течение 7 дней после окончания лечения. Ооци 21Cryptosporidium parvum, снижая количество ооцист в фекалиях инфицированных мышей по сравнению с контрольными животными. Тестируемое лекарство снижало количество ооцист у 22 6 из 10 мышей, проходящих курс лечения, на третий день приема лекарства. На 7-й, последний день лечения наблюдалось полное отсутствие ооцист в фекалиях по сравнению с контрольными (без лечения) мышами. Этот эффект сохранялся, по крайней мере, в течение последующих 7 дней после окончания лечения, что видно из данных, полученных на 3-й и 7-й дни после окончания лечения. Количество ooцист в поле зрения (суспензия ооцист в масле) 3-й день лечения Последний день лечения 3-й день после лечения 7-й день после лечения Группа,Группа,Группа,Группа,Контрольная Контрольная Контрольная Контрольная мыши принимавшая принимавшая принимавшая принимавшая группа группа группа группа лекарства лекарства лекарства лекарства 1 3,0 0,0 5,0 0,0 4,0 0,0 2,0 0,0 2 4,0 0,0 4,0 0,0 3,0 0,0 1,0 0,0 3 6,0 0,0 5,0 0,0 4,0 0,0 0,5 0,0 4 3,0 2,0 3,0 0,0 2,0 0,0 1,0 0,0 5 5,0 2,0 3,0 0,0 3,0 0,0 0,5 0,0 6 3,0 0,0 4,0 0,0 5,0 0,0 2,0 0,0 7 3,0 0,0 5,0 0,0 4,0 0,0 1,0 0,0 8 5,0 1,0 5,0 0,0 1,0 0,0 0,5 0,0 9 3,0 3,0 3,0 0,0 2,0 0,0 1,0 0,0 10 0,0 5,0 0,0 2,0 0,0 0,5 0,0 Всего 35 8,0 42 0,0 30 0,0 10 0,0 Среднее 3,5 0,8 4,2 0,0 3,0 0,0 1,0 0,0 Эффек 60% 100% 100% 100% тивность Пример 8. Mycobacterium. Нитазоксанид сравнивали с антибиотиком изониазидом. В качестве штамма микобактерий использовали BCG (Bacille de Calmette et Guerin). Чувствительность этого штамма была аналогичной чувствительности М. tuberculosis, однако, этот штамм менее опасный и не требует серьезных мер предосторожности. Пример 9. Fasciola hepatica. Активность нитазоксанида и дезацетилнитазоксанида проверяли по их действию на Fasciolahepatica in vitro. Зрелые F. hepatica выделяли из желчных протоков печени 3 телят, пораженных фасциолезом, в Ветеринарной медицинской диагностиче Селезенка 68250 65000 75000 60000 20000 15250 60000 20000 102 500 140 000 98000 105 000 ской лаборатории Луизианы, Hardy's Maet Packers,Bunkie, LA. Трематоды промывали стерильным солевым раствором в течение 1 ч и помещали в стерильный солевой раствор или RPMI (рН 7,4) на дополнительные 3 ч. Затем трематоды инкубировали в стерильной RPMI-кроличьей сыворотке(50:50 об./об.) или RPMI (рН 7,4) в течение ночи при 37 С в атмосфере 5% СО 2. Культуру обрабатывали in vitro согласно модифицированной методике Ибарра и Дженкинса (Ibarra and Jenkins) (Z. Parasitenkd. 70:655661, 1984). Применяя стерильную технику, трематоды дважды промывали по 2-3 мин сбалансированным солевым раствором по Ханку (рН 7,2) и каждую помещали в лунку на пластину с культурой Linbro из 6 лунок, содержащую 10 мл указанных растворов лекарства в культурной среде,которая состояла из стерильной RPMI-кроличьей сыворотки (50:50 об./об.) с 2% крови кролика,100 частей на миллион пенициллина и 100 частей на миллион стрептомицина. Использовали только те трематоды, которые имели нормальную активность и морфологию. Маточные растворы нитазоксанида и его метаболита дезнитазоксанида, полученные от Rоmark, растворяли в ДМСО(2000 мкг/мл) и разбавляли культурной средой в мерных колбах на 100 мл для получения следующих концентраций лекарства (100, 50, 25, 10,5, 3, 1 мкг/мл). По 2 контрольные трематоды были включены в каждый параллельный опыт, одна с культурной средой без лекарства с RBC и одна с культурной средой без лекарства без RBC. Исследовали действие лекарств на трематоды, которое проявлялось в их гибели, нарушениях подвижности или изменении морфологии по сравнению с контрольными трематодами. Для тестирования трематод использовали панель, освещенную контрaжурным светом и линзы с трехкратным увеличением. Результаты. Опыт 1. При использовании дезнитазоксанида в дозах 50 и 100 мкг трематоды агонизировали или погибли через 1 ч. При дозе 25 мкг в течение 1 ого часа 4 из 7 трематод агонизировали, две оставались активны, одна была вялой; через 3 ч все,кроме 2 вялых трематод, погибли и только одна вялая трематода осталась живой через 4 ч. При дозе 10 мкг снижение активности было отмечено через 1, 3 и 4 ч и все трематоды агонизировали или погибли через 7 ч. При дозах 5 и 3 мкг снижение активности некоторых трематод было отмечено через 24 ч с некоторым слабым всплеском активности при дозе 3 мкг; через 50 ч все погибли кроме одной вялой особи в каждой группе. При дозе 1 мкг некоторая слабая активность была отмечена через 42-74 ч и только 3 активных и 1 агонизирующая трематода остались живыми через 91 ч; через 115 ч осталась живой только 1 вялая трематода. Смертельный исход наблюдался в контрольной группе с RBC через 66 ч (одна особь), через 91 ч (одна особь), через 115 ч (четыре особи). В контрольной группе без RBC через 91 ч все были живы, одна погибла через 115 ч. Опыт 2. При использовании нитазоксанида была отмечена более сильная активность при более ранних смертельных исходах и снижении под 002920 24 вижности в 8 параллельных опытах по сравнению с результатами для дезнитазоксанида. При дозах 100, 50 и 25 мкг все трематоды погибли или агонизировали через 1 ч, кроме одной при 25 мкг,она погибла через 3 ч. Соответствующее дозе снижение подвижности для каждой другой группы, обработанной лекарством, начиналось через 1 ч. При дозе 10 мкг только одна особь выжила через 16 ч. При дозе 5 мкг только три особи были активны на 6-й час и не осталось ни одной активной через 16 ч. Через 23 ч только 2 вялых трематоды в группе с дозой 3 мкг остались живыми; они погибли через 41 ч. При дозе 1 мкг одна погибла через 16 ч, три - через 41 ч и пять - через 74 ч; три особи остались активны через 91 ч и одна через 115 ч. В контрольной группе с RBC 7 из 8 трематод выжили через 74 ч; три через 91 ч и две через 115 ч. В контрольной группе без RBC 6 из 8 трематод сохранили активность через 74 ч, четыре остались живы через 91 ч и две сохранили активность через 115 ч. Смертность трематод в группах с высокими дозами (25, 50, 100 мкг) была высокой и была связана с контрактацией и брюшным искривлением. В группах с низкими дозами большая часть трематод на некоторое время снижала подвижность и была более расслабленной и уплощенной во время агонии и гибели. Через 91 ч наблюдалось заражение, которое влияло на точность опыта. При использовании дезнитазоксанида разрастание бактерий и грибов и связанная с этим смертность имела место на 2 пластинах параллельных опытов через 115 ч. При использовании нитазоксанида разрастание бактерий и грибов и смертность трематод имела место через 91 ч (2 пластины) и через 115 ч (5 пластин). Наблюдения через 139 ч нельзя считать достоверными из-за высокой степени заражения большинства пластин. Выводы. Опыты показали высокую антитрематодную активность нитазоксанида и дезнитазоксанида. Несколько более высокая активность против F. hepatica наблюдалась для нитазоксанида по сравнению с дезнитазоксанидом, основным метаболитом, который, как предполагают, является активным на печеночном уровне. Быстрая смертность трематод in vitro наблюдается при дозе дезнитазоксанида 50 мкг через 1 ч, при дозе 25 мкг - через 4 ч и при дозе 10 мкг - через 6-7 ч. Доза 10 мкг может быть подходящей, если фармакокинетические данные показывают, что уровень лекарства в тканях сохраняется в течение 6-8 ч после одного приема. Сильная антитрематодная активность через 74 ч (3 дня) наблюдалась для обоих соединений при дозах 3 и 5 мкг. При дозе 1 мкг наблюдалось длительное сохранение жизни паразитов, но отличное от контрольной группы, которая не обрабатывалась лекарством. Подача такого количества лекарства трематодам в печеночные ткани в течение 3-4 дней может оказать неадекватное действие на паразитов. 25 Пример 10. Fasciola gigantica. Нитазоксанид тестировали против незрелых и зрелых Fasciola gigantica у кроликов, инфицированных опытным путем. Инкапсулированные Fasciola gigantica метацеркарии (ЕМС) были собраны в лист целлофана через 28-35 дней после инфицирования L.calludi улиток мирацидием Fasciola gigantica методом Абделя-Гани (Abdel-Ghany), в ходе которого улиток ежедневно в течение 30 мин освещали искусственным светом в чистой дехлорированной водопроводной воде. Полученные инкапсулированные метацеркарии (ЕМС) хранились при 4 С в холодильнике в течение 58 дней под водой, пока они не были использованы для инфицирования опытных животных. В опыте использовали 40 кроликов Boscat весом от 1,5 до 2 кг, которые были разделены на две группы по 20 животных. Животных из группы 1 инфицировали орально 35-40 инкапсулированными метацеркариями, завернутыми в лист салата,который вводили на корень языка животных. После этого рот животного закрывали рукой и держали до тех пор, пока лист салата не был проглочен. Эту группу животных использовали для тестирования эффективности нитазоксанида против незрелых (4-5 недельных) Fasciola gigantica. Животных из группы 2 орально инфицировали, как описано выше, 10-15 инкапсулированными метацеркариями и использовали для тестирования нитазоксанида против раннезрелых трематод (возраст 10 недель). 10 животных из группы 1 принимали 35 мг нитазоксанида утром и вечером в течение 7 последовательных дней через 4 недели после их заражения паразитами в незрелой стадии их развития. Оставшихся 10 животных использовали в качестве контрольных без лечения. Всех животных кормили сухим кормом до окончания опыта. Через 7 дней после введения последней дозы нитазоксанида все кролики из каждой группы были убиты. Поверхность печени исследовали на наличие некротических борозд от миграции паразитов, особенно незрелой стадии их развития. Эти некротические участки исследовали двумя хирургическими иглами, чтобы выделить молодых мигрирующих особей трематод, используя технику,описанную Эль-Бахи (El-Bahy). Печень нарезали на маленькие кусочки, особенно вокруг борозд миграции, и размягчали под микроскопом, для того чтобы выделить трематод. Брюшную полость и внутренние поверхности промывали теплой водой. Затем воду собирали, процеживали и исследовали на наличие молодых особей трематод. Всех собранных паразитов, а также их части подсчитывали в обеих группах у животных, принимавших лекарство, и контрольных. Живые трематоды были розового цвета, прозрачными, с неповрежденной оболочкой, легко экстрагировались из тканей печени теплой водой, мертвые трематоды были сероватого цвета и имели поврежденную 26 некротическую поверхность. Эффективность нитазоксанида рассчитывали по формуле где а - количество трематод, выделенных из фекалий контрольных животных;b - количество трематод, выделенных из фекалий животных, принимавших лекарство. Результаты. Как показано в табл. 7, наблюдалось уменьшение количества незрелых трематод,выделенных из печени кроликов, в группе, принимавшей лекарство, по сравнению с контрольной группой. Средний процент уменьшения составил 46,77% (диапазон 40-60%). Таблица 7 Эффективность нитазоксанида против незрелыхF. gigantica (возраст 4 недели) у кроликов,инфицированных опытным путем Количество трематод, выделенных из печени ЭффекКонтрольная Кролики, принимавшие тивность,группа кролика(без лечения) лекарство 1 7 4 42 2 7 4 42 3 6 3 50 4 8 4 50 5 5 3 40 6 5 2 60 7 5 3 40 8 6 3 50 9 8 4 50 10 5 3 40 Среднее 6,2 3,3 46,77 В стадии ранней зрелости паразитов нитазоксанид проявил полный эффект (100% уничтожение). По сравнению с контрольными животными при исследовании печени кроликов,принимавших лекарство, гельминтов не было обнаружено, что показано в табл. 8. Таблица 8 Эффективность нитазоксанида противF. gigantica ранней зрелости (возраст 10 недель) у кроликов, инфицированных опытным путем Количество трематод, выделенных из печени ЭффекКонтрольная Кролики, принимавшие тивность,группа кролика 27 Нитазоксанид, вводимый ежедневно в дозе 70 мг в течение 7 последовательных дней, был умеренно эффективен против незрелых F. gigantica и полностью эффективен против паразитов ранней стадии зрелости. Пример 13. Schistosoma. Нитазоксанид тестировали против Schistisoma mansoni и Schistosoma hematobium у мышей, инфицированных опытным путем. 40 белых мышей весом от 30 до 50 г разделили на две группы по 20 мышей в группе. Первую группу инфицировали 300-500 свободными активными церкариями Schistisoma mansoni,суспендированными в 0,25 мл дистиллированной воды, которые были введены каждой мыши путем внутрибрюшинной инъекции. Вторая группа была таким же образом инфицирована церкариями Schistosoma hematobium. Затем за этими двумя группами животных наблюдали в лаборатории в течение 70 дней. Через 70 дней после заражения 10 мышей было пролечено нитазоксанидом орально дозой 1,3 мг утром и вечером в течение 7 последовательных дней. Через 7 дней после окончания лечения все мыши были убиты, гельминтов выделяли из печени каждого животного путем перфузии теплой водой (37 С), подсчитывали количество выделенных шистосом у всех пролеченных и контрольных животных. Эффективность нитазоксанида рассчитывали по формуле где а - количество шистосом, выделенных из фекалий контрольных животных;b - количество шистосом, выделенных из фекалий животных, принимавших лекарство. Результаты. Из табл. 9 и 10 видно, что нитазоксанид,введенный в ежедневной дозе 2,6 мг в течение 7 последовательных дней, был более эффективен против Schistosoma hematobium (сокращение количества гельминтов составило 82,85% по сравнению с контрольной группой), чем противSchistisoma mansoni (сокращение количества гельминтов составило 59,91% по сравнению с контрольной группой). Эти результаты согласуются с результатами Abaza и др., согласно которым нитазоксанид не был эффективен против Schistisoma mansoni, что было показано анализами на яйца гельминтов у пациентов, прошедших курс лечения. Таблица 9 Эффективность нитазоксанида против зрелыхSchistosoma mansoni (возраст 13 недель) у мышей Количество трематод, выделенных из печени Контрольная груп- Мыши, принимав мыши па (без лечения) шие лекарство 1 21 10 2 29 9 3 32 10 4 26 11 Таблица 10 Эффективность нитазоксанида против зрелыхSchistosoma hematobium (возраст 13 недель) у мышей Количество трематод, выделенных из печени Контрольная груп- Мыши, принимав мыши па (без лечения) шие лекарство 1 18 3 2 16 3 3 14 2 4 19 2 5 12 4 6 10 4 7 13 2 8 12 2 9 17 0,0 10 9 2 Всего 140 24 Среднее 14 2,4 Эффект-ть 82,85 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая в качестве активного агента, по крайней мере, одно соединение, выбранное из группы,состоящей из соединения формулы I и фармацевтически приемлемую кислоту в количестве, улучшающем ее стабильность. 2. Композиция по п.1, в которой фармацевтически приемлемая кислота выбрана из группы, состоящей из лимонной, глутаминовой, янтарной, этансульфокислоты, уксусной, винной,аскорбиновой, метансульфокислоты, фумаровой, адипиновой, яблочной кислот и их смесей. 3. Композиция по п.2, отличающаяся тем,что она представляет собой твердую лекарственную форму и активные частицы гранулированы в присутствии гранулирующего агента для образования гранулированных активных твердых частиц. 4. Композиция по п.2, представляющая собой суспензию твердых частиц, по меньшей 29 мере, одного из соединений формулы I и формулы II в жидкости. 5. Композиция по п.4, в которой жидкостью является вода. 6. Композиция по п.4, в которой упомянутая суспензия имеет рН от 2 до 6. 7. Композиция по п.4, в которой упомянутая суспензия имеет рН от 3 до 5. 30 8. Композиция по п.2, представляющая собой пасту, содержащую твердые частицы, по меньшей мере, одного из соединений формулы I и формулы II, увлажняющий агент и загуститель.
МПК / Метки
МПК: A61K 31/426, C07D 277/58, A61P 33/00
Метки: композиции, фармацевтические, основе, тизоксанида, нитазоксанида
Код ссылки
<a href="https://eas.patents.su/17-2920-farmacevticheskie-kompozicii-na-osnove-tizoksanida-i-nitazoksanida.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции на основе тизоксанида и нитазоксанида</a>
Предыдущий патент: Е – 2 – [4 - (4 - хлор - 1, 2 - дифенил - бут - 1 - енил) фенокси] этанол и фармацевтические композиции на его основе
Следующий патент: Новые ацилгуанидиновые производные в качестве ингибиторов резорбции костной ткани и антагонистов витронектиновых рецепторов
Случайный патент: Газонокосилочный трактор с косилочным механизмом и каналом для сбрасывания (скошенного материала)












