Аналоги 4-замещенных пиперидинов и их применение в качестве антагонистов субтипов селективных рецепторов nmda.
Номер патента: 1133
Опубликовано: 30.10.2000
Авторы: Бидж Кристофер Ф., Зоу Занг-Лин, Кина Джон Ф.В., Кай Суи Ксионг, Райт Джонатан, Лан Нэнси К., Вудвард Ричард, Вебер Экард
Формула / Реферат
1. Соединение, представленное формулой (I)

или его фармацевтически приемлемая соль, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой;
z представляет собой одинарную связь;
Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;
R1 представляет водород или гидроксил;
n = 1 или 2;
Q представляет -СуС-; и
R4 представляет водород или гидроксил.
2. Соединение по п.1, где Аr1 представляет собой замещенный или незамещенный фенил.
3. Соединение по п.1, где Аr1 представляет собой галогенфенильную группу.
4. Соединение по п.1, выбираемое из группы, состоящей из:
N-4-(1-(4-(3-аминофенил)бутин-3-ил)пиперидинил)-2-оксобензимидазола;
1-(4-бензо[1,3]диоксол-5-ил-бут-3-инил)-4-бензилпиперидина;
4-бензил-1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)бут-3-инил]пиперидина;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1H-индола;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1H-индазола;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1,3-дигидробензимидазол-2-она;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1H-индол-2,3-диона; и их фармацевтически приемлемая соль.
5. Фармацевтическая композиция, полезная при лечении расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата, таких как удар, церебральная ишемия, травма центральной нервной системы, гипогликемия, нейродегенеративные расстройства, тревога, головные боли, вызванные мигренью, судороги, потеря слуха, вызванная аминогликозидными антибиотиками, хроническая боль, психоз, глаукома, ретинит, вызванный цитомегаловирусом, опиоидная толерантность или абстиненция, или недержание мочи, при этом указанная композиция включает фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество, по крайней мере, одного соединения по п.1.
6. Соединение, представленное формулой
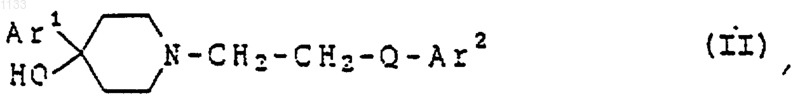
или его фармацевтически приемлемая соль, где Аr1 представляет арил, замещенный галогеном, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
7. Соединение, представленное формулой
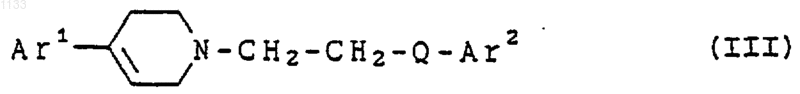
или его фармацевтически приемлемая соль, где Аr1 представляет арил, замещенный галогеном, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
8. Соединение, представленное формулой
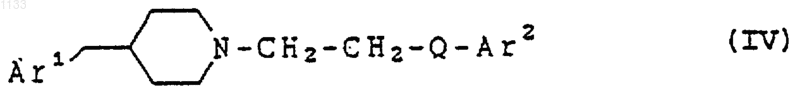
или его фармацевтически приемлемая соль, где:
Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
9. Соединение, представленное формулой
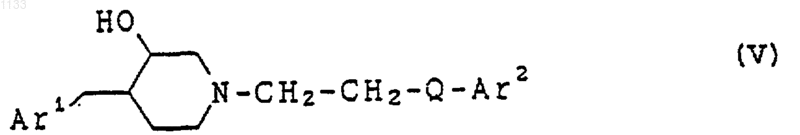
или его фармацевтически приемлемая соль, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
10. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение, в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой
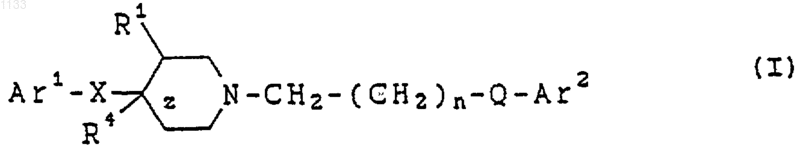
или его фармацевтически приемлемой соли, где
Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой;
z представляет одинарную связь;
Х представляет -(CHR2)m-, где каждый R2 представляет водород, a m = 1;
R1 представляет водород или гидроксил;
n = 1 или 2;
Q представляет -СуС-; и
R4 представляет водород или гидроксил.
11. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой
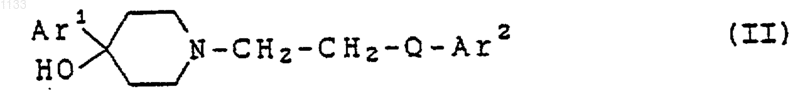
или его фармацевтически приемлемой соли, где
Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
12. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой
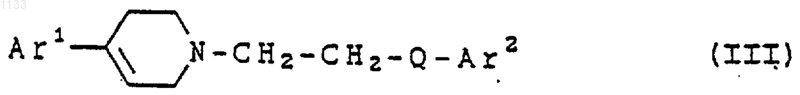
или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилюь, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и
Q представляет -СуС-.
13. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой
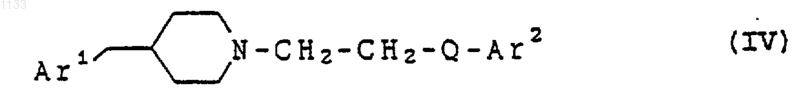
или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
14. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой
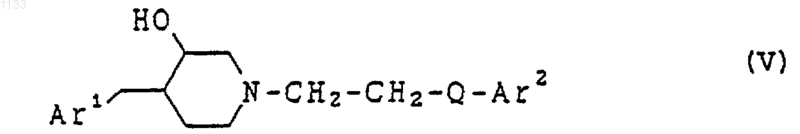
или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой; и Q представляет -СуС-.
15. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, выбранного из группы, включающей
N-4-(1-(4-(3-аминофенил)бутин-3-ил)пиперидинил)-2-оксобензимидазол;
1-(4-бензо[1,3]диоксол-5-ил-бут-3-инил)-4-бензилпиперидин;
4-бензил-1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)бут-3-инил]пиперидин;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1H-индол;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1H-индазол;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1,3-дигидробензимидазол-2-он;
5-[4-(4-бензилпиперидин-1-ил)бут-1-инил]-1H-индол-2,3-дион;
и фармацевтически приемлемые соли этих соединений.
16. Способ получения соединения, представленного формулой I
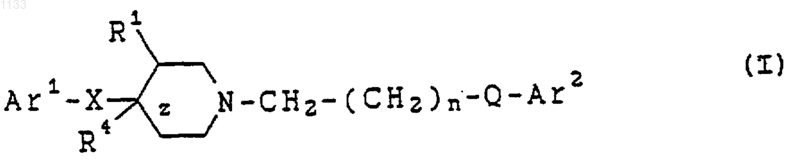
или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой;
z представляет собой одинарную связь;
Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;
R1 представляет водород или гидроксил;
n = 1 или 2;
Q представляет -СуС-; и
R4 представляет водород или гидроксил, при этом указанный способ включает следующие стадии:
(а) реакцию, в присутствии основания, соединения формулы VII
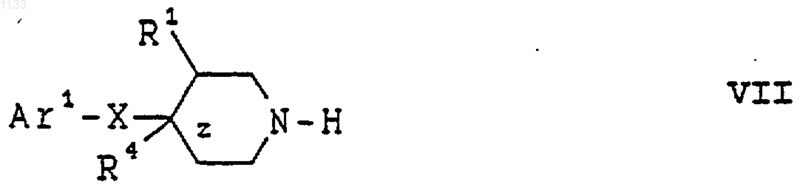
где Аr1, X, R1, R4 и z имеют вышеуказанные значения, с соединением формулы IX
L-CH2-(CH2)n-Q-H IX,
где n и Q имеют вышеуказанные значения, a L представляет собой отщепляемую группу, для получения соединения формулы X
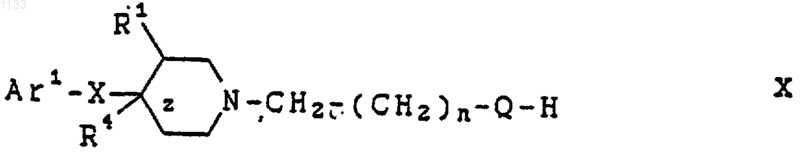
где Аr1, X, R1, R4, z, n и Q имеют вышеуказанные значения; и
(b) реакцию соединения формулы Х с Аr2Y, где Аr2 имеет вышеуказанные значения, a Y представляет собой трансметаллозамещаемую группу, в присутствии палладиевого катализатора для получения соединения формулы I.
17. Способ по п.16, в котором указанную трансметаллозамещаемую группу выбирают из группы, состоящей из Вr, I, В(ОН)2 и НgСl.
18. Способ получения соединения, представленного формулой I
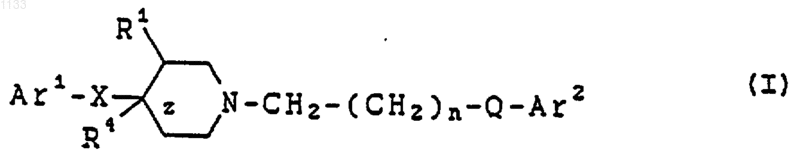
или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой, низшей алкиламиногруппой или низшей алкоксигруппой;
z представляет одинарную связь;
Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;
R1 представляет водород или гидроксил;
n = 1 или 2;
Q представляет -СуС-; и
R4 представляет водород или гидроксил, включающий следующие стадии:
(a) реакцию в присутствии палладиевого катализатора соединения формулы XI
P-O-CH2-(CH2)n-QH XI,
где Р представляет собой общую защитную группу, a n и Q имеют вышеуказанные значения, с Аr2Y, в котором Аr2 имеет вышеуказанные значения, a Y представляет собой трансметаллозамещаемую группу, для получения соединения, представленного формулой XII
P-O-CH2-(CH2)n-Q-Ar2 XII,
где Р, n, Q и Аr2 имеют вышеуказанные значения;
(b) снятие защиты с соединения формулы XII для получения соединения, представленного формулой XIII
НО-СН2-(СН2)n-Q-Ar2 XIII,
где n, Q и Аr2 имеют вышеуказанные значения;
(c) реакцию соединения формулы XIII с активирующим соединением в присутствии основания для получения соединения, представленного формулой XIV
A-CH2-(CH2)n-Q-Ar2 XIV
где А представляет собой активирующую группу, a n, Q и Аr2 имеют вышеуказанные значения; и
(d) реакцию, в присутствии основания, соединения формулы XIV с соединением формулы VII
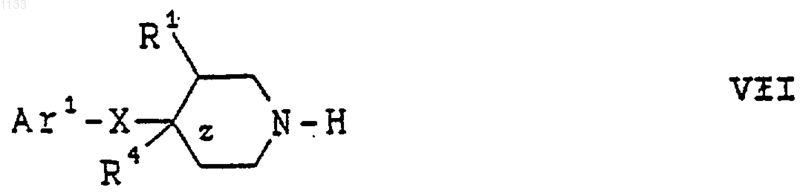
где Аr1, X, R1, R4 и z имеют вышеуказанные значения, для получения соединения формулы I.
19. Способ по п.18, в котором указанную трансметаллозамещаемую группу выбирают из группы, состоящей из Вr, I, В(ОН)2 и НgСl.
20. Способ по п.19, в котором указанное активирующее соединение выбирают из группы, состоящей из тозилатов, трифлатов, мезилатов и диэтилазадикарбоксилата.
21. Соединение, представленное формулой (X)
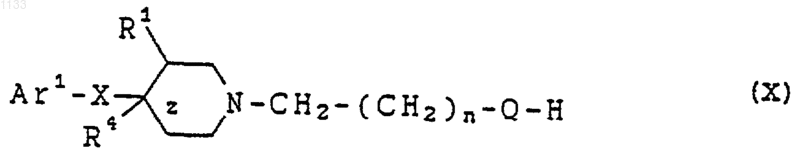
или его соль, где Аr1 представляет собой арильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилюь, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, низшей алкиламиногруппой или низшей алкоксигруппой;
z представляет одинарную связь;
Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;
Q представляет -CуC-;
R1 представляет водород или гидроксил; и R4 представляет водород или гидроксил.
22. Соединение по п.21, выбираемое из группы, включающей
4-бензил-1-(3-бутинил)пиперидин;
4-(4-хлор)бензил-1-(3-бутинил)пиперидин;
4-(3-трифторметил)бензил-1-(3-бутинил) пиперидин;
4-(4-хлор)бензил-1-(2-пропинил)пиперидин;
4-(4-хлор)бензил-1-(4-пентинил)пиперидин;
4-бензил-1-(3-бутинил)-3-гидроксипиперидин;
4-(4-хлор)бензил-1-(3-бутинил)-3-гидроксипиперидин;
4-(3-трифторметил)бензил-1-(3-бутинил)-3-гидроксипиперидин;
4-(4-хлор)бензил-3-гидрокси-1-(2-пропинил)пиперидин;
4-(4-хлор)бензил-3-гидрокси-1-(4-пентинил)пиперидин;
1-(бут-3-инил)-4-(4-хлорбензил)пиперидин;
4-бензил-1-(бут-3-ин-1-ил)-4-гидроксипиперидин;
4-(4-метилбензил)-4-гидрокси-1-(бут-3-ин-1-ил)пиперидин;
и его соль.
23. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой (X)
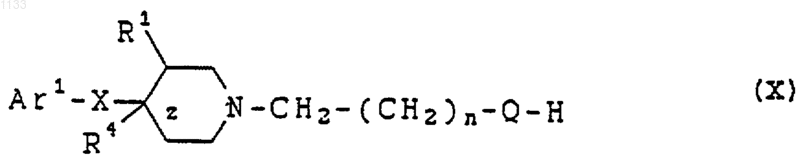
или его фармацевтически приемлемой соли, где
Аr1 представляет собой арильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, низшей алкиламиногруппой или низшей алкоксигруппой;
z представляет одинарную связь;
Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;
Q представляет -СуС-;
R1 представляет водород или гидроксил; и
R4 представляет водород или гидроксил.
24. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой удар, церебральную ишемию, травму центральной нервной системы или гипогликемию.
25. Способ по любому из пп. 10-15 и 23, в которых указанное расстройство представляет собой тревогу, судороги или хроническую боль.
26. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой потерю слуха, вызванную аминогликозидными антибиотиками.
27. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой болезнь Паркинсона.
28. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой головную боль, вызванную мигренью.
29. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой глаукому или ретинит, вызванный цитомегаловирусом.
30. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой психоз.
31. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой недержание мочи.
32. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой опиоидную толерантность или абстиненцию.
Текст
1 Область изобретения Данное изобретение относится к 4 замещенным пиперидиновым аналогам, включая гидроксипиперидиновые и тетрагидропиридиновые аналоги, а также новые промежуточные соединения 4-замещенных аналогов. Эти аналоги обладают селективной активностью в качестве антагонистов субтипов рецепторов Nметил-D-аспартата (NMDA). Данное изобретение также относится к применению 4 замещенных пиперидиновых аналогов в качестве нейрозащитных средств для лечения таких заболеваний, как удар, церебральная ишемия,травма центральной нервной системы, гипогликемия, тревога, судороги, потеря слуха, вызванная аминогликозидными антибиотиками, головная боль, вызванная мигренью, хроническая боль, глаукома, ретинит, вызванный цитомегаловирусом, психоз, недержание мочи, опиоидная толерантность или абстиненция, или нейродегенеративные расстройства, такие как латиризм (lathyrism), болезнь Альцгеймера, паркинсонизм и болезнь Гентингтона (Хантингтона). Предшествующий уровень техники Чрезмерное возбуждение, передаваемое нейромедиаторами, может вызвать дегенерацию и гибель нейронов. Предполагают, что такую дегенерацию частично вызывает возбуждающетоксическое действие глютамата и аспартата возбуждающих аминокислот (ЕАА) в рецептореN-метил-D-аспартата. Считается, что такое возбуждающе-токсическое действие отвечает за потерю нейронов при церебрально-сосудистых нарушениях, таких как церебральная ишемия или церебральный инфаркт, образующийся в результате тромбоэмболического или геморрагического удара, церебральных вазоспазмов,гипогликемии, остановки сердца, эпилептического статуса, перинатальной асфиксии, аноксии, возникающей при утоплении, операциях на легких и церебральных травмах, а также латиризм, болезнь Альцгеймера, болезнь Паркинсона и болезнь Гентингтона. Известны различные классы аналогов замещенных пиперидинов. Например, патент США 5 273 977 в общем описывает производные тетрагидропиридина и гидроксипиперидина, имеющие формулу где n - целое число, равное 2, 3 или 4; Аr1 и Аr2 каждый независимо представляет замещенный или незамещенный арил, гетероароматическое кольцо или гетероароматическое бициклическое кольцо. В данной ссылке указано, что тетрагидропиридины и гидроксипиперидины могут быть использованы в качестве лекарственных средств для центральной нервной системы, в частности, как допаминергические, 001133 2 антипсихотические и противогипертонические средства, а также для лечения нарушений центральной нервной системы, таких как болезнь Паркинсона, болезнь Гентингтона и депрессия. Примеры конкретных 4-замещенных пиперидинов, включая 4-гидроксипиперидины и тетрагидропиридины, в данном изобретении не приведены. Кроме того, отсутствует описание или упоминание лечения нарушений с помощью антагонистов субтипов селективных рецепторов где R представляет незамещенный фенил или фенил, замещенный метилом, галогеном, нитро,амино, (низший алканоил)амино или низшим алкоксилом; и либо А представляет собой алкил, имеющий от 1 до 4 атомов углерода, и А' представляет собой алкил, имеющий от 1 до 4 атомов углерода, бензил, хлорбензил или диметоксибензил; либо А и А' вместе с соседним атомом азота из одного из следующих гетероциклических колец: пирролидино, морфолино,тиоморфолино, 4-фенилпиперидино, 4-фенил-4 гидроксипиперидино, N'-метилпиперазино, N'бензилпиперазино, N'-фенилпиперазино, N'хлорфенилпиперазино, N'-толилпиперазино, N'метоксифенилпиперамино, N'-(-гидроксиэтил)пиперазино, N'-(-ацетоксиэтил)пиперазино, N'(-пропионилоксиэтил)пиперазино, N'-карбэтоксипиперазино, гексаметиленимино и гептаметиленимино; при условии, что когда R представляет собой фенил, п-метоксифенил, о- или п-нитрофенил или о-аминофенил, не представляет собой диметиламино или диэтиламино; и их кислых аддитивных солей, особенно солей, содержащих физиологически безопасные анионы. Указывается, что соединения,описанные в данной ссылке, обладают противоязвенной активностью. Эта ссылка не содержит описания или упоминания об аналогах 4 замещенных пиперидинов, раскрываемых в данном изобретении, или об их применении в качестве антагонистов субтипов селективных рецепторов NMDA.DE 3703435 описывает соединения,имеющие пиперидиновое кольцо, замещенное аминотиазольным остатком. Указано, что эти соединения могут применяться для лечения болезни Паркинсона, шизофрении и нарушений кровообращения, оказывая особое действие на допаминергическую систему. Данная ссылка не описывает или упоминает соединения, раскрываемые в настоящем изобретении, не говоря уже об их антагонистах субтипов селективных рецепторов NMDA. 3 Международная публикация РСТWO 92/02502 в общем раскрывает N-гидрокарбил 4 замещенные пиперидины, имеющие формулуR1 представляет водород, C1-8 алкил или фенил С 1-4 алкил;m = 0-3; и Аr представляет арил или гетероарил, каждый из которых может быть необязательно замещен; и их соли. В этой ссылке приведены примеры 4 арилоксиалкил пиперидинов. Указано, что замещенные пиперидины являются блокаторами кальциевых каналов, которые могут быть использованы при лечении аноксии, ишемии,включая удары, мигрень, эпилепсию, травматические повреждения головы, слабоумие, связанное со СПИДом, нейродегенеративные нарушения и наркоманию. В этой ссылке отсутствует описание или упоминание о конкретных аналогах 4-замещенных пиперидинов, раскрываемых в данном изобретении, или об их применении в качестве антагонистов субтипов селективных рецепторов NMDA для лечения поддающихся расстройств. Международная публикация РСТWO 93/15052 в целом описывает соединения, заявляемые как антагонисты кальциевых каналов,широко представленные формулой и их соли, где W представляет -СН 2-, связь, O или S; k = 0, или когда W представляет -СН 2-, k тоже может быть равно 2, в этом случае пунктирные линии представляют простые связи;R представляет C1-8 алкил (фенил)р, С 2-8 алкенил (фенил)р, С 1-8 алкинил (фенил)р, С 3-8 циклоалкил или C1-8 алкил С 3-8 циклоалкил, или R может также представлять собой водород, когдаk = 2; р = 0-2, n = 0-6; m=0-6; и А представляет связь, -СН=СН-, -СС-, кислород, серу или NR1; R1 представляет водород,C1-8 алкил или фенил С 1-4 алкил; и Аr представляет собой арил или гетероарил, каждый из которых может быть необязательно замещен; при условии что: когда W представляет собой связь, боковая цепь нахо 001133W представляет СН 2, k = 0, боковая цепь находится в 3- или 4-позиции пиперидинового кольца, и А представляет собой связь, кислород, серу или NR1, то Аr представляет собой арил, замещенный фенокси или замещенным фенокси,или представляет собой трициклическую гетероарильную группу, как указано ниже; и когда-(СН 2)nА(СН 2)mАr не находится в -позиции к атому азота. Данная ссылка иллюстрирует главным образом 2- и 3-замещенные пиперидины. Кроме того, конкретная группа 3- и 4 замещенных пиперидинов, описываемых в данной ссылке, требует, чтобы А представляло СН=СН- или -CC-. Эта ссылка не описывает или упоминает аналоги 4-замещенных пиперидинов, раскрываемых в данном изобретении. Более того, она не содержит упоминания о применении аналогов 4-замещенных пиперидинов в качестве антагонистов субтипов селективных рецепторов NMDA. ЕР 0235463 описывает N-замещенныеарилалкиловые и арилалкиленовые аминогетероциклические соединения как коронарные сосудорасширяющие,противогипертонические,антиаритмические, антиаллергические, антигистаминные и антисекреторные средства. Аналоги 4-замещенных N-алкенов и алкинпиперидинов,раскрываемые в данном изобретении, а также ихNMDA-антагонистическая активность не описываются и не упоминаются. Патент США 5 169 855 в общем описывает производные дизамещенных пиперидиновых эфиров, которые могут быть использованы в качестве антипсихотических средств, селективных для сигма-рецепторов. Подобным образом международные публикации РСТWO 92/18127 иWO 91/06297 в общем описываютN-фталимидоалкил пиперидины, которые могут быть использованы как антипсихотические средства и которые являются селективными для сигма-рецепторов. Однако эти ссылки не раскрывают аналоги 4-замещенных пиперидинов,описываемые в данном изобретении, и не упоминают об активности рецепторов NMDA. Многочисленные ссылки описывают дополнительные производные пиперидинов, замещенных в 4 и 3 позициях, которые могут быть использованы для различных видов лечения. Такими ссылками являются, например, патент США 3 255 196 (3- и 4-замещенные пиперидины, которые являются сильными противокашлевыми средствами и обладают аналгезирующими, противорвотными и местными обезболивающими свойствами); патент США 5 202 346 (4-замещенные пиперидины, которые являются антиаритмическими средствами III класса); Международная публикация РСТWO 88/02365 (3- и 4-замещенные пиперидины,которые могут быть использованы при лечении(4-замещенные пиперидины, которые могут быть использованы как сосудорасширяющие средства и -адренергические ингибиторы); FP 2681319 (4-замещенные пиперидины, которые могут быть использованы в качестве нейрозащитных и противосудорожных средств); и DE 2939292 (4-замещенные пиперидины, которые могут быть использованы как антиаллергические и противовоспалительные средства). Ни одна из этих ссылок не описывает или упоминает аналоги 4-замещенных пиперидинов, раскрываемых в данном изобретении, или их применение в качестве антагонистов субтипов селективных рецепторов NMDA. Полезность антагонистов, возбуждающих аминокислотные рецепторы, блокирующие рецепторы NMDA, для лечения расстройств общеизвестна. Рецепторы NMDA тесно связаны с явлением возбуждающей токсичности, которая может оказаться решающей детерминантой исхода некоторых неврологических расстройств. Расстройства, отвечающие на блокаду рецептора NMDA, включают острую церебральную ишемию (например, удар или церебральная травма), мышечные спазмы, судороги, невропатические боли и тревогу, и могут явиться важным причинным фактором при хронических нейродегенеративных расстройствах, таких как болезнь Паркинсона (Т. Klockgether, L.Turski,Ann. Neurol. 34, 585-593 (1993, нейронное повреждение, связанное с вирусом иммунодефицита человека, боковой амиотрофический склероз, болезнь Альцгеймера (P.T. Francis, N.R.Pharmacol. 45, 1547-1561 (1993) и приводимые ссылки). Антагонисты рецептора NMDA могут также быть использованы для предотвращения толерантности к опиатной аналгезии или для контроля над абстинентными симптомами, возникающими в результате приема лекарственных препаратов, вызывающих привыкание (Eur.Pat.Appl.488, 959A). Экспрессирующее клонирование первой подъединицы рецептора NMDA NMDAR1(NR1) в лаборатории Nakanishi в 1991 г. позволило получить первоначальный вид молекулярной структуры рецептора NMDA (Nature 354,31-37 (1991.Существует несколько других структурно связанных подъединиц (NMDAR2A через NMDAR2D), соединяющих NR1 в гетеромерические сборки для образования функционального ионного канального комплекса рецептора (Annu. Rev. Neurosci 17, 31-108 (1994. Молекулярная гетерогенность рецепторовNMDA предполагает будущий потенциал для средств с селективной фармакологией подтипа. 6 Многие свойства нативных рецепторовNMDA видны в рекомбинантных гомомерических рецепторах NR1. Эти свойства изменяются подъединицами NR2. Рекомбинантные рецепторы NMDA, экспрессируемые в ооцитах Xenopus, изучаются с помощью записей, сделанных с использованием электрического зажима, а также эволюционное и региональное экспрессирование мРНК, кодирующих подъединицы рецепторов NMDA. Для характеристики действия соединений в рецепторах NMDA, экспрессируемых в ооцитах Xenopus, используют электрофизиологические анализы. Соединения анализируют в трех сочетаниях подъединиц клонированных рецепторов NMDA крыс, соответствующих четырем предполагаемым субтипам рецептора NMDA (Moriyoshi, et al. Nature 1991,354, 31-37; Monyer et al. Science 1992, 256, 12171221; Kutsuwada et al. Nature 1992, 358, 36-41;Sugihara et al, Biochem. Biophys.Res.Commun.,1992, 185, 826-832). Целью данного изобретения является разработка новых аналогов 4-замещенного пиперидина, действующих в качестве антагонистов субтипов селективного рецептора NMDA. Другой целью данного изобретения является разработка фармацевтической композиции,содержащей эффективное количество аналогов 4-замещенного пиперидина для лечения церебро-сосудистых расстройств, отвечающих на селективную блокаду субтипов рецептора NMDA. Следующей целью данного изобретения является разработка способа лечения расстройств, отвечающих на антагонисты субтипов селективных рецепторов NMDA у животных,путем введения фармацевтически эффективного количества аналогов 4-замещенного пиперидина. Очередной целью данного изобретения является разработка новых способов получения аналогов 4-замещенного пиперидина. Другой целью данного изобретения является разработка новых промежуточных соединений аналогов 4-замещенного пиперидина,описываемых в данном изобретении. Краткое описание изобретения Данное изобретение относится к новым аналогам 4-замещенного пиперидина, представленных формулой (I): или их фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую или гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом,алкилом, галогеном, нитро, арилом, аралкилом,амино, галоидированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -CONH алкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкил аминогруппой или низшей алкоксигруппой;R1 представляет водород или гидроксил;R4 представляет водород или гидроксил. Соединения по данному изобретению могут существовать в виде оптических изомеров и включать рацемические смеси таких оптических изомеров, а также отдельные энантиомеры. Примеры фармацевтически приемлемых солей присоединения включают неорганические и органические кислые соли присоединения,такие как гидрохлорид, гидробромид, фосфат,сульфат, цитрат, лактат, тартрат, малеат, фумарат, манделат, оксалат и ацетат. Галоген представляет собой фтор, хлор,бром или иод, при этом фтор, хлор и бром являются предпочтительными группами. Алкил означает прямую или разветвленную цепь, имеющую 1-6 атомов углерода, или циклический алкил, имеющий 3-7 атомов углерода, включающий (но не ограничивающийся) метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, циклопропил,циклобутил, циклопентил и циклогексил. Арил означает моноциклическое или бициклическое карбоциклическое ароматическое кольцо, которое может быть замещено или не замещено, например (но не ограничивающийся) фенил, нафтил или т.п. Гетероарил означает бициклическую карбоциклическую ароматическую кольцевую систему, замещенную одним или более гетероатомами, которые могут быть одинаковыми или различными, и включает, например, бензо[b]тиенил, нафто[2,3[b]тиенил, тиантренил,изобензофуранил, хроменил, ксантенил, феноксантиинил, индолизинил, изоиндолил, 3 Ниндолил, индолил, индазолил, 4 Н-хинолизинил,изохинолил,хинолил,фтализинил,нафтиридинил, хинозалинил, циннолинил, птеридинил,5 аН-карбозолил,карбозолил,карболинил, фенантридинил, акриндинил, перимидинил, фенантролинил, феназинил, фенотиазинил, феноксазинил, хиноксалинил, 2,3 диоксохиноксалинил,бензимидазолил,2 оксобензимидазолил,2-оксиндолил и 2 тиобензимидазолилгруппы. Аралкил означает любые алкильные группы, указанные в данном описании, замещенные любыми арильными группами, указанными в данном описании. Галогенированный алкил означает любые алкильные группы, указанные в данном описании, замещенные одной или более галогенными группами, как указано в данном описании. 8 Алкилгуанидин означает гуанидин, замещенный одной из алкильных групп, указанных в данном описании. Низший алкил амино означает любые алкильные группы, указанные в данном описании,замещенные аминогруппой. Низший алкокси означает алкоксигруппу,содержащую алкильную группу, как указано в данном описании. Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение, представленное формулой I в количестве, эффективном для лечения церебрососудистых расстройств, отвечающих на селективную блокаду субтипов рецептора NMDA, и фармацевтически приемлемый носитель. Примеры расстройств, отвечающих на такое лечение, включают церебральную ишемию, вызванную церебральной травмой, удар, гипогликемию, сердечный приступ и операцию на сердце; тревогу, психоз и шизофрению; глаукому; ретинит, вызванный цитомегаловирусом; недержание мочи; опиоидную толерантность или абстиненцию; и хронические нейродегенеративные расстройства, такие как болезнь Гентингтона,боковой амиотрофический склероз, паркинсонизм и болезнь Альцгеймера. Фармацевтическая композиция по данному изобретению также может быть использована как анальгетик или для лечения эпилептической головной боли или мигрени. Данное изобретение также относится к способу получения соединения формулы (I),включающему стадии:IX где n и Q имеют вышеуказанные значения, a L представляет собой отщепляемую группу, для получения соединения формулы X: где Аr1, X, R1, R4, z, n и Q имеют вышеуказанные значения; и (b) реакции соединения формулы Х с Аr2Y, где Аr2 имеет вышеуказанные значения, a Y представляет собой металлозамещаемую группу, такую как, например, Вr, I,В(ОН)2 или НgСl в присутствии палладиевого катализатора, для получения соединения формулы I. Отщепляемую группу L предпочтительно выбирают из группы, состоящей из паратолуолсульфоната, галогена, трифлата и т.п. Наиболее предпочтительным является паратолуолсульфонат. Металлозамещающая группа- это группа, способная к замещению палладием. Основание, используемое на стадии (а) вышеописанного процесса, обычно присутствует, по крайней мере, в количестве, эквивалентном тозилату формулы IX для обеспечения гашения тозиковой кислоты, выделяющейся во время реакции. Такие основания включают, например, триэтиламин, карбонат калия и т.п. Реакцию стадии (а) проводят в полярном апротонном растворителе, таком как, например, тетрагидрофуран, диметилформамид, ацетонитрил или т.п. Реакцию обычно можно проводить при температуре между температурой окружающей среды и 100 С, хотя обычно температура не имеет значения. Реакцию стадии (b) обычно проводят в присутствии палладиевого катализатора, такого как РdСl2(РРh3)2, т.е. бис(трифенилфосфин) палладий (II) хлорид, и основания, такого как, например, триэтиламин. Реакцию данной стадии обычно проводят при температуре от приблизительно 60 до приблизительно 100 С в полярном растворителе, таком как тетрагидрофуран, метанол, ацетонитрил, трет-бутиламин или т.п. Образующийся продукт может быть очищен способами, хорошо известными специалистам в данной области. Очередной способ по данному изобретению для получения соединения формулы (I) включает следующие стадии:XI где Р представляет собой общую защитную группу, а n и Q имеют вышеуказанные значения,с Аr2Y, в котором Аr2 имеет вышеуказанные значения, a Y представляет собой металлозамещаемую группу, такую как, например, Вr, I,В(ОН)2 или НgСl, для получения соединения,представленного формулой XII:(c) реакцию соединения формулы XIII с активирующим соединением, таким как тозилаты, например, тозилхлорид, мезилаты, трифлаты, диэтилазадикарбоксилаты или т.п., в присутствии основания, для получения соединения,представленного формулой XIV: А-СН 2-(СН 2)n-Q-Ar2XIV где А представляет собой активирующую группу, такую как, например, паратолуолсульфонатная группа, a n, Q и Аr2 имеют вышеуказанные значения; и где Аr1, X, R1, R4 и z имеют вышеуказанные значения, для получения соединения формулы I. Общую защитную группу Р этого способа по данному изобретению, например, выбирают из группы, состоящей из т-бутилдиметилсилила,метоксиметила, тетрагидропиранила, триметилсилила и т.п., с предпочтительной силильной защитной группой. Палладиевым катализатором, используемым на стадии (а) данного способа, может быть, например, PdCl2(РРh3)2. Обычно эту стадию реакции проводят в присутствии основания, такого как триэтиламин, в интервале температур 60-100 С в полярном растворителе, таком как тетрагидрофуран, метанол,ацетонитрил, трет-бутиламин или т.п. Стадию (d) данного способа также проводят в присутствии основания, такого как триэтиламин или карбонат калия, для обеспечения гашения тозиковой кислоты, выделяющейся во время реакции. Эту стадию (d) реакции проводят в апротонном полярном растворителе, таком как тетрагидрофуран, диметилформамид, ацетонитрил или т.п., при температуре обычно между температурой окружающей среды и приблизительно 100 С. Образующийся продукт может быть очищен способами, хорошо известными специалистам в данной области. Данное изобретение далее касается новых промежуточных соединений, которые могут быть получены во время получения аналогов 4 замещенного пиперидина по данному изобретению. Эти новые промежуточные соединения также обладают селективной активностью субтипа NMDA. Новые промежуточные соединения представлены формулой (X): или их соль, где Аr1 представляет собой арильную группу,которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me,-N(SO2Me)2, -СОNНалкилом, -SO2NH2, низшей алкил аминогруппой или низшей алкоксигруппой;z представляет собой одинарную связь; Х=-(CHR2)m-, где R2 представляет собой водород, и m=1;R1 представляет собой водород или гидроксил; иR4 представляет собой водород или гидроксил. Данное изобретение далее касается способа лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метилD-аспартата у животных, страдающих от таких расстройств, включающего введение, в виде разовой лекарственной формы, по крайней мере,одного соединения, представленного формулой-NHAc, -NHSO2Me, -N(SO2 Ме)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкил аминогруппой или низшей алкоксигруппой; иQ представляет собой -СС-. Другой вариант новых 4-замещенных пиперидинов по данному изобретению представлен формулой (III): или его фармацевтически приемлемой солью,где: Аr1 представляет арил, замещенный галогеном, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом,амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкил аминогруппой или низшей алкоксигруппой; иQ представляет собой -СС-. Два дополнительных варианта новых 4 замещенных пиперидинов по данному изобретению представлены формулами (IV-V): или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, алкилом, галогеном,гидроксилом, нитро, арилом, аралкилом, амино,галоидированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкил аминогруппой или низшей алкоксигруппой;z представляет собой одинарную связь; Х представляет -(CHR2)m-, где каждый R2 представляет собой водород, и m=1;R1 представляет собой водород или гидроксил;R4 представляет собой водород или гидроксил. Данное изобретение также касается способа лечения расстройств, отвечающих на селективную блокаду субтипов рецептора Nметил-D-аспартата у животных, страдающих от таких расстройств, включающего введение, в виде разовой лекарственной формы, по крайней мере, одного промежуточного соединения,представленного формулой (X). Подробное описание изобретения Новые аналоги 4-замещенного пиперидина по данному изобретению представлены вышеприведенной формулой (I). Предпочтительно,Аr1 представляет собой фенил, более предпочтительно - фенил, замещенный галогеном, и наиболее предпочтительно - 4-хлорфенил. Предпочтительные варианты новых аналогов 4-замещенного пиперидина по данному изобретению представлены формулами (II-V). В частности, первый вариант представлен формулой (II): или его фармацевтически приемлемой солью,где Аr1 представляет арильную группу, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc,-NHSO2Me,-N(SO2Me)2,-СОNНалкилом,-SO2NH2, алкилгуанидиновой группой, низшей алкил аминогруппой или низшей алкоксигруппой; иQ представляет собой -СС-. Примеры предпочтительных соединений формулы I включают следующие: или его фармацевтически приемлемой солью,где Аr1 представляет арил, замещенный галогеном, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом,амино, галогенированной алкильной группой, 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индол; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индазол; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1,3-дигидробензимидазол-2-он; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индол-2,3-дион. или его фармацевтически приемлемой солью, 13 Данное изобретение также касается способа лечения расстройств, отвечающих на селективную блокаду субтипов рецептора NMDA у животных, страдающих от таких расстройств. Особенно предпочтительные варианты аналогов 4-замещенного пиперидина, используемых в способе по данному изобретению, представленных формулами (IV-V), а также формулами (IIIII), имеющими вышеуказанные значения. Иллюстративные предпочтительные соединения, которые могут быть использованы в способе по данному изобретению, включают:N-4-(1-(4-(3-аминофенил)бутин-3-ил)пиперидинил)-2-оксо-бензимидазол; 1-(4-бензо[1,3]диоксол-5-ил-бут-3-инил)-4 бензил-пиперидин; 4-бензил-1-[4-(2,3-дигидро-бензо[1,4]диоксин-6-ил)-бут-3-инил]пиперидин; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индол; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индазол; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1,3-дигидробензимидазол-2-он; 5-[4-(4-бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индол-2,3-дион. Соединения по данному изобретению могут быть получены способами, хорошо известными специалистам в данной области, как, например, способ, описанный в патенте США 5273977, приводимый в данном описании в качестве ссылки, или новыми способами, описываемыми в данном изобретении. Иллюстративные схемы реакции I и II показывают получение соединений по данному изобретению, обладающих функциональностью алкина. Исходные материалы, используемые в реакциях схем I и II,существуют в готовом виде или могут быть приготовлены известными способами. Схема I Способы, раскрываемые в данном описании, могут быть также использованы для получения новых промежуточных соединений по данному изобретению. Предпочтительные новые промежуточные соединения включают: 4-бензил-1-(3-бутинил)пиперидин; 4-(4-хлор)бензил-1-(3-бутинил)пиперидин; 14 4-(3-трифторметил)бензил-1-(3-бутинил) пиперидин; 4-(4-хлор)бензил-1-(2-пропинил)пиперидин; 4-(4-хлор)бензил-1-(4-пентинил)пиперидин; 4-бензил-1-(3-бутинил)-3-гидроксипиперидин; 4-(4-хлор)бензил-1-(3-бутинил)-3-гидроксипиперидин; 4-(3-трифторметил)бензил-1-(3-бутинил)3-гидроксипиперидин; 4-(4-хлор)бензил-3-гидрокси-1-(2-пропинил)пиперидин; 4-(4-хлор)бензил-3-гидрокси-1-(4-пентинил)пиперидин; 1-(бут-3-инил)-4-(4-хлорбензил)пиперидин; 4-бензил-1-(бут-3-ин-1-ил)-4-гидроксипиперидин; 4-(4-метилбензил)-4-гидрокси-1-(бут-3-ин 1-ил)пиперидин. Соединения по данному изобретению могут быть использованы для лечения или предотвращения нейронных потерь, нейродегенеративных заболеваний и хронической боли. Они также могут быть использованы как противосудорожные средства и для стимулирования обезболивания, а также для лечения эпилепсии и психоза. Терапевтический профиль и профиль побочного действия антагонистов и агонистов субтипов селективных рецепторов NMDA должны значительно отличаться от других ингибиторов несубтипа селективного рецептораNMDA. Селективные аналоги подтипа по данному изобретению вероятнее всего имеют незначительное или вовсе не имеют неблагоприятного побочного действия, вызываемого неспецифическим связыванием с другими рецепторами, в частности, РСР (1-(1-фенилциклогексил)пиперидин гидрохлорид) и сайты связывания глутаматов, ассоциируемые с рецепторомNMDA. Кроме того, селективность различных субтипов рецептора NMDA снижает побочное действие, такое как седативный эффект, свойственный антагонистам несубтипа селективного рецептора NMDA. Соединения по данному изобретению эффективны при лечении или предупреждении нежелательных последствий гиперактивности возбуждающих аминокислот, т.е. кислот, присутствующих в системе рецептораNMDA, предотвращая открытие каналов катионов, закрываемых лигандами, и обеспечивая дополнительный приток Са в нейроны, как это происходит во время ишемии. Нейродегенеративные заболевания, которые можно лечить соединениями по данному изобретению, включают заболевания, выбранные из группы, состоящей из болезни Альцгеймера, бокового амиотрофического склероза,болезни Гентингтона, болезни Паркинсона и синдрома Дауна. Соединения по данному изобретению особенно полезны при лечении или предупреждении нейронных потерь, ассоциируемых с множественными ударами, вызывающими слабо 15 умие. После того как у пациента был диагностирован удар, соединения по данному изобретению могут быть введены для уменьшения развития ишемии и предотвращения дальнейших нейронных повреждений, которые могут возникнуть в результате повторных ударов. Более того, соединения по данному изобретению способны преодолевать кровяной/ мозговой барьер, что делает их особенно полезными для лечения или предупреждения заболеваний, затрагивающих центральную нервную систему. Соединения по данному изобретению особенно полезны при лечении или предупреждении нежелательных неврологических последствий после операций. Например, операция по коронарному шунтированию требует использования аппарата сердце-легкие, имеющего тенденцию к образованию воздушных шариков в кровеносной системе, которые могут попасть в мозг. Присутствие таких воздушных шариков лишает нейронные ткани кислорода, приводя к аноксии и ишемии. До- или послехирургическое введение соединений по данному изобретению обеспечивает лечение или предупреждение возникающей ишемии. В предпочтительном варианте соединения по данному изобретению вводят пациентам, переносящим операцию по экстрапоральному кровообращению или каротидной эндартерэктомии. Соединения по данному изобретению также могут быть использованы для лечения или предупреждения хронической боли. Такая хроническая боль может возникнуть в результате операции, травмы, головной боли, артрита, болей от смертельного рака или дегенеративных заболеваний. Соединения по данному изобретению также особенно полезны при лечении фантомных болей, возникающих после ампутации конечности. Помимо снятия боли, предполагается, что соединения по данному изобретению могут быть использованы для стимулирования анестезии, общей или местной, например, во время операций. Антагонисты субтипа селективного рецептора NMDA, а также агонисты и модуляторы,могут быть исследованы на антисудорожную активность in vivo после внутрибрюшинной или внутривенной инъекции с помощью ряда антисудорожных тестов у мышей (аудиогенная модель припадка у мышей DBA-2; припадки, вызванные пентилентетразолом у мышей; припадки, вызванные максимальным электрошоком(MES), или смерть, вызванная NMDA). Данные соединения также могут быть исследованы в тестах по распознаванию лекарственных препаратов с использованием мышей, обученных распознавать РСР в слюне. Ожидается, что большая часть соединений по данному изобретению не может быть обобщена с РСР ни при каких дозах. Кроме того, также ожидается, что ни одно из данных соединений не вызовет поведенче 001133 16 ского возбуждения во время теста на двигательную активность у грызунов. Ожидается, что такие результаты предполагают, что антагонисты и агонисты субтипов селективных рецепторов NMDA по данному изобретению не оказывают РСР-подобного поведенческого побочного действия, обычного для блокаторов каналаNMDA, таких как МК-801 и РСР, или для конкурирующих антагонистов, таких как GGS 19755. Ожидается, что антагонисты и агонисты субтипа селективных рецепторов NMDA проявят потенциальную активность in vivo после внутрибрюшинной или внутривенной инъекции при условии, что эти соединения способны проникать через кровяной/мозговой барьер. Повышенный уровень глутамата связывают с глаукомой. Кроме того, было установлено,что лечение глаукомы, в частности, защита ретинальных ганглиозных клеток, может быть осуществлена путем введения пациенту соединения, способного снизить возбуждающую токсичность, вызванную глутаматом, имеющего эффективную концентрацию (см. WO 94/13275). Таким образом, соединения по данному изобретению вероятно обладающие способностью проникать через барьер крови и ретины, также вероятно могут быть использованы для лечения глаукомы. Предпочтительно, данное изобретение касается лечения пациентов с первичной открытоугольной глаукомой, хронической закрытоугольной глаукомой, псевдодоэксфолиацией или другими видами глаукомы или глазной гипертензией. Предпочтительно вводить данное соединение в течение длительного периода (например, по крайней мере, шести месяцев, предпочтительно, по крайней мере, в течение года),невзирая на изменения внутриглазного давления пациента, происходящие в период введения. Соединения по данному изобретению также могут быть использованы для лечения ретинита,вызванного цитомегаловирусом, особенно в сочетании с противовирусными средствами. Цитомегаловирус поражает ганглиозный клеточный слой, что может привести к повышенному уровню глутамата. Таким образом, антагонисты рецептора могут блокировать ретинит,блокируя токсичное действие высокого уровня глутамата. Аминогликозидные антибиотики успешно применяются для лечения серьезных грамотрицательных бактериальных инфекций. Однако длительное лечение этими антибиотиками приводит к разрушению афферентных слуховых нейронов внутреннего уха и, следовательно,вызывает постоянную потерю слуха. Исследования, недавно проведенные Basile, et al. (NatureMedicine, 2: 1338-1344, 1996), показывают, что аминогликозиды вызывают полиаминоподобное усиление возбуждающей токсичности глутаматов посредством взаимодействия с рецептором 17 изобретению с активностью антагониста рецептора NMDA могут быть использованы для предупреждения потери слуха, вызванной аминогликозидными антибиотиками, препятствуя их взаимодействию с рецептором. Соединения по данному изобретению могут быть использованы для лечения головных болей, в частности, вызванных мигренью. Во время приступа мигрени сенсорные нарушения с уникальными изменениями мозгового кровотока приводят к возникновению характерных аур мигрени. Поскольку это уникальное явление может быть воспроизведено в экспериментах с животными с корковой распространяющейся депрессией, описанной Leao, A.A.P.J., Neurophysiol. 7:359 390 (1944), такая депрессия считается важным явлением в патофизиологии мигрени с аурой (Tepley et al., In: Biomagnetism, eds.Press, New York (1990. Указанную депрессию связывают с распространением (26 мм/с.) проходящих изменений электрической активности,связанных с недостаточностью ионного гомеостаза в мозгу, оттоком возбуждающих аминокислот из нейронов и повышенным метаболизмом энергии (Lauritzen, М., Acta Neurol. Scand. 76 (Suppl. 113):4-40 (1987. Было показано, что возникновение корковой распространяющейся депрессии у различных животных, включая людей, влечет за собой освобождение глутамата и может быть вызвано NMDA (Curtis et al., Nature 191:1010-1011 (1961); и Lauritzen et al., BrainRes. 475:317-327 (1988. Антагонисты субтипа селективной NMDA могут быть использованы для лечения головных болей, вызванных мигренью, из-за ожидаемого незначительного побочного действия, способности преодолевать кровяной/мозговой барьер и системной биодоступности. Действие мочевого пузыря контролируется парасимпатическими преганглиозными нейронами в сакральном спинном мозге (DeGroat etal., J.Auton.Nerv.Sys. 3:135-160 (1981. Было показано, что у людей наивысшая плотность рецепторов NMDA в спинном мозге наблюдается на сакральном уровне, включая участки,предположительно содержащие парасимпатические преганглиозные нейроны мочевого пузыря(Shaw et al., Brain Research 539:164-168 (1991. Поскольку рецепторы NMDA являются возбуждающими по своей природе, фармакологическая блокада этих рецепторов подавляет активность мочевого пузыря. Было показано, что неконкурентный антагонист МК 801 рецептора NMDA увеличивает частоту мочеиспускания у крыс(Vеrа and Nadelhaft, Neuroscience Letters 134:135-138(1991. Кроме того, было обнаружено, что конкурентные антагонисты рецептораNMDA вызывают зависимое от дозы ингибирование мочевого пузыря и действия уретрального сфинктера (патент США 5 192 751). Таким образом, ожидается, что антагонисты субтипа се 001133 18 лективных рецепторов NMDA окажутся эффективными при лечении недержания мочи посредством модулирования активности канала рецептора. Неконкурентный антагонист МК 801 рецептора NMDA показал свою эффективность на различных животных моделях тревоги, в большой степени предсказывающих человеческую тревогу (Clineschmidt, B.V. et al., Drug Dev.Res. 2:147-163 (1982. Кроме того, антагонисты глицинового сайта рецептора NMDA показали свою эффективность в тестах на испуг с использованием крыс (Anthony, E.W., Eur J.Pharmacol. 250:317-324 (1993), а также на некоторых других животных анксиотических моделях Winslow, J. et al., Eur. J.Pharmacol. 190:11-22. (1990):(1992); and Kehne, J.H. et al., Eur.J.Pharmacol. 193:282-292 (1981. Было обнаружено, что антагонисты глицинового сайта, (+) НА-966 и 5,7-дихлоркинмочевой кислоты, после инъекции в ядро accumbens крысы, а не в полосатое тело, селективно противодействуют стимуляции, вызванной dамфетамином (Hutson P.H. et al., Br. J.Pharmacol. 103:2037-2044 (1991. Интересно, что НА-966 также обнаружил способность блокировать РСР и поведенческий подъем, индуцированный МК 801 (Bristow, L.J. et al., Br.J.Pharmacol. 108:11561163 (1993. Эти результаты дают возможность предположить, что модуляторы канала рецептора NMDA могут быть потенциально использованы в качестве атипичных нейролептиков, а не блокаторов канала. Показано, что на животной модели болезни Паркинсона - МРР+ или повреждение допаминергических нейронов, вызванное метамфетамином - может быть ингибировано антагонистами рецептора NMDA (Rojas et al., Drug Dev.Res. 29:222-226 (1993); и Sonsalla et al., Science 243:398-400 (1989. Кроме того, было обнаружено, что антагонисты рецептора NMDA ингибируют каталепсию, вызванную галоперидолом(Schmidt, W.J. et al., Аминокислоты (Amino Acids) 1:225-237 (1991); увеличивают активность грызунов с недостатком моноаминов (Carlsson etal., Trends Neurosci. 13:272-276 (1990, и увеличивают ипсилатеральную ротацию после одностороннего поражения черного вещества у крыс(Snell, L.D. et al., J.Pharmacol. Exp. Ther. 235:5057 (1985. Существуют также экспериментальные животные модели болезни Паркинсона. В исследованиях на животных антипаркинсоновские средства амантадин и мемантин проявляют антипаркинсоновскоподобную активность у животных на уровне плазмы, ведущую к антагонизму рецептора NMDA (Danysz, W. Et al.,J.Neural Trans. 7:155-166 (1994). Таким образом,возможно, что эти антипаркинсоновские средства действуют терапевтически через антагонизм рецептора NMDA. Поэтому равновесие активности рецептора NMDA может оказаться 19 важным для регулирования экстрапирамидальной функции, связанной с появлением симптомов Паркинсона. В медицине хорошо известно применение опиатов, например, морфина, для снижения боли. В данном описании термин опиаты означает любой препарат или производное опиума,особенно природно содержащихся алкалоидов в нем, которых насчитывается около 20, например морфин, носкапин, кодеин, папаверин и тебаин,а также их производные. К сожалению, при продолжительном применении организм вырабатывает толерантность к опиату, таким образом, для поддержания облегчения пациент должен получать постоянно увеличивающиеся дозы. Толерантность развивается как после острого, так и хронического введения морфина (Kornetsky et al., Science 162:1011-1012 (1968); WayHuidobro et al., J.Pharmacol. Exp. Ther.198:318329 (1976); Lutfy et al., J.Pharmacol. Exp. Ther. 256:575-580 (1991. Это само по себе может нанести вред здоровью пациента. Кроме того,может наступить время, когда толерантность по существу исчерпывается и болеутоляющие свойства лекарственного препарата более не эффективны. Кроме того, введение больших доз морфина может привести к угнетению дыхания и его прекращению у пациента. Поиск альтернативных лекарственных средств для осуществления аналгезии без возникновения толерантности или в виде дополнительной, блокирующей толерантность терапии без взаимодействия с аналгезией, представляет собой активную область исследований. В недавних исследованиях высказывается предположение о модулирующей роли для рецептора NMDA в морфинной толерантности.Herman et al., Neuropsychopharmacology 12:269-294 (1995). Далее говорится о том, что антагонисты рецептора NMDA могут быть использованы для ингибирования опиоидной толерантности и некоторых симптомов опиоидной абстиненции. Таким образом, настоящее изобретение также относится к введению соединений, раскрываемых в данном описании, с целью ингибирования опиатной толерантности и устранения или снижения симптомов опиатной абстиненции, блокируя сайт коагониста глицина, ассоциируемый с рецептором NMDA. Таким образом, данное изобретение касается соединений, имеющих высокую аффинность по отношению к конкретной подъединице(субтипу) рецептора NMDA и низкую аффинность по отношению к другим сайтам, таким как допамин и другие рецепторы катехоламина. В соответствии с данным изобретением, соединения, имеющие высокое связывание с конкрет 001133 20 ной подъединицей NMDA, по результатам анализа связывания подъединицы NMDA имеютIС 50 приблизительно 100 м или менее (см. Таблицу 1). Предпочтительно, соединения по данному изобретению имеют IС 50 селективной подъединицы, равное 10 м или менее. Более предпочтительно, соединения по данному изобретению имеют IС 50 селективной подъединицы, приблизительно равный 1,0 м или менее,наиболее предпочтительноприблизительно 0,1 м или менее. Композиции, подпадающие под объем данного изобретения, включают все композиции, содержащие соединения по данному изобретению в количестве, эффективном для осуществления его назначения. Несмотря на различие конкретных случаев, оптимальные интервалы эффективного количества каждого компонента могут быть определены специалистом в данной области. Обычно соединения могут быть введены млекопитающим, например, людям,перорально в дозе от 0,0025 до 50 мг/кг, или эквивалентное количество их фармацевтически приемлемой соли, в сутки массы тела млекопитающего, проходящего лечение от тревоги, например, генерализованной тревоги, фобий, навязчивого компульсивного состояния, паники и посттравматического стресса или от шизофрении или других психозов. Обычно для лечения или предупреждения таких расстройств предпочтительно перорально вводят от приблизительно 0,01 до приблизительно 10 мг/кг. Для внутримышечной инъекции доза приблизительно составляет половину пероральной дозы. Например, для лечения или предупреждения тревоги подходящая внутримышечная доза составляет приблизительно от 0,0025 до приблизительно 15 мг/кг, а наиболее предпочтительно от приблизительно 0,01 до приблизительно 10 мг/кг. В способе лечения или предупреждения нейронных потерь при ишемии, травме головного и спинного мозга, гипоксии, гипогликемии и операциях, лечении или предупреждении глаукомы или недержания мочи, а также при лечении болезни Альцгеймера, бокового амиотрофического склероза, болезни Гентингтона,болезни Паркинсона и синдрома Дауна, или в способе лечения заболевания, в котором патофизиология расстройства включает гиперактивность возбуждающих аминокислот или нейротоксичность, связанную с ионным каналом рецептора NMDA, фармацевтические композиции по данному изобретению могут включать соединения по изобретению на уровне единичной дозы в количестве от приблизительно 0,01 до приблизительно 50 мг/кг массы тела, или эквивалентное количество их фармацевтически приемлемой соли, по схеме: 1-4 раза в сутки. При лечении хронической боли, мигрени, стимуляции анестезии, лечении или предупреждения 21 опиатной толерантности или лечении опиатной абстиненции соединения по данному изобретению могут быть введены на уровне единичной дозировки, составляющей от приблизительно 0,01 до приблизительно 50 мг/кг массы тела,или эквивалентного количества их фармацевтически приемлемой соли, по схеме: 1-4 раза в сутки. Конечно, следует понимать, что точный уровень лечения зависит от истории болезни животного, например, человека, проходящего лечение. Точный уровень лечения может быть определен специалистом в данной области без излишних экспериментов. Единичная пероральная доза может включать от приблизительно 0,01 до приблизительно 50 мг, предпочтительно от приблизительно 0,1 до приблизительно 10 мг соединения. Единичная доза может быть введена один или несколько раз в сутки в виде одной или нескольких таблеток, каждая из которых содержит от приблизительно 0,1 до приблизительно 10 мг, обычно приблизительно 0,25-50 мг данного соединения или его сольватов. Помимо введения соединения в виде необработанного химического вещества, соединения по данному изобретению могут быть введены как часть фармацевтического препарата, содержащего подходящие фармацевтически приемлемые носители, включающие наполнители и вспомогательные вещества, облегчающие переработку соединений в препараты, которые могут быть использованы в фармацевтике. Предпочтительно, препараты, в частности, препараты,которые могут быть введены перорально и которые могут быть использованы для предпочтительного способа введения, такие как таблетки,драже и капсулы, а также препараты, которые могут быть введены ректально, такие как суппозитории, а также подходящие растворы для введения путем инъекции или перорально, содержат приблизительно 0,01-99%, предпочтительно, приблизительно, 0,25-75% активного соединения (соединений), вместе с наполнителем. В объем данного изобретения также входят нетоксичные фармацевтически приемлемые соли соединений по данному изобретению. Кислые соли присоединения получают, смешивая раствор конкретного антагониста или агониста субтипа селективного рецептора NMDA с раствором фармацевтически приемлемой нетоксичной кислоты, такой как соляная, фумаровая,малеиновая, янтарная, уксусная, лимонная, винная, угольная, фосфорная, щавелевая и т.п. кислота. Фармацевтические композиции по данному изобретению могут быть введены любому животному, которое может ощутить полезное действие соединений по данному изобретению. Прежде всего, такими животными являются млекопитающие, например люди, хотя данное изобретение ими не ограничивается. 22 Фармацевтические композиции по данному изобретению могут быть введены любыми способами, обеспечивающими выполнение их назначения. Например, введение может осуществляться парентеральным, подкожным, внутривенным, внутримышечным, внутрибрюшинным, трансдермальным или трансбуккальным способом. Альтернативно или одновременно введение также может осуществляться пероральным способом. Вводимая дозировка зависит от возраста, здоровья и веса реципиента, вида сопутствующего лечения, при наличии такового, частоты лечения и природы желаемого действия. Фармацевтические препараты по данному изобретению изготавливают известным способом, например, используя обычные процессы смешивания, гранулирования, изготовления драже, растворения или лиофилизирования. Таким образом, фармацевтические препараты для перорального применения могут быть получены путем объединения активных соединений с твердыми наполнителями, необязательного измельчения полученной смеси и обработки смеси гранул после добавления, при желании или необходимости, подходящих вспомогательных веществ для получения ядер таблеток или драже. Подходящими наполнителями являются, в частности, такие наполнители как сахариды,например, лактоза или сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например, трикальций фосфат или кальций водород фосфат, а также связующие,такие как крахмальная паста, с использованием,например, кукурузного, пшеничного, рисового и картофельного крахмала, желатин, трагакант,метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинил пирролидон. При желании могут быть добавлены расщепители, такие как вышеупомянутые крахмалы, а также карбоксиметил крахмал, поперечно-сшитый поливинил пирролидон, агар или альгиновая кислота или ее соль,такая как натрий альгинат. Вспомогательные вещества включают, без ограничения, средства,регулирующие текучесть и замасливатели, например, двуокись кремния, тальк, стеариновую кислоту или ее соли, такие как магний стеарат или кальций стеарат, и/или полиэтилен-гликоль. При желании на ядра драже наносят подходящие покрытия, резистентные к желудочным сокам. Для этой цели могут быть использованы концентрированные растворы сахаридов, которые могут необязательно содержать гуммиарабик, тальк, поливинил пирролидон, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или их смеси. Для получения покрытий, резистентных к желудочным сокам, могут быть использованы растворы подходящих целлюлозных препаратов, такие как ацетилцеллюлоза фталат или гидроксипропилметилцеллюлоза фталат. К 23 покрытиям таблеток или драже могут быть добавлены красители или пигменты, например,для их идентификации или для различия сочетаний доз активного соединения. Другие фармацевтические препараты для перорального использования включают легко проглатываемые капсулы, сделанные из желатина, а также мягкие закрытые капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбит. Удобные для проглатывания капсулы могут содержать активные соединения в виде гранул, которые могут быть смешаны с наполнителями, такими как лактоза,связывающими веществами, такими как крахмалы, и/или замасливателями, такими как тальк или стеарат магния, и, необязательно, стабилизаторы. В мягких капсулах активные соединения предпочтительно растворяют или суспендируют в подходящих жидкостях, таких как жирные масла или жидкий парафин. Кроме того, к ним могут быть добавлены стабилизаторы. Возможные фармацевтические препараты,которые могут быть использованы ректально,включают, например, суппозитории, содержащие сочетание одного или нескольких активных соединений с суппозиторной основой. Подходящими суппозиторными основами являются,например, натуральные или синтетические триглицериды или парафиновые углеводороды. Кроме того, можно применять желатиновые ректальные капсулы, включающие сочетание активных соединений с основанием. Подходящие материалы для основы включают, например, жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды. Подходящие составы для парентерального введения включают жидкие растворы активных соединений в водорастворимом виде, например,водорастворимые соли и щелочные растворы. Кроме того, суспензии активных соединений могут быть введены в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или наполнители включают жирные масла, например, кунжутное масло, или синтетические эфиры жирных кислот, например, этилолеат или триглицериды,или полиэтиленгликоль-400 (данные соединения растворимы в полиэтиленгликоле-400). Водные суспензии для инъекций могут содержать вещества, повышающие вязкость суспензии, и включают, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран. Суспензия может также необязательно содержать стабилизаторы. Охарактеризовать сайты связывания подъединицы NMDA in vitro нелегко из-за отсутствия селективных лигандов лекарственного средства. Таким образом, соединения по данному изобретению могут быть использованы для характеристики подъединиц NMDA и их распределения. Особенно предпочтительными антагонистами и агонистами субтипа селективных рецепторов NMDA по данному изобретению, 001133 24 которые могут быть использованы для этой цели, являются меченые радиоизотопами производные, например, такие производные, в которых атомы замещены 3H, 11 С, 15N, 18F или 14 С. Электрофизиологические анализы подъединиц рецепторов NMDA Получение РНК. Клоны кДНК, кодирующие NR1A, NR2A, NR2B, NR2C и NR2D субтипов рецепторов NMDA крыс получены д-ромP.H. Seeburg. Подробное описание этих клонов или их мышиных гомологов дают Moriyoshi et(1992); Monyer et al., Science (Washington, D.C.) 256:1217-1221 (1992); Ikeda et al., FEBS Lett. 313-34-38 (1992); Inshii et al., J.Biol. Chem. 268:2836-2843 (1993). Эти клоны трансформируют в соответствующие бактерии-хозяева и плазмидные препараты получают, используя обычные способы очистки ДНК. Образец каждого клона линеаризуют путем рестрикционной гидролизации фермента и кРНК синтезируют с помощью полимеразы РНК ТЗ. кРНК разбавляют до 400 нг/л хранят в аликвотных порциях по 1 л при -80 С до инъецирования. Система экспрессии ооцитов Xenopus Взрослые женские особи Xenopus laevis анестизируют (20-40 мин), используя 0,15% этиловый эфир 3-аминобензойной кислоты, и хирургическим путем удаляют 2-4 дольки яичников. Ооциты в 1V-VI стадии развития(Dumont, J.N., J. Morphol.136:153-180 (1972,отсекают от яичника вместе с покрывающими его овариальными тканями. В ооциты, заключенные в фолликулы, вводят с помощью микроинъекции 1:1 смеси KPHK:NR1A + NR2A, 2 В,2 С или 2D; инъецируя 2,5 или 20 нг РНК, кодируя каждую подъединицу рецептора. 20 нгMgSO4 0,82; NaHCO3 2,4; HEPES 5; рН 7,4, с 0,1 мг/мл гентамицин сульфата. К среде Барта, в которой находятся ооциты, покрытые овариальными тканями, добавляют 0,1% бычью сыворотку. Фолликулы на ооцитах удаляют через 1-2 дня после инъекций, обрабатывая их коллагеназой (0,5 мг/мл, Сигма, тип 1, в течение 0,5-1 ч)(Miledi and Woodward, J. Physiol. (Lond.) 416:601-621 (1989), а затем хранят в бессывороточной среде. Электрозаписи делают, используя обычный двухэлектродный электрический зажим Применяя ооциты, экспрессирующие различные сочетания подъединиц рецептора NMDA, токиNMDA активируют совместным действием глутамата (100 м) и глицина (1-100 м). Ингибиторную активность новых антагонистов определяют по реакции, даваемой определенными концентрациями глутамата и глицина, измеряя уменьшение токов, вызванное все увеличивающимися концентрациями антагониста. Кривые ингибирования концентрации согласуются с уравнением 1. Уравн. 1, где Iконтроль представляет собой ток, вызванный только агонистами, pIC50 = - log IC50, IС 50 представляет собой концентрацию антагониста, вызывающую половину максимального ингибирования, а n - коэффициент наклона. (De Lean etal., Am.J. Physiol.235:E97-102 (1978. Для неполных кривых анализ путем согласования является неточным, и величину IC50 подсчитывают путем простой регрессии линейных участков кривых (источник: математическое обеспечениеMicrocal). Максимальные припадки, вызванные электрошоком Припадки вызывают, пропуская электрический ток (50 мА, 60 импульсов/с, широта импульса - 0,8 с, продолжительность 1 с/постоянный ток) через покрытые слюной корнеальные электроды, используя прибор UgoBasile ЕСТ (модель 7801). Мышей удерживают,захватывая кожу на дорсальном участке, к двум роговицам слегка прижимают электроды, затем включают ток и в течение 30 с наблюдают экстензорную реакцию тонической задней конечности мышей. Тонический припадок определяют как выпрямление задней конечности более чем на 90 по отношению к плоскости тела. Результаты обрабатывают квантовым способом. Приводимые ниже примеры предназначены для иллюстрации некоторых предпочтительных вариантов изобретения, не предполагая никаких его ограничений. Пример 1. 1-(3-Бутинил)-4-(4-хлорбензил) пиперидин. Суспензию NаНСО 3 (4 г) и 4-[(4 хлорфенил)метил]пиперидина (18 ммол ) в диметилформамиде (25 мл) перемешивают в атмосфере N2 при 0 С и по каплям обрабатывают 3 бутинилтозилатом (20 ммол ) в виде раствора в диметилформамиде (50 мл). Реакционную смесь нагревают при 80 С и перемешивают в течение еще 18 ч. После охлаждения реакционную смесь энергично перемешивают с добавлением воды(200 мл), а затем экстрагируют этилацетатом. Органический слой высушивают над сульфатом 26 магния, фильтруют и выпаривают. Остаток очищают колоночной хроматографией на силикагеле (100:1 СН 2 Сl2:МеОН), получая 1-(3 бутинил)-4-(4-хлорфенил)пиперидин. Пример 2. 1-(3-Бутинил)-4-[(4-трифторметилфенил)метил]пиперидин. Смесь 4-[(4-трифторметилфенил)метил]пиперидина (30 ммол ), К 2 СО 3 (4,5 г) и 3 бутинилтозилит (39 ммол ) в ацетонитриле (150 мл) нагревают с обратным холодильником в течение 8 ч. После охлаждения ацетонитрил удаляют в роторном испарителе, а остаток разделяют между дихлорметаном и водой. Объединенный органический раствор высушивают над сульфатом натрия, фильтруют и выпаривают. Продукт очищают колоночной хроматографией на силикагеле. В качестве альтернативы реагенты смешивают подобным образом, за исключением того,что растворителем является ацетон, а смесь нагревают с обратным холодильником в течение 16 ч. После охлаждения реакционную смесь фильтруют и фильтрат выпаривают. Остаток очищают хроматографией на силикагеле. Пример 3. 4-(4-Хлор)бензил-1-[4-(3-аминофенил)-3-бутинил] пиперидин. Смесь 1-(3-бутинил)-4-[(4-хлорфенил)метил]пиперидина (3,8 ммол ), получаемого в соответствии с примером 1, и м-броманилина (3,8 ммол ) в н-бутиламине (20 мл) обрабатывают в атмосфере азота тетракис(трифенилфосфин) палладием (0) (0,17 г), а затем нагревают до кипячения с обратным холодильником в течение 18 ч. После удаления растворителя в вакууме остаток растворяют в СН 2 Сl2 и промывают насыщенной NaHCO3. Объединенный органический раствор высушивают над сульфатом магния, фильтруют и выпаривают. Вышеописанный продукт очищают хроматографией на силикагеле. В качестве альтернативы суспензиюNаНСО 3 (1 г) и 4-[(4-хлорфенил)метил]пиперидина (4 ммол ) в диметилформамиде (25 мл) перемешивают в атмосфере N2 при 0 С и по каплям обрабатывают 1-[(4-метилфенил)сульфонил]окси-4-(3-амино)фенил-3-бутином(4 ммол), получаемым в соответствии с примером 5, в виде раствора в диметилформамиде (20 мл). Реакционную смесь нагревают до 80 С в течение 12 ч. После охлаждения реакционную смесь энергично перемешивают с добавлением воды(200 мл), а затем экстрагируют этилацетатом. Органический слой высушивают над сульфатом магния, фильтруют и выпаривают. Остаток очищают колоночной хроматографией на силикагеле (100:1 CH2Cl2:MeOH), получая вышеописанный продукт. Пример 4. 4-(4-Трифторметил)бензил-1-[4(3-аминофенил)-3-бутинил]пиперидин.(50 мл) в атмосфере азота обрабатывают бис(трифенилфосфин)палладий (II) хлоридом(0,5 г). После кипячения с обратным холодильником в течение 16 ч, растворитель удаляют роторным выпариванием, а вышеописанный продукт очищают хроматографией на силикагеле (100:1 СН 2 Сl2:МеОН). Пример 5. 1-(т-Бутилдиметилсилокси)-4(3-аминофенил)-3-бутин. Смесь 1-(т-Бутилдиметилсилилокси)-3 бутина (10 ммол) и м-броманилина (10 ммол) в н-бутиламине (50 мл) в атмосфере азота обрабатывают тетракис(трифенилфосфин)палладием(0) (0,17 г), а затем нагревают до кипения с обратным холодильником в течение 18 ч. После удаления растворителя в вакууме остаток растворяют в CH2Cl2 и промывают насыщеннымNаНСО 3. Объединенный органический раствор высушивают над сульфатом магния, фильтруют и выпаривают, получая вышеописанный аддукт,защищенный силилом. Пример 6. 1-Тозил-4-(3-аминофенил)-3 бутин. Раствор 1-(т-Бутилдиметилсилилокси)-4(3-аминометил-3-бутина (3 ммол ), получаемого в соответствии с примером 5, в СН 2 Сl2 (100 мл) охлаждают в ледяной бане, а затем обрабатывают тетрабутиламмонийфторидом (3,1 ммол). После перемешивания в течение 30 мин добавляют 100 мл воды, органический слой разделяют и высушивают над сульфатом магния,фильтруют и выпаривают. Остаток растворяют в тетрагидрофуране (50 мл) с помощью триэтиламина (2 мл), а затем обрабатывают тозилхлоридом (3 ммол). После перемешивания при комнатной температуре в течение 4 ч, добавляют насыщенный водный NaCl (100 мл), а орга 001133 28 нический слой разделяют. Водный слой повергают обратному экстрагированию метиленхлоридом. Объединенные органические слои высушивают над сульфатом магния, фильтруют и выпаривают. Вышеописанный тозилированный продукт очищают колоночной хроматографией,и он может быть использован в процедуре, описанной в примере 2, для получения аналогов 4 замещенного пиперидина по данному изобретению. Пример 7. 1-[4-(5-(2-Амино)пиридинил)-3 бутинил]-4-гидрокси-4-(4-хлорфенил)пиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 8. 1-[4-(3-Аминофенил)-3-бутинил]-4-гидрокси-4-(4-хлорфенил) пиперидин.(2,54 г, 12,0 ммол ) и К 2 СО 3 (4,14 г, 30,0 ммол ) в СН 3 СN (25 мл) кипятят с обратным холодильником в течение 12 ч. Смесь фильтруют и промывают EtOAc (3 х 30 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией,получая продукт в виде твердого бесцветного вещества (2,30 г, 87%): т.пл. 98-100 С; 1 Н ЯМР (CDCl3) 1,55 (s, 1H), 1,74(m, 2H),1,99 (m, 1H), 2,10 (m, 2H), 2,42 (m, 4H), 2,65 (m,2H), 2,79 (m, 2H), 7,32 (d, J=7,2 Гц, 2 Н), 7,42 (d, JB) 1-(4-(3-Аминофенил)-3-бутинил)-4-(4 хлорфенил)-4-гидроксипиперидин. Раствору 1-(3-бутинил)-4-(4-хлорфенил)-4 гидроксипиперидина (263 мг, 1,00 ммол ), 3 иоданилина (208 мг, 0,950 ммол ) и тетракис(трифенилфосфин)палладия (0) (46 мг) в нбутиламине (5 мл) позволяют кипеть с обратным холодильником в течение 15 ч. Растворитель выпаривают в вакууме, получая остаток,который очищают флэш-хроматографией для получения продукта в виде твердого беловатого вещества (231 мг, 69%): т.пл. 139-140 С; 1 Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 10. 1-[4-(5-(2-Амино)пиридинил)-3 бутинил]-4-(4-хлорфенил)-1,2,5,6-тетрагидропиридин. Вышеописанный продукт получают способом,описанным в примерах 3 или 4. Пример 11. 1-[4-(3-Аминофенил)-3-бутинил]-4-фенил-1,2,5,6-тетрагидропиридин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 12. 1-[4-(4-Метиламинофенил)-3 бутинил]-4-фенил-1,2,5,6-тетрагидропиридин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 13. 1-[4-(4-Аминофенил)-3-бутинил]-4-фенил-1,2, 5,6-тетрагидропиридин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 14. 1-[4-(5-Аминофенил)-3-бутинил]-4-фенил-1,2,5,6-тетрагидропиридин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 17. 4-(4-Хлор)бензил-1-[4-(5-(2 амино)пиридинил)-3-бутинил] пиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 18. 4-Бензил-1-(4-фенил-3-бутинил)пиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 20. 4-(4-хлор)бензил-1-[4-(5-(2 амино)пиридинил)-3-бутинил]-3-гидроксипиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 15. 1-[4-(5-Метиламинофенил)-3 бутинил]-4-фенил-1,2,5,6-тетрагидропиридин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 16. 1-[4-(4-Метоксиаминофенил)3-бутинил]-4-фенил-1,2,5,6-тетрагидропиридин. Вышеописанный продукт получают способом, описанным в примерах 3 и 4. Пример 21. 1-[4-(3-Аминофенил)-3 бутинил]-4-(4-хлор)феноксипиперидин. 31 Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 22. 1-[4-(5-(2-Амино)пиридинил)3-бутинил]-4-(4-хлор)феноксипиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 23. 1-[4-(3-Аминофенил)-3-бутинил]-4-(4-хлорфенил)аминопиперидин Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 24. 1-[4-(5-(2-Амино)пиридинил)3-бутинил]-4-(4-хлорфенил)аминопиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 25. 4-Фенил-1-(4-фенил-3-бутинил) пиперидин.(120 мл), содержащем 148 мл пиридина. Полученный раствор перемешивают при комнатной температуре в течение 20 ч. Смесь выливают в лед (50 г). Органический слой отделяют и водную фазу экстрагируют с помощью CH2Cl2 (3 х 30 мл). Объединенный органический экстракт выпаривают для удаления большей части пиридина. К остатку добавляют CH2Cl2 (100 мл). Полученный раствор промывают 100 мл 0,5N НСl(раствор), 50 мл холодного насыщенного раствора NаНСО 3 и 30 мл рассола, а затем высушивают над Na2SO4. Выпаривая СН 2 Сl2, получают продукт (22 г, 75%): 1 Н ЯМР (СDСl3) 2,06 (t, J=2,7 Гц, 1 Н), 2,66 32 ют и промывают EtN3 (3 х 15 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде светложелтого масла (560 мг, 50%): 1 Смесь 1-мезил-4-фенилбут-3-ина (352 мг,1,57 ммол ), 4-(3-(трифторметил)фенил)пиперидин-3-ол гидрохлорида (530 мг, 1,88 ммол ) и К 2 СО 3 (542 мг, 3,93 ммол ) в 20 мл CH3CN кипятят с обратным холодильником в течение 12 ч. Смесь фильтруют и промывают EtOAc (3 х 20 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде твердого беловатого вещества (120 мг,21%): т.пл. 77-79 С; 1 Н ЯМР (CDCl3) 1,71 (m, 2 Н), 2,15 (m, 3 Н),2,40 (bs, 1 Н), 2,62 (m, 4 Н), 2,72 (m, 1 Н), 2,83 (m,2 Н), 7,27-7,81 (m, 9 Н). Пример 27. 1-(4-(4-Аминофенил)-3-бутинил)4-(4-хлорфенил)-4-гидроксипиперидин. Раствор 1-(3-бутинил)-4-(4-хлорфенил)-4 гидроксипиперидина (263 мг, 1,00 ммол ), 4 иоданилина (208 мг, 0,950 ммол ) и 50 мг тетракис(трифенилфосфин)палладия в 10 мл бутиламина подвергают кипячению с обратным холодильником в течение 20 ч. Растворитель выпаривают в вакууме, получая остаток, который очищают флэш хроматографией для получения продукта в виде твердого беловатого веществаA) 3-Иодфенилцианамид. К раствору 3-иоданилина (3,50 г, 16,0 ммол) в 50 мл эфира при 0 С добавляют цианоген бромид (1,79 г, 16,9 ммол ). Полученную смесь перемешивают при комнатной температуре в течение 12 ч. Твердое вещество собирают фильтрацией и высушивают в вакууме, получая продукт в виде твердого вещества (3,32 г, 85%): т.пл. 86-88 С (EtOH/H2O); 1B) N-н-Бутил-N'-(3-(4-(4-(4-хлорфенил)-4 гидрокси)пиперидинил)бутинил)фенилгуанидин. Смесь 1-(3-бутинил)-4-(4-хлорфенил)-4 гидроксипиперидина (132 мг, 0,500 ммол ), 3 иодфенилцианамида (146 мг, 0,600 ммол ),Pd(PPh3)4 (25 мг, 0,020 ммол ) в 5 мл н-бутиламина кипятят с обратным холодильником в течение 12 ч. Выпаривая растворитель, получают остаток, который очищают флэш-хроматографией для получения продукта в виде твердого вещества: (90 мг, 40%): т.пл. 98-100 С; 1(40 мг), PdCl2(PPh3)2 (70 мг) в 12 мл Et3N перемешивают при комнатной температуре в атмосфере N2 в течение 20 ч. Смесь фильтруют и промывают Et3N (3 х 15 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде бледножелтого масла (565 мг, 47%): 1H ЯМР (СDСl3) 1,32 (m, 2 Н), 1,51 (m, 1 Н),1,65 (m, 2 Н), 1,94 (m, 3 Н), 2,36 (m, 2 Н), 2,54 (m,4 Н), 2,86 (d, J=11,4 Гц, 2 Н), 7,12-7,27 (m, 5 Н). В) 1-(4-(4-Аминофенил)-3-бутинил)-4 бензилпиперидин. Смесь 1-(бут-3-ин-1-ил)-4-бензилпиперидина (227 мг, 1,00 4-иоданилина (263 мг, 1,20 ммол ), иодида меди (1) (15 мг), РdСl2(РРh3)2 (28 мг) в 10 мл Et3N перемешивают при комнатной температуре в атмосфере N2 в течение 20 ч. Смесь фильтруют и промывают Et3N (3 х 15 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде бледно-желтого масла (50 мг, 16%): 1(307 мг, 1,61 ммол ) и К 2 СО 3 (555 мг, 4,02 ммол) в 15 мл СН 3 СN кипятят с обратным холодильником в течение 12 ч. Смесь фильтруют и промывают EtOAc (3 х 20 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией,получая продукт в виде твердого беловатого вещества (130 мг, 30%): т.пл. 80-82 С;(344 мг, 1,54 ммол ), 4-бензил-4-гидроксипиперидина (332 мг, 1,73 ммол ) и К 2 СО 3 (598 мг, 4,34 ммол ) в 15 мл СН 3 СN кипятят с обратным холодильником в течение 12 ч. Смесь фильтруют и промывают EtOAc (3 х 20 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде коричневого масла (100 мг, 20%): 1EtOAc (3 х 30 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде твердого бесцветного вещества (2,1 г, 86%): т.пл. 51-53 С; 1(I) (40 мг), РdСl2 (РРh3)2 (50 мг, 0,04 ммол ) в 10 мл Еt3N перемешивают при комнатной температуре в атмосфере N2 в течение 20 ч. Смесь фильтруют и промывают Et3N (3 х 15 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде коричневого масла (100 мг, 30%): 1 А) 4-(4-Хлорбензил)-1-(3-бутинил)пиперидин. Смесь 1-мезилбут-3-ина (2,22 г, 15,0 ммол), 4-(4-хлорбензил)пиперидин гидрохлорида (2,95 г, 12,0 ммол ), К 2 СО 3 (4,97 г, 36,0 ммол ) в 50 мл СН 3 СN кипятят с обратным холодильником в течение 12 ч. Неорганическую соль удаляют через короткую колонку с силикагелем и промывают EtOAc (3 х 30 мл). Выпаривая растворители, получают остаток, который очищают флэш-хроматографией для получения продукта в виде бледно-желтого масла (2,67 г, 85%): 1(d, J=8,1 Гц, 2 Н), 7,26 (d, J=8,1 Гц, 2 Н). В) 1-(4-(4-Аминофенил)-3-бутинил)-4-(4 хлорбензил)пиперидин. К раствору 4-(4-хлорбензил)-1-(бут-3-ин-1 ил)пиперидина (318 мг, 1,21 ммол ) и 4 иоданилина (265 мг, 2,19 ммол ) в 10 мл бутиламина добавляют 70 мг Pd(PPh3)4. Полученный раствор кипятят с обратным холодильником в течение 24 ч. Раствор выпаривают в вакууме и остаток очищают флэш-хроматографией, получая целевой продукт в виде коричневого масла К раствору 4-(4-хлорбензил)-1-(бут-3-ин-1 ил)пиперидина (400 мг, 1,53 ммол ) и 2-фторо-4 иоданилина (436 мг, 1,84 ммол ) в 10 мл бутиламина добавляют 70 мг Pd(PPh3)4. Полученный раствор кипятят с обратным холодильником в течение 24 ч. Растворитель выпаривают в вакууме и остаток очищают флэш-хроматографией, получая целевой продукт в виде коричневого масла (100 мг, 18%). 1EtOAc (3 х 30 мл). Фильтрат выпаривают в вакууме и очищают флэш-хроматографией, получая продукт в виде твердого бесцветного вещества (2,1 г, 86%): т.пл. 51-53 С; 1 Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 38. N-4-[4-(4-Феноксипиперидин-1-ил)-бут-1-инил]фенил ацетамид. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 39. 4-4-[4-(4-Метилбензил)пиперидин-1-ил]-бут-1-инилфениламин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 40. 4-Бензил-1-[4-(4-нитрофенил)бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примерах 3 или 4. Пример 41. 4-Бензил-1-[4-(4-метоксифенил)-бут-3-инил]пиперидин.(116 мг, 0,1 ммол) перемешивают в пирролидине (5 мл) и деоксигенируют, барботируя азот через раствор. Смесь перемешивают при комнатной температуре в атмосфере азота в течение 20 ч. Пирролидин выпаривают и остаток очищают жидкостной хроматографией среднего давления на силикагеле, элюируя 25-75% этилацетатом в гексане, получая продукт в виде бесцветного масла (286 мг, 43%). Масло перемешивают в этаноле (10 мл) и добавляют дигидрат щавелевой кислоты (108 мг) в этаноле (2 мл). 38 Смесь оставляют на ночь в морозильнике. Кристаллизовавшуюся соль собирают, промывают холодным этанолом и высушивают при 50 С в глубоком вакууме, получая целевое соединение в виде твердого беловатого вещества Вышеописанный продукт получают способом, описанным в примере 41. Пример 43. 4-Бензил-1-[4-(4-фторфенил)бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 44. 4-Бензил-1-[4-(4-хлорфенил)бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 45. 4-Бензил-1-[4-(3-хлорфенил)бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 46. 4-Бензил-1-[4-(2,3-дихлорфенил)-бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 47. 4-Бензил-1-[4-(3,4-дихлорофенил)-бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 48. 4-Бензил-1-(4-п-толил-бут-3 инил)пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 49. 4-Бензил-1-[4-(2,3-диметилфенил)-бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 50. 4-Бензил-1-[4-(3,4-диметилфенил)-бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 51. 3-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]фениламин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 52. 3-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]бензиламин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 53. N-4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]фенилацетамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 54. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил] фенилметиламин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 55. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]фенилдиметиламин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 56. N-4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]фенил)метансульфонамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 57. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]бензамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 58. N-(Метилсульфонил)-N-[4-[4[4-(фенилметил)-1-пиперидинил]-1-бутинил] фенил]метансульфонамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 59. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]бензолсульфонамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 60. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]-N-бутилбензамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 61. 1-(4-Бензо[1,3]диоксол-5-илбут-3-инил)-4-бензилпиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 62. 4-Бензил-1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-бут-3-инил]пиперидин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 63. 4-[3-(4-Бензилпиперидин-1 ил)-проп-1-инил]фениламин. Вышеописанный продукт получают способом, описанным в примере 41. Пример 64. N-4-[3-(4-Бензилпиперидин-1 ил)-проп-1-инил]фенилметансульфонамид. Вышеописанный продукт получают способом, описанным в примере 41. Вышеописанный продукт получают способом, описанным в примере 41. Пример 66. 5-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]-1 Н-индол.(200 мл) перемешивают при комнатной температуре в течение 5 мин. Добавляют бензолсульфонилхлорид (3,57 мл, 28 ммол ) и смесь перемешивают в течение 1 ч. Смесь разбавляют водой (500 мл) и экстрагируют EtOAc (3 х 100 мл). Экстракты промывают рассолом (250 мл), высушивают над MgSO4, фильтруют и выпаривают до желтого масла. Масло очищают колоночной хроматографией среднего давления на силикагеле, элюируя 10% EtOAc/гексанами для получения целевого соединения в виде твердого белого вещества (7,81 г).(1,34 г, 4 ммол ), 4-бензил-1-(3-бутинил) пиперидина (908 мг, 4 ммол ) и тетракис (трифенилфосфин)палладия (0) (600 мг) перемешивают в течение ночи в пирролидине (50 мл) при 50 С в атмосфере N2. Большую часть пирролидина выпаривают и остаток очищают колоночной хроматографией на силикагеле,элюируяEtOAc/гексанами с концентрацией, возрастающей от 50 до 100%, для получения целевого продукта в виде бледно-желтого масла (1,55 г).C) 5-[4-(4-Бензил-пиперидин-1-ил)-бут-1 инил]-1 Н-индол. Смесь 1-бензолсульфонил-5-[4-(4-бензилпиперидин-1 ил)-бут-1-инил]-1 Н-индола (1,49 г,3,1 ммол ) перемешивают в EtOH (200 мл) в 50% NaOH (1 мл) при комнатной температуре в течение 3 дней. Большую часть EtOH выпаривают, а остаток разбавляют водой (200 мл). Осадок отфильтровывают и обильно промывают водой. Остаток, перекристаллизовывают из горячего этанола, получая целевое соединение, в виде твердого беловатого вещества (854 мг): т.пл. 165-166 С. Пример 67. 4-4-[4-(4-Метилбензил)пиперидин-1-ил]-бут-1-инилфенол.A) 4-(4-Метилбензил)-1-(1-бутин-3-ил) пиперидин. Смесь 4-метилбензилпиперидин гидрохлорида (1,129 г, 5,0 ммол ), 1-бутин-3 илметансульфоната (0,888 г, 5,0 ммол ) и карбоната калия (2,48 г, 12,5 ммол ) в 30 мл ацетонитрила нагревают до кипячения с обратным холодильником в течение 12 ч. Неорганическую соль удаляют через короткую колонку с силикагелем и промывают этилацетатом (3 х 30 мл). Выпаривая растворители, получают остаток, который очищают флэш-хроматографией (50% EtOAc в гексане) для получения 0,96 г (80%) целевого соединения в виде бледно-желтого масла. 1B) 4-4-[4-(4-Метилбензил)-пиперидин-1 ил]-бут-1-инилфенол. К раствору 4-(4-метилбензил)-1-(1-бутин 3-ил)пиперидина (400 мг, 1,66 ммол ) и 4 иодфенола (347 мг, 1,57 ммол ) в 10 мл бутиламина добавляют 80 мг Рd(РРh3)4. Полученный раствор перемешивают при 55 С в течение 24 ч. Растворитель выпаривают в вакууме и остаток очищают флэш-хроматографией (20% EtOAc в гексане), получая 150 мг (27%) целевого продукта в виде коричневого масла. 1 Вышеописанный продукт получают способом, описанным в примере 41. Пример 69. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]-2-нитрофениламин.(2,27 г, 10 ммол ), 4-бромо-2-нитроанилина (2,17 г, 10 ммол ) и тетракис(трифенилфосфин) палладия (0) (600 мг) перемешивают в течение ночи в пирролидине (50 мл) при 50 С в атмосфере N2. Большую часть пирролидина выпаривают и остаток очищают колоночной хроматографией на силикагеле, элюируя EtOAc/гексаны с концен 43 трацией, возрастающей с 40 до 60%, для получения красного масла (3,14 г). Часть этого масла(340 мг) растворяют в EtOH (8 мл) и добавляют дигидрат щавелевой кислоты (126 мг) в EtOH (2 мл). После отстаивания при -20 С в течение ночи, соль монооксалата целевого продукта выпадает в осадок в виде твердого вещества, имеющего оранжевую окраску (200 мг), т.пл. 150153 С. Пример 70. 4-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]-бензол-1,2-диамин.EtOH (52 мл) и воде (8 мл) с концентрированной НСl (5 капель) и железными опилками (3,75 г) при 75 С в течение 2 ч. Смесь фильтруют и выпаривают. Остаток очищают колоночной хроматографией среднего давления на силикагеле,элюируя 200:8:1 CH2Cl2:EtOH:NH4OH для получения целевого продукта в виде твердого вещества, имеющего бежевую окраску (1,82 г): т.пл. 141-142 С. Пример 71. 5-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]-1,3-дигидробензоимидазол-2 он.(904 мг, 4 ммол ), Et3N (4 мл), CuI (76 мг, 0,4 ммол ) и Pd(PPh3)2Cl2 (41 мг, 0,1 ммол ) в диметилформамиде (10 мл) перемешивают при комнатной температуре в атмосфере N2 в течение 30 мин. Добавляют 5-иодизатин (546 мг, 2 ммол ) и перемешивание продолжают в течение ночи. Смесь выпаривают и остаток очищают колоночной хроматографией среднего давления на силикагеле, элюируя 50% EtOAc/гексаны (+ 1%Et3N) для получения твердого вещества, имеющего оранжевую окраску (238 мг). Твердое вещество перекристаллизовывают из горячей смеси 90:10 изопропанол:вода, получая целевое соединение в виде оранжевых кристаллов (152 мг): т.пл. 140-141 С. Пример 76. 4- (4-Метилензил)-4-гидрокси 1-(бут-3-ин-1-ил]пиперидин Смесь 4-[4-(4-Бензилпиперидин-1-ил)-бут 1-инил]-бензол-1,2-диамина (пример 70) (333 мг, 1 ммол ) и карбонил диимидазола (243 мг,1,5 ммол) в тетрагидрофуране (5 мл) перемешивают при комнатной температуре в течение 1 ч. Образуется осадок; смесь разбавляют эфиром(10 мл), фильтруют и твердое вещество промывают эфиром для получения целевого соединения в виде белого порошка (233 мг): т.пл. 221223 С. Пример 72. N-4-[4-(4-Фенилсульфанилпиперидин-1-ил)-бут-1-инил]фенилметансульфонамид. Вышеописанный продукт получают способом, описанным в примере 41. Пример 73. 4-[3-(4-Бензилпиперидин-1 ил)-проп-1-инил]бензамид. Вышеописанный продукт получают способом, описанным в примере 41. Вышеописанный продукт получают способом, описанным в примере 41. Пример 75. 5-[4-(4-Бензилпиперидин-1 ил)-бут-1-инил]-1 Н-индол-2,3-дион. Смесь 4-метил-4-гидроксибензилпиперидин гидрохлорида (1,3 г, 5,4 ммол), 1-бутин-4 ил метансульфоната (0,96 г, 6,5 ммол), карбоната калия (2,5 г, 18 ммол) в 50 мл ацетонитрила кипятят с обратным холодильником в течение 12 ч. Неорганическую соль удаляют через короткую колонку на силикагеле и промывают этилацетатом (3 х 30 мл). Выпаривая растворители, получают остаток, который очищают флэш-хроматографией (50% EtOAc в гексане) для получения 0,90 г (65%) целевого соединения в виде бледно-желтого масла. 1 К раствору 4-гидрокси-4-(4-метилбензил)1-(1-бут-3-ин-1-ил)пиперидина (450 мг, 1,75 ммол ) и 4-иоданилина (383 мг, 1,75 ммол ) в 15 мл пирролидина добавляют 75 г Рd(РРh3)4. Полученный раствор перемешивают при комнат 45 ной температуре в течение 24 ч. Растворитель выпаривают в вакууме и остаток очищают флэш-хроматографией (20% EtOAc в гексане),получая 325 мг (54%) целевого соединения в виде коричневого масла. 1(m, 2 Н), 7,107-7,190 (m, 6 Н). Используя вышеописанные общие процедуры, могут быть получены дополнительные соединения по данному изобретению, показанные в таблицах 1 и 2. Таблица 1 Эффективность антагонизма для вышеописанных соединений из примеров 1, 7, 8, 11-16,18, 25-35 и 37-77 в экспрессируемых клонированных субтипах NMDA и их противосудорожная активность против максимального электрошока показаны ниже в таблице 3. Эти данные представляют собой средние величины 1C50 (м) для имеющихся реакций 50 мембраны, активированных NMDA. Данные показывают, что аналоги 4-замещенного пиперидина проявляют селективность по отношению к рецепторам субтипа 2 В по сравнению с рецепторами субтипа 2 А, 2 С и 2D. Кроме того, соединения 8, 18, 28, 30, 39,42, 53, 54 и 67 также продемонстрировали потенциальную активность против максимального электрошока (MES), как показано в таблице 3. Другие вариации и модификации данного изобретения очевидны для специалистов в данной области. Настоящее изобретение не ограничивается нижеизложенной формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой или его фармацевтически приемлемая соль, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой;z представляет собой одинарную связь; Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;R1 представляет водород или гидроксил;R4 представляет водород или гидроксил. 2. Соединение по п.1, где Аr1 представляет собой замещенный или незамещенный фенил. 3. Соединение по п.1, где Аr1 представляет собой галогенфенильную группу. 4. Соединение по п.1, выбираемое из группы, состоящей изN-4-(1-(4-(3-аминофенил)бутин-3-ил)пиперидинил)-2-оксобензимидазола; 1-(4-бензо[1,3]диоксол-5-ил-бут-3-инил)-4 бензилпиперидина; 4-бензил-1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)бут-3-инил]пиперидина; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1H-индола; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1H-индазола; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1,3-дигидробензимидазол-2-она; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1H-индол-2,3-диона; и их фармацевтически приемлемая соль. 51 5. Фармацевтическая композиция, полезная при лечении расстройств, отвечающих на селективную блокаду субтипов рецептора Nметил-D-аспартата, таких как удар, церебральная ишемия, травма центральной нервной системы, гипогликемия, нейродегенеративные расстройства, тревога, головные боли, вызванные мигренью, судороги, потеря слуха, вызванная аминогликозидными антибиотиками, хроническая боль, психоз, глаукома, ретинит, вызванный цитомегаловирусом, опиоидная толерантность или абстиненция, или недержание мочи,при этом указанная композиция включает фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество, по крайней мере, одного соединения по п.1. 6. Соединение, представленное формулой или его фармацевтически приемлемая соль, где Аr1 представляет арил, замещенный галогеном, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом,амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; и или его фармацевтически приемлемая соль, где Аr1 представляет арил, замещенный галогеном, и Аr2 представляет бициклическую гетероарильную группу, которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом,амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; иQ представляет -СС-. 8. Соединение, представленное формулой или его фармацевтически приемлемая соль, где: Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; и или его фармацевтически приемлемая соль, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; иQ представляет -СС-. 10. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение, в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой;R1 представляет водород или гидроксил;R4 представляет водород или гидроксил. 11. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалки 53 лом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; иQ представляет -СС-. 12. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; иQ представляет -СС-. 13. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой или его фармацевтически приемлемой соли, где: Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; иQ представляет -СС-. 14. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алки 001133 54 лом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNН алкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой; иQ представляет -СС-. 15. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, выбранного из группы, включающейN-4-(1-(4-(3-аминофенил)бутин-3 ил)пиперидинил)-2-оксобензимидазол; 1-(4-бензо[1,3]диоксол-5-ил-бут-3-инил)-4 бензилпиперидин; 4-бензил-1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)бут-3-инил]пиперидин; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1H-индол; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1H-индазол; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1,3-дигидробензимидазол-2-он; 5-[4-(4-бензилпиперидин-1-ил)бут-1 инил]-1H-индол-2,3-дион; и фармацевтически приемлемые соли этих соединений. 16. Способ получения соединения, представленного формулой I: или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой;z представляет собой одинарную связь; Х представляет -(CHR2)m-, в котором каждый R2 представляет водород, a m = 1;R1 представляет водород или гидроксил;R4 представляет водород или гидроксил,при этом указанный способ включает следующие стадии:IX,где n и Q имеют вышеуказанные значения, a L представляет собой отщепляемую группу, для получения соединения формулы X:(b) реакцию соединения формулы Х с Аr2Y, где Аr2 имеет вышеуказанные значения, aY представляет собой трансметаллозамещаемую группу, в присутствии палладиевого катализатора для получения соединения формулы I. 17. Способ по п.16, в котором указанную трансметаллозамещаемую группу выбирают из группы, состоящей из Вr, I, В(ОН)2 и НgСl. 18. Способ получения соединения, представленного формулой I: или его фармацевтически приемлемой соли, где Аr1 представляет арильную группу и Аr2 представляет бициклическую гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой,-NHAc, -NHSO2Me, -N(SO2Me)2, -СОNНалкилом, -SO2NH2, алкилгуанидиновой группой,низшей алкиламиногруппой или низшей алкоксигруппой;R1 представляет водород или гидроксил;R4 представляет водород или гидроксил,включающий следующие стадии:(a) реакцию в присутствии палладиевого катализатора соединения формулы XI:XI где Р представляет собой общую защитную группу, a n и Q имеют вышеуказанные значения,с Аr2Y, в котором Аr2 имеет вышеуказанные значения, a Y представляет собой трансметаллозамещаемую группу для получения соединения,представленного формулой XII:(c) реакцию соединения формулы XIII с активирующим соединением в присутствии основания для получения соединения, представленного формулой XIV:XIV где А представляет собой активирующую группу, a n, Q и Аr2 имеют вышеуказанные значения; и где Аr1, X, R1, R4 и z имеют вышеуказанные значения, для получения соединения формулы I. 19. Способ по п.18, в котором указанную трансметаллозамещаемую группу выбирают из группы, состоящей из Вr, I, В(ОН)2 и НgСl. 20. Способ по п.19, в котором указанное активирующее соединение выбирают из группы,состоящей из тозилатов, трифлатов, мезилатов и диэтилазадикарбоксилата. 21. Соединение, представленное формулой или его соль, где Аr1 представляет собой арильную группу,которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me,-N(SO2Me)2, -СОNНалкилом, -SO2NH2, низшей алкиламиногруппой или низшей алкоксигруппой;R1 представляет водород или гидроксил; и 4R представляет водород или гидроксил. 22. Соединение по п.21, выбираемое из группы, включающей 4-бензил-1-(3-бутинил)пиперидин; 4-(4-хлор)бензил-1-(3-бутинил)пиперидин; 4-(3-трифторметил)бензил-1-(3-бутинил) пиперидин; 4-(4-хлор)бензил-1-(2-пропинил)пиперидин; 4-(4-хлор)бензил-1-(4-пентинил)пиперидин; 4-бензил-1-(3-бутинил)-3-гидроксипиперидин; 4-(4-хлор)бензил-1-(3-бутинил)-3-гидроксипиперидин; 4-(3-трифторметил)бензил-1-(3-бутинил)3-гидроксипиперидин; 4-(4-хлор)бензил-3-гидрокси-1-(2-пропинил)пиперидин; 4-(4-хлор)бензил-3-гидрокси-1-(4-пентинил)пиперидин; 1-(бут-3-инил)-4-(4-хлорбензил)пиперидин; 4-бензил-1-(бут-3-ин-1-ил)-4-гидроксипиперидин; 4-(4-метилбензил)-4-гидрокси-1-(бут-3-ин 1-ил)пиперидин; и его соль. 23. Способ лечения расстройств, отвечающих на селективную блокаду субтипов рецептора N-метил-D-аспартата у животного, страдающего от таких расстройств, включающий введение в виде разовой дозированной формы, по крайней мере, одного соединения, представленного формулой (X): или его фармацевтически приемлемой соли, где Аr1 представляет собой арильную группу,которая может быть независимо замещена водородом, гидроксилом, алкилом, галогеном, нитро, арилом, аралкилом, амино, галогенированной алкильной группой, -NHAc, -NHSO2Me,-N(SO2Me)2, -СОNНалкилом, -SO2NH2, низшей алкиламиногруппой или низшей алкоксигруппой;R1 представляет водород или гидроксил; иR4 представляет водород или гидроксил. 58 24. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой удар, церебральную ишемию, травму центральной нервной системы или гипогликемию. 25. Способ по любому из пп. 10-15 и 23, в которых указанное расстройство представляет собой тревогу, судороги или хроническую боль. 26. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой потерю слуха, вызванную аминогликозидными антибиотиками. 27. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой болезнь Паркинсона. 28. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой головную боль, вызванную мигренью. 29. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой глаукому или ретинит, вызванный цитомегаловирусом. 30. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой психоз. 31. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой недержание мочи. 32. Способ по любому из пп.10-15 и 23, в которых указанное расстройство представляет собой опиоидную толерантность или абстиненцию.
МПК / Метки
МПК: C07D 215/16, A61K 31/445
Метки: nmda, селективных, качестве, аналоги, субтипов, 4-замещенных, антагонистов, пиперидинов, применение, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-1133-analogi-4-zameshhennyh-piperidinov-i-ih-primenenie-v-kachestve-antagonistov-subtipov-selektivnyh-receptorov-nmda.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги 4-замещенных пиперидинов и их применение в качестве антагонистов субтипов селективных рецепторов nmda.</a>
Предыдущий патент: Способ рассылки корреспонденции и других почтовых отправлений внутри страны и за границу путем использования почтовых номеров
Следующий патент: Изделие с голографическими и световозвращающими элементами
Случайный патент: Способ изготовления прессованного фармацевтического препарата, содержащего тиболон












