Бис(дигидрофосфатная) соль 6-{2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси}-3-этокси-1,2-бензизоксазола (1:2), способ ее получения и ее применение в композиции и способе лечения или предотвращения пикорнавирусных инфекций
Формула / Реферат
1. Бис(дигидрофосфатная) соль 6-{2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси}-3-этокси-1,2-бензизоксазола (1:2).
2. Бис(дигидрофосфатная) соль по п.1, которая является кристаллической.
3. Бис(дигидрофосфатная) соль по п.2, имеющая рентгеновскую порошковую дифрактограмму с 2θ (±0,2°) пиками при 3,3°, 6,7°, 12,8°, 13,3°, 14,1°, 19,2°, 20,0°, 21,1° и 22,4°.
4. Бис(дигидрофосфатная) соль по любому из пп.1-3, которая находится в форме физиологически пригодного сольвата или гидрата.
5. Фармацевтическая композиция для лечения или предотвращения пикорнавирусной инфекции, содержащая бис(дигидрофосфатную) соль по любому из пп.1-4 вместе с одним или несколькими фармацевтически пригодными носителями.
6. Фармацевтическая композиция по п.5, дополнительно содержащая глюкозу.
7. Пероральная форма фармацевтической композиции по п.5 или 6.
8. Интраназальная форма фармацевтической композиции по п.5.
9. Фармацевтическая композиция по п.5, где пикорнавирусная инфекция представляет собой риновирус человека (HRV).
10. Применение соединения по любому из пп.1-4 в производстве медикамента для лечения или профилактики пикорнавирусной инфекции.
11. Применение по п.10, при котором пикорнавирусная инфекция является инфекцией, вызванной риновирусом человека (HRV).
12. Способ получения бис(дигидрофосфатной) соли по п.1 или 3, включающий этап взаимодействия 6-{2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси}-3-этокси-1,2-бензизоксазола примерно с 2 мол.экв. фосфорной кислоты.
Текст
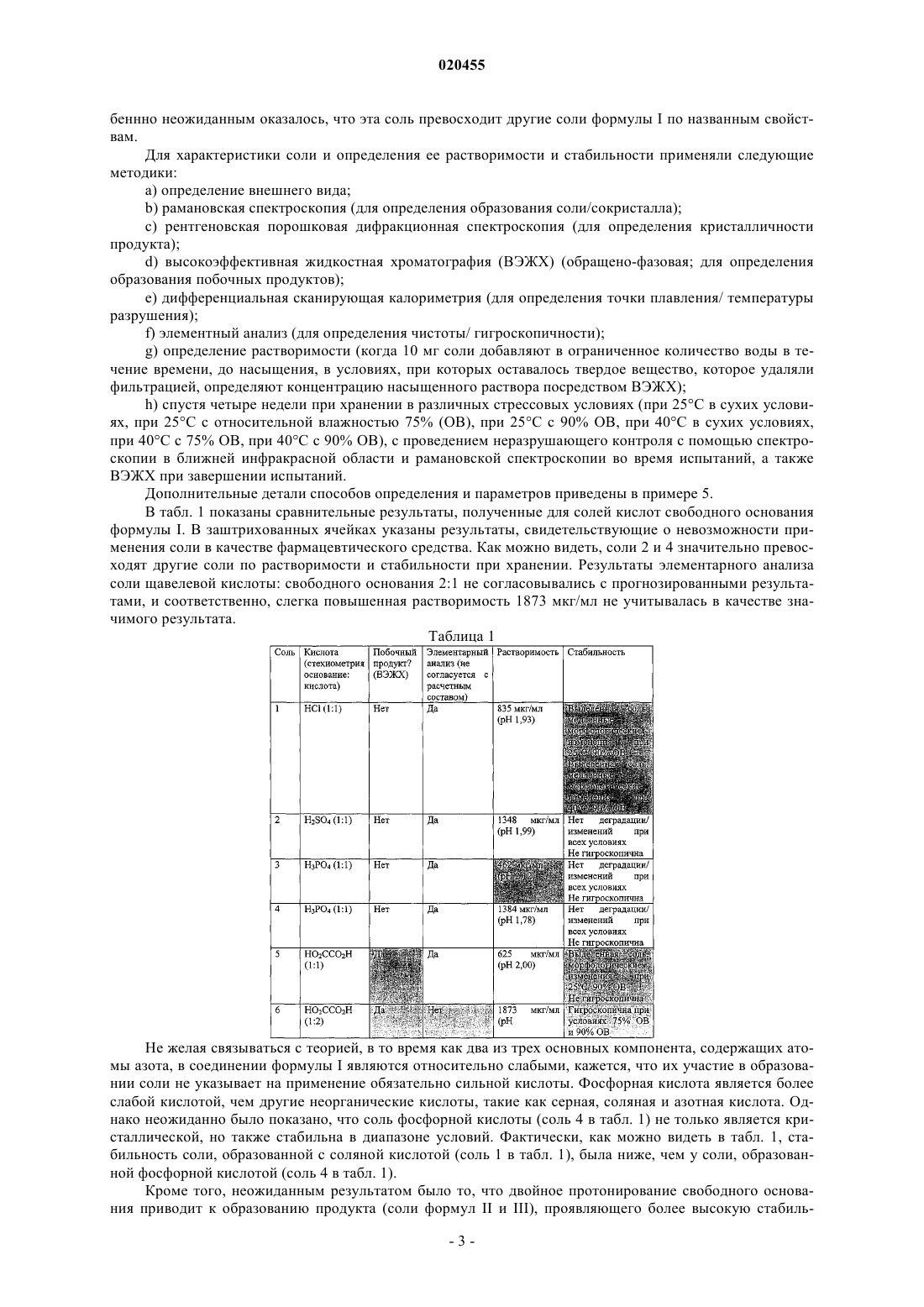
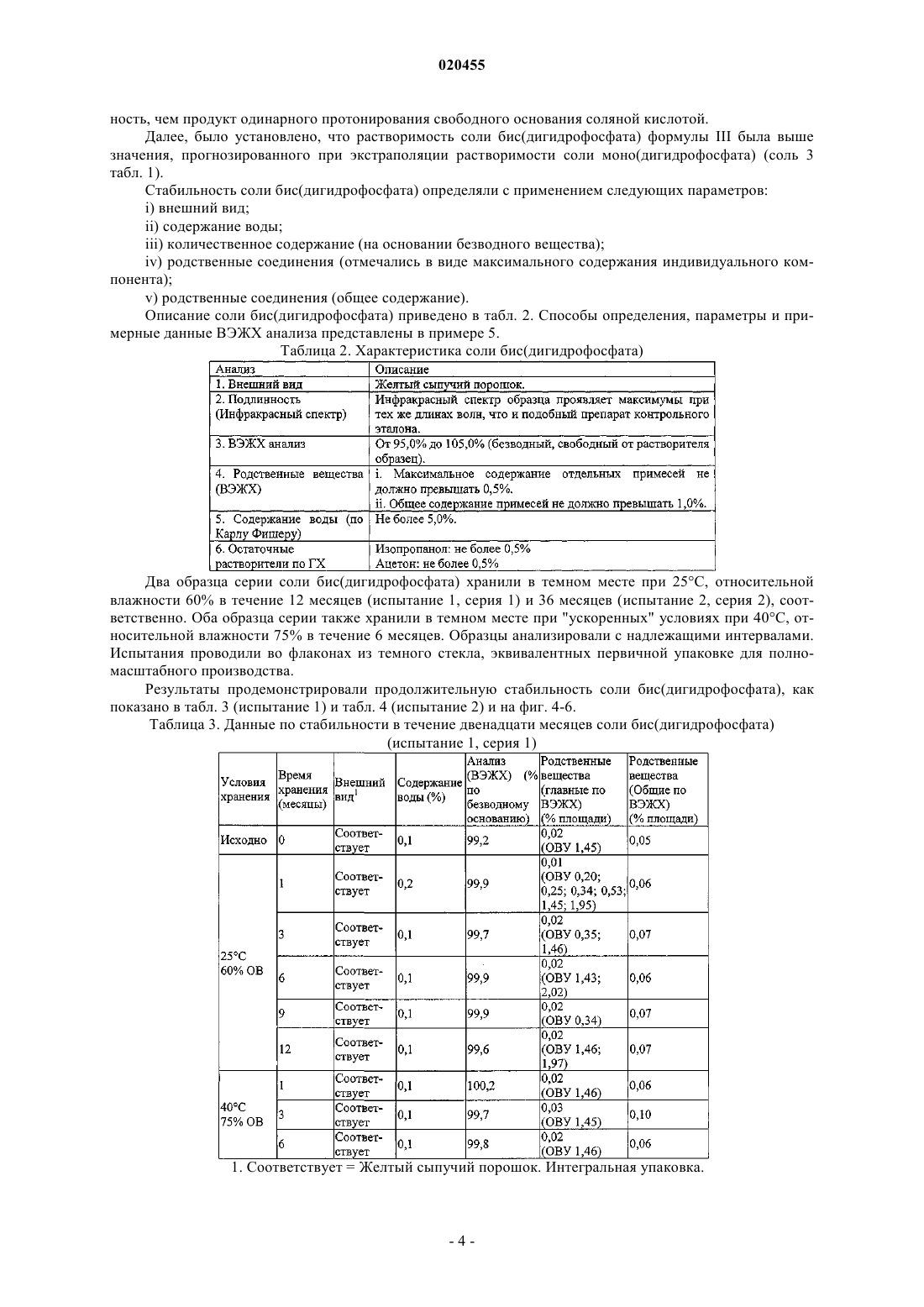
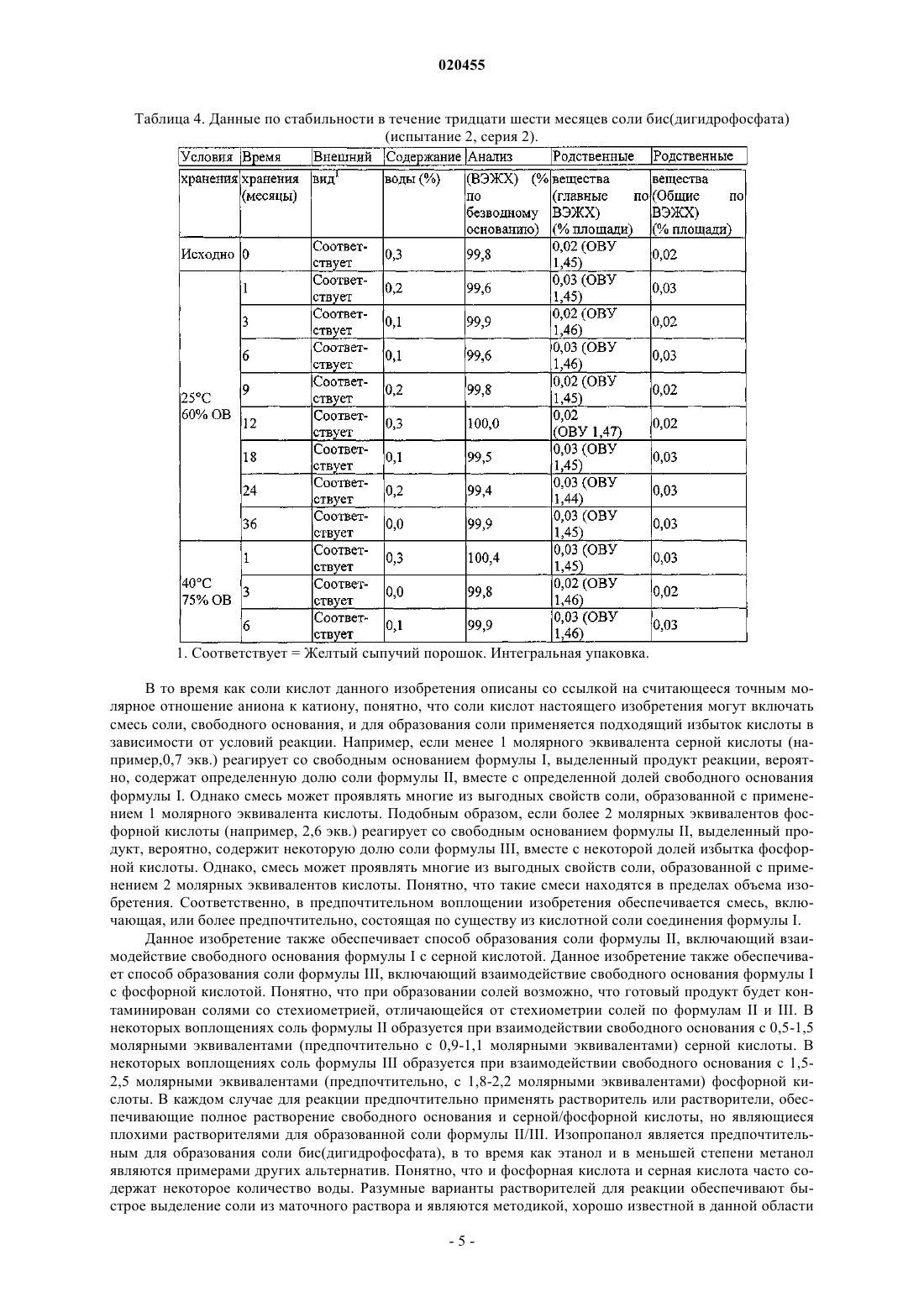
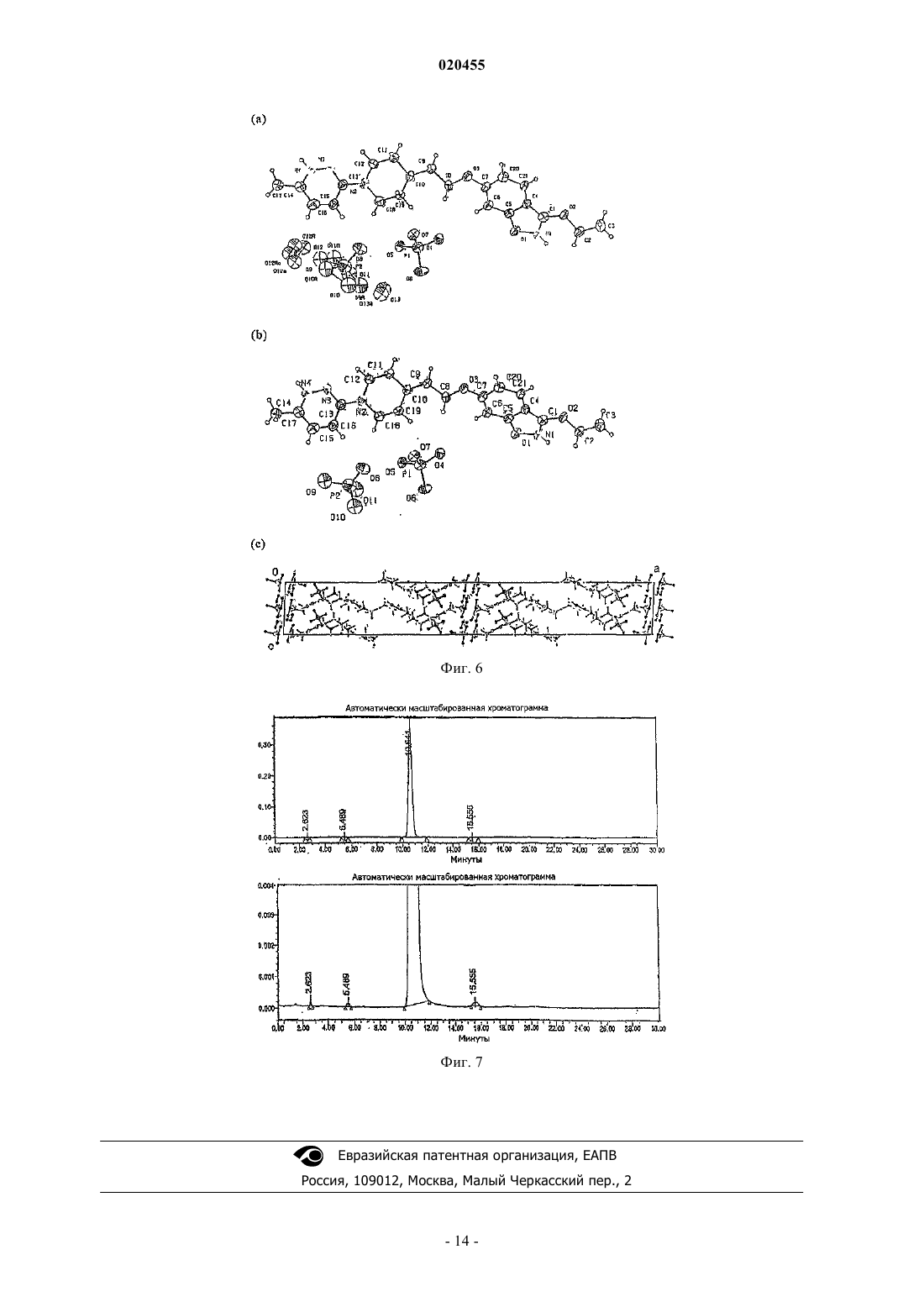
БИС(ДИГИДРОФОСФАТНАЯ) СОЛЬ 6-2-[1-(6-МЕТИЛ-3-ПИРИДАЗИНИЛ)-4 ПИПЕРИДИНИЛ]ЭТОКСИ-3-ЭТОКСИ-1,2-БЕНЗИЗОКСАЗОЛА (1:2), СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ В КОМПОЗИЦИИ И СПОСОБЕ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ПИКОРНАВИРУСНЫХ ИНФЕКЦИЙ Данное изобретение относится к противовирусному агенту, а именно к бис(дигидрофосфатной) соли 6-2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси-3-этокси-1,2-бензизоксазола (1:2),пригодной для лечения инфекций, вызванных вирусами семейства Picornaviridae, такими как риновирус человека (HRV), и способе ее получения. Изобретение также относится к применению этих солей для лечения пикорнавирусных инфекций. Соль по изобретению особенно пригодна для лечения HRV, однако нужно понимать, что изобретение также применимо к другим вирусам из семейства пикорнавирусов. Райан Джейн, Бат Маргарет Энн (AU) Агуреев А.П. (RU)(71)(73) Заявитель и патентовладелец: БАЙОТА САЙЕНТИФИК МЕНЕДЖМЕНТ ПТИ ЛТД. (AU) Область техники, к которой относится изобретение Данное изобретение относится к противовирусным агентам, в частности к соли, пригодной для лечения инфекций, вызываемых вирусами семейства Picornaviridae, такими как риновирус человека (ЧРВ),и способу ее приготовления. Изобретение также относится к применению этой соли в лечении инфекций,обусловленных пикорнавирусами. Соль данного изобретения особо пригодна для применения при лечении ЧРВ, однако понятно, что изобретение также применимо к другим вирусам из семейства пикорнавирусов. Предшествующий уровень техники Риновирусы человека (ЧРВ) - это специфические пикорнавирусы, которые являются наиболее распространенными инфекционными вирусными агентами респираторной системы. Действительно, они являются основной причиной "простуды". Вирусные частицы состоят из модульной белковой капсулы(капсида), покрывающей короткую одноцепочечную РНК. Одним из специфических антипикорнавирусных соединений, действующих как ингибитор, связывающийся с капсидой, и прошедших недавние клинические испытания на людях, является 4-[2-[1-(6 метил-3-пиридазинил)-4-пиперидинил]этокси]бензоат, известный также как "Пиродавир". Пиродавир,являясь липофильным соединением, обладает плохой растворимостью в воде, и часто вводится в состав рецептур с циклодекстриновым носителем. Полученный комплекс обладает более высокой растворимостью в водной среде, и обеспечивает доставку лекарства такими средствами, как назальный спрей. Однако было показано, что легкое эндогенное расщепление эфирного компонента в пиродавире ведет к плохой биодоступности молекулы, независимо от выбранного носителя. Кроме того, было показано, что помимо стоимости, циклодекстриновые молекулы-хозяева имеют другие недостатки при составлении рецептур фармацевтических средств (Int. J, Pharm., 2002, 246, 25-35). Другое подающее надежды антипикорнавирусное соединение, "Плеконарил", как было установлено, проявляет нежелательные эффекты при взаимодействии с принимаемыми пациентом препаратами пероральных контрацептивов. Ясно, что имеется потребность в антипикорнавирусном соединении, проявляющем необходимую растворимость в воде, стабильном при физиологических условиях и проявляющем мало нежелательных побочных эффектов. Кроме того, необходимо, чтобы такое соединение можно было относительно легко получить, и оно было устойчивым при хранении в твердой форме и в форме раствора. Сущность изобретенияWO 2002/50045 раскрывает новый класс противовирусных соединений, которые, как было установлено, обладают особо благоприятными противовирусными свойствами. Неожиданно было установлено,что бис(дигидрофосфатная) соль 6-2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси-3-этокси-1,2 бензизоксазола (1:2) соединения 35 из таблицы 3 WO 2002/50045, обладает особым преимуществом по сравнению с другими соединениями, предлагаемыми в настоящее время для лечения пикорнавирусов. Соединение 35 ("свободное основание" - представленное формулой I ниже), как было показано, проявляет мощную активность против HRV2 (IC50 0,001 мкг/мл) и HRV14 (IC50 0,005 мкг/мл). Эти анализы проводили с применением диметилсульфоксида (ДМСО) в качестве несущего растворителя. Химическое наименование соединения формулы I - 6-2-[1-(6-метил-3-пиразинил)-4-пиперидинил]этокси-3-этокси 1,2-бензизоксазол. Особо предпочтительной стехиометрической формой соли свободного основания (формулы I) в соответствии с изобретением является соль фосфорной кислоты (2 эквивалента) со свободным основанием. В соответствии с одним аспектом изобретение обеспечивает соль фосфорной кислоты (2 экв.) свободного основания соединения формулы I. Эта соль обладает следующими свойствами:a) она проявляют мощную биологическую активность, подобную свободному основанию (например, ЕС 50 против риновируса человека составляет 14,4 нМ для свободного основания соединения формулы I и 17,7 нМ для соли фосфорной кислоты (2 экв.) свободного основания соединения формулы I);b) она обладает существенно более высокой растворимостью в воде по сравнению с другими солями свободного основания, а также с самим свободным основанием;c) ее легко получить и легко очистить; иd) она легко кристаллизуется, и эта кристаллическая соль устойчива как в маточном растворе, так и в изолированной форме. Эти свойства считают особо необходимыми для получения соли свободного основания биологически активной молекулы, облегчения обработки, составления рецептур и т.д. В другом аспекте изобретение обеспечивает фармацевтические композиции, содержащие указанную соль и один или несколько носителей. В другом аспекте изобретение обеспечивает способ образования соли фосфорной кислоты, вклю-1 020455 чающий этап взаимодействия свободного основания с фосфорной кислотой. Предпочтительно свободное основание взаимодействует примерно с 2 молярными эквивалентами фосфорной кислоты, более предпочтительно примерно с 1,8-2,2 молярными эквивалентами фосфорной кислоты. В другом аспекте данное изобретение обеспечивает применение соли по изобретению в производстве медикамента для лечения субъекта от пикорнавирусной инфекции. В другом аспекте данное изобретение обеспечивает применение соли по изобретению в производстве медикамента для профилактики пикорнавирусной инфекции у нуждающегося в профилактике субъекта. Краткое описание чертежей Фиг. 1 является изображением, полученным с помощью сканирующей электронной микроскопии(СЭМ) кристаллов соли фосфорной кислоты (2 экв.) соединения формулы I в соответствии с предпочтительным воплощением изобретения. Фиг. 2 является спектром порошковой рентгеновской дифрактометрии соли фосфорной кислоты (2 экв.) соединения формулы I в соответствии с предпочтительным воплощением изобретения. Расчетные значения пиков 29 (0,2) составили 3,3, 6,7, 12,8, 13,3, 14,1, 19,2, 20,0, 21,1 и 22,4. Фиг. 3 показывает результаты определения содержания воды, полученные в испытании 1 и испытании 2, как описано в табл. 3 и 4, для соли бис(дигидрофосфат) в соответствии с предпочтительным воплощением изобретения. Фиг. 4 показывает результаты определения количественного содержания безводного вещества, полученные в испытании 1 и испытании 2, как описано в табл. 3 и 4, для соли бис(дигидрофосфата) в соответствии с предпочтительным воплощением изобретения. Фиг. 5 показывает результаты определения общего содержания родственных веществ, полученные в испытании 1 и испытании 2, как описано в табл. 3 и 4, для соли бис(дигидрофосфата) в соответствии с предпочтительным воплощением изобретения. Фиг. 6 является рентгеновской кристаллической структурой соли бис(дигидрофосфата) соли в предпочтительном воплощении изобретения, (а) демонстрирующей асимметричный блок, показывающий разупорядоченность Н 2 РО 4 и Н 2 О (ORTEP чертеж показывает 30% вероятность эллипсоидов), (b) демонстрирующей асимметричный блок, показывающий разупорядоченности удаленных Н 2 О молекул и Н 2 РО 4 (ORTEP чертеж показывает 30% вероятность эллипсоидов), (с) демонстрирующей уплотнение поb-оси. Фиг. 7 показывает типичную ВЭЖХ хроматограмму соли бис(дигидрофосфата) в соответствии с предпочтительным воплощением изобретения. Можно предположить, что соль диссоциирует, по меньшей мере до некоторой степени, при анализе в этих условиях. Подробное изложение сущности изобретения Не желая быть связанными какой-либо теорией, авторы считают, что из атомов азота, присутствующих в соединении формулы I, только атом азота из пиперидинила быстро протонируется кислотой. Два других основных компонента, содержащих атомы азота в молекуле (бензизоксазолил и пиридазинил), являются относительно слабыми основаниями, и считается, что только реакция любой из этих групп с сильной кислотой может привести к образованию устойчивой соли кислоты. С другой стороны,также считается, что свободное основание соединения чувствительно к воздействию сильных кислот, что представляет другую проблему для повышения растворимости свободного основания в воде - достижение баланса между образованием стабильной соли и разрушением молекулы. Неожиданно в настоящее время установлено, что реакция свободного основания (формула I) примерно с 2 молярными эквивалентами фосфорной кислоты приводит опять же к образованию соли бис(дигидрофосфата) биспротонированного свободного основания (формула III), без какой-либо видимой деградации. Как применяется здесь, эта соль представляет собой соль 6-2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси 3-этокси-1,2-бензизоксазол бис(дигидрофосфат) (1:2). Обозначение "(1:2)" означает молярное отношение бис-протонированного конъюгата кислоты свободного основания формулы I к дигидрофосфат-аниону. Одновременно с тем, что эта соль активного соединения может проявлять одно или несколько свойств, которые делают е пригодной для применения в качестве фармацевтического средства, осо-2 020455 беннно неожиданным оказалось, что эта соль превосходит другие соли формулы I по названным свойствам. Для характеристики соли и определения ее растворимости и стабильности применяли следующие методики:c) рентгеновская порошковая дифракционная спектроскопия (для определения кристалличности продукта);d) высокоэффективная жидкостная хроматография (ВЭЖХ) (обращено-фазовая; для определения образования побочных продуктов);e) дифференциальная сканирующая калориметрия (для определения точки плавления/ температуры разрушения);g) определение растворимости (когда 10 мг соли добавляют в ограниченное количество воды в течение времени, до насыщения, в условиях, при которых оставалось твердое вещество, которое удаляли фильтрацией, определяют концентрацию насыщенного раствора посредством ВЭЖХ);h) спустя четыре недели при хранении в различных стрессовых условиях (при 25 С в сухих условиях, при 25 С с относительной влажностью 75% (ОВ), при 25 С с 90% ОВ, при 40 С в сухих условиях,при 40 С с 75% ОВ, при 40 С с 90% ОВ), с проведением неразрушающего контроля с помощью спектроскопии в ближней инфракрасной области и рамановской спектроскопии во время испытаний, а также ВЭЖХ при завершении испытаний. Дополнительные детали способов определения и параметров приведены в примере 5. В табл. 1 показаны сравнительные результаты, полученные для солей кислот свободного основания формулы I. В заштрихованных ячейках указаны результаты, свидетельствующие о невозможности применения соли в качестве фармацевтического средства. Как можно видеть, соли 2 и 4 значительно превосходят другие соли по растворимости и стабильности при хранении. Результаты элементарного анализа соли щавелевой кислоты: свободного основания 2:1 не согласовывались с прогнозированными результатами, и соответственно, слегка повышенная растворимость 1873 мкг/мл не учитывалась в качестве значимого результата. Таблица 1 Не желая связываться с теорией, в то время как два из трех основных компонента, содержащих атомы азота, в соединении формулы I являются относительно слабыми, кажется, что их участие в образовании соли не указывает на применение обязательно сильной кислоты. Фосфорная кислота является более слабой кислотой, чем другие неорганические кислоты, такие как серная, соляная и азотная кислота. Однако неожиданно было показано, что соль фосфорной кислоты (соль 4 в табл. 1) не только является кристаллической, но также стабильна в диапазоне условий. Фактически, как можно видеть в табл. 1, стабильность соли, образованной с соляной кислотой (соль 1 в табл. 1), была ниже, чем у соли, образованной фосфорной кислотой (соль 4 в табл. 1). Кроме того, неожиданным результатом было то, что двойное протонирование свободного основания приводит к образованию продукта (соли формул II и III), проявляющего более высокую стабиль-3 020455 ность, чем продукт одинарного протонирования свободного основания соляной кислотой. Далее, было установлено, что растворимость соли бис(дигидрофосфата) формулы III была выше значения, прогнозированного при экстраполяции растворимости соли моно(дигидрофосфата) (соль 3 табл. 1). Стабильность соли бис(дигидрофосфата) определяли с применением следующих параметров:iv) родственные соединения (отмечались в виде максимального содержания индивидуального компонента);v) родственные соединения (общее содержание). Описание соли бис(дигидрофосфата) приведено в табл. 2. Способы определения, параметры и примерные данные ВЭЖХ анализа представлены в примере 5. Таблица 2. Характеристика соли бис(дигидрофосфата) Два образца серии соли бис(дигидрофосфата) хранили в темном месте при 25 С, относительной влажности 60% в течение 12 месяцев (испытание 1, серия 1) и 36 месяцев (испытание 2, серия 2), соответственно. Оба образца серии также хранили в темном месте при "ускоренных" условиях при 40 С, относительной влажности 75% в течение 6 месяцев. Образцы анализировали с надлежащими интервалами. Испытания проводили во флаконах из темного стекла, эквивалентных первичной упаковке для полномасштабного производства. Результаты продемонстрировали продолжительную стабильность соли бис(дигидрофосфата), как показано в табл. 3 (испытание 1) и табл. 4 (испытание 2) и на фиг. 4-6. Таблица 3. Данные по стабильности в течение двенадцати месяцев соли бис(дигидрофосфата) Таблица 4. Данные по стабильности в течение тридцати шести месяцев соли бис(дигидрофосфата) 1. Соответствует = Желтый сыпучий порошок. Интегральная упаковка. В то время как соли кислот данного изобретения описаны со ссылкой на считающееся точным молярное отношение аниона к катиону, понятно, что соли кислот настоящего изобретения могут включать смесь соли, свободного основания, и для образования соли применяется подходящий избыток кислоты в зависимости от условий реакции. Например, если менее 1 молярного эквивалента серной кислоты (например,0,7 экв.) реагирует со свободным основанием формулы I, выделенный продукт реакции, вероятно, содержат определенную долю соли формулы II, вместе с определенной долей свободного основания формулы I. Однако смесь может проявлять многие из выгодных свойств соли, образованной с применением 1 молярного эквивалента кислоты. Подобным образом, если более 2 молярных эквивалентов фосфорной кислоты (например, 2,6 экв.) реагирует со свободным основанием формулы II, выделенный продукт, вероятно, содержит некоторую долю соли формулы III, вместе с некоторой долей избытка фосфорной кислоты. Однако, смесь может проявлять многие из выгодных свойств соли, образованной с применением 2 молярных эквивалентов кислоты. Понятно, что такие смеси находятся в пределах объема изобретения. Соответственно, в предпочтительном воплощении изобретения обеспечивается смесь, включающая, или более предпочтительно, состоящая по существу из кислотной соли соединения формулы I. Данное изобретение также обеспечивает способ образования соли формулы II, включающий взаимодействие свободного основания формулы I с серной кислотой. Данное изобретение также обеспечивает способ образования соли формулы III, включающий взаимодействие свободного основания формулы I с фосфорной кислотой. Понятно, что при образовании солей возможно, что готовый продукт будет контаминирован солями со стехиометрией, отличающейся от стехиометрии солей по формулам II и III. В некоторых воплощениях соль формулы II образуется при взаимодействии свободного основания с 0,5-1,5 молярными эквивалентами (предпочтительно с 0,9-1,1 молярными эквивалентами) серной кислоты. В некоторых воплощениях соль формулы III образуется при взаимодействии свободного основания с 1,52,5 молярными эквивалентами (предпочтительно, с 1,8-2,2 молярными эквивалентами) фосфорной кислоты. В каждом случае для реакции предпочтительно применять растворитель или растворители, обеспечивающие полное растворение свободного основания и серной/фосфорной кислоты, но являющиеся плохими растворителями для образованной соли формулы II/III. Изопропанол является предпочтительным для образования соли бис(дигидрофосфата), в то время как этанол и в меньшей степени метанол являются примерами других альтернатив. Понятно, что и фосфорная кислота и серная кислота часто содержат некоторое количество воды. Разумные варианты растворителей для реакции обеспечивают быстрое выделение соли из маточного раствора и являются методикой, хорошо известной в данной области техники. Альтернативно, можно избежать применения растворителя посредством применения чистой серной кислоты или чистой фосфорной кислоты. В любом случае понятно, что опытный химик может легко модифицировать температуру реакционной смеси во время и/или после реакции для оптимизации образования соли и/или оптимизации выхода соли из реакционной смеси после образования соли. Например, свободное основание и кислоту можно исходно нагреть для влияния на растворение и/или облегчения смешивания, перед охлаждением реакционной смеси для снижения количества соли, остающейся в растворе. Предпочтительно, чтобы соли добавления кислот из настоящего изобретения находились по существу в кристаллической форме. Вместе с тем понятно, что такие соединения могут находиться в частично кристаллической или даже аморфной форме, например, в зависимости от условий, в которых образуется твердый продукт. Эти формы также охватываются данным изобретением. Кроме того, понятно, что некоторые кристаллические соединения могут находиться в различных кристаллических формах - этот феномен известен как полиморфизм. Эти отдельные кристаллические формы и их смеси также охватываются данным изобретением. Понятно, что специалисту в данной области техники известен ряд различных параметров, которые можно изменить для влияния на природу твердого вещества, производимого путем действия кислоты на свободное основание формулы I. Данное изобретение также относится к сольватам (включая гидраты) соли по изобретению формулы II и III. Растворители, используемые для кристаллизации, могут включать спирты (например, метанол, этанол, изо-PrOH), альдегиды, кетоны (например, ацетон), эфиры (например, этилацетат) и воду,каждый из которых, в какой-то степени, неизбежно встраивается в образуемые соли. Количество и размещение молекул(ы) растворителя в образованной соли зависит от таких факторов, как растворитель(и) для кристаллизации, температура, при которой происходит кристаллизация, давление, при котором происходит кристаллизация, скорость кристаллизации, меж- и внутримолекулярные силы, условия хранения и сушки после выделения и т.д. Предпочтительно растворитель, применяемый для образования солевых продуктов, является фармацевтически приемлемым. Данное изобретение также обеспечивает твердые и жидкие фармацевтические композиции, включающие соль по изобретению, предпочтительно в терапевтически эффективном количестве, вместе с одним или несколькими фармацевтически пригодными твердыми и/или жидкими носителями. Как применяется здесь, термин "фармацевтически приемлемый носитель" охватывает такие элементы, как уплотнитель, разбавитель, наполнитель, добавочное или инкапсулирующее вещество, которые можно безопасно использовать при наружном, местном или системном применении. Фармацевтически активные производные из данного изобретения можно легко использовать для составления рецептур с фармацевтически приемлемыми носителями, хорошо известными в данной области техники, такими как ароматизаторы,солюбилизаторы, любриканты, суспендирующие агенты, связующие агенты, консерванты, агенты для дезинтеграции таблеток и инкапсулирующие материалы. Такие носители позволяют составлять рецептуры с соединениями в соответствии с изобретением в виде таких лекарственных форм, как таблетки, порошки, облатки, пастилки, пилюли, капсулы, растворы, гели, сиропы, суспензии и тому подобное. Эти носители широко известны в данной области техники и могут включать сахара, крахмалы, целлюлозу и е производные, солод, желатин, магния карбонат, магния стеарат, тальк, кальция сульфат, растительные масла, синтетические масла, полиолы, альгиновую кислоту, фосфатные буферные растворы, эмульгаторы, пектин, трагакант, легкоплавкий воск, масло какао, изотонический солевой раствор и апирогенную воду. Неожиданные свойства соли по изобретению делают ее особо пригодной для применения в твердых фармацевтических композициях. Например, отсутствие в них гигроскопичности облегчает обработку(взвешивание, транспортировку и т.д.), в то же время, повышая срок их годности после синтеза и выделения. В частности, фармацевтические композиции для перорального применения можно получить путем объединения активных соединений с твердыми наполнителями, при необходимости с перемалыванием полученной смеси, и обработки смеси гранул после добавления подходящих вспомогательных веществ, если необходимо, для получения таблеток или сердцевин (ядра) драже. Подходящие наполнители включают уплотнители, такие как сахара (включая лактозу, глюкозу, сахарозу, маннитол или сорбитол) и препараты целлюлозы, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, камедь трагаканта, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрия карбоксиметилцеллюлоза, а также поливинилпирролидон (ПВП). Если необходимо, могут быть добавлены дезинтегрирующие агенты, такие как поперечно-сшитый поливинилпирролидон, агар, или альгиновая кислота или е соли (такие, как натрия альгинат). Изобретение также обеспечивает сердцевины драже, содержащие подходящие оболочки. С этой целью можно применять концентрированные растворы сахара, которые могут при необходимости содержать гуммиарабик, тальк, по ивинилпирролидон, гель карбопола, полиэтиленгликоль и/или титана диоксид, растворы глазури и подходящие органические растворители или смеси растворителей. В таблетки или оболочки драже можно добавлять красители или пигменты для идентификации или для характеристики различных комбинаций доз активного соединения. В соответствии с предпочтительным воплощением фармацевтическая композиция, содержащая соль по изобретению, готовится для перорального применения. Фармацевтические средства для перорального применения включают твердые капсулы из двух частей, приготовленные из желатина, а также мягкие запечатанные капсулы, приготовленные из желатина и пластификатора, такого как глицерин или сорбитол. Твердые капсулы из двух частей могут содержать активные ингредиенты в смеси с уплотнителем, таким как лактоза, связующими агентами, такими как крахмалы, и/или любрикантами, такими как тальк или магния стеарат и, при необходимости, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин, или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Сравнительно высокая растворимость в воде соли по изобретению делает ее пригодной для применения в фармацевтических композициях, содержащих полярный (особенно водный) растворитель(и). В частности, жидкие фармацевтические композиции, обеспеченные данным изобретением, могут содержать подходящие разбавители и носители, знакомые специалистам в данной области техники, и включать без ограничения солевой раствор, стерильную воду, этоксилированные и не-этоксилированные сурфактанты, поли(этиленгликоль), поли(пропиленгликоль), жирные спирты, жирные кислоты, углеводородные масла (такие как пальмовое масло, кокосовое масло, и минеральное масло), воски масла какао,силиконовые масла, регуляторы рН, производные целлюлозы, эмульгирующие агенты, такие как неионные органические и неорганические основания, синтетические камеди, смолы, консерванты, эфиры воска, стероидные спирты, триглицеридные эфиры, фосфолипиды, такие как лецитин и цефалин, эфиры многоатомных спиртов, эфиры жирных спиртов, гидрофильные производные ланолина, гидрофильные производные пчелиного воска и молекулы-хозяева, такие как циклодекстрины (например, -, - и/или циклодекстрин), которые могут модифицировать экспозицию частей молекул-гостей (например, солей изобретения) к растворителю. Композиции данного изобретения также можно применять в респираторном тракте в виде интраназального или внутрилегочного аэрозоля для ингаляций с распылителем, или в виде сверхтонкого порошка (предпочтительно с частицами размером порядка 1-10 мкм или меньше) для введения, по отдельности или в комбинации с инертным носителем, таким как лактоза, или с другими фармацевтически пригодными наполнителями. Рецептуры аэрозолей включают те, в которых соль обеспечена в упаковке под давлением с подходящим пропеллентом, таким как хлорфторуглерод (ХФУ), например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. Аэрозоль может для удобства также содержать сурфактант, такой как лецитин. Дозировка лекарственного средства может контролироваться путем обеспечения дозирующего клапана. Соль может также обеспечиваться в фармацевтической рецептуре, образующей гель в носовой полости. Порошковая композиция может быть представлена в форме разовой дозы, например, в капсулах или картриджах, например, из желатина, или в блистерных упаковках, порошок из которых можно применять посредством ингалятора. Соответственно, в другом предпочтительном воплощении фармацевтическая композиция, содержащая соль по изобретениею, выполняется для интраназального применения. Фармацевтические композиции данного изобретения могут быть обеспечены для замедленного высвобождения активного соединения. Предпочтительно фармацевтические композиции данного изобретения представлены в форме разовых доз. Фармацевтические композиции данного изобретения могут также содержать один или несколько других лечебных и/или профилактических ингредиентов. Соли в соответствии с изобретением могут быть пригодны в комбинации с хорошо известными противовирусными или противо-ретровирусными агентами или другими фармацевтическими средствами, используемыми в лечении вирусных инфекций. Типичные примеры этих дополнительных фармацевтических средств включают иммуномодуляторы,иммуностимуляторы, антибиотики и противовоспалительные средства. Примеры противовирусных агентов включают занамивир, римантидин, амантидин, рибавирин, АЗТ, ламивудин, (-) эмтрицитабин, ацикловир, фамцикловир, пенцикловир, диданозин, зальцитабин, ганцикловир, сакванивир, ловирид, другие не-нуклеотидные ингибиторы обратной транскриптазы (ОТ) и ингибиторы протеаз, противовирусные и антирецепторные антитела и аналоги рецепторов, таких как ICAM-1. Примеры иммуномодуляторов и иммуностимуляторов включают различные препараты интерлейкинов, цитокинов и антител. Примеры антибиотиков включают противогрибковые агенты и антибактериальные агенты. Примеры противовоспалительных агентов включают глюкокортикоиды и нестероидные противовоспалительные соединения. Как применяется здесь, термин "эффективное количество" относится к количеству одного или нескольких активных веществ, эффективных для достижения необходимого результата у субъекта, нуждающегося в лечении или профилактике, либо в единичной дозе, либо как части из серий. Такой эффект может быть измерен, например, по уменьшению числа частиц конкретного вируса или вирусов, или по облегчению симптомов у субъекта. Эффективное количество варьирует в зависимости от здоровья и физического состояния индивидуума, получающего лечение, таксономической группы субъекта, получающего лечение, рецептуры композиции, оценки клинического случая и других существенных факторов. Количество фармацевтически активного соединения(ий), которое предполагается применить, может за-7 020455 висеть от субъекта, получающего лечение, включая возраст, пол, массу тела и общее состояние здоровья. Ожидается, что эффективное количество находится в пределах относительно широкого диапазона, который можно определять посредством рутинных испытаний. В некоторых случаях применение "эффективного количества" активного вещества может вызвать 50% уменьшение симптомов и/или числа соответствующих вирусных частиц у субъекта. Доза активных соединений, применяемых у субъекта, должна быть достаточной для достижения благоприятного ответа у субъекта по прошествии времени, такого как уменьшение или облегчение симптомов вирусной инфекции. В этом отношении, точные количества активного соединения(ий) для применения будут зависеть от мнения практикующего врача. При определении эффективного количества активного соединения(ий), подлежащего применению, врач может оценивать тяжесть симптомов, связанных с вирусной инфекцией, и/или применять некоторые другие средства определения степени вирусной инфекции. Рецептуры, содержащие одну сотню (100) миллиграмм активного ингредиента, или более широко, от 0,1 до четырехсот (400) мг на таблетку, являются, соответственно, подходящими типичными лекарственными формами. Как применяется здесь, термины "субъект", или "индивидуум", или "пациент" могут применяться взаимозаменяемо и относиться к любому субъекту, предпочтительно к позвоночному субъекту, и еще более предпочтительно к млекопитающему субъекту, для которого необходимо лечение или профилактика. Наиболее предпочтительно субъект является человеком, нуждающимся в лечении или профилактике вируса, предпочтительно семейства пикорнавирусов, особенно ЧРВ. В другом аспекте изобретение обеспечивает применение соли в производстве медикамента для лечения субъекта от пикорнавирусной инфекции. В другом аспекте изобретение обеспечивает применение соли в производстве медикамента для профилактики пикорнавирусной инфекции у субъекта, нуждающегося в профилактике. Пикорнавирусная инфекция может быть вызвана любым вирусом из семейства Picornaviridae. Типичные члены семейства включают человеческие риновирусы, полиовирусы, энтеровирусы, включая коксакивирусы и эховирусы, гепатовирус, кардиовирусы, афтовирус, вирус гепатита А и другие пикорнавирусы, не относящиеся к конкретным родам, включая один или несколько серотипов этих вирусов. Предпочтительно, изобретение применяется для профилактики или лечения инфекции, вызванной риновирусом, относящимся к одному или нескольким серотипам. Термины "лечение" и "обработка", применяемые здесь, охватывают любое лечение состояния или заболевания у субъекта, предпочтительно у млекопитающего (млекопитающего животного или человека), более предпочтительно у человека, и включают: (i) ингибирование вирусной инфекции, т.е. остановку е развития; (ii) ослабление инфекции, т.е. стимуляцию снижения тяжести инфекции; или (iii) облегчение состояния, вызванного инфекцией, т.е. симптомов инфекции. Термины "профилактика" и "предотвращение", применяемые здесь, охватывают предотвращение или профилактику состояния или заболевания у субъекта, предпочтительно у млекопитающего (млекопитающего животного или человека), более предпочтительно у человека, и включают профилактику вирусной инфекции у субъекта, предрасположенного к инфекции, но у которого не поставлен диагноз инфекции. Далее изобретение описано со ссылкой на примеры. Необходимо понять, что конкретность следующего описания не заменяет общие положения предшествующего описания изобретения. Пример 1. 6-2-[1-(6-Метил-3-пиридазинил)-4-пиперидинил]этокси-3-этокси-1,2-бензоксазола фосфат [формула III] Свободное основание формулы I добавляют к изопропанолу (24 л). Суспензию нагревают с обратным холодильником, растворяя основание. Водный раствор фосфорной кислоты (81% м/м, 0,63 кг, 2,1 экв.) в изопропаноле (2,3 л) нагревают до 80 С, перед быстрым добавлением при перемешивании в дефлегмируемый раствор свободного основания. Немедленно выпадает осадок. Суспензию перемешивают при температуре 78-82 С в течение 5 мин перед охлаждением до комнатной температуры. Твердый продукт промывают изопропанолом (310 л), затем ацетоном (310 л) перед высушиванием при 40 С под вакуумом до постоянной массы, получая соединение в виде ярко-желтого твердого кристаллического вещества (1,5 кг, 97%). Пример 2. Фармацевтические композиции, содержащие соль формулы III, готовят путем заполнения коричневых жестких желатиновых капсул 0 размера солью и добавления до необходимой массы безводной глюкозы. Состав капсул приведен в табл. 5. Дост.кол. = количество, достаточное для достижения предварительно заданного веса заполнения. Пример 3. Рентгеновская кристаллография. Получают рентгеновские кристаллические структуры соли бис(дигидрофосфата) после рекристаллизации из метанола. Моногидрат соли бис(дигидрофосфата) (молекулярная формула [C21H28N4O3](H2PO4)2(H2O. Для рекристаллизации соли бис(дигидрофосфата) оценивали шесть различных растворителей (этанол, метанол, ацетон, тетрагидрофуран, ацетонитрил и 2-пропанол). Был выбран метанол, поскольку он показал наилучшую растворимость соли при повышенной температуре. 20 мг соли бис(дигидрофосфата) растворяли в теплом метаноле при 40 С, а затем медленно охлаждали до комнатной температуры, позволяя образоваться желтым кристаллам. Желтый кристалл устанавливали в дифрактометрической системе с пластиной изображения Stoe Mark II (StoeCie, 2002), оснащенной графитовым монохроматором. Сбор данных проводили при -100 С с применением Мо-K излучения (= 0.71073 ). Было получено 180 экспозиций по 10 минут на экспозицию при расстоянии пластины изображения 135 мм,= 0 и 0180 с осцилляцией кристалла через 1 в . Разрешение составило D мин - D макс 0,82 - 24,00 . Соль бис(дигидрофосфат) кристаллизовали в центросимметричной моноклинной ячейке, пространственная группа P21/c. Соединение кристаллизовали в виде ди-катиона с двумя Н 2 РО 4- анионами и одной сильно разупорядоченной молекулой воды. Была установлена разупорядоченность для одного из двух анионов, приводящая к частичному заполнению атомов O9, О 10, O11, О 9 а, O10 а и O11 а (заполнение 0.5). Для Н 2 РО 4- анионов не было найдено атомов водорода, но они были включены в расчеты. Разупорядоченные и частично заполненные молекулы воды были уточнены в изотропном приближении. Для молекул воды не было найдено атомов водорода, но они были включены в расчеты. Структуру этого соединения определяли прямыми способами с помощью программы SHELXS-97(Sheldrick, G.M., Acta Cryst. (2008) А 64, 112-122) и уточняли по полной матрице наименьших квадратов по F (Spek, A. L. J. Appl. Cryst. (2003) 36, 7-13) с SHELXH-97. Атомы водорода N-H были получены по разностным картам Фурье, а затем обработаны как верхние атомы, в то время как оставшиеся атомы водорода были прямо включены в расчетные позиции и обработаны как верхние атомы с применением параметров SHELXH-97 по умолчанию. Все не-водородные атомы были уточнены в анизотропном приближении. Не применяли поправку на поглощение. Кристалл слабо дифрагировал относительно своего размера (0,450,400,05 мм). Кристаллы были получены в виде очень тонких пластин. Структуру уточняли с применением приемлемых стандартных неопределенностей для длины связей и углов. Рентгенокристаллографические данные для соли бис(дигидрофосфата) Кристаллографические данные Форма кристалла: пластинчатая. Цвет кристалла: желтый. Размер кристалла 0,450,400,05 мм. Эмпирическая формула C21H34N4O12P. Молекулярная масса: 596.46. Кристаллическая система: моноклинная. Пространственная группа: С 2/с. Параметры ячейки: а = 54.964(14) А альфа = 90 град.; b= 12.692(2) А бета = 91.931(18) град.; с = 7.8918(15) А гамма = 90 град. Объем: 5502(2) 3. Параметры уточнения ячейки: рефлексы 4485; диапазон угла 1.48 тета 21.98; Z = 8. Плотность (расчетная) 1.440 г/см 3. Излучение MoK. Длина волны 0.71073 А. Коэффициент линейного поглощения 0.226 мм-1. Температура 173(2) K. Подробности сбора данных Дифрактометр STOE IPDS 2. Способ сканирования - метод вращения. Количество измеренных рефлексов 19426. Количество независимых рефлексов 3608. Количество наблюдаемых рефлексов 1416. Критерий распознавания 2 сигма(I). R(int) = 0.2505. Тета-диапазон для сбора данных 1.48 - 22.50 град. Интервальный индекс: -58=h=58, -13=k=13, -8=l=8; F(000) 2512. Подробности уточнения Способ уточнения по полной матрице наименьших квадратов по F2. Окончательные R индексы[=SUM(FoHFc)/SUMFo]; wR2 =[SUM(w(Fo2-Fc2)2)/SUM(wFo4)]1/2. Метод Н-размещения и уточнения; количество рефлексов 3608; число ограничений наименьших квадратов 7; число уточненных параметров 342; критерий соответствия F2 0.928. S =[SUM w(Fo2-Fc2)2]/(n-p)1/2 n= количествоP=(Fo2+2Fc2)/3; максимум дельта/сигма 0.000; максимум е-плотности 0.610 е.А-3; минимум еплотности -0.417 е.А-3. Использованные компьютерные программы Программа сбора данных STOE X-AREA; программа уточнения ячейки STOE X-AREA; программа преобразования данных STOE X-RED; программа определения структуры SHELXS-97 (Sheldrick, 1990); программа уточнения структуры SHELXL-97 (Sheldrick, 1997). Пример 4. Способы и параметры определения характеристик соли. Соль в соответствии с изобретением характеризовали с применением следующих способов и параметров. Параметры для рамановских измерений. Спектрометр: рамановский спектрометр Bruker RFS 100/S. Мощность возбуждения лазера: 400 мВт. Разрешение: 2 см-1. Число сканирований: 128. Диапазон обнаружения: 3300-0 см-1. Размер щели: 5,0 мм. Тип флакона: стеклянный флакон формата RPD 96-луночного планшета или стеклянный флакон формата RPD 96-луночного планшета с покрытием из фторированного этилен-пропилена. Размещение образца: оптимизировано для наилучшей интенсивности сигнала. Предварительная обработка спектра: линейная коррекция по базовой линии, нормализация. Параметры для измерений в ближней инфракрасной области спектра. Спектрометр: спектрометр для ближней инфракрасной области Brucker Vector 22. Разрешение: 2 см-1. Число сканирований: 64. Диапазон обнаружения: 833-2500 нм. Размер щели: 5,0 мм. Тип флакона: стеклянный флакон формата RPD 96-луночного планшета. Предварительная обработка спектра: линейная коррекция по базовой линии. Получение ПЗС-изображения. Камера: Sony XCD-C710CR. Объектив: Navitar Precision Eye (Тубус арт. 1-61449 с насадками 1.33 X (арт.1-41448) и 0.5 X(арт.1-60110). Рентгеновская порошковая дифракция. Спектрометр: дифрактометр Stoe Stadip. Детектор/геометрия: позиционно-чувствительный детектор/ геометрия Дебая-Шерера. Источник рентгеновского излучения: Cu K альфа. Режим измерения: трансмиссия в 0,5 мм капилляре. Элементарный анализ. Для определения элементарного состава использовали следующие способы: С, Н, N: термическое разложение и количественное определение в потоке отходящего газа (приборCl: определение посредством ионной хроматографии после разложения по методу Шнигера.S: термическое разложение и количественное определение в потоке отходящего газа с применением ИК детектора (прибор LECO-CHN-932). Р: фотометрическое определение после микроволнового разложения. Дифференциальная сканирующая калориметрия. ДСК анализ проводили с применением дифференциального сканирующего калориметра Mettler Toledo со скоростью нагревания 5 С в минуту. Определение растворимости. Примерно 10 мг соли добавления кислоты уравновешивали в течение 24 часов при 25 С с деионизованной водой. Суспензию фильтровали, определяли содержание свободного основания посредством ВЭЖХ и измеряли рН насыщенных растворов. ВЭЖХ анализ. Анализируемый раствор соли добавления кислоты готовили путем растворения 10,0 мг соли в смеси ацетонитрил: этанол = 1:1 и разбавляли до концентрации 1,0 мг/мл. Примерные данные ВЭЖХ анализа для соли бис(дигидрофосфата). Хроматографические условия. В этих условиях время удерживания для соли бис(дигидрофосфата) составило примерно 9-11 мин. Примерная ВЭЖХ хроматограмма, показанная на фиг. 9, имеет следующие пики: Стабильность. Примерно 30 мг соли хранили в 96-луночных стеклянных флаконах в течение четырех недель в следующих условиях: 25 С / сухие условия 25 С /75% относительной влажности 40 С / сухие условия 40 С / 75 % относительной влажности Во время хранения анализируемых образцов получали спектры в ближней инфракрасной области и рамановские спектры (неразрушающий контроль) в предварительно заданные моменты времени. Набор данных для спектров в ближней инфракрасной области и рамановских спектров анализировали по отношению к гигроскопичности (спектры в ближней инфракрасной области), морфологическим изменениям(спектры в ближней инфракрасной области и рамановские спектры) и химическим изменениям анализируемого вещества. ВЭЖХ анализируемых веществ проводили по окончании периода хранения. В данном описании и формуле изобретения, если в контексте не требуется иного, слово"включать" и его вариации, такие как "включает" и "включающий", подразумевают включение установленного целого числа или этапа, или группы целых чисел или этапов, но не исключение какого-либо другого целого числа или этапа, или группы целых чисел или этапов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Бис(дигидрофосфатная) соль 6-2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси-3-этокси 1,2-бензизоксазола (1:2). 2. Бис(дигидрофосфатная) соль по п.1, которая является кристаллической. 3. Бис(дигидрофосфатная) соль по п.2, имеющая рентгеновскую порошковую дифрактограмму с 2(0,2) пиками при 3,3, 6,7, 12,8, 13,3, 14,1, 19,2, 20,0, 21,1 и 22,4. 4. Бис(дигидрофосфатная) соль по любому из пп.1-3, которая находится в форме физиологически пригодного сольвата или гидрата. 5. Фармацевтическая композиция для лечения или предотвращения пикорнавирусной инфекции,содержащая бис(дигидрофосфатную) соль по любому из пп.1-4 вместе с одним или несколькими фармацевтически пригодными носителями. 6. Фармацевтическая композиция по п.5, дополнительно содержащая глюкозу. 7. Пероральная форма фармацевтической композиции по п.5 или 6. 8. Интраназальная форма фармацевтической композиции по п.5. 9. Фармацевтическая композиция по п.5, где пикорнавирусная инфекция представляет собой риновирус человека (HRV). 10. Применение соединения по любому из пп.1-4 в производстве медикамента для лечения или профилактики пикорнавирусной инфекции. 11. Применение по п.10, при котором пикорнавирусная инфекция является инфекцией, вызванной риновирусом человека (HRV). 12. Способ получения бис(дигидрофосфатной) соли по п.1 или 3, включающий этап взаимодействия 6-2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси-3-этокси-1,2-бензизоксазола примерно с 2 мол. экв. фосфорной кислоты.
МПК / Метки
МПК: A61P 31/16, A61K 31/50, A61K 31/423, C07D 413/14, A61K 31/444
Метки: применение, композиции, способ, получения, бис(дигидрофосфатная, предотвращения, лечения, способе, 1,2, 6-{2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси}-3-этокси-1,2-бензизоксазола, пикорнавирусных, инфекций, соль
Код ссылки
<a href="https://eas.patents.su/15-20455-bisdigidrofosfatnaya-sol-6-2-1-6-metil-3-piridazinil-4-piperidiniletoksi-3-etoksi-12-benzizoksazola-12-sposob-ee-polucheniya-i-ee-primenenie-v-kompozicii-i-sposobe-lecheniya-ili-pr.html" rel="bookmark" title="База патентов Евразийского Союза">Бис(дигидрофосфатная) соль 6-{2-[1-(6-метил-3-пиридазинил)-4-пиперидинил]этокси}-3-этокси-1,2-бензизоксазола (1:2), способ ее получения и ее применение в композиции и способе лечения или предотвращения пикорнавирусных инфекций</a>