Соль щавелевой кислоты с 5-[4-[2-(n-метил-n-(2-пиридил )-амино) этокси]бензил]тиазолидин-2,4-дионом, способ её получения и применение
Формула / Реферат
1. Соль щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дионом формулы III

включая ее таутомеры и сольваты.
2. Соль по п.1, отличающаяся тем, что она имеет чистоту 99,5% и выше по данным высокоэффективной жидкостной хроматографии (ВЭЖХ) с содержанием индивидуальных примесей менее 0,1%.
3. Соль щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дионом по п.1 в кристаллической форме.
4. Соль по п.3, характеризующаяся следующими отражениями в дифрактограмме рентгеновских лучей: 15,6; 16,5; 18,7; 20,4; 22,2; 24,3 (ш2q).
5. Соль по п.3, характеризующаяся точкой плавления в пределах температурного интервала от 154 до 160шС.
6. Соль по п.3, характеризующаяся картиной дифференциальной сканирующей калориметрии (ДСК) с максимумом при 156,5-157,5шС.
7. Соль по п.3, характеризующаяся следующими полосами инфракрасной спектроскопии с преобразованием Фурье ИК-ПФ (KBr): 1751, 1707, 1617, 1509, 1248 (см-1).
8. Соль по п.3, характеризующаяся следующими сигналами при 13С ядерно-магнитном резонансе с кросс-поляризацией и вращением образца под магическим углом (13С КП ВМУ ЯМР): 35,1; 48,5; 56,4; 64,0; 112,1; 124,0; 127,8; 130,1; 135,4; 142,4; 152,1; 155,9; 168,2; 170,1; 174,3; 175,6 (млн-1).
9. Соль по пп.1-8, отличающаяся тем, что она является растворимой в воде и в водных растворах соляной кислоты.
10. Соль по п.9, отличающаяся тем, что 1 г соли формулы III растворяется в 35-40 мл 0,1 М соляной кислоты в течение 1-10 мин.
11. Способ получения соли щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-дионом формулы III, отличающийся тем, что 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион формулы I подвергают взаимодействию с щавелевой кислотой, причем эту реакцию проводят в органическом растворителе или в его смеси с водой
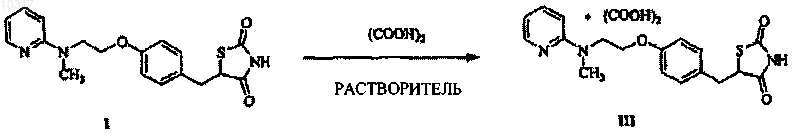
12. Способ по п.11, отличающийся тем, что в качестве растворителей используют спирты, эфиры карбоновых кислот, простые эфиры, кетоны, ацетонитрил, их произвольные смеси и смеси с водой в любом соотношении.
13. Способ по п.11, отличающийся тем, что в качестве растворителя используют этанол или его смесь с водой в любом соотношении.
14. Кристаллическая соль, получаемая способом по пп.11-13, отличающаяся тем, что она представлена в виде кристаллов, имеющих размеры от 1 до 80 мкм, причем более чем 95% частиц имеют максимальный размер меньше чем 50 мкм.
15. Применение соли по пп.1-10 или 14 для производства фармацевтически применимых композиций.
16. Применение соли по пп.1-10 или 14 для производства лекарства, обладающего антигипергликемическим эффектом.
Текст
010317 Область техники Изобретение относится к новой соли розиглитазона, т.е. 5-[4-[2-(N-метил-N-(2-пиридил)амино) этокси]бензил]тиазолидин-2,4-диона, с щавелевой кислотой и включает также способ ее получения. Эту соль можно использовать для изготовления фармацевтических препаратов для лечения гипергликемии у пациентов с сахарным диабетом типа 2. Предшествующий уровень техники Розиглитазон, в химическом смысле представляющий собой 5-[4-[2-(N-метил-N-(2-пиридил)амино) этокси]бензил]тиазолидин-2,4-дион формулы I, является известным антигипергликемическим агентом,впервые описанным в патенте ЕР 306228 (1989), принадлежащем Beecham. Розиглитазон применяют на практике в форме солей, в частности, с малеиновой кислотой (WO 94/05659 А 1, формула II). Недавно стал известен ряд кристаллических модификаций розиглитазона малеата II и его гидратов (WO 2000/064893 А 2 и WO 2000/064892 А 2, WO 2002/026737 A1, WO 99/31095 A1, WO 99/31094 А 1 и WO 99/31093 А 1). Также известен ряд других солей присоединения как с минеральными кислотами, так и с сильными органическими кислотами (WO 02/20519 А 1, WO 02/20518 А 1). Описанное здесь решение дает возможность получения ранее не раскрытой соли розиглитазона с щавелевой кислотой с качеством, требуемым для фармацевтических субстанций. Можно предположить,что полученная соль проявляет такую же антигипергликемическую активность, как другие соли розиглитазона. Раскрытие изобретения Изобретение относится к соли щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-дионом формулы III и к способу ее получения, который характеризуется взаимодействием 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона формулы I с щавелевой кислотой, которое проводят в подходящем органическом растворителе. Используемый способ,осуществляемый без каких-либо трудностей, при котором химическая чистота составляет 99,5% и выше при содержании индивидуальных примесей менее 0,1%, описывается уравнением на схеме 1. Также открыт экономически приемлемый способ получения этой соли, который можно использовать также в промышленном масштабе. Схема 1 С химической точки зрения предлагаемый продукт представляет собой соль, которая содержит компонент, описанный формулой I, и щавелевую кислоту (СООН)2 в соотношении 1:1, т.е. розиглитазона оксалат. Химическая структура соли, полученной авторами изобретения, может быть описана формулами III, III-a, III-b и III-c, которые эквивалентны друг другу. Однако для простоты далее в тексте будет использована формула III Способ получения соединения формулы III характеризуется использованием подходящего органического растворителя. Выбор растворителя зависит от растворимости исходного вещества и продукта. В-1 010317 качестве растворителей можно использовать спирты (например, метанол, этанол, 1-пропанол, 2 пропанол, бутанолы), эфиры карбоновых кислот (например, этилацетат), простые эфиры (например, диоксан, тетрагидрофуран, диэтиловый эфир), кетоны (например, ацетон, циклобутанон), ацетонитрил, их произвольные смеси и смеси с водой в любых соотношениях. В предпочтительном воплощении настоящего изобретения растворитель представляет собой этанол или его смесь с водой в любом соотношении. Было показано, что выбранный подход позволяет получить кристаллическую соль формулы III, которая содержит соединение I и щавелевую кислоту в соотношении 1:1. Химическую стабильность соли формулы III можно видеть из примера 3, где в результате взаимодействия двух эквивалентов свободного основания розиглитазона I с одним эквивалентом щавелевой кислоты образуется не ожидаемая соль формулы IV, а эквимолярная смесь соли формулы III и свободного основания розиглитазона формулы I. Если при взаимодействии соединения формулы I с щавелевой кислотой (пример 4) используют избыток щавелевой кислоты, образуется кристаллическая соль формулы III в качестве единственного продукта, содержащая соединение, описанное формулой I, и щавелевую кислоту в соотношении 1:1. Вышеописанные эффекты оказывают весьма значительное влияние на получаемую чистоту и стабильность продукта. Предпочтительной формой соли формулы III является кристаллическая форма, которая является химически стабильной, химически очень чистой (выше 99,5% по данным ВЭЖХ - высокоэффективной жидкостной хроматогафии), хорошо растворимой в воде и в водных растворах соляной кислоты, которую можно получить с высоким выходом в определенной кристаллической модификации, и которая характеризуется размером частиц, подходящим для дальнейшей обработки. Кристаллическая форма соли формулы III, полученная авторами изобретения, соответствует этим требованиям. Кристаллическая структура этой соли формулы III уникально охарактеризована результатами следующих аналитических методов: дифракция рентгеновских лучей на порошке (ДРП), точка плавления,дифференциальная сканирующая калориметрия (ДСК), 13 С ядерный магнитный резонанс с кроссполяризацией и вращением образца под магическим углом (КП ВМУ ЯМР) и инфракрасная спектроскопия с преобразованием Фурье (ИК-ПФ спектроскопия). Результаты анализов представлены в примерах и на прилагаемых фигурах. В противоположность некоторым другим солям розиглитазона вышеописанная кристаллическая соль формулы III хорошо растворима в воде и в водных растворах соляной кислоты. Растворимость в растворах соляной кислоты является особенно важной вследствие особенностей кислотно-основных условий пищеварительной системы (особенно желудка). Ее можно использовать как показатель растворимости вещества после его переваривания, что является очень важным фактором для оценки фармацевтической эффективности вещества. Сравнение растворимости соли соединения формулы III в кислой среде с некоторыми другими солями розиглитазона показано в примере 7. Например, 1 г кристаллической соли формулы III можно полностью растворить в 40 мл 0,1 М водного раствора соляной кислоты при 25 С. Однако такое же количество розиглитазона гидрохлорида, полученного в соответствии с WO 2000/063205, как и такое же количество используемого в фармацевтике розиглитазона малеата формулыII, полученного в соответствии с WO 94/05659, не удалось растворить в тех же условиях. Особенно предпочтительно получать кристаллическую форму соли соединения формулы III согласно изобретению, используя в качестве растворителя этанол или его смесь с водой в любом соотношении. При этом способе получают исключительно определенную кристаллическую модификацию(ДСК и ДРП) и определенный размер частиц; кроме того, этот способ характеризуется высокими выходами, которые могут быть воспроизводимо достигнуты. Перечисленные свойства кристаллической соли формулы III дают большие преимущества для ее производства и фармацевтического применения. При выполнении описанного способа воспроизводимо получают кристаллическую соль щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дионом формулы III с выходом от 85 до 95%, которая имеет во всех случаях одинаковую и уникально определенную кристаллическую модификацию, что документировано результатами сравнительных измерений ДРП, представленными на фиг. 1. Данная методика дает возможность получить кристаллический продукт с размером частиц от 1 до 80 мкм, причем более чем 95% частиц характеризуются максимальным измерением менее чем 50 мкм. Этот результат был получен без использования сложного процесса измельчения или других способов дезинтеграции, обычно применяющихся в фармацевтической технологии. Размер частиц крайне важен-2 010317 для фармацевтического применения продукта, и часто бывает очень трудоемко или невозможно получить продукт, который обладал бы пригодным размером частиц. Способы производства, которые дают такой продукт непосредственно, таким образом, уникальны и исключительно желательны. Полученную соль щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дионом формулы III можно использовать для изготовления фармацевтически применимых композиций, в частности, лекарств с антигипергликемическим эффектом. Сущность изобретения более подробно объяснена в приведенных ниже примерах, которые, однако,ни в каком отношении не ограничивают объем изобретения, определенный формулой изобретения. Краткое описание чертежей Фиг. 1 представляет собой дифракцию рентгеновских лучей на порошке кристаллической соли щавелевой кислоты с розиглитазоном (III), полученной согласно примеру 1,фиг. 2 - кривую ДСК кристаллической соли щавелевой кислоты с розиглитазоном (III), полученной согласно примеру 1,фиг. 3 - спектр 13 С КП ВМУ ЯМР кристаллической соли щавелевой кислоты с розиглитазоном (III),полученной согласно примеру 1,фиг. 4 - инфракрасные спектры с преобразованием Фурье (ИК-ПФ спектры) кристаллической соли щавелевой кислоты с розиглитазоном (III), полученной согласно примеру 1,фиг. 5 - диаграмму распределения частиц по размеру в соответствии с максимальным измерением(MaxFeret) для кристаллической соли щавелевой кислоты с розиглитазоном (III), полученной согласно примеру 1. Примеры Пример 1. 20 г свободного основания розиглитазона формулы I и 7,4 г дигидрата щавелевой кислоты растворяли в 600 мл этанола. Эту смесь перемешивали и нагревали до образования флегмы. Полученный таким образом раствор оставляли свободно охлаждаться при перемешивании в течение 5 ч. Выпавший в осадок продукт отфильтровывали, промывали 50 мл этанола и высушивали в вакуумной сушилке. Кристаллическую соль формулы III получали с выходом 90%, температура плавления (т. пл.) 155-157 С. Химическая чистота продукта составляла 99,76% по данным ВЭЖХ. Содержание индивидуальных примесей всегда было менее чем 0,1%. Пример 2. 10 г свободного основания розиглитазона формулы I растворяли в 250 мл кипящего этанола. К кипящему раствору добавляли раствор дигидрата щавелевой кислоты (3,7 г) в 50 мл этанола. Этот раствор оставляли свободно охлаждаться при перемешивании в течение 3 ч. После фильтрации,промывания фильтровального кека 20 мл этанола и высушивания в вакуумной сушилке получали кристаллическую соль формулы III с выходом 90%, т. пл. 157-158 С. Пример 3. 10 г свободного основания розиглитазона I растворяли в 250 мл кипящего этанола. К раствору при кипячении с обратным холодильником добавляли раствор дигидрата щавелевой кислоты (1,8 г) в 30 мл этанола. Этот раствор оставляли свободно охлаждаться при перемешивании в течение 3 ч. После фильтрации, промывания фильтровального кека 20 мл этанола и высушивания в вакуумной сушилке получали 11,2 г смеси, которая представляла собой исходное соединение формулы I и кристаллическую соль формулы III. Эту смесь характеризовали, используя ДСК, без какой-либо дополнительной оценки. Таким образом, подтвердили, что не произошло образования единственной ожидаемой соли - гидрооксалата розиглитазона. Пример 4. 10 г свободного основания розиглитазона I растворяли в 250 мл кипящего этанола. К кипящему раствору добавляли раствор дигидрата щавелевой кислоты (7,4 г) в 100 мл этанола. Этот раствор оставляли свободно охлаждаться при перемешивании в течение 3 ч. После фильтрации, промывания фильтровального кека 30 мл этанола и высушивания в вакуумной сушилке получали кристаллическую соль формулы III с выходом 84%, т. пл. 154-157 С. Пример 5. 10 г свободного основания розиглитазона формулы I растворяли в 250 мл кипящего ацетонитрила. К кипящему раствору добавляли раствор дигидрата щавелевой кислоты (3,7 г) в 50 мл ацетонитрила. Этот раствор оставляли свободно охлаждаться при перемешивании в течение 5 ч. После фильтрации, промывания фильтровального кека 30 мл ацетонитрила и высушивания в вакуумной сушилке получали кристаллическую соль III с выходом 78%, т. пл. 153-156 С. Пример 6. 10 г свободного основания розиглитазона (I) растворяли в 250 мл кипящего изопропилового спирта. К кипящему раствору добавляли раствор дигидрата щавелевой кислоты (3,7 г) в 50 мл изопропилового спирта. Этот раствор оставляли свободно охлаждаться при перемешивании в течение 5 ч. После фильтрации, промывания фильтровального кека 30 мл изопропилового спирта и высушивания в вакуумной сушилке получали кристаллическую соль формулы III с выходом 87%, т. пл. 155-157 С. Пример 7. Растворимость солей розиглитазона. Определяли растворимость кристаллического розиглитазона оксалата химической формулы III, который был получен с помощью методики в соответствии с примером 1. 1 г кристаллической соли формулы III растворяли при перемешивании при 25 С в 20, 30, 35 и 40 мл 0,1 М раствора соляной кислоты. Эту смесь перемешивали при 25 С в течение 5 мин. При использовании 20 и 30 мл растворителя раствора не получили. При использовании 35 мл растворителя получили мутный раствор. При использовании 40 мл-3 010317 растворителя получили не мутный раствор. В таких же условиях не растворялось ни такое же количество розиглитазона гидрохлорида, полученного с помощью методики, описанной в WO 2000/063205, ни такое же количество применяемого в фармацевтике розиглитазона малеата формулы II, полученного согласноWO 94/05659. Растворы невозможно было получить даже при увеличении времени растворения и при дополнительном разведении 0,1 М раствором соляной кислоты. Аналитические данные (А-Е). Приведенные ниже аналитические данные ясно характеризуют кристаллическую соль розиглитазона оксалат химической формулы III. А. Дифракция рентгеновских лучей на порошке (ДРП). Паттерны дифракции рентгеновских лучей кристаллических солей розиглитазона оксалата III, которые были получены в соответствии с примером 1, показаны на фиг. 1. Значения характеристических углов дифракции представлены в таблице. Паттерны дифракции получали, используя дифрактометрSeifert 3000 XRD, в приведенных ниже экспериментальных условиях: Таблица Значения характеристических углов дифракции 2 и межплоскостные расстояния d кристаллической соли розиглитазона оксалата формулы III Б. Точка плавления. Точки плавления кристаллических солей розиглитазона оксалата формулы III измеряли в блоке Кофлера при скорости нагревания образца 10 С (до 120 С) и 4 С (выше 120 С) в минуту. Измеренные значения точек плавления находились в интервале от 154 до 160 С. Типичные значения точек плавления представлены в примерах 1-6. В. Дифференциальная сканирующая калориметрия (ДСК). Значения ДСК измеряли, используя прибор Perkin Elmer PYRIS 1. Измерения проводили для образцов массой 3,6 мг. Образцы нагревали до температуры 20-280 С при скорости нагревания 10 С в минуту. Полученные кривые ДСК представлены на фиг. 2. Кристаллическая соль розиглитазона оксалат формулыIII проявляет максимум при температуре от 156,5 до 157,5 С. Г. Углеродный спектр ЯМР в твердом состоянии (13 С КП ВМУ ЯМР). Спектр ЯМР кристаллической соли розиглитазона оксалата формулы III для изотопа углерода 13 С измеряли, используя спектрометр Avance 500 Bruker, с частотой измерения 125,77 МГц, используя методику кросс-поляризации и вращения образца под магическим углом с частотой вращения 15 кГц. Полученный спектр представлен на фиг. 3. Положения основных пиков (химический сдвиг выражен в млн-1) следующие: 35,1; 48,5; 56,4; 64,0; 112,1; 124,0; 127,8; 130,1; 135,4; 142,4; 152,1; 155,9; 168,2; 170,1; 174,3; 175,6. Д. Инфракрасная спектроскопия с преобразованием Фурье (ИК-ПФ). Инфракрасный спектр соли III измеряли, используя методику таблеток KBr, на ИК-ПФ спектрометре Perkin Elmer XB Spectrum с разрешением 8 см-1. Полученные спектры представлены на фиг. 4. Положения основных пиков (длина волны выражена в см-1) следующие: 2775, 1751, 1707, 1617, 1509, 1328,1248, 1220, 1050, 826, 764, 710.-4 010317 Е. Измерение распределения частиц по размеру. Распределение частиц по размеру измеряли с помощью микроскопа, проводя автоматическую оценку измерения. Диаграмма распределения частиц по размеру в соответствии с максимальным измерением (MaxFeret) представлена на фиг. 5. Измерение показало, что кристаллическая соль розиглитазона оксалат формулы III имеет распределение размеров частиц от 0 до 80 мкм при максимуме в интервале 010 мкм (частота встречаемости примерно 65%). Более чем 99% частиц имели максимальное измерение меньше 50 мкм. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соль щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4 дионом формулы III включая ее таутомеры и сольваты. 2. Соль по п.1, отличающаяся тем, что она имеет чистоту 99,5% и выше по данным высокоэффективной жидкостной хроматографии (ВЭЖХ) с содержанием индивидуальных примесей менее 0,1%. 3. Соль щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4 дионом по п.1 в кристаллической форме. 4. Соль по п.3, характеризующаяся следующими отражениями в дифрактограмме рентгеновских лучей: 15,6; 16,5; 18,7; 20,4; 22,2; 24,3 (2). 5. Соль по п.3, характеризующаяся точкой плавления в пределах температурного интервала от 154 до 160 С. 6. Соль по п.3, характеризующаяся картиной дифференциальной сканирующей калориметрии(ДСК) с максимумом при 156,5-157,5 С. 7. Соль по п.3, характеризующаяся следующими полосами инфракрасной спектроскопии с преобразованием Фурье ИК-ПФ (KBr): 1751, 1707, 1617, 1509, 1248 (см-1). 8. Соль по п.3, характеризующаяся следующими сигналами при 13 С ядерно-магнитном резонансе с кросс-поляризацией и вращением образца под магическим углом (13 С КП ВМУ ЯМР): 35,1; 48,5; 56,4; 64,0; 112,1; 124,0; 127,8; 130,1; 135,4; 142,4; 152,1; 155,9; 168,2; 170,1; 174,3; 175,6 (млн-1). 9. Соль по пп.1-8, отличающаяся тем, что она является растворимой в воде и в водных растворах соляной кислоты. 10. Соль по п.9, отличающаяся тем, что 1 г соли формулы III растворяется в 35-40 мл 0,1 М соляной кислоты в течение 1-10 мин. 11. Способ получения соли щавелевой кислоты с 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-дионом формулы III, отличающийся тем, что 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-дион формулы I подвергают взаимодействию с щавелевой кислотой, причем эту реакцию проводят в органическом растворителе или в его смеси с водой 12. Способ по п.11, отличающийся тем, что в качестве растворителей используют спирты, эфиры карбоновых кислот, простые эфиры, кетоны, ацетонитрил, их произвольные смеси и смеси с водой в любом соотношении. 13. Способ по п.11, отличающийся тем, что в качестве растворителя используют этанол или его смесь с водой в любом соотношении. 14. Кристаллическая соль, получаемая способом по пп.11-13, отличающаяся тем, что она представлена в виде кристаллов, имеющих размеры от 1 до 80 мкм, причем более чем 95% частиц имеют максимальный размер меньше чем 50 мкм. 15. Применение соли по пп.1-10 или 14 для производства фармацевтически применимых композиций. 16. Применение соли по пп.1-10 или 14 для производства лекарства, обладающего антигипергликемическим эффектом. Фиг. 1 Дифракция рентгеновских лучей на порошке кристаллической соли щавелевой кислоты с розиглитазоном (III), полученной согласно примеру 1 Фиг. 2 Кривая ДСК кристаллической соли щавелевой кислоты с розиглитазоном (III),полученной согласно примеру 1 Фиг. 3 Спектр 13 С КП ВМУ ЯМР кристаллической соли щавелевой кислоты с розиглитазоном (III),полученной согласно примеру 1 Фиг. 4 Спектр ИК-ПФ кристаллической соли щавелевой кислоты с розиглитазоном (III),полученной согласно примеру 1 Фиг. 5 Диаграмма распределения частиц по размеру в соответствии с максимальным измерением (MaxFeret) для кристаллической соли щавелевой кислоты с розиглитазоном (III), полученной согласно примеру 1
МПК / Метки
МПК: C07D 417/12, A61P 3/10, A61K 31/4402
Метки: кислоты, амино, применение, щавелевой, способ, соль, получения, 5-[4-[2-(n-метил-n-(2-пиридил, этокси]бензил]тиазолидин-2,4-дионом
Код ссылки
<a href="https://eas.patents.su/8-10317-sol-shhavelevojj-kisloty-s-5-4-2-n-metil-n-2-piridil-amino-etoksibenziltiazolidin-24-dionom-sposob-eyo-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соль щавелевой кислоты с 5-[4-[2-(n-метил-n-(2-пиридил )-амино) этокси]бензил]тиазолидин-2,4-дионом, способ её получения и применение</a>
Предыдущий патент: Перевязочный материал на основе целлюлозы микробного происхождения, его применение и содержащий его набор
Следующий патент: Новый способ синтеза (2s, 3аs, 7аs)-1-[(s)-аланил]-октагидро-1н-индол- 2-карбоновых кислот и их применение в синтезе периндоприла
Случайный патент: Замещенные соединения миноциклина, фармацевтическая композиция и способ лечения чувствительного к тетрациклину состояния млекопитающего












