Арилпиперазины, имеющие активность в отношении 1 а рецептора серотонина
Номер патента: 3703
Опубликовано: 28.08.2003
Авторы: Колман Даниел Тимоти, О` Тул Джон Каннингэм, Ксу Яо-Чанг, Годфри Александр Гленн, Занг Тони Янтао
Формула / Реферат
1. Соединение формулы
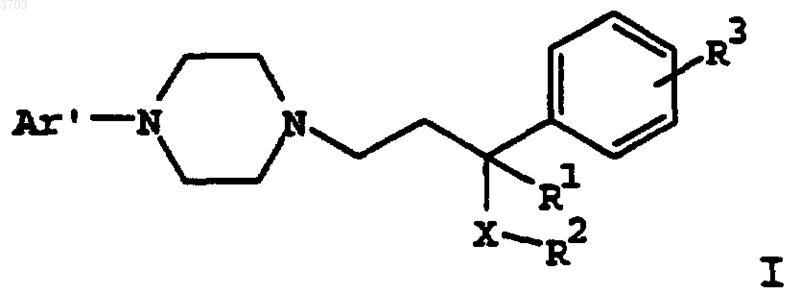
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемая соль, рацемат, оптический изомер или сольват.
2. Соединение по п.1, где Ar' представляет собой фенил или пиридин.
3. Соединение по п.2, где Ar' представляет собой фенил, замещенный (C1-C6)алкокси.
4. Соединение по п.3, где R2 представляет собой фенил или (C3-C12)циклоалкил.
5. Соединение по п.4, где R1 представляет собой водород.
6. Соединение по п.5, где X представляет собой -C=O.
7. Способ антагонизации 1A-рецептора серотонина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
8. Способ купирования симптомов, вызванных синдромом отмены или частичным синдромом отмены употребления табака или никотина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы
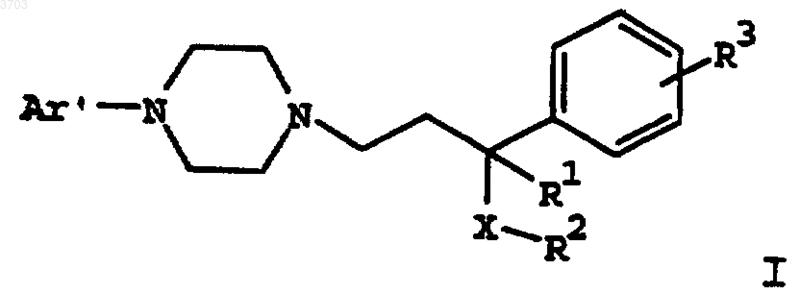
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
9. Способ по п.8, отличающийся тем, что соединение представляет собой
1-(2-метоксифенил)-4-[3-(бензоил)-3-(фенил)пропил]пиперазин;
1-(2-пиридил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил] пиперазин;
1-(2-этоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин гидрохлорид;
1-(2-метоксифенил)-4-[3-(бензоил)-3-(фенил)бутил]пиперазин оксалат;
1-(2-метоксифенил)-4-[3-(циклопептанкарбонил)-3-(фенил)пропил]пиперазин гидрохлорид;
1-(2-метоксифенил)-4-[3-(циклогептанкарбонил)-3-(фенил)пропил]пиперазин гидрохлорид
и 1-(2-метоксифенил)-4-[4-(циклогексил)-4-(гидрокси)-3-(фенил)бутил]пиперазин оксалат.
10. Способ лечения состояния тревоги, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы
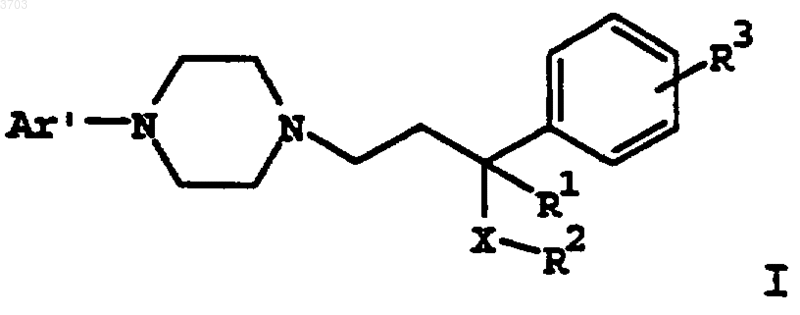
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
11. Способ лечения депрессии, артериальной гипертонии, нарушений познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти, нарушений аппетита, ожирения, токсикомании, обсессивно-компульсивного заболевания, панического расстройства или мигрени, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы
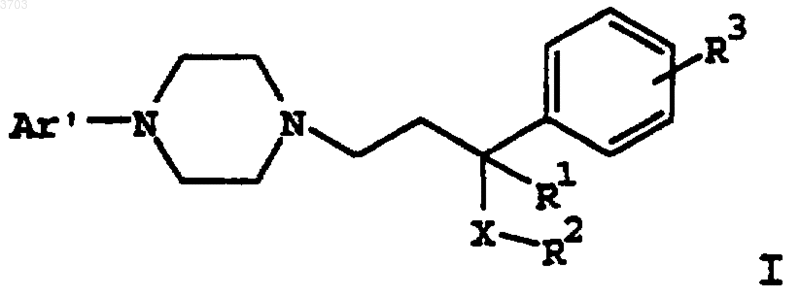
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкениыр, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
12. Способ потенциирования действия ингибитора обратного захвата серотонина в отношении увеличения содержания серотонина, норэпинефрина и допамина в мозге, включающий введение пациенту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством соединения формулы
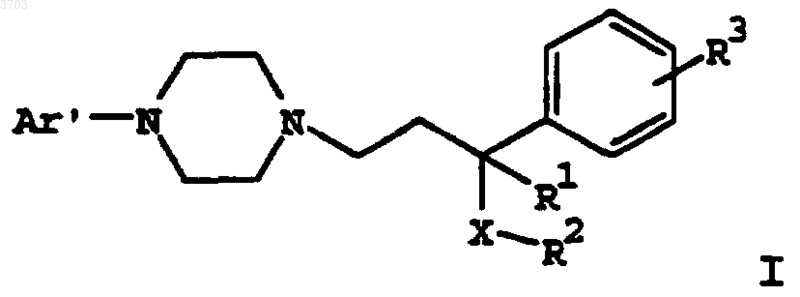
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенилаили галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
13. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п.1.
14. Способ по п.8, отличающийся тем, что вводят эффективное количество ингибитора обратного захвата серотонина.
15. Способ по п.14, отличающийся тем, что ингибитор обратного захвата серотонина представляет собой флуоксетин, дулоксетин, венлафаксин, мильнаципран, циталопрам, флувоксамин или пароксетан.
16. Способ помощи пациенту в прекращении или снижении употребления им табака или никотина, включающий введение пациенту эффективного количества соединения формулы
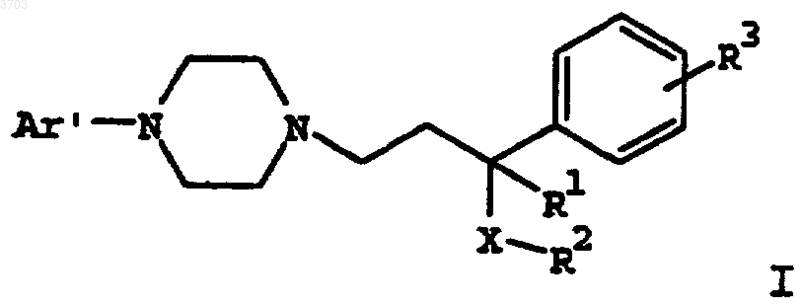
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
17. Соединение формулы
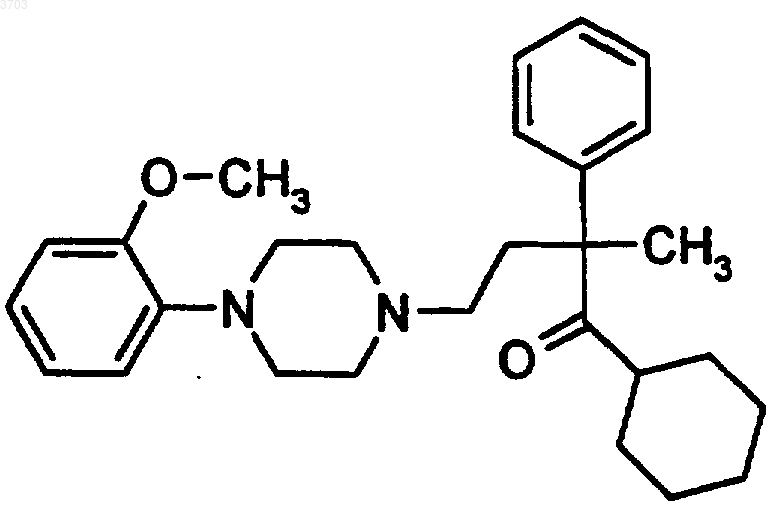
или его фармацевтически приемлемые соли.
18. Соединение, которое представляет собой (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин и его фармацевтически приемлемые соли.
19. Соединение по п.18, где фармацевтически приемлемая соль является дигидрохлоридом.
20. Соединение по п.18, где фармацевтически приемлемая соль является солью щавелевой кислоты.
21. Соединение по п.18, где фармацевтически приемлемая соль является солью малеиновой кислоты.
22. Соединение по п.18, где фармацевтически приемлемая соль является солью фосфорной кислоты.
23. Соединение, которое представляет собой (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил] пиперазин монохлоргидат.
24. Способ купирования симптомов, вызванных синдромом отмены или частичным синдромом отмены употребления табака или никотина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы
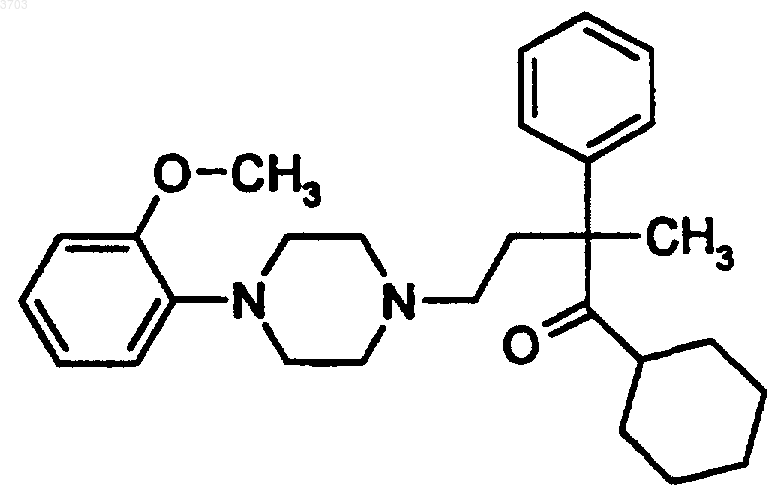
или его фармацевтически приемлемых солей.
25. Способ купирования симптомов, вызванных синдромом отмены или частичным синдромом отмены употребления табака или никотина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей.
26. Способ потенциирования действия ингибитора обратного захвата серотонина в отношении увеличения содержания серотонина, норэпинефрина и допамина в мозге, включающий введение пациенту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством соединения формулы
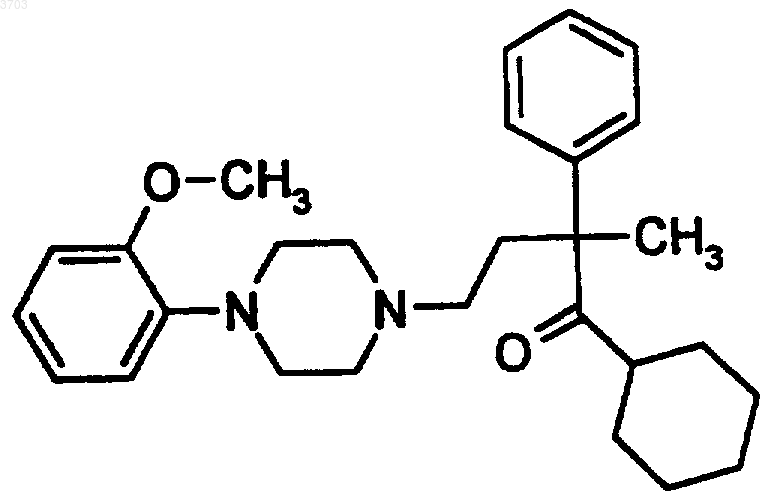
или его фармацевтически приемлемых солей.
27. Способ потенциирования действия ингибитора обратного захвата серотонина в отношении увеличения содержания серотониэр, норэпинефрина и допамина в мозге, включающий введение пациенту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей.
28. Способ по п.27, отличающийся тем, что ингибитор обратного захвата серотонина является флуоксетаном.
29. Способ антагонизации 1A-рецептора серотонина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин или его фармацевтически приемлемых солей.
30. Способ лечения состояния тревоги, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей.
31. Способ лечения депрессии, артериальной гипертонии, нарушений познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти, расстройства аппетита, ожирения, токсикомании, обсессивно-компульсивного заболевания, панического расстройства или мигрени, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей.
32. Способ помощи пациенту в прекращении или уменьшении употребления им табака или никотина, включающий введение пациенту эффективного количества соединения формулы
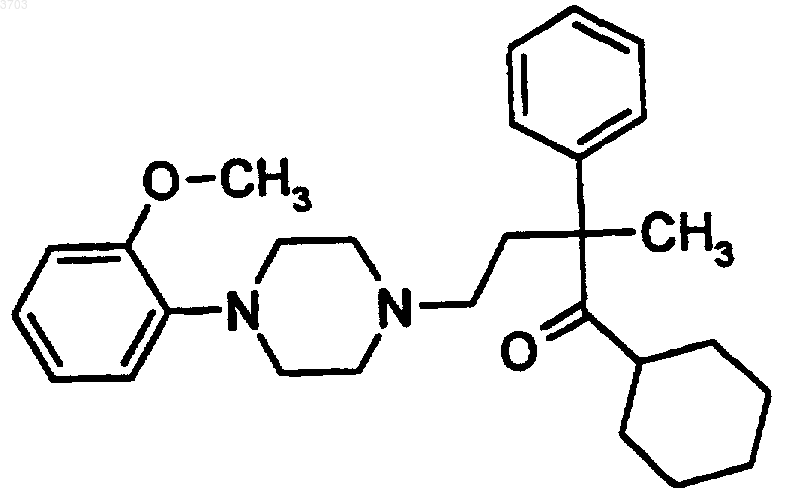
или его фармацевтически приемлемых солей.
33. Способ помощи пациенту в прекращении или уменьшении употребления им табака или никотина, включающий введение пациенту эффективного количества (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин или его фармацевтически приемлемых солей.
34. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин или его фармацевтически приемлемые соли.
35. Способ получения соединения формулы II
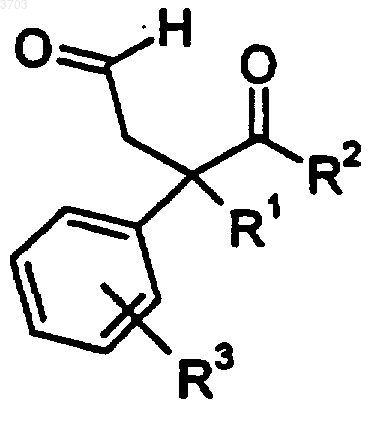
где R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида,
включающий обработку соединения формулы III
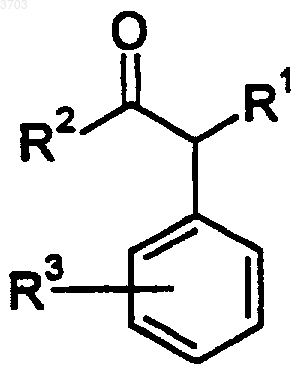
где R1, R2 и R3 являются такими, как описано выше, подходящим основанием и соединением формулы IV

где X представляет собой подходящую покидающую группу, для получения соединения формулы V
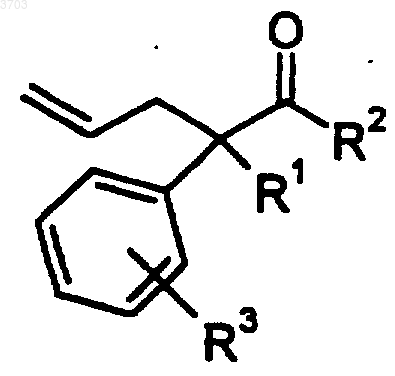
и окисление соединения формулы V подходящим окисляющим агентом для получения соединения формулы II.
36. Способ по п.35, отличающийся тем, что
R1 означает CH3;
R2 означает циклогексил и
R3 означает водород.
37. Способ по п.36, отличающийся тем, что X означает Br или Cl.
38. Способ по п.37, отличающийся тем, что подходящим окисляющим агентом является озон.
39. Способ по п.38, отличающийся тем, что подходящим основанием является трет-бутилат калия.
40. Соединение формулы

R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида.
41. Соединение по п.40, где
R1 означает CH3;
R2 означает циклогексил и
R3 означает водород.
42. Соединение формулы
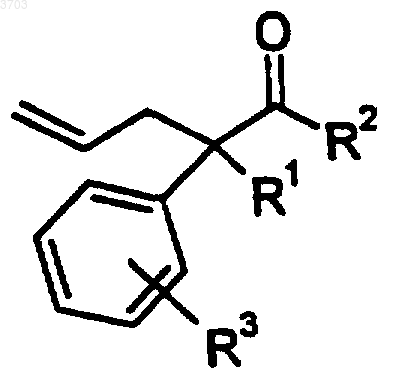
где R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил или (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида.
43. Соединение по п.42, где
R1 представляет собой метил;
R2 представляет собой циклогексил и
R3 представляет собой водород.
44. Соединение формулы
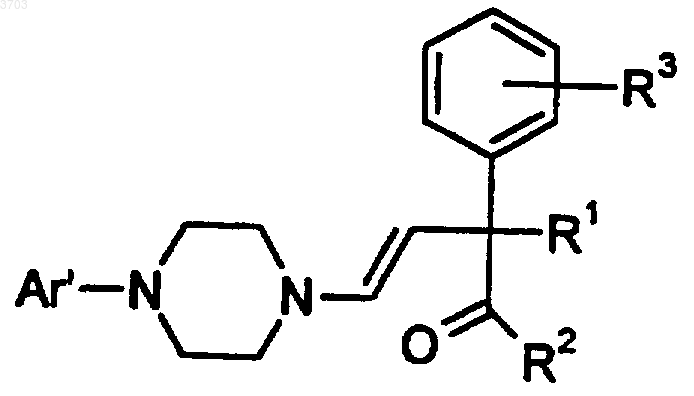
где Ar' представляет собой моно- или бициклический арильный или гетероарильный радикал, замещенный от одного до трех заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
R1 представляет собой водород, (C1-C6)алкил, (C1-C6)алкокси, (C1-C6)алкилтио;
R2 представляет собой фенил, нафтил шыш (C3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкенила, (C3-C8)циклоалкенила или галоида;
R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила, (C1-C6)алкилгалоида, (C3-C8)циклоалкила, (C3-C8)циклоалкенила или галоида;
X означает -C(=O)-, -CHOH- или -CH2-;
или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата.
45. Соединение по п.44, где Ar' представляет собой
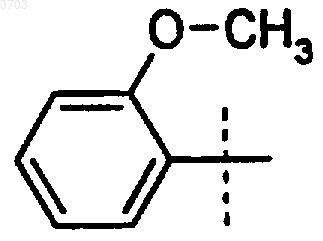
где R1 означает метил;
R2 означает циклогексил и
R3 означает водород.
Текст
1 Данное изобретение относится к области фармакологии и медицинской химии и предлагает новые фармацевтические средства, полезные для лечения заболеваний, которые вызываются или сопровождаются расстройствами серотонинзависимых неврологических систем, в частности систем, связанных с 1 А-рецептором. В последние годы фармацевты-исследователи обнаружили, что нейроны мозга, которые содержат моноамины, чрезвычайно важны для многочисленных физиологических процессов, на которые, в свою очередь, оказывают сильное влияние многие психологические и аффективно-личностные процессы, В частности,обнаружено, серотонин (5-гидрокситриптамин; 5-НТ) является ключевым фактором для многочисленных процессов, которые воздействуют как на физиологические, так и на психологические функции. Поэтому лекарственные средства, которые оказывают влияние на функцию серотонина в мозге, имеют большое значение и в настоящее время применяются в поразительно большом количестве различных терапий. Предыдущие поколения воздействующих на серотонин лекарственных средств характеризуются целым рядом различных физиологических эффектов, рассматриваемых как со структурной, так и терапевтической точек зрения. Совсем недавно появилась возможность изучать функцию лекарственных средств на индивидуальных рецепторах in vitro или ex vivo и также стало ясно, что терапевтические средства с однонаправленным механизмом действия оказываются часто благоприятными для пациента. Таким образом, в настоящее время целью исследования является обнаружение не только агентов, которые воздействуют на все функции серотонина, но и агентов, которые влияют только на одну функцию серотонина на одном идентифицируемом рецепторе. В данном изобретении предлагают соединения, которые проявляют высоко избирательную активность в качестве антагонистов 1 Арецептора серотонина. Данное изобретение относится к серии новых соединений арилпиперазина, способам их применения для фармацевтических целей и фармацевтическим композициям, посредством которых соединения могут быть удобно введены. Изобретение также раскрывает способы антагонизации 5-НТ-1 А-рецептора и терапевтические способы, связанные с их воздействием на 5 НТ-1 А-рецептор. Такие способы лечения включают, в частности, способы купирования симптомов, вызванных синдромом отмены или синдромом частичной отмены употребления табака или никотина, заключающиеся во введении пациенту, нуждающемуся в таком лечении, соединения формулы I где Аr' представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(C1-С 6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио,(С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 2-С 6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1 С 6)алкокси, (C1-C6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-С 6)алкокси, (C1 С 6)алкилтио, (С 2-С 6)алкенила, (С 2-С 6)алкинила,(C1-С 6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3 С 8)циклоалкенила или галоида; Х означает -С(=O)-, -СНОН- или -CH2-; или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. Кроме того, такие терапевтические способы включают способы лечения состояния тревоги, депрессии, артериальной гипертонии, нарушений познавательной способности, психоза,нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти, нарушений аппетита и ожирения, токсикомании, обсессивно-компульсивного заболевания, панического расстройства и мигрени. Следующий способ лечения, предлагаемый данным изобретением, представляет собой способ потенциирования действия ингибитора обратного захвата серотонина, включающий введение пациенту эффективного количества соединения формулы I в сочетании с ингибитором обратного захвата серотонина. Более конкретно, данное изобретение относится к соединениям формулы Iа или их фармацевтически приемлемым солям. Соединения формулы Iа входят в объем соединений формулы I и поэтому являются полезными в способах, описанных в заявке для соединений формулы I. Например, данное изобретение предлагает способы антагонизации 3 5 НТ-1 А-рецептора и терапевтические способы,которые связаны с их воздействием на 5 НТ-1 Арецептор. Такие способы лечения включают, в частности, купирование симптомов, вызванных синдромом отмены или синдромом частичной отмены употребления табака или никотина, заключающиеся во введении пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы Iа. Кроме того, такие терапевтические способы включают лечение состояния тревоги, депрессии, артериальной гипертонии, нарушений познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти, нарушений аппетита и ожирения, токсикомании,обсессивно-компульсивного заболевания, панического расстройства и мигрени. Кроме того, данное изобретение относится к способу потенциирования действия ингибитора обратного захвата серотонина, включающему введение пациенту эффективного количества соединения формулы Iа в комбинации с ингибитором обратного захвата серотонина. Далее изобретение относится также к способу помощи пациенту в прекращении или уменьшении употребления табака или никотина,включающему введение пациенту эффективного количества соединения формулы I или формулыIа. Данное изобретение также охватывает новые способы получения соединений формулы I и формулы Iа, способы получения их новых промежуточных соединений и, к тому же, включает новые промежуточные соединения сами по себе. Описание предпочтительных воплощений В данном документе все описания концентраций, количеств, соотношений и тому подобное представлены в весовых единицах, если не указано иное. Все температуры представлены в градусах Цельсия. Соединения Полагают, что специалистам достаточно обобщенного описания вышеупомянутых соединений для объяснения их природы; обращение к следующим примерам также способствует этому. Несколько дополнительных описаний гарантирует уверенность, что не возникнет неправильного понимания. В общем описании все основные химические термины употребляются в их обычных и привычных значениях. Например, низшие алкильные или алкоксигруппы, такие как (C1C6)алкильные и (C1-С 6)алкоксигруппы, в зависимости от размера групп, включают метил,этил, пропил, изопропил, н-бутил, втор-бутил,пентал, 3-метилбутил, гексил и гексильные группы с разветвленной цепью и соответствующие алкокси группы, также можно использовать индивидуально названные группы. Если несколько возможных замещающих групп 4 предполагается на группу, такие как от одной до трех алкильных, алкокси или галоидных групп на группу Аr, понятно, что рассматриваются только те замещения, которые возможны электронно и пространственно. Термин "алкенил", который используют в описании, представляет ненасыщенную группу с разветвленной или прямой цепью, имеющей,по крайней мере, одну двойную связь. Примеры таких групп включают радикалы, такие как винил, аллил, 2-бутенил, 3-бутенил, 2-пентен, 3 пентен, 4-пентен, 2-гексен, 3-гексен, 4-гексен, 5 гексен, а также диены и триены с прямой и разветвленной цепями. Термин "алкинил" означает такие радикалы, как этинил, пропилил, бутинил, пентинил,гексинил, а также да- и триины. Термин "(С 1-С 6)алкилтио" означает прямую или разветвленную алкильную цепь, содержащую от одного до шести атомов углерода,присоединенных к остатку молекулы посредством атома серы. Типичные (C1-C6)алкилтиогруппы включают метилтио, этилтио, пропилтио, бутилтио, пентилтио, гексилтио и подобные. Термин "(С 1-С 6)алкилгалоид" относится к алкильным заместителям, содержащим один или более независимо выбранных галоидных атомов, присоединенных к одному или более доступных атомам углерода. Эти термины включают хлорметил, бромэтил, трифторэтил,трифторметил, 3-бромпропил, 2-бромпропил, 3 хлорбугил,2,3-дихлорбутил,3-хлор-2 бромбутил, трихлорметил, дихлорэтил, 1,4 дихлорбутил, 3-бромпентил, 1,3-дихлорбутил,1,1-дихлорпропил и тому подобные. Более предпочтительные(C1-C6)алкилгалоидные группы представляют собой трихлорметил, трихлорэтил и трифторметил. Наиболее предпочтительным (C1-C6)алкилгалоидом является трифторметил. Термин "(С 3-С 8)циклоалкил" включает такие группы, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктол. Термин "(С 3-С 8)циклоалкил включает (С 3 С 6)циклоалкил. Термин "(С 3-С 8)циклоалкенил" представляет ненасыщенное кольцо с олефиновой связью, содержащее от 3 до 8 атомов углерода,включая группы, такие как циклопропенил,циклобутенил, циклопентенил, циклогексенил,циклогептенил, циклооктенил и тому подобные. Термин "(С 3-С 8)циклоалкенил" включает (С 3 С 6)циклоалкенил. Термин "арил" означает фенил или нафтал. Термин "бициклический" подразумевает или ненасыщенное, или насыщенное стабильное от 7- до 12-членное, с мостиковой связью или конденсированное бициклическое углеродное кольцо. Бициклическое кольцо может быть присоединено к любому атому углерода, который 5 дает стабильную структуру. Не ограничиваясь этим, термин включает нафтил, дициклогексил,дациклогексенил и подобные. Термин моно- или бициклический гетероарильный радикал относится к радикалам,полученным из моноциклических или полициклических ароматических ядер, имеющих от 5 до 14 атомов в кольце и содержащих от 1 до 3 атомов, выбранных из группы, состоящей из азота,кислорода или серы. Типичными гетероциклическими радикалами являются пирролил, фуранил, тиофенил, пиразолил, имидазолил, индолизинил, изохинолил, бензотиенил, изоиндолизинил, оксазолил, индолил, карбазолил, норгарманил, азаиндолил, дибензофуранил, тианафтенил, дабензотиофенил, индазолил, имидазо(1.2 А)пиридинил, антранилил, пуринил, пириданил,фенилпиридинил, пиримидинил, пиразинил,хинолинил. Термины "галоид или "галогенид", употребляемые в вышеупомянутой формуле, относятся к фтору, хлору, брому или иоду. Термин "апротонный растворитель" относится к полярным растворителям с умеренно высокой диэлектрической константой, которые не содержат кислотного водорода. Примерами обычных апротонных растворителей являются диметилсульфоксид (DMSO), диметилформамид, сульфолан, тетрагидрофуран, диэтиловый эфир, метил-т-бутиловый эфир или 1,2 диметоксиэтан. Термин протонный растворитель относится к растворителю, содержащему водород,который присоединен к кислороду, и, следовательно, определенно является кислотным. Обычные протонные растворители включают такие растворители, как вода, метанол, этанол,2-пропанол и 1-бутанол. Термин атмосфера инертного газа относится к условиям реакции, в которой смесь покрыта слоем инертного газа, такого как азот или аргон. Используемый в описании термин Me относится к -СН 3 группе, термин Et относится к -СН 2 СН 3 группе, а термин Рr подразумевает-СН 2 СН 2 СН 3 группу. Используемый в описании термин стереоизомер относится к соединению, образованному из одинаковых атомов, связанных одинаковыми связями, но имеющих различные трехмерные структуры, которые не являются взаимозаменяемыми. Трехмерные структуры называют конфигурациями. Используемый в описании термин энантиомер относится к двум стререоизомерам, молекулы которых не являются полностью совпадающим зеркальным изображением один другого. Используемый термин оптический изомер эквивалентен термину энантиомер. Термины рацемат, рацемическая смесь или рацемическая модификация относятся к смесям равных частей энантиомеров. Термин хиральный центр означает 6 атом углерода, к которому присоединены четыре различный группы. Термин энантиомерное обогащение, который употребляют в описании, подразумевает увеличение количества одного энантиомера по сравнению с другим. Соответствующим способом выражения достигнутого энантиомерного обогащения является представление энантиомерного избытка или ее, которое определяют, используя следующее уравнение: где E1 означает количество первого энантиомера, a E2 является количеством второго энантиомера. Так, если исходное соотношение двух энантиомеров составляет 50:50, такое, как существует в рацемической смеси, и достигается энантиомерное обогащение, достаточное, чтобы получить конечное соотношение 50:30, то "ее" в отношении первого энантиомера составляет 25%. Однако, если конечное соотношение оказывается 90:10, то "ее" в отношении первого энантиомера составляет 80%. Предпочтительным является "ее" более 90%, а "ее" больше 95% является наиболее предпочтительным и "ее" больше 99% является особенно наиболее предпочтительным. Специалисты в данной области легко определят энантиомерное обогащение,используя стандартные технологии и процедуры, такие как газовая хроматография или жидкостная хроматография высокого разрешения с хиральной колонкой. Выбор соответствующей хиральной колонки, элюента и условий, необходимых для эффективного разделения энантиомерной пары определяется уровнем знаний специалистов в данной области. Кроме того, энантиомеры соединений формул I или Iа могут быть разделены специалистами при использовании стандартных способов, хорошо известных в данном уровне техники, таких как способы,описанные J. Jacques, et al., "Enantiomers, Racemates, and Resolutions", John Willey and Sons,Inc., 1981. Примеры способов разделения включают способы перекристаллизации или хиральную хроматографию. Соединения формулы I и формулы Iа, как класс, являются высокоактивными, важными и особенно полезными в способах лечения данного изобретения, но определенные классы соединений являются предпочтительными. В следующих разделах описываются такие предпочтительные классы. Ясно, что предпочтительные классы относятся как к способам лечения, так и к новым соединениям данного изобретения. Понятно, что предпочтительные классы соединений можно комбинировать с образованием дополнительных, более обширных или более ограниченных классов предпочтительных соединений.a) Аr7 представляет собой фенил или пиридил;s) энантиомер формулы Iа, где []D20 в метаноле представляет собой (+). Так как соединения этого изобретения являются основными по природе, они соответственно реагируют с любой из ряда неорганических и органических кислот с образованием фармацевтически приемлемых солей присоединения кислот. Соли, включенные в изобретение,представляют собой моно- и дисоли. Кислоты,обычно используемые для образования таких солей, являются неорганическими кислотами,такими как хлористо-водородная кислота, бромисто-водородная кислота, иодисто-водородная кислота, серная кислота, фосфорная кислота и подобные, и органическими кислотами, такими как п-толуолсульфокислота, метансульфокислота, щавелевая кислота, п-бромфенилсульфокислота, угольная кислота, янтарная кислота,лимонная кислота, бензойная кислота, уксусная кислота и подобные. Таким образом, примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, однозамещенный фосфат, двузамещенный фосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, прогоюнат, деканоат, каприлат, акрилат, формиат,изобутират, капролат, гептаноат, пропиолат,оксалат, малонат, сукцинат, суберат, себакат,фумарат, малеат, бутин-1,4-диоат, гексин-1,6 диоат, бензоат, хлорбензоат, метилбензоат, данигробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, кселенсульфонат, фенилацетат, фенилпропионат, фенилбутират, 003703 8 цитрат, лактат, -гидроксибутират, гликолят,тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,манделат и подобные. Предпочтительные фармацевтически приемлемые соли представляют собой гидрохлорид, дигидрохлорид, гидробромид, дипедробромид, формула Ia/сукцинат (1:1),формула Ia/сукцинат (1:1), формула I/сукцинат(2:1), формула Ia/сукцинат 2:1, фосфат, dтартрат, 1-тартрат или малеат. Специалистам понятно, что гидраты свободных оснований или фармацевтически приемлемых солей включены в объем настоящего изобретения. Большинство соединений формулы I,включая соединения формулы Iа, представляют собой оптические изомеры. Например, соединения имеют асимметричный центр (или хиральный центр) у атома углерода, к которому присоединяются R1 и X. Однако когда соединение данного изобретения называют без указания асимметрической формы, то подразумевают любую или все из возможных асимметричных форм. Данное изобретение не ограничивается каким-либо определенным изомером, а включает все возможные индивидуальные изомеры и рацематы. Промежуточные соединения и конечные продукты можно выделить и очистить с помощью общепринятых способов, таких как очистка хроматографией на силикагеле или перекристаллизация выделенных кристаллов. Специалистам понятно, что исходные материалы специально не описаны, являются или коммерчески доступными, или могут быть легко получены помощью известных способов из коммерчески доступного сырья. Все другие реагенты, используемые для получения соединений данного изобретения, коммерчески доступны. Соединения изобретения обычно получают в соответствии со следующими схемами. Схема I 9 Исходное соединение (1) обрабатывают основанием, предпочтительно трет-бутоксидом калия, с последующим алкилированием 2 бромметил-1,3-диоксоланом. Другие приемлемые основания включают гидрид натрия, гидроокись натрия, гидроокись калия, углекислый калий, углекислый цезий и подобные. Предпочтительно реакцию проводят в растворителе, таком как диметилсульфоксид при температуре от 15 С до температуры кипения, с обратным холодильником, с наиболее предпочтительным диапазоном температур 45-55 С и фактически завершают в течение от 1 до 24 ч с получением промежуточного соединения (2). В результате обработки (2) кислотой, такой как хлористо-водородная кислота или птолуолсульфоновая кислота в приемлемом растворителе получают альдегид (3). Обычно реакцию проводят в протонном растворителе, как например смесь водной кислоты и ацетона, при температуре приблизительно от 5 до 75 С,предпочтительно при температуре окружающей среды. Для получения соединения (5), альдегид(3) и требуемый арилпиперидин (4) подвергают восстановительному аминированию. Предпочтительно реакцию проводят при температуре окружающей среды в нереакционноспособном растворителе, таком как дихлорэтан или хлористый метилен, в присутствии триацетоксиборгидрида и фактически завершают в течение от 1 до 24 ч. Для примера, см. A.F.Abdel-Magid, etal., J. Otg. Chem., 61, 3849 (1996). Восстановление (5) осуществляют быстро,используя восстанавливающие агенты, такие как боргидрид натрия или предпочтительно гидрид диизобутилалюминия, чтобы получить гадроксисоединение (6). Предпочтительно реакцию проводят в органическом растворителе,таком как хлористый метилен, при температуре приблизительно от -20 до 0 С. Для получения продукта (7) дальнейшее восстановление (6) можно осуществить обработкой восстанавливающим агентом, таким как триэтилсилан или трифторид бора (когда R2 является фенилом или замещенным фенилом) или обработкой кислотой, такой как хлористоводородная кислота или трифторуксусная кислота в апротонном растворителе, таком как тетрагидрофуран при температуре окружающей среды с образованием двойной связи с последующей гидрогенизацией, например, водородом и палладием на углероде. Исходный материал (1) или является коммерческим, или может быть получен сочетанием (8) [см. Nahm and Weinreb Tetrahedron Lett 22, 3815, (1981)] и (9), как описывают в схеме II ниже. М означает атом металла или группу галогенида металла, такую как хлорид лития или магния. Реакцию предпочтительно проводят в атмосфере инертного газа, предпочтительно азота, в апротонном растворителе, таком как тетрагидрофуран, при температуре окружающей среды. Более конкретно, соединения формулы Iа можно получать, следуя методике, описанной в схеме III. Все заместители, если не указано иное, являются такими, как определены ранее. Реагенты и исходные материалы легко доступны специалистам в данной области. Схема III(10) обрабатывают бензилмагнийхлоридом или бензилмагнийбромидом при стандартных условиях, хорошо известных в данной области, чтобы получить кетон структуры (11). Например,приблизительно от 1,05 до 1,1 экв. соответствующего амина, такого как диметиламин, растворяют в подходящем органическом растворителе, таком как тетрагидрофуран (охлажденном приблизительно до -5 С) в атмосфере инертного газа. Раствор нагревают до комнатной температуры и при перемешивании добавляют 1,0 экв. сложного эфира (10). Затем к раствору медленно добавляют приблизительно от 1,0 до 1,05 экв. бензилмагнийхлорида, поддерживая температуру приблизительно при 15-20 С на охлаждающей бане во время добавления. После окончания добавления реакционную смесь перемешивают при комнатной температуре приблизительно в течение от 1 до 2 ч, затем охлаждают до температуры ниже 0 С, а затем осторожно гасят подходящей кислотой такой как НСl. Эту реакционную смесь затем экстрагируют подходящим органическим растворителем, таким как трет-бутилметиловый эфир (в дальнейшем МТВЕ), органические слои объединяют, высушивают над безводным сульфатом магния, 11 фильтруют и концентрируют, чтобы получить кетон (11). Кетон (11) можно очистить с помощью способов, хорошо известных в данной области, таких как флэш-хроматография на силикагеле с соответствующим элюентом, таким как смесь этилацетат/гексан для получения очищенного продукта. Альтернативно, неочищенный кетон (11) можно перенести на стадию В. На схеме III, стадия В кетон (11) алкилируют диэталацеталем бромацетоальдегида, а затем иодметаном при условиях, хорошо известных в данной области, чтобы получить соединение структуры (12). Например, кетон (11) растворяют в подходящем органическом растворителе, таком как метилсульфоксид, и обрабатывают приблизительно от 1,05 до 1,1 экв. подходящего основания, такого как третбутоксид калия. Реакционную смесь перемешивают приблизительно в течение от 15 до 30 мин и в реакционную смесь добавляют по каплям приблизительно от 1,0 до 1,05 экв. диэтилацеталя бромацетоальдегида. Специалисты в данной области понимают, что диметилацеталь бромацетоальдегида, этиленацеталь бромацетоальдегида и подобные можно использовать вместо соответствующего диэтилацеталя. Реакционную смесь затем нагревают приблизительно до 50 С приблизительно в течение от 2 до 2,5 ч. Потом реакционную смесь охлаждают на водноледяной бане и добавляют приблизительно 2,2 экв. подходящего основания, такого как третбутоксид калия. Реакцию оставляют для перемешивания приблизительно в течение от 15 до 30 мин при непрерывном охлаждении, а затем к реакционной смеси по каплям добавляют приблизительно от 1,5 до 1,8 экв. иодметана, сохраняя температуру смеси ниже 41 С, предпочтительно ниже 21 С. После завершения добавления реакцию нагревают до комнатной температуры и перемешивают приблизительно в течение от 1 до 4 ч. Реакционную смесь затем распределяют между водой и подходящим органическим растворителем, таким как МТВЕ (метилтретбутиловый эфир). Слои разделяют и органическую фазу промывают водой, соляным раствором, сушат над безводным сульфатом магния, фильтруют и концентрируют под вакуумом, чтобы получить соединение (12). В схеме III, стадия С соединение (12) гидролизуют в кислых условиях для получения альдегида (13) по способу, аналогичному способу, описанному в схеме I. Точнее, например,соединение (12) растворяют в подходящем органическом растворителе, таком как ацетон, и обрабатывают подходящей кислотой, такой как хлористо-водородная кислота. Реакционную смесь перемешивают приблизительно в течение от 1 до 3 ч при комнатной температуре. Затем реакционную смесь экстрагируют подходящим органическим растворителем, таким как этилацетат или хлористый метилен, органические экстракты объединяют, промывают соляным 12 раствором, высушивают над безводным сульфатом магния, фильтруют и концентрируют под вакуумом для получения альдегида (13) - альдегид (13) можно очистить с помощью способов,хорошо известных в данной области, таких как флэш-хроматография на силикагеле с подходящим элюентом, таким как этилацетат/гексан. Альтернативно, неочищенный альдегид (13) можно использовать непосредственно на стадииD. В схеме III, стадия D альдегид (13) подвергают восстановительному аминированию пиперазином (14) в условиях, хорошо известных в данном уровне техники, чтобы получить соединение формулы Iа по способу, аналогичному способу, описанному в схеме I. Точнее сказать,например, альдегид (13) растворяют в подходящем органическом растворителе, таком как хлористый метилен. К этому раствору добавляют приблизительно 1,1 экв. пиперазина (14). Возможно добавление уксусной кислоты, чтобы способствовать растворению пиперазина (14). Потом добавляют приблизительно от 1,2 до 1,3 экв. триацетоксиборгидрида натрия и реакционную смесь перемешивают при комнатной температуре приблизительно в течение от 3 до 5 ч. Реакцию затем останавливают добавлением подходящего основания, такого как гидроксид натрия, чтобы обеспечить рН приблизительно от 10 до 12. Реакционную смесь затем экстрагируют подходящим органическим растворителем,таким как хлористый метилен. Органические экстракты объединяют, промывают соляным раствором, высушивают над безводным сульфатом магния, фильтруют и концентрируют под вакуумом, чтобы получить соединение формулыIа. Это вещество можно очистить с помощью способов, хорошо известных в данной области,таких как флэш-хроматография на силикагеле с подходящим элюентом таким как, этилацетат/гексан. Свободное основание формулы Iа можно превратить в соответствующие фармацевтически приемлемые соли при стандартных условиях, хорошо известных в данной области. Например, свободное основание формулы Iа растворяют в подходящем органическом растворителе, таком как метанол, обрабатывают одним эквивалентом, например, малеиновой или щавелевой кислоты или двумя эквивалентами, например, хлористо-водородной кислоты, а затем концентрируют под вакуумом, чтобы получить соответствующую фармацевтически приемлемую соль. Остаток затем можно очистить с помощью перекристаллизации из подходящего органического растворителя или смеси органических растворителей, такой как метанол/диэтиловый эфир. В схеме III, стадия Е (+) энантиомер формулы Iа можно отделить от (-) энатоиомера, используя способы и процедуры, хорошо известные в данной области, такие как способы, опи 13 санные J. Jacques, et al., Enantiomers, Racemates, and Resolutions, John Willey and Sons,Inc., 1981. Например, для эффективного разделения энантиомеров можно также применять хиральную хроматографию с подходящим органическим растворителем, таким как этанол/ ацетонитрил и насадку Chiralpak AD, 20 мкм. В схеме III, стадия F (+) энантиомер формулы Iа превращают в его фармацевтически приемлемую соль, такую как моногидрохлорид,дигидрохлорид, моногидробромид, дигидробромид, формула Ia/сукцинат (1:1), формулаIa/сукцинат 2:1, фосфат, д-тартрат, л-тартрат или малеат, по способу, аналогичному способу,описанному выше в конце стадии D. Альтернативно, соединения структуры (5) можно получить, следуя способу, описанному в схеме IV. Все заместители, если не указано иное, являются такими, как ранее указано. Реагенты и исходные материалы легко доступны специалистам в данной области. Схема IV В схеме IV, стадия А, чтобы получить спирт (17), альдегид (15) смешивают с подходящим металлорганическим реагентом (16) в условиях, хорошо известных в данном уровне техники. Примеры металлорганических реагентов включают реагент Гриньяра, алкиллитиевые реагенты, алкилцинковые реагенты и подобные. Предпочтительными являются реагенты Гриньяра. Примеры типичных реагентов Гриньяра и условий реакций см. J. March, "Advanced Organic Chemistry: Reactions, Mechanims, andStructure", 2nd Edition, McGraw-Hill, pages 836841 (1977). Более конкретно, альдегид (15) растворяют в подходящем органическом растворителе, таком как тетрагидрофуран или толуол,охлаждают приблизительно до -5 С и обрабатывают приблизительно от 1,1 до 1,2 экв. реагента Гриньяра формулы (16), где М означает MgCl или MgBr. Реакционную смесь оставляют для перемешивания приблизительно в течение от 14 0,5 до 2 ч, затем останавливают, а спирт (17) отделяют. Например, реакционную смесь вливают в охлажденную льдом 1N НСl, смесь экстрагируют подходящим органическим растворителем, таким как толуол, органические экстракты высушивают или азеотропно, или над подходящим высушивающим агентом, таким как безводный сульфат магния, фильтруют и концентрируют под вакуумом, чтобы получить спирт(1), спирт (17) окисляют при стандартных условиях, хорошо известных в данной области, таких как условия, описанные J. March, "AdvancedStructure, 2nd Edition, McGraw-Hill, pages 10821084 (1977). [Кетон (1) является исходным материалом, используемым в схеме I выше]. Например, спирт (17) растворяют в подходящем органическом растворителе, таком как хлористый метилен, раствор охлаждают в бане влажный лед-ацетон и обрабатывают от 2,5 до 3,0 экв. даметилсульфоксида. После перемешивания в течение приблизительно 30 мин, реакционную смесь обрабатывают приблизительно 1,8 экв. Р 2O5. Реакционную смесь оставляют для перемешивания в течение приблизительно 3 ч, а затем предпочтительно обрабатывают приблизительно в течение 30 мин 3,5 экв. подходящего амина, такого как триэтиламин. Затем охлаждающую баню удаляют и реакционную смесь оставляют для перемешивания приблизительно в течение от 8 до 16 ч. Кетон (1) затем выделяют с помощью стандартных способов экстракции,хорошо известных в данной области. Вышеупомянутое окисление также проводят, используя стандартные условия окисления по Swern'y, которые хорошо известны специалистам в данной области. В схеме IV, стадия С для получения соединения (19), кетон (1) обрабатывают подходящим основанием с последующим добавлением алкена (18), где Х является соответствующей уходящей группой. Например, кетон (1) смешивают с избытком алкена (18) в подходящем органическом растворителе, таком как тетрагидрофуран,и охлаждают на бане влажный лед-ацетон. Примерами подводящих уходящих групп являются О, Вr, I, тозилат, мезилат и подобные. Предпочтительными уходящими группами являются Сl и Вr. Добавляют приблизительно 1,1 экв. подходящего основания и реакционную смесь оставляют для перемешивания приблизительно в течение 2 ч при комнатной температуре. Примерами подходящих оснований являются третбутоксид калия, гидрид натрия, NaN(Si(СН 3)3)2LDA, KN(Si(СН 3)3)2, NaNH2, этоксид натрия,метоксид натрия и подобные. Трет-бутоксид калия является предпочтительным подходящим основанием. Затем реакцию гасят водной кислотой, а соединение (19) выделяют экстракцией подходящим органическим растворителем, та 15 ким как гептан. Гептановые экстракты промывают двууглекислым натрием, высушивают над безводным сульфатом магния, фильтруют и концентрируют под вакуумом с получением соединения (19). В схеме IV, стадия D для получения альдегида (3), соединение (19) обрабатывают подходящим окисляющим агентом. [Альдегид (3) также получают по схеме I]. Примерами подходящих окисляющих агентов являются озон,NаIO4/осмиевый катализатор и подобные. Озон является предпочтительным окисляющим агентом. Примеры подходящих окисляющих реагентов и условий реакций описываются J. March,"Advanced Organic Chemistry: Reactions, Mechanisms, and Structure", 2nd Edition, McGraw-Hill,pages 1090-1096 (1977). Например, соединение (19) растворяют в подходящем органическом растворителе, таком как метанол, добавляют незначительное количество Судана III, а раствор охлаждают приблизительно до -20 С. Озон барбатируют в раствор приблизительно в течение 4 ч до тех пор, пока розовый цвет не станет бледно-желтым. Затем в реакционную смесь добавляют Me2S и удаляют охлаждающую баню. Концентрирование реакционной смеси под вакуумом дает промежуточный диметилацеталь альдегида (3). Этот диметилацеталь быстро гидролизуют при стандартных кислых условиях для получения альдегида(3). Альтернативно, непосредственная кислотная обработка неочищенной реакционной смеси дает альдегид (3). Альтернативно, альдегид (3) можно получать непосредственно озонолизом(19) в не образующем ацеталь растворителе,таком как хлористый метилен. В схеме IV, стадия Е, чтобы получить соединение (5), альдегид (3) подвергают восстановительному амидированию при условиях, аналогичных условиям, описанным выше в схемеIII, стадия D. [Соединение (5) также получают по схеме I]. На схеме V представлен альтернативный синтез для получения соединения (5). Все заместители, если не указано иное, являются такими, как определено ранее. Реагенты и исходные материалы легко доступны специалистам в данной области. Схема V 16 На стадии А схемы V для получения енамина (20) альдегид (3) конденсируют с пиперидином (4) при стандартных условиях, хорошо известных в данной области. Например, приблизительно 1,05 экв. альдегида (3), растворенного в соответствующем органическом растворителе, таком как изопропилацетат или изопропанол, добавляют к чистому пиперазину (4) в форме свободного основания. Чтобы получить суспензию, добавляют дополнительный органический растворитель и реакционную смесь перемешивают приблизительно в течение от 1 до 2 ч, енамин (20) затем выделяют с помощью стандартных способов, таких как фильтрация. На схеме V, стадия В для получения соединения (5) енамин (20) гидрогенизируют в условиях, хорошо известных специалистам в данной области. Например, в аппарате Парра енамин (20) смешивают с приемлемым органическим растворителем, таким как изопропиловый спирт и каталитическим количеством 5% палладия на углероде. Смесь помещают в атмосферу водорода при 50 пси и встряхивают в течение приблизительно 2 дней при комнатной температуре. Затем для удаления катализатора суспензию фильтруют, а фильтрат концентрируют, чтобы получить соединение (5). Следующие примеры представляют типичные синтезы вышеописанных соединений формулы I и формулы Iа. Эти примеры никоим образом не ограничивают изобретение, а только иллюстрируют его. Реагенты и исходные материалы легко доступны специалистам в данной области. Используемые в описании следующие термины имеют указанные значения: aq означает водный (водн.); "eq" (экв.) относится к эквивалентам; "g" (г) означает грамм; mg (мг) означает миллиграмм; "L" (л) означает литры;ml (мл) означает миллилитры; "L" (мкл) означает микролитры; mol (моль) означает моли; "mmol" означает миллимоли; "psi" (пси) означает футы (453,6 г) на квадратный дюйм (2,5 см); "min" (мин) означает минуты; "h" - часы;"HPLC" (ВЭЖХ) - высокоэффективная жидкостная хроматография; "Rf" - фактор удерживания; "Rt" - время удерживания; означает части на миллион отсчитываемых от тетраметилсилана; TNF - тетрагидрофуран; "DMF" означает N,N-диметилформамид; "IPA" - изопропиловый спирт; "iPrOAc" - изопропилацетат; АсОН - уксусная кислота; "HRMS" означает масс-спектрометрию высокого разрешения;"Et3N" - триэталамин; "LDA" - диизопропиламид лития; RT относится к комнатной температуре; SRI означает ингибитор обратного захвата серотонина; и "МТВЕ" означает третбутилметиловый эфир. Пример 1. 1-(2-Метоксифенил)-4-[3(бензоил)-3-(фенил)пропил]пиперазин оксалат. А. Получение 2-(2'-бензоил-2'-фенид)этил 1,3-диоксолана. К перемешиваемой суспензии гидрида натрия (61,25 ммоль) в 150 мл диметилформамида при 0 С под азотом по каплям добавляют раствор деоксибензоина (50,96 ммоль) в 150 мл тетрагидрофурана. Смесь перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 1 ч. К смеси добавляют 2-бромметил 1,3-диоксолан (60,55 ммоль) и катализатор иодид калия (6,0 ммоль). Смесь нагревают при температуре кипения с обратным холодильником в течение 13 ч. После охлаждения добавляют диэтиловый эфир (300 мл) и воду (300 мл). Органический слой отделяют и промывают водой (150 мл 2). Очистка флэш-хроматографией с использованием гексана и этилацетата дает 2-(2'-бензоил-2'-фенил)этил-1,3-диоксолан(8,18 г; 57%). В. Получение 3-бензоил-3-фенилпропиональдегида. К 100 мл ацетона добавляют 2-(2'-бензоил 2'-фенил)этил-1,3-диоксолан (8,85 ммоль) и 100 мл раствора 2N хлористо-водородной кислоты. После перемешивания смеси при комнатной температуре в течение 7 ч, добавляют 100 мл 2N гидроксида натрия. Ацетон упаривают, а остаток экстрагируют диэтиловым эфиром и тексаном (1:1; 100 мл 3). Объединенный органический слой высушивают (сульфат натрия),фильтруют и концентрируют. Обнаружено, что остаток является довольно чистым материалом(3-бензоил-3-фенилпропиональдегид) и поэтому используется на следующей стадии. С. Получение 1-(2-метоксифенил)-4-[3(бензоил)-3-(фенил)пропил]пиперазина. Остаток 3-бензоил-3-фенилпропиональдегида, полученного на стадии В выше (8,85 ммоль), растворяют в 110 мл хлористого метилена. К этому раствору добавляют 2 метоксифенилпиперазин (10,61 ммоль) и триацетоксиборгидрид натрия, NаВН(ОАс)3, (10,61 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч. Водная обработка с последующей флэш-хроматографией дает чистый продукт 1-(2-метоксифенил)-4-[3-(бензоил)3-(фенил)пропил]пиперазин (3,48 г) с 95% выходом для двух последних стадий. Один эквивалент щавелевой кислоты добавляют к свободному основанию, растворенному в метаноле. Растворитель упаривают, а продукт высушивают под вакуумом с образованием соли щавелевой кислоты. Точка плавления = 161-163 С; МС (м/е): 414 (М+). А. Получение циклогексилбензилкетона. К перемешиваемому раствору N-метил-Nметоксициклогексанкарбоксамида (7,42 ммоль) в 30 мл тетрагидрофурана при 0 С под азотом добавляют раствор бензилмагния хлорида (2,0 М в тетрагидрофуране, 4,5 мл, 9,0 ммоль). Смесь перемешивают при 0 С в течение 30 мин и еще в течение 1 ч при комнатной температуре. Добавляют диэтиловый эфир (50 мл) и воду (20 мл). Органический слой отделяют, высушивают,фильтруют и концентрируют. Очистка остатка методом флэш-хроматографии с использованием гексана и этилацетата дает циклогексилбензилкетон (1,05 г) с 70% выходом в виде масла. В. Получение 2-(2-циклогексанкарбонил 2'-фенил)этил-1,3-диоксолана. В результате осуществления процедур,описанных в примере 1 стадия А, при взаимодействии циклогексилбензилкетона(5,09 ммоль) и 2-бромметил-1,3-диоксолана (7,63 ммоль) в присутствии гидрида натрия (5,60 ммоль) получают 2-(2'-циклогексанкарбонил-2'фенил)этил-1,3-диоксолан (0,86 г) с 59% выходом. С. Получение 3-циклогексанкарбонил-3 фенилпропиональдегида. В результате выполнения процедур, описанных в примере 1 стадия В, при взаимодействии 2-(2'-циклогексанкарбонил-2'-фенил)этил 1,3-диоксолана (2,98 ммоль) с 1N хлористоводородной кислотой получают 3 циклогексанкарбонил-3-фенилпропиональдегид в виде очищенного продукта с 100% выходом.D. Получение 1-(2-метоксифенил)-4-[3(циклогексанкарбонил)-3-(фенил)пропил]пиперазина. В результате осуществления способов,описанных в примере 1 стадия С, при взаимодействии 3-циклогексанкарбонил-3-фенилпропиональдегида (1,39 ммоль) и 2-метоксифенилпиперазина (1,39 ммоль) с триацетоксиборгидридом натрия (1,80 ммоль) получают чистый продукт 1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин(464 мг) с 79% выходом. Соль щавелевой кислоты получают по способу, описанному выше. Точка плавления = 149-151 С; МС (m/е): 420 (М+). Пример 3. 1-(2-Пиридил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин оксалат. В результате осуществления способов,описанных в примере 1 стадия С, при взаимодействии 3-циклогексанкарбонил-3-фенилпропиональдегида (1,55 ммоль) и 1-(2-пиридил) пиперазина (1,55 ммоль) с триацетоксиборгидридом натрия (2,0 ммоль) получают чистый продукт 1-(2-пиридил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин (475 мг) с 78% выходом. Соль щавелевой кислоты получают как описано выше. Точка плавления = 185 - 187 С; МС (m/е): 391 (М+). Пример 4. 1-(2-Этоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин дигидрохлорид. В результате осуществления способов,описанных в примере 1 стадия С, при взаимодействии 3-циклогексанкарбонил-3-фенилпропиональдегида (1,02 ммоль) и 1-(2-этоксифенил)пиперазина (1,13 ммоль) с триацетоксиборгидридом натрия (1,3 ммоль) получают чистый продукт 1-(2-этоксифенил)-4-[3-циклогексанкарбонил)-3-(фенил)пропил]пиперазин (270 мг) с 52% выходом. К раствору свободного основания в метаноле добавляют требуемое количество раствора хлористо-водородной кислоты в диэтиловом эфире. Растворители удаляют при пониженном давлении, а продукт высушивают под вакуумом с получением соли хлористоводородной кислоты. Точка плавления = 180-183 С; МС (m/е): 434 (М+) Пример 5. 1-(2-Метоксифенил)-4-[3-(бензоил)-3-(фенил)бутил]пиперазин оксалат. А. Получение 2-(2'-бензоил-2'-фенил) пропил-1,3-диоксолана. В результате осуществления способов,описанных в примере 1 стадия А, при взаимодействии 2-(2'-бензоил-2'фенил)этил-1,3-диоксолана (3,54 ммоль) и иодметана (10,62 ммоль) в присутствии гидрида натрия (4,25 ммоль) получают 2-(2'-бензоил-2'-фенил)пропил-1,3-диоксолан (0,60 г). В. Получение 3-бензоил-3-фенилбутиральдегида.(0,32 г) и 1-(2-метоксифенил)пиперазина (0,23 г) с триацетоксиборгидратом натрия (0,33 г) получают чистый продукт, 1-(2-метоксифенил)-4-[3(бензоил)-3-(фенил)бутил]пиперазин (0,12 г). Соль щавелевой кислоты получают, как описано выше. Точка плавления = 192-193 С; МС (m/е): 428 (М+). Пример 6. 1-(2-Метоксифенил)-4-[3-(циклогептанкарбонил)-3-(фенил)пропил]пиперазин дигидрохлорид. В результате осуществления способов,описанных в примере 1 стадия С, при взаимодействии 3-циклогептанкарбонил-3-фенилпропиональдегида (2,52 ммоль) и 1-(2-метоксифенил)пиперазина (2,52 ммоль) с триацетоксиборгидридом натрия (3,28 ммоль) получают чистый продукт - 1-(2-метоксифенил)-4-[3(циклогептанкарбонил)-3-(фенил)пропил]пиперазин (770 мг) с 70% выходом. Дихлоргидрат получают, как описано выше. Точка плавления = 193-194 С; В результате осуществления способов,описанных в примере 1 стадия С, при взаимодействии 3-циклопентанкарбонил-3-фенилпропиональдегида (1,36 ммоль) и 1-(2-метоксифенил)пиперазина (1,49 ммоль) с триацетоксиборгидридом натрия (1,77 ммоль) получают чистый продукт - 1-(2-метоксифенил)-4-[3(циклопентанкарбонил)-3-(фенил)пропил]пиперазин (370 мг) с 67% выходом. Дигидрохлорид получают, как описано выше. Точка плавления = 210-212 С; Получение 2-фенил-1-циклогексан-этан-1 Вышеупомянутую охлажденную реакционную смесь затем медленно вливают при перемешивании в охлажденный разбавленный кислотный раствор. Происходит сильная экзотермическая реакция (необходима предосторожность). Для поддержания температуры охлажденного раствора ниже 45 С необходимо контролировать скорость добавления реакционной смеси. После добавления реакционной смеси к разбавленному кислотному раствору, эту реакционную смесь охлаждают до комнатной температуры, а рН доводят приблизительно до 6,5-7,5 достаточным количеством концентрированной НСl. Погашенную реакционную смесь экстрагируютMIВЕ (метилизобутиловый эфир) (1,71 л). Слои разделяют и органический слой промывают смесью вода/MIBE (1,03 л/1,37 л), с последующим вторым промыванием смесью вода/MIВЕ(1,03 л/1,03 л). Органические слои объединяют, промывают соляным раствором (683 мл), высушивают над безводным сульфатом магния (167 г),фильтруют и концентрируют под вакуумом. Неочищенное масло высушивают под обычным вакуумом в течение 5-16 ч до получения неочищенного 2-фенил-1-циклогексанэтан-1-она(522,3 г). Этот сырой продукт используют в следующей реакции без дальнейшей очистки. Получение 1,1-диэтокси-3-фенил-3-циклогексанкарбонилбутана. Схема III, стадия А. В 5-литровый реакционный сосуд загружают тетрагидрофуран (1,05 л) в атмосфере азота. Раствор охлаждают на бане ацетон-лед приблизительно до -5 С. Затем через тефлоновую трубку насадки добавляют жидкий диметиламин (115,9 г, 2,57 моль). Охлаждающую баню удаляют, а раствор оставляют для нагревания приблизительно до 15-20 С. Затем добавляют метилциклогексанкарбоксилат(341,7 г, 2,40 моль), получая в результате раствор цвета чая. Затем медленно добавляют бензилмагний хлорид (2,52-2,0 М раствора в THF,246 моль) со скоростью, которая позволяет завершить добавление приблизительно в течение от 1,8 до 2,2 ч. Во время добавления используют охлаждающую баню для поддержания температуры реакционной смеси приблизительно при 15-20 С. После добавления раствора бензилмагний хлорида полученную суспензию перемешивают при комнатной температуре приблизительно в течение 1-2 ч. Затем реакционную смесь охлаждают до температуры ниже 0 С. Концентрированную НСl (709,7 г, 7,2 моль) смешивают с водой (3,08 л) и раствор охлаждают до температуры ниже 5 С. Разбавленную кислотную смесь добавляют в 22-литровый реакционный сосуд охлаждаемый ледяной баней.III,стадия В. 2-Фенил-1 циклогексанэтан-1-он (8,26 г, 40,8 ммоль) смешивают с DMSO (45 мл) в 3-горлой круглодонной 250 мл колбе, снабженной магнитной мешалкой, цифровым термопаратермометром и дополнительной воронкой. К перемешиваемому раствору добавляют трет-бутоксид калия (5,04 г,44,9 ммоль). При 16 С наблюдается выделение тепла, а желтый раствор становится темнокоричневым. После окончания добавления, реакционную смесь перемешивают в течение дополнительных 15 мин, а затем в течение приблизительно 10 мин через дополнительную воронку по каплям добавляют диэтилацеталь бромацетальдегида (8,26 г, 41,9 ммоль). Затем реакционную смесь нагревают при 50 С в течение от 2 до 2,5 ч, во время которых реакционная смесь становится желтой. Реакционную смесь затем охлаждают на водно-ледяной бане приблизительно до 9,5 С и добавляют третбутоксид калия (10,07 г, 89,7 ммоль), что приводит к экзотермической реакции и изменению цвета от желтого до коричневого. Сохраняя охлаждение, реакционную смесь перемешивают в течение дополнительных 15 мин, с последующим добавлением по каплям иодметана (10,26 г, К перемешиваемому раствору 1-(2 метоксифенил)-4-[3-(циклогексанкарбонил)-3(фенил)пропил]пиперазина (0,11 г, 0,20 ммоль) в хлористом метилене (10 мл) при -78 С под азотом добавляют Dibal-H-pacтвop (0,89 ммоль). Смесь перемешивают при -78 С в течение 1 ч, а затем медленно нагревают до комнатной температуры в течение 16 ч. Обработка с последующей очисткой с помощью флэшхроматографии дает чистый 1-(2-метоксифенил)-4-[4-(циклогексил)-4-(гидрокси)-3(фенил)бутил]пиперазин (0,086 г) с 78% выходом. Соль щавелевой кислоты получают, как описано выше. Точка плавления = 100-102 С; МС (m/е): 422 (М+). Пример 9. 1-(2-Метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин. 23 72,3 ммоль, чистый). Температуру реакционной смеси поддерживают при 21 С или ниже. Любую экзотермическую реакцию во время добавления иодметана следует поддерживать ниже 41-43 С, т.е. при температуре, которая является точкой кипения иодметана. После окончания добавления, реакционную смесь оставляют для перемешивания в течение от 1 до 4 ч при комнатной температуре. Реакционную смесь затем распределяют между МIВЕ (100 мл) и водой(100 мл). Органическую фазу промывают водой(350 мл), соляным раствором (50 мл), высушивают над безводным сульфатом магния,фильтруют под вакуумом и концентрируют под вакуумом с получением 1,1-диэтокси-3-фенил 3-циклогексанкарбонилбутана (13,6 г) в виде желтого масла. Этот сырой материал используют в следующей реакции без дальнейшей очистки. Получение 1-циклогексил-2-фенилбутан-1 он-4-аля. Схема III, стадия С. 1,1-Диэтокси-3-фенил 3-циклогексанкарбонилбутан (74,4 г, 224 ммоль) растворяют в ацетоне (800 мл) с последующим добавлением 3,0N НСl (800 мл). Реакционную смесь перемешивают в течение одного часа при комнатной температуре. Смесь концентрируют под вакуумом с тем, чтобы получить менее 1/2 ее исходного объема, затем экстрагируют хлористым метиленом (800 мл). Органический экстракт промывают соляным рассолом (300 мл),высушивают над безводным сульфатом магния,фильтруют под вакуумом и концентрируют под вакуумом с получением сырого 3-фенил-3 циклогексанкарбонилбутан-1-аля (57,8 г). Альтернативно, высушенный и отфильтрованный раствор в хлористом метилене можно использовать на следующей стадии без концентрирования. Получение целевого соединения 1-(2 метоксифенил)-4-[3-(циклогексанкарбонил)-3(фенил)бутил]пиперазина. СхемаD. 3-Фенил-3 циклогексанкарбонилбутан-1-ал (57,8 г, 224 ммоль) растворяют в метиленхлориде (1650 мл),с последующим добавлением 1-(2-метоксифенил)пиперазина гидрохлорида (56,3 г, 246 ммоль). Возможно добавление уксусной кислоты (41 мл) для перевода суспензии в раствор. К перемешиваемому раствору медленно добавляют триацетоксиборгидрат натрия (60,3 г, 284 ммоль). В результате происходит незначительное выделение тепла и образуется суспензия. Реакционную смесь перемешивают в течение дополнительных 3 ч при комнатной температуре. Затем реакцию останавливают добавлением 2,0N гидроксида натрия (1050 мл), доводя рН 24 реакционной смеси до приблизительно 10. Смесь затем экстрагируют хлористым метиленом (2 раза, 1 л и 300 мл). Органические экстракты объединяют, промывают последовательно 1,0N НСl (600 мл), 1,0N гидроксидом натрия(600 мл), соляным раствором (600 мл), высушивают над безводным магнием, фильтруют и концентрируют под вакуумом с получением целевого указанного в заголовке соединения в виде густого масла. УФ (МеОН): max = 243 нм, 243 = 7110;max = 281 нм, 281 = 3200 ИК (CDCl3, см-1) 2937, 2856, 2836, 1698,1499, 1451, 1377, 131, 1242, 1029 1 Н ЯМР (300 МГц, DMSO)7,75 (2 Н,мультиплет), 7,55 (2 Н, мультиплет), 6,93 (3H,мультиплет), 6,85 (2 Н, мультиплет), 3,75 (3H,синглет), 2,90 (4 Н, мультиплет), 2,43 (4 Н, мультиплет), 2,08 (5 Н, мультиплет), 1,5 (10H, мультиплет), 1,05 (3 Н, мультиплет) 13 С ЯМР (300 МГц, DMSO)214,18; 151,94; 141,25; 141,23; 128,45; 126,85; 126,74; 122,22; 120,79; 117,81; 111,97; 55,28; 54,54; 53,67; 53,13; 50,01; 45,30; 33,75; 30,44; 30,12; 25,21; 24,98; 24,93; 19,94. Анализ. Рассчитано для C28H38N2O2: С 77,38; Н 8,81; N 6,45 Найдено: С 76,44; Н 8,89; N 6,01. Получение 1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина малеата. 1-(2-Метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин (полученный на вышеописанной стадии) растворяют в теплом метаноле (50 мл) с последующим добавлением малеиновой кислоты (26,8 г) и МTВЕ (200 мл). Эту смесь концентрируют до пасты, а затем повторно растворяют добавлением метанола (приблизительно 15 мл) и МTВЕ (200 мл). Смесь затравливают кристаллами и как только инициируется кристаллизация добавляют дополнительное количество МТВЕ (300 мл). Смесь фильтруют под вакуумом, твердое вещество промывают МТВЕ и высушивают под вакуумом в течение 5 ч при 40 С, чтобы получить названное соединение (122 г). Кроме того, специалисты в данной области могут получить названное соединение 1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин по способу, аналогичному способам, описанным выше,из 3-циклогексанкарбонил-3-фенилбутиральдегида и 1-(2-метоксифенил)пиперазина, как в основном описано на схеме V. Получение 1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина 2 НСl. Названное соединение получают по способу, аналогичному получению вышеописанной соли малеиновой кислоты, из свободного основания и хлористо-водородной кислоты с образо 25 ванием белого твердого вещества; точка плавления (DSC)=192,81 С. Получение(Chiral Technologies, 730 Springdale Drive, Exton,PA 19341) в пропаноле (1 л). Готовят элюент,содержащий приблизительно 5% 3 А спирта в ацетонитриле. Скорость течения в колонке составляет 155 мл/мин, а детектор устанавливают на 280 нм. Рацемический 1-(2-метоксифенил)-4[3-(циклогексанкарбонил)-3-(метил)-3-(фенил) пропил]пиперазин (25 г) растворяют в ацетонитриле (50 мл). Приблизительно 3 г этого раствора взвешивают в колбу и разбавляют ацетонитрилом (50 мл). Затем этот раствор насосом подают в колонку, чтобы начать разделение (+) и (-) энантиомеров 1-(2-метоксифенил)-4-[3(циклогексанкарбонил)-3-(фенил)бутил]пиперазина. Затем собирают фракции, содержащие (-) энантиомер, который элюируется первым. Общее время цикла составляет приблизительно 15 мин. Энантиомерный избыток двух разделенных изомеров определяют при следующих условиях: Колонка: 4615 см Chiralcel OH-H Элюент: 3%этанол в гептане, содержащем 0,2% диметиламина Скорость течения: 0,6 мл/мин Температура: окружающей среды УФ: 280 нм(+)-1-(2 Метоксифенил)-4-[3-(циклогексанкарбонил)-3(фенил)бутил]пиперазин (15,0 г, 34,5 ммоль,полученного выше) разбавляют метанолом (40 мл). К этому раствору добавляют НСl (9,58 г 26,3% раствора в метаноле, 69,0 ммоль). Смесь начинает образовывать желатинообразные кристаллы и затвердевает в твердое вещество в течение нескольких минут. К этой смеси при энергичном перемешивании добавляют диэтиловый эфир (100 мл). Белое твердое вещество собирают с помощью фильтрации под вакуу 003703 26 мом, а затем высушивают под вакуумом при 45 С в течение двух дней с получением названного соединения (13,4 г, 76%) в виде белого твердого вещества; точка плавления (DSC) = 195,58 С. ИК (СDСl3, см-1) 2976, 2939, 1700, 1502,1462, 1451, 1267, 1243, 1021; 1 Н ЯМР (300 МГц, DMSO)7,40 (2H,мультиплет), 73,1 (3 Н, мультиплет), 7,03 (3 Н,М), 6,90 (1 Н, мультиплет), 3,78 (3H, синглет),3,49 (4 Н, мультилет), 3,16 (5 Н, мультиплет),2,64 (1 Н, мультиплет), 2,40 (3H, мультиплет),1,56 (3H, синглет), 1,46 (4 Н, мультиплет), 1,11(+)-1-(2 Метоксифенил)-4-[3-(циклогексанкарбонил)-3(фенил)бутил]пиперазин (6,05 г, 31,9 ммоль) разбавляют МТВЕ (120 мл) с последующим добавлением НСl (2,2 М раствор в изопропаноле,6,3 мл, 13,9 ммоль, полученного из 0,80 г газообразной НСl в 10 мл изопропанола). Реакционная смесь образует смесь масло/твердое вещество, которая при дальнейшем перемешивании дает однородный кристаллический материал. Смесь фильтруют с отсасыванием и промывают МТВЕ с получением белого твердого вещества,которое высушивают под вакуумом при 45 С(+)-1-(2-Метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин моногидрохлорид можно получить из эквивалента концентрированной водной НСl вместо газообразной НСl по способу, аналогичному вышеописанному. Альтернативное получение 1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил) бутил]пиперазина. Получение 1-циклогексил-2-фенилпропанола. Схема IV, стадия А. К раствору циклогексилмагний хлорида (50 ммоль) в 25 мл Et2O и 40 мл TNF при -5 С добавляют раствор 2 фенилпропанальдегида (5,36 г, 40 ммоль) в 10 мл THF. При этом реакционная смесь разогревается до 5 С. После перемешивания при ком 27 натной температуре в течение 75 мин раствор вливают в охлажденную льдом 1N НСl, экстрагируют толуолом, высушивают над МgSO4 и концентрируют с получением названного соединения в виде бесцветного масла (6,15 г,70%). 1 Н ЯМР (d6-DMSO):7,23-7,30 (мультиплет, 2 Н, фенил СН), 7,15-7,22 (мультиплет, 3H,фенил СН), 4,17-4,51 (широкий синглет, 1 Н,-ОН), 3,23-3,33 (мультиплет, 1 Н, R2CHOH), 2,78 Схема IV, стадия В. DMSO (118 мл, 1,6674 моль) добавляют по каплям к раствору 126,42 г(1,0422 моль) P2O5. Через 11 мин охлаждающую баню удаляют. Аликвоты смеси, остановленнойEt3N реакции, показывают, что реакция завершается в пределах 3 ч при комнатной температуре. Реакционную смесь охлаждают в бане влажный лед-ацетон. К охлажденной реакционной смеси по каплям добавляют Et3N (282 мл,2,0265 моль) в течение 30-минутного периода. Удаляют охлаждающую баню, а смесь перемешивают в течение ночи при комнатной температуре. Реакцию гасят добавлением по каплям 500 мл 3N НСl (водн.) (рН=0). После встряхивания в разделительной воронке водную фазу удаляют. Органическую фазу промывают 500 мл 3N НСl(водн.) (рН=0), промывают дважды 1 л 10% К 2 СО 3 (водн.) (рН=12; 12), три раза промывают 500 мл раствора NaOCl (водн.), промывают 1 л воды и 1 л 25% NaCl (водн.), высушивают надMgSO4, фильтруют через самотечный фильтр и концентрируют под вакуумом с ловушкой с сухим льдом для поглощения Me2S. Получают названное соединение в виде янтарного масла Схема IV, стадия С. Раствор 31,39 г (0,2797 моль) t-BuOK в 100 мл THF добавляют по каплям к раствору 55,00 г (0,2543 моль) циклогексил-1-фенилэтилкетона и 26,4 мл (0,3052 моль) аллилбромида в 136 мл THF (охлажденных в бане влажный лед-ацетон). THF-промывки (16 мл) добавляют к реакционной смеси. После добавления охлаждающую баню удаляют. После завершения реакции (2 ч), реакционную смесь гасят 300 мл 1N НСl (рН=0) и экстрагируют 300 мл гептана. Гептановый экстракт промывают 10% NaHCO3 (водн.) (рН=9), высушивают надMgSO4, фильтруют через самотечный фильтр и концентрируют под вакуумом с получением 59,70 г (91,58%) названного соединения в виде масла янтарного цвета: 1 Н ЯМР (d6-DMSO):7,32-7,42 (мультиплет, 2 Н, фенил СН), 7,24-7,31 (мультиплет, 3H,фенил СН), 5,34-5,47 (мультиплет, 1 Н,-СН=СН 2), 5,02 (двойной дуплет, J=17,1 Гц,J=2,1 Гц, 1 Н, -СН=СН-Н (транс, 4,97 (ddd,J=10,2 Гц, J=2,2 Гц, J=1,0 Гц, 1 Н, -СН=СН-Н Схема IV, стадия D. Озон барбатируют через мутную смесь 56,50 г (0,2204 моль) 2-фенил 2-метил-4-пентеноилциклогексана н незначительного количества (10 мг) Судана III в 220 мл МеОН (охлажденного на бане сухой ледацетон при -20 С) в течение 4 ч до тех пор, пока розовый цвет не превратится в бледно-желтый. После того как весь олефин израсходуется, в реакционную смесь добавляют Me2S (50 мл). Охлаждающую баню удаляют. Выделяющееся тепло повышает температуру до 38 С и смесь охлаждают в охлаждающей бане до тех пор,пока не прекратится выделение тепла. Затем охлаждающую баню удаляют, а смесь перемешивают в течение ночи. Реакционный раствор концентрируют под вакуумом с ловушкой с сухим льдом для поглощения избытка Ме 2S, с по 29 лучением 83,65 г неочищенного диметилацеталя 4-циклогексил-3-метил-4-оксо-3-фенилбутиральдегида в виде розового масла. 1 Н ЯМР (d6-DMSO):7,34-7,39 (мультиплет, 2 Н, фенил СН), 7,24-7,30 (мультиплет, 3H,фенил СН), 3,99 (двойной дуплет, J=4,2 Гц,J=5,9 Гц, 1 Н, СН(ОСН 3)2), 3,14 (синглет, 3H,СН(ОСН 3)2), 3,06 (синглет, 3H, СН(ОСН 3)2),2,34-2,43 (мультиплет, 1 Н, циклогексил СН),2,10-2,20 (мультиплет, 2 Н, -СН 2 СН(ОСН 3)2),1,55-1,67 (мультиплет, 1 Н, циклогексил -СН 2),1,53 (синглет, 3H, R2 С(СН 3)Рh), 0,80-1,52 (мультиплет, 9 Н, циклогексил -СН 2). К раствору 82,65 г (66,29 г, 0,2177 моль) диметилацеталя 4-циклогексил-3-метил-4-оксо 3-фенилбутиральдегида в 539 мл ацетона добавляют 3N НСl (водн.) при температуре реакции. После окончания реакции (2 ч), смесь концентрируют до 426,5 г (или 1/3 объема) остатка(при температуре реакции 40 С). Остаток, содержащий главным образом воду (рН=0), экстрагируется дважды 300 мл МТВЕ. МТВЕэкстракт промывают 300 мл 25% NaCl (водн.),высушивают над МgSO4, фильтруют через самотечный фильтр и концентрируют с получением 54,92 г (97,65%) названного соединения в виде розового масла: 1 Н ЯМР (d6-DMSO):9,54 (триплет, J=2,0 Гц, 1 Н, -СНО), 7,36-7,45 (мультиплет, 2 Н, фенил СН), 7,28-7,35 (мультиплет, 3H, фенил СН), 2,95R2C(CH3)Ph), 0,85-1,66 (мультиплет, 10 Н, циклогексил -СН 2). Получение целевого соединения 1-(2 метоксифенил)-4-[3-(циклогексанкарбонил)-3(фенил)бутир]пиперазина. Схема IV стадия Е. Суспензия 13,72 г(0,05310 моль) 4-циклогексил-3-метил-4-оксофенилбутиральдегида и 11,57 г (0,05058 моль) 1-(2'-мeтoкcифeнил)пипepaзинa гидрохлорида в 391 мл СН 2 Сl2 добавляют 9,7 мл АсОН с тем,чтобы сделать реакционную смесь гомогенной. К реакционному раствору медленно добавляют 14,63 г (0,06904 моль) NаВН(ОАс)3. После перемешивания в течение 4 дней (реакцию следует завершить в течение 2-5 ч), к реакционной смеси добавляют 200 мл 1N НСl (водн.) (рН=1). Смесь экстрагируют 200 мл CH2Cl2 СН 2 Сl2 экстракт промывают 200 мл 1N НСl (водн.)(рН=1). Обе HCl-промывки (водн.) объединяют и сохраняют. Органический экстракт промывают 200 мл 1N NaOH (водн.) (рН=14). Образуется эмульсия, которая разрушается при добавлении 100 мл воды и 100 мл МТВЕ. Органическую фазу снова промывают 200 мл 1N NaOH (водн.)(рН=14) н 200 мл 25% NaCl (водн.), высушивают над МgSO4, фильтруют через самотечный фильтр и концентрируют до получения 22,74 г 30 сырого указанного в заголовке соединения в виде масла янтарного цвета. ВЭЖХ-анализ чистоты по сравнению со стандартом показал, что сырой продукт масла содержит 13,66 г (61,71%) названного соединения. Для того чтобы сделать смесь основной(рН=14), к объединенной HCl-промывке добавляют 28,44 г NaOH (тверд.). Мутную смесь дважды экстрагируют 100 мл СН 2 Сl2. СН 2 Сl2 экстракты объединяют, промывают 25% NaCl(водн.), высушивают над МgSO4, фильтруют через самотечный фильтр и концентрируют до получения 1,86 г остатка масла янтарного цвета,который содержит 0,096 г (в целом = 62,15%) названного соединения и 1,05 г (10,8% выход) 1(2'-метоксифенил)пиперазина. 1 Н ЯМР (d6-DMSO):7,35-7,43 (мультиплет, 2 Н, фенил СН), 7,26-7,32 (мультиплет, 3H,фенил СН), 6,89-6,96 (мультиплет, 2 Н, фенил СН), 6,83-6,88 (мультиплет, 2 Н, фенил СН), 3,76(0,1093 моль) 1-(2'-метоксифенил)пиперазина гидрохлорида в 42 мл воды добавляют 14,5 млNH4OH (водн.) (рН=9). Смесь экстрагируют дважды 250 мл смесью THF:толуол, 1:1(об./об.). Органические экстракты объединяют,высушивают над МgSO4, фильтруют через самотечный фильтр и концентрируют, чтобы получить 20,17 г (96,00%) 1-(2'-метоксифенил) пиперазина в виде масла, бледно-зеленого цвета. 1 Н ЯМР (d6 DMSO): 6,90-6,97 (мультиплет,2 Н, фенил СН), 6,83-6,90 (мультиплет, 3H, фенил СН), 3,77 (синглет, 3H, ОСН 3), 2,77-2,91iPrOAc, смесь становится мутной, а затем превращается в твердую массу. Твердое вещество суспендируют в 45 мл iPrOAc. Через 1,5 ч реак 31 цию останавливают. Твердое вещество фильтруют под вакуумом и промывают 10 мл iPrOAc и высушивают на воздухе, получая 9,81 г(мультиплет, 1 Н, циклогексил -СН 2). Получение целевого указанного в заголовке соединения. Схема V, стадия В. В 500-миллилитровом аппарате Парра к 5,35 г (0,00101 моль) 5% Pd/C,охлажденному на ледяной бане, добавляют 8,68 г (0,0201 моль), полученного выше енамина. К твердой смеси добавляют 40 мл IРА, охлажденный в морозильнике (-22 С). Вводят Н 2 при 50 пси и смесь встряхивают в течение 2 дней при комнатной температуре для завершения реакции. Черную суспензию фильтруют под вакуумом и концентрируют, чтобы получить 8,70 г бесцветного масла. Pd/C-катализатор промывают 50 мл IPA при перемешивании. Черную суспензию фильтруют под вакуумом. Фильтрат смешивают с 8,70 г остатка и концентрируют,чтобы получить 10,03 г целевого указанного в заголовке соединения в виде бесцветного масла. Дополнительными соединениями, включенными в данное изобретение, которые специалисты в данной области могут получить по способу, аналогичному описанным выше способам, являются следующие:(17) (+)-1-(2-метоксифенил)-4-[3-(циклогексан(фенил)бутил]пиперазин малеат. Активность в отношении 1A-рецептора серотонина. Соединения данного изобретения являются избирательными антагонистами в отношении 1 А-рецептора серотоннна. Известные ранее соединения с активностью в отношении lAрецептора обычно характеризуются недостатками, связанными с наличием других активностей, направленных на центральную нервную систему. В настоящее время фармакологи и врачи хорошо понимают, что фармацевтические средства, которые характеризуются одной физиологической активностью или которые более эффективны при проявлении требуемой активности, чем при проявлении их других активностей, являются наиболее желательными для терапии, чем соединения (пиндолол, например),которые характеризуются многообразными активностями в той же дозе. Многие другие известные антагонисты lAрецептора серотонина с таким же успехом проявляют -адренергическую, -адренергическую активности или активность в отношении допамина-2 и поэтому являются неизбирательными в отношении lA-рецептора. 5-НТ-1 А-рецепторсвязывающую способность настоящих соединений измеряют с помощью модификации метода определения эффективности связывания, описанного Taylor, et al.(1993). Мембраны для определения эффективности связывания получают из самцов SpraqueDawley крыс (150-250 г). Животных умерщвляют декапитацией, а мозг быстро охлаждают и вскрывают, чтобы извлечь гиппокамп. Мембраны гиппокампа или получают в тот же день, или гиппокамп хранят замороженным (-70 С) до дня получения. Мембраны получают гомогенизацией ткани в 40 объемах охлажденного льдом буфера Трис-хлористо-водородная кислота (50 мМ, рН 7,4 при 22 С), используя гомогенизатор в течение 15 с, гомогенат центрифугируют при 39800 х g в течение 10 мин. Затем осадок повторно суспендируют в том же буфере, и чтобы промыть мембраны, центрифугирование и процесс ресуспендирования повторяют три дополнительных раза. Чтобы способствовать удалению эндогенных лигандов, между вторым и третьим промыванием повторно суспендированные мембраны инкубируют в течение 10 мин при 37 С. Конечный осадок повторно суспендируют в 67 мМ буфере Трис-хлористоводородная кислота, рН 7,4, до концентрации 2 мг исходного влажного веса ткани/200 мкл. Этот гомогенат хранят замороженным (-70 С) до дня определения эффективности связывания. Каждая пробирка для определения связывания имеет конечный объем 800 мкл и содержит следующее: Трис-хлористо-водородную кислоту(50 мМ), паргнлин (10 мкМ) (Ж 12 (3 мМ), [3H] 8-OH-DPAT (1,0 нМ), соответствующие растворители интересующих лекарственных средств и ресуспензию мембран, эквивалентную 2 мг первоначального веса ткани, для окончательного рН 7,4. Опытные пробирки инкубируют в течение или 10, или 15 мин при 37 С, а содержимое затем быстро фильтруют через GF/B фильтры(предварительно обработанные 0,5% полиэтиленамином), с последующими четырьмя по одному мл промывками охлажденным льдом буфером. Удержанную фильтрами радиоактивность качественно определяют с помощью жидкостной сцинтилляционной спектрометрии, а специфическое [3H]8-OH-DPAT(8-гидрокси-2(ди-н-пропиламино)тетралин, меченный тритием)связывание с 5-НТ-1 А-участками определяют как разницу между [3H]8-ОН-DРАТ-уровнями в присутствии и отсутствии 10 мкМ 5-НТ. Значение IC50, т.е. концентрацию, необходимую для 50% ингибирования связывания,устанавливают по данным кривых конкурентного связывания, определенных по 12 точкам, используя нелинейную регрессию (SYSTAT,SYSTAT, Inc., Evanston, II). Из значений IС 50 устанавливают величины Ki, используя уравнение Cheng-Pnigoff (Biochem. Pharmacol., 22,3099-3108 (1973). Все эксперименты проводят с тремя повторами. Дополнительное определение эффективности связывания для некоторых из данных соединений проводят с помощью метода исследования, в котором используют клонированную клеточную линию, которая экспрессирует 1Aрецептор серотонина лучше, чем мембраны гиппокампа. Такие клонированные клеточные линии описаны Fargin, et al., J. Bio. Chem., 264,14848-14852 (1989), Aune, et al., J. Immunology,151, 1175-1183 (1993) и Raymond, et al., NaunynSchmiedeberg's Arch. Phamiacol., 346, 127-137(1992). Результаты определений, проведенных на клеточной линии, в основном согласуются с результатами, полученными при анализе мембран гиппокампа. а) Подкожное исследование 5 НТ 1 Аантагонизма. В пределах диапазона доз для подкожного введения, исследовали активность соединений,блокирующую вызванные 8-OH-DPAT поведенческие реакции и гипотермию. У самцов Sprague-Dawley крыс (- 250 г от Harlan SpragueDawley) регистрируют более слабое сокращение губ (LLR) и положение тела, растянувшегося во всю длину (FBP). Как LLR и FBP оценивают по шкале 0-3 (Wolff et al., 1997). В анализе LLRповеденческой реакция 0 означает нормальное положение губ; 1 означает незначительное расхождение губ; 2 означает, что губы открыты так, что в некоторой степени видны зубы; 3 означает, что губы полностью открыты и обнажены все передние зубы. В FBPанализе отметка 0 указывает на нормальное 34 положение тела; 1 указывает, что желудок располагается на диафрагме при спине в ее нормальном закругленном положении; 2 означает, что желудок располагается на диафрагме при выпрямленной и поднимающейся от плеч к бедрам спине; 3 означает, что желудок вдавлен в диафрагму, а спина выровнена одинаково с плечами и бедрами. Температуру тела определяют с помощью ректального зонда, вставляемого на 0,5 см сразу после оценки поведенческой реакции. За 35 мин до начала наблюдения крысам подкожно вводят соединение (0; 0,3; 1,0 и 3,0 мг/кг), а за 20 мин до оценки вводят 8-OHDPAT (0,1 мг/кг подкожно).b) Подкожное исследование 5HТ 1Aантагониста. Для выяснения вызывают ли соединения гипотермию, подобную гипотермии, индуцируемой 5 НТ 1 А-агонистом, исследовали соединения при высокой дозе 10 мг/кг как таковые при подкожном введении. Высокая активность в отношении 1Aрецептора серотонина данных соединений позволяет применять их для некоторых фармацевтических и терапевтических целей. Одним из таких применений является способ помощи людям в устранении у них табак- или никотинзависимости. Синдром отмены табака или никотина. Хорошо известно, что хроническое употребление никотина приводит к толерантности и,в конце концов, зависимости. Употребление табака стало чрезвычайно распространенным во всех странах, несмотря на хорошо известные побочные эффекты от применения табака по всех его формах. Так ясно, что употребление табака формирует стойкую привычку, если не наркоманию, и что его употребление обеспечивает потребителю приятные и желательные ощущения, даже если потребитель полностью осознает сильнодействующие, продолжительные, болезненные воздействия его применения. Совсем недавно проходили энергичные кампании против употребления табака н в настоящее время общеизвестно, что прекращение курения влечет за собой ряд неприятных симптомов синдрома отмены, которые включают раздражительность, состояние тревоги, беспокойное состояние, недостаток концентрации внимания,головокружение, бессонницу, тремор, повышенное чувство голода и увеличение веса и,конечно, страстное желание табака. В настоящее время, вероятно, наиболее широко применяемой терапией с целью помощи в прекращении употребления табака является никотиновое замещение, посредством использования никотиновой жевательной резинки или обеспечивающих никотин чрескожных пластырей. Однако широко известно, что никотиновое замещение менее эффективно без изменяющего привычку психологического лечения и тренировки. 35 Способ данного изобретения является довольно полезным при оказании помощи людям,которые хотят прекратить или уменьшить употребление табака или никотина. Наиболее распространенной формой употребления табака является курение, наиболее часто курение сигарет. Однако данное изобретение также полезно при оказании помощи в ликвидации привычки всех типов курения табака, также как и использования вдыхания, жевания табака и так далее. Данный способ также полезен для людей, которые замещают или частично возмещают употребление табака применением никотинзаместительной терапии. Так, таким пациентам можно помочь снизить или даже полностью устранить их зависимость от никотина во всех формах. Понятно, что данное изобретение полезно для предупреждения или купирования симптомов синдрома отмены, поражающие пациентов,которые пытаются исключить или снизить употребление табака или никотина. Обычные симптомы синдрома отмены у таких людей включают, по крайней мере, раздражительность,состояние тревоги, беспокойное состояние, отсутствие концентрации внимания, бессонницу,нервный тремор, повышенное чувство голода и увеличение веса, головокружение и страстное желание табака или никотина. Предупреждение или купирование таких симптомов, когда они вызываются или происходят в связи с прекращением или уменьшением употребления пациентом табака или никотина, является желательным результатом данного изобретения и его важным аспектом. Данное изобретение осуществляют путем введения эффективного количества соединения формулы I или формулы Iа пациенту, который нуждается в снижении или прекращении употребления табака или осуществляет это. Используемый в описании термин пациент относится к теплокровным животным, таким как млекопитающие. Термин пациент включает человека,собак, крыс, мышей и тому подобное. Ясно, что предпочтительным пациентом является человек. Эффективное количество соединения формулы I или формулы Iа означает количество или дозу соединения, которое обеспечивает требуемый эффект у пациента при диагностике или лечении. Вводимая доза соединения формулы I или формулы Iа эффективна в пределах широкого диапазона дозировок, в основном доза составляет приблизительно от 1 до 200 мг/день; как обычно, ежедневную дозу можно вводить в одном болюсе или в разделенных дозах в зависимости от назначения врача, наблюдающего пациента. Более предпочтительный диапазон доз составляет приблизительно от 5 до 100 мг/день; другой диапазон доз, который может быть предпочтительным при определенных обстоятельствах, составляет приблизительно от 10 до 50 мг/день; приблизительно от 5 до 50 мг/день; приблизительно от 10 до 25 мг/день и 36 особо предпочтительный диапазон составляет приблизительно от 20 до 25 мг/день. Понятно,что дозу для определенного пациента устанавливает наблюдающий врач и что дозу изменяют в зависимости от веса и телосложения пациента,характеристик выбранного определенного соединения, интенсивности привычки пациента к табаку, интенсивности симптомов синдрома отмены у пациента и психологических факторов, которые могут влиять на физиологические реакции пациента. Эффективность соединений в купировании симптомов синдрома отмены никотина оценивают на крысах посредством теста слухового возбуждения, который осуществляют следующим образом. Способы изучения синдрома отмены никотина. Животные. Самцов Long Evans крыс размещают отдельно в контролируемой среде при 12-часовом цикле свет-темнота и обеспечивают им свободный доступ к пище (Purina RodentChow) и воде. Все обрабатываемые группы состоят из 8-10 крыс. Хроническая обработка никотином. Крыс анестезируют галотаном и подкожно им имплантируют Abet осмотические мининасосы(Alza Corporation, Palo Alto, CA, Model 2ML2). Дитартрат никотина растворяют в физиологическом растворе. Насосы заполняют или дитартратом никотина (6 мг/кг веса/день), или физиологическим раствором. Через двенадцать дней после имплантации насосов, крыс анестезируют галотаном и удаляют насосы. Ответ на тест слухового возбуждения. Чувствительные двигательные реакции [ответ на слуховое возбуждение (амплитуда пикаVmax)] индивидуальных крыс регистрируют,используя камеры стимуляции San Diego Instruments (San Diego; CA). Сеансы возбуждения состоят из 5-минутного периода адаптации при фоновом уровне звука 703 дБ, непосредственно за которым следует 25 стимуляций слуха(1203 дБ звука, 50 мс продолжительность), с 8 секундными интервалами. Затем выводят среднее значение амплитуд пиков возбуждения для всех 25 стимулов для каждого сеансаю. Реакции на слуховое возбуждение оценивают ежедневно с 24-часовыми интервалами на 1-4 дни вслед за отменой никотина. Комбинация с ингибиторами обратного захвата серотонина. Следующее применение соединений формулы I или формулы Iа представляет собой их применение в комбинации с ингибитором обратного захвата серотонина для дальнейшего потенциирования действия таких лекарственных средств путем увеличения содержания серотонина, а также норэпинефрина и допамина в мозге пациентов, которым вводят комбинацию лекарственных средств. Типичные и приемлемые ингибиторы обратного захвата серотонина(SRI) представляют собой флуоксетин, дулоксетин, венлафаксин, милнаципран, циталопрам,флувоксамин и пароксетин. Соответственно данное изобретение касается способа потенциирования действия ингибитора обратного захвата серотонина, особенно одной из групп, состоящей из флуоксетина, дулоксетина, венлафаксина, милнаципрана, циталопрама, флувоксамина и пароксетина, в увеличении содержания серотонина, норэпинефрина и допамина в мозге,включающий введение названного ингибитора в комбинации с соединением формулы I или формулы Iа. Изобретение также относится к фармацевтическим композициям, которые содержат ингибитор обратного захвата серотонина в комбинации с соединением формулы I или формулы Iа, и к способу лечения патологического состояния, которое вызывается или зависит от сниженного содержания серотонина, допамина или норэпинефрина, способу, который включает назначение вспомогательной терапии пациентам, нуждающимся в таком лечении. Флуоксетин, N-метил-3-(п-трифторметилфенокси)-3-фенилпропиламин, продается в форме гидрохлоридной соли и в виде рацемической смеси его двух энантиомеров. Патент США 4314081 является ранним упоминанием этого соединения. Robertson, et al., J.Mtd. Chem.,31, 1412 (1988) описали разделение R и S энантиомеров флуоксетина и показывали, что их активности как ингибиторов обратного захвата серотонина подобны друг другу. В этом документе слово "флуоксетин" будет использовано для обозначения любой соли присоединения кислоты или свободного основания и включает или рацемическую смесь, или любой из R и S энантиомеров. Дулоксетин,N-метил-3-(1-нафталенилокси)-3-(2-тиенил)пропанамин, обычно вводится в виде гидрохлоридной соли и является (+) энантиомером. Впервые он был предложен в патенте США 4956388, в котором показана его высокая эффективность. Используемое в данном описании слово дулоксетин подразумевает любую соль присоединения кислоты и свободное основание молекулы. Венлафаксин известен из литературы, а способ его синтеза и его активность как ингибитора обратного захвата серотонина и норэпинефрина описаны в патенте США 4761501. В том патенте венлафаксин идентифицирован как соединение А. Мильнаципран(N,N-диэтил-2-аминометил-1-фенилциклопропанкарбоксамид) раскрыт в патенте США 4478836, в котором мильнаципран получен в примере 4. В патенте описаны его соединения как антидепрессанты.(1985) описывает его фармакологические активности. Циталопрам, 1-[3-(диметиламино)пропил]1-(4-фторфенил)-1,3-дигидро-5-изобензофуран 003703 38 карбонитрил, описан в патенте США 4136193 как ингибитор обратного захвата серотонина. Его фармакологию раскрывает Christensen, et al.,Eur. J. PharmacoL, 41, 153 (1977), и описание его клинической эффективности при депрессии можно обнаружить у Dufow, et al., Int. Clin. Psychopharmacol., 2, 225 (1987) и Timmerman. et al.,ibid., 239. Флувоксамин, 5-метокси-1-[4-(трифторметил)фенил]-1-пентанон-О-(2-аминоэтил)оксим,раскрыт в патенте США 4085225. Научные статьи об этом лекарственном средстве опубликованы Claassen, et al., Brit. J. Pharmacol., 60, 505(1986). Пароксетин, транс-(-)-3-[(1,3-бенздиоксол 5-илокси)метил]-4-(4-фторфенил)пиперидин,можно обнаружить в патентах США 3912743 и 4007196. Описания активности лекарственного средства имеются у Lassen, Eur. J.J.Clm. PharmacoL, 19, 705 (1985); Laursen, et al.,Acta Psychiat. Scand., 71, 249 (1985); и Battegay,et al., Neuropsychobiology, 13, 31 (1985). Все патенты США, которые упоминаются выше в связи с соединениями, используются в данном изобретении и включены в описание посредством ссылки. Вообще, комбинации и способы лечения, в которых используют флуоксетин или дулоксетин в качестве SRI, являются предпочтительными. Специалистам понятно, что все соединения, используемые в данном изобретении, способны образовывать соли и что обычно применяются солевые формы фармацевтических средств, часто потому, что соли легче кристаллизовать и очищать, чем свободные основания. Во всех случаях применение фармацевтических средств, описанных выше в виде солей, рассматривают в описании и часто их предпочитают, а фармацевтически приемлемые соли всех соединений включены в их названия. Дозировки лекарственных средств, используемые в данной комбинации, в конечном счете, устанавливает врач, используя сведения о лекарственных средствах, свойствах лекарственных средств в комбинации, которые установлены в клинических испытаниях, и характеристики пациента, включая сопутствующие заболевания помимо того, по причине которого лечат пациента. Представлены общие описания дозировок и некоторые предпочтительные дозировки. Рекомендации относительно дозировок для некоторых из лекарственных средств сначала будут даны отдельно; для создания руководства для любой желательной комбинации, следует выбрать рекомендации для каждого из компонентов лекарственных средств. Флуоксетин: приблизительно от 1 до 80 мг,один раз/день; предпочтительно приблизитель 39 но от 10 до 40 мг один раз/день; в случае булимии и обсессивно-компульсивного заболевания предпочтительно от 20 до 80 мг один раз/день; Дулоксетин: приблизительно от 1 до 30 мг один раз/день; предпочтительно приблизительно от 5 до 20 мг один раз/день; Венлафаксетин: приблизительно от 10 до 150 мг один-три раза/день; предпочтительно приблизительно от 25 до 125 мг трижды/день; Мильнаципран: приблизительно от 10 до 100 мг один-два раза/день; предпочтительно приблизительно от 25 до 50 мг дважды/день; Циталопрам: приблизительно от 5 до 50 мг один раз день; предпочтительно приблизительно от 10 до 30 мг один раз/день; Флувоксамин: приблизительно от 20 до 500 мг один раз день; предпочтительно приблизительно от 50 до 300 мг один раз/день; Пароксетин: приблизительно от 5 до 100 мг один раз день; предпочтительно приблизительно от 5 до 300 мг один раз/день. В общих чертах, комбинаций данного изобретения создают, выбирая дозировки SRI в соответствии с вышеупомянутыми рекомендациями, а дозировки соединения формулы I или формулы Iа выбирают в диапазонах, предложенных выше. Вспомогательную терапию данного изобретения осуществляют введением SRI вместе с соединением формулы I или формулы Iа с помощью любого способа, который обеспечит эффективные уровни двух соединений в организме одновременно. Все из рассматриваемых соединений приемлемы для перорального введения и обычно вводятся перорально, а подобное пероральное введение вспомогательной комбинации является предпочтительным. Их можно вводить вместе в одной дозированной форме или раздельно. Однако пероральное введение не является единственным способом или даже предпочтительным способом введения. Например, трансдермальное введение может оказаться желательным для пациентов, которые забывчивы или относятся с предубеждением к приему перорального лекарственного средства. Одно из лекарственных средств можно вводить с помощью такого способа, как пероральный, а при особых обстоятельствах другое может быть введено посредством трансдермального, чрескожного,внутривенного, внутримышечного, интраназального или интраректального способа. Способ введения можно изменять любым образом, ограниченным физическими свойствами лекарственных средств, удобством и безопасностью для пациента. Однако особенно предпочтительным способом введения вспомогательной комбинации является введение ее в виде одной фармацевтической композиции, и такие фармацевтические композиции, включающие как SRI, так и соединение формулы I или формулы Iа являются 40 важным воплощением данного изобретения. Такие композиции могут иметь любую физическую форму, которая оказывается фармацевтически приемлемой, однако фармацевтические композиции, пригодные для перорального применения, особенно предпочтительны. Такие вспомогательные фармацевтические композиции содержат эффективное количество каждого из соединений, эффективное количество которого относится к ежедневной дозе вводимых соединений. Каждая вспомогательная стандартная доза может содержать ежедневные дозы обоих соединений, или может содержать часть ежедневной дозы, такую как одна треть дозы. Альтернативно, каждая стандартная доза может содержать целую дозу одного из соединений и часть дозы другого соединения. В таком случае,пациент ежедневно будет получать одну из стандартных доз комбинации и одну или более стандартных доз, содержащих только другое соединение. Количество каждого лекарственного средства, которое содержится в каждой стандартной дозе, зависит от идентичности лекарственных средств, выбранных для терапии, и других таких факторов, как показания, на основании которых применяют вспомогательную терапию. Как сказано выше, преимуществом вспомогательной терапии является ее способность вызывать увеличение содержания серотонина,норэпинефрина и допамина посредством SRIсоединений, приводя в результате к увеличенной активности при лечении различных состояний, описанных подробно ниже. Увеличение содержания серотонина особенно важно и является предпочтительным аспектом изобретения. Кроме того, изобретение обеспечивает более быстрое начало действия препаратов, чем обычно обеспечивается при лечении одним SRI. Предпочтительные патологические состояния, которые следует лечить с помощью данного метода вспомогательной терапии,включают депрессию, булимию, обсессивнокомпульсивное заболевание и ожирение. Другим предпочтительным состоянием более специфичным в отношении лечения комбинациями,включающими дулоксетин, а также венлафаксин и мильнадипран, является недержание мочи. В последнее время депрессия, со многими ее проявлениями, стала значительно более очевидной для широкой публики, чем ранее. В настоящее время она рассматривается как крайне разрушающее расстройство и как расстройство,которое поражает большую часть населения. Самоубийство является экстремальным симптомом депрессии, но миллионы людей, не так сильно пораженные заболеванием, живут в страдании и в частичной или полной бесполезности, и в результате их недуга также страдают семьи. Появление флуоксетина оказалось прорывом в лечении депрессии и в настоящее время, по всей вероятности, депрессивные состоя 41 ния лучше диагносцируются и лечатся, чем десять лет назад. Дулоксетин проходит клинические испытания в отношении лечения депрессии. Депрессия часто сопровождается другими заболеваниями и состояниями, или вызывается такими другими состояниями. Например, она связана с болезнью Паркинсона; СПИДом; болезнью Альцгеймера и со злоупотреблением анаболическими стероидами. Депрессия также может быть связана со злоупотреблением любыми веществами, или связана с поведенческими проблемами, являющимися следствием травмы головы, отставанием умственного развития или шока или возникающими при этих состояниях. Депрессия во всех ее проявлениях является предпочтительным объектом для лечения данным способом вспомогательной терапии и композициями. Обсессивно-компульсивное заболевание проявляется в различной степени и с большим разнообразием и симптомов, обычно связанных с неконтролируемым побуждением пациента производить бесполезные, ритуальные действия. Видимыми характеристиками заболевания являются действия приобретения, приказывания мытья и тому подобные вне любой разумной потребности и целесообразности. В результате заболевания, тяжело пораженный пациент не способен делать что-то кроме осуществления ритуальных действий. Флуоксетин, одобренный для лечения обсессивно-компульсивного заболевания в США и других странах, как было показано, оказался эффективным. Ожирение является часто встречающимся заболеванием среди населения Америки. Обнаружено, что флуоксетин позволяет тучному пациенту уменьшить вес, что сопровождается благоприятным воздействием на кровообращение и состояние сердца пациента при общем хорошем самочувствии и энергии. Недержание мочи обычно классифицируют как недержание мочи при напряжении или побудительное недержание, зависящее от того,является ли причинным фактором неспособность мышц сфинктера к контролю или гиперфункция мышц мочевого пузыря. Дулоксетин регулирует оба типа недержания мочи, или оба типа сразу, и, таким образом, является важным для многих людей, которые страдают от этого мешающего и калечащего нарушения. Данная комбинация полезна для лечения множества других заболеваний, нарушений и состояний, которые представлены ниже. Во многих случаях, упоминаемые в описании заболевания классифицированы в International Classification of Diseases, 9th Edition (ICD), или в Diagnostic and Statistical Manual of Mental Disorders, 3rd Version Revised, опубликованными Ассоциацией психиаторов Америки (DSM). В таком случае, для удобства чтения ниже представлены номера кодов ICD или DSM. 42 Депрессия, ICD 296,2296,3; DSM 296; 294,80; 293,81; 293,82; 293,83; 310,10; 318,00; 317,00 мигрень боль, особенно невропатическая боль булимия, ICD 307,51; DSM 307,51 предменструальный синдром или синдром поздней лютеиновой фазы, DSM 307,90 алкоголизм, ICD 305,0; DSM 305,00303,90 злоупотребление табаком, ICD 305,1; DSM 305,10292,00 паническое расстройство, ICD 300,01;DSM 307,10 нарушения сна, ICD 307,4 аутизм мутизм трихотилломания Кроме того, соединения формулы I или формулы Iа особенно полезны для купирования симптомов прекращения курения или синдрома отмены никотина, когда их вводят в комбинации с ингибитором обратного захвата серотонина. SRI's (ингибиторы обратного захвата серотонина), которые применяют в этом способе лечения, способы введения и композиции описаны выше. Применение соединений в комбинации с SRI's пациентами, старающимися прекратить употребление табака или никотина,обеспечивает им неожиданно полное купирование обычно болезненных и повреждающих симптомов, включая неврозность, раздрожимость,жажду чего-либо, чрезмерный аппетит, состояние тревоги, депрессию во многих формах, невозможность концентрировать внимание и тому подобное. Терапевтическое применение. Соединения формулы I или формулы Iа полезны для других важных терапевтических целей, а также в сочетании с SRI's при синдроме отмены никотина или в случаях прекращения курения. В частности, соединения полезны для 43 антагонизации 1A-рецептора серотонина и, соответственно, используются для лечения или предупреждения состояний, вызванных избыточной активностью такого рецептора или зависимых от этой активности. Точнее, соединения формулы I или формулы Iа полезны при лечении состояния тревоги,депрессии, артериальной гипертонии, нарушений познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти, расстройств аппетита и ожирения, токсикомании, обсессивно-компульсивного заболевания, панического расстройства и мигрени. Чувство тревоги и часто сопутствующее ему паническое расстройство можно особо упомянуть в связи с данными соединениями. Предмет тщательно описывают в Diagnostic and Statistical Manual of Mental Disorders, опубликованном Ассоциацией психиаторов Америки, в котором состояние тревоги классифицируют как класс 300,02. Другим особо отмечаемым нарушением является депрессия и группа связанных с депрессией расстройств, которые обсуждались выше при описании вспомогательной терапии с помощью SRT's. Фармацевтические композиции. Экспериментально обосновано приготовление фармацевтических средств для введения,которое обеспечивает контроль за дозировкой и стабильностью продукта при доставке и хранении, а используемые способы приготовления лекарственного средства вполне применимы к соединениям формулы I и формулы Iа. Такие композиции, содержащие, по крайней мере,один фармацевтически приемлемый носитель,являются ценными и новыми вследствие присутствия в них соединений формулы I или формулы Iа. Хотя химикам-фармацевтам хорошо известны многочисленные эффективные пути приготовления фармацевтических средств, технология которых применима к данным соединениям, для удобства читателя некоторое обсуждение этого вопроса в описании прилагается. Используют обычные способы приготовления лекарственного средства, применяемые в фармацевтической отрасли, и обычные типы композиций, включающие таблетки, жевательные таблетки, капсулы, растворы, парентеральные растворы, интраназальные аэрозоли или порошки, пастилки и суспензии. Обычно композиции содержат всего приблизительно от 0,5 до 50% соединения, в зависимости от требуемой дозы и типа применяемой композиции. Однако количество соединения формулы I или формулыIа лучше всего определить как эффективное количество, т.е. количество соединения, которое обеспечивает требуемую дозу пациенту, нуждающемуся в таком лечении. Активность соединений не зависит от типа композиции, так как композицию выбирают и готовят только для 44 удобства и экономии. Любое соединение может быть приготовлено в любой желаемой форме композиции. Определенное обсуждение различных композиций предлагается с последующей демонстрацией некоторых типичных препаратов. Капсулы готовят смешиванием соединения с приемлемым разбавителем и заполняют капсулы надлежащим количеством смеси. Обычные разбавители включают инертные порошкообразые вещества, такие как крахмал многих различных видов, порошкообразную целлюлозу,особенно кристаллическую и микрокристаллическую целлюлозу, сахара, такие как фруктоза,маннит и сахароза, зерновую гранулированную муку и подобные съедобные порошки. Таблетки готовят прямым прессованием,влажным гранулированием или сухим гранулированием. В их составы обычно вводят разбавители, связующие вещества, смазки и дезинтеграторы, а также соединение. Типичные разбавители включают, например, различные типы крахмала, лактозу, маннит, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлорид натрия, и порошкообразный сахар. Также полезны порошкообразные производные целлюлозы. Типичными связующими веществами таблеток являются такие вещества, как крахмал, желатин и сахара, такие как лактоза,фруктоза, глюкоза и тому подобные. Также подходят природные и синтетические смолы,включая аравийскую камедь, альгинат, метилцеллюлозу, поливинилпирролидин и подобные. В качестве связующих веществ могут служить полиэтиленгликоль, этилцеллюлоза и вески. Смазки необходимы в составе таблеток для предохранения таблетки от склеивания с пуансоном в матрице. Смазки выбирают из таких скользких твердых веществ, как тальк, стеарат магния и кальция, стеариновая кислота и гидрогенизированные растительные масла. Таблеточные дезинтеграторы представляют собой вещества, которые набухают при смачивании, чтобы разрушить таблетку и высвободить соединение. Они включают крахмал, глины, целлюлозы, алгины и смолы. Точнее, можно использовать, например, кукурузный и картофельный крахмал, метилцеллюлозу, агар, бентонит, древесную целлюлозу, порошкообразную природную губку, катионообменные смолы,альгиновую кислоту, гуарную смолу, цитрусовую пульпу и карбоксиметилцеллюлозу, а также лаурилсульфат натрия. Энтерические композиции часто применяют, чтобы защитить активный ингредиент от кислотного содержимого желудка. Такие композиции создают посредством покрытия твердой дозированной формы пленкой полимера,который нерастворим в кислотной среде, а растворяется в основной среде. Образцами пленок являются ацетатфталатцеллюлоза, поливинилацетатфталат, фталатгидроксипропилметилцел 45 люлоза и ацетатсукцинатгидроксипропилметилцеллюлоза. Таблетки часто покрывают сахаром в качестве вкусового вещества и герметика или пленкообразующими защищающими агентами для изменения растворимости таблетки. Соединения также могут изготавливаться в виде жевательных таблеток, с использованием в препарате большого количества имеющих приятный вкус веществ, таких как маннит, что хорошо укоренилось в практике. В настоящее время быстрорастворяющиеся таблеткоподобные композиции также часто применяют для гарантии, что пациент получает дозированную форму и чтобы избежать затруднений при глотании твердого предмета, что беспокоит некоторых пациентов. При необходимости введения комбинации в виде суппозитория можно использовать обычные основы. Масло какао является традиционной основой суппозиторий, которые можно модифицировать добавлением восков, чтобы незначительно повысить точку плавления. Также широко используют смешивающиеся с водой основы суппозиторий, включающие, в частности, полиэтиленгликоли с различными молекулярными массами. В последнее время становятся популярными трансдермальные пластыри. Обычно они содержат смолистую композицию, в которой растворяют лекарственное средство, или частично растворяют, которая удерживается при контакте с кожей с помощью пленки, защищающей композицию. В последнее время множество патентов появилось в данной области. Также находят применение другие более сложные пластырные композиции, особенно композиции, пронизанные бесчисленными порами,через которые лекарственные средства нагнетаются посредством осмотического действия. Следующие типичные составы предлагаются для интереса информации фармацевтов. Композиция 1. Твердые желатиновые капсулы готовят,используя следующие ингредиенты: Соединение примера 1 Крахмал, высушенный Стеарат магния Итого Композиция 2. Таблетки готовят, используя представленные ниже ингредиенты: Соединение примера 2 Целлюлоза, микрокристаллическая Диоксид силикона, дымящаяся Стеариновая кислота Итого 46 Компоненты смешивают и прессуют для образования таблеток, каждая весом 425 мг. Композиция 3. Таблетки, каждая из которых содержит 10 мг активного ингредиента, делают следующим образом: Соединение примера 3 Крахмал Целлюлоза, микрокристаллическая Поливинилпирролидон(в виде 10% раствора) Натрийкарбоксиметилкрахмал Стеарат магния Тальк Итого Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш U.S. и основательно перемешивают. Водный раствор,содержащий поливинилпирролидон, смешивают с полученным порошком, а смесь затем пропускают через сито 14 меш U.S. Полученные таким образом гранулы высушивают при 50 С и пропускают через сито 18 меш U.S. Натрийкарбоксиметилкрахмал, стеарат магния и тальк,предварительно пропущенные через сито 60 меш U.S., затем добавляют к гранулам, которые после смешивания прессуют в машине для изготовления таблеток для получения таблеток, каждая весом 100 мг. Композиция 4. Капсулы, каждая содержащая по 30 мг активного ингредиента, делают следующим образом: Соединение примера 4 Крахмал Целлюлоза, микрокристаллическая Стеарат магния Итого Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 45 U.S. и заливают в твердые желатиновые капсулы в количестве 150 мг. Композиция 5. Суппозитории, каждая содержащая по 5 мг активного ингредиента, производят следующим образом: Соединение примера 5 Насыщенные глицериды жирных кислот Итого Активный ингредиент пропускают через сито 60 меш U.S. и суспендируют в насыщенных глицеридах жирных кислот, предварительно расплавленных при минимально необходимом нагревании. Смесь затем заливают в суппозиторную форму с номинальной емкостью 2 г и оставляют для охлаждения. Композиция 6. Суспензии, каждая содержащая по 10 мг активного ингредиента на 5 мл дозы, готовят следующим образом: Соединение примера 6 Натрийкарбоксиметилцеллюлоза Сироп Раствор бензойной кислоты Вкусовое вещество Краситель Очищенная вода до объема 10 мг 50 мг 1,25 мл 0,10 мл Достаточное количество Достаточное количество 5 мл Активный ингредиент пропускают через сито 45 меш U.S. и смешивают с натрийкарбоксиметилцеллюлозой и сиропом до образования однородной пасты. Раствор бензойной кислоты, вкусовое вещество и краситель разбавляют порцией воды и добавляют при перемешивании. Затем добавляют достаточное количество воды, чтобы получить требуемый объем. Композиция 7. Внутривенную композицию можно приготовить следующим образом: Соединение примера 7 Изотонический солевой раствор Композиция 8. Твердые желатиновые капсулы готовят по способу, аналогичному способу приготовления композиции 1, используя следующие ингредиенты: Количество(+)-1-(2-Метоксифенил)-4-[3(циклогексанкарбонил)-3-(фенил)бутил]пиперазин НСl Крахмал, высушенный Стеарат магния Итого(+)-1-(2-Метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил] пиперазин НСl Крахмал Целлюлоза, микрокристаллическая Поливинилпирролидон (в виде 10% раствора) Натрийкарбоксиметилкрахмал Стеарат магния Тальк Итого Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш U.S. и основательно перемешивают. Водный раствор,содержащий поливинилпирролидон, смешивают с полученным порошком, а затем смесь пропускают через сито 14 меш U.S. Полученные таким образом гранулы высушивают при 50 С и пропускают через сито 18 меш U.S. Натрийкарбоксиметил крахмал, стеарат магния и тальк,предварительно пропущенные через сито 60 меш U.S., затем добавляют к гранулам, которые после смешивания прессуют на машине для изготовления таблеток, чтобы получить таблетки,каждая весом 100 мг. Композиция 11. Капсулы, каждая содержащая по 30 мг активного ингредиента, делают следующим образом по способу, аналогичному способу для композиции 4:(+)-1-(2-Метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил] пиперазин НСl Крахмал Целлюлоза, микрокристаллическая Стеарат магния Итого Композиция 9. Таблетки готовят, используя представленные ниже ингредиенты: Количество(+)-1-(2-Метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил) бутил]пиперазин НСl Целлюлоза, микрокристаллическая Диоксид силикона, дымящийся Стеариновая кислота Итого Соединения смешивают и прессуют для образования таблеток, каждая из которых содержит 425 мг, по способу аналогичному способу приготовления композиции 2. Композиция 10. Таблетки, каждая из которых содержит по 10 мг активного ингредиента, делают следующим способом: где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(C1-C6)алкила, (C1-C6)алкокси, (C1-С 6)алкилтио,(С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 2-С 6)алкилгалоида, (С 3-C8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1 С 6)алкокси, (C1-С 6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3 49 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1 С 6)алкилтио, (С 2-С 6)алкенила, (С 2-С 6)алкинила,(C1-C6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3 С 8)циклоалкенила или галоида; Х означает -С(=O)-, -СНОН- или -СН 2-; или его фармацевтически приемлемая соль, рацемат, оптический изомер или сольват. 2. Соединение по п.1, где Аr представляет собой фенил или пиридин. 3. Соединение по п.2, где Аr представляет собой фенил, замещенный (C1-С 6)алкокси. 4. Соединение по п.3, где R2 представляет собой фенил или (С 3-С 12)циклоалкил. 5. Соединение по п.4, где R1 представляет собой водород. 6. Соединение по п.5, где Х представляет собой -С=O. 7. Способ антагонизации 1A-рецептора серотонина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения по п.1 или его фармацевтически приемлемой соли, рацемата, оптического изомера или сольвата. 8. Способ купирования симптомов, вызванных синдромом отмены или частичным синдромом отмены употребления табака или никотина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(С 1-С 6)алкила, (C1-C6)алкокси, (C1-С 6)алкилтио,(С 2-С 6)алкенила, (C2-C6)алкинила, (C2-C6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1C6)алкокси, (C1-C6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида; 50 или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. 9. Способ по п.8, отличающийся тем, что соединение представляет собой 1-(2-метоксифенил)-4-[3-(бензоил)-3-(фенил)пропил]пиперазин; 1-(2-пиридил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин; 1-(2-этоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)пропил]пиперазин гидрохлорид; 1-(2-метоксифенил)-4-[3-(бензоил)-3-(фенил)бутил]пиперазин оксалат; 1-(2-метоксифенил)-4-[3-(циклопептанкарбонил)-3-(фенил)пропил]пиперазин гидрохлорид; 1-(2-метоксифенил)-4-[3-(циклогептанкарбонил)-3-(фенил)пропил]пиперазин гидрохлорид; и 1-(2-метоксифенил)-4-[4-(циклогексил)4-(гидрокси)-3-(фенил)бутил]пиперазин оксалат. 10. Способ лечения состояния тревоги,включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(C1-С 6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио,(С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 2-С 6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1 С 6)алкокси, (C1-C6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3C8)циклоалкила, (С 3-C8)циклоалкенила или галоида;R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1C6)алкилтио, (C2-C6)алкенила, (C2-C6)алкинила,(C1-C6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3 С 8)циклоалкенила или галоида; Х означает -С(=O)-, -СНОН- или -СН 2-; или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. 11. Способ лечения депрессии, артериальной гипертонии, нарушений познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти, 51 нарушений аппетита, ожирения, токсикомании,обсессивно-компульсивного заболевания, панического расстройства или мигрени, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио,(С 2-С 6)алкенила, (С 2-С 6)алкинила, (C2-C6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1C6)алкокси, (C1-C6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1C6)алкилтио, (C2-C6)алкенила, (С 2-С 6)алкинила,(C1-C6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3 С 8)циклоалкенила или галоида; Х означает -С(=O)-, -СНОН- или -СН 2-; или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. 12. Способ потенциирования действия ингибитора обратного захвата серотонина в отношении увеличения содержания серотонина, норэпинефрина и допамина в мозге, включающий введение пациенту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством соединения формулы где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(С 1-С 6)алкила, (C1-C6)алкокси, (C1-C6)алкилтио,(С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 2-С 6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1C6)алкокси, (C1-C6)алкилтио, (C2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3C8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1C6)алкилтио, (С 2-С 6)алкенила, (C2-C6)алкинила,(C1-C6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3 С 8)циклоалкенила или галоида; Х означает -С(=O)-, -СНОН- или -СН 2-; или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. 13. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п.1. 14. Способ по п.8, отличающийся тем, что вводят эффективное количество ингибитора обратного захвата серотонина. 15. Способ по п.14, отличающийся тем, что ингибитор обратного захвата серотонина представляет собой флуоксетин, дулоксетин, венлафаксин, мильнаципран, циталопрам, флувоксамин или пароксетан. 16. Способ помощи пациенту в прекращении или снижении употребления им табака или никотина, включающий введение пациенту эффективного количества соединения формулы где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(C1-C6)алкила, (C1-С 6)алкокси, (C1-C6)алкилтио,(C2-C6)алкенила, (С 2-С 6)алкинила, (С 2-С 6)алкилгалоида, (С 3-C8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-С 6)алкила, (C1C6)алкокси, (C1-C6)алкилтио, (С 2-С 6)алкенила,(C2-C6)алкинила, (C1-C6)алкилгалоида, (С 3 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;R3 выбирают из группы, состоящей из водорода, (C1-C6)алкила, (C1-C6)алкокси, (C1C6)алкилтио, (С 2-С 6)алкенила, (С 2-С 6)алкинила,(C1-С 6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3C8)циклоалкенила или галоида; Х означает -С(=O)-, -СНОН- или -СН 2-; или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. или его фармацевтически приемлемые соли. 18. Соединение, которое представляет собой (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин и его фармацевтически приемлемые соли. 19. Соединение по п.18, где фармацевтически приемлемая соль является дигидрохлоридом. 20. Соединение по п.18, где фармацевтически приемлемая соль является солью щавелевой кислоты. 21. Соединение по п.18, где фармацевтически приемлемая соль является солью малеиновой кислоты. 22. Соединение по п.18, где фармацевтически приемлемая соль является солью фосфорной кислоты. 23. Соединение, которое представляет собой (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин монохлоргидат. 24. Способ купирования симптомов, вызванных синдромом отмены или частичным синдромом отмены употребления табака или никотина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы или его фармацевтически приемлемых солей. 25. Способ купирования симптомов, вызванных синдромом отмены или частичным синдромом отмены употребления табака или никотина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1-(2-метоксифенил)-4-[3(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей. 26. Способ потенциирования действия ингибитора обратного захвата серотонина в отношении увеличения содержания серотонина, норэпинефрина и допамина в мозге, включающий введение пациенту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством соединения формулы или его фармацевтически приемлемых солей. 27. Способ потенциирования действия ингибитора обратного захвата серотонина в отношении увеличения содержания серотонина, норэпинефрина и допамина в мозге, включающий введение пациенту, нуждающемуся в таком лечении, ингибитора обратного захвата серотонина в сочетании с эффективным количеством (+)1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей. 28. Способ по п.27, отличающийся тем, что ингибитор обратного захвата серотонина является флуоксетаном. 29. Способ антагонизации 1A-рецептора серотонина, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1-(2-метоксифенил)-4[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин или его фармацевтически приемлемых солей. 30. Способ лечения состояния тревоги,включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества(+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей. 31. Способ лечения депрессии, артериальной гипертонии, нарушений познавательной способности, психоза, нарушений сна, нарушений двигательной функции желудка, сексуальной дисфункции, травмы мозга, потери памяти,расстройства аппетита, ожирения, токсикомании, обсессивно-компульсивного заболевания,панического расстройства или мигрени, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества (+)-1(2-метоксифенил)-4-[3-(циклогексанкарбонил)3-(фенил)бутил]пиперазина или его фармацевтически приемлемых солей. 32. Способ помощи пациенту в прекращении или уменьшении употребления им табака или никотина, включающий введение пациенту эффективного количества соединения формулы или его фармацевтически приемлемых солей. 33. Способ помощи пациенту в прекращении или уменьшении употребления им табака или никотина, включающий введение пациенту эффективного количества (+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил) 55 бутил]пиперазин или его фармацевтически приемлемых солей. 34. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и(+)-1-(2-метоксифенил)-4-[3-(циклогексанкарбонил)-3-(фенил)бутил]пиперазин или его фармацевтически приемлемые соли. 35. Способ получения соединения формулы II(С 3-C12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (С 1-С 6)алкила, (C1C6)алкокси, (C1-С 6)алкилтио, (C2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3C8)циклоалкила, (С 3-С 8)циклоалкенила или галоида; где R1, R2 и R3 являются такими, как описано выше, подходящим основанием и соединением формулы IV где Х представляет собой подходящую покидающую группу для получения соединения формулы V и окисление соединения формулы V подходящим окисляющим агентом для получения соединения формулы II. 36. Способ по п.35, отличающийся тем, что 56 38. Способ по п.37, отличающийся тем, что подходящим окисляющим агентом является озон. 39. Способ по п.38, отличающийся тем, что подходящим основанием является трет-бутилат калия. 40. Соединение формулы(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1C6)алкокси, (C1-C6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-С 6)алкилгалоида, (С 3 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-C6)алкила, (C1C6)алкокси, (С 1-С 6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3 С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;R2 представляет собой циклогексил и где Аr представляет собой моно- или бициклический арильный или гетероарильный радикал,замещенный от одного до трех заместителями,выбранными из группы, состоящей из водорода,(C1-C6)алкила, (C1-C6)алкокси, (C1-С 6)алкилтио,(С 2-С 6)алкенила, (С 2-С 6)алкинила, (С 2-С 6)алкилгалоида, (С 3-С 8)циклоалкила, (С 3-С 8)циклоалкенила или галоида;(С 3-С 12)циклоалкил, замещенный одним или двумя заместителями, выбранными из группы,состоящей из водорода, (C1-С 6)алкила, (C1C6)алкокси, (C1-С 6)алкилтио, (С 2-С 6)алкенила,(С 2-С 6)алкинила, (C1-C6)алкилгалоида, (С 3 58 С 8)циклоалкенила, (С 3-С 8)циклоалкенила или галоида;X означает -С(=O)-, -СНОН- или -СН 2-; или его фармацевтически приемлемой соли,рацемата, оптического изомера или сольвата. 45. Соединение по п.44, где Аr представляет собой
МПК / Метки
МПК: C07D 295/092, A61K 31/4965, A61P 25/34
Метки: серотонина, арилпиперазины, имеющие, рецептора, активность, отношении
Код ссылки
<a href="https://eas.patents.su/30-3703-arilpiperaziny-imeyushhie-aktivnost-v-otnoshenii-1-a-receptora-serotonina.html" rel="bookmark" title="База патентов Евразийского Союза">Арилпиперазины, имеющие активность в отношении 1 а рецептора серотонина</a>
Предыдущий патент: Производные фталазина в качестве ингибиторов фосфодиэстеразы 4
Следующий патент: Фунгицидная смесь на основе амидных соединений и производных бензамидоксима
Случайный патент: Композиция липосом для введения млекопитающему, в том числе человеку












