Производные амида кинуреновой кислоты как антагонисты nr2b подтипа рецептора nmda
Номер патента: 11636
Опубликовано: 28.04.2009
Авторы: Хорват Чилла, Надь Йожеф, Колок Шандор, Фаркаш Шандор, Борза Иштван
Формула / Реферат
1. Производные амида кинуреновой кислоты, соответствующие формуле (I)
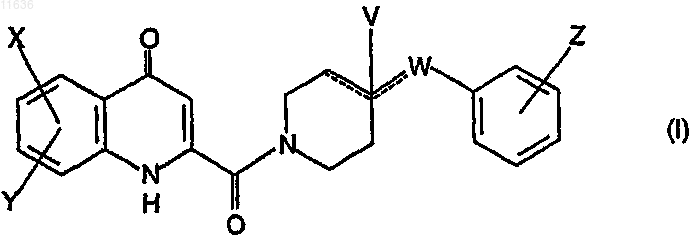
в которой значения X и Y независимо друг от друга представляют собой водород, гидрокси, амино,
C1-C4алкилсульфонамидо, факультативно замещенную атомом галогена либо атомами галогена,
C1-C4алканоиламидо, факультативно замещенную атомом галогена либо атомами галогена,
C1-C4алкокси, C1-C4алкоксикарбонильную группу; либо
соседние X и Y группы вместе с одним либо более идентичным или отличающимся дополнительным гетероатомом и -СН= и/или -СН2-группами могут сформировать необязательно замещенное
4-7-членное гомо- либо гетероциклическое кольцо, предпочтительно морфолиновое, пиррольное, пирролидиновое, оксо- или тиоксопирролидиновое, пиразоловое, пиразолидиновое, имидазольное, имидазолидиновое, оксо- или тиоксоимидазольное или имидазолидиновое, 1,4-оксазиновое, оксазольное, оксазолидиновое, оксо- или тиоксооксазолидиновое или 3-оксо-1,4-оксазиновое кольцо;
W представляет собой атом кислорода, так же как и C1-C4алкилен, C2-C4алкенилен, аминокарбонил, -NH-, -N(алкил)-, -СН2О-, -CH2S-, -СН(ОН)-, -ОСН2-группу, где алкил представляет собой
C1-C4алкильную группу,
когда отмеченные штрихом связи соответствуют простой С-С связи, значение V соответствует гидроксигруппе или атому водорода, или
когда W представляет собой C1-C4 алкиленовую или C3-C4 алкениленовую группу, тогда одна из отмеченных штрихом связей ![]() может соответствовать дополнительной двойной С-С связи, и в этом случае V обозначает электронную пару, которая участвует в двойной связи;
может соответствовать дополнительной двойной С-С связи, и в этом случае V обозначает электронную пару, которая участвует в двойной связи;
Z представляет собой водород либо атом галогена, C1-C4алкильную, C1-C4алкокси, трифторметильную, гидрокси- либо карбоксильную группу,
а также их оптические изомеры, рацемические соединения и соли.
2. Соединение по п.1, в котором в формуле (I)
X означает атом водорода и
Y означает гидрокси- либо бензилоксигруппу или
соседние X и Y группы образуют -NH-CO-O-цепь;
W соответствует атому кислорода, так же как и C1-C4алкилен-, -СН2О- либо -ОСН2-группе;
V соответствует гидроксигруппе либо атому водорода;
Z соответствует атому водорода либо атому галогена, либо C1-C4алкильной группе, и
отмеченные штрихом связи ![]() соответствуют простым С-С связям.
соответствуют простым С-С связям.
3. Соединение по п.1, выбранное из нижеследующей группы:
2-[4-(4-фторбензил)пиперидин-1-карбонил]-6-гидрокси-1Н-хинолин-4-он,
2-(4-бензилпиперидин-1-карбонил)-6-гидрокси-1Н-хинолин-4-он,
6-гидрокси-2-[4-(4-метилбензил)пиперидин-1-карбонил]-1Н-хинолин-4-он,
2-[4-(4-хлорбензил)пиперидин-1-карбонил]-6-гидрокси-1Н-хинолин-4-он,
2-(4-бензилоксипиперидин-1-карбонил)-6-гидрокси-1Н-хинолин-4-он,
6-гидрокси-2-(4-феноксиметилпиперидин-1-карбонил)-1Н-хинолин-4-он,
2-[4-(4-хлорофенокси)пиперидин-1-карбонил]-6-гидрокси-1Н-хинолин-4-он,
6-гидрокси-2-(4-паратолилоксипиперидин-1-карбонил)-1Н-хинолин-4-он,
6-(4-бензилпиперидин-1-карбонил)-1,5-дигидрооксазоло[4,5-g]хинолин-2,8-дион,
6-гидрокси-2-(4-феноксипиперидин-1-карбонил)-1Н-хинолин-4-он,
2-(4-бензил-4-гидроксипиперидин-1-карбонил)-6-гидрокси-1Н-хинолин-4-он и
2-(4-бензил-4-гидроксипиперидин-1-карбонил)-7-гидрокси-1Н-хинолин-4-он.
4. Фармацевтические композиции, содержащие эффективное количество производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, Y, W, V, Z и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, либо их оптических изомеров, рацемических соединений или солей в качестве активных компонентов, а также вспомогательные вещества, широко применяемые в фармацевтической практике, такие как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на рН и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие или доставляющие композицию.
соответствуют тем значениям, которые приведены в п.1, либо их оптических изомеров, рацемических соединений или солей в качестве активных компонентов, а также вспомогательные вещества, широко применяемые в фармацевтической практике, такие как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на рН и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие или доставляющие композицию.
5. Способ получения производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, W, V, Z, Y и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, характеризующийся реакцией карбоновой кислоты, соответствующей формуле (II)
соответствуют тем значениям, которые приведены в п.1, характеризующийся реакцией карбоновой кислоты, соответствующей формуле (II)
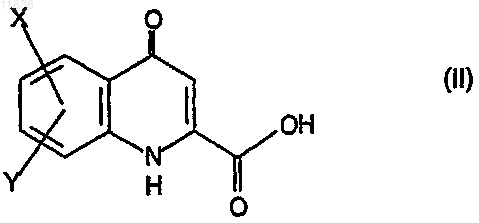
где значения X и Y соответствуют тем значениям, которые приведены в п.1,
либо ее химически активного производного с амином, соответствующим формуле (III)
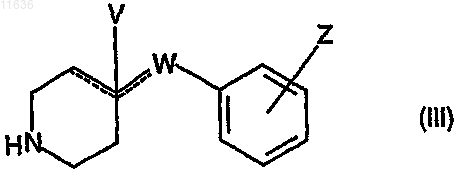
где значения Z, V, W и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, с последующей необязательной трансформацией полученных таким образом производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, Y, W, V, Z и отмеченных штрихом связей
соответствуют тем значениям, которые приведены в п.1, с последующей необязательной трансформацией полученных таким образом производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, Y, W, V, Z и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, в другие соединения, соответствующие формуле (I), путем введения новых заместителей и/или модификации, или удаления имеющихся заместителей, и/или путем формирования соли, и/или высвобождения соединения, соответствующего формуле (I), из состава солей, и/или путем разложения полученных рацемических соединений с использованием оптически активных кислот или оснований с применением известных методов.
соответствуют тем значениям, которые приведены в п.1, в другие соединения, соответствующие формуле (I), путем введения новых заместителей и/или модификации, или удаления имеющихся заместителей, и/или путем формирования соли, и/или высвобождения соединения, соответствующего формуле (I), из состава солей, и/или путем разложения полученных рацемических соединений с использованием оптически активных кислот или оснований с применением известных методов.
6. Способ по п.5, характеризующийся реакцией активного производного карбоновой кислоты, соответствующей формуле (II), в которой значения X и Y соответствуют тем значениям, которые приведены в п.1, с амином, соответствующим формуле (III), в которой значения Z, V, W и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, предпочтительно в присутствии основания.
соответствуют тем значениям, которые приведены в п.1, предпочтительно в присутствии основания.
7. Способ по п.5, характеризующийся реакцией карбоновой кислоты, соответствующей формуле (II), в которой значения X и Y соответствуют тем значениям, которые приведены в п.1, с амином, соответствующим формуле (III), в которой значения Z, V, W и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, в присутствии триэтиламина и О-бензотриазол-1-ил-N,N,N',N'-тетраметилурониумгексафторфосфата (HBTU) в диметилформамиде.
соответствуют тем значениям, которые приведены в п.1, в присутствии триэтиламина и О-бензотриазол-1-ил-N,N,N',N'-тетраметилурониумгексафторфосфата (HBTU) в диметилформамиде.
8. Способ производства фармацевтических композиций, обладающих эффектом NR2B селективного антагониста рецептора NMDA, характеризующийся смешиванием производного амида кинуреновой кислоты, соответствующего формуле (I), в которой значения X, W, V, Z, Y и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, либо его оптических изомеров, рацемических соединений, либо фармацевтически приемлемых солей в качестве активных компонентов, и вспомогательных веществ, широко применяемых в фармацевтической практике, таких как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на pH и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие или доставляющие композицию.
соответствуют тем значениям, которые приведены в п.1, либо его оптических изомеров, рацемических соединений, либо фармацевтически приемлемых солей в качестве активных компонентов, и вспомогательных веществ, широко применяемых в фармацевтической практике, таких как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на pH и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие или доставляющие композицию.
9. Способ лечения и облегчения симптомов следующих заболеваний млекопитающих, включая человека: травматического повреждения головного или спинного мозга, повреждения нервных клеток, связанных с наличием вируса иммунодефицита человека (HTV), бокового амиотрофического склероза (болезнь Шарко), толерантности и/или зависимости при лечении бюыш с применением синтетических наркотических препаратов (опиоидов), синдромов отмены, например, алкоголя, опиоидов или кокаина, ишемических расстройств ЦНС, хронических нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боли и хронических болевых состояний, таких как невропатическая боль или боль, связанная с раковым заболеванием, эпилепсии, тревожности, депрессии, мигрени, психоза, мышечного спазма, слабоумия различного происхождения, гипогликемии, дегенеративных расстройств сетчатки, глаукомы, астмы, звона в ушах, потери слуха, вызванной применением аминогликозидных антибиотиков, характеризующийся введением нуждающимся в лечении млекопитающим эффективного количества/количеств производного амида кинуреновой кислоты, соответствующего формуле (I), в которой значения X, W, V, Z, Y и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, либо его оптических изомеров, рацемических соединений, либо фармацевтически приемлемых солей как самих по себе, так и в комбинации с носителями, наполнителями и т.п., традиционно применяемыми в фармацевтической практике.
соответствуют тем значениям, которые приведены в п.1, либо его оптических изомеров, рацемических соединений, либо фармацевтически приемлемых солей как самих по себе, так и в комбинации с носителями, наполнителями и т.п., традиционно применяемыми в фармацевтической практике.
10. Применение производного амида кинуреновой кислоты, соответствующего формуле (I), в которой значения X, W, V, Z, Y и отмеченных штрихом связей ![]() соответствуют тем значениям, которые приведены в п.1, и/или его оптических изомеров, рацемических соединений и/или фармацевтически приемлемых солей для производства фармацевтических композиций, предназначенных для лечения и облегчения симптомов следующих заболеваний млекопитающих, включая человека: травматического повреждения головного или спинного мозга, повреждения нервных клеток, связанных с наличием вируса иммунодефицита человека (HIV), бокового амиотрофического склероза (болезнь Шарко), толерантности и/или зависимости при лечении боли с применением синтетических наркотических препаратов (опиоидов), синдромов отмены, например, алкоголя, опиоидов или кокаина, ишемических расстройств ЦНС, хронических нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боли и хронических болевых состояний, таких как невропатическая боль или боль, связанная с раковым заболеванием, эпилепсии, тревожности, депрессии, мигрени, психоза, мышечного спазма, слабоумия различного происхождения, гипогликемии, дегенеративных расстройств сетчатки, глаукомы, астмы, звона в ушах, потери слуха, вызванной применением антибиотиков-аминогликозидов.
соответствуют тем значениям, которые приведены в п.1, и/или его оптических изомеров, рацемических соединений и/или фармацевтически приемлемых солей для производства фармацевтических композиций, предназначенных для лечения и облегчения симптомов следующих заболеваний млекопитающих, включая человека: травматического повреждения головного или спинного мозга, повреждения нервных клеток, связанных с наличием вируса иммунодефицита человека (HIV), бокового амиотрофического склероза (болезнь Шарко), толерантности и/или зависимости при лечении боли с применением синтетических наркотических препаратов (опиоидов), синдромов отмены, например, алкоголя, опиоидов или кокаина, ишемических расстройств ЦНС, хронических нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боли и хронических болевых состояний, таких как невропатическая боль или боль, связанная с раковым заболеванием, эпилепсии, тревожности, депрессии, мигрени, психоза, мышечного спазма, слабоумия различного происхождения, гипогликемии, дегенеративных расстройств сетчатки, глаукомы, астмы, звона в ушах, потери слуха, вызванной применением антибиотиков-аминогликозидов.
Текст
011636 Область техники, к которой относится изобретение Настоящее изобретение касается новых производных амида кинуреновой кислоты, которые являются антагонистами NMDA рецептора либо представляют собой промежуточные продукты для их получения. Уровень техники. Рецепторы N-метил-D-аспартата (NMDA) представляют собой катионные каналы, управляемые лигандами, встроенные в клеточные мембраны нервных клеток. Сверхактивация рецепторов NMDA глутаматом, их естественным лигандом, может приводить к перегрузке клеток кальцием. Это запускает каскад внутриклеточных событий, которые изменяют функционирование клетки и в конечном счете могут привести к гибели нейронов [TINS, 10, 299-302 (1987)]. Антагонисты рецепторов NMDA могут применяться для лечения многих заболеваний, которые сопровождаются избыточным высвобождением глутамата,основного возбуждающего нейротрансмиттера в центральной нервной системе. Рецепторы NMDA представляют собой гетеромерные комплексы, состоящие по меньшей мере из 7 субъединиц, для которых известны кодирующие их гены. Субъединица NR1 является необходимым компонентом функциональных каналов-рецепторов NMDA. Обнаружены четыре гена, кодирующие субъединицы NR2 (NR2A-D). Как пространственное распределение в центральной нервной системе(ЦНС), так и фармакологическая чувствительность рецепторов NMDA, имеющих в своем составе различные NR2 субъединицы, являются различными. Недавно были обнаружены субъединицы NR3A иNR3B. Особенно интересной из этих субъединиц является субъединица NR2B в связи с ее ограниченным распределением (наивысшие плотности в переднем мозге и в студенистом веществе спинного мозга). Соединения, селективные для данного подтипа, являются доступными, и их эффективность была показана на животных моделях инсульта [Stroke, 28, 2244-2251 (1997)], при травматических повреждениях мозга [Brain Res., 792, 291-298 (1998)], болезни Паркинсона [Exp. Neural., 163, 239-243 (2000)], невропатической и воспалительной боли [Neuropharmacology, 38, 611-623 (1999)]. Более того, ожидается, что селективные антагонисты NR2B подтипа рецепторов NMDA обладают незначительными или менее опасными побочными действиями по сравнению с неселективными антагонистами рецепторов NMDA, которые обычно вызывают нежелательные эффекты, а именно психотомиметические эффекты, такие как головокружение, головная боль, галлюцинации, дисфория и нарушения когнитивной и двигательной функции. Антагонизм, селективный в отношении NR2B подтипа рецепторов NMDA, может бьпъ достигнут при использовании соединений, которые специфически связываются и действуют на аллостерический регуляторный центр рецепторов, содержащих NR2B субъединицу. Этот связывающий центр может быть охарактеризован путем исследования замещения (связывания) с использованием специфических радиактивно-меченых лигандов, таких как [125J]-ифенпродил [J. Neurochem., 61, 120-126 (1993)] или [3H]-Ro 25,6981 [J. Neurochem., 70, 2147-2155 (1998)]. Поскольку ифенпродил был первым известным лигандом этого рецептора, хотя и недостаточно специфичным, он был также назван ифенпродилсвязывающий центр. Близкие структурные аналоги производных амида карбоновой кислоты, соответствующих формуле(I), из литературы не известны. Раскрытие изобретения Неожиданно было обнаружено, что новые производные амида кинуреновой кислоты, соответствующие формуле (I), являющиеся объектом настоящего изобретения, являются функциональными антагонистами рецепторов NMDA, содержащих субъединицу NR2B, в то время как они не являются эффективными в отношении рецепторов NMDA, содержащих субъединицу NR2A. Таким образом, можно полагать, что они являются антагонистами, специфическими в отношении NR2B подтипа NMDA. Показано, что некоторые соединения эффективны in vivo на мышиной модели боли после перорального введения. Осуществление изобретения Настоящее изобретение, таким образом, в первую очередь касается новых производных амида кинуреновой кислоты, соответствующих формуле (I) в которой значения X и Y независимо друг от друга представляют собой водород, гидрокси, амино,C1-C4 алкилсульфонамидо, факультативно замещенную атомом галогена либо атомами галогена,C1-C4 алканоиламидо, факультативно замещенную атомом галогена либо атомами галогена,C1-C4 алкокси, C1-C4 алкоксикарбонильную группу; либо соседние X и Y группы вместе с одним либо более идентичным или отличающимся дополнительным гетероатомом и -СН= и/или -СН 2-группами могут сформировать необязательно замещенное 4-7-членное гомо- либо гетероциклическое кольцо, предпочтительно морфолиновое, пиррольное, пирролидиновое, оксо- или тиоксопирролидиновое, пиразоловое, пиразолидиновое, имидазольное, имидазоли-1 011636 диновое, оксо- или тиоксоимидазольное или имидазолидиновое, 1,4-оксазиновое, оксазольное, оксазолидиновое, оксо- или тиоксооксазолидиновое или 3-оксо-1,4-оксазиновое кольцо;W представляет собой атом кислорода, также как и C1-C4 алкилен, C2-C4 алкенилен, аминокарбонил,-NH-, -N(алкил)-, -СН 2 О-, -CH2S-, -СН(ОН)-, -ОСН 2-группу, где алкил представляет собойC1-C4 алкильную группу,когда отмеченные штрихом связи соответствуют простой С-С связи, значение V соответствует гидроксигруппе или атому водорода или когда W представляет собой C1-C4 алкиленовую или C3-C4 алкениленовую группу, тогда одна из отмеченных штрихом связей может соответствовать дополнительной двойной С-С связи, и в этом случае V обозначает электронную пару, которая участвует в двойной связи;Z представляет собой водород либо атом галогена, C1-C4 алкильную, C1-C4 алкокси, трифторметильную, гидрокси- либо карбоксильную группу,а также их оптических изомеров, рацемических соединений и солей. Следующими объектами настоящего изобретения являются способы производства новых производных амида кинуреновой кислоты, соответствующих формуле (I), и фармацевтического изготовления медикаментов, содержащих в своем составе данные соединения, равно как и способы лечения с применением данных соединений, что означает введение препаратов в организм нуждающегося в лечении млекопитающего, включая человека, эффективного количества/количеств новых производных амида кинуреновой кислоты, соответствующих формуле (I), являющихся объектом настоящего изобретения, как самих по себе, так и в составе медикамента. Новые производные амида кинуреновой кислоты, соответствующие формуле (I), являющиеся объектом настоящего изобретения, являются высокоэффективными и селективными антагонистами рецептора NMDA и, более того, большая часть этих соединений является селективными антагонистами NR2B подтипа рецептора NMDA. Согласно настоящему изобретению производные амида кинуреновой кислоты, соответствующие формуле (I), синтезируются посредством реакции карбоновой кислоты, соответствующей формуле (II) где значения X и Y являются теми же, которые определены ранее для формулы (I),либо ее активного производного с амином, соответствующим формуле (III) являются теми же, которые определены где значения Z, V, W и отмеченных штрихом связей выше для формулы (I),после чего полученные таким образом производные амида кинуреновой кислоты, соответствующие формуле (I), где значения X, Y, W, Z и отмеченных штрихом связей являются теми же, которые определены выше для формулы (I), в данном случае превращаются в другие соединения, соответствующие формуле (I), путем введения новых заместителей, и/или модификации, или удаления имеющихся заместителей, и/или образования соли, и/или высвобождения соединения из состава солей, и/или разложения полученных рацемических соединений с использованием оптически активных кислот или оснований с применением известных методов. Реакция карбоновой кислоты, соответствующей формуле (II), и амина, соответствующего формуле(III), т.е. формирование амидной связи, осуществляется предпочтительно путем получения активного производного из карбоновой кислоты, соответствующей формуле (II), которое и реагирует с амином,соответствующим формуле (III), предпочтительно в присутствии основания. Превращение карбоновой кислоты в химически активное производное происходит in situ в процессе формирования амидной связи в подходящем растворителе (например, диметилформамиде, ацетонитриле,хлорированных углеводородах или углеводородах). Химически активные производные могут представлять собой хлориды кислот (полученные, например, из карбоновой кислоты и тионилхлорида), смешанные ангидриды (полученные, например, из карбоновой кислоты и изобутилхлорформата в присутствии основания, например, триэтиламина), химически активные сложные эфиры (полученные, например, из карбоновой кислоты и гидроксибензтриазола и дициклогексилкарбодиимида либо О-бензотриазол-1-илN,N,N',N'-тетраметилурониумгексафторфосфата (HBTU) в присутствии основания, такого как, например,триэтиламин). Химически активные производные образуются в диапазоне температур от комнатной температуры до 0 С. Подходящий амин, соответствующий формуле (III), добавляют к полученному таким образом раствору или суспензии в виде основания или в виде соли, образованной с неорганической ки-2 011636 слотой, таким образом, что основание, например триэтиламин, необходимое для высвобождения амина,добавляется в реакционную смесь отдельно. После завершения реакции конденсации проводится тонкослойная хроматография. Необходимое время реакции составляет 6-20 ч. Обработка реакционной смеси может быть осуществлена с применением различных методов. Когда реакционная смесь представляет собой суспензию, осадок отфильтровывают и проводят перекристаллизацию из подходящего растворителя для получения чистого продукта. Если кристаллизация не приводит к получению чистого продукта, то далее для его очистки может быть использована колоночная хроматография. Колоночную хроматографию проводят с использованием Kieselgel 60 в качестве адсорбента и различных систем растворителей, например толуол/метанол, хлороформ/метанол или толуол/ацетон, в качестве элюентов. В том случае, когда реакционная смесь представляет собой раствор, после завершения процесса ацилирования (введения ацильной группы) он концентрируется, после чего продукт кристаллизуется либо очищается с применением колоночной хроматографии, как это описано выше. Структуру продуктов определяют методам инфракрасной спектроскопии (IR), ядерного магнитного резонанса (ЯМР) и масс-спектрометрии. Полученное производное амида кинуреновой кислоты, соответствующее формуле (I), независимо от способа получения в данном случае может быть превращено в другое производное амида кинуреновой кислоты, соответствующее формуле (I), путем введения новых заместителей, и/или модификации, и/или удаления имеющихся заместителей, и/или образования солей с кислотами, и/или высвобождения производного амида карбоновой кислоты, соответствующего формуле (I), из состава полученных добавлением кислоты солей посредством обработки основанием, и/или свободное производное амида кинуреновой кислоты, соответствующее формуле (I), может быть превращено в соль посредством обработки основанием. Например, отщепление метильной и бензильной групп от метокси- и бензилоксигрупп, которые являются кандидатами для X, Y и Z, приводит к образованию производных фенола. Удаление бензильной группы может быть осуществлено, например, путем каталитической гидрогенизации или с использованием бромистого водорода в растворе уксусной кислоты, отщепление метильной группы может быть проведено с использованием трехбромистого бора в растворе дихлорметана. Производные амида кинуреновой кислоты, соответствующие формуле (I), содержащие свободную фенольную гидроксильную группу, могут быть превращены в соединения, содержащие ацилоксигруппу с применением различных ацилирующих агентов. Реакции проводятся при комнатной температуре в хлорированных углеводородах с использованием кислого хлорида либо ангидрида кислоты в качестве ацилирующего агента в присутствии основания (например, триэтиламина или карбоната натрия). Производные амида кинуреновой кислоты, соответствующие формуле (I), содержащие аминогруппу, могут быть превращены в ациламид- или сульфамидопроизводные с применением различных ацилирующих или сульфонилирующих агентов,описанных для ацилирования фенольных гидроксильных групп. Свободные гидроксильные группы могут быть эстерифицированны с использованием ангидридов кислот либо галогенидов кислот в присутствии основания. Карбоновые кислоты, соответствующие формуле (II), и вторичные амины, соответствующие формуле (III), являются как коммерчески доступными, так и могут быть синтезированы с применением различных известных методов. Способы синтеза некоторых коммерчески недоступных карбоновых кислот,соответствующих формуле (II), и вторичных аминов, соответствующих формуле (III), описаны в разделе примеры. Протоколы экспериментов Экспрессия рекомбинантных рецепторов NMDA. Для того чтобы доказать селективность соединений в отношении NR2B, авторы изобретения тестировали их на клеточных линиях, устойчиво экспрессирующих рекомбинантные рецепторы NMDA с субъединичными составами NR1/NR2A или NR1/NR2B. кДНК субъединиц NR1-3 и NR2A человека или субъединиц NR1a и NR2B крысы, субклонированные в индуцибельные экспрессионные векторы млекопитающих, были интродуцированы в HEK 293 клетки, не содержащие рецепторов NMDA, с использованием опосредованного положительно заряженными липидами метода трансфекции [Biotechniques, 1997May; 22(5), 982-7. (1997); Neurochemistry International, 43, 19-29. (2003)]. Устойчивость к неомицину и гигромицину использовалась для отбора клонов, содержащих оба вектора, и моноклональные клеточные линии были получены на основе тех клонов, которые обеспечивали наибольший ответ на взаимодействие с NMDA. Соединения тестировались на их ингибиторную активность в отношении вызванного NMDA увеличения уровня внутриклеточного кальция, который регистрировался при флуоресцентных измерениях содержания кальция. Исследования проводились через 48-72 ч после добавления индуцирующего агента. Кетамин (500 мкМ) также присутствовал в ходе индукции с целью предотвращения цитотоксичности.-3 011636 Определение функциональной активности соединений как антагонистов NMDA на клеткахHEK 293, экспрессирующих рекомбинантные рецепторы NMDA, на основе измерения внутриклеточной концентрации кальция с использованием сканирующего флуориметра для прочтения планшетов. Так как известно, что рецепторы NMDA проницаемы для ионов кальция при возбуждении, степень активации рецептора NMDA и его ингибирование функциональными анатагонистами могут быть определены посредством измерения увеличения внутриклеточной концентрации кальция после воздействия агониста (NMDA) на клетки. Поскольку существует очень высокая степень гомологии между последовательностями рецепторов NMDA крысы и человека (99, 95, 97% для NR1, NR2A и NR2B субъединиц соответственно), полагают, что существует незначительная, если это вообще имеет место, разница в их фармакологической чувствительности. Поэтому результаты, полученные при исследовании (клонированных или нативных) рецепторов NMDA крысы, могут быть в значительной степени достоверно экстраполированы на рецепторы человека. Измерения внутриклеточной концентрации кальция проводили на клетках HEK 293, экспрессирующих NR1a и NR2B или NR2A субъединицы рецептора NMDA. Клетки вносили в стандартные 96-луночные микропланшеты и культуры инкубировали в атмосфере 95% воздуха, 5% СО 2 при 37 С до проведения измерений. Перед измерением в клетки вводили флуоресцентный Са 2+-чувствительный краситель Fluo-4/AM(2-2,5 мкМ). Для остановки введения красителя в клетки клетки дважды промывали раствором, использовавшимся в ходе измерений (140 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 5 мМ HEPES [4-(2-гидроксиэтил)-1 пиперазинэтансульфоновая кислота], 5 мМ HEPES-Na, 20 мМ глюкозы, 10 мкМ глицина, рН 7,4). Затем к клеткам добавляли тестируемые соединения, растворенные в указанном выше растворе (90 мкл/лунку). Измерения внутриклеточной концентрации кальция производили с использованием сканирующего флуориметра для прочтения планшетов. Увеличение флуоресценции Fluo-4, которое соответствовало увеличению внутриклеточной концентрации кальция, индуцировали посредством введения 200 мкМNMDA. Ингибиторную активность тестируемого соединения определяли посредством измерения снижения роста концентрации кальция в присутствии различных концентраций тестируемого соединения. Ингибиторная активность соединения в одной концентрационной точке выражалась как процент ингибирования контрольного ответа на NMDA. Для клеток, эксрессирующих NR1a/NR2B, были построены кривые концентрация-ингибирование. По экспериментальным точкам были построены сигмоидальные кривые концентрация-ингибирование и значения IC50 были определены как концентрация, которая обеспечивает полумаксимальное ингибирование при использовании соединения. Средние значенияIC50 определяли, используя данные по меньшей мере трех независимых экспериментов. Для клеток, экспрессирующих NR1-3/NR2A, антагонизм по отношению к NMDA, который индуцировал рост внутриклеточной концентрации кальция, при использовании соединений настоящего изобретения и соединений для сравнения определяли при концентрации 10 и 15 мкМ соответственно. Биологическая активность соединений. В табл. 1 приведены величины IC50, которые были определены на клетках, трансформированных кДНК для NR1a/NR2B, и процент ингибирования при концентрации 15 мкМ для выбранных примеров соединений, являющихся объектом настоящего изобретения, полученный на клетках, трансформированных кДНК для NR1-3/NR2A. Для сравнения в табл. 2 приведены результаты, которые были получены также с наиболее эффективными известными соединениями для сравнения. Соединения, являющиеся объектом настоящего изобретения, демонстрируют величины IC50 менее чем 15 мкМ, полученные в функциональном тесте на NMDA-антагонизм на клетках, трансформированных кДНК для NR1/NR2B, и являются неактивными при этой концентрации на NR1-3/NR2 Атрансформированных клетках. Таким образом, соединения и фармацевтические композиции настоящего изобретения являются селективными антагонистами по отношению к NR2B подтипу NMDA. Некоторые из соединений обладают более высокой активностью по сравнению с известными соединениями, которые использовали как соединения для сравнения (см. табл. 1).-4 011636 Таблица 1 Активность соединений как антагонистов NMDA, измеренная флуориметрическим методом на клетках, экспрессирующих субъединицы NR1a/NR2B или NR1-3/NR2A Таблица 2 Активность как антагонистов NMDA соединений, используемых для сравнения, измеренная флуориметрическим методом на клетках, экспрессирующих субъединицы Соединениями для сравнения являются следующие:MK-801: (+)-5-метил-10,11-дигидро-5 Н-дибензо[а,d]циклогептен-5,10-имин. Мышиный формалиновый тест для измерения эффективности in vivo. Известно, что инъекция разбавленного формалина в заднюю лапу крысы или мыши обусловливает проявление и развитие двухфазного поведения, связанного с болью, интенсивность которого измеряется как время, затраченное на зализывание/кусание раненной лапы. Вторая фаза, как правило, определяется как связанные с болью события, детектируемые в 15-60-минутном интервале после инъекции формалина. Известно, что рецепторы NMDA вовлечены во вторую фазу ответа на инъекцию формалина, и этот поведенческий ответ чувствителен к блокированию рецепторов NMDA [Dickenson, A. and Besson J.-M.Hypersensitivity: Excitatory Amino Acid Mechanisms and Their Control In Pharmacology of Pain. SpringerVerlag (Berlin) 1997.] Таким образом, авторы использовали вторую фазу формалинового теста для определения эффективности соединений in vivo. Считается, что ингибирование второй фазы ответа отражает анальгетический эффект против продолжительной химически-индуцированной боли [Hunker, S., et al.:Formalin Test in Mice, a Useful Technique for Evaluating Mild Analgesics, Journal of Neuroscience Methods,14 (1985), 69-76.] Использовались самцы-альбиносы мышей линии NMRI (20-25 г). Животные не получали никакой твердой пищи на протяжении приблизительно 16 ч перед экспериментом, но имели свободный доступ к 20% раствору глюкозы. Далее животные получали 1-часовой период акклиматизации (привыкания) в стеклянном цилиндре (примерно 15 см в диаметре), затем помещались в такой же цилиндр с располо-5 011636 женным сзади зеркалом для облегчения наблюдения. Тестируемые соединения суспендировались в 5%Tween-80 (10 мл на 1 кг массы тела) и вводились перорально путем кормления за 15 мин до инъекции формалина (20 мкл 1% формалина в 0,9% растворе хлорида натрия в воде (физиологическом растворе) инъецировалось подкожно в дорзальную поверхность правой задней лапы). Время, потраченное на зализывание и кусание раненой лапы, при проведении измерений составляло от 20 до 25 мин после инъекции формалина. Для определения величины ED50 различные дозы (по меньшей мере пять различных доз) тестируемых соединений давались группам по 5 мышей и результаты выражались как проценты уменьшения времени, потраченного на зализывание, по сравнению с контрольной группой, наблюдавшейся в тот же день, которой давался только растворитель. Величины ED50 (т.е. дозы, вызывающие уменьшение на 50%) были рассчитаны с применением метода подгонки сигмоидальной кривой по Больцману (Boltzman'ssigmoidal curve fitting). Таблица 3 Значения ED50 соединений, отобранных в ходе мышиного формалинового теста Расстройства, которые могут быть успешно вылечены антагонистами рецепторов NMDA, действующими по сайтам, содержащим NR2B, как это было недавно описано Loftis [PharmacologyTherapeutics, 2003, 97: 55-85], включают в себя шизофрению, болезнь Паркинсона, болезнь Хантингтона, усиленную цитотоксичность, вызываемую гипоксией и ишемией, припадки, лекарственную зависимость и боль,в особенности невропатическую, воспалительную и внутреннюю боль любой природы [Eur. J. Pharmacol. 2001,429: 71-78]. Благодаря незначительной тяжести их побочных эффектов по сравнению с неселективными антагонистами NMDA, селективные антагонисты NR2B могут быть полезны при тех заболеваниях, при которых может быть эффективным антагонист NMDA, таких как боковой амиотрофический склероз (болезнь Шарко) [Neurol. Res., 21, 309-12 (1999)]; синдромы отмены, например алкоголя, опиоидов или кокаина[Drag and Alcohol Depend., 59, 1-15 (2000)]; мышечный спазм [Neurosci. Lett., 73, 143-148 (1987)]; слабоумие различного происхождения [Expert Opin. Investig. Drugs, 9, 1397-406 (2000)]; тревожность, депрессия, мигрень, гипогликемия, дегенеративные расстройства сетчатки (например, цитомегаловирусные(CMV) ретиниты); глаукома; астма; звон в ушах; потеря слуха [Drag News Perspect. 11, 523-569 (1998) и международная заявка на WO 00/00197]. Таким образом, эффективные количества соединений настоящего изобретения могут с успехом применяться для лечения травматических повреждений головного или спинного мозга, толерантности и/или зависимости при лечении болей с применением синтетических наркотических препаратов (опиоидов), развития устойчивости, снижения возможного злоупотребления и синдромов отмены при лекарственной зависимости и зависимости, например, от алкоголя, опиоидов или кокаина, ишемических расстройств ЦНС, хронических нейродегенеративных расстройств, таких как, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болей и хронических болевых состояний, таких как,например, невропатическая боль. Соединения, являющиеся объектом настоящего изобретения, а также их фармацевтически приемлемые соли, могут использоваться как сами по себе, так и, соответственно, в составе фармацевтических-6 011636 композиций. Данные композиции (лекарства) могут быть в твердой, жидкой либо полужидкой формах,кроме того, в них могут входить фармацевтические вспомогательные лекарственные вещества и вспомогательные материалы, которые широко применяются на практике, такие как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на рН и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие и доставляющие композицию. Дозировка, необходимая для обеспечения терапевтического эффекта, может варьировать в широких пределах и будет оптимизироваться под индивидуальные требования в каждом конкретном случае в зависимости от стадии заболевания, состояния и массы тела нуждающегося в лечении пациента, так же,как и от чувствительности пациента к активному веществу, способа введения и частоты приема препарата в течение дня. Точная доза используемого активного вещества может быть безошибочно определена лечащим врачом, опытным в данной области и имеющим полную информацию о нуждающемся в лечении пациенте. Фармацевтические композиции, содержащие активное вещество в соответствии с настоящим изобретением, содержат, как правило, от 0,01 до 100 мг активного вещества в единичной дозированной форме. Само собой, возможно, что количество активного вещества в некоторых композициях выходит за верхние либо нижние пределы указанного выше диапазона. Твердые формы фармацевтических композиций могут представлять собой, например, таблетки,драже, капсулы, пилюли или ампулы, содержащие лиофилизированные порошки, пригодные для приготовления инъекций. Жидкие композиции представляют собой пригодные для инъекций и вливаний композиции, жидкие медикаменты, капсулы с жидким содержимым (packing fluids) и капли. Полужидкие композиции могут представлять собой мази, бальзамы, кремы, взбалтываемые микстуры и суппозитории. С целью удобства применения является пригодным, если фармацевтические композиции включают в себя дозированные формы, содержащие в своем составе такое количество активного вещества, которое пригодно для однократного приема либо нескольких повторных приемов или приема их половины, трети либо четвертой части. Такими дозированными формами являются, например, таблетки, которые могут быть покрыты бороздками, позволяющими разламывать их пополам или на четыре части с целью приема строго необходимого количества активного вещества. Таблетки могут быть покрыты кислоторастворимым слоем для того, чтобы гарантировать высвобождение содержащегося в таблетке активного вещества после прохождения таблетки через желудок. Такие таблетки являются покрытыми энтеросолюбильной оболочкой. Подобный эффект может быть также достигнут при инкапсулировании активного вещества. Фармацевтические композиции, пригодные для перорального применения, могут содержать, например, лактозу или крахмал в качестве наполнителей,натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, поливинилпирролидон либо крахмальную пасту в качестве связующих веществ или гранулирующих агентов. Картофельный крахмал или микрокристаллическая целлюлоза добавляются как дезинтегрирующие агенты, но также могут использоваться ультраамилопектин либо формальдегид казеин. Тальк, коллоидная кремниевая кислота, стеарин, стеараты кальция или магния могут применяться в качестве антиадгезивных и смазывающих веществ. Таблетки могут быть изготовлены, например, посредством сырого гранулирования с последующим спрессовыванием. Смешанные активные вещества и наполнители, также как и в данном случае часть дезинтегрирующих веществ, подвергаются гранулированию с применением водного, спиртового либо водно-спиртового раствора связующих веществ с использованием соответствующего оборудования, после чего гранулят подвергается высушиванию. К высушенному грануляту добавляются другие дезинтегрирующие вещества, смазывающие вещества и антиадгезивные агенты, после чего смесь спрессовывается в таблетку. В данном случае таблетки изготавливаются с бороздкой посередине, что облегчает прием препарата. Таблетки могут быть изготовлены непосредственно из смеси активного вещества и подходящих вспомогательных веществ путем спрессовывания. В данном случае таблетки могут покрываться дополнительными веществами, широко применяющимися в фармакологической практике, такими как, например, стабилизаторы, ароматизаторы, красители, такие как сахар, производные целлюлозы (метил- или этилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и т.д.), поливинилпирролидон, фосфат кальция, карбонат кальция, пищевые красители, пищевые добавки, ароматизирующие вещества, пигменты на основе окиси железа, и т.д. В случае капсул смесь активного вещества и вспомогательных веществ заключается внутрь капсул. Жидкие композиции, предназначенные для перорального применения, такие как, например, суспензии, сиропы, эликсиры, могут изготавливаться с применением воды, гликолей, масел, спиртов, красителей и ароматизирующих веществ. Композиции, предназначенные для ректального применения, изготавливаются в виде суппозиториев или растворов для клизм. Суппозитории, помимо активного вещества, могут содержать в своем составе носитель, так называемые основы для суппозиториев (adeps pro suppository). Носителями могут являться растительные масла, такие как гидрированные растительные масла, триглицериды C12-C18 жирных кислот (предпочтительно, носители, имеющие торговое название Witepsol). Активное вещество гомоген-7 011636 но смешивается с измельченной основой для суппозиториев, после чего формуются суппозитории. Композиция, предназначенная для парентерального применения, изготавливается в виде раствора для инъекций. Для приготовления раствора для инъекций активные вещества растворяются в дистиллированной воде и/или в различных органических растворителях, таких как гликолиевые эфиры, в данном случае в присутствии солюбилизаторов, например полиоксиэтиленсорбитанмонолаурата, -моноолеата либо моностеарата (Tween 20, Tween 60, Tween 80). Раствор для инъекций может также содержать различные вспомогательные вещества, такие как консервирующие агенты, например этилендиаминтетраацетат, также как и регулирующие рН агенты и буфера, и в данном случае местное анестезирующее вещество, например лидокаин. Раствор для инъекций, содержащий активное вещество, являющееся объектом настоящего изобретения, перед внесением в ампулы подвергается фильтрованию и стерилизуется после наполнения ампулы. Если активное вещество является гигроскопическим, в таком случае оно может быть стабилизировано посредством лиофилизации. Нижеследующие примеры иллюстрируют настоящее изобретение, никоим образом его не ограничивая. Пример 1. 2-[4-(4-Фторбензил)пиперидин-1-карбонил]-6-гидрокси-1 Н-хинолин-4-он. Смесь 0,5 г (2,4 ммоль) 6-гидрокси-4-оксо-1,4-дигидрохинолин-2-карбоновой кислоты[О-бензотриазол-1-ил-N,N,N',N'-тетраметилурониумгексафторфосфата (Advanced Chem. Tech.)] и 15 мл диметилформамида перемешивается в течение 24 ч при комнатной температуре. Реакционная смесь концентрируется и продукт очищается с применением колоночной хроматографии с использованиемKieselgel 60 в качестве адсорбента (Merck) и смеси толуол:метанол=4:1 в качестве элюента с выходом,соответствующим 0,18 г (19%) титульного соединения. Точка плавления: 190 С (диэтиловый эфир). Пример 2. 2-(4-Бензилпиперидин-1-карбонил)-6-гидрокси-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-бензилпиперидина в соответствии со способом, описанным в примере 1. Точка плавления: 127 С (диэтиловый эфир). Пример 3. 6-Гидрокси-2-[4-(4-метилбензил)пиперидин-1-карбонил 1-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-(4-метилбензил)пиперидина [J. Org. Chem., 64, 3763, (1999)] в соответствии со способом, описанным в примере 1. Точка плавления: 152 С (диэтиловый эфир). Пример 4. 2-[4-(4-Хлорбензил)пиперидин-1-карбонил 1-6-гидрокси-1H-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-(4-хлорбензил)пиперидина (С.А. 77, 34266 w) в соответствии со способом, описанным в примере 1. Точка плавления: 194 С (диэтиловый эфир). Пример 5. 2-(4-Бензилоксипиперидин-1-карбонил)-6-гидрокси-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-бензилоксипиперидина [Tetrahedron Lett., 36, 3465. (1995)] в соответствии со способом, описанным в примере 1. Точка плавления: 103 С (диэтиловый эфир). Пример 6. 6-Гидрокси-2-(4-феноксиметилпиперидин-1-карбонил)-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-феноксиметилпиперидина [DE 254999 (1977)] в соответствии со способом, описанным в примере 1. Точка плавления: 130 С (диэтиловый эфир). Пример 7. 2-[4-(4-Хлорфенокси)пиперидин-1-карбонил]-6-гидрокси-1 Н-хинолин-4-он.a) трет-Бутиловый сложный эфир 4-(4-хлорфенокси)пиперидин-1-карбоновой кислоты. В атмосфере аргона к перемешиваемому раствору 10,0 г (49,7 ммоль) трет-бутилового сложного эфира 4-гидроксипиперидин-1-карбоновой кислоты [Bioorg. Med. Chem. Lett. 10,2815. (2000)] в 80 мл диметилформамида добавляется 3,0 г (60%, 75 ммоль) гидрида натрия. Реакционная смесь перемешивается в течение 1 ч при 40 С, затем при температуре 20 С в нее по каплям добавляется 5,3 мл (49,7 ммоль) 1-хлор-4-фтор-бензена (Aldrich) в 20 мл диметилформамида. Реакционная смесь перемешивается в течение 4 ч при 80 С, охлаждается до 20 С, затем в нее по каплям добавляется 1 мл этилового спирта, после чего смесь выливается в 100 мл воды и экстрагируется этилацетатом. Органический слой высушивается над сульфатом натрия и концентрируется. Продукт очищается с применением колоночной хроматографии с использованием Kieselgel 60 в качестве адсорбента (Merck) и этилацетата в качестве элюента с выходом, соответствующим 11,07 г (75,5%) титульного соединения. Точка плавления: масло.b) 4-(4-Хлорфенокси)пиперидин гидрохлорид. К раствору 150 мл 2,5 М соляной кислоты в этилацетате добавляется 11,07 г (37,5 ммоль) третбутилового сложного эфира 4-(4-хлорфенокси)пиперидин-1-карбоновой кислоты. Реакционная смесь перемешивается в течение 3 ч при 20 С, после чего концентрируется до конечного объема, равного 50 мл. Преципитировавшие кристаллы отфильтровываются, после чего промываются этилацетатом с вы-8 011636 ходом, соответствующим 7,0 г (75,2%) титульного соединения. Точка плавления: 194-196 С. с) 2-[4-(4-Хлорфенокси)пиперидин-1-карбонил]-6-гидрокси-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-(4-хлор-фенокси)пиперидина в соответствии со способом, описанным в примере 1. Точка плавления: 91 С (диэтиловый эфир). Пример 8. 6-Гидрокси-2-(4-паратолилоксипиперидин-1-карбонил)-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-паратолилоксипиперидина [J. Med. Chem., 21, 309, (1978)] в соответствии со способом, описанным в примере 1. Точка плавления: 258-260 С (диэтиловый эфир). Пример 9. 6-(4-Бензилпиперидин-1-карбонил)-1,5-дигидрооксазоло[4,5-g]хинолин-2,8-дион.a) Диметиловый сложный эфир 2-(2-оксо-2,3-дигидробензооксазол-6-иламино)-бут-2-ендиоиковой кислоты Смесь 1,0 г (6,66 ммоль) 6-амино-3 Н-бензооксазол-2-она [US 2806853], 0,9 мл (7,3 ммоль) диметил ацетилендикарбоксилата (Aldrich) и 15 мл метанола подвергается нагреванию с обратным холодильником в течение 2 ч. Реакционная смесь охлаждается до 20 С, преципитировавшие кристаллы отфильтровываются, после чего промываются метанолом с выходом, соответствующим 1,7 г (87%) титульного соединения. Точка плавления: 172 С.b) Метиловый сложный эфир 2,8-диоксо-1,2,5,8-тетрагидрооксазоло[4,5-g]хинолин-6-карбоновой кислоты. К перемешиваемому кипящему раствору 10 мл Dowtherm (Fluka) в малых порциях добавляется 1,7 г(5,8 ммоль) диметилового сложного эфира 2-(2-оксо-2,3-дигидробензооксазол-6-иламино)-бут-2 ендиоиковой кислоты. После добавления последнего реакционная смесь подвергается нагреванию с обратным холодильником в течение 10 мин, затем охлаждается до комнатной температуры, после чего преципитировавший продукт отфильтровывается и промывается гексаном с выходом, соответствующим 1,16 г (76%) титульного соединения. Точка плавления: 297 С.c) 2,8-Диоксо-1,2,5,8-тетрагидрооксазоло[4,5-g]хинолин-6-карбоновая кислота. Смесь 1,16 г (4,4 ммоль) метилового сложного эфира 2,8-диоксо-1,2,5,8-тетрагидрооксазоло[4,5g]хинолин-6-карбоновой кислоты, 40 мл метанола, 10 мл воды и 1,25 г (31,2 ммоль) гидроксида натрия перемешивается в течение 1 ч при 20 С. Метанол испаряется в условиях пониженного давления. Реакционная смесь подкисляется с использованием 2 М соляной кислоты, после чего преципитировавшие кристаллы отфильтровываются и промываются водой с выходом, соответствующим 0,9 г (82%) титульного соединения. Точка плавления: 300 С.d) 6-(4-Бензилпиперидин-1-карбонил)-1,5-дигидрооксазоло[4,5-g]хинолин-2,8-дион. Титульное соединение получают с использованием 2,8-диоксо-1,2,5,8-тетрагидрооксазоло[4,5g]хинолин-6-карбоновой кислоты и 4-бензилпиперидина в соответствии со способом, описанным в примере 1. Точка плавления: 215 С (диэтиловый эфир). Пример 10. 6-Гидрокси-2-(4-феноксипиперидин-1-карбонил)-1H-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-феноксипиперидина [J. Med. Chem., 17, 1000-1003, (1974)] в соответствии со способом, описанным в примере 1. Точка плавления: 270 С (диэтиловый эфир). Пример 11. 2-(4-Бензил-4-гидроксипиперидин-1-карбонил)-6-гидрокси-1 Н-хинолин-4-он. Титульное соединение получают с использованием 6-гидрокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты и 4-бензилпиперидин-4-ола [J. Med. Chem., 42, 2087-2104, (1999)] в соответствии со способом, описанным в примере 1. Точка плавления: 178 С (диэтиловый эфир). Пример 12. 2-(4-Бензил-4-гидроксипиперидин-1-карбонил)-7-гидрокси-1 Н-хинолин-4-он. а) 2-(4-Бензилпиперидин-1-карбонил)-7-бензилокси-1 Н-хинолин-4-он. Титульное соединение получают с использованием 7-бензилокси-4-оксо-1,4-дигидрохинолин-2 карбоновой кислоты [J. Med. Chem., 34, 1243-1252, (1991)] и 4-бензилпиперидина в соответствии со способом, описанным в примере 1. Точка плавления: 228 С (изопропанол).b) 2-(4-Бензил-4-гидроксипиперидин-1-карбонил)-7-гидрокси-1 Н-хинолин-4-он. Смесь 0,5 г (1,1 ммоль) 2-(4-бензилпиперидин-1-карбонил)-7-бензилокси-1H-хинолин-4-она, 20 мл тетрагидрофурана, 20 мл метанола, 0,2 г 10% Pd/C катализатора гидрогенизируется в течение 2 ч. Катализатор отфильтровывается, промывается тетрагидрофураном и фильтрат концентрируется. Продукт очищается с применением колоночной хроматографии с использованием Kieselgel 60 в качестве адсорбента (Merck) и смеси толуол:метанол=4:1 в качестве элюента с выходом, соответствующим 0,32 гa) Таблетки. 0,01-50% активного вещества, соответствующего формуле (I), 15-50% лактозы, 15-50% картофельного крахмала, 5-15% поливинилпирролидона, 1-5% талька, 0,01-3% стеарата магния, 1-3% коллоидной двуокиси кремния и 2-7% ультраамилопектина смешивается, после чего гранулируется методом влажно-9 011636 го гранулирования и спрессовывается в таблетки.b) Драже, таблетки с пленочным покрытием. Таблетки, изготовленные описанным выше способом, покрываются слоем, состоящим из энтеро-,либо гастросолюбильной пленки, либо из сахара и талька. Драже натираются смесью пчелиного воска с карнаубским воском.c) Капсулы. 0,01-50% активного вещества, соответствующего формуле (I), 1-5% лаурилсульфата натрия, 15-50% крахмала, 15-50% лактозы, 1-3% коллоидной двуокиси кремния и 0,01-3% стеарата магния тщательно перемешиваются, смесь пропускают через сетчатый фильтр и вносят в твердые желатиновые капсулы.d) Суспензии. Ингредиенты: 0,01-15% активного вещества, соответствующего формуле (I); 0,1-2% гидроксида натрия; 0,1-3% лимонной кислоты; 0,05-0,2% нипагина (метил 4-гидроксибензоата натрия); 0,005-0,02% нипазола; 0,01-0,5% карбопола (полиакрилата); 0,1-5% 96% этилового спирта; 0,1-1% ароматизирующего агента; 20-70% сорбитола (70% водный раствор) и 30-50% дистиллированной воды. К раствору нипагина и лимонной кислоты в 20 мл дистиллированной воды добавляют карбопол маленькими порциями при энергичном перемешивании и раствор оставляют стоять в течение 10-12 ч. Затем при перемешивании добавляются гидроксид натрия в 1 мл дистиллированной воды, водный раствор сорбитола и в последнюю очередь - малиновый ароматизатор на основе этилового спирта. К этому носителю маленькими порциями добавляют активный компонент и суспендируют смесь при помощи погружаемого в смесь гомогенизатора. В завершение суспензию доводят до желаемого конечного объема дистиллированной водой и суспензию-сироп пропускают через оборудование для помола коллоидов.e) Суппозитории. Для изготовления каждого суппозитория тщательно перемешивается 0,01-15% активного вещества,соответствующего формуле (I), и 1-20% лактозы, после чего 50-95% основы для суппозиториев (adepspro suppository) (например, Witepsol 4) расплавляют, охлаждают до 35 С и смесь активного компонента и лактозы вмешивают в нее, используя гомогенизатор. Полученную смесь формуют в охлаждаемых формах.f) Композиции для ампул в виде лиофилизированного порошка. 5% раствор маннита или лактозы готовят на бидистиллированной воде, применяемой для инъекций,и раствор фильтруют так, как это делается для получения стерильного раствора. 0,01-5% раствор активного компонента, имеющего формулу (I), также готовят на бидистиллированной воде, применяемой для инъекций, и этот раствор фильтруют так, как это должно делаться для получения стерильного раствора. Эти два раствора смешивают в асептических условиях, вносят порциями по 1 мл в ампулы, содержание ампул лиофилизируют и ампулы запаивают под азотом. Содержимое ампул растворяют в стерильной воде или 0,9% (физиологическом) стерильном водном растворе хлористого натрия перед введением. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные амида кинуреновой кислоты, соответствующие формуле (I) в которой значения X и Y независимо друг от друга представляют собой водород, гидрокси, амино,C1-C4 алкилсульфонамидо, факультативно замещенную атомом галогена либо атомами галогена,C1-C4 алканоиламидо, факультативно замещенную атомом галогена либо атомами галогена,C1-C4 алкокси, C1-C4 алкоксикарбонильную группу; либо соседние X и Y группы вместе с одним либо более идентичным или отличающимся дополнительным гетероатомом и -СН= и/или -СН 2-группами могут сформировать необязательно замещенное 4-7-членное гомо- либо гетероциклическое кольцо, предпочтительно морфолиновое, пиррольное, пирролидиновое, оксо- или тиоксопирролидиновое, пиразоловое, пиразолидиновое, имидазольное, имидазолидиновое, оксо- или тиоксоимидазольное или имидазолидиновое, 1,4-оксазиновое, оксазольное, оксазолидиновое, оксо- или тиоксооксазолидиновое или 3-оксо-1,4-оксазиновое кольцо;W представляет собой атом кислорода, так же как и C1-C4 алкилен, C2-C4 алкенилен, аминокарбонил,-NH-, -N(алкил)-, -СН 2 О-, -CH2S-, -СН(ОН)-, -ОСН 2-группу, где алкил представляет собойC1-C4 алкильную группу,когда отмеченные штрихом связи соответствуют простой С-С связи, значение V соответствует гидроксигруппе или атому водорода, или когда W представляет собой C1-C4 алкиленовую или C3-C4 алкениленовую группу, тогда одна из отмеченных штрихом связей может соответствовать дополнительной двойной С-С связи, и в этом случае V обозначает электронную пару, которая участвует в двойной связи;Z представляет собой водород либо атом галогена, C1-C4 алкильную, C1-C4 алкокси, трифторметильную, гидрокси- либо карбоксильную группу,а также их оптические изомеры, рацемические соединения и соли. 2. Соединение по п.1, в котором в формуле (I)X означает атом водорода иY означает гидрокси- либо бензилоксигруппу или соседние X и Y группы образуют -NH-CO-O-цепь;W соответствует атому кислорода, так же как и C1-C4 алкилен-, -СН 2 О- либо -ОСН 2-группе;V соответствует гидроксигруппе либо атому водорода;Z соответствует атому водорода либо атому галогена, либо C1-C4 алкильной группе, и отмеченные штрихом связи соответствуют простым С-С связям. 3. Соединение по п.1, выбранное из нижеследующей группы: 2-[4-(4-фторбензил)пиперидин-1-карбонил]-6-гидрокси-1 Н-хинолин-4-он,2-(4-бензилпиперидин-1-карбонил)-6-гидрокси-1 Н-хинолин-4-он,6-гидрокси-2-[4-(4-метилбензил)пиперидин-1-карбонил]-1 Н-хинолин-4-он,2-[4-(4-хлорбензил)пиперидин-1-карбонил]-6-гидрокси-1 Н-хинолин-4-он,2-(4-бензилоксипиперидин-1-карбонил)-6-гидрокси-1 Н-хинолин-4-он,6-гидрокси-2-(4-феноксиметилпиперидин-1-карбонил)-1 Н-хинолин-4-он,2-[4-(4-хлорофенокси)пиперидин-1-карбонил]-6-гидрокси-1 Н-хинолин-4-он,6-гидрокси-2-(4-паратолилоксипиперидин-1-карбонил)-1 Н-хинолин-4-он,6-(4-бензилпиперидин-1-карбонил)-1,5-дигидрооксазоло[4,5-g]хинолин-2,8-дион,6-гидрокси-2-(4-феноксипиперидин-1-карбонил)-1 Н-хинолин-4-он,2-(4-бензил-4-гидроксипиперидин-1-карбонил)-6-гидрокси-1 Н-хинолин-4-он и 2-(4-бензил-4-гидроксипиперидин-1-карбонил)-7-гидрокси-1 Н-хинолин-4-он. 4. Фармацевтические композиции, содержащие эффективное количество производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, Y, W, V, Z и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, либо их оптических изомеров, рацемических соединений или солей в качестве активных компонентов, а также вспомогательные вещества, широко применяемые в фармацевтической практике, такие как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на рН и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие или доставляющие композицию. 5. Способ получения производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, W, V, Z, Y и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, характеризующийся реакцией карбоновой кислоты, соответствующей формуле (II) где значения X и Y соответствуют тем значениям, которые приведены в п.1,либо ее химически активного производного с амином, соответствующим формуле (III) соответствуют тем значениям, которые где значения Z, V, W и отмеченных штрихом связей приведены в п.1, с последующей необязательной трансформацией полученных таким образом производных амида кинуреновой кислоты, соответствующих формуле (I), где значения X, Y, W, V, Z и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, в другие соединения,соответствующие формуле (I), путем введения новых заместителей и/или модификации, или удаления- 11011636 имеющихся заместителей, и/или путем формирования соли, и/или высвобождения соединения, соответствующего формуле (I), из состава солей, и/или путем разложения полученных рацемических соединений с использованием оптически активных кислот или оснований с применением известных методов. 6. Способ по п.5, характеризующийся реакцией активного производного карбоновой кислоты, соответствующей формуле (II), в которой значения X и Y соответствуют тем значениям, которые приведены в п.1, с амином, соответствующим формуле (III), в которой значения Z, V, W и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, предпочтительно в присутствии основания. 7. Способ по п.5, характеризующийся реакцией карбоновой кислоты, соответствующей формуле(II), в которой значения X и Y соответствуют тем значениям, которые приведены в п.1, с амином, соответствующим формуле (III), в которой значения Z, V, W и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, в присутствии триэтиламина и О-бензотриазол-1-илN,N,N',N'-тетраметилурониумгексафторфосфата (HBTU) в диметилформамиде. 8. Способ производства фармацевтических композиций, обладающих эффектом NR2B селективного антагониста рецептора NMDA, характеризующийся смешиванием производного амида кинуреновой кислоты, соответствующего формуле (I), в которой значения X, W, V, Z, Y и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, либо его оптических изомеров, рацемических соединений, либо фармацевтически приемлемых солей в качестве активных компонентов, и вспомогательных веществ, широко применяемых в фармацевтической практике, таких как носители, наполнители, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества, влияющие на pH и осмотическое давление, отдушивающие или ароматизирующие вещества, а также добавки, активирующие или доставляющие композицию. 9. Способ лечения и облегчения симптомов следующих заболеваний млекопитающих, включая человека: травматического повреждения головного или спинного мозга, повреждения нервных клеток, связанных с наличием вируса иммунодефицита человека (HTV), бокового амиотрофического склероза (болезнь Шарко), толерантности и/или зависимости при лечении боли с применением синтетических наркотических препаратов (опиоидов), синдромов отмены, например, алкоголя, опиоидов или кокаина, ишемических расстройств ЦНС, хронических нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боли и хронических болевых состояний, таких как невропатическая боль или боль, связанная с раковым заболеванием, эпилепсии, тревожности, депрессии,мигрени, психоза, мышечного спазма, слабоумия различного происхождения, гипогликемии, дегенеративных расстройств сетчатки, глаукомы, астмы, звона в ушах, потери слуха, вызванной применением аминогликозидных антибиотиков, характеризующийся введением нуждающимся в лечении млекопитающим эффективного количества/количеств производного амида кинуреновой кислоты, соответствующего формуле (I), в которой значения X, W, V, Z, Y и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, либо его оптических изомеров, рацемических соединений, либо фармацевтически приемлемых солей как самих по себе, так и в комбинации с носителями, наполнителями и т.п., традиционно применяемыми в фармацевтической практике. 10. Применение производного амида кинуреновой кислоты, соответствующего формуле (I), в которой значения X, W, V, Z, Y и отмеченных штрихом связей соответствуют тем значениям, которые приведены в п.1, и/или его оптических изомеров, рацемических соединений и/или фармацевтически приемлемых солей для производства фармацевтических композиций, предназначенных для лечения и облегчения симптомов следующих заболеваний млекопитающих, включая человека: травматического повреждения головного или спинного мозга, повреждения нервных клеток, связанных с наличием вируса иммунодефицита человека (HIV), бокового амиотрофического склероза (болезнь Шарко), толерантности и/или зависимости при лечении боли с применением синтетических наркотических препаратов (опиоидов),синдромов отмены, например, алкоголя, опиоидов или кокаина, ишемических расстройств ЦНС, хронических нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боли и хронических болевых состояний, таких как невропатическая боль или боль, связанная с раковым заболеванием, эпилепсии, тревожности, депрессии, мигрени, психоза, мышечного спазма,слабоумия различного происхождения, гипогликемии, дегенеративных расстройств сетчатки, глаукомы,астмы, звона в ушах, потери слуха, вызванной применением антибиотиков-аминогликозидов.
МПК / Метки
МПК: C07D 401/06, A61P 25/04, A61K 31/4709, C07D 491/04
Метки: кинуреновой, кислоты, производные, рецептора, антагонисты, амида, подтипа
Код ссылки
<a href="https://eas.patents.su/13-11636-proizvodnye-amida-kinurenovojj-kisloty-kak-antagonisty-nr2b-podtipa-receptora-nmda.html" rel="bookmark" title="База патентов Евразийского Союза">Производные амида кинуреновой кислоты как антагонисты nr2b подтипа рецептора nmda</a>
Предыдущий патент: Новые производные амида гетероциклической карбоновой кислоты
Следующий патент: Лечение с использованием омега-3 жирных кислот и агониста и/или антагониста ppar и их комбинированный продукт
Случайный патент: Процесс получения этиловых эфиров 4 - (8-хлор-5,6-дигидро-11н-бензо-(5,6)-циклогепта-(1,2в) пиридин-11-илиден)-1-пиперидинкарбоновой кислоты (лоратадина)