Сложноэфирные производные декагидроизохинолин-3-карбоновой кислоты в качестве анальгетиков
Формула / Реферат
1. Соединение формулы
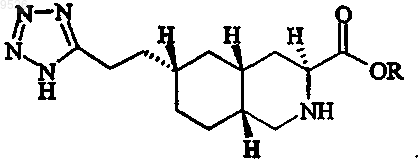
где R означает С1-С20алкил, или его фармацевтически приемлемые соли.
2. Соединение по п.1, где R означает C1-С10алкил.
3. Соединение по п.2, где R означает 2-этилбутил, изобутил, 3-метилбутил, децил или этил.
4. Соединение по п.3, где R означает 2-этилбутил.
5. Соединение по п.3, где R означает изобутил.
6. Соединение по п.3, где R означает 3-метилбутил.
7. Соединение по п.3, где R означает децил.
8. Соединение по п.3, где R означает этил.
9. Соединение, которое означает 2-этилбутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
10. Соединение по п.9, где фармацевтически приемлемая соль означает трифторацетатную соль.
11. Соединение по п.9, которое означает 2-этилбутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты.
12. Соединение, которое означает изобутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
13. Соединение по п.12, где фармацевтически приемлемая соль означает трифторацетатную соль.
14. Соединение по п.12, которое означает изобутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты.
15. Соединение, которое означает 3-метилбутиловый эфир (3S,4aR, 6R, 8aR)-6-[2-(1Н-тетразол-5-ил)этил]-l,2,3,4,4a,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
16. Соединение по п.15, где фармацевтически приемлемая соль означает трифторацетатную соль.
17. Соединение по п.15, которое означает 3-метилбутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты.
18. Соединение, которое означает дециловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
19. Соединение по п.18, где фармацевтически приемлемая соль означает трифторацетатную соль.
20. Соединение по п. 18, которое означает дециловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты.
21. Соединение, которое означает этиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения.
22. Соединение по п.21, где фармацевтически приемлемая соль означает хлористо-водородную соль.
23. Соединение по п.21, которое означает этиловый эфир (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты.
24. Соединение, которое означает моногидрат гидрохлорида этилового эфира (3S,4aR,6R,8aR)-6-[2-(1Н-тетразол-5-ил)этил]-1,2,3,4,4а,5,6,7,8,8а-декагидроизохинолин-3-карбоновой кислоты.
25. Фармацевтическая композиция, которая содержит соединение по любому из пп.1-24 и фармацевтически приемлемый разбавитель или носитель.
26. Фармацевтическая композиция для лечения боли или мигрени, которая содержит соединение по любому из пп.1-24 и фармацевтически приемлемый разбавитель или носитель.
27. Применение соединения по любому из пп.1-24 для изготовления лекарственного средства для лечения боли.
28. Применение соединения по любому из пп.1-24 для изготовления лекарственного средства для лечения мигрени.
Текст
009526 ОБЛАСТЬ ИЗОБРЕТЕНИЯ Настоящее изобретение касается новых пролекарственных форм (3S,4aR,6R,8aR)-6-[2-(1(2)Hтетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты, фармацевтических композиций, содержащих пролекарственные формы, и способов применения пролекарственных форм. ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ В патенте Соединенных Штатов 5670516 описано, что некоторые производные декагидроизохинолина являются АМРА-рецепторными антагонистами и в качестве таковых полезны при лечении многих разнообразных болезненных состояний, включающих боль и мигрень. Кроме того, WO 01/02367 A3,опубликованная 11 января 2001, описывает сложнодиэфирные пролекарственные формы селективного антагониста GluR5-3S,4aR,6S,8aR-6-4-карбокси)фенил)метил)-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. Цель настоящего изобретения состоит в получении сложных моноэфиров (3S,4aR,6R,8aR)-6-[2(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты, обеспечивающих улучшенную биодоступность исходной монокислоты в организме пациента. К тому же цель настоящего изобретения состоит в получении сложных моноэфиров (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол 5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты, по существу, превращающихся в исходную монокислоту в организме пациента. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Было обнаружено, что новые сложные моноэфиры монокислоты, (3S,4aR,6R,8aR)-6-[2-(1(2)Hтетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты обеспечивают значительно улучшенную биодоступность монокислоты по сравнению с биодоступностью, получаемой при введении самой монокислоты. Кроме того, сложные моноэфиры по существу превращаются в монокислоту в организме пациента. Монокислота описана в патенте США 5670516, опубликованном 23 сентября 1997 г. Таким образом, настоящее изобретение представляет соединения формулы где R означает С 1-С 20 алкил, или их фармацевтически приемлемые соли. К тому же настоящее изобретение представляет фармацевтическую композицию, которая содержит соединение формулы I и фармацевтически приемлемый разбавитель или носитель. Кроме того, настоящее изобретение относится к фармацевтической композиции для лечения боли или мигрени, которая содержит соединение формулы I и фармацевтически приемлемый разбавитель или носитель. Настоящее изобретение также касается применения соединения формулы I для изготовления лекарственного средства для лечения неврологического нарушения. Настоящее изобретение также касается применения соединения формулы I для изготовления лекарственного средства для лечения боли или мигрени. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Как использован здесь, термин "пролекарство" означает сложное моноэфирное производное лекарственного средства с карбокислотной функциональностью, где указанное производное при введении пациенту превращается в монокислоту (лекарственное средство). Ферментативное и/или химическое гидролитическое расщепление соединений настоящего изобретения происходит таким образом, что высвобождается исходная монокарбоновая кислота (лекарственное средство). Как использован здесь, термин "соединение А" означает (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновую кислоту. Как использован здесь, термин "соединение В" означает сложный этиловый эфир 6-[2-(2 Н-тетразол 5-ил)этил]декагидроизохинолин-3-карбоновой кислоты. Как использован здесь, термин "соединение С" означает сложный 2-этилбутиловый эфир 6-[2-(1 Нтетразол-5-ил)этил]декагидроизохинолин-3-карбоновой кислоты. Как использован здесь, термин "соединение D" означает сложный изобутиловый эфир 6-[2-(1 Нтетразол-5-ил)этил]декагидроизохинолин-3-карбоновой кислоты. Как использован здесь, термин "соединение E" означает сложный 3-метилбутиловый эфир 6-[2-(2 Нтетразол-5-ил)этил]декагидроизохинолин-3-карбоновой кислоты. Как использован здесь, термин "соединение F" означает дециловый эфир 6-[2-(1 Н-тетразол-5 ил)этил]декагидроизохинолин-3-карбоновой кислоты. Как использован здесь, термин "С 1-С 4 алкил" означает линейную или разветвленную, одновалентную, насыщенную алифатическую цепь из 1-4 атомов углерода и включает, но не в порядке ограничения,метил, этил, н-пропил, изопропил, н-бутил, изобутил и тому подобное.-1 009526 Как использован здесь, термин "C1-С 6 алкил" означает линейную или разветвленную, одновалентную, насыщенную алифатическую цепь из 1-6 атомов углерода и включает, но не в порядке ограничения,метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, н-гексил и тому подобное. Понятно, что термин "С 1-С 4 алкил" входит в определение термина "C1-С 6 алкил" . Как использован здесь, термин "C1-С 10 алкил" означает линейную или разветвленную, одновалентную, насыщенную алифатическую цепь из 1-10 атомов углерода и включает, но не в порядке ограничения, метил, этил, пропил, изопропил, н-бутил, изобутил, третичный бутил, пентил, изопентил, гексил,2,3-диметил-2-бутил, гептил, 2,2-диметил-3-пентил, 2-метил-2-гексил, октил, 4-метил-3-гептил и тому подобное. Понятно, что термины "С 1-С 4 алкил" и "C1-С 6 алкил" входят в определение термина "C1 С 10 алкил" . Как использован здесь, термин "С 1-С 20 алкил" означает линейную или разветвленную, одновалентную, насыщенную алифатическую цепь из 1-20 атомов углерода и включает, но не в порядке ограничения, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, гексил, 3 метилпентил, 2-этилбутил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил, н-додецил, н-тридецил, нтетрадецил, н-пентадецил, н-гексадецил, н-гептадецил, н-нонадецил, н-эйкозил и тому подобное. Понятно, что термины "С 1-С 4 алкил", "C1-С 6 алкил" и "C1-С 10 алкил" входят в определение термина "С 1 С 20 алкил". Как использованы здесь, термины "Me", "Et", "Pr", "iPr", "Bu" и "t-Bu" означают метил, этил, пропил, изопропил, бутил и трет-бутил, соответственно. Соединения настоящего изобретения содержат тетразольное кольцо, которое, как известно, существует в виде таутомерных структур. Тетразол, имеющий двойную связь на атоме азота в 1 положении и водород на атоме азота в 2 положении, называют 2H-тетразол и изображают следующей структурой Аналогичную таутомерную форму, где водород находится на атоме азота в 1 положении и двойная связь на атоме азота в 4 положении, называют 1H-тетразол и изображают следующей формулой Смеси из двух таутомеров обозначены здесь как 1(2)H-тетразолы. Настоящее изобретение рассматривает обе таутомерные формы, а также комбинацию двух таутомеров. означает связь, выступающую над плоскостью бумаги. Обозначение Обозначение означает связь, уходящую за плоскость бумаги. Настоящее изобретение включает гидраты и фармацевтически приемлемые соли соединений формулы I. Соединение данного изобретения может содержать функциональную группу достаточной основности, которая может взаимодействовать с некоторыми неорганическими и органическими кислотами с образованием фармацевтически приемлемой соли. Термин "фармацевтически приемлемая соль", как использован здесь, означает соли соединений формулы I, практически нетоксичные для живых организмов. Типичные фармацевтически приемлемые соли включают соли, полученные взаимодействием соединений настоящего изобретения с фармацевтически приемлемой минеральной или органической кислотой. Такие соли известны также как кислотноаддитивные соли. Кислотами, обычно используемыми для получения кислотно-аддитивных солей, являются неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и тому подобные, и органические кислоты, такие как п-толуолсульфоновая, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота,угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота, трифторуксусная кислота и тому подобные. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, бромид, иодид, ацетат, трифторацетат, пропионат, деканоат, каприлат, акрилат,формиат, гидрохлорид, дигидрохлорид, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат,сукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат,метилбензоат, гидроксибензоат, метоксибензоат, фталат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, -гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и тому подобные. Предпочтительными фармацевтически приемлемыми кислотно-аддитивными солями являются соли, образованные с минеральными кислотами, такими как хлористо-водородная кислота и бромисто-водородная кислота, и соли,образованные с органическими кислотами, такими как малеиновая кислота, щавелевая кислота, трифторуксусная кислота и метансульфоновая кислота.-2 009526 Общеизвестно, что конкретный противоион, входящий в состав соли настоящего изобретения,обычно не имеет решающего значения до тех пор, пока соль в целом является фармакологически приемлемой и пока противоион не наделяет соль нежелательными качествами в целом. Также очевидно, что такие соли могут существовать в виде гидрата. Как использован здесь, термин "стереоизомер" означает соединение, состоящее из тех же атомов,связанных теми же связями, но имеющее различные пространственные структуры, которые не являются взаимозаменяемыми. Трехмерные структуры называются конфигурациями. Как использован здесь, термин "энантиомер" означает два стереоизомера, чьи молекулы представляют собой зеркальные отображения, не совпадающие при наложении друг на друга. Термин "хиральный центр" означает атом углерода,к которому присоединены четыре различных группы. Как использован здесь, термин "диастереомеры" означает стереоизомеры, не являющиеся энантиомерами. Кроме того, два диастереомера, имеющие различную конфигурацию только по одному хиральному центру, называются здесь "эпимеры". Термины"рацемат", "рацемическая смесь" или "рацемическая модификация" означают смесь из равных частей энантиомеров. Термин "энантиомерно обогащенный", как использован здесь, означает количественное преобладание одного энантиомера по сравнению с другим. Общепринятым способом выражения достигнутого энантиомерного обогащения является понятие энантиомерного избытка или "ее", определяемого на основании следующего уравнения: где Е 1 означает количество первого энантиомера и Е 2 означает количество второго энантиомера. Таким образом, если исходное соотношение двух энантиомеров составляет 50:50, такое, как присутствует в рацемической смеси, и достигнуто энантиомерное обогащение, достаточное для получения конечного соотношения, равное 50:30, "ее" в отношении первого энантиомера составляет 25%. Однако, если конечное соотношение равно 90:10, "ее" в отношении первого энантиомера составляет 80%. Предпочтительно, чтобы "ее" было свыше 90%, наиболее предпочтительно "ее" свыше 95% и, в особенности предпочтительно, "ее" свыше 99%. Энантиомерное обогащение легко может быть определено специалистом в данной области путем использования стандартных способов и методик, таких как газовая или высокоэффективная жидкостная хроматография с применением хиральной колонки. Выбор подходящей хиральной колонки, элюента и условий, необходимых для эффективного разделения энантиомерной пары находится в пределах компетенции специалиста в данной области. Кроме того, энантиомеры соединений формулы I могут быть разделены специалистом в данной области путем использования стандартных способов, хорошо известных в данной области, таких как способы, описанные J. Jacques, et al., "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, Inc., 1981. Соединения настоящего изобретения могут иметь один или более хиральных центров и могут существовать в различных стереоизомерных конфигурациях. В результате наличия таких хиральных центров соединения настоящего изобретения существуют в виде рацематов, смесей энантиомеров и как индивидуальные энантиомеры, а также как диастереомеры и смеси диастереомеров. Все такие рацематы,энантиомеры и диастереомеры входят в объем настоящего изобретения и приложенных пунктов. Термины "R" и "S" использованы здесь, как обычно принято использовать в органической химии,для обозначения конкретной конфигурации хирального центра. Термин "R" (правый) означает, что конфигурация хирального центра в отношении старшинства групп (от наибольшей ко второй наименьшей) изменяется по часовой стрелке, если рассматривать вдоль связи в направлении к младшей группе. Термин "S" (левый) означает, что конфигурация хирального центра в отношении старшинства групп (от наибольшей ко второй наименьшей) изменяется против часовой стрелки, если рассматривать вдоль связи в направлении к младшей группе. Старшинство групп основано на их атомном номере (в порядке уменьшения атомного номера). Частичный перечень очередности и обсуждение стереохимии содержится в"Nomenclature of Organic Compounds: Principles and Practice", (J.H. Fletcher, et al., eds., 1974) на стр. 103120. Конкретные стереоизомеры и энантиомеры соединений формулы (I) могут быть получены специалистом в данной области путем использования хорошо известных методик и способов, таких как описаны в Eliel and Wilen, "Stereochemistry of Organic Compounds", John WileySons, Inc., 1994, Chapter 7,Separation of Stereoisomers. Resolution. Racemization, и как описано Collet and Wilen, "Enantiomers, Racemates, and Resolutions", John WileySons, Inc., 1981. Например, конкретные стереоизомеры и энантиомеры могут быть получены стереоспецифическим синтезом с использованием энантиомерно и геометрически чистых или энантиомерно или геометрически обогащенных исходных материалов. Кроме того,конкретные стереоизомеры и энантиомеры могут быть разделены и выделены такими способами, как хроматография на хиральных стационарных фазах, ферментативное разделение или фракционированная перекристаллизация аддитивных солей, образованных с используемыми для этой цели реагентами. Соединения формулы I могут быть получены легко доступными специалисту в данной области приемами и способами. Конкретней, соединения формулы I могут быть получены химически, например,-3 009526 согласно синтетическим способам, представленным на приведенной ниже схеме. Однако приведенное ниже обсуждение никоим образом не рассматривается как ограничивающее объем настоящего изобретения и приложенных пунктов. Например, конкретные стадии синтеза в приведенной здесь схеме могут быть объединены иначе в целях получения соединений формулы I. Все заместители, если не указано особо, принимают вышеуказанные значения. Реагенты и исходные материалы легко доступны любому специалисту в данной области. Например, некоторые исходные материалы могут быть получены специалистом в данной области согласно методикам, описанным в патентах Соединенных Штатов 5356902(опубликованном 18 октября 1994), 5446051 (опубликованном 29 августа 1995) и 5670516 (опубликованном 23 сентября 1997), содержание которых полностью включено здесь посредством ссылок. Другие необходимые реагенты и исходные материалы для приведенных ниже методик могут быть получены способами, выбираемыми из стандартных методик органической или гетероциклической химии, способов,осуществляемых по аналогии с синтезом известных структурно подобных соединений, и методик, описанных в примерах, включая новые методики. Схема I Согласно схеме I, соединение А подвергают этерификации, получая сложные моноэфиры формулыI, в стандартных условиях, хорошо известных в данной области. Например, соединение А растворяют в подходящем органическом растворителе и обрабатывают подходящей кислотой, такой как хлористоводородная кислота. Примеры подходящих органических растворителей включают метиловый спирт,этиловый спирт, пропиловый спирт, изопропиловый спирт, н-бутиловый спирт, изобутиловый спирт,трет-бутиловый спирт, пентиловый спирт, изопентиловый спирт, гексиловый спирт, 3-метилпентиловый спирт, 2-этилбутиловый спирт, н-гептиловый спирт, н-октиловый спирт, дециловый спирт и тому подобное. Реакционную смесь нагревают приблизительно до 40-60 С в течение, порядка, 4-16 ч. Затем продукт выделяют и очищают, используют приемы, хорошо известные специалисту в данной области, такие как методы экстракции и хроматография. Например, вышеуказанную реакционную смесь охлаждают, разбавляют подходящим органическим растворителем, таким как этилацетат, промывают насыщенным бикарбонатом натрия, насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме, получая соединение формулы I. Такой продукт может быть дополнительно очищен флэш хроматографией на силикагеле с использованием подходящего элюента, такого как этилацетат/гексан. Альтернативно, соединение А растворяют в подходящем органическом растворителе и обрабатывают избытком тионилхлорида. Примерами подходящих органических растворителей являются безводный метиловый спирт, этиловый спирт, пропиловый спирт, изопропиловый спирт, бутиловый спирт,изобутиловый спирт, трет-бутиловый спирт, пентиловый спирт, изопентиловый спирт, гексиловый спирт, 3-метилпентиловый спирт, 2-этилбутиловый спирт, н-гептиловый спирт, н-октиловый спирт, дециловый спирт и тому подобное. Раствор перемешивают при нагревании до температуры кипения с обратным холодильником в течение приблизительно 1-3 ч и при комнатной температуре около 8-16 ч. Затем смесь концентрируют в вакууме и остаток очищают способом, аналогичным приведенным выше способам, получая пролекарство в виде сложного моноэфира формулы I. Фармацевтически приемлемые соли формулы I легко могут быть получены специалистом в данной области с использованием стандартных методик и процедур. Например, указанный выше продукт суспендируют в диэтиловом эфире, насыщенном газообразным HCl. Смесь перемешивают около 1-3 ч. Затем остаток фильтруют и промывают диэтиловым эфиром в вакууме, получая фармацевтически приемлемую соль пролекарства, сложного моноэфира формулы I. Следующие примеры представляют типичные синтезы соединений формулы I, описанные в целом выше. Эти примеры являются исключительно иллюстративными и никоим образом не рассматриваются-4 009526 как ограничивающие изобретение. Реагенты и исходные материалы легко доступны специалисту в данной области. Как использовано здесь, приведенные термины имеют следующие значения: "экв." или "эквив." означает эквиваленты; "г" означает граммы; "мг" означает милиграммы; "л" означает литры; "мл" означает миллилитры; "мкл" означает микролитры; "моль" означает моли; "ммоль" означает миллимоли;"фунт/кв.дюйм" означает фунты на квадратный дюйм; "мин" означает минуты; "ч" означает часы; "С" означает градусы Цельсия; "ТСХ" означает тонкослойная хроматография; "ЖХВР" означает жидкостная хроматография высокого разрешения; означает сдвиг в частях на миллион в сторону слабого поля относительно тетраметилсилана; "ТГФ" означает тетрагидрофуран; "ДМФА" означает N,Nдиметилформамид; "ДМСО" означает метилсульфоксид; "водн." означает водный; "EtOAc" означает этилацетат; "iPrOAc" означает изопропилацетат; "МеОН" означает метанол; "МТВЕ" означает простой трет-бутилметиловый эфир и "RT" означает комнатная температура. Пример 1. 2-Этилбутиловый эфир 6-[2-(1 Н-тетразол-5-ил)этил]декагидроизохинолин-3-карбоновой кислоты К раствору 2,5 г (8,4 ммоль) моногидрата 6-[2-(1 Н-тетразол-5-ил)этил]декагидроизохинолин-3 карбоновой кислоты (получен, как описано в J. Med. Chem., 39 (11), pp. 2232-2244, (1996) или патенте США 5670516 (опубликован 23 сентября 1997 в 20 мл 2-этил-1-бутанола добавляют 6,8 мл (92,8 ммоль) тионилхлорида. Раствор перемешивают при 120 С в течение 3 ч. Смесь концентрируют в вакууме и остаток промывают этиловым эфиром. Остаток очищают SPE По существу, получен по методике, описанной выше в примере 1, при использовании 20 мл 2 метил-1-пропанола, что дает указанное в заголовке соединение. Электрораспылительный масс-спектр: М+1 = 336. Пример 3. 3-Метилбутиловый эфир 6-[2-(2 Н-тетразол-5-ил)этил]декагидроизохинолин-3 карбоновой кислоты По существу, получен по методике, описанной выше в примере 1, при использовании 20 мл 3 метил-1-бутанола, что дает указанное в заголовке соединение. Электрораспылительный масс-спектр: М+1 = 350. Пример 4. Дециловый эфир 6-[2-(1 Н-тетразол-5-ил)этил]декагидроизохинолин-3-карбоновой кислоты Раствор 6,0 г (21,5 ммоль) моногидрата 6-[2-(1 Н-тетразол-5-ил)этил]декагидроизохинолин-3 карбоновой кислоты в 70 мл этанола, насыщенного хлористым водородом, нагревают при температуре кипения с обратным холодильником в течение ночи. Смесь концентрируют в вакууме, суспендируют в диэтиловом эфире и вновь концентрируют в вакууме. Остаток суспендируют в диэтиловом эфире и нагревают при температуре кипения с обратным холодильником в течение 3 ч. Твердый продукт фильтруют и промывают диэтиловым эфиром, получая 7,4 г (100%) указанного в заголовке соединения. Электрораспылительный масс-спектр: М+1 = 308. Специфические аспекты соединений формулы I. Следующий перечень представляет некоторые группы конкретных заместителей соединений формулы I. Понятно, что соединения формулы I, имеющие такие конкретные заместители, представляют специфические аспекты настоящего изобретения. Также понятно, что каждая из приведенных групп может быть представлена в комбинации с другими приведенными группами, что создает дополнительные специфические аспекты настоящего изобретения. Итак, специфический аспект новых соединений формулы I составляет соединение, в котором:(c) R означает этил. Фармакологические результаты Следующие данные in vivo на крысах, собаках и обезьянах служат примером улучшенной биодоступности пролекарств настоящего изобретения в виде сложных моноэфиров по сравнению с монокислотой, которой является (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислотой. Процент биодоступности определяют, используя следующее уравнение: где AUC означает площадь, ограниченную кривой, п.о. означает пероральную дозу и в.в. означает внутривенную дозу. Биодоступность на собаках Собакам породы бигль (2 самцам и 1 самке) вводят пероральную дозу и затем внутривенную дозу(3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновую кислоту (10 мг/кг п.о; 1 мг/кг в.в.) в целях определения пероральной биодоступности. Впоследствии тем же самым трем собакам вводят пероральную дозу 10 мг/кг пролекарства в виде сложного эфира (например, HCL-соль этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 адекагидроизохинолин-3-карбоновой кислоты), чтобы определить, будет ли пролекарство повышать биодоступность исходной кислоты. Концентрации (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты в плазме определяют методомLC/MS/MS. Методики исследования: Живая фаза: (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновую кислоту (HCl-соль) растворяют в разбавленном гидроксиде натрия для перорального введения (30 мг/мл) и в 10% смеси этанол/вода для в.в. введения (10 мг/мл). HCL-соль этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты растворяют в воде для перорального введения (30 мг/мл). Собаки весят от 12 до 15 кг. Результаты Установленная на собаках пероральная биодоступность (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты составляет 18%. При введении этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (HCl-соль) биодоступность возрастает до 33,1%. Применение пролекарства в форме этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (HCl-соль) обеспечивает приблизительно 2-кратное увеличение биодоступности по сравнению с исходной кислотой. В приведенной ниже табл. 1 сведены фармакокинетические параметры, найденные для соединений А и В после введения собакам бигль 1 мг/кг (в.в.) или 10 мг/кг (п.о.).-6 009526 Таблица 1. Фармакокинетические параметры для соединения А на собаках бигль после введения дозы 1 мг/кг соединения А (в.в.) и введения дозы 10 мг/кг соединения А или пролекарства в виде сложного этилового эфира, соединения В, (п.о.). Биодоступность на крысах Самцам Fischer крыс вводят либо пероральную, либо в.в. дозу (3S,4aR,6R,8aR)-6-[2-(1(2)Hтетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (10 мг/кг) в целях определения пероральной биодоступности. Отдельной группе крыс вводят пероральную дозу 10 мг/кг пролекарства в виде сложного эфира (например, HCL-соль этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)Hтетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты), чтобы определить, будет ли пролекарство повышать биодоступность исходной кислоты. Концентрации (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты в плазме определяют методом LC/MS/MS. Результаты Установленная на крысах пероральная биодоступность (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты составляет 3,6%. При введении этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (HCL-соль) биодоступность возрастает до 17,7%. Применение пролекарства в форме этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 адекагидроизохинолин-3-карбоновой кислоты (HCl-соль) обеспечивает приблизительно 5-кратное увеличение биодоступности по сравнению с исходной кислотой. В приведенной ниже табл. 2 сведены фармакокинетические параметры, найденные для соединений А и В. Таблица 2. Фармакокинетические параметры для соединения А на Fischer крысах после введения дозы 10 мг/кг соединения А или пролекарства в виде сложного эфира, соединения В. Биодоступность на Cynomolgus обезьянах Двум самцам и двум самкам обезьян вводят пероральную и затем в.в. дозу (3S,4aR,6R,8aR)-6-[2(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (перорально: 3 мг/кг; в.в.: 0,3 мг/кг) в целях определения пероральной биодоступности. Впоследствии тем же самым животным вводят также пероральную дозу 3 мг/кг этилового эфира (3S,4aR, 6R,8aR)-6-[2-(1(2)Hтетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты), чтобы определить, будет ли пролекарство, в виде сложного эфира, повышать биодоступность исходной кислоты. Концентрации исходной кислоты в плазме определяют методом LC/MS/MS. Проведение исследования Четырем cynomolgus обезьянам (2/пол) дают разовую пероральную дозу (3S,4aR,6R,8aR)-6-[2(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (3 мг/кг) на день 0, разовую в.в. дозу (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (0,3 мг/кг) на день 4 и разовую пероральную дозу этилового эфира-7 009526 кислоты (3 мг/кг) на день 8. Пробы крови отбирают на период 0,5, 1, 2, 3, 4, 5, 6 и 8 часов после перорального введения дозы и 0,167, 0,33, 0,67, 1, 1,5, 2, 3 и 4 часов после в.в. введения дозы. Растворы доз,как в случае кислоты, так и сложного эфира, готовят в 0,9% хлориде натрия. Результаты Установленная на обезьянах пероральная биодоступность (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты составляет 4,5%. При введении этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты (HCL-соль) биодоступность возрастает до 11,4%. Применение пролекарства в форме этилового эфира (3S,4aR,6R,8aR)-6-[2-(1(2)H-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 адекагидроизохинолин-3-карбоновой кислоты (HCL-соль) обеспечивает приблизительно 2,5-кратное увеличение биодоступности по сравнению с исходной кислотой. В приведенной ниже табл. 3 сведены фармакокинетические параметры, найденные для соединений А и В после в.в. или перорального введения Cynomolgus обезьянам. Таблица 3. Фармакокинетические параметры для соединения А на Cynomolgus обезьянах после в.в. и п.о. дозированного введения соединения А или пролекарства в виде сложного эфира, соединения В. Избыточная или неадекватная стимуляция аминокислотных рецепторов возбуждения ведет к повреждению или потере нервных клеток по механизму, известному как эксцитотоксичность. Предполагается, что этот процесс опосредует нейронную дегенерацию при разнообразных неврологических нарушениях и состояниях. Последствия такой нейронной дегенерации превращают ослабление дегенеративных неврологических процессов в важную терапевтическую задачу. Например, эксцитотоксичность аминокислотных рецепторов возбуждения вовлечена в патофизиологию многочисленных неврологических нарушений, включающих этиологию церебральных нарушений после операции на сердце в условиях искусственного кровообращения и трансплантации, удар, ишемию головного мозга, спинно-мозговые повреждения, вызванные травмой или воспалением, перинатальную гипоксию, остановку сердечной деятельности и гипогликемическое нейрональное повреждение. Кроме того, эксцитотоксичность вовлечена в хронические нейродегенеративные нарушения, включающие такие нарушения как, болезнь Альцгеймера, хорея Гентингтона, наследственная атаксия, СПИД-индуцированная деменция, боковой амиотрофический склероз, идиопатическая и индуцированная лекарственными средствами болезнь Паркинсона,а также поражение зрения и ретинопатия. Другие неврологические нарушения с вовлечением эксцитотоксичности и/или глутаматной дисфункции включают такие нарушения как, мышечная спастичность,включая тремор, толерантность к лекарственному средству и синдром отмены, отек мозга, судорожный синдром, включая эпилепсию, депрессия, состояние тревоги и связанные с состоянием тревоги нарушения, такие как посттравматический синдром стресса, поздняя дискинезия и психоз, связанный с депрессией, шизофрения, биполярное расстройство, мания и лекарственная интоксикация или привыкание (см.,в основном, патенты Соединенных Штатов 5446051 и 5670516). Антагонисты аминокислотных рецепторов возбуждения могут также быть полезны в качестве болеутоляющих средств и для лечения или предупреждения различных форм головной боли, включая "гистаминовую" головную боль, головную боль типа напряжения и ежедневную хроническую головную боль. Вдобавок, в опубликованной международной патентной заявке WO 98/45720 сообщается, что эксцитотоксичность аминокислотных рецепторов возбуждения вовлечена в этиологию острых и хронических болевых состояний, включающих сильную боль, неукротимую боль, невропатическую боль, посттравматическую боль. Известно также, что ганглии тройничного нерва и соответствующие им нервные пути связаны с болевыми ощущениями головы и лица, такими как головная боль, и, в частности, мигрень. Moskowitz(Cephalalgia, 12, 5-7, (1992) выдвинул предположение, что неизвестные пусковые механизмы стимулируют ганглии тройничного нерва, которые, в свою очередь, иннервируют сосудистую сеть в цефалической ткани, вызывая высвобождение вазоактивных нейропептидов из нейритов, иннервирующих сосудистую сеть. Эти нейропептиды инициируют цепь событий, ведущих к нейрогенному воспалению оболочек мозга, следствием чего является боль. Такое нейрогенное воспаление блокируют суматриптаном в дозах, соответствующих дозам, требуемым для лечения острой мигрени у человека. Однако такие дозы суматриптана связаны с противопоказаниями по причине сопутствующих сосудосуживающих свойств суматриптана (см., MacIntyre, P.D., et al, British Journal of Clinical Pharmacology, 34, 541-546 (1992); Chester, A.H., et al., Cardiovascular Research, 24, 932-937 (1990); Conner, H.E., et al., European Journal of Pharmacology, 161, 91-94 (1990. Недавно появилось сообщение о том, что все пять членов каинатного подтипа-8 009526 ионотропных глутаматных рецепторов экспрессированы на нейронах тройничного нерва крыс и, в частности, обнаружены высокие уровни GluR5 и КА 2 (Sahara et al., The Journal of Neuroscience, 17(17), 6611(1997. Как таковая, мигрень представляет еще одно неврологическое нарушение, которое может быть связано с эксцитотоксичностью глутаматных рецепторов. Считается, что использование нейропротективного средства, такого как антагонист аминокислотных рецепторов возбуждения, полезно при лечении или предупреждении всех вышеупомянутых нарушений и/или в целях ослабления неврологического повреждения, связанного с указанными нарушениями. Например, исследования показали, что антагонисты АМРА-рецептора оказываются нейропротективными на моделях фокальной и глобальной ишемии. Сообщается, что конкурентный антагонист АМРАрецептора, NBQX (2,3-дигидрокси-6-нитро-7-сульфамоилбензо[f]хиноксалин), эффективен в предупреждении глобального и фокального ишемического нарушения. Sheardown et al., Science, 247, 571 (1900);Buchan et al., Neuroreport, 2, 473 (1991); LePeillet et al, Brain Research, 571, 115 (1992). Показано, что неконкурентный антагонист АМРА-рецептора GKYI 52466 является эффективным нейропротективным средством на крысиной моделях глобальной ишемии. LaPeillet et al., Brain Research, 571, 115 (1992). В опубликованной европейской патентной заявке 590789 А 1 и патентах Соединенных Штатов 5446051 и 5670516 описано, что некоторые соединения, представляющие собой производные декагидроизохинолина, являются антагонистами АМРА-рецептора и, как таковые, полезны в терапии множества болезненных состояний, включая головную боль и мигрень. WO 98/45270 описывает, что некоторые соединения, представляющие собой производные декагидроизохинолина, являются селективными антагонистами iGluR5-рецептора и полезны в терапии различных типов боли, включая острую, хроническую,неукротимую и невропатическую боль. Считается, что как таковые соединения настоящего изобретения полезны для лечения вышеуказанных неврологических нарушений. Такие соединения направлены на решение назревшей необходимости в безопасном и эффективном лечении неврологических нарушений, не сопровождающемся побочными эффектами. Это способствует лечению неврологических нарушений и нейродегенеративных заболеваний. Термин "лечение (терапия)" (или "лечить"), как использован здесь, имеет свое общепринятое значение, которое охватывает подавление, предотвращение, сдерживание и замедление, остановку или обращение развития, тяжести получаемого симптома. Как таковые, способы по настоящему изобретению охватывают как терапевтическое, так и профилактическое введение лекарственного средства. Характерная суточная доза составляет приблизительно от 0,01 до 100 мг/кг активного соединения данного изобретения. Предпочтительно, суточная доза составляет приблизительно от 0,05 до 50 мг/кг, более предпочтительно, от 0,1 до 25 мг/кг. Для эффективного лечения пациента, страдающего вышеуказанным заболеванием или имеющего вышеуказанное нарушение, соединение формулы (I) может быть введено в любой форме или любым способом, обеспечивающим биодоступность исходного монокислотного соединения в эффективных количествах, включая пероральный и парентеральный способы. Например, соединения формулы (I) могут быть введены перорально, подкожно, внутримышечно, внутривенно, трансдермально, интраназально,ректально, трансбуккально и тому подобным образом. Альтернативно, соединение может быть введено путем длительного вливания. Пероральное введение обычно предпочтительно. Специалист в области получения композиций легко может выбрать подходящую форму и способ введения в зависимости от конкретных характеристик выбранного соединения, болезненного состояния, которое лечат, стадии болезни и других относящихся к делу обстоятельств. Сведущему специалисту понятно, что все соединения, используемые по настоящему изобретению,способны к образованию солей, и что обычно используются солевые формы фармацевтических препаратов, часто потому, что их легче кристаллизовать и очищать, чем свободные основания. Во всех случаях возможность использования вышеуказанных фармацевтических средств в форме солей предполагается приведенным описанием, и часто предпочитается, и фармацевтически приемлемые соли всех соединений входят в перечень указанных соединений. Согласно другому аспекту, настоящее изобретение представляет фармацевтическую композицию,которая содержит соединение формулы I или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый разбавитель или носитель. Фармацевтические композиции получают известными способами, используя хорошо известные и легко доступные ингредиенты. При составлении композиций настоящего изобретения активный ингредиент обычно может быть смешан с носителем, или разбавлен носителем, или включен в носитель, и представлен в форме капсулы, саше, в бумажном пакете или другом контейнере. Когда носитель служит в качестве разбавителя, указанный носитель может быть твердым, полутвердым или жидким веществом,выступающим в качестве растворителя, эксципиента или среды для активного ингредиента. Композиции могут быть в форме таблеток, пилюль, порошков, лепешек, саше, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей, мазей, содержащих, например, до 10 мас.% активного соединения,мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильно упакованных порошков.-9 009526 Некоторые примеры подходящих носителей, эксципиентов и разбавителей включают такие вещества, как лактоза, декстроза, сахароза, сорбит, маннит, крахмалы, камедь, сок акации, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпирролидон,целлюлоза, водный сироп, метилцеллюлоза, метил- и пропил-гидроксибензоаты, тальк, стеарат магния и минеральное масло. Составы могут дополнительно включать лубриканты, смачивающие средства,эмульгирующие и суспендирующие средства, консерванты, подсластители или отдушки. Композиции изобретения могут быть составлены таким образом, чтобы обеспечить быстрое, длительное или замедленное высвобождение активного ингредиента после введения пациенту путем использования хорошо известных в данной области приемов. Композиции предпочтительно формулируют в единичную дозированную форму, где каждая дозировка содержит приблизительно от 1 до 500 мг, более предпочтительно приблизительно от 5 до 300 мг(например, 25 мг) активного ингредиента. Термин "единичная дозированная форма" означает физически дискретную единицу, подходящую в качестве унифицированной дозы для человека и другого млекопитающего, причем каждая единица содержит заранее определенное количество активного вещества, рассчитанное на получение желаемого терапевтического эффекта, совместно с подходящим фармацевтическим носителем, разбавителем или эксципиентом. Следующие примеры композиций являются исключительно иллюстративными и никоим образом не рассматриваются как ограничивающие объем изобретения и приложенных пунктов. Композиция 1 Твердые желатиновые капсулы получают, используя следующие ингредиенты: Вышеуказанные ингредиенты смешивают и заполняют твердые желатиновые капсулы в количествах 460 мг. Композиция 2 Таблетки, каждая из которых содержит 60 мг активного ингредиента, получают следующим образом: Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш США и энергично перемешивают. Раствор поливинилпирролидона смешивают с полученными порошками, затем пропускают через сито 14 меш США. Полученные таким образом гранулы сушат при 50 С и пропускают через сито 18 меш США. Затем к гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 меш США, после перемешивания прессуют на таблетировочной машине, получая таблетки, каждая из которых имеет массу 150 мг. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R означает С 1-С 20 алкил, или его фармацевтически приемлемые соли. 2. Соединение по п.1, где R означает C1-С 10 алкил. 3. Соединение по п.2, где R означает 2-этилбутил, изобутил, 3-метилбутил, децил или этил. 4. Соединение по п.3, где R означает 2-этилбутил.- 10009526 5. Соединение по п.3, где R означает изобутил. 6. Соединение по п.3, где R означает 3-метилбутил. 7. Соединение по п.3, где R означает децил. 8. Соединение по п.3, где R означает этил. 9. Соединение, которое означает 2-этилбутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 10. Соединение по п.9, где фармацевтически приемлемая соль означает трифторацетатную соль. 11. Соединение по п.9, которое означает 2-этилбутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол 5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. 12. Соединение, которое означает изобутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 13. Соединение по п.12, где фармацевтически приемлемая соль означает трифторацетатную соль. 14. Соединение по п.12, которое означает изобутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. 15. Соединение, которое означает 3-метилбутиловый эфир (3S,4aR, 6R, 8aR)-6-[2-(1 Н-тетразол-5 ил)этил]-l,2,3,4,4a,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 16. Соединение по п.15, где фармацевтически приемлемая соль означает трифторацетатную соль. 17. Соединение по п.15, которое означает 3-метилбутиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Нтетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. 18. Соединение, которое означает дециловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5-ил)этил]1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 19. Соединение по п.18, где фармацевтически приемлемая соль означает трифторацетатную соль. 20. Соединение по п. 18, которое означает дециловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. 21. Соединение, которое означает этиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5-ил)этил]1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты или фармацевтически приемлемую соль указанного соединения. 22. Соединение по п.21, где фармацевтически приемлемая соль означает хлористо-водородную соль. 23. Соединение по п.21, которое означает этиловый эфир (3S,4aR,6R,8aR)-6-[2-(1 Н-тетразол-5 ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. 24. Соединение, которое означает моногидрат гидрохлорида этилового эфира (3S,4aR,6R,8aR)-6-[2(1 Н-тетразол-5-ил)этил]-1,2,3,4,4 а,5,6,7,8,8 а-декагидроизохинолин-3-карбоновой кислоты. 25. Фармацевтическая композиция, которая содержит соединение по любому из пп.1-24 и фармацевтически приемлемый разбавитель или носитель. 26. Фармацевтическая композиция для лечения боли или мигрени, которая содержит соединение по любому из пп.1-24 и фармацевтически приемлемый разбавитель или носитель. 27. Применение соединения по любому из пп.1-24 для изготовления лекарственного средства для лечения боли. 28. Применение соединения по любому из пп.1-24 для изготовления лекарственного средства для лечения мигрени.
МПК / Метки
МПК: A61K 31/5377, A61K 31/4725, C07D 401/06, A61P 25/00
Метки: декагидроизохинолин-3-карбоновой, сложноэфирные, качестве, производные, кислоты, анальгетиков
Код ссылки
<a href="https://eas.patents.su/12-9526-slozhnoefirnye-proizvodnye-dekagidroizohinolin-3-karbonovojj-kisloty-v-kachestve-analgetikov.html" rel="bookmark" title="База патентов Евразийского Союза">Сложноэфирные производные декагидроизохинолин-3-карбоновой кислоты в качестве анальгетиков</a>
Предыдущий патент: Рекомбинантный модифицированный вирус осповакцины ankara, содержащий ati-промотор вируса коровьей оспы, и способы применения вируса и промотора
Следующий патент: Пиридилоксиметильные и бензизоксазольные азабициклические производные
Случайный патент: Способ получения высокомолекулярных полимеров (варианты) и высокомолекулярный акриловый полимер, полученный этим способом