Пиридилоксиметильные и бензизоксазольные азабициклические производные
Номер патента: 9527
Опубликовано: 28.02.2008
Авторы: Влодеки Бишоп, Бродней Майкл Аарон, Брайт Джин Майкл
Формула / Реферат
1. Пиридилоксиметил-бензизоксазольное азабициклическое соединение, имеющее формулу
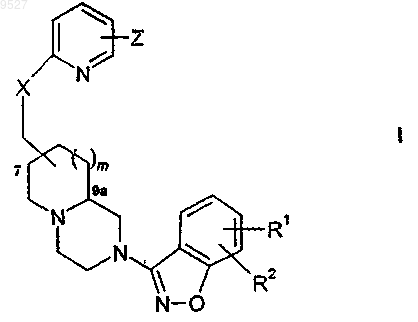
или его (R)- или (S)-энантиомер, или его цис- или транс-изомер, или его фармацевтически приемлемая соль, или сольват этого соединения или соли,
где m равно 0 или 1;
Z представляет собой
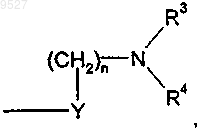
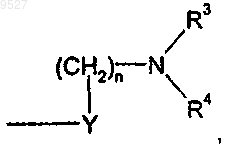
X представляет собой кислород;
Y представляет собой метилен, при этом n равно 0;
каждый из R1 и R2 независимо представляет собой водород, галоген или группу (C1-C6)алкил,
(C1-C6)алкокси или (C1-C6)алкокси(C1-C6)алкил, причем любая из этих групп может быть незамещенной либо замещенной одним или более галогенами;
каждый из R3 и R4 независимо представляет собой водород, группу (C1-C6)алкил, (C3-C7)циклоалкил или 5-6-членную гетероциклическую группу, где указанная гетероциклическая группа представляет собой циклическую группу, содержащую один или более гетероатомов, предпочтительно от одного до четырех гетероатомов, каждый из которых выбран из О, S и N; причем любая из этих групп может быть незамещенной либо замещенной любой одной или более из следующих групп: (C1-C4)алкил,
(C3-C7)циклоалкил, (C1-C4)алкокси, (C6-C10)арил, 5-6-членная гетероциклическая группа, где указанная гетероциклическая группа представляет собой циклическую группу, содержащую от одного до четырех гетероатомов, каждый из которых выбран из О, S и N, аминогруппа формулы NR5R6, где R5 и R6 независимо представляют собой Н или (C1-C4)алкил, группа галогено или гидрокси; или
R3 и R4 вместе с атомом азота, к которому они присоединены, образуют (1) 3-7-членное возможно ненасыщенное моноциклическое кольцо; причем указанное кольцо (1) может быть незамещенным либо замещенным одной или более группами (C1-C4)алкил, (C1-C4)алкокси, (C1-C4)алкокси(C1-C4)алкил,
(C3-C7)циклоалкил, (C6-C10)арил, (C7-C13)аралкил, 5-10-членный гетероарил, содержащий от одного до четырех гетероатомов, каждый из которых выбран из О, S и N, или гидрокси, аминогруппой формулы NR5R6, где R5 и R6 независимо представляют собой Н или (C1-C4)алкил; группой циано или галогено; при условии, что в любом кольце, образованном NR3R4:
а) присутствует не более чем один кольцевой атом кислорода;
б) отсутствует группировка гидрокси, алкокси, алкоксиалкил, циано, аминогруппа формулы NR5R6, где R5 и R6 независимо представляют собой Н или (C1-C4)алкил; или группировка алкиламино, непосредственно связанные с любым кольцевым атомом азота; и
в) отсутствует кольцевой атом углерода, связанный двойной связью с другим кольцевым атомом углерода, и никакая часть ароматической кольцевой системы не может быть связана с кольцевым атомом кислорода или кольцевым атомом азота.
2. Соединение по п.1, имеющее структуру
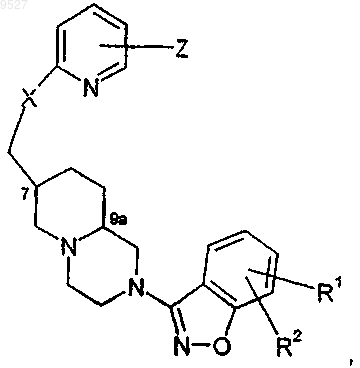
где Z представляет собой
X представляет собой кислород;
Y представляет собой метилен, при этом n равно 0;
каждый из R1 и R2 представляет собой водород или галоген;
R3 и R4 вместе с атомом азота, к которому они присоединены, образуют (1) насыщенное
3-7-членное моноциклическое кольцо,
причем указанное моноциклическое кольцо, возможно, имеет один или два дополнительных гетероатома, выбранных из азота, кислорода и серы, и любое указанное кольцо (1) может быть незамещенным либо замещенным одной или более чем одной группой (C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил или гидрокси,
или его (R)- или (S)-энантиомер, или его цис- или транс-изомер, или его фармацевтически приемлемая соль, или сольват этого соединения или соли.
3. Соединение по п.1 или 2, где Z представляет собой
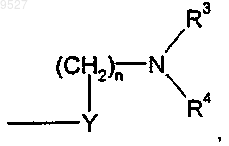
Y представляет собой метилен;
X представляет собой кислород;
n равно 0;
R1 представляет собой водород;
R2 представляет собой водород;
R3 и R4 вместе с атомом азота, к которому они присоединены, образуют (1) насыщенное неароматическое 3-7-членное моноциклическое кольцо, причем указанное кольцо (1) является незамещенным либо замещенным одной или более группами (C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил или гидрокси, или его (R)- или (S)-энантиомер, или его цис- или транс-изомер, или его фармацевтически приемлемая соль, или сольват этого соединения или соли.
4. Соединение по п.1 или 2, где Z представляет собой
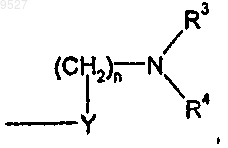
Y представляет собой метилен;
X представляет собой кислород;
n равно 0;
R1 представляет собой водород;
R2 представляет собой водород;
R3 и R4 вместе с атомом азота, к которому они присоединены, образуют незамещенное 5-6-членное гетероциклическое кольцо, которое кроме атома азота, к которому присоединены R3 и R4, имеет один дополнительный атом азота, серы или кислорода,
или его (R)- или (S)-энантиомер, или его цис- или транс-изомер, или его фармацевтически приемлемая соль, или сольват этого соединения или соли.
5. Соединение по п.1 или 2, где R1 представляет собой галоген и R3 и R4 вместе с атомом азота, к которому они присоединены, образуют (1) насыщенное 3-7-членное моноциклическое кольцо, которое может быть незамещенным либо замещенным одной или более группами фенил, (C1-C3)алкил или
(C1-C4)алкокси(C1-C4)алкил; или его (R)- или (S)-энантиомер, или его цис- или транс-изомер, или его фармацевтически приемлемая соль, или сольват этого соединения или соли.
6. Соединение по п.1 или 2, где указанное соединение выбрано из группы, состоящей из
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(6-морфолин-4-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(5-пиперидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-(5-фторбензо[d]изоксазол-3-ил)-7-(5-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-7-(5-азетидин-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-[5-(2-метилазиридин-1-илметил)пиридин-2-илоксиметил]октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-[5-(2-метоксиметилпирролидин-1-илметил)пиридин-2-илоксиметил]октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-7-(5-азетидин-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(S)-пирролидин-3-ола,
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридю[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(R)-пирролидин-3-ола,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-[5-(2-метилпирролидин-1-илметил)пиридин-2-илоксиметил]октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]пиперидин-4-ола,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(6-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(5-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-2-бензо[d]изоксазол-3-ил-7-(5-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина и
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]пирролидин-3-ола,
или его фармацевтически приемлемая соль, или сольват этого соединения или его соли.
7. Соединение по п.6, где указанное соединение выбрано из группы, состоящей из
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-пирролидин-3-ола,
(7R,9aS)-транс-7-(5-азетидин-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-[5-(2-метилпирролидин-1-илметил)пиридин-2-илоксиметил]октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-7-(5-азетидин-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(R)-пирролидин-3-ола,
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(S)-пирролидин-3-ола,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(5-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(6-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(5-пиперидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина и
(7S,9aS)-цис-2-бензо[d]изоксазол-3-ил-7-(5-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
или его фармацевтически приемлемая соль, или сольват этого соединения или его соли.
8. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]диэтиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]диметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]циклогексилметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]этилметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]циклопентилметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(2-метоксиэтил)метиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-трет-бутиламина,
(7S,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]этилметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]диметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]бензиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]циклопропилметиламина и
(7S,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]циклопентилметиламина,
или его фармацевтически приемлемая соль, или сольват этого соединения или его соли.
9. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из:
(7R,9aS)-транс-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]пирролидин-3-ола,
(7S,9aS)-цис-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]пирролидин-(S)-3-ола,
(7S,9aS)-цис-1-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]пирролидин-(R)-3-ола,
(7R,9aS)-транс-2-(5-фторбензо[d]изоксазол-3-ил)-7-(6-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(2-метокси-1-метилэтил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(2-метоксиэтил)метиламина,
(7S,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]циклогексилметиламина,
(7S,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]диметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]циклогексилметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(2-морфолин-4-илэтил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(2-морфолин-4-илэтил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(2-пирролидин-1-илэтил)амина,
(7S,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-диметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(3-метилпиридин-4-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]циклопропиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]циклопропилметиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(тетрагидрофуран-2-илметил)амина и
(7R,9aS)-транс-N-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-N,N'-диметилэтан-1,2-диамина,
или его фармацевтически приемлемая соль, или сольват этого соединения или его соли.
10. Соединение по п.1, где указанное соединение выбрано из группы, состоящей из
(7R,9aS)-транс-7-[6-(2,6-диметилпиперидин-1-илметил)пиридин-2-илоксиметил]-2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-(5-фторбензо[d]изоксазол-3-ил)-7-[6-(4-метилпиперазин-1-илметил)пиридин-2-илоксиметил]октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-(5-фторбензо[d]изоксазол-3-ил)-7-(6-пиперидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-7-[6-(2,5-диметилпирролидин-1-илметил)пиридин-2-илоксиметил]-2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-7-(6-азепан-1-илметилпиридин-2-илоксиметил)-2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-7-(5-азепан-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(5-тиазолидин-3-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-(5-имидазол-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-2-бензо[d]изоксазол-3-ил-7-(5-пиперидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-2-бензо[d]изоксазол-3-ил-7-[5-(2-метилазиридин-1-илметил)пиридин-2-илоксиметил]-октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-7-(5-азетидин-1-илметилпиридин-2-илоксиметил)-2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-2-бензо[d]изоксазол-3-ил-7-(6-морфолин-4-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7S,9aS)-цис-2-бензо[d]изоксазол-3-ил-7-(6-пирролидин-1-илметилпиридин-2-илоксиметил)октагидропиридо[1,2-а]пиразина,
(7R,9aS)-трансциклогексил-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}амина,
(7R,9aS)-транс-2-(этил-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}амино)этанола,
(7R,9aS)-транс-1,2-диметилпропил-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}амина,
(7R,9aS)-трансциклопропил-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]-пиридин-2-илметил}амина,
(7R,9aS)-трансциклопропилметил-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]-пиридин-2-илметил}амина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}диметиламина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}-(тетрагидрофуран-2-илметил)амина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}-[3-(4-метилпиперазин-1-ил)пропил]амина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}пирролидин-1-иламина,
(7S,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(2-метоксиэтил)метиламина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-3-илметил}диметиламина,
(7R,9aS)-трансэтил-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-3-илметил}метиламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(2-пирролидин-1-илэтил)амина,
(7R,9aS)-транс-2-бензо[d]изоксазол-3-ил-7-[5-(4-метил-[1,4]диазепан-1-илметил)пиридин-2-илоксиметил]-октагидропиридо[1,2-а]пиразина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(1Н-пиразол-3-ил)амина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}-(2-морфолин-4-илэтил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-трет-бутилметиламина,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}-[2-(1-метилпирролидин-2-ил)этил]амина,
или его фармацевтически приемлемая соль, или сольват этого соединения или его соли.
11. Соединение, выбранное из группы, состоящей из
(7R,9aS)-транс-(4-хлорбензил)-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметил}амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(3-метилизоксазол-4-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]тиазол-2-иламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(3-метилизоксазол-5-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(3-метилпиридин-4-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(5-метил-2Н-пиразол-3-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(5-метилпиридин-2-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(1Н-пиразол-3-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(6-метилпиридин-2-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]пиридин-2-иламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]пиримидин-4-иламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-илметил]-(6-метоксипиридин-3-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]тиазол-2-иламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(3-метилпиридин-4-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(5-метил-2Н-пиразол-3-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(5-метилпиридин-2-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(6-метилпиридин-2-ил)амина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]пиридин-2-иламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]пиримидин-4-иламина,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметил]-(6-метоксипиридин-3-ил)амина,
или его фармацевтически приемлемая соль, или сольват этого соединения или его соли.
12. Пиридилоксиметил-бензизоксазольное азабициклическое соединение формулы

или его (R)- или (S)-энантиомер, или его цис- или транс-изомер,
где X представляет собой кислород;
каждый из R1 и R2 независимо представляет собой водород, галоген или группу (C1-C6)алкил,
(C1-C6)алкокси или (C1-C6)алкокси(C1-C6)алкил, причем любая из этих групп может быть незамещенной либо замещенной одним или более галогенами;
Z представляет собой

R7 представляет собой водород или (C1-C3)алкокси;
R8 представляет собой водород, гидрокси или (C1-C3)алкокси;
R9 представляет собой (C1-C3)алкил.
13. Соединение по п.12, где указанное соединение выбрано из группы, состоящей из
(7R,9aS)-транс-6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)никотиновой кислоты метилового эфира,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-3-ил]метанола,
(7R,9aS)-трансметансульфоновой кислоты 6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметилового эфира,
(7R,9aS)-трансметансульфоновой кислоты 6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметилового эфира,
(7R,9aS)-транс-6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-карбоновой кислоты метилового эфира,
(7R,9aS)-транс-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-ил]метанола,
(7R,9aS)-транс-{6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-ил}метанола,
(7R,9aS)-транс-6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-карбоновой кислоты метилового эфира,
(7R,9aS)-цис-6-(2-бензо[d]изоксазол-3-илоктагидропиридю[1,2-а]пиразин-7-илметокси)пиридин-2-карбоновой кислоты метилового эфира,
(7R,9aS)-цис-[6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-ил]метанола,
(7R,9aS)-цис-метансульфоновой кислоты 6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметилового эфира,
(7R,9aS)-транс-5-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-карбоновой кислоты метилового эфира,
(7R,9aS)-транс-[5-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-ил]метанола и
(7R,9aS)-трансметансульфоновой кислоты 5-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2-илметилового эфира.
14. Способ лечения одного или более расстройств центральной нервной системы, включающий введение млекопитающему, которому необходимо такое лечение, терапевтически эффективного количества соединения по любому из пп.1-11.
Текст
009527 Область изобретения Данное изобретение относится к аминометилпиридилоксиметил-бензизоксазолзамещенным азабициклическим соединениям, которые, среди прочего, можно самостоятельно использовать в качестве эффективного ингибитора 5-HT1B-, 5-HT2A- и D2-рецепторов, например антагониста, обратного агониста и/или частичного агониста. Данное изобретение также относится к промежуточному соединению для получения указанных соединений; к фармацевтической композиции, содержащей указанные соединения; и к применению указанных соединений или других соединений, обладающих указанным эффективным связыванием с 5-HT1B-, 5-HT2A- и D2-рецепторами или их ингибированием, в способе лечения некоторых расстройств ЦНС или других расстройств. Предшествующий уровень техники Расстройства центральной нервной системы (ЦНС) можно лечить различными медицинскими способами. В этом отношении возрастающее значение имеют психотропные лекарственные средства. Но,несмотря на то, что такие лекарственные средства обладают терапевтическим эффектом, они также могут приводить к нежелательным и серьезным побочным эффектам. Например, шизофрению можно лечить так называемыми типичными лекарственными средствами, которые, как теоретически предполагают, блокируют в мозге некоторые дофаминовые рецепторы (D2), ответственные за позитивные симптомы маний, беспорядочного мышления и т.п. Однако, несмотря на то, что эти лекарственные средства могут улучшать некоторые из позитивных симптомов, они также могут неблагоприятно воздействовать на двигательную систему, вызывая мышечные проблемы, такие как спазмы, судороги, тремор и паркинсонизм. Так как эти типы побочных эффектов, обычно характеризуемые как экстрапирамидные симптомы (EPS), могут быть достаточно тяжелыми для нарушения ежедневной деятельности, было обращено внимание на так называемые нетипичные лекарственные средства. Нетипичные антипсихотические средства характеризуются меньшим количеством EPS и могут смягчать не только некоторые позитивные симптомы шизофрении, но также и некоторые негативные симптомы, такие как эмоциональную невосприимчивость, социальную самоизоляцию и подобное. Хотя полагают, что антипсихотические лекарственные средства являются более селективными в своем химическом воздействии на мозг, тем самым уменьшая EPS, они имеют слишком много побочных эффектов. Несмотря на то что эти побочные эффекты не часто оказывают такое же разрушительное действие как имеющие место при терапии типичными лекарственными средствами, они могут быть значимыми для пациента. Например, нетипичные лекарственные средства могут быть седативными и могут быть причиной увеличения массы пациента. Кроме того, ситуация усложняется, когда у пациента имеется несколько расстройств ЦНС. Например психоз, такой как шизофрения, часто может сосуществовать с депрессией, тревогой, обсессивнокомпульсивным расстройством (OCD) и другими подобными заболеваниями. В таких случаях лечение часто влечет за собой введение комбинации лекарственных средств, например одного для лечения шизофрении и одного для лечения депрессии или другого сопутствующего заболевания ЦНС. Так как каждое подобное лекарственное средство имеет свои собственные побочные эффекты, комбинированное введение может привести к увеличению или усилению этих заболеваний в ущерб пациенту. Кроме того, теоретически предполагается, что различные рецепторы мозга, или комбинация, или изменения рецепторов тем или иным образом вовлечены в каждое из разнообразных расстройств ЦНС; например, полагают, что шизофрения затрагивает D2- и 5-HT2A-рецепторы, тогда как депрессия связана с 5-HT1B-рецепторами. Класс аминометилфеноксиметил-бензизоксазолзамещенных азабициклических соединений, полезных в качестве селективных агонистов и антагонистов рецепторов серотонина 1(5-HT1), описан в WO 99/52907 (Bright). До сих пор утверждалось, что трудно найти одно лекарственное средство, которое может лечить пациента, страдающего разнообразными расстройствами ЦНС, при которых задействовано множество разных рецепторов. Соответственно, имеет место постоянная потребность в психотропных лекарственных средствах, которые имеют явно уменьшенные побочные эффекты и которые могут эффективно и самостоятельно лечить многочисленные расстройства ЦНС, при которых требуется антагонист или агонист разных рецепторов. Конкретно, желательно обнаружить лекарственное средство,которое может одновременно лечить шизофрению и депрессию, в которые вовлечены D2, 5-HT2A- и 5-HT1B-рецепторы.-1 009527 Краткое изложение сущности изобретения Настоящее изобретение обращено на упомянутые выше потребности. В одном аспекте изобретение относится к соединению, имеющему следующую формулу, обозначенную в описании изобретения формулой или его (R)- или (S)-энантиомеру, или его цис- или транс-изомеру, или его или любого из вышеуказанного фармацевтически приемлемой соли, сольвату или пролекарству,где m равно 0 или 1;R7 представляет собой водород или (C1-C3)алкокси;X представляет собой кислород или NR, где R представляет собой водород или (C1-C6)алкил;Y представляет собой метилен, при этом n равно 0, 1 или 2, или кислород, азот, или серу, при этом n равно 2, 3 или 4; каждый из R1 и R2 независимо представляет собой водород, галоген или (C1-C6)алкильную,(C1-C6)алкокси или (C1-C6)алкокси(C1-C6)алкильную группу,причем любая из этих групп может быть незамещенной либо замещенной одним или более галогенами; каждый из R3 и R4 независимо представляет собой водород, группу (C1-C6)алкил, (C3-C7)циклоалкил или 5-6-членную гетероциклическую группу, причем любая из этих групп может быть незамещенной либо замещенной любой одной или более из следующих групп: (C1-C4)алкил, (C3-C7)циклоалкил,(C1-C4)алкокси, (C6-C10)арил, 5-6-членная гетероциклическая группа, амино, галоген или гидрокси; или(1) 3-7-членное возможно ненасыщенное моноциклическое кольцо; или(2) 4-10-членное возможно ненасыщенное полициклическое кольцо, где указанное моноциклическое или полициклическое кольцо, возможно, содержит один или два дополнительных гетероатома, выбранных из азота, кислорода и серы,причем любое из указанных колец (1) или (2) может быть незамещенным либо замещенным одной или более группами: (C1-C4)алкил, (C1-C4)алкокси, (C1-C4)алкокси(C1-C4)алкил, (C3-C7)циклоалкил,(C6-C10)арил, (C7-C13)аралкил, 5-10-членный гетероарил, гидрокси, амино, циано или галоген. В конкретном воплощении соединение по изобретению имеет формулу или представляет собой его (R)- или (S)-энантиомер, или его цис- или транс-изомер, или его либо любого из вышеуказанного фармацевтически приемлемую соль, сольват или пролекарство, где Z представляет собой где R7 представляет собой водород или (C1-C3)алкокси;X представляет собой кислород или NR, R представляет собой водород или (C1-C6)алкил;Y представляет собой метилен, при этом n равно 0, 1 или 2, или кислород, азот, или серу, при этом n равно 2, 3 или 4; каждый из R1 и R2 независимо представляет собой водород, галоген или (C1-C6)алкильную,(C1-C6)алкокси или (C1-C6)алкокси(C1-C6)алкильную группу, каждая из которых может быть незамещенной либо замещенной одним или более галогенами; каждый из R3 и R4 независимо представляет собой водород, группу (C1-C6)алкил, (C3-C7)циклоалкил или 5-6-членную гетероциклическую группу, причем любая из этих групп может быть незамещенной либо замещенной любой одной или более чем одной из следующих групп: (C1-C4)алкил,(C3-C7)циклоалкил, (C1-C4)алкокси, (C6-C10)арил, 5-6-членная гетероциклическая группа, амино, галогено или гидрокси; или(1) 3-7-членное возможно ненасыщенное моноциклическое кольцо; или(2) 4-10-членное возможно ненасыщенное полициклическое кольцо, где указанное моноциклическое или полициклическое кольцо, возможно, содержит один или два дополнительных гетероатома, выбранных из азота, кислорода и серы,причем любое из указанных колец (1) или (2) может быть незамещенным либо замещенным одной или более чем одной группой: (C1-C4)алкил, (C1-C4)алкокси, (C1-C4)алкокси(C1-C4)алкил, (C3-C7)циклоалкил,(C6-C10)арил, (C7-C13)аралкил, 5-10-членный гетероарил, гидрокси, амино, циано или галогено. В других аспектах данное изобретение относится к фармацевтической композиции, содержащей указанное соединение, и к способу лечения одного или более расстройств ЦНС, при которых требуется лиганд, например антагонист, частичный агонист (с антагонизмом 80% и более) или обратный агонист в отношении D2-, 5-HT2A- и 5-HT1B-рецепторов, отдельно или в любой их комбинации. Данное изобретение также частично относится к соединению, демонстрирующему соотношение связывания с рецепторами D2:5-HT1B приблизительно 20 или менее и/или ингибиторную активность в отношении каждого из указанных D2-, 5-HT1B- и 5-HT2A-рецепторов. Соединения по изобретению обладают рецепторно-связывающей активностью в отношении по меньшей мере двух и предпочтительно всех трех D2-, 5-HT1B- и 5-HT2A-рецепторов. Степень ингибирования при этом такова, что соединение по изобретению является терапевтически эффективным для лечения расстройств(а) ЦНС у млекопитающего, при которых(ом) требуется активность в отношении всех этих рецепторов. Это означает, что соединение имеет значение эффективной Ki (константа ингибирования), равное 20 нМ или менее, в отношении всех трех рецепторов. Кроме того, изобретение предпочтительно включает в себя любые соединения с характеристической эффективностью (intrinsic efficacy) антагониста и/или обратного агониста в отношении D2-,5-HT1B- и 5-HT2A-рецепторов человека. Характеристическую эффективность измеряют посредством аденилатциклазной активности, фосфоинозитольного цикла или другими способами, известными в технике. Ни одно из известных из уровня техники соединений не проявляет активность антагониста или обратного агониста ко всем трем рецепторам. Более конкретно, данное изобретение предпочтительно включает в себя соединения с характеристической эффективностью антагониста и/или обратного агониста в отношении D2- и 5-HT2A-рецепторов человека и характеристической эффективностью антагониста более 80% в отношении 5-HT1B-рецепторов человека. Как упомянуто выше, характеристическую эффективность можно измерить посредством аденилатциклазной активности или фосфоинозитольного цикла. Данное изобретение предпочтительно включает в себя соединения с функциональным значением Ki на 5-HT1B-рецепторе человека, равным 5 нМ или менее, в сочетании с функциональным значением Ki,равным 20 нМ или менее, на D2- и 5-HT2A-рецепторах человека. Кроме того, данное изобретение предпочтительно включает в себя соединения, которые могут самостоятельно проявлять эффективность in vivo в животных моделях 5-HT1B, D1 и 5-HT2A антагонизма или обратного агонизма. Репрезентативные животные модели включают следующие ниже примеры, но не ограничены такими моделями. Соединения проверяют на способность противодействовать гипотермической реакции, вызванной 5-HT1B агонистом, в качестве показателя 5-HT1B антагонистической активности. Соединения или носитель подкожно (пк) вводят морским свинкам за 0-60 мин до 5-HTB агониста и в течение 4 ч после введения агониста следят за температурой тела. Настоящее изобретение предпочтительно включает в себя соединения с ID50 (дозой, вызывающей 50% ингибирование), равной 1 мг/кг или менее, подкожно, при гипотермии. В другой животной модели соединения проверяют на их способность противодействоватьDOI-(1-(2,5-диметокси-4-иодфенил)-2-аминопропан) индуцированным (взаимодействие лекарственных средств) подергиваниям головы в качестве показателя 5-HT2A антагонистической активности. Введение агониста 5-HT2A, DOI, вызывает характерное встряхивание головы (подергивание головы), которое объясняют активацией 5-HT2A-рецепторов. Соединения или носитель подкожно вводят приученным крысам за 30-60 мин до введения 3,2 мг/кг DOI и подсчитывают подергивания головы за 30-минутный период испытания. Данное изобретение предпочтительно включает в себя соединения с ID50, равной 10 мг/кг или менее, подкожно, при 5-HT2A-опосредованном подергивании головой.-3 009527 Кроме того,соединения проверяют на способность противодействоватьd-амфетамининдуцированной гиперактивности, в качестве показателя in vivo антагонистической активности в отношении дофаминовых D2-рецепторов. Введение низких доз непрямого агониста дофамина,d-амфетамина, приводит к значительному увеличению горизонтальной двигательной активности крыс феномен, который объясняют активацией мезолимбической дофаминовой системы и который, следовательно, обеспечивает модель гипердофаминергической активности у грызунов, вовлеченной в шизофрению. Соединения или носитель подкожно вводят приученным крысам за 30-60 мин до 1,0 мг/кгd-амфетамина SO4 и данные по двигательной активности регистрируют в компьютерно-контролируемых камерах для исследования активности в течение 3 ч продолжения гиперактивной реакции. Изобретение включает в себя соединения с ID50, равной 10 мг/кг или менее, подкожно, приd-амфетаминовой двигательной активности. Подробное описание изобретения В одном воплощении изобретение направлено на соединение, обладающее, среди прочего,связывающей активностью в отношении одного или многих рецепторов, включая D2, 5-HT1B и 5-HT2A-рецепторы, отдельно или в любой их комбинации. В предпочтительном воплощении соединение обладает связывающей активностью (на основании, например IC50 или Ki) в отношении D2- и 5-HT1B-рецепторов при соотношении D2:5-HT1B приблизительно 20 или менее; более предпочтительно это соотношение составляет приблизительно 10 или менее; приблизительно 5 или менее; наиболее предпочтительно приблизительно 1. Если не указано иное, термин "ингибиторная активность" и его родственные варианты, используемые в данном описании, означают, что соединение служит, без ограничения, антагонистом, обратным агонистом и/или частичным агонистом (антагонизм 80% и более) и подобным в отношении любого из рецепторов, указанных в описании; например, соединение проявляет аффинность связывания с Ki приблизительно 1 мкМ или менее, предпочтительно приблизительно 100 нМ или менее, приблизительно 50 нМ или менее, приблизительно 20 нМ или менее и наиболее предпочтительно приблизительно 10 нМ или менее в отношении любого из вышеупомянутых рецепторов. В примере воплощения соединение по изобретению имеет формулу I, указанную выше, включая его фармацевтически приемлемые соли, например его соли присоединения кислоты, соли присоединения основания и пролекарства и сольваты. Без ограничения, примерами фармацевтически приемлемых солей присоединения кислоты соединений формулы I являются соли соляной, пара-толуолсульфоновой, фумаровой, лимонной, янтарной, салициловой, щавелевой, бромисто-водородной, фосфорной, метансульфоновой, винной, малат, ди-пара-толуоилвинной и миндальной кислот. Другими возможными солями присоединения кислоты являются, например, соли, содержащие фармацевтически приемлемые анионы, такие как гидройодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат и памоат (т.е. 1,1'-метилен-бис(2-гидрокси-3-нафтоат. Соединения формулы I могут иметь оптические центры (например, в указанных положениях 7 и 9 а) и, следовательно, могут находиться в различных энантиомерных конфигурациях. Изобретение включает все энантиомеры, диастереомеры и другие стереоизомеры и оптические изомеры такого соединения формулы I, а также их рацемические и другие смеси. Например, соединение формулы I включает (R)- и(S)-энантиомеры и цис- и транс-изомеры. Кроме того, настоящее изобретение включает в себя все меченые радиоизотопом формы соединения формулы I. Предпочтительными соединениями, мечеными радиоизотопом, являются соединения, где радиоактивные метки выбраны из 3 Н, 11C, 14C, 18F, 123I и 125I. Такие соединения, меченые радиоизотопом, полезны в качестве исследовательских и диагностических инструментов в исследованиях фармакокинетки метаболизма и в анализах связывания у животных и человека. В другом воплощении изобретение направлено на соединения формулы I, где в анализе D2-,5HT-1B-или 5HT-2A-связывания указанное соединение демонстрирует Ki с характеристической эффективностью приблизительно 1 мкМ или менее; предпочтительно приблизительно 100 нМ или менее, приблизительно 50 нМ или менее, приблизительно 20 нМ или менее и наиболее предпочтительно приблизительно 10 нМ или менее. В этом случае используют известные в данной области или легко адаптируемые из уровня техники анализы. В предпочтительном воплощении Z представляет собойR2 представляет собой водород или галоген;R3 представляет собой водород или (C1-C3)алкил.R4 представляет собой а) (C1-C6)алкильную группу,б) (C3-C7)циклоалкильную группу или в) 5-6-членную гетероциклическую группу,каждая из групп а), б) или в) может быть незамещенной либо замещенной одной или более чем одной из следующих групп:(C1-C4)алкил,(C3-C7)циклоалкил,(C1-C4)алкокси,(C6-C10)арил,5-6-членная гетероциклическая группа, амино, галогено или гидрокси. Более предпочтительно R4 представляет собой: а) (C1-C4)алкил, который может быть незамещенным либо замещенным одной или более чем одной из следующих групп: фенил, циклопропил, метокси, или замещенным 5-6-членной гетероциклической группой, причем гетероциклическая группа содержит по меньшей мере один атом азота или кислорода; б) незамещенный (C3-C7) циклоалкил или в) 5-6-членную гетероциклическую группу, которая может быть незамещенной либо замещенной(C1-C3)алкилом или (C1-C3)алкокси, при этом указанная 5-6-членная гетероциклическая группа в) содержит по меньшей мере один атом азота и другой гетероатом, выбранный из азота, кислорода и серы, в количестве до одного включительно. Еще более предпочтительно R4 представляет собой: а) незамещенный C4 алкил; C3 алкил, замещенный метокси; (C1-C2)алкил, замещенный фенилом или циклопропилом; (C1-C2)алкил, замещенный 5-членной гетероциклической группой, содержащей атом азота или кислорода, или (C1-C2)алкил, замещенный 6-членной гетероциклической группой, содержащей по меньшей мере один атом азота; б) незамещенный циклопропил или в) 5-6-членную гетероциклическую группу, которая может быть незамещенной либо замещенной метилом или метокси, при этом указанная 5-6-членная гетероциклическая группа (в) содержит по меньшей мере один атом азота и другой гетероатом, выбранный из азота, кислорода и серы, в количестве до одного включительно, указанный (C1-C3)алкил представляет собой метил, и указанный (C1-C3)алкокси представляет собой метокси. В другом предпочтительном воплощении Z представляет собойR4 представляет собой: а) (C1-C4)алкильную группу или б) (C5-C6)циклоалкильную группу,каждая из групп а) или б) может быть незамещенной либо замещенной одной или более чем одной группой (C1-C3)алкокси или амино. Предпочтительно аминогруппа имеет формулу -NR5R6, где каждый из R5 и R6 независимо представляет собой водород или (C1-C4)алкил; более предпочтительно R4 представляет собой: а) (C1-C4)алкильную группу, незамещенную или замещенную одной или более метокси- или аминогруппами, где R5 представляет собой водород и R6 представляет собой метил, или б) незамещенную (C5-C6)циклоалкильную группу. В еще одном предпочтительном воплощении Z представляет собойn равно 0; каждый из R1 и R2 представляет собой водород или галоген иR3 и R4 вместе с атомом азота, к которому они присоединены, образуют 1) насыщенное 3-7-членное моноциклическое кольцо, причем указанное кольцо 1) является незамещенным либо замещенным одной или более чем одной группой (C1-C4)алкил, (C1-C4)алкокси(C1-C4)алкил или гидрокси. Альтернативно, R3 и R4 вместе с атомом азота, к которому они присоединены, образуют незамещенное 5-6-членное кольцо, которое имеет один дополнительный атом азота, серы или кислорода. Альтернативно, R1 представляет собой водород, R2 представляет собой галоген и R4 представляет собой: а) (C1-C5)алкильную группу; б) (C3-C6)циклоалкильную группу и каждая из групп а) или б) может быть незамещенной либо замещенной одной или более чем одной из следующих групп: циклопропил; галоген; гидрокси; 5-6-членная гетероциклическая группа, где указанная 5-6-членная гетероциклическая группа может быть незамещенной либо замещенной одной или более метильными группами; или фенил, где указанный фенил может быть незамещенным либо замещенным одним или более чем одним галогеном; или в) 5-членную гетероциклическую группу. Предпочтительно R2 представляет собой фтор и R3 представляет собой водород или метил. В другом предпочтительном воплощении Z представляет собойR1 представляет собой водород,R2 представляет собой галоген иR3 и R4 вместе с атомом азота, к которому они присоединены, образуют 1) насыщенное 3-7-членное моноциклическое кольцо, которое может быть незамещенным либо замещенным одной или более группами: фенил, (C1-C3)алкил или (C1-C4)алкокси(C1-C4)алкил либо 2) 5-6-членное кольцо, которое может быть незамещенным либо замещенным одной или более чем одной (C1-C3)алкильной группой и которое имеет дополнительный атом азота или атом кислорода. В соединении формулы I, любом кольце, образованном NR3R4:(a) присутствует не более чем один кольцевой атома кислорода;(б) отсутствует группировка гидрокси, алкокси, алкоксиалкил, циано, амино или алкиламино, непосредственно связанная с любым кольцевым атомом азота;(в) отсутствует кольцевой атом углерода, связанный двойной связью с другим кольцевым атомом углерода, и никакая часть ароматической кольцевой системы не может быть связана с кольцевым атомом кислорода или кольцевым атомом азота. Настоящее изобретение также направлено на фармацевтическую композицию, содержащую соединение по изобретению и фармацевтически приемлемый носитель. Если не указано иное, следующие термины и их родственные варианты, при использовании в данном описании изобретения, имеют приведенные ниже значения."Алкил", включая его использование в терминах "алкокси", "алкоксиалкил" и "аралкил", содержит насыщенные одновалентные углеводородные радикалы, имеющие неразветвленные или разветвленные группировки. Примеры алкильных групп включают метил, этил, н-пропил, изопропил и трет-бутил, но не ограничены ими."Метиленом" называется двухвалентный радикал -(CH2)p-, где p равно 1 (метилен), 2 (диметилен) или 3 (триметилен)."Циклоалкил" включает неароматические насыщенные циклические алкильные группировки, где алкил является таким, как определено выше. Примеры циклоалкила включают, но не ограничены ими,циклопропил, циклобутил, циклопентил, циклогексил и циклогептил; а также бициклоалкильные и трициклоалкильные группы, которые являются неароматическими насыщенными карбоциклическими группами, состоящими из двух или трех колец соответственно, где указанные кольца имеют по меньшей мере один общий атом углерода. Для целей настоящего изобретения, если не указано иное, бициклоалкильные группы включают спирогруппы и конденсированные кольцевые группы. Примеры бициклоалкильных групп включают бицикло[3.1.0]гексил, бицикло[2.2.1]гепт-1-ил, норборнил, спиро[4.5]децил, спиро[4.4]нонил, спиро[4.3]октил и спиро[4.2]гептил, но не ограничены ими. Примером трициклоалкильной группы является адамантил. Циклоалкильные группы также включают группы, замещенные одной или более группировками. примерами таких групп с оксогруппировками являются оксоциклопентил и оксоциклобутил."Арил" включает в себя органический радикал, полученный из ароматического углеводорода путем удаления одного водорода, такой как фенил, нафтил, инденил, инданил и флуоренил, и конденсированные кольцевые группы, в которых по меньшей мере одно кольцо является ароматическим."Гетероциклическая группа" относится к циклической группе, содержащей один или более гетероатом, предпочтительно от одного до четырех гетероатомов, каждый из которых выбран из О, S и N. Гетероциклические группы также включают кольцевые системы, замещенные одной или более оксогруппировкой. Примерами гетероциклических групп являются азиридинил, азетидинил, пирролидинил, пиперидинил, азепинил, пиперазинил, 1,2,3,6-тетрагидропиридинил, оксиранил, оксетанил,тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, морфолино, тиоморфолино, тиоксанил, пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил,пиразолинил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил,имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, хинолизинил, хинуклидинил,1,4-диоксаспиро[4.5]децил,1,4-диоксаспиро[4.4]нонил,1,4-диоксаспиро[4.3]октил и 1,4-диоксаспиро[4.2]гептил."Гетероарил" относится к ароматическим группам, содержащим один или более гетероатом (О, S или N), предпочтительно от одного до четырех гетероатомов. Мультициклическая группа, содержащая один или более гетероатом, где по меньшей мере одно кольцо группы является ароматическим, представляет собой "гетероарильной" группой. Гетероарильные группы по данному изобретению также могут включать в себя кольцевые системы, замещенные одной или более оксогруппировкой. Примерами гетероарильных групп являются пиридинил, пиридазинил, имидазолил, пиримидинил, пиразолил, триазолил,пиразинил, хинолил, изохинолил, 1,2,3,4-тетрагидрохинолил, тетразолил, фурил, тиенил, изоксазолил,тиазолил, оксазолил, изотиазолил, пирролил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, триазинил, 1,2,4-триазинил, 1,3,5-триазинил, изоиндолил,1-оксоизоиндолил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил,бензотриазолил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил, тетрагидроизохинолил, бензофурил, фуропиридинил,пиролопиримидинил и азаиндолил. Указанные группы, производные от структур, перечисленных выше, могут быть связаны через атом(связанный через атом N) или пиррол-3-ил (связанный через атом C). Относящиеся к группам термины также охватывают все возможные таутомеры."Амино" включает в себя группировки формулы -NR5R6, где каждый из R5 и R6 независимо представляет собой водород или (C1-C4)алкил."Лечение" относится к реверсированию, облегчению, подавлению развития или предупреждению расстройства или состояния, к которым такой термин относится, или одного или более симптомов такого состояния или расстройства. При использовании в данном описании термин также охватывает, в зависимости от состояния пациента, предупреждение расстройства, включая предупреждение проявления расстройства или любого из симптомов, связанных с ним, а также снижение тяжести расстройства или любого из его симптомов перед их проявлением. "Лечение", при использовании здесь, также относится к предупреждению рецидива расстройства. Термин "лечение", при использовании здесь, также относится к акту лечения, где "лечение" определено непосредственно выше. Например "лечение шизофрении или шизофреноподобного или шизоаффективного расстройства",при использовании здесь, также охватывает лечение одного или более симптомов (позитивных, негативных и других ассоциированных признаков) указанных расстройств, например лечение бредовых состояний и/или галлюцинации, связанной с ними. Другие примеры симптомов шизофрении и шизофреноформного и шизоаффективного расстройств включают в себя дезорганизованную речь, эмоциональную тупость, алогию, ангедонию, неадекватную эмоциональную реакцию, дисфорическое настроение (в форме, например, депрессии, тревоги или гнева) и некоторые симптомы когнитивной дисфункции."Млекопитающее" относится к любому члену класса "Млекопитающие", включая людей, собак и кошек, но не ограничиваясь ими."Модулирование серотонинергической нейротрансмиссии" относится к усилению или улучшению либо к уменьшению или замедлению нейронального процесса, при котором серотонин высвобождается пресинаптической клеткой при возбуждении и пересекает синапс, чтобы стимулировать или ингибировать постсинаптическую клетку."Химическая зависимость" означает ненормальную тягу к лекарственному средству, или желание лекарственного средства, или аддикцию к нему. Такие лекарственные средства больные индивидуумы обычно принимают любым из множества путей, включая пероральный, парентеральный, назальный или ингаляционный. Примерами зависимостей от химических веществ, поддающихся лечению способами по настоящему изобретению, являются зависимости от алкоголя, никотина, кокаина, героина, фенобарбитала и бензодиазепинов (например, от Valium). "Лечение химической зависимости", при использовании здесь, означает снижение или облегчение такой зависимости и/или тяги вследствие этого.-7 009527 В данном изобретении предложен способ лечения одного или более расстройств ЦНС млекопитающего, включая человека, нуждающегося в таком лечении. Без ограничения, расстройствами ЦНС в этом смысле являются такие расстройства, при которых показан лиганд D2-, 5-HT1B- и 5-HT2Aрецепторов: индивидуально или в любой их комбинации. В одном аспекте способ включает введение терапевтически эффективного количества соединения, которое является ингибитором по отношению по меньшей мере к двум из следующих рецепторов: D2, 5-HT1B и 5-HT2A. В другом аспекте данного изобретения способ включает введение терапевтически эффективного количества D2/5-HT1 В/5-HT2Aингибитора. В еще одном аспекте способ включает введение терапевтически эффективного количестваD2/5-HT1B-ингибитора, имеющего соотношение ингибиторной активности D2:5-HT1B приблизительно 20 или менее, при этом предпочтительно указанное соотношение составляет приблизительно 10 или менее; приблизительно 5 или менее и наиболее предпочтительно приблизительно 1. Предпочтительно ингибитор, вводимый для лечения согласно способу по изобретению, имеет структуру формулы I. Расстройства ЦНС, являющиеся объектами изобретения, хорошо известны в данной области и включают в себя, без ограничения, такие расстройства, при которых показан лиганд, например антагонист, обратный агонист и/или частичный агонист и подобное D2-, 5HT-1B- и 5HT-2A-рецепторов, либо индивидуально, либо в любых их комбинациях. Таким образом, согласно данному изобретению предпочтительно можно лечить одно или более расстройство ЦНС одним соединением; например изобретение может лечить шизофрению, при которой обычно требуется ингибирование D2- и 5-HTA-рецепторов,и депрессию, при которой обычно требуется ингибирование 5-HTB-рецепторов. Соединение по изобретению также можно применять в комбинации с другими лекарственными средствами, например традиционно применяемыми для лечения любого из расстройств ЦНС, описанных в данном документе. Например, соединение по изобретению можно применять в комбинации с зипразидоном и аналогичными соединениями для лечения шизофрении или с ингибитором обратного захвата 5HT и аналогичными соединениями для лечения депрессии. В расстройства ЦНС, предполагаемые для лечения посредством настоящего изобретения, включены, без ограничения, следующие. Тревога или психотические расстройства, такие как шизофрения, например, параноидного, дезорганизованного, кататонического, недифференцированного или остаточного типа; шизофреноформное расстройство; шизоаффективное расстройство, например, бредового или депрессивного типа; бредовое расстройство; психотическое расстройство, вызванное употреблением веществ, например психоз, вызванный употреблением алкоголя, амфетамина, марихуаны, кокаина, галлюциногенов, средств, используемых для вдыхания, опиоидов или фенциклидина; расстройство личности параноидного типа; расстройство личности шизоидного типа. Примеры тревожных расстройств включают в себя паническое расстройство; агорафобию; специфическую фобию; социальную фобию; обсессивно-компульсивное расстройство; посттравматическое стрессовое расстройство; острое стрессовое расстройство; генерализованное тревожное расстройство,но не ограничиваются ими. Двигательные нарушения, в том числе болезнь Гентингтона и дискинезия, связанная с терапией агонистом дофамина; болезнь Паркинсона и синдром беспокойных ног. Зависимости от химических веществ, например аддикция к алкоголю, амфетаму, кокаину, опиату,никотину. Расстройства, включающие в качестве симптома когнитивный дефицит, например субнормальное функционирование в одном или более когнитивных аспектах, таких как память, интеллект, или способность к обучению, или логические способности у конкретного индивидуума по сравнению с другими индивидуумами в рамках той же общей возрастной популяции. Также любое ослабление любого функционирования у конкретного индивидуума в одном или более когнитивных аспектах, например, как это происходит в случае возрастного когнитивного снижения. Примерами расстройств, включающих в себя в качестве симптома когнитивный дефицит, который можно лечить в соответствии с настоящим изобретением, являются деменция, например, при болезни Альцгеймера, мультиинфарктная деменция, алкогольная деменция или другая деменция, связанная с употреблением веществ, деменция, ассоциированная с внутричерепными опухолями или церебральной травмой, деменция, ассоциированная с болезнью Гентингтона или болезнью Паркинсона, или СПИД-ассоциированная деменция; деменция, связанная с болезнью Альцгеймера;-8 009527 бред; амнестическое расстройство; посттравматическое стрессовое расстройство; умственная отсталость; расстройство учебных навыков, например расстройство чтения, расстройство математических навыков, послеоперационное когнитивное снижение или расстройство письменной речи; расстройство дефицита внимания/гиперактивности; возрастное когнитивное снижение. Расстройства настроения или аффективные эпизоды, такие как эпизод большой депрессии легкой, средней или тяжелой степени, маниакальный эпизод или эпизод смешанного характера, гипоманикальный эпизод; эпизод депрессии с нетипичными признаками; эпизод депрессии с признаками меланхолии; эпизод депрессии с кататоническими признаками; аффективный эпизод с послеродовым проявлением; депрессия после инсульта; большое депрессивное расстройство; дистимическое расстройство; малое депрессивное расстройство; устойчивая к лечению депрессия;SSRI-резистентная (резистентная к селективным ингибиторам обратного захвата серотонина) депрессия; предменструальное дисфорическое расстройство; постпсихотическое депрессивное расстройство при шизофрении; большое депрессивное расстройство, наложенное на психотическое расстройство, такое как бредовое расстройство или шизофрения; биполярное расстройство, например биполярное расстройство I типа, биполярное расстройствоII типа и циклотимическое расстройство. Другие расстройства ЦНС включают в себя резистентную к лечению депрессию,SSRI-недостаточности, аутизм и послеоперационное снижение. Другие расстройства, поддающиеся лечению посредством изобретения, и на которые можно воздействовать путем ингибирования любого или всех из D2-, 5-HT1B- и 5-HT2A-рецепторов, включают расстройства, выбранные из гипертензии, аутизма, депрессии (например, депрессии у пациентов, больных раком, пациентов с болезнью Паркинсона, депрессии после инфаркта миокарда, субсиндромальной симптоматической депрессии, депрессии у бесплодных женщин, детской депрессии, большой депрессии,единичного эпизода депрессии, рекуррентной депрессии, депрессии, вызванной жестоким обращением с ребенком, и послеродовой депрессии), генерализованного тревожного расстройства, фобий (например,агорафобии, социальной фобии и простых фобий), посттравматического стрессового синдрома, уклоняющегося расстройства личности, преждевременной эякуляции, расстройств приема пищи (например,нервной анорексии и нервной булимии), ожирения, зависимостей от химических веществ (например,аддикций к алкоголю, кокаину, героину, фенобарбиталу, никотину и бензодиазепинам), кластерной головной боли, мигрени, боли, болезни Альцгеймера, обсессивно-компульсивного расстройства, панического расстройства, расстройств памяти (например, деменции, амнестических расстройств и возрастного когнитивного снижения (ARCD, болезней Паркинсона (например, деменции при болезни Паркинсона,нейролептического паркинсонизма и поздних дискинезий), эндокринных расстройств (например, гиперпролактинемии), вазоспазма (в частности, в сосудистой сети головного мозга), мозжечковой атаксии,расстройств желудочно-кишечного тракта (включая изменения моторики и секреции), негативных симптомов шизофрении, шизоаффективного расстройства, обсессивно-компульсивного расстройства, мании,предменструального синдрома, фибромиалгического синдрома, стрессового недержания, синдромя де ля Туретта, трихотилломании, клептомании, мужской импотенции, рака (например, мелкоклеточного рака легкого) хронической пароксизмальной гемикрании и головной боли (ассоциированной с сосудистыми расстройствами). Настоящее изобретение также относится к способу лечения расстройства или состояния, которое можно лечить путем модулирования серотонинергической нейтротранс-миссии у млекопитающего,предпочтительно человека, при котором млекопитающему, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения по изобретению, в том числе предпочтительно соединения формулы I. Другие расстройства и состояния - объекты лечения посредством настоящего изобретения рассмотрены в заявке Bright WO 99/52907, которая включена в данное описание изобретения посредством ссылки. Настоящее изобретение также относится к фармацевтической композиции для лечения вышеупомянутых расстройств/состояний, содержащей, среди прочего, терапевтически эффективное количество со-9 009527 единения по изобретению, предпочтительно содержащей соединение, определенное формулой I, и фармацевтически приемлемый носитель. Примерами предпочтительных соединений формулы I являются соединения, имеющие абсолютную стереохимическую конфигурацию, определенную как (7R,9aS)-транс- или как (7S,9aS)-цис-. Примерами конкретных воплощений соединений формулы I являются соединения, описанные в примерах 1-110. В другом, более конкретном воплощении, изобретение относится к следующему соединению формулы I': в виде рацемата, или его (R)- и (S)-энантиомеров, или его цис- и транс-изомеров,где X представляет собой кислород или NR, R представляет собой водород или (C1-C6)алкил; каждый из R1 и R2 независимо является таким, как определено выше, и где R7 представляет собой водород или (C1-C3)алкокси;R9 представляет собой (C1-C3)алкил. Соединения формулы I' особенно полезны в синтезе соединений формулы I. Примерами конкретных соединений формулы I' являются следующие ниже соединения, и они относятся ко всем энантиомерам и стереоизомерам этих соединений:(7R,9aS)-транс-6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2 карбоновой кислоты метиловый эфир;(7S,9aS)-цис-6-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2 карбоновой кислоты метиловый эфир;(7R,9aS)-транс-5-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-илметокси)пиридин-2 карбоновой кислоты метиловый эфир;- 10009527 Следующие ниже схемы 1-5 иллюстрируют, без ограничения, типичные способы получения соединений формулы I. Следует принимать во внимание, что могут быть использованы и рассмотрены другие методики или варианты. Схема 1 На схеме 1 проиллюстрирован способ получения соединений формулы I, имеющих (7R,9aS)-трансили (7S,9aS)-цисстереохимию. Соединения с (7S,9aR)-стереохимией также могут быть получены способами, аналогичными указанному, или другим проиллюстрированными способами. Согласно схеме 1 известное соединение формулы II (например, Bright WO 99/52907) объединяют с соединением формулы III в условиях сочетания Мицунобу в присутствии трифенилфосфина и соединения формулыRO2CN=NCO2R, где R представляет собой метил или этил, с образованием соединения формулы IV(О. Mitsunobu, Synthesis, 1, 1981). Подходящие растворители для этой реакции включают тетрагидрофуран (THF), другие эфиры и углеводородные растворители, при этом THF является предпочтительным. Эту реакцию обычно проводят при температуре приблизительно от комнатной температуры до приблизительно 65C в течение приблизительно от 1 до приблизительно 24 ч. Реакцию предпочтительно проводят приблизительно при 50C в течение приблизительно от 4 до 18 ч. Восстановление соединения формулы IV приводит к соединению формулы V. Это восстановление можно осуществить, используя алюмогидрид лития или другие алюмогидриды в качестве восстанавливающего агента, в растворителе, выбранном из диэтилового эфира и других диалкиловых эфиров, предпочтительно в диэтиловом эфире, при температуре приблизительно от -5C до приблизительно комнатной температуры в течение приблизительно от 0,5 до приблизительно 18 ч. Затем соединение формулы V может быть превращено в соединение формулы VI путем его взаимодействия с метансульфонилхлоридом в присутствии основания - третичного амина, такого как триэтиламин (ТЕА), в метиленхлориде или другом углеводородном растворителе при температуре приблизительно от -5C до приблизительно комнатной температуры в течение периода времени приблизительно от 10 мин до приблизительно 2 ч. Взаимодействие образовавшегося соединения формулы VI с соединением формулы HNR3R4, где R3 4 и R вместе с атомом азота, к которому они присоединены, образуют кольцо, как изображено на схеме 1,приводит к соответствующему соединению, имеющему формулу VII. Обычно данную последнюю реакцию проводят в THF, N,N-диметилформамиде (DMF) или ацетонитриле, или в смеси двух или более упомянутых выше растворителей при температуре приблизительно от комнатной температуры до приблизительно 100C в течение периода времени приблизительно от 1 до приблизительно 18 ч. На схеме 2 показан способ получения соединений формулы I, имеющих (7R,9aS)-транс- или(7S,9aS)-цисстереохимию. Согласно схеме 2, соединение формулы II может быть превращено в соединение формулы VIII путем его взаимодействия с метансульфонилхлоридом в присутствии основания - тре- 13009527 тичного амина, такого как триэтиламин (TEA), в метиленхлориде или в другом углеводородном растворителе при температуре приблизительно от -5C до приблизительно комнатной температуры в течение периода времени приблизительно от 10 мин до приблизительно 2 ч. Соединение формулы VIII объединяют с соединением формулы III в условиях основного сочетания с образованием соединения формулыIX. Подходящие основания включают гидрид натрия, гидрид калия, алкиллитий, бистриметилсилиламиды натрия. Подходящие растворители для этой реакции включают тетрагидрофуран(THF), другие эфиры, диметилформамид и N-метилпирролидинон (NMP), при этом NMP является предпочтительным. Эту реакцию обычно проводят при температуре приблизительно от комнатной температуры до приблизительно 100C в течение приблизительно от 1 до приблизительно 24 ч. Предпочтительно реакцию проводят приблизительно от 70 до приблизительно 100C. Обычно реакция протекает в течение периода времени приблизительно от 1 до приблизительно 24 ч. Восстановление соединения формулы IX приводит к соединению формулы X. Это восстановление может быть осуществлено с использованием алюмогидрида лития в качестве восстанавливающего агента в растворителе, выбранном из диэтилового эфира и других диалкиловых эфиров, предпочтительно в диэтиловом эфире, при температуре приблизительно от -5C до приблизительно комнатной температуры в течение приблизительно от 0,5 до приблизительно 18 ч. Затем соединение формулы X может быть превращено в соединение формулы XI посредством его взаимодействия с метансульфонилхлоридом в присутствии основания - третичного амина, такого как триэтиламин (TEA), в метиленхлориде или другом углеводородном растворителе, при температуре приблизительно от -5C до приблизительно комнатной температуры в течение периода времени приблизительно от 10 мин до приблизительно 2 ч. Взаимодействие соединения формулы XI с соединением формулы HNR3R4, где R3 и R4 вместе с атомом азота, к которому они присоединены, образуют кольцо, как изображено на схеме 2, приводит к соответствующему соединению, имеющему формулу XII. Обычно эту реакцию проводят в THF,N,N-диметилформамиде (DMF) или ацетонитриле или в смеси двух или более упомянутых выше растворителей при температуре приблизительно от комнатной температуры до приблизительно 100C в течение периода времени приблизительно от 1 до приблизительно 18 ч. На схеме 3 показан способ получения соединений формулы I, имеющих (7R,9aS)-транс- или(7S,9aS)-цисстереохимию. Согласно схеме 3 соединение формулы II можно превратить в соединение формулы XV путем его взаимодействия с соединением формулы XIV с подходящим основанием, таким как трет-бутилат калия, в тетрагидрофуране, других эфирах или диметилформамиде или углеводородных растворителях. Подходящие основания включают гидрид натрия, гидрид калия, алкиллитий, бистриметилсилиламиды натрия. Эту реакцию обычно проводят при температуре приблизительно от комнатной температуры до приблизительно 80C в течение приблизительно от 1 до приблизительно 24 ч. Предпочтительно реакцию проводят приблизительно при 60C в течение приблизительно от 1 до 12 ч. Соединение формулы XIV может быть получено из соединения формулы XIII с использованием соединения формулы HNR3R4, где R3 и R4 вместе с атомом азота, к которому они присоединены, образуют кольцо, как изображено на схеме 3, и основания, такого как карбонат калия, в растворителе, таком как ацетонитрил. Подходящие растворители для этой реакции включают тетрагидрофуран (THF), другие эфиры, диметилформамид и углеводородные растворители, при этом ацетонитрил является предпочтительным. Подходящие основания включают гидрид натрия, карбонат калия, карбонат натрия, алкиллитий, бис-триметилсилиламиды натрия или лития, LDA (лития диизопропиламид). Данную реакцию обычно проводят при температуре приблизительно от комнатной температуры до приблизительно 80C в течение приблизительно от 1 до приблизительно 24 ч, предпочтительно приблизительно при 60C в течение приблизительно от 1 до 12 ч. На схеме 4 показан способ получения соединений формулы I, имеющих (7R,9aS)-транс- или(7S,9aS)-цисстереохимию. Согласно схеме 4 соединение формулы XVI можно превратить в соединение формулы XVII путем его взаимодействия с соединением формулы XIV с подходящим основанием, таким как трет-бутилат калия, в тетрагидрофуране, других эфирах или диметилформамиде, или углеводородных растворителях. Подходящие основания включают гидрид натрия, гидрид калия, алкиллитий, бистриметилсилиламиды натрия. Данную реакцию обычно проводят при температуре приблизительно от комнатной температуры до приблизительно 80C в течение приблизительно от 1 до приблизительно 24 ч,предпочтительно приблизительно при 60C в течение приблизительно от 1 до 12 ч. Соединение формулыXIV можно получить из соединения формулы XIII, используя соединение формулы HNR3R4, где R3 и R4 вместе с атомом азота, к которому они присоединены, образуют кольцо, как изображено на схеме 4, и основания, такого как карбонат калия, в растворителе, таком как ацетонитрил. Подходящие растворители для этой реакции включают тетрагидрофуран (THF), другие эфиры, диметилформамид и углеводородные растворители, при этом ацетонитрил является предпочтительным. Данную реакцию обычно проводят при температуре приблизительно от комнатной температуры до приблизительно 80C в течение приблизительно от 1 до приблизительно 24 ч, предпочтительно приблизительно при 60C в течение приблизительно от 1 до 12 ч.- 14009527 Затем можно удалить защиту с соединения формулы XVII с образованием соли присоединения соляной кислоты к соответствующему соединению формулы XVIII. Это может быть осуществлено с использованием безводной соляной кислоты (HCl) в диэтиловом эфире, другом диалкиловом эфире или углеводородном растворителе приблизительно при комнатной температуре. Данную реакцию также можно проводить без растворителя, используя трифторуксусную кислоту, в этом случае образуется соль присоединения двух молекул трифторуксусной кислоты. Обычно эта реакция протекает приблизительно от 2 ч до приблизительно 18 ч. Целевое соответствующее соединение формулы XX может быть образовано путем взаимодействия соединения формулы XVIII из упомянутой выше реакции с соответствующим соединением формулыXIX, где R1 и R2 являются такими, как определено выше для формулы I, и 1,8-диазабицикло[5.4.0]ундец 7-еном (DBU). Эту реакцию обычно проводят в пиридине при температуре приблизительно от 50 до приблизительно 110C в течение периода времени приблизительно от 1 до приблизительно 48 ч. Схема 5 представляет собой альтернативный способ получения соединений формулы I, имеющих такую же стереохимию в положениях 7 и 9 а, как и соединения формулы XX, и где аминометильная боковая цепь феноксигруппы может быть присоединена в любом положении (т.е. орто-, мета- или пара-) этой группы. Согласно схеме 5 дигидрохлорид соответствующего соединения формулы XVIII взаимодействует с син-, анти- или со смесью син- и антиизомеров соединения формулы(т.е. соответствующим образом замещенного бензогидроксиминоилхлорида) в присутствии основания,такого как DBU, с образованием соответствующего соединения формулы XXI. Подходящие растворители для этой реакции включают хлоруглеводороды, такие как хлороформ и метиленхлорид. Подходящие температуры реакции находятся в пределах приблизительно от -78 до приблизительно 50C. Данную реакцию предпочтительно проводят при температуре приблизительно от 20 до приблизительно 40C в течение периода времени приблизительно от 0,5 до приблизительно 24 ч. Полученное в результате соединение формулы XXI затем может быть превращено в целевой конечный продукт формулы XX путем взаимодействия его с сильным нуклеофильным органическим основанием (например, н-бутиллитием) или гидридом натрия. Данную реакцию обычно проводят в растворителе, таком как толуол, DMF или THF, при температуре приблизительно от комнатной температуры до приблизительно 110C в течение приблизительно от 1 до 48 ч. Предпочтительно растворитель представляет собой смесь толуола и THF и реакцию проводят при температуре приблизительно от 80 до приблизительно 100C. Если не оговорено иное, давление для каждой из реакций не является критичным. Обычно реакции проводят при давлении приблизительно от 1 до приблизительно 3 атм., предпочтительно приблизительно при давлении окружающей среды (приблизительно 1 атм.). Соединения формулы I, которые по своей природе являются основными, способны к образованию широкого множества разных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто желательно сначала выделить соединение формулы I из реакционной среды в виде фармацевтически неприемлемой соли и затем просто превратить последнюю соль обратно в соединение в форме свободного основания путем обработки щелочным реагентом, а потом превратить свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений по этому изобретению легко получают путем обработки основного соединения, по существу, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После аккуратного выпаривания растворителя получают целевую твердую соль. Кислоты, которые применяют для получения фармацевтически приемлемых солей присоединения кислоты к основным соединениям по данному изобретению, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислоты, например соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат и памоат, т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат). Соединение формулы I преимущественно можно применять в сочетании с одним или более терапевтическими агентами, например разными антидепрессантами, такими как трициклические антидепрессанты (например, амитриптилин, дотиепин, доксепин, тримипрамин, бутриптилин, кломипрамин, дезипрамин, имипрамин, иприндол, лофепрамин, нортриптилин или протриптилин), ингибиторами моноаминоксидазы (например, изокарбоксазидом, фенелзином или транилциклопрамином) или ингибиторами обратного захвата 5-HT(серотонина) (например, флувоксамином, сертралином, флуоксетином или паро- 15009527 ксетином), и/или с антипаркинсоническими агентами, такими как дофаминергические антипаркинсонические агенты (например, леводопа, предпочтительно в комбинации с ингибитором периферической декарбоксилазы, таким как бенсеразид или карбидопа, или с агонистом дофамина, например бромкриптином, лизуридом или перголидом). Также его можно применять с ацетохолинестеразами, такими как донепезил. Очевидно, что настоящее изобретение охватывает применение соединения формулы I или его физиологически приемлемой соли или сольвата в комбинации с одним или более другими терапевтическими агентами. Соединение формулы I и его фармацевтически приемлемые соли в комбинации с ингибитором обратного захвата 5-HT (например, флувоксамином, сертралином, флуоксетином или пароксетином), предпочтительно сертралином, или его фармацевтически приемлемой солью или полиморфом (в данном описании комбинация соединения формулы I с ингибитором обратного захвата 5-HT называется "активная комбинация") являются полезными психотерапевтическим средствами и их можно применять в лечении или профилактике расстройств, лечению или профилактике которых способствует модулирование серотонинергической нейтротрансмиссии, таких как гипертензия, депрессия (например, депрессия у пациентов, больных раком, пациентов с болезнью Паркинсона, депрессия после инфаркта миокарда, субсиндромальная симптоматическая депрессия, депрессия бесплодных женщин, детская депрессия, глубокая депрессия, один эпизод депрессии, реккурентная депрессия, депрессия, вызванная жестоким обращением с ребенком, и послеродовая депрессия), генерализованное тревожное расстройство, фобии (например,агорафобия, социальная фобия и простые фобии), посттравматический стрессовый синдром, избегающее расстройство личности, преждевременная эякуляция, расстройства приема пищи (например, нервная анорексия и нервная булимия), ожирение, зависимости от химических веществ (например, аддикции к алкоголю, кокаину, героину, фенобарбиталу, никотину и бензодиазепинам), кластерная головная боль,мигрень, боль, болезнь Альцгеймера, обсессивно-компульсивное расстройство, паническое расстройство,расстройства памяти (например, деменция, амнестические расстройства и связанное с возрастом когнитивное снижение (ARCD, болезни Паркинсона (например, деменция при болезни Паркинсона, паркинсонизм, индуцированный нейролептиками, и поздние дискинезии), эндокринные расстройства (например, гиперпролактинемия), вазоспазм (в частности в сосудистой сети головного мозга), мозжечковая атаксия, расстройства желудочно-кишечного тракта (включая изменения моторики и секреции), негативные симптомы шизофрении, предменструальный синдром, фибромиалгический сидром, стрессовое недержание, болезнь Туретта, трихотилломания, клептомания, мужская импотенция, рак (например, мелкоклеточная карцинома легкого), хроническая пароксизмальная гемикрания и головная боль (связанная с сосудистыми расстройствами). Ингибиторы обратного захвата серотонина (5-HT), предпочтительно сертралин, проявляют положительную активность в отношении депрессии; зависимостей от химических веществ; тревожных расстройств, включая паническое расстройство, генерализованное тревожное расстройство, агорафобию,простые фобии, социальную фобию и посттравматическое стрессовое расстройство; обсессивнокомпульсивного расстройства; избегающего расстройства личности и преждевременной эякуляции у млекопитающих, включая человека, в частности вследствие их способности блокировать синаптосомальный захват серотонина. Сертралин, (1S-цис-)-4-(3,4-дихлорфенил)-1,2,3,4-тетрагидро-N-метил-1-нафталинамин, имеет химическую формулу C17H17NC12; его синтез описан в патенте США 4536518, включенном в данное описание изобретения посредством ссылки. Гидрохлорид сертралина полезен в качестве антидепрессанта и анорексического агента и также полезен в лечении депрессии, зависимостей от химических веществ, тревожных обсессивно-компульсивных расстройств, фобий, панического расстройства, посттравматического стрессового расстройства и преждевременной эякуляции. Активность активной комбинации в качестве антидепрессантов и связанные с этим фармакологические свойств могут быть определены способами (1)-(4), указанными ниже, которые описаны в Koe, B. etal., Journal of Pharmacology and Experimental Therapeutics, 226 (3), 686-700 (1983). Более конкретно активность может быть определена путем изучения (1) их способности влиять на попытки мышей спастись из плавательного резервуара (тест Порсолта "поведенческое отчаяние" на мышах), (2) их способности усиливать индуцированные 5-гидрокситриптофаном симптомы поведения мышей in vivo, (3) их способности антагонизировать серотонин-истощающую активность гидрохлорида пара-хлорамфетамина в головном мозге крыс in vivo и (4) их способности блокировать захват серотонина, норэпинефрина и дофамина синаптосомальными клетками головного мозга крыс in vitro. Способность активной комбинации препятствовать резерпиновой гипотермии у мышей in vivo можно определить способами, описанными в патенте США 4029731. Соединение по изобретению можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями в однократной дозе либо в многократных дозах. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции, образованные таким образом,затем можно легко вводить во множество лекарственных форм, таких как таблетки, порошки, пастилки,жидкие препараты, сиропы, растворы для инъекции и т.п. Такие фармацевтические композиции, возмож- 16009527 но, могут содержать дополнительные ингредиенты, такие как корригенты, связующие агенты, эксципиенты и т.п. Таким образом, соединение по изобретению может быть приготовлено для перорального, защечного, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного), трансдермального (например, пластырь) или ректального введения или в форме, подходящей для введения путем ингаляции или инсуффляции. Для перорального введения фармацевтические композиции могут принимать форму, например,таблеток или капсул, изготовленных традиционными способами с фармацевтически приемлемыми эксципиентами, такими как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или натрия крахмала гликолят) или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой способами, хорошо известными в технике. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий или они могут быть представлены в виде сухого продукта для разведения водой или другим подходящим носителем перед применением. Такие жидкие препараты могут быть получены традиционными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитный сироп, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или гуммиарабик); неводные носители (например, миндальное масло, сложные жирные эфиры или этиловый спирт); консерванты (например, метил- или пропил-пара-гидроксибензоаты или сорбиновая кислота). Для защечного введения композиция может принимать форму таблеток или пастилок, приготовленных традиционным способом. Соединение по изобретению может быть приготовлено для парентерального введения путем инъекции, в том числе с применением традиционных методов катетеризации или инфузии. Препараты для инъекции могут быть представлены в виде стандартной лекарственной формы, например в ампулах или в мультидозовых контейнерах, с добавленным консервантом. Они могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных растворителях, и могут содержать препаратообразующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для разведения подходящим носителем,например стерильной и апирогенной водой, перед применением. В дополнительном аспекте данного изобретения предлагаются композиции вещества, пригодные для введения пациенту-человеку в виде раствора (например, инъекционно или интраназально), содержащие комплекс включения соли соединений по изобретению в таком веществе, как циклодекстрин. Преимущественно в предпочтительном воплощении указанный комплекс включения обеспечивает количество соединения по меньшей мере 2,5 мгА/мл (1 мг активного вещества в виде основания на 1 мл), когда количество соединения, обеспечиваемое указанным комплексом, измеряют при концентрации циклодекстрина в воде 40% (мас./об.). Комплекс включения соединения в циклодекстрин сначала может быть выделен путем сушки, обычно посредством лиофилизации. Выделенный сухой комплекс включения можно хранить при комнатной температуре в течение периода времени до двух лет и более и восстанавливать до раствора продукта по мере необходимости. Когда требуется раствор продукта, его можно приготовить путем растворения выделенного комплекса включения в воде (или другой водной среде) в количестве,достаточном для получения раствора требуемой силы для перорального или парентерального введения пациентам. Если выбранным путем введения является парентеральное введение, то предпочтительной является внутримышечная инъекция. Соединения могут быть приготовлены для быстро диспергируемых лекарственных форм (fddf), которые предназначены для высвобождения активного ингредиента в полости рта. Часто их готовят с использованием матриц на основе быстрорастворимого желатина. Эти лекарственные формы хорошо известны и их могут применять для доставки широкого круга лекарственных средств. В наиболее быстро диспергируемых лекарственных формах дозы в качестве носителя или структурирующего агента используется желатин. Обычно желатин используют для достижения достаточной прочности лекарственной формы для предохранения от разрушения во время извлечения из упаковки, но будучи помещенным в рот, желатин делает возможным немедленное растворение лекарственной формы. Альтернативно, для достижения такого же эффекта используют различные крахмалы. Соединение по изобретению также может входить в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащих традиционные суппозиторные основы,такие как какао-масло или другие глицериды. Для интраназального введения или введения путем ингаляции соединение по изобретению удобно поставлять в форме раствора или суспензии из накачиваемого аэрозольного контейнера, который пациент сжимает или накачивает, или в виде аэрозоля из находящегося под давлением контейнера или распы- 17009527 лителя, с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля, находящегося под давлением, единицу дозы можно установить, обеспечив клапан для высвобождения отмеренного количества. Находящийся под давлением контейнер или распылитель может содержать раствор или суспензию активного соединения. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть изготовлены так, чтобы содержать порошковую смесь соединения по изобретению и подходящую порошковую основу, такую как лактоза или крахмал.(Другие фармацевтические препараты, которые необходимо добавить, представляют собой IM и быстрорастворимые FDDF.) Предлагаемая доза активных соединений по изобретению для перорального, парентерального, ректального или защечного введения среднему взрослому человеку для лечения состояний, указанных выше(например, депрессии), составляет приблизительно от 0,1 до приблизительно 200 мг активного ингредиента на единицу дозы, которую можно было бы вводить, например, от 1 до 4 раз в сутки. Аэрозольные препараты для лечения указанных выше состояний (например, мигрени) среднего взрослого человека предпочтительно приспособлены таким образом, что каждая отмеренная доза или"пуф" аэрозоля, содержит приблизительно от 20 до приблизительно 1000 мг соединения по изобретению. Среднесуточная доза с аэрозолем будет находиться в пределах приблизительно от 100 до приблизительно 10 мг. Введение можно осуществлять несколько раз в сутки, например 2, 3, 4 или 8 раз, давая каждый раз, например 1, 2 или 3 дозы. В связи с применением соединения по изобретению вместе с ингибитором обратного захвата 5-HT,предпочтительно сертралином, для лечения пациентов с любым из упомянутых выше состояний, необходимо отметить, что их можно вводить или отдельно или в комбинации с фармацевтически приемлемыми носителями любым из указанных ранее путей и что такое введение можно осуществлять как в однократной, так и в многократных дозах. Более конкретно, активную комбинацию можно вводить в большом множестве разных лекарственных форм, т.е. их можно объединять с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, пастилок, лепешек, твердых леденцов,порошков, аэрозолей, водной суспензии, растворов для инъекций, эликсиров, сиропов и т.п. Такие носители включают твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и т.д. Кроме того, такие пероральные фармацевтические препараты можно подсластить и/или ароматизировать подходящим образом при помощи различных агентов, обычно используемых для таких целей. В общем случае соединения формулы I присутствуют в таких лекарственных формах в концентрациях в интервале приблизительно от 0,5 до приблизительно 90 мас.% от общей композиции, т.е. в количествах, которые достаточны для обеспечения требуемой единицы дозы, а ингибитор обратного захвата 5-HT, предпочтительно сертралин, присутствует в таких лекарственных формах в концентрациях в интервале приблизительно от 0,5 до приблизительно 90 мас.% от общей композиции, т.е. в количествах, которые достаточны для обеспечения требуемой единицы дозы. Предлагаемая суточная доза соединения по изобретению в комбинированном препарате (препарате,содержащем соединение по изобретению и ингибитор обратного захвата 5-HT) для перорального, парентерального, ректального или защечного введения среднему взрослому человеку для лечения указанных выше состояний составляет приблизительно от 0,01 до приблизительно 2000 мг, предпочтительно приблизительно от 0,1 до приблизительно 200 мг активного ингредиента формулы I на единицу дозы, которую можно вводить, например, от 1 до 4 раз в сутки. Предлагаемая суточная доза ингибитора обратного захвата 5-HT, предпочтительно сертралина, в комбинированном препарате для перорального, парентерального или защечного введения среднему взрослому человеку для лечения указанных выше состояний составляет приблизительно от 0,1 до приблизительно 2000 мг, предпочтительно приблизительно от 1 до приблизительно 200 мг ингибитора обратного захвата 5-HT на единицу дозы, которую можно вводить, например, от 1 до 4 раз в сутки. Предпочтительное отношение доз сертралина к дозе активного соединения по данному изобретению в комбинированном препарате для перорального, парентерального или защечного введения среднему взрослому человеку для лечения указанных выше состояний составляет приблизительно от 0,00005 до приблизительно 20000; предпочтительно приблизительно от 0,25 до приблизительно 2000. Аэрозольные комбинированные препараты для лечения указанных выше состояний среднего взрослого человека предпочтительно приспособлены таким образом, что каждая отмеренная доза или "пуф" аэрозоля содержит приблизительно от 0,01 до приблизительно 100 мг активного соединения по данному изобретению, предпочтительно приблизительно от 1 до приблизительно 10 мг такого соединения. Введение можно осуществлять несколько раз в сутки, например 2, 3, 4 или 8 раз, давая каждый раз, например,1, 2 или 3 дозы. Аэрозольные фармацевтические препараты для лечения указанных выше состояний среднего взрослого человека предпочтительно приспособлены таким образом, что каждая контролируемая доза или "пуф" аэрозоля содержит приблизительно от 0,01 до приблизительно 2000 мг ингибитора обратного захвата 5-HT, предпочтительно сертралина, предпочтительно приблизительно от 1 до приблизи- 18009527 тельно 200 мг сертралина. Введение можно осуществлять несколько раз в сутки, например 2, 3, 4 или 8 раз, давая каждый раз, например, 1, 2 или 3 дозы. Как указано ранее, ингибитор обратного захвата 5-HT, предпочтительно сертралин, в комбинации с соединениями формулы I легко адаптировать для терапевтического применения в качестве антидепрессантов. В общем случае эти антидепрессантные композиции, содержащие ингибитор обратного захвата 5-HT, предпочтительно сертралин, и соединение формулы I, обычно вводят в дозах в интервале приблизительно от 0,01 до приблизительно 100 мг на 1 кг массы тела в сутки ингибитора обратного захвата 5HT, предпочтительно сертралина, предпочтительно приблизительно от 0,1 до приблизительно 10 мг массы тела в сутки сертралина; приблизительно от 0,001 до приблизительно 100 мг на 1 кг массы тела в сутки соединения формулы I, предпочтительно приблизительно от 0,01 до приблизительно 10 мг массы тела в сутки соединения формулы I; хотя, в зависимости от состояний пациента, которого лечат и конкретного выбранного пути введения, обязательно будут иметь место изменения. Следующие примеры иллюстрируют получение различных соединений по настоящему изобретению. Температуры плавления не корректировали. Данные ЯМР анализа выражены в миллионных долях и отнесены к фиксированному сигналу дейтерия из эталонного растворителя (дейтериохлороформа, если не оговорено иное). Удельное вращение измеряли при комнатной температуре, используя D-линию натрия (589 нм). Имеющиеся в продаже реагенты использовали без дополнительной очистки. THF относится к тетрагидрофурану. DMF относится к N,N-диметилформамиду. Хроматография относится к колоночной хроматографии, выполняемой с использованием силикагеля (47-61 меш) и осуществляемой под давлением азота (флэш-хроматография). Комнатная или температура окружающей среды относится к 20-25 С. Все неводные реакции для удобства и для обеспечения максимальных выходов проводили в атмосфере азота. Концентрирование при пониженном давлении означает, что применяли роторный испаритель. Примеры являются только иллюстративными; их не следует истолковывать как ограничивающие объем, сущность и варианты данного изобретения. Пример 1. (7R,9aS)-транс-Циклогексил-6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2 а]пиразин-7-илметокси]пиридин-2-илметиламин. Стадия 1.(16 мл) и затем нагревали (110C) при перемешивании в течение 18 ч. Добавляли 10% водный бикарбонат натрия и метиленхлорид (по 250 мл каждого) и смесь интенсивно перемешивали. Затем водную фазу реэкстрагировали тремя 100 мл порциями свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом до получения аморфного твердого вещества (4,88 г). В результате флэш-хроматографии всего образца (силикагель, 47-61 мкм меш; элюирование смесью метанол/метиленхлорид = 6,94 по объему) получали указанное в заголовке соединению (3,46 г, выход 43%) в виде аморфного твердого вещества. МС (масс-спектр) m/z 306 (М+1). Стадия 2. (7R,9aS)-транс-6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7 илметокси]пиридин-2-карбоновой кислоты метиловый эфир. Раствор соединения, указанного в заголовке предыдущей стадии (3,05 г, 10,0 ммоль), 6-метил-2 гидроксипиколинат (1,91 г, 12,5 ммоль), диэтилазодикарбоксилат (1,1 мл, 12,0 ммоль) и трифенилфосфин(3,14 г, 12,0 ммоль) объединяли в тетрагидрофуране (35 мл). Раствор нагревали (50C) и перемешивали в течение 18 ч. Добавляли 10% водный бикарбонат натрия и метиленхлорид (по 100 мл каждого) и смесь интенсивно перемешивали. Затем водную фазу реэкстрагировали тремя порциями по 50 мл свежего метиленхлорида. Объединенные органические экстракты по очереди последовательно экстрагировали 1 н. водным гидроксидом натрия и 10% водным бикарбонатом натрия. Отделенную органическую фазу сушили (безводным сульфатом натрия) и под вакуумом удаляли растворитель, получая липкое твердое вещество. В результате флэш-хроматографии образца получали указанное в заголовке соединение(2,14 г, выход 48%) в виде белого твердого вещества. Анализ 1 Н ЯМР (400 МГц, CDCl3) 1,18-1,78 (m, 3H), 1,90-2,15 (m, 4H), 2,41-2,58 (m, 1H), 2,81-2,95(m, 2H), 3,01-3,08 (m, 1H), 3,20-3,40 (m, 1H), 3,74-3,88 (m, 2H), 3,93 (s, 3H), 4,17 (dd, 1H, J=10,8 и 7,1 Гц),4,28 (dd, 1H, J=10,8 и 5,4 Гц), 6,87-6,92 (m, 1H), 7,18-7,21 (m, 1H), 7,29 (dd, 1H, J=9,3 и 2,5 Гц), 7,36 (dd,1 Н, J=9,1 и 3,8 Гц), 7,63-7,69 (m, 2 Н); МС m/z 441,3 (М+Н). Стадия 3. (7R,9aS)-транс-6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7 илметокси]пиридин-2-илметанол. К хорошо перемешанному, охлажденному на ледяной бане раствору частично растворенного соединения, указанного в заголовке предыдущей стадии (440 мг, 1,0 ммоль), в тетрагидрофуране (10 мл) по каплям добавляли 1,0 М раствор алюмогидрида лития в тетрагидрофуране (1,2 мл, 1,20 ммоль). Затем реакционную смесь интенсивно перемешивали при 0C в течение 1 ч, после чего гасили осторожным добавлением по каплям 1 мл 1 н. водного раствора гидроксида натрия. После перемешивания при темпе- 19009527 ратуре окружающей среды в течение 30 мин смесь сушили безводным сульфатом натрия и затем фильтровали через целит. Растворитель удаляли под вакуумом с получением масла. В результате флэшхроматографии образца получали указанное в заголовке соединение в виде белого твердого вещества(m, 2 Н), 4,63 (s, 2 Н), 6,59 (d, 1H, J=8,2 Гц), 6,76 (d, 1 Н, J=7,5 Гц), 7,19-7,39 (m, 3H), 7,53 (t, 1H, J=7,4 Гц); МС m/z 413,3 (М+Н). Стадия 4. (7R,9aS)-Трансметансульфоновой кислоты 6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметиловый эфир. К хорошо перемешанной смеси соединения, указанного в заголовке предыдущей стадии (162 мг,0,39 ммоль, частичного растворенного), и триэтиламина (0,11 мл, 0,79 ммоль) в метиленхлориде (10 мл) при температуре окружающей среды добавляли метансульфонилхлорид (34 мкл, 0,43 ммоль). Реакционную смесь перемешивали в течение 12 ч, затем гасили 10% водным бикарбонатом натрия. Реакционную смесь экстрагировали тремя порциями по 10 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом. Масло очищали флэш-хроматографией с получением указанного в заголовке соединения в виде белого твердого вещества(58 мг, 30%). Продукт использовали на следующей стадии без дополнительной очистки. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 5,16 (s, 2H); МС m/z 491,4 (M+H). Стадия 5. Общая методика: реакционную смесь, состоящую из мезилата соединения, указанного в заголовке предыдущей стадии (0,035 ммоль, 17,2 мг), и соответствующего амина (0,15 ммоль) в ацетонитриле(1 мл) перемешивали во флаконе на 2 драхмы (23,888 г=7,776 г) при 90C в течение 12 ч. После охлаждения в каждый флакон добавляли 0,75 мл гидроксида натрия и 2,2 мл этилацетата. После перемешивания органический слой отделяли и пропускали через Na2SO4 (6 мл SPE колонка (колонка для твердофазной экстракции), 2 г). Процесс экстракции повторяли еще два раза с метиленхлоридом. Растворитель удаляли и остаток растворяли в 1 мл DMSO (диметилсульфоксид) и фильтровали через 0,45 MM NylonAcrodisc в 1232 мм флаконы для ВЭЖХ-очистки. К амину (0,15 ммоль) во флаконах на 2 драхмы(7,776 г) добавляли мезилат и 0,9 мл ацетонитрила. Реакционную смесь встряхивали и нагревали при 80C в течение 12 ч в герметичном флаконе.(7R,9aS)-Трансциклогексил-6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7 илметокси]пиридин-2-илметиламин. Указанный в заголовке мезилат, полученный выше, (7R,9aS)-трансметансульфоновой кислоты 6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметиловый эфир и циклогексиламин объединяли в соответствии со стадией 5, описанной выше. Очистка с использованием препаративной ВЭЖХ-колонки обеспечила получение указанного в заголовке соединения:Waters Symmetry (C18, 5 мкМ, 30150 мм, поток 20 мл/мин, 0,1% TFA (трифторуксусная кислота)/CH3CN), RT=6,66 мин. МС m/z 493,6. В примерах 2-18 указанные в заголовках соединения получали, используя общую методику, описанную в примере 1, стадия 5, с очисткой на препаративной ВЭЖХ-колонке и на Waters Symmetry (C18,5 мкМ, 30150 мм, поток 20 мл/мин, 0,1% TFA/CH3CN). Для каждого примера указано исходное вещество. Пример 2. (7R,9aS)-транс-2-(Этил-6-[2-(5-фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин-7-илметокси]пиридин-2-илметиламино)этанол. Исходное вещество: 2-этиламиноспирт. RT(время удерживания)=7,60 мин. МС m/z 483,6. Пример 3. (7R,9aS)-транс-7-[6-(2,6-Диметилпиперидин-1-илметил)пиридин-2-илоксиметил]-2-(5 фторбензо[d]изоксазол-3-ил)октагидропиридо[1,2-а]пиразин. Исходное вещество: 2,6-диметилпиперидин. RT=7,76 мин. МС m/z 507,7. Пример 4.(12,9 мл, 85 ммоль) и 3-хлорбензо[d]изоксазол (5,54 г, 32,3 ммоль) растворяли в пиридине (16 мл) и затем нагревали (110C) при перемешивании в течение 18 ч. Добавляли 10% водный бикарбонат натрия и метиленхлорид (по 250 мл каждого) и смесь интенсивно перемешивали. Затем водную фазу реэкстрагировали тремя порциями по 100 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом до аморфного твердого вещества(4,88 г). В результате флэш-хроматографии всего образца (силикагель, 47-61 мкм меш; элюирование смесью метанол/метиленхлорид = 6,94 по объему) получали указанное в заголовке соединение (3,46 г, выход 43%) в виде аморфного твердого вещества.(7R,9aS)-транс-5-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-2-карбоновой кислоты метиловый эфир. К хорошо перемешанной смеси соединения, указанного в заголовке предыдущей стадии (1,49 г,5,0 ммоль, частичного растворенного), и триэтиламина (1,4 мл, 10,0 ммоль) в метиленхлориде (40 мл) при температуре окружающей среды добавляли метансульфонилхлорид (0,86 мл, 5,5 ммоль). Реакционную смесь перемешивали в течение 12 ч и гасили 10% водным бикарбонатом натрия. Реакционную смесь экстрагировали тремя порциями по 10 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом. Масло очищали флэшхроматографией с получением соответствующего мезилата. Продукт использовали на следующей стадии без дополнительной очистки. К 5-метил-2-гидроксиникотинату (0,92 г, 17 ммоль) в тетрагидрофуране (50 мл) добавляли 0,18 г(6,0 ммоль) гидрида натрия (60% в минеральном масле). Реакционную смесь нагревали до 100C в течение 1 ч. Мезилат, приготовленный выше, растворяли в 10 мл тетрагидрофурана и добавляли к реакционной смеси. Раствор нагревали (100C) и перемешивали в течение 18 ч. Реакционную смесь концентрировали и фильтровали с этиловым эфиром. Отделенную органическую фазу сушили (безводным сульфатом натрия) и под вакуумом удаляли растворитель. В результате флэш-хроматографии образца получали указанное в заголовке соединение (440 мг, выход 21%) в виде не совсем белого твердого вещества. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,17-1,25 (m, 1H), 1,29-1,39 (m, 1H), 1,75-1,80 (m, 1H), 1,85-1,98(7R,9aS)-транс-[5-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7 илметокси)пиридин-2-ил]метанол. К хорошо перемешанному, охлажденному на ледяной бане раствору частично растворенного соединения, указанного в заголовке предыдущей стадии (991 мг, 2,35 ммоль) в тетрагидрофуране(30 мл) по каплям при 0C добавляли 1,0 М раствор алюмогидрида лития в тетрагидрофуране (4,7 мл,4,70 ммоль). Затем реакционную смесь интенсивно перемешивали в течение 1 ч, после чего гасили осторожным добавлением по каплям (при 0C) 1 мл 1 н. водного раствора гидроксида натрия. После перемешивания при температуре окружающей среды в течение 30 мин смесь сушили безводным сульфатом натрия и затем фильтровали через целит. После удаления растворителя под вакуумом и последующей флэш-хроматографии образца получали указанное в заголовке соединение в виде белого твердого вещества (447 мг; выход 48%). Анализ: 1 Н ЯМР (400 МГц, CDCl3) 3,87 (d, 1H, J=12,9 Гц), 3,96 (d, 1H, J=12,4 Гц), 4,06 (dd, 1H,J=10,8 и 5,4 Гц), 4,59 (d, 2H, J=5,4 Гц), 6,70 (d, 1H, J=8,8 Гц), 7,17-7,21 (m, 1 Н), 7,42-7,49 (m, 2 Н), 7,59 (dd,1H, J=8,7 и 2,5 Гц), 7,65 (d, 1H, J=7,9 Гц), 8,06 (d, 1 Н, J=2,5 Гц); МС m/z 395,2 (М+Н). Стадия 4. (7R,9aS)-Трансметансульфоновой кислоты 5-(2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7-илметокси)пиридин-2-илметиловый эфир. К хорошо перемешанной смеси соединения, указанного в заголовке предыдущей стадии (148 мг,0,38 ммоль, частичного растворенного), и триэтиламина (0,1 мл, 0,75 ммоль) в метиленхлориде (5 мл) при температуре окружающей среды добавляли метансульфонилхлорид (40 мкл, 0,05 ммоль). Затем реакционную смесь перемешивали в течение 1 ч, после чего гасили 10% водным бикарбонатом натрия(с добавлением 20 мл метиленхлорида). Реакционную смесь экстрагировали тремя порциями по 10 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом с получением указанного в заголовке соединения в виде вязкого масла. Продукт использовали на следующей стадии без дополнительной очистки. Стадия 5. Общая методика описана ниже. Реакционную смесь,состоящую из(1 мл), перемешивали во флаконе на 2 драхмы (7,776 г) при 90C в течение 12 ч. После охлаждения растворитель удаляли и остаток растворяли в 1,8 мл DMSO и фильтровали через 0,45 MM Nylon Acrodisc в 1232 мм флаконы для ВЭЖХ-очистки. В примерах 20-39 указанные в заголовках соединения получали, используя общую методику, описанную в примере 19, стадия 5, с очисткой на препаративной ВЭЖХ-колонке и на Waters Symmetry (C18,5 мкМ, 30150 мм, поток 20 мл/мин, 0,1% TFA/CH3CN). Для каждого примера указано исходное вещество.(12,9 мл, 85 ммоль) и 3-хлорбензо[d]изоксазол (5,54 г, 32,3 ммоль) растворяли в пиридине (16 мл) и затем нагревали (110C) при перемешивании в течение 18 ч. Добавляли 10% водный бикарбонат натрия и метиленхлорид (по 250 мл каждого) и смесь интенсивно перемешивали. Затем водную фазу реэкстрагировали тремя порциями по 100 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом до аморфного твердого вещества(4,88 г). В результате флэш-хроматографии всего образца (силикагель, 47-61 мкм меш; элюирование смесью метанол/метиленхлорид = 6,94 по объему) получали указанное в заголовке соединение (3,46 г, выход 43%) в виде аморфного твердого вещества. МС m/z 306 (М+1). Стадия 2.(7R,9aS)-транс-6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-2-карбоновой кислоты метиловый эфир. Раствор соединения, указанного в заголовке предыдущей стадии (4,07 г, 14,18 ммоль), 6-метил-2 гидроксипиколинат (3,25 г, 21,3 ммоль), диэтилазодикарбоксилат (2,7 мл, 17,0 ммоль) и трифенилфосфин(4,46 г, 17,0 ммоль) объединяли в тетрагидрофуране (50 мл). Раствор нагревали (50C) и перемешивали в течение 18 ч. Добавляли 10% водный бикарбонат натрия и метиленхлорид (по 100 мл каждого), и смесь интенсивно перемешивали. Затем водную фазу реэкстрагировали тремя порциями по 50 мл свежего метиленхлорида. Объединенные органические экстракты по очереди последовательно экстрагировали 1 н. водным гидроксидом натрия и 10% водным бикарбонатом натрия. Отделенную органическую фазу сушили (безводным сульфатом натрия) и под вакуумом удаляли растворитель. В результате флэшхроматографии образца получали указанное в заголовке соединение (3,39 г, выход 56%) в виде белого твердого вещества. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,21-1,29 (m, 1H), 1,40-1,79 (m, 2H), 1,95-1,99 (m, 1H), 2,01-2,09(7R,9aS)-транс-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7 илметокси)пиридин-2-ил]метанол. К хорошо перемешанному, охлажденному на ледяной бане раствору частично растворенного соединения, указанного в заголовке предыдущей стадии (2,76 г, 6,54 ммоль) в тетрагидрофуране (30 мл), по каплям добавляли 1,0 М раствор алюмогидрида лития в тетрагидрофуране (7,0 мл, 7,0 ммоль). Реакционную смесь перемешивали при 0C в течение 1 ч, затем гасили осторожным добавлением по каплям (при 0C) 1 мл 1 н. водного раствора гидроксида натрия. После перемешивания при температуре окружающей среды в течение 30 мин смесь сушили безводным сульфатом натрия и затем фильтровали через целит. В результате удаления растворителя под вакуумом получали масло. В результате флэш-хроматографии образца получали указанное в заголовке соединение в виде белого твердого вещества (2,05 г; выход 50%).(7R,9aS)-Трансметансульфоновой кислоты 6-(2-бензо[d]изоксазол-3 илоктагидропиридо[1,2-a]пиразин-7-илметокси)пиридин-2-илметиловый эфир. К хорошо перемешанной смеси соединения, указанного в заголовке предыдущей стадии (2,05 г,5,2 ммоль, частичного растворенного), и триэтиламина (1,09 мл, 7,90 ммоль) в метиленхлориде (20 мл) при температуре окружающей среды добавляли метансульфонилхлорид (0,45 мл, 5,7 ммоль). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре и затем гасили 10% водным бикарбонатом натрия (с добавлением 20 мл метиленхлорида). Реакционную смесь экстрагировали тремя порциями по 10 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом с получением указанного в заголовке соединения в виде вязкого масла (2,21 г, 90%). Продукт использовали на следующей стадии без дополнительной очистки. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 5,15 м.д. (миллионных долей). Стадия 5. Общая методика. Реакционную смесь, состоящую из мезилата соединения, указанного в заголовке предыдущей стадии (0,03 ммоль, 14,2 мг) и соответствующего амина (0,12 ммоль) в ацетонитриле (1 мл) перемешивали во флаконе на 2 драхмы (7,776 г) при 90C в течение 12 ч. После охлаждения удаляли растворитель и остаток растворяли в 1,8 мл DMSO и фильтровали через 0,45 MM Nylon Acrodisc в 1232 мм флаконы для ВЭЖХ-очистки. В примерах 41-52 указанные в заголовках соединения получали, используя общую методику,описанную в примере 40, стадия 5, с Waters Symmetry (C18, 5 мкМ, 30150 мм, поток 20 мл/мин,0,1% TFA/CH3CN). Для каждого примера указано исходное вещество. Пример 41.(7R,9aS)-транс-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-2-илметил]тиазол-2-иламин. Исходное вещество: 2-аминотиазол и мезилат со стадии 4. RT=8,50 мин. МС m/z 476,2. Пример 42.(12,9 мл, 85 ммоль) и 3-хлорбензо[d]изоксазол (5,54 г, 32,3 ммоль) растворяли в пиридине (16 мл) и затем нагревали (110C) при перемешивании в течение 18 ч. Добавляли 10% водный бикарбонат натрия и метиленхлорид (по 250 мл каждого) и смесь интенсивно перемешивали. Затем водную фазу реэкстрагировали тремя порциями по 100 мл свежего метиленхлорида. Объединенные органические экстракты сушили (безводным сульфатом натрия) и концентрировали под вакуумом до аморфного твердого вещества(4,88 г). В результате флэш-хроматографии всего образца (силикагель, 47-61 мкм меш; элюирование смесью метанол/метиленхлорид = 6,94 по объему) получали (7R,9aS)-транс-[2-бензо[d]изоксазол-3 илоктагидропиридо[1,2-а]пиразин-7-ил]метанол (3,46 г, выход 43%) в виде аморфного твердого вещества. МС m/z 306 (М+1). К раствору 2-хлор-5-(хлорметил)пиридина (0,28 г, 1,7 ммоль) в 3 мл сухого ацетонитрила добавляют 0,36 мл (3,46 ммоль) диэтиламина, затем 240 мг (1,73 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, экстрагируют три раза метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получали масло, которое очищали хроматографией на силикагеле с получением 290 мг (выход 85%) 1-(6-хлор-пиридин-3-илметил)диэтиламина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,01-1,15 (m, 6H), 2,35-2,50 (m, 4H), 3,45-3,65 (m, 2H), 7,30 (d,1H, J=8,3 Гц), 8,31 (d, 1H, J=2,1 Гц); МС 199,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (336 мг,1,17 ммоль) добавляют 6 мл тетрагидрофурана, затем 1,46 мл 1,0 М раствора трет-бутилата, калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют 1-(6-хлор-пиридин-3 илметил)диэтиламин (290 мг, 1,46 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 2 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (98 мг, выход 22%). Анализ: C13 ЯМР (100 МГц, CDCl3) 11,8, 27,2, 29,2, 36,3, 46,6, 48,5, 53,9, 54,2, 54,4, 59,0, 60,4, 68,9,110,7, 110,9, 116,4, 122,4, 122,5, 127,7, 129,7, 140,0, 146,9, 161,3, 163,3, 164,2; МС m/z 405,4 (М+1). Пример 54.(7R,9aS)-транс-1-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-3-илметил]пирролидин-3-ол. К раствору 2-хлор-5-(хлорметил)пиридина (1,0 г, 6,2 ммоль) в 10 мл сухого ацетонитрила добавляют 1,03 мл (12,4 ммоль) (S)-3-гидроксипирролидина, а затем 858 мг (6,2 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 2 ч. После охлаждения реакционную смесь гасят 20 мл воды,три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 900 мг(выход 68%) (S)-1-(6-хлор-пиридин-3-илметил)пирролидин-3-ола. Анализ: C13 ЯМР (100 МГц, CDCl3) 35,1, 52,5, 56,7, 63,0, 71,4, 124,2, 133,4, 139,6, 149,9, 150,4; МС 213,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (193 мг,0,67 ммоль), полученному в соответствии с примером 53, стадия 1, добавляют 2,5 мл тетрагидрофурана,а затем 0,66 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют (S)-1-(6-хлор-пиридин-3-илметил)пирролидин-3-ол (140 мг, 0,66 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 2 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество- 26009527 очищают хроматографией на силикагеле с получением указанного в заголовке соединения (52 мг, выход 17%). Анализ: C13 ЯМР (100 МГц, CDCl3) 27,1, 29,1, 35,1, 48,4, 52,4, 53,9, 54,4, 56,9, 59,0, 60,3, 62,8, 68,9,71,3, 110,7, 111,0, 116,3, 122,3, 122,5, 126,9, 129,7, 139,9, 146,8, 161,2, 163,4, 164,1; МС m/z 464,5 (М+1). Пример 55.(7R,9aS)-транс-1-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-3-илметил]пирролидин-3-ол. К раствору 2-хлор-5-(хлорметил)пиридина (1,0 г, 6,2 ммоль) в 10 мл сухого ацетонитрила добавляют 1,05 мл (12,6 ммоль) (R)-3-гидроксипирролидина, а затем 858 мг (6,2 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 2 ч. После охлаждения реакционную смесь гасят 20 мл воды, экстрагируют три раза метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 1,03 г (выход 77%) (R)-1-(6-хлор-пиридин-3-илметил)пирролидин-3-ола. Анализ: C13 ЯМР (100 МГц, CDCl3) 35,1, 52,5, 56,7, 63,0, 71,4, 124,2, 133,4, 139,6, 149,9, 150,4; МС 213,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (189 мг,0,66 ммоль), полученному в соответствии с примером 53, стадия 1, добавляют 2,5 мл тетрагидрофурана,а затем 0,65 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют (R)-1-(6-хлор-пиридин-3-илметил)пирролидин-3-ол (138 мг, 0,65 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 2 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (40 мг, выход 13%). Анализ: C13 ЯМР (100 МГц, CDCl3) 27,1, 29,1, 35,1, 48,4, 52,4, 53,9, 54,4, 56,9, 59,0, 60,3, 62,8, 68,9,71,3, 110,7, 111,0, 116,3, 122,3, 122,5, 126,9, 129,7, 139,9, 146,8, 161,2, 163,4, 164,1; МС m/z 464,5 (M+1). Пример 56.(7R,9aS)-транс-7-(5-Азетидин-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин. К раствору 2-хлор-5-(хлорметил)пиридина (0,34 г, 2,1 ммоль) в 4 мл сухого ацетонитрила добавляют 389 мг (4,14 ммоль) азетидина гидрохлорида, а затем 572 мг (4,14 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 3 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 200 мг(выход 53%) 1-(6-хлор-пиридин-3-илметил)азетидина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 2,06-2,14 (m, 2 Н), 3,23 (t, 4H, J=7,0 Гц), 3,55 (s, 2 Н), 7,27 (d, 1H,J=7,9 Гц), 7,61 (dd, 1H, J=8,3 и 2,5 Гц), 8,26 (d, 1 Н, J=2,5 Гц); МС 183,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (255 мг,0,88 ммоль), полученному как в примере 53, стадия 1, добавляют 2,5 мл тетрагидрофурана, а затем 1,10 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют 1-(6-хлор-пиридин-3-илметил)азетидин (200 мг, 1,10 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 5 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (157 мг, выход 41%). Анализ: C13 ЯМР (100 МГц, CDCl3) 17,7, 25,0, 25,2, 33,5, 48,4, 53,8, 54,4, 55,1, 56,7, 60,6, 60,7, 66,9,110,6, 110,9, 116,4, 122,4, 122,5, 126,4, 129,6, 139,5, 146,7, 161,3, 163,7, 164,1; МС m/z434,5 (M+1). Пример 57.(7R,9aS)-транс-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7 илметокси)пиридин-3-илметил]-(2-метоксиэтил)метиламин. К раствору 2-хлор-5-(хлорметил)пиридина (384 мг, 2,37 ммоль) в 4 мл сухого ацетонитрила добавляют 0,51 мл (4,74 ммоль) 1-метил-2-метоксиэтиламина, а затем 328 мг (2,37 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 3 ч. После охлаждения реакционную смесь гасят 5 мл воды, экстрагируют три раза метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 395 мг (выход 78%) (6-хлор-пиридин-3-илметил)-(2-метоксиэтил)метиламина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 2,25 (s, 3H), 2,59 (t, 2H, J=5,6 Гц), 3,32 (s, 3H), 3,49 (t, 2H,J=5,6 Гц), 7,26 (d, 1H, J=8,5 Гц), 7,68 (dd, 1H, J=8,3 и 2,5 Гц), 8,27 (d, 1 Н, J=1,6 Гц); МС 215,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (344 мг,1,20 ммоль), полученному как в примере 53, стадия 1, добавляют 8 мл тетрагидрофурана, а затем 1,5 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добав- 27009527 ляют (6-хлор-пиридин-3-илметил)-(2-метоксиэтил)метиламин (325 мг, 1,50 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (308 мг, выход 55%). Анализ: C13 ЯМР (100 МГц, CDCl3) 27,2, 29,2, 36,3, 39,2, 42,6, 48,5, 53,9, 54,4, 56,2, 58,9, 59,0, 59,1,59,3, 60,4, 68,9, 70,9, 110,7, 110,9, 116,4, 122,4, 122,5, 126,8, 129,7, 140,2, 147,2, 161,3, 163,5, 164,2; МС m/z 466,5 (М+1). Пример 58.(7R,9aS)-транс-[6-(2-Бензо[d]изоксазол-3-илоктагидро-пиридо[1,2-a]пиразин-7 илметокси)пиридин-3-илметил]циклопентилметиламин. К раствору 2-хлор-5-(хлорметил)пиридина (318 мг, 1,96 ммоль) в 4 мл сухого ацетонитрила добавляют 395 мг (3,92 ммоль) N-метилциклопентиламина, а затем 270 мг (1,96 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 340 мг (выход 77%) (6-хлор-пиридин-3-илметил)циклопентилметиламина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,40-1,90 (m, 4H), 2,15 (s, 3H), 2,78-2,89 (m, 1 Н), 3,56 (s, 2 Н), 7,29(d, 1 Н, J=8,3 Гц), 7,70-7,80 (m, 1H), 8,28 (d, 1 Н, J=2,1 Гц); МС 225,3 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (350 мг,1,21 ммоль), полученному как в примере 53, стадия 1, добавляют 8 мл тетрагидрофурана, а затем 1,52 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют (6-хлор-пиридин-3-илметил)циклопентилметиламин (340 мг, 1,52 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 5 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (271 мг, выход 47%). Анализ: C13 ЯМР (100 МГц, CDCl3) 24,5, 27,2, 29,2, 30,6, 36,6, 39,9, 48,5, 53,9, 54,4, 57,3, 59,0, 60,4,66,6, 66,9, 110,7, 110,9, 116,4, 122,4, 122,5, 127,3, 129,7, 140,2, 147,1, 161,2, 153,3, 164,1; МС m/z 476,5 (М+1). Пример 59.(7R,9aS)-транс-N-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-3-илметил]-N,N'-диметилэтан-1,2-диамин. К раствору 2-хлор-5-(хлорметил)пиридина (586 мг, 3,62 ммоль) в 8 мл сухого ацетонитрила добавляют 756 мг (7,24 ммоль) N-N'-диметилэтилендиамина, а затем 500 мг (3,62 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 1 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 400 мг (выход 52%) N-(6-хлор-пиридин-3-илметил)-N,N'-диметилэтан-1,2-диамина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 2,18 (s, 3H), 2,31 (brs, 3H), 2,48 (s, 3H), 2,61 (t, 2H, J=6,1 Гц), 2,76(t, 2H, J=6,1 Гц), 3,47 (s, 2H), 7,28 (d, 1 Н, J=7,9 и 2,5 Гц), 8,31 (d, 1 Н, J=1,6 Гц); МС 214,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (273 мг,0,95 ммоль), полученному как в примере 53, стадия 1, добавляют 6 мл тетрагидрофурана, а затем 1,19 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют N-(6-хлор-пиридин-3-илметил)-N,N'-диметилэтан-1,2-диамин (253 мг, 1,19 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (25 мг, выход 5%). Анализ: C13 ЯМР (100 МГц, CDCl3) 2,8, 27,1, 29,2, 31,8, 35,3, 36,3, 41,7, 48,2, 48,5, 53,9, 54,4, 54,9,59,0, 59,4, 60,4, 68,9, 110,7, 111,1, 116,4, 122,3, 122,4, 126,8, 129,7, 140,1, 147,0, 161,3, 163,5, 164,1; МС m/z 465,5 (M+1). Пример 60. (7R,9aS)-транс-2-Бензо[d]изоксазол-3-ил-7-[5-(2-метилазиридин-1-илметил)пиридин-2 илоксиметил]октагидропиридо[1,2-a]пиразин. К раствору 2-хлор-5-(хлорметил)пиридина (352 мг, 2,17 ммоль) в 4 мл сухого ацетонитрила добавляют 0,4 мл (4,34 ммоль) 2-метилазиридина, а затем 300 мг (2,17 ммоль) карбоната калия. Реакционную смесь нагревают при 60C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 66 мг (выход 17%) 2-хлор-5-(2-метилазиридин-1-илметил)пиридина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,15 (d, 3H, J=5,4 Гц), 1,34 (d, 1H, J=6,6 Гц), 1,47-1,55 (m, 2H),3,35 (abq, 2H, J=5,8 Гц), 7,25 (d, 1H, J=6,3 Гц), 7,65 (dd, 1H, J=8,3 и 2,5 Гц), 8,27 (d, 1 Н, J=1,7 Гц); МС 183,2 (М+Н).- 28009527 К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (83 мг,0,29 ммоль), полученному как в примере 53, стадия 1, добавляют 2 мл тетрагидрофурана, а затем 0,36 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют 2-хлор-5-(2-метилазиридин-1-илметил)пиридин (66 мг, 0,36 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (20 мг, выход 16%). Анализ: C13 ЯМР (100 МГц, CDCl3) 18,5, 27,1, 29,1, 35,0, 35,2, 36,3, 48,4, 53,9, 54,4, 59,0, 60,4, 61,6,68,8, 110,7, 111,0, 116,3, 122,3, 122,4, 127,9, 139,0, 146,0, 161,2, 163,3, 164,1; МС m/z 434,4 (М+1). Пример 61. (7R,9aS)-транс-7-(5-Азепан-1-илметилпиридин-2-илоксиметил)-2-бензо[d]изоксазол-3 илоктагидропиридо[1,2-а]пиразин. К раствору 2-хлор-5-(хлорметил)пиридина (419 мг, 2,59 ммоль) в 5 мл сухого ацетонитрила добавляют 512 мг (5,18 ммоль) азациклогептана, а затем 358 мг (2,59 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получали масло, которое очищали хроматографией на силикагеле с получением 340 мг(выход 59%) 1-(6-хлор-пиридин-3-илметил)-азепана. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,40-1,70 (m, 8 Н), 2,50-2,65 (m, 4H), 3,65 (s, 2H), 7,28 (d, 1H,J=8,3 Гц), 7,65-7,70 (m, 1H), 8,30 (d, 1H, J=2,1 Гц); МС 225,3 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (284 мг,0,99 ммоль), полученному как в примере 53, стадия 1, добавляют 6 мл тетрагидрофурана, а затем 1,24 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют 1-(6-хлор-пиридин-3-илметил)азепан (278 мг, 1,24 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (37 мг, выход 8%). Анализ: C13 ЯМР (100 МГц, CDCl3) 27,1, 27,2, 28,1, 29,2, 36,3, 48,5, 53,9, 54,4, 55,5, 59,0, 59,4, 60,3,68,9, 110,6, 110,9, 116,3, 122,4, 122,5, 127,8, 129,7, 139,9, 146,8, 161,3, 163,3, 164,2; МС m/z 476,5 (М+1). Пример 62.(7R,9aS)-транс-2-Бензо[d]изоксазол-3-ил-7-[5-(2-метоксиметилпирролидин-1 илметил)пиридин-2-илоксиметил]октагидропиридо[1,2-a]пиразин. К раствору 2-хлор-5-(хлорметил)пиридина (369 мг, 2,28 ммоль) в 5 мл сухого ацетонитрила добавляют 521 мг (4,52 ммоль) (5)-(+)-2-(метоксиметил)-пирролидинона, а затем 314 мг (2,28 ммоль) карбоната калия. Реакционную смесь нагревают при 55C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получали масло, которое очищали хроматографией на силикагеле с получением 450 мг (выход 82%) 2-хлор-5-(2-метоксиметилпирролидин-1-илметил)пиридина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 3,35 (s, 2H), 7,28 (d, 1H, J=7,9 Гц), 7,40-7,50 (m, 1H), 8,31 (d, 1H,J=2,1 Гц); МС 241,3 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (287 мг,1,00 ммоль), полученному как в примере 53, стадия 1, добавляют 6 мл тетрагидрофурана, а затем 1,25 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют 2-хлор-5-(2-метоксиметилпирролидин-1-илметил)пиридин (300 мг, 1,25 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 5 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (177 мг, выход 36%). Анализ: C13 ЯМР (100 МГц, CDCl3) 22,8, 27,1, 28,5, 29,2, 36,3, 48,5, 53,9, 54,4, 56,1, 59,0, 59,3, 60,3,62,9, 68,8, 76,6, 110,6, 110,8, 116,3, 122,3, 122,4, 129,7, 140,2, 146,9, 161,2, 163,3, 164,2; МС m/z 492,5 (M+1). Пример 63.(7R,9aS)-транс-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7 илметокси)пиридин-3-илметил]-трет-бутиламин. К раствору 2-хлор-5-(хлорметил)пиридина (537 мг, 3,31 ммоль) в 7 мл сухого ацетонитрила добавляют 0,7 мл (6,62 ммоль) трет-бутиламина, а затем 457 мг (3,31 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 12 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получают масло, которое очищают хроматографией на силикагеле с получением 387 мг- 29009527 МС 199,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (222 мг,0,77 ммоль), полученному как в примере 53, стадия 1, добавляют 4 мл тетрагидрофурана, а затем 0,96 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют трет-бутил-(6-хлор-пиридин-3-илметил)амин (190 мг, 0,96 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (150 мг, выход 43%). Анализ: C13 ЯМР (100 МГц, CDCl3) 27,2, 29,2, 29,3, 36,3, 44,1, 48,5, 51,1, 53,9, 54,4, 59,0, 60,3, 68,8,110,6, 110,9, 116,3, 122,3, 122,4, 129,7, 139,5, 146,3, 161,2, 163,3, 164,2; МС m/z 450,5 (M+1). Пример 64.(7R,9aS)-транс-[6-(2-Бензо[d]изоксазол-3-илоктагидропиридо[1,2-a]пиразин-7 илметокси)пиридин-3-илметил]-трет-бутил-метиламин. К раствору 2-хлор-5-(хлорметил)пиридина (570 мг, 3,52 ммоль) в 7 мл сухого ацетонитрила добавляют 608 мг (7,04 ммоль) N-метил-трет-бутиламина, а затем 486 мг (3,52 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 12 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получали масло, которое очищали хроматографией на силикагеле с получением 420 мг (выход 56%) N-метил-трет-бутил-(6-хлор-пиридин-3-илметил)амина. Анализ: 1 Н ЯМР (400 МГц, CDCl3) 1,14 (s, 9H), 2,06 (s, 3H), 3,48 (s, 2H), 7,26 (d, 1H, J=6,2 Гц), 7,68(d, 1 Н, J=6,6 Гц), 8,28 (d, 1 Н, J=2,5 Гц); МС 213,3 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (226 мг,0,79 ммоль), полученному как в примере 53, стадия 1, добавляют 4 мл тетрагидрофурана, а затем 0,98 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют N-метил-трет-бутил-(6-хлорпиридин-3-илметил)амин (206 мг, 0,98 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (111 мг, выход 30%). Анализ: C13 ЯМР (100 МГц, CDCl3) 26,4, 27,1, 29,2, 34,5, 36,3, 48,5, 52,0, 53,9, 54,4, 59,0, 60,4, 68,8,110,7, 110,9, 116,3, 122,3, 122,4, 129,7, 139,8, 146,6, 161,2, 163,2, 164,1; МС m/z 464,5 (М+1). Пример 65.(7R,9aS)-транс-2-Бензо[d]изоксазол-3-ил-7-(5-тиазолидин-3-илметилпиридин-2 илоксиметил)октагидропиридо[1,2-a]пиразин. К раствору 2-хлор-5-(хлорметил)пиридина (500 мг, 3,08 ммоль) в 4 мл сухого ацетонитрила добавляют 0,42 мл (6,17 ммоль) тиазолидина, а затем 852 мг (6,17 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получали масло, которое очищали хроматографией на силикагеле с получением 275 мг (выход 42%) 2-хлор-5-тиазолидин-3-илметилпиридина. Анализ: C13 ЯМР (100 МГц, CDCl3) 29,8, 53,6, 57,7, 60,3, 112,4, 124,4, 133,3, 139,6, 150,1; МС 215,2 (М+Н). К (7R,9aS)-транс-[2-бензо[d]изоксазол-3-илоктагидропиридо[1,2-а]пиразин-7-ил]метанолу (134 мг,0,47 ммоль), полученному как в примере 53, стадия 1, добавляют 2 мл тетрагидрофурана, а затем 0,58 мл 1,0 М раствора трет-бутилата калия. Реакционную смесь нагревают в течение 30 мин при 50C и добавляют 2-хлор-5-тиазолидин-3-илметилпиридин (124 мг, 0,58 ммоль). Раствор нагревают до кипения с обратным холодильником в течение 12 ч, гасят 5 мл воды и экстрагируют метиленхлоридом. Органический слой сушат сульфатом натрия, концентрируют и полученное твердое вещество очищают хроматографией на силикагеле с получением указанного в заголовке соединения (184 мг, выход 84%). Анализ: C13 ЯМР (100 МГц, CDCl3) 27,1, 29,1, 29,7, 36,2, 48,4, 53,6, 53,9, 54,4, 57,5, 58,9, 60,1, 60,3,68,9, 110,6, 111,2, 116,3, 122,3, 122,4, 126,9, 129,7, 139,9, 147,0, 161,2, 163,6, 164,1; МС m/z 466,5 (М+1). Пример 66.(7R,9aS)-транс-2-Бензо[d]изоксазол-3-ил-7-(5-имидазол-1-илметилпиридин-2 илоксиметил)октагидропиридо[1,2-a]пиразин. К раствору 2-хлор-5-(хлорметил)пиридина (500 мг, 3,08 ммоль) в 4 мл сухого ацетонитрила добавляют 420 мл (6,17 ммоль) имидазола, а затем 852 мг (6,17 ммоль) карбоната калия. Реакционную смесь нагревают при 80C в течение 20 ч. После охлаждения реакционную смесь гасят 5 мл воды, три раза экстрагируют метиленхлоридом и сушат над сульфатом натрия. В результате концентрирования растворителя получали масло, которое очищали хроматографией на силикагеле с получением 410 мг (выход 69%) 2-хлор-5-имидазол-1-илметилпиридина. Анализ: C13 ЯМР (100 МГц, CDCl3) 47,7, 119,2, 124,9, 130,6, 131,1, 137,5, 137,8, 148,6, 151,8; МС 194,2 (М+Н).
МПК / Метки
МПК: C07D 471/04, A61K 31/495
Метки: пиридилоксиметильные, бензизоксазольные, азабициклические, производные
Код ссылки
<a href="https://eas.patents.su/30-9527-piridiloksimetilnye-i-benzizoksazolnye-azabiciklicheskie-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридилоксиметильные и бензизоксазольные азабициклические производные</a>
Предыдущий патент: Сложноэфирные производные декагидроизохинолин-3-карбоновой кислоты в качестве анальгетиков
Следующий патент: Пептид (варианты), содержащая его композиция и лекарственный препарат для профилактики и лечения атеросклероза
Случайный патент: Полиморфные формы 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона












