Производные пиперазина, применяемые в качестве модуляторов кальциевого канала cav2.2
Номер патента: 18621
Опубликовано: 30.09.2013
Авторы: Николсон Невилль Хьюберт, Глив Роберт Джеймс, Пэйдж Ли Уилльям, Вайл Сэйди, Бесвик Пол Джон, Хир Джаг Пол, Кридлэнд Эндрю Питер, Кэмпбелл Алистер
Формула / Реферат
1. Соединение, которое представляет собой (2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-{[4-(трифторметил)фенил]сульфонил}пиперазин или его фармацевтически приемлемую соль формулы
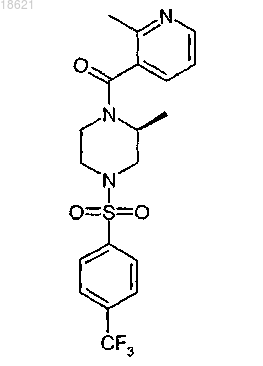
2. Соединение по п.1, которое представляет собой (2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-{[4-(трифторметил)фенил]сульфонил}пиперазин или (2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-{[4-(трифторметил)фенил]сульфонил}пиперазин гидрохлорид.
3. Соединение по п.1 или 2, которое представляет собой (2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-{[4-(трифторметил)фенил]сульфонил}пиперазин.
4. Фармацевтическая композиция, предназначенная для лечения боли, содержащая (a) соединение или его фармацевтически приемлемую соль по любому из пп.1-3 и (b) фармацевтически приемлемый наполнитель.
5. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-3 для лечения боли.
6. Применение по п.5, где указанная боль включает острую боль, хроническую боль, хроническую суставную боль, скелетно-мышечную боль, нейропатическую боль, воспалительную боль, висцеральную боль, боль, связанную с раком, боль, связанную с мигренью, головную боль напряжения и кластерные головные боли, боль, связанную с функциональными нарушениями кишечника, боль в нижнем отделе спины и боль в шее, боль, связанную с растяжениями связок и сухожилий, симпатически поддерживаемую боль; миозит, боль, связанную с гриппом или другими вирусными инфекциями, например с простудой, боль, связанную с ревматической атакой, боль, связанную с ишемией миокарда, послеоперационную боль, боль при химиотерапии рака, головную боль, зубную боль и дисменорею.
7. Применение по п.6, где указанная боль представляет собой нейропатическую боль.
8. Применение по п.6, где указанная боль представляет собой боль в нижнем отделе спины и боль в шее.
9. Применение по п.5 или 6, где указанная боль представляет собой воспалительную боль или хроническую суставную боль, включающую ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагрический артрит и ювенильный артрит.
Текст
ПРОИЗВОДНЫЕ ПИПЕРАЗИНА, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ КАЛЬЦИЕВОГО КАНАЛА CaV2.2 Изобретение относится к новому соединению, которое представляет собой (2S)-2-метил-1[(2-метил-3-пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин или его фармацевтически приемлемую соль, к фармацевтической композиции, содержащей указанное соединение, и к применению указанного соединения для лечения заболеваний, при которых полезно блокировать кальциевые каналы CaV2,2. Настоящее изобретение относится к новым производным пиперазина; к фармацевтической композиции, содержащей указанные производные; и к терапевтическому применению указанных производных для лечения заболеваний, при которых необходимо блокирование кальциевых каналов CaV2.2. Пресинаптические CaV2.2 (N-типа) потенциалозависимые кальциевые каналы в дорсальном роге спинного мозга модулируют высвобождение ключевых проноцицептивных медиаторов, таких как глутамат, субстанции Р (СП) и кальцитонин ген-связанный пептид (CGRP), что указывает на потенциальное терапевтическое применение блокаторов кальциевых каналов CaV2.2 в качестве анальгетиков. Показано, что пептидные -конотоксины, выделенные из яда конических улиток, являются селективными для кальциевых каналов CaV2.2 и могут блокировать высвобождение СП (SP) в спинном мозге(Smith et al. (2002), Pain, 96: 119-127). Кроме того, выявлена их антиноцицептивность в животных моделях хронической боли при интратекальном введении (Bowersox et al. (1996), Journal of Pharmacology andExperimental Therapeutics, 279: 1243-1249; Smith et al. (2002), supra) и было показано, что они являются эффективными анальгетиками при клиническом применении, в особенности при лечения нейропатической боли (Brose et al. (1997), Clinical Journal of Pain, 13: 256-259). Дополнительно, показано значение кальциевых каналов CaV2.2 для нормальной функции нейронов(Winquist et al. (2005), Biochemical Pharmacology, 70: 489-499). Таким образом, существует задача идентификации новых молекул, которые предпочтительно блокируют CaV2.2 в условиях повышенной возбудимости нейронов, так называемых частотно-зависимых блокаторов, как в случае синдромов хронической боли. В WO 2007/111921 (Amgen Inc.) описан ряд диазагетероциклических амидных производных, которые, как утверждается, являются полезными для лечения диабета, ожирения и связанных с ними состояний и нарушений. В DE 10155684 (Bayer A.G.) описан ряд 2-(аминосульфонил)фенил]уреидо]тиазолов в качестве антибиотиков. В WO 2008/024284 (MerckCo) описан ряд сульфонилированных пиперазинов в качестве модуляторов каннабиноидных 1 (СВ 1)-рецепторов, которые заявлены как полезные для лечения, например, психоза, когнитивных нарушений и болезни Альцгеймера. Настоящее изобретение относится к соединению, которое способно блокировать указанные кальциевые каналы CaV2.2. В первом аспекте настоящее изобретение обеспечивает соединение, которое представляет собой(2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин или его фармацевтически приемлемую соль, формулы Во втором аспекте настоящее изобретение обеспечивает соединение, которое представляет собой(2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин гидрохлорид. В третьем аспекте настоящее изобретение обеспечивает соединение, которое представляет собой(2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин. Настоящее изобретение относится также к фармацевтической композиции, предназначенной для лечения боли, содержащей указанное выше соединение или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель. В ещ одном аспекте настоящее изобретение относится к применению указанного выше соединения или его фармацевтически приемлемой соли для лечения боли. Указанная боль включает острую боль, хроническую боль, хроническую суставную боль, скелетномышечную боль, нейропатическую боль, воспалительную боль, висцеральную боль, боль, связанную с раком, боль, связанную с мигренью, головную боль напряжения и кластерные головные боли, боль, связанную с функциональными нарушениями кишечника, боль в нижнем отделе спины и боль в шее, боль,связанную с растяжениями связок и сухожилий, симпатически поддерживаемую боль; миозит, боль, связанную с гриппом или другими вирусными инфекциями, например с простудой, боль, связанную с ревматической атакой, боль, связанную с ишемией миокарда, послеоперационную боль, боль при химиотерапии рака, головную боль, зубную боль и дисменорею. В частном варианте указанная боль представляет собой нейропатическую боль. В другом частном варианте указанная боль представляет собой боль в нижнем отделе спины и боль в шее. В ещ одном частном варианте указанная боль представляет собой воспалительную боль или хроническую суставную боль, включающую ревматоидный артрит, остеоартрит, ревматоидный спондилит,подагрический артрит и ювенильный артрит. Соединение согласно настоящему изобретению может образовывать кислотно-аддитивные соли. Следует понимать, что соединения согласно настоящему изобретению для медицинского применения можно использовать в виде солей, и в этом случае соли должны быть фармацевтически приемлемыми. Фармацевтически приемлемые соли включают соли, описанные авторами Berge, Bighley and Monkhouse,J. Pharm. Sci., 1977, 66, 1-19. Термин "фармацевтически приемлемые соли" включает соли, изготовленные из фармацевтически приемлемых кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, гидробромистую, соляную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, виннокаменную, п-толуолсульфоновую кислоту и т.п. Примеры фармацевтически приемлемых солей включают соли, образованные малеиновой, фумаровой, бензойной, аскорбиновой, памовой, янтарной, соляной, серной, бис-метиленсалициловой, метансульфоновой, этандисульфоновой, пропионовой, виннокаменной, салициловой, лимонной, глюконовой,аспарагиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой,бензолсульфоновой, циклогексилсульфамовой, фосфорной и азотной кислотами. Соединения, упомянутые в первом-третьем аспектах, можно изготавливать согласно указаниям следующих ниже схем и примеров. Способ получения включает:(а) взаимодействие соединения формулы (II) или его производного с соединением формулы (III) в которых R1, R2, R3, R4, R5, R6, m и n соответствуют вышеуказанным определениям иL1 представляет собой подходящую уходящую группу, такую как атом галогена (например, хлор или бром), или гидроксильную группу, активированную коммерчески доступными реагентами связывания амида (например, НОВТ, HBTU или HATU);(b) взаимодействие соединения формулы (IV) в которых R1, R2, R3, R4, R5, R6, m и n соответствуют вышеуказанным определениям иL2 представляет собой подходящую уходящую группу, такую как атом галогена (например, хлор или бром);(с) взаимопревращение в другие соединения, упомянутые в первом-четвертом аспектах. Способ (а) обычно включает взаимодействие соединения формулы (II) с соединением формулы (III) в подходящем растворителе, таком как ацетонитрил, тетрагидрофуран, N,N-диметилформамид или ди-2 018621 хлорметан, в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина,или DIPEA) при температуре от 0C до температуры окружающей среды (например, при комнатной температуре). Способ (b) обычно включает взаимодействие соединения формулы (IV) и формулы (V) в присутствии подходящего растворителя (такого как дихлорметан или ацетонитрил) в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, или DIPEA) при температуре от 0C до температуры окружающей среды (например, при комнатной температуре). Альтернативно, способ (b) обычно может включать взаимодействие промежуточных продуктов в присутствии подходящего основания в качестве растворителя (например, пиридина). Способ (с) можно осуществлять, используя общепринятые способы взаимопревращения, такие как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное ароматическое замещение. Одним из таких примеров взаимопревращения может быть взаимопревращение соединения, упомянутого в аспектах от первого до четвертого, в котором R3 представляет собой бром, в соединение, упомянутое в первом-четвертом аспектах, в котором R3 представляет собой циано. Такое взаимопревращение можно осуществлять путем обработки соединения брома солью цианида (например,цианидом меди(I в подходящем растворителе (например, в N,N-диметилформамиде) при высокой температуре (например, 200C, применяя использование микроволнового излучения). Альтернативно, взаимопревращение можно осуществлять с использованием соли цианида (например, цианида цинка) в присутствии источника палладиевого катализатора (например, трис-(дибензилиденацетон)дипалладия(0 и лиганда (например, 1,1'-бис-(дифенилфосфино)ферроцена) в подходящем растворителе (таком какN,N-диметилформамид) при высоких температурах (например, 120C). Этот вид взаимопревращения также можно проводить с промежуточными продуктами соединений, указанных в первом-четвертом аспектах, например с соединениями формулы (VII). Другим примером взаимопревращения является взаимопревращение соединения формулы (VII), в котором R4 представляет собой бром, в соединение, где R4 представляет собой метил. Такое взаимопревращение можно осуществлять путем обработки соединения брома метилбороновой кислотой или сложным эфиром (например, триметилбороксином) в присутствии палладиевого катализатора (например, тетракис-трифенилфосфин палладия(0 в подходящем растворителе (таком как 1,4-диоксан) при высокой температуре (например, 100C). Другой пример взаимопревращения в другие соединения, указанные в аспектах от первого до четвертого, показан на схеме 1 Схема 1Q представляет собой C1-4 алкил или C3-6 циклоалкил. Стадия (i) обычно включает взаимодействие соединения формулы (Id) с галидом C1-4 алкилцинка в присутствии катализатора, такого как PdCl2 (dppf) в подходящем растворителе, например в 1,4-диоксане,при высокой температуре (например, 100C). Альтернативно, стадия (i) может включать взаимодействие соединения формулы (Id) с подходящейC1-4 алкилбороновой кислотой или C3-6 циклоалкилбороновой кислотой в присутствии катализатора, такого как ацетат палладия(II), лиганда, такого как трициклогексилфосфин, и основания, такого как фосфат калия, в растворителе, например в смеси толуола и воды, при высокой температуре. Дополнительный пример взаимопревращения в другие соединения, указанные в первом-четвертом аспектах, показан на схеме 2. в которой R1, R1a, R1b, R2, R3, R4, R5, R6 и m соответствуют вышеуказанным определениям иn равен 0 или 1. Стадия (i) обычно включает взаимодействие соединения формулы (If) с амином HNR1aR1b в подходящем растворителе, таком как изопропанол, при микроволновом излучении при температуре в диапазоне 100-180C в течение времени, необходимого для достижения надлежащего превращения в (Ig), такого как, например, от 1 до 48 ч. Соединения формулы (II) можно изготавливать по следующей схеме. Схема 3 в которой определения R2, R3, R4, R5, R6, m и L2 приведены выше и Р 1 представляет собой подходящую защитную группу, такую как трет-бутоксикарбонил. Альтернативно, если Р 1 является Н, тогда этап (ii) не требуется. Стадия (i) обычно включает взаимодействие соединения формулы (V) и (VI) в подходящем растворителе, таком как дихлорметан ДХМ или MeCN, в присутствии основания (например, триэтиламина,диизопропилэтиламина, или DIPEA) при температуре от 0C до температуры окружающей среды (например, при температуре окружающей среды). Альтернативно, этап (i) обычно можно осуществлять с использованием подходящего основания в качестве растворителя, например пиридина, или этап (i) также можно проводить в смеси растворителей тетрагидрофурана ТГФ и воды, используя подходящее основание, например гидроксид натрия. Стадия (ii) обычно включает снятие защиты. Например, если Р 1 является трет-бутоксикарбонилом,этап (ii) будет обычно содержать обработку кислотой, например соляной или трифторуксусной кислотой,-4 018621 в растворителе (таком как 1,4-диоксан, дихлорметан или смесь метанола и 1,4-диоксана). Соединения формулы (IV) можно получить согласно схеме 4. Схема 4 в которой определения R2, m, R1, n и Р 1 приведены выше. Стадия (i) обычно включает взаимодействие соединения формулы (VI) с соединением формулы (III) в подходящем растворителе (таком как MeCN, ТГФ, ДМФ или ДХМ) в присутствии подходящего основания (например, триэтиламина, диизопропилэтиламина, или DIPEA) при температуре от 0C до температуры окружающей среды (например, при температуре окружающей среды). Стадия (ii) обычно включает снятие защиты, которую можно проводить аналогичным образом, как на вышеупомянутом этапе (ii). Соединения формул (III), (V) и (VI) представляют собой коммерчески доступные соединения или их можно изготавливать известными способами. Соединения, способные блокировать кальциевые каналы CaV2.2, могут быть полезными для лечения или профилактики боли, включающей острую боль, хроническую боль, хроническую суставную боль, скелетно-мышечную боль, нейропатическую боль, воспалительную боль, висцеральную боль, боль,связанную с раком, боль, связанную с мигренью, головную боль напряжения и кластерные головные боли, боль, связанную с функциональными нарушениями кишечника, боль в нижнем отделе спины и боль в шее, боль, связанную с растяжениями связок и сухожилий, симпатически поддерживаемую боль; миозит,боль, связанную с гриппом или другими вирусными инфекциями, например с простудой, боль, связанную с ревматической атакой, боль, связанную с ишемией миокарда, послеоперационную боль, боль при химиотерапии рака, головную боль, зубную боль и дисменорею. Состояния "хронической суставной боли" включают ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагрический артрит и ювенильный артрит."Боль, связанная с функциональными расстройствами кишечника" включает диспепсию неязвенного происхождения, некардиогенную боль в груди и синдром раздраженного кишечника. Синдромы "нейропатической боли" включают диабетическую невропатию, ишиалгию, неспецифическую боль в пояснице, невралгию тройничного нерва, боль при рассеянном склерозе, фибромиалгию,нейропатию, связанную с ВИЧ, постгерпетическую невралгию, невралгию тройничного нерва и боль,обусловленую физической травмой, ампутацией, синдром фантомной боли, боль, обусловленную операцией на позвоночнике, раком, состояниями интоксикации или хронического воспаления. Дополнительно,состояния нейропатической боли включают боль, связанную с обычными неболевыми ощущениями, такими как "покалывания" (парестезии и дизестезии), повышенную чувствительность к прикосновению(гиперестезия), болезненное ощущение после безвредного раздражения (динамическая, статическая, тепловая или холодовая аллодиния), повышенную чувствительность к вредным раздражителям (тепловая,холодовая, механическая гипералгезия), продолжительные болевые ощущения после удаления раздражителя (гиперпатия) или отсутствие или дефицит селективных сенсорных проводящих путей (гипоалгезия). Другие состояния, которые потенциально можно лечить соединениями, указанными в первомтретьем аспектах, включают нейродегенеративные болезни и нейродегенерацию, посттравматическую нейродегенерацию, тиннитус, состояния зависимости от средства, вызывающего зависимость, такого как опиоиды (например, морфин), депрессанты ЦНС (например, этанол), психостимуляторы (например, ко-5 018621 каин) и никотин. Нейродегенеративные болезни включают деменцию, в частности дегенеративную деменцию (включающую сенильную деменцию, деменцию с тельцами Леви, болезнь Альцгеймера, болезнь Пика, хорею Гентингтона, болезнь Паркинсона и болезнь Крейтцфельдта-Якоба, боковой амиотрофический склероз,болезнь моторных нейронов); сосудистую деменцию (включающую мультиинфарктную деменцию); а также деменцию, связанную с поражением интракраниального пространства; травму; инфекции и связанные с ними состояния (включающие ВИЧ-инфекцию, менингит и опоясывающий лишай); нарущение метаболизма; воздействие токсинов; кислородное голодание и дефицит витаминов и умеренные когнитивные нарушения, связанные с возрастом, в частности возрастное нарушение памяти. Соединения, указанные в аспектах от первого до третьего, также могут быть полезными для нейропротекции и для лечения или профилактики нейродегенерации после травмы, такой как удар, остановка сердца, легочное шунтирование, травматическое повреждение головного мозга, повреждение спинного мозга или подобное. Другое состояние, которое потенциально можно лечить соединением, указанным в первом-третьем аспектах, представляет собой спастичность или мышечную гипертоничность. В контексте настоящего изобретения термин "лечение" относится к симптоматическому лечению, и используемый термин "профилактика" означает предотвращение симптомов у субъекта, уже пораженного патологией, или предотвращение повторения симптомов у пораженного патологией субъекта, без ограничений до полного предотвращения поражения. Для применения соединения, указанного в первом-третьем аспектах, или его фармацевтически приемлемой соли, для лечения или профилактики у людей и других млекопитающих рецептуру соединения в виде фармацевтической композиции обычно создают согласно стандартной фармацевтической практике. Для терапевтического применения соединения, указанного в первом-третьем аспектах, или его фармацевтически приемлемой соли рецептуру соединений в виде фармацевтической композиции обычно формулируют согласно стандартной фармацевтической практике. Указанное в первом-третьем аспектах соединение или его фармацевтически приемлемую соль, применяемые для лечения или профилактики боли, можно использовать в комбинации с другими лекарствами, которые известны как полезные для лечения или профилактики боли нейропатического происхождения, включающей невралгии, невриты и боль в пояснице, и боли воспалительного происхождения, включающей остеоартрит, ревматоидный артрит, острую воспалительную боль, боль в пояснице и мигрень. Такие терапевтические средства включают в качестве указанного соединения ингибиторы ЦОГ-2 (циклооксигеназы-2), такие как целекоксиб,деракоксиб, рофекоксиб, валдекоксиб, парекоксиб, ЦОГ-189 или 2-(4-этоксифенил)-3-(4 метансульфонилфенил)пиразоло[1,5-b]пиридазин (WO 99/012930); ингибиторы 5-липоксигеназы; НПВСNMDA-рецепторов (N-метил-D-аспатрат-рецепторов), такие как антагонисты глициновых рецепторов или мемантин; лиганды для 2-субъединиц потенциал-зависимых кальциевых каналов, такие как габапентин, прегабалин и солзира; трициклические антидепрессанты, такие как амитриптилин; нейронстабилизирующие противоэпилептические лекарственные средства; ингибиторы холинэстеразы, такие как галантамин; моноаминергические ингибиторы захвата, такие как венлафаксин; опиоидные анальгетики; локальные анестетики; агонисты 5-HT1, такие как триптаны, например, соединения суматриптан,наратриптан, золмитриптан, элетриптан, фроватриптан, алмотриптан или ризатриптан; модуляторы никотиновых ацетилхолиновых рецепторов (nACh); модуляторы глутаматных рецепторов, соединения,представляющие собой модуляторы подтипа NR2B; лиганды рецептора EP4; лиганды рецептора ЕР 2; лиганды рецептора ЕР 3; агонисты ЕР 4 и агонисты ЕР 2; антагонисты ЕР 4; антагонисты ЕР 2 и антагонисты ЕР 3; лиганды каннабиноидного рецептора; лиганды брадикининового рецептора; лиганды ваниллоидного рецептора или транзиторного рецепторного потенциала (TRP) и лиганды пуринергических рецепторов,включающие антагонисты Р 2 Х 3, Р 2 Х 2/3, Р 2 Х 4, Р 2 Х 7 или Р 2 Х 4/7; активаторы каналов KCNQ/Kv7, такие как ретигабин; дополнительные ингибиторы ЦОГ-2 раскрыты в патентах США 5474995, US 5633272;US 5466823, US 6310099 и US 6291523 и в WO 96/25405, WO 97/38986, WO 98/03484, WO 97/14691,WO 99/12930, WO 00/26216, WO 00/52008, WO 00/38311, WO 01/58881 и WO 02/18374. Применяемое для лечения или профилактики болезни Альцгеймера соединение, указанное в первом-третьем аспектах, или его фармацевтически приемлемая соль могут использоваться в комбинации с другими лекарствами, которые полезны в качестве болезнь-модифицирующих препаратов или для симптоматического лечения болезни Альцгеймера. Подходящие примеры таких других терапевтических средств могут представлять собой средства,известные в качестве модификаторов холинергической передачи, такие как антагонисты 5-HT1A (например, лекозотан), антагонисты 5-НТ 6, агонисты М 1-мускариновых рецеторов, антагонисты М 2 мускариновых рецепторов, ингибиторы ацетилхолинэстеразы (например, тетрагидроаминоакридин, донепезил или ривастигмин), или аллостерические модуляторы, агонисты никотиновых рецепторов или аллостери-6 018621 ческие модуляторы, симптоматические агенты, такие как антагонисты 5-НТ 6 рецепторов, напримерSB742457, антагонисты Н 3 рецепторов, например GSK189254 и GSK239512, агонист 5-НТ 4 рецептора,агонисты PPAR, также антагонисты или модуляторы NMDA рецепторов, также болезньмодифицирующие препараты, такие как ингибиторы - или -секретазы (например, R-флурбипрофен),также положительные модуляторы АМРА-рецепторов и ингибиторы транспортеров обратного захвата глицина. Если соединение согласно первому-третьему аспектам или его фармацевтически приемлемая соль применяется в комбинации с другим терапевтическим средством, эти соединения можно вводить или последовательно, или одновременно любым удобным путем. Фармацевтическая композиция настоящего изобретения, которую можно изготавливать путем смешивания, для чего подходит температура окружающей среды и атмосферное давление, обычно адаптирована для перорального, парентерального или ректального введения и также может быть представлена в виде таблеток, капсул, пероральных жидких препаратов, порошков, гранул, пастилок, восстанавливаемых порошков, растворов или суспензий для инъекций или инфузий или в виде суппозиториев. Предпочтительными обычно являются перорально вводимые композиции. Таблетки и капсулы для перорального введения могут представлять собой монолитную лекарственную форму и могут содержать общепринятые вспомогательные вещества, такие как связующие агенты,наполнители, таблетирующие лубриканты, дезинтегрирующие вещества и приемлемые увлажняющие агенты. Таблетки можно покрывать согласно способам, общеизвестным в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в виде, например, водной или масляной суспензии,растворов, эмульсий, сиропов или эликсиров или могут представлять собой сухой продукт для восстановления водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать общепринятые добавки, например суспендирующие агенты, эмульгирующие агенты, неводные носители (которые могут включать съедобные масла), консерванты и, если желательно, общепринятые ароматизаторы или красители. Жидкие лекарственные формы для парентерального введения изготавливают, используя соединение по изобретению или его фармацевтически приемлемую соль и стерильный носитель. Соединение, в зависимости от носителя и применяемой концентрации, можно или суспендировать, или растворять в носителе. Для приготовления раствора для инъекций соединение можно растворять и стерилизовать фильтрованием перед наполнением в подходящий флакон или ампулу и герметизацией. Полезным является растворение в носителе адъювантов, таких как местные анестетики, консерванты и буферные агенты. Для повышения стабильности после наполнения флакона композицией ее можно замораживать и удалять воду в вакууме. Парентеральные суспензии приготавливают, по существу, таким же образом, за исключением того, что соединение суспендируют в носителе вместо растворения, и путем фильтрации нельзя достигнуть стерилизации. Перед суспендированием в стерильном носителе соединение можно стерилизовать воздействием этиленоксида. Преимущество дает включение в композицию сурфактанта или увлажняющего агента для облегчения равномерного распределения соединения. Активный материал в композиции может содержаться в количестве от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% в зависимости от способа введения. Доза соединения, указанного в первомчетвертом аспектах, или его фармацевтически приемлемой соли, используемая для лечения или профилактики вышеупомянутых нарушений, будет варьировать в обычном порядке в зависимости от тяжести заболевания, веса больного и других подобных факторов. Вместе с тем, в качестве общих указаний подходящими монолитными дозами могут быть дозы от 0,05 до 1000 мг, более подходящими от 1,0 до 200 мг, и такие монолитные дозы можно вводить более одного раза в день, например два или три раза в день. Такое лечение можно продолжать в течение многих недель, месяцев, лет или даже в течение жизни. Дополнительным аспектом изобретения является фармацевтическая композиция, содержащая от 0,05 до 1000 мг соединения, указанного в первом-четвертом аспектах, или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель в количестве от 0 до 3 г,более применимо от 0 до 2 г. Все публикации, включающие без ограничения патенты и патентные заявки, цитируемые в настоящем описании, включены в него путем ссылки, как если бы каждая отдельная публикация была бы конкретно и отдельно предназначена для включения в изобретение путем ссылки, как изложенная. Сокращения:MDAP - масс-направленная автоматизированная препаративная жидкостная хроматография; МеОН - метанол;SP4 - автоматизированная система очистки Biotage-SP4; ТГФ - тетрагидрофуран; ТФУ - трифторуксусная кислота;API-ES - ионизация электрораспылением при атмосферном давлении. Примеры В следующих далее методиках после каждого исходного материала обычно приведена ссылка на промежуточный продукт. Для квалифицированного химика это служит просто вспомогательной ссылкой. Исходный материал может необязательно быть приготовлен из упомянутой партии. Описание 1. (3S)-3-Метил-1-[4-(трифторметил)фенил]сульфонилпиперазин К раствору 1,1-диметилэтил (2S)-2-метил-1-пиперазинкарбоксилата (5,00 г, 25,0 ммоль, фирмапоставщик Small Molecules Inc.) в ДХМ (200 мл) добавляли DIPEA (11,4 мл, 65,5 ммоль) и 4-(трифторметил)бензолсульфонилхлорид (5,68 г, 23,2 ммоль). Реакционную смесь перемешивали в течение 1 ч. ДХМ (200 мл) добавляли в реакционную смесь, которую переносили в делительную воронку. Раствор промывали насыщенным раствором бикарбоната натрия (50 мл, дважды) и затем дистиллированной водой (50 мл). Органический слой высушивали над сульфатом магния, который удаляли фильтрацией, и фильтрат выпаривали досуха на роторном испарителе с получением 8,90 г белого твердого вещества. Твердое вещество растворяли в 1,4-диоксане (30 мл) и 4 М HCl в 1,4-диоксане (10 мл) и добавляли несколько капель воды, затем реакционную смесь перемешивали в течение 1 ч. После этого дополнительно добавляли 4 М HCl в 1,4-диоксане (20 мл) и реакционную смесь перемешивали в течение ночи. Реакционную смесь выпаривали до сухого состояния в вакууме, остаток растворяли в МеОН и загружали в колонку SCX (Biotage). Колонку промывали с МеОН (2 объема колонки) и продукт элюировали 1 М аммиаком в МеОН. ЖХ-МС показывала большое количество желательного продукта, присутствующего в промывочном МеОН, поэтому его выпаривали досуха на роторном испарителе. Остаток растворяли вEtOAc (100 мл) и экстрагировали с помощью 2 М водной HCl (50 мл). Водный слой ощелачивали 2 М водным раствором NaOH, пока уровень рН не становился выше 7, и экстрагировали EtOAc (100 мл). Органический слой выпаривали досуха на роторном испарителе с получением указанного в заголовке соединения в виде белого твердого вещества (4,34 г).(2S)-2-Метилпиперазин (15 г, 150 ммоль) растворяли в тетрагидрофуране (300 мл) и раствор охлаждали до 0C. Добавляли гидроксид натрия (150 мл, 449 ммоль), затем по капле добавляли 4-(трифторметил)бензолсульфонилхлорид (40 г, 164 ммоль) (растворенный в 200 мл ТГФ) и полученную смесь перемешивали в течение 1 ч. После этого добавляли 4-(трифторметил)бензолсульфонилхлорид(0,06 экв., 2,2 г) и смесь перемешивали в течение 10 мин. Смесь разводили ДХМ (500 мл) и водой(500 мл) и перемешивали в течение 5 мин. Фазы разделяли, водный слой экстрагировали ДХМ (1000 мл),затем органические фазы выпаривали при пониженном давлении. Остаток поглощали 1 М HCl (500 мл) и промывали ДХМ, чтобы экстрагировать примеси. Водную фазу ощелачивали до уровня рН 9 с помощью 3 M NaOH, экстрагировали ДХМ (3500 мл) и объединенные органические фазы высушивали надNa2SO4 перед удалением растворителя при пониженном давлении, с получением указанного в заголовке соединения (30 г). К раствору (3S)-3-метил-1-[4-(трифторметил)фенил]сульфонилпиперазина (описание 1) (100 мг,0,324 ммоль) в ДМФ (5 мл) добавляли 2-метил-3-пиридинкарбоновую кислоту (44,5 мг, 0,324 ммоль),НОВТН 2 О (49,7 мг, 0,324 ммоль) и HATU (123 мг, 0,324 ммоль). В конце добавляли DIPEA (0,170 мл,0,973 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Растворитель удаляли выпариванием, и очистка MDAP приводила к получению указанного в заголовке соединения в виде соли муравьиной кислоты. Соль муравьиной кислоты суспендировали в насыщенном водном бикарбонате натрия и свободное основание экстрагировали в ДХМ. Выпаривание приводило к получению свободного основания в виде светло-желтого масла. Это масло обрабатывали эфирной 1 М HCl с получением указанного в заголовке соединения (118 мг) в виде порошкообразного крема.(3S)-3-Метил-1-[4-(трифторметил)фенил]сульфонилпиперазин (может быть подготовлен согласно описанию 1 или 1 а) (30 г, 97 ммоль) растворяли в тетрагидрофуране (300 мл) перед добавлением по капле 3 М гидроксида натрия (97 мл, 292 ммоль) при 0C и реакционную смесь перемешивали в течение 10 мин. Порциями добавляли 2-метил-3-пиридинкарбонилхлорид (26,2 г, 136 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 10 мин. Из смеси удаляли ТГФ при пониженном давлении и полученную суспензию экстрагировали ДХМ (2300 мл). Органический слой промывали соляным раствором, высушивали над Na2SO4, фильтровали и выпаривали досуха с получением указанного в заголовке соединения (39,9 г).m/z (API-ES) 428 [М+Н]+; ЯМР показывает смесь ротамеров: 1(2S)-2-Метил-1-[(2-метил-3-пиридинил)карбонил]-4-[4(трифторметил)фенил]сульфонилпиперазин (может быть приготовлен согласно описанию примера 1 или 1 а) (39,9 г, 93 ммоль) растворяли в диэтиловом эфире (500 мл). По капле добавляли 1,0 М HCl в эфире (103 мл, 103 ммоль) (твердое вещество получено из раствора) и смесь перемешивали в течение 20 мин. Белое твердое вещество восстанавливали фильтрацией и высушивали в вакууме при 70C в течение 36 ч с получением указанного в заголовке соединения (41,48 г) в виде хлористо-водородной соли.m/z (API-ES) 428 [М+Н]+; ЯМР показывает смесь ротамеров: 1 Фармакологические данные. Соединения настоящего изобретения можно тестировать на их биологическую активность in vitro в анализах hCaV2.2 согласно следующим исследованиям. Способы. Цитобиология. Были созданы устойчивые клеточные линии, экспрессирующие человеческую субъединицу CaV2.2(1B), наряду с человеческими вспомогательными субъединицами 3 и 21, и затем последовательно трансфицировали и выбирали клетки человеческой эмбриональной почки (HEK293). Клетки(2 мМ; Invitrogen, кат.25030-024) и неосновных аминокислот (5%; Invitrogen, кат.11140-035). Вначале клетки HEK293 трансфицировали двумя плазмидными векторами для экспрессии субъединицыhCaV2,2(pCIN5-hCaV2.2, которая несет маркер устойчивости к неомицину) и субъединицы hCaV 3(pCIH-hCaV 3, которая несет маркер устойчивости к гигромицину). Выделяли клональные клеточные линии с последующей селекцией в среде с добавлением 0,4 мг/мл генетицина G418 (Invitrogen,кат.10131-027) и 0,1 мг/мл гигромицина (Invitrogen, кат.10687-010). Эти клональные клеточные линии оценивали по текущей экспрессии, опосредованной CaV2.2 /3, с применением электрофизиологической технологии планарной матрицы IonWorks (описанной ниже). Определяли клональную линию,которая проявляла приемлемый уровень текущей экспрессии функционального CaV2.2 /3. Эту клеточную линию трансфицировали плазмидным вектором для экспрессии человеческой субъединицы 21(pCIP-21, которая несет маркер устойчивости к пуромицину), выделяли клональные клеточные линии с последующей селекцией в среде, содержащей 0,62 мг/мл пуромицина (Sigma, кат.Р-7255), в дополнение к 0,4 мг/мл генетицина G418 и 0,1 мг/мл гигромицина. Были идентифицированы несколько клеточных линий, которые показывали надежные уровни текущей экспрессии, опосредованной CaV2.2/3/21, и одну из них отобрали для анализа профиля соединений. Экспрессию всех трех субъединиц в указанной клеточной линии поддерживали непрерывно путем включения в нее G418 (0,4 мг/мл), гигромицина (0,1 мг/мл) и пуромицина (0,62 мг/мл). Клетки находились при 37C в увлажненной среде, содержащей 5% CO2 в воздухе. Клетки доставали из культуральных флаконов Т 175 для пассажа и сбора с использованием TrpLE (Invitrogen, кат.12604-013). Подготовка клеток. Клетки выращивали до конфлюентности 30-60% во флаконах Т 175 и сохраняли при 30C в течение 24 ч перед считыванием данных. Клетки поднимали посредством удаления ростовой среды, промывали фосфатно-буферным раствором (ФБР), не содержащим Ca2+ (Invitrogen, кат.14190-094) и инкубировали с 3 мл подогретого (37C) TrpLE (Invitrogen, кат.12604-013) в течение 6 мин. Снятые клетки суспендировали в 10 мл внеклеточного буфера. Клеточную суспензию затем помещали в пробирку объемом 15 мл и центрифугировали в течение 2 мин при 700 об/мин. После центрифугирования удаляли супернатант и клеточный дебрис ресуспендировали в 4,5 мл внеклеточного раствора. Электрофизиология. Потоки регистрировали при комнатной температуре (21-23C) с применением электрофизиологической технологии планарной матрицы IonWorks (Molecular Devices Corp.). Протоколы возбуждения и получение и накопление осуществляли с использованием микрокомпьютера (Dell Pentium 4). Для определения сопротивления отверстия плоским электродом (Rp) на каждое отверстие в течение 160 мс воздействовали разностью потенциалов 10 мВ. Эти измерения проводили перед добавлением клеток. После добавления клеток проводили тест на герметичность перед введением антибиотика (амфотерицина), чтобы достичь внутриклеточного доступа. Вычитание утечек проводили во всех экспериментах с помощью 160 мс гиперполяризующего (10 мВ) подготовительного импульса 200 мс перед тестовым импульсом,чтобы измерить проводимость утечки. В течение 20 мс воздействовали тестовыми импульсами с шаговым изменением от исходного потенциала (VH) -90 до 10 мВ и повторяли воздействие 10 раз с частотой 10 Гц. Во всех экспериментах протокол тестовых импульсов выполняли при отсутствии соединения(предварительное считывание) и в присутствии соединения (постсчитывание). Пред- и постсчитывание были разделены посредством добавления соединения с последующим инкубированием в течение 3-3,5 мин. Растворы и лекарственные средства. Внутриклеточный раствор содержал следующее (в мМ): K-глюконат - 120, KCl - 20, MgCl2 - 5,EGTA - 5, HEPES - 10, с уровнем рН, регулируемым до 7,3. Амфотерицин был приготовлен в виде стокового раствора 30 мг/мл, который разводили до конечной рабочей концентрации во внутриклеточном буферном растворе 0,2 мг/мл. Внеклеточный раствор содержал следующее (в мМ): Na-глюконат - 120,NaCl - 20, MgCl2 - 1, HEPES - 10, BaCl2 - 5, уровень pH регулировали до 7,4. Соединения приготавливали в ДМСО в виде 10 мМ стоковых растворов и затем осуществляли последовательные разведения 1:3. В итоге соединения во внешнем растворе разводили 1:100, что давало конечную концентрацию ДМСО 1%. Анализ данных. Данные анализировали и фильтровали, используя сопротивление печати (40 M), уменьшение сопротивления (35%) и пиковую амплитуду тока (200 пА) в отсутствие соединения, чтобы устранить от дальнейшего анализа неподходящие клетки. Применяли парные сравнения между данными перед добавлением соединения и после добавления соединения, чтобы определить ингибирующий эффект каждого соединения. Концентрации соединений, необходимые для подавления 50% тока, вызываемого первым деполяризующим импульсом (тоник(tonic)pIC50), были определены, применяя уравнения Хилла к данным зависимости от концентрации. Дополнительно, определяли зависимые от использования ингибирующие свойства соединений с помощью оценки эффекта соединений на 10-й деполяризующий импульс по сравнению с их эффектом на первый импульс. Отношение эффекта 10- и 1-го импульсов определяли в отсутствие и в присутствии лекарственного средства и рассчитывали % подавления зависимости от использования. Подбор данных осуществляли с применением того же уравнения, что и для расчета тоникpIC50, и определяли концентрацию, дающую 30% подавление (зависимое от использования pUD30). Соединения примера 1 тестировали в анализе hCaV2.2, и они показывали следующие значенияpUD30 и pIC50. Соединения тестировали в форме, которая соответствует их описанию в примерах. Все тестированные соединения анализировали один или более раз (до 11 раз). Между тестами могли возникать изменения значений pUD30 и pIC50. Соединения примера 1 показывали значение pUD30 5,5 или более чем 5,5. Соединения примера 1 показывали среднее значение pIC50 4,5 или менее чем 4,5. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, которое представляет собой (2S)-2-метил-1-[(2-метил-3-пиридинил)карбонил]-4-[4(трифторметил)фенил]сульфонилпиперазин или его фармацевтически приемлемую соль формулы(2S)-2-метил-1-[(2-метил-3 пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин или (2S)-2-метил-1-[(2-метил 3-пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин гидрохлорид. 3. Соединение по п.1 или 2, которое представляет собой (2S)-2-метил-1-[(2-метил-3 пиридинил)карбонил]-4-[4-(трифторметил)фенил]сульфонилпиперазин. 4. Фармацевтическая композиция, предназначенная для лечения боли, содержащая (a) соединение или его фармацевтически приемлемую соль по любому из пп.1-3 и (b) фармацевтически приемлемый наполнитель. 5. Применение соединения или его фармацевтически приемлемой соли по любому из пп.1-3 для лечения боли. 6. Применение по п.5, где указанная боль включает острую боль, хроническую боль, хроническую суставную боль, скелетно-мышечную боль, нейропатическую боль, воспалительную боль, висцеральную боль, боль, связанную с раком, боль, связанную с мигренью, головную боль напряжения и кластерные головные боли, боль, связанную с функциональными нарушениями кишечника, боль в нижнем отделе спины и боль в шее, боль, связанную с растяжениями связок и сухожилий, симпатически поддерживаемую боль; миозит, боль, связанную с гриппом или другими вирусными инфекциями, например с простудой, боль, связанную с ревматической атакой, боль, связанную с ишемией миокарда, послеоперационную боль, боль при химиотерапии рака, головную боль, зубную боль и дисменорею. 7. Применение по п.6, где указанная боль представляет собой нейропатическую боль. 8. Применение по п.6, где указанная боль представляет собой боль в нижнем отделе спины и боль в шее. 9. Применение по п.5 или 6, где указанная боль представляет собой воспалительную боль или хроническую суставную боль, включающую ревматоидный артрит, остеоартрит, ревматоидный спондилит,подагрический артрит и ювенильный артрит. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/4409, A61P 25/00, A61K 31/4402, A61K 31/44, C07D 213/81
Метки: канала, cav2.2, производные, качестве, пиперазина, применяемые, кальциевого, модуляторов
Код ссылки
<a href="https://eas.patents.su/12-18621-proizvodnye-piperazina-primenyaemye-v-kachestve-modulyatorov-kalcievogo-kanala-cav22.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперазина, применяемые в качестве модуляторов кальциевого канала cav2.2</a>
Предыдущий патент: Производные тиенотриазолодиазепина, активные в отношении apo a1
Следующий патент: Устройство для нагрева воды, предназначенное для водопроводящего бытового прибора, и бытовой прибор с таким устройством
Случайный патент: Способ переработки для повторного использования изделий на основе армированного волокном полимера












