Ингибиторы синтазы оксида азота
Номер патента: 2033
Опубликовано: 24.12.2001
Авторы: Ноулс Ричард Грэм, Френзмен Карл Витолд, Френд Энтони Джозеф, Ходсон Хэролд Фрэнсис, Бимз Ричард Менсфилд, Риз Дэрил Дейвид, Дрисдейл Мартин Джеймс, Сойер Дейвид Алан
Формула / Реферат
1. Соединение формулы (I)
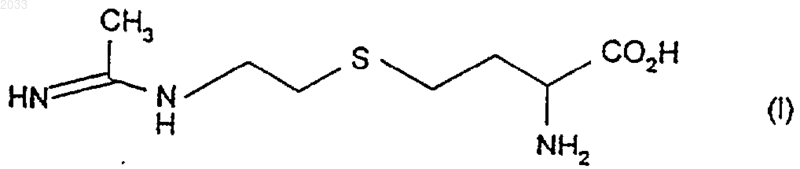
или его соль, сольват или физиологически функциональное производное.
2. Соединение формулы (I), выбранное из
(R,S)-[2-(1-иминоэтиламино)этил]-DL-гомоцистеина,
(S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеина и
(R)-[2-(1-иминоэтиламино)этил]-D-гомоцистеина или его соль, сольват или физиологически функциональное производное.
3. Соединение формулы (I), которое представляет собой (S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеин или его соль, сольват или физиологически функциональное производное.
4. Способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, при котором вводят терапевтически эффективное количество соединения формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного.
5. Способ по п.4, при котором клиническое состояние выбрано из артрита, астмы, илеуса и мигрени.
6. Соединение формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для применения в медицинской терапии.
7. Фармацевтический препарат, содержащий соединение формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один другой терапевтический ингредиент.
8. Применение соединения формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного в производстве лекарства для профилактики или лечения клинического состояния, для которого показан ингибитор синтазы оксида азота.
9. Применение по п.8, при котором клиническое состояние выбрано из артрита, астмы, илеуса и мигрени.
10. Способ получения соединения формулы (I) или его соли, сольвата или физиологически функционального производного, который включает в себя:
(1) взаимодействие соединения формулы (II)
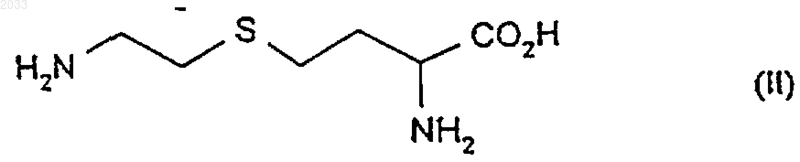
или его энантиомера, соли или защищенного производного с соединением формулы (III)

или его соли, где L представляет собой отщепляемую группу, с последующими стадиями, следующими в любом порядке;
(2) возможное удаление любых защитных групп;
(3) возможное отделение энантиомера от смеси энантиомеров;
(4) возможное превращение продукта в соответствующие его соль, сольват или физиологически функциональное производное.
11. Соединение, выбранное из
(R,S)-7N-бензилоксикарбонил-2,7-диамино-5-тиогептановой кислоты,
(S)-2N-трет-бутоксикарбонил-2,7-диамино-5-тиогептановой кислоты,
(S)-трет-бутил-2N-трет-бутоксикарбонил-7N-бензилоксикарбонил-2,7-диамино-5-тиогептаноата,
(S)-трет-бутил-2N-трет-бутоксикарбонил-2,7-диамино-5-тиогептаноата,
(R,S)-трет-бутил-2N-трет-бутоксикарбонил-7N-бензилоксикарбонил-2,7-диамино-5-тиогептаноата и
(R,S)-трет-бутил-2N-трет-бутоксикарбонил-2,7-диамино-5-тиогептаноата.
Текст
1 Настоящее изобретение относится к новым амидиносоединениям, к способу их производства, к содержащим их фармацевтическим композициям и к их применению в терапии, в частности их применению в качестве селективных ингибиторов индуцибельной синтазы оксида азота. Оксид азота является эндогенным стимулятором растворимого фермента гуанилатциклазы, и он вовлечен в ряд биологических действий. Считается также, что избыточное продуцирование оксида азота вовлечено в ряд состояний, в том числе септический шок и многие воспалительные заболевания. Фермент синтазаNO (оксида азота) катализирует биохимический синтез оксида азота из L-аргинина. Многие ингибиторы синтазы NO были описаны и предложены для терапевтического применения. Еще недавно в этой области ставилась задача обеспечить ингибиторы синтазы NO, проявляющие селективность в отношении либо индуцибельной синтазы NO (iNOS), либо нейрональной синтазы NO (nNOS) по сравнению с эндотелиальной синтазой NO (eNOS). Так, известны [WO 93/13055] селективные ингибиторы синтазы NO формулы и их соли и фармацевтически приемлемые сложные эфиры и амиды, в которых:R1 представляет собой C1-6 алкильную группу с нормальной или разветвленной цепью,С 2-6 алкенильную группу,С 2-6 алкинильную группу, С 3-6 циклоалкильную группу или С 3-6 циклоалкилС 1-6 алкильную группу;Q представляют собой группу алкилен, алкенилен или алкинилен, имеющую от 3 до 6 атомов углерода, которая возможно может быть замещена одной или более чем одной C1-3 алкильной группой; группу формулы -(CH2)pX(CH2)q, где р равно 2 или 3, q равно 1 или 2, а Х представляет собой S(O)x, где х равно 0, 1 или 2, О или NR2,где R2 представляет собой Н или С 1-6 алкил; или группу формулы -(СН 2)rА(СН 2)s, где r равно 0, 1 или 2, s равно 0, 1 или 2, а А представляет собой 3-6-членное карбоциклическое или гетероциклическое кольцо, которое возможно может быть замещено одним или более чем одним подходящим заместителем, таким как С 1-6 алкил, C1-6 алкокси, гидрокси, галогено, нитро,циано, трифторС 1-6 алкил, амино, C1-6 алкиламино или диС 1-6 алкиламино. В настоящее время мы обнаружили соединения, попадающие в объем WO 93/13055, которые, также являясь селективными ингибиторами iNOS, обнаруживают преимущества, которые заключаются в том, что они обладают длительным периодом полужизни и перорально биодоступны при введении in vivo. Поэтому, в соответствии с настоящим изобретением, предложено соединение формулы (I) или его соль, сольват или физиологически функциональное производное. Формула (I) включает в себя асимметрический центр в аминокислотной группе, и хотя предпочтительна природная L или (S) конфигурация аргинина, предполагается, что формула(I) включает в себя как (S), так и (R) энантиомеры либо в по существу чистой форме, либо смешанные в любых соотношениях. Таким образом, альтернативно, согласно настоящему изобретению предложено соединение, выбранное из(R,S)-[2-(1-иминоэтиламино)этил]-DLгомоцистеина,(S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеина,(R)-[2-(1-иминоэтиламино)этил]-D-гомоцистеина и его соли, сольваты и физиологически функциональные производные. В предпочтительном аспекте настоящего изобретения предложен (S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеин или его соль, сольват или физиологически функциональное производное. В особенно предпочтительном аспекте настоящего изобретения предложен (S)-[2-(1 иминоэтиламино)этил]-L-гомоцистеин или его соль. Соли и сольваты соединений формулы (I),которые пригодны для применения в медицине,представляют собой соли или сольваты, в которых противоион или ассоциированный растворитель является фармацевтически приемлемым. Однако соли и сольваты, имеющие нефармацевтически приемлемые противоионы или ассоциированные растворители, находятся в объеме настоящего изобретения, например для применения в качестве промежуточных соединений при получении других соединений формулы (I) и их фармацевтически приемлемых солей, сольватов и физиологически функциональных производных. Под термином "физиологически функциональное производное" подразумевается химическое производное соединения формулы (I), обладающее той же самой физиологической функцией, что и свободное соединение формулы (I),например производное, способное превращаться в свободное соединение формулы (I) в организме. В соответствии с настоящим изобретением примеры физиологически функциональных производных включают в себя сложные эфиры,амиды и карбаматы; предпочтительно сложные эфиры и амиды. Подходящие соли по изобретению включают в себя соли, которые образованы как с органическими, так и с неорганическими кислотами, или с основаниями. Фармацевтически приемлемые соли, образованные присоединением кислоты, включают в себя соли, которые обра 3 зованы из хлороводородной, бромоводородной,серной, лимонной, винной, фосфорной, молочной, пировиноградной, уксусной, трифторуксусной, янтарной, щавелевой, фумаровой, малеиновой, щавелевоуксусной, метансульфоновой, этансульфоновой, п-толуолсульфоновой,бензолсульфоновой и изэтионовой кислоты. Фармацевтически приемлемые соли оснований включают в себя аммониевые соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, и соли с органическими основаниями, такие как дициклогексиламинные и N-метил-D-глутаминные. Фармацевтически приемлемые сложные эфиры и амиды соединений формулы (I) могут включать в себя кислотную группу, превращенную в C1-6 алкил, арил, арилС 1-6 алкил, или сложный эфир аминокислоты или амид. Фармацевтически приемлемые амиды и карбаматы соединений формулы (I) могут иметь аминогруппу,превращенную в C1-6 алкил, арил, арилС 1-6 алкил,или амид аминокислоты или карбамат. Как упомянуто выше, соединения формулы (I) представляют собой ингибиторы синтазыNO, что продемонстрировано ниже в тестах на ингибирование NOS. Таким образом, соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и физиологически функциональные производные имеют применение при профилактике и лечении клинических состояний, для которых показан ингибитор синтазы NO, в частности ингибитор iNOS. Такие состояния включают в себя воспалительные состояния, шоковые состояния, иммунные расстройства и расстройства желудочно-кишечной проходимости. Соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и физиологически функциональные производные можно также применять при профилактике и лечении заболеваний центральной нервной системы, в том числе мигрени. Под шоковыми состояниями подразумеваются состояния, которые являются результатом избыточного продуцирования NO, такие как септический шок, геморрагический шок, травматический шок или шок, вызванный скоротечной печеночной недостаточностью или терапией цитокинами, такими как TNF (фактор некроза опухоли), IL-1(интерлейкин-1) и IL-2 (интерлейкин-2), или терапией агентами, индуцирующими цитокины, например 5,6-диметилксантенонуксусной кислотой. Примеры воспалительных состояний и иммунных расстройств включают в себя воспалительные состояния и иммунные расстройства суставов, в частности артрит (например ревматоидный артрит, остеоартрит, повреждение суставов при протезировании), или желудочнокишечного тракта (например язвенный колит,болезнь Крона и другие воспалительные заболе 002033 4 вания пищеварительного тракта, гастрит и воспаление слизистой оболочки, являющееся следствием инфекции, энтеропатии, спровоцированной нестероидными противовоспалительными лекарственными средствами), легких (например,респираторный дистресс-синдром взрослых,астма, муковисцидоз или хроническое обструктивное заболевание легких), сердца (например,миокардит), нервной ткани (например, множественный склероз), поджелудочной железы (например, сахарные диабеты и их осложнения),почек (например, гломерулонефрит), кожи (например, дерматит, псориаз, экзема, крапивница),глаз (например, глаукома), а также трансплантированных органов (например, отторжение), и заболевания многих органов (например, системная красная волчанка), и воспалительное осложнение вирусных или бактериальных инфекций. Кроме того, имеется доказательство избыточного продуцирования NO индуцибельной синтазой NO при атеросклерозе и последующих гипоксических или ишемических инсультах(протекающих с или без реперфузии), например при заболевании головного мозга или при ишемической болезни сердца. Расстройства желудочно-кишечной проходимости включают в себя илеус, например послеоперационный илеус и илеус во время сепсиса. Под заболеваниями центральной нервной системы подразумеваются заболевания, в которые вовлечено избыточное продуцирование NO,например мигрень, психоз, тревога, шизофрения, расстройства сна, церебральная ишемия,травма ЦНС, эпилепсия, множественный склероз, деменция при СПИДе, хроническое нейродегенеративное заболевание (например, деменция Lewy Body, болезнь Гантингтона, болезнь Паркинсона или болезнь Альцгеймера) и острая и хроническая боль, и состояния, в которые может быть вовлечен неадренергический нехолинергический нерв, такие как приапизм, ожирение и гиперфагия. Примеры острой боли включают в себя скелетно-мышечную боль, послеоперационную боль и хирургическую боль. Примеры хронической боли включают в себя хроническую воспалительную боль (например, ревматоидный артрит и остеоартрит), невропатическую боль (например, невралгию после герпеса, диабетические невропатии, ассоциированные с диабетами,тригеминальную невралгию, боль, ассоциированную с функциональными расстройствами пищеварительного тракта, например, синдром раздраженной кишки, не кардиологическая боль в груди и симпатически поддерживаемая боль) и боль, ассоциированная с раком и фибромиалгией. Кроме того, ингибирование синтазы NO может иметь преимущество в предотвращении потери лимфоцитов, связанной с ВИЧ-инфе 5 кцией, в повышении радиочувствительности опухолей во время радиотерапии и в уменьшении роста опухоли, прогрессирования опухоли,ангиогенеза и метастазирования. Соответственно согласно настоящему изобретению предложен способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, например ингибитор iNOS, при котором вводят терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного. В частности,согласно настоящему изобретению предложен способ профилактики или лечения воспалительного и/или иммунного расстройства, такого как артрит или астма. В предпочтительном аспекте настоящего изобретения предложен способ профилактики или лечения клинического состояния, выбранного из артрита, астмы, илеуса и мигрени. Альтернативно предложено также соединение формулы (I) или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для применения в медицинской терапии, в частности для применения при профилактике или лечении клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, например ингибитор iNOS. В частности, предложено соединение формулы (I) или его фармацевтически приемлемая соль,сольват или физиологически функциональное производное для профилактики или лечения воспалительного и/или иммунного расстройства, такого как артрит или астма. В предпочтительном аспекте предложено соединение формулы (I) или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для профилактики или лечения артрита, астмы, илеуса и мигрени. Количество соединения формулы (I) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного, которое требуется для достижения терапевтического эффекта, будет, конечно,варьировать в зависимости от конкретного соединения, пути введения, субъекта, которого лечат, и конкретного расстройства или заболевания, которое лечат. Соединения по изобретению можно вводить перорально или посредством инъекции в дозе от 0,1 до 1500 мг/кг в сутки, предпочтительно от 0,1 до 500 мг/кг в сутки. Интервал дозы для взрослых людей обычно составляет от 5 мг до 35 г/сутки и предпочтительно от 5 мг до 2 г/сутки. Таблетки или другие формы предъявления, предоставляемые в виде раздельных единиц, приемлемо могут содержать соединение по изобретению в количестве,которое является эффективным при такой дозировке, или в виде множества одинаковых, на 002033 6 пример, единиц, содержащих от 5 мг до 500 мг,обычно от приблизительно 10 мг до 200 мг. Хотя возможно вводить соединение формулы (I) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное само по себе, предпочтительно представлять его в виде фармацевтического препарата. Соответственно, согласно настоящему изобретению предложен также фармацевтический препарат, содержащий соединение формулы (I) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один другой терапевтический ингредиент. Согласно настоящему изобретению предложено также применение соединения формулы(I) или его фармацевтически приемлемой соли,сольвата или физиологически функционального производного в производстве лекарства для профилактики или лечения клинического состояния, для которого показан ингибитор синтазы оксида азота, например ингибитор iNOS, например, воспалительного и/или иммунного расстройства, такого как артрит или астма. В предпочтительном аспекте предложено применение соединения формулы (I) или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное в производстве лекарства для профилактики или лечения клинического состояния, выбранного из артрита, астмы, илеуса и мигрени. В этом документе термин "активный ингредиент" означает соединение формулы (I) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное. Препараты включают в себя препараты,пригодные для перорального, парентерального(в том числе подкожного, внутрикожного, внутримышечного, внутривенного и внутрисуставного), ингаляционного (в том числе тонкодисперсные пыли или туманы, которые могут быть созданы при помощи различных типов находящихся под давлением аэрозолей с отмеренной дозой, распылителей или инсуффляторов), ректального и местного (в том числе дермального,буккального, подъязычного и внутриглазного) введения, хотя наиболее подходящий путь может зависеть, например, от состояния и расстройства реципиента. Препараты приемлемо могут быть представлены в стандартной лекарственной форме и могут быть приготовлены любым из способов, хорошо известных в области фармации. Все способы включают в себя стадию соединения активного ингредиента с носителем, который состоит из одного или более чем одного вспомогательного ингредиента. Как правило, препараты готовят равномерным и однородным соединением ингредиента с жид 7 кими носителями или тонко измельченными твердыми носителями, или обоими, а затем, если необходимо, формованием продукта в желаемый препарат. Препараты по настоящему изобретению,пригодные для перорального введения могут быть представлены в виде раздельных единиц,таких как капсулы, облатки или таблетки, каждая из которых содержит предопределенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент может быть также представлен в виде болюса, электуария или пасты. Таблетка может быть изготовлена прессованием или формованием, возможно с использованием одного или более чем одного вспомогательного ингредиента. Прессованные таблетки могут быть приготовлены прессованием на подходящей машине активного ингредиента в сыпучей форме, такой как порошок или гранулы, возможно смешанного со связующим, смазочным материалом, инертным разбавителем,смазывающим, поверхностно-активным или деспергирующим агентом. Формованные таблетки могут быть изготовлены формованием на подходящей машине смеси порошкообразного соединения, увлажненного жидким инертным разбавителем. Таблетки возможно могут быть покрыты, или на них могут быть сделаны метки,и могут быть приготовлены так, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента. Препараты для парентерального введения включают в себя водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые делают препарат изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загустители. Препараты могут быть представлены в однодозовых или многодозовых контейнерах, например, запаянных ампулах и виалах, и могут храниться в лиофилизированном состоянии, требующем лишь добавления стерильного жидкого носителя, например физиологического раствора или воды для инъекций, непосредственно перед применением. Растворы и суспензии для незапланированной инъекции могут быть приготовлены из стерильных порошков, гранул и таблеток того вида, который был описан ранее. Препараты для ректального введения могут быть представлены в виде суппозитория с обычными носителями, такими как масло какао или полиэтиленгликоль. Препараты для местного введения в рот,например буккального или подъязычного,включают в себя лепешки, содержащие актив 002033 8 ный ингредиент в корригентной основе, такой как сахароза и аравийская камедь или трагакант,и пастилки, содержащие активный ингредиент в основе, такой как желатин и глицерин или сахароза и аравийская камедь. Предпочтительные стандартные лекарственные препараты представляют собой препараты, которые содержат эффективную дозу, такую как изложено ранее, или ее соответствующую долю, активного ингредиента. Следует понимать, что вдобавок к ингредиентам, особо упомянутым выше, препараты по данному изобретению могут включить в себя другие агенты, традиционные в данной области техники, имеющие отношение к типу обсуждаемого препарата, например препараты, которые пригодны для перорального введения, могут включать в себя корригенты. Согласно следующему аспекту изобретения предложен способ получения соединения формулы (I) или его соли, сольвата или физиологически функционального производного, который включает в себя: или его энантиомера, соли или защищенного производного с соединениемформулы (III) или его солью, где L представляет собой отщепляемую группу, наиболее приемлемо C1-6 алкоксигруппу, например этокси- или алкилтио-,аралкилтио- или арилтиогруппу, например бензилтио- или 1- или 2-нафтилметилтиогруппу; с последующими стадиями, следующими в любом порядке:(2) возможное удаление любых защитных групп;(3) возможное отделение энантиомера от смеси энантиомеров;(4) возможное превращение продукта в его соответствующую соль, сольват или физиологически функциональное производное. Когда L представляет собой C1-6 алкокси,взаимодействие на стадии (i), описанной выше,может быть осуществлено в растворе при щелочном рН, например рН от 8 до 11, приемлемо при рН 10,5, и при низкой температуре, например от -5 до 20 С, приемлемо от 0 до 5 С. КогдаL представляет собой алкилтио-, аралкилтиоили арилтиогруппу, взаимодействие может быть осуществлено в органическом растворителе,например тетрагидрофуране или С 1-4 спирте,таком как этанол, при умеренной температуре,например от 10 до 40 С, приемлемо при комнатной температуре. Соединения формулы (III) и их соли коммерчески доступны или могут быть получены 9 способами органической химии, хорошо известными специалистам в данной области техники,например, как описано Shearer et al. в Tetrahedron Letters, 1997, 38, 179-182. Соединения формулы (II) и соли и их защищенные производные могут быть получены из гомоцистеина или его защищенного производного расщеплением дисульфидной связи с образованием гомоцистеина или его защищенного производного и сочетанием с соединением формулы (IV) или его защищенным производным, где L1 представляет собой отщепляемую группу, например галогено, такую как бромо, или алкил,арил или эфирную аралкилсульфонатную группу, такую как толуолсульфонил. Расщепление дисульфидной связи гомоцистена или его защищенного производного с образованием гомоцистеина или его защищенного производного может быть осуществлено способами, известными специалистам в данной области техники, например с использованием натрия в жидком аммиаке, дитиотрейтола или борогидрида натрия. Защищенные производные гомоцистеина,например трет-бутиловый эфир N-трет-бутоксикарбонилгомоцистеина, могут взаимодействовать с соединениями формулы (IV) в условиях подходящего органического растворителя (например, толуола) по реакции, опосредованной основанием, таким как 1,8-диазобицикло[5.4.0] ундец-7-ен или подобным агентом, который может знать квалифицированный специалист. Гомоцистеин, соединения формулы (IV) и его защищенные производные коммерчески доступны или могут быть получены способами органической химии, хорошо известными специалистам в данной области техники. Защитные группы, используемые при получении соединений формулы (I), могут быть использованы традиционным образом, например с использованием известных способовSons, 1991)]; в этой публикации описаны также способы удаления таких групп. В вышеуказанных реакциях первичные амины подходящим образом защищают, используя ацильные группы, такие как третбутоксикарбонильная или бензилоксикарбонильная группа, которые могут быть удалены в кислотных условиях, например обработкой хлороводородной кислотой или бромоводородной кислотой, или гидрогенолизом. Специалисту в данной области техники ясно, что использование таких защитных групп может включать в себя ортогональную защиту 10 аминогрупп в соединениях формулы (II) для облегчения селективного удаления одной группы в присутствии другой, делая таким образом возможной селективную функционализацию одной функциональной аминогруппы. Например, бензилоксикарбонильная группа может быть селективно удалена гидрогенолизом. Специалисту в данной области техники понятны также другие стратегии ортогональной защиты,доступные с помощью традиционных средств,как описано Theodora W. Green (смотри выше). Энантиомерные соединения по изобретению могут быть получены а) разделением компонентов соответствующей рацемической смеси, например при помощи хиральной хроматографической колонки, методами ферментного разделения или получением и разделением соответствующих диастереоизомеров, или б) прямым синтезом из соответствующих хиральных промежуточных соединений способами, описанными выше. Возможное превращение соединения формулы (I) в соответствующую соль может быть удобно осуществлено путем взаимодействия с соответствующей кислотой или основанием. Возможное превращение соединения формулы(I) в соответствующий сольват или физиологически функциональное производное может быть осуществлено способами, известными специалистам в данной области техники. Согласно следующему аспекту настоящего изобретения предложены новые промежуточные соединения для получения соединений формулы(I), например соединение формулы (II), как оно определено выше, или его энантиомер, соль или защищенное производное; в частности соединение, выбранное из(R,S)-трет-бутил-2N-трет-бутоксикарбонил-2,7-диамино-5-тиогептаноата. Некоторые защищенные производные соединений формулы (I) также полезны в качестве промежуточных соединений для получения соединений формулы (I), в частности соединение,выбранное из(S)-2N-трет-бутоксикарбонил-7N-(1-иминоэтил)-2,7-диамино-5-тиогептановой кислоты,(S)-трет-бутил-2N-трет-бутоксикарбонил 7N-(1-иминоэтил)-2,7-диамино-5-тиогептаноата,(R,S)-2N-трет-бутоксикарбонил-7N-(1 иминоэтил)-2,7-диамино-5-тиогептановой кислоты,(R,S)-трет-бутил-2N-трет-бутоксикарбонил-7N-(1-иминоэтил)-2,7-диамино-5-тиогептаноата и его соли и сольваты. Для лучшего понимания изобретения в качестве иллюстрации приведены следующие примеры. Примеры синтеза Пример 1. Синтез (S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеина или (S)-7N-(1 иминоэтил)-2,7-диамино-5-тиогептановой кислоты(1) (S)-7N-Бензилоксикарбонил-2,7-диамино-5-тиогептановая кислота. К жидкому аммиаку (130 мл), охлажденному до -80 С, добавляли L-гомоцистеин (3 г),затем добавляли металлический натрий (1,06 г) до тех пор, пока голубое окрашивание на будет сохраняться в течение 15 мин. После этого периода времени добавляли N-бензилоксикарбонил-этаноламинатозилат (8,16 г), и реакционную смесь перемешивали при температуре окружающей среды до тех пор, пока аммиак не испарится. Остаток растворяли в воде (80 мл) и обрабатывали 0,5 М натриевой солью ЭДТА(этилендиаминтетраацетат натрия) (2 мл). рН раствора доводили до 7,0 2 н. серной кислотой, и полученный белый осадок отфильтровывали,промывали холодной водой и ацетоном и сушили в вакуумном эксикаторе с получением указанного в заголовке соединения в виде белого твердого вещества, 5,3 г. Масс-спектр М+Н 313.(S)-7N-Бензилоксикарбонил-2,7-диамино 5-тиогептановую кислоту (5,3 г) обрабатывали 45% НВr в уксусной кислоте (23 мл) в течение 1 ч. Образовывалась непластичная смола, и к смеси добавляли эфир для обеспечения полного осаждения продукта. Жидкость декантировали,а твердые вещества растворяли в горячем SVM. Этот горячий раствор обрабатывали пиридином до тех пор, пока не образуется осадок, и смеси давали возможность охладиться до комнатной температуры. Полученный осадок отфильтровывали и перекристаллизовывали из смеси 12 соединения в виде белого твердого вещества,2,2 г, т.пл. 222 С (разл.).(2,17 г) перемешивали в 1 н. NaOH (16,75 мл) до рН 10,5 при 0-5 С. К этому раствору постепенно добавляли гидрохлорид этилацетимидата (2,07 г), поддерживая рН 10,5 с использованием 1 н.NaOH. Когда реакция заканчивалась, рН доводили до 3 с использованием 1 н. HCl, и смесь направляли в колонку Dowex AGX8 с ионообменной смолой в Н+-форме. Колонку промывали до нейтрального рН, затем 2,5 М пиридином и снова водой до нейтрального рН. Элюирование 0,5 М аммиаком и сбор нингидрин-позитивных фракций выполняли после выпаривания. Полученный остаток обрабатывали 1 н. HCl до рН 4,5 и выпаривали досуха. Остаток затем обрабатывали этанолом и выпаривали досуха, а затем диэтиловым эфиром и выпаривали досуха с получением моногидрохлорида указанного в заголовке соединения в виде густой белой пены. Микроанализ продукта соответствовал 1,75 гидрату. Найдено (вычислено): С 33,56 (33,45); Н 7,11(7,49); N 13,74(14,63). Пример 2.H ЯМР продукта соответствовал предлагаемой структуре. Пример 2 а. Рацемический продукт примера 2 тщательно растворяли в двух составляющих энантиомерах [идентичных продукту (S) в примерах 1 и 4 и продукту (R) в примере 3], используя хиральную колонку ВЭЖХ Crownpac(+) и элюирование водной трифторуксусной кислотой при рН 2.(S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеин. Микроанализ продукта соответствовал гидрату дитрифторацетатной соли C8H17N3O2S(R)-[2-(1-Иминоэтиламино)этил]-D-гомоцистеин. Микроанализ продукта соответствовал солевой форме. 1,67 трифторацетат.0,3 HCl.1,5 гидрат С 8 Н 17N3O2S(СF3 СO2 Н)1,67 НСl0,31,5 Н 2O. Найдено (вычислено): С 30,18 (30,40); Н 4,92 (4,97); N 9,53 (9,41); S 7,41 (7,18); Cl 1,86(1) (S)-7N-Бензилоксикарбонил-2,7-диамино-5-тиогептановая кислота. К жидкому аммиаку (430 мл), охлажденному до -80 С, добавляли L-гомоцистеин (10 г,37,45 ммоль). Охлаждающую баню удаляли и постепенно добавляли металлический натрий(3,18 г, 138,26 ммоль) в течение свыше 25 мин,давая возможность температуре подняться до температуры дефлегмации. Перемешивание продолжали при дефлегмации в течение дополнительных 30 мин, после которых добавляли Nбензилоксикарбонил-этаноламин-тозилат (25 г,74,9 ммоль), и реакционную смесь перемешивали при температуре окружающей среды в течение ночи до тех пор, пока не испарится аммиак. Остаток перемешивали с водой (250 мл) при 40 С в течение 10 мин, охлаждали до комнатной температуры и отфильтровывали. рН раствора доводили до 7,0 2 М серной кислотой, и полученный белый осадок отфильтровывали, промывали холодной водой и ацетоном и сушили в вакуумном эксикаторе с получением (S)-7Nбензилоксикарбонил-2,7-диамино-5-тиогептановой кислоты в виде белого твердого вещества,т.пл. 240 С (разл.).(2) (S)-2N-Трет-бутоксикарбонил-7N-бензилоксикарбонил-2,7-диамино-5-тиогептановая кислота. К гидроксиду натрия (6,357 г, 159 ммоль) в воде (110 мл) добавляли (S)-7N-бензилоксикарбонил-2,7-диамино-5-тиогептановую кислоту (15,5 г, 49,67 ммоль), затем добавляли диоксан (55 мл). К этой смеси добавляли дитрет-бутилдикарбонат (16,26 г, 74,5 ммоль), и смесь перемешивали в течение ночи при комнатной температуре под азотом. После этого периода времени осажденные твердые вещества отфильтровывали, добавляли толуол (300 мл), и слои разделяли. Водный слой охлаждали и подкисляли до рН 3 с использованием 1 н. HCl. Подкисленную фракцию экстрагировали толуолом (4 х 100 мл) и этилацетатом (3 х 100 мл), и объединенные органические фракции сушили над MgSO4. Объединенные органические вещества концентрировали при пониженном давлении с получением (S)-2N-трет-бутоксикарбонил-7N-бензилоксикарбонил-2,7-диамино-5 тиогептановой кислоты в виде белой смолы. Масс-спектр М+Н 413.(0,678 г) всю сразу. К этому охлажденному рас 002033 14 твору добавляли смесь метанола (50 мл) и муравьиной кислоты (11 мл, 196 ммоль) за период 1 мин,затем добавляли(S)-2N-третбутоксикарбонил-7N-бензилоксикарбонил-2,7 диамино-5-тиогептановую кислоту (2 г, 4,85 ммоль) в метаноле (50 мл) за период 2 мин. Смеси давали возможность перемешиваться в течение ночи при температуре окружающей среды, добавляли еще палладиевой черни (257 мл), и перемешивание продолжали в течение дополнительных 3 часов. Реакционную смесь фильтровали через Hyflo и концентрировали при пониженном давлении. Остаток распределялся между водой и этилацетатом, водный слой промывали дополнительным этилацетатом,и водный слой концентрировали с получением формиатной соли (S)-2N-трет-бутоксикарбонил 2,7-диамино-5-тиогептановой кислоты в виде белого твердого вещества. Масс-спектр М+Н 279 (65%), 223 (100%).(2,154 г, 6,59 ммоль) в этаноле (50 мл) при комнатной температуре под азотом добавляли гидрохлорид(50 мл). При перемешивании при температуре окружающей среды твердые вещества растворялись через 2 ч, и раствор перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме, остаток обрабатывали водой, и водную фракцию промывали диэтиловым эфиром(4 х 50 мл). Концентрирование водной фракции в вакууме дало гидрохлорид(S)-2N-третбутоксикарбонил-7N-(1-иминоэтил)-2,7-диамино-5-тиогептановой кислоты в виде белого гигроскопичного твердого вещества. Масс-спектр М+Н 320 (75%), 264 (100%),220 (15%).(S)-[2-(1-Иминоэтиламино)этил]-Lгомоцистеин. К гидрохлориду (S)-2N-трет-бутоксикарбонил-7N-(1-иминоэтил)-2,7-диамино-5-тиогептановой кислоты (3,086 г, 8,69 ммоль) медленно добавляли 4 н. HCl/диоксан (20 мл), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме, остаток растворяли в воде и промывали диэтиловым эфиром (3 х 20 мл). Водный слой концентрировали в вакууме с получением указанного в заголовке соединения в форме гидрохлорида в виде гигроскопического твердого вещества. Масс-спектр М+Н 220. 1 Н ЯМР (D2O) : 2,1-2,35 (5 Н, m), 2,76 (2 Н,t), 2,87 (2 Н, t), 3,51 (2 Н, t), 4,12 (1H, t). Пример 5. Синтез (S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеина.N-бензилоксикарбонил-этаноламинтозилат (349 мг, 1 ммоль) и 1,8-диазобицикло[5.4.0]ундец-7-ен (150 мкл, 1 ммоль), и смесь энергично перемешивали в течение ночи при комнатной температуре под азотом. Смесь распределяли между этилацетатом и 1 н. воднымHCl по 50 мл каждого. Дополнительный органический экстракт объединяли, и эти экстракты промывали водным бикарбонатом натрия, водой и рассолом, затем сушили и упаривали. Очистка колоночной хроматографией привела к получению указанного в заголовке соединения. Масс-спектр М+Н 469 (25%), 369 (100%). При альтернативном способе превращение продукта из примера 4, стадия (2), в его третбутиловый эфир с использованием N,Nдиметилформамид ди-O-трет-бутилацеталя или О-трет-бутил-1,1,1-трихлорацетимидат дало указанное в заголовке соединение в виде белого кристаллического твердого вещества.(50 мл) добавляли гидроксид палладия на углероде (20%, 0,5 г) и формиат аммония (1,34 г). Суспензию нагревали с обратным холодильником в течение 2,5 ч, охлаждали и фильтровали через слой кремнезема, который хорошо промывали смесью этанол-вода 1:1, и выпаривали с получением указанного в заголовке соединения в форме формиатной соли. Масс-спектр М+Н 335.(3) Гидрохлорид (S)-трет-бутил-2N-третбутоксикарбонил-7N-(1-иминоэтил)-2,7-диамино-5-тиогептаноата. Неочищенную формиатную соль (S)-третбутил-2N-трет-бутоксикарбонил-7N-2,7-диамино-5-тиогептаноата, полученную на стадии (2),суспендировали в 50 мл тетрагидрофурана,жидкость декантировали и смешивали с гидрохлоридом(0,5 г, 2 ммоль) и перемешивали в течение 24 ч при комнатной температуре. Растворитель выпаривали, а остаток распределялся между 25 мл эфира и 25 мл воды, затем 2 раза промывали эфиром; нижние водные экстракты объединяли и выпаривали с получением белой пасты. Ее дважды сушили сублимацией с получением указанного в заголовке соединения в виде белого гигроскопичного твердого вещества.(4) (S)-S-[2-(1-Иминоэтиламино)этил]-Lгомоцистеин. Снятие защиты гидрохлорида (S)-третбутил-2N-трет-бутоксикарбонил-7N-(1-иминоэтил)2,7-диамино-5-тиогептаноата с использованием 4 н. HCl в диоксане способами, аналогичными способам, использованным в примере 4 стадия (5), дало (S)-S-[2(1-иминоэтиламино) этил]-L-гомоцистеин. Характеризующие данные для указанного в заголовке соединения соответствовали данным для продукта примера 4. Биологическая активность 1. Ингибирование eNOS и iNOS в кольцах аорты крысы. Ингибирование eNOS и iNOS in situ в кольцах аорты крысы оценивали измерением усиления натяжения в кольцах, вызванное ингибированием синтазы NO. Для исследования базального тонуса (отражающего eNOS) кольца грудной аорты с интактным эндотелием готовили как описано ранее (Rees et al. (1989) Вr. J.Pharmol. 96, 418-424), и получали совокупные концентрационные кривые для ингибиторов в присутствии следовых концентраций фенилефрина (ED10 10 нМ). Для исследования индуцированного тонуса гладкой мышцы (отражающего iNOS) кольца с оголенным эндотелием подвергли действию ЛПС (липополисахарида) (0,1 мкг/мл из S.typhosa) в присутствии фенилефрина при приблизительно ED90 в течение 6 ч как описано ранее (Rees et al. (1990) Biochem. Biophys. Res. Commun. 173. 541-547). Во время этого периода происходила прогрессивная потеря тонуса вследствие индукции iNOS. Затем получали совокупные концентрационные кривые для ингибиторов. Результаты приведены в следующей таблице:eNOS в таком же тесте. 2. Ингибирование iNOS в кортикальных срезах крысы. Эффекты соединений на iNOS в срезах головного мозга крысы определяли как описаноFurfine и др. в J. Biol. Chem. (1994) 269, 2667726683 и Lizasoain и др. в J. Neurochem. (1995) 64, 636-642. Синтез NO, стимулированный KCl (54 нМ), оценивали по превращению 14 С-аргинина в 14 С-цитруллин за период 2 ч при 37 С в сре 17 зах коры головного мозга крысы (0,2 мм х 0,2 мм), нарезанных по Mcllwain, с последующим периодом преинкубации в течение 1 ч в отсутствии соединения или высокого содержания KCl. Было определено, что соединение примера 1 имеет IC50 220 мкМ, предполагающую приблизительно 300-кратную селективность в отношении iNOS по сравнению с nNOS. 3. Способ определения пероральной биодоступности соединений-ингибиторов iNOS. Обработка животных. Мышам (трем животным на один момент времени) вводили внутривенно (10 мг/кг) и перорально (50 мг/кг) тестируемое соединение в водном растворе. Образцы крови брали через определенные интервалы времени после введения, и получали плазму центрифугированием. Образцы хранили при -20 С до анализа. Анализ соединений в плазме. Плазму (50 мкл) депротеинировали и получали производное соединения с использованием четвертично-аммониевого реагента. Образцы затем впрыскивали в систему ВЭЖХ, и определяли концентрацию соединения, используя спектрометрическое детектирование. Фармакокинетический анализ. Концентрации в плазме, полученные вышеуказанным методом, вводили в фармакокинетический пакет программных средств (PKCAL версия 1.2s), и данные соразмеряли с использованием неразделительного метода. Пероральную биодоступность соединений определяли,сравнивая величины площади под кривой(ППК), вычисленные программными средствами, для перорального профиля с величинами ППК для внутривенного профиля. Периоды полужизни получали, соразмеряя моменты времени конечной фазы внутривенного профиля. Было обнаружено, что (S)-[2-(1-иминоэтиламино)этил]-L-гомоцистеин имеет пероральную биодоступность 55% и период полужизни 5,7 ч. При повторном введении крысам внутривенных и пероральных доз 10 мг/кг (S)-[2-(1 иминоэтиламино)этил]-L-гомоцистеин имел биодоступность 92%. ФОРМУЛА ИЗОБРЕТЕНИЯ(R)-[2-(1-иминоэтиламино)этил]-D-гомоцистеина или его соль, сольват или физиологически функциональное производное. 3. Соединение формулы (I), которое представляет собой (S)-[2-(1-иминоэтиламино)этил]L-гомоцистеин или его соль, сольват или физиологически функциональное производное. 4. Способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, при котором вводят терапевтически эффективное количество соединения формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного. 5. Способ по п.4, при котором клиническое состояние выбрано из артрита, астмы, илеуса и мигрени. 6. Соединение формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для применения в медицинской терапии. 7. Фармацевтический препарат, содержащий соединение формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один другой терапевтический ингредиент. 8. Применение соединения формулы (I),как оно определено в любом из пп.1-3, или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного в производстве лекарства для профилактики или лечения клинического состояния,для которого показан ингибитор синтазы оксида азота. 9. Применение по п.8, при котором клиническое состояние выбрано из артрита, астмы,илеуса и мигрени. 10. Способ получения соединения формулы (I) или его соли, сольвата или физиологически функционального производного, который включает в себя: или его соль, сольват или физиологически функциональное производное. 2. Соединение формулы (I), выбранное из или его энантиомера, соли или защищенного производного с соединением формулы (III) или его соли, где L представляет собой отщепляемую группу, с последующими стадиями,следующими в любом порядке;(2) возможное удаление любых защитных групп;(3) возможное отделение энантиомера от смеси энантиомеров;(4) возможное превращение продукта в соответствующие его соль, сольват или физиологически функциональное производное. 11. Соединение, выбранное из
МПК / Метки
МПК: A61P 29/00, A61K 31/197, C07C 323/58
Метки: синтазы, оксида, ингибиторы, азота
Код ссылки
<a href="https://eas.patents.su/11-2033-ingibitory-sintazy-oksida-azota.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы синтазы оксида азота</a>
Предыдущий патент: Инсектицидные композиции и способы борьбы с вредителями
Следующий патент: Композиция на основе пароксетина
Случайный патент: Пакетировочно-упаковочная машина и способ пакетирования и упаковки объекта















