Способы увеличения продуцирования окиси азота.
Формула / Реферат
1. Способ увеличения продуцирования окиси азота (NO) в васкулярных эндотелиальных клетках нуждающегося в таком лечении пациента, включающий введение указанному пациенту соединения формулы I
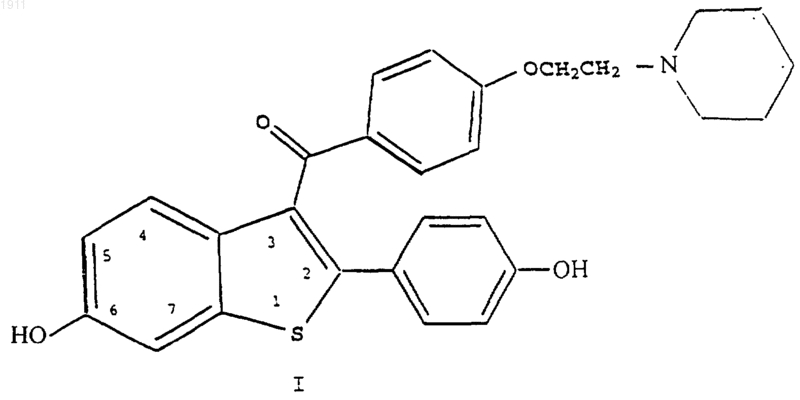
или его фармацевтически приемлемой соли или сольвата.
2. Способ по п.1, где указанным соединением формулы I является гидрохлорид [2-(4-гидроксифенил)-6-гидроксибензо[b]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанона.
3. Способ подавления физиологического состояния, связанного с отсутствием или недостатком окиси азота, либо с потребностью в окиси азота (NO), включающий введение нуждающемуся в таком лечении пациенту соединения формулы I

или его фармацевтически приемлемой соли или сольвата.
4. Способ по п.3, где указанным соединением формулы I является гидрохлорид [2-(4-гидроксифенил)-6-гидроксибензо[b]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанона.
Текст
1 Данная заявка относится к области органической химии и фармакологии и предлагает соединения и способы, позволяющие увеличить продуцирование эндотелиальной окиси азота(NO); особенно в васкулярных клетках эндотелия. Обоснование изобретения Окись азота является регуляторной молекулой, играющей жизненно важную роль в физиологии сердечно-сосудистой, кишечной, центральной нервной и иммунной систем. Окись азота синтезируется из L-аргинина посредством группы ферментов, известных как NO-синтетаза(NOS). Особенно подходящей для данного изобретения является кальций-зависимая NOS,продуцируемая в васкулярных эндотелиальных клетках, известная как eNOS. В последнее время проведены многочисленные исследования, которые связали регулирование eNOS гена с гормоном эстрогена. Показано, что эстроген полностью контролирует продуцирование eNOS mPHK и, следовательно, синтез eNOS в эндотелиальных клетках. Это увеличение количества eNOS позволяет эндотелиальным клеткам продуцировать больше NO в ответ на соответствующий стимул в сосудистой системе. В сосудистой сети NO эндотелиального происхождения оказывает ряд воздействий, среди которых ингибирование агрегации тромбоцитов, адгезия воспалительных клеток и пролиферация клеток гладкой мышцы.NO эндотелиального происхождения является важным регулятором сосудистого тонуса. Зависящая от кровотока дилатация (обычно используемый индекс эндотелиальных функций) в значительной мере опосредована NO. Механизм регулирования сосудистого тонуса посредством NO инициируется посредством воздействия стимуляторов, таких как ацетилхолин, брадикинин, стресс сдвига (shear) на эндотелиальные выстилающие клетки. Эндотелиальные клетки в ответ реагируют продуцированием NO из L-аргинина посредствомeNOS. Продуцированный NO покидает эндотелиальные клетки и стимулирует активность гуанилатциклазы в примыкающих клетках гладкой мышцы. Активация гуанилатциклазы повышает уровень cGMP и заставляет релаксировать гладкие клетки, таким образом, расширяя сосуд и увеличивая кровоток. Для дополнительной информации, см.: Moncada et al., New Eng. J. Med.,329, pp. 2002-2012 (1993) и Vallance, et. al., J.NO может привести к ослабленной вазодилатации, аномальному вазоспазму, повышенной агрегации тромбоцитов и повышенной адгезии и инфильтрации воспалительных клеток. Снижение эндотелиального NO и эндотелиальной функции связаны с факторами риска для заболеваний коронарной артерии, включающими 2 курение, гиперхолестеринемию, гомоцистеинурию и диабет. Изменение NO-модулированной активности в коронарных артериях может способствовать острому коронарному синдрому,приводящему к инфаркту миокарда. Изменение системы эндотелиального NO и являющаяся его результатом вазоконстрикция влекут за собой усиливающееся разрушение нейронов в случаях церебральной ишемии, таких как внезапный приступ. Кроме того, последние исследования показали, что эндотелиальный NO опосредует чувствительность сосудов к инсулину, таким образом, усиленное продуцирование NO может быть полезно в лечении влияния диабета на сосуды. Вообще, существует масса доказательств,как экспериментальных, так и клинических, которые указывают на то, что возрастающие уровни NO в сосудистой сети благотворны во многих патологических состояниях, таких как диабет, внезапный приступ, атеросклероз и гипертензия. Современная терапия с целью повышенияNO уровней в сосудистой системе может заключаться либо во введении высоких доз Lаргинина (eNOS-субстрат), либо соединений,таких как нитроглицерин или нитропруссид натрия, метаболически высвобождающих NO. Хотя такая терапия может быть эффективна, для каждой из них определены нежелательные побочные действия. Вдобавок, их недостатком является то, что они не могут поддерживать замедленное высвобождение NO ввиду быстрого вымывания из организма. Было бы замечательным достижением, если бы новая терапия оказалась способной увеличивать концентрацииNO в сосудистой системе. Краткое описание изобретения Данное изобретение предлагает способы увеличения продуцирования NO эндотелиального происхождения, включающие введение пациенту эффективного количества соединения формулы I, или его фармацевтически приемлемой соли или сольвата. Подробное описание изобретения Рассматриваемое изобретение связано с открытием того, что выбранная группа 2 арилбензо[b]тиофенов (соединений формулы I) полезна для увеличения eNOS и концентрацииNO эндотелиального происхождения. Общие термины, используемые для описания указанных здесь соединений, имеют обычные смысловые значения. К примеру, "C1-C4 алкил" обозначает линейные или разветвленные алифатические цепи с 1-4 углеродными атома 3 ми, включающие метил, этил, пропил, изопропил, н-бутил и тому подобные. Термин "замещенный фенил" относится к фенильной группе с одним или двумя заместителями, которые выбирают из группы, включающей C1-C4 алкил, C1-C4 алкокси, гидрокси,нитро, хлор, фтор или три(хлор или фтор)метил."O(C1-C4 алкил)" обозначает C1-C4 алкильную группу, присоединенную через кислородный мостик, такую как метокси, этокси, н-пропокси,изопропокси и тому подобные. Термин "фармацевтически приемлемая соль" относится к кислотной, либо основной аддитивной солям, про которые известно, что они не токсичны и обычно используются согласно фармацевтической литературе. Обычно применяемые кислотные аддитивные соли включают: неорганические соли, образующиеся при добавлении серной кислоты, азотной кислоты, хлористо-водородной кислоты, бромистоводородной кислоты, фосфорной кислоты, фосфористой кислоты и тому подобных; или органические соли, образующиеся при добавлении уксусной кислоты, муравьиной кислоты, бензойной кислоты, лимонной кислоты, метансульфокислоты и тому подобных. Обычно используемые основные аддитивные соли включают соли, образованные щелочными или щелочно-земельными гидроокисями, гидроокисью аммония, алкил-или ароматическими аминами и тому подобными. Предпочтительная соль по данному изобретению должна быть хлористо-водородной солью. Фраза "ингибирование физиологических состояний, связанных с недостатком окиси азота или с потребностью в окиси азота (NO)" включает предотвращение, предупреждение, сдерживание и замедление, прекращение или обращение развития заболевания, тяжести состояния или возникающего симптома или влияния указанного физиологического состояния. Такие физиологические состояния включают упомянутые в данной заявке, такие как патологическая агрегация тромбоцитов, патологическая вазоконстрикция (сужение сосудов), влияние на сосуды диабета, внезапного приступа, атеросклероза и аномального вазоспазма. Термин "сольват" обозначает агрегат, который включает одну или более из молекул растворенного вещества, такого как соединение формулы I, с одним или более молекулами подходящего растворителя. Гидрохлорид ралоксифена, который является предпочтительным вариантом воплощения данного изобретения, является соединением формулы I, где каждый из заместителей R и R1 обозначает гидроксил; R2 обозначает 1 пиперидинил, и представляет собой его хлористоводородную соль. Ралоксифеном называется: гидрохлорид [2-(4-гидроксифенил)-6-гидроксибензо[b]тиен-3-ил][4-[2-(1-пиперидинил)этокси]фенил]метанона. 4 Обычно в рецептурный состав включают,по меньшей мере, одно соединение формулы I и общепринятые эксципиенты, разбавители или носители и прессуют таблетки или получают составы в виде эликсиров или растворов для удобного перорального введения или введения внутримышечным или внутривенным способами. Соединения могут быть введены чрескожно и могут быть составлены в виде стандартных форм замедленного высвобождения и тому подобных. Соединения, используемые в способах по настоящему изобретению, могут быть получены существующими способами, такими как способы, подробно описанные в патентах США 4.133.814, 4.418.068, 4.380.635 и 5.393.763,включенных в данное описание в качестве литературных ссылок. В основном, способы исходят из бензо[b]тиофена, имеющего 6-гидроксильную группу и 2-(4-гидроксифенил)-группу. Исходные соединения защищают, ацилируют и снимают защиту, что приводит к соединениям формулы I. Примеры получения таких соединений приведены в вышеуказанных патентах США. Используемые по способам данного изобретения соединения образуют фармацевтически приемлемые кислотные и основные аддитивные соли с широким рядом органических и неорганических кислот и оснований и включают физиологически приемлемые соли, часто используемые в фармацевтической химии. Такие соли также являются частью данного изобретения. Характерные неорганические кислоты, используемые для получения таких солей, включают хлористо-водородную,бромистоводородную, иодисто-водородную, азотную,серную, фосфорную, гипофосфорную и тому подобные кислоты. Могут быть также использованы соли, полученные из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, алифатические и ароматические сульфокислоты. Такие фармацевтически приемлемые соли таким образом включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат,бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, оацетоксибензоат, нафталин-2-бензоат, бромид,изобутират, фенилбутират, -гидроксибутират,бутин-1,4-диоат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат,фумарат, гликолят, гептаноат, гиппурат, лактат,малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат,оксалат, фталат, тетрафталат, фосфат, вторичный кислый фосфат, первичный кислый фосфатметафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себацинат,сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбен 5 золсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и тому подобные. Предпочтительной солью является хлористо-водородная соль. Фармацевтически приемлемые кислотноаддитивные соли обычно получают по реакции соединения формулы I с эквимолярным или избыточным количеством кислоты. Реагенты обычно смешивают во взаимном растворителе,таком как диэтиловый эфир или бензол. Соль обычно осаждается из раствора за период от одного часа до десяти дней и может быть выделена фильтрованием или растворитель может быть удален общепринятыми способами (например, отпариванием). Термин "эффективное количество", как использован здесь, означает количество соединения формулы I, способное увеличивать концентрацию NO эндотелиального происхождения у пациента, нуждающегося в таком лечении. Пациенты, нуждающиеся в таком лечении,включают, не ограничиваясь перечисленным,больных, страдающих сужением сосудов или патологической агрегацией тромбоцитов в результате ухудшения состояния эндотелиальныхNO регуляторных проводящих путей факторами риска при коронарном заболевании, диабете и тому подобном. Как представляется в связи с данным изобретением, соединение формулы I может быть полезно в подавлении, улучшении,восстановлении, ограничении или предупреждении патологических последствий, обусловленных ухудшением состояния эндотелиальныхNO регуляторных проводящих путей. Конкретная доза вводимого по данному изобретению соединения будет, конечно, определяться конкретными обстоятельствами, сопровождающими случай заболевания, включающими, к примеру, вводимое соединение,способ введения, состояние пациента и требующую лечения патологию. Типичная суточная доза должна содержать нетоксичный уровень дозировки, приблизительно от 0,1 мг до 1000 мг/день соединения по данному изобретению, а более конкретно, приблизительно от 15 мг до 80 мг/день при ежедневном приеме от одного до трех раз, или так часто, как требуется для эффективного лечения. Вдобавок, соединения формулы I могут быть использованы конкурентно или последовательно с другими агентами, которые взаимодействуют с эндотелиальными NO проводящими путями, например, с нитроглицерином, нитропруссидом натрия, L-аргинином и тому подобными. Под "фармацевтически приемлемым составом" подразумевается, что носитель, разбавитель, эксципиенты и соль должны быть совместимы с активным ингредиентом (соедине 001911 6 ние формулы I) состава и не должны быть вредными для реципиента. Фармацевтические составы могут быть получены известными в соответствующей области техники методами. К примеру, соединения по данному изобретению могут быть составлены в композиции с общепринятыми эксципиентами,разбавителями или носителями и сформованы в таблетки, капсулы и тому подобное. Примеры подходящих для таких составов эксципиентов,разбавителей и носителей, включают следующие: наполнители и заменители, такие как крахмал, сахара, маннитол и кремневые производные; связывающие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие средства, такие как глицерин; дезинтегрирующие средства, такие как агар-агар, карбонат кальция и бикарбонат натрия; средства для замедления растворения, такие как парафин; ресорбционные катализаторы,такие как соединения четвертичного аммония; поверхностно-активные вещества, такие как цетиловый спирт, моностеарат глицерина; адсорбционные носители, такие как каолин и бентонир, и смазывающие вещества, такие как тальк, стеарат кальция и магния и твердые полиэтиленгликоли. Конечными фармацевтическими формами могут быть следующие: пилюли, таблетки, порошки, лепешки, сиропы, аэрозоли, саше, облатки, эликсиры, суспензии,эмульсии, мази, суппозитории, стерильные растворы для инъекций или стерильно упакованные порошки, в зависимости от типа используемого эксципиента. Вдобавок, соединения по данному изобретению хорошо подходят для составления стандартных форм замедленного высвобождения. Фармацевтические составы могут быть также так составлены, что они будут высвобождать активный ингредиент только или предпочтительно в конкретном отделе желудочнокишечного тракта, возможно в течение некоторого периода времени. Такие составы должны включать покрытия, оболочки или защитные матрицы, которые могут быть изготовлены из полимерных материалов или парафинов. Последующие составы приведены в целях иллюстрации и ни в коей мере не могут рассматриваться как ограничивающие. Общее количество активных ингредиентов в таких составах находится в пределах от 0,1 до 99,9% от веса состава. Термин "активный ингредиент" обозначает соединение формулы I или его соль или сольват. Технологии приготовления лекарственных средств Состав 1. Желатиновые капсулы Твердые желатиновые капсулы получают,используя следующие ингредиенты: 7 Ингредиент Активный ингредиент Крахмал, NF) Крахмал сыпучий, порошок Силиконовая жидкость 350 сантистокс) NF-Национальная Фармакопея США Ингредиенты смешивают, пропускают через сито 45 меш. США и распределяют по твердым желатиновым капсулам. Вышеуказанный состав может быть изменен согласно предложенным приемлемым вариантам. Таблеточный состав получают, используя следующие ингредиенты: Состав 2. Таблетки Ингредиент Активный ингредиент Целлюлоза, микрокристаллическая Двуокись кремния, тонкоизмельченная Стеариновая кислота Компоненты смешивают и прессуют, формуя таблетки. Альтернативно, таблетки, каждая из которых содержит 2,5-1000 мг активного ингредиента, получают следующим образом: Состав 3. Таблетки Ингредиент Активный ингредиент Крахмал Целлюлоза, микрокристаллическая Поливинилпирролидон(в виде 10 % раствора в воде) Натрийкарбоксиметилцеллюлоза Стеарат магния Тальк Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш. США и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученным порошком и затем пропускают через сито 14 меш. США. Полученные таким образом гранулы сушат при 50-60 С и пропускают через сито 18 меш. США. Затем к гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 меш. США, и после перемешивания прессуют на таблеточной машине, получая таблетки. Суспензии, каждая из которых содержит 0,1-1000 мг лекарственного препарата на 5 млдозу, получают следующим образом: 8 Состав 4. Суспензии Ингредиент Активный ингредиент Натрий-карбоксиметилцеллюлоза Сироп Раствор бензойной кислоты Отдушка Краситель Очищенная вода до Лекарственное вещество пропускают через сито 45 меш. США и смешивают с натрийкарбоксиметилцеллюлозой и сиропом до получения однородной пасты. Раствор бензойной кислоты, отдушку и краситель разбавляют некоторым количеством воды и добавляют при перемешивании. Затем добавляют воду в количестве, достаточном для получения требуемого объема. Получают аэрозольный раствор, содержащий следующие ингредиенты: Состав 5. Аэрозоль Ингредиент Активный ингредиент Этанол Пропеллент 22 (Хлордифторметан) Активный ингредиент смешивают с этанолом и смесь добавляют к порции пропеллента 22, охлажденного до 30 С, и переносят в наполняющее устройство. Затем требуемым количеством наполняют контейнер из нержавеющей стали и разбавляют оставшимся пропеллентом. После чего контейнер снабжают запирающим клапаном. Суппозитории получают следующим образом: Состав 6. Суппозитории Ингредиент Активный ингредиент Глицериды насыщенных жирных кислот Активный ингредиент пропускают через сито 60 меш. США и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с применением минимального необходимого нагрева. Затем смесь выливают в матрицу для суппозиториев с номинальной емкостью 2 г и дают охладиться. Внутривенный состав получают следующим образом: Состав 7. Внутривенный раствор Ингредиент Активный ингредиент Изотонический раствор Раствор указанных выше ингредиентов вводят пациенту внутривенно со скоростью порядка 1 мл в минуту. Методика испытаний В качестве доказательства полезности соединений по настоящему изобретению для повышения концентрации NO в эндотелиальной ткани используются следующие тесты. Культуры клеток Криогенно законсервированные(сохраненные) единичные донорские человеческие эндотелиальные клетки пупочной вены (HUVEC) закупают у Clonetics Corporation, San Diego CA. Эти клетки определяются Clonetics, как 1 (клетки первоначального пассажа). Клетки сохраняют в жидком азоте и для каждого эксперимента берут свежие аликвоты. Клетки размораживают и помещают в Т-75-колбы с 75 мл среды. Для всех HUVEC культур, все лабораторные образцы (консервирование) покрывают 0.2 % желатином (Sigma Chemical Co) в М 199 среде (Gibco) в течение двадцати минут при 37 С. Клетки выращивают в не содержащем фенол красный M199, с 10% сыворотки плода коровы (Gibco), 50 мкг/мл добавки для эндотелиального клеточного роста (Collaborative Biochemical Products, Bedford MA), 100 мкг/мл свиного гепарина (Gibco), 10 ед/мл пенициллина, 10 мкг/мл стрептомицина и 0,2 мМ L-глутамина при 37 С и 5% CO2. Когда клетки 2 культуры достигают 70-90% слияния, их разделяют 1:3 в покрытые желатином Т-75-колбах с 15 мл среды, получая клетки 3 культуры. После того, как эти культуры достигнут 70-90% слияния (обычно через 3-4 дня), эти клетки культуры 4 разделяют 1:3 в покрытые 12-ячеечные пластины в 1 мл среды. Все эксперименты проводят с этими клетками четвертого пассажа. Через 72 ч клетки сливают и начинают лекарственную обработку. Старые среды отсасывают и добавляют 1 мл среды для испытуемого лекарства с лекарственным средством (15 % сыворотки мерина (GeminiBioproducts, Calabasas Са, 10 ед/мл пеницилина,10 мкг/мл стрептомицина и 0,2 мМ Lглутамина). Основные растворы испытуемых соединений формулы I или 17 эстрадиола готовят при 10 мМ в ДМСО. Клетки обрабатывают лекарственным средством в течение 48 ч при 37 С. Индукция зависящего от окиси азота cGMP Три пластины (один опыт) вынимают из инкубатора и помещают на бумажное полотенце для предупреждения охлаждения. С одной пластины к этому времени удаляют среду и добавляют 1 мл теплого HBSS (Gibco). Этот HBSS удаляют и заменяют 0,5 мл равновесного буфе 10 ра +/- 200 мкл L-NAME (метиловый эфир Nнитро-L-аргинина, Sigma). Равновесный буфер состоит из HBSS, 10 мМ HEPES, 1,2 мМ CaCl2,0,6 мМ MgSO4 и 0,5 мМ изобутилметилксантина(IBMX) и 10 мкМ L-аргинина, который добавляют свежим к каждому основному раствору.IBMX готовят в виде 200 мМ основного раствора в ДМСО при 37 С. Клеткам дают уравновеситься в течение 30 мин при 37 С в 5% СО 2. После инкубации добавляют в течение 10 мин 0,5 мл "стимулирующего" буфера со стимулятором. Стимулирующий буфер для контролей состоит из равновесного буфера плюс указанный стимулятор; контролями являются: 1) негативный контроль, 2) позитивный контроль, 1 мМ нитропруссид натрия (Sigma), 3) 1 мкМ А-23187(кальциевый ионофор) (Sigma), 4) 1 мкМ А 23187 и 200 мкМ L-NAME Эта контрольная группа демонстрирует, что обнаруженные в этом испытании эффекты (cGMP увеличивается), обусловлены исключительно тем, что NO продуцируется в эндотелиальных клетках. Испытуемые клетки, обработанные соединениями формулы I, стимулируют с помощью 1 мкМ А 23187. Через 10 мин буферы удаляют и добавляют 200 мкл 0,01 н НСl, и cGMP экстрагируют,встряхивая клетки в течение 30 мин при 4 С. Каждую 200-мл аликвоту помещают в пробирку, содержащую 2 мкл 1 н NaOH. Образцы замораживают при -20 С для хранения. К каждой ячейке пластины добавляют 250 мкл 0,5% SDS в 0,1 н NaOH для солюбилизации прикрепленных клеток. Пластины заворачивают в пластиковую упаковку и замораживают при -20 С для последующего анализа на белок ВСА методом (PierceChemical Co.). Среднее общее количество белка в мг определяют для всех ячеек в эксперименте и используют для нормализации содержанияcGMP. Содержание cGMP определяют ферментативным иммуноанализом (Amersham Co.,RPN.226) по промышленным инструкциям для методики ацетилирования. Испытания проводят согласно инструкциям, за тем исключением, что ацетилирование 200 мкл-образцов выполняют с 20 мкл реагента вместо 100 мкл для 1 мл образцов. Испытания количественно оценивают на спектрометре Thermomax при 450 нМ. Позитивный контроль 17 эстрадиол демонстрирует ожидаемое увеличение количества зависящего от NO cGMP. Установлено, что соединения формулы I повышают концентрациюNO и индуцируют cGMP в этих эндотелиальных клетках. В таблице 1 показано повышение уровня зависящего от NO cGMP для ралоксифенгидрохлорида. Соединение Контроль Ралоксифен а ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ увеличения продуцирования окиси азота (NO) в васкулярных эндотелиальных клетках нуждающегося в таком лечении пациента, включающий введение указанному пациенту соединения формулы I или его фармацевтически приемлемой соли или сольвата. 2. Способ по п.1, где указанным соединением формулы I является гидрохлорид [2-(4 гидроксифенил)-6-гидроксибензо[b]тиен-3 ил][4-[2-(1-пиперидинил)этокси]фенил]метанона. 12 3. Способ подавления физиологического состояния, связанного с отсутствием или недостатком окиси азота, либо с потребностью в окиси азота (NO), включающий введение нуждающемуся в таком лечении пациенту соединения формулы I или его фармацевтически приемлемой соли или сольвата. 4. Способ по п.3, где указанным соединением формулы I является гидрохлорид [2-(4 гидроксифенил)-6-гидроксибензо[b]тиен-3 ил][4-[2-(1-пиперидинил)этокси]фенил]метанона.
МПК / Метки
МПК: A61P 3/10, A61K 31/381
Метки: азота, способы, продуцирования, окиси, увеличения
Код ссылки
<a href="https://eas.patents.su/7-1911-sposoby-uvelicheniya-producirovaniya-okisi-azota.html" rel="bookmark" title="База патентов Евразийского Союза">Способы увеличения продуцирования окиси азота.</a>
Предыдущий патент: Складываемая труба
Следующий патент: Замещенные 1,2,3,4 -тетрагидро-2-дибензофуранамины
Случайный патент: Способ получения 3-[2-(3,4-диметокси-бензоил)-4,5-диметокси-фенил]-пентан-2-она











