Диазепино-индоловые ингибиторы фосфодиэстераз iv
Номер патента: 1593
Опубликовано: 25.06.2001
Авторы: Паскаль Ив, Жакобелли Анри, Пен Адриан, Кальве Ален, Даль Свен Ж.
Формула / Реферат
1. Диазепино-индолы формулы (I)
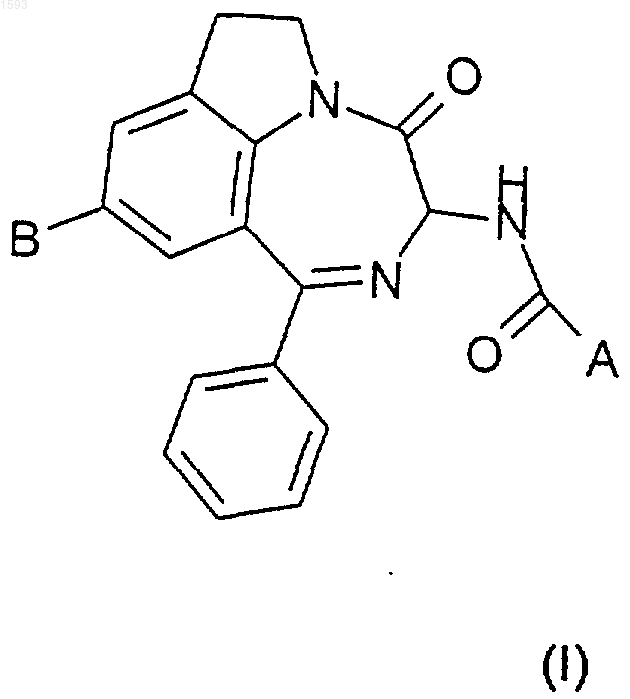
в которой
А представляет собой фенил или нафтил или азотсодержащий гетероарил, причем каждый возможно замещен 1-3 группами, независимо выбранными из галогена, С1-4алкила, галоалкила, С1-4алкокси, циклоалкилокси, амино, С1-4алкилкарбониламино или С1-4алкилоксикарбониламино;
В представляет собой:
1ш) -OR1, причем R1 является -Н или R4,
2ш) -NR2R3, причем R2 является -С(NН)NН2 и R3 является -Н,
3ш) -NR2R3, причем R2 является R4 и R3 является -Н,
4ш) -NR2R3, причем R2 и R3 независимо представляют собой -Н или C1-4алкил, или
5ш) -N-R2-R3, причем R2 и R3 образуют вместе с атомом азота, к которому они присоединены, насыщенный 5-7-членный гетероцикл, который в качестве второго гетероатома, не присоединенного непосредственно к атому азота, может содержать кислород, серу или азот;
R4 представляет собой:
1ш)-СН2-СO2Н,
2ш) -СО-(СН2)р-СO2Н,
3ш) -СО-А, где А определено как указано выше,
4ш) -СО-СН=СН-СO2Н,
5ш) -СО-(СН2)n-СН3, причем n является целым числом, равным или превышающим 0 и меньшим чем или равным 18,
6ш) -СО-(СН2-O-СН2)р-СН2-O-СН3,
7ш) -СО-(СН2-O-СН2)р-СO2Н,
8ш) -(CH2)p-NR5R6, причем R5 и R6 независимо представляют собой -Н или С1-4алкил, или
9ш) -(CH2)p-N-R5-R6, причем R5 и R6 образуют вместе с атомом азота, к которому они присоединены, насыщенный 5-7-членный гетероцикл, который в качестве второго гетероатома, не присоединенного непосредственно к атому азота, может содержать кислород, серу или азот;
р является целым числом, равным 2, 3 или 4;
их рацемические формы и изомеры конфигурации, определяемой, в частности, 3-углеродом кольца диазепино-индол-4-она,
а также их фармацевтически приемлемые соли.
2. Диазепино-индолы формулы (I) по п.1, отличающиеся тем, что асимметрический атом углерода в альфа положении по отношению к карбонилу диазепинового кольца имеет абсолютную конфигурацию R согласно правилу Кана-Ингольда-Прелога.
3. Диазепино-индолы формулы (I) по п.1 или 2, отличающиеся тем, что В представляет собой OR1 или NR2R3, где R1, R2, R3 являются водородами.
4. Диазепино-индолы формулы (I) по одному из пп.1-3, в которой А является фенилом или нафтилом, замещенным 1-3 группами, независимо выбранными из галогена, амино и С1-4алкокси.
5. Диазепино-индолы формулы (I) по одному из пп.1-4, в которой А является азотсодержащим моноциклическим гетероарилом, содержащим от 1 до 2 атомов азота, или бициклическим азотсодержащим гетероарилом, содержащим от 1 до 4 атомов азота.
6. Диазепино-индолы формулы (I) по п.5, в которой А является гетероарилом, замещенным группами амино, С1-4алкил, С1-4алкилоксикарбониламино или С1-4алкилкарбониламино.
7. Соединение (I) по одному из пп.1-6, которое выбрано из группы, состоящей из:
(3R)-изохинолин-3-карбоновой кислоты(9-гидрокси-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амида;
(3R)-4-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-4-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-4-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-3,5-дихлорбензамида;
(3R)-4-амино-N-[9-(4-амино-3,5-дихлорбензамидо)-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил]-3,5-дихлорбензамида;
(3R)-2-ацетиламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-2-метоксибензамида;
(3R)-4-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-5-хлор-2-метоксибензамида;
(3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-3-циклопентилокси-4-метоксибензамида;
(3R)-пиридин-2-карбоновой кислоты(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амида;
(3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)никотинамида;
(3R)-N-(9-aмино-4-оксo-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида;
(3R)-3-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида;
(3R)-3-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида;
(3R)-3-ацетиламино-N-(9-ацетиламино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида;
(3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-3,5-дихлоризоникотинамида;
(3R)-пиразин-2-карбоновой кислоты(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амида;
(3R)-изохинолин-3-карбоновой кислоты(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амида;
(3R)-хинолин-3-карбоновой кислоты(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амида;
(3R)-4,7-диметилпиразоло[5,1-с][1,2,4]триазин-3-карбоновой кислоты(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-амида;
(3R)-4-амино-3,5-дихлор-N-(9-диметиламино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-4-амино-3,5-дихлор-N-(4-оксо-1-фенил-9-пирролидин-1-ил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-4-амино-3,5-дихлор-N-(4-оксо-1-фенил-9-морфолин-1-ил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-4-амино-3,5-дихлор-N-(9-гуанидино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]-индол-3-ил)бензамида;
(3R)-N-(9-ацетиламино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-4-амино-3,5-дихлорбензамида;
(3R)-4-амино-3,5-дихлор-N-(9-{2-[2-(2-метоксиэтокси)этокси]-ацетиламино}-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-(2-{2-[3-(4-амино-3,5-дихлорбензоиламино)-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-9-илкарбамоилметокси]этокси}-этокси)-уксусной кислоты;
(3R)-гексадекановой кислоты[3-(4-амино-3,5-дихлорбензоиламино)-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-9-иламида;
(3R)-изохинолин-3-карбоновой кислоты (9-ацетиламино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-9-ил)амида;
(3R)N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-2-бензофуранкарбоксамида;
-(3R)N-[4-оксо-1-фенил-9-(пирролидин-1-ил)-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил]-изоникотинамида; и
(3R)4,7-диметил-пиразоло[5,1-с][1,2,4]триазин-3-карбоновой кислоты [4-оксо-1-фенил-9-(пирролидин-1-ил)-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил]амида.
8. (3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)никотинамид.
9. (3R)-4-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид.
10. Соединение, выбранное из группы, состоящей из:
(3R)-4-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида;
(3R)-3-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида; и
(3R)-3-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида.
11. Лекарство, отличающееся тем, что оно содержит диазепино-индол, как он определен в одном из пп.1-10.
12. Лекарство, отличающееся тем, что оно содержит (3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3 ил)никотинамид.
13. Лекарство, отличающееся тем, что оно содержит (3R)-4-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-бензамид.
14. Лекарство, отличающееся тем, что оно содержит соединение, выбранное из группы, состоящей из:
(3R)-4-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида;
(3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида;
(3R)-3-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида; и
(3R)-3-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида.
15. Амино-диазепино-индолы, которые являются промежуточными соединениями в получении соединений формулы (I) по любому из пп.1-14, соответствующие формуле (II)
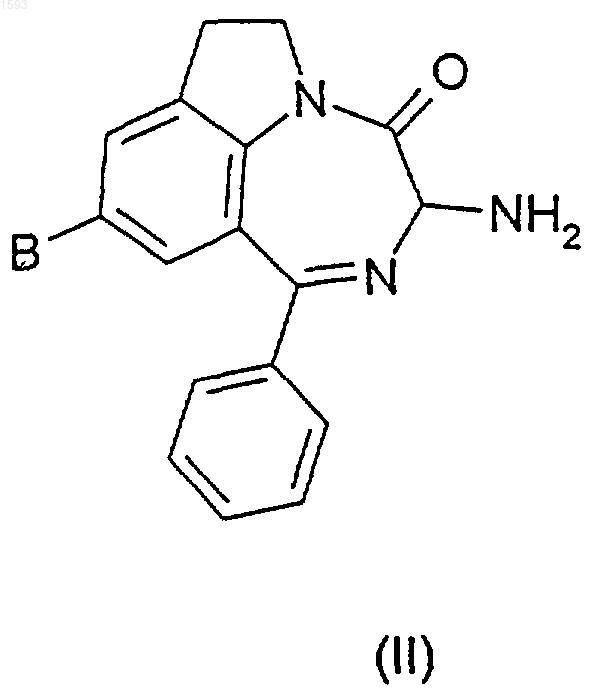
в которой В представляет собой OR1 или NR2R3, причем R1, R2 и R3 являются водородами.
16. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ib) формулы (I), в которой В является группой -ОН, ацилируют амино-диазепино-индол (IIb) формулы (II) как определено в п.15, в которой В является группой -ОН, реактивом (III) формулы Z-CO-A, в которой А представляет собой азотсодержащий фенил или нафтил или гетероарил, причем каждый возможно замещен 1-3 группами, независимо выбранными из галогена, С1-4алкила, С1-4галоалкила, С1-4алкокси, циклоалкилокси, амино, С1-4алкилоксикарбониламино или C1-4алкилкарбониламино,
a Z представляет собой галоген, гидроксигруппу, азидогруппу, группу имидазол-1-ил или группу -O-CO-Z1, причем Z1 может быть, кроме А, объемистым алкильным или алкоксильным радикалом, содержащим от 3 до 6 атомов углерода, или же альтернативно Z может быть группой O-Z2, причем
Z2 является ароматической группой, содержащей одно или два кольца, замещенных одним или более чем одним нитро- или галогенорадикалами.
17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ie) формулы (I), в которой В является группой -NH2, ацилируют соединение (IIе) формулы (II), в которой В является группой -NH2, реактивом (III), определенным в п.16.
18. Способ по п.17, где в реактиве (III) Z является группой ОН.
19. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ibb) формулы (I), в которой В является группой -O-CO-V; причем V обозначает группу, выбранную из:
-А, такого, как определено в п.16,
-(СН2)р-СO2Н, где р означает целое число, равное 2, 3 или 4,
-СН=СН-СO2Н,
-(СН2)n-СН3, где n является целым числом, равным или превышающим 0 и меньшим чем или равным 18,
-(СН2-O-СН2)р-СН2-O-СН3, где р означает целое число, равное 2, 3 или 4, или
-(СН2-O-СН2)р-СO2Н, где р означает целое число, равное 2, 3 или 4,
этерифицируют соединение (Ib), определенное в п.16, реактивом (III') формулы V-CO-Z, в которой Z имеет значение, определенное в п.16.
20. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ibс) формулы (I), в которой В является группой -O-R4, причем R4 является группой, выбранной из:
-CH2-CO2H,
-(CH2)p-NR5R6, где R5 и R6 независимо являются -Н или С1-4алкилом, или
-(CH2)p-N-R5-R6, где R5 и R6 образуют вместе с атомом азота, к которому они присоединены, гетероцикл,
приводят во взаимодействие соединение (Ib), определенное в п.16, с сильным основанием, таким как гидрид щелочного металла, для того чтобы получить фенолят, который приводят во взаимодействие с галогенидом XR4.
21. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Iea) формулы (I), в которой В является группой -NH-C(NH)-NH2, приводят во взаимодействие соединение (Ie), определенное в п.17, с агентом гуанилирования, таким как цианамид.
22. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ieb) формулы (I), в которой В является группой -NH-CO-V, причем V имеет значение, определенное в п.19, амидируют соединение (Ie), определенное в п.17, реактивом (III') V-CO-Z, определенном в п.19.
23. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Iec) формулы (I), в которой В является группой -NH-R2, причем R2 представляет собой С1-4алкил или группу R4, так как она определена в п.20, приводят во взаимодействие соединение (Ie), определенное в п.17, в присутствии сильного основания с алкилгалогенидом XR2.
24. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ied) формулы (I), в которой В является группой -NR2R3, причем R2 и R3 представляют собой С1-4алкилы, осуществляют восстановительное алкилирование соединения (Iec), определенного в п.23, альдегидом R'3CHO, в котором R'3 представляет собой ближайший низший гомолог R3.
25. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Iee) формулы (I), в которой В является группой -N-R2-R3, причем R2 и R3 образуют гетероцикл, осуществляют циклизацию путем взаимодействия соединения (Ie), определенного в п.17, с реактивом формулы X-(CH2)l-Q-(CH2)m-X', в которой Х и X', которые могут быть одинаковыми или разными, являются галогенами, Q представляет собой:
- простую валентную связь, и l и m являются целыми числами от 1 до 3, причем l + m больше чем или равно 4 и меньше чем или равно 6,
- кислород, серу или группу -NH-, и в этом случае l и m являются целыми числами от 1 до 3, причем l + m больше чем или равно 3 и меньше чем или равно 5.
26. Способ получения соединений формулы (I) по п.1, отличающийся тем,что для получения соединений (Ib) формулы (I), в которой В является группой -ОН, O-деметилируют в положении 9 диазепино-индольного кольца промежуточное соединение (1'c) формулы
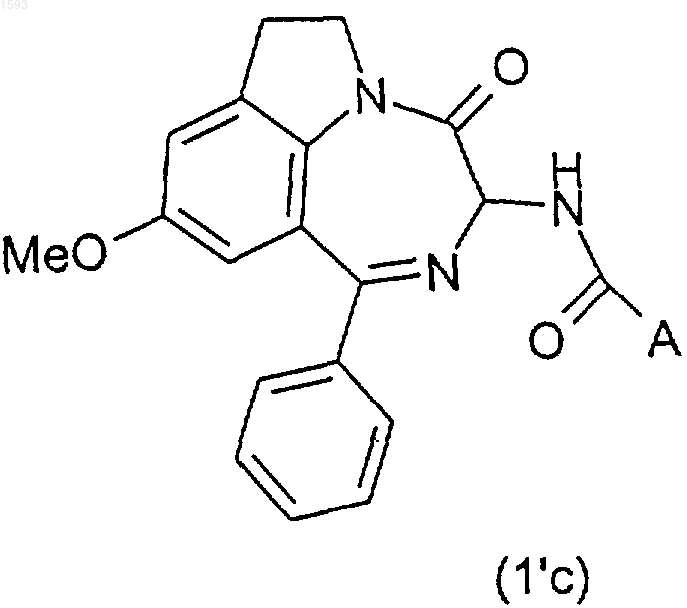
галогенидом бора или алюминия.
27. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ib) формулы (I), в которощ В является группой -ОН, диазотируют на первой стадии соединение (Ie) формулы (I), в которой В является группой -NH2, и затем на второй стадии гидролизуют промежуточную соль диазония.
28. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ie) формулы (I), в которой В является группой -NH2, восстанавливают нитрорадикал промежуточного соединения (1'd) формулы
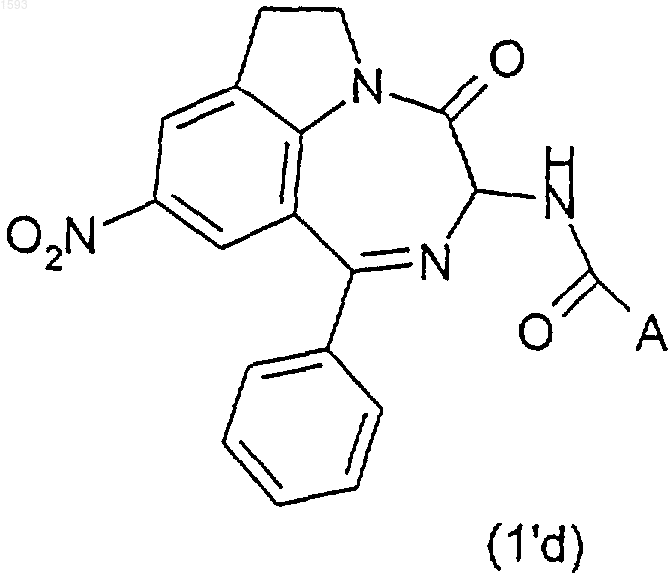
действием металла, такого как Zn или Sn, в кислой среде или действием хлорида или сульфида металла, такого как TiCl3 или Na2S.
29. Способ получения (3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]-диазепино[6,7,1-hi]индол-3-ил)никотинамида, при котором (3R)-3,9-диамино-1-фенил-6,7-дигидро-3Н-[1,4]диазепино[6,7,1-hi]индол-4-он приводят во взаимодействие с 3-пиридинкарбоновой кислотой и выделяют желаемый продукт.
30. Способ получения (3R)-4-амино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамида, при котором (3R)-4-трет-бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид приводят во взаимодействие с трифторуксусной кислотой и выделяют желаемый продукт.
Текст
1 Область изобретения Настоящее изобретение касается новых[1,4]диазепино[6,7,1-hi]индолов для получения лекарств, позволяющих лечить болезни, на которые оказывает влияние терапия ингибитором фосфодиэстераз IV. Эти лекарства используют,в частности, как противовоспалительные, противо-аллергические, бронхорасширяющие или анти-астматические средства, и они не обладают побочным действием на пищеварение или сердце. Предпосылки изобретения В отличие от свойств, раскрываемых настоящим изобретением, из уровня техники известно, что [1,4]диазепино[6,7,1-hi]индолы обладают свойствами антагонистов холецистокинина (ХЦК) и/или гастрина, и они предложены для заболеваний пищеварительного тракта: желудка, кишечника, поджелудочной железы и желчного пузыря, и особенно нарушения сытости. Так, заявка на европейский патент 340 064 описывает соединения формулы в которой R1 и R2 являются водородом или галогеном, Аr представляет собой индолил или фенил, и n равно 2 или 3. Эти соединения являются периферическими антагонистами холецистокинина (ХЦКA). Заявка на европейский патент 360 079 описывает соединения, являющиеся периферическими и/или центральными антагонистами ХЦК, формулы в которой R1 представляет собой арил, в некоторых случаях замещенный, Х представляет собой кислород или метилен, в некоторых случаях замещенный низшим алкильным радикалом, А представляет собой связь или низший алкилен,который может иметь группу или группы низших алкилов, R2 представляет собой водород или ацил. Не опубликованная заявка на французский патентFR 94 12282 описывает применение производных диазепиноиндолов формулы 2 в которой R представляет собой водород, низший алкил, низший алкокси, А представляет собой ароматический цикл, в некоторых случаях замещенный, причем некоторые из производных являются новыми, для приготовления лекарств, предназначенных для лечения заболеваний, на которые оказывает влияние ингибитор фосфодиэстераз IV. Говоря об ингибировании фосфодиэстераз,следует вспомнить, что циклический аденозин 3',5'-монофосфат (цАМФ) является вездесущим вторичным внутриклеточным мессенджером,посредником между первичным мессенджером(гормон, нейротрансмиттер, физиологически активное вещество) и функциональными клеточными ответными реакциями: первичный мессенджер стимулирует фермент, ответственный за синтез цАМФ; затем в соответствующих клетках начинает действовать цАМФ в широком спектре функций: метаболической, сократительной, или секреторной. Действие цАМФ заканчивается, когда он разлагается фосфодиэстеразами циклических нуклеотидов, внутриклеточными ферментами,которые катализируют его гидролиз в неактивный аденозин-5'-монофосфат. У млекопитающих различают по меньшей мере пять больших семейств фосфодиэстераз циклических нуклеотидов (ФДЭ), пронумерованных от I до V в соответствии с их структурой, кинетикой, субстратной специфичностью,или чувствительностью к эффекторам (BeavoJ.A. и др. (1990) Trends Pharmacol.Sci. 11, 150155, Beavo J.A. и др. (1994) Molecular Pharmacol. 46, (399-405). ФДЭIV специфичны для цАМФ. Известны соединения, являющиеcя неспецифичными ингибиторами фосфодиэстераз и ингибирующие несколько семейств ферментов. Например некоторые метилксантины, такие как теофиллин. Эти соединения имеют слабый терапевтический индекс, особенно по причине их действия на типы ФДЭ, присутствующие в иных клетках, чем клетки мишени. Наоборот, некоторые семейства ФДЭ могут быть селективно ингибированы различными фармакологическими агентами: гидролиз циклических нуклеотидов замедляется и, следовательно, их концентрация увеличивается только в клетках, где находится тип ФДЭ, чувствительный к ингибитору. Особенный интерес проявляется к фосфодиэстеразам IV (ФДЭIV), которые были идентифицированы во многих тканях, среди которых центральная нервная система, сердце, сосудистый эндотелий, гладкая мышца сосудов и гладкая мышца дыхательных путей, миело-идные пути и лимфоидные пути. Увеличение цАМФ в клетках, вовлеченных в воспалительный процесс, ингибирует их активацию: ингибирование синтеза и высвобождения медиаторов на уровне лаброцитов, моноцитов, полиядерных эозинофилов и базофилов, ингибирование хемотропизма и дегрануля 3 ции полиядерных нейрофилов и эозинофилов,ингибирование деления и дифференциации лимфоцитов. Цитокины, особенно ФНО (TNF) и интерлейкины, выработанные различными типами лейкоцитов, таких как Т-лейкоциты и полиядерные эозинофилы, играют важную роль в начале воспалительных проявлений, в частности в ответ на стимуляцию аллергеном на уровне дыхательных путей. С другой стороны, цАМФ уменьшает тонус волокон гладких мышц дыхательных путей; ингибиторы ФДЭIV определяют бронхорелаксацию. Следовательно, можно надеяться, что селективные ингибиторы ФДЭIV обладают терапевтической активностью как противовоспалительные, антиаллергические, бронхорасширяющие лекарства и при лечении астмы, когда наблюдается инфильтрация дыхательных путей воспалительными клетками и сжатие бронхов. Теофиллин давно очень широко используют при лечении астмы, и несмотря на то, что механизм его действия сложен, ингибирование ФДЭ способствует его действию, но так же способствует возникновению и некоторых нежелательных эффектов, таких как тошнота и головная боль. В течение нескольких лет проводилось экстенсивное исследование получения и уточнения сильнодействующих ингибиторов ФДЭIV. Это оказывается трудным, потому что многие из потенциальных ингибиторов ФДЭIV не лишены активности по отношению к фосфодиэстеразам других разновидностей. На сегодняшний день недостаток селективности ингибиторов ФДЭIV представляет,таким образом, важную проблему из-за широты функций, регулируемых посредством цАМФ,причем указанную проблему следует считать плохо или совсем нерешенной. Таким образом,существует необходимость в сильных и селективных ингибиторах для ФДЭIV, то есть таких,которые не действуют на ФДЭ, принадлежащие к другим разновидностям. Так, ролипрам (DCI), производное пирролидона, синтезированное в 1975, рассматривают как представителя специфических ингибиторов ФДЭIV. Многочисленные соединения, родственные ролипраму, были синтезированы с целью их применения как ингибиторов ФДЭIV. Invitro ролипрам ингибирует активность воспалительных клеток у грызунов: ингибирование синтеза медиаторов лаброцитами, полиядерными эозинофилами и базофилами, и моноцитами; ингибирование хемотропизма и дегрануляции полиядерных. Ролипрам предложен как антидепрессант; однако его применение сопровождается нежелательными эффектами типа тошноты и рвоты. 4 Краткое изложение изобретения Итак, трудности, о которых говорилось при описании уровня техники, были преодолены и сейчас обнаружены новые производные[1,4]диазепино[6,7,1-hi]индолов, которые являются сильными ингибиторами ФДЭIV в концентрациях, при которых они мало или совсем не действуют на другие разновидности ФДЭ. Данное изобретение касается диазепиноиндолов формул (I) в которой А представляет собой фенил или нафтил или содержащий азот гетероарил, каждый в некоторых случаях замещен 1-3 группами, независимо выбранными из галогена, С 1-4 алкила, галоалкила, С 1-4 алкокси, циклоалкокси, амино, C1-4aлкoкcикaрбонилaминo или С 1-4 алкилкарбониламино; В представляет собой радикал гидрокси или амино, который в некоторых случаях замещенный,способ их получения и их применение для приготовления лекарств, предназначенных для лечения заболеваний, на которые влияет терапия ингибированием ФДЭIV. Подробное описание изобретения Данное изобретение предлагает диазепиноиндолы формулы (I) в которой А представляет собой фенил или нафтил или содержащий азот гетероарил, каждый в некоторых случаях замещен 1-3 группами, независимо выбранными из галогена, С 1-4 алкила, галоалкила, С 1-4 алкокси, циклоалкокси, амино, С 1-4 алкоксикарбониламино или С 1-4aлкилкарбониламино; В представляет собой: 1) -OR1, причем R1 представляет собой -Н или R4,2) -NR2R3, причем R2 представляет собой C(NH)NH2, и R3 является -Н,3) -NR2R3, причем R2 представляет собойR4, и R3 является -Н,4) -NR2R3, причем R2 и R3 независимо представляют собой -Н или C1-4aлкил, или 5) -N-R2-R3, причем R2 и R3 образуют вместе с атомом азота, к которому они присоединены, насыщенный 5-7-членный гетероцикл,который в качестве второго гетероатома, неR4 представляет собой: 1) -СН 2-СО 2 Н,2) -СО-(СН 2)р-СO2 Н,3) -СО-А, где А определено, как указано выше,4) -СО-СН = СН-СO2 Н,5) -СО-(СН 2)n-СН 3, причем n является целым числом, равным или выше 0, и ниже или равным 18,6) -СО-(СН 2-O-СН 2)р-СН 2-O-СН 3,7) -СО-(СН 2-O-СН 2)р-СO2 Н,8) -(CH2)p-NR5R6, причем R5 и R6 независимо представляют собой -Н или С 1-4 алкил, или 9) -(CH2)p-N-R5-R6, причем R5 и R6 образуют вместе с атомом азота, к которому они присоединены, насыщенный 5-7-членный гетероцикл, который в качестве второго гетероатома, не присоединенного непосредственно к атому азота, может содержать кислород, серу, или азот; р представляет собой целое число, равное 2, 3 или 4; их рацемические формы и их изомеры,особенно изомеры конфигураций, определенных углеродом 3 цикла диазепино-индол-4-она,так же, как их фармацевтически приемлемые соли. В том,что упомянуто ранее, так же как и в том, что последует далее: под азотсодержащим гетероарилом подразумевают ненасыщенный моноцикл или полицикл, содержащий по меньшей мере один атом азота, и, предпочтительно, гетеромоноциклы,имеющие от пяти до семи углов и содержащие от 1 до 4 атомов азота, или конденсированные ненасыщенные гетероциклы, содержащие от 1 до 4 атомов азота, в некоторых случаях метилированные или этилированные по атому азота,заряженному положительно; под галогеном подразумевают фтор, хлор,бром или иод; под С 1-4 алкилом, в том что касается радикалов, содержащих алкильный фрагмент, подразумевают, что алкил является нормальным или разветвленным и включает от одного до четырех атомов углерода, или также представляет циклопропилметильный радикал; под циклоалкилом подразумевают циклопропильные, циклобутильные, циклопентильные и циклогексильные группы; под галоалкилом подразумевают моно-,ди- или тригалоалкил. В J.Pharm.Sci., 1977, 66, 1-19 находится общий обзор приемлемых в фармации солей. Тем не менее, под фармакологически приемлемой солью соединения формулы (I), представляющего основную часть, подразумевают соли присоединения соединений формулы (I), которые образуются исходя из не токсических минеральных или органических кислот, как напри 001593 6 мер соли бромоводородной, хлороводородной,серной, фосфорной, азотной, уксусной, янтарной, винной, лимонной, малеиновой, гидроксималеиновой, бензойной, фумаровой, толуолсульфоновой, изетионовой и других. Различные четвертичные аммониевые соли производных (I) также включены в эту категорию соединений данного изобретения. И под фармакологически приемлемой солью соединения формулы (I),представляющего кислотную часть, подразумевают обычные соли соединений формулы (I),которые образуются исходя из не токсических минеральных или органических оснований, как,например, гидроксилы щелочных или щелочноземельных металлов (натрия, калия, магния и кальция), аминов (дибензилэтилендиамин, триметиламин, пиперидин, пирролидин, бензиламин и другие) или, кроме того, гидроксиды четвертичного аммония, как гидроксид тетраметиламмония. Предпочитают главным образом диазепино-индолы формулы (I), в которых асимметрический атом углерода в альфа положении по отношению к карбонилу "3-он" диазепинового цикла имеет абсолютную конфигурацию (R) согласно правилу Кана-Ингольда-Прелога. Предпочтительной является группа соединенийNR2R3 с R1, R2, R3, представляющими собой водород. Другая группа соединений (I), предстaвленная теми, у которых А является фенилом или нафтилом, замещенным группами, от 1 до 3,независимо выбранными среди галогена, амино,С 1-4 алкокси или С 1-4 алкилоксикарбониламино,является выгодно предпочтительной так же,как группа соединений (I), в которых А представляет собой моноциклический арил, включающий от 1 до 2 атомов азота, или бициклический, содержащий от 1 до 4 атомов азота. Особенно предпочитают следующие соединения (I):(3R)3-трет-бутоксикарбониламино-N-(9 амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4] диазепино[6,7,1-hi]индол-3-ил)-никотинамид и его соль присоединения с серной кислотой;(3R)4,7-диметилпиразол[5,1-с][1,2,4]триазин-3-карбоновая кислота[4-оксо-1-фенил-9(пирролидин-1-ил)-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил]-амид. Другой аспект данного изобретения имеет в виду способ получения диазепино-индолов (I),который представлен на схеме I: Схема I и состоит в следующем: а) для получения соединений (Ib) формулы(I), в которой В представляет собой группу -ОН:- в ацилирировании промежуточного амино-диазепино-индола (IIb) формулы (II), в котором в представляет собой группу -ОН, реактивом (III) формулы Z-CO-A, в которой А такой,как определено для (I), и Z представляет собой галоген, гидроксигруппу, азидогруппу, группу имидазол-1-ил или группу -O-CO-Z1, причем Z1 может быть, кроме А, пространственно затрудненным ал-кильным или алкоксильным радикалом, включающим от 3 до 6 атомов углерода,или Z может быть группой О-Z1, причем Z1 представляет собой ароматическую группу,включающую один или два цикла, замещенные одним или несколькими нитро-радикалами или галогенами, или- в деметилировании промежуточного соединения (I'с) формулы галогенидом бора или алюминия, или- в диазотировании на первом этапе соединения (Iс) формулы (I), в которой В является группой -NН 2, потом гидролизе на втором этапеb) для получения соединений (Iе) формулы- в восстановлении нитрорадикала промежуточного соединения (I'd) формулы действием металла, такого как Zn или Sn в кислой среде, или действием хлорида или сульфида металла, таких как ТiСl3 или Na2S,и, как показывает следующая далее схема 2, который состоит: Схема 2 с) для получения соединений (Ibb) формулыi) - А, такой как определено ранее в а),ii) - (СН 2)р-СО 2 Н, где р является целым числом, равным 2, 3 или 4,iii) - СН=СН-СО 2 Н,iv) - (СН 2)n-СН 3, где n является целым числом, равным или больше 0, и меньше или равным 18,v) - (СН 3-O-СН 3)p-СН 2-O-СН 3, где р является целым числом, равным 2, 3 или 4, илиd) для получения соединений (Ibc) формулы (I), в которой В является группой -O-R4,причем R4 выбран среди:i) - СН 2-СO2 Н,ii) - (СН 2)p-NR5R6, где R5 и R6 независимо представляют собой -Н или низший алкил, или- в приведении во взаимодействие соединения (Ib), определенного в а), с сильным основанием, таким как гидрид щелочного металла, с образованием фенолята, который приводят во взаимодействие с гидридом XR4; и, как показывает последующая схема 3, этот способ получения так же состоит: е) для получения соединений (Ieа) формулы(I), в которой В является группой -NH-C(NH)NH3,- в приведении во взаимодействие соединения (Iс), определенного в b), с агентом гуанилирования, таким как цианамид, иf) для получения соединений (Ieb) формулыg) для получения соединений (Iec) формулы(I), в которой В является группой -NH-R2, причем R2 является низшим алкилом или группойR4, такой как определена в d),- в приведении во взаимодействие соединения (Ie), определенного в b), в присутствии сильного основания с алкилгалогени-дом XR2, иh) для получения соединений (Ied) формулы (I), в которой В является группой -NR2R3,причем R2R3 являются низшими алкилами,- в проведении восстановительного алкилирования соединения (Iес), определенного в g),альдегидом R'3 СНО, в котором R'3 является ближайшим низшим гомологом R3, и наконец i) для получения соединений (Iee) формулы (I), в которой В является группой -N-R2-R3, причемR2 и R3 образуют гетероцикл,- в осуществлении циклизации взаимодействием соединения (Ie), определенного в b), с реактивом формулы Х-(СН 2)l-Q-(СН 2)m-Х',в которой Х и X', подобные или различные, являются галогенами, Q представляет собой:- простую валентную связь, а l и m являются целыми числами от 1 до 3 с l+m больше или равное 6,- кислород, серу или группу -NH-, причем в этом случае l и m- являются целыми числами от 1 до 3 с l+m меньше или равное 5, или, альтернативно,- в алкилировании промежуточного аминодиазепино-индола (IIf) формулы (II), в которой В является группой -N-R2-R3, причем R2 и R3 образуют с атомом азота гетероцикл, реактивом(III) формулы Z-CO-A, такой как определена ранее. Более точно, получение диазепиноиндолов формулы (I) прибегает именно к реакциям ацилирования, в частности, для получения непосредственно соединений (Ib) и (Ie), исходя из промежуточных аминов (IIb) и (IIе) (схема 1) и для получения соединений (Iee), исходя из промежуточных соединений (IIf), как показано 10 на схеме 4bis. Для осуществления этого этапа три способа, обозначенные А, В и С, предпочтительны. Они различаются, в частности, природой участвующего ацилирующего агента (III) формулы Z-CO-A. Таким образом, Z представляет собой, смотря по обстоятельствам:- галоген Х, когда, в способе "А", участвует ацилирующий агент (IIIA) формулы Х-СО-А;- группа пентафторфенилокси, когда, в способе "В" участвует ацилирующий агент (IIIB) формулы С 6F5-О-СО-А;- радикал гидрокси, когда, в способе "С",участвует ацилирующий агент (IIIC) формулы А-СООН. Реакцию ацилирования, согласно этим трем способам, проводят в безводном органическом растворителе как, например, дих-лорметан или хлороформ, нормальный или циклический простой эфир как диметокси-1,2-этан, тетрагидрофуран или диоксан, апротонный полярный растворитель как пиридин, диметилсульфоксид или любой другой подходящий растворитель,или смесь нескольких из этих растворителей. Выгодно, когда реакция благоприятно смещается добавлением основания и/или конденсирующего вещества как N,N'-дизамещенный карбодиимид, N,N'-карбонилимидазол, или как, предпочтительно, тетрафторборат О[(этоксикарбонил)цианметиламино]-N,N,N',N'тетраметилурония или гексафторфосфат бромтрис-пирролидино-фосфония. Реакционные условия способов А, В и С детализированы в начале химической экспериментальной части. Схема 1 представляет два альтернативных пути подхода к соединениям (IИ):- один заключается в O-деметилировании галогенидом бора или алюминия промежуточного соединения (Iс), чья фенольная функция защищена метильной группой; кислотой Льюиса, предпочтительной для данной реакции, является трибромид бора, в случае которого действуют при начальной температуре от -70 до- другой заключается в диазотировании соединения (Iе) азотистой кислотой в присутствии минеральной кислоты, затем, на следующем этапе, в гидролизе нагреванием полученной соли диазония, предпочтительно в присутствии соли меди. Схема 1 показывает, что соединеие (Iе) можно так же получить восстановлением нитрогруппы промежуточного соединения (I'd), особенно посредством TiCl3 или Na2S. Схема 2 показывает способ этерификации,ведущий к диазепино-индолам формулы (Ibb),который заключается в приведении во взаимодействие продукта формулы (Ib) с производным карбоновой кислоты формулы V-(CO)-Z, в которой Z имеет значение, указанное выше, а V имеет значение, указанное в схеме 2. 11 Способ этерификации, представленный в схеме 2, и приводящий к диазепино-индолам формулы (Ibc), заключается в приведении во взаимодействие продукта формулы (Ib) с сильным основанием, как гидрид натрия для образования фенолята, который приводят во взаимодействие с алкилгалогенидом XR4, в котором R4 является алкильным радикалом, замещенным функцией карбоновой кислоты XR4, а именно радикалом -СН 2-СО 2 Н в защищенной форме,или R4 является алкильным радикалом, замещенным аминной концевой функцией, особенно радикалом (CH2)p-NR5R6,причем R5 и R6 независимо представляют собой -Н или низший алкил,или R5 и R6 образуют, вместе с атомом азота, с которым они связаны, насыщенный гетероцикл,имеющий от пяти до семи звеньев цепи, могущий включать, как гетероатом, не связанный прямо с упомянутым атомом азота, кислород,серу или азот; а р является целым числом, равным 2, 3 или 4. Когда R4 несет функцию карбоновой кислоты, она защищена: используют, например, трет-бутилбромацетат; после взаимодействия с фенолятом у полученного продукта снимают защиту трифторуксусной кислотой с получением продукта (Ibc) , где R4 = -СН 2-СО 2 Н. Схема 3- способ получения диазепино-индолов формулы (Iеа), который заключается в приведении во взаимодействие диазепино-индол формулы (Ie) с цианамидом в ацетонитриле; альтернативно, можно использовать N-амидинопиразол в качестве агента гуанили-рования, или его 3,5-диметильное производное;- способ получения диазепининдолов формулы (leb), который заключается в приведении во взаимодействие диазе-пино-индола (Ie) с производным карбоновой кислоты формулы V(CO)-Z, в котором Z имеет значение, указанное выше, и V -значение, указанное на схеме 3, согласно одному из способов А, В, С, описанных выше, а, предпочтительно, способу С.- способ получения диазепино-индолов формулы (Iec), который заключается в приведении во взаимодействие продукта формулы (Ie) в присутствии сильного основания как гидрид натрия для образования амида, который приводят во взаимодействие с алкилгалогенидом XR2,в котором R2 имеет значение, указанное на схеме 3. Когда R2=R4=-(CH2)p-NR5R6, используют ХR4 в форме хлоргидрата;- способ получения диазепино-индолов формулы (Ied), который заключается в осуществлении восстановительного алкилирования диазепино-индола (Iec), который подвергают взаимодействию с альдегидом R'3 СНО, в котором R'3 является непосредственным низшим гомологомR3 в присутствии муравьиной или уксусной кислоты и гидрида, предпочтительно NaBH4 или- способ получения диазепино-индолов формулы (Iee), который заключается в осуществлении циклизации действием соединения (Iс) на реактив формулы Х-(СН 2)l-Q-(СН 2)m-Х', в которой Х и X', подобные или различные, являются галогенами, и, предпочтительно, бромом,Q представляет собой простую валентную связь и l и m являются целыми числами от 1 до 3 и сумма которых составляет от 4 до 6; или Q представляет собой -O-,-S-, или -NH-, причем в этом случае сумма l+m составляет от 3 до 5. Промежуточные соединения формулы (I'c) и (I'd) Способы А, В или предпочтительный С,уже описанные, позволяют, как указано на схеме 1, исходя из промежуточных соединений (IIc) или (IId) формулы (II), где В представляет соответственно группу -ОСН 3 или -NO2, получить промежуточные соединения (I'с) или (I'd). Общий способ получения промежуточных аминов(II) проиллюстрирован на следующей далее схеме 4 и детализирован дальше. Схема 4 Промежуточные соединения формулы (IIе) и (IId) Можно получить амин (IIe), нитруя углерод в положении 9 диазепино-индола (IIa) нитратом калия в сернокислой среде. Получают предпочтительно (IId), функция -NO2 которого может быть восстановлена до -NH2 многими восстановителями, среди которых SnCl2. Один вариант для получения промежуточного соединения (IIc) заключается в нитровании диазепино-индола формулы (Va). Затем приводят во взаимодействие полученное соединение(Vd) и оксимирующий реактив с получением оксима (IVd). Восстановление (IVd) водородом в присутствии катализатора восстановления или взаимодействием с цинком в присутствии ки 13 слоты позволяет восстановить оксимные и нитро-группы с получением (IIe). Промежуточное соединение формулы (IIf) Промежуточные соединения получают как показано на следующей схеме 4 бис, осуществляя последовательно:i) - защиту аминной группы промежуточного нитрованного соединения (IId) с получением промежуточного соединения (IIdp), содержащего например трет-бутоксикарбонильную группу (трет.Воc), затемii) восстановление нитро-группы этого промежуточного соединения гидрированием,которое, например, можно катализировать рутением, с получением промежуточного аминаiii) алкилирование полученной аминогруппы реактивом формулы X-(CH2)l-Q-(CH2)mX', ранее определенным, с получением циклизацией гетероциклического амина (Ifp), затемiv) элиминирование введенной на стадии I) этого получения защиты, приведением во взаимодействие, например, защищенного с помощью трет-Вос, соединения с трифторуксусной кислотой в безводной среде с получением промежуточного соединения (IIf). Схема 4 бис Промежуточное соединение формулы (IIa) Общий способ получения промежуточных аминов (IIа) в их рацемической и/или энантиомерной форме приведен в литературе. Например, можно получить амин формулы (IIa), аминируя в альфа-положении карбонил диазепининдола формулы (Va) производным гидроксиламина или хлорамином; или, в два этапа, приводя во взaимодействие соединение формулы(Va) с оксимирующим реактивом с получением оксима формулы (IVa), причем второй этап заключается в восстановлении оксима каталитически водородом в присутствии катализатора восстановления или взаимодействием с цинком в присутствии уксусной кислоты или с хлоридом олова в присутствии хлороводородной кислоты, с получением аминированного производного (IIа). Промежуточные соединения формулы (IIb) и(Vc), получают в две стадии, с промежуточным оксимом (IVc) и согласно способу, по существу идентичному способу, использованному для получения (IIa), соединение (IIc). Действием бромида бора деметилируют (IIс) в промежуточное соединение (IIb). Следующая далее схема 6 иллюстрирует способ синтеза (Vc): Индол (IX) восстанавливают в соответствующий индолин (VIII), который конденсируют с бензнитрилом (VII) в присутствии кислоты Льюиса с получением, после гидролиза, бензофенона (VI). Получение, исходя из (VI), в присутствии этилглицината в пиридине, продукта формулы(Vc) является адаптированным методом, описанным (метод N) Дж.В. Хестером и др., 1970,J.Med. Chem. 13: 827-835. Среди других возможностей получения соединения формулы (II) в оптически активной форме можно рассматривать:L, в котором аминная группа защищена легко подвижной группой, предпочтительно, третбутоксикарбонильной группой. В полученном соединении гидролизом снимают защиту, предпочтительно, в кислой среде в присутствии трифторуксусной кислоты, 15 и полученный продукт разделяют на его диастереомеры хроматографией; получают два изомера амина, конденсированного с аминированной кислотой. Затем разложением Эдмана возвращаются к двум энантиомерам амина (II); или(II) в растворе оптически активной кислоты, как,например, энантиомер миндальнной, дибензоилвинной, ди-паратолуилвинной, камфосульфоновой, паранитробензоилглутаминовой, или винной кислот с образованием двух солей диастереизомеров, затеи используя различия в растворимости, селективная кристаллизация их в подходящем растворителе. Промежуточные продукты формулы (IV) продукты формулы (II) являются промежуточными продуктами, используемыми для получения активных продуктов согласно изобретению. Изобретение также имеет целью лекарство для борьбы против воспалительных заболеваний, аллергий, против спазма бронхов, или полезное при лечении астмы, отличающееся тем,что оно содержит диазепино-индол согласно изобретению, в фармацевтической форме, адаптированной к подлежащему лечению заболеванию. Экспериментальная часть Химическая часть Следующие примеры иллюстрируют, не ограничивая, применение способов и продуктов данного изобретения. Чистота, идентичность и физико-химические характеристики основных полученных продуктов и промежуточных соединений определяют, таким образом:- чистоту проверяют тонкослойной хроматографией на силикагеле (Merck 60-F254) и наблюдаемые Rf приведены для использованного элюирующего растворителя, который, чаще всего, идентичен тому, который использовали для препаративной хроматографической очистки соединений. Эти растворители определяют по следующим сокращениям:- идентичность элементарной формулы полученных соединений с намеченной структурой подтверждено анализом основных элементов. Результаты не приведены, но указанные сообра 001593 16 зуются с предложенной структурой, учитывая возможные сольваты или гидраты.- идентичность полученных продуктов с предложенными структурами подтверждена их спектрами протонного ядерного магнитного резонанса и инфракрасной спектрографией. Спектры ЯМР 1H проводили при 400 МГц на приборе марки Брюкер, причем соединения растворяют в дейтерохлороформе с тетраметилсиланом как внутренний стандарт. Отмечают природу сигналов, их химический сдвиг в частях на млн, число протонов, которые они представляют, и их способность обмена с D2O. ИК спектры снимали в таблетках с бромидом калия на спектрометре Shimadzu IR-435.- отмеченные физико-химические характеристики представляют собой их точки плавления, определенные методом капилляра, и приведенные значения которых не исправлены, их вращательная способность, определенная при комнатной температуре, близкой к 20 С, на приборе Polatronic в кювете длиной 10 см и чьи результаты в некоторых случаях позволяют оценить оптическую чистоту расчетом энантиомерного избытка (э.и.). В целях нормализации химическую номенклатуру приведенных в примерах продуктов определяют с помощью справочника "Autonom", версия 1,0 (Beilstein Institut - Изд.Springler), который строит систематические номенклатуры соединений по правилам IUPAC. Как описано ранее, получение соединений(I) данного изобретения использует реакцию промежуточных аминов (II) с галогенидами(IIIA) по способу А, сложными эфирами, особенно пентафторфениловыми (IIIB) по способу В, или карбоновыми кислотами (IIIC) по способу С. Общий порядок осуществления этих способов следующий: Способ А. В реакторе, защищенном от влаги, растворяют при перемешивании 10,0 ммол промежуточного амина (II) в 60 мл безводного дихлорметана. При температуре около 20 С затем добавляют 10,0 ммол кислого галогенида(IIIA), затем по каплям 10 ммол триэтиламина. Реакцию продолжают при перемешивании при комнатной температуре, заключенной между 15 и 25 С, и развитие реакции наблюдают с помощью тонкослойной хроматографии. Когда реакцию считают завершенной, в реакционную среду добавляют 120 мл дихлорметана, смесь последовательно экстрагируют 60-ю мл раствора 1 н НСl, 60-ю мл насыщенного раствора бикарбоната натрия и наконец 60-ю мл воды. После сушки дихлорметан выпаривают при пониженном давлении, остаток очищают хроматографически на колонке из диоксида кремния по методу, адаптированному Still и др., (1978) J, Orq,Chem. 43: 2993, причем элюирующий растворитель представляет собой смесь с растущей полярностью, включающую, например, ацетон в 17 дихлорметане. Вымываемые фракции после определения содержания в них чистого вещества объединяли, затем выпаривали при пониженном давлении. С остаточным очищенным продуктом проведены определения структуры и чистоты,ранее описанные. Способ В. Стадия 1: в 25 мл дихлорметана растворяют 10,0 ммол промежуточной кислоты (IIIC) формулы А-СООН и 3,55 г (19,3 ммол) пентафторфенола. Затем добавляют 0,81 г (2,6 ммол) паратолуолсульфоната парадиметиламинопиридина и- либо 22,4 ммол дициклогексилкарбодиимида в способе В.а,- либо 22,4 ммол N-(3-диметиламинопропил)-N'-этил-карбодиимида в способе В.b. Смесь перемешивают в течение 16 ч при комнатной температуре, близкой к 20 С, затем фильтруют нерастворимую часть. Растворитель отгоняют, остаток очищают методом скоростной хроматографии на колонке из диоксида кремния, используя наиболее обычно как элюирующий растворитель градиент ацетона в дихлорметане. Чистые фракции, определенные посредством С.С.М. объединяют, растворитель выпаривают и, после анализа, остаточный промежуточный сложный эфир (IIIB), в форме аморфного мелкодисперсного вещества, используют как есть на следующей стадии. Стадия 2: 10,0 ммол сложного эфира пентафторфенила (IIa), полученного на предыдущей стадии, добавляют к 10,0 ммол промежуточного амина (II), растворенного в безводном этилацета-те. Через 16 ч перемешивания при комнатной температуре, близкой к 20 С, нерастворимую часть отфильтровывают, этилацетат выпаривают в вакууме, затем остаток очищают методом скоростной хроматографии на колонке из диоксида кремния, используя наиболее обычно в качестве элюента градиент метанола в дихлорметане. Чистые фракции, определенные посредством С.С.М., объединяют, растворитель выпаривают и очищенный остаток идентифицируют и анализируют. Способ С (предпочтительный): в реакторе,защищенном от влажности, растворяют при перемешивании 10,0 ммол промежуточного амина(IIIC) формулы А-СООН, затем 10,0 ммол (3,28 г) "TOTU" (сокращенное название для тетрафторбората О-[(этоксикарбонил)цианметиламино]-N,N,N',N'-тетраметилурония - поставщик Fluka ссылка 02580). Смесь охлаждают до 0 С, добавляют затем 20,0 ммол (2,55 г) N,Nдиизопропил-этиламина, после чего смесь перемешивают в течение 12 ч при комнатной температуре, затем последовательно экстрагируют с помощью 50 мл 1 н. раствора НСl, 50 мл на 001593 18 сыщенного раствора бикарбоната натрия и, наконец, 50 мл воды. Растворитель выпаривают в вакууме и остаток очищают посредством скоростной хроматографии на колонке из диоксида кремния, используя обычно как элюирующий растворитель градиент метанола в дихлорметане. Чистые фракции, определенные посредством С.С.М.,объединяют, растворитель выпаривают и очищенный остаток идентифицируют и анализируют. Промежуточные соединения (II). Промежуточное соединение 1: (3R)-3 амино-1-фенил-6,7-дигидро-3 Н-[1,4]диазепино[6,7,1-hi]индол-4-он[(IIa)-R; В = Н]. Получение этого соединения в рацемической форме описано в примере 1 стадии а) и d) в ЕР 0340064 А 1. Также энантиомер (R) данного соединения описан в примере 5 стадии а) b) с) g)h) того же самого патента. Тем не менее предпочтителен альтернативный способ, который заключается в расщеплении рацемического соединения образованием и разделением диастереоизомеров с помощью N-ацетил-L-фенилаланина, он приведен ниже:- 74,0 г (267 ммол) (3R,S)-3-амино-1 фенил-6,7-дигидро-3 Н-[1,4]диазепино[6,7,1hi]индол-4-она растворяют в 210 мл кипящего нпропанола. Кроме того, 44 г (267 ммол) Nацетил-L-фенил-аланина растворяют в 140 мл кипящего н-пропанола. Оба раствора смешивают, дают остыть, вводят несколько кристаллов для затравки. Через три дня кристаллы фильтруют и сушат. Вес: 50 г (т.е. 77%). Продукт дважды последовательно перекристаллизовывают из кипящего этилацетата. Получают 39,0 г (т.е. 97%). Маточники от первой кристаллизации выпаривают, осадок собирают кипящим этил-ацетатом. После кристаллизации, фильтрования и сушки получают 35,0 г кристаллов (т.е. 50%), что, после двух последовательных кристаллизаций из кипящего этилацетата позволило получить 17,0 г (т.е. 97%) продукта. Две объединенные порции представляют 56,0 г ( выход = 95%) соли энантиомера 3R амина с N-ацетил-L-фенил-аланином. Т.пл. = 171 С. []D = +132 (с=1, метанол).- 42,4 г (96 ммол) соли амина (3R) энергично перемешивают в присутствии 500 мл этилацетата и 500 мл нормального раствора гидроксида натрия. После растворения,фазу этилацетата отделяют, промывают насыщенным раствором хлорида натрия, затем обезвоживают и выпаривают. Получают 25,4 г ожидаемого амина. Выход = 95%. Т.пл. = 79 С. []D = 172R2 = R3 = H]. Стадия 1: в реактор на 100 мл вводят 51 мл концентрированной серной кислоты (d=1,83) и при перемешивании добавляют 16,0 г (57,7 ммол)(3R)-3-амино-1-фенил-6,7-дигидро-3 Н[1,4]диазепино[6,7,1-hi]индол-4-она, ранее описанного промежуточного соединения 1. Во время экзотермического введения температура достигает 70 С, полученный каштановый раствор охлаждают до 5-10 С. После этого быстро вводят 6,93 г (68,5 ммол) чистого нитрата калия,растворенного в 17,0 мл серной кислоты(d=1,83). Температура поднимается до 40 С,затем раствор держат в течение 40 мин при перемешивании до 20 С. Раствор выливают в 600 мл смеси воды со льдом. Смесь подщелачивают концентрированным раствором аммиака, затем экстрагируют три раза 150 мл дихлорметана, органические фазы промывают водой, обезвоживают, затем растворитeли отгоняют. Получают светлокаштановый, похожий на безе остаток (17,5 г),который очищают скоростной хроматографией на диоксиде кремния. Вымыва-ние дихлорметаном, последовательно обогащаемым метанолом,позволяет получить 12,0 г (3R)-3-амино-9 нитро-1-фенил-6,7-диги-дро-3 Н-[1,4]диазепино= 75%, Т.пл. 177-178 С, []D =+ 66,8 (с=0,4,СН 2 Сl2). Стадия 2: в реактор на 250 мл помещают 13,0 г (40,3 ммол) нитро-производного, полученного на предыдущей стадии, 45,5 г (202 ммол) безводного хлорида олова и 81 мл этанола. При перемешивании смесь нагревают до 70 С и держат 30 мин при этой температуре. Получают каштaновый раствор и отгоняют около 60 мл растворителя. Остаток собирают в 400 мл ледяной воды и водную фазу экстрагируют эфиром, а резиноподобная часть остатка нерастворима. Эфирную фазу удаляют. Водную фазу и резиноподобную часть подщелачивают раствором гидроксида натрия до рН 12. Смесь экстрагируют три раза 150 мл дихлорметана. Органические фазы объединяют, промывают, сушат,затем отгоняют дихлорметан. Остаток (13,0 г) очищают хроматографически на колонке из диоксида кремния, элюируя дихлорметаном, постепенно обогащающимся метанолом. Получают 12,4 г (3R)-3,9-диамино-1-фенил-6,7 дигидро-3H-[1,4]диазепино[6,7,1-hi]индол-4-она(3R,S)-3-амино-9-метокси-1-фенил 6,7-дигидро-3 Н-[1,4]ди-азепино[6,7,1-hi]индол 4-он [(IIc) - R,S; В = СН 3O]. Соединение получают в 5 стадий, исходя из 5-метoксииндола. Стадия 2: 5-метоксииндолин. К раствору 50,0 г (340 ммол) 5 метоксииндола в 700 мл ледяной уксусной кислоты добавлят при 15-20 С маленькими порциями 53,4 г (850 ммол) цианборгидрида натрия. Добавление, слабо экзотермическое и сопровождаемое слабым выделением водорода,осуществляют в течение 12 ч. Оставляют при 20 С и перемешивании на 12 ч, затем добавляют 700 мл воды и устанавливают рН реакционной среды между 10 и 12 добавлением 1200 мл 3%го раствора гидроксида натрия. Смесь дважды экстрагируют дихлорметаном, затем органическую фазу промывают 300 мл воды. Выпаривают, остаток очищают скоростной хроматографией на колонке из диоксида кремния, причем используемый элюент представляет собой смесь метанола с дихлорметаном с возрастающей полярностью. Получают 41,84 г бесцветного масла, который при хранении становится светло-желтым(s,1H обм.); 3,50 (t, 2H); 3,70 (s,3H); 6,60 (s,2H); 6,80 (s, 1H). Стадия 2: 7-бензоил-5-метоксииндолин. 5, 00 г (33,5 ммол) 5-метоксилиндолина растворяют в 50 мл 1,2-дихлорэтана. Добавляют по каплям при t 5 С 33,5 мл (33,5 ммол) трихлорида бора в молярном растворе в дихлорметане 6,90 г (97 ммол) бензнитрила. Смесь нагревают в течение 6 ч при кипении с обратным холодильником (т-ра = 82-84 С). После охлаждения гидролизуют добавлением 33,5 мл 4 н соляной кислоты и нагревают в течение 20 мин при 80 С. Оставляют остыть до 20 С и экстрагируют дихлорметаном. Водную фазу повторно экстрагируют 100 мл дихлорметана. Объединенные органические фазы промывают раствором гидроксида натрия, затем концентрированным раствором хлорида натрия и сушат над сульфатом натрия. После фильтрования и выпаривания получают 3,12 г желто-оранжевого твердого вещества. Выход = 38% - Т.пл. = 123 С - C.C.M.: 21 В 75 мл пиридина вводят 4,71 г (18,6 ммол) 7-бензоил-5-метоксилиндолина, затем 16,2 г(116 ммол) хлоргидрата этилглицината. Нагревают при перемешивании при 110-115 С, отгоняя образующиеся легкие фракции. Через 12 ч охлаждают и добавляют 100 мл 2,5%-ного раствора карбоната натрия в воде и 100 мл дихлорметана. Водную фазу отделяют, экстрагируют посредством 100 мл дихлорметана. Органические фазы объединяют и промывают водой. Растворитель выпаривают, затем остаток очищают хроматографически на колонке из диоксида кремния, причем используемый элюент представляет собой градиент ацетона в дихлорметане. Получают 4,15 г очищенного продукта в форме коричневой смолы. Выход = 82% - С.С.М.: S.A6: 0,73. ЯМР 1 Н(част.на млн): 3,10 (t,2H); 3,70(s,1H); 7,30-7,50 (m,3H); 7,60 (d,2H). Стадия 4: 3-гидроксиимино-9-метокси-1 фенил-6,7-дигидро-3 Н-[1,4]диазепино[6,7,1-hi] индол-4-он. 6,78 г (26 ммол) предыдущего продукта растворяют в смеси 26 мл тетрагидрофурана и 51 мл толуола. Охлаждают и добавляют, при температуре ниже 0 С, 7,29 г (65 ммол) третбутилата калия. Добавление экзотермично, и раствор окрашивается в черный цвет. Через 20 мин перемешивания добавляют в течение приблизительно 10 мин 3,20 г (27,3 ммол) изоамилнитрита. В течение 10 мин перемешивают при температуре ниже 0 С, затем добавляют 10,3 мл ледяной уксусной кислоты 100 мл воды. Отфильтровывают нерастворимую часть и добавляют 50 мл дихлорметана. Декантируют и промывают водную фазу 100 мл дихлорметана. Органические фазы объединяют и промывают 100 мл воды. После выпаривания растворителя остаток очищают хроматографически. Получают желто-оранжевое твердое вещество. Выход = 53% - Т.пл.= 205 С; С.С.М.: S.A5; 0,17. ЯМР 1H(част.на млн): 3,20 (t,2H); 3,70(s,3H); 4,40 (t,2H); 6,70 (t,2H); 7,10 (s,1H); 7,407,60 (m,3 Н); 7,80 (d,2H); 8,60 (s,1H). Стадия 5. (3R,S)-3-амино-9-метокси-1 фенил-6,7-дигидро-3 Н-[1,4]диазепино[6,7,1-hi] индол-4-он. К раствору 14,6 г (45 ммол) продукта, полученного на предыдущей стадии, в 1,0 л метанола добавляют 4,38 г 5%-ного рутения на угле. Гидрируют при давлении 8 бар при 80 С в течение 6 ч, затем фильтруют и ополаскивают катализатор. После выпаривания остаток очищают скоростной хроматографией на колонке из диоксида кремния, причем используемый элюент представляет собой смесь дихлорметана, обогащенного последовательно метанолом. Получают 9,66 г очищенного амина в форме светло-бежевого твердого вещества.[(IIc) - R; В=СН 3 О]. 10,0 г (32,3 ммол) промежуточного 3.а амина (R,S) растворяют в 100 мл кипящего с обратным холодильником ацетонитрила, Кроме того, 12,47 г (32,3 ммол) ди-паратолуолвинной кислоты растворяют при кипении с обратным холодильником в 100 мл ацетонитрила. Теплые растворы смешивают, затем оставляют для кристаллизации при охлаждении до комнатной температуры. После выдерживания в течение ночи белые кристаллы фильтруют и промывают их 100 мл холодного ацетонитрила, затем сушат. Эти кристаллы (т.е.= 37%) перекристаллизуют два раза последовательно из ацетонитрила с получением очищенного продукта ( = 99,5%). За этой очисткой следует хроматография на оптически активной колонке С 18 типа Pirckle, при элюировании смесью 50/50 изопропанола и нгексана. Получают 9,9 г продукта. Выход = 44%. Т.пл. = 168 С. 9,9 г предыдущей соли суспендируют в 100 мл этилацетата. Добавляют при сильном перемешивании насыщенный раствор бикарбоната натрия, через несколько минут водную фазу удаляют. Органическую фазу промывают 50-ю мл воды, сушат,затем на холоду в атмосфере азота выпаривают растворитель. Получают 4,1 г очищенного основания. Выход = 95%, Т.пл.= 84 С, []D =[(I'c); A = 3-изохинолил, В = СН 3O]. Соединение получают так, как описано в общем способе В с предшествующим промежуточным соединением 3.b и промежуточным пентафторфениловым сложным эфиром изохинолин-3-карбоновой кислоты. Выход = 87% - твердое белое вещество Т.пл. =211 С -[(]D = +0,30 (c=1, СН 2 Сl2); С.С.М. S.B1; 0,30. ЯМР 1H(част. на млн): 3,10 (m,1 Н); 3,35 23 Стадия 1: i) в реактор, защищенный от влаги и в атмосфере азота, вводят 13,0 г (40,3 ммол)(IId); В = NO2, полученное k промежуточному соединению 2-стадия 1] в 78 мл ТГФ, обезвоженного на молекулярных ситах. Раствор охлаждают и при температуре ниже 5 С добавляют при перемешивании 10,56 г (48,4 ммол) третбутилкарбоната в 40 мл ТГФ. Дают температуре подняться до 20-25 С и оставляют на 16 ч. Растворители отгоняют на водяной бане и в вакууме, остаток помещают в 100 мл петролейного эфира, затем фильтруют и сушат (выход 100 %).(3R)-N-(9-нитро-4-оксо-1-фенил-6,7-дигидро 3 Н-[1,4]диазепино[6,7,1-hi]индол-3-ил)-третбутоксикарбамид (IIdp) участвует как в следующей стадии. ii) в автоклав для гидрирования вводят, в 1 л метанола, 11,0 г (26 ммол) промежуточного соединения, полученного на предыдущей стадии, и 4,0 г 5%-ного рутения на угле. В атмосфере водорода восстановление проводят при перемешивании при 85 С в течение 6 ч. Катализатор отфильтровывают, растворитель удаляют перегонкой в вакууме и остаток очищают скоростной хроматографией на колонке из диоксида кремния. Элюция дихлорметаном, содержащим 2% метанола, позволяет получить после удаления растворителей, очищенный(ДМФ), 6,0 г (15,3 ммол) предыдущего промежуточного соединения (IIер), 3,60 мл либо 6,60 г 1,4-дибромбутана (30,6 ммол) и 6,38 г (76 ммол) гидрокарбоната натрия. Суспензию нагревают при 60 С при перемешивании в течение 7 ч, затем ДМФ отгоняют в вакууме, остаток растворяют в 150 мл дихлорметана. Раствор экстрагируют водой, затем сушат, растворитель отгоняют в вакууме остаток очищают скоростной хроматографией на диоксиде кремния. Элюция дихлорметаном, содержащим 1% метанола (объемн.) позволяет получить 4,10 г очищенного(3R)-N-(4-оксо-1-фенил-9-(пирролидин-1-ил)-6,7-дигидро-3 Н-[1,4] диазепино[6,7,1hi]индол-3-ил)-трет-бутосикарбамид (IIfp). Выход = 60% - ССМ: S.A8 Rf: 0,60 Стадия 3: в реактор, защищенный от влаги,вводят в 48 мл безводного дихлорметана 4,10 г(9,2 ммол) промежуточного соединения (IIfp),полученного на предыдущей стадии. К полученному раствору добавляют по каплям при комнатной температуре 24,75 мл либо 36,34 г(321 ммол) не содержащей примесей трифторуксусной кислоты (d=1,48). Смесь перемешивают в течение 2 ч при 20-25 С, затем растворители отгоняют в вакууме. Остаток очищают скоростной хроматографией на колонке из ди 001593 24 оксида кремния, элю-ция дихлорметаном, содержащим 5% (объемн) метанола, позволяет получить после выпаривания растворителей очищенный продукт в аморфной форме. Вес: 4,35 г. Соединение переводят в соль трифторуксусной кислотой. Обрабатывают насыщенным раствором бикарбоната натрия и смесь экстрагируют дихлорметаном. После выпаривания получают(9-гидрокси-4-оксо-1-фенил-3,4,6,7 тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)амид [(IB); А = изохинолил; В = -OR1, R1 = Н]. В реактор на 50 мл, снабженный защитой от влаги, и в атмосфере азота растворяют 1,00 г(3R)изохинолин-3-карбоновая кислота(9-метокси-4-ок-со-1-фенил-3,4,6,7-тетрагидро-[1,4] диазепино[6,7,1-hi]индол-3-ил)-амид в 20,0 ил дихлорметана, обезвоженного на молекулярных ситах. Раствор охлаждают при -50 С и, при перемешивании, быстро добавляют 5,41 г (22 ммол) трибромида бора. Смесь, коричневую и гетерогенную, перемешивают при 20-25 С в течение 3 ч, затем высаживают в смесь 50 мл воды и 30 мл дихлорметана. Фильтруют нерастворившееся, водную фазу удаляют и дихлорметан выпаривают. Остаток после выпаривания и нерастворимую часть объединяют и очищают хроматографически на колонке из диоксида кремния. Элюция смесьюS.A8 позволяет получить 0,48 г очищенного аморфного желтого продукта - выход = 49,5%. Т.пл. = 215 С. Анализ подтверждает для C27H20N4 О 3 (0,15 СН 2 Сl2) - С.С.М.: S.A1; 0,33. ЯМР 1H(част. на млн): 3,10 (m,1 Н); 3,35(m,1H)7 3,95 (m,1H); 4,50 (m,1H); 5,40 (d,1H); 6,05 (d,1H); 7,1 (d,1H); 7,45 (m,5H); 7,90 (m,2H); 8,30 (m,2H); 8,65 (s,1H); 9,50 (s,1H); 9,70 (d,1H,обм. D20); 9,75 (s,1H,oбм. D20); ИКС: 3450, 3200,1680, 1660, 1620, 1590,1510, 1460, 1440, 1370, 1320, 1270, 1230, 1140,1100, 1060, 960, 860, 760, 740, 700, 630, 540, 490 см-1 Пример 2. (3R)4-трет-Бутилоксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-бензамид [(Ie); А = 4-трет-бутилоксикарбониламинофенил; В =-NR2R2; R2 = R3 = Н]. В реакторе, защищенном от влаги, при перемешивании растворяют 1,60 г (5,5 ммол) (3R)3,9-диамино-1-фенил-6,7-дигидро-3 Н-[1,4] диазепино[6,7,1-hi]индол-4-она(промежуточное соединение 2) в 60,0 мл безводного дихлорметана. При 20 С приблизительно затем добавляют 1,44 г (6,05 ммол) 4-трет-бутилоксикарбониламинобензойной кислоты, затем 1,80 г(5,5 ммол) "TOTU" (сокращенное название название для тетрафторбората O-[(этоксикарбонил)-цианметиламино]-N,N,N',N'-тетраметилурония - поставщик Fluka, ссылка 02580. Смесь охлаждают до 0 С, добавляют затем 1,9 мл либо 1,42 г (11,0 ммол) N,N дииопропилэтиламина,после чего смесь перемешивают в течение 12 ч при комнатной температуре, затем экстрагируют последовательно 50 мл 1 н. раствора НСl, 50 мл насыщенного раствора бикарбоната натрия и, наконец, 50 мл воды. Растворитель выпаривают в вакууме и остаток весом 2,75 г очищают посредством скоростной хроматографии на колонке из диоксида кремния, используя как растворитель для элюции смесь этилацетат-гексан 80-20 (объемн.). Чистые фракции, определенные с помощью С.С.М. объединяют,растворитель выпаривают и очищенный остаток (1,78 г) растворяют в 6 мл изопропанола, затем осаждают добавлением 100 л гексана. Продукт фильтруют,сушат в вакууме. Вес: 1,30 г. Выход = 46% - желтый порошок - Т.пл. 215-225 С - []D = +47 (с=1, СН 3 Сl3). Анализ подтверждает для С 29H29N5O4 С.С.М.: S.D; 0,45. ЯМР 1H(част. на млн): 1,50 (s,9H); 2,953,10 (m,1 Н); 3,20-3,35 (9m,1H); 3,80 (s,2H); 3,854,00 (m,1 Н); 4,55-4,70 (m,1H); 5,55-5,65 (d,1H); 6,40 (d,1H); 6,85 (d,1H); 7,15 (s,1H); 7,30-7,60[6,7,1-hi]индол-3-ил)-бензамид [(Ie); A = 4 аминофенил; В = -NR2R3; R2 = R3 = н]. В реакторе на 50 мл растворяют при перемешивании в 30 мл безводного дихлорметана 1,00 г (1,95 ммол) (3R)-4-трет-бутил-оксикарбониламино-N-(9-амино-4-оксо-1-фенил-3,4,6,7 тетрагидро [1,4]диазепино[6,7,1-hi]индол-3 ил)бензамида (продукт примера 2). Светло-желтый раствор охлаждают при 0 С и добавляют, не превышая 5C, 10,0 мл трифторуксусной кислоты (d=1,480). Реакционную среду, которая становится краснооранжевой, поддерживают в течение 45 мин при 0-5 С при перемешивании, затем выпаривают в вакууме на водяной бане. Остаток собирают с помощью 100 мл дихлорметана и промывают 2 н раствором NaOH, затем водой. Растворитель затем выпаривают в вакууме и получают 0,85 г желтого остатка, который очищают скоростной хроматографией на колонке из оксида кремния,элюируя смесью S.А 8. Очищенные выпаренные фракции дают 0,60 г желтого продукта, который кристаллизуют при 20 С примерно из 20 мл изопропанола. Фильтруют нерастворимую часть и сушат. Вес: 0,50 г. Выход = 60% - Желтый порошок - Т.пл.= 276 С -[]D = +63 (с=1, Ме 001593R3 = н]. Соединение получают в соответствии с способом примера 2, исходя из промежуточного амина 2 и 4-амино-3,5-дихлорбензойной кислоты. После взаимодействия остаток очищают скоростной хроматографией на колонке из диоксида кремния, элюируя смесью S.A8. Полученный продукт окончательно перекристаллизуют из этилацетата. Выход = 55% - Желтый порошок - Т.пл. = 280 С -[]D = +48,5 (с=1, СН 3 ОН). Анализ сообразуется с C24H19Cl2N5O2. ЯМР 1 Н(част. на млн): 2,85-3,05 (m,1 Н); 3,20-3,35 (m,1H); 3,80-3,90 (m,1H); 4,40-4,50(s,2H); 6,40 (s,1H); 6,90 (s,1H); 7,40-7,60 (m,5H); 8,00 (s,2H); 9,45 (d,1H). ИКС: 3300, 3200, 1670, 1610, 1510, 1480,1380, 1280, 1240, 1180, 1130, 850, 790, 700 см-1. Пример 5. (3R)4-Амино-N-[9-(4-амино-3,5 дихлорбензамидо)-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил]-3,5 дихлорбензамид [(Ieb); А=4-амино-3,5-дихлорфенил; В = -NR2R3; R2 = R3=-CO-A; R3=Н] Фракции с примесями, полученные при хроматографической обработке предыдущего примера 4, объединили и упарили в вакууме. Остаток собирают и обрабатывают с помощью скоростной хроматографии на колонке из диоксида кремния, элюируя дихлорметаном, последовательно обогащаемым ацетоном. Очищенный продукт вымывают смесью в соотношении 80-20 (объемн.). После выпаривания вес 0,20 г бежево-белый порошок - Т.пл.220 С. Анализ сообразуется с С 31 Н 22N6 О 3 Сl4, (0,5 СН 3-СО-СН 3) 27 В реакторе на 100 мл, защищенном от влаги и в атмосфере азота, растворяют 1,23 г (6,84 ммол) 2-ацетиламинобензойной кислоты в 40 мл безводного тетрагидрофурана (ТГФ) и 0,76 г(7,5 ммол) 4-метилморфолина. Раствор перемешивают в течение 5 мин,затем охлаждают до -20 С, затем добавляют 0,93 г (6,84 ммол) изобутилхлорформата, затем белую суспензию выдерживают при перемешивании при -20 С в течение 30 мин. После этого добавляют, при той же температуре, 2,00 г (6,84 ммол) промежуточного амина 2 в растворе в 11 мл ТГФ. Суспензию выдерживают в течение часа при перемешивании, затем 2 ч при 0 С. После этого нерастворившееся отфильтровывают, фильтрат концентрируют в вакууме, и остаток очищают скоростной хроматографией на диоксиде кремния. Элюируют дихлор-метаном и рекуперируют 1,50 г очищенного аморфного продукта, который кристаллизуют из 100 мл этилового эфира. Осадок фильтруют, потом сушат. Вес: 1,20 г - Выход = 39% - желтый порошок - Т.пл. = 275 С. Анализ сообразуется с С 26 Н 23N5O3 С.С.М.: S.A6; 0,40. ЯМР 1 Н(част. на млн): 2,20 (s,3H); 3,003,10 (m,1H); 3,20-3,30 (m,1 Н); 3,70-3,80 (m,2 Н обм.); 3,85-4,00 (m,1 Н); 4,55-4,70 (m,1 Н); 5,55(m,1 Н). ИКС: 3300, 1690, 1640, 1500, 1440, 1370,1300, 1270, 1240, 1190, 1100, 850, 750, 700 см-1. Принер 7. (3R)N-(9-Амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi] индол-3-ил)-2-метоксибензамид [(Ie; А = 2 метоксифенил; В = -NR2R3; R2 = R3 = н]. Соединение получают coответственно способу примера 2, исходя из промежуточного амина 2 и 2-метоксибензойной кислоты. Продукт очищают скоростной хроматографией на колонке из диоксида кремния , элюируя смесьюS.А 8. После выпаривания растворителей очищенный продукт собирают этиловым эфиром. Выход = 65% -Желтый порошок - Т.пл. = 234 С 28 Соединение получают таким же способом,как в примере 2, исходя из промежуточного амина 2 и 4-амино-5-хлор-2-метоксибензойной кислоты. Продукт очищают с помощью скоростной хроматографии на диоксиде кремния,элюируя дихлорметаном, постепенно обогащаемым метанолом. Выход = 38% - желтый порошок - Т.пл. = 198-200 С - []D = +36,5 (с=0,5, СН 3 ОН). Анализ сообразуется с С 25 Н 22 СlN5 О 3 С.С.М.: S.A3; 0,50. ЯМР 1 Н(част. на млн): 2,95-3,10 (s,1H); 3,15-3,30 (m,1H); 3,75 (s,2H); 3,95 (s,2H); 3,854,00 (m,1H); 4,55 (s,2H); 4,55-4,65 (m,1H); 5,65(d,1H); 6,35 (s,1H); 6,55 (d,1H); 6,80 (s,1H); 7,307,45 (m,3H); 7,55 (d,2H); 8,15 (s,1H); 9,65 (d,1H). ИКС: 3300, 1660, 1620, 1580, 1470, 1370,1300, 1240, 1160, 1110,1040, 980, 700 см-1. Пример 9. (3R)N-(9-Амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi] индол-3-ил)-3-циклопентилокси-4-метоксибензамид [(Ic); A = 3-циклопентилокси-4-метоксифенил; В=NR2R3; R2=R3=Н] Соединение получают по такому же способу, как в примере 2, исходя из промежуточного амина 2 и 3-циклопентилокси-4-метоксибензойной кислоты (полученной согласноJ.Med. Chem. 1994, 37, 1696-1703). После очистки скоростной хроматографией на колонке из диоксида кремния, элюируя этилацетатом, продукт окончательно выделяют растворением в этилацетате с последующим осаждением гексаном. Выход = 65% -желтый порошок - Т.пл. = 138-146 С []D = +48 (с=1, СН 2 Сl2). Анализ сообразуется с С 30 Н 30N4O4 С.С.М.: S.B; 0,40. ЯМР 1 Н(част. на млн): 1,55-1,70 (m,2 Н); 1,75-2,10 (m,6 Н); 2,95-3,10 (m,1 Н); 3,20-3,35[(Iе); А = 2-пиридил; В = -NR2R3; R2 = R3 = H]. Получение таким же образом как в примере 2, исходя из промежуточного амина 2 и пиколиновой (или пиридин-2-карбоновой) кислоты. Продукт очищают перекристаллизацией из изопропаола. Выход = 50% - желтый порошок Т.пл. = 266-267 С []D +67 (с=1, СН 2 Сl2). Анализ сообразуется с C23H19N5O2 С.С.М.: S.A2; 0,45. ЯМР 1 Н(част. на млн): 2,95-3,10 (m,1 Н); 3,15-3,35 (m,1H); 3,70-3,85 (s,2H); 3,85-4,00(m,1H); 8,60-8,70 (m,1 Н); 9,60-9,80 (d,1H). ИКС: 3320, 1660, 1500, 1370, 1270, 1230,1170, 995,830,690 см-1. Пример 11. (3R)N-(9-Амино-4-оксо-1 фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1hi]индол-3-ил)-никотинамид [(Ie); А = 3 пиридил; В = -NR2R3; R2=R3= H]. Получение так же, как в предыдущем примере 10, с промежуточным амином 2 и никотиновой (или пиридин-3-карбоновой) кислотой. После очистки хроматографией, элюируя смесью S.A9, продукт кристаллизуют из метанола. Выход = 33% - желтый порошок - Т.пл. = 250 С Анализ сообразуется с C23H19N5O2 (0,4 СН 3 ОН) - C.C.M.: S.A1;0,50. ЯМР 1 Н(част. на млн): 2,95-3,10 (m,1 Н); 3,20-3,30 (m,1H); 3,80-3,90 (m,1 Н); 4,40-4,50(d,1H); 9,15 (s,1H); 9,90 (d,1H). ИКС: 3300, 3200, 1660, 1580, 1460, 1380,1265, 1235, 1165, 1020, 840, 695 см-1. Пример 12 А. (3R)N-(9-Амино-4-оксо-1 фенил-3,4,6,7-тетрагид-ро-[1,4]диазепино[6,7,1hi]индол-3-ил)-изоникотинамид [(Ie); А = 4 пиридил; В = -NR2R3; R2=R3=H]. Получение таким же образом, как в примере 10, с промежуточным амином 2 и изоникотиновой (или пиридин-4-карбоновой) кислотой. После очистки хроматографией, элюируя смесью S.A1, продукт собирают в диэтиловый эфир. Выход = 41% - желтый порошок - Т.пл. = 280 С []D = +60,8 (с=1, СН 3 ОН). Анализ сообразуется с C23H119N5O2 C.C.M.:- сульфат: в реактор вводят при перемешивании 1,00 г (2,5 ммол) полученного выше соединения в 20 мл безводного этанола. К суспензии добавляют по каплям 0,50 мл концентрированной серной кислоты (d=1,84). Температура суспензии повышается и среда окрашивается. Добавляют снова 0,50 мл кислоты и перемешивают еще в течение часа. Нерастворенную часть фильтруют, промывают эта-нолом, затем сушат. Вес: 1,00 г - Т.пл.= 230 С. []D = -37,0 (с=1,Н 2 О) - С.С.М.: S.A10; 0,50. Анализ сообразуется с C23H19N5O2, 2H2SO4 30 В высушенном реакторе растворяют 1,50 г(3,7 ммол) соединения из примера 12 А в форме основания в 15,1 мл безводного пиридина. К раствору добавляют 7,3 мл либо 7,85 г (77 ммол) уксусного ангидрида, затем раствор оставляют при перемешивании при 20-25 С в течение 16 ч. Туда добавляют 70 мл воды и продолжают перемешивание еще 4 ч. Затем смесь экстрагируют три раза по 75 мл этилацетата, органические фазы объединяют, промывают 2 раза по 75 мл насыщенного раствора бикарбоната натрия, затем сушат. Растворители отгоняют в вакууме на водяной бане, затем остаток очищают скоростной хроматографией на колонке из диоксида кремния. Элюция смесью дихлорметан-метанол 90-10 (по объему) приводит к получению очищенного продукта в аморфной форме. Вес: 1,20 г - выход = 71% - желтый порошок -Т.пл.= 204205 С Анализ сообразуется с С 25 Н 21N5 О 3 (0,75 Н 2O)-С.С.М.: S.A10; 0,50. ЯМР 1 Н(част. на млн): 2,10 (s,3H); 3,053,20 (m,1H); 3,25-3,40 (m,1 Н); 3,95 (q,1H); 4,65= H] В реакторе, защищенном от влаги и в атмосфере азота, растворяют в 10 мл безводного тетрагидрофурана 0,50 г (1,7 ммол) промежуточного амина 2 и 0,41 г (1,7 ммол) 3-третбутилоксикарбониламино-пиридин-4-карбоновой кислоты, полученной взаимодействием в диоксане 3-амино-изоникотиновой кислоты с третбутил-карбонатом. Затем при перемешивании при 20-25 С добавляют 0,96 г (2,05 ммол) РуВrор (гексафторфосфат бром-трис-пирролидинофосфония) и 0,52 г (5,1 ммол) триэтиламина. Смесь перемешивают в течение 16 ч при 20-25 С, нерастворимую часть удаляют фильтрованием и фильтрат концентрируют в вакууме на водяной бане. Остаток очищают скоростной хроматографией на колонке из диоксида кремния. Элюция смесью S.A8 позволяет получить 0,55 г очищенного продукта. Выход = 63% - желтый кристаллический порошок - Т.пл. = 221-225 С []D = -24,5 (с=0,5,СН 2 Сl2). Анализ сообразуется с С 28 Н 28N6O4 (0,6(3R)3-трет-бутил-оксикарбониламино-N-(9 амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4] диазепино[6,7,1-hi]индол-3-ил)-изониеотинамида, полученного в предыдущем примере, в 20 мл безводного дихлорметана. По каплям добавляют при перемешивании при 20 С 4,27 г (37,5 ммол) чистой трифторуксусной кислоты(D=1,480). После 30 мин перемешивания при 20-25 С концентрируют перегонкой в вакууме на водяной бане. Остаток растворяют в 25 мл этилацетата, раствор промывают 2 раза 10 мл насыщенного раствора бикарбоната натрия, затем сушат. Отгоняют растворитель в вакууме и остаток очищают с помощью скоростной хроматографии на диоксиде кремния. Элюирование дихлорметаном, последовательно обогащаемым метанолом, позволяет получить 0,17 г очищенного одинакового продукта. Выход = 38% Желтый кристаллический порошок- Т.пл.= 215230 С []D = -4,35 (с=0,5, СН 2 Сl2). Анализ сообразуется с С 23 Н 20N6 О 2 (0,3(3R)3-Ацетиламино-N-(9 ацетиламино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)-изоникотинамид [(Ieb); A = 2-ацетиламино-4-пиридил; В = -NR2R3; R2 = R4 = -CO-CH3; R3 = H]. В защищенную от влаги колбу вводят 0,130 г (0,315 ммол) полученного на предыдущей стадии (3R)3-амино-N-(9-амино-4-оксо-1 фенил-3,4,6,7-тетрагидро-[1,4][6,7,1-hi]индол-3 ил)-изоникотинамида, 1,3 мл безводного пиридина и 0,69 г (6,75 ммол) уксусного ангидрида. Смесь перемешивают в течение 16 ч при 20-25 С, затем добавляют б,5 мл воды и продолжают перемешивание еще в течение 5 ч, экстрагируют с 15 мл этилацетата, органические фазы объединяют, промывают насыщенным раствором бикарбоната натрия, затем сушат. Этилацетат отгоняют, затем остаток очищают посредством скоростной хроматографии на диоксиде кремния. Элюция дихлорметаном, постепенно обогащаемым метанолом, позволяет получить 0,50 г очищенного продукта. Выход = 32%001593H]. Соединение получают, действуя таким же образом, как в примере 2, исходя из промежуточного амина 2 и 3,5-дихлорпиридин-4 карбоновой кислоты. Продукт очищают хроматографически, причем элюцию осуществляют смесью S.A8. Продукт в конечном счете кристаллизуют из смеси этилацетат-гексан. Выход[(Ie); А = 2-пиразил; В = -NR2R3; R2 = R3 = Н]. Соединение получают таким же способом,как в примере 2, с промежутoчным амином 2 и пиразин-2-карбоновой кислотой. Продукт очищают с помощью скоростной хроматографии,затем кристаллизацией из гексана. Выход = 59%H]. Соединение получают таким же способом,как в примере 2, с промежуточным амином 2 и изохинолин-3-карбоновой кислотой. Очищенный продукт получают кристаллизацией и скоростной хромато-графией на диоксиде кремния,элюируя смесью S.A8. Выход = 55% - Желтый порошок - Т.пл. = 282 С []D = +16 (с=1,СН 2 Сl2).(s,1H); 7,40-7,55 (m,5H); 7,20-7,95 (m,2H); 8,208,35 (m,2H); 8,65(s,1H); 9,5 (s,1H); 9,65 (s,1H); ИКС: 3300, 3200, 1670, 1500, 1380, 1300,1270, 1230, 1160, 940, 935, 850, 740, 700 см-1. Пример 19. (3R)хинолин-3-карбоновая кислота (9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)амид [(Ie); А = 3-хинолил; В = -NR2R3; R2 = R3 = H]. Соединение получают таким же способом,как в примере 2, с промежуточным амином 2 и хинолин-3-карбоновой кислоты. Продукт очищают с помощью скоростной хроматографии на диоксиде кремния, элюируя дихлорметаном,постепенно обогащаемым метанолом. Выход = 44% - Желтый порошок - Т.пл. = 277 С []D =(m,1H); 7,85 (m,1H); 7,95 (d,1H); 8,15 (d,1H); 8,25 (d,1H); 8,75 (d,1H); 9,45 (d,1H). ИКС: 3300, 3200, 1650, 1620, 1500, 1480,1240, 1220, 790, 760, 690 см-1. Пример 20. (3R)4,7-диметил-пиразоло[5,1 с][1,2,4]триазин-3-карбоновая кислота (9-амино 4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)-амид [(Ie); A = 4,7 метил-пиразоло[5,1-с][1,2,4]-3-триазинил; В = NR2R3; R2 = R3 = H]. Соединение получают таким же способом,как в примере 2, и исходя из промежуточного соединения 2,4,7-диметилпиразоло[5,1-с][1,2,4] триазин-3-карбоновой кислоты. Продукт очищают скоростной хроматографией на диоксиде кремния, элюируя дихлорметаном, последовательно обогащаемым метанолом. Выход = 40% Желто-оранжевый порошок - Т.пл.= 168-170 С. Анализ сообразуется с C25H22N8O2, (0,5(42 ммол), затем 0,80 г (12,5 ммол) цианборгидрида натрия и 0,50 мл уксусной кислоты. Перемешивают в течение 2 ч при комнатной температуре, затем снова добавляют 0,50 мл уксусной кислоты, после чего перемешивают в течение 15 мин, затем осаждают смесь в 350 мл этилового эфира. Белый осадок, который образовался,фильтруют и отбрасывают, фильтрат экстрагируют два раза по 100 мл н раствором NaOH. Эфирную фазу промывают насыщенным раствором NaCl, затем сушат. Этиловый эфир отгоняют и остаток очищают скоростной хроматографией на диоксиде кремния. Элюция дихлорметаном, последовательно обогащаемым ацетоном, приводит к получению 0,80 г очищенного продукта, который собирают в смесь этиловый эфир/гептан. Продукт фильтруют,затем сушат. Вес 0,75 г. Выход = 35% : - желтооранжевый порошок - Т.пл. = 174-176 С Анализ сообразуется с C26H23Cl2N5O2, (0,3 H2O) С.С.М.:(продукт примера 4) в 100 мл ацетонитрила. Добавляют 1,48 г (6,9 ммол) 1,4-дибромбутана и кипятят с обратным холодильником при перемешивании в течение 16 ч. Ацетонитрил отгоняют в вакууме,остаток собирают в 250 мл воды и подщелачивают натровым щелоком. Смесь экстрагируют 3 раза по 100 мл дихлорметана, объединенные органические фазы промывают, затем сушат и отгоняют растворитель. Остаток очищают посредством скоростной хроматографии на колонке из диоксида кремния, элюируя дихлорметаном, постепенно обогащаемым ацетоном. Вес: 0,75 г, выход = 7,5%. Анализ соотносится с C28H25Cl2N5O2 С.С.М.: S.A6; 0,85. ЯМР 1H(част. на млн): 1,90-2,05 (m,4H); 3,00-3,10 (m,1H); 3,15-3,25 (m,4H); 3,25-3,40= -NR2R3; R2-R3 = -(СН 2)2-O-(СН 2)2-]. Соединение получают тем же способом,как в предыдущем примере 22, исходя из 1,0 г= 4-амино-3,5-дихлорфенил В = -NR2R3; R2 = C(NH)NH2 R3 = Н]. В реактор на 250 мл вводят 2,02 г (4,2 ммол) (3R)4-амино-N-(9-амино-4-оксо-1-фенил 3,4,6,7-тeтрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)-3,5-дихлорбензамида в растворе в 50 мл дихлор-метана. Добавляют 5 мл 4 н. хлороводородного эфира, затем выпаривают в вакууме. Остаток собирают при перемешивании в 150 мл ацетонитрила и при перемешивании при 20-25 С добавляют 0,192 г (4,6 ммол) цианамида. При перемешивании суспензию нагревают и кипятят с обратным холодильником в течение 41 ч. После охлаждения примерно до 10 С нерастворимую часть фильтруют, собирают в 25 мл воды. Смесь подщелачивают 10 н. натровым щелоком и экстрагируют 2 раза 50-ю мл дихлорметана. Объединенные органические фазы промывают, сушат, затем растворитель отгоняют. Сырой продукт (1,0 г) очищают методом скоростной хроматографии на диоксиде кремния. Элю-ция дихлорметаном и метанолом с 10% аммиака в соотношении 50-50 дает возможность очистить ожидаемый продукт. Вес = 0,27 г. Выход = 13% - светло-желтый порошок Т.пл. = 220 С. Анализ сообразуется с C25P21Cl2N7O2 (4H2O) С.С.М.: S.C; 0,20. ЯМР 1H(част. на млн): 3,00-3,15 (m,1 Н); 3,20-3,35 (m,1H); 3,90 q,1H); 4,45 (t,1H); 5,45 36 мид [(leb; A = 4-амино-3,5-дихлорфенил; В = NR2R3; R2 = R4 -С(O)СН 3; R3 = Н]. В колбу емкостью 25 мл вводят 2,50 г (3,12 ммол) (3R)4-амино-N-(9-амино-4-оксо-1-фенил 3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)-3,5-дихлорбензамида в растворе 12,85 мл безводного пиридина, затем добавляют 6,70 г либо 6,2 мл (6,56 ммол) уксусного ангидрида. Раствор перемешивают в течение 16 ч при 2025 С, затем в него добавляют 65 мл воды и перемешивают еще 4 ч при комнатной температуре. После чего смесь экстрагируют 3 раза с помощью 75 мл этилацетата, объединенные органические фазы промывают насыщенным раствором бикарбоната натрия, затем сушат и выпаривают в вакууме. Остаток очищают посредством скоростной хроматографии на колонке из диоксида кремния, элюируя дихлорметаном,последовательно обогащаемым метанолом. Очищенный остаток весом 2,0 г растворяют в этилацетате и промывают НСl, потом водой для удаления остаточного пиридина. Вес: 0,70 г выход = 43% - Т.пл. = 192 С. Анализ сообразуется с C26H21Cl2N5O3, (0,6 H2O) С.С.М.: S.A1; 0,75. ЯМР 1H(част. на млн): 2,10 (s,3H); 3,003,15 (m,1 Н); 3,20-3,35 (m,1H); 3,95 (q,1H); 4,60(t,1H); 4,85 (s,2H); 5,35(d,1H); 7,00 (s,1H); 7,257,50 (m,5H); 7,80 (s,2H); 7,85 (d,1H); 7,95 (s,1H); 8,35 (s,1H). ИКС: 3300, 1660, 1610, 1540, 1470, 1370,1270, 780, 700 см-1. Пример 26. (3R)4-Амино-3,5-дихлор-N-(92-[2-(2-метокси-эток-си)этокси]-ацетиламино 4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4] диазепино[6,7,1-hi]индол-3-ил)-бензамид [(Ieb; А = 4 амино-3,5-дихлорфенил; В = -NR2R3; R2 = R4 = СН 3-(О-СН 2-СН 2)2-O-СН 2-СО; R3 = Н]. Соединение получают тем же способом,как в примере 2, исходя из (3R)4-амино-N-(9 амино-4-оксо-1-фенил-3,4,6,7-тетрагидро-[1,4] диазепино[6,7,1-hi]индол-3-ил)-3,5-дихлорбензамида (продукт примера 4) и 3,6,9-триоксодекановой кислоты. Продукт счищают скоростной хроматографией на диоксиде кремния, элюируя дихлорметаном, постепенно обогaщаемым ацетоном. Выход = 45% - белый порошок - Т.пл. = 105107 С -Анализ сообразуется с C31H31Cl2N5O6,(0,55 Н 2 О) - C.C.M.: S.A6; 0,25. ЯMP 1H(част. на млн): 3,05-3,20 (m,1H); 3,25 (s,3H); 3,30-3,40 (m,3H); 3,45-3,60 (m,2H); 3,60-3,80 (m,4H); 4,00 (q,1H); 4,10 (d,2H); 4,65= -NR2R3; R2 = R4 = HOOC-CH2-(O-CH2-CH2)2O-CH2-CO; R3 = H]. Соединение получают так же, как в предыдущем примере 23 с 3,6,9-триоксаундекановой кислотой. Продукт очищают хроматографически, затем собирают в диэтиловый эфир. Выход= -NR2R3; R2 = R4 = СН 3-(СН 2)14-СО; R3 = Н]. В колбе емкостью 25 мл, в атмосфере азота, растворяют 1,00 г (2,1 ммол) (3R)4-аиино-N(9-амино-4-оксо-1-фенил-3,4,6,7-тет-рагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)-3,5 дихлорбензамида (продукт примера 4) в 10,0 мл безводного пиридина. Затем добавляют при 2025 С 0,63 г (2,3 ммол) гексадеканового ангидрида (или пальмитилхлорида). Раствор перемешивают при 20-25 С в течение 22,5 ч, затем концентрируют в вакууме. Остаток собирают в 50 ил смеси дихлорметан-диэтиловый эфир 1-1(по объему). Органическую фазу промывают 3 раза 25 мл раствора HClN, затем последовательно 3 раза 25 мл 10% раствора NaOH и 3 раза 25 мл воды, после чего ее сушат и растворители отгоняют. Остаток собирают в гептан, фильтруют, затем сушат. Вес: 0,90 г Выход = 60% белый порошок - Т.пл. = 130 С -Анализ сообразуется с C40N49Cl2N5O3 - С.С.М.: S.A; 0,85. ЯМР 1H(част. на млн): 0,85 (t,3H); 1,25R4 = СН 3-СО; R3 = Н]. В колбе на 50 мл в атмосфере азота растворяют 0,45 г (1,ммол) (3R)изохинолин-3 карбоновой кислоты (9-амино-4-оксо-1-фенил 3,4,6,7-тетрагидро-[1,4][6,7,1-hi]индол-3-ил)амида (продукта примера 18) в 10 мл безводногопиридина. Добавляют 3,0 мл (30 ммол) уксус 001593 38 ного ангидрида, перемешивают смесь при 2025 С в течение 30 мин, затем осаждают смесь в 100 мл ледяной воды, раствор экстрагируют дихлорметана, органическую фазу промывают водой, сушат, затем растворители отгоняют в вакууме. Остаток собирают в 100 мл этилового эфира и перемешивают при 10 С в течение 30 мин, осаждают и сушат. Вес: 0,40 г Выход = 82% -Белый порошок - Т.пл. = 280 С Анализ сообразуется с C29H23N5O3 - С.С.М.: S.A; 0,20 ЯМР 1H(част. на млн): 2,10 (s3H); 3,00-3,10H]. Получение таким же образом, как в примере 10, с промежуточным амином 2 и бензфуран 2-карбоновой кислотой. После очистки хроматографией, элюируя дихлорметаном, последовательно обогащаемым ацетоном, затем отгонки растворителей, продукт получают в форме аморфного порошка.[(lee); А = 4-пиридил; В = -NR2R3; R2 = R3 = (CH2)4-]. В реакторе, защищенном от влаги, растворяют в 24,0 ил безводного пиридина 1,20 г (3,46 ммол) (3R)-3-амино-1-фенил-9-(пирролидин-1 ил)-6,7-дигидро-3 Н-[1,4]диазепино[6,7,1-hi]индол-4-она IIf) промежуточного соединения 4. К раствору при температуре 0 С добавляют 0,92 г (5,17 ммол) хлоргидрата ангидрида изоникотиновой кислоты. Суспензию перемешивают при 20-25 С в течение 48 ч в атмосфере азота. Затем добавляют 10 мл воды и 10 мл дихлорметана. Органическую фазу отделяют,водную фазу экстрагируют снова дихлорметаном. Органические фазы объединяют, промывают водой и сушат. После выпаривания растворителей остаток очищают скоростной хроматографией на колонке из оксида кремния. Элюция дихлормета 39 ном,постепенно обогащаемым метанолом, приводит к получению, после удаления растворителей, продукта в чистой форме в виде аморфного желтого порошка. Вес: 0,30 г - Выход = 19,2% Т.пл.= 273 С -С.С.М.: S.A10; 0,50. ЯМР 1H(част. на млн): 2,00 (m,4H); 3,00= 4,7-диметилпиразоло[5,1-с][1,2,4]-3-триазинил; В = -NR2R3; R2-R3 = (CH2)4-. Соединение получают таким же способом,как в примере 2, исходя из промежуточного соединения 4 4,7-диметилпиразоло[5,1-с][1,2,4] триазин-3-карбоновой кислоты. Продукт очищают посредством скоростной хроматографии на диоксиде кремния, элюируя дихлорметаном,последовательно обогащаемым метанолом. Выход = 20% - Аморфный желтый порошок - Т.пл.= 300 С С.С.М.: S.A87 0,20. ЯМР 1H(част. на млн): 2,10 (m,4H); 2,60(s,3H); 3,00(m,1H); 3,15 (s,4H); 3,25 (s,3H); 3,30 (s,1H); 3,90 (q,1H); 4,60(m,1H); 5,60 (d,1H); 6,25 (s,1H); 6,70 (s,1H); 7,00 (s,2H); 7,35 (m,3H); 7,60 (d,2H); 9,80 (d,1H). ИКС: 1660, 1560, 1450, 1360, 1240, 700 см-1. Биологическая часть Ингибирующая активность фосфодиэстеразы Способность соединений формулы (I) данного изобретения ингибировать фосфодиэстеразы циклических нуклеотидов оценивают посредством измерения их IC50 (концентрация,необходимая для ингибирования 50% ферментативной активности). В случае ФДЭIV эту величину сравнивают с IC50 ролипрама, специфического ингибитора ФДЭIV, через отношение IC50 ролипрама к IC50 испытуемого соединения на одинаковых ферментативных препаратах. Различные типы фосфодиэстераз получены в частично очищенном виде на колонке ДЭАЭцеллюлозы (диэтиламиноэтил-целлюлоза) из трахеи морской свинки и аорты собаки, согласно адаптированному методу W.J. Thompson и др., 1979, Advances in cyclic Nucleotide Research,Vol.10:69-92, изд.G. Brooker и др. Raven Press,New York, и P.J. Silver и др.,1988,Eur.J.Pharmacol. 150:85-94, и из клеточной линии человека U937, согласно адаптированному методу T.J. Torphy и др., 1992, J.Pharm.Exp.Ther. 263: 1195-1205. Затем измерение ферментативной активности разного типа ФДЭ, и в частности ФДЭIV, осуществляли аналогично адаптированному методу W.J. Thompson (там же). Для определения IC50 ферментативную активность 40 измеряют в присутствии ингибитора в диапазоне концентраций от 0,1 до 100 M. Следующая таблица иллюстрирует ингибирующую активность. ФДЭIV по сравнению с активностью ролипрама на одном препарате фермента, полученного из линии U937. Опыт 1 4 8 12 А 12 А (соль) 13 Изучение результатов, данных в предыдущей таблице, показывает, что в опытах испытуемые соединения в соответствии с изобретением ингибируют обычно фермент ФДЭIV человеческого происхождения более эффективно,чем ролипрам, а в некоторых случаях они примерно в 30 раз более активны, чем ролипрам. Кроме того, опыты, поставленные на очищенных ФДЭ разного типа, полученных из трахеи морской свинки или аорты собаки, показывают,что значения IC50, полученные для соединений согласно изобретению, для ФДЭ типа III и типаI и V являются значительно более высокими,чем значения, измеренные для ФДЭ типа IV. Эти результаты доказывают сильное и селективное ингибирующее действие на ФДЭIV соединений данного изобретения. Противовоспалительное и антиаллергическое действие in vivo Действие соединений данного изобретения изучали на морской свинке в модели инфильтрации эозинофилов, вызванной антигенной стимуляцией или действием аэрозоля PAF (фактора активации тромбоцитов) по методологии, описанной Lagente V. и др., (1994) Br.J.Pharmacol. 112, 83P. Введение соединений примеров (1-30 мг/кг веса) значительно снижает число эозинофилов в бронхо-альвеолярной омывающей жидкости. Введение соединений согласно изобретению также снижает воспалительные реакции,вызванные интратрахеальным капельным вливанием IL-5 у морской свинки. Эти результаты показывают противовоспалительное и/или иммуно-супреcсорное действие соединений данного изобретения. Соединения согласно изобретению будут, таким образом, особенно полезны для лечения и профилактики: аллергических патологий, а именно астмы, атопического дерматита, воспалительных патологий, а именно на уровне бронхов, но также ревматоидного полиартрита, а также воспалительных кишечных заболеваний (кровоточащий ректоколит и болезнь Крона); включая патологии, когда присутствует аутоиммунный компонент. Галеновая часть Соединения данного изобретения вводят в форме составов, соответствующих природе и тяжести заболевания, которое подлежит лечению. Ежедневная доза для человека обычно составляет от 2 мг до 1 г соединения, которые могут быть введены в виде одной или нескольких порций. Составы готовят в форме, соответствующей предусмотренным путям введения, например, в форме таблетки, драже, капсулы, лекарства для слизистой оболочки горла и носа,аэрозоли, порошка для ингаляции, суппозитория, геля или суспензии. Эти составы получают способами, обычными для специалиста, и они включают от 0,5 до 60% по весу основного активного вещества (состав формулы I) и от 40 до 99,5% по весу фармацевтического наполнителя,соответствующего и совместимого с основным активным веществом и физической формой предполагаемого состава. В качестве примера представляют состав и приготовление таблеток,содержащих соединение данного изобретения: Активное вещество формулы (I) Лактоза Микрокристаллическая целлюлоза Поливинилпирролидон Натриевый карбоксиметиламидон Стеарат магния Перемешать активное вещество, лактозу,микрокристаллическую целлюлозу и карбоксиметиламидон. Смочить и гранулировать с помощью водного или спиртового поливинилпирролидона соответствующей концентрации. Сушить и калибровать гранулы. Смешать гомогенным образом стеарат магния. Прессовать с усилием 200 мг на таблетку. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Диазепино-индолы формулы (I) в которой А представляет собой фенил или нафтил или азотсодержащий гетероарил, причем каждый возможно замещен 1-3 группами, независимо выбранными из галогена, С 1-4 алкила, галоалкила, С 1-4 алкокси, циклоалкилокси, амино,С 1-4 алкилкарбониламино или С 1-4 алкилоксикарбониламино; В представляет собой: 1) -OR1, причем R1 является -Н или R4,2)-С(NН)NН 2 и R3 является -Н,3) -NR2R3, причем R2 является R4, и R3 является -Н, 42 4) -NR2R3, причем R2 и R3 независимо представляют собой -Н или C1-4 алкил, или 5) -N-R2-R3, причем R2 и R3 образуют вместе с атомом азота, к которому они присоединены, насыщенный 5-7-членный гетероцикл,который в качестве второго гетероатома, не присоединенного непосредственно к атому азота, может содержать кислород, серу или азот;R4 представляет собой: 1)-СН 2-СO2 Н,2) -СО-(СН 2)р-СO2 Н,3) -СО-А, где А определено как указано выше,4) -СО-СН=СН-СO2 Н,5) -СО-(СН 2)n-СН 3, причем n является целым числом, равным или превышающим 0 и меньшим чем или равным 18,6) -СО-(СН 2-O-СН 2)р-СН 2-O-СН 3,7) -СО-(СН 2-O-СН 2)р-СO2 Н,8) -(CH2)p-NR5R6, причем R5 и R6 независимо представляют собой -Н или С 1-4 алкил, или 9) -(CH2)p-N-R5-R6, причем R5 и R6 образуют вместе с атомом азота, к которому они присоединены, насыщенный 5-7-членный гетероцикл, который в качестве второго гетероатома, не присоединенного непосредственно к атому азота, может содержать кислород, серу или азот; р является целым числом, равным 2, 3 или 4; их рацемические формы и изомеры конфигурации, определяемой, в частности, 3 углеродом кольца диазепино-индол-4-она,а также их фармацевтически приемлемые соли. 2. Диазепино-индолы формулы (I) по п.1,отличающиеся тем, что асимметрический атом углерода в альфа положении по отношению к карбонилу диазепинового кольца имеет абсолютную конфигурацию R согласно правилу Кана-Ингольда-Прелога. 3. Диазепино-индолы формулы (I) по п.1 или 2, отличающиеся тем, что В представляет собой OR1 или NR2R3, где R1, R2, R3 являются водородами. 4. Диазепино-индолы формулы (I) по одному из пп.1-3, в которой А является фенилом или нафтилом, замещенным 1-3 группами, независимо выбранными из галогена, амино и С 1-4 алкокси. 5. Диазепино-индолы формулы (I) по одному из пп.1-4, в которой А является азотсодержащим моноциклическим гетероарилом,содержащим от 1 до 2 атомов азота, или бициклическим азотсодержащим гетероарилом, содержащим от 1 до 4 атомов азота. 6. Диазепино-индолы формулы (I) по п.5, в которой А является гетероарилом, замещенным группами амино, С 1-4 алкил, С 1-4 алкилоксикарбониламино или С 1-4 алкилкарбониламино. 7. Соединение (I) по одному из пп.1-6, которое выбрано из группы, состоящей из(3R)-3-амино-N-(9-амино-4-оксо-1-фенил 3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида. 11. Лекарство, отличающееся тем, что оно содержит диазепиноиндол, как он определен в одном из пп.1-10. 12. Лекарство, отличающееся тем, что оно содержит (3R)-N-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3 ил)никотинамид. 13. Лекарство, отличающееся тем, что оно содержит(3R)-4-амино-N-(9-амино-4-оксо-1 фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1hi]индол-3-ил)-бензамид. 14. Лекарство, отличающееся тем, что оно содержит соединение, выбранное из группы,состоящей из(3R)-3-амино-N-(9-амино-4-оксо-1-фенил 3,4,6,7-тетрагидро-[1,4]диазепино[6,7,1-hi]индол-3-ил)изоникотинамида. 15. Амино-диазепино-индолы, которые являются промежуточными соединениями в получении соединений формулы (I) по любому из пп.1-14, соответствующие формуле (II) в которой В представляет собой OR1 или NR2R3,причем R1, R2 и R3 являются водородами. 16. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ib) формулы (I), в которой В является группой -ОН, ацилируют аминодиазепино-индол (IIb) формулы (II) как определено в п.15, в которой В является группой -ОН,реактивом (III) формулы Z-CO-A, в которой А представляет собой азотсодержащий фенил или нафтил или гетероарил, причем каждый возможно замещен 1-3 группами, независимо выбранными из галогена, С 1-4 алкила, С 1-4 галоалкила, С 1-4 алкокси, циклоалкилокси, амино, С 1-4 алкилоксикарбониламино или C1-4 алкилкарбониламино,a Z представляет собой галоген, гидроксигруппу, азидогруппу, группу имидазол-1-ил или группу -O-CO-Z1, причем Z1 может быть, кроме А, объемистым алкильным или алкоксильным 46 радикалом, содержащим от 3 до 6 атомов углерода, или же альтернативно Z может быть группой O-Z2, причемZ2 является ароматической группой, содержащей одно или два кольца, замещенных одним или более чем одним нитро- или галогенорадикалами. 17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ie) формулы (I), в которой В является группой -NH2, ацилируют соединение-NH2, реактивом (III), определенным в п.16. 18. Способ по п.17, где в реактиве (III) Z является группой ОН. 19. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ibb) формулы (I), в которой В является группой -O-CO-V; причем V обозначает группу, выбранную из-А, такого, как определено в п.16,-(СН 2)р-СO2 Н, где р означает целое число,равное 2, 3 или 4,-СН=СН-СO2 Н,-(СН 2)n-СН 3, где n является целым числом,равным или превышающим 0 и меньшим чем или равным 18,-(СН 2-O-СН 2)р-СН 2-O-СН 3, где р означает целое число, равное 2, 3 или 4, или-(СН 2-O-СН 2)р-СO2 Н, где р означает целое число, равное 2, 3 или 4,этерифицируют соединение (Ib), определенное в п.16, реактивом (III') формулы V-CO-Z,в которой Z имеет значение, определенное в п.16. 20. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ibс) формулы (I), в которой В является группой -O-R4, причем R4 является группой, выбранной из(Ib), определенное в п.16, с сильным основанием, таким как гидрид щелочного металла, для того чтобы получить фенолят, который приводят во взаимодействие с галогенидом XR4. 21. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Iea) формулы (I), в которой В является группой -NH-C(NH)-NH2, приводят во взаимодействие соединение (Ie), определенное в п.17, с агентом гуанилирования, таким как цианамид. 22. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ieb) формулы (I), в которой В является группой -NH-CO-V, причем V имеет(III') V-CO-Z, определенном в п.19. 23. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Iec) формулы (I), в которой В является группой -NH-R2, причем R2 представляет собой С 1-4 алкил или группу R4, так как она определена в п.20, приводят во взаимодействие соединение (Ie), определенное в п.17, в присутствии сильного основания с алкилгалогенидомXR2. 24. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ied) формулы (I), в которой В является группой -NR2R3, причем R2 и R3 представляют собой С 1-4 алкилы, осуществляют восстановительное алкилирование соединения (Iec),определенного в п.23, альдегидом R'3CHO, в котором R'3 представляет собой ближайший низший гомолог R3. 25. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Iee) формулы (I), в которой В является группой -N-R2-R3, причем R2 и R3 образуют гетероцикл, осуществляют циклизацию путем взаимодействия соединения (Ie), определенного в п.17, с реактивом формулы X-(CH2)lQ-(CH2)m-X', в которой Х и X', которые могут быть одинаковыми или разными, являются галогенами, Q представляет собой:- простую валентную связь, и l и m являются целыми числами от 1 до 3, причем l + m больше чем или равно 4 и меньше чем или равно 6,- кислород, серу или группу -NH-, и в этом случае l и m являются целыми числами от 1 до 3, причем l + m больше чем или равно 3 и меньше чем или равно 5. 26. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ib) формулы (I), в которой В является группой -ОН, O-деметилируют в положении 9 диазепино-индольного кольца промежуточное соединение (1'c) формулы галогенидом бора или алюминия. 27. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ib) формулы (I), в которой В является группой -ОН, диазотируют на первой стадии соединение (Ie) формулы (I), в которой В является группой -NH2, и затем на второй стадии гидролизуют промежуточную соль диазония. 28. Способ получения соединений формулы (I) по п.1, отличающийся тем, что для получения соединений (Ie) формулы (I), в которой В является группой -NH2, восстанавливают нитрорадикал промежуточного соединения (1'd) формулы действием металла, такого как Zn или Sn, в кислой среде или действием хлорида или сульфида металла, такого как TiCl3 или Na2S. 29. Способ получения (3R)-N-(9-амино-4 оксо-1-фенил-3,4,6,7-тетрагидро[1,4]-диазепино(3R)-3,9-диамино-1-фенил-6,7-дигидро-3 Н-[1,4] диазепино[6,7,1-hi]индол-4-он приводят во взаимодействие с 3-пиридинкарбоновой кислотой и выделяют желаемый продукт. 30. Способ получения (3R)-4-амино-N-(9 амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4] диазепино[6,7,1-hi]индол-3-ил)бензамида, при котором (3R)-4-трет-бутилоксикарбониламиноN-(9-амино-4-оксо-1-фенил-3,4,6,7-тетрагидро[1,4]диазепино[6,7,1-hi]индол-3-ил)бензамид приводят во взаимодействие с трифторуксусной кислотой и выделяют желаемый продукт.
МПК / Метки
МПК: C07D 487/06, A61P 11/06, C07D 519/00, A61K 31/551
Метки: ингибиторы, диазепино-индоловые, фосфодиэстераз
Код ссылки
<a href="https://eas.patents.su/25-1593-diazepino-indolovye-ingibitory-fosfodiesteraz-iv.html" rel="bookmark" title="База патентов Евразийского Союза">Диазепино-индоловые ингибиторы фосфодиэстераз iv</a>
Предыдущий патент: Буксируемая сейсмоприемная коса, используемая при морской сейсмической разведке
Следующий патент: Ингибиторы адгезии клеток.
Случайный патент: Композиция для очистки твердых поверхностей












