Способ получения соединений имидазола
Номер патента: 6770
Опубликовано: 28.04.2006
Авторы: Брукс Руди Лоран Мария, Леэр Стефан Марсель Херман, Филльер Вальтер Фердинанд Мария
Формула / Реферат
1. Способ получения 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил-1Н-имидазол-5-ил)метил]-1-метил-2(1Н)-хинолинона (III) и его фармацевтически приемлемых солей
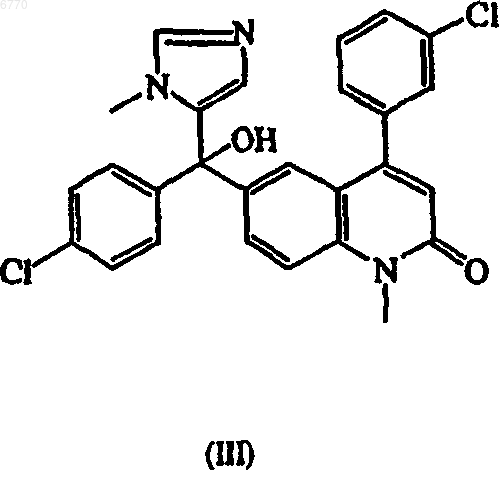
который включает взаимодействие 6-(4-хлорбензоил)-4-(3-хлорфенил)-1-метил-2(1Н)-хинолинона (II)
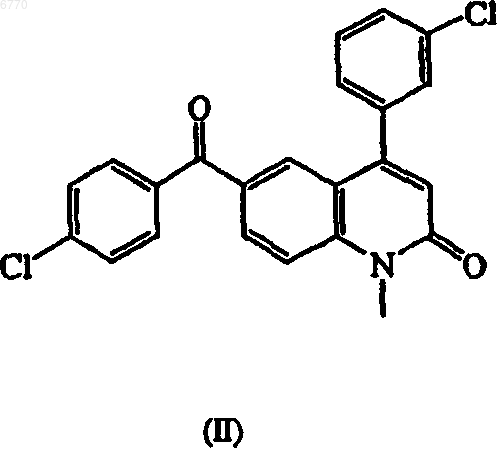
с н-гексиллитием, 1-метилимидазолом и три-изобутилсилилхлоридом при температуре по меньшей мере -20шС.
2. Способ по п.1, в котором взаимодействие проводят при температуре от -5 до +5шС.
3. Способ по п.1 или 2, в котором полученное соединение (III) далее применяют в качестве промежуточного соединения для получения R-(+)-6-[амино(4-хлорфенил)(1-метил-1Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1Н)-хинолинона.
Текст
006770 Данное изобретение относится к получению 5-замещенных соединений имидазола, которые обладают ингибирующим действием в отношении фарнезилтрансферазы и которые также применяются в качестве промежуточных соединений для получения других соединений имидазола, имеющих такое действие. Онкогены часто кодируют белковые компоненты путей трансдукции сигнала, что ведет к стимулированию роста клеток и митогенезу. Экспрессия онкогенов в культивированных клетках приводит к клеточной трансформации, характеризующейся способностью клеток расти в мягком агаре, и росту клеток в виде плотных очагов, при отсутствии контактного ингибирования, которым обладают нетрансформированные клетки. Мутация и/или чрезмерная экспрессия определенных онкогенов часто связана с раком человека. Определенная группа онкогенов известна как ras и была выявлена у млекопитающих, птиц,насекомых, моллюсков, растений, грибов и дрожжей. Семейство ras онкогенов млекопитающих состоит из трех основных членов ("изоформ"): H-ras, К-ras и N-ras онкогены. Такие ras онкогены кодируются для высокородственных белков, известных как p21ras. При присоединении к мембранам плазмы мутант или онкогенная форма p21ras дает сигнал для трансформации и неконтролируемого роста клеток злокачественной опухоли. Для того чтобы приобрести такой трансформирующий потенциал, предшественникp21ras онкобелка должен претерпеть катализируемое ферментами фарнезилирование цистеинового остатка, расположенного в тетрапептиде с концевым карбоксилом. Поэтому ингибиторы ферментов, которые катализируют данную модификацию, т.е. фарнезилтрансферазы, предотвращают присоединение p21ras к мембране и блокируют аномальный рост ras-трансформированных опухолей. Следовательно, в данной области техники принято, что ингибиторы фарнезилтрансферазы могут быть очень полезны в качестве противораковых агентов для опухолей, в трансформации которых играет роль ras. В WO 97/16443, WO 97/21701, WO 98/40383 и WO 98/49157 описаны производные 2-хинолона, которые обладают действием, ингибирующим фарнезилтрансферазу. В WO 00/39082 описан класс новых 1,2-аннелированных соединений хинолина, имеющих связанный с атомом азота или углерода имидазол,которые демонстрируют действие, ингибирующее фарнезилпротеинтрансферазу и геранилгеранилтрансферазу. Другие соединения хинолина, имеющие действие, ингибирующее фарнезилтрансферазу, описаны в WO 00/12498, 00/12499 и 00/47574. Определенное соединение, описанное в указанном выше WO 97/21701, а именно, (R)-(+)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)1-метил-2(1 Н)-хинолинон, обладает очень сильным действием против неоплазии и в настоящее время является предметом клинических испытаний, проводимых для определения величины его терапевтического действия против различных раковых заболеваний. Абсолютная стереохимическая конфигурация соединения не определена в экспериментах, описанных в указанном выше описании к патенту, но соединение идентифицировано префиксом "(В)", показывающим, что это второе соединение, выделенное хроматографией на колонке. Было обнаружено, что полученное таким образом соединение имеет (R)-(+)конфигурацию. Это соединение, которое ниже обозначено его опубликованным кодом R115777, имеет следующую формулу (I): Получение R115777 описано в WO 97/21701 и представляет собой синтез, который включает ключевую стадию введения 1-метилимидазолильной группы в соответствующее оксосоединение, как показано ниже: Как описано в примере В 1 указанного выше описания к патенту, 1-метилимидазол в тетрагидрофуране смешивают с раствором н-бутиллития в гексановом растворителе, к которому добавляют хлортриэтилсилан (триэтилсилилхлорид) с последующим добавлением н-бутиллития в гексане, полученную смесь охлаждают до -78 С перед добавлением раствора соединения (II) в тетрагидрофуране. Реакционную смесь последовательно доводят до комнатной температуры и затем гидролизуют, экстрагируют-1 006770 этилацетатом и органический слой обрабатывают с получением желаемого продукта, 52% выхода соединения (III). Последнее соединение может быть превращено в R115777, как описано в WO 97/21701. Для того чтобы получать R115777 в промышленных масштабах в целях развития и маркетинга, требуется эффективный способ синтеза для получения R115777. Однако метод, описанный в WO 97/21701,превращения соединения (II) в соединение (III) имеет ряд недостатков. Например, метод приводит к нежелательному образованию соответствующего соединения, в котором имидазольное кольцо присоединено к остатку молекулы в положении 2 кольца, вместо желаемого положения 5 в R115777. Для достижения экономичного производства желаемого 5-изомера, важно снизить образование нежелательного 2 изомера, и в промышленном масштабе даже такое снижение, как 1% или 2%, очень ощутимо. Также имеется значительное образование других примесей в конечном продукте, например, соответствующего соединения бисимидазола. Применение н-бутиллития также является нежелательным в коммерческом процессе, с точки зрения его пирофорной природы и образования бутана, воспламеняющегося газа, в качестве побочного продукта. Наконец, проведение процесса при низкой температуре, такой как -78 С, неудобно и дорого в промышленном масштабе, так как для проведения промышленного процесса при такой низкой температуре необходимо специальное оборудование. Поэтому существует необходимость в улучшении указанной выше стадии взаимодействия, которая может проводиться эффективным и экономичным способом в промышленном масштабе. Объектом данного изобретения является новый и улучшенный способ получения соединения (III) из соединения (II) с улучшенным выходом первого соединения при минимизации образования нежелательных изомеров и в условиях, которые обеспечивают экономические преимущества для производства в промышленных масштабах. Заявители обнаружили, что улучшение выхода, чистоты и коммерческой простоты проведения процесса может быть достигнуто применением н-гексиллития вместо н-бутиллития и применением триизобутилсилилхлорида вместо триэтилсилилхлорида, где особенно предпочтительные результаты получают при применении температуры по меньшей мере -40 С. Согласно одной из характеристик данного изобретения представлен способ получения соединения(III), т.е. 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-2(1 Н)хинолинона, и его фармацевтически приемлемых солей: который включает взаимодействие соединения формулы (II), т.е. 6-(4-хлорбензоил)-4-(3-хлорфенил)-1 метил-2(1 Н)-хинолинона: с соединением С 6-8 алкиллития, 1-метилимидазолом и три(C4-6 алкил)силилгалогенидом. Соединение С 6-8 алкиллития, предпочтительно, представляет собой соединение гексиллития, особенно н-гексиллитий. Три(С 4-6 алкил)силилгалогенид, предпочтительно, является трибутилсилилгалогенидом, особенно триизобутилсилилгалогенидом. Силилгалогенид, предпочтительно, является силилхлоридом. Указанное выше взаимодействие проводят при температуре по меньшей мере -40 С, предпочтительно по меньшей мере -20 С и предпочтительно при от -5 до +5 С, особенно при 0 С, более высокие температуры обеспечивают улучшенное соотношение С 5-/С 2-изомеров, т.е. соотношение между соединением, в котором имидазолильная группа присоединена к остатку молекулы в положении С 5, и соответствующего соединения, присоединенного в положении С 2. Такая селективность при относительно высоких температурах является примечательной, с точки зрения предположений, имеющихся в литературе, что силильная группа не подходит в качестве блокирующей группы из-за миграции из положения 2 в положение 5 2-(триалкилсилил)замещенных 5-литий-1-метилимидазолов (G. Shapiro and M. Marzi, Tetrahedron Letters, том 34,21, стр. 3401-3404, 1993; G. Shapiro and В. Gomez-Lor, J. Organic Chemistry,том 59, стр. 5524-5526, 1994). Взаимодействие обычно проводят в эфирном органическом растворителе, например, простом диэтиловом эфире, простом трет-бутилметиловом эфире или более предпочтительно тетрагидрофуране.-2 006770 Более подробно, взаимодействие может проводиться сначала получением раствора 1-метилимидазола в растворителе, таком как тетрагидрофуран, к которому добавляют порцию гексиллития в растворителе, таком как н-гексан. Затем к полученной реакционной смеси добавляют силилгалогенид и добавляют дополнительную часть гексиллития в растворителе, таком как н-гексан. Соединение формулы(II) в растворителе, таком как тетрагидрофуран, затем добавляют к реакционной смеси, сохраняя температуру от -5 С до 0 С. Полученный продукт формулы (III) может быть выделен кристаллизацией в виде основания или образованием соли. После концентрации реакционной смеси к остатку добавляют подходящий растворитель, предпочтительно изопропилацетат, с получением осаждения продукта. Для образования соли газообразную хлористо-водородную кислоту или раствор хлористо-водородной кислоты предпочтительно в 2-пропаноле, добавляют непосредственно в реакционную смесь в тетрагидрофуране с получением осаждения соли. Альтернативно, хлористо-водородную кислоту добавляют к раствору реакционного остатка в подходящем растворителе, предпочтительно ацетоне, с получением осаждения соли. Полученное соединение формулы (III) может быть далее превращено в R115777, например, как описано в WO97/21701, или более предпочтительно, как описано ниже. Таким образом, например, соединение формулы (III) может быть хлорировано с получением следующего соединения формулы (IV), т.е. 4-(3-хлорфенил)-6-[хлор(4-хлорфенил)(1-метил-1 Н-имидазол-5 ил)метил]-1-метил-2(1 Н)-хинолинона: Указанное выше хлорирование может быть проведено, например, обработкой соединения формулы(III) тионилхлоридом или трихлоридом фосфора, в инертном растворителе, например толуоле, N,Nдиметилацетамиде или более предпочтительно N,N-диметилимидазолидиноне, например, при температуре от 0 С до температуры кипения реакционной смеси, предпочтительно при комнатной температуре. Соединение хлора формулы (IV) может быть обработано in situ, без необходимости выделения соединения, аминирующим агентом с получением следующего аминосоединения формулы (V), т.е. 6-[амино(4 хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона: Реакция аминирования может быть проведена обработкой соединения формулы (IV) газообразным аммиаком или раствором аммиака в подходящем растворителе, предпочтительно метаноле, где взаимодействие проводят в инертном растворителе, например толуоле, или добавлением аммиака к раствору соединения (IV) в N,N-диметилацетамиде или предпочтительно N,N-диметилимидазолидиноне. Взаимодействие проводят, например, при температуре от 0 до 40 С, предпочтительно при комнатной температуре. Если растворитель является N,N-диметилимидазолидиноном, полученное соединение выделяют добавлением воды, что дает осаждение соединения формулы (V), которое затем может быть отфильтровано, промыто водой и высушено. Соединение формулы (V) получают в виде неразделенной формы, и оно может быть разделено на свои энантиомеры обычным методом, например, обработкой хиральной кислотой с получением соответствующих диастереомерных солей, которые затем могут быть разделены,и соль, имеющую желаемую R-конфигурацию, превращают в соответствующее соединение R115777. Таким образом, например, соединение может быть подвергнуто взаимодействию с L-(-)-дибензоилвинной кислотой (ДБВК) с получением диастереомерного тартрата, который обрабатывают основанием,предпочтительно водным гидроксидом аммония, с получением неочищенного R-(+)-R115777, которое затем очищают перекристаллизацией из этанола. Указанный выше промежуточный тартрат, т.е. R-(-)-6[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинон [R(R,R)]-2,3-бис(бензоилокси)бутандиоат (2:3), является новым соединением и представляет собой еще один объект данного изобретения. Полученный R-(+)-R115777 может применяться для терапевтического лечения раковых заболеваний, как описано в WO 97/21701. Исходное соединение формулы (II), которое-3 006770 применяется в способе в соответствии с данным изобретением, может быть получено, как описано в WO 97/21701. Следующие примеры иллюстрируют данное изобретение. Получение соединения (III) 110 мл сухого тетрагидрофурана добавляют к 7,6 мл 1-метилимидазола (0,0946 моль) и полученный раствор охлаждают до температуры -15 С. Добавляют 37,8 мл н-гексиллития 2,5 М в н-гексане (0,0946 моль), температуру во время добавления поддерживают на уровне от -5 С до 0 С. После добавления реакционную смесь перемешивают в течение 15 мин, охлаждая до -12 С. Добавляют 26,2 мл триизобутилсилилхлорида (0,0964 моль), температуру во время добавления поддерживают на уровне от -5 С до 0 С. После добавления реакционную смесь перемешивают в течение 15 мин, охлаждая до -13 С. Добавляют 37,2 мл н-гексиллития 2,5 М в н-гексане (0,0930 моль), температуру во время добавления поддерживают на уровне от -5 С до 0 С (имеет место некоторое осаждение). После добавления реакционную смесь перемешивают в течение 15 мин, охлаждая до -14 С. 128 мл сухого тетрагидрофурана добавляют к 26,22 г 6-(4-хлорбензоил)-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона (соединение (II (0,0642 моль) и перемешивают до растворения. Этот раствор добавляют к реакционной смеси, температуру во время добавления поддерживают на уровне от -5 до 0 С. После добавления реакционную смесь перемешивают в течение 15 мин при температуре от -5 до 0 С. К реакционной смеси добавляют 128 мл воды с последующим добавлением 10,6 мл уксусной кислоты. Смесь нагревают до 40 С и перемешивают в течение 2 ч. Слои разделяют и органический слой промывают 32 мл воды. 64 мл воды и 7,8 мл водного NaOH 50% добавляют к органическому слою, который перемешивают в течение 1 ч при температуре окружающей среды. Слои разделяют и органический слой концентрируют при пониженном давлении с получением 51,08 г коричневого масла (46,6 мас.% 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил-1 Н-имидазол-5 ил)метил]-1-метил-2(1 Н)-хинолинона (соединение (III); 75,6% выход). Продукт может быть выделен описанными ниже методами. Полученный продукт анализируют ВЭЖХ, применяя следующие условия: Колонка: Hypersil C18-BD 3 мкм, 100 мм x 4 мм (внутренний диаметр). Подвижная фаза: Растворитель А: 0,5% NH4OAc Растворитель В: Детектор: УФ 254 нм Растворитель: ДМФ. Найдено, что продукт имеет соотношение С 5:С 2 99,8:0,2. Для сравнения, при применении нбутиллития вместо н-гексиллития, триэтилсилилхлорида вместо триизобутилсилилхлорида и проведении процесса при -70 С, т.е. согласно методу, известному из уровня техники, описанному выше, полученный продукт имеет соотношение С 5:С 2 95:5, что имеет значительную разницу в промышленном масштабе. Получение соединения (IV) В 1-литровую реакционную колбу загружают 105,4 г гидрохлорида 4-(3-хлорфенил)-6-[(4 хлорфенил)гидрокси(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-2(1 Н)-хинолинона (соединения (III и добавляют 400 мл N,N-диметилимидазолидинон при температуре 22 С. Смесь энергично перемешивают в течение 15 мин при температуре 22 С, и она становится гомогенной. К реакционной смеси добавляют 32,1 мл тионилхлорида в течение более 10 мин, температуру реакции повышают с 22 С до 40 С. После добавления тионилхлорида реакционную смесь охлаждают с 40 С до 22 С и перемешивают в течение 3 ч при последней температуре с получением раствора 4-(3-хлорфенил)-6-[хлор(4-хлорфенил)(1-метил-1 Нимидазол-5-ил)метил]-1-метил-2(1 Н)-хинолинона (соединения (IV. Получение неразделенного соединения (I) 429 мл аммиака в 7 н. метаноле охлаждают до 5 С в 3-литровой реакционной колбе и добавляют раствор соединения (IV), полученный на предыдущей стадии, при перемешивании в течение более 10 мин, при экзотермической реакции при повышении температуры с 5 до 37 С. После завершения добавления реакционную смесь охлаждают до 22 С и перемешивают в течение 20 ч. Затем добавляют 1000 мл воды в течение более 20 мин, добавление является слегка экзотермическим, поэтому реакционную смесь охлаждают для поддержания температуры ниже 30 С. Затем смесь перемешивают в течение 22 ч при 22 С, полученный осадок отфильтровывают и осадок промывают 3 раза 100 мл воды с получением выхода 70-75% 6[амино(4-хлорфенил)-1-метил-1 Н-имидазол-5-илметил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона.-4 006770 Разделение соединения (I) а) В 3-литровую реакционную колбу загружают 146,8 г 6-[амино(4-хлорфенил)(1-метил-1 Нимидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона и 301,1 г моногидрата L-(-)-дибензоилвинной кислоты, добавляют 1200 мл ацетона и реакционную смесь энергично перемешивают в течение 10 мин при 22 С с получением раствора, в который вносят затравку 100 мг конечного тартрата (полученного в предыдущих скриннинговых экспериментах) и затем перемешивают в течение 22 ч при 22 С. Полученный осадок отфильтровывают и промывают дважды 75 мл ацетона, и продукт сушат при 50 С в вакууме с получением 114,7 г R-(-)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4(3-хлорфенил)-1-метил-2 (1 Н)-хинолинона [R-(R,R)]-2,3-бис(бензоилокси)бутандиоата (2:3).b) 41,08 г продукта стадии а) и 80 мл этанола перемешивают в течение 15 мин при 22 С. Добавляют 12,0 мл концентрированного водного гидроксида аммония в течение более 2 мин и реакционную смесь перемешивают в течение 1 ч при 25 С. Добавляют 160 мл воды в течение более 10 мин при 25 С и смесь кипятят с обратным холодильником и перемешивают при кипении в течение 1 ч. Затем реакционную смесь охлаждают до 20 С и перемешивают в течение 16 ч при 20 С. Продукт фильтруют, промывают дважды 8 мл воды и сушат при 50 С в вакууме с получением 16,87 г R-(+)-6-[амино(4-хлорфенил)(1 метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2 (1 Н)-хинолинона (соединения (I. Очистка соединения (I) 265 мл этанола добавляют к 19,9 г соединения (I), полученного как описано в предыдущей стадии, и смесь нагревают до температуры кипения с обратным холодильником (78 С) при перемешивании и затем перемешивают при температуре кипения с обратным холодильником в течение 15 мин перед охлаждением раствора до 75 С. Затем к смеси добавляют 1,0 г активированного угля (Norit A Supra), смесь перемешивают при температуре кипения с обратным холодильником в течение 1 ч, фильтруют теплой и затем фильтр промывают 20 мл теплого этанола. Фильтрат и промывной растворитель объединяют (продукт самопроизвольно кристаллизуется при 48 С) и смесь нагревают до температуры кипения с обратным холодильником и концентрируют удалением 203 мл этанола. Полученную суспензию охлаждают до 22 С, перемешивают в течение 18 ч при 22 С, охлаждают до 2 С и перемешивают в течение 5 ч при 2 С. Осадок отфильтровывают и промывают 4 мл этанола и продукт сушат при 50 С в вакууме с получением 17,25 г очищенного соединения (I), которое соответствует инфракрасному спектру, представленному в ссылке. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 4-(3-хлорфенил)-6-[(4-хлорфенил)гидрокси(1-метил-1 Н-имидазол-5-ил)метил]-1-метил-2(1 Н)-хинолинона (III) и его фармацевтически приемлемых солей который включает взаимодействие 6-(4-хлорбензоил)-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинона (II) с н-гексиллитием, 1-метилимидазолом и три-изобутилсилилхлоридом при температуре по меньшей мере -20 С. 2. Способ по п.1, в котором взаимодействие проводят при температуре от -5 до +5 С. 3. Способ по п.1 или 2, в котором полученное соединение (III) далее применяют в качестве промежуточного соединения для получения R-(+)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4(3-хлорфенил)-1-метил-2(1 Н)-хинолинона. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 403/06
Метки: соединений, получения, имидазола, способ
Код ссылки
<a href="https://eas.patents.su/6-6770-sposob-polucheniya-soedinenijj-imidazola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения соединений имидазола</a>
Предыдущий патент: Производные аминоизоксазола в качестве ингибиторов киназы
Следующий патент: Полиморфная форма римонабанта, способ её получения и содержащие её фармацевтические композиции
Случайный патент: Способ изготовления токопроводящего рельса, используемого при электролизе, и токопроводящий рельс










