Производные 5-гидрокси-4-аминометил-1-циклогексил(или циклогептил)-3-алкоксикарбонилиндола и их фармацевтически приемлемые соли, обладающие противовирусной активностью в отношении вируса гриппа а
Номер патента: 18346
Опубликовано: 30.07.2013
Авторы: Цыб Анатолий Фёдорович, Трофимов Фёдор Александрович, Цышкова Нина Гавриловна, Гончарова Анна Яковлевна, Розиев Рахимджан Ахметджанович, Подгородниченко Владимир Константинович, Верховский Юрий Григорьевич
Формула / Реферат
1. Средство, обладающее противовирусной активностью в отношении вируса гриппа А и представляющее собой производное 5-гидрокси-4-аминометил-1-циклогексил(или циклогептил)-3-алкоксикарбонилиндола общей формулы (I)
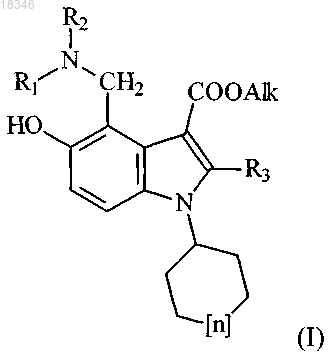
где n=1 или 2;
R3 представляет собой С1-С3-алкил;
Alk представляет собой C1-С6-алкильную группу;
R1 и R2, каждый независимо, представляет собой С1-С4-алкил или
группа NR1R2 означает группы, соответствующие формулам
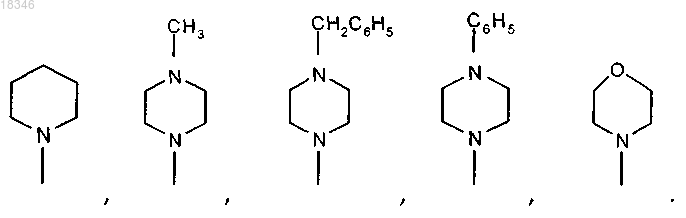
или его фармацевтически приемлемую соль.
2. Средство по п.1, где R1 и R2, каждый, представляет собой метил.
Текст
ПРОИЗВОДНЫЕ 5-ГИДРОКСИ-4-АМИНОМЕТИЛ-1-ЦИКЛОГЕКСИЛ(ИЛИ ЦИКЛОГЕПТИЛ)-3-АЛКОКСИКАРБОНИЛИНДОЛА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА А Рахимджан Ахметджанович, Цыб Анатолий Фдорович, Гончарова Анна Яковлевна, Трофимов Фдор Александрович, Подгородниченко Владимир Константинович (RU) Изобретение относится к производным 5-гидрокси-4-аминометил-1-циклогексил(или циклогептил)-3-алкоксикарбонилиндолов общей формулы (I) и их фармацевтически приемлемым солям, обладающим противовирусной активностью в отношении вируса гриппа А. Изобретение также относится к способу получения соединений формулы (I) где n=1 или 2, R3 представляет собой С 1-С 3-алкил, Alk представляет собой С 1-С 6-алкильную группу,R1 и R2 независимо выбираются из С 1-С 4-алкила, преимущественно метила, или группа NR1R2 означает группы, соответствующие формулам Изобретение относится к новой группе производных 5-гидрокси-4-аминометил-1-циклогексил(или циклогептил)-3-алкоксикарбонилиндолов, а также их фармацевтически приемлемым солям, обладающим противовирусной активностью. Указанные соединения могут найти применение для получения лекарственных средств для профилактики и лечения вирусных заболеваний. Известные противовирусные соединения и лекарственные препараты на их основе, как правило, обладают противовирусной активностью только в отношении определенных вирусов. Поэтому поиск и создание новых соединений, обладающих противовирусной активностью, и создание препаратов на их основе является жизненно необходимым. Механизм действия современных противовирусных средств заключается в блокировании одного из этапов воспроизводства вирусов в клетках вирусоносителя (человека), которые включают этап прикрепления вируса к клетке и проникновение внутрь е, встраивание нуклеиновой кислоты вируса в геном клетки-хозяина, синтез собственной ДНК и РНК, синтез и сборку собственных белков вируса. Большая часть имеющихся противовирусных средств представляет собой аналоги нуклеозидов. Они эффективны,однако после их применения у ряда больных возможен феномен рикошета, приводящий к обострению болезни. Кроме того, для ряда соединений с противовирусной активностью характерно развитие устойчивости вирусов к ним. В настоящее время для лечения гриппа широко используются в медицинской практике препараты,имеющие в качестве активной компоненты соединения группы амантадина (амантадин и ремантадин)(RU 2214997). Однако такие препараты оказывают побочное действие на ЦНС. Важным направлением в поиске новых противовирусных средств является поиск биологически активных соединений, на основе которых могут быть созданы лекарственные средства, которые обладали бы новым механизмом действия. Это могут быть средства, способные модулировать (стимулировать или подавлять) иммунные реакции организма. Таким средством является Арбидол (RU 2033156 и RU 2033157), представляющий собой 1-метил-2-фенилтиометил-3-карбэтокси-4-диметиламинометил-5-окси-6-броминдол. Арбидол способен стимулировать различные функции системы иммунитета и, как показано, оказывает профилактическое и лечебное действие при вирусных инфекциях. При этом Арбидол практически не токсичен и хорошо переносится здоровыми и больными гриппом людьми. Однако Арбидол недостаточно эффективен к некоторым штаммам вирусов, например к вирусам гриппа А и В. Имеется ряд других патентных публикаций (ЕР 1731506 А 1, JP-63-188665 и CN 1482118), относящихся к производным 5-гидроксииндол-3-карбоксилатов, обладающим противовирусной активностью. Наиболее близкими к соединениям настоящего изобретения являются 5-гидроксииндол-3-карбоксилаты и их использование для получения лекарственных средств для лечения и предупреждения вирусных инфекций, таких как гепатит В и ВИЧ-инфекция, описанные в ЕР 1731506 А 1. Однако ни в одной из указанных публикаций не получены и не раскрываются соединения настоящего изобретения, а также их использование для получения лекарственных средств для лечения или предупреждения вирусных инфекций, таких как грипп А или В, а также птичий грипп. Задача предлагаемого изобретения - поиск новых производных индола, обладающих иммуностимулирующей активностью одновременно с высокой противовирусной активностью в отношении конкретных вирусов, например вирусов гриппа А и В, а также птичьего гриппа. Согласно настоящему изобретению предлагаются производные 1-циклогексил(или циклогептил)-3 алкоксикарбонил-4-диаминометил-5-гидроксииндола, соответствующие общей формуле (I)R1 и R2 независимо выбираются из С 1-С 4-алкила, преимущественно метила, или R1 и R2 вместе с атомом азота (т.е. группа NR1R2) означает группы, соответствующие формулам Изобретение также относится к фармацевтически приемлемым солям указанных соединений общей формулы (I). Соли могут быть получены обычными методами, например обработкой соединения форму-1 018346 лы (I) соответствующими кислотами. К фармацевтически приемлемым солям относятся, прежде всего, гидрохлориды, мезилаты, оксалаты и др. Предпочтительным соединением является 5-гидрокси-4-диметиламинометил-2-метил-1 циклогексил-3-этоксикарбонилиндол (соединение А) и его гидрохлориды. Синтез соединений осуществляют согласно схеме 1 В указанной схеме R1, R2, R3, Alk, n имеют вышеуказанные значения. Согласно указанной схеме 1 способ осуществляют следующим образом. При взаимодействии алкилкарбонилуксусного эфира формулыR3COCH2COOAlk,предпочтительно ацетоуксусного эфира, с циклогексиламином или циклогептиламином в присутствии каталитического количества кислоты, например соляной кислоты, в среде растворителя, например бензола или толуола, получают соответствующий алкиловый эфир -циклогексил(или циклогептил)аминоалкениловой кислоты, преимущественно С 1-С 6-алкиловый эфир -циклогексил(или циклогептил)аминокротоновой кислоты, формулы (II) При взаимодействии эфира формулы (II) с бензохиноном получают 5-гидрокси-2-алкил-1 циклогексил(или циклогептил)-3-алкоксикарбонилиндол формулы (III) Затем соединение формулы (III) подвергают аминометилированию соответствующим бисаминометаном общей формулы в условиях реакции Манниха с получением соответствующего 5-гидрокси-4-аминометил-2-алкил-1 циклогексил(или циклогептил)-3-алкоксикарбонилиндола формулы (IA) Значения радикалов R1, R2, R3, Alk, n во всех структурных формулах такие, как указано выше. Для получения соединения формулы (IA), где группа NR1R2 означает группы, соответствующие формулам предпочтительно использовать в качестве аминометилирующего агента соответствующий циклический вторичный амин и формальдегид. При получении соединения (IA), где каждый из R1 и R2 означают,например, метил, также можно использовать в качестве аминометилирующего агента формальдегид и соответствующий диалкиламин. Полученные продукты выделяют в свободном виде или в виде фармацевтически приемлемых солей. Предлагаемые согласно настоящему изобретению соединения являются активными в отношении различных штаммов вируса гриппа. При этом имеются различия в эффективности предлагаемых соединений и аналога - Арбидола по отношению к различным штаммам. Предлагаемые соединения также эффективны и против других вирусов и при этом не являются аналогами нуклеозидов. Это позволяет предполагать, что соединения данного изобретения пополнят список соединений с "мягким", не затрагивающим обменные процессы в клетках механизмом действия. Кроме того, способ получения соединений проще и предполагает меньшее количество стадий, чем при получении известных аналогов. Поэтому способ получения предлагаемых соединений является более экономически выгодным. При этом способ получения предлагаемых соединений не требует использования неприятных и ядовитых исходных соединений, таких как тиофенол. Нижеприведенные примеры более подробно иллюстрируют предлагаемое изобретение. Способ получения 5-гидрокси-4-диметиламинометил-2-метил-1-циклогексил-3-этоксикарбонилиндола (А). Схема синтеза 2 Пример 1. Этиловый эфир -циклогексил аминокротоновой кислоты(II). К 13 г (0,1 моль) ацетоуксусного эфира в 20 мл толуола добавляют 11,9 г (0,12 моль) циклогексиламина и 1 каплю концентрированной HCl. Оставляют при комнатной температуре на сутки. Затем отгоняют выделившуюся воду с насадкой Дина-Старка. Толуол упаривают в вакууме, остаток перегоняют. Т.кип. 130-134 С/1 мм. Пд 21 1,514. Выход (II) 18,5 г (87%). Пример 2. 5-Гидрокси-2-метил-1-циклогексил-3-этоксикарбонилиндол(III). К раствору 2,1 г (0,01 моль) (II) в 10 мл ледяной уксусной кислоты при помешивании добавляют 1,08 г (0,01 моль) 1,4-бензохинона. Реакционную смесь оставляют при комнатной температуре на сутки. Образовавшийся осадок отфильтровывают, промывают холодной уксусной кислотой и сушат. Выход(III) 0,6 г (20%), т.пл. 237 С (из уксусной кислоты). Найдено, %: С 71,14; Н 7,87; N 4,78. C18H23NO3. Вычислено: С 71,74; Н 7,69; N 4,65. Пример 3. 5-Гидрокси-4-диметиламинометил-2-метил-1-циклогексил-3-этоксикарбонилиндол (А). Смесь 1,2 г (0,004 моль) (III), 0,9 мл бис-(диметиламино)метана в 10 мл диоксана кипятят 4 ч. После отгонки диоксана в вакууме добавляют 5 мл спирта, охлаждают, осадок отфильтровывают. Выход 1,0 г(69,7%), т.пл. 141-142 С (из спирта). Найдено, %: С 70,25; Н 8,32; N 7,72, C21H30N2O3. Вычислено: С 70,35; Н 8,44; N 7,82. Гидрохлорид получают добавлением HCl в эфире к раствору основания в ацетоне, т.пл. 194-195 С(из спирта с эфиром). Найдено, %: С 63,93; Н 7,70; N 6,99, C21H31ClN2O3. Вычислено: С 63,87; Н 7,91; N 7,09. В аналогичных условиях с использованием соответствующих исходных соединений получают 5-гидрокси-4-диметиламинометил-2-метил-1-циклогептил-3-этоксикарбонилиндол,5-гидрокси-4-диэтиламинометил-2-метил-1-циклогексил-3-этоксикарбонилиндол. При обработке соединений соответствующей кислотой были получены соли этих соединений. Используя соответствующее исходное соединение (III), формальдегид и вторичный циклический амин, в условиях реакции Манниха получают следующие соединения: 5-гидрокси-4-пиперидинометил-2-метил-1-циклогексил-3-этоксикарбонилиндол и его гидрохлорид,5-гидрокси-4-морфолинометил-2-метил-1-циклогексил-3-этоксикарбонилиндол и его гидрохлорид,5-гидрокси-4-(N-метилпиперазино)метил-2-этил-1-циклогексил-3-этоксикарбонилиндол, его гидрохлорид и мезилат,5-гидрокси-4-(N-бензилпиперазино)метил-2-метил-1-циклогексил-3-этоксикарбонилиндол и его гидрохлорид,5-гидрокси-4-(N-фенилпиперазино)метил-2-метил-1-циклогексил-3-этоксикарбонилиндол, его оксалат и гидрохлорид. Соли соединений были получены при обработке оснований соответствующей кислотой. Индивидуальность полученных продуктов подтверждена хроматографически в системе бензолспирт 10:2 на пластинках Silufol UV 254. Была изучена in vitro антивирусная активность этих соединений и была обнаружена антигриппозная активность этих соединений в отношении вирусов гриппа А. Противовирусная активность. Изучение действия соединения А на вирус гриппа А методом иммуноферментного анализа (ИФА) проводились по следующей схеме: на монослой клеток МДСК в 96-луночной панели вносили исследуемое соединение (предварительно растворнное в этиловом спирте, затем в питательной среде MEM). К вирусному контролю добавляли по 100 мкл этой же среды, а к клеточному контролю - по 200 мкл. Панели инкубировали при 37 С в атмосфере 5% СО 2 в течение 2 ч. При определении действия противовирусных препаратов на экспрессию вирусных антигенов к клеткам после их инкубации с соединением А добавляли десятикратные разведения вируса с учетом разведения препаратом (1:5, 1:50, 1:500 и т.д.) в объме 100 мкл. Среды MEM. Панели инкубировали в термостате в атмосфере 5% СО 2 в течение 24 ч при 37 С. Среду удаляли и клетки фиксировали 80% ацетоном на фосфатно-солевом буфере PBS в течение 15-20 мин в объме 100 мкл, затем хорошо высушивали и отмывали раствором PBS. Затем к клеткам добавляли по 100 мкл ИФА-буфера (фосфатно-солевой буфер с 1% фетальной сывороткой и 0,05% TWEEN 20) и инкубировали при 37 С в течение 30 мин. После удаления раствора к клеткам добавляли по 100 мкл моноклональных антител (МКА) к внутренним белкам М и NP вируса гриппа А в разведении 1:1000 на ИФА-буфере. После инкубации с антителами в течение 1 ч при 37 С и последующей 2-кратной отмывки в лунки вносили по 100 мкл IgG кролика против IgG мыши, меченных пероксидазой хрена, в разведении 1:5000 на ИФА-буфере и инкубировали 1 ч при 37 С. После 3-кратной отмывки легированную пероксидазу выявляли добавлением в лунки 100 мкл 0,05% раствора ортофенилендиамина (ОФД) в 0,003% цитратном буфере рН 5,0, содержащем 0,003% Н 2 О 2 (субстрактный буфер). Панели выдерживали 15-30 мин в темноте до появления жлтого окрашивания, реакцию останавливали добавлением в каждую лунку 50 мкл 1 N H2SO4. Далее измеряли оптическую плотность (ОП) на автоматическом спектрофотометре при длине волны 492 нм. В качестве контроля использовали лунки, незаражнные вирусом. Процент ингибирования вирусной репродукции соединением А определяли по формуле процент ингибирования=100-(ОП опыта-ОП клеточного контроля/ОП вирусного контроля в отсутствие соединения-ОП клеточного контроля)100. Для одной точки опыта использовали три лунки панели. Концентрацию препарата или соединения,уменьшающую значение величины ОП на 50%, принимали за минимальную ингибирующую концентрацию (МИК 50). Таблица 1 Минимальная ингибирующая концентрация (МИК 50) и активность соединения А по отношению к эталонному вирусу А/Новая Каледония/20/99 (H1N1) в опытах in vitro Определение эффективности соединения А на модели гриппозной пневмонии мышей. Опыты выполнены на 60 белых мышах массой 12-15 г. Животных инфицировали интраназально под лгким эфирным наркозом вирусом гриппа А/Аичи/2/69 (H3N2) (10 ЛД 50). Испытуемые соединения вводили per os в дозе 60 или 15 мг/кг/день. Лечение проводили по следующей схеме: за 24 и за 1 ч до инфицирования, далее 2 раза в день (в 8 ч утра и в 8 ч вечера) в течение 5 дней. Химиотерапевтическую активность Арбидола и соединения А на модели гриппозной пневмонии мышей оценивали по двум критериям: показатель защиты от смертельной вирусной инфекции и увеличение средней продолжительности жизни леченных животных по сравнению с контрольной группой. Средняя продолжительность жиз-4 018346 ни мышей высчитывалась по формуле f(d-1)/n, где f - количество мышей, умерших на день d (выжившие мыши включены в f, d в этом случае = 16); n - количество мышей в группе. Таблица 2 Эффективность соединения А в сравнении с Арбидолом на модели гриппозной инфекции у мышей (вирус А/Аичи/2/69) Таким образом, полученные результаты свидетельствуют о вирусспецифической активности заявленных соединений. Соединение А в опытах in vitro оказалось несколько активнее Арбидола (табл. 1). В опытах на животных соединение А было значительно активнее Арбидола. Так эффективность соединения А в дозе 15 мг/кг/день при лечении гриппозной пневмонии мышей была равна эффективности Арбидола в дозе в 4 раза большей (60 мг/кг/день). В дозе 15 мг/кг/день Арбидол был практически не активен (табл. 2). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Средство, обладающее противовирусной активностью в отношении вируса гриппа А и представляющее собой производное 5-гидрокси-4-аминометил-1-циклогексил(или циклогептил)-3 алкоксикарбонилиндола общей формулы (I) или его фармацевтически приемлемую соль. 2. Средство по п.1, где R1 и R2, каждый, представляет собой метил.
МПК / Метки
МПК: A61K 31/404, C07D 209/42
Метки: фармацевтически, циклогептил)-3-алкоксикарбонилиндола, обладающие, гриппа, противовирусной, вируса, производные, соли, приемлемые, отношении, 5-гидрокси-4-аминометил-1-циклогексил(или, активностью
Код ссылки
<a href="https://eas.patents.su/6-18346-proizvodnye-5-gidroksi-4-aminometil-1-ciklogeksilili-ciklogeptil-3-alkoksikarbonilindola-i-ih-farmacevticheski-priemlemye-soli-obladayushhie-protivovirusnojj-aktivnostyu-v-otnoshen.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-гидрокси-4-аминометил-1-циклогексил(или циклогептил)-3-алкоксикарбонилиндола и их фармацевтически приемлемые соли, обладающие противовирусной активностью в отношении вируса гриппа а</a>
Предыдущий патент: Непрерывный способ получения амидов ароматических карбоновых кислот
Следующий патент: Способ изготовления сита вибросита
Случайный патент: Протез










