Триазольные соединения, полезные в терапии
Номер патента: 9460
Опубликовано: 28.12.2007
Авторы: Брайанс Джастин Стивен, Рикманс Томас, Джонсон Патрик Стивен, Рассел Рейчел Джейн, Стоби Алан, Уайман Кристофер Питер
Формула / Реферат
1. Соединение формулы (I)

или его фармацевтически приемлемое производное, где
V представляет собой -(СН2)d(O)e-, -СО- или -СН(С1-6алкил)-;
W представляет собой -О-, -S(O)a- или -N(R1)-;
R1 представляет собой Н, C1-6алкил, (CH2)bCOR2, CO(CH2)bNR2R3, SO2R2, (CH2)cOR2, (CH2)cNR2R3 или (CH2)bhet1;
het1 представляет собой насыщенный или ненасыщенный гетероцикл из 3-8 атомов, содержащий один или более чем один гетероатом, выбранный из О, N или S, возможно замещенный C1-6алкилом;
Х и Y независимо представляют собой Н, C1-6алкил, галоген, ОН, CF3, OCF3, OR4;
Z представляет собой -(CH2)f(O)g-, -CO- или -СН(С1-6алкил)-;
кольцо А представляет собой 4-7-членный насыщенный N-содержащий гетероцикл, возможно замещенный ОН, и где возможно по меньшей мере один кольцевой N замещен О;
кольцо В представляет собой фенил или 4-7-членный ненасыщенный N-содержащий гетероцикл, возможно замещенный ОН, галогеном, CN, CONH2, CF3, OCF3, и где возможно по меньшей мере один кольцевой N замещен О;
R2 и R3 независимо представляют собой Н, C1-6алкил [возможно замещенный ОН, галогеном,
N(С1-6алкил)2 или C1-6алкилокси], C1-6алкилокси, N(С1-6алкил)2 или [С3-8циклоалкил];
или R2 и R3 вместе с атомом азота, к которому они присоединены, независимо представляют собой гетероцикл из 3-8 атомов, возможно замещенный C1-6алкилом;
R4 представляет собой неразветвленный или разветвленный C1-6алкил,
а и с независимо представляют собой 0, 1 или 2;
b, е и g независимо представляют собой 0 или 1; и
d и f независимо представляют собой 1 или 2.
2. Соединение по п.1, где W представляет собой NR1.
3. Соединение по п.1 или 2, где R1 представляет собой Н, C1-6алкил, -(CH2)bCOR2 или SO2R2.
4. Соединение по любому из пп.1-3, где R1 представляет собой метил.
5. Соединение по п.1 или 2, где R2 представляет собой морфолинил или пиримидинил (возможно замещенный C1-6алкилом [возможно замещенным ОН, галогеном, N(С1-6алкил)2 или C1-6алкилокси] или NMe2).
6. Соединение по любому из пп.1-5, где Х представляет собой Н.
7. Соединение по любому из пп.1-6, где Y находится в 4-м положении фенильного кольца (в соответствии с нумерацией формулы (I)), к которому он присоединен.
8. Соединение по п.7, где Y представляет собой хлоро.
9. Соединение по любому из пп.1-8, где кольцо А связано с кольцом В через атом азота в кольце А.
10. Соединение по любому из пп.1-9, где А представляет собой пиперидинил (возможно замещенный ОН и возможно по меньшей мере один N замещен О).
11. Соединение по любому из пп.1-10, где кольцо В представляет собой пиридинил или пиримидинил (возможно замещенный ОН, галогеном, CN, CONH2, CF3, OCF3, и возможно по меньшей мере один кольцевой N замещен О).
12. Соединение по п.11, где кольцо В представляет собой пиридинил.
13. Соединение по любому из пп.1-12, где V представляет собой -СН2-.
14. Соединение по любому из пп.1-13, где Z представляет собой -СН2-.
15. Соединение по любому из пп.1-3, где, когда R2 и R3 вместе с атомом азота, к которому они присоединены, представляют собой гетероцикл, этот гетероцикл выбран из пиперазинила, пирролидинила, пиперидинила, пиримидинила, тетрагидропиранила или морфолинила, возможно замещенного
C1-6алкилом.
16. Соединение по п.1, выбранное из
тригидрохлорида 8-хлор-5-метил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
тригидрохлорида 8-хлор-5-изопропил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
дигидрохлорида 1-[8-хлор-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-ил]этанона;
8-хлор-5-метансульфонил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
8-хлор-5-метил-1-(1-пиримидин-2-илпиперидин-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
8-хлор-5-метансульфонил-1-(1-пиримидин-2-илпиперидин-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
9-хлор-5-метил-1-(1-пиридин-2-илпиперидин-4-ил)-4,5,6,7-тетрагидро[1,2,4]триазоло[4,3-а][1,4]бензодиазоцина;
9-хлор-1-(1-пиридин-2-илпиперидин-4-ил)-6,7-дигидро-4H-[1,2,4]триазоло[4,3-а][4,1]бензоксазоцина;
1-[8-хлор-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-ил]-2-диметиламиноэтанона;
[8-хлор-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-ил]морфолин-4-илметанона;
(+)- или (-)-8-хлор-5-(4-метилморфолин-2-илметил)-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
8-хлор-5-пиримидин-2-ил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена;
диметиламида 8-хлор-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-сульфоновой кислоты;
диметиламида 8-хлор-1-(1-пиримидин-2-илпиперидин-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-сульфоновой кислоты;
9-хлор-6-метил-1-(1-пиридин-2-илпиперидин-4-ил)-4,5,6,7-тетрагидро[1,2,4]триазоло[4,3-а][1,5]бензодиазоцина;
9-хлор-5-метил-1-(1-пиримидин-2-илпиперидин-4-ил)-4,5,6,7-тетрагидро[1,2,4]триазоло[4,3-а][1,4]бензодиазоцина;
или их фармацевтически приемлемых производных.
17. Соединение по п.1, представляющее собой 8-хлор-5-метил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулен.
18. Дибезилат 8-хлор-5-метил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулена.
19. Применение соединения по любому из пп.1-18 в качестве лекарства.
20. Способ лечения тревоги, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), дисменореи (первичной и вторичной), эндометриоза, рвоты (включая морскую болезнь), задержки внутриутробного развития, воспаления (включая ревматоидный артрит), межменструальной боли, преэклампсии, преждевременного семяизвержения, преждевременных (досрочных) родов и болезни Рейно, включающий введение пациенту, страдающему таким расстройством, терапевтически эффективного количества соединения по любому из пп.1-18.
21. Способ по п.20, где расстройство представляет собой тревогу.
22. Способ по п.20, где расстройство представляет собой дисменорею (первичную или вторичную).
23. Применение соединения по любому из пп.1-18 в изготовлении лекарства для лечения тревоги, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), дисменореи (первичной и вторичной), эндометриоза, рвоты (включая морскую болезнь), задержки внутриутробного развития, воспаления (включая ревматоидный артрит), межменструальной боли, преэклампсии, преждевременного семяизвержения, преждевременных (досрочных) родов и болезни Рейно.
24. Применение по п.23 для лечения тревоги.
25. Применение по п.23 для лечения дисменореи (первичной или вторичнющ).
26. Фармацевтический препарат, включающий соединение по любому из пп.1-18 вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
27. Промежуточное соединение формулы (II)
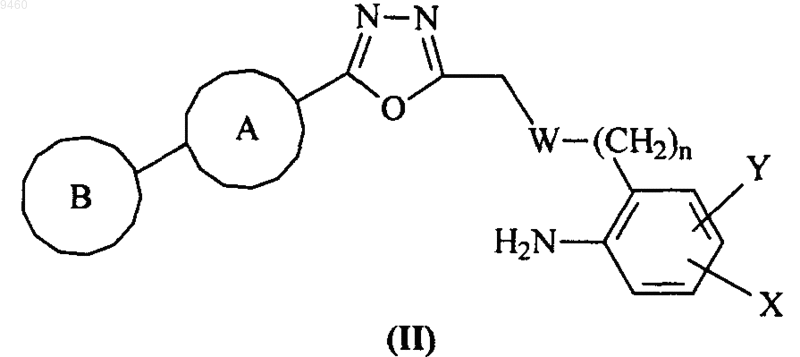
где V, W, X, Y, Z и кольца А и В являются такими, как определено в п.1.
28. Промежуточное соединение формулы (III)
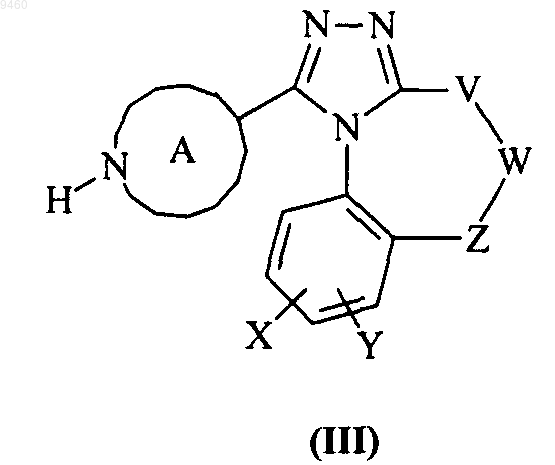
где V, W, X, Y, Z и кольцо А являются такими, как определено в п.1.
29. Промежуточное соединение формулы (X)
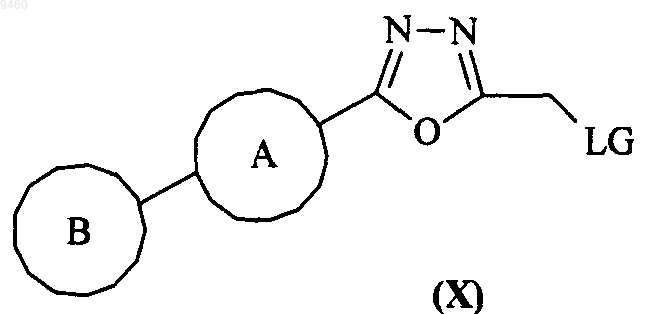
где кольца А и В являются такими, как определено в п.1, и LG представляет собой уходящую группу, такую как галоген.
30. Промежуточное соединение формулы (XV)
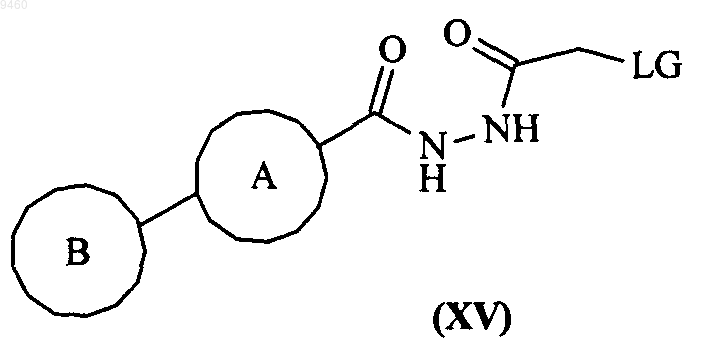
где кольца А и В являются такими, как определено в п.1, и LG представляет собой уходящую группу, такую как галоген.
31. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемого производного, включающий взаимодействие соединения формулы (II) с кислотным катализатором
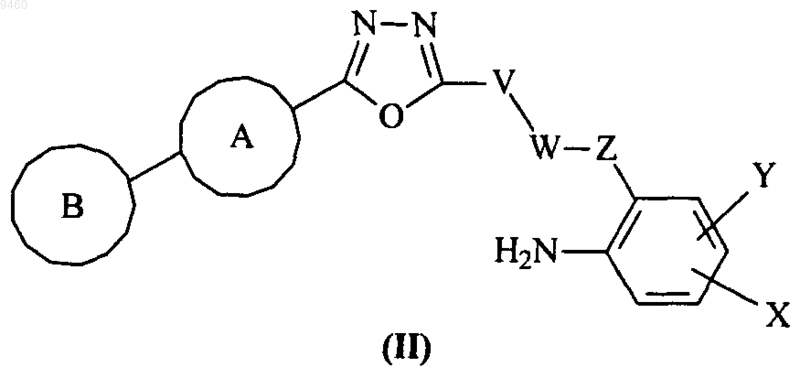
где кольца А и В и группы V, W, X, Y и Z являются такими, как определено выше.
32. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемого производного, включающий взаимодействие соединения формулы (III)

с соединением формулы (IV)
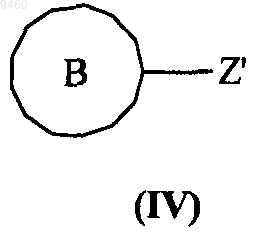
где кольца А и В и группы V, W, X, Y и Z являются такими, как определено в п.1, и Z' представляет собой уходящую группу, такую как галоген.
33. Способ получения соединения формулы (I) по п.1, где W представляет собой NR1, или его фармацевтически приемлемого производного, включающий взаимодействие соединения формулы (V)
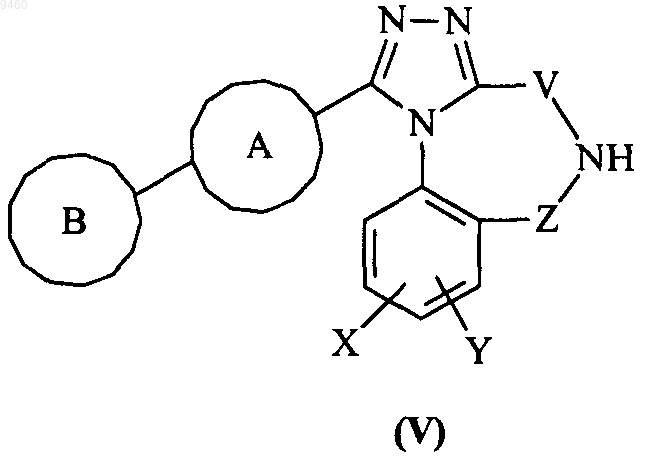
с соединением формулы (VI)
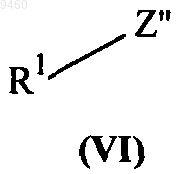
где кольца А и В и группы R1, V, X, Y и Z являются такими, как определено в п.1, и Z" представляет собой уходящую группу, такую как галоген.
34. Способ получения соединения формулы (I) по п.1, где W представляет собой NR1, или его фармацевтически приемлемого производного, включающий взаимодействие соединения формулы (V)
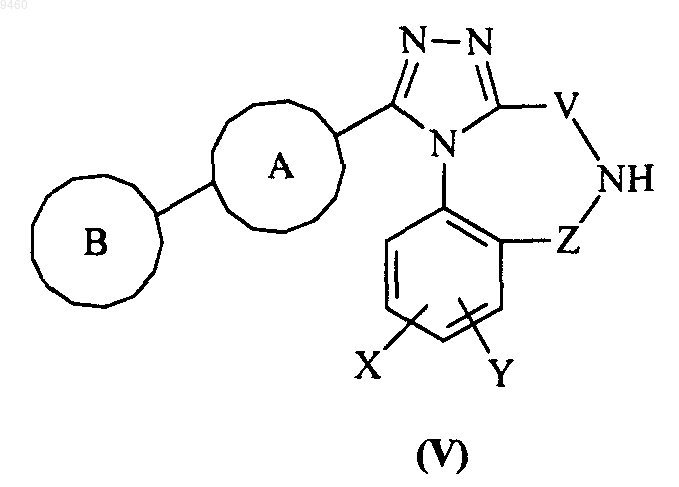
с соединением формулы (VII)
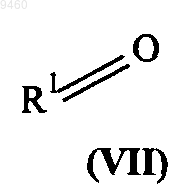
где кольца А и В и группы R1, V, X, Y и Z являются такими, как определено в п.1.
35. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемого производного, включающий взаимодействие соединения формулы (XIII)
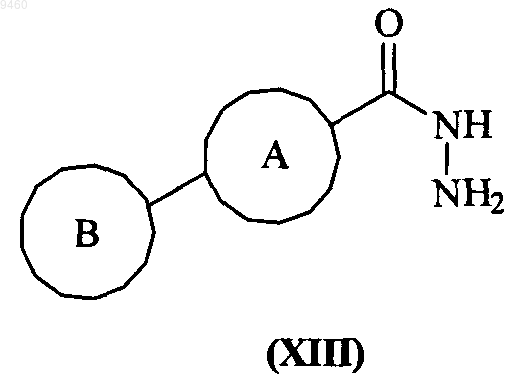
с соединением формулы (XXIV)

где кольца А и В и группы V, W, X, Y и Z являются такими, как определено в п.1.
36. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемого производного, включающий взаимодействие соединения формулы (XIII)
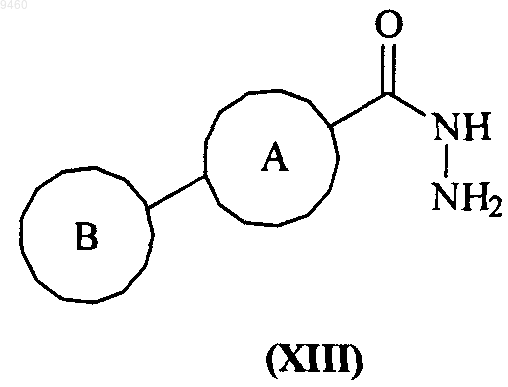
с соединением формулы (XXV)
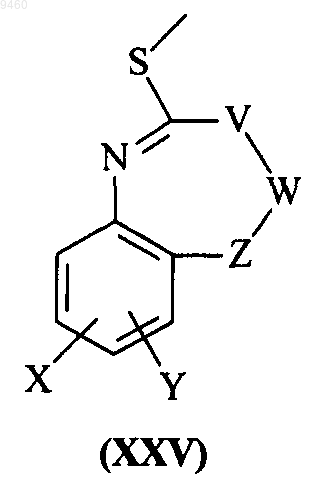
где кольца А и В и группы V, W, X, Y и Z являются такими, как определено в п.1.
Текст
009460 Данное изобретение относится к новым соединениям, полезным в терапии, и к способам получения таких производных, промежуточным соединениям, используемым в их получении, композициям, содержащим их, и их применению. В японской заявке на патент 09328484 описаны триазольные хиноксалины, полезные в качестве противоаллергических и противовоспалительных средств. В японской заявке на патент 09132576 описаны триазольные хиноксалины, полезные в качестве противоаллергических и противовоспалительных средств. В японской заявке на патент 06135965 описаны триазольные хиноксалины, полезные для лечения и профилактики аллергий, воспаления и PAF-ассоциированных заболеваний. В японской заявке на патент 06128262 описаны триазольные хиноксалины, полезные в качестве промежуточных соединений лекарств и агрохимикатов. В WO 02/083678 описаны бензодиазепиновые производные, полезные для лечения, среди прочего, тревоги, сердечно-сосудистых заболеваний и дисменореи. Было обнаружено, что соединения по настоящему изобретению обладают полезными фармацевтическими свойствами. Они могут быть использованы для лечения агрессии, болезни Альцгеймера, нервной анорексии, тревоги, тревожного расстройства, астмы, атеросклероза, аутизма, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), катаракты, заболевания центральной нервной системы, ишемии сосудов головного мозга, цирроза, расстройства познавательной способности, синдрома Иценко-Кушинга, депрессии, сахарного диабета, дисменореи (первичной и вторичной), рвоты (включая морскую болезнь), эндометриоза, желудочно-кишечного заболевания, глаукомы, гинекологического заболевания, болезни сердца, задержки внутриутробного развития, воспаления (включая ревматоидный артрит), ишемии, ишемической болезни сердца, опухоли легких, расстройства мочеиспускания, межменструальной боли, неоплазмы, нефротоксичности, инсулиннезависимого сахарного диабета, ожирения, обсессивно-компульсивного расстройства, глазной гипертензии, преэклампсии, преждевременного семяизвержения, преждевременных (досрочных) родов, легочного заболевания, болезни Рейно, болезни почек, почечной недостаточности, сексуальной дисфункции у мужчин или женщин, септического шока, расстройства сна, повреждения спинного мозга, тромбоза, инфекции мочеполового тракта или мочекаменной болезни. Особенный интерес представляют следующие заболевания или расстройства: тревога, сердечнососудистое заболевание (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность,отек, гипернатриемию), дисменорея (первичная и вторичная), эндометриоз, рвота (включая морскую болезнь), задержка внутриутробного развития, воспаление (включая ревматоидный артрит), межменструальная боль, преэклампсия, преждевременное семяизвержение, преждевременные (досрочные) роды и болезнь Рейно. В частности, они демонстрируют антагонистическую активность в отношении вазопрессина и могут быть использованы в лечении дисменореи (первичной и вторичной). Существует значительно неудовлетворенная потребность в области менструальных расстройств, и было оценено, что до 90% всех менструирующих женщин в определенной степени испытывают страдания при менструации. До 42% женщин теряют работоспособность или другие виды деятельности вследствие менструальной боли, и было оценено, что в США ежегодно теряется в результате около 600 миллионов рабочих часов (составляя приблизительно 2 млрдв потере производительности). Менструальная боль в нижней части живота вызывается гиперактивностью миометрия и сниженным кровотоком в матке. Эти патофизиологические изменения приводят в результате к боли в животе,которая распространяется на спину и ноги. Это может привести в результате к тому, что женщина испытывает тошноту, головную боль и страдает от бессонницы. Это состояние называют дисменореей, и его можно классифицировать как первичную или вторичную дисменорею. Первичную дисменорею диагностируют в тех случаях, когда не выявлено никакой аномалии, вызывающей это состояние. Она поражает до 50% женского населения. Когда имеется основное гинекологическое расстройство, такое как эндометриоз, воспаление тазовых органов (PID), фибромы или раковые опухоли, диагностируют вторичную дисменорею. Вторичную дисменорею диагностируют только у приблизительно 25% женщин, страдающих от дисменореи. Дисменорея может иметь место в сочетании с меноррагией, которая составляет приблизительно 12% от общего числа обращений в амбулаторные гинекологические отделения. В настоящее время, женщин, страдающих от первичной дисменореи, лечат нестероидными противовоспалительными лекарственными средствами (НПВС) или пероральными контрацептивными таблетками. В случае вторичной дисменореи для коррекции основного гинекологического расстройства может быть применено хирургическое вмешательство. У женщины, страдающей от дисменореи, в один и тот же период менструального цикла уровни вазопрессина в системе кровообращения выше по сравнению с уровнями, наблюдаемыми у здоровой женщины. Ингибирование фармакологических действий вазопрессина на уровне рецептора вазопрессина в матке может предотвращать дисменорею. В соответствии с настоящим изобретением предложено соединение формулы (I) или его фармацевтически приемлемое производное, гдеhet1 представляет собой насыщенный или ненасыщенный гетероцикл из 3-8 атомов, содержащий один или более чем один гетероатом, выбранный из О, N или S, возможно замещенный C1-6 алкилом; Х и Y независимо представляют собой Н, C1-6 алкил, галоген, ОН, CF3, OCF3, OR4;Z представляет собой -(CH2)f(O)g-, -CO- или -СН(С 1-6 алкил)-; кольцо А представляет собой 4-7-членный насыщенный N-содержащий гетероцикл, возможно замещенный ОН, и где возможно по меньшей мере один кольцевой N замещен О; кольцо В представляет собой фенил или 4-7-членный ненасыщенный N-содержащий гетероцикл,возможно замещенный ОН, галогеном, CN, CONH2, CF3, OCF3, и где возможно по меньшей мере один кольцевой N замещен О;R2 и R3 независимо представляют собой Н, C1-6 алкил [возможно замещенный ОН, галогеном,N(С 1-6 алкил)2 или C1-6 алкилокси], C1-6 алкилокси, N(С 1-6 алкил)2 или [С 3-8 циклоалкил]; или R2 и R3 вместе с атомом азота, к которому они присоединены, независимо представляют собой гетероцикл из 3-8 атомов, возможно замещенный C1-6 алкилом;R4 представляет собой неразветвленный или разветвленный C1-6 алкил,а и с независимо представляют собой 0, 1 или 2;b, е и g независимо представляют собой 0 или 1;d и f независимо представляют собой 1 или 2. В вышеприведенных определениях галоген обозначает фторо, хлоро, бромо или йодо. Алкильные группы, содержащие необходимое количество атомов углерода, за исключением тех случаев, когда указано, могут представлять собой неразветвленную или разветвленную цепь. Примеры включают метил,этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Примеры алкилокси включают метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси и третбутилокси. Гетероциклы, включенные в определение "гетероцикл", представляют собой пирролил, имидазолил,триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил,пиридазинил, пиразинил, индолил, изоиндолил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил и хиноксалинил, вместе с их частично или полностью насыщенными вариантами, а также азетидинил, пирролидинил, пиперидинил, пиперазинил, гомопиперазинил, оксазепанил и морфолинил. Предпочтительные группы соединений представляют собой группы, где применено любое одно или более чем одно из следующего:(5) het1 представляет собой пирролидинил, пиперидинил, морфолинил, азетидинил, оксазепанил,пиримидинил, пиридинил, тиазолил или имидазолил (возможно замещенный C1-6 алкилом);(7) R2 представляет собой морфолинил или пиримидинил (возможно замещенный C1-6 алкилом [возможно замещенным ОН, галогеном, N(С 1-6 алкил)2 или C1-6 алкилокси] или NMe2);(8) R2 и R3 вместе с атомом азота, к которому они присоединены, представляют собой морфолинил,пирролидинил, пиперазинил, азетидинил, тетрагидропиранил, пиримидинил или пиперидинил (возможно замещенный C1-6 алкилом);(16) Y находится в 4-м положении фенильного кольца (в соответствии с нумерацией формулы (I, к которому он присоединен;(24) кольцо А связано с кольцом В через атом азота в кольце А;(25) кольцо А представляет собой пиперидинил (возможно замещенный ОН, и возможно по меньшей мере один N замещен О);(26) кольцо В представляет собой пиридинил (возможно замещенный одной или более чем одной группой, выбранной из ОН, галогена, CN, CONH2, CF3, OCF3, и возможно по меньшей мере один кольцевой N замещен О), предпочтительно оно представляет собой 2-пиридинил;(27) кольцо В представляет собой пиримидинил (возможно замещенный одной или более чем одной группой, выбранной из ОН, галогена, CN, CONH2, CF3, OCF3, и возможно по меньшей мере один кольцевой N замещен О), предпочтительно 2-пиримидинил;(29) n представляет собой 2. Предпочтительные соединения в соответствии с настоящим изобретением представляют собой тригидрохлорид 8-хлор-5-метил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H2,3,5,10b-тетраазабензо[е]азулена; тригидрохлорид 8-хлор-5-изопропил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро 4H-2,3,5,10b-тетраазабензо[е]азулена; дигидрохлорид 1-[8-хлор-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-ил]этанона; 8-хлор-5-метансульфонил-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-5,6-дигидро-4H2,3,5,10b-тетраазабензо[е]азулен; 8-хлор-5-метил-1-(1-пиримидин-2-илпиперидин-4-ил)-5,6-дигидро-4H-2,3,5,10b-тетраазабензо[е]азулен; 8-хлор-5-метансульфонил-1-(1-пиримидин-2-илпиперидин-4-ил)-5,6-дигидро-4H-2,3,5,10bтетраазабензо[е]азулен; 13-хлор-8-метил-3-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-2,4,5,8-тетраазатрицикло[9.4.0.02,6]пентадека-1(11),3,5,12,14-пентаен; 13-хлор-3-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-8-окса-2,4,5-триазатрицикло[9.4.0.02,6]пентадека-1(11),3,5,12,14-пентаен; 1-[8-хлор-1-(3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-ил)-4H,6H-2,3,5,10b-тетраазабензо[е]азулен-5-ил]-2-диметиламиноэтанон;-3 009460 Альтернативно предложено соединение формулы (I)R1 представляет собой Н, C1-6 алкил, -(СН 2)a-[С 3-8 циклоалкил], фенил, бензил, пиридил, пиримидил,-COR2, -CO2R2, -СО-(CH2)a-NR2R3, -SO2R2, -(CH2)b-OR2, -(CH2)b-NR2R3, или насыщенный гетероцикл из 38 атомов, содержащий один или более чем один гетероатом, выбранный из О, N и S; Х и Y независимо представляет собой Н, галоген, ОН, CF3, OCF3, R4, -(CH2)d-CONR4R5, -(CH2)d-CN,-(CH2)d-SO2NR4R5, -(CH2)d-NR4SO2Me, -(CH2)d-COR4, -(CH2)d-OCOR4, -(CH2)d-NHCOR4, -(CH2)d-NR4COR5,-(CH2)d-OR6 или -(CH2)d-CO2R6; кольцо А представляет собой группу пиперидинил, пиперазинил, пирролидинил или азетидинил; кольцо В представляет собой группу фенил, пиридинил или пиримидинил (возможно замещенную одной или более чем одной группой, независимо выбранной из галогена, CN, CONH2, CF3, OCF3, R7 иR2, R3, R4, R3 и R7 независимо представляют собой Н, неразветвленный или разветвленныйC1-6 алкил, -(СН 2)c-[С 3-8 циклоалкил], фенил, бензил, пиридил или пиримидил; или R2 и R3, или R4 и R5 вместе с атомом азота, к которому они присоединены, независимо представляют собой гетероцикл из 3-8 атомов;R6 и R8 независимо представляют собой Н, неразветвленный или разветвленный C1-6 алкил, -(СН 2)с[С 3-8 циклоалкил], -(СН 2)e-NR4R5, -(CH2)e-OR4, фенил, бензил, пиридил или пиримидил;n равно 0, 1 или 2; а, с, d и f все независимо выбраны из 0, 1, 2 или 3;b и е независимо выбраны из 2 или 3. Фармацевтически приемлемые производные соединений формулы (I) по данному изобретению включают соли, сольваты, комплексы, полиморфы, пролекарства, стереоизомеры, геометрические изомеры, таутомерные формы и изотопные варианты соединений формулы (I). Предпочтительно фармацевтически приемлемые производные соединений формулы (I) включают соли, сольваты, сложные эфиры и амиды соединений формулы (I). Более предпочтительно фармацевтически приемлемые производные соединений формулы (I) представляют собой соли и сольваты. Фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислоты и основания. Подходящие соли присоединения кислоты получают из кислот, образующих нетоксичные соли. Примеры включают соли ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат, борат,камзилат, цитрат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, D- и L-лактат,малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, пальмоат, фосфат, гидрофосфат, дигидрофосфат, сахарат, стеарат, сукцинат, сульфат, Dи L-тартрат, тозилат и трифторацетат. Особенно подходящая соль представляет собой производное безилат соединений по настоящему изобретению. Подходящие основные соли получают из оснований, образующих нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Обзор подходящих солей см. в Stahl and Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection and Use, Wiley-VCH, Weinheim, Germany (2002). Фармацевтически приемлемую соль соединения формулы (I) можно легко получить путем смешивания вместе растворов соединения формулы (I) и желаемой кислоты или основания, как подходит. Соль можно осадить из раствора и собрать путем фильтрования, или она может быть выделена путем выпаривания растворителя. Степень ионизации в соли может варьировать от полностью ионизированной до почти неионизированной. Соединения по данному изобретению могут существовать как в несольватированной, так и сольватированной формах. Термин "сольват" используется здесь для описания молекулярного комплекса,включающего соединение по данному изобретению и одну или более чем одну молекулу фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используется в том случае, когда указанный растворитель представляет собой воду.-4 009460 В объем данного изобретения включены комплексы, такие как клатраты, комплексы включения лекарство-хозяин (drug-host), где, в противоположность вышеупомянутым сольватам, лекарство и хозяин представлены в стехиометрических или нестехиометрических количествах. Также включены комплексы лекарства, содержащие два или более чем два органических и/или неорганических компонента,которые могут присутствовать в стехиометрических или нестехиометрических количествах. Получающиеся в результате комплексы могут быть ионизированы, частично ионизированы или неионизированы. Обзор таких комплексов см. в J Pharm Sci, 64 (8), 1269-1288 by Haleblian (August 1975). Далее, все ссылки на соединения формулы (I) и фармацевтически приемлемые производные включают ссылки на их соли, сольваты и комплексы, и сольваты и комплексы их солей. Соединения по настоящему изобретению включают соединения формулы (I), как определено выше,их полиморфы, пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры),как определено далее, и меченые изотопами соединения формулы (I). Как указано, данное изобретение включает все полиморфы соединений формулы (I), как определено выше. Также в объеме данного изобретения находятся так называемые "пролекарства" соединений формулы (I). Так, некоторые производные соединений формулы (I), которые сами могут обладать небольшой фармакологической активностью или не обладать такой активностью, при введении в организм или на поверхность организма могут превращаться в соединения формулы (I), обладающие желаемой активностью, например, путем гидролитического расщепления. Такие производные называют "пролекарствами". Дополнительную информацию относительно применения пролекарств можно найти в "Prodrugs as NovelDesign", Pergamon Press, 1987 (ed. E В Roche, American Pharmaceutical Association). Пролекарства, в соответствии с данным изобретением, могут быть получены, например, путем замещения подходящих функциональных групп, представленных в соединениях формулы (I), некоторыми группировками, известными специалистам в данной области техники как "прогруппировки", как описано, например, в "Design of Prodrugs" by H Bundgaard (Elsevier, 1985). Некоторые примеры пролекарств, в соответствии с данным изобретением, включают:(1) когда соединение формулы (I) содержит карбоксильную функциональную группу (-СООН), ее сложный эфир, например, замещение атома водорода (С 1-C8)алкилом;(2) когда соединение формулы (I) содержит спиртовую функциональную группу (-ОН), ее простой эфир, например, замещение атома водорода (C1-С 6)алканоилоксиметилом; и(3) когда соединение формулы (I) содержит первичную или вторичную аминную функциональную группу (-NH2 или -NHR, где R отличается от H), ее амид, например, замещение одного или обоих атомов водорода (С 1-С 10)алканоилом. Дополнительные примеры групп заместителей в соответствии с предшествующими примерами и примерами других типов пролекарств могут быть найдены в вышеупомянутых ссылках. Наконец, некоторые соединения формулы (I) сами могут действовать в качестве пролекарств других соединений формулы (I). Кроме того, в объеме данного изобретения находятся метаболиты соединений формулы (I), образующиеся in vivo. Соединения формулы (I), содержащие один или более чем один асимметрический атом углерода,могут существовать в виде двух или более чем двух стереоизомеров. Когда соединение формулы (I) содержит алкенильную или алкениленовую группу, возможны геометрические цис/транс (или Z/E) изомеры, и когда соединение содержит, например, группу кето или оксим, или ароматическую группировку,может иметь место таутомерная изомерия ("таутомерия"). Следовательно, одно соединение может демонстрировать более чем один тип изомерии. В объем настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений формулы (I), включая соединения, демонстрирующие более чем один тип изомерии, и смеси одного или более чем одного такого соединения. Также включены соли присоединения кислоты или основания, где противоион является оптически активным, например, D-лактат или Lлизин, или рацемическим, например, DL-тартрат или DL-аргинин. Цис/транс-изомеры могут быть разделены с использованием обычных способов, хорошо известных специалистам в данной области техники, например, путем фракционной кристаллизации и хроматографии. Обычные способы получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например, спиртом, или, в случае когда соединения формулы (I) содержат кислую или основную группировку, с кислотой или основанием, такими как винная кислота или 1-фенилэтиламин. Получающуюся в результате смесь диастереоизомеров можно-5 009460 разделить путем хроматографии и/или фракционной кристаллизации, и один или оба диастереоизомера превратить в соответствующий(е) чистый(е) энантиомер(ы) с использованием способов, хорошо известных специалистам. Хиральные соединения по данному изобретению (и их хиральные предшественники) могут быть получены в виде энантиомерно обогащенной формы с использованием хроматографии, как правило ВЭЖХ, на асимметричной смоле с подвижной фазой, состоящей из углеводорода, как правило гептана или гексана, содержащей от 0 до 50% изопропанола, как правило от 2 до 20%, и от 0 до 5% алкиламина,как правило 0,1% диэтиламина. Концентрирование элюата позволяет получить обогащенную смесь. Стереоизомерные конгломераты могут быть разделены с использованием обычных способов, известных специалистам в данной области техники, см., например, "Stereochemistry of Organic Compounds"E L Eliel (Wiley, New York, 1994). Настоящее изобретение также включает все фармацевтически приемлемые изотопные варианты соединения формулы (I), один или более чем один атом которого замещен атомами, имеющими то же самый атомный номер, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно обнаруживаемого в природе. Примеры изотопов, подходящих для включения в соединения по данному изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11 С, 13 С и 14 С, азота, такие как 13N и 15N, кислорода, такие как 15 О, 17O и 18 О, фосфора, такие как 32P, серы, такие как 35S, фтора, такие как 18F, йода, такие как 123I и 125I, и хлора, такие как 36Cl. Некоторые меченые изотопами соединения формулы (I), например соединения, включающие радиоактивный изотоп, являются полезными в исследованиях распределения лекарства и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3 Н, и углерода-14, т.е. 14C, особенно полезны для этой цели ввиду легкости их включения и доступных средств обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может представлять определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например, увеличенного периода полувыведения in vivo или уменьшенной потребности в дозах, и следовательно, в некоторых случаях может быть предпочтительным. Замещение позитрон-испускающими изотопами, такими как 11C, 18F, 15O и 13N, может быть полезным в исследованиях путем позитронной эмисионной томографии (PET) для проверки оккупации рецептора субстратом. Как правило, меченые изотопами соединения формулы (I) могут быть получены с использованием обычных способов, известных специалистам в данной области техники, или способов, аналогичных способам, описанным в приведенных примерах и подготовительных примерах, с использованием соответствующих меченых изотопами реагентов вместо ранее используемого немеченного реагента. Фармацевтически приемлемые сольваты в соответствии с данным изобретением включают сольваты, где кристаллизационный растворитель может быть замещен на изотопы, например D2O, d6-ацетон иd6-диметилсульфоксид (ДМСО). В соответствии с настоящим изобретением также предложен способ получения соединения формулы (I), включающий: а) взаимодействие соединения формулы (II) с кислотным катализатором где кольца А и В, и группы V, W, X, Y, Z, и n являются такими, как определено выше; б) взаимодействие соединения формулы (III) где кольца А и В, и группы V, W, X, Y, Z, и n являются такими, как определено выше, и Z' представляет собой уходящую группу, такую как галоген; в) когда W в соединении (I) представляет собой NR1, взаимодействие соединения формулы (V) где кольца А и В, и группы R1, V, X, Y, Z, и n являются такими, как определено выше, и Z" представляет собой уходящую группу, такую как галоген; или г) когда W в соединении (I) представляет собой NR', взаимодействие соединения формулы (V) где кольца А и В, и группы R1, V, X, Y, Z, и n являются такими, как определено выше; д) взаимодействие соединения формулы (XIII) где кольца А и В и группы V, W, X, Y и Z являются такими, как определено выше; е) взаимодействие соединения формулы (XIII) где кольца А и В и группы V, W, X, Y и Z являются такими, как определено выше. Если не указано иначе:DCC обозначает N,N'-дициклогексилкарбодиимид; НОАТ обозначает 1-гидрокси-7-азабензотриазол; НОВТ обозначает гидрат 1-гидроксибензотриазола;EtOAc обозначает этилацетат; ТГФ обозначает тетрагидрофуран,ДМСО обозначает диметилсульфоксид,ДХМ обозначает дихлорметан,ДМФ обозначает N,N-диметилформамид,NMP обозначает N-метил-2-пирролидинон; АсОН обозначает уксусную кислоту,ТФУ обозначает трифторуксусную кислоту;OH обозначает гидрокси. На следующих схемах проиллюстрировано получение соединений формулы (I), где кольца А и В и группы V, W, X, Y и n являются такими, как определено выше, если не указано иначе. (I') представляет собой (I), когда W представляет собой NR1. Стадия (а). Оксадиазол (II) подвергают взаимодействию с кислотным катализатором с получением соединения формулы (I). Как правило, это взаимодействие осуществляют путем нагревания исходных веществ до повышенных температур, таких как 50-150 С, в течение 1-48 ч, с подходящим кислотным катализатором, таким как p-TSA, трифторуксусная кислота или катализатор кислота Льюиса, например хлорид магния, возможно с использованием растворителя, такого как ксилол, толуол или тетрагидрофуран. Предпочтительные условия представляют собой: амин (II) и кат. p-TSA в ксилоле при 140 С в течение 48 ч; или амин (II), трифторуксусная кислота в тетрагидрофуране при 60 С в течение 24 ч. Когда W=NR', тоZ' представляет собой OH или галогено, как правило Cl. Соединения, подходящие для использования в качестве соединения (VI), имеются в продаже или известны из литературы. Стадия (б). Взаимодействие амина (V) с соединением (VI) может быть осуществлено стандартными способами. Когда R1=(CH2)bCOR2, CO(CH2)bNR2R3, SO2R2, то, как правило, сочетание может быть осуществлено с использованием:(1) хлорангидрида/сульфонилхлорида (VI) + амина (V) с избытком акцептора кислоты в подходящем растворителе; или(2) кислоты (VI) с обычным агентом сочетания + амином (V), возможно в присутствии катализатора, с избытком акцептора кислоты в подходящем растворителе; и(3) когда R1 представляет собой арильную группу, арилгалогенида (VI) + амина (V), возможно в присутствии катализатора, с избытком акцептора кислоты в подходящем растворителе. Как правило, условия являются следующими. Ацилирование/Сульфонилирование, Z'=Cl.(1) Избыток хлорангидрида/сульфонилхлорида (VI) (образованного in situ), 1 экв. амина (V), возможно с избытком третичного амина, такого как Et3N, основание Хюнига или NMM, в ДХМ или ТГФ,без нагревания в течение 1-24 ч. Предпочтительные условия: амин (V), 1,1-3,0 экв. хлорангидрид/сульфонилхлорид (VI), 1,5-3 экв. NMM, Et3N или пиридина в ДХМ при комнатной температуре в течение 1-16 ч. Образование амидной связи, Z'=OH.(2) Избыток кислоты (VI), WSCDI/DCC и НОВТ/НОАТ, 1 экв. амина (V), с избытком NMM, Et3N,основания Хюнига в ТГФ, ДХМ или EtOAc, при комнатной температуре в течение 4-48 ч; илиNMM, Et3N, основанием Хюнига в ТГФ, ДХМ или EtOAc, при комнатной температуре в течение 4-24 ч. Предпочтительные условия: амин (V), 2 экв. HBTU, 2 экв. кислоты (R1OH) в ДХМ при комнатной температуре в течение 18 ч; или амин (V), НОВТ, WSCDI, Et3N в ДХМ при комнатной температуре в течение 18 ч. Арилирование (R1=арил, гетероарил), Z'=галогено.(3) Арилирование соединения (V) может быть осуществлено путем катализируемой палладием реакции перекрестного сочетания с использованием подходящего основания (t-BuONa), каталитического количества подходящей добавки, такой как 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил, и подходящего палладиевого катализатора в толуоле при повышенной температуре в течение 1-24 ч в атмосфере инертного газа с получением соединения (I'). Альтернативно, соединение (I') может быть получено путем взаимодействия амина (V) с соединением (VI) путем нагревания при повышенной температуре, такой как 50-140 С, в подходящем растворителе, таком как ДМФ, NMP или 1,4-диоксан, в течение приблизительно 1-48 ч с основанием, таким как карбонат калия, гидрокарбонат натрия или основание Хюнига. Предпочтительные условия: 1-2,5 экв. галогенида (VI), 1-2 экв. карбоната калия в N,N-диметилформамиде при 50-95 С в течение 4-18 ч; или 1-2,5 экв. галогенида (VI), 2-3 экв. основания Хюнига в 1,4-диоксане или NMP при дефлегмации в течение 18-48 ч; или 1 экв. галогенида (VI), 3,5 экв. NaOt-Bu, 0,08 экв. BINAP, 0,4 экв. Pd(dba)2, в толуоле в течение 8 ч при 70 С. Алкилирование (R1=замещенный алкил), Z'=галогено, предпочтительно Br или Cl. Алкилирование соединения (V) может быть осуществлено путем взаимодействия с подходящим алкилирующим агентом, R1Z', в присутствии подходящего третичного амина (NMM, Et3N или основание Хюнига) или основания щелочного металла (K2CO3, Cs2CO3) в подходящем растворителе (MeCN, ДМФ),при приблизительно комнатной температуре. Предпочтительные условия: амин (V) R1Z', избыток K2CO3 или основания Хюнига в ДМФ в течение 18 ч при комнатной температуре. Альтернативно, соединения (I') могут быть получены с использованием пути, изображенного на схеме 1.3 ниже. Схема 1.3 Соединения, подходящие для использования в качестве соединения (VII), имеются в продаже или известны из литературы. Стадия (в). Амин (V) подвергают взаимодействию с избытком альдегида/кетона (VII) в присутствии восстановителя, такого как триацетоксиборгидрид натрия или цианоборгидрид натрия, с получением соединения формулы (I'). Это взаимодействие может быть осуществлено путем перемешивания исходных веществ при температурах, таких как 20-80 С, в течение 1-48 ч в подходящем растворителе, таком как дихлорметан, или нагревания амина (V) с избытком соединения (VII) с подходящим катализатором кислотой Льюиса,таким как тетрахлорид титана или тетраизопропоксид титана, при температурах, таких как 50-100 С, в подходящем растворителе, таком как дихлорэтан или этанол, в течение 1-18 ч, с последующим восстановлением промежуточных иминных/иминиевых групп подходящим восстановителем, таким как боргидрид натрия, или гидрогенолизом над подходящим катализатором, таким как оксид платины или палладий на углероде. Предпочтительные условия: амин (V), 1-1,5 экв. альдегида/кетона (VII), 1-2,0 экв. триацетоксиборгидрида натрия в дихлорметане, возможно в присутствии АсОН при комнатной температуре в течение 2 ч. Когда кольцо В связано с кольцом А через атом N, и W представляет собой О или S, то Схема 2.1 Защит. представляет собой подходящую защитную группу для азота, например Boc, CBz или аллилкарбамат. Для защитных групп азота используют стандартные способы, такие как обнаруживаемые в руководствах (например, "Protecting Groups in Organic Synthesis" by T.W. Greene and P. Wutz). Z" представляет собой уходящую группу, такую как галоген. Соединения, подходящие для использования в качестве соединения (IV), имеются в продаже или известны в литературе. Арилирование соединения (III) может быть осуществлено, как описано на стадии (б) выше. Предпочтительные условия: 1-2,5 экв. галогенида (IV), 1-2 экв. карбоната калия в N,N-диметилформамиде при 50 С в течение 418 ч; или 1-2,5 экв. галогенида (IV), 2-3 экв. основания Хюнига в 1,4-диоксане или NMP при дефлегмации в течение 18-48 ч; или 1 экв. галогенида (IV), 3,5 экв. NaOt-Bu, 0,08 экв. BINAP, 0,4 экв. Pd(dba)2 в толуоле в течение 8 ч при 70 С. Стадия (г). Удаление защиты с соединения (IX) осуществляют с использованием стандартных способов в соответствии с тем, как описано в Protecting Groups in Organic Synthesis" by T.W. Greene and P.Wutz. Когда Защит. представляет собой Boc, предпочтительные способы представляют собой: хлорид водорода в подходящем растворителе, таком как 1,4-диоксан, при комнатной температуре в течение 1-16 ч; или раствор трифторуксусной кислоты в дихлорметане в течение 1-2 ч. Когда Защит. представляет собой CBz, предпочтительный способ представляет собой гидрогенолиз с использованием подходящего палладиевого катализатора в растворителе, таком как этанол. Когда Защит. представляет собой аллилкарбамат, предпочтительные условия представляют собой тиобензойную кислоту и подходящий палладиевый катализатор, такой как Pd2(Dba)3, с подходящей фосфиновой добавкой, такой как 1,4-бис-(дифенилфосфино)бутан в тетрагидрофуране, в течение 20 мин. Когда кольцо В связано с кольцом А через атом N, и W представляет собой NR1, то Схема 2.2 Защит. представляет собой подходящую защитную группу для азота, например Boc, CBz или аллилкарбамат. Для защитных групп азота используют стандартные способы, такие как обнаруживаемые в руководствах (например, "Protecting Groups in Organic Synthesis" by T.W. Greene and P. Wutz).Z' представляет собой уходящую группу (как правило, Cl или ОН). Z" представляет собой галогено(как правило, Cl). Соединения, подходящие для использования в качестве соединения (IV), имеются в продаже или известны в литературе. Соединение (IX"), как правило, может быть получено из соединения (IX') с использованием способов, описанных на стадии (б) или стадии (в) выше. Соединение (III'), как правило, может быть получено из соединения (IX') с использованием способов, описанных на стадии (г) выше. Соединения (I'), как правило, могут быть получены путем арилирования соединений (III') с использованием способов, описанных на стадии (б) выше. Соединения, подходящие для использования в качестве соединений (II) и (VIII), известны из литературы или могут быть получены в соответствии с тем, как представлено на схемах 3.1, 3.2 и 3.3 ниже.LG представляет собой уходящую группу, как правило, галогено, и предпочтительно хлоро или бромо. Схема 3.1 Когда кольца А и В связаны через атом N, тоLG представляет собой уходящую группу, как правило, галогено, и предпочтительно хлоро или бромо. Схема 3.2 Соединения, подходящие для использования в качестве соединений (XI), известны из литературы или могут быть получены с использованием стандартных способов, например восстановлением бензойных кислот (см. подготовительный пример 7 ниже) или бензонитрилов (см. подготовительный пример 10 ниже) или нитробензолов (подготовительные примеры 57 и 58). Когда W представляет собой NR1. Стадия (д). Соединение (Х)/(XII) подвергают взаимодействию с избытком соединения (XI) с получением соединения (II)/(VIII), соответственно, возможно в присутствии избытка основания, такого как триэтиламин, основание Хюнига или NMM, или карбонат калия в качестве акцептора протонов, возможно в присутствии катализатора (например, NaI) в подходящем высококипящем растворителе, таком как ТГФ, толуол или ДМФ, при температурах от 50 до 100 С в течение 1-48 ч. Предпочтительные условия: 2,5 экв. соединения (XI) в ТГФ при 50 С в течение 48 ч; или 1,1 экв. соединения (XI), 1,1 экв. NMM или K2CO3, 0,5 экв. NaI в ТГФ при 50 С. Когда W представляет собой О или S. Стадия (д). Соединение (X)/(XII) подвергают взаимодействию с избытком соединения (XI) в присутствии основания, такого как гидрид натрия, гексаметилдисилазид калия, н-бутиллитий или хлорид изопропил магния, в подходящем растворителе, таком как ТГФ, толуол или NMP, при температурах от 0 до 50 С в течение 1-24 ч с получением соединения (II)/(VIII) соответственно. Предпочтительные условия: 1,1-3 экв. соединения (XI) и 1,1-2,5 экв. NaH в ТГФ при 20 С в течение 2 ч. Когда W=NR1 и Z=CO, то Схема 3.3 Стадия (и). Амин (XX) может быть получен путем аминирования соединения (X) амином R1NH2 в растворителе, таком как этанол или тетрагидрофуран, при 25-75 С в течение 5-72 ч. Предпочтительные условия: Соединение (X), избыток R1NH2 в этаноле и ТГФ при комнатной температуре в течение приблизительно 72 ч. Соединение (II) может быть получено путем сочетания амина (XX) с кислотой (XXI) в соответствии со способом, описанным ранее на стадии (б). Соединения, подходящие для использования в качестве соединений (X) и (XII), известны в литературе или могут быть получены в соответствии с тем, как представлено на схемах 4.1 и 4.2.X' представляет собой ОН или галогено, и предпочтительно представляет собой Cl. LG представляет собой уходящую группу, как правило галогено и предпочтительно хлоро или бромо. Когда кольца А и В связаны через атом N, тоX' представляет собой ОН или галогено, и предпочтительно представляет собой Cl. LG представляет собой уходящую группу, как правило галогено и предпочтительно хлоро или бромо. Соединение (XIV) либо имеется в продаже, либо известно в литературе. Стадия (е). Реакция гидразида (XIII/XIII') с соединением (XIV) может быть осуществлена с использованием стандартных способов. Сочетание может быть осуществлено с использованием: или (I) хлорангидрида (XIV) + гидразида (XIII/XIII') с избытком акцептора кислоты в подходящем растворителе; или (II) кислоты (XIV) с обычным агентом сочетания + гидразида (XIII/XIII'), возможно в присутствии катализатора, с избытком акцептора кислоты в подходящем растворителе. Как правило, условия являются следующими:(I) хлорангидрид (XIV) (образованный in situ), избыток гидразида (XIII/XIII'), возможно с избытком третичного амина, такого как Et3N, основание Хюнига или NMM, в ДХМ или ТГФ, без нагревания в течение 1-24 ч; или(II) кислота (XIV), WSCDI/DCC и НОВТ/НОАТ, избыток гидразида (XIII/XIII'), с избытком NMM,Et3N, основание Хюнига в ТГФ, ДХМ или EtOAc, при комнатной температуре в течение 4-48 ч; или(III) кислота (XIV), PYBOP/PyBrOP/реагент Мукайяма, избыток гидразида (XIII/XIII'), с избытком NMM, Et3N, основание Хюнига в ТГФ, ДХМ или EtOAc, при комнатной температуре в течение 4-24 ч. Предпочтительные условия: гидразид (XIII/XIII'), 1,5 экв. хлорацетилхлорида (XIV), 1,5 экв. NMM в ДХМ при комнатной температуре в течение 16 ч. Стадия (ж). Циклизацию соединения (XV/XV') осуществляют в подходящих дегидратирующих условиях при повышенных температурах в течение до 18 ч. Как правило, дегидратирующие агенты, такие как полифосфорная кислота, оксихлорид фосфора,трифторметансульфоновый (triflic) ангидрид, используют при температурах 20-120 С в течение от 5 мин до 12 ч. Возможно, это взаимодействие может быть осуществлено в присутствии основания, такого как пиридин, и подходящих растворителей, таких как дихлорметан и ацетонитрил. Альтернативно, оксадиазол (XII/X) может быть получен в соответствии со способом Rigo et. al. Synth. Commun. 16(13), 1665,1986. Предпочтительные условия: оксихлорид фосфора при 100 С в течение 8 ч, или 2,5 экв. трифторметансульфонового ангидрида в ацетонитриле при 20 С в течение 5 ч. Соединения, подходящие для использования в качестве соединений (XIII/XIII'), известны в литературе или могут быть получены в соответствии с тем, как изображено на схемах 5.1 и 5.2. Схема 5.1 Когда кольца А и В связаны через атом N, то Схема 5.2 Соединения (XVI)/(XVI') и защищенный гидразин или имеются в продаже, или известны в стандартной методологии, такой как гидролиз соответствующего сложного эфира. Карбоновая кислота (XVI)/(XVI') и защищенный гидразин, где защит., как правило, представляет собой Boc, могут быть подвергнуты сочетанию с получением соединения (XVII/XVII'), соответственно, с использованием условий, описанных выше для получения (XV/XV'), и затем защит. удаляют с использованием стандартных способов в соответствии с тем, как описано на стадии (г) выше, с получением (XIII/XIII'). Альтернативные пути получения соединения (XIII/XIII') представлены ниже на схемах 6.1 и 6.2:R, как правило, представляет собой С 1-2 алкил Схема 6.1 Когда кольца А и В связаны через атом N, то- 16009460 Стадия (з). Сложный эфир (XVIII/XVIII') может быть подвергнут взаимодействию с гидразином в подходящем растворителе, таком как метанол, при повышенной температуре с получением гидразида(XVII/XVII'). Предпочтительные условия: 3 экв. гидразина в метаноле при дефлегмации в течение 18 ч. Альтернативно, соединения формулы (I) могут быть получены в соответствии со схемой 7.0 ниже.R=H или С 1-С 4 алкил, как правило, трет-бутил, метил или этил. Схема 7.0 Когда R=H, соединения формулы (XXIII) могут быть получены путем внутримолекулярного сочетания аминокислоты (XXII) в соответствии со способом, ранее описанным на стадии (б). Предпочтительно соединение (XXII) обрабатывают 1,4 экв. HBTU, 4,5 экв. NMM в ДХМ при комнатной температуре в течение приблизительно 18 ч. Когда R=С 1-С 4 алкил, соединения формулы (XXIII) могут быть получены путем катализируемой основанием циклизации сложного эфира аминокислоты (XXII), как правило, осуществляемой при комнатной температуре или ниже в течение 1-5 ч. Как правило, используют основания, такие как трет-бутилат калия, этилат натрия или хлорид изопропилмагния, при температуре 20 С или ниже в подходящем растворителе, таком как тетрагидрофуран или этанол, в течение 1-5 ч. Предпочтительно соединение (XXII) обрабатывают 1,1 экв. трет-бутилата калия в ТГФ при 20 С в течение приблизительно 2 ч. Стадия (к). Получение тиоамида. Тионирование амида (XXIII) с использованием подходящего тионирующего агента (например, реагента Лавессона, P4S10) и возможно в присутствии основания (например, Na2CO3) в подходящем растворителе (например ТГФ) при температуре от 0 С до комнатной температуры. Предпочтительные условия: 1 экв. P4S10, 1 экв. Na2CO3, 1 экв. амида (XXIII) в ТГФ при 3-25 С в течение 18-72 ч. Стадия (л). Образование тиоимидата. Обработка тиоамида (XXIV) сильным основанием, таким как KO tBu или LDA, в подходящем растворителе, таком как ТГФ или простой эфир, с последующим гашением аниона, образующегося подходящим источником метила (например, MeI, Me паратозилат), позволяет получить тиоимидат (XXV). Предпочтительные условия: 1 экв. тиоамида (XXIV), обработанного 1 экв. KO tBu, 1 экв. Me паратозилата в ТГФ. Образование триазола. Стадия (м). Тиоимидат (XXV) обрабатывают гидразидом (XIII) в подходящем растворителе, как правило этаноле, при повышенной температуре с получением соединения формулы (I), возможно в присутствии катализирующей кислоты, такой как ТФУ, p-TSA. Предпочтительные условия: 1 экв. тиоимидата (XXV), 1 экв. гидразида (XIII) в этаноле при дефлегмации в течение 2 ч.- 17009460 Стадия (н). Тиоамид (XXIV) обрабатывают гидразидом (XIII) в подходящем растворителе, как правило н-бутан-1-оле, при повышенной температуре с получением соединения формулы (I), возможно в присутствии катализирующей кислоты, такой как ТФУ, p-TSA. Предпочтительные условия: 1 экв. тиоамида (XXIV), 1 экв. гидразида (XIII) в н-бутан-1-оле при температуре дефлегмации в течение 18 ч. Соединения, подходящие для использования в качестве соединений (XXII), известны в литературе или могут быть получены с использованием стандартных способов, например, см. C. Apfel et. al., J. Med.Chem. 44(12), 1847-1852, 2001, С.Р. Lang et. al., WO2002008228, F.Ishikawa, J. Med. Chem. 28(10), 1387-93,1985 или Uskokovic, M. et. al., Journal of Organic Chemistry (1965), 30(9), 3111-14. Специалисту в данной области техники понятно, что в процессе синтеза соединения формулы (I) может потребоваться введение и удаление защиты чувствительных функциональных групп. Это может быть достигнуто с использованием обычных способов, например как описано в "Protective Groups in Organic Synthesis" Т. W. Greene and P. G. M. Wuts, John Wiley and Sons Inc, 1991, как проиллюстрировано в примерах 42-49 и 55-58. Некоторые соединения формулы (I) могут быть превращены в альтернативные соединения формулы (I) с использованием стандартных химических превращений. Их примеры представлены ниже. Аминирование (например, примеры 40 и 41). Когда R1 содержит уходящую группу, такую как заместитель хлоро, он может вступать в реакцию с подходящим амином HNR2R3 в присутствии подходящего основания третичного амина (Et3N, NMM или основание Хюнига) или основания щелочного металла (K2CO3, Cs2CO3) в подходящем растворителе (например ДМФ, MeCN), возможно при повышенной температуре. Предпочтительно хлоросоединение обрабатывают избытком HNR2R3, в присутствии избытка K2CO3 в ДМФ при 70 С. Восстановление (например, примеры 50-54, 64 и 65). Соединения, содержащие карбонильную функциональную группу, могут быть восстановлены с использованием подходящего восстановителя, такого как гидрид диизобутилалюминия (DIBAL) или боран,в подходящем растворителе, таком как простой эфир или ТГФ, при температуре от комнатной до температуры дефлегмации реакции. Предпочтительно амидное соединение обрабатывают 10 экв. борана в ТГФ при температуре дефлегмации, а затем избытком HCl при температуре дефлегмации. Восстановительное аминирование (например, примеры 69-81 и 84-90). Соединения формулы (I), содержащие реакционноспособный атом N, могут быть подвергнуты взаимодействию с альдегидом или кетоном в соответствии со способами, описанными на стадии (в). Предпочтительно амин формулы (I) обрабатывают избытком альдегида/кетона и 2 экв. Na(OAc)3BH в ДХМ, возможно в присутствии избытка Et3N и уксусной кислоты, при комнатной температуре в течение до 18 ч. Окисление (например, когда W=S). Соединения формулы (I), содержащие атом серы, могут быть подвергнуты окислению с использованием подходящего окислителя, такого как перекись водорода или мета-хлорпербензойная кислота, в подходящем растворителе, таком как трифторуксусная кислота или 1,1,1,3,3,3-гексафтор-пропан-2-ол,при 0-25 С. Когда окисляют до сульфоксида (W=S(O)1), предпочтительно сульфид формулы (I) обрабатывают 1-1,2 экв. 30% водной перекиси водорода в 1,1,1,3,3,3-гексафтор-пропан-2-оле при комнатной температуре в течение периода времени до 1 ч. Когда окисляют до сульфона (W=S(O)2), предпочтительно сульфид формулы (I) обрабатывают 2-3 экв. 30% водной перекиси водорода в трифторуксусной кислоте в течение периода времени до 1 ч.(Альтернативно, сульфоксид (W=S(O)1), представленный выше, может быть окислен до сульфона(W=S(O)2) с использованием 1-2 экв. 30% водной перекиси водорода в трифторуксусной кислоте в течение периода времени до 1 ч). В соответствии с настоящим изобретением также предложено промежуточное соединение формулы промежуточное соединение формулы (III) промежуточное соединение формулы (X) промежуточное соединение формулы (XV) промежуточное соединение формулы (XXIV) и промежуточное соединение формулы (XXV) где V, W, X, Y, Z, кольца А и В, LG и n являются такими, как определено выше. Соединения по настоящему изобретению полезны, поскольку они обладают фармакологической активностью у животных. В частности, они полезны для лечения множества состояний, включая агрессию,болезнь Альцгеймера, нервную анорексию, тревогу, тревожное расстройство, астму, атеросклероз, аутизм, сердечно-сосудистое заболевание (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), катаракту, заболевание центральной нервной системы, ишемию сосудов головного мозга, цирроз, расстройство познавательной способности, синдром ИценкоКушинга, депрессию, сахарный диабет, дисменорею (первичную и вторичную), рвоту (включая морскую болезнь), эндометриоз, желудочно-кишечное заболевание, глаукому, гинекологическое заболевание, болезнь сердца, задержку внутриутробного развития, воспаление (включая ревматоидный артрит), ишемию, ишемическую болезнь сердца, опухоль легких, расстройство мочеиспускания, межменструальную боль, неоплазму, нефротоксичность, инсулиннезависимый сахарный диабет, ожирение, обсессивнокомпульсивное расстройство, глазную гипертензию, преэклампсию, преждевременное семяизвержение,преждевременные (досрочные) роды, легочное заболевание, болезнь Рейно, болезнь почек, почечную недостаточность, сексуальную дисфункцию у мужчин или женщин, септический шок, расстройство сна,повреждение спинного мозга, тромбоз, инфекцию мочеполового тракта или мочекаменную болезнь.- 19009460 Особенный интерес представляет собой дисменорея (первичная или вторичная), более конкретно, первичная дисменорея. Таким образом, в соответствии с еще одним аспектом данного изобретения предложен способ лечения дисменореи, включающий введение пациенту, страдающему тревогой, сердечно-сосудистым заболеванием (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), дисменореей (первичной и вторичной), эндометриозом, рвотой (включая морскую болезнь),задержкой внутриутробного развития, воспалением (включая ревматоидный артрит), межменструальной болью, преэклампсией, преждевременным семяизвержением, преждевременными (досрочными) родами или болезнью Рейно, терапевтически эффективного количества соединения по данному изобретению. Также предложено применение соединений в качестве лекарства и применение соединений по настоящему изобретению в изготовлении лекарства для лечения тревоги, сердечно-сосудистого заболевания(включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию),дисменореи (первичной и вторичной), эндометриоза, рвоты (включая морскую болезнь), задержки внутриутробного развития, воспаления (включая ревматоидный артрит), межменструальной боли, преэклампсии, преждевременного семяизвержения, преждевременных (досрочных) родов или болезни Рейно, в особенности, дисменореи. Соединения по данному изобретению, предназначенные для фармацевтического применения, могут быть введена в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде кусочков твердого вещества, порошков или пленок с использованием способов, таких как осаждение, кристаллизация, сублимационная сушка, сушка распылением или сушка выпариванием. Для этой цели может быть использована микроволновая сушка или сушка радиоизлучением. Они могут быть введены сами по себе или в комбинации с одним или более чем одним другим соединением по данному изобретению или в комбинации с одним или более чем одним другим лекарственным средством (или в виде любой их комбинации). Например, соединения по настоящему изобретению могут быть введены в комбинации с пероральным контрацептивом. Альтернативно, они могут быть введены в комбинации с ингибитором фосфодиэстеразы 5 (ФДЭ 5). Они также могут быть введены в комбинации с донором NO. Альтернативно, они могут быть введены в комбинации с L-аргинином или в виде соли аргината. Соединения по настоящему изобретению могут также применяться в комбинации с ингибитором циклооксигеназы (ЦОГ). Как правило, их вводят в виде препарата в сочетании с одним или более чем одним фармацевтически приемлемым эксципиентом. Термин "эксципиент" использован здесь для описания любого ингредиента, отличающегося от соединения(ий) по данному изобретению. Выбор эксципиента в значительной степени зависит от факторов, таких как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их приготовления легко понятны специалистам в данной области техники. Такие композиции и способы их приготовления можно найти, например, в "Remington's Pharmaceutical Sciences", 19thEdition (Mack Publishing Company, 1995). Таким образом, в соответствии с еще одним аспектом настоящего изобретения предложен фармацевтический препарат, включающий соединение формулы (I) в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Соединения по данному изобретению могут быть введены перорально. Пероральное введение может включать в себя проглатывание, так что соединение попадает в желудочно-кишечный тракт, или может быть использовано трансбуккальное или подъязычное введение, посредством которых соединение проникает в кровоток непосредственно из ротовой полости. Препараты, подходящие для перорального введения, включают твердые препараты, такие как таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включая заполненные жидкостью), жевательные резинки, препараты с множеством частиц и препараты наночастиц, гели, твердый раствор, липосома, пленки (включая адгезивные в отношении слизистой оболочки), овули, спреи и жидкие препараты. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты могут быть использованы в качестве наполнителей в мягких или твердых капсулах и, как правило, включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и/или более чем один эмульгатор и/или суспендирующий агент. Жидкие препараты также могут быть приготовлены путем растворения твердого вещества, например, из саше. Соединения по данному изобретению могут также быть использованы в быстрорастворимых, быстрораспадающихся лекарственных формах, таких как формы, описанные в Expert Opinion in TherapeuticPatents, 11 (6), 981-986 by Liang and Chen (2001). Для лекарственных форм в виде таблеток, в зависимости от дозы, лекарство может составлять от 1 до 80 мас.% от лекарственной формы, как правило от 5 до 60 мас.% от лекарственной формы. В дополнение к лекарству таблетки, как правило, содержат разрыхлитель. Примеры разрыхлителей включают крахмалгликолят натрия, натрий-карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, натрий- 20009460 кроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, прежелатинизированный крахмал и альгинат натрия. Как правило, разрыхлитель составляет от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% от массы лекарственной формы. Связывающие вещества, как правило, используют для придания таблетированному препарату связующих свойств. Подходящие связывающие вещества включают микрокристаллическую целлюлозу,желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, моногидрат, высушенный распылением, безводная и тому подобное), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат гидрофосфата кальция. Таблетки также могут включать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. Когда присутствуют поверхностно-активные вещества, они могут составлять от 0,2 до 5 мас.% от массы таблетки, и скользящие вещества могут составлять от 0,2 до 1 мас.% от массы таблетки. Кроме того, таблетки, как правило, содержат смазывающие вещества, такие как стеарат магния,стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния и лаурилсульфата натрия. Смазывающие вещества, как правило, составляют от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% от массы таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, корригенты, консерванты и агенты, маскирующие вкус. Примеры таблеток содержат до приблизительно 80% лекарства, от приблизительно 10 до приблизительно 90 мас.% связывающего вещества, от приблизительно 0 до приблизительно 85 мас.% разбавителя,от приблизительно 2 до приблизительно 10 мас.% разрыхлителя и от приблизительно 0,25 до приблизительно 10 мас.% смазывающего вещества. Таблетируемые смеси могут быть подвергнуты прессованию непосредственно или с использованием валика с получением таблеток. Таблетируемые смеси или части смесей альтернативно могут быть подвергнуты влажному или сухому гранулированию либо гранулированию из расплава, застыванию из расплава или экструдированию перед таблетированием. Конечный препарат может включать один или более чем один слой и может быть покрыт оболочкой или не содержать оболочки; он даже может быть инкапсулирован. Препараты таблеток обсуждаются в "Pharmaceutical Dosage Forms: Tablets, Vol. 1", H. Lieberman andL. Lachman, Marcel Dekker, N.Y., N.Y, 1980 (ISBN 0-8247-6918-X). Твердые препараты для перорального введения могут быть изготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают препараты с замедленным, длительным, импульсным, контролируемым, нацеленным и программируемым высвобождением. Подходящие препараты с модифицированным высвобождением для целей данного изобретения описаны в патенте США 6106864. Подробная информация о других подходящих способах высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые оболочкой частицы,можно найти в Verma et al., Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Применение жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. Соединения по данному изобретению могут также быть введены непосредственно в кровоток, в мышцу или внутренний орган. Подходящие способы парентерального введения включают внутривенное,внутриартериальное, внутрибрюшинное, внутриоболочечное, внутрисуставное, внутриуретральное,внутригрудинное, внутричерепное, внутримышечное и подкожное. Подходящие способы парентерального введения включают инъекции иглой (включая микроиглу), безыгольные инъекции и инфузии. Препараты для парентерального введения, как правило, представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и забуферивающие агенты (предпочтительно до pH от 3 до 9), но для некоторых применений они более подходящим образом могут быть изготовлены в виде стерильного неводного раствора или в виде высушенной формы, используемой в сочетании с подходящим разбавителем, таким как стерильная апирогенная вода. Приготовление препаратов для парентерального введения в стерильных условиях, например, путем лиофилизации, может быть легко осуществлено с использованием стандартных фармацевтических способов, известных специалистам в данной области техники. Растворимость соединений формулы (I), используемых при приготовлении растворов для парентерального введения, может быть увеличена путем подходящей обработки, например путем применения высокоэнергетических, высушенных распылением дисперсий (см. WO 01/47495) и/или путем применения подходящих способов приготовления препарата, таких как использование агентов, увеличивающих растворимость. Препараты для парентерального введения могут быть изготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включа- 21009460 ют препараты с замедленным, длительным, импульсным, контролируемым, нацеленным и программируемым высвобождением. Таким образом, соединения по данному изобретению могут быть изготовлены в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантируемых депо-препаратов, обеспечивающих модифицированное высвобождение активного соединения. Примеры таких препаратов включают покрытые лекарством стенты и микросферы на основе поли-DL-молочной-согликолевой кислоты (PGLA). Соединения по данному изобретению могут также быть введены местно на кожу или слизистые оболочки, либо дермально или трансдермально. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки,имплантаты, губки, волокна, бандажи и микроэмульсии. Также могут быть использованы липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин,полиэтиленгликоль и пропиленгликоль. Могут быть включены агенты, усиливающие проницаемостьсм., например, J. Pharm. Sci., 88 (10), 955-958 by Finnin and Morgan (Октябрь, 1999). Другие способы местного введения включают доставку путем ионофореза, электропорации, фонофореза, сонофореза и инъекции микроиглой или безыгольные инъекции (например, Powderject, Bioject и т.д.). Препараты для местного введения могут быть изготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты с замедленным, длительным, импульсным, контролируемым, нацеленным и программируемым высвобождением. Соединения по данному изобретению могут также быть введены интраназально или путем ингаляции, как правило в форме сухого порошка (самого по себе, в виде смеси, например сухой смеси с лактозой, или в виде смешанных частиц компонентов, например смешанных с фосфолипидами, такими как фосфатидилхолин) из сухого порошкового ингалятора или в виде аэрозольного спрея из герметичного контейнера, насоса, спрея, пульверизатора (предпочтительно пульверизатора с использованием электрогидродинамики для получения мелкодисперсного тумана), или распылителя, с использованием подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или без него. Для интраназального применения порошок может включать биоадгезивный агент, например хитозан или циклодекстрин. Герметичный контейнер, насос, спрей, пульверизатор или распылитель содержат раствор или суспензию соединения(ий) по данному изобретению, включающие, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, растворения и длительного высвобождения активного агента, пропеллент(ы) в качестве растворителя и возможное поверхностно-активное вещество,такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота. Перед использованием в сухом порошке препарата в виде суспензии лекарственный продукт измельчают до размера, подходящего для доставки путем ингаляции (как правило, меньше 5 мкм). Это может быть достигнуто с использованием любого подходящего способа измельчения, такого как перемалывание в спирально-вихревой мельнице, перемалывание в струйной мельнице с псевдоожиженным слоем,сверхкритическая жидкостная обработка с образованием наночастиц, гомогенизация высоким давлением или сушка распылением. Капсулы (изготовленные, например, из желатина или гидроксипропилметилцеллюлозы (НРМС,блистеры и картриджи для использования в ингаляторе или инсуффляторе могут быть изготовлены таким образом, чтобы содержать порошкообразную смесь соединения по данному изобретению, подходящую порошкообразную основу, такую как лактоза или крахмал, и модификатор свойств, такой как 1 лейцин, маннит или стеарат магния. Лактоза может быть безводной или быть в форме моногидрата,предпочтительно последнее. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу,сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий препарат в виде раствора для использования в пульверизаторе с использованием электродинамики для получения микродисперсного тумана может содержать от 1 мкг до 20 мг соединения по данному изобретению на одно срабатывание, и объем срабатывания может варьировать от 1 до 100 мкл. Типичный препарат может включать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Подходящие корригенты, такие как ментол и левоментол, или подсластители, такие как сахарин или натриевый сахарин, могут быть добавлены к препаратам по данному изобретению, предназначенным для введения путем ингаляции/интраназального введения. Препараты для введения путем ингаляции/интраназального введения могут быть изготовлены в виде препаратов немедленного и/или модифицированного высвобождения с использованием, например,поли-DL-молочной-согликолевой кислоты (PGLA). Препараты модифицированного высвобождения включают препараты с замедленным, длительным, импульсным, контролируемым, нацеленным и программируемым высвобождением.- 22009460 Соединения по данному изобретению могут быть введены ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Масло какао представляет собой традиционную основу суппозитория, но когда подходит, могут быть использованы различные альтернативные варианты. Препараты для ректального/вагинального введения могут быть изготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты с замедленным, длительным, импульсным, контролируемым, нацеленным и программируемым высвобождением. Соединения по данному изобретению могут также быть введены непосредственно в глаз или ухо,как правило в форме капель микронизированной суспензии или раствора в изотоническом стерильном физиологическом растворе с отрегулированным pH. Другие препараты, подходящие для внутриглазного и внутриушного введения, включают мази, биоразрушаемые (например, абсорбируемые гелевые губки,коллаген) и не подвергающиеся биоразрушению (например, силикон) имплантаты, облатки, линзы и системы частиц или везикул, такие как ниосомы или липосомы. Может быть включен полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая камедь, вместе с консервантом, таким как хлорид бензалкония. Такие препараты могут также быть доставлены путем ионофореза. Препараты для внутриглазного/внутриушного введения могут быть приготовлены в виде препаратов немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают препараты с замедленным, длительным, импульсным, контролируемым, нацеленным и программируемым высвобождением. Соединения по данному изобретению можно объединять с растворимыми макромолекулярными веществами, такими как циклодекстрин или полиэтиленгликольсодержащие полимеры, для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности при применении в любом из вышеупомянутых способов введения. Например, было обнаружено, что комплексы лекарство-циклодекстрин, как правило, полезны для большинства лекарственных форм и путей введения. Могут быть использованы комплексы включения и без включения. В качестве альтернативы прямому комплексообразованию с лекарством, циклодекстрин может быть использован в качестве дополнительной добавки, то есть как носитель, разбавитель или растворитель. Обычно для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых могут быть обнаружены в Международных заявкахWO 91/11172, WO 94/02518 и WO 98/55148. Поскольку может быть желательно вводить комбинацию активных соединений, например, с целью лечения конкретного заболевания или состояния, в объеме настоящего изобретения, две или более чем две фармацевтические композиции, по меньшей мере одна из которых содержит соединение по данному изобретению, для удобства можно объединять в форме набора, подходящего для совместного введения этих композиций. Таким образом, набор по данному изобретению включает две или более чем две отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединения формулы (I) по данному изобретению, и средства для раздельного содержания указанных композиций, такие как контейнер,разделенный флакон или разделенный пакет из фольги. Примером такого набора является обычная блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного. Набор по данному изобретению особенно подходит для введения различных лекарственных форм,например перорального и парентерального, для введения отдельных композиций с различными интервалами дозирования или для титрования отдельных композиций относительно друг друга. Для удобства набор, как правило, включает указания по введению и может быть снабжен так называемой памяткой. Для введения пациентам-людям, общая суточная доза соединений по данному изобретению, как правило, находится в диапазоне от приблизительно 0,01 до приблизительно 15 мг/кг массы тела, в зависимости от способа введения. Общая суточная доза может быть введена в виде однократной дозы или разделенных доз в течение суток. Эти дозировки рассчитаны на среднестатистического человека, имеющего массу от приблизительно 65 до 70 кг. Лечащий врач легко может определить дозы для субъектов,масса которых находится за пределами этого диапазона, таких как младенцы и пожилые люди. Используемые здесь термины "лечение" и "лечить" означают облегчение симптомов, устранение этиологии, временно или постоянно, либо предотвращение или замедление проявления симптомов. Термин "лечение" включает облегчение, устранение этиологии (временно или постоянно) или профилактику симптомов и расстройств, ассоциированных с первичной и/или вторичной дисменореей. Лечение может представлять собой профилактическое лечение, а также лечение после начала проявления симптомов. Соединения по настоящему изобретению могут быть тестированы в скринингах, представленных ниже. 1.0. Анализ связывания с фильтром V1A. 1.1. Препарат мембран. Анализы связывания с рецептором осуществляли на клеточных мембранах, полученных из клеток яичника китайского хомячка (СНО), стабильно экспрессирующих человеческий рецептор V1A(CHO- 23009460hV1A). Клеточная линия CHO-hV1A была любезно предоставлена в соответствии с лицензионным соглашением Марком Тибониером (Marc Thibonnier), Dept. of Medicine, Case Western Reserve University Schoolof Medicine, Cleveland, Ohio. Клетки CHO-hV1A стандартно поддерживали при 37 С в увлажненной атмосфере с 5% CO2 в модифицированной по способу Дульбекко среде Игла (DMEM)/питательной смесиHams F12, дополненной 10% фетальной телячьей сывороткой, 2 мМ L-глутамином, 15 мМ HEPES и 400 мкг/мл G418. Для получения партий клеточных осадков адгерентные клетки CHO-hV1A выращивали до конфлюэнтности 90-100% во вращающихся колбах на 850 см 2, содержащих среду DMEM/питательную смесь Hams F12, дополненную 10% фетальной телячьей сывороткой, 2 мМ L-глутамином и 15 мМHEPES. Конфлюэнтные клетки CHO-hV1A промывали забуференным фосфатом физиологическим раствором (PBS), собирали в охлажденный на льду PBS и центрифугировали при 1000 об/мин. Клеточные осадки хранили при -80 С до использования. Клеточные осадки подвергали оттаиванию на льду и гомогенизировали в буфере для препарата мембран, состоящем из 50 мМ Tris-HCl, pH 7,4, 5 мМ MgCl2 и дополненном смесью ингибиторов протеаз (Roche). Клеточный гомогенат центрифугировали при 1000 об/мин в течение 10 мин при 4 С и супернатант удаляли и хранили на льду. Оставшийся осадок гомогенизировали и центрифугировали, как описано выше. Супернатанты объединяли и центрифугировали при 25000g в течение 30 мин при 4 С. Осадок ресуспендировали в буфере для замораживания, состоящем из 50 мМ Tris-HCl, pH 7,4, 5 мМ MgCl2 и 20% глицерина, и хранили небольшими аликвотами при -80 С до использования. Концентрацию белка определяли с использованием реагента Брэдфорда и бычьего сывороточного альбумина (БСА) в качестве стандарта. 1.2. Связывание с фильтром V1A. Линейность для белка с последующими исследованиями насыщающего связывания осуществляли на каждой новой партии мембран. Выбирали концентрацию мембран, которая обеспечивала специфическое связывание на линейном участке кривой. Исследования насыщающего связывания затем осуществляли с использованием различных концентраций [3H]-аргинин-вазопрессина ([3H]-AVP) (0,05 нМ-100 нМ) и определяли Kd и Bmax. Соединения тестировали в отношении их воздействий на связывание [3H]-AVP с мембранами CHOhV1A (3H-AVP; специфическая активность 65,5 Ки/ммоль; NEN Life Sciences). Соединения растворяли в диметилсульфоксиде (ДМСО) и разбавляли до рабочей концентрации 10% ДМСО буфером для анализа,содержащим 50 мМ Tris-HCl, pH 7,4, 5 мМ MgCl2 и 0,05% БСА. 25 мкл соединения и 25 мкл [3H]-AVP(конечная концентрация на уровне Kd или ниже, определенная для партии мембран, составляла обычно 0,5 нМ-0,6 нМ) добавляли в 96-луночный круглодонный полипропиленовый планшет. Реакцию связывания инициировали путем добавления 200 мкл мембран и планшеты осторожно встряхивали в течение 60 мин при комнатной температуре. Реакцию останавливали путем быстрого фильтрования с использованием аппарата для сбора клеток Filtermate Cell Harvester (Packard Instruments) через 96-луночный GF/В UniFilter Plate, который был предварительно промыт 0,5% полиэтиленимином для предотвращения адгезии пептидов. Фильтры трижды промывали 1 мл охлажденного на льду буфера для отмывки, содержащего 50 мМ Tris-HCl, pH 7,4 и 5 мМ MgCl2. Планшеты сушили и в каждую лунку добавляли по 50 мкл Microscint0 (Packard instruments). Планшеты закрывали и подсчитывали с использованием сцинтилляционного счетчика TopCount Microplate Scintillation Counter (Packard Instruments). Неспецифическое связывание(NSB) определяли с использованием 1 мкМ немеченного d(CH2)5Tyr(Me)AVP ([-меркапто-,циклопентаметиленпропионил, O-Ме-Tyr2, Arg8]вазопрессин) (MCPVP) (Sigma). Данные о связывании радиоактивного лиганда анализировали с использованием четырехпараметрического логистического уравнения с минимумом до 0%. Наклон был подогнан и составлял от -0,75 до -1,25 для подходящих кривых. Специфическое связывание рассчитывали путем вычитания среднего значения имп/мин для NSB из общего среднего значения имп/мин. Для тестируемых соединений количество лиганда, связавшегося с рецептором, выражали в виде %связывания = (имп/мин для образца - имп/мин для NSB)/имп/мин для специфического связывания 100. Строили график зависимости %связывания от концентрации тестируемого соединения и сигмоидальную кривую подгоняли. Рассчитывали константу ингибирования диссоциации (Ki) с использованием уравнения Ченга-Прусоффа (Cheng-Prusoff): Ki=IC50/(1+[L]/Kd), где [L] представляет собой концентрацию лиганда, находящегося в лунке, и Kd представляет собой константу диссоциации радиоактивного лиганда, полученную в результате анализа графика Скэтчарда (Scatchard). 2.0. Функциональный анализ V1A. Ингибирование опосредованной AVP/V1A-R мобилизации Са 2+ с использованием считывающего устройства для флуоресцентной визуализации планшетов FLIPR (Fluorescent Imaging Plate Reader) (Molecular Devices). Внутриклеточное высвобождение кальция оценивали в клетках CHO-hV1A с использованием FLIPR,дающего возможность для быстрого обнаружения кальция после активации рецептора. Клеточная линияCHO-hV1A была любезно предоставлена в соответствии с лицензионным соглашением Марком Тибониером (Marc Thibonnier), Dept. of Medicine, Case Western Reserve University School of Medicine, Cleveland,Ohio. Клетки CHO-V1A стандартно поддерживали при 37 С в увлажненной атмосфере с 5% СО 2 в средеDMEM/питательной смеси Hams F12, дополненной 10% фетальной телячьей сывороткой, 2 мМ Lглутамином, 15 мМ HEPES и 400 мкг/мл G418. Утром перед анализом клетки высевали с плотностью- 24009460 20000 клеток на лунку в темные стерильные 96-луночные планшеты с прозрачным дном для возможности наблюдения за клетками и оценки флуоресценции через дно каждой лунки. В день анализа готовили свежий буфер для отмывки, содержащий забуференный фосфатом физиологический раствор Дульбекко(DPBS) и 2,5 мМ пробенецид, и включаемый краситель, состоящий из среды для культуры клеток, содержащей 4 мкМ Fluo-3-AM (растворенного в ДМСО и плюроновой кислоте) (Molecular Probes) и 2,5 мМ пробенецид. Соединения растворяли в ДМСО и разбавляли буфером для анализа, состоящим из DPBS,содержащим 1% ДМСО, 0,1% БСА и 2,5 мМ пробенецид. Клетки инкубировали со 100 мкл включаемого красителя на лунку в течение 1 ч при 37 С в увлажненной атмосфере с 5% CO2. После включения красителя клетки трижды промывали 100 мкл буфера для отмывки с использованием устройства для промывания планшетов Denley. В каждую лунку вносили 100 мкл буфера для отмывки. Внутриклеточную флуоресценцию оценивали с использованием FLIPR. Считывания флуоресценции осуществляли с интервалами в 2 секунды с добавлением 50 мкл тестируемого соединения через 30 секунд. Затем проводили 155 дополнительных измерений с интервалами в 2 секунды для обнаружения какого-либо агонистического действия соединения. Затем добавляли 50 мкл аргинин-вазопрессина (AVP) таким образом, что конечный анализируемый объем составил 200 мкл. С интервалами в 1 секунду в течение 120 секунд осуществляли дополнительные считывания флуоресценции. Ответы оценивали в виде максимальной интенсивности флуоресценции (FI). Для характеризации фармакологических свойств базовую FI вычитали из каждого флуоресцентного ответа. Для кривых зависимости доза AVP-ответ, каждый ответ выражали в виде % от ответа на наибольшую концентрацию AVP в этой серии. Для определений IC50 каждый ответ выражали в виде % от ответа на AVP. Значения IC50 переводили в модифицированное значение Kb с использованием уравнения Ченга-Прусоффа (Cheng-Prusoff), в котором принимается во внимание концентрация агониста [А], ЕС 50 агониста и наклон: Kb=IC50/(2+[A]/A50n)1/n-1, где [А] представляет собой концентрациюAVP, А 50 представляет собой ЕС 50 AVP из кривой зависимости доза-ответ, и n представляет собой наклон кривой зависимости доза AVP-ответ. Соединения по данному изобретению могут обладать преимуществом, заключающимся в том, что они являются более эффективными, имеют большую продолжительность действия, обладают более широким диапазоном активности, являются более стабильными, имеют меньше побочных действий или являются более избирательными либо обладают другими более полезными свойствами по сравнению с соединениями предшествующего уровня техники. Таким образом, в данном изобретении предложено:(1) соединение формулы (I) или его фармацевтически приемлемое производное;(2) способ получения соединения формулы (I) или его фармацевтически приемлемого производного;(3) фармацевтический препарат, включающий соединение формулы (I) или его фармацевтически приемлемое производное вместе с фармацевтически приемлемыми эксципиентами, разбавителем или носителем;(4) соединение формулы (I) или его фармацевтически приемлемое производное или композиция для применения в качестве лекарства;(5) применение соединения формулы (I) или его фармацевтически приемлемого производного или композиции для изготовления лекарства для лечения агрессии, болезни Альцгеймера, нервной анорексии, тревоги, тревожного расстройства, астмы, атеросклероза, аутизма, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), катаракты, заболевания центральной нервной системы, ишемии сосудов головного мозга, цирроза,расстройства познавательной способности, синдрома Иценко-Кушинга, депрессии, сахарного диабета,дисменореи (первичной и вторичной), рвоты (включая морскую болезнь), эндометриоза, желудочнокишечного заболевания, глаукомы, гинекологического заболевания, болезни сердца, задержки внутриутробного развития, воспаления (включая ревматоидный артрит), ишемии, ишемической болезни сердца,опухоли легких, расстройства мочеиспускания, межменструальной боли, неоплазмы, нефротоксичности,инсулиннезависимого сахарного диабета, ожирения, обсессивно-компульсивного расстройства, глазной гипертензии, преэклампсии, преждевременного семяизвержения, преждевременных (досрочных) родов,легочного заболевания, болезни Рейно, болезни почек, почечной недостаточности, сексуальной дисфункции у мужчин или женщин, септического шока, расстройства сна, повреждения спинного мозга,тромбоза, инфекции мочеполового тракта или мочекаменной болезни;(6) применение, как в (5), где заболевание или расстройство представляет собой тревогу, сердечнососудистое заболевание (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность,отек, гипернатриемию), дисменорею (первичную и вторичную), эндометриоз, рвоту (включая морскую болезнь), задержку внутриутробного развития, воспаление (включая ревматоидный артрит), межменструальную боль, преэклампсию, преждевременное семяизвержение, преждевременные (досрочные) роды и болезнь Рейно;(7) применение, как в (5), где заболевание или расстройство представляет собой дисменорею (первичную или вторичную);(8) способ лечения у млекопитающего агрессии, болезни Альцгеймера, нервной анорексии, тревоги,тревожного расстройства, астмы, атеросклероза, аутизма, сердечно-сосудистого заболевания (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность, отек, гипернатриемию), катаракты, заболевания центральной нервной системы, ишемии сосудов головного мозга, цирроза, расстройства познавательной способности, синдрома Иценко-Кушинга, депрессии, сахарного диабета, дисменореи(первичной и вторичной), рвоты (включая морскую болезнь), эндометриоза, желудочно-кишечного заболевания, глаукомы, гинекологического заболевания, болезни сердца, задержки внутриутробного развития, воспаления (включая ревматоидный артрит), ишемии, ишемической болезни сердца, опухоли легких, расстройства мочеиспускания, межменструальной боли, неоплазмы, нефротоксичности, инсулиннезависимого сахарного диабета, ожирения, обсессивно-компульсивного расстройства, глазной гипертензии, преэклампсии, преждевременного семяизвержения, преждевременных (досрочных) родов, легочного заболевания, болезни Рейно, болезни почек, почечной недостаточности, сексуальной дисфункции у мужчин или женщин, септического шока, расстройства сна, повреждения спинного мозга, тромбоза, инфекции мочеполового тракта или мочекаменной болезни у млекопитающего, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) или его фармацевтически приемлемого производного или композиции;(9) способ, как в (8), где заболевание или расстройство представляет собой тревогу, сердечнососудистое заболевание (включая стенокардию, атеросклероз, гипертензию, сердечную недостаточность,отек, гипернатриемию), дисменорею (первичную и вторичную), эндометриоз, рвоту (включая морскую болезнь), задержку внутриутробного развития, воспаление (включая ревматоидный артрит), межменструальную боль, преэклампсию, преждевременное семяизвержение, преждевременные (досрочные) роды или болезнь Рейно;(10) способ, как в (7), где заболевание или расстройство представляет собой дисменорею (первичную и вторичную);(11) промежуточные соединения формул (II), (III), (X), (XV), (XXIV) и (XXV);(12) применение комбинации соединения формулы (I) с пероральным контрацептивом для лечения дисменореи (первичной и/или вторичной);(13) применение комбинации соединения формулы (I) с ингибитором ФДЭ 5 для лечения дисменореи (первичной и/или вторичной);(14) применение комбинации соединения формулы (I) с донором NO для лечения дисменореи (первичной и/или вторичной);(15) применение комбинации соединения формулы (I) с L-аргинином для лечения дисменореи (первичной и/или вторичной);(16) применение комбинации соединения формулы (I) с ингибитором ЦОГ для лечения дисменореи(первичной и/или вторичной). Данное изобретение проиллюстрировано следующими подготовительными примерами и примерами. Подготовительный пример 1. Гидразид 3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-карбоновой кислоты.(620 мкл, 20 ммоль), и кипятили с обратным холодильником в течение 18 ч. Смесь охлаждали до комнатной температуры и упаривали при пониженном давлении. Образованное твердое вещество растирали с пропан-2-олом с получением указанного в заголовке соединения в виде белого твердого вещества (493 мг). Масс-спектрометрия с химической ионизацией при атмосферном давлении (APCI MS) m/z 221 Карбонат калия (52,5 г, 0,379 моль) добавляли к перемешиваемому раствору 2-бромпиридина (60 г,0,379 моль) и этилизонипекотата (59,7 г, 0,379 моль) при температуре окружающей среды перед нагреванием до 120 С в течение 24 ч. Смесь охлаждали до комнатной температуры и к раствору добавляли пропан-2-ол. Реакционную смесь затем фильтровали и использовали в подготовительном примере 1 в. Гидрат гидразина (61,4 мл, 1,265 моль) добавляли к раствору этилового эфира 3,4,5,6-тетрагидро 2H-[1,2']бипиридинил-4-карбоновой кислоты (0,253 моль, 5 мл/г) (см. ссылку Farmaco, 1993, 48(10),1439) в пропан-2-оле перед кипячением с обратным холодильником в течение 18 ч. Смесь охлаждали до комнатной температуры и затем до 10 С и собирали путем фильтрования продукт в виде белого твердого вещества (44,5 г). В соответствии со способом, описанным в подготовительном примере 1, из этилового эфира 1 пиримидин-2-илпиперидин-4-карбоновой кислоты (см. Farmaco, 1993, 48(10), 1439) получили указанное в заголовке соединение с выходом 91%. Гидразид соединения подготовительного примера 1 (23,6 г, 0,11 моль) суспендировали в дихлорметане (500 мл) и добавляли 4-метилморфолин (17,7 мл, 0,16 моль). Смесь охлаждали с использованием ледяной бани и по каплям добавляли хлорацетилхлорид (12,8 мл, 0,16 моль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Образованное твердое вещество выделяли путем фильтрования, промывали дихлорметаном и диэтиловым эфиром и сушили в вакууме с получением указанного в заголовке соединения (20,4 г). Жидкостная хроматография/масс-спектрометрия (LCMS): m/z ES+ 297 [М+Н]+. Подготовительный пример 3 б. N'-(2-Хлорацетил)гидразид 3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-4-карбоновой кислоты. Гидразид подготовительного примера 1 в (5,0 г, 23 ммоль) суспендировали в дихлорметане (100 мл) и добавляли 4-метилморфолин (3,75 мл, 34 ммоль). Смесь охлаждали с использованием ледяной бани и по каплям добавляли хлорацетилхлорид (1,9 мл, 24 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Образованное твердое вещество выделяли путем фильтрования, промывали дихлорметаном и сушили в вакууме с получением указанного в заголовке соединения Указанное в заголовке соединение получали из гидразида подготовительного примера 2 и хлорацетилхлорида с выходом 96%, используя способ, описанный в подготовительном примере 3. Гидразид подготовительного примера 3 (20,4 г, 69 ммоль) суспендировали в оксихлориде фосфора(150 мл) при 100 С в течение 4 ч. Смесь охлаждали и растворитель выпаривали при пониженном давлении. Остаток растворяли в этилацетате и добавляли к воде. Водный слой подщелачивали путем добавления твердого гидрокарбоната натрия и фазы разделяли. Водную фазу экстрагировали этилацетатом (2) и объединенные органические слои сушили над сульфатом магния и упаривали при пониженном давлении. Выделенное вещество растирали с диэтиловым эфиром с получением указанного в заголовке соединения в виде бежевого твердого вещества (15 г). 1 Н ЯМР (400 МГц, CD3OD):1,91 (m, 2 Н), 2,19 (m, 2H), 3,14 (m, 2H), 3,30 (m, 1H), 4,29 (m, 2H),4,86 (s, 2H), 6,69 (m, 1H), 6,89 (d, 1H), 7,58 (m, 1H), 8,08 (d, 1H). Подготовительный пример 5 б. 4-(5-Хлорметил-[1,3,4]оксадиазол-2-ил)-3,4,5,6-тетрагидро-2H[1,2']бипиридинил. Гидразид подготовительного примера 3 (50,0 г, 169 ммоль) суспендировали в ацетонитриле (250 мл) и охлаждали, используя ледяную баню. По каплям при температуре (Т) меньше 15 С добавляли трифторметансульфоновый ангидрид (29,9 мл, 177 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 16 ч. Реакционную смесь охлаждали с использованием ледяной бани и по каплям добавляли раствор гидрокарбоната натрия (29,8 г, 354 ммоль) в воде (250 мл). Добавляли дихлорметан (250 мл) и фазы разделяли. Органическую фазу, содержащую продукт, использовали в подготовительном примере 14 б. 1 Н ЯМР (400 МГц, CD3OD):1,91 (m, 2H), 2,19 (m, 2H), 3,14 (m, 2H), 3,30 (m, 1H), 4,29 (m, 2H),4,86 (s, 2H), 6,69 (m, 1H), 6,89 (d, 1H), 7,58 (m, 1H), 8,08 (d, 1H). Подготовительный пример 6. 2-[4-(5-Хлорметил-[1,3,4]оксадиазол-2-ил)пиперидин-1-ил]пиримидин. Указанное в заголовке соединение получали из гидразида подготовительного примера 4 с выходом 84%, используя способ, описанный в подготовительном примере 5. К охлажденному на льду 1 молярному раствору алюмогидрида лития (14,4 мл) в тетрагидрофуране по каплям добавляли 2-амино-5-метоксибензойную кислоту (2,0 г, 12 ммоль) в тетрагидрофуране (20 мл) и перемешивали при 5 С в течение 2 ч. По каплям добавляли воду (0,5 мл), а затем 2 молярный водный раствор гидроксида натрия (0,5 мл). Получающуюся в результате эмульсию сушили над сульфатом магния, затем фильтровали и упаривали при пониженном давлении с получением указанного в заголовке соединения в виде желтого твердого вещества (766 мг). Указанное в заголовке соединение получали из 2-амино-6-хлор-бензойной кислоты с выходом 69% в виде сероватого твердого вещества, следуя способу, описанному в подготовительном примере 7. Указанное в заголовке соединение получали из 2-амино-4-хлор-бензойной кислоты с выходом 48% в виде сероватого твердого вещества, следуя способу, описанному в подготовительном примере 7. К охлажденному на льду 1 молярному раствору алюмогидрида лития (100 мл) в тетрагидрофуране по каплям добавляли 2-амино-5-хлор-бензонитрил (9,0 г, 59 ммоль) в тетрагидрофуране (100 мл) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. По каплям добавляли воду (10 мл). Получающуюся в результате эмульсию сушили над сульфатом магния, фильтровали и упаривали при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (4,56 г). 1 К раствору N-[2-(2-гидроксиэтил)фенил]ацетамида (5,0 г, 27,9 ммоль) (см. ссылку Biochemistry 1979, 18(5), 860) в ледяной уксусной кислоте (50 мл) по каплям добавляли раствор хлора в ледяной уксусной кислоте (0,98 М, 30 мл) и смесь перемешивали при комнатной температуре в течение 20 ч. Ледяную уксусную кислоту удаляли при пониженном давлении. Получающееся в результате масло растирали с диэтиловым эфиром с получением после фильтрования указанного в заголовке соединения (3,3 г) в виде бледно-желтого твердого вещества. Соединение подготовительного примера 11 суспендировали в 2 молярной водной соляной кислоте(20 мл) и нагревали до 100 С в течение 4 ч. Раствор оставляли охлаждаться, подщелачивали (pH 9) с использованием 0,880 водного аммиака и распределяли с использованием этилацетата (50 мл). Органический слой промывали водой и насыщенным рассолом и сушили над сульфатом магния. Раствор фильтровали и затем упаривали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле, используя в качестве элюента метанол и гидроксид аммония в дихлорметане (5:0,5:95), с получением указанного в заголовке соединения в виде коричневого масла (0,43 г).- 29009460 К раствору оксадиазола подготовительного примера 5 (2,0 г, 7,18 ммоль) в тетрагидрофуране (50 мл) добавляли раствор 2-аминометил-фениламина (2,2 г, 17,9 ммоль) в тетрагидрофуране (50 мл) и смесь нагревали до 50 С в течение 18 ч. Реакционную смесь упаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле, используя в качестве элюента метанол и гидроксид аммония в дихлорметане (5:0,5:95), с получением указанного в заголовке соединения в виде бледно-желтой смолы (2,6 г). К раствору оксадиазола подготовительного примера 5 (4,56 г, 16 ммоль) в тетрагидрофуране (50 мл) добавляли раствор амина подготовительного примера 10 (6,4 г, 41 ммоль) в тетрагидрофуране (50 мл) и смесь нагревали до 50 С в течение 18 ч. Реакционную смесь упаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле, используя в качестве элюента метанол в дихлорметане (5:95), с получением указанного в заголовке соединения в виде белого твердого вещества (4,65 г). Раствор оксадиазола подготовительного примера 5 б в ацетонитриле/дихлорметане перегоняли, остаток помещали в ацетонитрил и затем в течение 5 ч кипятили с обратным холодильником с гидрокарбонатом натрия (14,9 г, 177 ммоль) и амином подготовительного примера 10 (39,7 г, 253 ммоль). Смесь охлаждали и добавляли воду (250 мл) и дихлорметан (1500 мл). Фазы разделяли и органическую фазу перегоняли и замещали этилацетатом. Получающийся в результате остаток выделяли путем фильтрования с получением указанного в заголовке соединения в виде желтого твердого вещества (32,8 г). К раствору оксадиазола подготовительного примера 6 (2,95 г, 11 ммоль) в тетрагидрофуране (50 мл) добавляли раствор амина подготовительного примера 10 (4,12 г, 26 ммоль) в тетрагидрофуране (50 мл) и нагревали до 50 С в течение 18 ч. Реакционную смесь упаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле, используя в качестве элюента этилацетат, с получением указанного в заголовке соединения в виде сероватого твердого вещества (2,34 г).
МПК / Метки
МПК: C07D 413/14, C07D 487/04, A61P 29/00, C07D 513/04, C07D 498/04, A61K 31/501, A61K 31/4427, C07D 249/00, C07D 401/04, C07D 243/00, A61K 31/55
Метки: соединения, триазольные, полезные, терапии
Код ссылки
<a href="https://eas.patents.su/30-9460-triazolnye-soedineniya-poleznye-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Триазольные соединения, полезные в терапии</a>












