Производные 6-азаурацила, ингибирующие il-5
Номер патента: 4806
Опубликовано: 26.08.2004
Авторы: Лакрамп Жан Фернан Арман, Эмбрехтс Вернер Констант Йохан, Дерос Фредерик Дирк, Фрейн Эдди Жан Эдгар, Фортэн Жером Мишель Клод
Формула / Реферат
1. Соединение формулы
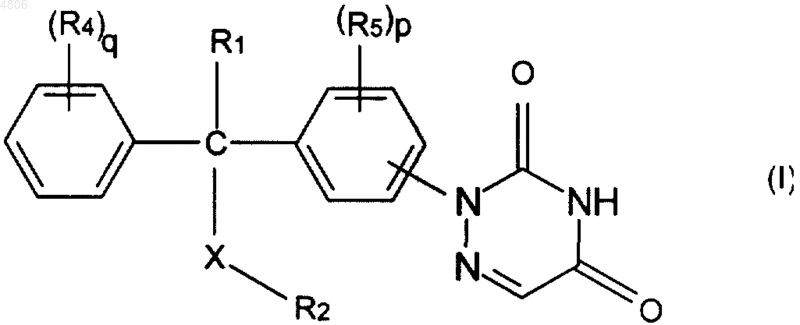
его N-оксид, фармацевтически приемлемая аддитивная соль, четвертичный амин и стереохимически изомерная форма, где
p равно целому числу 0, 1 или 2;
q равно целому числу 1;
X представляет S или
R1 представляет водород;
R2 представляет пиридил, замещенный -C(=O)-Z-R14, или C1-6алкил, замещенный одним или двумя заместителями, выбранными из NR7R8 и Het3;
каждый R4 независимо представляет галоген;
каждый R5 независимо представляет галоген;
R7 и R8, каждый независимо, выбран из водорода, C1-4алкила, -C(=O)-Z-R14 и Het3;
каждый Z независимо представляет O или S;
каждый R14 независимо представляет водород и C1-20алкил или R14 представляет радикал формулы
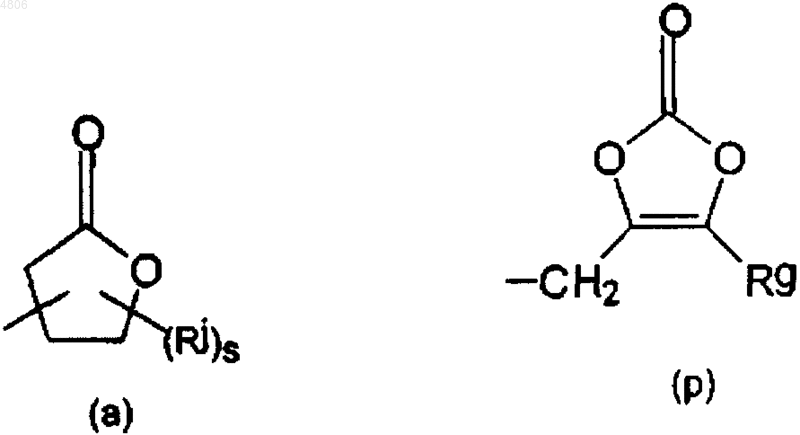
где s равно 0-4;
Rg и Rj, каждый независимо, представляет водород или C1-4алкил;
Het3 представляет моноциклический гетероцикл, выбранный из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и тетрагидропиранила; где каждый из указанных моноциклических гетероциклов независимо может быть необязательно замещен, когда это возможно, одним, двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из гидрокси, C1-4алкила, C1-4алкилокси, -C(=O)-Z-R14, C1-4алкилкарбонила.
2. Фармацевтическая композиция для лечения эозинофилзависимых воспалительных заболеваний, содержащая соединение по п.1 в качестве активного ингредиента и фармацевтически приемлемый носитель или эксципиент.
3. Применение соединения по п.1 в качестве лекарственного средства для лечения эозинофилзависимых воспалительных заболеваний.
4. Применение соединения по п.1 для производства лекарственного средства для лечения бронхиальной астмы.
5. Способ получения соединения по п.1, включающий взаимодействие промежуточного продукта формулы (II), где W1 представляет подходящую уходящую группу, с соответствующим реагентом формулы (III) необязательно в реакционно-инертном растворителе и в присутствии основания
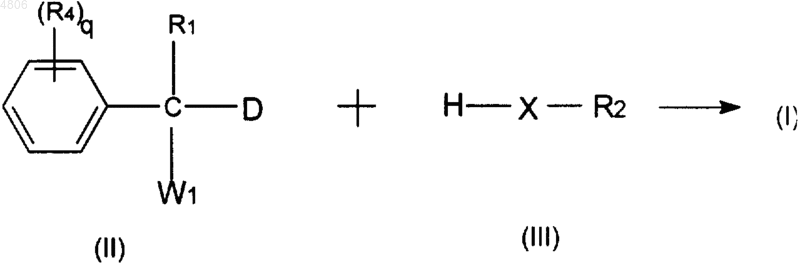
где R1, R2, R4, X и q принимают значения, определенные в п.1, и D представляет собой
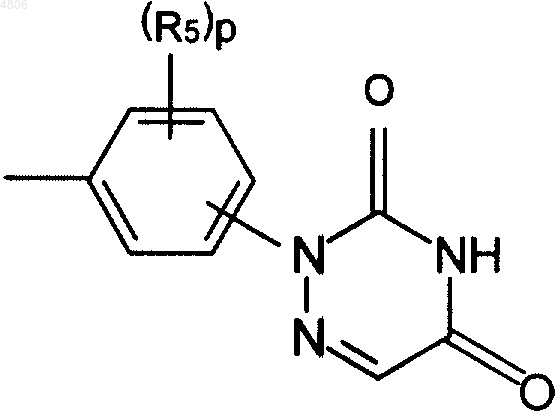
где R5 и p принимают значения, определенные в п.1,
и, если необходимо, превращение соединений формулы (I) друг в друга в соответствии с известными способами превращения, и далее, если необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или, наоборот, превращение кислотно-аддитивной соли в основание обработкой щелочью, или превращение основно-аддитивной соли в свободную кислоту обработкой кислотой; а также, если нужно, получение их стереохимически изомерных форм или N-оксидных форм.
6. Способ получения соединения по п.1, включающий удаление группы E из триазиндиона формулы (V)
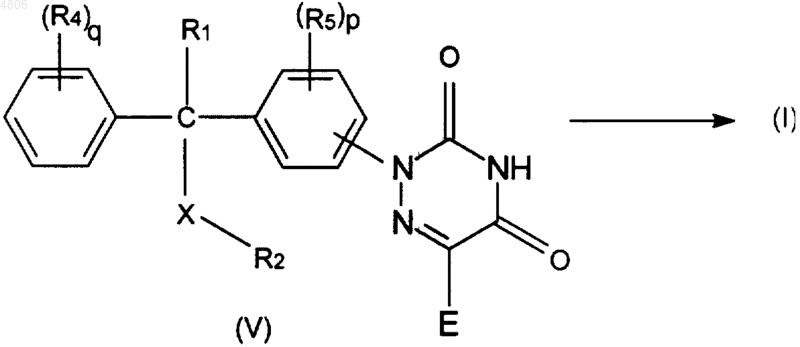
где R1, R2, R4, R5, X и q принимают значения, определенные в п.1,
и, если необходимо, превращение соединений формулы (I) друг в друга в соответствии с известными способами превращения, и далее, если необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или, наоборот, превращение кислотно-аддитивной соли в основание обработкой щелочью, или превращение основно-аддитивной соли в свободную кислоту обработкой кислотой; а также, если нужно, получение их стереохимически изомерных форм или N-оксидных форм.
7. Способ получения соединения по п.1, включающий взаимодействие промежуточного продукта формулы (XII), где W4 представляет подходящую уходящую группу, с промежуточным продуктом формулы (III) необязательно в присутствии подходящего основания с получением таким образом соединений формулы (I-b)
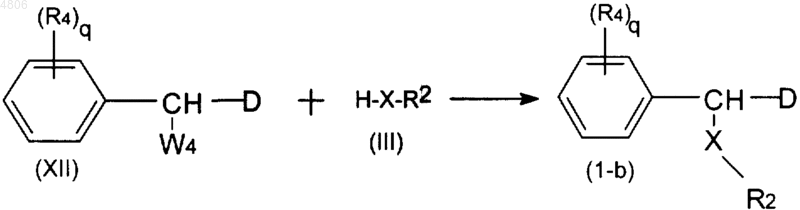
где R2, R4, X и q принимают значения, определенные в п.1, и D принимает значения, определенные в п.5;
и, если необходимо, превращение соединений формулы (I) друг в друга в соответствии с известными способами превращения, и далее, если необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или, наоборот, превращение кислотно-аддитивной соли в основание обработкой щелочью, или превращение основно-аддитивной соли в свободную кислоту обработкой кислотой; а также, если нужно, получение их стереохимически изомерных форм или N-оксидных форм.
8. Способ мечения рецептора, включающий стадии
a) введения радиоактивного изотопа в соединение по п.1;
b) введения указанного соединения, меченного радиоактивным изотопом, в биологический материал;
c) выявления излучений от соединения, меченного радиоактивным изотопом.
9. Способ визуального отображения органа, характеризующийся введением достаточного количества соединения формулы (I), меченного радиоактивным изотопом, в подходящую композицию и обнаружением излучений от радиоактивного соединения.
Текст
1 Данное изобретение относится к новым производным 6-азаурацила, ингибирующим IL5 и полезным для лечения эозинофилзависимых воспалительных заболеваний; способам их получения и композициям, содержащим данные соединения. Кроме того, изобретение относится к их применению в качестве лекарственного средства и производства лекарственного средства для лечения бронхиальной астмы, способу мечения рецептора и визуального отображения органа с их использованием. Приток эозинофилов, приводящий к последующему повреждению тканей, является важным патогенным событием в бронхиальной астме и аллергических заболеваниях. Цитокининовый интерлейкин-5 (IL-5), вырабатываемый, главным образом, Т-лимфоцитами в виде гликопротеина, индуцирует дифференциацию эозинофилов в костном мозге, питает эозинофилы для активации в периферийной крови и поддерживает их выживание в тканях. Сам по себеIL-5 играет решающую роль в процессе эозинофильного воспаления. Следовательно, возможность снижения ингибиторами продуцированияIL-5, активации и/или выживания эозинофилов обеспечила бы терапевтический подход к лечению бронхиальной астмы и аллергических заболеваний, таких как атопический дерматит, аллергический ринит, аллергический конъюнктивит, а также других эозинофилзависимых воспалительных заболеваний. Стероиды, которые в опытах in vitro значительно ингибируют продуцирование IL-5,длительное время использовались в качестве единственных лекарственных средств со значительной эффективностью при бронхиальной астме и атопическом дерматите, но они вызывают различные серьезные побочные реакции,такие как диабет, гипертензия и катаракта. Следовательно, было бы желательно найти нестероидальные соединения, обладающие способностью ингибировать IL-5 продуцирование в Тклетках человека и вызывающие незначительные или не вызывающие неблагоприятных побочных реакций. В патенте США 4631278 описываются-арил-4-(4,5-дигидро-3,5-диоксо-1,2,4-триазин 2(3 Н)-ил)бензолацетонитрилы, а в патенте США 4767760 описываются 2-(замещенный фенил)-1,2,4-триазин-3,5(2 Н,4 Н)дионы, которые обладают антипротозоальной активностью, в частности антикокцидиальной активностью. Вeвропейской заявкеЕР 831088 описываются 1,2,4-триазин-3,5-дионы в качестве антикокцидиальных средств. Данное изобретение предоставляет соединения, которые ранее не были описаны и которые обладают значительной фармакологической активностью в качестве ингибиторов продуцирования IL-5. Данное изобретение относится к соединениям формулыN-оксидам, фармацевтически приемлемым аддитивным солям, четвертичным аминам и стереохимически изомерным формам, где р равно целому числу 0, 1 или 2;q равно целому числу 1; Х представляет S;-С(=O)-Z-R14, или C1-6 алкил, замещенный одним или двумя заместителями, выбранными изR7 и R8, каждый независимо, выбран из водорода, С 1-4 алкила, -С(=O)-Z-R14 и Het3; каждый Z независимо представляет О или S; каждый R14 независимо представляет водород и С 1-20 алкил,или R14 представляет радикал формулыRg и Rj, каждый независимо, представляет водород или C1-4 алкил;Het3 представляет моноциклический гетероцикл, выбранный из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и тетрагидропиранила; где каждый из указанных моноциклических гетероциклов независимо может быть необязательно замещен, когда это возможно, одним,двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из гидрокси, С 1-4 алкила, С 1-4 алкилокси, -С(=O)-Z-R14,C1-4 алкилкарбонила. Особую группу составляют соединения формулы (I), в которыхR7 и R8, каждый независимо, выбран из водорода, С 1-4 алкила, -С(=O)-Z-R14 и Het3; каждый R14 независимо представляет водород и С 1-20 алкил, или R14 представляет радикал формулыRg и Rj, каждый независимо, представляет водород или C1-4 алкил;Het3 представляет моноциклический гетероцикл, выбранный из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и тетрагидропиранила; где каждый из указанных моноциклических гетероциклов независимо может быть необязательно замещен, когда это возможно, одним,двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из гидрокси, С 1-4 алкила, С 1-4 алкилокси, -С(=O)-Z-R14,C1-4 алкилкарбонила. В приведенных выше определениях и далее термин галоген означает фтор, хлор, бром и йод; термин С 1-4 алкил относится к насыщенным углеводородным радикалам с прямой и разветвленной цепью, содержащим от 1 до 4 атома углерода, таким как, например, метил,этил, пропил, бутил, 1-метилэтил, 2-метилпропил, 2,2-диметилэтил и т.п.; термин C1-6 алкил,как предполагается, включает С 1-4 алкил и его более высокие гомологи, содержащие 5 или 6 атомов углерода, такие как, например, пентил,2-метилбутил, гексил, 2-метилпентил и т.п.; термин С 1-20 алкил, как предполагается, включает C1-6 алкил и его высшие гомологи, содержащие от 7 до 20 атомов углерода, такие как,например, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, октадецил, нонадецил, эйкозил и т.п. Термин Het3, как предполагается, включает все возможные изомерные формы гетероциклов, перечисленных в определении терминаHet3. Гетероциклы, представленные Het3, могут присоединяться к остатку молекулы формулы (I) через любой соответствующий кольцевой атом углерода или гетероатом. Термин фармацевтически приемлемые аддитивные соли, приведенный выше, как подразумевается, включает терапевтически активные нетоксические кислотно-аддитивные солевые формы, которые способны образовывать соединения формулы (I). Последние могут быть получены обработкой соединения в форме основания такими подходящими кислотами, как неорганические кислоты, например галогенводородные кислоты, в частности хлористоводородная, бромисто-водородная и т.п.; серная кислота; азотная кислота; фосфорная кислота и т.п.; или органические кислоты, например уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, этандионовая,пропандионовая, бутандионовая, (Z)-2-бутендионовая, (Е)-2-бутендионовая, 2-гидроксибутандионовая, 2,3-дигидроксибутандионовая, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4 метилбензолсульфоновая, циклогексансульфаминовая, 2-гидроксибензойная, 4-амино-2-гидроксибензойная и т.п. кислоты. И наоборот, со 004806 4 левая форма может быть превращена в форму свободного основания обработкой щелочью. Соединения формулы (I), содержащие кислотные протоны, могут быть превращены в их терапевтически активные нетоксичные соли металлов или аминно-аддитивные солевые формы обработкой подходящими органическими или неорганическими основаниями. Подходящие основные солевые формы включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например лития,натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина, 2-амино-2(гидроксиметил)-1,3-пропандиола, гидрабамина,и соли с аминокислотами, такими как, например, аргинин, лизин, холин и т.п. И наоборот,солевая форма может быть превращена в форму свободной кислоты обработкой кислотой. Термин аддитивная соль включает также гидраты и аддитивные формы с растворителями,которые способны образовывать соединения формулы (I). Примеры таких форм включают,например, гидраты, алкоголяты и т.п. Формы N-оксидов соединений данного изобретения, как подразумевается, включают соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида. Например, один или несколько атомов азота любого из гетероциклов,обозначенных как Het1, Het2, Het3, Het4 и Het5,могут быть N-окисленными. Некоторые соединения формулы (I) могут также находиться в их таутомерных формах, и хотя они не показаны определенно в приведенной выше формуле, подразумевается, что они включены в объем данного изобретения. Например, гидроксизамещенный триазиновый фрагмент может также иметь форму соответствующего триазинонового фрагмента. Термин "стереохимически изомерные формы", используемый в данном описании, включает все возможные стереоизомерные формы, в которых могут находиться соединения формулы(I). Если не упомянуто или не приведено другое определение, с химической точки зрения, соединения представляют собой смесь всех возможных стереохимически изомерных форм,причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию,используемую в соответствии с номенклатуройChemical Abstracts. Стереохимически изомерные формы соединений формулы (I), как подразумевается, включены в объем данного изобретения. Соединения формулы (I) и некоторые промежуточные продукты в данном изобретении содержат один или несколько асимметрических атомов углерода. Чистые и смешанные стереохимически изомерные формы соединений фор 5 мулы (I), как подразумевается, включены в объем данного изобретения. Термин "соединения формулы (I)", используемый в данном описании, как подразумевается, включает также формы их N-оксидов, их фармацевтически приемлемые аддитивные соли, четвертичные амины и их стереохимически изомерные формы. Нумерация фенильного кольца, содержащего заместитель R4, приведена ниже и используется в данном описании для обозначения положения R4 заместителей на указанном фенильном кольце, если не указана другая нумерация. Атом углерода, к которому присоединены два фенильных кольца и R1 и -X-R2 заместители,будет называться центральным атомом углерода. Интересную группу соединений составляют соединения формулы (I), в которых 6-азаурацильный фрагмент присоединен к фенильному кольцу в пара- или мета-положении относительно центрального атома углерода, предпочтительно в пара-положении. Приемлемо, когда Het3 представляет пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил; где каждый из указанных моноциклических гетероциклов независимо и необязательно может быть замещен, когда это возможно, одним, двумя или тремя заместителями, каждый из которых независимо выбран из С 1-4 алкила, C1-4 алкилокси, -С(=O)-Z-R14, C1-4 алкилкарбонила. Другими особыми соединениями являются соединения формулы (I), в которых R2 представляет С 1-4 алкил, замещенный одним или двумя заместителями, выбранными из NR7R8 или Het3. Предпочтительными соединениями являются соединения формулы (I), в которых заместитель R4, предпочтительно хлор, находится в 4 положении. Другими предпочтительными соединениями являются соединения формулы (I), в которых р равно 1 или 2 и R5 заместитель, предпочтительно хлор, находятся в орто-положении относительно центрального атома углерода. Для того чтобы упростить структурное представление соединений формулы (I), группа будет далее обозначена как D. Соединения формулы (I) обычно могут быть получены взаимодействием промежуточ 004806 6 ного продукта формулы (II), где W1 представляет подходящую уходящую группу, такую как,например, атом галогена, с подходящим реагентом формулы (III). Указанная реакция может проводиться в инертном реакционном растворителе, таком как,например, ацетонитрил, N,N-диметилформамид,уксусная кислота, тетрагидрофуран, этанол или их смесь. Альтернативно, в том случае, когда реагент формулы (III) действует как растворитель, дополнительный инертный растворитель не требуется. Реакция необязательно проводится в присутствии основания, такого как, например, 1,8-диазабицикло[5,4,0]ундец-7-ен, бикарбонат натрия, этанолат натрия и т.п. Подходящие температуры реакции находятся в интервале от -70 С до температуры кипения с обратным холодильником. В данном и приведенных далее способах получения продукты реакции могут выделяться из реакционной среды и, если нужно, подвергаться дополнительной очистке в соответствии с методами, хорошо известными в данной области,такими как, например, экстракция, кристаллизация, перегонка, растирание и хроматография. Альтернативно, соединения формулы (I) обычно можно получать циклизацией промежуточного продукта формулы (IV), где L представляет подходящую уходящую группу, такую как, например, C1-6 алкилоксигруппа или галоген, и Е представляет соответствующую электронооттягивающую группу, такую как, например, группа сложного эфира, амидная группа,цианидная группа, C1-6 алкилсульфонилокси и т.п. группы; и удалением группы Е из полученного таким образом триазиндиона формулы (V). Указанная реакционная методика аналогична методике, описанной в ЕР-А-0170316. Некоторые из соединений и промежуточных продуктов данного изобретения могут быть получены в соответствии с методиками, аналогичными методикам, описанным в ЕР-А-0170316 и ЕР-А-0232932. Аналоги соединений формулы (I) , в которых Х представляет прямую связь, могут быть получены, исходя из кетона формулы (X) (cхема 1). 7 Взаимодействие указанного кетона формулы (X) с промежуточным продуктом формулы (III), где Х представляет прямую связь, а указанные промежуточные продукты представлены формулой(III-a), приводит к получению аналогов соединения формулы (I), в котором R1 представляет гидрокси и Х представляет прямую связь, причем указанные соединения представлены формулой (I-a-2). Указанную реакцию можно проводить в инертном реакционном растворителе,таком как, например, тетрагидрофуран, диэтиловый эфир, диизопропилацетамид или их смеси, в присутствии основания, такого как, например, бутиллитий. Альтернативно, промежуточный продукт формулы (III-a) можно сначала превратить в реактив Гриньяра, который затем можно подвергнуть взаимодействию с кетоном формулы (X). Указанные соединения формулы(I-a-2) далее можно превратить в аналоги соединения формулы (I), где R1 представляет C1-6 алкилокси, представленные формулой (I-а-3), с использованием известных реакций превращения функциональных групп. Соединения формулы (I-a-2) можно также превратить в аналоги соединения формулы (I), где R1 представляет галоген, причем указанные соединения представлены формулой (I-а-4). Стандартная методика представляет собой превращение гидроксигруппы в атом хлора с использованием подходящего реагента, такого как, например, тионилхлорид. Указанные соединения формулы (I-а-4) могут далее быть превращены в аналоги соединения формулы (I), в которых R1 представляет амино, причем указанные соединения представлены формулой (I-а-5), с использованием аммиака или его функционального производного в инертном реакционном растворителе, таком как,например, тетрагидрофуран; или могут быть превращены в соединения формулы (I-а-3) известными в данной области реакциями превращения функциональных групп. Восстановление кетона формулы (X) в его соответствующее гидроксильное производное формулы (XI) с использованием подходящего восстановителя, такого как, например, боргидрид натрия, в инертном реакционном растворителе, таком как, например, вода, спирт, тетрагидрофуран или их смесь, последующим превращением указанной гидроксигруппы в подходящую уходящую группу W4, например галоген,с получением промежуточного продукта формулы (XII), и, наконец, взаимодействием указанного промежуточного продукта формулы (XII) с промежуточным продуктом формулы (III) в подходящем растворителе, таком как, например,тетрагидрофуран, N,N-диметилформамид, ацетонитрил, уксусная кислота, этанол или их смесь, и необязательно в присутствии подходящего основания, такого как, например, 1,8-диазабицикло[5,4,0]ундец-7-ен или бикарбонат натрия,приведет к получению соединения формулы (I), 004806 8 где R1 представляет водород, причем указанные соединения представлены формулой (I-b). Альтернативно, промежуточные продукты формулы (XI) могут быть непосредственно превращены в соединения формулы (I-b), где Х представляет S, причем указанные соединения представлены формулой (I-b-1), с использованием подходящего меркаптосодержащего реагента формулы R2-SH в подходящем реакционной растворителе, таком как, например, трифторуксусная кислота, метансульфоновая кислота,трифторметансульфоновая кислота и т.п. Аналогично, исходя из кетона формулы (X),могут быть получены аналоги соединения формулы (I), где R1 представляет водород и -X-R2 представляет -NH-C(=O)-(арил или C1-6 алкил),причем указанные соединения представлены формулой (I-с). Для этого кетон формулы (X) подвергают взаимодействию с формамидом в муравьиной кислоте или с его функциональным производным при повышенных температурах. Образующийся промежуточный продукт формулы (XIII) гидролизуют до соответствующего амина формулы (XIV), который далее может быть подвергнут взаимодействию с промежуточным продуктом формулы (XV), где W3 представляет подходящую уходящую группу, в присутствии подходящего основания, такого как,например, пиридин, необязательно в присутствии реакционно-инертного растворителя, такого как, например, дихлорметан. Схема 1 Соединения формулы (I) можно также превращать друг в друга известными методами превращения функциональных групп, некоторые из которых приведены в качестве примеров ниже. Соединения формулы (I) можно также превращать в соответствующие N-оксидные формы в соответствии с известными методиками превращения трехвалентного азота в его Nоксидную форму. Указанную реакцию N-окисления можно обычно проводить взаимодействием исходного вещества формулы (I) с 3-фенил 2-(фенилсульфонил)оксазиридином или с соответствующим органическим или неорганиче 9 ским пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать надкислоты, такие как, например, пероксибензойная кислота или галогензамещенная пероксибензойная кислота, например 3-хлорпероксибензойная кислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например,вода, низшие алканолы, например этанол и т.п.,углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси этих растворителей. Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены по известным в данной области методикам. Диастереомеры можно разделять физическими методами, такими как избирательная кристаллизация и хроматографические методы, например противоточное распределение, жидкостная хроматография и т.п. Некоторые соединения формулы I и некоторые промежуточные продукты настоящего изобретения могут содержать ассиметрический атом углерода. Чистые стереохимичеки изомерные формы указанных соединений и промежуточных продуктов могут быть получены по известным методикам. Например,диастереоизомеры можно разделять физическими методами, такими как избирательная кристаллллизация и хроматографические методы,например противоточное распределение, жидкостная хроматография и аналогичные методики. Энантиомеры могут быть получены из рацемических смесей сначала путем превращения указанных рацемических смесей с подходящими агентами разделения, такими как, например,хиральные кислоты, в смеси диастереомерных солей или соединений; затем физическим разделением указанных смесей диастереомерных солей или соединений, например селективной кристаллизацией или хроматографическими методами, например жидкостной хроматографией и т.п.; и, наконец, превращением указанных разделенных диастеремерных солей соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм соответствующих промежуточных продуктов и исходных веществ при условии, что промежуточные реакции протекают стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных продуктов включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной неподвижной фазы. 10 Некоторые промежуточных продукты и исходные вещества, используемые в реакциях по методикам, описанным выше, представляют собой известные соединения и могут быть коммерчески доступными или могут быть получены в соответствии с известными методиками.IL-5, известный также как фактор дифференциации эозинофилов (EDF) или фактор, стимулирующий колониеобразование эозинофиллов (Eо-CSF), представляет собой главный фактор выживания и диффепрециации эозинофилов и, как полагают, играет ключевую роль в инфильтрации эозинофилов в ткани. Имеется большое количество доказательств, что приток эозинофилов является важным патогенным событием, вызывающим бронхиальную астму и аллергические заболевания, такие как хейлит,заболевание раздраженного пищеварительного тракта, экзема, крапивница, васкулит, вульвит,заболевание "зимних ног", атопический дерматит, поллиноз, аллергический ринит и аллергический конъюнктивит; и другие воспалительные заболевания, такие как эозинофильный синдром, аллергический ангиит, эозинофильный фасциит, эозинофильная пневмония, синдром легочного инфильтрата в сочетании с эозинофилией, идиопатический эозинофильный лейкоцитоз, эозинофильная миалгия, болезнь Кронха, неспецифический колит и т.п. заболевания. Рассматриваемые соединения также ингибируют продуцирование других хемокинов, таких как моноцитный хемотаксический протеин-1 и -3 (МСР-1 и МСР-3). Известно, что МРС-1 притягивает как Т-клетки, в которых, главным образом, протекает продуцирование IL-5, так и моноциты, которые, как известно, действуют синергически с эозинофилами (Carr et al., 1994,Immunology, 91, 3652-3656). МСР-3 также играет первичную роль в аллергическом воспалении,поскольку, как известно, мобилизует и активирует базофильные и эозинофильные лейкоциты(3), 127-133). Рассматриваемые соединения не оказывают или оказывают незначительное действие на продуцирование других хемокинов, таких как(IFN-) и фактор, стимулирующий колониеобразование гранулоцитарных макрофагов (GM-CSF),и этот факт показывает, что данные ингибиторыIL-5 не являются иммуносупрессантами широкого спектра действия. Эффект селективного ингибирования хемокина данными соединениями может быть продемонстрирован измерением хемокина в крови человека в опыте in vitro. Наблюдения в опыте in vivo, такие как ингибирование эозинофилии в ухе мыши, ингибирование кровяной эозинофилии в модели мыши Ascaris; снижение в организме мыши продуцирования сывороточ 11 ного IL-5 и mRNA экспрессии селезеночного IL5, индуцированной анти-СD3 антителом, и ингибирование аллергенилиSephradexиндуцированного легочного притока эозинофилов в организме морской свинки являются показательными для демонстрации полезности рассматриваемых соединений в лечении эозинофилзависимых воспалительных заболеваний. Рассматриваемые ингибиторы продуцирования IL-5 являются особенно полезными при введении с помощью ингаляции. Промежуточные соединения формулы (ХIа) представляют собой интересные промежуточные продукты. Они, в частности, полезны не только как промежуточные продукты при получении соединений формулы (I), но и как вещества, обладающие ценной фармакологической активностью. Принимая во внимание указанные выше фармакологические свойства, соединения формулы (I) могут использоваться в качестве лекарственного средства. В частности, рассматриваемые соединения могут использоваться при производстве лекарственного средства для лечения эозинофилзависимых воспалительных заболеваний, которые указаны выше, в частности бронхиальной астмы, атонического дерматита,аллергического ринита и аллергического конъюнктивита. Ввиду полезности соединения формулы (I) данное изобретение предоставляет способ лечения теплокровных животных, включая людей,страдающих эозинофилзависимыми заболеваниями, в частности бронхиальной астмой, атопическим дерматитом, аллергическим ринитом и аллергическим конъюнктивитом. Указанный способ включает системное или местное введение эффективного количества соединения формулы (I), его N-оксидной формы, фармацевтически приемлемой аддитивной соли или возможной стереоизомерной формы теплокровным животным, включая людей. Данное изобретение предоставляет также композиции для лечения эозинофилзависимых воспалительных заболеваний, включающие терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. Для получения фармацевтических композиций данного изобретения терапевтически эффективное количество конкретного соединения в форме основания или в форме аддитивной соли в качестве активного ингредиента объединяется в однородную смесь с фармацевтически приемлемым носителем, который может принимать различные формы в зависимости от формы препарата, требуемого для введения. Эти фармацевтические композиции желательно находятся в дозированной лекарственной форме,приемлемой предпочтительно для системного введения, такого как парентеральное введение; или для местного применения, такого как инга 004806 12 ляция, назальный спрей или т.п. Применение указанных композиций может осуществляться посредством аэрозоля, например, с пропеллентом, таким как азот, диоксид углерода, фреон,или без пропеллента, например, в виде спрея под давлением, в виде капель, лосьонов или в виде полутвердной композиции, такой как сгущенная композиция, которая может наноситься с помощью помазка. В частности, удобно будет применять полутвердые композиции, такие как бальзамы, кремы, гели, мази и т.п. Особенно предпочтительно готовить перечисленные выше фармацевтические композиции в дозированной лекарственной форме для удобного применения и однородной дозировки. Термин дозированная лекарственная форма,используемый в данном описании и в формуле изобретения, относится к физически дискретным единицам, подходящим для однородной дозировки, причем каждая единица содержит заранее установленное количество активного ингредиента, рассчитанное для получения нужного терапевтического действия, в сочетании с нужным фармацевтическим носителем. Примерами таких дозированных лекарственных форм являются таблетки (включая таблетки с бороздками или покрытые оболочкой таблетки), капсулы, пилюли, расфасованные в пакетики порошки, облатки, растворы или суспензии для инъекций, наполненная дозировочная чайная ложечка, наполненная дозировочная столовая ложка и т.п. и их сочетания. Для повышения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях они могут преимущественно применяться с -, - или -циклодекстринами или их производными. Кроме того, растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях могут улучшать сорастворители, такие как спирты. При получении водных композиций аддитивные соли рассматриваемых соединений являются,очевидно, более подходящими ввиду их повышенной растворимости в воде. Подходящими циклодекстринами являются -, -, -циклодекстрины или их смешанные простые эфиры, в которых одна или несколько гидроксильных групп ангидроглюкозных единиц циклодекстрина замещены C1-6 алкилом, в частности метилом, этилом или изопропилом,например произвольно метилированный -CD; гидроксиС 1-6 алкилом, в частности гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбоксиС 1-6 алкилом, в частности карбоксиметилом или карбоксиэтилом; С 1-6 алкилкарбонилом, в частности ацетилом; С 1-6 алкилоксикарбонилС 1-6 алкилом или карбоксиС 1-6 алкилоксиС 1-6 алкилом, в частности карбоксиметоксипропилом или карбоксиэтоксипропилом; С 1-6 алкилкарбонилоксиС 1-6 алкилом, в частности 2-ацетилоксипропилом. Заслуживающими внимания соеди 13 нениями в качестве комплексообразующих соединений и/или солюбилизаторов являются -CD,произвольно метилированный -CD, 2,6-диметил-CD, 2-гидроксиэтилСD, 2-гидроксиэтил-СD, 2-гидроксипропилСD и (2-карбоксиметокси)пропилCD, и в частности 2-гидроксипропилСD (2-HPCD). Термин смешанные простые эфиры относится к производным циклодекстрина, в которых по меньшей мере две гидроксильных группы циклодекстрина этерифицированы различными группами, такими как, например, гидроксипропил и гидроксиэтил. Среднее молярное замещение (M.S.) используется как мера среднего количества молей алкоксигрупп на моль ангидроглюкозы. Значение M.S. может быть определено различными аналитическими методами, и предпочтительно,как определено методом масс-спектрометрии,M.S. находится в интервале от 0,125 до 10. Термин средняя степень замещения(D.S.) относится к среднему числу замещенных гироксильных групп на ангидроглюкозную единицу. D.S. может быть определена различными аналитическеими методами, и предпочтительно,как определено методом масс-спектрометрии,D.S. находится в интервале от 0,125 до 3. Благодаря высокой селективности в качестве ингибиторов IL-5, соединения формулы (I),определенные выше, полезны также для мечения или идентификации рецепторов. Для этой цели соединения данного изобретения следует пометить, в частности, замещением, частичным или полным, одного или нескольких атомов в молекуле их радиоактивными изотопами. Примерами подобных меченых соединений являются соединения, содержащие по меньшей мере один атом галогена, который представляет собой радиоактивный изотоп йода, брома или фтора; или соединения, содержащие по меньшей мере один 11 С-атом или атом трития. Одна конкретная группа состоит из соединений формулы (I), в которых R4 и/или R5 представляют собой радиоактивный атом галогена. В общем случае, любое соединение формулы(I), содержащее атом галогена, подходит для замещения атома галогена подходящим изотопом. Подходящими радиоизотопами галогена для этой цели являются радиоактивные йодиды,например 122I, 123I, 125I,131I; радиоактивные бромиды, например 75 Вr, 76 Вr, 77 Вr и 82 Вr, и радиоактивные фториды, например 18F. Введение радиоактивного атома галогена может осуществляться подходящими реакциями обмена или с использованием любой из методик, описанных выше для получения галогенпроизводных формулы (I). Другой интересной формой мечения радиоактивным изотопом является замещение атома углерода атомом 11 С или замещение атома водорода атомом трития. 14 Следовательно, указанные соединения формулы (I), меченные радиоактивным изотопом, могут использоваться в процессе специфического мечения рецепторных сайтов в биологическом материале. Указанный процесс включает стадию (а) радиоактивного мечения соединения формулы (I), (b) введение данного меченного радиоактивным изотопом соединения в биологический материал и затем (с) обнаружение излучения от соединения, меченного радиоактивным изотопом. Подразумевается, что термин биологический материал, включает любой вид материала биологического происхождения. Более точно, данный термин относится к образцам тканей, плазме или жидкости организма, а также к животным, особенно теплокровным животным, или частям организмов животных, таким как органы. Меченные радиоактивным изотопом соединения формулы (I) также полезны в качестве средств для определения, обладает ли испытываемое соединение способностью занимать или связывать определенный рецепторный сайт. Степень, до которой испытываемое соединение будет замещать соединение формулы (I) в таком конкретном рецепторном сайте, будет показывать активность испытываемого соединения в качестве агониста, антагониста или агониста/антагониста указанного рецептора. При использовании в опыте in vivo соединения, меченные радиоактивным изотопом,вводятся в соответствующей композиции животному, и местоположение указанных меченых соединений определяется с использованием визуальных методов, таких как, например, однофотонная эмиссионная компьютерная томография(Single Photon Emossion Computerized Tomography "SPECT") или позитронная эмиссионная томография (Positron Emossion Tomography PET) и т.п. Таким образом можно определить распределение конкретных рецепторных сайтов в организме, и органы, содержащие указанные рецепторные сайты, могут быть визуально отображены с использованием указанных выше визуальных методов. Данный способ визуального отображения органа введением соединений формулы (I), меченных радиоактивным изотопом, и фиксированием излучения от радиоактивного соединения также составляет часть данного изобретения. Обычно подразумевается, что терапевтически эффективное количество для ежедневного введения должно составлять от 0,01 до 50 мг/кг массы тела, в частности от 0,05 до 10 мг/кг массы тела. Способ лечения может также включать введение активного ингредиента в режиме от 2 до 4 раз в день. 15 Экспериментальная часть А. Получение соединения формулы (I). Пример А 1.(20 мл), перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь выливают в ледяную воду и добавляют этилацетат. Органический слой отделяют, промывают рассолом, сушат, фильтруют и растворитель выпаривают. Остаток пермешивают в кипящем этаноле, отфильтровывают, промывают простым диизопропиловым эфиром и сушат, в результате получают 3,1 г (91%) промежуточного продукта 1 МС (ES+) m/z 535 [МН+].b) Реакцию проводят в атмосфере N2. Раствор промежуточного продукта (1) (0,00187 моль) в N,N-диметилформамиде (20 мл) обрабатывают 1,1'-карбонилбис-1H-имидазолом (0,00373 моль) и смесь перемешивают в течение 12 ч при комнатной температуре. H2S барботируют через смесь в течение от 15 до 30 мин. Затем реакционную смесь перемешивают в течение 2 ч. Смесь выливают в ледяную воду (насыщенный раствор соли) и экстрагируют 3 раза этилацетатом. Объединенные органические фракции промывают рассолом, сушат, фильтруют и растворитель выпаривают. Остаток 3 раза совместно выпаривают с толуолом, в результате получают 1 г (100%) промежуточного продукта 2 МС(1 ммоль) в N,N-диметилформамиде (2 мл) по каплям добавляют к охлажденной льдом суспензии промежуточного продукта 2 (0,91 ммоль) и(5 мл). Реакционную смесь перемешивают в течение 15 мин и затем распределяют между водой (25 мл) и этилацетатом (25 мл). Органический слой отделяют, промывают водой (2 х 25 мл),сушат, фильтруют и растворитель выпаривают. Остаток очищают хроматографией на силикаге 004806 16 ле (элюент с градиентом: этилацетат/гексан от 20-80 до 80-20% (об./об Чистые фракции собирают и растворитель выпаривают, в результате получают 0,243 г (42%) соединения 1 МСa) Смесь промежуточного продукта 1(0,075 моль) в SOCl2 (300 мл) при перемешивании кипятят с обратным холодильником в течение 2 ч. Растворитель выпаривают. Остаток растворяют в толуоле и растворитель выпаривают,в результате получают 41,6 г промежуточного продукта 3.b) NaBH4 (0,495 моль) порциями в течение 90 мин добавляют к смеси промежуточного продукта 3 (0,075 моль) в 1,4-диоксане (500 мл),перешивая при комнатной температуре. Полученную смесь перемешивают в течение 48 ч при комнатной температуре, затем охлаждают на ледяной бане. По каплям добавляют НСl (2N)CH2Cl2, отделенную органическую фракцию сушат, фильтруют и растворитель выпаривают. Остаток очищают, пропуская через силикагель на стеклянном фильтре (элюент: CH2Cl2/СН 3 ОН 97/3). Чистые фракции собирают и растворитель выпаривают, в результате получают 2,2 г промежуточного продукта 4.c) Смесь промежуточного продукта 4(10 мл) при 0-5 С и полученную реакционную смесь перемешивают в течение 1 ч при 5 С. Добавляют триэтиламин (0,70 мл) и полученную реакционную смесь перемешивают в течение 1 ч при 0 С, в результате получают 2,4 г промежуточного продукта 5.d) Раствор 1-ацетилпиперазина (0,03624 моль) в CH2Cl2 (30 мл) добавляют по каплям к раствору промежуточного продукта 5 (0,01208 моль) и триэтиламина (0,0302 моль) в CH2Cl2(150 мл) с перемешиванием при 0 С. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем промывают насыщенным раствором NаНСО 3, насыщенным раствором соли, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент с градиентом: CH2Cl2/СН 3 ОН от 98/2 до 95/5). Чистые фракции собирают и растворитель выпаривают,затем выпаривают совместно с этилацетатом. Остаток перемешивают с 2-метокси-2-метилпропаном, отфильтровывают и сушат, в результате получают 1,51 г (20%) промежуточного продукта 6.e) Промежуточное соединение 6 (0,00321 моль) растворяют в 1,4-диоксане (50 мл). Добавляют 2N НСl (0,05 моль) и реакционную смесь при перемешивании кипятят с обратным холодильником в течение 12 ч. Реакционную смесь охлаждают, медленно выливают в смесь насыщенного водного раствора NаНСО 3 (150 мл) и льда (100 г) и эту смесь экстрагируютCH2Cl2/СН 3 ОН (90/10). Объединенные органические фракции промывают рассолом, сушат,фильтруют и растворитель выпаривают, затем выпаривают совместно с этилацетатом. При втором добавлении этилацетата образуется осадок. Осадок отфильтровывают, промывают простым диизопропиловым эфиром и сушат, в результате получают 1,39 г (74%) промежуточного продукта 7.f) Смесь промежуточного продукта 7(0,0034 моль) в СН 3 СN (60 мл) перемешивают при комнатной температуре. Добавляют триэтиламин (1,47 мл). По каплям добавляют этиловый эфир бромуксусной кислоты (0,0034 моль) и полученную реакционную смесь перемешивают в течение 90 мин при комнатной температуре. Растворитель выпаривают. Остаток переносят вCH2Cl2. Органический раствор промывают водой. Водный слой экстрагируют CH2Cl2/СН 3 ОН(90/10). Органический слой промывают водой,объединяют с другим органическим слоем, сушат, фильтруют и растворитель выпаривают,очищают колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 99/1). Чистые фракции собирают и растворитель выпаривают. Остаток выпаривают совместно с этилацетатом. Остаток перемешивают в диизопропиловом эфире, отфильтровывают, промываютa) CH2Cl2 (20 мл) перемешивают при комнатной температуре. НСl (газообразный) барботируют через этот раствор в течение 15 мин. Полученный раствор добавляют по каплям к раствору промежуточного продукта 4 (0,01 моль) в CH2Cl2 (50 мл). Соль НСl выпадает в осадок. Добавляют SOCl2 (0,05 моль) и смесь при перемешивании кипятят с обратным холодильником в течение 2 ч. Добавляют SOCl2 (3,6 мл) и реакционную смесь при перемешивании кипятят с обратным холодильником в течение 2 ч. Смесь охлаждают. Осадок отфильтровывают. Твердое вещество и фильтрат снова объединяют, растворитель выпаривают. Снова добавляют дополнительное количество CH2Cl2 (70 мл) и SOCl2 (3,6 мл) и реакционную смесь при перемешивании кипятят с обратным холодильником в течение 3 ч,затем охлаждают и образующийся осадок отфильтровывают, промывают диизопропиловым эфиром и сушат, в результате получают 4 г промежуточного продукта 8.(0,02244 моль) в СН 3 СN (20 мл) добавляют к раствору промежуточного продукта 8 (0,00748 моль) в CH3CN (60 мл) и полученную реакционную смесь выдерживают в течение 3 ч при 60 С, затем в течение ночи при комнатной температуре. Растворитель выпаривают. Остаток смешивают с кипящим этилацетатом, затем отфильтровывают и переносят в смесьCH2Cl2/СН 3 ОН 95/5. Органический раствор промывают рассолом, сушат, фильтруют и растворитель выпаривают. Остаток очищают ВЭЖХ на диоксиде кремния (элюент:CH2Cl2/(CH2Cl2/CH3OH 90/10)/СН 3 ОН (0 мин) 100/0/0, (34 мин) 65/35/0, (40 мин) 50/0/50, (43 мин) 0/0/100, (46,6-60 мин) 100/0/0). Чистые фракции собирают и растворитель выпаривают. Остаток перемешивают в диизопропиловом эфи 19 ре, отфильтровывают и сушат, в результате получают 3,42 г (64%) промежуточного продукта 9.c) Смесь промежуточного продукта 9(0,00409 моль) в метаноле (30 мл) и смеси HCl/2 пропанол (4 мл) перемешивают в течение ночи при комнатной температуре. Добавляют дополнительное количество смеси HCl/2-пропанол (2 мл) и перемешивание продолжают в течение 2 ч. Реакционную смесь выливают в воду (300 мл) и добавляют CH2Cl2/СН 3 ОН 90/10 (400 мл). Реакционную смесь нейтрализуют, добавляя по каплям насыщенный водный раствор NаНСО 3. Слои разделяют. Водный слой экстрагируют CH2Cl2/ СН 3 ОН 90/10. Объединенные органические слои сушат, фильтруют и растворитель выпаривают. Добавляют этилацетат и растворитель отгоняют в виде азеотропа на роторном испарителе. Остаток смешивают с кипящим СН 3 СN, охлаждают,отфильтровывают, промывают диизопропиловым эфиром и сушат, в результате получают 2,27 г (90%) промежуточного продукта 10.d) Триэтиламин (1,42 мл) добавляют к промежуточному продукту 10 (0,00304 моль) в диметилсульфоксиде (100 мл). Смесь перемешивают при 60 С. Затем добавляют этиловый эфир бромуксусной кислоты (0,00304 моль),полученному раствору дают охладиться до комнатной температуры и перемешивают в течение ночи. Реакционную смесь выливают в воду (300 мл) и эту смесь экстрагируют толуолом. Толуольные слои объединяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают ВЭЖХ на силикагеле (элюент с градиентом:CH2Cl2/СН 3 ОН). Две группы чистых фракций объединяют и растворитель выпаривают. Целевую фракцию растворяют в этилацетате, фильтруют через гофрированный бумажный фильтр и растворитель выпаривают. Остаток перемешивают в н-гексане, отфильтровывают и сушат, в результате получают 0,87 г (41%) соединения 3. Пример А 4. 20 а) Смесь 2-[3,5-дихлор-4-[(4-хлорфенил) гидроксиметил]фенил]-1,2,4-триазин-3,5(2 Н,4 Н) диона (0,05 моль) [САS 219981-46-1] и 6-меркапто-3-пиперидинкарбоновой кислоты (0,05 моль) порциями в течение 1 ч добавляют к метансульфоновой кислоте (100 мл), перемешивая при комнатной температуре. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем выливают в ледяную воду и эту смесь экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают, в результате получают 26,8 г промежуточного продукта 11.b) Смесь промежуточного продукта 11 (0,05 моль) в SOCl2 (250 мл) при перемешивании кипятят с обратным холодильником в течение 2 ч. Растворитель выпаривают. Остаток растворяют в толуоле и растворитель выпаривают, в результате получают 27,7 г промежуточного продукта 12.c) NaBH4 (0,33 моль) порциями добавляют в течение 60 мин к смеси промежуточного продукта 12 (0,05 моль) в 1,4-диоксане (350 мл),перемешивают при комнатной температуре. Полученную реакционную смесь перемешивают в течение 2 ч при комнатной температуре, затем охлаждают на ледяной бане. По каплям добавляют НСl (конц.) до получения кислой среды. Добавляют воду и эту смесь экстрагируютCH2Cl2. Отделенный органический слой сушат,фильтруют и растворитель выпаривают. Остаток очищают, пропуская через силикагель на стеклянном фильтре (элюент с градиентом:CH2Cl2/CH3OH от 98/2 до 97/3). Чистые фракции собирают и растворитель выпаривают, в результате получают 10,4 г промежуточного продукта 13.d) Смесь SOCl2 (0,2375 моль) в CH2Cl2 (200 мл) перемешивают при комнатной температуре. По каплям добавляют смесь промежуточного продукта 13 (0,0475 моль) с CH2Cl2 (50 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Растворитель выпаривают. Остаток перемешивают с диизопропиловым эфиром, отфильтровывают и сушат, в результате получают 23,8 г промежуточного продукта 14.e) К раствору промежуточного продукта 14(0,000347 моль) и 3-азетидинилкарбоновой кислоты (0,000381 моль) в СН 3 СN (4 мл) добавляют триэтиламин (0,001388 моль). Реакционную смесь перемешивают в течение 12 ч при 60 С. Целевой продукт выделяют и очищают ВЭЖХС(элюент с градиентом: CH3CN/H2O). Целевые фракции собирают и растворитель выпаривают,в результате получают 0,009 г (5%) соединения 4. Смесь промежуточного продукта 5 (0,004 моль), гидрохлорида этилового эфира глицина(0,0044 моль) и триэтиламина (0,016 моль) в СН 3 СN (50 мл) перемешивают в течение 24 ч при 50 С. Растворитель выпаривают. Остаток перемешивают в воде и экстрагируют CH2Cl2. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюент с градиентом: CH2Cl2/СН 3 ОН от 99,5/0,5 до 98/2). Целевые фракции собирают и растворитель выпаривают. Остаток дополнительно очищают ВЭЖХ (элюент с градиентом:(0,5% NH4OAc в H2O)/СН 3 СN/СН 3 ОН). Чистые фракции собирают и растворитель выпаривают. Остаток сушат, в результате получают 0,11 г Раствор 4-(бромметил)-5-метил-1,3-диоксол-2-она (0,0062 моль) в N,N-диметилформамиде (5 мл) добавляют по каплям к раствору промежуточного продукта 1 (0,00373 моль) и 1H-имидазола (0,007 моль) в N,N-диметилформамиде (25 мл). Смесь перемешивают при 60 С в течение ночи. Растворитель выпаривают. Остаток переносят в этилацетат, промывают водой и насыщенным раствором NaCl. Органический слой отделяют, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: гексан/ этилацетат 75/25). Целевые фракции собирают и растворитель выпаривают. Остаток очищают,пропуская через силикагель на стеклянном фильтре (элюент с градиентом: гексан/этилацетат от 75/25 до 50/50). Чистые фракции собирают и растворитель выпаривают. Остаток перемешивают с диизопропиловым эфиром. Осадок отфильтровывают, промывают диизопропиловым эфиром и сушат, в результате получают 0,595 г (25%) соединения 6. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы его N-оксид, фармацевтически приемлемая аддитивная соль, четвертичный амин и стереохимически изомерная форма, где р равно целому числу 0, 1 или 2;q равно целому числу 1; Х представляет S; или-С(=O)-Z-R14, или C1-6 алкил, замещенный одним или двумя заместителями, выбранными изR7 и R8, каждый независимо, выбран из водорода, С 1-4 алкила, -С(=O)-Z-R14 и Het3; каждый Z независимо представляет О или S; каждый R14 независимо представляет водород и С 1-20 алкил,или R14 представляет радикал формулыRg и Rj, каждый независимо, представляет водород или C1-4 алкил;Het3 представляет моноциклический гетероцикл, выбранный из азетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, тиоморфолинила и тетрагидропиранила; где каждый из указанных моноциклических гетероциклов независимо может быть необязательно замещен, когда это возможно, одним,двумя, тремя или четырьмя заместителями, каждый из которых независимо выбран из гидрокси, С 1-4 алкила, С 1-4 алкилокси, -С(=O)-Z-R14,C1-4 алкилкарбонила. 2. Фармацевтическая композиция для лечения эозинофилзависимых воспалительных заболеваний, содержащая соединение по п.1 в качестве активного ингредиента и фармацевтически приемлемый носитель или эксципиент. 3. Применение соединения по п.1 в качестве лекарственного средства для лечения эозинофилзависимых воспалительных заболеваний. 4. Применение соединения по п.1 для производства лекарственного средства для лечения бронхиальной астмы. 5. Способ получения соединения по п.1,включающий взаимодействие промежуточного продукта формулы (II), где W1 представляет подходящую уходящую группу, с соответст 23 вующим реагентом формулы (III), необязательно, в реакционно-инертном растворителе и в присутствии основания где R5 и р принимают значения, определенные в п.1,и, если необходимо, превращение соединений формулы (I) друг в друга в соответствии с известными способами превращения, и далее,если необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или, наоборот, превращение кислотно-аддитивной соли в основание обработкой щелочью, или превращение основноаддитивной соли в свободную кислоту обработкой кислотой; а также, если нужно, получение их стереохимически изомерных форм или Nоксидных форм. 6. Способ получения соединения по п.1,включающий удаление группы Е из триазиндиона формулы (V) где R1, R2, R4, R5, Х и q принимают значения,определенные в п.1,и, если необходимо, превращение соединений формулы (I) друг в друга в соответствии с известными способами превращения, и далее,если необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную не 24 токсичную основно-аддитивную соль обработкой основанием, или, наоборот, превращение кислотно-аддитивной соли в основание обработкой щелочью, или превращение основноаддитивной соли в свободную кислоту обработкой кислотой; а также, если нужно, получение их стереохимически изомерных форм или Nоксидных форм. 7. Способ получения соединения по п.1,включающий взаимодействие промежуточного продукта формулы (XII), где W4 представляет подходящую уходящую группу, с промежуточным продуктом формулы (III), необязательно, в присутствии подходящего основания с получением таким образом соединений формулы (I-b) где R2, R4, Х и q принимают значения, определенные в п.1, и D принимает значения, определенные в п.5; и, если необходимо, превращение соединений формулы (I) друг в друга в соответствии с известными способами превращения, и далее,если необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль обработкой кислотой или в терапевтически активную нетоксичную основно-аддитивную соль обработкой основанием, или, наоборот, превращение кислотно-аддитивной соли в основание обработкой щелочью, или превращение основноаддитивной соли в свободную кислоту обработкой кислотой; а также, если нужно, получение их стереохимически изомерных форм или Nоксидных форм. 8. Способ мечения рецептора, включающий стадииa) введения радиоактивного изотопа в соединение по п.1;c) выявления излучений от соединения,меченного радиоактивным изотопом. 9. Способ визуального отображения органа, характеризующийся введением достаточного количества соединения формулы (I), меченного радиоактивным изотопом, в подходящую композицию и обнаружением излучений от радиоактивного соединения.
МПК / Метки
МПК: A61P 11/06, A61K 31/53, C07D 253/06
Метки: 6-азаурацила, производные, ингибирующие
Код ссылки
<a href="https://eas.patents.su/13-4806-proizvodnye-6-azauracila-ingibiruyushhie-il-5.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-азаурацила, ингибирующие il-5</a>
Предыдущий патент: 5-аминоиндено [1, 2-с]пиразол-4-оны в качестве противораковых и антипролиферативных агентов
Следующий патент: Аминопроизводные как ингибиторы протеазы
Случайный патент: Способы и композиции, содержащие жасмонаты или родственные соединения, для усиления биозащитной активности в растениях












