Замещенные производные 1,4-дипиперидин-4-илпиперазина и их применение в качестве нейрокининовых антагонистов
Номер патента: 9217
Опубликовано: 28.12.2007
Авторы: Ленартс Йозеф Элизабет, Ван Росбрук Ив Эмиль Мария, Соммен Франсуа Мария, Янссенс Франс Эдуард, Дильс Гастон Станислас Марселла, Де Бук Бенуа Кристиан Альберт Гилейн
Формула / Реферат
1. Соединение общей формулы (I)
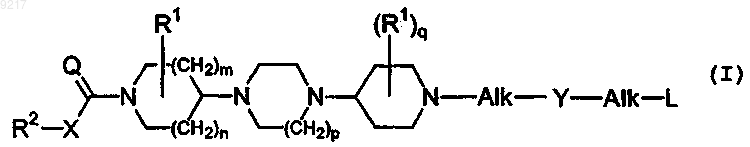
его фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли, его стереохимически изомерные формы и его N-оксидная форма, где
n представляет собой целое число, равное 0, 1 или 2;
m представляет собой целое число, равное 1 или 2, при условии, что если m равно 2, то n равно 1;
р представляет собой целое число, равное 1 или 2;
Q представляет собой О или NR3;
X представляет собой ковалентную связь или двухвалентный радикал формулы -O-, -S- или -NR3-;
каждый R3 независимо друг от друга представляет собой водород или алкил;
каждый R1 независимо друг от друга выбран из группы, содержащей Ar1, Ar1-алкил и ди(Ar1)алкил;
q представляет собой целое число, равное 0 или 1;
R2 представляет собой алкил, Ar2, Ar2-алкил, Het1 или Het1-алкил;
Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)- или -SO2-;
каждый Alk представляет собой независимо друг от друга ковалентную связь; двухвалентный прямой или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный или ненасыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими алкил-, фенил-, галоген-, циано-, гидрокси-, формил- и аминорадикалами;
L выбран из группы, содержащей водород, алкилокси, Ar3-окси, алкилоксикарбонил, моно- и ди(алкил)амино, моно- и ди(Ar3)амино, моно- и ди(алкилоксикарбонил)амино, Ar3, Ar3-карбонил, Het2 и Het2-карбонил;
Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей галоген, алкил, циано, аминокарбонил и алкилокси;
Ar2 представляет собой нафталинил или фенил, каждый необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей галоген, нитро, амино, моно- и ди(алкил)амино, циано, алкил, гидрокси, алкилокси, карбоксил, алкилоксикарбонил, аминокарбонил и моно- и ди(алкил)аминокарбонил;
Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей алкилокси, алкил, галоген, гидрокси, пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино и циано;
Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы, содержащей пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, содержащей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; каждый гетероциклический радикал необязательно может быть замещенным на любом атоме радикалом, выбранным из группы, содержащей галоген или алкил;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, содержащей пирролидинил, диоксолил, имидазолидинил, пиразолидинил, пиперидинил, морфолинил, дитианил, тиоморфолинил, пиперазинил, имидазолидинил, тетрагидрофуранил, 2H-пирролил, пирролинил, имидазолинил, пиразолинил, пирролил, имидазолил, пиразолил, триазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил и триазинил; или бициклический гетероциклический радикал, выбранный из группы, содержащей бензопиперидинил, хинолинил, хиноксалинил, индолил, изоиндолил, хроменил, бензимидазолил, имидазо[1,2-а]пиридинил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; каждый радикал необязательно замещен одним или несколькими радикалами, выбранными из группы, содержащей Ar1, Ar1-алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо, алкилокси, алкилоксиалкил и алкилоксикарбонил; и
алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклические насыщенные углеводородные радикалы, содержащие от 3 до 6 атомов углерода; необязательно замещенный на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из группы, содержащей фенил-, галоген-, циано-, оксо-, гидрокси-, формил- и аминорадикалы.
2. Соединение по п.1, отличающееся тем, что
n равно 1;
m равно 1;
р равно 1;
Q представляет собой О;
X представляет собой ковалентную связь;
каждый R1 представляет собой Ar1 или Ar1-алкил;
q равно 0 или 1;
R2 представляет собой Ar2;
Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)- или -SO2-;
каждый Alk представляет собой независимо друг от друга ковалентную связь; двухвалентный прямой или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный или ненасыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими фенил-, галоген-, циано-, гидрокси-, формил- и аминорадикалами;
L выбран из группы, содержащей водород, алкилокси, Ar3-окси, алкилоксикарбонил, моно- и ди(алкил)амино, моно- и ди(Ar3)амино, Ar3 и Het2;
Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 алкилрадикалами;
Ar2 представляет собой фенил, необязательно замещенный 1, 2 или 3 алкилрадикалами;
Ar3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей алкилокси, алкил, галоген, гидрокси, пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино и циано;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, содержащей пирролидинил, пиперидинил, морфолинил, пирролил, имидазолил, пиразолил, фуранил, тиенил, изоксазолил, тиазолил, тиадиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, содержащей бензопиперидинил, хинолинил, хиноксалинил, индолил, хроменил и бензимидазолил; каждый радикал необязательно замещен одним или несколькими радикалами, выбранными из группы, содержащей Ar1, Ar1-алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо и алкилоксикарбонил; и
алкил представляет собой прямой углеводородный радикал, содержащий от 1 до 6 атомов углерода, необязательно замещенный одним или несколькими галогенрадикалами.
3. Соединение по любому из пп.1, 2, отличающееся тем, что R1 представляет собой Ar1-метил и присоединен в положении 2 или R1 представляет собой Ar1 и присоединен в положении 3.
4. Соединение по любому из пп.1-3, отличающееся тем, что R2-X-C(=Q)-фрагмент представляет собой 3,5-ди(трифторметил)фенилкарбонил.
5. Соединение по п.1, отличающееся тем, что соединение представляет собой {4-[4-(1-бензоилпиперидин-4-ил)пиперазин-1-ил]-2-бензилпиперидин-1-ил}-(3,5-бис-трифторметилфенил)метанон.
6. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
7. Применение соединения по любому из пп.1-5 для производсттр лекарственного средства для лечения нейрокинин-опосредованных состояний.
8. Применение соединения по п.7 для производства лекарственного средства для лечения рвоты, депрессии, состояний тревоги, боли, панкреатита, расстройств мочеиспускания, в частности гиперфункции мочевого пузыря и синдрома раздраженного кишечника (IBS).
9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-5.
10. Фармацевтическая композиция по п.9, отличающаяся тем, что она находится в форме, подходящей для орального введения.
11. Способ получения композиции по любому из пп.1-5, отличающийся тем, что фармацевтически приемлемый носитель однородно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-4.
12. Способ получения соединения формулы (I), более конкретно формулы (Ia), формулы (Ib) или формулы (Ic), отличающийся тем, что
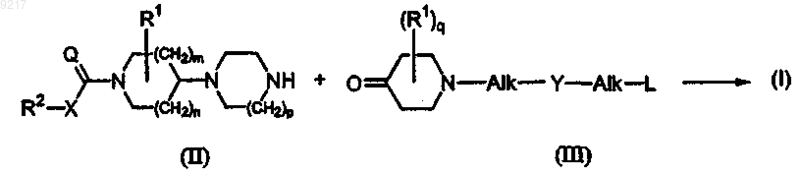
а) конечное соединение формулы (I) получают N-гидроалкилированием промежуточного соединения формулы (II), где R1, R2, X, Q, m, n и p принимают значения, определенные в формуле (I), с N-замещенным пиперидиноном формулы (III), где R1, Alk, Y, L и q принимают значения, определенные в формуле (I), в реакционно-инертном растворителеи в присутствии восстановителя; или
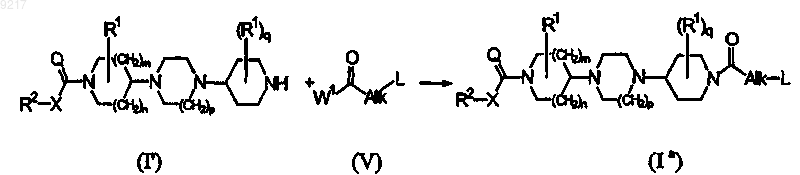
b) конечное соединение формулы (Ia) получают ацилированием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, p и q принимают значения, определенные в формуле (I), с помощью ацильного соединения формулы (V), где Alk и L принимают значения, определенные в формуле (I), и W1 представляет собой уходящую группу, в реакционно-инертном растворителе и в присутствии основания; или
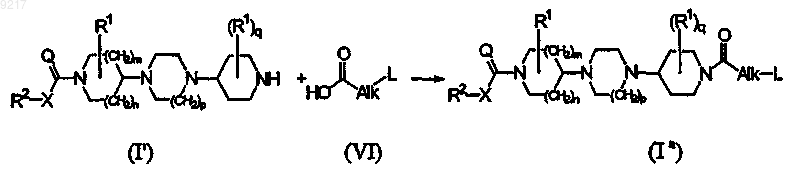
с) конечное соединение формулы (Ia) получают реакцией нуклеофильного присоединения катализируемой основанием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, р и q принимают значения, определенные в формуле (I), к карбоновой кислоте формулы (VI), где Alk и L принимают значения, определенные в формуле (I), или к ее сложному эфиру в реакционно-инертном растворителе и в присутствии основания; или
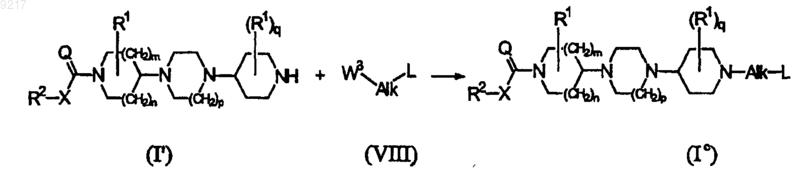
d) конечное соединение формулы (Ib) получают реакцией нуклеофильного присоединения катализируемой основанием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, p и q принимают значения, определенные в формуле (I), к соединению формулы (VIII), где Alk и L принимают значения, определенные в формуле (I), и W2 представляет собой уходящую группу, в реакционно-инертном растворителе и в присутствии основания; или

е) конечное соединение формулы (Ic) получают гидроаминированием/гидроалкилированием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, р и q принимают значения, определенные в формуле (I), с помощью соединения формулы (VIII), где Alk и L принимают значения, определенные в формуле (I), и W3 представляет собой уходящую группу, в реакционно-инертном растворителе и в присутствии основания; или
f) конечное соединение формулы (I) получают превращением соединений формулы (I) друг в друга в соответствии с хорошо известными в данной области реакциями превращения; и дополнительно, превращением соединений формулы (I) в кислотно-аддитивную соль обработкой кислотой или в основно-аддитивную соль обработкой основанием, или наоборот, кислотно-аддитивная солевая форма может быть превращена в свободное основание обработкой щелочью, или основно-аддитивная соль может быть превращена в свободную кислоту обработкой кислотой; и получения N-оксида и/или его стереохимически изомерных форм.
13. Способ получения соединения формулы (XIII), отличающийся тем, что соединение формулы (XI), где A представляет собой арил или гетероарил, Z может быть любым фрагментом, предпочтительно фрагментом Z1, как определено ниже, где каждый заместитель принимает значения, определенные в формуле (I), Hal представляет собой галоген и r представляет собой целое число, изменяющееся от 1 до числа, равного числу доступных атомов углерода в ариле или в гетероарильном фрагменте A, подвергают взаимодействию с ненасыщенным гетероарилом Het формулы (XII) в присутствии каталитических количеств Pd(OAc)2 и 1,3-бис-дифенилфосфинопропана, в присутствии подходящего основания, предпочтительно Сs2СО3 или K(AcO) и в реакционно-инертном полярном растворителе.
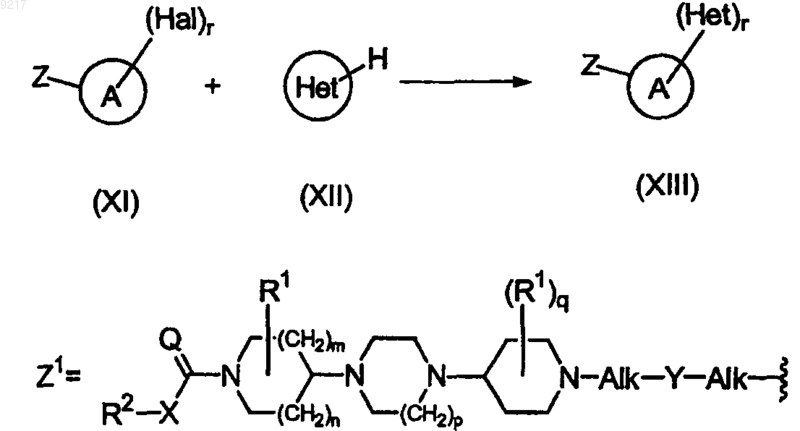
14. Способ по п.13, в котором Hal представляет собой бром или йод, A представляет собой фенил или пиридинил, Z представляет собой Z1 и Het выбран из группы, содержащей имидазо[1,2-а]пиридинил, пирролил и тиенил.
Текст
009217 Область техники, к которой относится изобретение Данное изобретение относится к производным 1,4-дипиперидин-4-илпиперазина, обладающим нейрокининовой антагонистической активностью, в частности, NK1 антагонистической активностью, к их получению, композициям, содержащим указанные соединения, а также к их применению в качестве лекарственных средств, в частности, для лечения рвоты, состояния тревоги, депрессии, панкреатита и IBS(синдром раздраженного кишечника). Предпосылки изобретения Нейрокинины принадлежат к группе коротких пептидов, которые широко распределены в центральной и периферической нервной системе млекопитающих (Bertrand and Geppetti, Trends Pharmacol.Sci. 17:255-259 (1996); Lundberg, Can. J. Physiol. Pharmacol. 73:908-914 (1995); Maggi, Gen. Pharmacol. 26:911-944 (1995); Regoli et al., Pharmacol. Rev. 46 (1994. Они содержат общую С-концевую последовательность Phe-Xaa-Gly-Leu-Met-NH2. Полагают, что нейрокинины, высвобождаемые из периферических чувствительных нервных окончаний, включаются в нейрогенное воспаление. В спинном мозге/центральной нервной системе нейрокинины могут играть роль в передаче/ощущении боли и в некоторых автономных рефлексах и поведенческих реакциях. Три основных нейрокинина представляют собой вещество P (SP), нейрокинин A (NKA) и нейрокинин В (NKB) с предпочтительным сродством к трем различным подтипам рецепторов, называемых NK1, NK2 и NK3 соответственно. Однако функциональное изучение на клонированных рецепторах свидетельствует о сильном функциональном перекрестном взаимодействии между 3 нейрокининами и их соответствующими рецепторами (Maggi and Schwartz,Trends Pharmacol. Sci. 18:351-355 (1997. Видовые различия в структуре NK1-рецепторов ответственны за различия в эффективности NK1 антагонистов по отношению к видам (Maggi, Gen. Pharmacol. 26:911-944 (1995); Regoli et al., Pharmacol.Rev. 46(4):551-599 (1994. NK1-рецептор человека очень похож на NK1-рецептор морских свинок и песчанок, но значительно отличен от NK1-рецептора грызунов. Разработка нейрокининовых антагонистов привела на сегодняшний день к серии пептидных соединений, из анализа которых можно заключить, что они являются метаболически слишком лабильными для применения в качестве фармацевтически активных веществ (Longmore J. et al., DNP 8(1):5-23 (1995. Нейрокинины участвуют в реакциях, ассоциированных с рвотой, состоянием тревоги (связанные со стрессом), воспалительными реакциями, сокращением гладкой мышцы и ощущением боли. Нейрокининовые антагонисты разрабатываются для следующих показаний: рвота, состояние тревоги и депрессия,синдром раздраженного кишечника (IBS), расстройства циркадного ритма, висцеральная боль, нейрогенное воспаление, астма, нарушения мочеиспускания и чувствительность к боли. Рвота. Тошнота и рвота относятся к самым изнурительным побочным эффектам раковой химиотерапии. Они снижают качество жизни и могут вызвать у пациентов задержку приема или отказ от потенциально полезного лекарственного средства (Kris et al., J. Clin. Oncol., 3:1379-1384 (1985. Частота, интенсивность и тип рвоты определяются различными факторами, такими как химиотерапевтическое средство,доза и путь введения. Обычно, быстрая или острая рвота начинается в течение первых 4 ч после проведения химиотерапии, достигая максимума в период от 4 до 10 ч, и снижается в период от 12 до 24 ч. Отложенная рвота (развивающаяся через 24 ч и продолжающаяся вплоть до 3-5 дней после химиотерапии) наблюдается при приеме большинства 'высокорвотных' химиотерапевтических лекарственных средств(уровень 4 и 5 согласно Hesketh et al., J. Clin. Oncol. 15:103 (1997. У людей данные 'высокорвотные' противораковые терапии, включающие цисплатин, вызывают острую рвоту у 98% и отложенную рвоту у 60-90% раковых больных. Опыты на животных моделях по химиотерапии на примере вызванной цисплатином рвоты у африканских хорьков (Rudd and Naylor, Neuropharmacology 33:1607-1608 (1994); Naylor and Rudd, Cancer.Surv. 21:117-135 (1996, позволили успешно предсказать клиническую эффективность антагонистов 5 НТ 3-рецепторов. Хотя данное открытие привело к успешной терапии при лечении тошноты у раковых больных, вызванной химиотерапией и облучением, 5-НТ 3-антагонисты, такие как ондансетрон и гранисетрон (ни тот, ни другой не связан с дексаметазоном) являются эффективными в регулировании острой рвотной фазы (первые 24 ч), но могут только уменьшить развитие отложенной фазы (24 ч) со слабой эффективностью (De Mulder et al., Annuals of Internal Medicine 113:834-840 (1990); Roila, Oncology 50:163-167 (1993. Вопреки данным по современным наиболее эффективным терапиям для предупреждения как острой, так и отложенной рвоты, вплоть до 50% пациентов страдают от отложенной рвоты и/или тошноты (Antiemetic Subcommittee, Annals Oncol. 9:811-819 (1998. В противоположность 5-HT3-антагонистам, NK1-антагонисты, такие как СР-99994 (Piedimonte et al.,L. Pharmacol. Exp. Ther. 266:270-273 (1993) и апрепитант (также известный как MK-869 или L-754030;Kramer et al., Science 281:1640-1645 (1998); Rupniak and Kramer, Trends Pharmacol. Sci. 20:1-12 (1999 показаны сейчас для ингибирования не только острой, но также и отложенной фазы рвоты у животных,вызванной цисплатином (Rudd et al., Br. J. Pharmacol. 119:931-936 (1996); Tattersall et al., Neuropharmacology 39:652-663 (2000. NK1-антагонисты также продемонстрированы для снижения 'отложенной' рвоты у человека при отсутствии сопутствующей терапии (Cocquyt et al., Eur. J. Cancer 37:835-842 (2001); Navariet al., N. Engl. L. Med. 340:190-195 (1999. Кроме того, при введении вместе с дексаметазоном и 5-НТ 3 антагонистами NK1-антагонисты (такие как MK-869 и CJ-11974, также известный как эзлопитант) были рекомендованы для получения дополнительных эффектов в предотвращении острой рвоты (Campos et al.,J. Clin. Oncol. 19:1759-1767 (2001); Hesketh et al., J. Clin. Oncol. 17:338-343 (1999. Центральные нейрокининовые NK1-рецепторы играют главную роль в регулировании рвоты. NK1 антагонисты являются активными против широкого набора стимуляторов рвоты (Watson et al., Br. J.Pharmacol. 115:84-94 (1995); Tattersall et al., Neuropharmacol. 35:1121-1129 (1996); Megens et al., J. Pharmacol. Exp. Ther. 1-14 (2002. Полагают, что данные соединения действуют блокированием центральныхNK1-рецепторов в ядре одиночного пути (nucleus tractus solitarius). Кроме NK1-антагонизма, проницаемость ЦНС (CNS) представляет собой таким образом необходимое как условие для проявления противорвотной активности данных соединений. Вызванная лоперамидом рвота у африканских хорьков может быть использована в качестве быстрой и достоверной скрининговой модели для определения противорвотной активности NK1-антагонистов. Дальнейшая оценка их терапевтической силы в лечении как острой, так и замедленной (отложенной) фаз рвоты, вызванной цисплатином, была продемонстрирована на используемой модели африканского хорька (Rudd et al., Br. J. Pharmacol. 119:931-936 (1994. Ha данной модели исследуется как 'острая', так и 'отложенная' рвота после введения цисплатина, которая выражена в виде ее чувствительности к антагонистам 5-НТ 3-рецепторов, глюкокортикоидам (Sam et al., Eur. J.Pharmacol. 417:231-237 (2001 и другим фармакологическим нагрузкам. Маловероятно, что любое будущее противорвотное средство будет клинически одобрено, если только оно не будет эффективным в лечении как 'острой', так и 'отложенной' фаз рвоты. Депрессия и состояние тревоги. Депрессия представляет собой одно из самых общих аффективных расстройств современного общества с высоким и все увеличивающимся распространением, особенно среди более молодой части населения. По современным оценкам, распространенность глубокой депрессии на протяжении жизни(MDD, DSM-IV) составляет 10-25% среди женщин и 5-12% среди мужчин, причем у примерно 25% пациентов MDD на протяжении жизни рецидивирует без полного между приступами выздоровления и налагается на дистимическое расстройство. Существует высокая совместная распространенность депрессии с другими психическими расстройствами, и особенно среди более молодого населения, сильно связанная со злоупотреблением наркотиков и алкоголя. Ввиду того, что депрессия в основном поражает население в возрасте от 18 до 44 лет, т.е. наиболее трудоспособное население, очевидно, что все это накладывает большой груз ответственности на людей, семьи и на общество в целом. Среди терапевтических возможностей наиболее эффективной неоспоримо является терапия с применением антидепрессантов. Большое число антидепрессантов было разработано и выпущено на рынок в течение последних 40 лет. Тем не менее ни один из современных антидепрессантов не удовлетворяет всем критериям идеального лекарственного средства (высокотерапевтическая и профилактическая эффективность, быстрое начало действия, достаточно удовлетворительная кратковременная и долговременная безопасность, простая и благоприятная фармакокинетика) или обладает побочными эффектами,которые тем или иным способом ограничивают их применение во всех группах или подгруппах пациентов, страдающих депрессией. Так как в настоящее время не существуют, также не ожидаются методы лечения причины депрессии, не имеется никаких антидепрессантов, эффективных для более чем 60-70% пациентов, то разработка нового антидепрессанта, который может преодолеть любой из недостатков доступных лекарственных средств, оправдана. Несколько фактов указывает на включение SP в состояния тревоги, связанные со стрессом. Центральная инъекция SP вызывает кардиоваскулярный ответ, схожий с классической реакцией "борьба или отступление", физиологически характеризующийся васкулярной дилатацией в скелетных мышцах и уменьшением мезентериального и почечного кровотока. Данная кардиоваскулярная реакция сопровождается поведенческим ответом, наблюдаемым у грызунов после ядовитых раздражителей или стресса(Culman and Unger, Can. J. Physiol. Pharmacol. 73:885-891 (1995. У мышей центрально введенные NK1 агонисты и антагонисты представляют собой анксиогенные и анксиолитические средства, соответственно (Teixeira et al., Eur. J. Pharmacol. 311:7-14 (1996. Способность NK1-антагонистов ингибировать сильное воздействие, вызванное SP (или электрическим шоком; Ballard et al., Trends Pharmacol. Sci. 17:255259 (2001, могла бы соответствовать данной антидепрессантной/анксиолитической активности, так как в случае песчанок сильные воздействия играют роль сигналов тревоги или предупредительных сигналов для особей, принадлежащих к одному виду.NK1-рецептор широко распространен в лимбической системе и тревогопроводящих путях головного мозга, включающих миндалевидное тело, гиппокамп, перегородку, гипоталамус и периакведуктальное серое вещество. Кроме того, вещество P высвобождается в центральной нервной системе в ответ на травматические или ядовитые раздражители, и нейротрансмиссия, ассоциированная с веществом P, может давать вклад или быть включенной в состояния тревоги, страха и в эмоциональные расстройства,которые сопровождают аффективные нарушения, такие как депрессия и тревога. Подтверждением данной точки зрения служат изменения в содержании вещества P в дискретных участках мозга в ответ на-2 009217 стрессовые раздражители (Brodin et al., Neuropeptides 26:253-260 (1994. Центральная инъекция миметиков (агонистов) вещества P вызывает ряд защитных поведенческих и кардиоваскулярных изменений, включающих выработанную реакцию антипатии к данному местуBrain. Res. 63:81-88 (1994, дистрессовые вокализации, выделительную реакцию (Kramer et al., Science 281: 1640-1645 (1998 и тревогу на повышенное замешательство (Aguiar and Brandao, Physiol. Behav. 60:1183-1186 (1996. Данные соединения не изменяли двигательную активность и координацию на роторном аппарате или способность передвигаться при активизации в клетке. Снижение регулирования биосинтеза вещества P происходит в ответ на введение известных анксиолитических и антидепрессантных лекарственных средств (Brodin et al., Neuropeptides 26:253-260 (1994); Shirayama et al., Brain. Res. 739:70-78 (1996. Аналогично, реакция вокализации у морских свинок, вызванная центрально введенным NK1-агонистом, может быть подавлена (ингибирована) антидепрессантами, такими как имипрамин и флуоксетин, а также с помощью L-733060, NK1-антагониста. Приведенные исследования обеспечивают доказательство, подтверждающее, что блокада центральных NK1-рецепторов может ингибировать физиологический стресс способом, схожим с воздействием антидепрессантов и анксиолитиков (Rupniak andKramer, Trends Pharmacol. Sci. 20:1-12 (1999, но без побочных эффектов данных лекарственных средств. Приведенное предположение подтверждается данными, показывающими, что апрепитант представляет собой клинически эффективный антидепрессант со значительной анксиолитической активностью в рандомизированном двойном слепом плацебо-контролируемом опыте (Kramer et al., Science 281:1640-1645(1998. Синдром раздраженного кишечника (IBS). Для пациентов с синдромом раздраженного кишечника характерно пониженное качество жизни, и они интенсивно используют источники здравоохранения в поисках лучших "решений" (включающих необходимость повторных исследований или даже хирургии). Хотя данные пациенты страдают от "легкого" расстройства (иными словами, они не умрут или получат значительные осложнения), но тем не менее они создают значительную экономическую нагрузку за счет интенсивного использования источников здравоохранения и отсутствия на работе. Опубликован приемлемый ряд доклинических публикаций о роли NK1-рецепторов в проявлении висцеральной боли. При использовании мышей без NK1-рецепторов и NK1-антагонистов на моделях животных, различные группы исследователей показали важную роль, осуществляемую NK1-рецепторами, в гипералгезии и висцеральной боли. Распределение NK1-рецепторов и вещества P играет более важную роль для проявления висцеральной, нежели соматической боли. Фактически более 80% висцеральных первичных афферентов содержат вещество P по сравнению с 25% кожных афферентов. NK1-рецепторы включаются также в моторику желудочно-кишечного тракта (Tonini et al., Gastroenterol. 120:938-945(2001); Okano et al., J. Pharmacol. Exp. Ther. 298:559-564 (2001. Из-за указанной двойной роли как в моторике желудочно-кишечного тракта, так и в проявлении болевого синдрома, полагают, что NK1 антагонисты обладают потенциалом для уменьшения интенсивности синдромов у пациентов, страдающих IBS. Панкреатит. Предполагалось, что вещество P, как одно из двух главных нейропептидов, включенных в нейрогенное воспаление, действующих через NK1-рецептор, играет важную провоспалительную роль в регулировании тяжести острого панкреатита и легочного повреждения, связанного с панкреатитом. Ослабленная легочная функция при тяжелых острых панкреатитах является главной причиной распространенности заболевания и смертности в данном состоянии. Это было четко продемонстрировано при использовании NK1-/- мышей (Bhatia et al., Proceedings of the National Academy of Sciences of the USA 95(8):47604765 (1998. Также было показано, что делеция гена препротахикинина-А защищает мышей от острого панкреатита (Bhatia et al., American J. of Physiology 284 (5) :G380-G386 (2003. Кроме того, были опубликованы исследования, указывающие на то, что NK1-антагонисты (например, CP-96345 и CP-99994) могут играть роль при лечении панкреатита, например, влиять на интенсивность, продолжительность и частоту боли у пациентов, страдающих хроническим панкреатитом (Маа et al., American J. of Physiology 279:G726-G732 (2000); Grady et al., British J. of Pharmacology 130(3):505-512 (2000); Vera-Portocarrero etal., Anesthesiology 98(2):474-484 (2003) and Shrikhande et al., Pain 91(3):209-217 (2001. Предшествующий уровень техники Соединения, содержащие 1-пиперидин-4-илпиперазинильный фрагмент, были опубликованы в WO 97/16440-А 1, опубликованной May 9, 1997 by Janssen Pharmaceutica N.V., для применения в качестве антагонистов вещества P, в WO 02/32867, опубликованной April 25, 2002 by Glaxo Group Ltd., в отношении их специфических преимуществ как нейрокининовых антагонистов (более конкретно, были раскрыты амидные производные 4-пиперазин-1-илпиперидин-1-карбоновой кислоты), в WO 01/30348-A1, опубликованной May 03, 2-1 by Janssen Pharmaceutica N.V., для применения в качестве антагонистов вещества P с целью воздействия на циркадную временную систему и в WO 02/062784-A1, опубликованной August 15, 2002 by Hoffman-La Roche AG, для применения в качестве антагонистов нейрокининовых 1-рецепторов.-3 009217 Соединения настоящего изобретения отличаются от соединений уровня техники замещением пиперазинильного фрагмента, представляя собой замещенную пиперидинильную группу, а также их повышенной способностью в качестве сильнодействующих, орально и центрально активных нейрокининовых антагонистов терапевтического значения, особенно для лечения рвоты, тревожного состояния и депрессии, синдрома раздраженного кишечника (IBS), расстройств циркадного ритма, висцеральной боли, нейрогенного воспаления, астмы, нарушений мочеиспускания и болевого синдрома. Описание изобретения Настоящее изобретение относится к новым производным 1,4-дипиперидин-4-илпиперазина общей формулы (I) их фармацевтически приемлемым кислотно-аддитивным или основно-аддитивным солям, их стереохимически изомерным формам, их N-оксидной форме и их пролекарствам, гдеn представляет собой целое число, равное 0, 1 или 2;m представляет собой целое число, равное 1 или 2, при условии, что если m равно 2, то n равно 1; р представляет собой целое число, равное 1 или 2;X представляет собой ковалентную связь или двухвалентный радикал формулы -O-, -S- или -NR3-; каждый R3 независимо друг от друга представляет собой водород или алкил; каждый R1 независимо друг от друга выбран из группы, содержащей Ar1, Ar1-алкил и ди(Ar1)алкил;q представляет собой целое число, равное 0 или 1;Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)- или -SO2-; каждый Alk представляет собой, независимо друг от друга, ковалентную связь; двухвалентный прямой или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный или ненасыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими алкил-, фенил-, галоген-, циано-, гидрокси-, формил- и аминорадикалами;Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей галоген, алкил, циано, аминокарбонил и алкилокси;Ar2 представляет собой нафталинил или фенил, каждый необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей галоген, нитро, амино, моно- и ди(алкил)амино, циано, алкил, гидрокси, алкилокси, карбоксил, алкилоксикарбонил,аминокарбонил и моно- и ди(алкил)аминокарбонил;Ar3 представляет собой нафталинил или фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей алкилокси, алкил, галоген, гидрокси, пиридинил, морфолинил, пирролидинил, имидазо[1,2-a]пиридинил, морфолинилкарбонил,пирролидинилкарбонил, амино и циано;Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы, содержащей пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, содержащей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; каждый гетероциклический радикал необязательно может быть замещенным на любом атоме радикалом, выбранным из группы, содержащей галоген или алкил;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, содержащей пирролидинил, диоксолил, имидазолидинил, пиразолидинил, пиперидинил, морфолинил, дитианил, тиоморфолинил, пиперазинил, имидазолидинил, тетрагидрофуранил, 2 Н-пирролил, пирролинил,имидазолинил, пиразолинил, пирролил, имидазолил, пиразолил, триазолил, фуранил, тиенил, оксазолил,изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил и триазинил; или бициклический гетероциклический радикал, выбранный из группы, содержащей бензопиперидинил, хинолинил, хиноксалинил, индолил, изоиндолил, хроменил, бензимидазолил, имидазо[1,2 а]пиридинил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; каждый радикал необязательно замещен одним или несколькими радикалами, выбранными из группы, содержащей Ar1, Ar1-алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо,-4 009217 алкилокси, алкилоксиалкил и алкилоксикарбонил; и алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклические насыщенные углеводородные радикалы, содержащие от 3 до 6 атомов углерода; необязательно замещенный на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из группы, содержащей фенил-, галоген-, циано-, оксо-, гидрокси-, формил- и аминорадикалы. Более конкретно, данное изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым кислотно-аддитивным или основно-аддитивным солям, его стереохимически изомерным формам, его N-оксидной форме и его пролекарству, гдеX представляет собой ковалентную связь; каждый R1 представляет собой Ar1 или Ar1-алкил;Y представляет собой ковалентную связь или двухвалентный радикал формулы -С(=O)- или -SO2-; каждый Alk представляет собой независимо друг от друга ковалентную связь; двухвалентный прямой или разветвленной, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный или ненасыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими фенил-, галоген-, циано-, гидрокси-, формил- и аминорадикалами;Ar3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, содержащей алкилокси, алкил, галоген, гидрокси,пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино и циано;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, содержащей пирролидинил, пиперидинил, морфолинил, пирролил, имидазолил, пиразолил, фуранил, тиенил, изоксазолил, тиазолил, тиадиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, содержащей бензопиперидинил, хинолинил, хиноксалинил, индолил, хроменил и бензимидазолил; каждый радикал необязательно замещен одним или несколькими радикалами, выбранными из группы, содержащей Ar1, Ar1-алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо и алкилоксикарбонил; и алкил представляет собой прямой углеводородный радикал, содержащий от 1 до 6 атомов углерода,необязательно замещенный одним или несколькими галогенрадикалами. В особенности, данное изобретение относится к соединению общей формулы (I), к его фармацевтически приемлемым кислотно-аддитивным или основно-аддитивным солям, его стереохимически изомерным формам, его N-оксидной форме и его пролекарству, где R1 представляет собой Ar1-метил, присоединенный в положении 2, или R1 представляет собой Ar1, присоединенный в положении 3, как приведено в качестве примера в любой из следующих формул для соединений, соответствующих формуле (I), где m иn равны 1 и Ar представляет собой незамещенный фенил. Предпочтительно, Ar1-метил представляет собой незамещенный бензильный радикал. В особенности, данное изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым кислотно-аддитивным или основно-аддитивным солям, его стереохимически изомерным формам, его N-оксидной форме и его пролекарству, где R2-X-C(=Q)-фрагмент представляет собой 3,5-ди(трифторметил)фенилкарбонил. В рамках данного изобретения алкил определен как одновалентный прямой или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, например метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил, гексил; алкил далее означает одновалентный циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например цик-5 009217 лопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Определение алкила включает также алкильный радикал, который необязательно замещен на одном или нескольких атомах углерода одним или несколькими фенил-, галоген-, циано-, оксо-, гидрокси-, формил- и аминорадикалами, такими,например, как гидроксиалкил, особенно гидроксиметил и гидроксиэтил, и полигалогеналкил, особенно дифторметил и трифторметил. В рамках данного описания галоген представляет собой общий термин, относящийся к фтор-,хлор-, бром- и йодрадикалам. В рамках данного описания выражение "соединения данного изобретения" обозначает соединение общей формулы (I), его фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли, его стереохимически изомерные формы, его N-оксидную форму и его пролекарство. В рамках данного описания, в частности, во фрагменте Alka-Y-Alkb в формуле (I), если два или несколько последовательных элементов указанного фрагмента обозначают ковалентную связь, то в данном случае указана простая ковалентная связь. Например, когда Alkа и Y оба обозначают ковалентную связь и Alkb представляет собой -CH2-, то фрагмент Alka-Y-Alkb обозначен как -CH2-. Термин "фармацевтически приемлемые соли" охватывает терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые способны образовывать соединения формулы (I). Указанные соли могут быть получены обработкой основной формы соединений формулы (I) подходящими кислотами, например, неорганическими кислотами, такими как галоидводородная кислота, в частности,хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, такими, например, как уксусная кислота, гидроксиуксусная кислота, пропановая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота,лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, птолуолсульфоновая кислота, цикламовая кислота, салициловая кислота, п-аминосалициловая кислота и памовая кислота. Особенно предпочтительной является фумаровая кислота. Соединения формулы (I), содержащие кислотные протоны, могут быть также превращены в их терапевтически активные нетоксичные металлические солевые формы или амино-аддитивные солевые формы обработкой подходящими органическими и неорганическими основаниями. Соответствующие основные солевые формы содержат, например, соли аммония, соли щелочных или щелочно-земельных металлов, в частности, лития, натрия, калия, магния и кальция, соли с органическими основаниями, например, соли бензатина, N-метил-D-глюкамина, гибрамина, и соли с аминокислотами, например, с аргинином и лизином. Наоборот, указанные солевые формы могут быть превращены в свободные формы обработкой соответствующим основанием или кислотой. Термин "аддитивная соль", используемый в данном описании, включает также сольваты, которые могут образовывать соединения формулы (I), а также и их соли. Такие сольваты, например, представляют собой гидраты и алкоголяты.N-оксидные формы соединений формулы (I) предназначены для включения тех соединений формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида, особенно, техN-оксидов, где один или несколько третичных атомов азота (например, в пиперазинил- или пиперидинилрадикалах) являются N-окисленными. Подобные N-оксиды могут быть получены специалистами без особого труда, и они представляют собой очевидные альтернативы для соединений формулы (I), так как являются метаболитами, которые образуются за счет окисления в организме человека после поглощения. Как общеизвестно, окисление обычно является первой стадией, включенной в метаболизм лекарственного средства (Textbook of Organic Medicinal and Pharmaceutical Chemistry, 1977, pages 70-75). Также общеизвестно, что метаболитная форма соединения может быть также введена человеку вместо самого соединения почти с теми же эффектами. Соединения данного изобретения обладают по меньшей мере двумя атомами азота, способными к окислению (фрагменты третичных аминов). Следовательно, существует высокая вероятность того, что Nоксиды должны образовываться в процессе метаболизма в человеке. Соединения формулы (I) могут быть превращены в соответствующие N-оксидные формы по известным в данной области процедурам для превращения трехвалентного азота в N-оксидную форму. Указанные реакции N-окисления, как правило, могут быть проведены взаимодействием исходного продукта формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды включают надкислоты, такие, например, как бензолкарбопероксокислота или галогензамещенная бензолкарбопероксокислота, например 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды, например, третбутилгидропероксид. Подходящие растворители представляют собой, например, воду, низшие спирты,например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, или смеси таких растворителей.-6 009217 Термин "стереохимически изомерные формы", используемый в данном изобретении выше, охватывает все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если не оговорено особо или не указано, то химическое обозначение соединений относится к смеси всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или Sконфигурацию; заместители в двухвалентных циклических (частично) насыщенных радикалах могут быть либо в цис-, либо в транс-конфигурации. Соединения с двойными связями могут соответствовать Eили Z-стереоизомерам при указанной двойной связи. Очевидно, что стереохимически изомерные формы соединений формулы (I) предназначены для охвата рамками данного изобретения. По правилам CAS номенклатуры, в случае присутствия в молекуле двух стереогенных центров известной абсолютной конфигурации обозначения R или S отнесены (согласно правилу последовательности Cahn-Ingold-Prelog (Кана-Ингольда-Прелога к хиральному центру с наименьшим номером, эталонному центру. Конфигурация второго стереогенного центра указана с применением соответствующих обозначений [R,R] или [R,S], где R всегда относится к эталонному центру и [R,R] относится к центрам с одинаковой хиральностью, a [R,S] относится к центрам с отличающейся хиральностью. Например, если хиральный центр с наименьшим номером в молекуле имеет S-конфигурацию и второй центр представляет собой R, то стереообозначение должно выглядеть как S-[R,S]. Если применены обозначения и : положение наиболее старшего заместителя у асимметрического атома углерода в циклической системе, имеющей самый низкий номер в кольце, является всегда произвольным в положении средней плоскости, определяемой данной циклической системой. Положение наиболее старшего заместителя у другого асимметрического атома углерода в циклической системе (водородный атом в соединениях, соответствующих формуле (I относительно положения наиболее старшего заместителя у эталонного атома обозначено как , если он находится на той же стороне средней плоскости, определяемой циклической системой, или , если он находится на другой стороне средней плоскости, определяемой циклической системой. Соединения формулы (I) и некоторые промежуточные соединения содержат по меньшей мере два стереогенных центра в их структуре, а именно, в 2-положении пиперидинильного фрагмента (R или S) и в 4-положении, где присоединенный радикал может находиться либо в цис-, либо в транс-положении по отношению к радикалу в 2-положении пиперидинильного фрагмента. Данное изобретение содержит также производные (обычно называемые как "пролекарства") фармакологически активных соединений данного изобретения, которые разлагаются in vivo с образованием соединений данного изобретения. Пролекарства обычно (но не всегда) обладают меньшей эффективностью по отношению к целевому рецептору в сравнении с соединениями, из которых они получаются в результате разложения. Пролекарства особенно применимы, когда желаемое соединение обладает химическими или физическими свойствами, которые затрудняют его введение или делают его неэффективным. Например, требуемое соединение может быть слаборастворимым, оно может плохо перемещаться по слизистому эпителию или может обладать нежелательно коротким периодом полураспада в плазме. Дальнейшее рассмотрение пролекарств может быть найдено в публикации Stella V.J. et al., "Prodrugs",Drug Delivery Systems, 1985, pp. 112-176, and Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений данного изобретения, как правило, будут включать соединения формулы (I), их фармацевтически приемлемые кислотно- или основноаддитивные соли, их стереохимически изомерные формы и их N-оксиды, содержащие кислотную группу,которая этерифицирована или амидирована. Подобные этерифицированные кислотные группы представляют собой группы формулы -COORx, где Rx представляет собой С 1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой H,С 1-6 алкил, фенил или бензил и Rz представляет собой -ОН, H, С 1-6 алкил, фенил или бензил. Соединения данного изобретения, содержащие аминогруппу, могут быть превращены действием кетона или альдегида, такого как формальдегид, в основание Манниха. Указанное основание в водном растворе будет гидролизоваться по кинетике первого порядка. Соединения формулы (I), полученные по способам, описанным ниже, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены один от другого по известным в данной области процедурам. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделены, например, селективной или фракционной кристаллизацией и энантиомеры выделены щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной-7 009217 стационарной фазы. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных продуктов при условии, что взаимодействие происходит стереоспецифически. Предпочтительно, если требуется специфический стереоизомер, то указанное соединение следует синтезировать стереоспецифическими способами получения. В данных способах будут преимущественно использоваться энантиомерно чистые исходные продукты. Фармакология Вещество P и другие нейрокинины включаются во множество биологических воздействий, таких как передача боли (чувствительность к боли), нейрогенное воспаление, сокращение гладкой мышцы, экстравазация протеинов плазмы, вазодилатация, секреция, дегрануляция тучных клеток, а также в активацию иммунной системы. Полагают, что ряд болезней вызывается активацией нейрокининовых рецепторов, в частности NK1-рецептора, избыточным высвобождением вещества P и других нейрокининов в конкретных клетках, таких как нейронные сплетения желудочно-кишечного тракта, немиелинизированные первичные сенсорные афферентные нейроны, симпатические и парасимпатические нейроны и ненейронные клеточные типы (DNP 8 (1):5-23 (1955) and Longmore J. et al., "Neurokinin Receptors" Pharmacological Reviews 46(4):551-599 (1994. Соединения настоящего изобретения являются сильными ингибиторами нейрокининопосредованных эффектов, в особенности, опосредованных посредством NK1-рецептора, и поэтому могут быть описаны как нейрокининовые антагонисты или тахикининовые антагонисты, особенно в качестве антагонистов вещества P, как установлено in vitro путем антагонизма релаксации коронарных артерий свиньи, вызванной веществом P, который описан в данном изобретении ниже. Сродство связывания соединений настоящего изобретения для нейрокининовых рецепторов человека, морской свинки и песчанок может быть определено in vitro в тесте по связыванию рецептора с применением 3 Н-вещества P в качестве радиолиганда. Соединения также проявляют антагонистическую активность в отношении вещества P in vivo, что может быть доказано, например, антагонизмом вызванной веществом P экстравазации плазмы у морских свинок или антагонизмом вызванной лекарственными средствами рвоты у африканских хорьков (Watson et al., Br. J. Pharmacol. 115:84-94 (1995. С учетом их способности противодействовать действиям нейрокининов путем блокирования нейрокининовых рецепторов и, в особенности, противодействие действиям вещества P через блокированиеNK1-рецептора соединения данного изобретения являются полезными в качестве лекарственных средств,особенно для профилактики и терапевтического лечения нейрокинин-опосредованных состояний. Данное изобретение, следовательно, относится к соединению общей формулы (I), его фармацевтически приемлемым кислотно- или основно-аддитивным солям, его стереохимически изомерным формам,его N-оксидной форме и их пролекарствам, для применения в качестве лекарственных средств. Изобретение также относится к применению соединения по любому из пп.1-3 для изготовления лекарственного средства для лечения, либо профилактического, либо терапевтического или для того и другого, нейрокинин-опосредованных состояний. Соединения данного изобретения применимы для лечения расстройств ЦНС, особенно, депрессии,состояний тревоги, нарушений, связанных со стрессом, нарушений сна, нарушений познавательной способности, расстройств личности, шизоаффективных нарушений, нарушений питания, нейродегенеративных заболеваний, наркологических нарушений, нарушения настроения, сексуальной дисфункции, болевых и других состояний, связанных с ЦНС; воспаления; аллергических нарушений; рвоты; желудочнокишечных расстройств, в особенности, синдрома раздраженного кишечника (IBS); кожных нарушений; вазоспастических заболеваний; фиброзных и коллагеновых заболеваний; нарушений, связанных с повышением или подавлением иммунитета, ревматических заболеваний и для регулирования массы тела. В частности, соединения данного изобретения применимы при лечении или предупреждении депрессии, включающей, но без ограничения только ими, глубокие депрессивные нарушения, в том числе биполярную депрессию; униполярную депрессию; единичные или повторяющиеся глубокие депрессивные приступы с или без психотических признаков, кататонических признаков, меланхолических особенностей, атипических признаков или послеродового проявления и, в случае повторяющихся приступов, с или без сезонных особенностей. Другие эмоциональные расстройства, охваченные термином "глубокое депрессивное расстройство", включают дистимическое нарушение с ранним или поздним началом заболевания и с или без атипических признаков, биполярное I расстройство, биполярное II расстройство,циклотимическое расстройство, рецидивирующее кратковременное депрессивное расстройство, смешанное аффективное расстройство, невротическую депрессию, посттравматическое стрессовое расстройство и социальную фобию; слабоумие типа болезни Альцгеймера с ранним или поздним началом, с подавленным настроением; васкулярное слабоумие с подавленным настроением; вызванные веществом эмоциональные расстройства, такие как расстройства настроения, вызванные алкоголем, амфетаминами, кокаином, галлюциногенами, летучими препаратами, опиоидами, фенциклидином, седативными средствами,снотворными средствами, анксиолитиками и другими веществами; шизоаффективное расстройство подавленного типа; регуляторные расстройства с подавленным настроением. Глубокие депрессивные расстройства могут быть также результатом общего медицинского состояния, включающего, но не ограни-8 009217 чивающегося ими, инфаркт миокарда, диабет, выкидыш или аборт и т.д. В частности, соединения данного изобретения применимы при лечении или предупреждении состояний тревоги, включающих, но без ограничения только ими, приступ паники; агорафобию; паническое состояние без агорафобии; агорафобию без предшествующего панического расстройства; специфическую фобию; социальную фобию; обсессивно-компульсивное расстройство; посттравматическое стрессовое расстройство; острое стрессовое расстройство; генерализованное состояние тревоги; состояние тревоги, обусловленное общим медицинским состоянием; состояние тревоги, вызванное веществом; и неспецифицированное состояние тревоги. В частности, соединения данного изобретения применимы при лечении или предупреждении нарушений, связанных со стрессом, связанных с депрессией и/или тревогой, которые включают, но без ограничения только ими, острую стрессовую реакцию; регуляторные расстройства, такие как кратковременная депрессивная реакция, пролонгированная депрессивная реакция, смешанные тревога и депрессивная реакция, регуляторное расстройство с преобладающим нарушением других эмоций, регуляторное расстройство с преобладающим нарушением проводимости, регуляторное расстройство со смешанным расстройством эмоций и проводимости и регуляторные расстройства с другими специфическими преобладающими симптомами; другие реакции на тяжелый стресс. В частности, соединения данного изобретения применимы при лечении или предупреждении нарушений сна, включающих, но без ограничения только ими, дисомнию и/или парасомниаз как первичные расстройства сна; инсомнию; сонную асфиксию; нарколепсию; расстройство циркадного ритма; нарушения сна, связанные с другим психическим расстройством; нарушение сна, обусловленное общим медицинским состоянием; нарушение сна, вызванное веществом. В частности, соединения данного изобретения применимы при лечении или предупреждении нарушений познавательной способности, включающих, но без ограничения только ими, деменцию; расстройства, относящиеся к амнезии, и неспецифицированные нарушения познавательной способности, в частности деменцию, вызванную дегенеративными расстройствами, патологическими изменениями, травмами, инфекциями, сосудистыми нарушениями, токсинами, гипоксией, витаминной недостаточностью или эндокринными расстройствами; деменцию типа болезни Альцгеймера с ранним или поздним началом с подавленным настроением; деменцию, ассоциированную со СПИД, или расстройства памяти, вызванные алкоголем или другими причинами недостаточности тиамина, двусторонним поражением височной доли головного мозга, обусловленным энцефалитом от Herpes simplex, и другими лимбическими энцефалитами, нейронной недостаточностью, вторичной от гипоксии/гипогликемии/тяжелых конвульсий и оперативного вмешательства, дегенеративными расстройствами, сосудистыми нарушениями или патологиейIII желудочка головного мозга. Кроме того, соединения данного изобретения применимы в качестве усилителей памяти и познавательной способности у здоровых людей, не страдающих дефицитом познавательной способности и/или памяти. В частности, соединения данного изобретения применимы при лечении или предупреждении расстройств личности, включающих, но без ограничения только ими, параноидное изменение личности; шизоидное изменение личности; шизотипическое изменение личности; антисоциальное изменение личности; пограничное изменение личности; неестественное изменение личности; нарциссистическое изменение личности; избегаемое изменение личности; зависимое изменение личности; обсессивнокомпульсивное изменение личности и неспецифицированное изменение личности. В частности, соединения данного изобретения применимы при лечении или предупреждении шизоаффективных расстройств, полученных от различных причин и включающих шизоаффективные расстройства маниакального типа, депрессивного типа, смешанного типа; параноидную, деструктивную,кататоническую, недифференцируемую и остаточную шизофрению; шизофреноформальное расстройство; шизоаффективное расстройство; бредовое расстройство; обычное психотическое расстройство; частичное психотическое расстройство; психотическое расстройство, вызванное веществом, и неспецифицированное психотическое расстройство. В частности, соединения данного изобретения применимы также при лечении или предупреждении расстройств питания, включающих неврозную анорексию; атипическую неврозную анорексию; неврозную булимию; атипическую неврозную булимию; переедание, связанное с другими физиологическими нарушениями; рвоту, связанную с другими физиологическими нарушениями; и неспецифицированные расстройства питания. В частности, соединения данного изобретения применимы также при лечении или предупреждении нейродегенеративных болезней, включающих, но без ограничения только ими, болезнь Альцгеймера; хорею Хантингтона; болезнь Крейтцфельда-Якоба; болезнь Пика; демиелинизирующие нарушения, такие как рассеянный склероз и ALS (болезнь Альцгеймера); другие невропатии и невралгию; рассеянный склероз; боковой амиотрофический склероз; внезапный приступ и головную травму. В частности, соединения данного изобретения применимы также при лечении или предупреждении расстройств, связанных с наркоманией, включающих, но без ограничения только ими, зависимость от вещества или злоупотребление им с или без физиологической зависимости, особенно в случаях, где вещество представляет собой алкоголь, амфетамины, амфетаминоподобные вещества, кофеин, кокаин, гал-9 009217 люциногены, летучие препараты, никотин, опиоиды (такие как гашиш, героин и морфин), фенциклидин,фенциклидиноподобные соединения, седативно-снотворные средства, бензодиазепины и/или другие вещества, частично используемые для лечения абстиненции в отношении вышеуказанных веществ и алкогольного абстинентного делирия. В частности, соединения данного изобретения применимы также при лечении или предупреждении расстройств настроения, вызванных особенно алкоголем, амфетаминами, кофеином, гашишем, кокаином,галлюциногенами, летучими препаратами, никотином, опиоидами, фенциклидином, седативными средствами, снотворными средствами и другими веществами. В частности, соединения данного изобретения применимы также при лечении или предупреждении сексуальной дисфункции, включающей, но без ограничения только ими, расстройства сексуального желания; расстройства сексуального возбуждения; расстройства оргазма; сексуально-болевые расстройства; сексуальную дисфункцию, обусловленную общим медицинским состоянием; сексуальную дисфункцию,вызванную веществом, и неспецифицированную сексуальную дисфункцию. В частности, соединения данного изобретения применимы также при лечении или предупреждении боли, включающей, но без ограничения только ими, травматическую боль, такую как послеоперационная боль; травматическую авульсионную боль, такую как боль плечевого сплетения; хроническую боль, такую как хроническая боль, вызванная панкреатитом, или артритная боль, возникающая при остеоревматоидном или псориатическом артрите; невропатическую боль, такую как постгерпетическая невралгия,тригеминальная невралгия, сегментальная или межреберная невралгия, фибромиалгия, каузалгия, периферическая невропатия, диабетическая невропатия, невропатия, вызванная химиотерапией, невропатия,связанная со СПИД, затылочная невралгия, невралгия при синдроме коленчатого ганглия, глоссофарингеальная невралгия, рефлекторная симпатическая дистрофия и фантомная боль; различные формы головной боли, такие как мигрень, острая и хроническая головная боль от давления, височнонижнечелюстная головная боль, верхнечелюстная пазушная головная боль и "гистаминовая" головная боль; зубную боль; боль при раке; висцеральную боль; желудочно-кишечную боль; боль при ущемлении нерва; боль при спортивном повреждении; дисменорею; менструальную боль; менингит; арахноидит; скелетно-мышечную боль; задненижнюю боль, такую как спинальный стеноз, пролапс диска, ишиалгия,стенокардия, анкилозирующий спондилоартрит; подагру; ожоги; рубцовую боль; зудневую чесотку и таламическую боль, такую как постударная таламическая боль. В частности, соединения данного изобретения применимы также при лечении или предупреждении следующих других состояний, связанных с ЦНС, таких как акинезия, акинетик-ригидные синдромы,дискинезия и паркинсонизм, вызванные лекарственными средствами, синдром Жилль де ла Туретта и его симптомы, тремор, хорея, миоклонус, тики и дистония, дефицит внимания/гиперактивность (ADHD),болезнь Паркинсона, паркинсонизм, вызванный лекарственными средствами, постэнцефалитный паркинсонизм, прогрессирующий супрануклеарный паралич, множественная системная атрофия, кортикобазальная дегенерация, сочетание паркинсонизм-ALS деменция и базальная ганглиозная кальцификация,поведенческие нарушения и расстройства проводимости в деменции и психически заторможенные,включающие беспокойство и ажитацию, экстрапирамидальные двигательные расстройства, болезнь Дауна и акатизия. В частности, соединения данного изобретения применимы также при лечении или предупреждении воспаления, включающего, но без ограничения только ими, воспалительные состояния при астме, пневмонии, хронических бронхитах и ревматоидных артритах; воспаления в желудочно-кишечном тракте,такие как, но без ограничения только ими, болезнь Крона, язвенный колит, синдром раздраженного кишечника, повреждение, вызванное нестероидными противовоспалительными лекарственными средствами; воспалительные состояния кожи, такие как герпес и экзема; воспалительные состояния мочевого пузыря, такие как цистит и недержание мочи; воспаление глаз и зубов и панкреатит, в особенности хронический и острый панкреатит. В частности, соединения данного изобретения применимы также при лечении или предупреждении аллергических реакций, включающих, но без ограничения только ими, аллергические поражения кожи,такие как, но без ограничения только ими, крапивница; аллергические поражения дыхательных путей,такие как, но без ограничения только ими, риниты. В частности, соединения данного изобретения применимы также при лечении или предупреждении рвоты, т.е. тошноты, вызывающей позыв на рвоту и саму рвоту, включающей, но без ограничения только ими, острую рвоту, отложенную рвоту и периодическую рвоту; рвоты, вызываемой лекарственными средствами, такими как химиотерапевтические противораковые средства, такие как алкилирующие средства, например, циклофосфамид, кармустин, ломустин и хлорамбуцил; цитотоксические антибиотики,например, дактиномицин, доксорубицин, митомицин-С и блеомицин; антиметаболиты, например, цитарабин, метотрексат и 5-фторурацил; алкалоиды растений рода Vinca, например, этопозид, винбластин и винкристин; и другие лекарственные средства, такие как цисплатин, дакарбазин, прокарбазин и гидроксимочевина; и их комбинации; рвоты, вызванной лучевой болезнью; лучевой терапией, такой как при лечении рака; отравлениями; токсинами, такими как токсины, вызываемые метаболическими нарушениями или инфекцией, такой как гастрит, или высвобождаемые в процессе бактериальной или вирусной- 10009217 желудочно-кишечной инфекции; беременностью; вестибулярными расстройствами, такими как укачивание, головокружение, болезнь Меньера; послеоперационной тошнотой; желудочно-кишечной непроходимостью; пониженной желудочно-кишечной перистальтикой; висцеральной болью, такой как инфаркт миокарда и перитонит; мигренью; повышенным внутричерепным давлением; пониженным внутричерепным давлением (высотной болезнью); опиоидными анальгетиками, такими как морфин; гастроэзофагеальным рефлюксом; кислотной диспепсией; излишним потреблением пищи или напитков; кислотным желудком; раздраженным желудком; изжогой/регургитацией; изжогой, такой как эпизодическая изжога, ночная изжога и изжога, вызванная едой; и диспепсией. В частности, соединения данного изобретения применимы также при лечении или предупреждении желудочно-кишечных расстройств, включающих, но без ограничения только им, синдром раздраженного кишечника (IBS), поражений кожи, таких как псориаз, зуд и солнечный ожог; вазоспастических заболеваний, таких как стенокардия, васкулярная головная боль и болезнь Рейно, церебральная ишемия, такая как церебральный вазоспазм, сопровождаемый субарахноидальной геморрагией; фиброзных и коллагеновых заболеваний, таких как склеродермия и эозинофильный фасциолез; расстройств, связанных с активизацией или подавлением иммунитета, таких как системная красная волчанка и ревматические заболевания, такие как фиброзиты; кашля; и для регулирования массы тела, включая ожирение. Настоящее изобретение также относится к способу лечения и/или профилактики заболеваний, опосредованных нейрокининами, в частности, для лечения и/или профилактики депрессии, состояний тревоги, рвоты и синдрома раздраженного кишечника (IBS), включающему введение пациенту, нуждающемуся в подобном введении, эффективного количества соединения данного изобретения, в частности, соответствующего формуле (I), его фармацевтически приемлемых кислотно- или основно-аддитивных солей,его стереохимически изомерных форм, его N-оксидной формы и его пролекарств. Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения данного изобретения, в частности, соединения формулы (I), его фармацевтически приемлемых кислотно- или основно-аддитивных солей, его стереохимически изомерных форм, его N-оксидной формы и его пролекарства. Соединения данного изобретения, в частности, соединения формулы (I), их фармацевтически приемлемые кислотно- или основно-аддитивных соли, их стереохимически изомерные формы, их Nоксидная форма и их пролекарства или любая их подгруппа или комбинация могут быть составлены в различные фармацевтические формы для целей введения. В качестве соответствующих композиций могут быть указаны все композиции, обычно используемые для систематического введения лекарственных средств. Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в виде аддитивной соли, в качестве активного ингредиента, объединяют в однородную смесь с фармацевтически приемлемым носителем, который можно использовать в различных формах в зависимости от формы препарата, требуемой для введения. Данные фармацевтические композиции желательны в единичной дозирозанной форме, подходящей, в частности, для введения орально, ректально, подкожно, ингаляцией или с помощью парентеральной инъекции. Например, для получения композиций в дозированной форме для орального введения, может быть использована любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и т.п.; в случае оральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие средства, дезинтегранты и т.п. в случае порошков, гранул, капсул и таблеток. Из-за простоты введения таблетки и капсулы представляют собой наиболее выгодные оральные дозированные формы, в которых обычно применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерильную воду, по крайней мере, в большом количестве, хотя могут быть включены и другие ингредиенты, например, для повышения растворимости. Растворы для инъекций, например, могут быть получены с носителем, содержащим физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Суспензии для инъекций могут быть также приготовлены с использованием соответствующих жидких носителей, суспендирующих средств и т.п. Включенными в объем изобретения также являются препараты в твердой форме, которые предназначены незадолго перед применением для превращения в жидкие препараты. В композициях, подходящих для введения через кожу, носитель необязательно содержит средство, повышающее проникновение, и/или подходящий смачивающий агент, необязательно объединенный с подходящими добавками любой природы в малых соотношениях, причем добавки не оказывают вредного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут способствовать приготовлению желаемой композиции. Данные композиции могут быть введены различными путями, например, как трансдермальный пластырь, наклейка, мазь. Особенно выгодно составлять вышеупомянутые фармацевтические композиции в виде единичной дозированной формы для облегчения введения и для однородности дозировки. Единичная дозированная форма, как использовано в данном изобретении, относится к физически дискретным единицам, подходящим как единичные дозы, причем каждая единица содержит ранее определенное количество активного- 11009217 ингредиента, вычисленное для достижения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Примерами подобных единичных дозированных форм являются таблетки (включающие шероховатые таблетки или таблетки с покрытием), капсулы, гранулы, пакеты с порошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п. и их сегрегированные множественные формы. Так как соединения данного изобретения являются сильными NK1-антагонистами для орального введения, то фармацевтические композиции, содержащие указанные соединения для орального введения,являются особенно предпочтительными. Получение Соединения данного изобретения, как правило, могут быть получены последовательностью стадий,каждая из которых известна специалисту в данной области техники. Соединения формулы (I) получают подходящим образом N-гидроалкилированием промежуточного соединения формулы (II), где R1, R2, X, Q, m, n и р принимают значения, определенные в формуле (I), сN-замещенным пиперидиноном формулы (III), где R1, Alk, Y, L и q принимают значения, определенные в формуле (I). Указанное N-гидроалкилирование может быть проведено в реакционно-инертном растворителе, таком как, например, дихлорметан, этанол, или толуол, или их смесь, и в присутствии соответствующего восстановителя, такого как, например, борогидрид, например борогидрид натрия, цианоборогидрид натрия или триацетоксиборогидрид. В случае применения борогидрида в качестве восстановителя можно использовать комплексообразующий агент, такой как, например, изопропилат титана(IV), как описано в публикации J. Org. Chem., 1990, 55, 2552-2554. Применение указанного комплексообразующего агента может также приводить к улучшенному соотношению цис/транс-изомеров в пользу трансизомера. В качестве восстановителя может быть также использован водород в комбинации с подходящим катализатором, таким как, например, палладий-на-угле или платина-на-угле. В случае применения водорода в качестве восстановителя может быть полезно добавлять в реакционную смесь дегидратирующий агент, такой как, например, трет-бутоксид алюминия. Для предотвращения нежелательного дальнейшего гидрирования некоторых функциональных групп в реагирующих веществах и в продуктах реакции может быть полезно добавлять в реакционную смесь каталитический яд, например, тиофен или хинолин/серу. Перемешивание и необязательно повышенные температуры и/или давление могут увеличивать скорость реакции. В данном и в последующих синтезах продукты реакции могут быть выделены из реакционной смеси и, если необходимо, дополнительно очищены в соответствии с методологиями, хорошо известными в данной области, такими как, например, экстракция, кристаллизация, порошкование и хроматография. Особенно подходящим является получение соединения данного изобретения по представленной ранее схеме реакции, где Alk-Y-Alk-L-фрагмент является бензилом, таким образом приводящей к соединению формулы (I), где Alk-Y-Alk-L-фрагмент представляет собой бензил. Указанное соединение является фармакологически активным и может быть превращено в соединение данного изобретения, в которомAlk-Y-Alk-L-фрагмент представляет собой водород, восстановительным гидрированием с применением,например, водорода в качестве восстановителя в комбинации с подходящим катализатором, таким как,например, палладий-на-угле или платина-на-угле. Образующееся соединение данного изобретения затем может быть превращено в другие соединения данного изобретения с помощью известных в данной области процедур превращения, например ацилирования и алкилирования. В частности, соединения формулы (Ia) могут быть получены взаимодействием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, p и q принимают значения, определенные в формуле (I), с ацильным соединением формулы (V), где Alk и L принимают значения, определенные в формуле (I), и W1 представляет собой соответствующую уходящую группу, такую как, например, галоген, например хлор или бром, или уходящую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси. Реакция может быть проведена в реакционно-инертном растворителе, таком как, например, хлорированный углеводород, например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повышать скорость реакции. Реакция предпочтительно может быть проведена при температуре от комнатной до температуры флегмы. Альтернативно, соединения формулы (Ia) могут быть получены взаимодействием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, р и q принимают значения, определенные в формуле (I), с карбоновой кислотой формулы (VI), где Alk и L принимают значения, определенные в формуле (I) (катализируемая основанием реакция нуклеофильного присоединения). Реакция может быть проведена в реакционно-инертном растворителе, таком как, например, хлорированный углеводород, например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повышать скорость реакции. Реакция предпочтительно может быть проведена при температуре от комнатной до температуры флегмы. Реакция, представленная выше, может быть проведена с эфиром карбоновой кислоты формулы (VI) при эквивалентных условиях. В частности, соединения формулы (Ib) могут быть получены взаимодействием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, р и q принимают значения, определенные в формуле (I), с кетосоединением формулы (VII), где W2 представляет собой соответствующую уходящую группу, такую как,например, галоген, например хлор или бром, или уходящую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси. Реакция может быть проведена в реакционно-инертном растворителе, таком как, например, хлорированный углеводород, например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как,например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повышать скорость реакции. Реакция предпочтительно может быть проведена при температуре от комнатной до температуры флегмы. Соединения формулы (Ic) могут быть получены гидроаминированием/гидроалкилированием конечного соединения формулы (I'), где R1, R2, X, Q, m, n, p и q принимают значения, определенные в формуле(I), с соединением формулы (VIII), где Alk и L принимают значения, определенные в формуле (I), и W3 представляет собой соответствующую уходящую группу, такую как, например, галоген, например, хлор или бром, или уходящую сульфонилоксигруппу, например метансульфонилокси или бензолсульфонилокси. Реакция может быть проведена в реакционно-инертном растворителе, таком как, например, хлорированный углеводород, например дихлорметан, спирт, например этанол, или кетон, например метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повышать скорость реакции. Реакция предпочтительно может быть проведена при температуре от комнатной до температуры флегмы. Исходные продукты и некоторые промежуточные соединения представляют собой известные соединения и являются коммерчески доступными или могут быть получены по соответствующим подходящим методикам, обычно известным в данной области. Например, промежуточное соединение форму- 13009217 лы (II) может быть получено N-гидроалкилированием промежуточного соединения формулы (IX) с помощью промежуточного соединения формулы (X), где W4 представляет собой бензильный радикал, после чего соединение формулы (X) восстанавливается с образованием промежуточного соединения формулы (II). Указанное N-гидроалкилирование может быть проведено в реакционно-инертном растворителе, таком как, например, дихлорметан, этанол, толуол или их смесь, и в присутствии соответствующего восстановителя, такого как, например, борогидрид, например, борогидрид натрия, цианоборогидрид натрия или триацетоксиборогидрид. В случае применения борогидрида в качестве восстановителя можно использовать комплексообразующий агент, такой как, например, изопропилат титана(IV), как описано в публикации J. Org. Chem., 1990, 55, 2552-2554. Применение указанного комплексообразующего агента может также приводить к улучшенному соотношению цис/транс-изомеров в пользу транс-изомера. В качестве восстановителя может быть также использован водород в комбинации с подходящим катализатором, таким как, например, палладий-на-угле или платина-на-угле. В случае применения водорода в качестве восстановителя можно добавлять в реакционную смесь дегидратирующий агент, такой как, например, трет-бутоксид алюминия. Для предотвращения нежелательного дальнейшего гидрирования некоторых функциональных групп в реагирующих веществах и в продуктах реакции можно добавлять в реакционную смесь каталитический яд, например, тиофен или хинолин/серу. Перемешивание и необязательно повышенные температуры и/или давление могут увеличивать скорость реакции. Получение указанных и других промежуточных соединений описано в публикации WO 97/16440 А 1, опубликовано May 9, 1997 by Janssen Pharmaceutica N.V., которая приводится здесь как ссылка, а также в других публикациях, цитируемых в WO 97/16440-A1, таких как, например, ЕР-0532456-А. Соединения данного изобретения могут быть превращены друг в друга по известным в данной области реакциям превращения, представленным далее. Более конкретно, соединения формулы (XIII), где А представляет собой арил или гетероарил, Z может быть любым фрагментом, предпочтительно фрагментом Z1, определенным ниже, Het представляет собой ненасыщенный гетероарил и r представляет собой целое число, изменяющееся от 1 до числа, равного числу доступных атомов углерода в ариле или в гетероарильном фрагменте А, например, 5 в фениле и 4 в пирролиле, могут быть получены по реакции Хека (Heck) нового типа, по которой соединение формулы (XI), где Z, А и r принимают значения, определенные в формуле (XIII), и Hal представляет собой галоген, и, следовательно, содержащее активный или неактивный галогензамещенный арил или галогензамещенный гетероарил, более предпочтительно моно- или полизамещенный бром- и/или йодарил или гетероарильный фрагмент, подвергают взаимодействию с ненасыщенным гетероарилом формулы (XII) в присутствии каталитических количеств Pd(OAc)2 и 1,3-бис-дифенилфосфинопропана, в присутствии подходящего основания, предпочтительно Cs2CO3 или K(AcO), в реакционно-инертном полярном растворителе, таком как предпочтительно NMP (N-метил-2-пирролидон), DMA (диметилацетамид), DMF(диметилформамид) и т.п., и при повышенной температуре реакции, предпочтительно при 140-150C, в течение определенного периода времени, предпочтительно примерно 6-20 ч, предпочтительно 12-18 ч. Предпочтительно r равно 1. Het может представлять собой ненасыщенный моноциклический или бициклический гетероарильный фрагмент, такой как, например, имидазо[1,2-а]пиридинил, пирролил,тиенил, тиазолил, имидазолил, оксазолил, фуранил, бензимидазолил, бензоксазолил, бензтиазолил, бензофуранил, бензотиенил или индолил или любой из ненасыщенных радикалов в группах Het1 и Het2, как определено в формуле (I), необязательно замещенный одним или несколькими радикалами, выбранными из группы, содержащей Ar1, Ar1-алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо,алкилокси, алкилоксиалкил и алкилоксикарбонил. Предпочтительно, А представляет собой фенил или пиридинил. Указанная реакция приводит к более высокому выходу по сравнению со способом, описанным в уровне техники (Yutaka Aoyagi et al., Heterocycles, 1992, 33, 257 and Sommai Pivsa-Art, Bull. Chem. Soc. Также соединения данного изобретения могут быть превращены в кислотно-аддитивную соль обработкой кислотой или в основно-аддитивную соль обработкой основанием или, наоборот, кислотноаддитивная солевая форма может быть превращена в свободное основание обработкой щелочью, или основно-аддитивная соль может быть превращена в свободную кислоту обработкой кислотой. Следующие примеры предназначены для иллюстрации, но не для ограничения объема настоящего изобретения. Экспериментальная часть Здесь и далее "RT" означает комнатную температуру, "CDI" означает 1,1'-карбонилдиимидазол,"DIPE" означает диизопропиловый эфир, "MIK" означает метилизобутилкетон, "BINAP" означает [1,1'бинафталин]-2,2'-диил-бис-[дифенилфосфин], "NMP" означает 1-метил-2-пирролидон, "Pd2(dba)3" означает трис-(дибензилиденацетон)дипалладий и "DMF" означает N,N-диметилформамид. Получение промежуточных соединений Пример A1. а. Получение промежуточного соединения 1.Et3N (0,55 моль) добавляли к перемешиваемой смеси 7-(фенилметил)-1,4-диокса-8 азаспиро[4,5]декана (0,5 моль) в толуоле (1500 мл). Затем к содержимому добавляли 3,5-бис(трифторметил)бензоилхлорид (0,5 моль) в течение более 1 ч (экзотермическая реакция). Смесь перемешивали при комнатной температуре 2 ч, затем ее оставляли на выходные, после чего промывали три раза водой (500 мл, 2250 мл). Органический слой отделяли, высушивали, фильтровали и растворитель выпаривали. Выход: 245 г (100%). Часть данной фракции кристаллизовали из петролейного эфира. Осадок отфильтровывали и высушивали. Выход: 1,06 г промежуточного соединения 1.b. Получение промежуточного соединения 2.HCl х.ч. (ср) (300 мл) добавляли к смеси промежуточного соединения 1 (0,5 моль) в этаноле (300 мл) и воде (300 мл). Реакционную смесь перемешивали при 60C в течение 20 ч. Осадок отфильтровывали, измельчали, перемешивали с водой, отфильтровывали, промывали петролейным эфиром и сушили. Выход: 192 г промежуточного соединения 2 +-)-1-[3,5-бис-(трифторметил)бензоил]-2-(фенилметил)-4 пиперидинон) (89,4%) (смесь R- и S-энантиомеров). с. Получение промежуточного соединения 3. Смесь промежуточного соединения 2 (0,046 моль), 1-(фенилметил)пиперазина (0,051 моль) и С(0,056 моль) перемешивали 2 ч при 40C. Реакционную смесь охлаждали до комнатной температуры. К содержимому добавляли этанол (350 мл), аналитически чистый (р.а.). Затем добавляли BH4Na (0,138- 15009217 моль). Полученную реакционную смесь перемешивали 1 ч при комнатной температуре, затем 1 ч при 50C. Добавляли еще BH4Na (5,2 г) и реакционную смесь перемешивали 2 ч при 50C. Снова добавлялиBH4Na и реакционную смесь перемешивали ночь при комнатной температуре, затем 2 ч при 50C. К содержимому добавляли воду (10 мл). Смесь перемешивали в течение 15 мин. Добавляли CH2Cl2 (200 мл) и смесь перемешивали в течение 15 мин. Органическую фазу отделяли, сушили (MgSO4), добавляли дикалит (dicalite). Смесь фильтровали от декалита и фильтрат упаривали. Данную фракцию разделяли на(CIS) и (TRANS) колоночной хроматографией на силикагеле. Целевые (TRANS)-фракции собирали и растворитель выпаривали, получая 14,8 г остатка I), 1,06% (CIS и 4,9 г остатка II), 6% (CIS. Разделение и очистку (TRANS)-фракций (20 г в целом) проводили хроматографией на стационарной фазеChiralcel OD (1900Gr) в Prochrom LC110 35 bar (элюент: гексан/этанол 90/10). Целевые фракции собирали и растворитель выпаривали. Выход: 9,5 г промежуточного соединения 3, (2R-транс)-1-[3,5-бис(трифторметил)бензоил]-2-(фенилметил)-4-[4-(фенилметил)-1-пиперазинил]пиперидин.d. Получение промежуточного соединения 4. Смесь промежуточного соединения 3 (0,288 моль) в метаноле (700 мл) гидрировали при 40C в присутствии катализатора Pd/C, 10% (5 г). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Выход: 141,2 г промежуточного соединения 4, (+)-(2R-транс)-1-[3,5-бис(трифторметил)бензоил]-2-(фенилметил)-4-(1-пиперазинил)пиперидин. Пример А 2. а. Получение промежуточного соединения 5. Смесь N-[(1,1-диметилэтокси)карбонил]-L-тирозин-1,1-диметилэтилкарбоната (0,005 моль), N,Nдиметил-4-пиридинамина (0,006 моль) и Et3N (0,006 моль) в CH2Cl2, аналитически чистый (р.а.) (10 мл) перемешивали при комнатной температуре. Моногидрохлорид N-(этилкарбонимидоил)-N,N-диметил 1,3-пропандиамина (0,006 моль) добавляли порциями и смесь перемешивали 45 мин при комнатной температуре. Затем добавляли конечное соединение 2 (описанное в примере B1b) (0,005 моль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь промывали H2O и Na2CO3. Отделенный органический слой сушили, фильтровали и растворитель выпаривали. Остаток очищали на силикагеле на стеклянном фильтре (элюент: CH2Cl2/MeOH 100/0; 98/2; 96/4; 94/6). Самые чистые фракции объединяли и растворитель выпаривали. Выход: 1,4 г промежуточного соединения 5 (30%). Пример A3. а. Получение промежуточного соединения 6.b. Получение промежуточного соединения 7. Смесь промежуточного соединения 6 (0,5 моль) в метаноле (700 мл) гидрировали при 50C в течение ночи в присутствии катализатора Pd/C, 10% (5 г). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток обрабатывали водой и экстрагировали CH2Cl2. Органический слой сушили (MgSO4), фильтровали и упаривали. Выход: 99 г промежуточного соединения 7 (85%). с. Получение промежуточного соединения 8.Et3N (0,55 моль) добавляли к смеси промежуточного соединения 7 (0,5 моль) в толуоле (1500 мл). К содержимому медленно добавляли по каплям 3,5-диметилбензоилхлорид (0,5 моль) в течение более 1 ч,при этом температуру поддерживали ниже 50C и продолжали перемешивание. Смесь перемешивали в течение ночи при комнатной температуре, затем промывали три раза водой (500 мл, 2250 мл) и разделяли слои. Органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 197 г(113%). Часть данной фракции высушивали. Выход: 0,65 г промежуточного соединения 8.d. Получение промежуточного соединения 9. Смесь промежуточного соединения 8 (0,56 моль) в этаноле (300 мл), HCl (300 мл) и H2O (300 мл) перемешивали при 60C в течение 8 ч. Смесь перемешивали при комнатной температуре в течение выходных дней. Осадок отфильтровывали, обрабатывали водой, отфильтровывали, промывали петролейным эфиром и сушили. Выход: 140,9 г промежуточного соединения 9 (88%). е. Получение промежуточного соединения 10. Смесь промежуточного соединения 9 (0,05 моль) и 1-(фенилметил)пиперазина (0,05 моль) в тиофене, 4% раствор (2 мл), и толуоле (500 мл) гидрировали в присутствии катализатора Pd/C, 10% (1 г). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) 99/1). Очищенные фракции собирали и упаривали. Выход: 17,07 г (71%). Очищенные фракции 1 собирали и упаривали. Выход: 2,5 г промежуточного соединения 10 (10%).f. Получение промежуточного соединения 11. Смесь промежуточного соединения 10 (0,0052 моль) в метаноле (100 мл) гидрировали при 50C в течение ночи в присутствии катализатора Pd/C, 10% (1 г). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали на силикагеле на стеклянном фильтре (элюент:CH2Cl2/(CH3OH/NH3) 99/1, 98/2, 97/3, 96/4 и 95/5). Очищенные фракции собирали и упаривали. Выход: 1,7 г промежуточного соединения 11 (83%).- 17009217 Пример А 4. Получение промежуточного соединения 12. Смесь конечного соединения 2 (полученного по B1b) (0,01 моль) и KOH (0,15 моль) в 2-пропаноле(50 мл) перемешивали и кипятили с обратным холодильником 18 ч. Растворитель выпаривали, затем остаток помещали в воду (20 мл) и смесь экстрагировали CH2Cl2. Органический слой промывали NaOH(1N), сушили (MgSO4), фильтровали и растворитель выпаривали. Выход: 3,25 г промежуточного соединения 12 (95%). Получение конечных соединений Пример B1. а. Получение конечного соединения 1. Смесь промежуточного соединения 4 (0,12 моль) и 1-(фенилметил)-4-пиперидинона (0,12 моль) в метаноле (250 мл) гидрировали при 50C в присутствии катализатора Pd/C 10% (3 г) и раствора тиофена(2 мл). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток суспендировали в петролейном эфире, отфильтровывали и кристаллизовали из DIPE. Выход: 46 г (F1). Фильтрат упаривали. Выход: 37,7 г (F2). F1 и F2 объединяли и очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH 91/9). Фракции продукта собирали и растворитель выпаривали. Выход: 46 г (F3). Часть F3 кристаллизовали из DIPE. Выход: 0,65 г конечного соединения 1.b. Получение конечного соединения 2. Смесь конечного соединения 1 (0,0074 моль) в метаноле (150 мл) гидрировали в присутствии катализатора Pd/C 10% (1 г). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат концентрировали. Выход: 4,3 г конечного соединения 2. Пример В 2. Получение конечного соединения 3. Смесь конечного соединения 2 (0,0015 моль) и Et3N (0,1 моль) в CH2Cl2 (100 мл) перемешивали при комнатной температуре. Бензоилхлорид (0,0025 моль) растворяли в CH2Cl2 и добавляли по каплям к реакционной смеси. Смесь перемешивали 1 ч при комнатной температуре. Затем к содержимому добавлялиNaOH (1N; 100 мл) и смесь перемешивали 30 мин при комнатной температуре. Отделенный водный слой экстрагировали CH2Cl2. Органический слой промывали водой, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH 100/0; 90/10). Целевые фракции собирали и растворитель выпаривали. Выход: 0,624 г конечного соединения 3 (61%).- 18009217 Пример В 3. а. Получение конечного соединения 4. Смесь 5-метил-4-изоксазолкарбоновой кислоты (0,0015 моль) в CH2Cl2 (20 мл) и 1,1'-карбонил-бис 1 Н-имидазола (0,0015 моль) перемешивали 2 ч при комнатной температуре. К содержимому добавляли конечное соединение 2 (полученное по B1b) (0,001 моль). После перемешивания в течение ночи реакционную смесь промывали разбавленным раствором NaOH, затем H2O, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2 градиент 0-10% MeOH). Фракции продукта собирали и растворитель выпаривали. Остаток сушили. Выход: 0,204 г конечного соединения 4.b. Получение конечного соединения 5.Et3N (0,00255 моль) в CH2Cl2 (200 мл) перемешивали при комнатной температуре. К содержимому добавляли порциями N,N-диметил-N'-(метилкарбонимидоил)-1,3-пропандиамин (0,00255 моль) и смесь перемешивали 1 ч при комнатной температуре. Затем добавляли по каплям раствор конечного соединения 2 (полученного по B1b) (0,00188 моль) в CH2Cl2 и реакционную смесь перемешивали в течение выходных дней при комнатной температуре. Смесь выливали в 1 г NaOH/вода. Слои разделяли. Водный слой экстрагировали CH2Cl2. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH от 100/0 до 90/10). Фракции продукта собирали и растворитель выпаривали. Выход: 0,749 г конечного соединения 5 (58%). Пример В 4. а. Получение конечного соединения 6. Смесь конечного соединения 2 (полученного по B1b) (0,005 моль), 4-(хлорфенилацетил)морфолина(0,005 моль) и Na2CO3 (0,01 моль) в MIK, аналитически чистый (р.а.) (125 мл) перемешивали и кипятили с обратным холодильником 18 ч с отделением воды. Реакционную смесь промывали водой, сушили,фильтровали и растворитель выпаривали. Остаток очищали на силикагеле на стеклянном фильтре (элюент: CH2Cl2/(CH3OH/NH3) 95/5). Фракции продукта собирали и растворитель выпаривали. Осадок суспендировали в DIPE, отфильтровывали и высушивали. Выход: 1,702 г конечного соединения 6.b. Получение конечного соединения 7.- 19009217 Смесь конечного соединения 2 (полученного по B1b) (0,0012 моль), 2-(хлорметил)-1 Нбензимидазола (0,0014 моль) и K2CO3 (0,0018 моль) в CH3CN (5 мл) перемешивали и кипятили с обратным холодильником 12 ч, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток обрабатывали CH2Cl2. Органический слой промывали H2O, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (0,95 г) очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 90/10/0,5; 15-40 мкм). Очищенные фракции собирали и растворитель выпаривали. Остаток (0,14 г) кристаллизовали из DIPE. Осадок отфильтровывали и высушивали. Выход: 0,087 г конечного соединения 7 (10%) (т. пл. 135C). с. Получение конечного соединения 8. К смеси конечного соединения 2 (полученного по B1b) (0,005 моль) и 2-(хлорметил)-6-метил-3 пиридинола (0,006 моль) в DMF (50 мл) добавляли N-метил-N-(1-метилэтил)пропанамин (0,02 моль). Реакционную смесь перемешивали при 65 С в течение ночи. Растворитель выпаривали. Остаток обрабатывали CH2Cl2 и промывали разбавленным раствором NH3. Отделенный органический слой сушили,фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: CH2Cl2/(МеОН/NH3) 95/5). Целевые фракции собирали и растворитель выпаривали. Осадок суспендировали в DIPE. Осадок отфильтровывали и высушивали. Выход: 1,423 г конечного соединения 8. Пример В 5. Получение конечного соединения 9. Смесь конечного соединения 2 (полученного по B1b) (0,003 моль) и 1-метил-1 Н-пиррол-2 карбоксальдегида (0,0046 моль) гидрировали при действии H2 при 50C в присутствии катализатора Pd/C 10% (1 г) и раствора тиофена (1 мл). После поглощения H2 (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/(MeOH/NH3) 97/3; 95/5). Фракции продукта собирали и растворитель выпаривали. Осадок суспендировали в петролейном эфире. Выход: 1,079 г конечного соединения 9. Пример В 6. Получение конечного соединения 10 и 11.[2,4(2R,4S)]=соединение 11 Смесь промежуточного соединения 2 (полученного по A1b) (0,005 моль), промежуточного соединения 11 (полученного по A3f) (0,005 моль) и Ti(OiPrO)4 (3 г) в метаноле (150 мл) гидрировали при 50C в токе N2 в присутствии катализатора Pd/C 10% (1 г) и раствора тиофена (1 мл). После поглощения H2(1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток обрабатывали H2O и CH2Cl2. Смесь перемешивали 10 мин и фильтровали через дикалит. Отделенный органический слой сушили,фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: CH2Cl2/(CH3OH/NH3) 97/3). Две фракции собирали и выпаривали из них растворитель. Выход: 0,53 г соединения 10 и 0,4 г соединения 11.- 20009217 Пример В 7. Получение конечного соединения 12. Смесь конечного соединения 2 (полученного по B1b) (0,001 моль) в CH2Cl2 (50 мл) и CDI (0,0015 моль) перемешивали в течение ночи. Реакционную смесь промывали разбавленным раствором NaOH,затем H2O, сушили и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 100/0 и 90/10). Фракции продукта собирали и растворитель выпаривали. Выход: 0,645 г конечного соединения 12. Пример В 8. Получение конечного соединения 13. Смесь промежуточного соединения 5 (полученного по А 2) (0,0015 моль) в HCl/2-пропаноле (5 мл) и метаноле (20 мл) перемешивали и кипятили с обратным холодильником в течение 1 ч. Реакционную смесь кристаллизовали, фильтровали и сушили. Выход: 0,43 г конечного соединения 13 (38%). Пример В 9. Получение конечного соединения 40. Смесь конечного соединения 31 (полученного по В 2) (0,065 ммоль), 4-пиридинилбороновой кислоты (0,09 ммоль), Pd(OAc)2 (0,015 ммоль), 1,3-бис-(дифенилфосфино)пропана (0,03 ммоль), Na2CO3, 2 М (1 мл) и DME (2 мл) перемешивали при 100C в течение 16 ч. Растворитель выпаривали, остаток обрабатывали H2O и экстрагировали CH2Cl2. Органический слой отделяли, сушили над MgSO4 и растворитель выпаривали. Остаток очищали колоночной хроматографией на кромазиле (градиент: CH2Cl2/CH3OH 95/5). Желаемые фракции собирали и растворитель выпаривали. Выход: 1 мг конечного соединения 40. Пример B10. Получение конечного соединения 85. Смесь конечного соединения 83 (полученного по В 2) (0,0004 моль), пирролидина (0,0006 моль),Pd2(dba)3 (0,00001 моль), BINAP (0,00003 моль) и натриевой соли 2-метил-2-пропанола (0,0006 моль) в толуоле (5 мл) перемешивали при 100C в течение 16 ч. Растворитель выпаривали, остаток обрабатывалиH2O и экстрагировали CH2Cl2. Органический слой отделяли, сушили над MgSO4 и растворитель выпаривали. Остаток очищали колоночной хроматографией на кромазиле (градиент: CH2Cl2/CH3OH 95/5). Желаемые фракции собирали и растворитель выпаривали. Выход: 0,119 г конечного соединения 85.- 21009217 Пример B11. Получение конечного соединения 43. Смесь конечного соединения 31 (полученного по В 2) (0,065 ммоль), имидазо(1,2-а)пиридина (0,09 ммоль), Pd(OAc)2 (0,015 ммоль), 1,3-бис-(дифенилфосфино)пропана (0,03 ммоль) и Cs2CO3 (0,09 ммоль) вH2O и экстрагировали CH2Cl2. Органический слой отделяли, сушили над MgSO4 и растворитель выпаривали. Остаток очищали колоночной хроматографией на кромазиле (градиент: CH2Cl2/CH3OH 95/5). Желаемые фракции собирали и растворитель выпаривали. Выход: 8 мг конечного соединения 43. Пример B12. Получение конечного соединения 44. Смесь соединения 31 (полученного по В 2) (0,065 ммоль), морфолина (0,2 ммоль), Pd(OAc)2 (0,015 ммоль) и 1,3-бис-(дифенилфосфино)пропана (0,03 ммоль) в диглиме (3 мл) в присутствии СО (1 атм) перемешивали при 150C в течение 16 ч. Растворитель выпаривали, остаток обрабатывали H2O и экстрагировали CH2Cl2. Органический слой отделяли, сушили над MgSO4 и растворитель выпаривали. Остаток очищали колоночной хроматографией на кромазиле (градиент: CH2Cl2/CH3OH 95/5). Желаемые фракции собирали и растворитель выпаривали. Выход: 3 мг конечного соединения 44. Пример B13. Получение конечного соединения 144. Смесь метилового эфира 4-[(4-ацетилокси)метил]-1,2,3-тиадиазол-5-карбоновой кислоты (0,001 моль), конечного соединения 2 (полученного по B1b) (0,002 моль), NaCN (20 мг) в метаноле (20 мл) перемешивали и кипятили с обратным холодильником в течение 20 ч. Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH от 100/0 до 80/20). Желаемые фракции собирали и растворитель выпаривали. Остаток суспендировали в петролейном эфире. Осадок отфильтровывали и высушивали. Выход: 0,110 г конечного соединения 144. Пример B14. Получение конечного соединения 130. Смесь конечного соединения 2 (полученного по B1b) (0,001 моль), димера гликолевого альдегида(0,001 моль) и 3-тиофенбороновой кислоты (0,001 моль) в 2,2,2-трифторэтаноле (5 мл) перемешивали при комнатной температуре в течение 18 ч. Затем добавляли раствор K2CO3 (10%) и смесь экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток (0,6 г) очищали хроматографически на колонке с силикагелем (CH2Cl2/MeOH/NH4OH 92/08/0,2) и фракции продукта концентрировали, получая 0,29 г (47%) конечного соединения 130. Пример B15. Получение конечного соединения 153. Смесь промежуточного соединения 12 (полученного по А 4) (0,00934 моль) и Et3N (0,02 моль) вCH2Cl2 (200 мл) перемешивали при охлаждении на бане со льдом, затем к реакционной смеси добавляли по каплям раствор 4-метил-1,2,3-тиадиазол-5-карбонилхлорида (0,00943 моль) в CH2Cl2 (20 мл) в течение 15 мин при 0C. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали 1 ч при комнатной температуре, затем добавляли NaOH (20 мл) и перемешивали еще 15 мин при комнатной температуре. Слои разделяли и водный слой экстрагировали CH2Cl2. Органический слой промывалиH2O, сушили над MgSO4, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH/(MeOH/NH3) от 100/0/0 до 90/10/0). Две фракции продукта собирали и из каждой выпаривали растворитель. Выход фракции 1: 1,260 г конечного соединения 153 (22%). Соединения, представленные в следующих таблицах, были получены аналогичными способами,описанными в вышеприведенных примерах B1-B15. Аналитические данные Для ряда соединений были определены температуры плавления, или ВЭЖХ данные, или оптическое вращение. Температуры плавления. По возможности температуры плавления (или интервалы) определялись на аппарате В-545 Bchi для определения температур плавления. Среда для нагревания представляет собой металлический блок. Плавление образца визуально наблюдают с помощью увеличивающих изображение линз и при сильном световом контрасте. Температуры плавления измеряют при температурном градиенте 3 или 10C/мин. Условия получения данных ВЭЖХ. ВЭЖХ-градиент обеспечивался системой Waters Alliance HT 2790 с комплектом колоночного нагревателя при 40C. Поток из колонки направлялся в детектор с фотодиодной матрицей (PDA) Water 996 и в масс-спектрометр Waters-Micromass ZQ с источником электрораспылительной ионизации, работающим по механизму положительной и отрицательной ионизации. Обращенная фаза ВЭЖХ выполнена на колонке Xterra MS C18 (3,5 мм, 4,6100 мм) при скорости потока 1,6 мл/мин. Три подвижных фазы (подвижная фаза А: 95% 25 мМ аммонийацетат + 5% ацетонитрил; подвижная фаза В: ацетонитрил; подвижная фаза С: метанол) были использованы для достижения градиентного состояния от 100% А до 50% В и 50% С в 6,5 мин, до 100% В в 1 мин, 100% В в течение 1 мин и восстановленного равновесия с 100% А в- 24009217 течение 1,5 мин. Использованный объем для инъекции составлял 10 мл. Масс-спектры были получены сканированием от 100 до 1000 в 1 с при использовании интервала в 0,1 с. Напряжение в капиллярных иглах составляло 3 кВ, и источник температуры поддерживали при 140C. Азот использовали в качестве газа-распылителя. Коническое напряжение составляло 10 В для положительной ионизации и 20 В для отрицательной ионизации. Полученные данные обработаны с помощью системы Waters-Micromass MassLynx-Openlynx. Оптическое вращение. Оптические вращения были зарегистрированы на поляриметре (Perkin Elmer) при 20C. Данные по
МПК / Метки
МПК: C07D 405/14, C07D 413/14, C07D 417/14, C07D 211/58, C07D 409/14, C07D 401/14, C07D 471/04
Метки: нейрокининовых, применение, антагонистов, 1,4-дипиперидин-4-илпиперазина, замещенные, качестве, производные
Код ссылки
<a href="https://eas.patents.su/30-9217-zameshhennye-proizvodnye-14-dipiperidin-4-ilpiperazina-i-ih-primenenie-v-kachestve-nejjrokininovyh-antagonistov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 1,4-дипиперидин-4-илпиперазина и их применение в качестве нейрокининовых антагонистов</a>
Предыдущий патент: Способы идентификации средств, модулирующих активность аспартилпротеазы asp2 человека
Следующий патент: Способ сжигания с низким выделением soxдисперсии тяжелых нефтяных остатков в воде
Случайный патент: Способ, устройство и система аутентификации личности владельца смарт-карты или паспорта, смарт-карта и электронный паспорт












