4-замещённые бензимидазолы и их применение в качестве ингибиторов желудочной секреции
Номер патента: 8779
Опубликовано: 31.08.2007
Авторы: Циммерманн Петер Ян, Зенн-Билфингер Йёрг, Бур Вильм, Зимон Вольфганг-Александер, Пальмер Андреас, Кромер Вольфганг, Хиеза Витториа, Брем Кристоф, Постиус Штефан, Грундлер Герхард
Формула / Реферат
1. Соединение формулы 1
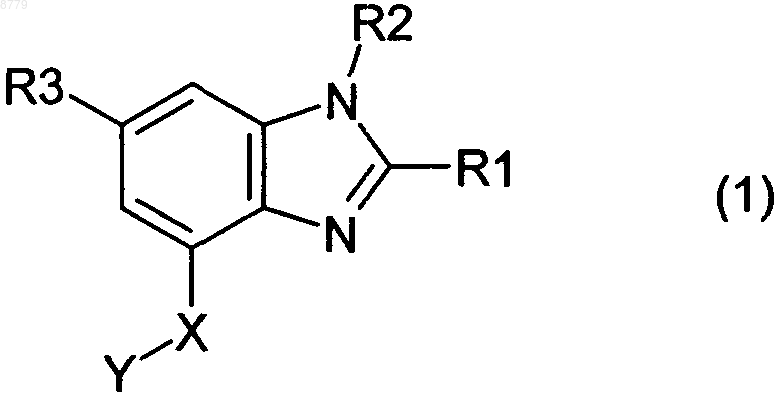
в котором
R1 представляет собой водород, C1-4-алкил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил, C1-4-алкокси, C1-4-алкокси-C1-4-алкил, C1-4-алкоксикарбонил, С2-4-алкенил, С2-4-алкинил, фтор-C1-4-алкил, гидрокси-C1-4-алкил, моно- или ди-C1-4-алкиламино или С1-4-алкилкарбонилокси-С1-4-алкил,
R2 представляет собой водород, C1-4-алкил, арил, С3-7-циклоалкил, С3-7-циклоалкил-С1-4-алкил, C1-4-алкоксикарбонил, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонил, гидрокси-C1-4-алкил, фтор-С2-4-алкил, арил-C1-4-алкокси-C1-4-алкил, гидрокси или C1-4-алкокси,
R3 представляет собой водород, галоген, фтор-С1-4-алкил, карбоксил, -СО-С1-4-алкокси, гидрокси-C1-4-алкил, С1-4-алкокси-С1-4-алкил, C1-4-алкокси-C1-4-алкокси-C1-4-алкил, фтор-C1-4-алкокси-С1-4-алкил, циано, группу -СО-NR31R32, группу SO2-NR31R32 или группу Het, где
R31 представляет собой водород, гидроксил, C1-7-алкил, гидрокси-C1-4-алкил, С1-4-алкокси-С1-4-алкил или С3-7-циклоалкил, амино и
R32 представляет собой водород, С1-7-алкил, гидрокси-С1-4-алкил или C1-4-алкокси-C1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу и
Het представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, где
R33 представляет собой водород, С1-4-алкил, гидрокси-С1-4-алкил, С1-4-алкокси, С2-4-алкенилокси, C1-4-алкилкарбонил, карбокси, С1-4-алкоксикарбонил, карбокси-C1-4-алкил, С1-4-алкоксикарбонил-С1-4-алкил, галоген, гидрокси, арил, арил-C1-4-алкил, арилокси, арил-С1-4-алкокси, трифторметил, нитро, амино, моно- или ди-С1-4-алкиламино, C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, C1-4-алкокси-C1-4-алкоксикарбониламино или сульфонил,
R34 представляет собой водород, C1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R35 представляет собой водород, C1-4-алкил, С1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
X представляет собой О (кислород) или NH и
Y имеет значение -СН2-Ar, где
Ar представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 и R7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила, 1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила, изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, или
Y обозначает группу gp
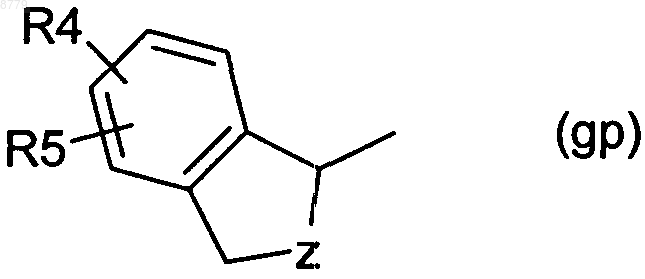
где Z имеет значение -CHR8- или -CHR8-CHR9-,
где в Ar и/или в группе gp
R4 представляет собой водород, C1-4-алкил, гидрокси-С1-4-алкил, C1-4-алкокси, С2-4-алкенилокси, C1-4-алкилкарбонил, карбокси, C1-4-алкоксикарбонил, карбокси-C1-4-алкил, C1-4-алкоксикарбонил-C1-4-алкил, галоген, гидрокси, арил, арил-С1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-C1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, C1-4-алкокси-C1-4-алкоксикарбониламино или сульфонил,
R5 представляет собой водород, C1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R6 представляет собой водород, С1-4-алкил или галоген и
R7 представляет собой водород, С1-4-алкил или галоген,
R8 представляет собой водород, C1-7-алкил, С2-7-алкенил, гидроксил, C1-4-алкокси, оксозамещенный C1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси, гидрокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси, C1-4-алкокси-С1-4-алкокси-C1-4-алкокси, С3-7-циклоалкокси-C1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-С1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-С1-4-алкиламино-С1-4-алкилкарбонилокси, С1-4-алкокси-С1-4-алкоксикарбониламино или С1-4-алкокси-С1-4-алкилкарбонилокси,
R9 представляет собой водород, С1-7-алкил, С2-7-алкенил, гидроксил, C1-4-алкокси, оксозамещенный C1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси, гидрокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси, C1-4-алкокси-С1-4-алкокси-С1-4-алкокси, С3-7-циклоалкокси-С1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-С1-4-алкокси, C1-4-алкилкарбонилокси, галоген-С1-4-алкокси, амино, моно- или ди-С1-4-алкиламино, C1-4-алкилкарбониламино, С1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, С1-4-алкокси-С1-4-алкоксикарбониламино или С1-4-алкокси-С1-4-алкилкарбонилокси и где
арил представляет собой фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями из группы С1-4-алкила, C1-4-алкокси, карбокси, С1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,
при условии, что R3 не представляет собой водород или галоген, когда Y обозначает -СН2-Ar и R2 обозначает водород, C1-4-алкил или С3-7-циклоалкил-С1-4-алкил,
или его соль.
2. Соединение по п.1, в котором
R1 представляет собой водород, С1-4-алкил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил, C1-4-алкокси, C1-4-алкокси-С1-4-алкил, C1-4-алкоксикарбонил, С2-4-алкенил, С2-4-алкинил, фтор-C1-4-алкил или гидрокси-C1-4-алкил,
R2 представляет собой водород, С1-4-алкил, арил, С3-7-циклоалкил, С3-7-циклоалкил-С1-4-алкил, С1-4-алкоксикарбонил, моно- или ди-C1-4-алкиламино-С1-4-алкилкарбонил, гидрокси-C1-4-алкил или фтор-С2-4-алкил,
R3 представляет собой водород, галоген, фтор-C1-4-алкил, карбоксил, -СО-C1-4-алкокси, гидрокси-C1-4-алкил, С1-4-алкокси-C1-4-алкил, C1-4-алкокси-C1-4-алкокси-C1-4-алкил, фтор-C1-4-алкокси-C1-4-алкил или группу -СО-NR31R32, где
R31 представляет собой водород, гидроксил, С1-4-алкил, гидрокси-C1-4-алъшы или C1-4-алкокси-C1-4-алкил,
R32 представляет собой водород, С1-4-алкил, гидрокси-C1-4-алкил или C1-4-алкокси-C1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино или морфолиногруппу,
X представляет собой О (кислород) или NH и
Y имеет значение -СН2-Ar, где
Ar представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 и R7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила, 1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила, изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, или
Y обозначает группу gp
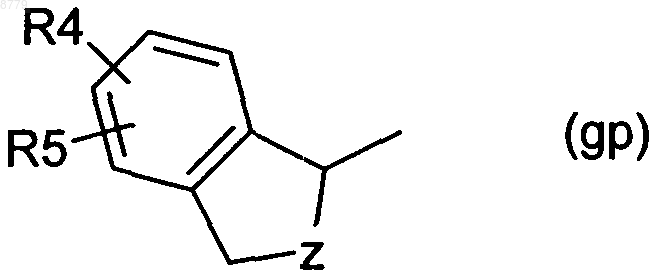
где Z имеет значение -CHR8- или -CHR8-CHR9-,
где в Ar и/или в группе gp
R4 представляет собой водород, C1-4-алкил, гидрокси-С1-4-алкил, C1-4-алкокси, С2-4-алкенилокси, C1-4-алкилкарбонил, карбокси, C1-4-алкоксикарбонил, карбокси-C1-4-алкил, С1-4-алкоксикарбонил-С1-4-алкил, галоген, гидрокси, арил, арил-С1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-С1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, С1-4-алкокси-С1-4-алкоксикарбониламино или сульфонил,
R5 представляет собой водород, C1-4-алкил, С1-4-алкокси, С1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R6 представляет собой водород, C1-4-алкил или галоген и
R7 представляет собой водород, C1-4-алкил или галоген,
R8 представляет собой водород, C1-7-алкил, С2-7-алкенил, гидроксил, С1-4-алкокси, оксозамещенный C1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-C1-4-алкокси, гидрокси-C1-4-алкокси, C1-4-алкокси-C1-4-алкокси, C1-4-алкокси-С1-4-алкокси-С1-4-алкокси, С3-7-циклоалкокси-С1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-С1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-С1-4-алкиламино-C1-4-алкилкарбонилокси или C1-4-алкокси-С1-4-алкоксикарбониламино,
R9 представляет собой водород, С1-7-алкил, С2-7-алкенил, гидроксил, C1-4-алкокси, оксозамещенный C1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-C1-4-алкокси, гидрокси-C1-4-алкокси, С1-4-алкокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси-С1-4-алкокси, С3-7-циклоалкокси-C1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-С1-4-алкиламино, C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси или С1-4-алкокси-С1-4-алкоксикарбониламино и где
арил представляет собой фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, С1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,
при условии, что R3 не представляет собой водород или галоген, когда Y обозначает -СН2-Ar,
или его соль.
3. Соединение по п.1 формулы 1а
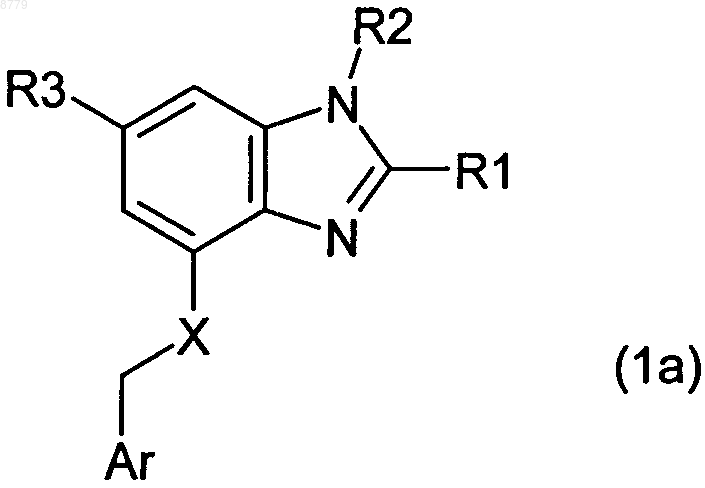
в котором
R1 представляет собой водород, С1-4-алкил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил, C1-4-алкокси, C1-4-алкокси- C1-4-алкил, С1-4-алкоксикарбонил, С2-4-алкенил, С2-4-алкинил, фтор-С1-4-алкил, гидрокси-C1-4-алкил, моно- или ди-С1-4-алкиламино или С1-4-алкилкарбонилокси-С1-4-алкил,
R2 представляет собой водород, С1-4-алкил, арил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил, C1-4-алкоксикарбонил, моно- или ди-C1-4-алкиламино-С1-4-алкилкарбонил, гидрокси-С1-4-алкил, фтор-С2-4-алкил, арил-C1-4-алкокси-С1-4-алкил, гидрокси или C1-4-алкокси,
R3 представляет собой водород, галоген, фтор-C1-4-алкил, карбоксил, -СО-C1-4-алкокси, гидрокси-С1-4-алкил, С1-4-алкокси-C1-4-алкил, C1-4-алкокси-C1-4-алкокси-C1-4-алкил, фтор-С1-4-алкокси-С1-4-алкил, циано, группу -СО-NR31R32, группу SO2-NR31R32 или группу Het, где
R31 представляет собой водород, гидроксил, С1-7-алкил, гидрокси-С1-4-алкил, C1-4-алкокси-C1-4-алкил или С3-7-циклоалкил, амино и
R32 представляет собой водород, С1-4-алкил, гидрокси-С1-4-алкил или C1-4-алкокси-С1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-С1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу и
Het представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, где
R33 представляет собой водород, C1-4-алкил, гидрокси-С1-4-алкил, С1-4-алкокси, С2-4-алкенилокси, С1-4-алкилкарбонил, карбокси, С1-4-алкоксикарбонил, карбокси-С1-4-алкил, С1-4-алкоксикарбонил-С1-4-алкил, галоген, гидрокси, арил, арил-C1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-C1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, С1-4-алкокси-С1-4-алкоксикарбониламино или сульфонил,
R34 представляет собой водород, C1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R35 представляет собой водород, C1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
X представляет собой О (кислород) или NH и
Ar представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 и R7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила, 1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила, изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, где
R4 представляет собой водород, С1-4-алкил, гидрокси-C1-4-алкил, C1-4-алкокси, С2-4-алкенилокси, C1-4-алкилкарбонил, карбокси, C1-4-алкоксикарбонил, карбокси-C1-4-алкил, C1-4-алкоксикарбонил-С1-4-алкил, галоген, гидрокси, арил, арил-C1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-С1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламиэю, С1-4-алкокси-С1-4-алкоксикарбониламино или сульфонил,
R5 представляет собой водород, C1-4-алкил, С1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R6 представляет собой водород, С1-4-алкил или галоген и
R7 представляет собой водород, C1-4-алкил или галоген и где
арил представляет собой фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями из группы С1-4-алкила, С1-4-алкокси, карбокси, C1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,
при условии, что R3 не представляет собой водород или галоген, когда Y обозначает -СН2-Ar и R2 обозначает водород, С1-4-алкил или С3-7-циклоалкил-С1-4-алкил,
или его соль.
4. Соединение по п.1 формулы 1b
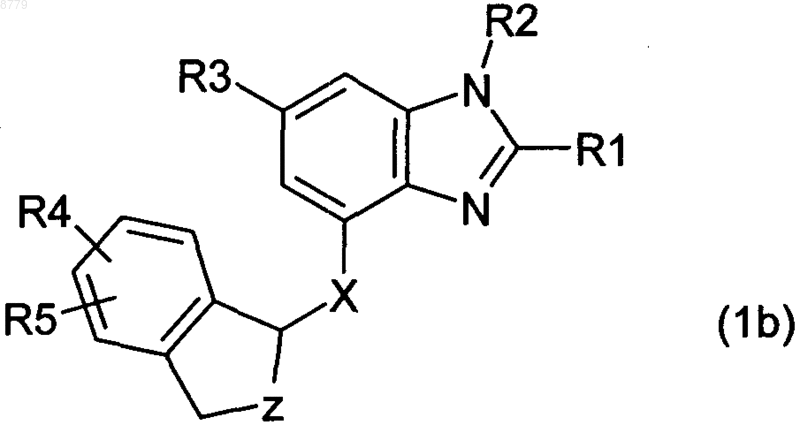
в котором
R1 представляет собой водород, С1-4-алкил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил, C1-4-алкокси, C1-4-алкокси-C1-4-алкил, C1-4-алкоксикарбонил, С2-4-алкенил, С2-4-алкинил, фтор-С1-4-алкил, гидрокси-С1-4-алкил, моно- или ди-C1-4-алкиламино или С1-4-алкилкарбонилокси-С1-4-алкил,
R2 представляет собой водород, С1-4-алкил, арил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил, C1-4-алкоксикарбонил, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонил, гидрокси-С1-4-алкил, фтор-С2-4-алкил, арил-C1-4-алкокси-С1-4-алкил, гидрокси или C1-4-алкокси,
R3 представляет собой водород, галоген, фтор-С1-4-алкил, карбоксил, -СО-С1-4-алкокси, гидрокси-С1-4-алкил, С1-4-алкокси-C1-4-алкил, С1-4-алкокси-С1-4-алкокси-C1-4-алкил, фтор-С1-4-алкокси-С1-4-алкил, циано, группу-СО-NR31R32, группу SO2-NR31R32 или группу Het, где
R31 представляет собой водород, гидроксил, С1-7-алкил, гидрокси-С1-4-алкил, С1-4-алкокси-С1-4-алкил или С3-7-циклоалкил, амино и
R32 представляет собой водород, С1-7-алкил, гидрокси-С1-4-алкил или C1-4-алкокси-С1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу и
Het представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, где
R33 представляет собой водород, С1-4-алкил, гидрокси-C1-4-алкил, С1-4-алкокси, С2-4-алкенилокси, C1-4-алкилкарбонил, карбокси, C1-4-алкоксикарбонил, карбокси-C1-4-алкил, С1-4-алкоксикарбонил-C1-4-алкил, галоген, гидрокси, арил, арил-С1-4-алкил, арилокси, арил-С1-4-алкокси, трифторметил, нитро, амино, моно- или ди-C1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, C1-4-алкокси-С1-4-алкоксикарбониламино или сульфонил,
R34 представляет собой водород, С1-4-алкил, С1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R35 представляет собой водород, C1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
R4 представляет собой водород, С1-4-алкил, гидрокси-С1-4-алкил, С1-4-алкокси, С2-4-алкенилокси, C1-4-алкилкарбонил, карбокси, С1-4-алкоксикарбонил, карбокси-C1-4-алкил, С1-4-алкоксикарбонил-C1-4-алкил, галоген, гидрокси, арил, арил-C1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-С1-4-алкиламино, C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, С1-4-алкокси-С1-4-алкоксикарбониламино или сульфонил,
R5 представляет собой водород, С1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,
X представляет собой О (кислород) или NH и
Z имеет значение -CHR8- или -CHR8-CHR9-, где
R8 представляет собой водород, С1-7-алкил, С2-7-алкенил, гидроксил, С1-4-алкокси, оксозамещенный С1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси, гидрокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси, C1-4-алкокси-С1-4-алкокси-С1-4-алкокси, С3-7-циклоалкокси-С1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-С1-4-алкилкарбонилокси, C1-4-алкокси-C1-4-алкоксикарбониламино или С1-4-алкокси-С1-4-алкилкарбонилокси,
R9 представляет собой водород, С1-7-алкил, С2-7-алкенил, гидроксил, С1-4-алкокси, оксозамещенный С1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4алкокси, гидрокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси-С1-4-алкокси, С3-7-циклоалкокси-С1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, С1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, С1-4-алкокси-С1-4-алкоксикарбониламино или С1-4-алкокси-С1-4-алкилкарбонилокси и где
арил представляет собой фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями из группы С1-4-алкила, С1-4-алкокси, карбокси, С1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,
или его соль.
5. Соединение формулы 1а по п.3 формулы 1а-1
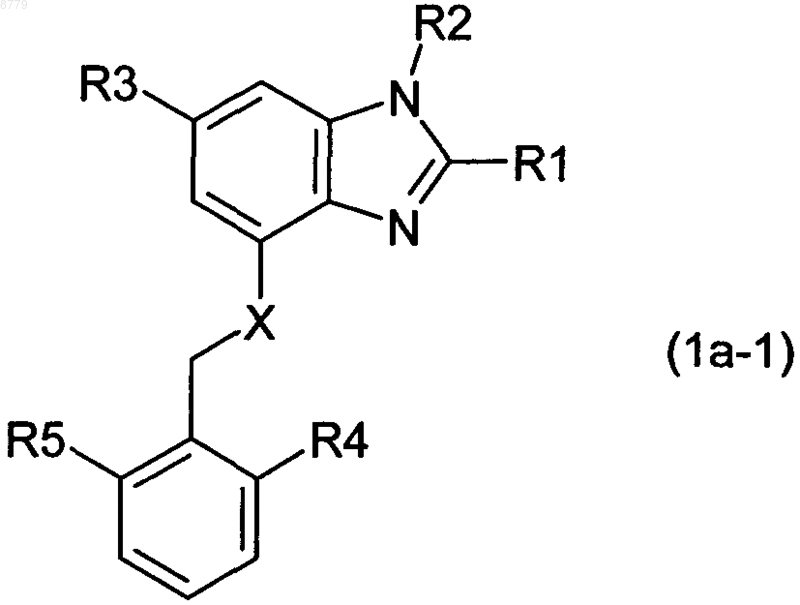
где
R1 представляет собой водород, С1-4-алкил, С3-7-циклоалкил, гидрокси-С1-4-алкил или С1-4-алкокси-C1-4-алкил,
R2 представляет собой водород, C1-4-алкил, гидрокси, C1-4-алкокси или арил-C1-4-алкокси-С1-4-алкил,
R3 представляет собой карбоксил, -СО-С1-4-алкокси, гидрокси-С1-4-алкил, C1-4-алкокси-С1-4-алкил, циано, группу -CO-NR31R32, группу SO2-NR31R32 или группу Het, где
R31 представляет собой водород, C1-7-алкил, гидрокси-С1-4-алкил, С1-4-алкокси-С1-4-алкил, С3-7-циклоалкил или амино и
R32 представляет собой водород или С1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-С1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу и
Het представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола и дигидроимидазола, где
R33 представляет собой водород или C1-4-алкил,
R34 представляет собой водород или C1-4-алкил
R35 представляет собой водород или С1-4-алкил,
R4 представляет собой водород, C1-4-алкил, гидрокси-C1-4-алкил, C1-4-алкокси, C1-4-алкоксикарбонил, трифторметил, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, С1-4-алкоксикарбониламино или С1-4-алкокси-C1-4-алкоксикарбониламино,
R5 представляет собой водород, С1-4-алкил или C1-4-алкокси и
X представляет собой О (кислород) или NH,
или его соль.
6. Соединение формулы 1b по п.4 формулы 1b-1
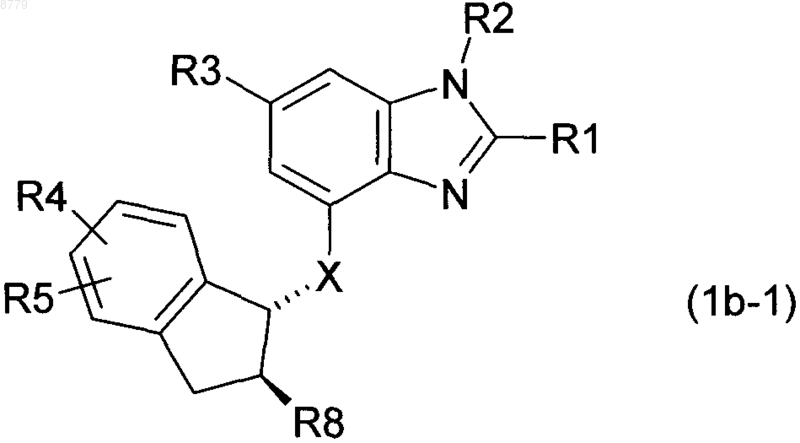
в котором
R1 представляет собой С1-4-алкил или С3-7-циклоалкил,
R2 представляет собой водород или С1-4-алкил,
R3 представляет собой карбоксил, -СО-С1-4-алкокси, С1-4-алкокси-С1-4-алкил, С1-4-алкокси-С1-4-алкокси-C1-4-алкил или группу -CO-NR31R32, где
R31 представляет собой водород, С1-7-алкил, гидрокси-С1-4-алкил, С1-4-алкокси-C1-4-алкил или С3-7-циклоалкил и
R32 представляет собой водород, С1-7-алкил, гидрокси-C1-4-алкил или C1-4-алкокси-С1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,
R4 представляет собой водород, С1-4-алкил, C1-4-алкокси или галоген,
R5 представляет собой водород или С1-4-алкил,
R8 представляет собой гидроксил, С1-4-алкокси, оксозамещенный C1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-C1-4-алкокси, гидрокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси, С1-4-алкокси-С1-4-алкокси-С1-4-алкокси, С3-7-циклоалкокси-C1-4-алкокси, С3-7-циклоалкил-C1-4-алкокси-С1-4-алкокси, С1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-С1-4-алкиламино, С1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, С1-4-алкокси-С1-4-алкоксикарбониламино или C1-4-алкокси-С1-4-алкилкарбонилокси,
X представляет собой О (кислород) или NH,
или его соль.
7. Соединение формулы 1b-1 по п.6, в котором
R1 представляет собой С1-4-алкил,
R2 представляет собой водород или С1-4-алкил,
R3 представляет собой карбоксил, -CO-C1-4-алкокси, С1-4-алкокси-С1-4-алкил, C1-4-алкокси-C1-4-алкокси-C1-4-алкил или группу -CO-NR31R32, где
R31 представляет собой водород, С1-7-алкил, гидрокси-С1-4-алкил, C1-4-алкокси-С1-4-алкил или С3-7-циклоалкил и
R32 представляет собой водород, С1-4-алкил, гидрокси-С1-4-алкил или C1-4-алкокси-С1-4-алкил или где
R31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-С1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,
R4 представляет собой водород, С1-4-алкил, С1-4-алкокси или галоген,
R5 представляет собой водород,
R8 представляет собой гидроксил, С1-4-алкокси, оксозамещенный С1-4-алкокси, С3-7-циклоалкокси, С3-7-циклоалкил-C1-4-алкокси, гидрокси-C1-4-алкокси, С1-4-алкокси-С1-4-алкокси, С1-4-алкокси-C1-4-алкокси-C1-4-алкокси, С3-7-циклоалкокси-С1-4-алкокси, С3-7-циклоалкил-С1-4-алкокси-С1-4-алкокси, С1-4-алкилкарбонилокси, галоген-С1-4-алкокси, амино, моно- или ди-С1-4-алкиламино, C1-4-алкилкарбониламино, С1-4-алкоксикарбониламино, моно- или ди-С1-4-алкиламино-С1-4-алкилкарбонилокси, С1-4-алкокси-С1-4-алкоксикарбониламино или C1-4-алкокси-C1-4-алкилкарбонилокси,
X представляет собой О (кислород) или NH,
или его соль.
8. Соединение формулы 1а-1 по п.5, в котором
R1 представляет собой С1-4-алкил,
R2 представляет собой С1-4-алкил,
R3 представляет собой карбоксил, -CO-C1-4-алкокси, С1-4-алкокси-С1-4-алкил или группу -CO-NR31R32, где
R31 представляет собой водород, С1-4-алкил, гидрокси-С1-4-алкил, С1-4алкокси-С1-4-алкил или С3-7-циклоалкил и
R32 представляет собой водород или С1-4-алкил,
R4 представляет собой C1-4-алкил или С1-4-алкилкарбониламино,
R5 представляет собой С1-4-алкил,
X представляет собой О (кислород) или NH,
или его соль.
9. Соединение формулы 1 по п.1, выбранное из группы, включающей
метил-4-(2-этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
4-(2-этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
метил-4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
4-бензилокси-6-гидроксиметил-1,2-диметил-1H-бензимидазол,
4-бензилокси-6-метоксиметил-1,2-диметил-1H-бензимидазол,
4-бензилокси-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол,
4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-[(1S,2S)-2,3-дигидро-2-гидрокси-1-инденилокси]-6-(N,N-этилдиметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-(транс-2,3-дигидро-2-метокси-1-инденилокси)-6-(N,N-этилдиметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-[транс-2,3-дигидро-2-(метоксиметилкарбонилокси)-1-инденилокси]-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-метоксиметил-1,2-диметил-1H-бензимидазол,
этил 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
этил 4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
этил 4-(транс-2,3-дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
4-(транс-2,3-дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
4-(транс-2,3-дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-6-[(1-пирролидино)карбонил]-1H-бензимидазол,
4-(транё-2,3-дигидро-2-гидрокси-1-инденилокси)-6-[N-(2-метоксиэтил)-N-метиламинокарбонил]-1,2-диметил-1H-бензимидазол,
4-(трас-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-6-[(1-пиперидино)карбонил]-1H-бензимидазол,
6-(циклопропиламинокарбонил)-4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол,
этил 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
этил 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксилат,
этил 4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1Н-бензимидазол-6-карбоксилат,
этил 4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1Н-бензимидазол-6-карбоксилат,
4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновую кислоту,
4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол-6-карбоновую кислоту,
4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол-6-карбоновую кислоту,
4-(2-этил-6-метилбензиламино)-6-(2-гидроксиэтиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-6-(2-гидроксиэтиламинокарбонил)-1,2-диметил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-6-(2-гидроксиэтиламинокарбонил)-2-метоксиметил-1-метил-1H-бензимидазол,
4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксамид,
4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксамид,
4-(2-этил-6-метилбензиламино)-1,2-диметил-6-(пирролидинокарбонил)-1H-бензимидазол,
4-(2-этил-6-метилбензиламино)-1,2-диметил-6-(морфолинокарбонил)-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол,
гидрохлорид 6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-1-метил-1H-бензимидазола,
6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
6-(1-азетидинокарбонил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
1-бензилоксиметил-6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-метоксикарбониламино-6-метилбензиламино)-1,2-диметил-1H-бензимидазол,
4-(транс-2,3-дигидро-2-гидрокси-1-индениламино)-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол,
этил 4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилат,
метил-4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилат,
6-(1-азиридинилкарбонил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-1,2-диметил-6-(N-метиламинокарбонил)-1H-бензимидазол,
4-(2,6-диметилбензиламино)-6-(N-2-гидроксиэтил-N-метиламинокарбонил)-1,2-диметил-1H-бензимидазол,
гидразид 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты,
4-(2,6-диметилбензиламино)-6-гидроксиметил-1,2-диметил-1H-бензимидазол,
2-циклопропил-4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1-метил-1H-бензимидазол-6-карбоновую кислоту,
2-циклопропил-4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-1,2-диметил-4-(2-метилбензиламино)-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2,4-диметилфуран-3-ил-метиламино)-1,2-диметил-1H-бензимидазол,
диметиламид 7-(2,6-диметилбензиламино)-2,3-диметил-3H-бензимидазол-5-сульфоновой кислоты,
этил 1-бензилоксиметил-4-(2,6-диметилбензиламино)-2-метил-1Н-бензимидазол-6-карбоксилат,
1-бензилоксиметил-4-(2,6-диметилбензиламино)-2-метил-1H-бензимидазол-6-карбоновую кислоту,
1-бензилоксиметил-6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-2-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-2-метил-1H-бензимидазол,
1-бензилоксиметил-6-(N-метиламинокарбонил)-4-(2,6-диметилбензиламино)-2-метил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-6-(N-метиламинокарбонил)-2-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-гидроксиметил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол,
6-циано-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
6-(4,5-дигидро-1H-имидазол-2-ил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
6-(4,5-дигидро-1-метил-1H-имидазол-2-ил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
6-(4,5-дигидрооксазол-2-ил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-N-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксамидин,
6-бром-4-(2,6-диметилбензиламино)-1-гидрокси-2-метил-1H-бензимидазол,
6-бром-4-(2,6-диметилбензиламино)-1-метокси-2-метил-1H-бензимидазол,
этил 4-(2,6-диметилбензиламино)-1-метокси-2-метил-1H-бензимидазол-6-карбоксилат,
4-(2,6-диметилбензиламино)-1-метокси-2-метил-1H-бензимидазол-6-карбоновую кислоту,
6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-1-метокси-2-метил-1Н-бензимидазол,
2-ацетоксиметил-6-бром-4-(2,6-диметилбензиламино)-1-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-2-гидроксиметил-1-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-гидроксиметил-1-метил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-6-(5-этил[1,3,4]оксадиазол-2-ил)-1,2-диметил-1H-бензимидазол,
4-(2,6-диметилбензиламино)-6-(5-метил[1,3,4]оксадиазол-2-ил)-1,2-диметил-1H-бензимидазол,
этил 4-бензилокси-2-циклопропил-1-метил-1H-бензимидазол-6-карбоксилат,
6-(N,N-диметиламинокарбонил)-2-(N,N-диметиламино)-4-(2,6-диметилбензиламино)-1-метил-1H-бензимидазол,
6-(N,N-диметиламинокарбонил)-2-(N,N-диметиламино)-4-(2-этил-6-метилбензиламино)-1-метил-1H-бензимидазол
и его соли.
10. Соединение 6-(N,N-диметиламинокарбонил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол или его соль.
11. Лекарственное средство, включающее соединение по п.1 и/или его фармакологически приемлемую соль вместе с обычными фармацевтическими добавками и/или эксципиентами.
12. Применение соединения по п.1 и его фармакологически приемлемых солей для профилактики и лечения желудочно-кишечных заболеваний.
Текст
008779 Область техники Данное изобретение относится к новым соединениям, которые могут использоваться в фармацевтической промышленности в качестве активных соединений для получения лекарственных средств. Уровень техники В ЕР 266326 (который соответствует US 5106862) описаны производные бензимидазола с очень широким рядом заместителей, которые являются активными в качестве противоязвенных агентов. ЗаявкаWO 97/47603 (которая соответствует US 6465505) раскрывает производные бензимидазола, замещенные 2,6-диалкилфенильной группой, которые являются эффективными в качестве ингибиторов H+,K+АТФазы. Раскрытие изобретения Настоящее изобретение относится к соединениям формулы 1R31 и R32 вместе, включая атом азота, с которым они связаны, представляют собой пирролидино,пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу иHet представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранными из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, гдеAr представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 иR7, которые выбраны из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила,1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила,изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, илиC1-4-алкокси, С 3-7-циклоалкокси, С 3-7-циклоалкил-C1-4-алкокси, гидрокси-C1-4-алкокси, C1-4-алкокси-C1-4 алкокси, C1-4-алкокси-C1-4-алкокси-C1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино,C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, C1-4-алкокси-C1-4-алкоксикарбониламино или C1-4-алкокси-C1-4-алкилкарбонилокси и где арил представляет собой фенил или фенил, замещенный одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, C1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,при условии, что R3 не представляет собой водород или галоген, когда Y обозначает -СН 2-Ar и R2 обозначает водород, C1-4-алкил или С 3-7-циклоалкил-C1-4-алкил,и солям этих соединений.C1-4-Алкил представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Примерами являются бутильная, изобутильная, втор-бутильная, трет-бутильная, пропильная, изопропильная, этильная и метильная группы. С 3-7-Циклоалкил представляет собой циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, из которых циклопропил, циклобутил и циклопентил являются предпочтительными. С 3-7-Циклоалкил-C1-4-алкил представляет собой одну из указанных выше C1-4-алкильных групп, которая замещена одной из указанных выше С 3-7-циклоалкильных групп. Примерами являются циклопропилметильная, циклогексилметильная и циклогексилэтильная группы.C1-4-Алкокси представляет собой группы, которые кроме атома кислорода содержат линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Примерами являются бутокси,изобутокси, втор-бутокси, трет-бутокси, пропокси, изопропокси и предпочтительно этокси и метоксигруппы.C1-4-Алкокси-C1-4-алкил представляет собой одну из указанных выше C1-4-алкильных групп, которая замещена одной из указанных выше C1-4-алкоксигрупп. Примерами являются метоксиметильная, метоксиэтильная группа и бутоксиэтильная группы.C1-4-Алкоксикарбонил (-CO-C1-4-алкокси) представляет собой карбонильную группу, с которой связана одна из указанных выше C1-4-алкоксигрупп. Примерами являются метоксикарбонильная (СН 3 ОС(О)-) и этоксикарбонильная группы (СН 3 СН 2O-С(O)-). С 2-4-Алкенил представляет собой линейную или разветвленную алкенильную группу, имеющую от 2 до 4 атомов углерода. Примерами являются 2-бутенильная, 3-бутенильная, 1-пропенильная и 2-пропенильная группы (аллильная группа). С 2-4-Алкинил представляет собой линейную или разветвленную алкинильную группу, имеющую от 2 до 4 атомов углерода. Примерами являются 2-бутинильная, 3-бутинильная и предпочтительно 2-пропинильная группы (пропаргильная группа). Фтор-C1-4-алкил представляет собой одну из указанных выше C1-4-алкильных групп, которая замещена одним или несколькими атомами фтора. Примером является трифторметильная группа. Гидрокси-C1-4-алкил представляет собой указанные выше C1-4-алкильные группы, которые замещены гидроксигруппой. Примерами являются гидроксиметильная, 2-гидроксиэтильная и 3-гидроксипропильная группы.C1-4-Алкилкарбонил представляет собой группу, которая кроме карбонильной группы содержит одну из указанных выше C1-4-алкильных групп. Примером является ацетильная группа. Моно- или ди-C1-4-алкиламино представляет собой аминогруппу, которая замещена одной или двумя одинаковыми или различными группами из указанных выше C1-4-алкильных групп. Примерами являются диметиламино, диэтиламино и диизопропиламиногруппы. Моно- или ди-С 1-4-алкиламино-C1-4-алкилкарбонил представляет собой С 1-4-алкилкарбонильную группу, которая замещена моно- или ди-C1-4-алкиламиногруппами. Примерами являются диметиламинометилкарбонильная и диметиламиноэтилкарбонильная группы. Фтор-С 2-4-алкил представляет собой С 2-4-алкильные группы, которые замещены одним или несколькими атомами фтора. Примером является 2,2,2-трифторэтильная группа.-2 008779 Арил-C1-4-алкокси обозначает арилзамещенный C1-4-алкоксирадикал. Примером является радикал бензилокси. Арил-C1-4-алкокси-C1-4-алкил обозначает одну из указанных выше C1-4-алкильных групп, которая замещена одним из указанных выше арил-C1-4-алкоксирадикалов. Примером является бензилоксиметильный радикал. Галоген в настоящем изобретении представляет собой бром, хлор и фтор.C1-4-Алкокси-C1-4-алкокси представляет собой одну из указанных выше C1-4-алкоксигрупп, которая замещена другой C1-4-алкоксигруппой. Примерами являются группы 2-(метокси)этокси (СН 3-О-СН 2-СН 2 О-) и 2-(этокси)этокси (СН 3-СН 2-O-СН 2-СН 2-О-).C1-4-Алкокси-C1-4-алкокси-C1-4-алкил представляет собой одну из указанных выше C1-4-алкокси-C1-4 алкильных групп, которая замещена одной из указанных выше C1-4-алкоксигрупп. Примером является группа 2-(метокси)этоксиметил (СН 3-О-СН 2-СН 2-О-СН 2-). Фтор-C1-4-алкокси-C1-4-алкил представляет собой одну из указанных выше C1-4-алкильных групп,которая замещена фтор-C1-4-алкоксигруппой. Фтор-C1-4-алкокси в этом случае представляет собой одну из указанных выше C1-4-алкоксигрупп, которая полностью или почти полностью замещена фтором. Примерами полностью или почти полностью фторзамещенных C1-4-алкоксигрупп являются 1,1,1,3,3,3-гексафтор-2-пропокси, 2-трифторметил-2-пропокси, 1,1,1-трифтор-2-пропокси, перфтор-трет-бутокси, 2,2,3,3,4,4,4 гептафтор-1-бутокси, 4,4,4-трифтор-1-бутокси, 2,2,3,3,3-пентафторпропокси, перфторэтокси, 1,2,2-трифторэтокси, особенно 1,1,2,2-тетрафторэтокси, 2,2,2-трифторэтокси, трифторметокси и предпочтительно дифторметоксигруппы. С 1-7-Алкил представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 7 атомов углерода. Примерами являются гептил, изогептил (5-метилгексил), гексил, изогексил (4-метилпентил), неогексил (3,3-диметилбутил), пентил, изопентил (3-метилбутил), неопентил (2,2-диметилпропил), бутил, изобутил, втор-бутил, трет-бутил, пропил, изопропил, этил и метил. С 2-4-Алкенилокси представляет собой группы, которые кроме атома кислорода содержат одну из указанных выше С 2-4-алкенильных групп. Примерами являются 2-бутенилокси, 3-бутенилокси, 1 пропенилокси и 2-пропенилоксигруппы (аллилоксигруппа). Карбокси-C1-4-алкил представляет собой C1-4-алкильную группу, которая замещена карбоксильной группой. Примерами являются карбоксиметильная и 2-карбоксиэтильная группы.C1-4-Алкоксикарбонил-C1-4-алкил представляет собой C1-4-алкильную группу, которая замещена одной из указанных выше C1-4-алкоксикарбонильных групп. Примерами являются метоксикарбонилметильная и этоксикарбонилметильная группы. Арил-C1-4-алкил обозначает арилзамещенный C1-4-алкильный радикал. Примером является бензильный радикал.C1-4-Алкилкарбониламино представляет собой аминогруппу, к которой присоединена C1-4-алкилкарбонильная группа. Примерами являются пропиониламино (С 3 Н 7 С(O)NH-) и ацетиламиногруппы (ацетамидогруппа) (CH3C(O)NH-).C1-4-Алкоксикарбониламино представляет собой аминогруппу, которая замещена одной из указанных выше C1-4-алкоксикарбонильных групп. Примерами являются этоксикарбониламино и метоксикарбониламиногруппы.C1-4-Алкокси-C1-4-алкоксикарбонил представляет собой карбонильную группу, к которой присоединены указанные выше C1-4-алкокси-C1-4-алкоксигруппы. Примерами являются 2-(метокси)этоксикарбонильная (СН 3-О-СН 2 СН 2-О-СО-) и 2-(этокси)этоксикарбонильная группы (СН 3 СН 2-О-СН 2 СН 2-О-СО-).C1-4-Алкокси-C1-4-алкоксикарбониламино представляет собой аминогруппу, которая замещена одной из указанных выше C1-4-алкокси-C1-4-алкоксикарбонильных групп. Примерами являются 2-(метокси) этоксикарбониламино и 2-(этокси)этоксикарбониламиногруппы. С 2-7-Алкенил представляет собой линейную или разветвленную алкенильную группу, имеющую от 2 до 7 атомов углерода. Примерами являются 2-бутенильная, 3-бутенильная, 1-пропенильная, 2-пропенильная (аллильная) и винильная группы. Указанные выше С 2-4-алкенильные группы являются предпочтительными. С 2-7-Алкенил представляет собой линейную или разветвленную алкенильную группу, имеющую от 2 до 7 атомов углерода. Примерами являются 2-бутенильная, 3-бутенильная, 1-пропенильная, 2-пропенильная (аллильная) и винильная группы. Указанные выше С 2-4-алкенильные группы являются предпочтительными. Оксозамещенный C1-4-алкокси представляет собой C1-4-алкоксигруппу, которая вместо метиленовой группы содержит карбонильную группу. Примером является 2-оксопропоксигруппа. С 3-7-Циклоалкокси представляет собой циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и циклогептилокси, из которых циклопропилокси, циклобутилокси и циклопентилокси являются предпочтительными. С 3-7-Циклоалкил-C1-4-алкокси представляет собой одну из указанных выше C1-4-алкоксигрупп, которая замещена одной из указанных выше С 3-7-циклоалкильных групп. Примерами являются циклопропилметокси, циклобутилметокси и циклогексилэтоксигруппы.-3 008779 Гидрокси-C1-4-алкокси представляет собой указанную выше С 1-4-алкоксигруппу, которая замещена гидроксигруппой. Предпочтительным примером является 2-гидроксиэтоксигруппа. С 1-4-Алкокси-C1-4-алкокси-С 1-4-алкокси представляет собой одну из указанных выше C1-4-алкоксигрупп, которая замещена одной из указанных выше C1-4-алкокси-C1-4-алкоксигрупп. Предпочтительным примером является метоксиэтоксиэтоксигруппа. С 3-7-Циклоалкокси-С 1-4-алкокси представляет собой одну из указанных выше C1-4-алкоксигрупп, которая замещена одной из указанных выше С 3-7-циклоалкоксигрупп. Примерами являются циклопропоксиметокси, циклобутоксиметокси и циклогексилоксиэтоксигруппы. С 3-7-Циклоалкил-C1-4-алкокси-C1-4-алкокси представляет собой одну из указанных выше C1-4-алкоксигрупп, которая замещена одной из указанных выше С 3-7-циклоалкил-C1-4-алкоксигрупп. Примерами являются циклопропилметоксиэтокси, циклобутилметоксиэтокси и циклогексилэтоксиэтоксигруппы.C1-4-Алкилкарбонилокси представляет собой C1-4-алкилкарбонильную группу, которая связана с атомом кислорода. Примером является ацетоксигруппа (СН 3 СО-О-).C1-4-Алкилкарбонилокси-C1-4-алкил представляет собой одну из указанных выше C1-4-алкильных групп, которая замещена одной из указанных выше C1-4-алкилкарбонилоксигрупп. Примером является ацетоксиметильная группа (СН 3 СО-O-СН 2). Галоген-C1-4-алкокси представляет собой C1-4-алкоксигруппы, которые полностью или почти полностью замещены галогеном. "Почти полностью" здесь обозначает, что более половины атомов водорода вC1-4-алкоксигруппах замещены атомами галогена. Галоген-C1-4-алкоксигруппы, в первую очередь, представляют собой хлор- и/или, в частности, фторзамещенные C1-4-алкоксигруппы. Примерами галогензамещенных C1-4-алкоксигрупп являются 2,2,2-трихлорэтокси, гексахлоризопропокси, пентахлоризопропокси,1,1,1-трихлор-3,3,3-трифтор-2-пропокси, 1,1,1-трихлор-2-метил-2-пропокси, 1,1,1-трихлор-2-пропокси, 3 бром-1,1,1-трифтор-2-пропокси, 3-бром-1,1,1-трифтор-2-бутокси, 4-бром-3,3,4,4-тетрафтор-1-бутокси,хлордифторметокси, 1,1,1,3,3,3-гексафтор-2-пропокси, 2-трифторметил-2-пропокси, 1,1,1-трифтор-2-пропокси, перфтор-трет-бутокси, 2,2,3,3,4,4,4-гептафтор-1-бутокси, 4,4,4-трифтор-1-бутокси, 2,2,3,3,3-пентафторпропокси, перфторэтокси, 1,2,2-трифторэтокси, в частности 1,1,2,2-тетрафторэтокси, 2,2,2-трифторэтокси, трифторметокси и предпочтительно дифторметоксигруппы. Моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси представляет собой C1-4-алкилкарбонилоксигруппу, которая замещена одной из указанных выше моно- или ди-C1-4-алкиламиногрупп. Примерами являются диметиламинометилкарбонилокси и диметиламиноэтилкарбонилоксигруппы.C1-4-Алкокси-C1-4-алкилкарбонилокси представляет собой один из указанных выше C1-4-алкилкарбонилоксирадикалов, который замещен одной из указанных выше C1-4-алкоксигрупп. Примером является метоксиметилкарбонилоксигруппа. Возможными солями соединений формулы 1 или 2 в зависимости от заместителя являются особенно все кислотные аддитивные соли. Особенно предпочтительны фармакологически приемлемые соли неорганических и органических кислот, обычно используемых в фармацевтической промышленности. Подходящими являются водорастворимые и водонерастворимые кислотные аддитивные соли с кислотами,такими как, например, соляная кислота, бромоводородная кислота, фосфорная кислота, азотная кислота,серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4 гидроксибензоил)бензойная кислота, бутановая кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, оксалиновая кислота,винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтойная кислота, где кислоты для приготовления соли используются в зависимости от того, является ли кислота моно- или полиосновной, и от того, какая соль необходима - в эквимолярном количественном соотношении или другом соотношении. Фармакологически неприемлемые соли, которые могут быть получены изначально, например, в продуктах для получения соединений по изобретению в промышленном масштабе, превращают в фармакологически приемлемые соли способами, известными специалисту в данной области техники. Специалисту в данной области техники известно, что соединения по изобретению и их соли, например, если они выделены в кристаллической форме, могут содержать различные количества растворителей. Данное изобретение также включает все сольваты, и в частности все гидраты соединений формулы I, а также все сольваты, и в частности все гидраты солей соединений формулы I. Один вариант осуществления (вариант осуществления а) включает соединения формулы 1, в которыхR1 представляет собой моно- или ди-C1-4-алкиламино,R2, R3, X и Y имеют указанные выше значения по изобретению,при условии, что R3 не имеет значение водород или галоген, когда Y обозначает -СН 2-Ar и R2 обозначает водород, C1-4-алкил или С 3-7-циклоалкил-C1-4-алкил,и соли этих соединений. Один вариант осуществления (вариант осуществления б) включает соединения формулы 1, в которыхR2, R3, X и Y имеют указанные выше значения по изобретению,и соли этих соединений. Другой вариант осуществления (вариант осуществления в) включает соединения формулы 1, в которыхR2 представляет собой гидрокси или C1-4-алкокси иR1, R3, X и Y имеют указанные выше значения по изобретению,и соли этих соединений. Другой вариант осуществления (вариант осуществления г) включает соединения формулы 1, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу иHet представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, гдеR1, R2, X и Y имеют указанные выше значения по изобретению,и соли этих соединений. Другой вариант осуществления (вариант осуществления д) включает соединения формулы 1, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,X представляет собой О (кислород) или NH иY представляет собой или -СН 2-Ar, гдеAr представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 иR7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила,1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила,изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, илиC1-4-алкокси, С 3-7-циклоалкокси, С 3-7-циклоалкил-C1-4-алкокси, гидрокси-C1-4-алкокси, C1-4-алкокси-C1-4 алкокси, C1-4-алкокси-C1-4-алкокси-C1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино,C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, C1-4-алкокси-C1-4-алкоксикарбониламино или C1-4-алкокси-C1-4-алкилкарбонилокси и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, C1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,при условии, что R3 не имеет значение водород или галоген, когда Y обозначает -СН 2-Ar,и соли этих соединений. Другой вариант осуществления (вариант осуществления е) включает соединения формулы 1, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино или морфолиногруппу,X представляет собой О (кислород) или NH иY или имеет значение -СН 2-Ar, гдеAr представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 иR7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила,1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила,изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, илиC1-4-алкокси, С 3-7-циклоалкокси, С 3-7-циклоалкил-C1-4-алкокси, гидрокси-С 1-4-алкокси, С 1-4-алкокси-С 1-4 алкокси, С 1-4-алкокси-С 1-4-алкокси-С 1-4-алкокси, С 3-7-циклоалкокси-С 1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-C1-4-алкокси, C1-4-алкилкарбонилокси, галоген-С 1-4-алкокси, амино, моно- или ди-C1-4-алкиламино,С 1-4-алкилкарбониламино, С 1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси или C1-4-алкокси-С 1-4-алкоксикарбониламино и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, C1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,при условии, что R3 не имеет значение водород или галоген, когда Y обозначает -СН 2-Ar,и соли этих соединений. В одном варианте настоящее изобретение относится к соединениям формулы 1 аR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу иHet представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, гдеAr представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 иR7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила,1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила,изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, гдеR7 представляет собой водород, C1-4-алкил или галоген и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, C1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,при условии, что R3 не имеет значение водород или галоген, когда Y обозначает -СН 2-Ar и R2 обозначает водород, C1-4-алкил или С 3-7-циклоалкил-C1-4-алкил,и солям этих соединений. В другом варианте осуществления настоящее изобретение относится к соединениям формулы 1 а, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,X представляет собой О (кислород) или NH иAr представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 иR7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила,1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила,изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, гдеR7 представляет собой водород, C1-4-алкил или галоген и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы С 1-4-алкила, C1-4-алкокси, карбокси, С 1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,и солям этих соединений. В другом варианте осуществления настоящее изобретение относится к соединениям формулы 1 а, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино или морфолиногруппу,X представляет собой О (кислород) или NH иAr представляет собой моно- или бициклический ароматический остаток, замещенный R4, R5, R6 иR7, который выбран из группы, состоящей из фенила, нафтила, пирролила, пиразолила, имидазолила,1,2,3-триазолила, индолила, бензимидазолила, фурила, бензофурила, тиенила, бензотиенила, тиазолила,изоксазолила, пиридинила, пиримидинила, хинолинила и изохинолинила, гдеR7 представляет собой водород, C1-4-алкил или галоген и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, С 1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,и солям этих соединений. В другом варианте осуществления настоящее изобретение относится к соединениям формулы 1bR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-С 1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу иHet представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола, дигидроимидазола, оксазола, имидазола, изоксазола, дигидроизоксазола, пиразола и тетразола, гдеC1-4-алкокси, С 3-7-циклоалкокси, С 3-7-циклоалкил-C1-4-алкокси, гидрокси-С 1-4-алкокси, С 1-4-алкокси-С 1-4 алкокси, C1-4-алкокси-C1-4-алкокси-C1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-С 1-4-алкокси, С 1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-С 1-4-алкиламино,С 1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-С 1-4-алкиламино-С 1-4-алкилкарбонилокси, С 1-4-алкокси-С 1-4-алкоксикарбониламино или С 1-4-алкокси-C1-4-алкилкарбонилокси и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, С 1-4-алкокси, карбокси, C1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,и солям этих соединений. В другом варианте осуществления настоящее изобретение относится к соединениям формулы 1b, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,R4 представляет собой водород, C1-4-алкил, гидрокси-С 1-4-алкил, С 1-4-алкокси, С 2-4-алкенилокси, C1-4 алкилкарбонил, карбокси, C1-4-алкоксикарбонил, карбокси-C1-4-алкил, C1-4-алкоксикарбонил-C1-4-алкил,галоген, гидрокси, арил, арил-C1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-С 1-4-алкиламино, C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, С 1-4-алкокси-С 1-4-алкоксикарбониламино или сульфонил,R5 представляет собой водород, С 1-4-алкил, C1-4-алкокси, С 1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,X представляет собой О (кислород) или NH иC1-4-алкокси, С 3-7-циклоалкокси, С 3-7-циклоалкил-C1-4-алкокси, гидрокси-С 1-4-алкокси, С 1-4-алкокси-С 1-4 алкокси, С 1-4-алкокси-С 1-4-алкокси-С 1-4-алкокси, С 3-7-циклоалкокси-С 1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-С 1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино,C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, С 1-4-алкокси-C1-4-алкоксикарбониламино или С 1-4-алкокси-С 1-4-алкилкарбонилокси и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, С 1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,и солям этих соединений.- 10008779 В другом варианте осуществления настоящее изобретение относится к соединениям формулы 1b, в которыхR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-С 1-4-алкилпиперазино или морфолиногруппу,R4 представляет собой водород, С 1-4-алкил, гидрокси-C1-4-алкил, C1-4-алкокси, С 2-4-алкенилокси, C1-4 алкилкарбонил, карбокси, C1-4-алкоксикарбонил, карбокси-С 1-4-алкил, С 1-4-алкоксикарбонил-С 1-4-алкил,галоген, гидрокси, арил, арил-C1-4-алкил, арилокси, арил-C1-4-алкокси, трифторметил, нитро, амино, моно- или ди-С 1-4-алкиламино, С 1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, C1-4-алкокси-C1-4-алкоксикарбониламино или сульфонил,R5 представляет собой водород, C1-4-алкил, С 1-4-алкокси, C1-4-алкоксикарбонил, галоген, трифторметил или гидрокси,X представляет собой О (кислород) или NH иC1-4-алкокси, С 3-7-циклоалкокси, С 3-7-циклоалкил-C1-4-алкокси, гидрокси-С 1-4-алкокси, C1-4-алкокси-С 1-4 алкокси, C1-4-алкокси-C1-4-алкокси-C1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-С 1-4-алкокси, С 1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино,C1-4-алкилкарбониламино, C1-4-алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси или С 1-4-алкокси-С 1-4-алкоксикарбониламино и где арил представляет собой фенил или замещенный фенил с одним, двумя или тремя одинаковыми или различными заместителями из группы C1-4-алкила, C1-4-алкокси, карбокси, С 1-4-алкоксикарбонила, галогена, трифторметила, нитро, трифторметокси, гидрокси и циано,и солям этих соединений. Соединения формулы 1b имеют вплоть до трех хиральных центров в своей структуре. Данное изобретение, таким образом, относится ко всем возможным стереоизомерам в любом соотношении смеси друг к другу, включая чистые энантиомеры, которые являются предпочтительными объектами изобретения. Среди соединений формулы 1 а предпочтительными соединениями являются соединения формулы 1 а-1R32 представляет собой водород или С 1-7-алкил, или гдеR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу иHet представляет собой гетероциклический остаток, замещенный R33, R34 и R35, выбранный из группы, состоящей из оксадиазола, дигидрооксазола и дигидроимидазола, гдеR33 представляет собой водород или C1-4-алкил,R34 представляет собой водород или C1-4-алкил,R35 представляет собой водород или С 1-4-алкил,R4 представляет собой водород, С 1-4-алкил, гидрокси-C1-4-алкил, С 1-4-алкокси, C1-4-алкоксикарбонил, трифторметил, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, С 1-4-алкоксикарбониламино или C1-4-алкокси-C1-4-алкоксикарбониламино,R5 представляет собой водород, C1-4-алкил или C1-4-алкокси иX представляет собой О (кислород) или NH,и соли этих соединений. Среди соединений формулы 1 а особенно предпочтительными соединениями являются соединения формулы 1 а-1, гдеR1 представляет собой водород, С 1-4-алкил или гидрокси-C1-4-алкил,R2 представляет собой водород или C1-4-алкил,R3 представляет собой карбоксил, -СО-С 1-4-алкокси, гидрокси-С 1-4-алкил, C1-4-алкокси-С 1-4-алкил или группу -CO-NR31R32, гдеR32 представляет собой водород или С 1-7-алкил или гдеR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,R4 представляет собой водород, С 1-4-алкил, гидрокси-С 1-4-алкил, С 1-4-алкокси, C1-4-алкоксикарбонил, трифторметил, амино, моно- или ди-С 1-4-алкиламино, С 1-4-алкилкарбониламино, С 1-4-алкоксикарбониламино или C1-4-алкокси-C1-4-алкоксикарбониламино,R5 представляет собой водород, C1-4-алкил или C1-4-алкокси иX представляет собой О (кислород) или NH,и соли этих соединений. Особенно предпочтительными соединениями формулы 1 а-1 являются соединения, в которыхR32 представляет собой водород или С 1-4-алкил,R4 представляет собой С 1-4-алкил или C1-4-алкилкарбониламино,R5 представляет собой C1-4-алкил,X представляет собой О (кислород) или NH,и их соли. Среди соединений формулы 1b соединения формулы 1b-1 являются предпочтительными. Предпочтительными соединениями формулы 1b-1 являются соединения, в которыхR1 представляет собой С 1-4-алкил или С 3-7-циклоалкил,R2 представляет собой водород или C1-4-алкил,R3 представляет собой карбоксил, -СО-C1-4-алкокси, С 1-4-алкокси-C1-4-алкил, C1-4-алкокси-C1-4-алкокси-C1-4-алкил или группу -CO-NR31R32, гдеR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-С 1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,R4 представляет собой водород, С 1-4-алкил, C1-4-алкокси или галоген,R5 представляет собой водород или C1-4-алкил,R8 представляет собой гидроксил, С 1-4-алкокси, оксозамещенный C1-4-алкокси, С 3-7-циклоалкокси,С 3-7-циклоалкил-C1-4-алкокси, гидрокси-C1-4-алкокси, С 1-4-алкокси-С 1-4-алкокси, С 1-4-алкокси-С 1-4-алкокси-С 1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-С 1-4-алкокси-С 1-4-алкокси, C1-4-алкилкарбонилокси, галоген-C1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, C1-4 алкоксикарбониламино, моно- или ди-С 1-4-алкиламино-C1-4-алкилкарбонилокси, С 1-4-алкокси-С 1-4-алкоксикарбониламино или С 1-4-алкокси-С 1-4-алкилкарбонилокси,X представляет собой О (кислород) или NH,и их соли. Особенно предпочтительными соединениями формулы 1b-1 являются соединения, в которыхR1 представляет собой C1-4-алкил,R2 представляет собой водород или C1-4-алкил,R3 представляет собой карбоксил, -CO-C1-4-алкокси, С 1-4-алкокси-С 1-4-алкил, С 1-4-алкокси-C1-4-алкокси-C1-4-алкил или группу -CO-NR31R32, гдеR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,R4 представляет собой водород, C1-4-алкил, С 1-4-алкокси или галоген,R5 представляет собой водород или алкил,R8 представляет собой гидроксил, C1-4-алкокси, оксозамещенный C1-4-алкокси, С 3-7-циклоалкокси,С 3-7-циклоалкил-С 1-4-алкокси, гидрокси-С 1-4-алкокси, C1-4-алкокси-С 1-4-алкокси, C1-4-алкокси-С 1-4-алкокси-C1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-С 1-4-алкокси-C1-4-алкокси, С 1-4-алкилкарбонилокси, галоген-С 1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, C1-4 алкоксикарбониламино, моно- или ди-C1-4-алкиламино-C1-4-алкилкарбонилокси, С 1-4-алкокси-C1-4-алкоксикарбониламино или C1-4-алкокси-C1-4-алкилкарбонилокси,X представляет собой О (кислород) или NH,и их соли. Особенно предпочтительными соединениями формулы 1b-1 являются соединения, в которыхR1 представляет собой C1-4-алкил,R2 представляет собой водород или С 1-4-алкил,R3 представляет собой карбоксил, -CO-C1-4-алкокси, С 1-4-алкокси-C1-4-алкил, C1-4-алкокси-С 1-4-алкокси-C1-4-алкил или группу -CO-NR31R32, гдеR31 и R32 вместе, включая атом азота, с которым они оба связаны, представляют собой пирролидино, пиперидино, пиперазино, N-C1-4-алкилпиперазино, морфолино, азиридино или азетидиногруппу,R4 представляет собой водород, C1-4-алкил, C1-4-алкокси или галоген,R5 представляет собой водород,R8 представляет собой гидроксил, C1-4-алкокси, оксозамещенный C1-4-алкокси, С 3-7-циклоалкокси,С 3-7-циклоалкил-С 1-4-алкокси, гидрокси-C1-4-алкокси, С 1-4-алкокси-C1-4-алкокси, C1-4-алкокси-С 1-4-алкокси-C1-4-алкокси, С 3-7-циклоалкокси-C1-4-алкокси, С 3-7-циклоалкил-C1-4-алкокси-С 1-4-алкокси, C1-4-алкилкарбонилокси, галоген-С 1-4-алкокси, амино, моно- или ди-C1-4-алкиламино, C1-4-алкилкарбониламино, C1-4 алкоксикарбониламино, моно- или ди-С 1-4-алкиламино-C1-4-алкилкарбонилокси, C1-4-алкокси-C1-4-алкоксикарбониламино или С 1-4-алкокси-С 1-4-алкилкарбонилокси,X представляет собой О (кислород) или NH,и их соли. Предпочтительными соединениями являются соединения формулы 1 а-1. Особенно предпочтительными являются соединения, представленные в качестве конечных продуктов формулы 1 в примерах, и соли этих соединений. Соединения в соответствии с изобретением могут быть получены из соответствующих исходных соединений, например в соответствии с приведенными ниже схемами реакций. Синтез осуществляют известным для специалиста способом, например как описано более подробно в следующих примерах.- 13008779 Исходные соединения являются известными, например, из М.W. Lovell, S.G. Schulman, Anal. Chem. 1983, 55, 963-965 (например, 4-бром-6-нитро-1,2-фенилендиамин). 6-галоген, 4-нитрозамещенные бензимидазолы известны из уровня техники, например 6-хлор-2-метил-4-нитро-1(3)H-бензимидазол (Gillespie и др., J. Org. Chem. 1960, 25, 942), или они могут быть получены аналогичными стадиями реакций. 1,2 Эпоксииндан описан, например, в W.F. Whitmore; A.I. Gebhart, J. Am. Chem. Soc. 1942, 64, 912. Обычно замещенные алкил-, алкокси- или галогенэпоксиинданы могут быть получены из соответствующих замещенных инденов способами, известными из уровня техники (например, эпоксидированием). Соединения общей формулы 1 а могут быть получены реакцией замещенных бензимидазолов формулы I с соединениями формулы II, как представлено на схеме 1. Схема 1 Аналогично, соединения общей формулы 1b получают реакцией замещенных бензимидазолов формулы I с эпоксиинданами III, вводя любой нужный заместитель R4 и R5 (схема 2 для соединения 1b-1). Схема 2 Представленные выше реакционные стадии осуществляют известным способом, например как описано более подробно в примерах. Введение радикалов, при необходимости, в соединения, полученные в соответствии с приведенными выше схемами 1 и 2 (например, конверсия группы R3 в другую группу R3,или R2=Н в другую группу R2, или конверсия гидроксильной группы в алкокси или эфирную группу) аналогично осуществляется известным способом. Если нужно получить соединения, в которых R3=-СОС 1-4-алкокси или R3=-CO-NR31R32, известным способом может осуществляться подходящее введение радикалов (например, катализируемым металлом карбонилированием соответствующего бромсоединения или конверсией эфира в амид) на стадии бензимидазолов формулы I (схемы 1 и 2) или удобнее на конечной стадии. Следующие примеры служат для более подробной иллюстрации изобретения без его ограничения. Аналогично, другие соединения формулы 1, получение которых не было конкретно описано, могут быть получены аналогичным способом или способом, близким к обычным способам, известным специалисту в данной области техники. Сокращение мин обозначает минуту (минуты), ч - час (часы) и tпл - температуру плавления. ПримерыI. Исходные реагенты. А. 2-Бензилокси-4-бром-6-нитроанилин. К суспензии 50 г (325 ммоль) 2-амино-3-нитрофенола, 45 г (325 ммоль) карбоната калия и 2 г (13 ммоль) йодида натрия в 400 мл этанола добавляли 47 мл (408 ммоль) бензилхлорида и смесь нагревали до 80 С. Через 2 ч реакционную смесь охлаждали и растворитель упаривали. Остаток растворяли в этилацетате и экстрагировали водой. Органический слой высушивали над безводным сульфатом магния и упаривали. Совместное упаривание с дихлорметаном приводило к получению темно-коричневого маслянистого остатка, который растворяли в 400 мл ацетонитрила. После добавления 63,4 г (356 ммоль) N-бромсукцинимида реакционную смесь кипятили с обратным холодильником в течение 1 ч. После охлаждения добавляли 400 г силикагеля и смесь упаривали досуха. Полученное твердое вещество очищали колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (4:1). Упаривание элюента приводило к получению твердого вещества, которое перекристаллизовывали из смеси этилацетат/н-гептан с получением 62 г (59%) указанного в заголовке соединения в виде красного твердого вещества (tпл 90C). Б. N-Ацетил-N-(2-бензилокси-4-бром-6-нитрофенил)ацетамид. Суспензию 20 г (62 ммоль) 2-бензилокси-4-бром-6-нитроанилина в 120 мл уксусного ангидрида и 2 мл- 14008779 метансульфоновой кислоты нагревали до 120 С. После окончания реакции (15 мин) избыток уксусного ангидрида упаривали. Остаток растворяли в смеси дихлорметан/вода и нейтрализовали 6N водным гидроксидом натрия. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Кристаллизация остатка из смеси этилацетат/н-гептан приводила к получению 23,2 г (92%) указанного в заголовке соединения в виде бежевого твердого вещества (tпл 148C). В. N-(2-Амино-6-бензилокси-4-бромфенил)ацетамид. Суспензию 23 г (56 ммоль) N-ацетил-N-(2-бензилокси-4-бром-6-нитрофенил)ацетамида, 5,5 г (34 ммоль) хлорида железа(III) и 13,8 г активированного угля в 600 мл метанола нагревали при кипении с обратным холодильником. К реакционной смеси добавляли 28 мл гидразингидрата (95%), продолжая кипячение. После окончания реакции (2 ч) смесь охлаждали и отфильтровывали через целит. Остаток на фильтре тщательно промывали смесью дихлорметан/метанол и фильтрат упаривали досуха. Остаток разделяли между смесью дихлорметан/метанол и водой. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали. Остаток перекристаллизовывали из кипящей смеси этилацетат/н-гептан с получением 12,3 г (65%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 185C). Г. N-(2-Бензилокси-4-бром-6-диметиламинофенил)ацетамид. Суспензию 5,0 г (15 ммоль) N-(2-амино-6-бензилокси-4-бромфенил)ацетамида в 80 мл метанола и 34 мл формальдегида (37%) подкисляли насыщенной метанольной соляной кислотой с получением прозрачного желтого раствора. К раствору добавляли 1,5 г (24 ммоль) цианоборгидрида натрия небольшими частями. После окончания реакции (15 мин) смесь нейтрализовали водным гидрокарбонатом натрия и экстрагировали дихлорметаном. Органический слой высушивали над безводным сульфатом магния и упаривали. Кристаллизация остатка из смеси этилацетат/н-гептан приводила к получению 4,3 г (79%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 177C). Д. 4-Бензилокси-6-бром-1,2-диметил-1H-бензимидазол. Суспензию 26,2 г (72 ммоль) N-(2-бензилокси-4-бром-6-диметиламинофенил)ацетамида в 180 мл фосфорилхлорида нагревали при 70 С в течение 24 ч. После окончания реакции избыток фосфорилхлорида упаривали. Остаток суспендировали в дихлорметане и осторожно нейтрализовали 6N водным гидроксидом калия и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Кристаллизация остатка из этилацетата приводила к получению 15,1 г (63%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 177-179C). Е. Этил 4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилат. Суспензию 12,0 г (37 ммоль) этил 4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилата в 100 мл этанола гидрировали над 1 г 10% Pd/C (50 С, 5 бар Н 2) в течение 16 ч. Катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из смеси этанол/диэтиловый эфир с получением 5,91 г (69%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 272-273C). Ж. Метил-4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилат. Суспензию 8,5 г (27 ммоль) метил-4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилата в 100 мл метанола гидрировали над 0,7 г 10% Pd/C (30 С, 1 бар H2) в течение 2 ч. Катализатор отфильтровывали, промывали несколько раз горячим метанолом и фильтрат упаривали. Остаток кристаллизовали из смеси метанол/диэтиловый эфир с получением 6 г (99%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 286 С). З. 4-Гидрокси-6-метоксиметил-1,2-диметил-1H-бензимидазол. Раствор 1,2 г (4,1 ммоль) 4-бензилокси-6-метоксиметил-1,2-диметил-1H-бензимидазола в 12 мл метанола гидрировали над 0,12 г 10% Pd/C (1 бар Н 2) в течение 16 ч. Катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из смеси этилацетат/низкокипящий петролейный эфир с получением 0,83 г (99%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 219-220C). И. 6-(N,N-Диметиламинокарбонил)-4-гидрокси-1,2-диметил-1 Н-бензимидазол. Раствор 2,3 г (7,1 ммоль) 4-бензилокси-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазола в 80 мл метанола гидрировали над 0,3 г 10% Pd/C (1 бар Н 2) в течение 16 ч. Катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из ацетона с получением 1,2 г (71%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 248C). К. 6-Бром-2-метил-4-нитро-1(3)H-бензимидазол. К суспензии 65 г (0,28 моль) 5-бром-3-нитро-1,2-фенилендиамина в 600 мл этанола добавляли 140 мл 5N соляной кислоты. Реакционную смесь кипятили с обратным холодильником и одной порцией добавляли 58 мл (0,56 моль) 2,4-пентандиона. Через 1 ч смесь охлаждали, выливали в 500 мл воды и нейтрализовали концентрированным аммиаком. Осадок собирали, промывали тщательно водой и сушили над пентоксидом фосфора с получением 70,8 г (99%) указанного в заголовке соединения (tпл 229-231 С). Л. 6-Бром-4-нитро-1(3)H-бензимидазол. К суспензии 14,25 г (61,4 ммоль) 5-бром-3-нитро-1,2-фенилендиамина в 120 мл 4N соляной кислоты добавляли 4,65 мл (123 ммоль) муравьиной кислоты. Реакционную смесь нагревали до 120 С. Через 1,5 ч- 15008779 смесь охлаждали и нейтрализовали концентрированным аммиаком. Осадок собирали, промывали водой и сушили над пентоксидом фосфора. Перекристаллизация из этанола с активированным углем приводила к получению 9,79 г (66%) указанного в заголовке соединения (tпл 249C). М. 6-Бром-2-метоксиметил-4-нитро-1(3)H-бензимидазол. Суспензию 1 г (4,3 ммоль) 5-бром-3-нитро-1,2-фенилендиамина в 4 мл метоксиуксусной кислоты нагревали при 110 С в течение 16 ч. Смесь выливали в ледяную воду, нейтрализовали 6N водным гидроксидом натрия и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из этилацетата с активированным углем приводила к получению 0,9 г (73%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 173 С). Н. 6-Бром-1-метил-4-нитро-1H-бензимидазол. Суспензию 5,12 г (21,2 ммоль) 6-бром-4-нитро-1(3)H-бензимидазола и 4,6 г (33,3 ммоль) карбоната калия в 200 мл ацетона перемешивали в течение 30 мин и затем добавляли 1,54 мл (24,7 ммоль) метилйодида. После перемешивания в течение 18 ч при температуре окружающей среды избыток растворителя упаривали и остаток разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из этилацетата приводила к получению 2,7 г (50%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 198 С). О. 6-Бром-2-метоксиметил-1-метил-4-нитро-1H-бензимидазол. К суспензии 13 г (45,4 ммоль) 6-бром-2-метоксиметил-4-нитро-1(3)H-бензимидазола и 12,6 г (90,9 ммоль) карбоната калия в 130 мл ацетона добавляли 6,8 г (47,7 ммоль) метилйодида и смесь перемешивали в течение 18 ч при температуре окружающей среды. Мелкую суспензию выливали в 200 мл воды и экстрагировали дихлорметаном. Органический слой высушивали над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из диизопропилового эфира приводила к получению 13,6 г (99%) указанного в заголовке соединения в виде желтого твердого вещества (tпл 145-147 С). П. 1-Бензилоксиметил-6-бром-2-метил-4-нитро-1H-бензимидазол. К суспензии 0,26 г (6,4 ммоль) гидрида натрия (60% дисперсия в минеральном масле) в 10 мл N,Nдиметилформамида медленно добавляли раствор 1,5 г (5,9 ммоль) 6-бром-2-метил-4-нитро-1(3)Hбензимидазола в 5 мл N,N-диметилформамида при 0 С. Через 1 ч при 0 С добавляли 2,29 г (8,8 ммоль) бензилоксиметилхлорида (60%) в течение 20 мин. После окончания реакции (1 ч) осторожно добавляли 10 мл воды и смесь разделяли между дихлорметаном и водой. Органический слой высушивали над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:триэтиламин (95:5) приводила к получению масла, которое кристаллизовали из диизопропилового эфира с получением 1,16 г (53%) указанного в заголовке соединения в виде желтого твердого вещества (tпл 106-109 С). Р. 6-Бром-1,2-диметил-4-нитро-1H-бензимидазол. К суспензии 4,3 г (107 ммоль) гидрида натрия (60% дисперсия в минеральном масле) в 25 мл N,Nдиметилформамида медленно добавляли раствор 25 г (98 ммоль) 6-бром-2-метил-4-нитро-1(3)Hбензимидазола в 100 мл N,N-диметилформамида при 0 С. Через 30 мин при 0 С добавляли 15,2 г (107 ммоль) метилйодида в течение 20 мин. После окончания реакции (45 мин) осторожно добавляли 200 мл воды и смесь перемешивали 1 ч при температуре окружающей среды. Осадок собирали, промывали тщательно водой и сушили над пентоксидом фосфора. Перекристаллизация из метанола приводила к получению 19,6 г (74%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 193-195C). С. 4-Амино-6-бром-1-метил-1H-бензимидазол. К суспензии 10 г (39 ммоль) 6-бром-1-метил-4-нитро-1H-бензимидазола в 100 мл метанола добавляли 7,6 г (46,9 ммоль) хлорида железа(III) и 2,5 г активированного угля. Реакционную смесь нагревали до 80 С и медленно добавляли 9,5 мл гидразингидрата (95%). После кипячения в течение 2 ч добавляли следующее количество 2 мл гидразингидрата (95%). Через 5 ч горячую реакционную смесь отфильтровывали через целит и остаток на фильтре промывали метанолом и дихлорметаном. Фильтрат упаривали до получения твердого вещества, которое очищали колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,6:0,4). Кристаллизация из диизопропилового эфира приводила к получению 6,8 г (77%) указанного в заголовке соединения в виде светло-желтого твердого вещества (tпл 170C). Т. 4-Амино-6-бром-2-метоксиметил-1-метил-1H-бензимидазол. К суспензии 8,5 г (28,3 ммоль) 6-бром-2-метоксиметил-1-метил-4-нитро-1H-бензимидазола в 150 мл метанола добавляли 5,51 г (34 ммоль) хлорида железа(III), 2,5 г активированного угля и 6,9 мл гидразингидрата (95%). После кипячения в течение 2 ч добавляли следующее количество 4 мл гидразингидрата(95%). Через 4 ч горячую реакционную смесь отфильтровывали через целит и остаток на фильтре промывали метанолом и дихлорметаном. Фильтрат упаривали и остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (20:1). Кристаллизация из диизопропилового эфира приводила к получению 5,5 г (72%) указанного в заголовке соединения в виде бесцветного твердо- 16008779 го вещества (tпл 138-140C). У. 4-Амино-1-бензилоксиметил-6-бром-2-метил-1H-бензимидазол. К суспензии 10 г (26,6 ммоль) 1-бензилоксиметил-6-бром-2-метил-4-нитро-1H-бензимидазола и 1 г активированного угля в 150 мл метанола добавляли 5,2 г (31,9 ммоль) хлорида железа(III) и 6,5 мл гидразингидрата (95%). После кипячения в течение 1 ч добавляли следующее количество 3 мл гидразингидрата (95%). Через 6 ч горячую реакционную смесь отфильтровывали через целит и остаток на фильтре промывали горячим метанолом. Фильтрат упаривали до получения желтого твердого вещества, которое очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (9:1). Кристаллизация из диизопропилового эфира приводила к получению 6,68 г (73%) указанного в заголовке соединения в виде светло-желтого твердого вещества (tпл 142C). Ф. 4-Амино-6-бром-1,2-диметил-1H-бензимидазол. К раствору 19 г (70 ммоль) 6-бром-1,2-диметил-4-нитро-1H-бензимидазола в 250 мл метанола добавляли 13,7 г (84 ммоль) хлорида железа(III) и 6 г активированного угля. Реакционную смесь нагревали до 80 С и медленно добавляли 17 мл гидразингидрата (95%). После кипячения в течение 3 ч горячую реакционную смесь отфильтровывали через целит и остаток на фильтре промывали метанолом и дихлорметаном. Фильтрат упаривали до получения суспензии, которую обрабатывали н-гептаном. Осадок собирали, промывали н-гептаном и сушили с получением 13,3 г (79%) указанного в заголовке соединения в виде твердого вещества (tпл 206-209 С).X. 6-Бром-4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол. К суспензии 12 г (50 ммоль) 4-амино-6-бром-1,2-диметил-1H-бензимидазола и 8,8 г (52 ммоль) 2-этил 6-метилбензилхлорида в 220 мл ацетона добавляли 5,5 г (52 ммоль) карбоната натрия и 1,5 г (10 ммоль) йодида натрия. Через 3 ч перемешивания при 45 С реакционную смесь выливали в 400 мл воды и экстрагировали этилацетатом. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (100:3) и кристаллизация из н-гептана приводили к получению 15,6 г (84%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 145-147C). Ц. 6-Бром-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол. К суспензии 0,97 г (4 ммоль) 4-амино-6-бром-1,2-диметил-1H-бензимидазола и 0,66 г (4,2 ммоль) 2,6-диметилбензилхлорида в 25 мл ацетонитрила добавляли 0,56 г (4 ммоль) карбоната калия и 70 мг(0,4 ммоль) йодида калия. Через 1 ч перемешивания при 65 С добавляли 2 мл 1N водного аммиака и реакционную смесь упаривали. Остаток разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (1:1) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,93 г (64%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 185 С). Ч. 1-Бензилоксиметил-6-бром-4-(2-этил-6-метилбензиламино)-2-метил-1H-бензимидазол. К суспензии 6,5 г (18,8 ммоль) 4-амино-1-бензилоксиметил-6-бром-2-метил-1H-бензимидазола и 3,32 г (19,7 ммоль) 2-этил-6-метилбензилхлорида в 120 мл ацетонитрила добавляли 3,0 г (28,2 ммоль) карбоната натрия и 0,56 г (3,75 ммоль) йодида натрия. После 3 ч кипячения реакционную смесь выливали в 300 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (2:3) и кристаллизация из диизопропилового эфира приводили к получению 6,88 г (77%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 117-119 С). Ш. 6-Бром-4-(2-этил-6-метилбензиламино)-1-метил-1H-бензимидазол. К суспензии 2,0 г (8,9 ммоль) 4-амино-6-бром-1-метил-1H-бензимидазола и 1,6 г (9,5 ммоль) 2-этил-6 метилбензилхлорида в 40 мл ацетонитрила добавляли 1,4 г (13,1 ммоль) карбоната натрия и 0,3 г (2 ммоль) йодида натрия. Через 1 ч при 70 С смесь разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (100:1) приводила к получению 2,0 г(63%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 132-134C). Щ. 6-Бром-4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол. К суспензии 6,8 г (25,2 ммоль) 4-амино-6-бром-2-метоксиметил-1-метил-1H-бензимидазола и 4,46 г(26,4 ммоль) 2-этил-6-метилбензилхлорида в 70 мл ацетонитрила добавляли 7,0 г (50,3 ммоль) карбоната калия и каталитическое количество йодида калия. Через 5 ч при 70 С реакционную смесь выливали в 200 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (1:1) и кристаллизация из диизопропилового эфира приводили к получению 5,46 г (54%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 110-112 С). Э. 6-Бром-4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол. К суспензии 2,5 г (9,25 ммоль) 4-амино-6-бром-2-метоксиметил-1-метил-1H-бензимидазола и 1,52 г(9,72 ммоль) 2,6-диметилбензилхлорида в 50 мл ацетонитрила добавляли 2,56 г (18,5 ммоль) карбоната калия и каталитическое кличество йодида калия. Через 3 ч при 70 С реакционную смесь выливали в 150 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (100:1) и кристаллизация из диизопропилового эфира приводили к получению 0,84 г(23%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 143-145 С). Ю. 4-Амино-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол. К суспензии 3 г (12,5 ммоль) 4-амино-6-бром-1,2-диметил-1 Н-бензимидазола в 100 мл диметиламина (2 М раствор в тетрагидрофуране) добавляли 280 мг (1,25 ммоль) ацетата палладия(II) и 2 г (7,5 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (6 бар давление монооксида углерода, 120 С) в течение 16 ч. Реакционную смесь охлаждали, выливали в 200 мл воды и 100 мл насыщенного водного хлорида аммония и экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:метанол (4:1) и кристаллизация из диизопропилового эфира приводили к получению 0,7 г (24%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 230-234C). Я. (2-Бензилокси-4-бром-6-нитрофенил)амид циклопропанкарбоновой кислоты. Суспензию 20,0 г (61,9 ммоль) 2-бензилокси-4-бром-6-нитроанилина и 11,2 мл (123,4 ммоль) циклопропанкарбонилхлорида в 130 мл диоксана нагревали до 100 С. Через 5 ч колбу погружали в ледяную баню, осадок собирали, промывали толуолом и сушили в вакууме с получением 21,2 г (87%) указанного в заголовке соединения в виде желтого твердого вещества (tпл 191 С). АА. (2-Амино-6-бензилокси-4-бромфенил)амид циклопропанкарбоновой кислоты. Суспензию 11,0 г (28,1 ммоль) (2-бензилокси-4-бром-6-нитрофенил)амида циклопропанкарбоновой кислоты, 3,0 г (18,5 ммоль) хлорида железа(III) и 7,4 г активированного угля в 140 мл метанола нагревали до кипения. К реакционной смеси добавляли 14,7 мл гидразингидрата (95%), продолжая кипячение. После окончания реакции (1 ч) смесь охлаждали и отфильтровывали через целит. Остаток на фильтре промывали тщательно горячей смесью метанол/ацетон и фильтрат упаривали досуха. Остаток кристаллизовали из этилацетата с получением 7,5 г (73%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 207-208C). ББ. 4-Бензилокси-6-бром-2-циклопропил-1-метил-1H-бензимидазол. Суспензию 7,5 г (20,8 ммоль) (2-амино-6-бензилокси-4-бромфенил)амида циклопропанкарбоновой кислоты в 80 мл метанола и 13,3 мл формальдегида (37%) подкисляли насыщенной метанольной соляной кислотой с получением прозрачного желтого раствора. К раствору добавляли 0,75 г (11,9 ммоль) цианоборгидрида натрия небольшими порциями. После окончания реакции (4 ч) смесь выливали в воду и нейтрализовали 40% водным гидроксидом натрия. Осадок собирали, промывали водой и сушили над пентоксидом фосфора с получением 5,3 г бесцветного твердого вещества. Твердое вещество суспендировали в 10 мл фосфорилхлорида и смесь нагревали при 90 С в течение 2 ч. После окончания реакции смесь разбавляли дихлорметаном и нейтрализовали 6N водным гидроксидом калия и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан (10:1) и кристаллизация из диэтилового эфира приводили к получению 2,97 г (40%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 153-154 С). ВВ. Этил 2-циклопропил-4-гидрокси-1-метил-1H-бензимидазол-6-карбоксилат. Суспензию 2,3 г (6,6 ммоль) этил 4-бензилокси-2-циклопропил-1-метил-1 Н-бензимидазол-6-карбоксилата в 23 мл метанола гидрировали над 0,27 г 10% Pd/C (25 С, 1 бар Н 2) в течение 5 ч. Катализатор отфильтровывали и фильтрат упаривали. Остаток кристаллизовали из этилацетата с получением 1,5 г(88%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 201-202 С). ГГ. 4-Амино-N,N-диметил-3,5-динитробензолсульфонамид. Суспензию 5,0 г (27,3 ммоль) 2,6-динитроанилина в 40 мл хлорсульфоновой кислоты нагревали до 100 С. Через 2,5 ч реакционную смесь охлаждали и осторожно выливали в 1000 мл измельченного льда. Суспензию экстрагировали дихлорметаном. Органический слой высушивали над безводным сульфатом магния и упаривали досуха. Остаток растворяли в 100 мл тетрагидрофурана и медленно добавляли раствор 25 мл диметиламина в 25 мл тетрагидрофурана. Через 20 мин суспензию упаривали и остаток разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из этанола приводила к получению 6,7 г (85%) указанного в заголовке соединения в виде оранжевого твердого вещества (tпл 169-170C). ДД. 3,4-Диамино-N,N-диметил-5-нитробензолсульфонамид. 50 мл 2N водного аммиака насыщали сульфидом водорода при 0 С. Раствор разбавляли 50 мл этанола и добавляли 5,58 г (19,2 ммоль) 4-амино-N,N-диметил-3,5-динитробензолсульфонамида. Через 40 мин при 60 С смесь разбавляли водой и отфильтровывали через целит. Остаток на фильтре экстрагировали несколько раз кипящим дихлорметаном и метанолом. Объединенные экстракты упаривали и остаток пе- 18008779 рекристаллизовали из смеси этанол/диэтиловый эфир с получением 1,18 г (24%) указанного в заголовке соединения в виде красного твердого вещества (tпл 211-213C). ЕЕ. Диметиламид 2-метил-7-нитро-3H-бензимидазол-5-сульфоновой кислоты. Суспензию 1,0 г (3,84 ммоль) 3,4-диамино-N,N-диметил-5-нитробензолсульфонамида в 20 мл этанола и 5 мл 5N соляной кислоты нагревали до 80 С. К реакционной смеси добавляли 1,6 мл (15,4 ммоль) 2,4-пентандиона двумя порциями в течение 1 ч. Раствор охлаждали и нейтрализовали 6N водным гидроксидом натрия. Осадок собирали, промывали водой и сушили в вакууме над пентоксидом фосфора с получением 0,99 г (90%) бежевого твердого вещества (tпл 254-255C). ЖЖ. Диметиламид 2,3-диметил-7-нитро-3H-бензимидазол-5-сульфоновой кислоты. Суспензию 1,87 г (6,6 ммоль) диметиламида 2-метил-7-нитро-3H-бензимидазол-5-сульфоновой кислоты, 1,82 г (13,2 ммоль) карбоната калия и 0,71 мл (11,5 ммоль) метилйодида в 50 мл ацетона перемешивали в течение 3 ч при температуре окружающей среды. Смесь разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали досуха. Перекристаллизация остатка из кипящего этилацетата приводила к получению 1,5 г (76%) указанного в заголовке соединения в виде бежевого твердого вещества (tпл 194-196 С). ЗЗ. Диметиламид 7-амино-2,3-диметил-3H-бензимидазол-5-сульфоновой кислоты. Суспензию 1,2 г (4,0 ммоль) диметиламида 2,3-диметил-7-нитро-3H-бензимидазол-5-сульфоновой кислоты в 15 мл метанола и 5 мл уксусной кислоты нагревали до 60 С и добавляли 1,1 г (20 ммоль) железных стружек. Через 1,5 ч твердые остатки отфильтровывали и экстрагировали несколько раз кипящим дихлорметаном. Объединенные экстракты упаривали и остаток кристаллизовали из смеси этилацетат/нгептан с получением 0,99 г (92%) указанного в заголовке соединения в виде бежевого твердого вещества(tпл 255-258C). ИИ. N-(4-Бром-2,6-динитрофенил)ацетамид. Суспензию 5,0 г (19,1 ммоль) 4-бром-2,6-динитроанилина в 50 мл уксусного ангидрида и 1 мл метансульфоновой кислоты перемешивали в течение 3 ч при 30 С. Осадок собирали, промывали диэтиловым эфиром и сушили с получением 4,8 г (83%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 238-239C). КК. 4-Амино-6-бром-1-гидрокси-2-метил-1H-бензимидазол. К суспензии 2,0 г (6,6 ммоль) N-(4-бром-2,6-динитрофенил)ацетамида и 0,4 г рутения на угле (5%) в 80 мл этанола добавляли 1,2 мл (24,7 ммоль) гидразингидрата (95%) в течение 1,5 ч при 60 С. Катализатор отфильтровывали и фильтрат упаривали досуха. Остаток экстрагировали кипящим этилацетатом с получением 1,23 г (77%) указанного в заголовке соединения в виде светло-серого твердого вещества (tпл 257-258C). ЛЛ. N-[5-Бром-2-(2-хлорацетиламино)-3-нитрофенил]-2-хлорацетамид. К раствору 46,4 г (200 ммоль) 4-бром-2,6-динитроанилина в 500 мл N,N-диметилформамида и 20 мл пиридина медленно добавляли 80 мл (1000 ммоль) хлорацетилхлорида. Через 3 ч реакционную смесь выливали в 600 мл ледяной воды и полученную суспензию нейтрализовали 6N водным гидроксидом натрия. Осадок собирали, промывали водой и сушили в вакууме с получением 74,1 г (96%) указанного в заголовке соединения в виде бежевого твердого вещества (tпл 172-173 С). ММ. 6-Бром-2-хлорметил-4-нитро-1H-бензимидазол. Суспензию 1,0 г (2,59 ммоль) N-[5-бром-2-(2-хлорацетиламино)-3-нитрофенил]-2-хлорацетамида в 25 мл 4N соляной кислоты и 20 мл этанола нагревали до кипения. Через 4 ч реакционную смесь выливали в 75 мл воды и нейтрализовали насыщенным водным гидрокарбонатом натрия. Осадок собирали,промывали водой и сушили над пентоксидом фосфора с получением 0,65 г (86%) указанного в заголовке соединения в виде оранжевого твердого вещества (tпл 148-150 С). НН. 6-Бром-2-хлорметил-1-метил-4-нитро-1H-бензимидазол. К раствору 39,3 г (135,3 ммоль) 6-бром-2-хлорметил-4-нитро-1H-бензимидазола в 500 мл ацетона добавляли 26,0 г (206,1 ммоль) диметилсульфата и 50,0 г (362 ммоль) карбоната калия. Через 1,25 ч перемешивания при комнатной температуре реакционную смесь выливали в 1000 мл воды. Осадок собирали, промывали водой и перекристаллизовали из метанола с получением 32,5 г (63%) указанного в заголовке соединения в виде бежевого твердого вещества (tпл 154-155C). ОО. 2-Ацетоксиметил-6-бром-1-метил-4-нитро-1H-бензимидазол. К раствору 30,0 г (98,5 ммоль) 6-бром-2-хлорметил-1-метил-4-нитро-1H-бензимидазола в 200 мл ацетона добавляли 16,4 г (98,5 ммоль) йодида калия. Полученную суспензию перемешивали 1 ч при температуре окружающей среды и добавляли 14,5 г (147,8 ммоль) ацетата калия. Через 2 ч при 40 С реакционную смесь выливали в 500 мл воды и экстрагировали дихлорметаном. Органический слой отделяли,сушили над безводным сульфатом магния и упаривали досуха. Перекристаллизация остатка из кипящего этанола приводила к получению 23,9 г (74%) указанного в заголовке соединения в виде оранжевого твердого вещества (tпл 143-145C). ПП. 2-Ацетоксиметил-4-амино-6-бром-1-метил-1H-бензимидазол. К суспензии 10,0 г (30,5 ммоль) 2-ацетоксиметил-6-бром-1-метил-4-нитро-1H-бензимидазола в 40 мл уксусной кислоты добавляли 6,8 г (122 ммоль) железных стружек и реакционную смесь нагревали до- 19008779 60 С. Через 4 ч добавляли другое количество 1,0 г (18 ммоль) железных стружек и нагревание продолжали в течение 1,25 ч. Осадок собирали, растворяли в дихлорметане и экстрагировали водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали досуха. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (7:3) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 4,6 г (51%) указанного в заголовке соединения в виде бежевого твердого вещества (tпл 104-106 С).PP. 4-Амино-6-бром-2-гидроксиметил-1-метил-1H-бензимидазол. Суспензию 7,5 г (22,9 ммоль) 2-ацетоксиметил-6-бром-1-метил-4-нитро-1H-бензимидазола в 180 мл метанола гидрировали над никелем Ренея (25 С, 1 бар Н 2) в течение 2,5 ч. Катализатор отфильтровывали и фильтрат разделяли между водой и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток кристаллизовали из смеси этанол/диизопропиловый эфир с получением 1,32 г (22%) указанного в заголовке соединения в виде твердого вещества (tпл 216-218C). СС. 2,6-Дибром-1-метил-4-нитро-1H-бензимидазол. К раствору 1,0 г (3,9 ммоль) 6-бром-1-метил-4-нитро-1H-бензимидазола в 25 мл дихлопентана добавляли 5 г силикагеля и 0,94 г (5,3 ммоль) N-бромсукцинимида. Через 2,5 ч при 85 С смесь охлаждали и отфильтровывали. Фильтрат экстрагировали насыщенным водным гидрокарбонатом натрия, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (1:1) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,745 г (57%) указанного в заголовке соединения в виде желтого твердого вещества (tпл 235-236C). ТТ. 6-Бром-2-(N,N-диметиламино)-1-метил-4-нитро-1H-бензимидазол. К раствору 3,0 г (11,7 ммоль) 6-бром-1-метил-4-нитро-1H-бензимидазола в 75 мл дихлопентана добавляли 25 г силикагеля и 2,5 г (14,1 ммоль) N-бромсукцинимида. Через 3 ч при 85 С смесь охлаждали и отфильтровывали. Фильтрат упаривали и остаток растворяли в 100 мл тетрагидрофурана. Медленно добавляли раствор 10 мл диметиламина в 20 мл тетрагидрофурана и смесь перемешивали в течение 4 ч. Смесь упаривали до 1/4 от объема и разделяли между насыщенным водным гидрокарбонатом натрия и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из этилацетата приводила к получению 1,6 г (46%) указанного в заголовке соединения в виде оранжевого твердого вещества (tпл 206-207C). УУ. 4-Амино-6-бром-2-(N,N-диметиламино)-1-метил-1H-бензимидазол. К суспензии 1,0 г (3,3 ммоль) 6-бром-2-(N,N-диметиламино)-1-метил-4-нитро-1H-бензимидазола в 25 мл метанола и 8 мл уксусной кислоты добавляли 0,85 г (15,2 ммоль) порошка железа при 65 С. Через 2 ч твердые вещества отфильтровывали и промывали дихлорметаном. Фильтрат экстрагировали водой,сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата и кристаллизация из диэтилового эфира приводили к получению 0,2 г(22%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 137 С). ФФ. 6-Бром-1,2-диметил-4-(2-метилбензиламино)-1H-бензимидазол. К раствору 0,9 мл (6,4 ммоль) 2-метилбензилхлорида в 20 мл ацетона добавляли 1,1 г (6,6 ммоль) йодида натрия и смесь перемешивали 1,5 ч при комнатной температуре. Твердое вещество отфильтровывали и к фильтрату добавляли 1,5 г (4,4 ммоль) 4-амино-6-бром-1,2-диметил-1H-бензимидазола и 1,3 г(9,4 ммоль) карбоната калия. Через 3 ч при кипячении с обратным холодильником смесь разделяли между водой и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (30:1) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 1,28 г (61%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 128-129C).XX. 6-Бром-4-(2,4-диметилфуран-3-ил-метиламино)-1,2-диметил-1H-бензимидазол. К суспензии 1,95 г (4,6 ммоль) перйодинана Десс-Мартина в 10 мл дихлорметана и 0,5 мл пиридина по каплям добавляли раствор 0,5 г (4,0 ммоль) (2,4-диметилфуран-3-ил)метанола в 5 мл дихлорметана при комнатной температуре. Через 30 мин добавляли воду и 1 мл насыщенного водного сульфита натрия и смесь экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток отфильтровывали через силикагель с помощью смеси этилацетат:низкокипящий петролейный эфир (9:1) с получением бесцветного масла после упаривания. Сырой продукт растворяли в 10 мл метанола и 0,5 мл уксусной кислоты. После добавления 0,48 г (2 ммоль) 4-амино-6-бром 1,2-диметил-1H-бензимидазола добавляли 0,3 г (4,8 ммоль) цианоборгидрида натрия тремя порциями в течение 2,5 ч. Через 2 ч добавляли насыщенный водный гидрокарбонат натрия и смесь экстрагировали дихлорметаном. Органический слой высушивали над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,45 г (65%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 207-208C). ЦЦ. 6-Бром-4-(2-гидроксиметил-6-метилбензиламино)-1,2-диметил-1 Н-бензимидазол. К раствору 0,8 г (5,4 ммоль) 7-метил-3H-изобензофуран-1-она в 15 мл сухого толуола медленно до- 20008779 бавляли 4,3 мл (6,5 ммоль) гидрида диизобутилалюминия (1,5 М раствор в толуоле) при -78 С. Через 1 ч реакционную смесь гасили 1 мл метанола и нагревали до комнатной температуры. Смесь разделяли между насыщенным водным тартратом калия натрия и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Полученное масло растворяли в 20 мл метанола и 1 мл уксусной кислоты. После добавления избытка цианоборгидрида натрия смесь перемешивали в течение 4 ч при 45 С. Смесь разделяли между водой и дихлорметаном и нейтрализовали 6N водным гидроксидом натрия. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,35 г (24%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 215-216C). ЧЧ. 6-Бром-4-(2-этил-6-метилбензиламино)-2-гидроксиметил-1-метил-1 Н-бензимидазол. Суспензию 1,25 г (4,88 ммоль) 4-амино-6-бром-2-гидроксиметил-1-метил-1H-бензимидазола, 0,86 г(5,12 ммоль) 2-этил-6-метилбензилхлорида, 1,35 г (9,76 ммоль) карбоната калия и каталитического количества йодида калия в 15 мл ацетонитрила нагревали при 70 С. Через 6 ч реакционную смесь выливали в воду и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (100:3) и кристаллизация из диизопропилового эфира приводили к получению 0,54 г(29%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 206-208 С). ШШ. 6-Бром-2-(N,N-диметиламино)-4-(2,6-диметилбензиламино)-1-метил-1H-бензимидазол. К раствору 0,46 г (1,7 ммоль) 4-амино-6-бром-2-(N,N-диметиламино)-1-метил-1H-бензимидазола и 0,3 г (2,2 ммоль) 2,6-диметилбензальдегида в 10 мл дихлорметана и 2,5 мл уксусной кислоты добавляли 0,6 г (2,8 ммоль) триацетоксиборгидрида натрия. Через 1 ч при температуре окружающей среды добавляли насыщенный водный гидрокарбонат натрия и перемешивание продолжали в течение 30 мин. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата и кристаллизация из смеси этилацетат/нгептан приводили к получению 0,46 г (70%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 157-158C). ЩЩ. 1-Бензилоксиметил-6-бром-4-(2,6-диметилбензиламино)-2-метил-1H-бензимидазол. К суспензии 7,6 г (22 ммоль) 4-амино-1-бензилоксиметил-6-бром-2-метил-1H-бензимидазола и 3,56 г(23,0 ммоль) 2,6-диметилбензилхлорида в 140 мл ацетонитрила добавляли 3,5 г (32,7 ммоль) карбоната натрия и 0,66 г (4,4 ммоль) йодида натрия. Через 3,5 ч кипячения с обратным холодильником реакционную смесь разделяли между водой и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (2:3) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 6,8 г (64%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 147-148C).II. Конечные продукты формулы 1. 1. Метил-4-(2-этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат. К раствору 2,0 г (9,1 ммоль) метил-4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилата и 1,7 г(17,5 ммоль) гидрида натрия (60% дисперсия в минеральном масле). Через 1 ч добавляли другое количество 0,3 г (1,8 ммоль) 2-этил-6-метилбензилхлорида и смесь перемешивали в течение 4 ч. Смесь осторожно гидролизовали насыщенным водным хлоридом аммония и разделяли между дихлорметаном и водой. Органический слой высушивали над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из смеси вода/ацетон приводила к получению 2,7 г (84%) указанного в заголовке соединения в виде твердого вещества (tпл 157 С). 2. 4-(2-Этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоновая кислота. К суспензии 2,6 г (7,4 ммоль) метил-4-(2-этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол-6 карбоксилата в 75 мл диоксана добавляли 15 мл 2N водного гидроксида натрия. Через 3 ч при 80 С реакционную смесь охлаждали и рН доводили до рН 7 добавлением 6N соляной кислоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (4:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из диэтилового эфира с получением 2,67 г (колич.) указанного в заголовке соединения (сырой продукт, содержащий силикагель), которое без дополнительной очистки использовали на следующей стадии. 3. Метил-4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат. К раствору 3,6 г (16,4 ммоль) метил-4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилата и 2,8 г(32,5 ммоль) гидрида натрия (60% дисперсия в минеральном масле) в течение 2 ч. После окончания реакции смесь осторожно гидролизовали насыщенным водным хлоридом аммония и разбавляли 500 мл воды. Осадок собирали, промывали тщательно водой и сушили над пентоксидом фосфора с получением- 21008779 4,04 г (73%) указанного в заголовке соединения (tпл 165-169C). 4. 4-(2,6-Диметилбензилокси)-1,2-диметил-1H-бензимидазол-6-карбоновая кислота. К суспензии 3,5 г (10,3 ммоль) метил-4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол-6 карбоксилата в 100 мл диоксана добавляли 20 мл 2N водного гидроксида натрия. Через 2 ч при 80 С реакционную смесь охлаждали и рН доводили до рН 7 добавлением 6N соляной кислоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток наносили на колонку и элюировали смесью дихлорметан:метанол (4:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из смеси этилацетат/диэтиловый эфир с получением 2,33 г (70%) указанного в заголовке соединения (tпл 285-286C). 5. 4-Бензилокси-6-гидроксиметил-1,2-диметил-1H-бензимидазол. К суспензии 0,7 г (18,4 ммоль) литийалюмогидрида в 40 мл тетрагидрофурана медленно добавляли раствор 3 г (9,7 ммоль) метил-4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилата в 10 мл тетрагидрофурана. После окончания добавления реакционную смесь осторожно гидролизовали 0,13 мл воды,0,25 мл 6N водного гидроксида калия и 0,13 мл воды. Добавляли безводный сульфат магния и смесь перемешивали 1 ч. После фильтрации суспензии через целит фильтрат упаривали и остаток кристаллизовали из ацетона с получением 1,99 г (74%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 213-214C). 6. 4-Бензилокси-6-метоксиметил-1,2-диметил-1H-бензимидазол. К раствору 1,5 г (5,3 ммоль) 4-бензилокси-6-гидроксиметил-1,2-диметил-1H-бензимидазола в 12 млN,N-диметилформамида медленно добавляли 0,4 г (10 ммоль) гидрида натрия (60% дисперсия в минеральном масле) и смесь нагревали до 50 С. Через 1 ч реакционную смесь охлаждали до -10 С и добавляли 0,4 мл (6,4 ммоль) метилйодида в течение 30 мин. Реакционную смесь перемешивали 3 ч и затем осторожно гидролизовали насыщенным водным хлоридом аммония. Смесь разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из низшего петролейного эфира приводила к получению 1,25 г (80%) указанного в заголовке соединения в виде твердого вещества (tпл 113C). 7. 4-Бензилокси-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол. К раствору 3,0 г (9,1 ммоль) 4-бензилокси-6-бром-1,2-диметил-1H-бензимидазола в 100 мл диметиламина (3,2 М раствор в тетрагидрофуране) добавляли 0,3 г (1,3 ммоль) ацетата палладия(II) и 1,4 г(5,3 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 6 бар, 120 С) в течение 16 ч. Реакционную смесь охлаждали, упаривали и остаток растворяли в дихлорметане. Органический слой промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата приводила к получению 2,3 г (78%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 159160C). 8. 6-(N,N-Диметиламинокарбонил)-4-(2-этил-6-метилбензилокси)-1,2-диметил-1H-бензимидазол. К суспензии 0,35 г (1,5 ммоль) 6-(N,N-диметиламинокарбонил)-4-гидрокси-1,2-диметил-1H-бензимидазола и 0,32 г (3 ммоль) карбоната натрия в 5 мл ацетона добавляли 0,5 г (3 ммоль) 2-этил-6-метилбензилхлорида и смесь перемешивали 20 ч при температуре окружающей среды. Смесь разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата приводила к получению 0,38 г (68%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 161-162 С). 9. 6-(N,N-Диметиламинокарбонил)-4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол. К суспензии 1,0 г (3,08 ммоль) этил 4-(2,6-диметилбензилокси)-1,2-диметил-1H-бензимидазол-6 карбоновой кислоты в 40 мл дихлорметана и 10 мл N,N-диметилформамида добавляли 1,7 г (5,3 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 1 ч добавляли 3,7 мл (18,5 ммоль) диметиламина (5 М раствор в тетрагидрофуране) при температуре окружающей среды. Через 30 мин реакционную смесь разделяли между 2N водным гидроксидом натрия и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1) приводила к получению масла, которое кристаллизовали из смеси этилацетат/низкокипящий петролейный эфир с получением 1,0 г (91%) указанного в заголовке соединения в виде желтого твердого вещества (tпл 180C). 10. Оксалат 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1,2 диметил-1H-бензимидазола. К суспензии 0,5 г (2,1 ммоль) 6-(N,N-диметиламинокарбонил)-4-гидрокси-1,2-диметил-1H-бензимидазола и 1,1 г (8,3 ммоль) 1,2-эпоксииндана в 5,3 мл метанола и 1,3 мл воды добавляли 0,6 мл триэтиламина и смесь нагревали до 70 С в течение 30 мин. Охлажденный раствор разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1) при- 22008779 водила к получению масла, которое растворяли в ацетоне и обрабатывали раствором 0,27 г (2,1 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном с получением 0,64 г(65%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 144-145C). 11. Оксалат 4-[(1S,2S)-2,3-дигидро-2-гидрокси-1-инденилокси]-6-(N,N-этилдиметиламинокарбонил)1,2-диметил-1H-бензимидазола. К суспензии 0,5 г (2,1 ммоль) 6-(N,N-диметиламинокарбонил)-4-гидрокси-1,2-диметил-1H-бензимидазола и 0,75 г (5,7 ммоль) (1R,2S)-эпоксииндана в 5 мл этанола и 1,25 мл воды добавляли 0,6 мл триэтиламина и смесь нагревали до 60 С в течение 48 ч. Охлажденный раствор разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1) приводила к получению масла, которое растворяли в ацетоне и обрабатывали раствором 0,12 г (1 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном и диэтиловым эфиром с получением 0,14 г (14%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 126-127C, 92% ее). 12. Оксалат 4-(транс-2,3-дигидро-2-метокси-1-инденилокси)-6-(N,N-этилдиметиламинокарбонил)1,2-диметил-1H-бензимидазола. К раствору 0,57 г (1,56 ммоль) 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазола в 5 мл N,N-диметилформамида медленно добавляли 0,15 г (2,3 ммоль) гидрида натрия (60% дисперсия в минеральном масле) при 0 С. Через 5 мин добавляли 0,13 мл (2 ммоль) метилйодида и перемешивание продолжали в течение 40 мин при температуре окружающей среды. Реакционную смесь осторожно гидролизовали 1 мл 1N водным аммиаком и разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3:1) приводила к получению масла, которое растворяли в ацетоне и обрабатывали раствором 0,19 г (1,6 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном и диэтиловым эфиром с получением 0,51 г (70%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 126-127C). 13. 4-[транс-2,3-Дигидро-2-(метоксиметилкарбонилокси)-1-инденилокси]-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазол. К раствору 0,2 мл (1,9 ммоль) метоксиуксусной кислоты в 4 мл тетрагидрофурана добавляли 0,3 г(1,9 ммоль) N,N'-карбонилдиимидазола. Через 15 мин добавляли 0,4 г (1,1 ммоль) 4-(транс-2,3-дигидро-2 гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазола и 0,3 мл (2 ммоль) 1,8-диазабицикло[5,4,0]ундец-7-ена и перемешивание продолжали в течение 1 ч. Смесь разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,5:0,5) и кристаллизация из смеси 2-пропанол/диэтиловый эфир/н-гептан приводили к получению 0,47 г (97%) указанного в заголовке соединения в виде твердого вещества (tпл 140C). 14. Оксалат 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-метоксиметил-1,2-диметил-1H-бензимидазола. К суспензии 0,8 г (3,9 ммоль) 4-гидрокси-6-метоксиметил-1,2-диметил-1H-бензимидазола и 1,03 г(7,8 ммоль) 1,2-эпоксииндана в 9,5 мл метанола и 2,5 мл воды добавляли 1,08 мл триэтиламина и смесь нагревали при 50 С в течение 4 ч. Охлажденный раствор разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (20:1) приводила к получению масла, которое растворяли в ацетоне и обрабатывали раствором 0,51 г (4 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном с получением 0,72 г (42%) указанного в заголовке соединения в виде бесцветного твердого вещества (чистота: 93%). 15. Этил 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоксилат. К суспензии 5,0 г (21,4 ммоль) этил 4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилата и 5,65 г (42,8 ммоль) 1,2-эпоксииндана в 48 мл этанола и 12 мл воды добавляли 6 мл триэтиламина и смесь нагревали при 60 С в течение 4 ч. Охлажденный раствор разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из смеси этанол/диэтиловый эфир приводила к получению 5,66 г (72%) указанного в заголовке соединения, которое использовали без дополнительной очистки на следующей стадии. 16. 4-(транс-2,3-Дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновая кислота. К суспензии 5,6 г (15,3 ммоль) этил 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил 1H-бензимидазол-6-карбоксилата в 50 мл диоксана добавляли 10 мл 2N водного гидроксида натрия. Через 2,5 ч при 80 С реакционную смесь охлаждали и рН доводили до рН 6 добавлением 6N соляной ки- 23008779 слоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток помещали на колонку и элюировали смесью дихлорметан:метанол (4:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из смеси этилацетат/н-гептан с получением 5,3 г (колич.) указанного в заголовке соединения (tпл 306C). 17. Этил 4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6 карбоксилат. К суспензии 1,17 г (5,0 ммоль) этил 4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилата и 2,47 г (10 ммоль) 2-бром-5-хлор-2,3-дигидро-1H-инден-1-ола в 20 мл этанола и 5 мл воды добавляли 4,14 г(30 ммоль) карбоната калия и смесь нагревали при 50 С. Через 2 ч добавляли другое количество 1 г (4 ммоль) 2-бром-5-хлор-2,3-дигидро-1H-инден-1-ола и 2 г (14,5 ммоль) карбоната калия и перемешивание продолжали в течение 5 ч. Охлажденный раствор разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол(100:3) приводила к получению 0,52 г (26%) указанного в заголовке соединения, которое использовали без дополнительной очистки на следующей стадии. 18. 4-(транс-5-Хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновая кислота. К суспензии 0,51 г (1,27 ммоль) этил 4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2 диметил-1H-бензимидазол-6-карбоксилата в 13 мл диоксана добавляли 2,5 мл 2N водного гидроксида натрия. Через 4 ч при 80 С реакционную смесь охлаждали и рН доводили до рН 6 добавлением 6N соляной кислоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток помещали на колонку и элюировали смесью дихлорметан:метанол (4:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из н-гептана с получением 0,63 г указанного в заголовке соединения (содержащего силикагель), которое использовали без дополнительной очистки на следующей стадии. 19. Оксалат 4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1-инденилокси)-6-(N,N-диметиламинокарбонил)1,2-диметил-1H-бензимидазола. К суспензии 0,63 г (1,27 ммоль, содержащий силикагель) 4-(транс-5-хлор-2,3-дигидро-2-гидрокси-1 инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 14 мл дихлорметана и 7 мл N,N-диметилформамида добавляли 0,6 г (1,9 ммоль) тетрафторборат O-(1H-бензотриазол-1-ил)-N,N,N'N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 30 мин добавляли 1,5 мл (7,5 ммоль) диметиламина (5 М раствор в тетрагидрофуране) при температуре окружающей среды. Через 30 мин реакционную смесь разделяли между 2N водным гидроксидом натрия и дихлорметаном. Органический слой отделяли,сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1). Фракции продукта упаривали и остаток растворяли в ацетоне и обрабатывали раствором 0,27 г (2,1 ммоль) дигидрата щавелевой кислоты в ацетоне. После охлаждения осадок собирали и промывали ацетоном с получением 0,42 г указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 158-159C). 20. Этил 4-(транс-2,3-дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-1,2-диметил-1H-бензимидазол 6-карбоксилат. К суспензии 1,17 г (5,0 ммоль) этил 4-гидрокси-1,2-диметил-1H-бензимидазол-6-карбоксилата и 2,41 г (10 ммоль) 2-бром-2,3-дигидро-4,7-диметил-1H-инден-1-ола в 20 мл этанола и 5 мл воды добавляли 4,14 г (30 ммоль) карбоната калия и смесь нагревали до 50 С. Через 1 ч добавляли другое количество 2,41 г (10 ммоль) 2-бром-2,3-дигидро-4,7-диметил-1H-инден-1-ола и 1,4 г (10 ммоль) карбоната калия и перемешивание продолжали в течение 1 ч. Охлажденный раствор разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (100:3) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,85 г (43%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 184C). 21. 4-(транс-2,3-Дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-1,2-диметил-1H-бензимидазол-6 карбоновая кислота. К суспензии 0,8 г (2 ммоль) этил 4-(транс-2,3-дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-1,2 диметил-1H-бензимидазол-6-карбоксилата в 20 мл диоксана добавляли 4 мл 2N водного гидроксида натрия. Через 4 ч при 80 С реакционную смесь охлаждали и рН доводили до рН 6 добавлением 10% соляной кислоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток помещали на колонку и элюировали смесью дихлорметан:метанол (4:1). Упаривание растворителя приводило к получению 0,8 г указанного в заголовке соединения (содержащего силикагель) в виде твердого вещества, которое использовали без дополнительной очистки на следующей стадии. 22. 4-(транс-2,3-Дигидро-2-гидрокси-4,7-диметил-1-инденилокси)-6-(N,N-диметиламинокарбонил)1,2-диметил- 1H-бензимидазол. К суспензии 0,7 г (1,8 ммоль, содержащий силикагель) 4-(транс-2,3-дигидро-2-гидрокси-4,7-диме- 24008779 тил-1-инденилокси)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 20 мл дихлорметана и 10 млN,N-диметилформамида добавляли 0,8 г (2,5 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)N,N,N',N'-тетраметилypoия (TBTU) и смесь нагревали до 40 С. Через 30 мин добавляли 2 мл (10 ммоль) диметиламина (5 М раствор в тетрагидрофуране) при температуре окружающей среды. Через 20 мин реакционную смесь разделяли между 2N водным гидроксидом натрия и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1). Кристаллизация из смеси этилацетат/н-гептан приводила к получению 0,72 г указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 134C). 23. Оксалат 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-6-[(1-пирролидино)карбонил]-1H-бензимидазола. К суспензии 1,0 г (2,96 ммоль) 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1Hбензимидазол-6-карбоновой кислоты в 20 мл дихлорметана и 10 мл 1-метил-2-пирролидинона добавляли 1,45 г (4,5 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 15 мин добавляли 0,49 мл (6 ммоль) пирролидина при температуре окружающей среды. Через 2 ч реакционную смесь разделяли между насыщенным водным хлоридом аммония и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол(13:1). Полученное масло растворяли в ацетоне и обрабатывали раствором 0,38 г (3 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном и диэтиловым эфиром с получением 1,06 г (74%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 124C). 24. Оксалат 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-6-[N-(2-метоксиэтил)-N-метиламинокарбонил]-1,2-диметил-1H-бензимидазола. К суспензии 1,0 г (2,96 ммоль) 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1Hбензимидазол-6-карбоновой кислоты в 20 мл дихлорметана и 10 мл 1-метил-2-пирролидинона добавляли 1,45 г (4,5 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N'N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 15 мин добавляли 0,54 г (6 ммоль) N-(2-метоксиэтил)-N-метиламина при температуре окружающей среды. Через 1 ч реакционную смесь разделяли между насыщенным водным хлоридом аммония и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1). Фракции продукта упаривали и остаток растворяли в ацетоне и обрабатывали раствором 0,19 г (1,5 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном и диэтиловым эфиром с получением 0,55 г (38%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 141C). 25. Оксалат 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-6-[(1-пиперидино)карбонил]-1H-бензимидазола. К суспензии 1,3 г (3,84 ммоль) 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1Hбензимидазол-6-карбоновой кислоты в 25 мл дихлорметана и 10 мл N,N-диметилформамида добавляли 1,85 г (5,76 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 15 мин добавляли 0,64 мл (7,7 ммоль) пиперидина при температуре окружающей среды. Через 1 ч реакционную смесь разделяли между насыщенным водным хлоридом аммония и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1). Полученное масло растворяли в ацетоне и обрабатывали раствором 0,25 г (2 ммоль) дигидрата щавелевой кислоты в ацетоне. Осадок собирали и промывали ацетоном и диэтиловый эфиром с получением 0,95 г (50%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 115116 С). 26. 6-(Циклопропиламинокарбонил)-4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил 1H-бензимидазол. К суспензии 1,0 г (2,96 ммоль) 4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1,2-диметил-1Hбензимидазол-6-карбоновой кислоты в 20 мл дихлорметана и 10 мл N,N-диметилформамида добавляли 1,45 г (4,5 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 1 ч добавляли 0,45 мл (6,5 ммоль) циклопропиламина при температуре окружающей среды. Через 1 ч реакционную смесь разделяли между 2N водным гидроксидом натрия и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали кристаллизацией из смеси этилацетат/метанол/н-гептан с получением 0,78 г (70%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 148-149C). 27. Этил 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксилат. 1,0 г (2,7 ммоль) 6-бром-4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазола растворяли в 15 мл этанола и 2,5 мл триэтиламина и переносили в автоклав. После добавления 0,1 г (0,45 ммоль) ацетата палладия(II) и 0,33 г (1,25 ммоль) трифенилфосфина реакционную смесь карбонилировали (дав- 25008779 ление монооксида углерода 5 бар, 100 С) в течение 16 ч. Реакционную смесь охлаждали, отфильтровывали и упаривали с получением оранжевого масла, которое растворяли в этилацетате и экстрагировали водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из смеси этилацетат/низкокипящий петролейный эфир приводила к получению 0,8 г (81%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 171-173 С). 28. Этил 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксилат. 8,8 г (24,6 ммоль) 6-бром-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазола растворяли в 130 мл этанола и 21,3 мл триэтиламина и переносили в автоклав. После добавления 0,8 г (3,6 ммоль) ацетата палладия(II) и 3,2 г (12,2 ммоль) трифенилфосфина реакционную смесь карбонилировали (давление монооксида углерода 10 бар, 100 С) в течение 16 ч. Реакционную смесь охлаждали, отфильтровывали и упаривали с получением оранжевого масла, которое растворяли в дихлорметане и экстрагировали водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (1:1) и кристаллизация из этилацетата приводили к получению 6,18 г (72%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 190C). 29. Этил 4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1 Н-бензимидазол-6-карбоксилат. 3,4 г (8,45 ммоль) 6-бром-4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазола растворяли в 80 мл этанола и 10 мл триэтиламина и переносили в автоклав. После добавления 0,28 г(1,3 ммоль) ацетата палладия(II) и 1,1 г (4,2 ммоль) трифенилфосфина реакционную смесь карбонилировали (давление монооксида углерода 6 бар, 100 С) в течение 16 ч. Реакционную смесь охлаждали, выливали в 250 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (3:7) и кристаллизация из диизопропилового эфира приводили к получению 2,2 г (66%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 106-107 С). 30. Этил 4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1 Н-бензимидазол-6-карбоксилат. 2,5 г (6,43 ммоль) 6-бром-4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазола растворяли в 60 мл этанола и 7 мл триэтиламина и переносили в автоклав. После добавления 0,22 г(0,96 ммоль) ацетата палладия(II) и 0,84 г (3,2 ммоль) трифенилфосфина реакционную смесь карбонилировали (давление монооксида углерода 6 бар, 110 С) в течение 16 ч. Реакционную смесь охлаждали, выливали в 250 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (1:1) и кристаллизация из диизопропилового эфира приводили к получению 1,84 г (81%) указанного в заголовке соединения в виде желтого твердого вещества (tпл 134-135 С). 31. 4-(2-Этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновая кислота. К суспензии 5,0 г (13,7 ммоль) этил 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол 6-карбоксилата в 80 мл диоксана добавляли 50 мл 2N водного гидроксида натрия. Через 2 ч при 100 С реакционную смесь охлаждали, выливали в 50 мл насыщенного водного хлорида аммония и рН доводили до рН 6 добавлением 6N соляной кислоты. Тонкий осадок собирали, промывали водой и перекристаллизовали из этанола с получением 3,7 г (81%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 312-314 С). 32. 4-(2,6-Диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновая кислота. К суспензии 5,0 г (14,2 ммоль) этил 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6 карбоксилата в 50 мл диоксана добавляли 20 мл 2N водного гидроксида натрия. Через 16 ч при 100 С реакционную смесь охлаждали и рН доводили до рН 7 добавлением 6N соляной кислоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток наносили на колонку и элюировали смесью дихлорметан:метанол (13:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из ацетона с получением 4,15 г (90%) указанного в заголовке соединения (tпл 315318C). 33. 4-(2-Этил-6-метилбензиламино)-2-метоксиметил-1-метил-1 Н-бензимидазол-6-карбоновая кислота. К суспензии 1,6 г (4,04 ммоль) этил 4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1Hбензимидазол-6-карбоксилата в 30 мл диоксана добавляли 16 мл 2N водного гидроксида натрия. Через 2 ч при 100 С реакционную смесь охлаждали, выливали в 30 мл воды и рН доводили до рН 6 добавлением 6N соляной кислоты. Осадок собирали, промывали водой и этанолом и сушили над пентоксидом фосфора с получением 1,06 г (71%) указанного в заголовке соединения в виде бесцветного твердого вещества(tпл 275-278 С). 34. 4-(2,6-Диметилбензиламино)-2-метоксиметил-1-метил-1 Н-бензимидазол-6-карбоновая кислота. К суспензии 1,3 г (3,4 ммоль) этил 4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол-6-карбоксилата в 25 мл диоксана добавляли 13 мл 2N водного гидроксида натрия. Через 3 ч при 100 С реакционную смесь охлаждали, выливали в 75 мл воды и рН доводили до рН 6 добавлением 6N- 26008779 соляной кислоты. Осадок собирали, промывали водой, этанолом и диизопропиловым эфиром с получением 0,96 г (80%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 269272C). 35. 4-(2-Этил-6-метилбензиламино)-6-(2-гидроксиэтиламинокарбонил)-1,2-диметил-1H-бензимидазол. Суспензию 1,0 г (2,74 ммоль) этил 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6 карбоксилата в 10 мл 2-аминоэтанола нагревали при 110 С в течение 30 ч. Реакционную смесь охлаждали, разбавляли насыщенным водным хлоридом аммония и экстрагировали этилацетатом. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из смеси этилацетат/диэтиловый эфир приводила к получению 0,72 г (69%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 200-201 С). 36. 4-(2,6-Диметилбензиламино)-6-(2-гидроксиэтиламинокарбонил)-1,2-диметил-1H-бензимидазол. Суспензию 1,0 г (2,85 ммоль) этил 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6 карбоксилата в 15 мл 2-аминоэтанола нагревали при 100 С в течение 16 ч. Реакционную смесь охлаждали, разбавляли водой и экстрагировали смесью дихлорметан/метанол. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из смеси этилацетат/метанол и активированным углем приводила к получению 0,64 г (61%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 259-260C). 37. 4-(2,6-Диметилбензиламино)-6-(2-гидроксиэтиламинокарбонил)-2-метоксиметил-1-метил-1H-бензимидазол. Суспензию 0,4 г (1,04 ммоль) этил 4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1Hбензимидазол-6-карбоксилата в 4 мл 2-аминоэтанола нагревали при 140 С в течение 3 ч. Реакционную смесь охлаждали, выливали в 15 мл воды и 10 мл насыщенного водного хлорида аммония и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,6:0,4) и кристаллизация из диизопропилового эфира приводили к получению 0,38 г (93%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 186-187C). 38. 4-(2-Этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксамид. К суспензии 1,0 г (2,96 ммоль) 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 10 мл тетрагидрофурана и 5 мл N,N-диметилформамида добавляли 0,54 г (3,26 ммоль)N,N'-карбонилдиимидазола. Через 1 ч добавляли 10 мл насыщенного метанольного аммиака и перемешивание продолжали в течение 1 ч. Добавляли 25 мл насыщенного водного хлорида аммония и 50 мл воды и смесь экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,8:0,2) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,8 г (80%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 240241 С). 39. 4-(2,6-Диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоксамид. К перемешиваемой суспензии 1,2 г (3,7 ммоль) 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 10 мл тетрагидрофурана и 5 мл N,N-диметилформамида добавляли 0,7 г(4,3 ммоль) N,N-карбонилдиимидазола. Через 1 ч через колбу барботировали аммиак в течение 1 ч. Смесь затем разделяли между дихлорметаном и 2N водным гидроксидом натрия. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из этилацетата приводила к получению 0,4 г (34%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 272C). 40. 4-(2-Этил-6-метилбензиламино)-1,2-диметил-6-(пирролидинокарбонил)-1H-бензимидазол. К суспензии 1,0 г (2,96 ммоль) 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 10 мл тетрагидрофурана и 3 мл N,N-диметилформамида добавляли 0,54 г (3,26 ммоль)N,N'-карбонилдиимидазола. Через 2 ч добавляли 0,63 г (3,26 ммоль) пирролидина и перемешивание продолжали. Через 1 ч добавляли 20 мл насыщенного водного хлорида аммония и 50 мл воды и смесь экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,9:0,1) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,91 г(79%) указанного в заголовке соединения в виде твердого вещества (tпл 126C). 41. 4-(2-Этил-6-метилбензиламино)-1,2-диметил-6-(морфолинокарбонил)-1H-бензимидазол. К суспензии 1,5 г (4,44 ммоль) 4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 20 мл тетрагидрофурана и 5 мл N,N-диметилформамида добавляли 1,48 г (8,88 ммоль)N,N'-карбонилдиимидазола и смесь нагревали до 60 С. Через 1 ч добавляли 1,94 г (22,2 ммоль) морфолина и реакционную смесь кипятили с обратным холодильником в течение 1 ч. Смесь затем выливали в 100 мл воды и 20 мл насыщенного водного гидрокарбоната натрия и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,9:0,1) и кристаллизация из- 27008779 смеси диизопропиловый эфир/н-гептан приводили к получению 1,6 г (89%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 229-231 С). 42. 6-(N,N-Диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1Hбензимидазол. К суспензии 0,9 г (2,44 ммоль) 4-(2-этил-6-метилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол-6-карбоновой кислоты в 10 мл тетрагидрофурана и 3 мл N,N-диметилформамида добавляли 0,8 г(4,9 ммоль) N,N'-карбонилдиимидазола. Через 1 ч добавляли 5 мл (5 ммоль) диметиламина (5 М раствор в тетрагидрофуране) и перемешивание продолжали в течение 4 ч. Смесь выливали в 60 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,9:0,1) и кристаллизация из диизопропилового эфира приводили к получению 0,88 г (91%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 154C). 43. 6-(N,N-Диметиламинокарбонил)-4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол. К суспензии 0,5 г (1,4 ммоль) 4-(2,6-диметилбензиламино)-2-метоксиметил-1-метил-1H-бензимидазол 6-карбоновой кислоты в 8 мл тетрагидрофурана и 3 мл N,N-диметилформамида добавляли 0,46 г (2,8 ммоль)N,N'-карбонилдиимидазола и смесь нагревали при 60 С в течение 5 мин. Через 1 ч при температуре окружающей среды добавляли 3 мл (15 ммоль) диметиламина (5 М раствор в тетрагидрофуране) и перемешивание продолжали в течение 1 ч. Смесь выливали в 40 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,8:0,2) и кристаллизация из диизопропилового эфира приводили к получению 0,49 г (92%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 156-157C). 44. 6-(N,N-Диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазол. К раствору 9,5 г (25,5 ммоль) 6-бром-4-(2-этил-6-метилбензиламино)-1,2-диметил-1H-бензимидазола в 225 мл диметиламина (3,2 М раствор в тетрагидрофуране) добавляли 0,85 г (2,55 ммоль) ацетата палладия(II) и 4 г (15,3 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 6 бар, 120 С) в течение 16 ч. Реакционную смесь охлаждали, выливали в 400 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (100:3) и кристаллизация из кипящего этилацетата приводили к получению 5,8 г (76%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 152153C). 45. Гидрохлорид 6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-1-метил-1H-бензимидазола. К раствору 2,0 г (5,6 ммоль) 6-бром-4-(2-этил-6-метилбензиламино)-1-метил-1H-бензимидазола в 30 мл диметиламина (5 М раствор в тетрагидрофуране) добавляли 0,2 г (0,9 ммоль) ацетата палладия(II) и 0,7 г(2,7 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 6 бар, 110 С) в течение 16 ч. Реакционную смесь охлаждали, разбавляли водой и экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистку остатка колоночной хроматографией производили на силикагеле сначала с помощью смеси дихлорметан:метанол (13:1), затем с помощью этилацетата. Фракции продукта упаривали и обрабатывали насыщенной соляной кислотой в диэтиловом эфире с получением 0,3 г (14%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 183-184 С). 46. 6-(N,N-Диметиламинокарбонил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол. К раствору 0,86 г (2,4 ммоль) 6-бром-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазола в 30 мл диметиламина (5 М раствор в тетрагидрофуране) добавляли 80 мг (0,36 ммоль) ацетата палладия(II) и 250 мг (0,96 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 5,5 бар, 110 С) в течение 16 ч. Реакционную смесь охлаждали, упаривали и разделяли между дихлорметаном и водой. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (20:1) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,4 г(48%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 142-143C). 47. 6-(1-Азетидинокарбонил)-4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол. К суспензии 1,1 г (3,4 ммоль) 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 20 мл дихлорметана и 5 мл N,N-диметилформамида добавляли 1,2 г (3,74 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 1 ч добавляли раствор 0,36 г (3,74 ммоль) гидрохлорида азетидина в 1,14 г (11,2 ммоль) триэтиламина. Через 45 мин реакционную смесь выливали в 120 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,6:0,4). Кристалли- 28008779 зация из диизопропилового эфира приводила к получению 0,46 г (37%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 193-195C). 48. Оксалат 1-бензилоксиметил-6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2 метил-1H-бензимидазола. К раствору 6,5 г (13,6 ммоль) 1-бензилоксиметил-6-бром-4-(2-этил-6-метилбензиламино)-2-метил 1H-бензимидазола в 44 мл диметиламина (5 М раствор в тетрагидрофуране) добавляли 0,3 г (1,36 ммоль) ацетата палладия(II) и 2,1 г (8,1 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 6 бар, 100 С) в течение 16 ч. Реакционную смесь охлаждали, выливали в 200 мл воды и экстрагировали этилацетатом. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси этилацетат:низкокипящий петролейный эфир (1:1) приводила к получению 3,1 г желтого масла, которое растворяли в 20 мл ацетонитрила и обрабатывали раствором 0,8 г (6,4 ммоль) дигидрата щавелевой кислоты в 5 мл ацетонитрила. Осадок собирали и промывали диэтиловым эфиром с получением 1,34 г (18%) указанного в заголовке соединения в виде твердого вещества (tпл 168-169C). 49. 6-(N,N-Диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-метил-1H-бензимидазол. 0,7 г (1,25 ммоль) оксалата 1-бензилоксиметил-6-(N,N-диметиламинокарбонил)-4-(2-этил-6-метилбензиламино)-2-метил-1H-бензимидазола разделяли между дихлорметаном и насыщенным водным гидрокарбонатом натрия. Органический слой отделяли и упаривали. Остаток растворяли в 15 мл метанола и гидрировали с помощью 0,3 г 10% Pd/C (70C, 1 бар H2) в течение 2 ч. Катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле сначала с помощью смеси дихлорметан:метанол (13:1), затем с помощью смеси этилацетат:триэтиламин (9:1). Кристаллизация из диизопропилового эфира приводила к получению 0,1 г (2%) указанного в заголовке соединения в виде твердого вещества (tпл 228-230 С). 50. 6-(N,N-Диметиламинокарбонил)-4-(2-метоксикарбониламино-6-метилбензиламино)-1,2-диметил 1H-бензимидазол. К суспензии 0,38 г (1,63 ммоль) 4-амино-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазола и 0,37 г (1,71 ммоль) 2-метоксикарбониламино-6-метилбензилхлорида в 20 мл ацетона добавляли 0,35 г (3,26 ммоль) карбоната натрия и 25 мг (0,16 ммоль) йодида натрия. Через 3 ч перемешивания при температуре окружающей среды реакционную смесь выливали в 80 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3,8:0,2) и кристаллизация из диизопропилового эфира приводили к получению 0,37 г (55%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 193-195C). 51. 4-(транс-2,3-Дигидро-2-гидрокси-1-индениламино)-6-(N,N-диметиламинокарбонил)-1,2-диметил 1H-бензимидазол. К суспензии 0,6 г (2,6 ммоль) 4-амино-6-(N,N-диметиламинокарбонил)-1,2-диметил-1H-бензимидазола и 1 г (7,7 ммоль) 1,2-эпоксииндана в 10 мл диоксана и 2 мл воды добавляли одну каплю триэтиламина и реакционную смесь перемешивали при 100 С в течение 6 ч. После охлаждения смесь выливали в 100 мл воды и экстрагировали дихлорметаном. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси толуол:диоксан:метанол (6:3:1) и кристаллизация из диизопропилового эфира приводили к получению 0,72 г (77%) указанного в заголовке соединения в виде бесцветного твердого вещества(tпл 219-221C). 52. Этил 4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилат. К раствору 15,0 г (45,3 ммоль) 4-бензилокси-6-бром-1,2-диметил-1H-бензимидазола в 200 мл этанола и 50 мл триэтиламина добавляли 1,53 г (6,8 ммоль) ацетата палладия(II) и 5,35 г (20,4 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 10 бар,100 С) в течение 18 ч. Реакционную смесь охлаждали, упаривали и остаток растворяли в дихлорметане. Органический слой экстрагировали водой, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из смеси этилацетат/н-гептан и активированным углем приводила к получению 12,3 г (84%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 152C). 53. Метил-4-бензилокси-1,2-диметил-1H-бензимидазол-6-карбоксилат. К раствору 27,0 г (81 ммоль) 4-бензилокси-6-бром-1,2-диметил-1H-бензимидазола в 340 мл метанола и 90 мл триэтиламина добавляли 2,7 г (12 ммоль) ацетата палладия(II) и 9,6 г (37 ммоль) трифенилфосфина. Смесь переносили в автоклав и карбонилировали (давление монооксида углерода 10 бар,100 С) в течение 16 ч. Реакционную смесь охлаждали, отфильтровывали и упаривали. Остаток растворяли в дихлорметане, экстрагировали водой, сушили над безводным сульфатом магния и упаривали. Остаток растворяли в горячем этилацетате и обрабатывали активированным углем. После фильтрации фильтрат упаривали с получением темно-коричневого твердого вещества, которое очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (30:1) с получением 15,6 г (62%) указанного в заголовке соединения в виде серого твердого вещества (tпл 166C).N,N'-карбонилдиимидазола. Через 2 ч при 60 С раствор охлаждали до 30 С и добавляли 1,5 мл (29 ммоль) азиридина тремя порциями в течение 1,5 ч. Добавляли 50 мл воды и смесь экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью этилацетата и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,92 г (86%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 201-202C). 55. 4-(2,6-Диметилбензиламино)-1,2-диметил-6-(N-метиламинокарбонил)-1H-бензимидазол. К суспензии 1,0 г (3,1 ммоль) 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 20 мл тетрагидрофурана и 10 мл N,N-диметилформамида добавляли 0,9 г (5,6 ммоль)N,N'-карбонилдиимидазола. Через 1,5 ч при 60 С раствор охлаждали до 40 С и добавляли 3,05 мл (6,1 ммоль) метиламина (2 М раствор в тетрагидрофуране). Через 30 мин добавляли насыщенный водный хлорид аммония и смесь экстрагировали дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка кристаллизацией из этилацетата приводила к получению 1,0 г (96%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 252253C). 56. 4-(2,6-Диметилбензиламино)-6-(N-2-гидроксиэтил-N-метиламинокарбонил)-1,2-диметил-1H-бензимидазол. К суспензии 1,0 г (3,1 ммоль) 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 45 мл дихлорметана и 10 мл N,N-диметилформамида добавляли 1,9 г (5,9 ммоль) тетрафторбората O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) и смесь нагревали до 40 С. Через 1 ч добавляли 0,6 мл (8,0 ммоль) 2-(метиламино)этанола при температуре окружающей среды. Через 4 ч реакционную смесь разделяли между 6N водным гидроксидом натрия и дихлорметаном. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Остаток очищали колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1). Кристаллизация из смеси ацетон/диэтиловый эфир приводила к получению 0,77 г (65%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 177-178C). 57. Гидразид 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты. К суспензии 1,0 г (3,1 ммоль) 4-(2,6-диметилбензиламино)-1,2-диметил-1H-бензимидазол-6-карбоновой кислоты в 20 мл тетрагидрофурана и 10 мл N,N-диметилформамида добавляли 0,9 г (5,6 ммоль)N,N'-карбонилдиимидазола. Через 1,5 ч при 60 С раствор охлаждали до 40 С и добавляли 0,3 мл (9,4 ммоль) гидразина. Через 1 ч осадок собирали и перекристаллизовали из 2-пропанола с получением 0,88 г (85%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 277-278C). 58. 4-(2,6-Диметилбензиламино)-6-гидроксиметил-1,2-диметил-1H-бензимидазол. К перемешиваемой суспензии 0,8 г (21 ммоль) алюмогидрида лития в 40 мл сухого тетрагидрофурана медленно добавляли раствор 4,0 г (11,4 ммоль) этил 4-(2,6-диметилбензиламино)-1,2-диметил-1Hбензимидазол-6-карбоксилата в 20 мл сухого тетрагидрофурана при 0 С под атмосферой азота. Через 2 ч добавляли дополнительное количество 0,4 г (10,5 ммоль) алюмогидрида лития и перемешивание продолжали при комнатной температуре в течение 1 ч. Реакционную смесь осторожно гидролизовали 0,3 мл воды, 0,6 мл 6N водного гидроксида калия и 0,3 мл воды. Добавляли безводный сульфат магния, суспензию отфильтровывали через целит и промывали кипящим дихлорметаном. После добавления 50 г силикагеля смесь упаривали досуха и остаток наносили на колонку и элюировали смесью дихлорметан:метанол (20:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из смеси этилацетат/н-гептан с получением 1,4 г (40%) указанного в заголовке соединения в виде бесцветного твердого вещества (tпл 245-246 С). 59. 2-Циклопропил-4-(транс-2,3-дигидро-2-гидрокси-1-инденилокси)-1-метил-1H-бензимидазол-6 карбоновая кислота. К суспензии 1,5 г (5,8 ммоль) этил 2-циклопропил-4-гидрокси-1-метил-1H-бензимидазол-6-карбоксилата и 1,5 г (11,5 ммоль) 1,2-эпоксииндана в 18 мл этанола и 5 мл воды добавляли 1,6 мл триэтиламина и смесь нагревали до 50 С в течение 4 ч. Охлажденный раствор разделяли между дихлорметаном и насыщенным водным хлоридом аммония. Органический слой отделяли, сушили над безводным сульфатом магния и упаривали. Очистка остатка колоночной хроматографией на силикагеле с помощью смеси дихлорметан:метанол (13:1) и кристаллизация из смеси этилацетат/н-гептан приводили к получению 0,8 г твердого вещества, которое суспендировали в 20 мл диоксана и 4 мл 2N водного гидроксида натрия. Через 3 ч при 80 С реакционную смесь охлаждали и рН доводили до рН 6 добавлением 6N соляной кислоты. После добавления 50 г силикагеля смесь упаривали досуха и остаток наносили на колонку и элюировали смесью дихлорметан:метанол (10:1). Упаривание растворителя приводило к получению твердого вещества, которое кристаллизовали из смеси этилацетат/диэтиловый эфир с получением 0,68 г (32%) указанного в заголовке соединения (tпл 132-134C).
МПК / Метки
МПК: C07D 235/06, A61K 31/4184, A61K 31/4245, C07D 403/06, C07D 235/12, C07D 235/08, C07D 403/04, A61K 31/422, A61P 1/04, C07D 413/04
Метки: бензимидазолы, секреции, применение, 4-замещённые, ингибиторов, качестве, желудочной
Код ссылки
<a href="https://eas.patents.su/30-8779-4-zameshhyonnye-benzimidazoly-i-ih-primenenie-v-kachestve-ingibitorov-zheludochnojj-sekrecii.html" rel="bookmark" title="База патентов Евразийского Союза">4-замещённые бензимидазолы и их применение в качестве ингибиторов желудочной секреции</a>
Предыдущий патент: Дигидроптеридиноны, способ их получения и их применение в качестве лекарственных средств
Следующий патент: Способ факофрагментации при факоэмульсификации
Случайный патент: Предохранительная крышка


































