Дигидроптеридиноны, способ их получения и их применение в качестве лекарственных средств
Номер патента: 8778
Опубликовано: 31.08.2007
Авторы: Брандль Трикси, Баум Анке, Шнапп Гизела, Грааэрт Маттиас, Квант Йенс Юрген, Кольбатцки Флориан, Брайтфельдер Штеффен, Штеегмайер Мартин, Солка Флавио, Хоффманн Маттиас, Айккмайер Кристиан
Формула / Реферат
1. Соединения общей формулы (I)
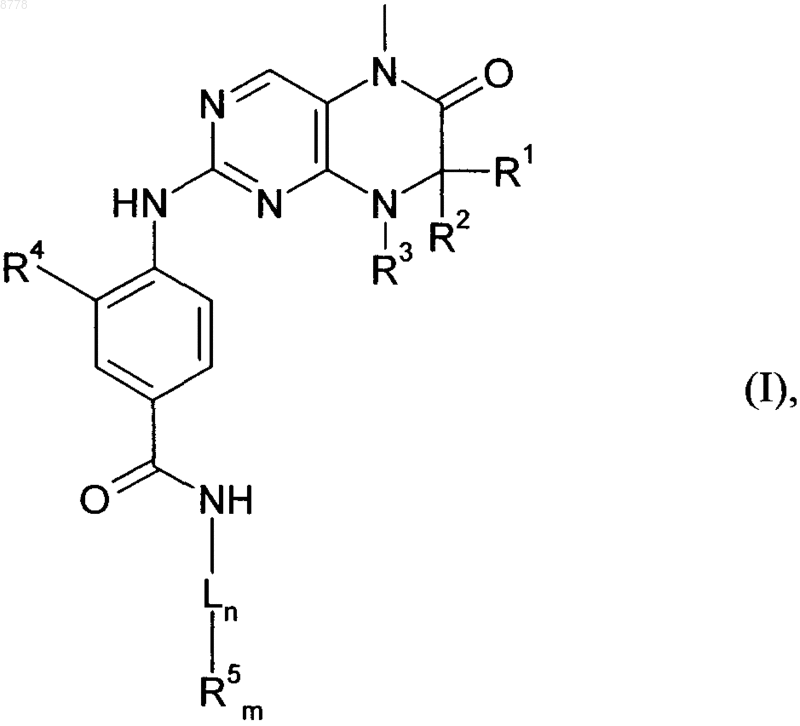
в которой R1 и R2 имеют идентичные или разные значения и обозначают водород или C1-С6алкил или
R1 и R2 совместно образуют 2-5-членный алкильный мостик,
R3 представляет собой водород или остаток, выбранный из группы, включающей С1-С12алкил и С6-С14арил, необязательно замещенные группой -O-C1-С3алкил, С3-С12циклоалкил, С3-С12гетероциклоалкил, содержащий 1-2 гетероатома,
R1 и R3 либо R2 и R3 совместно образуют насыщенный или ненасыщенный С3-С4алкильный мостик,
R4 представляет собой остаток, выбранный из группы, включающей водород, галоген либо C1-С5алкилоксигруппу,
L представляет собой линкер, выбранный из группы, включающей С2-С10алкил, С6-С14арил или С3-С12циклоалкил,
n обозначает 0 или 1,
m обозначает 1,
R5 представляет собой остаток, выбранный из группы, включающей R8-морфолинил, необязательно замещенный одной или несколькими метильными группами, R8-пиперидинил, необязательно замещенный одной или несколькими метильными группами, R8-пиперазинил, R8-пирролидинил, R8-тропанил, R8-азациклогептил, сульфоксоморфолинил, тиоморфолинил или -NR8R9, а
R8 и R9 имеют идентичные или разные значения и каждый представляет собой водород либо остаток, выбранный из группы, включающей C1-С6алкил, -С1-С4алкил-С3-С10циклоалкил, С6-С14арил, -С1-С4алкил-С6-С14арил, пиранил или С1-С4алкилкарбонил-,
необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
2. Соединения общей формулы (I), в которых
R1-R4, R6-R9, L и m имеют указанные выше в п.1 значения,
n обозначает 1, а
R5 представляет собой связанный с L через атом азота остаток, выбранный из группы, включающей R8-морфолинил, необязательно замещенный одной или несколькими метильными группами, R8-пиперидинил, необязательно замещенный одной или несколькими метильными группами, R8-пиперазинил или R8-пирролидинил,
необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
3. Соединения по п.1, в которых
R1-R4, R6-R9, L, n и m имеют указанные выше в п.1 значения, а
R5 представляет собой связанный с L через атом углерода остаток, выбранный из группы, включающей R8-пиперидинил, необязательно замещенный одной или несколькими метильными группами, R8-пиперазинил, R8-пирролидинил, R8-тропанил, R8-морфолинил, необязательно замещенный одной или несколькими метильными группами, или R8-азациклогептил,
необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
4. Соединения по одному из пп.1-3, в которых
L, m, n и R3-R9 имеют указанные выше в пп.1-3 значения, а
R1 и R2 имеют идентичные или разные значения и обозначают остаток, выбранный из группы, включающей водород, Me, Et или Pr, или
R1 и R2 совместно образуют С2-С4алкильный мостик,
необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
5. Соединения по одному из пп.1-4, в которых
R1-R3, m, n и R5-R9 имеют указанные выше в пп.1-4 значения, а
L представляет собой линкер, выбранный из группы, включающей фенил, циклогексил и разветвленный C1-С6алкил,
необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
6. Соединения общей формулы (I) по пп.1-5, представляющие собой следующие дигидроптеридиноны:

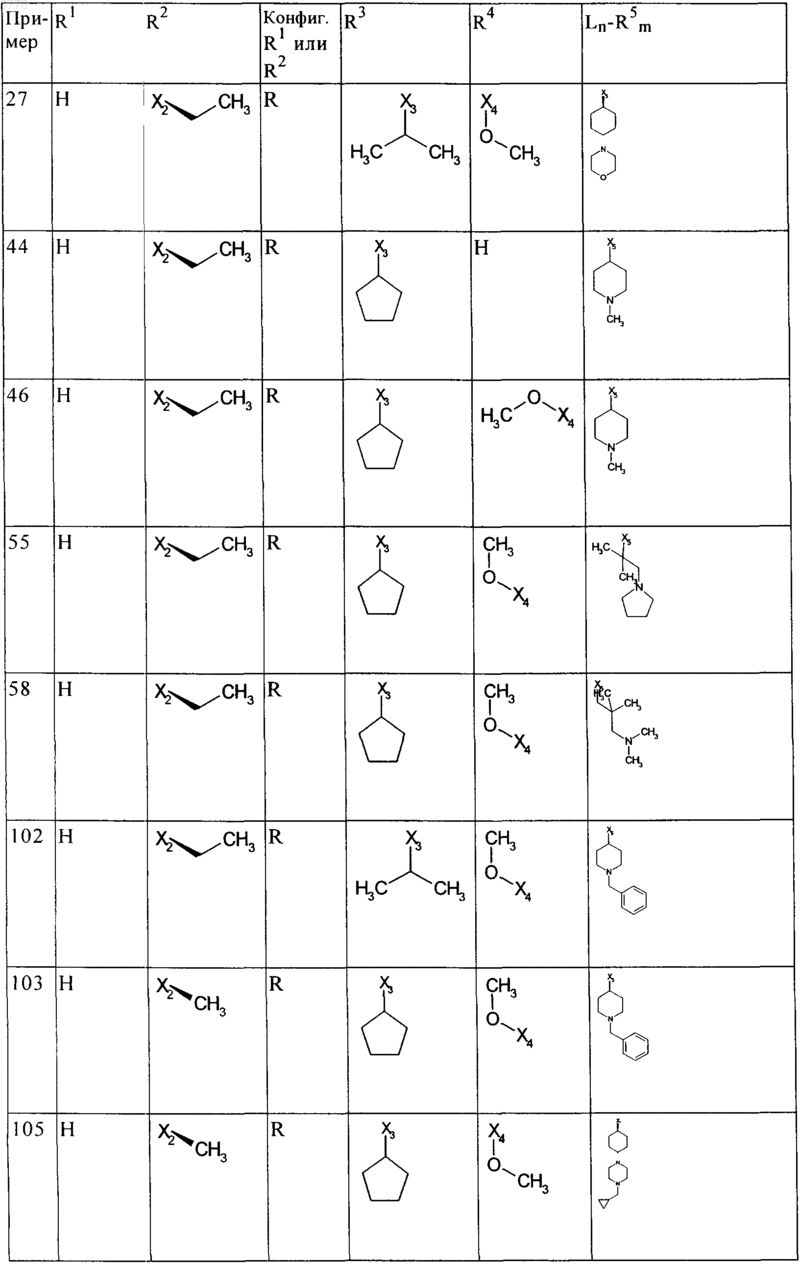
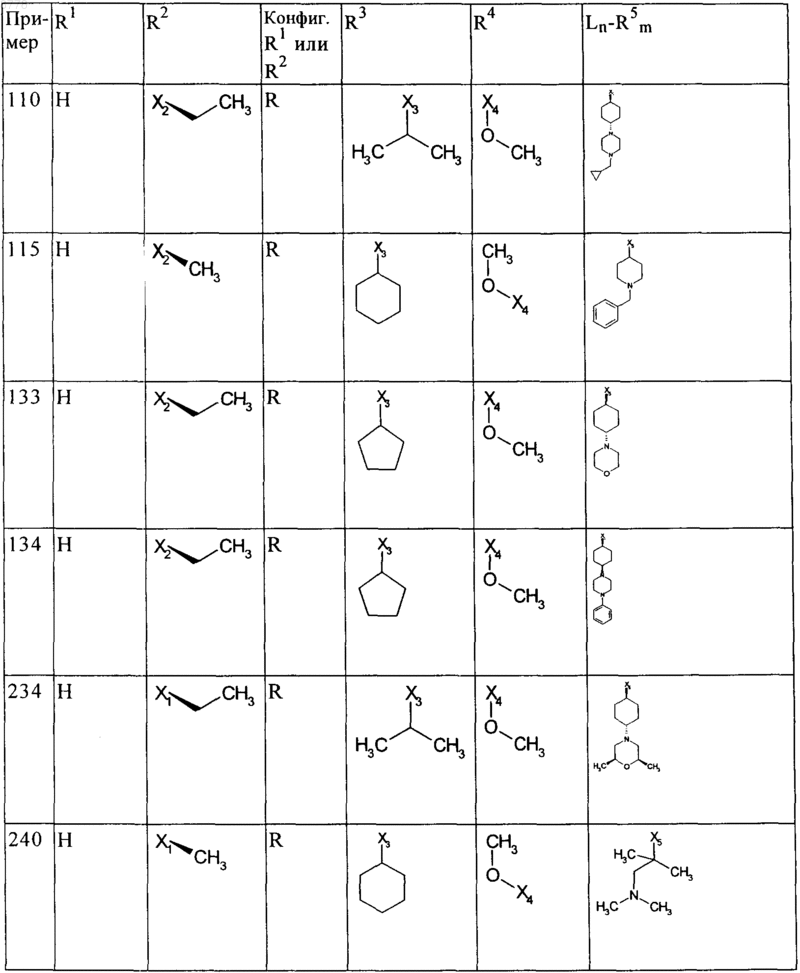
причем используемые выше сокращения Х1, Х2, Х3, Х4 и Х5 в каждом случае поддерживают связь с определенным положением вместо соответствующих остатков R1, R2, R3, R4 и Ln-R5, указанных в приведенной выше общей формуле (I), необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей.
7. Применение соединения формулы (I) по одному из пп.1-6 для получения лекарственного средства, предназначенного для лечения и/или предупреждения рака, инфекционных заболеваний, воспалительных заболеваний и аутоиммунных заболеваний.
8. Способ лечения и/или предупреждения рака, инфекционных заболеваний, воспалительных заболеваний и аутоиммунных заболеваний, отличающийся тем, что пациенту вводят эффективное количество соединения формулы (I) по одному из пп.1-6.
9. Фармацевтические композиции, содержащие в качестве действующего вещества одно либо несколько соединений общей формулы (I) по одному из пп.1-6 или его (их) физиологически приемлемые соли, при необходимости совместно с обычными вспомогательными веществами и/или носителями.
10. Способ получения соединения общей формулы (I)
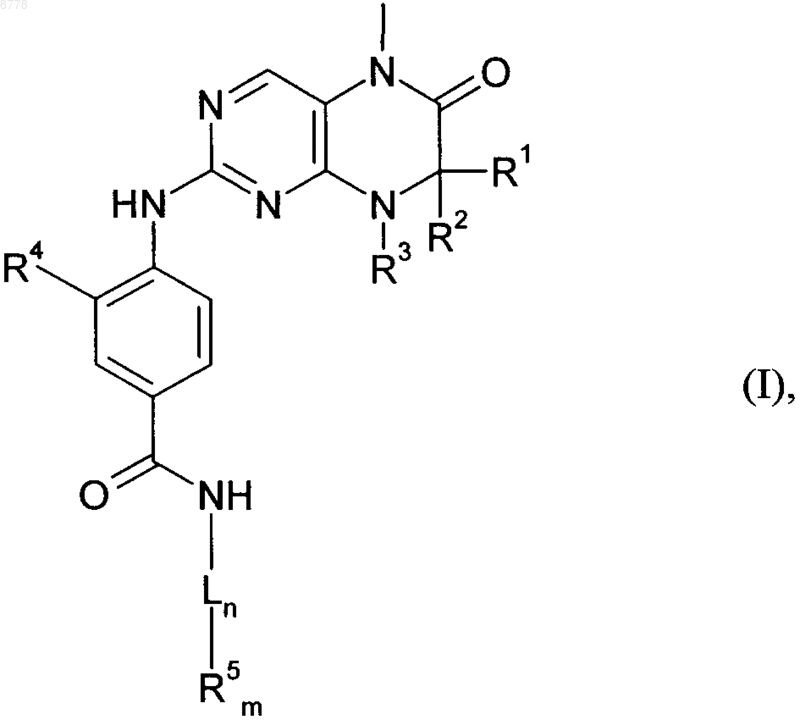
в которой R1-R5, m, n и L имеют значения, указанные в пп.1-5, отличающийся тем, что соединение общей формулы (II)

в которой R1-R3 имеют значения, указанные в пп.1-5, а А обозначает уходящую группу, выбранную из группы, включающей -О-метил, -SCN, хлор, бром, иод, метансульфонил, трифторметансульфонил и толуолсульфонил, подвергают взаимодействию с необязательно замещенным соединением общей формулы (III)

в которой R4 имеет значения, указанные в пп.1-5, a R10 представляет собой группу -ОН, -NH-L-R5, -О-метил или -О-этил, где R5 имеет значения, указанные в пп.1-5, и затем при определенных условиях продукт общей формулы (IV)

в которой R1-R4 имеют значения, указанные в пп.1-5, a R10 представляет собой группу -ОН, -NH-L-R5, -О-метил или -О-этил, где R5 имеет значения, указанные в пп.1-5, при необходимости после предшествующего гидролиза сложноэфирной группы -COR10, подвергают взаимодействию с амином общей формулы (V)
NH2-L-R5m (V),
в которой R5 имеет значения, указанные в пп.1-5.
11. Соединение формулы (II)
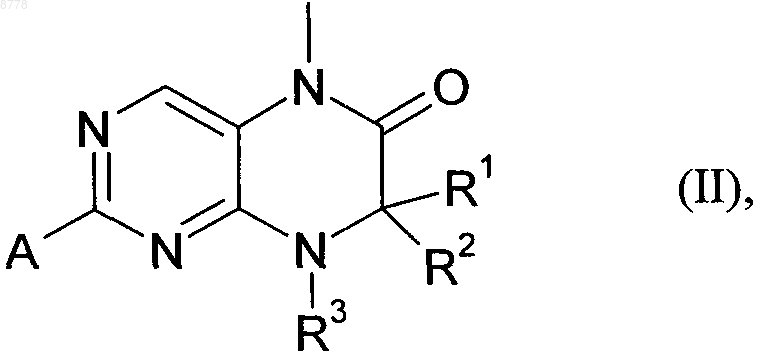
в которой R1-R3 имеют значения, указанные в пп.1-5, а А обозначает уходящую группу, выбранную из группы, включающей -О-метил, -SCN, хлор, бром, иод, метансульфонил, трифторметансульфонил и толуолсульфонил.
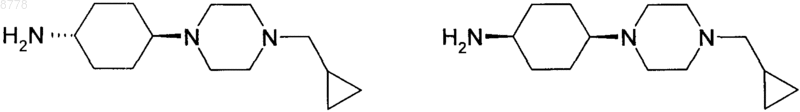
12. Промежуточное соединение для получения соединения формулы (I) по одному из пп.1-5, в которой
L представляет собой циклогексил,
n обозначает 1,
m обозначает 1, а
R5 представляет собой 4-циклопропилметилпиперазинил,
причем промежуточное соединение представляет собой цис- или транс-4-(4-циклопропилметилпиперазин-1-ил)циклогексиламин соответственно
Текст
008778 Настоящее изобретение относится к новым дигидроптеридинонам общей формулы (I) в которой остатки L, R1, R2, R3, R4 и R5 имеют указанные в формуле изобретения и в описании значения,к их изомерам, к способу получения этих дигидроптеридинонов, а также к их применению в качестве лекарственных средств. Предпосылки создания изобретения Производные птеридинонов известны из уровня техники в качестве действующих веществ, обладающих антипролиферативным действием. Так, в частности, в заявке WO 01/019825 описывается применение производных птеридинонов для лечения онкологических и вирусных заболеваний. Устойчивость многих видов опухолей обусловливает необходимость разработки и создания новых высокоэффективных противоопухолевых лекарственных средств. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача получить новые соединения, обладающие противовоспалительным и антипролиферативным действием. Подробное описание изобретения При создании изобретения было установлено, что соединения общей формулы (I), в которой остатки L и R1-R5 имеют указанные ниже значения, неожиданно проявляют эффективность в качестве ингибиторов особых киназ, участвующих в регуляции клеточного цикла. Благодаря этому предлагаемые в изобретении соединения могут применяться, например, для лечения заболеваний, которые так или иначе связаны с активностью специфических киназ, участвующих в регуляции клеточного цикла, и при которых характерна избыточная или аномальная пролиферация клеток. В соответствии с этим настоящее изобретение относится к соединениям общей формулы (I)R1 и R2 имеют идентичные или разные значения и обозначают водород или необязательно замещенный C1-С 6 алкил илиR1 и R2 совместно образуют 2-5-членный алкильный мостик, который может содержать 1-2 гетероатома,R3 представляет собой водород или остаток, выбранный из группы, включающей необязательно замещенный С 1-С 12 алкил, С 2-С 12 алкенил, С 2-С 12 алкинил и С 6-С 14 арил, либо остаток, выбранный из группы,включающей необязательно замещенный и/или соединенный мостиковой связью С 3-С 12 циклоалкил, С 3 С 12 циклоалкенил, С 7-С 12 полициклоалкил, С 7-С 12 полициклоалкенил, С 5-С 12 спироциклоалкил, С 3-С 12 гетероциклоалкил, содержащий 1-2 гетероатома, и С 3-С 12 гетероциклоалкенил, содержащий 1-2 гетероатома, илиR1 и R3 либо R2 и R3 совместно образуют насыщенный или ненасыщенный С 3-С 4 алкильный мостик,который может содержать 1 гетероатом,R4 представляет собой остаток, выбранный из группы, включающей водород, -CN, гидроксигруппу,-NR6R7 и галоген, либо остаток, выбранный из группы, включающей необязательно замещенный C1 С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 1-С 5 алкилоксигруппу, С 2-С 5 алкенилоксигруппу, С 2-С 5 алкинилоксигруппу, C1-С 6 алкилтиогруппу, C1-С 6 алкилсульфоксогруппу и C1-С 6 алкилсульфонил,L представляет собой линкер, выбранный из группы, включающей необязательно замещенный С 2-1 008778 С 10 алкил, С 2-С 10 алкенил, С 6-С 14 арил, -С 2-С 4 алкил-С 6-С 14 арил, -С 6-С 14 арил-C1-С 4 алкил, необязательно соединенный мостиковой связью С 3-С 12 циклоалкил и гетероарил, содержащий 1 или 2 атома азота,n обозначает 0 или 1,m обозначает 1 или 2,R5 представляет собой остаток, выбранный из группы, включающей необязательно замещенный морфолинил, пиперидинил, пиперазинил, пиперазинилкарбонил, пирролидинил, тропенил, R8-дикетометилпиперазинил, сульфоксоморфолинил, сульфонилморфолинил, тиоморфолинил, -NR8R9 и азациклогептил,R6 и R7 имеют идентичные или разные значения и обозначают водород или С 1-С 4 алкил иR8 и R9 представляют собой незамещенные азотные заместители при R5, имеют идентичные или разные значения и обозначают либо водород, либо остаток, выбранный из группы, включающей C1-С 6 алкил, -С 1-С 4 алкил-С 3-С 10 циклоалкил, С 3-С 10 циклоалкил, С 6-С 14 арил, -С 1-С 4 алкил-С 6-С 14 арил, пиранил, пиридинил, пиримидинил, С 1-С 4 алкилоксикарбонил, С 6-С 14 арилкарбонил-, С 1-С 4 алкилкарбонил-, С 6-С 14 арилметилоксикарбонил-, С 6-С 14 арилсульфонил-, С 1-С 4 алкилсульфонил- и С 6-С 14 арил-С 1-С 4 алкилсульфонил-,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Предпочтительными являются те соединения формулы (I), гдеR1-R4, R6 и R7 имеют указанные выше значения, аL представляет собой линкер, выбранный из группы, включающей необязательно замещенный С 2 С 10 алкил, С 2-С 10 алкенил, С 6-С 14 арил, -С 2-С 4 алкил-С 6-С 14 арил, -С 6-С 14 арил-С 1-С 4 алкил, необязательно соединенный мостиковой связью С 3-С 12 циклоалкил и гетероарил, содержащий 1 или 2 атома азота,n обозначает 1,m обозначает 1 или 2,R5 представляет собой связанный с L через атом азота остаток, выбранный из группы, включающей необязательно замещенный морфолинил, пиперидинил, R8-пиперазинил, пирролидинил, тропенил, R8-дикетометилпиперазинил, сульфоксоморфолинил, сульфонилморфолинил, тиоморфолинил, -NR8R9 и азациклогептил,R8 и R9 представляют собой незамещенные азотные заместители при R5, имеют идентичные или разные значения и обозначают водород либо остаток, выбранный из группы, включающей C1-С 6 алкил,-С 1-С 4 алкил-С 3-С 10 циклоалкил, С 3-С 10 циклоалкил, С 6-С 14 арил, -С 1-С 4 алкил-С 6-С 14 арил, пиранил, пиридинил, пиримидинил, С 1-С 4 алкилоксикарбонил, С 6-С 14 арилкарбонил-, С 1-С 4 алкилкарбонил-, С 6-С 14 арилметилоксикарбонил-, С 6-С 14 арилсульфонил-, С 1-С 4 алкилсульфонил- и С 6-С 14 арил-С 1-С 4 алкилсульфонил-,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Предпочтительны далее те соединения формулы (I), гдеR1-R4, R6 и R7 имеют указанные выше значения, аL представляет собой линкер, выбранный из группы, включающей необязательно замещенный С 2 С 10 алкил, С 2-С 10 алкенил, С 6-С 14 арил, -С 2-С 4 алкил-С 6-С 14 арил, -С 6-С 14 арил-С 1-С 4 алкил, необязательно соединенный мостиковой связью С 3-С 12 циклоалкил и гетероарил, содержащий 1 или 2 атома азота,n обозначает 0 или 1,m обозначает 1 или 2,R5 представляет собой связанный с L через атом углерода остаток, выбранный из группы, включающей R8-пиперидинил-, R8R9-пиперазинил-, R8-пирролидинил, R8-пиперазинилкарбонил-, R8-тропенил, R8-морфолинил и R8-азациклогептил, аR8 и R9 представляют собой незамещенные азотные заместители при R5, имеют идентичные или разные значения и обозначают водород либо остаток, выбранный из группы, включающей C1-С 6 алкил,-С 1-С 4 алкил-С 3-С 10 циклоалкил, С 3-С 10 циклоалкил, С 6-С 14 арил, -С 1-С 4 алкил-С 6-С 14 арил, пиранил, пиридинил, пиримидинил, С 1-С 4 алкилоксикарбонил, С 6-С 14 арилкарбонил-, С 1-С 4 алкилкарбонил-, С 6-С 14 арилметилоксикарбонил-, С 6-С 14 арилсульфонил-, С 1-С 4 алкилсульфонил- и С 6-С 14 арил-С 1-С 4 алкилсульфонил-,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. К особенно предпочтительным относятся те соединения формулы (I), гдеL, m, n и R3-R9 имеют указанные выше значения, аR1 и R2 имеют идентичные или разные значения и обозначают остаток, выбранный из группы,включающей водород, Me, Et, Pr, илиR1 и R2 совместно образуют С 2-С 4 алкильный мостик,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Наиболее предпочтительными являются те соединения формулы (I), гдеR1, R2, m, n и R5-R8 имеют указанные выше значения, аR3 представляет собой остаток, выбранный из группы, включающей необязательно замещенный C1 С 10 алкил, С 3-С 7 циклоалкил, С 3-С 6 гетероциклоалкил и С 6-С 14 арил, илиR1 и R3 либо R2 и R3 совместно образуют насыщенный или ненасыщенный С 3-С 4 алкильный мостик,-2 008778 который может содержать 1-2 гетероатома,R4 представляет собой остаток, выбранный из группы, включающей водород, ОМе, ОН, Me, Et, Рr,OEt, NHMe, NH2, F, Cl, Br, О-пропаргил, О-бутинил, CN, SMe, NMe2, CONH2, этинил, пропинил, бутинил и аллил, иL представляет собой линкер, выбранный из группы, включающей необязательно замещенный фенил, фенилметил, циклогексил и разветвленный С 1-С 6 алкил,необязательно в виде их таутомеров, их рацематов, их энантиомеров, их диастереомеров и их смесей, а также необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей. Еще одним объектом изобретения являются соединения формулы (I) для их применения в качестве лекарственных средств. Особое значение согласно изобретению придается соединениям формулы (I) для их применения в качестве лекарственных средств с антипролиферативным действием. Еще одним объектом изобретения является применение соединения формулы (I) для получения лекарственного средства, предназначенного для лечения и/или предупреждения рака, инфекционных, воспалительных и аутоиммунных заболеваний. Еще одним объектом изобретения является способ лечения и/или предупреждения рака, инфекционных, воспалительных и аутоиммунных заболеваний, который отличается тем, что пациенту вводят эффективное количество соединения формулы (I). Еще одним объектом изобретения являются фармацевтические композиции, содержащие в качестве действующего вещества одно либо несколько соединений общей формулы (I) или его (их) физиологически совместимые соли, при необходимости в сочетании с обычными вспомогательными веществами и/или носителями. Еще одним объектом изобретения является способ получения соединения общей формулы (I) в которой R1-R5 , m, n и L имеют указанные выше значения, который отличается тем, что соединение общей формулы (II) в которой R1-R3 имеют указанные выше значения, а А обозначает уходящую группу, подвергают взаимодействию с необязательно замещенным соединением общей формулы (III) в которой R4 имеет указанные выше значения, a R10 представляет собой группу ОН, NH-L-R5,-О-метил,-О-этил, и затем при определенных условиях продукт общей формулы (IV) в которой R1-R4 имеют указанные выше значения, a R10 представляет собой группу ОН, -NH-L-R5, -О-ме-3 008778 тил или -О-этил, при необходимости после предшествующего гидролиза сложноэфирной группы -COR10,подвергают взаимодействию с амином общей формулы (V)NH2-L-R5m (V) 5 в которой R имеет указанные выше значения. Еще одним объектом изобретения является соединение формулы (II) в которой R1-R3 имеют указанные выше значения, а А обозначает уходящую группу. Под алкильными группами индивидуально и в качестве фрагментов других остатков подразумеваются разветвленные и неразветвленные алкильные группы, содержащие от 1 до 12 атомов углерода,предпочтительно 1-6, особенно предпочтительно 1-4 атома углерода, например метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил и додецил. Под упомянутыми выше остатками, к которым относятся пропил, бутил, пентил, гексил, гептил, октил, нонил, децил и додецил, подразумеваются также, если не указано иное, все их возможные изомерные формы. Так, например, понятие "пропил" включает оба изомерных остатка н-пропил и изопропил, понятие "бутил" включает н-бутил, изобутил,втор-бутил и тpeт-бутил, понятие "пентил" включает изопентил, неопентил и т.д. В вышеназванных алкильных группах один или несколько атомов водорода при определенных условиях могут быть заменены на другие остатки. Так, например, эти алкильные группы могут быть замещены атомами фтора. При определенных условиях возможна также замена всех атомов водорода алкильной группы. Понятием "алкильный мостик" обозначаются, если не указано иное, разветвленные либо неразветвленные алкильные группы, содержащие 1-5 атомов углерода, например метиленовые, этиленовые, пропиленовые, изопропиленовые, н-бутиленовые, изобутильные, втор-бутильные, трет-бутильные и тому подобные мостики. Особенно предпочтительными являются метиленовые, этиленовые, пропиленовые и бутиленовые мостики. В названных алкильных мостиках 1-2 С-атома при определенных условиях могут быть заменены на один или несколько гетероатомов, выбранных из группы, включающей кислород, азот и серу. Под алкенильными группами (включая и те случаи, когда эти группы являются компонентами других остатков) подразумеваются разветвленные либо неразветвленные алкенильные группы, содержащие от 2 до 10 атомов углерода, предпочтительно от 2 до 6, особенно предпочтительно 2-3 атома углерода,при условии, что они имеют по меньшей мере одну двойную связь. В качестве примера можно назвать этенил, пропенил, бутенил, пентенил и т.п. Если не указано иное, то из числа вышеназванных понятий пропенил, бутенил и т.п. включают все возможные изомерные формы. Так, например, понятие "бутенил" включает 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-1-пропенил, 2-метил-2-пропенил и 1-этил-1-этенил. В вышеназванных алкенильных группах, если не указано иное, один или несколько атомов водорода при определенных условиях могут быть заменены на другие остатки. Так, например, эти алкенильные группы могут быть замещены атомами галогена фтора. При определенных условиях возможна также замена всех атомов водорода алкенильной группы. Под алкинильными группами (включая и те случаи, когда эти группы являются компонентами других остатков) подразумеваются разветвленные либо неразветвленные алкинильные группы, содержащие от 2 до 10 атомов углерода, при условии, что они имеют по меньшей мере одну тройную связь, в качестве примера можно назвать этинил, пропинил, бутинил, пентинил, гексинил и т.п., предпочтительны из них этинил и пропинил. В вышеназванных алкинильных группах, если не указано иное, один или несколько атомов водорода при определенных условиях могут быть заменены на другие остатки. Так, например, эти алкинильные группы могут быть замещены атомами фтора. При определенных условиях возможна также замена всех атомов водорода алкинильной группы. Понятием "арил" обозначается ароматическая циклическая система, содержащая от 6 до 14 атомов углерода, предпочтительно 6 или 10 атомов углерода, предпочтительно фенил, который, если не указано иное, может нести, например, один или несколько следующих заместителей: группу ОН, NO2, CN, -OCHF2,-OCF3, -NH2, галоген, предпочтительно фтор либо хлор, C1-С 10 алкил, предпочтительно С 1-С 5 алкил, более предпочтительно С 1-С 3 алкил, особенно предпочтительно метил или этил, -O-C1-С 3 алкил, предпочтительно -О-метил или -О-этил, группу -СООН, -СОО-С 1-С 4 алкил, предпочтительно -О-метил или -О-этил,группу -CONH2. В качестве гетероарильных остатков, в которых вплоть до 2 С-атомов могут быть заменены на 1 или 2 атома азота, можно назвать, например, пиррол, пиразол, имидазол, тиазол, пиридин и пиримидин,при этом каждый из вышеназванных гетероарильных циклов может быть, в свою очередь, при определенных условиях аннелирован с бензольным кольцом, предпочтительно с бензимидазолом, и, кроме того,эти гетероциклы, если не указано иное, могут нести, например, один или несколько следующих замести-4 008778 телей: F, Cl, Br, ОН, ОМе, метил, этил, CN, CONH2, NH2, необязательно замещенный фенил, необязательно замещенный гетероарил, предпочтительно необязательно замещенный пиридил. Под циклоалкильными остатками подразумеваются циклоалкильные остатки, содержащие от 3 до 12 атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, предпочтительно циклопропил, циклопентил или циклогексил, при этом каждый из вышеназванных циклоалкильных остатков, в свою очередь, может нести при определенных условиях один или несколько заместителей, например группу ОН, NO2, CN, OMe, -OCHF2, -OCF3, -NH2 или галоген, предпочтительно фтор или хлор, C1-С 10 алкил, предпочтительно С 1-С 5 алкил, более предпочтительно C1-С 3 алкил, особенно предпочтительно метил или этил, -О-С 1-С 3 алкил, предпочтительно -О-метил или -О-этил,-СООН, -СOO-С 1-С 4 алкил, предпочтительно -СОО-метил либо -СОО-этил, или -CONH2. Особенно предпочтительными заместителями циклоалкильных остатков являются =O, группа ОН, NH2, метил или F. Под циклоалкенильными остатками подразумеваются циклоалкильные остатки, содержащие от 3 до 12 атомов углерода и имеющие по меньшей мере одну двойную связь, например циклопропенил, циклобутенил, циклопентенил, циклогексенил или циклогептенил, предпочтительно циклопропенил, циклопентенил или циклогексенил, при этом каждый из вышеназванных циклоалкенильных остатков, в свою очередь, может нести при определенных условиях один или несколько заместителей."=O" обозначает присоединенный через двойную связь атом кислорода. Под гетероциклоалкильными остатками подразумеваются, если не указано иное, 5-, 6- или 7-членные насыщенные либо ненасыщенные гетероциклы, которые могут содержать в качестве гетероатомов азот,кислород либо серу, например тетрагидрофуран, тетрагидрофуранон, -бутиролактон, -пиран, -пиран,диоксолан, тетрагидропиран, диоксан, дигидротиофен, тиолан, дитиолан, пирролин, пирролидин, пиразолин, пиразолидин, имидазолин, имидазолидин, тетразол, пиперидин, пиридазин, пиримидин, пиразин,пиперазин, триазин, тетразин, морфолин, тиоморфолин, диазепан, оксазин, тетрагидрооксазинил, изотиазол и пиразолидин, предпочтительно морфолин, пирролидин, пиперидин или пиперазин, при этом такой гетероцикл, в свою очередь, может нести при определенных условиях заместители, например С 1-С 4 алкил,предпочтительно метил, этил или пропил. Под полициклоалкильными остатками подразумеваются необязательно замещенные би-, три-, тетра- или пентациклические циклоалкильные остатки, например пинан, 2,2,2-октан, 2,2,1-гептан или адамантан. Под полициклоалкенильными остатками подразумеваются необязательно соединенные мостиковой связью и/или замещенные 8-членные би-, три-, тетра- или пентациклические циклоалкенильные остатки, предпочтительно бициклоалкенильные или трициклоалкенильные остатки, при условии, что они имеют по меньшей мере одну двойную связь, например норборнен. Под спироалкильными остатками подразумеваются необязательно замещенные спироциклические С 5-С 12 алкильные остатки. Понятием "галоген" обозначается, как правило, фтор, хлор, бром или иод, предпочтительно фтор,хлор или бром, особенно предпочтительно хлор. Под уходящей группой А, имеющей идентичные либо разные значения, подразумевается такая уходящая группа, как, например, -о-метил, -SCN, хлор, бром, иод, метансульфонил, трифторметансульфонил или n-толуолсульфонил, предпочтительно хлор. Предлагаемые в изобретении соединения могут быть представлены в виде отдельных оптических изомеров, смесей отдельных энантиомеров, диастереомеров или рацематов, в виде таутомеров, а также в виде свободных оснований или соответствующих кислотно-аддитивных солей, образованных с фармакологически приемлемыми кислотами, например кислотно-аддитивных солей с галогеноводородными кислотами, такими как хлористо- или бромисто-водородная кислота, либо с органическими кислотами, такими как щавелевая, фумаровая, дигликолевая или метансульфоновая кислота. Заместитель R1 может представлять собой водород или остаток из группы, включающей необязательно замещенный и/или разветвленный C1-С 6 алкил, предпочтительно метил или этил. Заместитель R2 может представлять собой водород или остаток из группы, включающей необязательно замещенный и/или разветвленный С 1-С 6 алкил, предпочтительно метил или этил.R1 и R2 могут совместно образовывать 2-5-членный алкильный мостик, предпочтительно этиленовый,пропиленовый или бутиленовый мостик, который может содержать 1-2 гетероатома, предпочтительно кислород или азот, особенно предпочтительны из названных этиленовый и пропиленовый мостики. Заместитель R3 может представлять собой водород или остаток, выбранный из группы, включающей необязательно замещенный С 1-С 12 алкил, предпочтительно этил, пропил, бутил, пентил или гексил,особенно предпочтительно пропил, бутил, пентил или гексил, С 2-С 12 алкенил, предпочтительно С 5-С 7 алкенил, С 2-С 12 алкинил, предпочтительно С 5-С 7 алкинил, и С 6-С 14 арил, предпочтительно фенил, или может представлять собой остаток, выбранный из группы, включающей необязательно замещенный и/или соединенный мостиковой связью С 3-С 12 циклоалкил, предпочтительно циклопентил или циклогексил, С 3 С 12 циклоалкенил, предпочтительно С 5-С 7 циклоапкенил, С 7-С 12 полициклоалкил, С 7-С 12 полициклоалкенил,С 5-С 12 спироциклоалкил, С 3-С 12 гетероциклоалкил, предпочтительно пиранил или пиперинил, пирролидинил, пиразинил или морфолинил, содержащий 1-2 гетероатома, предпочтительно кислород или азот, и С 3-С 12 гетероциклоалкенил, содержащий 1-2 гетероатома, предпочтительно кислород или азот. НаиболееR1 и R3 либо R2 и R3 могут совместно образовывать насыщенный или ненасыщенный С 3-С 4 алкильный мостик, который может содержать 1 гетероатом, предпочтительно кислород или азот. Заместитель R4 может представлять собой остаток, выбранный из группы, включающей водород,-CN, гидроксигруппу, -NR6R7 и галоген, предпочтительно хлор или фтор, особенно предпочтительно хлор, или представлять собой остаток, выбранный из группы, включающей необязательно замещенный С 1-С 6 алкил, предпочтительно метил, этил или пропил, С 2-С 6 алкенил, предпочтительно этинил или пропенил, С 2-С 6 алкинил, предпочтительно этинил, пропинил или бутинил, С 1-С 5 алкилоксигруппу, предпочтительно метокси-, этокси- или пропаргилоксигруппу, С 2-С 5 алкенилоксигруппу, С 2-С 5 алкинилоксигруппу, C1-С 6 алкилтиогруппу, С 1-С 6 алкилсульфоксогруппу и С 1-С 6 алкилсульфонил. Наиболее предпочтительными в качестве заместителя R4 являются метоксигруппа, метил, этоксигруппа, этил, пропаргилоксигруппа или хлор.L может представлять собой линкер, выбранный из группы, включающей необязательно замещенный С 2-С 10 алкил, предпочтительно этил, пропил, бутил или пентил, С 2-С 10 алкенил, С 6-С 14 арил, предпочтительно фенил, -С 2-С 4 алкил-С 6-С 14 арил, -С 6-С 14 арил-С 1-С 4 алкил, предпочтительно -фенилметил, необязательно соединенный мостиковой связью С 3-С 12 циклоалкил, предпочтительно циклогексил, и гетероарил, содержащий 1-2 атома азота.R5 может представлять собой остаток, выбранный из группы, включающей необязательно замещенный морфолинил, пиперидинил, пиперазинил, пиперазинилкарбонил, пирролидинил, тропенил, R8-дикетометилпиперазинил, сульфоксоморфолинил, сульфонилморфолинил, тиоморфолинил, -NR8R9 и азациклогептил, предпочтительно пиперидинил, морфолинил, пирролидинил, сульфоксоморфолинил, пиперазинил, тиоморфолинил или тропенил. Остатки R6 и R7 могут быть идентичными или разными и представлять собой водород или С 1-С 4 алкил, предпочтительно метил или этил. Остатки R8 и R9 могут представлять собой незамещенные азотные заместители при R5, иметь идентичные или разные значения и обозначать либо водород, либо остаток, выбранный из группы, включающей С 1-С 6 алкил, предпочтительно метил, этил или пропил, -С 1-С 4 алкил-С 3-С 10 циклоалкил, предпочтительноR10 может представлять собой заместитель, выбранный из группы, включающей группу ОН, NH2LR5, -О-метил и -О-этил, предпочтительно группу ОН, LR5, -О-метил или -О-этил. Все остатки, указанные при раскрытии значений R1-R10, при определенных условиях могут быть разветвленными и/или могут быть замещены. Предлагаемые в изобретении соединения можно синтезировать с помощью описанного ниже способа А, при этом заместители в общих формулах (А 1)-(А 9) имеют указанные выше значения. Представленный способ служит лишь для более подробного пояснения изобретения, не ограничивая при этом его объем. Способ А Стадия 1 А. Соединение формулы (А 1) взаимодействием с соединением формулы (А 2) превращают в соединение формулы (A3) (схема 1 А). Данную реакцию можно проводить согласно WO 00/43369 или WO 00/43372. Соединение (А 1) является коммерчески доступным продуктом и поставляется, в частности, фирмой CityChemical LLC, расположенной по адресу: 139 Allings Crossing Road, West Haven, CT, 06516, USA. Соединение (А 2) можно получать по известной из литературы методике: a) F. Effenberger, U. Burkhart, J. Willfahrt,Liebigs Ann. Chem. 1986, cc. 314-333; б) T. Fukuyama, C.-K. Jow, M. Cheung, Tetrahedron Lett. 1995, 36, cc. 6373-6374; в) R.K. Olsen, J. Org. Chem. 1970, 35, cc. 1912-1915; г) F.E. Dutton, B.H. Byung, Tetrahedron-6 008778 На стадии 1 А 1 экв. соединения (А 1) и 1-1,5 экв., предпочтительно 1,1 экв., соответствующего основания, предпочтительно карбоната калия, гидрокарбоната калия, карбоната натрия либо гидрокарбоната натрия, карбоната кальция, особенно предпочтительно карбоната калия, перемешивают в разбавителе,необязательно с водой, например в ацетоне, тетрагидрофуране, диэтиловом эфире циклогексане, петролейном эфире или диоксане, предпочтительно в циклогексане или диэтиловом эфире. Далее при температуре в интервале от 0 до 15 С, предпочтительно от 5 до 10 С, по каплям добавляют 1 экв. аминокислоты формулы (А 2), растворенный в органическом растворителе, например в ацетоне, тетрагидрофуране,диэтиловом эфире, циклогексане или диоксане. Реакционную смесь нагревают при перемешивании до температуры в интервале от 18 до 30 С, предпочтительно до примерно 22 С, и затем продолжают перемешивание в течение последующих 10-24 ч, предпочтительно примерно в течение 12 ч. После этого разбавитель отгоняют, остаток смешивают с водой и смесь дважды или трижды экстрагируют с помощью органического растворителя, например диэтилового эфира или этилацетата. Объединенные органические экстракты сушат, а растворитель отгоняют. Остаток (соединение (A3 можно без предварительной очистки использовать на стадии 2. Стадия 2 А. Полученное на стадии 1 А соединение (A3) восстанавливают по нитрогруппе и циклизуют с образованием соединения (А 4) (схема 2 А). Схема 2 А На стадии 2 А 1 экв. нитросоединения (A3) растворяют в соответствующей кислоте, предпочтительно в ледяной уксусной кислоте, муравьиной кислоте либо водной соляной кислоте, прежде всего в ледяной уксусной кислоте, и нагревают до 50-70 С, предпочтительно до примерно 60 С. Затем вплоть до завершения экзотермической реакции добавляют восстановитель, например цинк, олово или железо, предпочтительно железный порошок, и в течение 0,2-2 ч, предпочтительно в течение 0,5 ч, перемешивают при температуре в интервале от 100 до 125 С, предпочтительно при температуре порядка 117 С. После охлаждения до комнатной температуры соль железа отфильтровывают, а растворитель отгоняют. Остаток растворяют в соответствующем растворителе либо в смеси растворителей, например в этилацетате или в смеси дихлорметана/метанола, взятых в соотношении 9:1, и полунасыщенного раствора NaCl, и фильтруют, например, через кизельгур. Органическую фазу сушат и концентрируют. Остаток (соединение (А 4 можно очищать с помощью хроматографии или путем кристаллизации либо использовать его в качестве сырого продукта на стадии 3 А синтеза. Стадия 3 А. Полученное на стадии 2 А соединение (А 4) можно путем электрофильного замещения согласно схеме 3 А превращать в соединение формулы (А 5). Схема 3 А На стадии 3 А 1 экв. амида формулы (А 4) растворяют в соответствующем органическом растворителе, например в диметилформамиде либо диметилацетамиде, предпочтительно в диметилацетамиде, и охлаждают до температуры в интервале от примерно -5 до +5 С, предпочтительно до 0 С. Затем добавляют 0,9-1,3 экв. гидрида натрия и 0,9-1,3 экв. метилирующего агента, например метилиодида. Реакционную смесь в течение 0,1-3 ч, предпочтительно в течение приблизительно 1 ч, перемешивают при 010 С, предпочтительно при температуре порядка 5 С, после чего в случае необходимости ее можно выдерживать в указанном интервале температур в течение последующих 12 ч. Затем реакционную смесь сливают на смесь воды и льда и осадок выделяют. Остаток (соединение (А 5 можно очищать с помощью хроматографии, предпочтительно на силикагеле, либо путем кристаллизации или использовать в качестве сырого продукта на стадии 4 А синтеза. Стадия 4 А. Аминирование полученного на стадии 3 А соединения (А 5) с получением соединения формулы (А 9)(схема 4 А) можно осуществлять по известным из литературы методам, а именно в соответствии со сле-7 008778 дующими вариантами: 4.1 А (a) M.P.V. Boarland, J.F.W. McOmie, J. Chem. Soc. 1951, cc. 1218-1221; б) Например, согласно варианту 4.1 А 1 экв. соединения (А 5) и 1-3 экв., предпочтительно 2 экв., соединения (А 6) без использования растворителя либо в соответствующем органическом растворителе,таком, например, как сульфолан, диметилформамид, диметилацетамид, толуол, N-метилпирролидон,диметилсульфоксид или диоксан, предпочтительно в сульфолане, нагревают до 100-220 С, предпочтительно до примерно 160 С, выдерживая при этой температуре в течение 0,1-4 ч, предпочтительно в течение 1 ч. После охлаждения добавлением органических растворителей либо смесей растворителей, например диэтилового эфира/метанола, этилацетата, метиленхлорида или диэтилового эфира, предпочтительно смеси диэтилового эфира/метанола в соотношении 9:1, продукт (А 9) кристаллизуют либо очищают его с помощью хроматографии. Согласно варианту 4.2 А 1 экв. соединения (А 5) и 1-3 экв. соединения (А 6) перемешивают с обратным холодильником в течение 1-48 ч, предпочтительно в течение примерно 5 ч, совместно с соответствующей кислотой, например с 1-10 экв. 10-38%-ной соляной кислоты, и/или с соответствующим спиртом, например этанолом, пропанолом, бутанолом, предпочтительно с этанолом. Выпавший в осадок продукт (А 9) отфильтровывают, при необходимости промывают водой, сушат и кристаллизуют из соответствующего органического растворителя. Согласно варианту 4.3 А 1 экв. соединения (А 5) и 1-3 экв. соединения (А 7) растворяют в соответствующем растворителе, например толуоле или диоксане, смешивают с соответствующим фосфиновым лигандом, например 2,2'-бис(дифенилфосфино)-1,1'-бинафтилом, и палладиевым катализатором, таким как трис(дибензилиденацетон)дипалладий(0), и соответствующим основанием, например карбонатом цезия, и в течение 1-24 ч, предпочтительно в течение 17 ч, кипятят с обратным холодильником. Затем реакционную смесь очищают, например, на силикагеле, и продукт (А 8) выделяют из раствора, и получают его путем соответствующей кристаллизации. Продукт (А 8) растворяют в соответствующем растворителе, таком как диоксан, и добавляют совместно с кислотой, например полуконцентрированной соляной кислотой, например, в соотношении растворитель/кислота 3:1. Затем в течение 1-48 ч, например в течение 12 ч, нагревают с обратным холодильником и выпавший осадок выделяют. При необходимости продукт (А 9) очищают путем кристаллизации. Вариант 5.1 А. Согласно данному варианту, например, 1 экв. соединения (А 9) вместе с 1 экв. активирующего реагента, такого, например, как тетрафторборат O-бензотриазолил-N,N,N',N'-тетраметилурония (ТБТУ), и примерно 1,5 экв. соответствующего основания, такого как диизопропилэтиламин (ДИПЭА), растворяют в соответствующем органическом растворителе, например дихлорметане, тетрагидрофуране, диметилформамиде, N-метилпирролидоне или диметилацетамиде, предпочтительно дихлорметане или диметилформамиде. После добавления 1 экв. амина (А 10) реакционную смесь в течение 0,1-24 ч, предпочтительно в течение примерно 2 ч, перемешивают при температуре в интервале от 20 до 100 С. В результате,например, кристаллизации или хроматографической очистки получают продукт формулы (A11). Новые соединения общей формулы (I) можно синтезировать аналогично представленным ниже примерам. Эти примеры служат лишь для более подробного пояснения изобретения, не ограничивая при этом его объем. Ниже описывается также получение некоторых промежуточных соединений, используемых для синтеза соединений формулы (I) в примерах. Получение кислот Для синтеза соединений в примерах 94 и 95 сначала получают описанным ниже путем промежуточное соединение Z1. 50,0 г (0,48 моля) метилового эфира D-аланинаHCl и 49,1 г (0,50 моля) циклогексанона предварительно помещали в 300 мл дихлорметана, после чего смешивали с 41,0 г (0,50 моля) ацетата натрия и 159,0 г (0,75 моля) триацетоксиборогидрида натрия. Смесь в течение ночи перемешивали и затем добавляли 300 мл 10%-ного раствора гидрокарбоната натрия. Водную фазу экстрагировали дихлорметаном. Объединенные органические фазы промывали 10%-ным раствором гидрокарбоната натрия, сушили надNa2SO4 и концентрировали. Выход: 72,5 г соединения Z1a (прозрачная жидкость). 72,5 г соединения Z1a предварительно помещали в 500 мл воды и добавляли 76,6 г (0,39 моля) 2,4-дихлор-5-нитропиримидина в 500 мл диэтилового эфира. При температуре -5 С по каплям добавляли 100 мл 10%-ного раствора гидрокарбоната калия. Сначала в течение 3 ч перемешивали при -5 С, а затем в течение 12 ч при комнатной температуре. Органическую фазу отделяли и сушили над Na2SO4. При концентрировании продукт выпадал в виде кристаллов. Выход: 48,0 г соединения Z1b (кристаллы желтого цвета). 48,0 г соединения Z1b растворяли в 350 мл ледяной уксусной кислоты и нагревали до 60 С. Затем порциями добавляли 47,5 г железного порошка, при этом температура повышалась до 105 С. Реакционную смесь в течение 3 ч перемешивали при 80 С, затем в горячем состоянии фильтровали через целлюлозу и концентрировали. Остаток разделяли путем перемешивания в воде и этиловом эфире уксусной кислоты, отделяли вакуум-фильтрацией и образовавшийся светло-серый осадок промывали этиловым эфиром уксусной кислоты. Фильтрат промывали разбавленным аммиаком и водой, органическую фазу сушили над Na2SO4, фильтровали через активированный уголь и концентрировали. В результате получали еще некоторое количество твердого вещества светло-серого цвета. Выход: 29,5 г соединения Z1c (кристаллы светло-серого цвета). 32,1 г соединения Z1c предварительно помещали в 300 мл диметилацетамида и смешивали с 13 мл-9 008778 60%-ной дисперсии в минеральном масле. Через 2 ч реакционную смесь сливали на 800 мл смеси воды и льда. Выпавший осадок отделяли вакуум-фильтрацией и промывали петролейным эфиром. Выход: 33,0 г соединения Z1d (кристаллы бежевого цвета). 4,0 г соединения Z1d и 2,3 г (15 ммолей) 4-амино-3-метилбензойной кислоты суспендировали в 50 мл этанола и 120 мл воды, смешивали с 2 мл концентрированной соляной кислоты и в течение 48 ч кипятили с обратным холодильником. Выпавший при охлаждении осадок отделяли вакуум-фильтрацией и промывали водой, этанолом и диэтиловым эфиром. Выход: 2,9 г соединения Z1 (бесцветные кристаллы). Для синтеза соединений в примерах 188 и 203 сначала получают описанным ниже путем промежуточное соединение Z2. Раствор 128,2 г (0,83 моля) этилового эфира D-аланинаHCl и 71,5 г (0,85 моля) циклопентанона в 1500 мл дихлорметана смешивали с 70,1 г (0,85 моля) ацетата натрия и 265,6 г (1,25 моля) триацетоксиборогидрида натрия. Реакционную смесь перемешивали в течение 12 ч и затем сливали в 1,5 л 10%-ного раствора гидрокарбоната натрия. Водную фазу экстрагировали дихлорметаном. Объединенные органические фазы сушили над Na2SO4 и концентрировали. Выход: 143,4 г соединения Z2a (бесцветное масло). 66,0 г соединения Z2a предварительно помещали в 500 мл воды и смешивали с 85,0 г (0,44 моля) 2,4-дихлор-5-нитропиримидина в 500 мл диэтилового эфира. При температуре -5 С по каплям добавляли 100 мл 10%-ного раствора гидрокарбоната калия и реакционную смесь в течение 48 ч перемешивали при комнатной температуре. Водную фазу экстрагировали диэтиловым эфиром, объединенные органические фазы сушили над Na2SO4 и концентрировали. Твердое вещество темно-красного цвета разделяли путем перемешивания с петролейным эфиром и отделяли вакуум-фильтрацией. Выход: 88,0 г соединения Z2b (кристаллы желтого цвета). 88,0 г соединения Z2b растворяли в 1000 мл ледяной уксусной кислоты и при 60 С смешивали порциями с 85 г железного порошка, при этом температура поднималась до 110 С. Смесь в течение 1 ч перемешивали при 60 С, затем в горячем состоянии отделяли вакуум-фильтрацией через целлюлозу и концентрировали. Твердое вещество коричневого цвета разделяли путем перемешивания с 700 мл воды и отделяли вакуум-фильтрацией. Выход: 53,3 г соединения Z2c (кристаллы, слегка окрашенные в коричневый цвет). 53,3 г соединения Z2c растворяли в 300 мл диметилацетамида и смешивали с 13 мл (0,21 моля) метилиодида. Затем при -5 С добавляли порциями 5,0 г (0,21 моля) гидрида натрия в виде 60%-ной дисперсии в минеральном масле. Через 12 ч реакционную смесь сливали на 1000 мл смеси воды и льда и образовавшийся осадок отделяли вакуум-фильтрацией. Выход: 40,0 г соединения Z2d (бесцветные кристаллы). 4,0 г соединения Z2d и 2,8 г (16 ммолей) 4-амино-3-метилбензойной кислоты суспендировали в 25 мл этанола и 60 мл воды, смешивали с 3 мл концентрированной соляной кислоты и в течение 43 ч кипятили с обратным холодильником. Выпавший при охлаждении осадок отделяли вакуум-фильтрацией и промывали водой, этанолом и диэтиловым эфиром. Выход: 0,9 г соединения Z2 (бесцветные кристаллы). Для синтеза соединений в примерах 19, 21, 22, 23, 45, 55, 58, 116, 128, 131, 133, 134, 136, 138, 177, 217,231, 239, 46, 184, 166 и 187 сначала получают описанным ниже путем промежуточное соединение Z3. 54,0 г (0,52 моля) D-2-аминомасляной кислоты суспендировали в 540 мл метанола и при охлаждении льдом медленно смешивали с 132 г (1,1 моля) тионилхлорида. В течение 1,5 ч смесь кипятили с обратным холодильником и затем концентрировали. Полученное масло смешивали с 540 мл трет-бутилметилового эфира и образовавшиеся кристаллы отделяли вакуум-фильтрацией.- 10008778 Выход: 78,8 г соединения Z3a (бесцветные кристаллы). 74,2 г соединения Z3a и 43,5 мл (0,49 моля) циклопентанона растворяли в 800 мл дихлорметана. После добавления при 0 С 40,0 г (0,49 моля) ацетата натрия и 150,0 г (0,71 моля) триацетоксиборогидрида натрия перемешивали в течение 12 ч при комнатной температуре и затем добавляли 500 мл 20%-ного раствора гидрокарбоната натрия. Водную фазу экстрагировали дихлорметаном. Объединенные органические фазы промывали водой, сушили над MgSO4 и концентрировали. Выход: 85,8 г соединения Z3b (масло, слегка окрашенное в желтый цвет). 40,0 г соединения Z3b и 30,0 г (0,22 моля) карбоната калия суспендировали в 600 мл ацетона и при охлаждении льдом смешивали с 45,0 г (0,23 моля) 2,4-дихлор-5-нитропиримидина в 200 мл ацетона. Через 12 ч добавляли еще 5,0 г 2,4-дихлор-5-нитропиримидина и перемешивали в течение 3 ч. Затем реакционную смесь концентрировали, растворяли в 800 мл этилового эфира уксусной кислоты и 600 мл воды и водную фазу экстрагировали этиловым эфиром уксусной кислоты. Объединенные органические фазы промывали водой, сушили над MgSO4 и концентрировали. Выход: 75,0 г соединения Z3c (масло коричневого цвета). 100 г соединения Z3c растворяли в 650 мл ледяной уксусной кислоты и при 70 С смешивали порциями с 20 г железного порошка. Далее сначала в течение 1 ч перемешивали при 70 С, а затем в течение 1,5 ч при 100 С, после чего отфильтровывали в горячем состоянии через кизельгур. Реакционную смесь концентрировали, растворяли в смеси метанола и дихлорметана, наносили на силикагель и очищали экстракцией по Сокслету с помощью этилового эфира уксусной кислоты. Растворитель удаляли и остаток разделяли путем перемешивания с метанолом. Выход: 30,0 г соединения Z3d (кристаллы светло-коричневого цвета). 25,0 г соединения Z3d и 6,5 мл (0,1 моля) метилиодида предварительно помещали в 250 мл диметилацетамида и при -10 С смешивали с 3,8 г (0,95 моля) гидрида натрия в виде 60%-ной дисперсии в минеральном масле. Далее перемешивали сначала в течение 20 мин при 0 С, а затем в течение 30 мин при комнатной температуре и в завершение добавляли лед. Реакционную смесь концентрировали и смешивали с 300 мл воды. Образовавшийся осадок отделяли вакуум-фильтрацией и промывали петролейным эфиром. Выход: 23,0 г соединения Z3e (бесцветное твердое вещество). 6,0 г соединения Z3e и 5,1 г (31 ммоль) 4-амино-3-метоксибензойной кислоты суспендировали в 90 мл этанола и 350 мл воды, смешивали с 3,5 мл концентрированной соляной кислоты и в течение 48 ч кипятили с обратным холодильником. Затем реакционную смесь концентрировали, остаток разделяли путем перемешивания со смесью метанола и диэтилового эфира и образовавшийся осадок отделяли вакуум-фильтрацией. Выход: 6,3 г соединения Z3 (кристаллы светло-бежевого цвета). Для синтеза соединений в примерах 81, 82, 93 и 137 сначала получают описанным ниже путем промежуточное соединение Z4. 25,0 г (0,19 моля) этилового эфира 1-аминоциклопропан-1-карбоновой кислотыHCl и 16,8 г (0,20 моля) циклопентанона растворяли в 300 мл дихлорметана и смешивали с 16,4 г (0,20 моля) ацетата натрия и 61,7 г (0,29 моля) триацетоксиборогидрида натрия. Далее перемешивали в течение ночи, после чего реакционную смесь сливали на 400 мл 10%-ного раствора гидрокарбоната натрия. Водную фазу экстрагировали дихлорметаном. Объединенные органические фазы сушили над Na2SO4 и концентрировали. Выход: 34,5 г соединения Z4a (бесцветное масло). К смеси 34,5 г соединения Z4a в 350 мл воды добавляли 42,5 г (0,22 моля) 2,4-дихлор-5-нитропиримидина в 350 мл диэтилового эфира. Затем при -5 С смешивали с 80 мл 10%-ного раствора гидрокарбоната калия и в течение ночи перемешивали при комнатной температуре. Водную фазу экстрагировали диэтиловым эфиром. Объединенные органические фазы сушили над Na2SO4 и концентрировали. Выход: 53,8 г соединения Z4b (масло коричневого цвета). 20,1 г соединения Z4b растворяли в 200 мл ледяной уксусной кислоты и при 60 С смешивали порциями с 19,1 г железного порошка, при этом температура поднималась до 100 С. Далее в течение 3 ч перемешивали при 60 С, затем отделяли вакуум-фильтрацией через целлюлозу и концентрировали. Остаток разделяли путем перемешивания в воде и этиловом эфире уксусной кислоты и выпавший осадок желтого цвета отделяли вакуум-фильтрацией. Фильтрат промывали разбавленным аммиаком и водой,органическую фазу сушили над Na2SO4 и концентрировали. После добавления диэтилового эфира кристаллизовался дальнейший продукт. Выход: 4,0 г соединения Z4c (кристаллы желтого цвета).- 11008778 7,8 г соединения Z4c и 2,6 мл (0,04 моля) метилиодида растворяли в 100 мл диметилацетамида и при -5 С смешивали порциями с 1,5 г (0,04 моля) гидрида натрия в виде 60%-ной дисперсии в минеральном масле. Через 2 ч реакционную смесь сливали на смесь воды и льда и образовавшийся осадок отделяли вакуум-фильтрацией. Выход: 7,5 г соединения Z4d (кристаллы, слегка окрашенные в коричневый цвет). 3,0 г соединения Z4d и 1,9 г (11 ммолей) 4-амино-3-метоксибензойной кислоты суспендировали в 40 мл этанола и 80 мл воды, смешивали с 2 мл концентрированной соляной кислоты и в течение 20 ч кипятили с обратным холодильником. Затем добавляли еще 0,5 г 4-амино-3-метоксибензойной кислоты и в течение 48 ч продолжали кипятить с обратным холодильником. Выпавший при охлаждении осадок отделяли вакуум-фильтрацией и промывали водой, этанолом и диэтиловым эфиром. Выход: 2,1 г соединения Z4 (бесцветные кристаллы), tпл 222-223C. Для синтеза соединений в примерах 162, 43, 53, 161, 202, 211, 215 и 212 сначала получают описанным ниже путем промежуточное соединение Z5. Смесь из 73,4 мл (0,5 моля) этилового эфира 2-бромизомасляной кислоты, 87,1 мл (0,75 моля) 3 метил-1-бутиламина, 82,5 г (0,6 моля) иодида натрия и 76,0 г (0,6 моля) карбоната калия в 1000 мл этилового эфира уксусной кислоты кипятили в течение 3 дней с обратным холодильником. Затем присутствующие соли отфильтровывали и фильтрат концентрировали. Выход: 97,0 г соединения Z5a (масло красного цвета). 49,0 г (0,25 моля) 2,4-дихлор-5-нитропиримидина и 38,3 г (0,28 моля) карбоната калия суспендировали в 500 мл ацетона и при 0 С смешивали с 93,0 г соединения Z5a в 375 мл ацетона. Затем реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали и концентрировали. Растворенный в этиловом эфире уксусной кислоты остаток промывали водой и органическую фазу сушили над MgSO4 и концентрировали. Выход: 102,7 г соединения Z5b (масло коричневого цвета). 22,7 г соединения Z5b растворяли в 350 мл ледяной уксусной кислоты и при 60 С смешивали порциями с 17,4 г железного порошка. После добавления указанного компонента в течение 0,5 ч кипятили с обратным холодильником, отфильтровывали в горячем состоянии и концентрировали. Остаток растворяли в 200 мл смеси дихлорметана и метанола (в соотношении 9:1) и промывали раствором хлорида натрия. Органическую фазу отделяли вакуум-фильтрацией через кизельгур, сушили над MgSO4, концентрировали и очищали колоночной хроматографией (элюент: этиловый эфир уксусной кислоты/циклогексан в соотношении 1:1). Выход: 1,9 г соединения Z5c (бесцветные кристаллы). 1,9 г соединения Z5c растворяли в 32 мл диметилацетамида и при охлаждении льдом смешивали с 0,3 г (7 ммолей) гидрида натрия в виде 60%-ной дисперсии в минеральном масле. Через 10 мин добавляли 0,5 мл (7 ммолей) метилиодида и перемешивали в течение 3 ч при комнатной температуре. Затем реакционную смесь концентрировали и смешивали с водой. Образовавшийся осадок отделяли вакуумфильтрацией и промывали петролейным эфиром. Выход: 1,6 г соединения Z5d (бесцветные кристаллы). 14,0 г соединения Z5d и 10,0 г (0,06 моля) 4-амино-3-метоксибензойной кислоты суспендировали в 200 мл диоксана и 80 мл воды, смешивали с 10 мл концентрированной соляной кислоты и кипятили в течение 40 ч с обратным холодильником. Выпавший при охлаждении осадок отделяли вакуум-фильтрацией и промывали водой, диоксаном и диэтиловым эфиром. Выход: 13,9 г соединения Z5 (бесцветные кристаллы). Для синтеза соединений в примерах 88, 194, 229 и 89 сначала получают описанным ниже путем промежуточное соединение Z6.- 12008778 6,0 г (0,06 моля) L-2-аминомасляной кислоты предварительно помещали в 80 мл 0,5-молярной серной кислоты и при 0 С смешивали с 5,5 г (0,08 моля) нитрита натрия в 15 мл воды. Реакционную смесь перемешивали в течение 22 ч при 0 С, смешивали с сульфатом аммония и фильтровали. Фильтрат экстрагировали диэтиловым эфиром и объединенные органические фазы сушили над MgSO4 и концентрировали. Выход: 6,0 г соединения Z6a (масло желтого цвета). 200 мл метанола при охлаждении льдом последовательно смешивали с 65,0 мл (0,89 моля) тионилхлорида и 76,0 г соединения Z6a в 50 мл метанола. Смесь в течение 1 ч перемешивали при 0 С и в течение 2 ч при комнатной температуре и затем метанол и остаточный тионилхлорид удаляли при 0 С в вакууме. Выход: 40,0 г соединения Z6b (масло желтого цвета). 30,0 мл (0,17 моля) ангидрида трифторметансульфоновой кислоты предварительно помещали в 150 мл дихлорметана и при охлаждении льдом смешивали в течение 1 ч с раствором 20,0 г соединения Z6b и 14,0 мл (0,17 моля) пиридина в 50 мл дихлорметана. Смесь в течение 2 ч перемешивали при комнатной температуре, образовавшиеся соли отделяли вакуум-фильтрацией и затем промывали 100 мл воды. Органическую фазу сушили над MgSO4 и концентрировали. Выход: 42,0 г соединения Z6c (масло светло-желтого цвета). К раствору 15,5 мл (0,17 моля) анилина и 24,0 мл (0,17 моля) триэтиламина в 400 мл дихлорметана при охлаждении льдом по каплям добавляли в течение 1 ч 42,0 г соединения Z6c в 200 мл дихлорметана. Раствор в течение 1 ч перемешивали при комнатной температуре и еще в течение 2 ч при 35 С. Реакционную смесь промывали водой, сушили над MgSO4 и концентрировали. Образовавшийся остаток очищали путем перегонки (95-100 С, 110-3 мбар). Выход: 14,0 г соединения Z6d (бесцветное масло). 14,0 г соединения Z6d и 16,0 г (0,1 моля) карбоната калия суспендировали в 100 мл ацетона и при 10 С смешивали с 16,0 г (0,08 моля) 2,4-дихлор-5-нитропиримидина. Затем смесь в течение 4 ч перемешивали при 40 С, образовавшиеся соли отделяли вакуум-фильтрацией и фильтрат концентрировали. Остаток растворяли в 300 мл этилового эфира уксусной кислоты и промывали водой. Органическую фазу сушили над MgSO4 и концентрировали. Выход: 31,0 г соединения Z6e (масло коричневого цвета). 31,0 г соединения Z6e растворяли в 200 мл ледяной уксусной кислоты и при 60 С смешивали порциями с 10 г железного порошка, при этом температура поднималась до 85 С. Перемешивание продолжали еще в течение 1 ч при 60 С, затем фильтровали через кизельгур и концентрировали. Остаток разделяли путем перемешивания с метанолом. Выход: 4,5 г соединения Z6f (кристаллы коричневого цвета). К смеси 4,5 г соединения Z6f и 1,0 мл (16 ммолей) метилиодида в 100 мл диметилацетамида при-20 С добавляли порциями 0,6 г (16 ммолей) гидрида натрия в виде 60%-ной дисперсии в минеральном масле. Через 1 ч реакционную смесь смешивали с 50 мл воды и концентрировали. Остаток размешивали с 200 мл воды и выпавший осадок отделяли вакуум-фильтрацией и промывали петролейным эфиром. Выход: 4,5 г соединения Z6g (бесцветные кристаллы). Суспензию 1,5 г соединения Z6g и 1,4 г (8 ммолей) метилового эфира 4-амино-3-метоксибензойной кислоты в 30 мл толуола смешивали с 0,4 г (0,6 ммоля) 2,2'-бис(дифенилфосфино)-1,1'-бинафтила, 0,23 г(0,3 ммоля) трис(дибензилиденацетон)дипалладия(0) и 7,0 г (21 ммоль) карбоната цезия и кипятили в течение 17 ч с обратным холодильником. Затем реакционную смесь наносили на силикагель и очищали хроматографией на колонке (элюент: дихлорметан/метанол в соотношении 9:1). Выход: 1,7 г соединения Z6h (кристаллы желтого цвета). 1,7 г соединения Z6h растворяли в 50 мл диоксана, смешивали с 15 мл полуконцентрированной соляной кислоты и кипятили в течение 12 ч с обратным холодильником. После охлаждения образовавшийся осадок отделяли вакуум-фильтрацией. Выход: 1,1 г соединения Z6 (бесцветное твердое вещество). Для синтеза соединений в примерах 26, 20, 32, 56, 101, 112 и 209 сначала получают описанным ниже путем промежуточное соединение Z7. 50,0 г (0,36 моля) метилового эфира D-аланинаHCl суспендировали в 500 мл дихлорметана и 35 мл ацетона и смешивали с 30,0 г (0,37 моля) ацетата натрия и 80,0 г (0,38 моля) триацетоксиборогидрида натрия. Затем перемешивали в течение 12 ч, после чего сливали на 400 мл 10%-ного раствора гидрокарбоната натрия. Органическую фазу сушили над Na2SO4 и концентрировали.- 13008778 Выход: 51,0 г соединения Z7a (масло желтого цвета). Суспензию 51,0 г соединения Z7a в 450 мл воды смешивали с 80,0 г (0,41 моля) 2,4-дихлор-5 нитропиридина в 400 мл диэтилового эфира. При -5 С по каплям добавляли 100 мл 10%-ного раствора гидрокарбоната калия. Реакционную смесь перемешивали в течение 3 ч, органическую фазу сушили надNa2SO4 и концентрировали. Выход: 74 г соединения Z7b (масло желтого цвета). 18,6 г соединения Z7b растворяли в 200 мл ледяной уксусной кислоты и при 60 С смешивали порциями с 20,0 г железного порошка. Смесь в течение 2 ч перемешивали при 60 С и затем проводили вакуум-фильтрацию через целлюлозу. Остаток растворяли в этиловом эфире уксусной кислоты и промывали водой и концентрированным аммиаком. Органическую фазу сушили над Na2SO4 и концентрировали. Остаток кристаллизовали из диэтилового эфира. Выход: 9,8 г соединения Z7c (бесцветные кристаллы). 17,0 г соединения Z7c и 7 мл (0,1 моля) метилиодида растворяли в 200 мл диметилацетамида и при-5 С смешивали с 4,0 г (0,1 моля) гидрида натрия в виде 60%-ной дисперсии в минеральном масле. Реакционную смесь перемешивали в течение 30 мин и затем сливали на 300 мл смеси воды и льда. Образовавшийся осадок отделяли вакуум-фильтрацией и выделяли путем размешивания с петролейным эфиром. Выход: 14,8 г соединения Z7d (кристаллы бежевого цвета). 0,9 г соединения Z7d и 1,5 г (9 ммолей) 4-амино-3-метоксибензойной кислоты нагревали до 210 С с выдержкой при этой температуре в течение 30 мин. После охлаждения остаток разделяли путем перемешивания с этиловым эфиром уксусной кислоты и образовавшийся осадок отделяли вакуум-фильтрацией. Выход: 1,2 г соединения Z7 (кристаллы серого цвета). Аналогично описанным выше вариантам синтеза получали среди прочих следующие кислоты. Синтез аминных структурных звеньев L-R5. Описанным ниже путем получали следующие амины: 1,1-диметил-2-диметиламино-1-илэтиламин и 1,1-диметил-2-пиперидин-1-илэтиламин Эти соединения получали по методике, описанной в следующих источниках: a) S. Schuetz и др.,Arzneimittel-Forschung 21, 1971, сс. 739-763; b) V.M. Belikov и др., Tetrahedron 26, 1970, сс. 1199-1216; с) Е.В. Butler и McMillan, Journ. Amer. Chem. Soc. 72, 1950, с. 2978. По модифицированной в приведенных источниках методике получали также следующие амины: 1,1-диметил-2-морфолин-1-илэтиламин 8,7 мл морфолина и 9,3 мл 2-нитропропана предварительно помещали совместно в реакционный сосуд при охлаждении льдом, а затем медленно добавляли по каплям 7,5 мл формальдегида (37%) и 4 мл 0,5-молярного раствора NaOH (10 С). После этого перемешивали в течение 1 ч при 25 С и в течение 1 ч при 50 С. Раствор обрабатывали водой и простым эфиром и водную фазу трижды экстрагировали простым эфиром. Органическую фазу сушили над Na2SO4 и смешивали с HCl в диоксане (4 моль/л), образо- 14008778 вавшийся осадок отделяли вакуум-фильтрацией. Выход: 21,7 г белого порошка. 5 г этого порошка растворяли в 80 мл метанола и при добавлении 2 г никеля Ренея обрабатывали водородом в течение 40 мин при 35 С и давлении 50 фунтов/кв.дюйм. В результате получили 3,6 г 1,1 диметил-2-морфолин-1-илэтиламина. Аналогично данной методике получали следующие амины: 1,1-диметил-N-метилпиперазин-1-илэтиламин 5 г 1,3-диморфолин-2-нитропропана фирмы Aldrich растворяли в 80 мл метанола и при добавлении 2 г никеля Ренея обрабатывали в течение 5,5 ч водородом при 30 С и давлении 50 фунтов/кв.дюйм. В результате получили 4,2 г 1,3-диморфолин-2-аминопропана. 4-Aминобензилморфолин Получение этого амина описано в следующей публикации: S. Mitsuru и др., Journ. Med. Chem. 43,2000, сс. 2049-2063. 4-Aмино-1-тетрагидро-4 Н-пиран-4-илпиперидин 20 г (100 ммолей) 4-трет-бутилоксикарбониламинопиперидина растворяли в 250 мл CH2Cl2 и в течение 12 ч перемешивали при КТ с 10 г (100 ммолей) тетрагидро-4 Н-пиран-4-она и 42 г (200 ммолей)NaBH(OAc)3. Затем смешивали с водой и карбонатом калия, органическую фазу отделяли, сушили и в вакууме удаляли растворитель. Остаток растворяли в 200 мл CH2Cl2 и перемешивали в течение 12 ч при КТ со 100 мл трифторуксусной кислоты. Растворитель удаляли в вакууме, остаток растворяли с помощью СHCl3 и повторно упаривали, после чего растворяли в ацетоне и с использованием HCl в простом эфире осаждали гидрохлорид. Выход: 14,3 г (56%). цис- и транс-4-Морфолиноциклогексиламин Дибензил-4-морфолиноциклогексиламин. 3,9 г (30 ммолей) 4-дибензилциклогексанона растворяли в 100 мл CH2Cl2 и в течение 12 ч перемешивали при КТ с 3,9 г (45 ммолей) морфолина и 9,5 г (45 ммолей) NaBH(ОАс)3. Затем смешивали с водой и карбонатом калия, органическую фазу отделяли, сушили и в вакууме удаляли растворитель. Остаток очищали на силикагелевой колонке (примерно 20 мл силикагеля; примерно 500 мл эфира уксусной кислоты и метанола в соотношении 90:10 + 1% концентрированного аммиака). Соответствующие фракции концентрировали в вакууме. Выход: 6,6 г (60%) цис-изомера и 2 г (18%) транс-изомера. Согласно другому варианту транс-дибензил-4-морфолиноциклогексиламин можно получать следующим путем. 33 г (112 ммолей) 4-дибензилциклогексанона растворяли в 300 мл МеОН, смешивали с 17,4 г (250 ммолей) гидрохлорида гидроксиламина и перемешивали в течение 4 ч при 60 С. Растворитель выпаривали в вакууме, затем примешивали 500 мл воды и 50 г карбоната калия и дважды экстрагировали дихлорметаном порциями по 300 мл. Органическую фазу сушили, концентрировали в вакууме, остаток кристаллизовали из петролейного эфира, растворяли в 1,5 л EtOH и нагревали до 70 С. Далее порциями добавляли 166 г- 15008778 натрия и кипятили с обратным холодильником до момента полного растворения натрия. Затем растворитель удаляли в вакууме, остаток смешивали со 100 мл воды и дважды экстрагировали простым эфиром порциями по 400 мл. Органическую фазу промывали водой, сушили, концентрировали в вакууме и с помощью соответствующей колонки (примерно 1,5 л силикагеля; примерно 2 л эфира уксусной кислоты и метанола в соотношении 80:2 + 2% концентрированного аммиака) выделяли транс-изомер. Выход: 12,6 г (41,2%). 6,8 г (23 ммоля) транс-1-амино-4-дибензиламиноциклогексана растворяли в 90 мл ДМФ и в течение 8 ч перемешивали при 100 С с 5 мл (42 ммоля) 2,2'-дихлорэтилового эфира и 5 г карбоната калия. После охлаждения смешивали с 30 мл воды, выпавшие кристаллы отделяли вакуум-фильтрацией и очищали на невысокой колонке (примерно 20 мл силикагеля, примерно 100 мл эфира уксусной кислоты). Остаток кристаллизовали из метанола и концентрированной HCl с получением дигидрохлорида. Выход: 7,3 г (72,4%). транс-4-Морфолиноциклогексиламин. 7,2 г (16,4 ммолей) транс-дибензил-4-морфолиноциклогексиламина растворяли в 100 мл МеОН и гидрировали в присутствии 1,4 г Pd/C (10%-ного) при температуре от 30 до 50 С. Затем растворитель удаляли в вакууме и остаток кристаллизовали из этанола и концентрированной HCl. Выход: 3,9 г (93%), tпл 312C. цис-Изомер можно получать аналогичным путем. цис- и транс-4-Пиперидиноциклогексиламин транс-Дибензил-4-пиперидиноциклогексиламин. 2,0 г (6,8 ммоля) транс-1-амино-4-дибензиламиноциклогексана (см. пример 2) растворяли в 50 мл ДМФ и в течение 48 ч перемешивали при КТ с 1,6 г (7 ммолей) 1,5-дибромпентана и 2 г карбоната калия. Затем смесь охлаждали, смешивали с водой, дважды экстрагировали дихлорметаном порциями по 100 мл, сушили и растворитель удаляли в вакууме. Остаток очищали на соответствующей колонке (примерно 100 мл силикагеля; примерно 500 мл эфира уксусной кислоты и метанола в соотношении 80:20 + 1% концентрированного аммиака). Соответствующие фракции концентрировали в вакууме и кристаллизовали из петролейного эфира. Выход: 1,2 г (49%). транс-4-Пиперидиноциклогексиламин. 1,7 г (4,8 ммолей) транс-дибензил-4-пиперидиноциклогексиламина растворяли в 35 мл МеОН и гидрировали в присутствии 350 мг Pd/C (10%-ного) при 20 С. Затем растворитель удаляли в вакууме и остаток кристаллизовали из этанола и концентрированной HCl. Выход: 1,1 г (78%). цис-Изомер можно получать аналогичным путем. цис- и транс-4-(4-Фенилпиперазин-1-ил)циклогексиламин 4,1 г (25,3 ммоля) 4-дибензилциклогексанона растворяли в 50 мл дихлорметана и в течение 12 ч перемешивали при КТ с 7,4 г (25,3 ммоля) N-фенилпиперазина и 7,4 г (35 ммолей) NaBH(ОАс)3. Затем смешивали с водой и карбонатом калия, органическую фазу отделяли, сушили и растворитель удаляли в вакууме. Остаток очищали на силикагелевой колонке (эфир уксусной кислоты и метанол в соотношении 80:20 + 0,5% концентрированного аммиака). Выход: 1,7 г (15,8%) цис-изомера и 0,27 г (2,5%) транс-изомера. транс-4-(4-Фенилпиперазин-1-ил)циклогексиламин. 270 мг (0,61 ммоля) транс-дибензил-[4-(4-фенилпиперазин-1-ил)циклогексил]амина растворяли в 5 мл МеОН и при температуре в интервале от 20 до 30 С гидрировали в присутствии 40 мг Pd/C (10%-ного). Затем растворитель удаляли в вакууме и остаток кристаллизовали из этанола и концентрированной HCl. Выход: 110 мг (69%). цис-Изомер можно получать аналогичным путем. цис- и транс-4-(4-Циклопропилметилпиперазин-1-ил)циклогексиламин 9,8 г (33,4 ммоля) 4-дибензилциклогексанона растворяли в 100 мл дихлорметана и в течение 12 ч перемешивали при КТ с 5,6 г (40 ммолей) N-циклопропилметилпиперазина и 8,5 г (40 ммолей)NaBH(OAc)3. Затем смешивали с водой и карбонатом калия, органическую фазу отделяли, сушили и растворитель удаляли в вакууме. Остаток очищали на силикагелевой колонке (примерно 50 мл силикагеля; примерно 3 л эфира уксусной кислоты и метанола в соотношении 95:5 + 0,25% концентрированного аммиака). Соответствующие фракции концентрировали в вакууме. Элюируемое с большей скоростью циссоединение кристаллизуется из эфира уксусной кислоты. транс-Соединение кристаллизовали из этанолаPd/C (10%-ного). Затем растворитель удаляли в вакууме и остаток кристаллизовали из этанола и концентрированной HCl. Выход: 4,4 г (91%). транс-Изомер можно получать аналогичным путем. Синтез соединений, представленных в примерах Пример 152. 0,15 г соединения Z10, 0,14 г ТБТУ, 0,13 мл ДИПЭА растворяли в дихлорметане и перемешивали в течение 20 мин при 25 С. Затем добавляли 90 мкл 1-(3-аминопропил)-4-метилпиперазина и продолжали перемешивание еще в течение 2 ч при 25 С. После этого раствор разбавляли дихлорметаном и экстрагировали водой. Добавлением петролейного эфира, простого эфира и этилацетата к органической фазе продукт осаждали. Выход: 0,16 г твердого вещества бежевого цвета. Пример 164. 0,10 г соединения Z10, 0,1 г ТБТУ, 0,08 мл ДИПЭА растворяли в 4 мл дихлорметана и перемешивали в течение 20 мин при 25 С. Затем добавляли 44 мкл диметиламинопропиламина и продолжали перемешивание еще в течение 2 ч при 25 С. После этого раствор разбавляли дихлорметаном и экстрагировали водой. Добавлением петролейного эфира, простого эфира и ацетона к органической фазе продукт осаждали. Выход: 0,08 г твердого вещества желтого цвета. Пример 242. 0,15 г соединения Z10, 0,14 г ТБТУ, 0,13 мл ДИПЭА растворяли в 5 мл дихлорметана и перемешивали в течение 20 мин при 25 С. Затем добавляли 75 мкл 1-(2-аминоэтил)пиперидина и продолжали перемешивание еще в течение 2 ч при 25 С. После этого раствор разбавляли дихлорметаном и экстрагировали водой. Добавлением петролейного эфира, простого эфира и этилацетата к органической фазе продукт осаждали. Выход: 0,14 г твердого вещества желтого цвета. Пример 188. 0,1 г соединения Z2, 0,09 г ТБТУ, 0,05 мл ДИПЭА растворяли в 15 мл дихлорметана и перемешивали в течение 20 мин при 25 С. Затем добавляли 33 мг 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 3 ч при 25 С. Раствор экстрагировали 20 мл воды, после чего концентрировали в вакууме. С помощью простого эфира продукт кристаллизовали. Выход: 0,047 г кристаллов белого цвета. Пример 203. 0,1 г соединения Z2, 0,09 г ТБТУ, 0,5 мл ДИПЭА растворяли в 15 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 50 мг 4-амино-1-бензилпиперидина и продолжали перемешивание еще в течение 3 ч при 25 С. Раствор экстрагировали 20 мл воды, после чего концентрировали в вакууме. Затем хроматографировали на силикагеле и выделенный продукт кристаллизовали с помощью простого эфира. Выход: 0,015 г кристаллов белого цвета. Пример 94. 0,17 г соединения Z1, 0,19 г ТБТУ, 0,11 мл ДИПЭА растворяли в 50 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 63 мг 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 17 ч при 25 С. Далее к раствору добавляли 50 мл воды и 1 г карбоната калия и органическую фазу отделяли на специальной колонке для разделения фаз, после чего концентрировали в вакууме. Затем продукт очищали хроматографией на силикагеле и очищенный продукт кристаллизовали с помощью простого эфира. Выход: 0,1 г кристаллов белого цвета. Пример 95. 0,17 г соединения Z1, 0,19 г ТБТУ, 0,11 мл ДИПЭА растворяли в 50 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 77 мг экзо-3 аминотропана и продолжали перемешивание еще в течение 17 ч при 25 С. Далее к раствору добавляли 50 мл воды и 1 г карбоната калия и органическую фазу отделяли с помощью специальной колонки для разделения фаз, после чего концентрировали в вакууме. Затем продукт очищали хроматографией на силикагеле и очищенный продукт кристаллизовали с помощью простого эфира. Выход: 0,03 г кристаллов белого цвета. Пример 46. 0,15 г соединения Z3, 0,12 г ТБТУ, 0,12 мл ДИПЭА растворяли в 5 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 50 мг 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 2,5 ч при 25 С. Далее раствор экстрагировали водой и после этого концентрировали. Остаток растворяли в теплом этилацетате и кристаллизовали с помощью простого эфира и петролейного эфира. Выход: 0,025 г кристаллов белого цвета, tпл 203 С (в виде основания).- 17008778 Пример 80. 0,2 г соединения Z8, 0,2 г ТБТУ, 0,1 мл ДИПЭА растворяли в 10 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 100 мг 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 17 ч при 25 С. Далее раствор экстрагировали разбавленным раствором карбоната калия и концентрировали. Остаток кристаллизовали с помощью простого эфира. Выход: 0,12 г кристаллов белого цвета. Пример 190. 0,2 г соединения Z8, 0,2 г ТБТУ, 0,3 мл ДИПЭА растворяли в 5 мл дихлорметана и перемешивали в течение 1 ч при 25 С. Затем добавляли 0,13 мг 4-амино-1-бензилпиперидина и продолжали перемешивание еще в течение 1 ч при 25 С. Далее раствор разбавляли 10 мл метиленхлорида и экстрагировали 20 мл воды. После этого продукт очищали на силикагеле и кристаллизовали с помощью этилацетата и простого эфира. Выход: 0,23 г соединения Z8. 0,23 г бензиламина Z8 растворяли в 10 мл метанола, смешивали с 50 мг Pd/C и гидрировали в течение 3 ч при давлении 3 бара и температуре 25 С. В результате добавления петролейного эфира и этилацетата получали кристаллы белого цвета, которые затем хроматографировали на силикагеле и кристаллизовали с помощью этилацетата и простого эфира. Выход: 0,075 г кристаллов белого цвета. Пример 196. 0,1 г соединения Z10, 0,09 г ТБТУ, 0,3 мл ДИПЭА растворяли в 4 мл дихлорметана и перемешивали в течение 20 мин при 25 С. Затем добавляли 67 мг амина и продолжали перемешивание еще в течение 2 ч при 25 С. Далее раствор разбавляли дихлорметаном и экстрагировали водой. Затем хроматографировали на силикагеле, остаток растворяли в ацетоне, смешивали с HCl в простом эфире и выделяли образовавшийся осадок. Выход: 0,09 г твердого вещества светло-желтого цвета. Пример 166. 0,1 г соединения Z10, 0,11 г ТБТУ, 0,14 мл ДИПЭА растворяли в 2 мл диметилформамида и перемешивали в течение 3 ч при 50 С. Затем добавляли 55 мг 4-морфолинометилфениламина. За счет охлаждения температуру реакции в течение 17 ч снижали до комнатной температуры. После этого диметилформамид удаляли в вакууме, остаток растворяли в дихлорметане и экстрагировали водой. В завершение хроматографировали на силикагеле и продукт кристаллизовали из этилацетата и простого эфира. Выход: 0,06 г кристаллов желтоватого цвета. Пример 81. 0,2 г соединения Z4, 0,2 г ТБТУ, 0,1 мл ДИПЭА растворяли в 10 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 0,1 г 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 17 ч при 25 С. Далее раствор экстрагировали водным раствором карбоната калия,после чего концентрировали. Продукт кристаллизовали с помощью простого эфира. Выход: 0,16 г кристаллов белого цвета. Пример 162. 0,1 г соединения Z5, 0,07 г ТБТУ, 0,15 мл ДИПЭА растворяли в 5 мл дихлорметана и перемешивали в течение 20 мин при 25 С. Затем добавляли 0,04 г 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 2 ч при 25 С. Далее раствор разбавляли 15 мл дихлорметана и экстрагировали 20 мл воды. Остаток растворяли в МеОН и ацетоне, смешивали с 1 мл HCl в простом эфире и концентрировали. С помощью простого эфира, этилацетата и небольшого количества МеОН получали кристаллический продукт. Выход: 0,1 г кристаллов белого цвета. Пример 88. 0,1 г соединения Z6, 0,12 г ТБТУ, 0,12 мл ДИПЭА растворяли в 10 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 0,04 г 1-метил-4-аминопиперидина и продолжали перемешивание еще в течение 2 ч при 25 С. Далее раствор разбавляли 10 мл дихлорметана и экстрагировали 10 мл воды. С помощью этилацетата, простого эфира и петролейного эфира получали кристаллический продукт. Выход: 0,6 г кристаллов белого цвета. Пример 89. 0,1 г соединения Z6, 0,08 г ТБТУ, 0,08 мл ДИПЭА растворяли в 10 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 37 мкл N,N-диметилнеопентандиамина и продолжали перемешивание еще в течение 2 ч при 25 С. Далее раствор разбавляли 10 мл дихлорметана и экстрагировали 10 мл воды. В завершение продукт хроматографировали на силикагеле и кристаллизовали с помощью этилацетата, простого эфира и петролейного эфира. Выход: 0,005 г кристаллов белого цвета. Пример 26. 0,15 г соединения Z7, 0,16 г ТБТУ, 1 мл ДИПЭА растворяли в 5 мл дихлорметана и перемешивали в течение 30 мин при 25 С. Затем добавляли 0,1 г 4-морфолиноциклогексиламина и продолжали перемешивание еще в течение 17 ч при 25 С. Остаток смешивали с 10 мл 10%-ного раствора карбоната калия,осадок выделяли и промывали водой. Далее его растворяли в дихлорметане и повторно концентрирова- 18008778 ли. С помощью этилацетата продукт кристаллизовали. Выход: 0,1 г кристаллов белого цвета. Пример 9. 150 мг соединения Z9 и 93 мг амина растворяли в 5 мл дихлорметана и в течение 12 ч перемешивали при КТ со 160 мг (0,50 ммоля) ТБТУ и 1 мл ДИПЭА. Затем растворитель удаляли в вакууме и остаток смешивали с 10 мл 10%-ного раствора карбоната калия. Осадок отделяли вакуум-фильтрацией, промывали водой, растворяли в дихлорметане, сушили и растворитель удаляли в вакууме. Остаток кристаллизовали из эфира уксусной кислоты. Выход: 82,0 мг, tпл 253C (в виде основания). Пример 16. 150 мг соединения Z8 и 73 мг транс-4-пиперидиноциклогексиламина растворяли в 5 мл дихлорметана и в течение 12 ч перемешивали при КТ со 160 мг (0,50 ммоля) ТБТУ и 1 мл ДИПЭА. Затем растворитель удаляли в вакууме и остаток смешивали с 10 мл 10%-ного раствора карбоната калия. Осадок отделяли вакуум-фильтрацией, промывали водой, растворяли в дихлорметане, сушили и растворитель удаляли в вакууме. Остаток кристаллизовали из эфира уксусной кислоты. Выход: 87,0 мг, tпл 237C (в виде основания). Пример 37. 100 мг соединения Z9 и 42 мг 3-амино-1-этилпирролидена растворяли в 10 мл дихлорметана и в течение 12 ч перемешивали при КТ с 90 мг ТБТУ и 0,5 мл ДИПЭА. Затем растворитель удаляли в вакууме и остаток смешивали с 10 мл 10%-ного раствора карбоната калия. Осадок отделяли вакуум-фильтрацией,промывали водой, растворяли в дихлорметане, сушили и растворитель удаляли в вакууме. Остаток кристаллизовали из эфира уксусной кислоты и петролейного эфира. Выход: 24,0 мг. Пример 120. 100 мг соединения Z11 и 73 мг 4-амино-1-тетрагидро-4 Н-пиран-4-илпиперидина растворяли в 10 мл дихлорметана и в течение 1 ч перемешивали при КТ с 90 мг ТБТУ и 0,5 мл ДИПЭА. Затем растворитель удаляли в вакууме и остаток смешивали с 10 мл 10%-ного раствора карбоната калия. Осадок отделяли вакуум-фильтрацией, промывали водой, растворяли в дихлорметане, сушили и растворитель удаляли в вакууме. Остаток кристаллизовали из эфира уксусной кислоты и петролейного эфира. Выход: 89 мг. Пример 212. 150 мг соединения Z5 и 150 мг транс-4-(4-циклопропилметилпиперазин-1-ил)циклогексиламина (в виде гидрохлорида) растворяли в 5 мл дихлорметана и в течение 2 ч перемешивали при КТ со 160 мг ТБТУ и 2 мл ДИПЭА. Затем растворитель удаляли в вакууме и остаток смешивали с 10 мл 10%-ного раствора карбоната калия. Осадок отделяли вакуум-фильтрацией, промывали водой, растворяли в дихлорметане, сушили и растворитель удаляли в вакууме. Остаток очищали на соответствующей колонке (20 мл силикагеля; 300 мл эфира уксусной кислоты и метанола в соотношении 90:10 + 2% концентрированного аммиака). Соответствующие фракции концентрировали в вакууме и кристаллизовали из эфира уксусной кислоты. Выход: 140 мг, tпл 187C (в виде основания). Пример 232. 390 мг соединения Z11 и 240 мг транс-4-(4-трет-бутилоксикарбонилпиперазин-1-ил)циклогексиламина растворяли в 2,5 мл N-метилпирролидона и в течение 2 ч перемешивали при КТ с 482 мг ТБТУ и 1 мл триэтиламина. Затем смешивали со 100 мл воды и 200 мг карбоната калия, осадок отделяли вакуумфильтрацией, промывали водой и очищали на силикагелевой колонке. Соответствующие фракции концентрировали в вакууме, растворяли в 2 мл дихлорметана, смешивали с 2 мл трифторуксусной кислоты и перемешивали в течение 2 ч при КТ. Затем повторно смешивали со 100 мл воды и 200 мг карбоната калия, осадок отделяли вакуум-фильтрацией и промывали водой. После этого осадок очищали на силикагелевой колонке. Соответствующие фракции концентрировали в вакууме и остаток кристаллизовали из этанола и концентрированной соляной кислоты. Выход: 95 мг, tпл 291C. Пример 213. 60 мг соединения из примера 232 растворяли в 10 мл эфира уксусной кислоты и в течение 30 мин перемешивали при КТ с 1 мл ангидрида уксусной кислоты и 1 мл триэтиламина. Затем растворитель удаляли в вакууме, остаток смешивали с водой и аммиаком, выпавшие в осадок кристаллы отделяли вакуумфильтрацией и промывали водой и небольшим количеством холодного ацетона. Выход: 40 мг, tпл 248C. Пример 218. 1,2 г соединения Z9 и 0,5 г 1,4-диоксаспиро[4,5]дец-8-иламина растворяли в 20 мл дихлорметана и в течение 12 ч перемешивали при КТ с 1,28 г ТБТУ и 4 мл триэтиламина. Затем смешивали с 50 мл воды и 0,5 г карбоната калия, органическую фазу отделяли, сушили и концентрировали в вакууме. Остаток кристаллизовали из эфира уксусной кислоты, смешивали с 25 мл 1 н. соляной кислоты и 20 мл метанола и в течение 30 мин перемешивали при 50 С. После этого метанол удаляли в вакууме, осадок отделяли ваку- 19008778 ум-фильтрацией, промывали водой и сушили. Остаток растворяли в 20 мл дихлорметана и в течение 12 ч перемешивали при КТ с 0,5 г тиоморфолина и 0,5 г NaBH(OAc)3. Затем примешивали воду и карбонат калия, органическую фазу отделяли, сушили и растворитель удаляли в вакууме. Остаток очищали на силикагелевой колонке. Соответствующие фракции концентрировали в вакууме и с помощью HCl в простом эфире осаждали гидрохлорид. Выход: 86 мг транс-изомера, аморфный порошок. Пример 187. 200 мг соединения Z3, растворенных в 5 мл дихлорметана, смешивали с 0,1 мл диизопропилэтиламина(ДИПЭА) и 180 мг ТБТУ и перемешивали в течение 30 мин. Затем добавляли 191 мг 4-(4-метилпиперазин 1-ил)фениламина и перемешивали в течение ночи. Реакционную смесь смешивали с водой и водную фазу экстрагировали дихлорметаном. Объединенные органические фазы сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией на колонке (элюент: дихлорметан/метанол в соотношении 100:7). Выход: 128 мг (кристаллы, слегка окрашенные в желтый цвет). По методике, аналогично описанной выше, получают среди прочих также соединения формулы (I),представленные в нижеследующей таблице. Используемые в этой таблице символы Х 1, Х 2, Х 3, Х 4 и Х 5 обозначают соответственно положение, в котором соответствующий остаток R1, R2, R3, R4 и L-R5 присоединен к остальной части молекулы приведенной перед таблицей общей формулы.
МПК / Метки
МПК: A61K 31/4375, A61K 31/4985, C07D 475/04
Метки: применение, лекарственных, способ, дигидроптеридиноны, качестве, получения, средств
Код ссылки
<a href="https://eas.patents.su/30-8778-digidropteridinony-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Дигидроптеридиноны, способ их получения и их применение в качестве лекарственных средств</a>
Предыдущий патент: Способы и продукты, относящиеся к лечению и предупреждению инфекции вируса гепатита с
Следующий патент: 4-замещённые бензимидазолы и их применение в качестве ингибиторов желудочной секреции
Случайный патент: Средство для лечения болезней суставов












