Антагонисты хемокинного рецептора и способы их применения
Номер патента: 8060
Опубликовано: 27.02.2007
Авторы: Гош Шомир, Элдер Эйми М., Накасато Йошисуки, Маттиа Карен М., Ошима Ецуо, Карсон Кеннет Дж., Харриман Джеральдина С.Б., Лали Джей Р.
Формула / Реферат
1. Соединение, имеющее формулу
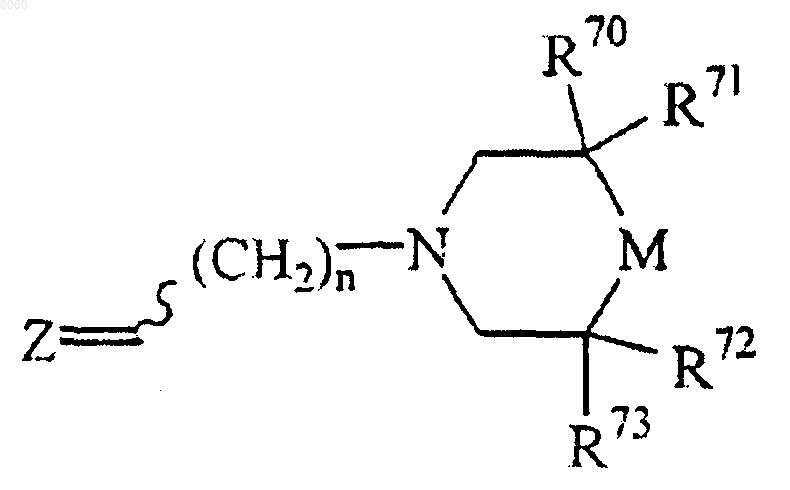
или его физиологически приемлемая соль,
в которой n - число от единицы до четырех;
М представляет собой >NR2 или >CR1R2;
R1 представляет собой -Н, -ОН, -N3, атом галогена, алифатическую группу, замещенную алифатическую группу, аминоалкильную группу, -O-(алифатическую группу), -O-(замещенную алифатическую группу), -SH, -S-(алифатическую группу), -S-(замещенную алифатическую группу), -ОС(O)-(алифатическую группу), -O-С(O)-(замещенную алифатическую группу), -C(O)O(алифатическую группу), -C(O)O(замещенную алифатическую группу), -СООН, -CN, -CO-NR3R4, -NR3R4 или R1 представляет собой ковалентную связь между кольцевым атомом при М и соседним атомом углерода в кольце, которое содержит М;
R2 представляет собой группу -ОН, атом галогена, ацильную группу, замещенную ацильную группу, группу -NR5R6, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу, бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу, замещенную неароматическую гетероциклическую группу, -O-(замещенную или незамещенную ароматическую группу), -O-(замещенную или незамещенную алифатическую группу), -С(O)-(замещенную или незамещенную ароматическую группу) или -С(O)-(замещенную или незамещенную алифатическую группу);
R3, R4, R5 и R6 независимо представляют собой -Н, ацильную группу, замещенную ацильную группу, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу, бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу или замещенную неароматическую гетероциклическую группу; или
R1 и R2, R3 и R4 или R5 и R6, взятые вместе с атомом, с которым они связаны, образуют замещенное или незамещенное неароматическое карбоциклическое или гетероциклическое кольцо;
R70 и R71 независимо представляют собой -Н, -ОН, -N3, атом галогена, алифатическую группу, замещенную алифатическую группу, аминоалкильную группу, -O-(алифатическую группу), -O-(замещенную алифатическую группу), -SH, -S-(алифатическую группу), -S-(замещенную алифатическую группу), -ОС(О)-(алифатическую группу), -O-С(O)-(замещенную алифатическую группу), -C(O)O (алифатическую группу), -C(O)O(замещенную алифатическую группу), -СООН, -CN, -CO-NR3R4, -NR3R4, ацильную группу, замещенную ацильную группу, бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу, замещенную неароматическую гетероциклическую группу, -O-(замещенную или незамещенную ароматическую группу);
R72 и R73 независимо представляют собой группу -ОН, -N3, атом галогена, алифатическую группу, замещенную алифатическую группу, аминоалкильную группу, -O-(алифатическую группу), -O-(замещенную алифатическую группу), -SH, -S-(алифатическую группу), -S-(замещенную алифатическую группу), -О-С(О)-(алифатическую группу), -O-С(O)-(замещенную алифатическую группу), -C(O)O (алифатическую группу), -C(O)O(замещенную алифатическую группу), -СООН, -CN, -CO-NR3R4, -NR3R4, ацильную группу, замещенную ацильную группу, бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу, замещенную неароматическую гетероциклическую группу, -O-(замещенную или незамещенную ароматическую группу);
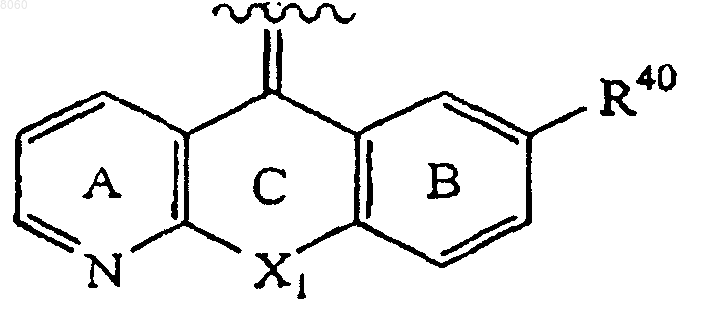
Z представляет собой
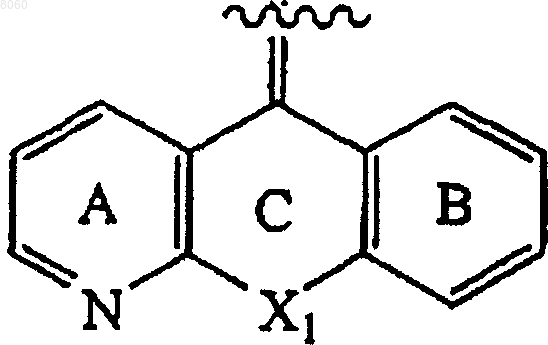
X1 представляет собой группы -CH2-O-, -O-CH2-, -S-, -CH2-, -CH2-CH2-, -CH2-S-, -S-CH2-, -NRc-CH2-, -CH2-NRc-, -SO-CH2-, -CH2-SO-, -S(O)2-CH2-, -CH2-S(O)2-, -CH=CH-, -NRc-CO-, связь, -О- или -CO-NRc-;
Rc представляет собой -Н, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу, бензильную группу или замещенную бензильную группу;
кольца А и В независимо являются незамещенными или замещенными;
указанная ацильная группа является алифатическим карбонилом, ароматическим карбонилом, алифатическим сульфонилом или ароматическим сульфонилом;
указанная алифатическая группа представляет собой C1-C6алкил, алкенил или алкинил;
указанную ароматическую группу выбирают из группы, состоящей из фенила, 1-нафтила, 2-нафтила, 1-антрацила, 2-антрацила, N-имидазолила, 2-имидазолила, 4-имидазолила, 5-имидазолила, 2-тиенила, 3-тиенила, 2-фуранила, 3-фуранила, 2-пирролила, 3-пирролила, 2-пиридила, 3-пиридила, 4-пиридила, 2-пиримидила, 4-пиримидила, 5-пиримидила, 3-пиридазинила, 4-пиридазинила, 3-пиразолила, 4-пиразолила, 5-пиразолила, 2-пиразинила, 2-тиазолила, 4-тиазолила, 5-тиазолила, 5-тетразолила, 2-оксазолила, 4-оксазолила, 5-оксазолила, тетрагидронафтила, 2-бензотиенила, 3-бензотиенила, 2-бензофуранила, 3-бензофуранила, 2-индолила, 3-индолила, 2-хинолинила, 3-хинолинила, 2-бензотиазолила, 2-бензооксазолила, 2-бензимидазолила, 1-изохинолинила, 3-хинолинила, 1-изоиндолила, 3-изоиндолила, акридинила, 3-бензизоксазолила, бензоциклопентила, бензоциклогексила;
указанная неароматическая гетероциклическая группа является пяти-восьмичленным неароматическим кольцом, которое содержит один или несколько гетероатомов, независимо выбранных из группы, состоящей из атома азота, кислорода или серы;
указанная замещенная алифатическая группа замещена одним или несколькими заместителями, выбранными из группы, состоящей из оксогруппы, эпоксигруппы, неароматического гетероциклического кольца, бензильной группы, замещенной бензильной группы, ароматической группы или замещенной ароматической группы, электроноакцепторной группы, атома галогена, азидогруппы, -CN, -CONR24R25, -NR24R25, -OS(O)2NR24R25, -S(O)2NR24R25, -SO3H, гуанидиногруппы, оксалильной группы, групп -C(=NR60)NR21R22, =NR60, -(O)u-(CH2)t-C(O)OR20, -(O)u-(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)-NR21R22, -(O)u-(CH2)t-NHC(O)O-R20, -Q-H, -Q-(алифатической группы), -Q-(замещенной алифатической группы), -Q-(арила), -Q-(ароматической группы), -Q-(замещенной ароматической группы), -Q-(CH2)р-(замещенной или незамещенной ароматической группы), -Q-(неароматической гетероциклической группы) или -Q-(CH2)p-(неароматической гетероциклической группы);
указанное замещенное неароматическое гетероциклическое кольцо замещено одним или несколькими заместителями, выбранными из группы, состоящей из =O, =S, электроноакцепторной группы, атома галогена, азидогруппы, -CN, -CONR24R25 , -NR24R25, -OS(O)2NR24R25, -S(O)2NR24R25, -SO3H, гуанидиногруппы, оксалильной группы, -C(=NR60)NR21R22, =NR60, -(O)u-(CH2)rC(O)OR20, -(O)u-(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)-NR21R22, -(O)u-(CH2)t-NHC(O)O-R20, -Q-H, -Q-(алифатической группы), -Q-(замещенной алифатической группы), -Q-(арила), -Q-(ароматической группы), -Q-(замещенэющ ароматической группы), -Q-(CH2)р-(замещенной или незамещенной ароматической группы), -Q-(неароматической гетероциклической группы) или -Q-(CH2)p-(неароматической гетероциклической группы);
указанная замещенная ароматическая группа, замещенная бензильная группа, кольцо А, когда оно замещено, и кольцо В, когда оно замещено, являются замещенными одним или несколькими заместителями, выбранными из группы, состоящей из электроноакцепторной группы, алифатической группы, замещенной алифатической группы, ароматической группы, замещенной ароматической группы, атома галогена, азидогруппы, -CN, -CONR24R25, -NR24R25, -OS(O)2NR24R25, -S(O)2NR24R25, -SO3H, гуанидиногруппы, оксалильной группы, -C(=NR60)NR21R22, =NR60, -(O)u-(CH2)t-C(O)OR20, -(O)u-(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)-NR21R22, -(O)u-(CH2)rNHC(O)O-R20, -Q-H, -Q-(алифатической группы), -Q-(замещенной алифатической группы), -Q-(арила), -Q-(ароматической группы), -Q-(замещенной ароматической группы), -Q-(CH2)р-(замещенной или незамещенной ароматической группы), -Q-(неароматической гетероциклической группы) или -Q-(CH2)р-(неароматической гетероциклической группы);
Q представляет собой группы -О-, -S-, -S(O)-, -S(O)2-, -OS(O)2-, -С(О)-, -ОС(О)-, -C(O)O, -C(O)C(O)-O-, -O-C(O)C(O), -NHC(O)-, -OC(O)NH-, -NH-C(O)-NH-, -S(O)2NH-, -NHS(O)2-, -C(NR23)NHNH-, -NHNHC(NR23)-, -NR24C(O)- или -NR24S(O)2-;
R20, R21 и R22 независимо представляют собой -Н, алифатическую группу, ароматическую группу, неароматическую гетероциклическую группу, -NHC(O)-O-(алифатическую группу), -NHC(O)-O-(ароматическую группу) или -NНС(O)-O-(неароматическую гетероциклическую группу) или R21 и R22, взятые вместе с атомом азота, с которым они связаны, могут образовать замещенное или незамещенное неароматическое гетероциклическое кольцо;
R23 представляет собой -Н, алифатическую группу, бензильную группу, арильную группу или неароматическую гетероциклическую группу;
R24 и R25 независимо представляют собой -Н, алифатическую группу, замещенную алифатическую группу, бензильную группу, арильную группу, неароматическую гетероциклическую группу или R24 и R25, взятые вместе с атомом азота, с которым они связаны, могут образовать замещенное или незамещенное неароматическое гетероциклическое кольцо;
R60 представляет собой -Н, -ОН, -NH2, ароматическую группу или замещенную ароматическую группу,
t - число от нуля до трех;
u является нулем или единицей;
р - число от нуля до пяти.
2. Соединение по п.1, в котором кольцо А является незамещенным и кольцо В замещено в параположение к атому углерода кольца В, который связан с группой X1 в кольце С, и группа Z представлена структурной формулой
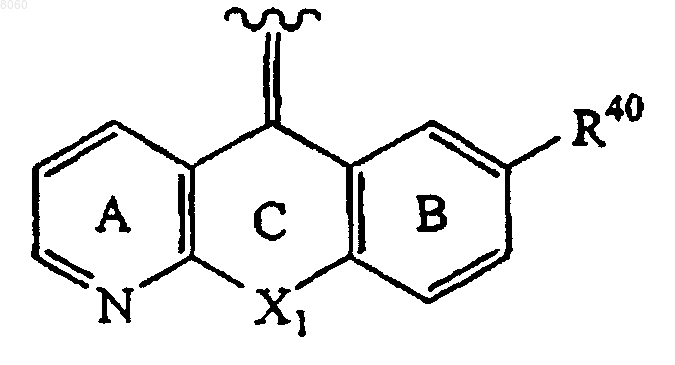
в которой R40 представляет собой -ОН, -СООН, -NO2, атом галогена, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу, -NR24R25, -CONR24R25, -NR24С(O)-(алифатическую группу), -NR24С(O)-(замещенную алифатическую группу), -NR24S(O)2-(алифатическую группу), -NR24S(O)2-(замещенную алифатическую группу), -C(O)O(алифатическую группу), -С(O)O-(замещенную алифатическую группу), -С(O)-(алифатическую группу), -С(О)-(замещенную алифатическую группу), -O-(алифатическую группу), -O-(замещенную алифатическую группу), -O-(ароматическую группу), -O-(замещенную ароматическую группу), электроноакцепторную группу, -(O)u-(CH2)t-C(O)OR20, -(O)u-(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)-NR21R22 или -(O)u-(CH2)t-NHC(O)O-R20;
R20, R21 или R22 независимо представляют собой -Н, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу или неароматическую гетероциклическую группу; или
R21 и R22, взятые вместе с атомом азота, с которым они связаны, образуют неароматическое гетероциклическое кольцо;
R24 и R25 независимо представляют собой -Н, алифатическую группу или замещенную алифатическую группу;
u является нулем или единицей и
t - число от нуля до трех.
3. Соединение по п.2, в котором М представляет собой >CR1R2; R1 представляет собой -Н или -ОН и R2 является замещенной ароматической группой, в которой указанная замещенная ароматическая группа представляет собой 4-галоидфенил.
4. Соединение по п.3, в котором указанный 4-галоидфенил выбран из группы, состоящей из 4-хлорфенила, 4-бромфенила и 4-фторфенила.
5. Соединение по п.4, в котором указанный 4-галоидфенил представляет собой 4-хлорфенил.
6. Соединение по п.3, в котором X1 представляет собой -CH2-О-.
7. Соединение по п.2, в котором по меньшей мере один из заместителей R70, R71, R72 и R73 представляет собой алифатическую группу или замещенную алифатическую группу;
в котором указанная алифатическая группа представляет собой C1-C6 алкил и указанная замещенная алифатическая группа является C1-C6 алкилом, замещенным заместителем, выбранным из группы, состоящей из -ОН, -(O)u-(CH2)t-C(O)OR20 и -O-(алифатической группы);
t - число от нуля до трех;
u является нулем или единицей и
R20 - является C1-C6алкилом.
8. Соединение по п.7, в котором оба заместителя R70 и R71 представляют собой -Н; R72 и R73 независимо выбирают из группы, состоящей из C1-C6 алкила и замещенного C1-C6 алкила.
9. Соединение по п.8, в котором R72 представляет собой -СН3.
10. Соединение, имеющее формулу
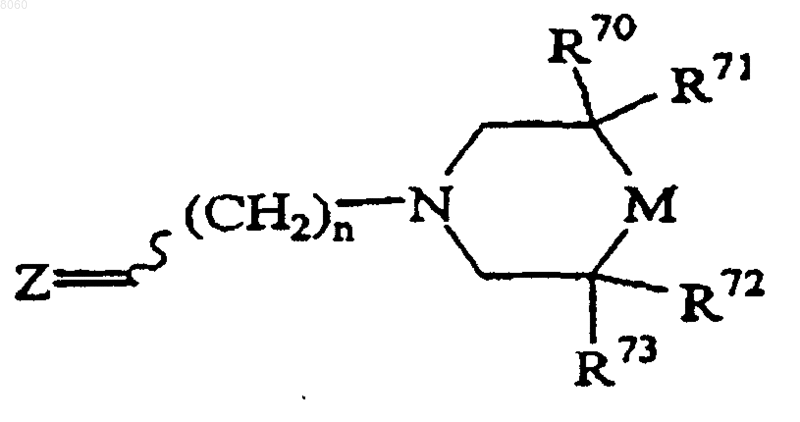
или его физиологически приемлемая соль,
в которой n - число от единицы до четырех;
М представляет собой >CR1R2;
R1 представляет собой -ОН;
R2 является 4-галоидфенилом;
R70 и R71 представляют собой -Н и
R72 и R73 это -СН3; или
R70 и R71 представляют собой -СН3 и
R72 и R73 это -Н;
Z представляет собой
X1 представляет собой -CH2-О- и
R40 выбирают из группы, состоящей из
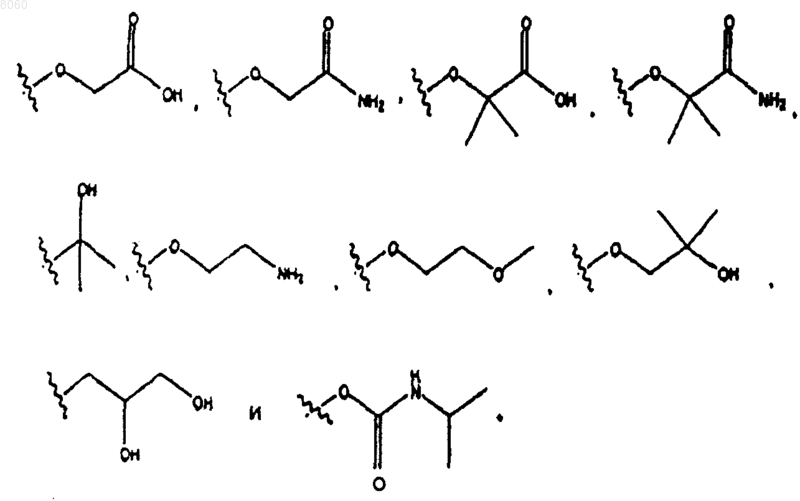
11. Соединение по п.10, в котором R40 представляет собой

12. Соединение по п.10, в котором указанный 4-галоидфенил выбирают из группы, состоящей из 4-хлорфенила, 4-бромфенила и 4-фторфенила.
13. Соединение по п.12, в котором указанный 4-галоидфенил представляет собой 4-хлорфенил.
14. Соединение по п.13, в котором R70 ш R71 представляют собой -Н, R72 и R73 - это -СН3, n равно двум, и соединение имеет структуру
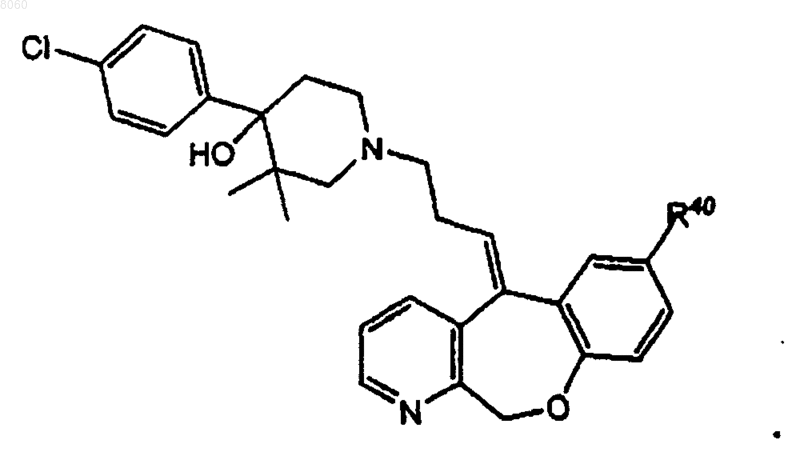
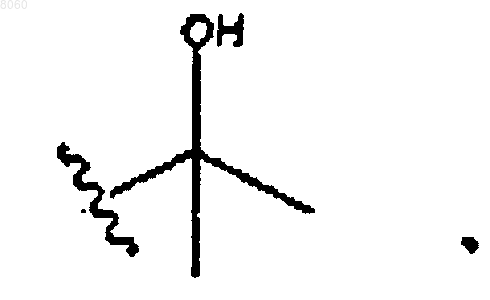
15. Соединение по п.14, в котором R40 представляет собой
16. Соединение, имеющее структуру
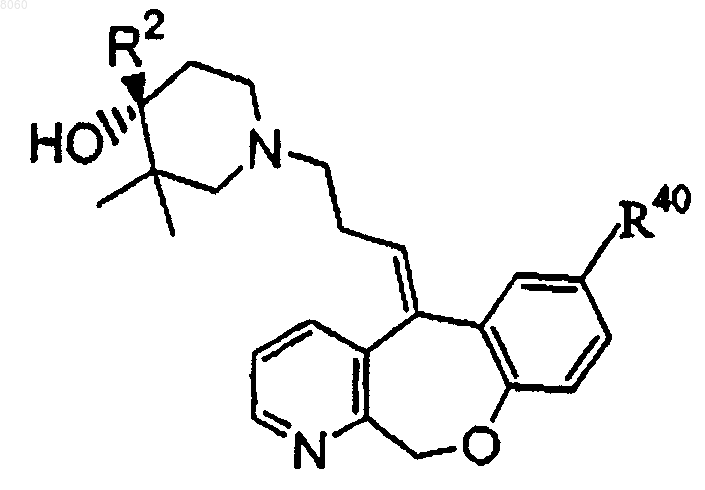
или его физиологически приемлемая соль, в котором R2 представляет собой 4-галоидфенил и R40 выбирают из группы, состоящей из
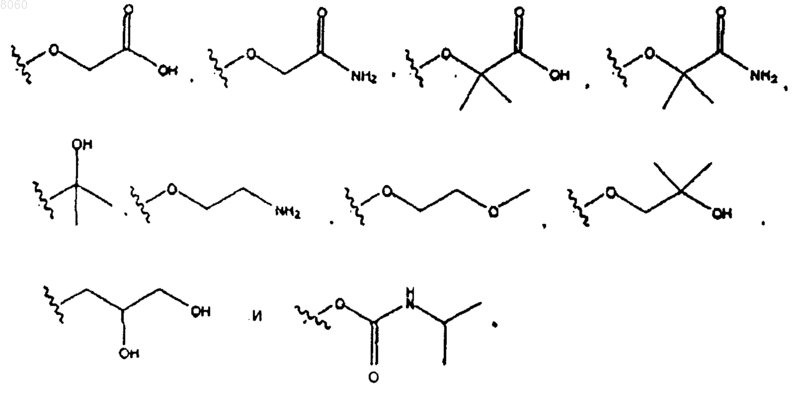
17. Соединение по п.16, в котором R40 представляет собой
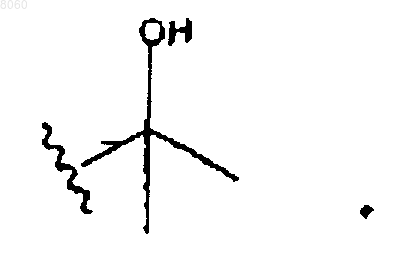
18. Соединение по п.16, в котором R2 выбирают из группы, состоящей из 4-хлорфенила, 4-бромфенила и 4-фторфенила.
19. Соединение по п.18, в котором R2 представляет собой 4-хлорфенил.
20. Соединение по п.17, в котором R2 представляет собой 4-хлорфенил.
21. Способ лечения заболевания, связанного с нарушенным восстановлением лейкоцитов, нарушенной активацией лейкоцитов или с нарушенным восстановлением и активацией лейкоцитов, который заключается во введении нуждающемуся субъекту эффективного количества соединения по пп.1, 10 или 15.
22. Способ по п.21, в котором указанное заболевание выбирают из группы, состоящей из атеросклероза, артериосклероза, рестеноза, ишемического/реперфузионного повреждения, диабетического меллита, псориаза, воспалительного заболевания кишечного тракта, отторжения трансплантированных органов или тканей, реакции "трансплантат против хозяина", аллергии и астмы.
23. Способ лечения заболевания, связанного с нарушенным восстановлением лейкоцитов, нарушенной активацией или с нарушенным восстановлением и активацией лейкоцитов, который заключается во введении нуждающемуся субъекту эффективного количества соединения по п.16 или 20.
24. Способ по п.23, в котором указанное заболевание выбирают из группы, состоящей из атеросклероза, артериосклероза, рестеноза, ишемического/реперфузионного повреждения, диабетического меллита, псориаза, воспалительного заболевания кишечного тракта, отторжения трансплантированных органов или тканей, реакции "трансплантат против хозяина", аллергии и астмы.
25. Способ лечения хронического воспалительного заболевания, который заключается во введении нуждающемуся субъекту эффективного количества соединения по пп.1, 10 или 15.
26. Способ лечения хронического воспалительного заболевания, который заключается во введении нуждающемуся субъекту эффективного количества соединения по п.16 или 20.
27. Способ лечения артрита, который заключается во введении нуждающемуся субъекту эффективного количества соединения по пп.1,10 или 15.
28. Способ по п.27, в котором указанным артритом является ревматоидный артрит.
29. Способ лечения артрита, который заключается во введении нуждающемуся субъекту эффективного количества соединения по п.16 или 20.
30. Способ по п.29, в котором указанным артритом является ревматоидный артрит.
31. Способ лечения множественного склероза, который заключается во введении нуждающемуся субъекту эффективного количества соединения по пп.1, 10 или 15.
32. Способ лечения множественного склероза, который заключается во введении нуждающемуся субъекту эффективного количества соединения по п.16 или 20.
33. Применение соединения по пп.1, 10 или 15 для изготовления лекарственного препарата для лечения заболевания, связанного с нарушенным восстановлением лейкоцитов, нарушенной активацией лейкоцитов или с нарушенным восстановлением и активацией лейкоцитов.
34. Применение по п.33 при котором указанное заболевание выбирают из группы, состоящей из атеросклероза, артериосклероза, рестеноза, ишемического/реперфузионного повреждения, диабетического меллита, псориаза, воспалительного заболевания кишечного тракта, отторжения трансплантированных органов или тканей, реакции "трансплантат против хозяина", аллергии и астмы.
35. Применение соединения по п.16 или 20 для изготовления лекарственного препарата для лечения заболевания, связанного с нарушенным восстановлением лейкоцитов, нарушенной активацией лейкоцитов или с нарушенным восстановлением и активацией лейкоцитов.
36. Применение по п.35, при котором указанное заболевание выбирают из группы, состоящей из атеросклероза, артериосклероза, рестеноза, ишемического/реперфузионного повреждения, диабетического меллита, псориаза, воспалительного заболевания кишечного тракта, отторжения трансплантированных органов или тканей, реакции "трансплантат против хозяина", аллергии и астмы.
37. Применение соединения по пп.1,10 или 15 для изготовления лекарственного препарата для лечения хронического воспалительного заболевания.
38. Применение соединения по пп.16 или 20 для изготовления лекарственного препарата для лечения хронического воспалительного заболевания.
39. Применение соединения по пп.1, 10 или 15 для изготовления лекарственного препарата для лечения артрита.
40. Применение по п.39, при котором указанным артритом является ревматоидный артрит.
41. Применение соединения по п.16 или 20 для изготовления лекарственного препарата для лечения артрита.
42. Применение по п.41, при котором указанным артритом является ревматоидный артрит.
43. Применение соединения по пп.1, 10 или 15 для изготовления лекарственного препарата для лечения множественного склероза.
44. Применение соединения по п.16 или 20 для изготовления лекарственного препарата для лечения множественного склероза.
45. Соединение по пп.1, 10 или 15 для применения в терапии.
46. Соединение по п.16 или 20 для применения в терапии.
47. Фармацевтическая композиция, содержащая соединение по пп.1, 10 или 15 и физиологически приемлемый носитель.
48. Фармацевтическая композиция, содержащая соединение по п.16 или 20 и физиологически приемлемый носитель.
Текст
008060 Данная заявка является частичным продолжением заявки на патент США 09/989086, поданной 21 ноября 2001 г., которая является частичным продолжением заявки на патент США 09/627886, поданной 28 июля 2000 г., которая является частичным продолжением заявки на патент США 09/362837, поданной 28 июля 1999 г., которая является частичным продолжением заявки на патент США 09/235102, поданной 21 января 1999 г., которая является частичным продолжением заявки на патент США 09/148823, поданной 4 сентября 1998 г.; все основные идеи указанных выше заявок вошли в настоящую заявку. Уровень техники Химически привлекающие (хемоатрактанты) цитокины или хемокины представляют собой семейство медиаторов, предшествующих воспалению, которые способствуют восстановлению и активации сложных последовательностей поколений лейкоцитов и лимфоцитов. Они могут выделяться во многих видах тканевых клеток после активации. Непрерывное выделение хемокинов в местах воспаления является промежуточным звеном развивающейся миграции клеток эффектора при хроническом воспалении. Охарактеризованные к настоящему времени хемокины связаны в первичную структуру. Они распределяют четыре сохраненных цистеина, которые образуют дисульфидные связи. На основе этого сохраненного цистеинового мотива это семейство подразделяется на две основные линии, обозначенные как С-ХС-хемокины (альфа-хемокины) и С-С-хемокины (бета-хемокины), в которых первые два сохраненных цистеина разделяются промежуточным или примыкающим остатком, соответственно (Baggiolini M.,Dahinden C.A., Immunology Today, vol. 15, pp. 127-133 (1994. С-Х-С-хемокины содержат ряд сильных хемоатрактантов и активаторов нейтрофилов, таких как интерлейкин 8 (IL-8), PF-4 и нейтрофил-активирующий пептид-2 (NAP-2). С-С-хемокины включаютRANTES (Регулируемый при Активации, Нормально Т-Выраженный и Секретированный), макрофаговые воспалительные протеины 1 и 1 (MIP-1 и MIP-1), эотаксин и моноцитные хемотактические протеины (МСР) человека 1-3 (МСР-1, МСР-2, МСР-3), которые были охарактеризованы как хемоатрактанты и активаторы моноцитов или лимфоцитов, но, по-видимому, они не являются хемоатрактантами для нейтрофилов. Хемокины, такие как RANTES и MIP-1, вовлечены в обширный круг острых и хронических воспалительных заболеваний человека, включающих респираторные заболевания, такие как астма и аллергические нарушения. Рецепторы хемокина являются членами надсемейства рецепторов со спареным G-протеином (GPCR), в которых распределены структурные признаки, отражающие общий механизм действия сигнальной трансдукции (Gerard С., Gerard N., Annu Rev. Immunol., 12, pp. 775-808 (1994); Gerard С, Gerard N., Curr. Opin. Immunol.,6, pp 140-145 (1994. Сохраненные признаки включают семь гидрофобных областей, охватывающих плазменные мембраны, которые соединяются посредством гидрофильных внеклеточных и внутриклеточных петель. Большинство первичной гомологической последовательности встречается в гидрофобных межмембранных областях, причем гидрофильные области являются более разнообразными. Первый рецептор для С-Схемокинов, который был подвергнут клонированию и экспрессии, связывает MIP-1 и RANTES. Соответственно, этот рецептор MIP-1/RANTES был обозначен как С-С-хемокинный рецептор 1 (также называетсяCCR-1; Neote et al., Cell, 72, pp. 415-425 (1993); Horuk и др., WO 94/11504, 26.05.94; Gao J. et al., J. Exp. Med.,177, pp. 1421-1427 (1993. Были охарактеризованы три рецептора, которые дают связь и/или импульс в ответ на RANTES: CCR3 является посредником при связывании или передаче импульса хемокинов, включающих эотаксин, RANTES и МСР-3 (Ponath et al., J. Exp. Med., 183, p. 2437 (1996, CCR4 связывает хемокины, включающие RANTES, MIP-1 и МСР-3 (Power et al., J. Biol. Chem., 270, pp. 194-95, 1995 и CCR5 связывает хемокины, включающие RANTES, MIP-l и MIP-1 (Samson et al., Biochem. 35, pp. 3362-3367 (1996. RANTES представляет собой хемотактичный хемокин для разнообразных типов клеток, включая моноциты, эозинофилы и подмножество Т-клеток. Ответная реакция этих различных клеток не всегда может передаваться тем же самым рецептором, и возможно, что для рецепторов CCR1, CCR4 и CCR5 будет обнаружена определенная селективность при распределении и функционировании рецептора между типами лейкоцитов, как уже было продемонстрировано для CCR3 (Ponath и др.). В частности, способность RANTES вызывать направленную миграцию моноцитов и запоминающую популяцию циркулирующих Т-клеток (Schall Т. et al. Nature, 347, 66971 (1990, позволяет предположить, что этот хемокин и его рецептор (рецепторы) могут играть решающую роль в хронических воспалительных заболеваниях, так как эти заболевания характеризуются деструктивными инфильтратами Т-клеток и моноцитов. Многие существующие лекарственные препараты были разработаны как антагонисты рецепторов для биогенных аминов, например как антагонисты допаминных и гистаминных рецепторов. Однако не были разработаны эффективные антагонисты рецепторов для более крупных белков, таких как хемокины и С 5 а. Небольшие молекулы антагонистов взаимодействия между рецепторами С-С-хемокина и их лигандами, включающими RANTES и MIP-l, могли бы обеспечить соединения, пригодные для торможения вредных воспалительных процессов, "запускаемых" при взаимодействии лигандов рецептора, а также ценный инструмент (зонд) для исследования взаимодействий рецептор-лиганд. Сущность изобретения Было обнаружено, что класс небольших органических молекул, которые являются антагонистами действия рецептора хемокина и могут ингибировать активацию и/или восстановление лейкоцитов. Анта-1 008060 гонист действия рецептора хемокина представляет собой молекулу, которая может ингибировать связывание и/или активацию одного или нескольких хемокинов, включающих С-С-хемокины, такие какRANTES, MIP-l, МСР-2, МСР-3 и МСР-4, с одним или несколькими рецепторами хемокина на лейкоцитах и/или других типах клеток. В результате, эти небольшие органические молекулы могут ингибировать процессы и клеточные ответные реакции, передаваемые хемокинными рецепторами. На основе этого открытия описан способ лечения заболевания, связанного с нарушенным восстановлением и/или активацией лейкоцитов, а также способ лечения заболевания, передаваемого за счет действия хемокинного рецептора. Этот способ включает введение нуждающемуся субъекту эффективного количества соединения или небольших органических молекул, которые являются антагонистами действия рецептора хемокина. Соединения или небольшие органические молекулы, для которых было установлено, что они являются антагонистами действия рецептора хемокина, подробно рассматриваются ниже, причем они могут применяться для производства лекарственных препаратов для лечения или предупреждения заболевания,связанного с нарушенным восстановлением и/или активацией лейкоцитов. В одном варианте изобретения применяется соединение, имеющее формулу или его физиологически приемлемая соль, в которой Z, n, M, R70, R71, R72 и R73 являются такими, как описано в заявке. Данное изобретение также относится к описанным соединениям или небольшим органическим молекулам, используемым при лечении или предупреждении заболевания, связанного с нарушенным восстановлением и/или активацией лейкоцитов. Изобретение также включает фармацевтические композиции, содержащие одно или несколько соединений или небольших органических молекул, для которых было установлено, что они являются антагонистами действия рецептора хемокина, и подходящий фармацевтический носитель. Изобретение дополнительно относится к новым соединениям, которые могут применяться для лечения пациента с заболеванием, связанным с нарушенным восстановлением и/или активацией лейкоцитов, и способам их получения. Краткое описание чертежей Фиг. 1- схема получения соединений, представленных структурной формулой (I). Фиг. 2 - схема получения соединений, представленных соединением (VI-b). Фиг. 3 - схема получения соединений, представленных структурной формулой (I). Фиг. 4 - схема и получения соединений, представленных структурной формулой (I), в которой группа Z представлена структурной формулой (III) и в которой кольцо А и/или кольцо В в Z замещено радикалом R40. Фиг. 5 - схема получения соединений, представленных структурной формулой (I), в которой группаZ представлена структурной формулой (III) и в которой кольцо А и/или кольцо В в Z замещено группами-(O)u-(CH2)t-COOR20, -(O)u-(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)NR21R22 или -(O)u-(CH2)t-NHC(O)O-R20. Фиг. 6 А-6Z иллюстрируют примеры структур соединений настоящего изобретения. Фиг. 7 иллюстрирует получение соединений, представленных структурной формулой (I), в которой группа Z представлена структурной формулой (III) и в которой кольцо А или кольцо В в Z замещено радикалом R40. Фиг. 8 А - схема получения 4-(4-хлорфенил)-4-фторпиперидина. Фиг. 8 В - схема получения 4-4-азидо-4-(4-хлорфенил)пиперидина. Фиг. 8 С - схема получения 4-(4-хлорфенил)-4-метилпиперидина. Фиг. 9 А - схема получения соединений, представленных структурными формулами (I), (VIII) и(VIII), в которых R1 представляет собой амин. Фиг. 9 В - схема получения соединений, представленных структурными формулами (I), (VIII) и(VIII), в которых R1 представляет собой алкиламин. Фиг. 9 С - схема получения 2-(4-хлорфенил)-1-(N-метил)этиламина. Фиг. 9D - схема получения 3-(4-хлорфенил)-3-хлор-1-гидроксипропана. Фиг. 9 Е - схема получения 3-(4-хлорфенил)-1-(N-метил)аминопропана. Фиг. 10 А - схема получения 3-(4-хлорфенил)-3-гидроксил-3-метил-1-N-метиламинопропана. Фиг. 10 В - схема получения 1-(4-хлорбензоил)-1,3-пропилендиамина. Фиг. 10 С - схема получения соединений, представленных структурными формулами (I), (VII),(VIII), (IX) и (XI), в которых группа Z представлена структурной формулой (III) и в которой кольцо А и/или кольцо В в Z замещено радикалом R40. Для фиг. 10 С радикал R40 представляет собой группу -(O)u(CH2)t-C(O)NR21R22, u равно единице, a t равно нулю.-2 008060 Фиг. 10D - схема получения 4-(4-хлорфенил)-4-пиридина. Фиг. 11 А-11 Т иллюстрируют примеры структур соединений настоящего изобретения. Фиг. 12 - схема получения соединений формулы (VI-c). Фиг. 13 - схема получения соединений формулы (VI-e). Фиг. 14 - схема получения соединений в примерах 434 и 435. Фиг. 15 - схема получения соединений в примерах 436-438. Фиг. 16 - схема получения соединений формулы (I-f). Фиг. 17 - схема получения соединений в примерах 441 и 442. Фиг. 18 - схема получения соединения в примере 443. Фиг. 19 - схема получения соединений в примерах 315, 455, 338 и 446. Фиг. 20-28 иллюстрируют примеры структур соединений настоящего изобретения. Подробное описание изобретения Настоящее изобретение относится к соединениям - небольшим молекулам, которые являются модуляторами действия рецептора хемокина. В предпочтительном варианте воплощения соединения - небольшие молекулы являются антагонистами действия рецептора хемокина. В соответствии с этим процессы или клеточные ответные реакции, передаваемые путем связывания хемокина с рецептором, могут быть ингибированы (ослаблены или предотвращены, полностью или частично), включая миграцию лейкоцитов, активацию интегрина, переходный процесс роста концентрации внутриклеточного свободного кальция [Ca]i, и/или гранулярное выделение медиаторов, предшествующих воспалению. Изобретение также относится к способу лечения, включая профилактическое и терапевтическое лечение, заболевания, связанного с нарушенным восстановлением и/или активацией лейкоцитов, или передаваемого хемокинами, или действием рецептора хемокина, включая хронические воспалительные нарушения, которые характеризуются наличием RANTES, MIP-1, МСР-2, МСР-3 и/или МСР-4 чувствительных Т-клеток, моноцитов и/или эозинофилов, включая, но не ограничиваясь такими заболеваниями,как артрит (например, ревматоидный артрит), атеросклероз, артериосклероз, рестеноз, ишемическое/реперфузионное повреждение, диабетический меллит (например, диабетический меллит типа 1),псориаз, множественный склероз, воспалительные заболевания кишечного тракта, такие как язвенный колит или гранулематозная болезнь, отторжение трансплантированных органов и тканей (например, острое отторжение аллогенного трансплантата, хроническое отторжение аллогенного трансплантата), реакция "трансплантат против хозяина", а также аллергические заболевания и астма. Другими заболеваниями, связанными с нарушенным восстановлением и/или активацией лейкоцитов, которые могут быть излечены (включая профилактическое лечение) описанными в этом изобретении способами, являются воспалительные заболевания, связанные с инфекцией вируса иммунодефицита человека (ВИЧ), например энцефалит, связанный с синдромом приобретенного иммунного дефицита (СПИД), связанная со СПИДом макропапулезная кожная сыпь, связанная со СПИДом интерстициальная пневмония, связанное со СПИДом поражение кишечника, связанное со СПИДом перипортальное воспаление печени и связанный со СПИДом гломерулярный нефрит. Этот способ включает введение субъекту, нуждающемуся в лечении, эффективного количества соединения (т.е. одного или нескольких соединений), которые являются ингибиторами действия рецептора хемокина, ингибируют связывание хемокина с лейкоцитами и/или другими типами клеток, и/или которые ингибируют миграцию лейкоцитов и/или их активацию в области воспаления. Настоящее изобретение также относится к способам антагонизации рецептора хемокина, такого какCCR1, у млекопитающего, которые включают введение в организм млекопитающего соединения, которое описано в этом изобретении. В соответствии с этим способом можно ингибировать передаваемый хемокином хемотаксис и/или активацию предшествующих воспалению клеток, несущих рецепторы для хемокина. Используемое здесь выражение "предшествующие воспалению клетки" включает лейкоциты (но не ограничивается ими),поскольку рецепторы хемокина могут быть подвергнуты экспрессии на других типах клеток, таких как нейроны и эпителиальные клетки. Несмотря на нежелание связывать себя с какой-либо конкретной теорией или механизмом действия,предполагается, что соединения изобретения являются антагонистами рецептора хемокина CCR1 и что терапевтические преимущества, получаемые от способа изобретения, являются результатом антагонизма действия рецептора CCR1. Таким образом, способ и соединения этого изобретения можно использовать для консервативного лечения состояния, включающего клетки, на поверхности которых осуществляется экспрессия CCR1 и которые реагируют на сигналы, перенесенные через CCR1, а также перечисленных выше конкретных состояний. В одном варианте воплощения антагонист действия рецептора хемокина представлен структурной формулой (I) и его физиологически приемлемыми солями,где Z является циклоалкильной или неароматической группой гетероциклического кольца, конденсированной с одним, двумя или несколькими ароматическими кольцами, причем каждое кольцо в Z является независимо замещенным или незамещенным,n является целым числом от 1 до 4. Предпочтительно, n равно 1, 2 или 3. Более предпочтительно, n равно 2. В альтернативных вариантах воплощения вместо группы (CH2)n можно использовать другие алифатические или ароматические пространственные группы (L) - спейсеры. Группа М представляет собой NR2 или CR1R2. Предпочтительно М является группой C(OH)R2. Радикал R1 является атомом водорода, группой -ОН, -N3, атомом галогена, алифатической группой,замещенной алифатической группой, аминоалкильной группой, -O-(алифатической группой), -O(замещенной алифатической группой), -SH, -S-(алифатической группой), -S-(замещенной алифатической группой), -ОС(O)-(алифатической группой), -ОС(O)-(замещенной алифатической группой), -С(O)O(алифатической группой), -С(O)O-(замещенной алифатической группой), -СООН, -CN, -CONR3R4,-NR3R4; или R1 может представлять собой ковалентную связь между кольцевым атомом в группе М и соседним атомом углерода в кольце, которое содержит М. Предпочтительно R1 представляет собой атом водорода или группу -ОН. Радикал R2 является атомом водорода, группой -ОН, галогеном, ацильной группой, замещенной ацильной группой, -NR5R6, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, бензильной группой, замещенной бензильной группой,неароматической гетероциклической группой, замещенной неароматической гетероциклической группой, -O-(замещенной или незамещенной ароматической группой), или -О-(замещенной или незамещенной алифатической группой), или -С(O)-(замещенной или незамещенной ароматической группой), или С(O)-(замещенной или незамещенной алифатической группой). Предпочтительно, R2 представляет собой ароматическую группу или замещенную ароматическую группу. Заместители R3, R4, R5 и R6 независимо являются атомом водорода, ацильной группой, замещенной ацильной группой, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, бензильной группой, замещенной бензильной группой, неароматической гетероциклической группой или замещенной неароматической гетероциклической группой. Заместители R1 и R2, R3 и R4 или R5 и R6, взятые вместе с атомом, с которым они связаны, альтернативно могут образовать замещенное или незамещенное, неароматическое карбоциклическое или гетероциклическое кольцо. В вариантах воплощения, в которых М является группой CR1R2 и R1 является ковалентной связью между атомом углерода в группе М и соседним атомом углерода в кольце, которое содержит М, антагонист действия хемокина может быть представлен структурной формулой (Iа) где Z, n и R - такие, как описано в структурной формуле (I). В одном предпочтительном варианте воплощения Z является трициклической кольчатой системой,содержащей две карбоциклических ароматических группы, конденсированные с 6-, 7- или 8-членной циклоалкильной группой или с неароматическим гетероциклическим кольцом. В одном примере Z представляется структурной формулой (II) Фенильные кольца в структурной формуле (II), помеченные А и В, в этом изобретении называются как кольцо А и кольцо В соответственно. Центральное кольцо, помеченное как С, называется кольцо С, и может быть, например, 6-, 7- или 8-членным неароматическим карбоциклическим кольцом (например,циклогептановым или циклооктановым кольцом) или неароматическим гетероциклическим кольцом. Когда кольцо С является неароматическим гетероциклическим кольцом, оно может содержать один или-4 008060 два гетероатома, таких как азот, сера или кислород. Когда Z представлено структурной формулой (II),трициклическая кольчатая система может быть соединена с остальной частью молекулы ковалентной двойной связью между атомом углерода в кольце С и атомом углерода, который связан с Z, как показано в структурной формуле (I). Кольцо А и/или кольцо В в структурной формуле (II) может быть незамещенным. Альтернативно,кольцо А и/или кольцо В может иметь один или несколько заместителей. Подходящие заместители описаны ниже. В одном примере кольцо А или кольцо В замещено группой -(O)u-(CH2)t-C(O)OR20, -(O)u(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)-NR21R22 или -(O)u-(CH2)t-NHC(O)OR20, u равно нулю или единице, t представляет собой целое число от нуля до приблизительно 3, а метиленовая группа -(СН 2)t- может быть замещенной, как описано здесь для алифатических групп, или незамещенной. Заместители R20, R21 или R22 независимо является атомом водорода, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой или неароматической гетероциклической группой. Альтернативно, R21 и R22, взятые вместе с атомом азота, с которым они связаны, могут образовать неароматическое гетероциклическое кольцо. Кольцо С необязательно содержит один или несколько заместителей, которые описаны ниже. Примеры подходящих трициклических кольчатых систем, Z, представлены структурной формулой Кольцо А и кольцо В в структурной формуле (III) такие, как описано для структурной формулы (II). Группа X1 представляет собой связь, -О-, -S-, -CH2-, -CH2-CH2-, -CH2-S-, -S-CH2-, -O-CH2-, -CH2-O-,-NRc-CH2-, -CH2-NRc-, -SO-CH2-, -CH2-SO-, -S(O)2-CH2-, -CH2-S(O)2, -CH=CH-, -NRc-CO или -СО-NRc-. Предпочтительно X1 представляет собой -CH2-O-, -CH2-CH2-, -CH2-S-, -NRc-CO или -CO-NRc-. Радикал Rc является атомом водорода, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, бензильной группой или замещенной бензильной группой. В одном примере Rc представляет собой группу -(CH2)s-COOR30, -(CH2)s-C(O)-NR31R32 или -(CH2)sNHC(O)-O-R30, в которой s является цельм числом от 1 до приблизительно 3. Заместители R30, R31 и R32 независимо являются атомом водорода, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой или неароматической гетероциклической группой. Альтернативно, R31 и R32, взятые вместе с атомом азота, с которым они связаны, образуют неароматическое гетероциклическое кольцо. Другие примеры подходящих трициклических кольчатых систем для Z включают бензодиазепины,бензооксазепины, бензооксазины, фенотиазины и группы, представленные следующими структурными формулами В других предпочтительных вариантах воплощения Z является трициклической кольчатой системой, содержащей две ароматические группы, конденсированные с 7- или 8-членной циклоалкильной группой или с неароматическим гетероциклическим кольцом, в котором по меньшей мере одна ароматическая группа является гетероарильной группой. В одном примере Z представлено структурной формулой (IV) Кольцо А в структурной формуле (IV) может быть замещенной или незамещенной гетероарильной группой. Кольцо В в структурной формуле (IV) может быть замещенной или незамещенной ароматической группой, например гетероарильной группой или карбоциклической арильной группой. Подходящие заместители описаны ниже. В одном примере кольцо А и/или кольцо В замещено группой -(O)u-(CH2)tC(O)OR20, -(O)u-(CH2)t-OC(O)R20, (O)u-(CH2)t-C(O)-NR21R22 или -(O)u-(CH2)t-NHC(O)O-R20, как описано выше. Числа u, t и заместители R20, R21 и R22 являются такими, как описано выше. X1 и Rc могут быть такими, как описано выше для структурной формулы (III). В другом варианте воплощения настоящего изобретения Z представлено структурной формулой(IV), в которой кольцо А является пиридильной группой, а кольцо В является ароматической или гетероароматической группой. В одном примере Z представлено структурной формулой (IVа) В этом варианте воплощения кольцо А и кольцо В являются независимо замещенными или незамещенными и предпочтительно кольцо В является фенильной группой. Группы X1 и Rc могут быть такими,как описано выше, в структурной формуле (III). В другом варианте воплощения как кольцо А, так и кольцо В являются пиридильными группами, aZ представлено структурной формулой (IVb) Кольцо А и кольцо В могут быть независимо замещенными или незамещенными, как описано выше, в структурной формуле (II), и группа X1 может быть такой, как описано выше, в структурной формуле (III). В других вариантах воплощения Z представляется структурной формулой (V) Кольцо А и кольцо В могут быть независимо замещенными или незамещенными, как описано выше, в структурной формуле (II), и группа X1 может быть такой, как описано выше, в структурной формуле (III). В особенно предпочтительных вариантах воплощения кольцо В в структурной формуле (V) замещено в параположении относительно атома углерода кольца В, который связан с группой X1 в кольце С,и Z представлено структурной формулой (VI) Группа X1 может быть такой, как описано выше, в структурной формуле (II). Предпочтительно X1 является группой -CH2-О-, -CH2-CH2- или -CH2-S-. Заместитель R40 является таким, как описано ниже для ароматических групп. В одном варианте воплощения R40 является группой -ОН, -СООН, -NO2, атомом галогена, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, -NR24R25,-6 008060-CONR24R25, -C(=NR60)NR21R22, -Q-(алифатической группой), -Q-(замещенной алифатической группой),-O-(алифатической группой), -O-(замещенной алифатической группой), -O-(ароматической группой), -O(замещенной ароматической группой), электронноакцепторной группой или -(O)u-(CH2)t-C(O)O-R20,-(O)u-(CH2)t-OC(O)-R20, R22, -(O)u-(CH2),-C(O)-NR21R22 или -(O)u-(CH2)t-NHC(O)O-R20. Группы Q, R20, R21,R22, R24, R25, R60, u и t имеют указанные выше значения. Предпочтительно R40 является алифатической группой, замещенной алифатической группой, -O(алифатической группой) или -O-(замещенной алифатической группой). В некоторых вариантах воплощения R40 является -О-алкилом, таким как -О-СН 3, -O-С 2 Н 5, -O-С 3 Н 7, или -O-С 4 Н 9. В другом варианте изобретения R40 может быть представлен группой -(O)u-(CH2)t-C(O)-NR21R22, в которой u равно 1, t равно нулю, a R21 и R22 имеют указанные выше значения. В этом варианте воплощения каждый радикал R21 и R22 независимо может быть атомом водорода, замещенной или незамещенной алифатической группой, замещенной или незамещенной ароматической группой, или R21 и R22, взятые вместе с атомом азота, с которым они связаны, образуют замещенное или незамещенное ароматическое неароматическое гетероциклическое кольцо (например, пирролидин, пиперидин, морфолин). В другом варианте изобретения R40 может быть представлен группой -(O)u-(CH2)t-C(O)-NR21R22, в которой u равно нулю, t равно от 1 до 3, a R21 и R22 имеют указанные выше значения. В другом варианте изобретения радикал R40 может быть представлен группой -(O)u-(CH2)t-C(O)21 22NR R , в которой u и t равны нулю, a R21 и R22 имеют указанные выше значения. В другом варианте изобретения R40 представляет собой алифатическую группу, например метил,этил, пропил, которая замещена группой -NR24R25, или -CONR24R25, в которой R24 и R25 такие, как описано ранее. Например, R40 может быть представлен структурами В другом варианте изобретения R40 представляет собой группу -O-C(O)-NR21R26, в которой R21 такой, как описано ранее, R26 может быть атомом водорода, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, неароматической гетероциклической группой, -С(O)-O-(замещенной или незамещенной алифатической группой), -С(O)-O(замещенной или незамещенной ароматической группой), -S(O)2-(замещенной или незамещенной алифатической группой), -S(O)2-(замещенной или незамещенной ароматической группой), или R21 и R26, взятые вместе с атомом азота, с которым они связаны, могут образовать замещенное или незамещенное неароматическое гетероциклическое кольцо. В дополнительных вариантах воплощения R40 может быть группой -S(O)2-NR21R22 или -N-C(O)21 22NR R , в которой R21 и R22 такие, как описано ранее. В предпочтительном варианте воплощения антагонист рецептора хемокина представляется структурной формулой (I), в которой n равно трем, М представляет собой -C(OH)R2, R2 является фенильной группой или галоидфенильной группой (например, 4-хлорфенил) и Z представлено структурной формулой (VI), в которой X1 является группой -CH2-О-. В одном примере этого варианта воплощения R40 может представлять собой -O-(замещенную алифатическую группу), такую как В особенно предпочтительных вариантах изобретения R40 представляет собой В других предпочтительных вариантах воплощения, R40 является замещенной алифатической группой, замещенной ароматической группой, -О-замещенной алифатической группой или -О-замещенной ароматической группой. Предпочтительно, алифатический или ароматический фрагмент замещенной алифатической группы, замещенной ароматической группы, -О-замещенной алифатической группы или-О-замещенной ароматической группы имеет заместитель, выбранный из группы, состоящей из -ОН,-COOR, -Q-алифатической группы или замещенной Q-ароматической группы, причем группа Q такая,как описано в заявке. Предпочтительно Q является группой -С(O)O-. Например, R40 может быть линейной, разветвленной или циклической алифатической группой, которая содержит от 1 до 6 атомов углерода, такой как C1-C6-алкильная группа, C2-C6-алкенил, C2-C6-алкинил, которая замещена группой -ОН,-СООН, -С(O)O-(C1-C6-алифатической) или -С(O)O-(ароматической) группой. В другом варианте изобретения антагонист активности хемокина может быть представлен соединением структурной формулы (VII) и его физиологически приемлемыми солями,n - как описано в структурной формуле (I), Z - как описано ранее, предпочтительно как описано в структурной формуле (V) или (VI),группа М представляет собой NR2, CR1R2, -O-CR1R2-O- или -CH2-CR1R2-O-,радикалы R1 и R2 являются такими, как описано в структурной формуле (I),q1 является целым числом от нуля до приблизительно 3, и q2 является целым числом от нуля до единицы. Кольцо, содержащее М, может быть замещенным или незамещенным. Таким образом, антагонист действия рецептора хемокина может быть представлен, например,структурными формулами (VIIa)-(VIIk) и их физиологически приемлемыми солями, в которых Z, n и М являются такими, как описано в структурной формуле (VII), и кольцо, содержащее М, является замещенным или незамещенным. Кольцо,содержащее группу М, может иметь один или несколько подходящих заместителей, которые являются одинаковыми или различными. Подходящие заместители для кольца, которое содержит группу М, и дру-8 008060 гих неароматических гетероциклических колец являются такими как описано выше. Например, кольцо,содержащее группу М, может быть замещено метилом, этилом, пропилом, бутилом или оксогруппой. Когда кольцо, содержащее группу М, является замещенным, соединение может быть представлено структурной формулой (VIII) или его физиологически приемлемой солью. Заместители R70, R71, R72, R73, R74, R75, R76 и R77 представляют собой независимо атом водорода,-ОН, -N3, атом галогена, алифатическую группу, замещенную алифатическую группу, аминоалкильную группу, -O-(алифатическую группу), -O-(замещенную алифатическую группу), -SH, -S-(алифатическую группу), -S-(замещенную алифатическую группу), -ОС(O)-(алифатическую группу), -ОС(О)(замещенную алифатическую группу), -C(O)O-(алифатическую группу), -С(O)O-(замещенную алифатическую группу), -COOH, -CN, -CO-NR3R4, -NR3R4, ацильную группу, замещенную ацильную группу,бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу, замещенную неароматическую гетероциклическую группу, -(О)-(замещенную или незамещенную ароматическую группу), или любые два заместителя из R70, R71, R72, R73, R74, R75, R76 и R77, взятые вместе с атомами, с которыми они связаны, образуют 3-8-членное кольцо. Число n является таким, как описано в структурной формуле (I). Группа Z является такой, как описано в изобретении, предпочтительно, как описано в структурной формуле (V) или (VI). Группа М является такой, как описано в структурной формуле (VII), предпочтительно М - это NR2 или CR1R2. В некоторых вариантах воплощения радикалы R74, R75, R76 и R77 представляют собой атом водорода. В других вариантах воплощения R74, R75, R76 и R77 представляют собой атом водорода и по меньшей мере один из R70, R71, R72 и R73 является алифатической группой или замещенной алифатической группой. Предпочтительными алифатическими группами при R70, R71, R72, R73, R74, R75, R76 и R77 являются С 1-С 6 алкилы, предпочтительными замещенными алифатическими группами являются C1-C6-алкилы, замещенные группами -ОН, -(O)u-(CH2)t-C(O)OR20 или -O-(алифатической группой), в которой t - целое число от 0 до 3, u равно нулю или единице и R20 является C1-C6-алкилом. В более конкретных вариантах воплощения соединение имеет формулу структурной формулы (VIII), в которой радикалы R70, R71, R72, R73, R74,R75, R76 и R77 являются атомами водорода и по меньшей мере один из R71 и R72 является метилом (-СН 3). В предпочтительном варианте воплощения антагонист хемокинного рецептора представлен структурной формулой (VIII), в которой n равно двум; группа М - это C(OH)R2; R2 является галоидфенильной группой (например, 4-хлорфенил); радикалы R72, R73, R74, R75, R76 и R77 являются атомами водорода,и R70 и R71 независимо являются C1-C6-алкилом или замещенным C1-C6-алкилом; или радикалы R72, R73,R74, R75, R76 и R77 являются атомами водорода и R72 и R73 независимо являются C1-C6-алкилом или замещенным C1-C6-алкилом; и группа Z представлена структурной формулой (VI), в которой X1 представляет собой -CH2O-. Когда R72 и R73 каждый является метилом, соединения этого предпочтительного варианта воплощения могут иметь формулу или применяются их физиологически приемлемые соли, в которых R2 является 4-галоидфенилом. Предпочтительно, R2 выбирают из группы, состоящей из 4-хлорфенила, 4-бромфенила и 4 фторфенила. Предпочтительные группы при R40 описаны в этом изобретении. Особенно предпочтительными группами при R40 являются алифатические группы (например, C1-C6-алкил) и замещенные алифатические группы. В особенно предпочтительном варианте воплощения соединение представляет собой (S)энантиомер соединения формулы (XII) и имеет структуру или его физиологически приемлемую соль, в которой R2 является 4-галоидфенилом. Особенно предпочтительные соединения изобретения имеют структуру формулы (XIII), в которой R2 является 4 хлорфенилом и R40 выбирают из группы, состоящей из В другом варианте воплощения соединение, представленное структурной формулой (VIIi) или его физиологически приемлемая соль, в которой n, R1 и R2 являются такими, как описано в структурной формуле (I), и группа Z такая, как описано в структурной формуле (V) или (VI). В некоторых вариантах воплощения группа Z представлена структурной формулой (VI), в которойX1 представляет собой -CH2-О-; n равно двум, R1 является атомом водорода и R2 - это -NR5R6. Предпочтительно, в этих вариантах воплощения соединения имеют структуру или их физиологически приемлемые соли, в которых R5 и R6 - такие, как описано в структурной формуле (I), и предпочтительные группы R40 - такие, как описано в изобретении. В конкретных вариантах воплощения R5 является алифатической группой (например, C1-C6 алкилом) или замещенной алифатической группой, и R6 является бензилом или замещенным бензилом; или R5 и R6, взятые вместе с атомами, с которыми они связаны, образуют замещенное или незамещенное неароматическое карбоциклическое или гетероциклическое кольцо. В более конкретных вариантах воплощения R5 является C1-C6-алкилом и R6 является галоидзамещенным бензилом. В предпочтительном варианте воплощения R5 является этилом и R6 является хлорзамещенным бензилом (например, 4 хлорбензилом). Атом азота в кольце, которое содержит группу М, может быть третичным атомом азота, как изображено в структурной формуле (IV), или атом азота может быть кватернизован подходящим заместителем, таким как замещенной или незамещенной алифатической группой, имеющей приблизительно от 1 до 6 атомов углерода или приблизительно от 1 до 3 атомов углерода. Соединения, которые содержат атом азота, также могут содержать противоанион, такой как хлорид, бромид, иодид, ацетат, перхлорат и т.п. Антагонист действия рецептора хемокина может быть представлен структурной формулой (VII), в которой гетероциклическое кольцо, содержащее группу М, замещено подходящей двухвалентной группой, которая связана с двумя атомами, находящимися в кольце, в результате чего образуется бициклическая функциональная группа. Подходящие двухвалентные группы включают, например, замещенные или незамещенные двухвалентные алифатические группы, такие как C1-C6 алкиленовые группы. Антагонист действия рецептора хемокина может содержать разнообразные бициклические функциональные группы. В одном варианте воплощения этот антагонист действия рецептора хемокина может быть представлен структурной формулой (VIII) и его физиологически приемлемыми солями. Группа М представляет собой NR2, CR1R2, -O-CR1R2O- или -CH2-CR1R2-O-. Предпочтительно М представляет собой группу NR2 или CR1R2. Заместители R1 и R2 являются такими, как описано в структурной формуле (I), a n и Z - такие, как описано в структурной формуле (VII). В другом варианте воплощения антагонист действия рецептора хемокина представляется структурной формулой (IX) и его физиологически приемлемыми солями. Группа Z является такой, как описано выше, предпочтительно как описано в структурной формулеn является целым числом от 1 до приблизительно 4. Предпочтительно, n равно 1, 2 или 3. Более предпочтительно, n равно 2. В других вариантах воплощения вместо (CH2)n могут использоваться другие алифатические или ароматические пространственные группы (L). Каждый из заместителей R50 и R51 независимо представляет собой -Н, алифатическую группу, замещенную алифатическую группу, аминоалкильную группу, -NR3R4, ароматическую группу, замещенную ароматическую группу, бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу, замещенную неароматическую гетероциклическую группу или ковалентную связь между атомом азота и соседним атомом углерода. Заместители R3 и R4 независимо представляют собой -Н, ацильную группу, замещенную ацильную группу, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу, бензильную группу, замещенную бензильную группу, неароматическую гетероциклическую группу или замещенную неароматическую гетероциклическую группу. Заместители R3 и R4, взятые вместе с атомом, к которому они присоединены, альтернативно могут образовать замещенное или незамещенное неароматическое карбоциклическое или гетероциклическое кольцо. В предпочтительном варианте воплощения R50 представляет собой замещенную алифатическую группу, такую как замещенную алкильную группу от C1 до приблизительно C12, и R51 представляет собой-Н или замещенную или незамещенную алифатическую группу. Более предпочтительно, R50 представляет собой замещенную линейную или разветвленную алифатическую группу от C2 до приблизительно С 7,в которой один или несколько атомов углерода могут быть заменены гетероатомом, таким как азот, кислород или сера, и R51 представляет собой -Н или линейную или разветвленную алифатическую группу от C1 до приблизительно C6 или алифатическую группу, имеющую приблизительно от 1 до 3 атомов углерода, в которой один или несколько атомов углерода могут быть заменены гетероатомом. РадикалыR50 и R51 могут быть замещены одним или несколькими подходящими заместителями, которые приведены в описании. Предпочтительной является ароматическая группа (например, фенил, 4-галоидфенил). Например, R50 может быть выбран из группы, состоящей из На активность антагонистов действия рецептора хемокина, представленных структурной формулой(IX), может влиять природа атома азота, к которому присоединены радикалы R50 и R51. Полагают, что соединения, в которых указанный атом азота является основным, могут обладать сильной активностью антагонистов действия рецептора хемокина. Известно, что основность атома азота может быть ослаблена, когда этот атом азота связан с карбонильной группой, сульфонильной группой или сульфинильной группой. Поэтому предпочтительно, чтобы ни R50, ни R51 не содержали карбонильную группу, сульфонильную группу или сульфинильную группу, которая непосредственно связана с атомом азота. С другой стороны, антагонист действия рецептора хемокина представляется структурной формулой и его физиологически приемлемыми солями. Группа Z является циклоалкилом или группой неароматического гетероциклического кольца, конденсированного с одним, двумя или несколькими ароматическими кольцами, в которых каждое кольцо вZ является независимо замещенным или незамещенным. Предпочтительно, Z является таким, как описано в структурной формуле (VI).n является целым числом от 1 до приблизительно 4. Предпочтительно, n равно 1, 2 или 3. Более предпочтительно n равно 2. В других вариантах воплощения вместо (CH2)n могут использоваться другие алифатические или ароматические пространственные группы (L). Группа М представляет собой NR2 или CR2. Заместитель R2 является -Н, -ОН, ацильной группой, замещенной ацильной группой, -NR5R6, алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, бензильной группой, замещенной бензильной группой, неароматической гетероциклической группой, замещенной неароматической гетероциклической группой, -O-(замещенной или незамещенной ароматической группой) или -O-(замещенной или незамещенной алифатической группой). Предпочтительно, R2 является ароматической группой или замещенной ароматической группой. Заместители R5 и R6 независимо являются -Н, ацильной группой, замещенной ацильной группой,алифатической группой, замещенной алифатической группой, ароматической группой, замещенной ароматической группой, бензильной группой, замещенной бензильной группой, неароматической гетероциклической группой или замещенной неароматической гетероциклической группой. Заместители R5 и R6, взятые вместе с атомом, к которому они присоединены, альтернативно могут образовать замещенное или незамещенное неароматическое карбоциклическое или гетероциклическое кольцо. Группа X- представляет собой физиологически приемлемый анион. Предпочтительно, X- представляет собой Сl- или Br. Описанный в изобретении антагонист рецептора хемокина может быть получен и введен пациенту в виде активных соединений или в виде пролекарств. Обычно пролекарства представляют собой аналоги фармацевтических агентов, которые могут претерпевать химическое превращение в результате метаболических процессов, для того чтобы приобрести полную активность. Например, пролекарство может быть получено за счет соответствующих групп для R40. В одном варианте воплощения пролекарство может быть представлено структурной формулой (XI) в которой R40 представляет собой Q-замещенную алифатическую группу, а алифатическая группа замещена группой -(O)u-(CH2)t-C(O)OR20, в которой Q представляет собой -C(O)O-, u равно единице, t равно нулю и R20 является циклической алифатической группой. Например, когда замещенная алифатическая группа представляет собой замещенную этильную группу, R40 может быть представлен формулой Такое пролекарство может быть превращено в активный антагонист рецептора хемокина, представленный структурной формулой (XI), в которой R40 является группой -СООН. Другой вариант воплощения настоящего изобретения включает новые соединения, которые используются в этих способах. Описанные в этом изобретении соединения могут быть получены в виде изомеров с Е- и Zконфигурацией. Необходимо отметить, что данное изобретение включает соединения с Е-конфигурацией и Z-конфигурацией вокруг двойной связи, соединяющей кольцо С группы Z с остальной частью молекулы, и способ лечения субъекта соединениями с Е-конфигурацией, Z-конфигурацией и их смесями. В соответствии с этим, в представленных в этом изобретении структурных формулах используется символ, чтобы представить как Е-конфигурацию, так и Z-конфигурацию. Предпочтительно, кольцо А и алкиленовая цепочка, связанная с кольцом С, находятся в цис-конфигурации. Например, соединения могут иметь конфигурацию Понятно, что соединения в одной конфигурации могут иметь бльшую активность, чем в другой конфигурации. Желаемая конфигурация может быть определена в результате скрининга соединений на активность с использованием описанных здесь методов. Кроме того, определенные соединения, согласно данному изобретению, могут быть получены в виде различных стереоизомеров (например, диастереоизомеров и энантиомеров). Соединения этого изобретения могут быть получены в виде рацематов или в виде практически чистых стереоизомеров. Стереоизомеры изобретения (например, (S)- и (R)-энантиомеры) могут быть получены с использованием любого подходящего способа. Например, энантиомеры могут быть расщеплены из рацемической смеси при использовании хиральной хроматографии или перекристаллизации. Предпочтительно, стереоизомеры(например, (S)- и/или (R)-энантиомеры) получают, используя стереоспецифический синтез, который описан в изобретении. Оптическая конфигурация стереоизомеров изобретения устанавливается по (R), (S)-методу CahnIngold-Prelog (см. книгу J. March, "Advanced Organic Chemistry," 4th Edn., Wiley Interscience, N.Y., pp. 109111 (1992. Данное изобретение включает все изомерные формы и рацемические смеси раскрытых соединений и способ лечения субъекта как чистыми изомерами, так и их смесями, включая рацемические смеси. Стереоизомеры могут быть разделены и выделены при использовании любого подходящего метода, такого как хроматография. И в этом случае подразумевается, что один стереоизомер может быть более активным, чем другой. Целевой изомер может быть установлен в результате скрининга. В настоящее изобретение также включены физиологически приемлемые соли соединений, представленных структурными формулами от (I) до (XI). Соли соединений, содержащих аминную или другую основную группу, могут быть получены, например, путем взаимодействия с соответствующими органическими или неорганическими кислотами, такими как хлористый водород, бромистый водород, уксусная кислота, лимонная кислота, перхлорная кислота и аналогичными кислотами. Соединения с четвертичной аммониевой группой также содержат противоанион, такой как хлорид, бромид, иодид, ацетат,перхлорат и т.п. Соли соединений, содержащих группу карбоновой кислоты или другую кислотную функциональную группу, могут быть получены путем взаимодействия с соответствующим основанием,например гидроксидным основанием. Соли кислотных функциональных групп содержат противокатион,такой как натрий, калий, аммоний, кальций и т.п. (см., например, статью Berge S.M. et al., "PharmaceuticalSalts", J. Pharma. Sci., 66: 1(1977. Используемые здесь алифатические группы включают углеводороды с прямой или разветвленной цепочкой или циклические углеводороды С 1-С 20, которые являются полностью насыщенными или которые содержат одну или несколько ненасыщенных связей. Предпочтительными алифатическими группами являются углеводородные группы приблизительно от С 1 до С 10. Более предпочтительными являются углеводородные группы приблизительно от C1 до С 6 или от C1 до С 3. Один или несколько атомов углерода в алифатической группе могут быть заменены гетероатомом, таким как азот, кислород или сера. Например, подходящие алифатические группы включают замещенные или незамещенные линейные, разветвленные или циклические алкильные, алкенильные или алкинильные группы.- 13008060 Аминоалкильная группа представляет собой алкильную группу, замещенную группой -NR24R25, гдеR и R25 такие, как описано выше. Предпочтительно, алкильный фрагмент содержит от одного до приблизительно двенадцати, более предпочтительно от 1 до приблизительно 6 атомов углерода. Алкильный фрагмент аминоалкильной группы может быть незамещенным или замещенным, как описано выше для алифатических групп. Примеры подходящих аминоалкильных групп включают аминометил, 2 аминоэтил, 3-аминопропил, 4-аминобутил, диметиламиноэтил, диэтиламинометил, метиламиногексил,аминоэтиленил и им подобные. Ароматические группы включают карбоциклические ароматические группы, такие как фенил, 1 нафтил, 2-нафтил, 1-антрацил и 2-антрацил, и гетероциклические ароматические или гетероарильные группы, такие как N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 2-тиенил, 3-тиенил, 2 фуранил, 3-фуранил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4 пиримидил, 5-пиримидил, 3-пиридазинил, 4-пиридазинил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2 пиразинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 5-тетразолил, 2-оксазолил, 4-оксазолил и 5-оксазолил. В тех случаях, когда эти кольца конденсированы, например, с кольцом С, оговоренным местом присоединения может быть любая из двух конденсированных связей. Ароматические группы также включают конденсированные полициклические ароматические кольчатые системы, в которых карбоциклическое ароматическое кольцо или гетероарильное кольцо конденсировано с одним или несколькими другими кольцами. Примеры включают тетрагидронафтил, 2 бензотиенил, 3-бензотиенил, 2-бензофуранил, 3-бензофуранил, 2-индолил, 3-индолил, 2-хинолинил, 3 хинолинил, 2-бензотиазолил, 2-бензооксазолил, 2-бензимидазолил, 2-хинолинил, 3-хинолинил, 1 изохинолинил, 3-хинолинил, 1-изоиндолил, 3-изоиндолил, акридинил, 3-бензизоксазолил и т.п. В объем термина "ароматическая группа", который используется в данном изобретении, также входит группа, в которой одно или несколько карбоциклических ароматических колец и/или гетероарильных колец конденсированы с циклоалкильным или неароматическим гетероциклическим кольцом, например бензоциклопентаном, бензоциклогексаном. Неароматические гетероциклические кольца представляют собой неароматические карбоциклические кольца, которые включают один или несколько гетероатомов, таких как азот, кислород или сера в кольце. Это кольцо может быть 5-, 6-, 7- или 8-членным и/или конденсированным с другим кольцом, таким как циклоалкильное или ароматическое кольцо. Примеры включают 1,3-диоксолан-2-ил, 3-1 Нбензимидазол-2-он, 3-1-алкилбензимидазол-2-он, 3-1-метилбензимидазол-2-он, 2-тетрагидрофуранил, 3 тетрагидрофуранил, 2-тетрагидротиофенил, 3-тетрагидротио-фенил, 2-морфолино, 3-морфолино, 4 морфолино, 2-тиоморфолино, 3-тиоморфолино, 4-тиоморфолино, 1-пирролидинил, 2-пирролидинил, 3 пирролидинил, 1-пиперазинил, 2-пиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4 пиперидинил, 4-тиазолидинил, диазолонил, N-замещенный диазолонил, 1-фталимидил, 1-3-алкилфталимидил, бензоксан, бензопиролидин, бензопиперидин, бензоксолан, бензотиолан, бензотиан, тетрагидрофуран-2-он-3-ил, 2,5-дигидро-5-оксо-4 Н-1,2,4-тиадиазол-3-ил, 2-оксо-3 Н-1,2,3,5-оксатиадиазол-4 ил,24 Подходящие заместители при алифатической группе, ароматической группе (карбоциклической и гетероарильной), неароматическом гетероциклическом кольце или бензильной группе включают, например, электроноакцепторную группу, галоген (хлорид, бромид, фторид, иодид), группы азидо-, -CN,-СООН, -ОН, -CONR24R25, NR24R25, OS(O)2NR24R25, S(O)2NR24R25, -SO3H, -S(O)2NH2, гуанидино-, -(O)u(CH2)t-C(O)OR20, -(O)u-(CH2)tOC(O)R20, -(O)u-(CH2)t-C(O)NR21R22, -(O)u-(CH2)t-NHC(O)OR20, Q-H, -Q(алифатическая группа), -Q-(замещенная алифатическая группа), -Q-(арил), -Q-(ароматическая группа),-Q-(замещенная ароматическая группа), -Q-(CH2)p-(замещенная или незамещенная ароматическая группа) (р - целое число от 1 до 5), -Q-(неароматическая гетероциклическая группа) или -Q-(CH2)р(неароматическая гетероциклическая группа). Заместители R20, R21 или R22 независимо представляют собой атом водорода, алифатическую группу, замещенную алифатическую группу, ароматическую группу, замещенную ароматическую группу,неароматическую гетероциклическую группу, -NHC(O)-O-(алифатическую группу), -NHC(O)-O- 14008060(ароматическую группу), -NHC(O)-O-(неароматическую гетероциклическую группу), причем R21 и R22,взятые вместе с атомом азота, с которым они связаны, могут образовать неароматическое гетероциклическое кольцо. Радикал R60 является атомом водорода, группой -ОН, -NH2, ароматической группой или замещенной ароматической группой.t представляет собой целое число от нуля до приблизительно трех, а метиленовая группа -(СН 2)tможет быть замещенной, как описано здесь для алифатических групп, или незамещенной. Число u равно нулю или единице. Группа Q представляет собой -О-, -S-, -S(O)-, -S(O)2-, -OS(O)2 -, -С(О)-, -ОС(О)-, -C(O)O-,-C(O)C(O)-O-, -O-C(O)C(O)-, -C(O)NH-, -NHC(O)-,-OC(O)NH-, -NHC(O)O-, -NH-C(O)-NH-, -S(O)2NH-,-NHS(O)2-, -N(R23)-, -C(NR23)NHNH-, -NHNHC(NR23)-, -NR24C(O)- или -NR24S(O)2-. Радикал R23 представляет собой атом водорода, алифатическую группу, бензильную группу, арильную группу или неароматическую гетероциклическую группу. Радикалы R24 и R25 независимо являются атомом водорода, группой -ОН, алифатической группой,замещенной алифатической группой, бензильной группой, арильной группой, неароматической гетероциклической группой или R24 и R25, взятые вместе с атомом азота, с которым они связаны, могут образовать замещенное или незамещенное неароматическое гетероциклическое кольцо. Замещенное неароматическое гетероциклическое кольцо, бензильная группа или ароматическая группа также могут иметь в качестве заместителя ароматическую группу, алифатическую или замещенную алифатическую группу. Когда неароматическое кольцо (карбоциклическое или гетероциклическое) или ароматическое кольцо (карбоциклическое ароматическое или гетероарильное) замещено другим кольцом, эти два кольца могут быть конденсированными. Замещенная алифатическая группа также может иметь в качестве заместителя оксогруппу, элоксигруппу, неароматическое гетероциклическое кольцо, бензильную группу, замещенную бензильную группу, ароматическую группу или замещенную ароматическую группу. Кроме того, замещенное неароматическое гетероциклическое кольцо может иметь в качестве заместителя группу =O, =S, =NH или =N(алифатическую, ароматическую или замещенную ароматическую группу). Замещенная алифатическая группа, замещенное ароматическое, замещенное неароматическое гетероциклическое кольцо или замещенная бензильная группа могут иметь больше одного заместителя, которые могут быть одинаковыми или различными. Ацильные группы включают замещенный и незамещенный алифатический карбонил, ароматический карбонил, алифатический сульфонил и ароматический сульфонил. Подходящие электронноакцепторные группы включают, например, алкилимины, алкилсульфонил,карбоксамидо-, карбоксильные алкиловые сложные эфиры, группы -CH=NH, -CN, -NO2 и атомы галогенов. В структурных формулах данного изобретения простая или двойная связь, посредством которой химическая группа или функциональная группа соединяется с остальной частью молекулы или соединения, обозначена следующим символом: Например, соответствующий символ в структурных формулах (II), (III) и (IV) обозначает двойную связь, посредством которой центральное кольцо трициклической кольчатой системы соединяется с остальной частью молекулы, представленной структурной формулой (I). Предпочтительно, субъектом является птица или млекопитающее, такое как человек, но это также может быть животное, нуждающееся в ветеринарном лечении, например домашние животные (например,собаки, кошки и т.п.), сельскохозяйственные животные (например, коровы, овцы, домашняя птица, свиньи, лошади и т.п.) и лабораторные животные (например, крысы, мыши, морские свинки и т.п.). Эффективным количеством соединения является такое количество, которое приводит к ингибированию одного или нескольких процессов, которые передаются путем связывания хемокина с рецептором в организме субъекта, пораженного заболеванием, связанным с нарушенным восстановлением и/или активацией лейкоцитов. Примеры таких процессов включают миграцию лейкоцитов, активацию интегрина,переходный процесс роста концентрации внутриклеточного свободного кальция [Са 2+]i, и гранулярное выделение медиаторов, предшествующих воспалению. Альтернативно, эффективное количество соединения представляет собой количество, которое достаточно для достижения целевого терапевтического и/или профилактического эффекта, т.е. такое количество, которое приводит к предупреждению или ослаблению симптомов, сопутствующих заболеванию, связанному с нарушенным восстановлением и/или активацией лейкоцитов. Количество соединения, назначаемого пациенту, будет зависеть от типа и степени серьезности заболевания, и от таких характеристик пациента, как общее состояние здоровья, возраст, пол, вес тела и переносимость лекарственных препаратов. Кроме того, оно будет зависеть от степени серьезности и вида заболевания. Квалифицированный специалист в этой области сможет определить соответствующие дозировки, в зависимости от указанных выше и других факторов. Обычно, для взрослого пациента эффективное количество соединения может изменяться приблизительно от 0,1 мг в сутки до приблизительно 100 мг в сутки. Предпочтительно, дозировка изменяется приблизительно от 1 мг в сутки до приблизительно 100 мг в сутки. Кроме того, антагонист действия рецептора хемокина может назначаться в соче- 15008060 тании с одним или несколькими дополнительными терапевтическими средствами, например теофиллином, бета-адренергическими бронхолитическими средствами, кортикостероидами, антигистаминами,противоаллергическими средствами, средствами, подавляющими иммунитет (например, циклоспорин A,FK-506, преднизон, метилпреднизолон), гормонами (например, адренокортикотропный гормон (АСТН,цитакинами (например, интерфероны (например, IFN-1a, IFN-1b и т.п. Можно назначать любой подходящий способ прима соединения, включая, например, пероральный прим в капсулах, суспензиях или таблетках или парэнтеральное введение. Парэнтеральное введение может включать, например, системное введение, такое как внутримышечная, внутривенная, подкожная или внутрибрюшинная инъекция. Кроме того, соединение можно вводить перорально (например, с пищей), через кожу, локально, посредством ингаляции (например, внутрь бронхов, внутрь носа, в полость рта или капли в нос) или ректально, в зависимости от вида заболевания или состояния, подлежащего лечению. Пероральное или парэнтеральное введение являются предпочтительными способами назначения. Соединение может быть назначено пациенту в сочетании с фармацевтически или физиологически приемлемым носителем, как часть фармацевтической композиции для лечения ВИЧ-инфекции, воспалительного заболевания или других заболеваний, рассмотренных выше. Форма использования назначенного соединения может изменяться в соответствии с выбранным способом его введения (например, раствор, эмульсия, капсула). Подходящие носители могут содержать инертные компоненты, которые не взаимодействуют с соединением. Могут применяться обычные технологии приготовления лекарственных препаратов, такие, что описаны в справочнике Remington's Pharmaceutical Sciences, Mack PublishingCompany, г. Истон, шт. Пенсильвания. Подходящие для парэнтерального введения носители включают,например, стерильную воду, физиологический раствор, бактериостатический физиологический раствор(физиологический раствор, содержащий приблизительно 0,9% бензилового спирта), физиологический раствор с фосфатным буфером, раствор Хэнка, лактат Рингера и т.п. Из уровня техники (см. книгу Baker и др. "Регулируемое выделение биологически активных агентов - Controlled Release of Biological ActiveAgents", J. WileySons, 1986) известны способы инкапсуляции композиций (такие как покрытие твердым желатином или циклодекстраном). Количество активного ингредиента (одно или несколько соединений изобретения) в композиции может изменяться приблизительно от 0,1 до 99,9 мас.%. Предпочтительно количество активного ингредиента составляет приблизительно от 10 до 90% или приблизительно от 20 до 80 мас.%. Стандартная упаковка препарата может содержать от 1 мг до приблизительно 1000 мг активного ингредиента, предпочтительно приблизительно от 10 до 100 мг активного ингредиента. Кроме того, по желанию, композиция может содержать другие совместимые терапевтические агенты, такие как теофиллин, бетаадренергические бронхолитические средства, кортикостероиды, антигистамины, противоаллергические средства, средства, подавляющие иммунитет (например, циклоспорин A, FK-506, преднизон, метилпреднизолон), гормоны (например, адренокортикотропный гормон (АСТН, цитокины (например, интерфероны (например, IFN-la, IFN-1b и т.п. В одном варианте воплощения фармацевтическая композиция содержит (S)-энантиомер соединения изобретения (например, соединение структурной формулы (XIII и физиологически приемлемый носитель или среду для лекарства. Например, в одном варианте воплощения композиция содержит (S)-4-(4 хлорфенил)-1-3-[7-(1-гидрокси-1-метилэтил)-11 Н-10-окса-1-аза-дибензо[а,d]циклопентен-5-илиден]пропил-3,3-диметилпиперидин-4-ол и физиологически приемлемый носитель или среду для лекарства. В некоторых вариантах воплощения фармацевтическая композиция содержит (S)-энантиомер соединения изобретения (например, соединение структурной формулы (ХIII и практически не содержит соответствующий (R)-энантиомер (содержание (S)-энантиомера составляет, по меньшей мере, приблизительно 98% или, по меньшей мере, приблизительно 99% и более). В другом варианте воплощения композиция содержит (S)-энантиомер соединения изобретения (например, соединение структурной формулы (XII,соответствующий (R)-энантиомер и физиологически приемлемый носитель или среду для лекарства. В более конкретном варианте воплощения композиция содержит рацемическое соединение структурной формулы (XII), например рацемический 4-(4-хлорфенил)-1-3-[7-(1-гидрокси-1-метилэтил)-11 Н-10-окса 1-аза-дибензо[а,d]циклопентен-5-илиден]-пропил-3,3-диметилпиперидин-4-ол. В других вариантах воплощения отношение (S)-энантиомера к (R)-энантиомеру (по массе) в композиции составляет, по меньшей мере, приблизительно 2:1, или приблизительно 5:1, или приблизительно 10:1, или приблизительно 20:1, или приблизительно 50:1. Активность соединений настоящего изобретения можно оценить, используя подходящие испытания, такие как испытания связывания рецептора и испытания хемотаксиса. Например, как описано в разделе примеров, небольшие молекулы антагонистов связывания RANTES и MIP-1 были идентифицированы с использованием клеток ТНР-1, которые связывают RANTES и хемотакс в ответ на RANTES иMIP-1, в качестве модели хемотаксиса лейкоцитов. Конкретно, был использован высокопроизводительный анализ связывания рецептора, в котором прослеживается связывание меченых изотопом иода-125,125I-RANTES и 125I-MIP-1 с клеточными мембранами ТНР-1, для того чтобы идентифицировать небольшие молекулы антагонистов, которые блокируют связывание RANTES и MIP-1. Кроме того, со- 16008060 единения настоящего изобретения могут быть идентифицированы благодаря их способности ингибировать стадии активации, которые запускаются посредством связывания хемокина с его рецептором, такие как хемотаксис, активация интегрина и гранулярное выделение медиатора. Они также могут быть идентифицированы благодаря их способности блокировать HL-60, передаваемый RANTES и MIP-1, Тклетки, моноядерные клетки периферической крови и хемотактическую ответную реакцию эозинофила. Соединения, раскрытые в этом изобретении, могут быть получены в соответствии со схемами, приведенными на фиг. 1-5 и 7. Эти схемы более подробно описаны ниже. На фиг. 1 показана схема получения соединений, представленных структурной формулой (I). Группа L1 представляет собой PPh3Cl, PPh3Br, PPh3I (PPh3 - трифенилфосфин) или диэтоксифосфиноксогруппу, (EtO)2P(O), L2 является подходящей отщепляемой группой, такой как галоидная группа, паратолуолсульфонат, мезилат, алкокси- и феноксигруппа; Pg является подходящей защитной группой, такой как тетрагидропиранил; и прочие символы являются такими, как определено выше. На стадии 1 фиг. 1, реакцию Виттига проводят в растворителе, таком как простой эфир или тетрагидрофуран (ТГФ), в присутствии основания, такого как гидрид натрия, н-бутиллитий или диизопропиламид лития (LDA), при температуре от 0 С до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. Соединения, представленные формулой (II) на фиг. 1, могут быть получены методами,раскрытыми в патенте Японии JP 61/152673, патенте США 5089496, заявках WO 89/10369, WO 92/20681 и WO 93/02081, все отличительные признаки которых включены в настоящую заявку путем ссылки. На стадии 2 фиг. 1 удаляют защитную группу под действием кислоты в растворителе, таком как метанол, при температуре от комнатной до температуры кипения используемого растворителя, в течение от 5 мин до 72 ч. Альтернативно, соединение, представленное формулой (V) на фиг. 1, может быть получено непосредственно на стадии 1, без выделения промежуточного соединения. Реакционная смесь, полученная после завершения реакции, описанной на стадии 1, может быть растворена в растворителе и обработана кислотой. На стадии 3 фиг. 1 гидроксильную группу можно превратить в отщепляемую группу известными методами. Соединения, представленные формулой (VI) на фиг. 1, могут быть получены способами, описанными в журнале J. Med. Chem., 1992 (35), 2074-2084 и в патенте Японии JP 61/152673. На стадии 4 фиг. 1 реакцию алкилирования проводят в растворителе, таком как ацетон, метилэтилкетон, этилацетат, толуол, тетрагидрофуран (ТГФ) или диметилформамид (ДМФ), в присутствии основания, такого как карбонат калия или гидрид натрия, и катализатора, такого как иодид щелочного металла, при температуре от комнатной до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. На фиг. 2 показана схема получения соединений, представленных формулой (VI-b). На стадии 1 фиг. 2 реакция Гриньяра может быть осуществлена в растворителе, таком как простой эфир или тетрагидрофуран (ТГФ), при температуре от 0 С до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. Соединение (VII) является коммерчески доступным. На стадии 2 фиг. 2 бромирование может быть проведено такими бромирующими агентами, как бромистоводородная кислота, бромтриметилсилан или комплекс трибромид бораметилсульфид, в растворителе, таком как уксусная кислота, дихлорметан или дихлорэтан, при температуре от комнатной до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. На фиг. 3 показана схема получения соединений, представленных структурной формулой (I). Как видно из фиг. 3, восстановительное аминирование может быть осуществлено с такими восстанавливающими агентами, как цианоборгидрид натрия, ацетоксиборгидрид натрия или боргидрид натрия, в растворителе, таком как метанол, этанол, тетрагидрофуран (ТГФ), дихлорметан или дихлорэтан, при температуре от комнатной до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. На фиг. 4 показана схема получения соединений, представленных структурной формулой (I), в которой группа Z представлена структурной формулой (III) и в которой кольцо А и/или кольцо В в Z замещено радикалом R40. Как видно из фиг. 4, реакция алкилирования может быть проведена в растворителе,таком как ацетон, метилэтилкетон, этилацетат, толуол, тетрагидрофуран (ТГФ) или диметилформамид(ДМФ), в присутствии основания, такого как карбонат калия или гидрид натрия, и катализатора, такого как иодид щелочного металла, при температуре от комнатной до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. На фиг. 5 показана схема получения соединений, представленных структурной формулой (I), в которой группа Z представлена структурной формулой (III) и в которой кольцо А и/или кольцо В в Z замещено группой -(O)u-(CH2)t-COOR20, -(O)u-(CH2)t-OC(O)R20, -(O)u-(CH2)t-C(O)NR21R22 или -(O)u-(CH2)tNHC(O)O-R20. Согласно фиг. 5 реакция гидролиза может быть проведена в смеси водного раствора гидроксида щелочного металла и растворителя, такого как метанол, этанол, тетрагидрофуран (ТГФ) или диоксан, при температуре от комнатной до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. Реакция ацилирования может быть проведена с использованием дициклогексилкарбодиимида(DCC) или (1-этил-3-(3-диметиламинопропил)карбодиимида (DEC), в растворителе, таком как тетрагидрофуран (ТГФ), диметилформамид (ДМФ) или хлористый метилен, в присутствии основания, такого как пиридин или триэтиламин (в случае необходимости) при температуре от 0 до 100 С, в течение от 5 мин- 17008060 до 72 ч. На фиг. 7 показана схема получения соединений, представленных структурной формулой (I), в которой группа Z представлена структурной формулой (III) и в которой кольцо А и/или кольцо В в Z замещено радикалом R40. Группа L4 является подходящей отщепляемой группой, такой как галоид или трифторметилсульфонат. Согласно фиг. 7 реакция спаривания под действием палладия, такая как спаривание Стилле, спаривание Сузуки, реакция Хека, или карбоксилирование с использованием монооксида углерода, может быть проведена с применением палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий, бис(трифенилфосфин)палладий хлорид и ацетат палладия, в растворителе, таком как тетрагидрофуран (ТГФ), 1,4-диоксан, толуол, диметилформамид (ДМФ) или диметилсульфоксид (ДМСО), в присутствии добавки (в случае необходимости), такой как трифенилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, триэтиламин, бикарбонат натрия, хлористый тетраэтиламмоний или хлористый литий, при температуре от комнатной до точки кипения используемого растворителя, в течение от 5 мин до 72 ч. На фиг. 10 С показаны три методики получения соединений, представленных структурными формулами (I), (VII), (VIII) и (IX), в которых группа Z представлена структурной формулой (III) и в которой кольцо А или кольцо В в Z замещено радикалом R40. На фиг. 10 С, радикал R40 представлен группой -(O)u(CH2)t-C(O)-NR21R22, u равно единице, t равно нулю. В соответствии с фиг. 10 С соединение, содержащее фенол, может вступить в реакцию с эквивалентом карбоната, таким как карбамоилхлорид (способ А), изоцианат (способ В) или ацилимидазол (способ С), в присутствии основания, такого как гидроксид натрия, карбонат калия или карбонат натрия, в растворителе, таком как диметилформамид или тетрагидрофуран, при температуре от 0 С до точки кипения используемого растворителя, приблизительно в течение от 5 мин до 72 ч. Соединения, представленные структурной формулой (I), в которой группа Z представлена структурными формулами (III) или (IV), X представляет собой группу -CO-NRc- и Rc является группой -(CH2)sCOOR30, -(CH2)s-C(O)NR31R32 или -(CH2)s-NHC(O)O-R30, могут быть получены в результате подходящей модификации схемы, приведенной на фиг. 1-5 и 7. В одной модификации используют исходный материал, показанный на фиг. 1, в которой X представляет собой -CO-NH-. Затем амид алкилируют реагентомL3-(CH2)s-COOR30, в котором L3 является подходящей отщепляемой группой, используя описанные выше методики алкилирования. Остальную часть синтеза проводят, как описано на фиг. 1-5 и 7. На фиг. 12 показано получение соединений формулы (VI-c). Реакция ацилирования по ФриделюКрафтсу может быть проведена с использованием хлорангидрида кислоты, в присутствии кислоты Льюиса, такой как треххлористый алюминий или четыреххлористый титан, в растворителе, таком как дихлорметан, дихлорэтан, нитробензол или дисульфид углерода. Реакция ацилирования может быть проведена при температуре приблизительно от комнатной до точки кипения выбранного растворителя, в течение периода приблизительно от 5 мин до 72 ч. На фиг. 13 показано получение соединений формулы (VIe). На стадии 1 фиг. 13 может быть осуществлена реакция хлорсульфонилирования с использованием хлорсульфоновой кислоты в растворителе,таком как дихлорметан, или в отсутствие растворителя, при температуре приблизительно от 0 до 60 С, в течение периода приблизительно в течение от 5 мин до 72 ч. На стадии 2 фиг. 12 реакцию спаривания можно осуществлять с использованием амина в присутствии основания, такого как триэтиламин, в растворителе таком как дихлорметан, ацетон, этанол, ТГФ или ДМФ. Реакция может быть проведена при температуре приблизительно от комнатной до точки кипения выбранного растворителя, в течение периода приблизительно от 5 мин до 72 ч. Хотя на фиг. 1-5, 7 и 13 показана схема получения соединений, в которых кольца А и В являются фенильными кольцами, аналогичные соединения с гетероарильными группами для колец А и В могут быть получены при использовании исходных материалов с гетероарильными группами в соответствующих положениях. Эти исходные материалы могут быть получены в соответствии с методами, раскрытыми в патенте Японии JP 61/152673, патенте США 5089496, заявках WO 89/10369, WO 92/20681 и WO 93/02081. Данное изобретение иллюстрируется следующими примерами, которые никоим образом не предназначены для его ограничения. Примеры Пример 1. 4-(4-Хлорфенил)-1-[3-(10,11-дигидро-5 Н-дибензо[а,d]циклогептен-5-илиден)пропил]пиперидин-4-ол. К раствору 200 мг 5-(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[а,d]циклогептена (описан в патенте Японии JP 48-030064) в 10 мл ДМФ добавляют 230 мг 4-(4-хлорфенил)-4-гидроксипиперидина, 360 мг карбоната калия и 50 мг иодида калия. Смесь перемешивают в течение 24 ч при 70 С. В реакционную смесь добавляют воду и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлористого натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (1:1) этилацетат/гексан,чтобы получить 250 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (CDCl3) : 1,65-2,11 (5 Н, м),- 18008060 2,32-3,10 (8 Н, м), 3,22-3,67 (4 Н, м), 5,87 (1H, т), 7,03-7,44 (12 Н, м). Масс-спектр (МС) m/z: 444 (M+1). м мультиплет, т - триплет, М - молекулярная масса. Пример 2. 4-(4-Хлорфенил)-1-[3-(6,11-дигидродибенз[b,е]оксепин-11-илиден)пропил]пиперидин-4 ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-6,11-дигидродибенз[b,е]оксепин. Спектр ЯМР 1 Н (CDCl3) : 1,61-2,16 (5 Н, м), 2,37-2,80 (8 Н, м), 5,22 (2 Н, ш.с.), 5,70(0,6x1 Н, т), 6,03 (0,4x1 Н, т), 6,73-6,90 (2 Н, м), 7,09-7,45 (10 Н, м). МС m/z: 446 (M+1). ш.с. - широкий синглет. Пример 3. Препараты мембран для связывания хемокина и анализ связывания. Мембраны готовят из клеток ТНР-1 (Коллекция культур американского типа АТССTIB202). Клетки собирают путем центрифугирования, дважды промывают физиологическим раствором с фосфатным буфером (PBS), и осадок клеток замораживают при температуре от -70 до -85 С. Замороженный осадок оттаивает в охлаждаемом льдом буферном растворе для лизиса, который содержит 5 ммоль/л (N2-гидрокси-этилпиперазин-N'-2-этансульфоновой кислоты (HEPES), значение рН 7,5, 2 ммоль/л этилендиаминтетрауксусной кислоты (ЭДТУК), и по 5 микрограмм(мкг)/мл каждого из ингибиторов протеазы апротинина, лейпептина и химостатина, и 100 мкг/мл фенилметансульфонилфторида (PMSF, также ингибитора протеазы) при концентрации от 10 до 50 млн клеток/мл. Такая обработка приводит к лизису клеток. Суспензию хорошо перемешивают, чтобы вновь суспендировать весь замороженный осадок клеток. Ядра и остатки клеток удаляют посредством центрифугирования при ускорении 400g в течение 10 мин при 4 С. Жидкость над осадком переносят в чистую пробирку и фрагменты мембран собирают центрифугированием при ускорении 25000g в течение 30 мин при 4 С. Жидкость над осадком отсасывают и осадок вновь суспендируют в охлаждаемом буферном растворе, содержащем 10 ммоль/л HEPES с рН 7,5,300 ммоль/л сахарозы, по 1 мкг/мл каждого - апротинина, лейпептина и химостатина и 10 мкг/мл PMSF(приблизительно 0,1 мл на каждые 100 млн клеток). Все агрегаты клеток пептизируют, используя минигомогенизатор, и определяют общую концентрацию белка, используя набор для анализа белков (Bio-Rad,фирма Hercules, шт. Калифорния,по каталогу 500-0002). Затем отбирают аликвоты мембранного раствора и замораживают их при температуре от -70 до -85 С, пока они не потребуются. При анализе связывания используют описанные выше мембраны. Белок мембраны (от 2 до 20 мкг суммарного белка мембраны) выдерживают с добавкой от 0,1 до 0,2 нмоль/л RANTES или MIP-l, меченых изотопом иода-125,в присутствии (или в отсутствие) немеченого конкурента (RANTES или MIP-l), или при различных концентрациях соединений. Реакцию связывания проводят в объеме от 60 до 100 мкл (микролитр) связывающего буферного раствора, содержащего 10 ммоль/л HEPES с рН 7,2, 1 ммоль/л CaCl2, 5 ммоль/лMgCl2 и 0,5% альбумина бычьей сыворотки (BSA) в течение 60 мин при комнатной температуре. Реакцию связывания прекращают, собирая мембраны путем быстрой фильтрации через фильтры со стекловолокном (GF/B или GF/C, фирма Packard), которое предварительно пропитывают 0,3% полиэтиленимина. Фильтры промывают приблизительно 600 мкл связывающего буфера, содержащего 0,5 моль/л хлористого натрия, сушат и определяют количество "связанной радиоактивности" посредством счета сцинцилляций в пластинчатом счетчике бета-излучения Topcount. Ниже в таблице приведены значения активности испытанных соединений в виде величин ИК 50 или концентрации ингибитора, которая требуется для 50%-ного ингибирования специфического связывания в испытании связывания рецептора с использованием в качестве лигандов I25I-RANTES или 125I-MIP-1 и клеточных мембран ТНР-1. Величина специфического связывания определяется по разности: общее связывание минус неспецифическое связывание; величина неспецифического связывания представляет собой число импульсов в минуту, которое еще определяется в присутствии избытка немеченого RANTES или I-MIP-1. Пример 8. 4-(4-Хлорфенил)-1-[3-(6,11-дигидродибенз[b,е]тиепин-11-илиден)пропил]пиперидин-4-ол. Стадия 1. 11-(3-Бромпропилиден)-6,11-дигидродибенз[b,е]тиепин получают, следуя методике примера 45,стадии 1 и 2, но заменяя 5,11-дигидро-7-метоксипиридо[2,3-с][1]бензоксепин-5-он на 6,11 дигидродибенз[b,е]тиепин-11-он.(8 Н, м). д - дублет. Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадии 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на продукт стадии 1. Спектр ЯМР 1 Н (CDCl3) : 1,65-1,80 (3 Н, м), 1,95-2,70 (10 Н, м), 3,35 (1 Н, д) 4,98 (1 Н, д), 5,96 (1 Н, т),7,09-7,43 (12 Н, м). МС m/z: 462(М+1). Пример 12. 1-[3-(5-Бензил)-(6,11-дигидро-6-оксо-5 Н-дибенз[b,е]азепин-11-илиден)пропил]-4-(4 хлорфенил)пиперидин-4-ол. К раствору 300 мг гидрохлорида 4-(4-хлорфенил)-1-[3-(6,11-дигидро-6-оксо-5 Н-дибенз[b,е]азепин 11-илиден)пропил]пиперидин-4-ола (пример 39) в 5 мл ДМФ добавляют 200 мг гидрида натрия (60%, в масле), 0,15 мл бензилбромида и смесь перемешивают 1 ч при комнатной температуре. К реакционной смеси добавляют воду и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом этилацетатом, чтобы получить 180 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (CDCl3) : 1,62-1,67 (2 Н, м), 1,99-2,20 (3 Н, м), 2,33-2,65 (8 Н, м), 5,10 (1 Н, д), 5,75[b,е]азепин-11-илиден)пропил]пиперидин-4-ола (пример 18) в одномолярном растворе хлористого водорода в диэтиловом эфире и смесь перемешивают 24 ч при комнатной температуре. К реакционной смеси добавляют водный раствор гидроксида натрия и этилацетат, водный слой отделяют и нейтрализуют разбавленной хлористоводородной кислотой. Осадок отфильтровывают, получая 250 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (ДМСО-d6) : 1,44-1,61 (2 Н, м), 2,07-2,17 (1 Н, м), 2,35-3,01 (9 Н, м), 4,28 (1 Н, д), 4,59(1H, д), 5,83 (1 Н, т), 7,18-7,71 (12 Н, м). МС m/z: 517 (М+1). Пример 18. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-5-этоксикарбонилметил-6-оксо-5 Н-дибенз[b,е]азепин-11-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[а,d]циклогептен на 11-(3-бромпропилиден)-5-этоксикарбонилметил-6-оксо-5 Н-дибенз[b,е]азепин. Спектр ЯМР 1 Н (CDCl3) : 1,30 (3 Н, т), 1,64-1,69 (2 Н, м), 1,97-2,10 (3 Н, м), 2,38-2,71 (8 Н, м), 4,27(2 Н, к), 4,32 (1 Н, д), 4,84 (1 Н, д), 5,88 (1 Н, т), 7,16-7,45 (11H, м), 7,88 (1 Н, дд). МС m/z: 545 (М+1), к квартет. Пример 19. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-5-метил-6-оксо-5 Н-дибенз[b,е]азепин-11-илиден) пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-5-метил-6-оксо 5 Н-дибенз[b,е]азепин. Спектр ЯМР 1H (CDCl3) : 1,58-2,06 (5 Н, м), 2,39-2,75 (8 Н, м), 3,53 (3H, с), 5,84 (1 Н, т), 7,10-7,44(11 Н, м), 7,85-7,89 (1 Н, м). МС m/z: 473 (М+1). Пример 21. 4-(4-Хлорфенил)-1-[3-(5 Н-дибенз[а,d]циклогептен-5-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[а,d]циклогептен на 5-(3-бромпропилиден)-5 Н-дибензо[a,d] циклогептен. Спектр ЯМР 1 Н (CDCl3) : 1,58-1,63 (2 Н, м), 2,00-2,05 (2 Н, м), 2,26-2,46 (6 Н, м), 2,62-2,66 (2 Н, м),5,55 (1 Н, т), 6,85 (2 Н, с), 7,24-7,40 (12 Н, м). МС m/z: 442 (М+1). Пример 22. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-метоксикарбонилдибенз[b,е]-оксепин-11-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-6,11-дигидро-2-метоксикарбонилдибенз[b,e]оксепин. Спектр ЯМР 1H (CDCl3) : 1,65-1,70 (2 Н, м), 2,01-2,13 (3H, м), 2,41-2,80 (7 Н, м), 3,85 (3H, с), 5,40(2 Н, ш.с.), 5,73 (0,6 х 1 Н, т), 6,09 (0,4 х 1H, т), 6,76 (0,6 х 1 Н, д), 6,82 (0,4 х 1H, д), 7,21-7,43 (8 Н, м), 7,73 (1 Н,дд), 7,87 (0,6 х 1 Н, д), 7,97 (0,4 х 1 Н, д). МС m/z: 504 (М+1). Пример 23. 1-[3-(2-Бутоксикарбонил-6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]-4-(4-хлорфенил)пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-2-бутокси-6,11- 23008060 дигидродибенз[b,e]оксепин. Спектр ЯМР 1H (CDCl3) : 0,96 (3H, т), 1,53 (2 Н, к), 1,70-1,77 (3H, м), 2,02-2,14 (3H, м), 2,39-2,78(1 Н, дд), 7,89 (0,8x1 Н, д), 7,98 (0,2x1 Н, д). МС m/z: 546 (М+1). Пример 24. 1-[3-(2-Карбоксил-6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]-4-(4-хлорфенил) пиперидин-4-ол. К раствору 100 мг 4-(4-хлорфенил)-1-[3-(6,11-дигидро-2-метоксикарбонилдибенз-[b,e]оксепин-11 илиден)пропил]пиперидин-4-ола (пример 22) в 3 мл этанола добавляют 0,6 мл 15% водного раствора гидроксида натрия и смесь нагревают до кипения в течение 12 ч. Растворитель отгоняют при пониженном давлении. К реакционной смеси добавляют воду и этилацетат, водный слой отделяют и нейтрализуют разбавленной хлористоводородной кислотой. Осадок отфильтровывают, чтобы получить 80 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (CD3OD) : 1,73-1,79 (2 Н, м), 2,14-2,19 (2 Н, м), 2,80-2,93 (3H, м), 3,02-3,11 (3H, м),3,24-3,29 (2 Н, м), 5,25 (2 Н, ш.с.), 5,61 (0,7 х 1 Н, т), 6,05 (0,3 х 1 Н, т), 6,72 (1 Н, д), 7,22-7,40 (8 Н, м), 7,52-7,65(1 Н, м), 7,75 (0,7x1 Н, д), 7,80 (0,3x1 Н, д). МС m/z: 490 (М+1). Пример 25. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-диметиламинокарбонилдибенз[b,e]-оксепин-11 илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-2-диметиламинокарбонил-6,11-дигидродибенз[b,e]оксепин. Спектр ЯМР 1H (CDCl3) : 1,62-1,67 (2 Н, м), 2,00-2,12 (2 Н, м), 2,37-2,47 (8 Н, м), 2,89 (6 Н, с), 5,25(2 Н, ш.с.), 5,68 (0,7 х 1 Н, т), 6,03 (0,3 х 1H, т), 6,71 (0,3 х 1 Н, д), 6,78 (0,7x1 Н, д), 7,13-7,40 (10 Н, м). МС m/z: 517 (М+1). Пример 26. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-гидроксиметилдибенз[b,e]оксепин-11-илиден) пропил]пиперидин-4-ол. К раствору 110 мг (4-хлорфенил)-1-[3-(6,11-дигидрометоксикарбонил-дибенз[b,e]-оксепин-11 илиден)пропил]пиперидин-4-ола в 8 мл ТГФ по каплям добавляют 0,42 мл 1-молярного раствора литийалюминийгидрида при 0 С и реакционную смесь перемешивают 1 ч при комнатной температуре. В реакционную смесь добавляют 1-молярный водный раствор гидроксида натрия, перемешивают в течение 30 мин, затем к смеси добавляют этилацетат и рассол. Органический слой отделяют и промывают насыщенным водным раствором хлористого натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (10:1) дихлорметан:метанол, чтобы получить 90 мг соединения, указанного в заголовке. Спектр ЯМР 1H (CDCl3) : 1,61-1,66 (2 Н, м), 1,98-2,03 (2 Н, м), 2,39-2,48 (3H, м), 2,57-2,79 (6 Н, м),4,52 (2 Н, с), 5,20 (2 Н, ш.с.), 5,66 (0,8 х 1 Н, т), 6,01 (0,2 х 1 Н, т), 6,67 (0,2 х 1 Н, д), 6,79 (0,8 х 1H, д), 7,06 (1 Н,дд), 7,15-7,37 (9 Н, м). МС m/z: 476 (М+1). Пример 27. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-(1-гидрокси-1-метил)этилдибенз[b,е]-оксепин-11 илиден)пропил]пиперидин-4-ол. К раствору 60 мг (4-хлорфенил)-1-[3-(6,11-дигидро-2-метоксикарбонилдибенз-[b,e]-оксепин-11-илиден)пропил]пиперидин-4-ола в 6 мл ТГФ по каплям добавляют 0,16 мл 3-молярного раствора метилмагнийхлорида при 0 С и смесь перемешивают 2 ч при комнатной температуре, реакцию в смеси прерывают добавлением насыщенного водного раствора аммиака, затем к смеси добавляют этилацетат и воду. Органический слой отделяют и промывают насыщенным водным раствором хлористого натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (95:5) этилацетат/метанол, получая 20 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (CDCl3) : 1,54 (0,7 х 6 Н, с), 1,62 (0,3 х 6 Н, с), 1,63-1,70 (2 Н, м), 2,03-2,10 (3H, м), 2,382,49 (3H, м), 2,62-2,82 (4 Н, м), 5,17 (2 Н, ш.с.), 5,68 (0,7 х 1 Н, т), 6,05 (0,3 х 1 Н, т), 6,75 (0,3 х 1 Н, д), 6;83(0,7 х 1 Н, д), 7,18-7,43 (10 Н, м). МС m/z: 504 (М+1). Пример 28. 4-(4-Хлорфенил)-1-[3-(2-циано-6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-2-циано-6,11 дигидродибенз[b,e]оксепин. Спектр ЯМР lH (CDCl3) : 1,67-1,72 (2 Н, м), 2,02-2,13 (2 Н, м), 2,37-2,77 (8 Н, м), 5,35 (2 Н, ш.с.), 5,75(0,7 х 1H, т), 6,07 (0,3 х 1 Н, т), 6,78 (0,3 х 1 Н, д), 6,82 (0,7 х 1 Н, д), 7,25-7,51 (10 Н, м). МС m/z: 471 (М+1). Пример 29. 1-[3-(2-Аминометил-6,11-дигидродибенз[b,е]оксепин-11-илиден)пропил]-4-(4-хлорфенил)пиперидин-4-ол. К раствору 380 мг 4-(4-хлорфенил)-1-[3-(2-циано-6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ола в 20 мл этанола добавляют 60 мг никеля Ренея (50%-ная суспензия в воде) и смесь подвергают гидрированию под давлением 100 кПа (15 фунт/кв. дюйм) в течение 2 ч. Смесь фильтруют- 24008060 через слой целита и перегоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (95:5:1) дихлорметан:метанол:водный аммиак, получая 130 мг соединения, указанного в заголовке. Спектр ЯМР 1H (CDCl3) : 1,76-1,94 (3H, м), 2,18-2,34 (2 Н, м), 2,85-3,10 (8 Н, м), 3,88 (2 Н, с), 5,30(2 Н, ш.с.), 5,59 (1 Н, т), 6,78 (1 Н, д), 7,13-7,40 (10 Н, м). МС m/z: 475 (М+1). Пример 30. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-нитродибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 1, но заменяя 5-(3 бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на 11-(3-бромпропилиден)-6,11-дигидро-2 нитродибенз[b,e]оксепин. Спектр ЯМР 1H (CDCl3) : 1,62-1,67 (2 Н, м), 1,80-2,12 (3H, м), 2,28-2,78 (8 Н, м), 5,05 (0,3 х 2 Н, ш.с.),5,40 (0,7 х 2 Н, ш.с.), 5,90 (0,7x1 Н, т), 6,17 (0,3x1 Н, т), 6,82 (0,3x1 Н, д), 6,92 (0,7 х 1H), 7,28-7,41 (8 Н, м), 8,15(0,7 х 1 Н, д), 8,22 (0,3 х 1 Н, д). МС m/z: 491 (М+1). Пример 31. 1-[3-(2-Амино-6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]-4-(4-хлорфенил)пиперидин-4-ол. К раствору 120 мг 4-(4-хлорфенил)-1-[3-(6,11-дигидро-2-нитродибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ола в 15 мл этанола добавляют 190 мг хлористого олова (II) и смесь нагревают до кипения в течение 1 ч. Растворитель отгоняют при пониженном давлении. К остатку добавляют этилацетат и водный раствор гидроксида натрия для нейтрализации. Органический слой отделяют и промывают насыщенным водным раствором хлористого натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (95:5) дихлорметан:метанол, получая 70 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (ДМСО-d6) : 1,54-1,60 (2 Н, м), 1,85-2,00 (2 Н, м), 2,30-2,80 (8 Н, м), 3,88 (2 Н, с), 5,07(2 Н, ш.с.), 5,66 (1 Н, т), 6,41-6,46 (2 Н, м), 6,59 (1 Н, д), 7,24-7,49 (8 Н, м). MC m/z: 461 (M+l). Пример 32. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-гидроксидибенз[b,e]оксепин-11-илиден)пропил] пиперидин-4-ол. Стадия 1. 11-(3-Бромпропилиден)-6,11-дигидро-2-гидроксидибенз[b,e]оксепин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метоксипиридо-[2,3-с][1]бензоксепин-5-он на 6,11 дигидро-2-гидроксидибенз[b,e]оксепин-11-он. Спектр ЯМР 1H (CDCl3) : 2,69 (2 Н, к), 3,39 (2 Н, т), 5,20 (2 Н, ш.с.), 5,92 (1 Н, т), 6,50-6,81 (4 Н, м),7,17-7,37 (4 Н, м). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на продукт стадии 1. Спектр ЯМР 1 Н (CDCl3) : 1,60-1,75 (3H, м), 1,95-2,10 (2 Н, м), 2,35-2,80 (8 Н, м), 5,10 (2 Н, ш.с.), 5,93(1 Н, т), 6,56 (2 Н, ш.с.), 6,71 (1 Н, ш.с.), 7,11-7,35 (8 Н, м). МС m/z: 462 (М+1). Пример 33. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-метоксидибенз[b,e]-оксепин-11-илиден)пропил] пиперидин-4-ол. Стадия 1. 11-(3-Бромпропилиден)-6,11-дигидро-2-метоксидибенз[b,e]оксепин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метоксипиридо-[2,3-с][1]бензоксепин-5-он на 6,11 дигидро-2-метоксидибенз[b,e]оксепин-11-он. Спектр ЯМР 1H (CDCl3) : 2,74 (2 Н, к), 3,43 (2 Н, т), 3,77 (3H, с), 5,10 (2 Н, ш.с.), 6,02 (1 Н, т), 6,706,83 (3H, м), 7,21-7,38 (4 Н, м). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на продукт стадии 1. Спектр ЯМР 1H (CDCl3) : 1,59-1,65 (2 Н, м), 1,95-2,66 (11 Н, м), 3,75 (3H, c), 5,10 (2 Н, ш.с.), 6,03 (1H,т), 6,69 (2H, ш.с.), 6,82 (1H, ш.с.), 7,20-7,40 (8H, м). MC m/z: 476 (M+l). Пример 34. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-2-этоксидибенз[b,e]оксепин-11-илиден)пропил] пиперидин-4-ол. К раствору 200 мг 4-(4-хлорфенил)-1-[3-(6,11-дигидро-2-гидроксидибенз[b,e]-оксепин-11 илиден)пропил]пиперидин-4-ола (пример 32) в 5 мл ДМФ добавляют 25 мг гидрида натрия (60%, в масле), 0,052 мл йодистого этила и смесь перемешивают 1 ч при комнатной температуре. К реакционной смеси добавляют воду и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (1:1) этилацетат:гексан,получая 170 мг соединения, указанного в заголовке. Спектр ЯМР 1H (CDCl3) : 1,37 (3H, т), 1,60-1,65 (2 Н, м), 1,95-2,08 (3H, м), 2,28-2,75 (8H, м), 3,96- 25008060 Пример 35. 1-[3-(3-Бром-6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ол. Стадия 1. 3-Бром-11-(3-бромпропилиден)-6,11-дигидродибенз[b,e]оксепин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метоксипиридо[2,3-с][1]бензоксепин-5-он на 3-бром-6,11 дигидродибенз[b,e]оксепин-11-он. Спектр ЯМР lH (CDCl3) : 2,74 (2 Н, к), 3,43 (2H, т), 3,77 (3H, c), 5,10 (2H, ш.с.), 6,02 (1H, т), 6,706,83 (3H, м), 7,21-7,38 (4H, м). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[а,d]циклогептен на продукт стадии 1. Спектр ЯМР 1 Н (CDCl3) : 1,63-1,70 (3H, м), 1,96-2,10 (2H, м), 2,32-2,69 (8H, м), 5,20 (2 Н, ш.с.), 6,00(1H, т), 6,92-7,00 (2H, м), 7,11-7,14 (1H, м), 7,24-7,42 (8H, м). МС m/z: 524, 526 (М+1). Пример 36. 4-(4-Хлорфенил)-1-[3-(6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил]-4-метоксипиперидин-4-ол. К раствору 400 мг 4-(4-хлорфенил)-1-[3-(6,11-дигидро-2-метоксидибенз[b,e]-оксепин-11-илиден) пропил]пиперидин-4-ола (пример 2) в 5 мл ДМФ добавляют 50 мг гидрида натрия (60%, в масле), 0,07 мл йодистого метила и смесь перемешивают 1 ч при комнатной температуре. К реакционной смеси добавляют воду и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (1:1) этилацетат:гексан, получая 100 мг соединения, указанного в заголовке. Спектр ЯМР 1H (CDCl3) : 1,90-2,04 (4H, м), 2,34-2,62 (8H, м), 2,93 (3H, c), 5,25 (2H, ш.с.), 6,04 (1H,т), 6,75-6,91 (3H, м), 7,09-7,37 (9H, м). МС m/z: 460 (М+1). Пример 37. 4-Ацетокси-4-(4-хлорфенил)-1-[3-(6,11-дигидродибенз[b,e]оксепин-11-илиден)пропил] пиперидин-4-ол. К раствору 200 мг 4-(4-хлорфенил)-1-[3-(6,11-дигидро-2-метоксидибенз[b,e]-оксепин-11-илиден)пропил]пиперидин-4-ола (пример 2) в 5 мл дихлорметана добавляют 0,06 мл хлористого ацетила,0,19 мл триэтиламина и смесь перемешивают 1 ч при комнатной температуре. К реакционной смеси добавляют водный раствор бикарбоната натрия и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью (1:4) этилацетат:гексан, получая 190 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (CDCl3) : 1,98-2,85 (12H, м), 2,02 (3H, c), 2,93 (3H, c), 5,23 (2H, ш.с.), 6,01 (1H, т),6,73-6,90 (3H, м), 7,11-7,40 (9H, м). МС m/z: 488 (М+1). Пример 38. 1-[3-(8-Бром-4,10-дигидротиено[3,2-с][1]бензоксепин-10-илиден)пропил]пиперидин-4(4-хлорфенил)-4-ол. Стадия 1. 8-Бром-10-(3-бромпропилиден)-4,10-дигидротиено[3,2-с][1]бензоксепин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метоксипиридо[2,3-с][1]бензоксепин-5-он на 4,10 дигидротиено[3,2-с][1]бензоксепин-10-он. Спектр ЯМР 1 Н (CDCl3) : 2,84 (2 Н, к), 3,45 (2H, т), 5,10 (2 Н,с), 6,11 (1H, т), 6,11 (1H, т), 7,03-7,08(2H, м), 7,38-7,43 (2H, м). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[a,d]циклогептен на продукт стадии 1. Спектр ЯМР 1 Н (CDCl3) : 1,66-1,75 (3H, м), 2,03-2,16 (2H, м), 2,40-2,86 (8H, м), 5,09 (0,7 х 2 Н, с),5,14 (0,3 х 2 Н, с), 5,90 (0,3 х 1H, т), 6,10 (0,7 х 1H, т), 6,64 (0,7 х 1 Н, д), 6,75 (0,3x1 Н, д), 6,90 (0,3x1 Н, д), 7,037,09 (2H, м), 7,21-7,45 (6H, м). МС m/z: 532 (М+1). Пример 39. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-6-оксо-5 Н-дибенз[b,e]азепин-11-илиден)пропил] пиперидин-4-ол. Стадия 1. 11-(3-Бромпропилиден)-6,11-дигидро-6-оксо-5 Н-дибенз[b,e]азепин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метоксипиридо-[2,3-с][1]-бензоксепин-5-он на 6,11 дигидро-6-5 Н-дибенз[b,e]азепин-6,11-дион. Спектр ЯМР 1H (CDCl3) : 2,70-2,92 (2 Н, м), 3,45 (2H, т), 5,92 (1H, т), 7,08-7,58 (7H, м), 8,05 (1 Н,дд), 9,00 (1H, ш.с.). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[а,d]циклогептен на продукт стадии 1. Спектр ЯМР 1H (CDCl3) : 1,61-1,66 (2H, м), 1,97-2,20 (3H, м), 2,35-2,68 (8H, м), 5,80 (1H, т), 7,037,53 (11H, м), 8,02 (1 Н, дд), 9,27 (1H, ш.с.). МС m/z: 459 (М+1).- 26008060 Пример 40. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-5-этил-6-оксо-5 Н-дибенз[b,e]азепин-11-илиден) пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 12, но заменяя бромистый бензил на йодистый этил. Спектр ЯМР 1 Н (CDCl3) : 1,19-1,28 (3H, м), 1,63-1,69 (2 Н, м), 1,99-2,16 (3H, м), 2,37-2,7 (8H, м),3,77-3,85 (1H, м), 4,40-4,48 (1H, м), 5,85 (1H, т), 7,12-7,45 (11H, м) 7,85 (1 Н, дд). Масс-спектр (МС) m/z: 487 (М+1). Пример 41. 1-[3-(5-н-Бутил-6,11-дигидро-6-оксо-5 Н-дибенз[b,e]азепин-11-илиден)пропил]-4-(4-хлорфенил)пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 12, но заменяя бромистый бензил на йодистый н-бутил. Спектр ЯМР 1H (CDCl3) : 0,90-0,98 (3H, м), 1,25-2,20 (9 Н, м), 2,40-2,87 (8H, м), 3,62-3,72 (1H, м),4,52-4,64 (1H, м), 5,85 (1H, т), 7,16-7,45 (11H, м) 7,88 (1 Н, дд). МС m/z: 515 (М+1). Пример 42. 4-(4-Хлорфенил)-1-[3-(6,11-дигидро-5-(3-гидроксипропил)-6-оксо-5 Н-дибенз[b,e]азепин-11-илиден)пропил]пиперидин-4-ол. К раствору 500 мг хлористо-водородного 4-(4-хлорфенил)-1-[3-(6,11-дигидро-6-оксо-5 Н-дибенз[b,e] азепин-11-илиден)пропил]пиперидин-4-ола (пример 39) в 8 мл ДМФ добавляют 200 мг гидрида натрия(60%, в масле), 0,5 мл 2-(3-бромпропокси)тетрагидро-2 Н-пирана и смесь перемешивают 6 ч при комнатной температуре. К реакционной смеси добавляют воду и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток растворяют в 1-молярном растворе хлористого водорода в диэтиловом эфире и перемешивают 1 ч при комнатной температуре. К реакционной смеси добавляют водный раствор бикарбоната натрия и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом этилацетатом, получая 250 мг соединения, указанного в заголовке. Спектр ЯМР 1 Н (CDCl3) : 1,25-2,87 (15 Н, м), 3,51-3,56 (2H, м), 3,76-3,82 (1H, м), 4,81-4,87 (1H, м),5,86 (1H, т), 7,16-7,45 (11H, м), 7,82 (1 Н, дд). МС m/z: 517 (М+1). Пример 43. 1-[3-(5-трет-Бутоксикарбонилметил-6,11-дигидро-6-оксо-5 Н-дибенз[b,e]азепин-11-илиден)пропил]-4-(4-хлорфенил)пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 12, но заменяя бромистый бензил на трет-бутилбромацетат. Спектр ЯМР 1H (CDCl3) : 1,50 (9 Н, с), 1,65-1,70 (2 Н, м), 1,95-2,10 (3H, м), 2,42-2,75 (8H, м), 4,24(1 Н, д), 4,75 (1 Н, д), 5,88 (1H, т), 7,16-7,46 (11H, м) 7,90 (1 Н, дд). (МС) m/z: 573 (М+1). Пример 44. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-гидрокси[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил]пиперидин-4-ол. Стадия 1. К раствору 4,3 г продукта примера 45, стадия 1, в 100 мл дихлорэтана добавляют 19,3 г комплекса трибромид бора-метилсульфид и смесь нагревают до кипения в течение 3 ч. К реакционной смеси добавляют воду и этилацетат и нейтрализуют ее разбавленным раствором гидроксида натрия. Органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле,элюируемом смесью (1:2) этилацетат:гексан, получая 3,2 г 5-(3-бромпропилиден)-5,11-дигидро-7 гидрокси[1]бензоксепино-[2,3-b]пиридина. Спектр ЯМР 1H (CDCl3) : 2,72 (2 Н, к), 3,45 (2H, т), 5,28 (2H, ш.с.), 6,03 (1H, т), 6,66-6,80 (3H, м),7,26 (1 Н, дд), 7,58 (1 Н, дд), 8,51 (1 Н, дд). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]-пиридин на продукт стадии 1. Спектр ЯМР 1H (ДМСО-d6) : 1,46-1,51 (2H, м), 1,74-1,85 (2H, м), 2,29-2,51 (8H, м), 5,15 (2H, ш.с.),6,07 (1H, т), 6,61-6,70 (3H, м), 7,33-7,48 (5H, м), 7,73 (1 Н, дд), 8,47 (1 Н, дд), 9,06 (1H, c). MC m/z: 463(M+1). Пример 45. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил]пиперидин-4-ол. Стадия 1. К раствору 5,09 г 5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-она в 50 мл тетрагидрофурана (ТГФ) добавляют при 0 С 25 мл 1,1-молярного раствора бромистого циклопропилмагния в ТГФ. Реакционную смесь нагревают до комнатной температуры и перемешивают 30 мин. К реакционной смеси добавляют водный раствор хлористого аммония и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток отфильтровывают и промывают смесью (1:2) этилацетат:гексан,- 27008060 получая 5,0 г 5-циклопропил-5,11-дигидро-7-метокси[1]-бензоксепино-[2,3-b]пиридин-5-ола. Стадия 2. В раствор 4,3 г продукта стадии 1 в уксусной кислоте (30 мл) добавляют 25 мл водного бромистого водорода (48% HBr) при 10 С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 12 ч. В реакционную смесь добавляют воду и этилацетат, и нейтрализуют разбавленным раствором NaOH. Органический слой выделяют и промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью этилацетат:гексан (1:4), чтобы получить 5(3-бромпропилиден)-5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин (5,6 г). 1 Н-ЯМР (CDCl3) : 2,74 (2 Н, к), 3,46 (2H, т), 3,78 (3H, c), 5,25 (2H, ш.с.), 6,07 (1H, т), 6,72-6,82 (3H,м), 7,21-7,42 (5H, м), 7,56 (1 Н, дд), 8,45 (1 Н, дд). Стадия 3. К раствору 1,1 г продукта стадии 2 в ДМФ (15 мл) добавляют 4-(4-хлорфенил)-4-гидроксипиперидин (0,81 г) и карбонат калия (0,53 г) и смесь перемешивают при комнатной температуре 3 ч. В реакционную смесь добавляют воду и этилацетат, органический слой выделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью хлористый метилен:метанол (10:1), чтобы получить указанное в заголовке соединение в виде основного региоизомера (0,86 г) и 0,05 г второстепенного региоизомера. Основной изомер. 1 Н-ЯМР (CDCl3) : 1,64-1,69 (2H, м), 1,91-2,08 (3H, м), 2,34-2,69 (8H, м), 3,77 (3H, c), 5,25 (2H, ш.с.),6,07 (1H, т), 6,72-6,82 (3H, т), 7,21-7,42 (5H, м), 7,56 (1 Н, дд), 8,45 (1 Н, дд). МС m/z: 477 (M+1). Второстепенный изомер. 1 Н-ЯМР (CDCl3) : 1,65-1,79 (3H, м), 2,01-2,13 (2H, м), 2,35-2,76 (8H, м), 3,76 (3H, c), 5,22 (2H, ш.с.),5,95 (1H, т), 6,72-6,80 (2H, м), 7,06 (1 Н, д),7,16 (1 Н, дд), 7,28 (2 Н, д), 7,42 (2 Н, д), 7,66 (1 Н, дд), 8,39 (1 Н,дд). МС m/z: 477 (М+1). Пример 46. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 34, но заменяя 4-(4-хлорфенил)-1-[3-(6,11-дигидро-2-гидроксидибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ол на 4-(4 хлорфенил)-1-[3-(5,11-дигидро-7-гидрокси[1]бензоксепино[2,3b]пиридин-5-илиден)пропил]пиперидин-4 ол (пример 44). 1 Н-ЯМР (CDCl3) : 1,38 (3H, т), 1,67-1,72 (3H, м), 2,05-2,16 (2H, м), 2,40-2,80 (8H, м), 3,99 (2 Н, к),5,26 (2H, ш.с.), 6,05 (1H, т), 6,71-6,82 (3H, м), 7,23-7,43 (5H, м), 7,57 (1 Н, дд), 8,47 (1 Н, дд). МС m/z: 491(М+1). Пример 47. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-изопропокси[1]бензоксепино[2,3-b]пиридин-5 илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 46, но заменяя йодистый этил на бромистый изопропил. 1 Н-ЯМР (CDCl3) : 1,30 (6 Н, д), 1,60-1,70 (3H, м), 1,99-2,09 (2H, м), 2,33-2,69 (8H, м), 4,37-4,48 (1H,м), 5,26 (2H, ш.с.), 6,06 (1H, т), 6,73-6,82 (3H, м), 7,21-7,43 (5H, м), 7,55 (1 Н, дд), 8,47 (1H, дд). МС m/z: 505 (M+1). Пример 48. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-метоксикарбонилметилокси[1]бензоксепино[2,3b]пиридин-5-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 46, но заменяя йодистый этил на этилбромацетат. 1 Н-ЯМР (CDCl3) : 1,28 (3H, т), 1,63-1,68 (2 Н, м), 1,97-2,02 (3H, м), 2,33-2,68 (8H, м), 4,24 (2 Н, к),4,55 (2 Н, с), 5,26 (2H, ш.с.), 6,06 (1H, т), 6,73-6,88 (3H, м), 7,21-7,42 (5H, м), 7,55 (1 Н, дд), 8,44 (1 Н, дд). МС m/z: 549 (М+1). Пример 49. 4-(4-Хлорфенил)-1-[3-(7-цианометилокси-5,11-дигидро[1]бензоксепино[2,3-b]пиридин 5-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 46, но заменяя йодистый этил на бромацетонитрил. 1 Н-ЯМР (CDCl3) : 1,62-1,67 (2H, м), 1,94-2,06 (2H, м), 2,21 (1H, ш.с.), 2,34-2,66 (8H, м), 4,70 (2H, s),5,26 (2H, ш.с.), 6,10 (1H, т), 6,80 (2H, ш.с.), 6,92 (1H, ш.с.), 7,22-7,41 (5H, м), 7,56 (1 Н, дд), 8,44 (1 Н, дд). МС m/z: 502 (М+1). Пример 50. 1-[3-(7-(2-Ацетоксиэтил)окси-5,11-дигидро[1]бензоксепино[2,3b]пиридин-5-илиден) пропил]-4-(4-хлорфенил)пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 46, но заменяя йодистый этил на 2-бромэтилацетат. 1 Н-ЯМР (CDCl3) : 1,65-1,72 (3H, м), 1,97-2,09 (5H, м), 2,37-2,70 (8H, м), 4,11-4,14 (2H, м), 4,37-4,41m/z: 549 (M+1). Пример 51. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-(2-гидроксиэтил)окси[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил]пиперидин-4-ол. К раствору 140 мг 1-[3-(7-(2-ацетоксиэтил)окси-5,11[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил]-4-(4 хлорфенил)пиперидин-4-ола (пример 50) в этаноле (5 мл) добавляют 2 мл 15% водного раствора гидроксида натрия и смесь кипятят с обратным холодильником в течение 1 ч. К реакционной смеси добавляют воду и этилацетат, органический слой выделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью хлористый метилен:метанол (10:1),чтобы получить указанное в заголовке соединение (120 мг). 1m/z: 507 (М+1). Пример 52. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-(2-морфолиноэтил)окси[1]бензоксепино[2,3-b] пиридин-5-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 46, но заменяя йодистый этил на 4-(2-хлорэтил)морфолин гидрохлорид. 1H-ЯМР (CDCl3) : 1,62-1,67 (2H, м), 1,95-2,08 (2H, м), 2,20-2,67 (13H,м), 2,74 (2H, т), 3,67-3,71 (4H,м), 4,04 (2H, т), 5,23 (2H, ш.с.), 6,05 (1H, т), 6,73-6,82 (3H, м), 7,20-7,41 (5H, м), 7,53 (1 Н, дд), 8,42 (1H,дд). МС m/z: 576 (M+1). Пример 53. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил] пиперидин-4-ол. Стадия 1. 5-(3-Бромпропилиден)-5,11-дигидро[1]бензоксепино[2,3-b]пиридин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-он на 5,11-дигидро[1]бензоксепино[2,3-b]пиридин-5-он. 1H-ЯМР (CDCl3) : 2,71 (2 Н, к), 3,46 (2H, т), 5,33 (2H, ш.с.), 6,04 (1H, т), 7,01-7,17 (3H, м), 7,29 (1 Н,дд), 7,56 (1 Н, дд), 8,53 (1 Н, дд). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-5,11-дигидро-7-метокси [1]бензоксепино[2,3-b]пиридин на продукт стадии 1. 1H-ЯМР (CDCl3) : 1,66-1,71 (2H, м), 2,00-2,20 (3H, м), 2,36-2,69 (8H, м), 5,34 (2H, ш.с.), 6,10 (1H, т),6,83-6,96 (3H, м), 7,17-7,44 (6H, м), 7,60 (1 Н, дд), 8,46 (1 Н, дд). МС m/z: 447 (M+1). Пример 54. 1-[3-(8-Бром-5,11-дигидро[1]бензоксепино[2,3-b]пиридин-5-илиден)пропил]-4-(4-хлорфенил)пиперидин-4-ол. Стадия 1. 8-Бром-5-(3-бромпропилиден)-5,11-дигидро[1]бензоксепино[2,3-b]пиридин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-он на 8-бром-5,11-дигидро[1]бензоксепино[2,3-b]пиридин-5-он. 1(3H, м), 7,59 (1 Н, дд), 8,54 (1 Н, дд). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-5,11 дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин на продукт стадии 1. 1H-ЯМР (CDCl3) : 1,64-1,69 (2H, м), 1,90-2,07 (3H, м), 2,30-2,67 (8H, м), 5,30 (2H, ш.с.), 6,08 (1H, т),7,00-7,07 (2H, м), 7,13 (1 Н, д), 7,25-7,42 (5H, м), 7,56 (1 Н, дд), 8,47 (1 Н, дд). МС m/z: 525, 527 (М+1). Пример 55. 4-(4-Хлорфенил)-1-[3-(10,11-дигидро-10-оксо-5 Н-пиридо[2,3 с][2]бензазепин-5-илиден) пропил]пиперидин-4-ол. Стадия 1. 5-(3-Бромпропилиден)-10,11-дигидро-10-оксо-5 Н-пиридо[2,3-с][2]бензазепин получают, следуя методике примера 45, стадии 1 и 2, но заменяя 5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-он на 10,11-дигидро-5 Н-пиридо[2,3-с][2]бензазепин-5,10-дион. 1(1 Н, дд), 10,00 (1H, ш.с.). Стадия 2. Указанное в заголовке соединение получают, следуя методике примера 45, стадия 3, но заменяя 5(3-бромпропилиден)-10,11-дигидро-5 Н-дибензо[а,d]циклогептен на продукт стадии 1. 1H-ЯМР (CDCl3) : 1,64-1,69 (3H, м), 2,00-2,12 (2H, м), 2,35-2,70 (8H, м), 5,82 (1H, т), 7,08 (1 Н, дд),7,23-7,62 (8H, м), 8,04 (1 Н, дд), 8,32 (1 Н, дд), 8,76 (1H, ш.с.). МС m/z: 460 (M+1). Пример 56. 4-(4-Хлорфенил)-1-[3-(10,11-дигидро-11-метил-10-оксо-5 Н-пиридо[2,3-с][2]бензазе- 29008060 пин-5-илиден)пропил]пиперидин-4-ол. Указанное в заголовке соединение получают, следуя методике примера 36, но заменяя 4-(4 хлорфенил)-1-[3-(6,11-дигидро-2-метоксидибенз[b,e]оксепин-11-илиден)пропил]пиперидин-4-ол на 5-(3 бромпропилиден)-10,11-дигидро-10-оксо-5 Н-пиридо[2,3-с][2]бензазепин. 1H-ЯМР (CDCl3) : 1,64-1,70 (3H, м), 2,00-2,10 (2H, м), 2,41-2,69 (8H, м), 3,62 (3H, c), 5,82 (1H, т),7,07 (1 Н, дд), 7,25-7,54 (8H, м), 7,91 (1 Н, дд), 8,34 (1 Н, дд). МС m/z: 474 (М+1). Пример 57. 4-(4-Хлорфенил)-1-[3-(5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-илиден)этил]пиперидин-4-ол. Стадия 1. В раствор бромистого метилтрифенилфосфония (2,2 г) в 20 мл ТГФ добавляют при температуре 0 С 1,6-молярный раствор н-бутиллития в гексане (2,9 мл) в течение 30 мин. В реакционную смесь, охлажденную до 0 С, по каплям добавляют 5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-он (1,0 г),в виде раствора в ТГФ (5 мл), и смесь нагревают до комнатной температуры, и перемешивают в течение 3 ч. К реакционной смеси добавляют водный раствор хлористого аммония и этилацетат, органический слой отделяют и промывают насыщенным водным раствором хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле,элюируемом смесью этилацетат:гексан (1:4), чтобы получить 5,11-дигидро-7-метокси-5-метиленпиридо[2,3-с][1]бензоксепин (0,14 г). Стадия 2. В раствор ДМФ (0,54 мл) в течение 10 мин добавляют оксихлорид фосфора (0,41 мл) при 0 С. В эту реакционную смесь добавляют продукт стадии 1 (210 мг) в четыреххлористом углероде (5 мл) и в течение 5 ч смесь кипятят с обратным холодильником. В реакционную смесь добавляют водный раствор бикарбонат натрия и этилацетат, органический слой выделяют, промывают насыщенным водным хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью этилацетат:гексан (1:4), чтобы получить 3-(5,11 дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-илиден)ацетальдегид (130 мг). 1H-ЯМР (CDCl3) : 3,77 (0,7 х 3H, c), 3,79 (0,3 х 3H, с), 5,31 (2 Н, с), 6,46 (0,7x1 Н, д), 6,52 (0,3 х 1 Н, д),6,78-7,40 (4H, м), 7,68 (0,3x1 Н, дд), 7,78 (0,7x1 Н, дд), 8,55 (0,7 х 1 Н, дд), 8,64 (0,3 х 1H, дд), 9,62 (0,3 х 1 Н, д),9,79 (0,7x1 Н, д). Стадия 3. Указанное в заголовке соединение получают, следуя методике примера 58, стадия 2, но заменяя 3(5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-илиден)пропанальдегид на продукт стадии 2. 1H-ЯМР (CDCl3) : 3,78 (0,3 х 3H, c), 3,80 (0,7 х 3H, c), 5,32 (2H, ш.с.), 6,34-6,39 (1H, м), 6,72-7,38 (6H,м), 7,58 (0,7 х 1 Н, дд), 7,77 (0,3x1 Н, дд), 8,49 (0,3x1 Н, дд), 8,60 (0,7x1 Н, дд), 9,51 (0,7 х 1 Н, д), 9,54 (0,3 х 1 Н,д). Стадия 2. В раствор продукта стадии 1 (90 мг) в дихлорметане (6 мл) добавляют триацетоксиборгидридборгидрид натрия (170 мг), 4-(4 хлорфенил)-4-гидроксипиперидин (70 мг) и уксусную кислоту(0,02 мл) и смесь перемешивают при комнатной температуре 24 ч. В реакционную смесь добавляют воду и этилацетат, органический слой выделяют и промывают насыщенным водным хлорида натрия и сушат сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографически на силикагеле, элюируемом смесью дихлорметан/метанол (95:5), чтобы получить 4-(4-хлорфенил)1-[4-(5,11-дигидро-7-метокси[1]бензоксепино[2,3-b]пиридин-5-илиден)бутен-2-ил]пиперидин-4-ол (110 мг). 1(0,7x1 Н, дд), 7,65 (0,3x1 Н, дд), 8,37 (0,3 х 1H, дд), 8,45 (0,7x1H, дд). МС m/z: 489 (M+1). Стадия 3. В раствор продукта стадии 2(8 мг) в этаноле (2 мл) добавляют катализатор - 10% Pd/C (2 мг), перемешивают в атмосфере водорода (из баллона) при комнатной температуре в течение 1 ч. Смесь фильтруют через целит и перегоняют при пониженном давлении, чтобы получить указанное в заголовке со- 30
МПК / Метки
МПК: C07D 513/04, C07D 519/00, A61K 31/4353, C07D 313/00, A61P 3/10, A61P 1/00, C07D 491/04, C07D 471/04, C07D 223/00, A61P 29/00, A61K 31/55
Метки: способы, применения, хемокинного, антагонисты, рецептора
Код ссылки
<a href="https://eas.patents.su/30-8060-antagonisty-hemokinnogo-receptora-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты хемокинного рецептора и способы их применения</a>
Предыдущий патент: Способы защиты от радиационного поражения с применением α-тимозина
Следующий патент: N-арилпиперидинзамещенные бифенилкарбоксамиды в качестве ингибиторов секреции аполипопротеина в
Случайный патент: Нейтрализующие антитела человека против b7rp1












