Нейтрализующие антитела человека против b7rp1
Номер патента: 21669
Опубликовано: 31.08.2015
Авторы: Йошинага Стивен Кийоши, Шэнь Вэньянь, Хуан Хайчунь, Сиу Джералд
Формула / Реферат
1. Изолированное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с человеческим B7RP1, содержащие тяжелую цепь и легкую цепь, где вариабельная область тяжелой цепи содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична любой из аминокислотных последовательностей SEQ ID NO: 7-14.
2. Антитело или антигенсвязывающий фрагмент по п.1, где вариабельная область тяжелой цепи содержит любую из аминокислотных последовательностей SEQ ID NO: 7-14.
3. Антитело или антигенсвязывающий фрагмент по п.1, где тяжелая цепь включает CDR1, который имеет аминокислотную последовательность SEQ ID NO: 27, 30 или 35.
4. Антитело или антигенсвязывающий фрагмент по п.1, где тяжелая цепь включает CDR3, который имеет аминокислотную последовательность SEQ ID NO: 29, 32, 34, 37, 38 или 40.
5. Антитело или антигенсвязывающий фрагмент по п.1, где тяжелая цепь включает CDR2, который имеет аминокислотную последовательность SEQ ID NO: 28, 31, 33, 36 или 39.
6. Изолированное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с человеческим B7RP1, содержащее:
а) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 1, или ее антигенсвязывающий фрагмент; или
б) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 8, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 1, или ее антигенсвязывающий фрагмент; или
в) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 9, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, или ее антигенсвязывающий фрагмент; или
г) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 10, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 3, или ее антигенсвязывающий фрагмент; или
д) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 11, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 3, или ее антигенсвязывающий фрагмент; или
е) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 12, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 4, или ее антигенсвязывающий фрагмент; или
ж) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 5, или ее антигенсвязывающий фрагмент; или
з) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 14, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 6, или ее антигенсвязывающий фрагмент.
7. Изолированное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с человеческим B7RP1, содержащее тяжелую цепь и легкую цепь, где вариабельная область легкой цепи содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична любой из аминокислотных последовательностей SEQ ID NO: 1-6.
8. Антитело или его антигенсвязывающий фрагмент по п.7, где вариабельная область легкой цепи содержит любую из аминокислотных последовательностей SEQ ID NO: 1-6.
9. Антитело или его антигенсвязывающий фрагмент по п.7, где легкая цепь включает CDR1, который имеет аминокислотную последовательность SEQ ID NO: 15, 18 или 24.
10. Антитело или его антигенсвязывающий фрагмент по п.7, где легкая цепь включает CDR3, который имеет аминокислотную последовательность SEQ ID NO: 17, 20, 22, 23, 25 или 26.
11. Антитело или его антигенсвязывающий фрагмент по п.7, где легкая цепь включает CDR2, который имеет аминокислотную последовательность SEQ ID NO: 16, 19 или 21.
12. Изолированное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с человеческим B7RP1, содержащие:
а) CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 27, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 28, и CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 29; или
б) CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 30, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 31, и CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 32; или
в) CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 27, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 33, и CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 34; или
г) CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 35, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 36, и CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 37; или
д) CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 27, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 33, и CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 38; или
е) CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 35, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 39, и CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 40.
13. Изолированное антитело или его антигенсвязывающий фрагмент, которые специфично связываются с человеческим B7RP1, содержащее аминокислотную последовательность, как представлено в любой из последовательностей SEQ ID NO: 44-58 или 70-76 согласно нижеследующей таблице:
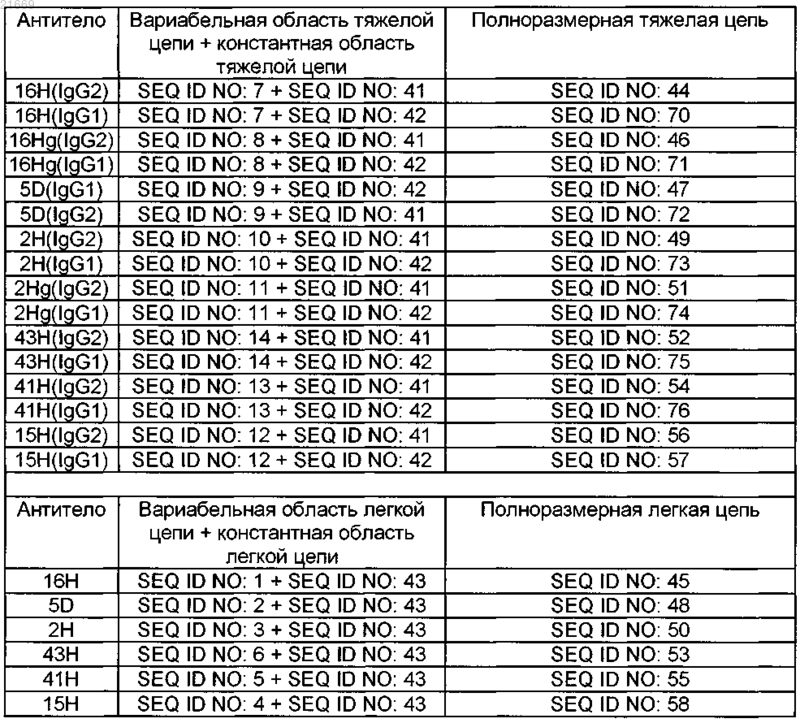
14. Антитело или антигенсвязывающий фрагмент по п.13, содержащее:
а) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 44 или 70, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 45, или ее антигенсвязывающий фрагмент; или
б) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46 или 71, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 45, или ее антигенсвязывающий фрагмент; или
в) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 47 или 72, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 48, или ее антигенсвязывающий фрагмент; или
г) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 49 или 73, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 50, или ее антигенсвязывающий фрагмент; или
д) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51 или 74, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 50, или ее антигенсвязывающий фрагмент; или
е) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56 или 57, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 58, или ее антигенсвязывающий фрагмент; или
ж) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 54 или 76, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 55, или ее антигенсвязывающий фрагмент; или
з) тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 52 или 75, или ее антигенсвязывающий фрагмент, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 53, или ее антигенсвязывающий фрагмент.
15. Антитело или антигенсвязывающий фрагмент по любому из пп.1-14, где вариабельные области тяжелой и легкой цепи образуют одноцепочечное антитело.
16. Антигенсвязывающий фрагмент по любому из пп.1-14, который представляет собой Fv, Fab, Fab' или (Fab')2 фрагмент.
17. Антитело или антигенсвязывающий фрагмент по любому из пп.1-14, где это антитело представляет собой полностью человеческое антитело или его антигенсвязывающий фрагмент.
18. Антитело или антигенсвязывающий фрагмент по любому из пп.1-14, ингибирующие активность B7RP1.
19. Изолированное антитело или антигенсвязывающий фрагмент по любому из пп.1-14, которые специфично связываются с аминокислотной последовательностью SEQ ID NO: 66, но не SEQ ID NO: 67, внеклеточного домена человеческого B7RP1.
20. Изолированное антитело или его антигенсвязывающий фрагмент по любому из пп.1, 7 или 12, которое специфично связывается с человеческим B7RP1 и конкурирует за связывание с человеческим B7RP1 с антителом или антигенсвязывающим фрагментом, имеющим тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 8, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 1.
21. Способ лечения аутоиммунного заболевания или воспалительного ответа у пациента, при котором пациенту вводят фармацевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-14.
22. Способ по п.21, где аутоиммунное заболевание представляет собой ревматоидный артрит или системную красную волчанку.
23. Способ по п.21, где воспалительный ответ представляет собой астму.
24. Способ ингибирования костимуляторного сигнала активации Т-клеток у пациента, при котором пациенту вводят фармацевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-14.
25. Способ лечения пациента, страдающего астмой, ревматоидным артритом или системной красной волчанкой, при котором пациенту вводят фармацевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-14.
26. Композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-14.
27. Способ лечения аутоиммунного заболевания или воспалительного ответа у пациента, при котором пациенту вводят композицию по п.26.
28. Способ обнаружения B7RP1 в биологическом образце, при котором:
а) приводят в контакт образец с антителом или его антигенсвязывающим фрагментом по любому из пп.1-14 в условиях, которые обеспечивают возможность связывания антитела с B7RP1; и
б) измеряют уровень связанного антитела в образце.
29. Молекула нуклеиновой кислоты, которая кодирует антитело или его антигенсвязывающий фрагмент по любому из пп.1-14.
30. Экспрессирующий вектор, включающий молекулу нуклеиновой кислоты по п.29.
31. Клетка-хозяин, содержащая нуклеиновую кислоту по п.29 или экспрессирующий вектор по п.30.
32. Изолированная клеточная линия, которая продуцирует антитело или антигенсвязывающий фрагмент по любому из пп.1-14.
33. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп.1-19, при котором культивируют клетку-хозяин по п.31 или клеточную линию по п.32 и собирают антитело или его антигенсвязывающий фрагмент из культуральной среды или из клетки-хозяина.
34. Антитело или его антигенсвязывающий фрагмент, полученное способом по п.33.
Текст
НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА ЧЕЛОВЕКА ПРОТИВ B7RP1 В данном изобретении предложены антитела, которые взаимодействуют с человеческим B7 связанным белком-1 (B7RP1) или связываются с ним, и антитела, которые связываются сB7RP1 и посредством этого нейтрализуют его функцию. В изобретении также предложены фармацевтические композиции указанных антител и способы нейтрализации функции B7RP1, в частности, для лечения иммунных расстройств (например, неадекватного иммунного ответа) путем введения фармацевтически эффективного количества антител анти-B7RP1. Также предложены способы определения количества B7RP1 в образце с использованием антител против B7RP1. 021669 В данной заявке заявлен приоритет по отношению к временной патентной заявке США, серийный номер 60/700265, поданной 18 июля 2005 г., описание которой полностью включено здесь путем ссылки. Область изобретения Изобретение относится к моноклональным антителам человека, которые связываются с В 7 связанным белком-1 (B7RP1). Также описаны композиции и способы лечения заболеваний и расстройств, относящихся к иммуносупрессии и к иммунной активации. Предшествующий уровень техники Т-клетки инициируют иммунный ответ, являются посредниками в функциях специфичного к антигену эффектора и регулируют активность других лейкоцитов путем секреции цитокинов. Для генерирования адекватного иммунного ответа Т-лимфоцитов (Т-клеток) антигенпрезентирующими клетками(АПК) должно быть передано два сигнала к Т-клеткам. Антиген должен быть презентирован Тклеточному рецептору (ТКР) через главный комплекс гистосовместимости (ГКГ) в событии, которое определяет специфичность. Т-клетки могут распознать только антиген, презентированный на АПК. В дополнение к рецептору антигена адекватная активация Т-клеток также требует взаимодействия других молекул клеточной поверхности как на Т-клетках, так и на АПК. Эти молекулы, называемые молекулами костимуляции, состоят из рецептора на клетке, отвечающей за дифференциацию, и лиганда, присутствующего на индукторной клетке. Этот независимый от антигена сигнал костимуляции должен быть доставлен путем связывания членов семейства В 7 на АПК их рецепторами на Т-клетках. Продуктивный иммунный ответ приводит к пролиферации, дифференциации, клональной экспансии и функции эффектора. В отсутствие второго сигнала костимуляции Т-клетки испытывают состояние стойкой невосприимчивости специфичного антигена, которую называют анергией. Клинические эксперименты фазы II показали,что блокирование одного биохимического пути костимула эффективно при лечении псориаза (Abrams et(Kremer et al., 2003, New England Journal of Medicine 349: 1907-15), что указывает на то, что эта общая стратегия является хорошей целью для иммуномодулирующей терапии. Особая молекула костимуляции В 7, В 7-связанный белок-1 (B7RP1), представляет собой трансмембранный белок типа 1 с сигнальной последовательностью и внеклеточным доменом при аминоконце, где внеклеточный домен содержит две петли Ig, трансмембранным доменом и внутриклеточным доменом карбоксильного конца (публикация заявки РСТWO 00/46240). B7RP1 преимущественно связывается сICOS (что означает "индуцибельный костимулятор"; Yoshinga et al., 2000, Int. Immun. 12: 1439-1447), который экспрессируется на клеточной поверхности Т-клеток. ICOS играет важную роль в продуцировании обоих типов цитокинов типа 1 и типа 2 активированными Т-клетками (Coyle et al., 2000, Immunity 13: 95105).B7RP1 является единственным лигандом, экспрессируемым конститутивно на АПК (Yoshinaga etal., 1999, Nature. 402: 827-32), тогда как ICOS экспрессируется только на активированных Т-клетках(McAdam et al., 2000, Journal of Immunology 165: 5035-40). B7RP1-зависимая передача сигнала требуется как для активации эффектора (то есть полностью активированной Т-клетки), так и для его созревания из его предшественника, не подвергнутого воздействию (Dong et al., 2003, Journal of Autoimmunity. 21: 25560; Coyle et al., 2000, Immunity. 13: 95-105). Следовательно, взаимодействие B7RP1/ICOS требуется для адекватных вторичных иммунных ответов, зависимых от Т-клеток (Dong et al., 2003, Journal of Autoimmunity. 21: 255-60). Современные попытки вмешательства в биохимический путь костимула Т-клеток сосредоточены,прежде всего, на полипептидах костимула, которые блокируют только активацию Т-клеток, но не сосредоточены на активации и созревании. Следовательно, эти терапии обеспечивают общее ингибирование функции Т-клеток. Напротив, блокирование взаимодействия B7RP1/ICOS обеспечивает более специфичное ингибирование функции Т-клеток посредством воздействия только на зрелые Т-клетки-эффекторы. Таким образом, в клинических ситуациях очень желательно блокирование взаимодействия B7RP1/ICOS,поскольку это обеспечило бы более ограниченный профиль побочных эффектов, чем терапии костимула,которые блокируют только активацию Т-клеток, не подвергнутых воздействию. Краткое изложение сущности изобретения В изобретении предложены моноклональные антитела, которые связываются с В 7-связанным белком-1 (B7RP1). В одном воплощении эти моноклональные антитела представляют собой человеческие моноклональные антитела, которые нейтрализуют биологические активности B7RP1 и, в частности, полезны для частичного или полного ингибирования иммунной костимулирующей активности B7RP1. В изобретении также предложены клетки, в частности клетки гибридомы, которые продуцируют моноклональные антитела по изобретению. В конкретных аспектах антитела по изобретению специфично связываются с Н или D доменом B7RP1, как описано здесь. Далее в изобретении предложены гибридные белки, включающие последовательность области Fc антитела и одну или более чем одну последовательность, идентифицируемую как последовательностьSEQ ID NO: 1-SEQ ID NO: 40. Такие молекулы могут быть получены с использованием методов, которые описаны, например, в международной заявке на патент, номер публикации WO 00/24782, которая включена здесь путем ссылки. Такие молекулы могут быть экспрессированы, например, в клетках млекопи-1 021669 тающих (например, в клетках яичника китайского хомячка) или в бактериальных клетках (например, в клетках Е. coli). В определенных аспектах в изобретении предложены антитела, включающие тяжелую цепь и легкую цепь, где тяжелая цепь содержит константную область тяжелой цепи, выбранную из константных областей тяжелых цепей IgG1, IgG2, IgG3, IgG4, IgM, IgA и IgE или любого их аллельного варианта (как обсуждено в публикации Kabat et al., 1991, Sequences of Proteins of Immunological Interest, Fifth Edition,U.S. Department of Health and Human Services, NIH Publication No. 91-3242, включенной здесь путем ссылки), и вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность,как представлено в любой из последовательностей SEQ ID NO: 7-SEQ ID NO: 14, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. Антитело по изобретению содержит любую аминокислотную последовательность константной области тяжелой цепи IgG2, как представлено в последовательности SEQ ID NO: 41, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, либо аминокислотную последовательность константной области тяжелой цепи IgG1, как представлено в последовательности SEQ ID NO: 42, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В некоторых воплощениях антитела представляют собой моноклональные антитела, человеческие антитела или предпочтительно человеческие моноклональные антитела. В определенных аспектах в изобретении предложены антитела, включающие тяжелую цепь и легкую цепь, где легкая цепь содержит константную область, имеющую аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 43, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, и вариабельная область легкой цепи содержит аминокислотную последовательность, как представлено в любой из последовательностей SEQ ID NO: 1SEQ ID NO: 6, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В некоторых воплощениях антитела представляют собой моноклональные антитела, антитела человека или предпочтительно моноклональные антитела человека. В некоторых аспектах антитела по изобретению включают тяжелую цепь и легкую цепь, где вариабельная область тяжелой цепи содержит аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 7 или SEQ ID NO: 8, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В других аспектах вариабельная область легкой цепи содержит аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 1, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В других аспектах антитела по изобретению включают тяжелую цепь и легкую цепь, где вариабельная область тяжелой цепи содержит аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 9, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В других аспектах вариабельная область легкой цепи содержит аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 2, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В дополнительных аспектах тяжелая цепь содержит по меньшей мере один гипервариабельный участок (CDR), имеющий аминокислотную последовательность, как представлено в любой из последовательностей SEQ ID NO: 27-SEQ ID NO: 40, или его антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. Еще в дополнительных аспектах легкая цепь включает по меньшей мере одну CDR, имеющую аминокислотную последовательность, как представлено в любой из последовательностей SEQ ID NO: 15-SEQ ID NO: 26, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В изобретении также предложены антитела, которые специфично связываются с B7RP1, где тяжелая цепь содержит вариабельную область, содержащую аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 7 или SEQ ID NO: 8, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, и легкая цепь содержит вариабельную область, включающую аминокислотную последовательность, как представлено в последовательности SEQID NO: 1, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. Кроме того, в изобретении предложены антитела, которые специфично связываются с B7RP1, где тяжелая цепь содержит вариабельную область, содержащую аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 9, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, и легкая цепь содержит вариабельную область, содержащую аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 2, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В определенных аспектах в изобретении также предложены антитела, включающие тяжелую цепь и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи и где вариабельная область тяжелой цепи содержит последовательность, которая имеет по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%,94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% идентичности аминокислотной последо-2 021669 вательности, как представлено в любой из последовательностей SEQ ID NO: 7-SEQ ID NO: 14, и где легкая цепь содержит вариабельную область легкой цепи и где эта вариабельная область легкой цепи содержит последовательность, которая имеет по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% идентичности аминокислотной последовательности, как представлено в любой из последовательностей SEQ ID NO: 1-SEQ ID NO: 6, где антитело специфично связывается с B7RP1. В изобретении также предложены антитела, которые специфично связываются с B7RP1, где тяжелая цепь содержит аминокислотную последовательность, как представлено в последовательности SEQ IDNO: 44 или SEQ ID NO: 46, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, и легкая цепь содержит аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 45, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В изобретении также предложены антитела, которые специфично связываются с B7RP1, где тяжелая цепь содержит аминокислотную последовательность, как представлено в последовательности SEQ IDNO: 47, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, и легкая цепь содержит аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 48, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. В определенных аспектах в изобретении предложены антитела, включающие тяжелую цепь и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи и где эта вариабельная область тяжелой цепи содержит по меньшей мере одну CDR, имеющую последовательность, которая имеет по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% идентичности аминокислотной последовательности, как представлено в любой из последовательностей SEQ ID NO: 27-SEQ ID NO: 40, и где легкая цепь содержит вариабельную область легкой цепи и где эта вариабельная область легкой цепи содержит по меньшей мере одну CDR, имеющую аминокислотную последовательность, которая имеет по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере примерно 99% идентичности аминокислотной последовательности, как представлено в последовательностях SEQID NO: 15-SEQ ID NO: 26, где это антитело специфично связывается с B7RP1. В изобретении также предложены одноцепочечные антитела, одноцепочечные антитела Fv, антитела F(ab), антитела F(ab)' и антитела (Fab')2. В конкретных аспектах в изобретении предложена легкая цепь, содержащая аминокислотную последовательность, как представлено в последовательностях SEQ ID NO: 15-SEQ ID NO: 26, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. Кроме того, в изобретении предложена тяжелая цепь, содержащая аминокислотную последовательность, как представлено в любой из последовательностей SEQ ID NO: 27-SEQ ID NO: 40, или ее антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. Изобретение также относится к изолированным антителам человека, которые специфично связываются с B7RP1, где антитело включает (а) каркасные области тяжелой цепи человека, область CDR1 тяжелой цепи человека, область CDR2 тяжелой цепи человека и область CDR3 тяжелой цепи человека; и(б) каркасные области легкой цепи человека, область CDR1 легкой цепи человека, область CDR2 легкой цепи человека и область CDR3 легкой цепи человека. В определенных аспектах область CDR1 тяжелой цепи человека может представлять собой область CDR1 тяжелой цепи, как представлено в любой из последовательностей SEQ ID NO: 27, 30 или 35, и область CDR1 легкой цепи человека может представлять собой область CDR1 легкой цепи, как представлено в любой из последовательностей SEQ ID NO: 15, 18 или 24. В других аспектах область CDR2 тяжелой цепи человека может представлять собой областьCDR2 тяжелой цепи, как представлено в любой из последовательностей SEQ ID NO: 28, 31, 33, 36 или 39, и область CDR2 легкой цепи человека может представлять собой область CDR2 легкой цепи, как представлено в любой из последовательностей SEQ ID NO: 16, 19 или 21. Кроме того, в других аспектах область CDR3 тяжелой цепи человека представляет собой область CDR3 тяжелой цепи, как представлено в любой из последовательностей SEQ ID NO: 29, 32, 34, 37, 38 или 40, и область CDR3 легкой цепи человека представляет собой область CDR3 легкой цепи, как представлено в любой из последовательностейSEQ ID NO: 17, 20, 22, 23, 25 или 26. Антитела по изобретению характеризуются способностью специфично связываться с B7RP1. Кроме того, антитела по изобретению обладают способностью антагонизировать по меньшей мере одну активность in vitro и/или in vivo, связанную с полипептидами B7RP1. В изобретении предложены изолированные человеческие антитела против человеческого B7RP1 с высоким сродством связывания к полипептидам B7RP1, где эти антитела связываются с человеческим полипептидом B7RP1 и диссоциируют от человеческого полипептида B7RP1 с константой диссоциации (KD) примерно 10-6 М, 10-7 М, 10-8 М, 10-9 М,10-10 М, 10-11 М, 10-12 М или менее, как определено с использованием технологии KinExA, или которые ингибируют индуцированное B7RP1 выживание в анализе на нейтрализацию in vitro с ЕС 50 примерно 10-6-3 021669 М, 10-7 М, 10-8 М, 10-9 М, 10-10 М, 10-11 М, 10-12 М или менее. В изобретении также предложены изолированные антитела человека или их антигенсвязывающие или иммунологически функциональные фрагменты иммуноглобулина, которые специфично связываются с B7RP1, где эти антитела или фрагменты включают вариабельную область тяжелой цепи, содержащуюa) CDR1 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 27, CDR2 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 28, и CDR3 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 29; б) CDR1 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 30, CDR2 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 31, и CDR3 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 32; в) CDR1 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 27, CDR2 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 33, и CDR3 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 34; г) CDR1 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 35, CDR2 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 36, и CDR3 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 37; д) CDR1 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 27, CDR2 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 33, и CDR3 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 38; или е) CDR1 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 35, CDR2 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 39, и CDR3 тяжелой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 40. В изобретении также предложено изолированное антитело человека или его антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина, который специфично связывается сB7RP1, где это антитело или фрагмент включает вариабельную область легкой цепи, содержащую CDR1,CDR2 и CDR3 легкой цепи, гдеa) CDR1 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 15, CDR2 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 16, и CDR3 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 17; б) CDR1 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 18, CDR2 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 19, и CDR3 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 20; в) CDR1 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 15, CDR2 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 21, и CDR3 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 22; г) CDR1 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 18, CDR2 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 19, и CDR3 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 23; д) CDR1 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 24, CDR2 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 16, и CDR3 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 25; или е) CDR1 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 24, CDR2 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 16, и CDR3 легкой цепи имеет аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 26. В изобретении также предложены антитела, которые конкурируют с антителами, описанными здесь, за связывание с B7RP1. В определенных аспектах конкурирующее антитело по изобретению конкурирует за связывание антитела, которое содержит любую из последовательностей SEQ ID NO: 1-40, сB7RP1 человека. Часть изобретения также составляют полинуклеотидные последовательности, которые кодируют-4 021669 человеческие антитела против B7RP1 человека, векторы, содержащие полинуклеотидные последовательности, кодирующие человеческие антитела против B7RP1 человека, клетки-хозяева, трансформированные векторами, включающими полинуклеотиды, которые кодируют человеческие антитела противB7RP1 человека, препараты, содержащие человеческие антитела против B7RP1 человека, и способы их получения и применения. В изобретении также предложены способы обнаружения B7RP1 в биологическом образце, включающие стадию приведения в контакт образца с антителом по изобретению или его антигенсвязывающим фрагментом. Антитело анти-B7RP1 по изобретению можно применять при любом известном способе анализа, таком как анализы конкурентного связывания, прямые и косвенные сэндвич-анализы, анализы иммунопреципитации и твердофазные иммуноферментные анализы (ЭЛАЙЗА) (см. Sola, 1987, Monoclonal Antibodies: A Manual of Techniques, pp. 147-158, CRC Press, Inc.) для обнаружения и количественного определения B7RP1. Антитела могут связывать B7RP1 со сродством, которое является пригодным для используемого способа анализа. Кроме того, в изобретении предложены способы лечения заболевания, обусловленного повышенным продуцированием B7RP1, повышенной чувствительностью к B7RP1, и/или заболеваний, связанных с регуляцией Т-клеточных ответов, которые включают стадию введения индивидууму, нуждающемуся в этом, фармацевтически эффективного количества фармацевтической композиции, содержащей по меньшей мере одно антитело по изобретению или его антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина. Воплощения изобретения станут очевидными на основании приведенного ниже подробного описания и формулы изобретения. Краткое описание графических материалов На фиг. 1 А изображена последовательность вариабельной области антитела 16 Н (SEQ ID NO: 7) и последовательность вариабельной области соответствующего антитела 16 Н гаметического типа (16Hg)(SEQ ID NO: 8). На фиг. 1 Б изображены результаты анализов костимуляции с использованием анти-CD3 и гибридного белка hB7RP1-Fc, которые показывают, что 16Hg сохраняет свою биологическую активность по сравнению с 16 Н. На фиг. 2 показаны результаты анализов связывания Biacore с антителами 16 Н, 16Hg и 5D. На фиг. 3 показаны результаты анализа связывания по технологии KinExA с антителом 5D. На фиг. 4 показаны результаты анализа связывания по технологии KinExA с антителом 2 Н. На фиг. 5 показаны результаты анализа связывания по технологии KinExA с антителом 2 Н гаметического типа (2Hg). На фиг. 6 изображены результаты анализов конкурентного связывания, показывающие, что антитело 16 Н конкурирует за связывание ICOS-Fc на B7RP-1, что проанализировано проточной цитометрией. На фиг. 7 изображены обобщенные результаты анализа полиморфизма одного нуклеотида в ДНК(SNP, single nucleotide polymorphism) B7RP-1. На фиг. 8 изображены обобщенные результаты анализа ряда моноклональных антител против человеческого B7RP-1 в конкурентных анализах ЭЛАЙЗА. Показанные значения представляют собой IC50 для ингибирования связывания гибридного белка ICOS-Fc. На фиг. 9 А показано флуоресцентное окрашивание внеклеточного домена (ECD) B7RP1 мечеными антителами 16 Н, 5D и ICOS. На фиг. 9 Б показана сходная эффективность связывания антител 16 Н и 5D с SNP вариантом B7RP1. На фиг. 9 В изображены результаты анализов костимуляции с антителами 16 Н или 5D и SNP вариантами. На фиг. 10 А показаны результаты планшетного анализа костимуляции моноклональными антителами 1B7v2 по сравнению с рядом различных моноклональных антител против мышиного B7RP-1. На фиг. 10 Б, 10 В и 101 Г показаны результаты экспериментов по стимуляции антигеном, проведенных для моноспецифической антисыворотки IgM (фиг. 10 Б), IgG2a (фиг. 10 В) и IgG1 (фиг. 10 Г). На фиг. 11 изображены результаты ЭЛАЙЗА, показывающие, что уровни ИЛ-5 в сыворотке репрессированы антителами 1B7v2. На фиг. 12 А показано, что антитела 16 Н могут связываться с B7RP1 яванской макаки (правая панель) и B7RP1 человека (левая панель). На фиг. 12 Б показано, что антитела 16 Н, 16Hg и 5D могут ингибировать B7RP1/ICOS-зависимую активацию Т-клеток яванской макаки. На фиг. 13 А изображены индивидуальные и групповые средние значения титра яванской макаки на сутки 53 и на сутки 57 после вторичной стимуляции столбнячным анатоксином на сутки 42 у животных,обработанных антителами 16 Н. На фиг. 13 Б изображены индивидуальные и групповые средние значения титра яванской макаки на сутки 53 и на сутки 57 после вторичной стимуляции столбнячным анатоксином на сутки 42 у животных,обработанных антителами 5D. Подробное описание определенных воплощений Заголовки разделов, используемые здесь, приведены только в организационных целях и не должны рассматриваться как ограничивающие описанную сущность изобретения. Все ссылки, цитируемые в данной заявке, включены в этот документ путем прямой ссылки для любой цели. Определения Для синтеза рекомбинантной ДНК, олигонуклеотидов, а также тканевых культур и трансформации(например, электропорации, липофекции) можно использовать общепринятые методики. Ферментативные реакции и методики очистки могут быть осуществлены согласно инструкциям изготовителя или как их обычно выполняют в данной области техники, либо как описано здесь. Вышеописанные методики и процедуры, как правило, можно выполнять согласно методам, хорошо известным в данной области техники, и как описано в различных общих и более конкретных ссылках, которые цитированы и обсуждены на протяжении всего настоящего описания (см., например, публикацию Sambrook et al., 2001, MOLECULAR CLONING: A LABORATORY MANUAL, 3d ed., Cold Spring Harbor Laboratory Press, Cold SpringHarbor, N.Y., которая включена здесь путем ссылки для любой цели). Если не приведены специальные определения, номенклатура, используемая в этой связи, а также лабораторные методики и методы аналитической химии, химии органического синтеза и медицинской и фармацевтической химии, описанные здесь, являются такими, как хорошо известно и обычно используется в данной области техники. Подобным образом, общепринятые методики можно использовать для химических синтезов, химических анализов, изготовления фармацевтических препаратов, технологии изготовления лекарственных средств и их доставки, а также лечения пациентов. Следует понимать, что если не указано иное, используемые в соответствии с настоящим описанием следующие термины имеют приведенные ниже значения. Выражения "биологическое свойство", "биологическая характеристика" и термин "активность" при ссылке на антитело по настоящему изобретению используют здесь взаимозаменяемо, и они включают, но не ограничены, сродство и специфичность к эпитопу (например, связывание человеческого антитела против B7RP1 человека с B7RP1 человека), способность антагонизировать активность целевого полипептида (например, активность B7RP1), стабильность антитела in vivo и иммуногенные свойства антитела. Другие идентифицируемые биологические свойства или характеристики антитела, признанные в данной области техники, включают, например, перекрстную реактивность (то есть с не человеческими гомологами B7RP1 или вообще с другими белками или тканями) и способность сохранять высокие уровни экспрессии белка в клетках млекопитающих. Вышеупомянутые свойства или характеристики можно наблюдать или измерять с использованием методик, признанных в данной области техники, которые включают, но не ограничены, ЭЛАЙЗА, конкурентный ЭЛАЙЗА, анализ поверхностного плазмонного резонанса, анализы на нейтрализацию in vitro и invivo (например, пример 2) и иммуногистохимию со срезами ткани из различных источников, включая человека, приматов или любой другой соответствующий источник. Конкретные активности и биологические свойства человеческих антител против B7RP1 человека подробно описаны ниже в примерах. Термин "изолированный полинуклеотид", используемый здесь, означает полинуклеотид геномной ДНК, кДНК, РНК или нуклеиновой кислоты синтетического происхождения, либо их некоторой комбинации, где по своему происхождению изолированный полинуклеотид (1) не связан с полноразмерным полинуклеотидом или его участком, с которым изолированный полинуклеотид обнаруживают в природе,(2) сцеплен с полинуклеотидом, с которым он не сцеплен в природе, или (3) не встречается в природе в виде части большей последовательности. Термин "полинуклеотид", упоминаемый здесь, означает однонитевые или двунитевые полимеры нуклеиновой кислоты длиной по меньшей мере 10 нуклеотидов. В определенных воплощениях нуклеотиды, составляющие полинуклеотид, могут представлять собой рибонуклеотиды или дезоксирибонуклеотиды, либо модифицированную форму любого типа нуклеотида. Указанные модификации включают модификации оснований, такие как бромуридин, модификации рибозы, такие как арабинозид и 2',3'дидезоксирибоза, и модификации межнуклеотидной связи, такие как фосфоротиоат, фосфородитиоат,фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфораниладат и фосфороамидат. Термин"полинуклеотид" конкретно включает однонитевые и двунитевые формы ДНК или РНК. Термин "олигонуклеотид", упоминаемый здесь, включает природные и модифицированные нуклеотиды, сшитые вместе с помощью природных и/или неприродных олигонуклеотидных связей. Олигонуклеотиды представляют собой подгруппу полинуклеотидов, включающую члены, которые обычно являются однонитевыми и имеют длину 200 нуклеотидов или менее. В определенных воплощениях олигонуклеотиды имеют длину 10-60 нуклеотидов. В определенных воплощениях олигонуклеотиды имеют длину 12, 13, 14, 15, 16, 17, 18, 19 или 20-40 нуклеотидов. Олигонуклеотиды могут быть однонитевыми или двунитевыми, например, для использования при конструировании генетического мутанта. Олигонуклеотиды по изобретению могут представлять собой смысловые или антисмысловые олигонуклеотиды в отношении последовательности, кодирующей белок. Термин "природные нуклеотиды" включает дезоксирибонуклеотиды и рибонуклеотиды. Термин"модифицированные нуклеотиды" включает нуклеотиды с модифицированными или замещенными сахарными группами и тому подобное. Термин "олигонуклеотидные связи" включает олигонуклеотидныеAcids Res., 14: 9081; Stec et al., 1984, J. Am. Chem. Soc., 106: 6077; Stein et al., 1988, Nucl. Acids Res., 16: 3209; Zon et al., 1991, Anti-Cancer Drug Design, 6: 539; Zon et al., 1991, OLIGONUCLEOTIDES AND ANALOGUES: A PRACTICAL APPROACH, pp. 87-108 (F.Eckstein, Ed.), Oxford University Press, Oxford England; Stec et al., US Pat. No. 5151510; Uhlmann and Peyman, 1990, Chemical Reviews, 90: 543, описание которых включено здесь путем ссылки для любых целей). Олигонуклеотид может включать обнаружимую метку для обеспечения обнаружения этого олигонуклеотида или его гибридизации. Термин "изолированный белок", упоминаемый здесь, означает, что обсуждаемый белок (1) свободен, по меньшей мере, от некоторых других белков, с которыми он должен находиться в природе, (2) по существу, свободен от других белков из того же источника, например, из тех же видов, (3) экспрессируется клеткой из другого вида, (4) отделен по меньшей мере примерно от 50 процентов полинуклеотидов,липидов, углеводов или других веществ, с которыми он связан в природе, (5) не связан (путем ковалентного или нековалентного взаимодействия) с участками белка, с которыми "изолированный белок" связан в природе, (6) оперативно связан (путем ковалентного или нековалентного взаимодействия) с полипептидом, с которым он не связан в природе, или (7) не встречается в природе. Такой изолированный белок может кодироваться геномной ДНК, кДНК, мРНК или другой РНК синтетического происхождения или любой их комбинацией. В одном воплощении изолированный белок, по существу, свободен от белков или полипептидов или других загрязняющих веществ, которые находятся в его естественном окружении,которые препятствовали бы его применению (терапевтическому, диагностическому, профилактическому,в исследованиях или другому)."Изолированное" антитело представляет собой антитело, которое было идентифицировано и отделено и/или выделено из компонента его естественного окружения. Компоненты загрязняющего вещества его естественного окружения представляют собой вещества, которые препятствовали бы диагностическим или терапевтическим применениям антитела и могут включать ферменты, гормоны и другие белковые или небелковые вещества. В определенных воплощениях антитело очищено (1) до более чем 95% мас./мас. или более чем 99% мас./мас. антитела, как определено методом Лоури, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности путем использования секвенатора с вращающимся стаканом или (3) до однородности на основании электрофореза в ДСН-ПААГ (полиакриламидном геле с додецилсульфатом натрия) в восстанавливающих или не восстанавливающих условиях с использованием окрашивания Кумасси синим или серебром. Изолированное антитело включает антитело in situ внутри рекомбинантных клеток, поскольку отсутствует по меньшей мере один компонент естественного окружения этого антитела. Термины "полипептид" или "белок" означают молекулы, имеющие последовательность нативных белков, то есть белков, продуцируемых природными, а конкретно не рекомбинантными клетками, либо сконструированными путем генной инженерии или рекомбинантными клетками, и включают молекулы,имеющие аминокислотную последовательность нативного белка, или молекулы, имеющие делеции, добавления и/или замены одной или более чем одной аминокислоты нативной последовательности. Термины "полипептид" и "белок" конкретно охватывают антитела анти-B7RP1 или последовательности, которые имеют делеции, добавления и/или замены одной или более чем одной аминокислоты антитела антиB7RP1. Термин "фрагмент полипептида" относится к полипептиду, который имеет аминоконцевую делецию, карбоксильно-концевую делецию и/или внутреннюю делецию. В определенных воплощениях фрагменты имеют длину по меньшей мере от 5 до примерно 500 аминокислот. Понятно, что в определенных воплощениях фрагменты имеют длину по меньшей мере 5, 6, 8, 10, 14, 20, 50, 70, 100, 110, 150,200, 250, 300, 350, 400 или 450 аминокислот. В частности, полезные фрагменты полипептида включают функциональные домены, включающие связывающие домены, в частности антигенсвязывающие домены, особенно те, где антиген представляет собой эпитоп B7RP1 человека. В случае антитела анти-B7RP1 полезные фрагменты включают, но не ограничены, область CDR, вариабельную область тяжелой или легкой цепи, участок цепи антитела или только ее вариабельной области, включая две CDR и тому подобное. Термин "специфично связывающийся агент" относится к природной или неприродной молекуле,которая специфично связывается с мишенью. Примеры специфично связывающихся агентов включают,но не ограничены, белки, пептиды, нуклеиновые кислоты, углеводы и липиды. В определенных воплощениях специфично связывающийся агент представляет собой антитело. Термин "агент, специфично связывающийся с B7RP1" относится к специфично связывающемуся агенту, который специфично связывает любой участок B7RP1. В определенных воплощениях агент, специфично связывающийся с B7RP1,представляет собой антитело, которое специфично связывается с B7RP1. Для примера, антитело "связывается специфично" с мишенью, если меченое антитело может быть конкурентно вытеснено от своей мишени соответствующим немеченым антителом. Термин "иммунологически функциональный фрагмент иммуноглобулина", используемый здесь,относится к фрагменту полипептида, который содержит, по меньшей мере, CDR-области тяжелых и лег-7 021669 ких цепей иммуноглобулина. Иммунологически функциональный фрагмент иммуноглобулина по изобретению способен связываться с антигеном. В определенных воплощениях антиген представляет собой лиганд, который специфично связывается с рецептором. В этих воплощениях связывание иммунологически функционального фрагмента иммуноглобулина по изобретению предотвращает связывание лиганда с его рецептором, прерывая биологический ответ в результате связывания лиганда с рецептором. В одном воплощении иммунологически функциональный фрагмент иммуноглобулина по изобретению специфично связывается с B7RP1. Предпочтительно фрагмент специфично связывается с B7RP1 человека. Термин "природный" или "нативный", используемый здесь и применимый к объекту, относится к тому факту, что объект может быть обнаружен в природе. Например, полипептидная или полинуклеотидная последовательность, которая присутствует в организме (включая вирусы), которая может быть выделена из природного источника и которая не была преднамеренно модифицирована человеком, является природной. Термин "неприродный" или "ненативный", используемый здесь, относится к веществу,которое не обнаруживается в природе или которое было структурно модифицировано или синтезировано человеком. Например, термин "неприродный" может относиться к варианту, такому как вариант полинуклеотида, который может быть получен с использованием известных в данной области техники методик мутагенеза, или к варианту полипептида, продуцируемому таким вариантом полинуклеотида. Такие варианты включают, например, варианты, полученные путем замен, делеций или добавлений нуклеотидов, которые могут включать один или более чем один нуклеотид. Варианты полинуклеотида могут быть изменены в кодирующих или некодирующих областях или и в тех и в других. Изменения в кодирующих областях могут вызвать консервативные или неконсервативные аминокислотные замены, делеций или добавления. Особенно надежными из них являются "молчащие" замены, добавления, делеции и консервативные замены, которые не изменяют свойства и активность антитела B7RP1 по изобретению. Специалист в данной области техники может легко определить, как получить такой вариант, используя методы,известные в данной области техники. Термин "оперативно сцепленный" означает, что компоненты, к которым применяют этот термин,находятся во взаимоотношениях, которые позволяют им осуществлять свойственные им функции при подходящих условиях. Например, регуляторная последовательность, "оперативно сцепленная" с кодирующей последовательностью белка, лигирована с ней таким образом, что экспрессия кодирующей последовательности белка достигается в условиях, совместимых с транскрипционной активностью этих регуляторных последовательностей. Термин "регуляторная последовательность", используемый здесь, относится к полинуклеотидным последовательностям, которые могут осуществлять экспрессию, процессинг или внутриклеточную локализацию кодирующих последовательностей, с которыми они оперативно сцеплены. Природа таких регуляторных последовательностей может зависеть от организма-хозяина. В конкретных воплощениях регуляторные последовательности для прокариотов могут включать промоторы, сайт связывания рибосомы и последовательность терминации транскрипции. В других конкретных воплощениях регуляторные последовательности для эукариотов могут включать промоторы, содержащие один или множество сайтов распознавания факторов транскрипции, последовательностей транскрипционных энхансеров, последовательностей терминации транскрипции и последовательностей полиаденилирования. В определенных воплощениях "регуляторные последовательности" могут включать лидерные последовательности и/или последовательности членов гибридной пары. Термин "вектор" включает молекулу нуклеиновой кислоты, способную к переносу в клетку другой нуклеиновой кислоты, с которой он сцеплен. Один тип вектора представляет собой "плазмиду", которая относится к кольцевой двунитевой петле ДНК, в которой могут быть лигированы дополнительные сегменты ДНК. Другой тип вектора представляет собой вирусный вектор, где дополнительные сегменты ДНК могут быть лигированы в вирусном геноме. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальную точку начала репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геноме клетки-хозяина при введении в клетку-хозяина и, таким образом, реплицируются параллельно с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они оперативно сцеплены. Такие векторы упомянуты здесь как "рекомбинантные экспрессионные векторы" (или просто "экспрессионные векторы"). Обычно экспрессионные векторы, полезные в практике методик рекомбинантных ДНК, часто находятся в форме плазмид. В настоящем описании "плазмида" и "вектор" могут использоваться взаимозаменяемо, поскольку плазмида является наиболее распространенно используемой формой вектора. Однако в изобретение следует включать такие другие формы экспрессионных векторов, как вирусные векторы (например, ретровирусы, дефектные по репликации, аденовирусы и аденоассоциированные вирусы), которые выполняют эквивалентные функции. Выражение "рекомбинантная клетка-хозяин" (или просто "клетка-хозяин") включает клетку, в которую был введен рекомбинантный экспрессионный вектор. Специалистам в данной области техники понятно, что такие термины следует относить не только к конкретной клетке, но и к потомству такой клетки. Поскольку некоторые модификации могут встречаться в последующих поколениях вследствие-8 021669 либо мутации, либо влияний окружающей среды, такое потомство фактически может не быть идентичным родительской клетке, но все же включено в объем термина "клетка-хозяин", используемого здесь. Для экспрессии антител по настоящему изобретению можно использовать широкое разнообразие экспрессионных систем-хозяев, включая экспрессионные системы бактерий, дрожжей, бакуловирусов и млекопитающих (а также экспрессионные системы фагового дисплея). Примером подходящего вектора для бактериальной экспрессии является pUC19. Чтобы экспрессировать антитело рекомбинантным путем, клетку-хозяина трансфецируют одним или более чем одним рекомбинантным экспрессионным вектором, несущим фрагменты ДНК, кодирующие легкие и тяжелые цепи иммуноглобулина этого антитела таким образом, что эти легкие и тяжелые цепи экспрессируются в клетке-хозяине и могут секретироваться в среду, в которой культивируют эти клетки-хозяева и из которой могут быть выделены эти антитела. Стандартные методологии рекомбинантных ДНК используют для получения генов тяжелой и легкой цепи антитела, включения этих генов в рекомбинантные экспрессионные векторы и введения этих векторов в клетки-хозяева, например, описаны в публикациях Sambrook et al. (2001, MOLECULAR CLONING,A LABORATORY MANUAL, Cold Spring Harbor Laboratories, Ausubel, F.M. et al. (eds.), CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Greene Publishing Associates, (1989) и патенте США 4816397 авторов Boss et al.). Термин "трансдукция" используют по отношению к переносу генов от одной бактерии к другой,обычно посредством фага. "Трансдукция" также относится к приобретению и переносу эукариотических клеточных последовательностей посредством ретровирусов. Термин "трансфекция" используют по отношению к захвату чужеродной или экзогенной ДНК клеткой, и клетка "трансфецирована", когда экзогенная ДНК введена внутрь клеточной мембраны. Ряд методик трансфекции хорошо известен в данной области техники и раскрыт здесь (см., например, публикацииMANUAL, Cold Spring Harbor Laboratories; Davis et al., 1986, BASIC METHODS IN MOLECULAR BIOLOGY, Elsevier; и Chu et al., 1981, Gene 13: 197). Такие методики можно использовать для введения одного или более чем одного экзогенного фрагмента ДНК в подходящие клетки-хозяева. Термин "трансформация", используемый здесь, относится к изменению в генетических характеристиках клетки, и клетка трансформирована, когда ее модифицируют таким образом, чтобы она содержала новую ДНК. Например, клетка трансформирована, если она генетически модифицирована из ее нативного состояния. После трансфекции или трансдукции трансформирующая ДНК может рекомбинировать с ДНК клетки путем физической интеграции в хромосому клетки, либо может временно поддерживаться в виде эписомного элемента без репликации, либо может реплицироваться независимо в виде плазмиды. Клетку считают стабильно трансформированной, когда ДНК реплицируется при делении клетки. Термин "антиген" относится к молекуле или участку молекулы, которые способны к связыванию избирательно связывающим агентом, таким как антитело, и дополнительно способны к использованию у животного для продуцирования антител, способных к связыванию с эпитопом этого антигена. Антиген может иметь один или более чем один эпитоп. В определенных воплощениях варианты антитела включают варианты гликозилирования, где число и/или тип сайта гликозилирования изменены по сравнению с аминокислотными последовательностями исходного полипептида. В определенных воплощениях варианты белка включают большее или меньшее число N-связанных сайтов гликозилирования, чем нативный белок. N-связанный сайт гликозилирования характеризуется последовательностью Asn-Xaa-Ser или Asn-Xaa-Thr, где аминокислотный остаток, обозначенный как Хаа, может представлять собой любой аминокислотный остаток, за исключением пролина. Замена аминокислотных остатков для создания этой последовательности обеспечивает потенциально новый сайт для присоединения N-связанной углеводной цепи. Альтернативно замены, которые элиминируют эту последовательность, удаляют существующую N-связанную углеводную цепь. Также обеспечивается перегруппировка N-связанных углеводных цепей, где удаляют один или более чем один Nсвязанный сайт гликозилирования (обычно тот, который является природным) и создают один или более чем один новый N-связанный сайт. Дополнительные варианты антитела включают варианты цистеина,где один или более чем один остаток цистеина делетируют или заменяют другой аминокислотой (например, серином) по сравнению с исходной аминокислотной последовательностью. Варианты цистеина могут быть полезны, когда антитела должны быть повторно уложены в биологически активную конформацию, например, после выделения нерастворимых телец включения. Варианты цистеина обычно имеют меньше остатков цистеина, чем нативный белок, и обычно имеют четное число, чтобы минимизировать взаимодействия за счет неспаренных остатков цистеина. В дополнительных воплощениях варианты антитела могут включать антитела, содержащие модифицированный фрагмент Fc или модифицированную константную область тяжелой цепи. Фрагмент Fc,что означает "фрагмент, который кристаллизуется", или константная область тяжелой цепи могут быть модифицированы посредством мутации, чтобы придать антителу измененные характеристики связывания (см., например, публикации Burton and Woof, 1992, Advances in Immunology 51: 1-84; Ravetch andTelleman and Junghans, 2000, Immunology 100: 245-251; Medesan et al., 1998, Eur. J. Immunol. 28: 2092-9 021669 2100; все из которых включены здесь путем ссылки). Такие мутации могут включать замены, добавления, делеции или любую их комбинацию, и типично их получают путем сайт-направленного мутагенеза с использованием одного или более чем одного мутагенного олигонуклеотида(ов) согласно методам,описанным здесь, а также согласно методам, известным в данной области техники (см., например, публикации Sambrook et al., MOLECULAR CLONING: A LABORATORY MANUAL, 3rd Ed., 2001, ColdCloning Techniques. 1987, Academic Press, Inc., San Diego, CA., которые включены здесь путем ссылки). Согласно определенным воплощениям аминокислотные замены могут (1) уменьшать чувствительность к протеолизу, (2) уменьшать чувствительность к окислению, (3) изменять связывающее сродство и/или (4) придавать или изменять другие физико-химические или функциональные свойства таких полипептидов. Согласно определенным воплощениям единичные или множественные замены аминокислот (в определенных воплощениях консервативные замены аминокислот) могут быть произведены в природной последовательности (в определенных воплощениях в участке полипептида вне домена(ов), образующего межмолекулярные контакты). В определенных воплощениях консервативная аминокислотная замена обычно существенно не изменяет структурные характеристики исходной последовательности (например,замененная аминокислота должна разрушать или иметь тенденцию к разрушению вторичной структуры,которая характеризует исходную последовательность, такой как спираль). Примеры вторичных и третичных полипептидных структур, известных в данной области техники, описаны в публикациях PROTEINS, STRUCTURES AND MOLECULAR PRINCIPLES Creighton, Ed.), 1984, W.H. Freeman and Company, New York; INTRODUCTION TO PROTEIN STRUCTURE (C. Branden and J. Tooze, eds.), 1991, Garland Publishing, New York, N.Y.; и Thornton et al., 1991, Nature 354:105, каждая из которых включена здесь путем ссылки)."Антитело" или "пептид(ы) антитела" относятся к интактному антителу или его связывающему фрагменту, который конкурирует с интактным антителом за специфичное связывание. В определенных воплощениях связывающие фрагменты продуцируют с помощью методик рекомбинантных ДНК. В дополнительных воплощениях связывающие фрагменты получают путем ферментативного или химического расщепления интактных антител. Связывающие фрагменты включают, но не ограничены, F(ab), F(ab'),F(ab')2, Fv и одноцепочечные антитела. В изобретении предложены антитела, которые включают тяжелую цепь и легкую цепь, где тяжелая и легкая цепи вместе образуют антигенсвязывающую структуру, способную к специфичному связыванию B7RP1. Полноразмерная тяжелая цепь включает домен вариабельной области VH и три домена константной области, CH1, CH2 и CH3. Домен VH находится на аминоконце полипептида, а домен CH3 находится на карбоксильном конце. Термин "тяжелая цепь", используемый здесь, охватывает полноразмерную тяжелую цепь и ее фрагменты. Полноразмерная легкая цепь включает домен вариабельной областиVL и домен константной области CL. Подобно тяжелой цепи домен вариабельной области легкой цепи находится на аминоконце полипептида. Термин "легкая цепь", используемый здесь, охватывает полноразмерную легкую цепь и ее фрагменты. Фрагмент F(ab) состоит из одной легкой цепи и CH1 и вариабельных областей одной тяжелой цепи. Тяжелая цепь молекулы F(ab) не может образовывать дисульфидную связь с другой молекулой тяжелой цепи. Фрагмент F(ab') содержит одну легкую цепь и одну тяжелую цепь, которая содержит большую часть константной области между доменами CH1 и CH2, так что между двумя тяжелыми цепями может быть образована межцепочечная дисульфидная связь с образованием молекулы F(ab')2. Область Fv включает вариабельные области, как от тяжелых, так и от легких цепей, но не имеет константных областей. Одноцепочечные антитела представляют собой молекулы Fv,в которых вариабельные области тяжелой и легкой цепи соединены гибким линкером с образованием единой полипептидной цепи, которая образует антигенсвязывающую область. Одноцепочечные антитела обсуждены подробно в международной заявке на патент, номер публикации WO 88/01649, а также в патентах США 4946778 и 5260203. Двухвалентное (нормальное) антитело, иное чем "полное" или "многофункциональное" антитело, в определенных воплощениях понимают как содержащее сайты связывания, имеющие идентичную антигенную специфичность. При оценке связывания и специфичности антитела согласно изобретению антитело существенно ингибирует адгезию лиганда к рецептору, когда избыток антитела уменьшает количество лиганда, связанного с рецептором, по меньшей мере примерно на 20%, 40%, 60%, 80%, 85% или более (как измерено,среди прочего, с использованием конкурентных анализов связывания in vitro). Под "нейтрализующим антителом" понимают молекулу антитела, которая способна блокировать или существенно снижать функцию эффектора целевого антигена, с которым она связывается. Соответственно, "нейтрализующее" антитело анти-B7RP1 способно блокировать или существенно снижать функцию эффектора B7RP1, такую как связывание рецептора и/или формирование клеточного ответа."Существенно снижать" предназначен для обозначения по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 75%, по меньшей мере примерно 80%, по меньшей мере примерно 85% или по меньшей мере примерно 90% снижения функции эффектора целевого антигена- 10021669 Термин "эпитоп" включает любой сайт на антигене, который способен к специфичному связыванию с иммуноглобулином или рецептором Т-клетки. В определенных воплощениях детерминанты эпитопа включают химически активные поверхностные группировки молекул, такие как аминокислоты, боковые цепи сахаров, фосфорильные группы или сульфонильные группы, и в определенных воплощениях могут иметь специфичные трехмерные структурные характеристики и/или специфичные зарядные характеристики. Эпитоп представляет собой область антигена, которая связывается антителом. В определенных воплощениях антитело считают специфично связывающим антиген, когда оно предпочтительно распознает свой антиген-мишень в сложной смеси белков и/или макромолекул. В определенных воплощениях антитело считают специфично связывающим антиген, когда константа диссоциации равновесия равна примерно 10-6 М, 10-7 М, 10-8 М, 10-9 М, 10-10 М, 10-11 М, 10-12 M или менее чем 10-12 М. Антитело связывает "по существу, тот же эпитоп", что и эталонное антитело, когда эти два антитела распознают идентичные или пространственно перекрывающиеся эпитопы. Наиболее широко используемыми и быстрыми методами определения того, связываются ли два антитела с идентичными или пространственно перекрывающимися эпитопами, являются конкурентные анализы связывания, которые могут быть адаптированы ко всем видам различных форматов с использованием либо меченого антигена,либо меченого антитела. Обычно антиген иммобилизуют на субстрате и измеряют способность немеченых антител блокировать связывание меченых антител, используя радиоактивные изотопы или ферментные метки. Термин "агент" используют здесь для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, которые получены из биологических материалов. Используемые здесь термины "метка" или "меченый" относятся к включению обнаружимого маркера, например, путем включения радиоактивно меченой аминокислоты или присоединения к полипептиду биотиновых группировок, которые могут быть обнаружены с помощью меченого авидина (например, стрептавидина, содержащего обнаружимый маркер, такой как флуоресцентный маркер, хемилюминесцентный маркер или ферментативная активность, что может быть обнаружено оптическими или колориметрическими методами). В определенных воплощениях метка может также быть терапевтической. Различные методы мечения полипептидов и гликопротеинов известны в данной области техники и могут быть выгодно использованы в способах, раскрытых здесь. Примеры меток для полипептидов включают,но не ограничены, радиоизотопы или радионуклиды, такие как 3 Н, 14 С, 15N, 35S, 90Y, 99mTc, 111In, 125I и 131I,флуоресцентные метки (например, флуоресцеинизотиоцианат, или ФИТЦ, родамин или лантаноидные люминофоры), ферментативные метки (например, пероксидазу хрена, -галактозидазу, люциферазу, щелочную фосфатазу), хемилюминесцентные метки, гаптеновые метки, такие как биотиниловые группы, и предопределенные эпитопы полипептида, распознаваемые вторичным репортером (например, парные последовательности "лейциновой молнии", сайты связывания вторичных антител, домены, связывающие металлы, или эпитопные метки). В определенных воплощениях метки присоединяют с помощью спейсерных групп (например, (СН 2)n, где nпримерно 20) различной длины для уменьшения потенциальных пространственных препятствий. Термин "биологический образец", используемый здесь, включает, но не ограничен, любое количество вещества от живого существа или прежде жившего существа. Такие живые существа включают, но не ограничены, людей, мышей, обезьян, крыс, кроликов и других животных. Такие вещества включают,но не ограничены, кровь, сыворотку, мочу, клетки, органы, ткани, кости, костный мозг, лимфатические узлы и кожу. Термин "фармацевтический агент или лекарственное средство", используемый здесь, относится к химическому соединению или композиции, которые способны вызывать желаемый терапевтический эффект при правильном введении пациенту. Выражение "фармацевтически эффективное количество" при ссылке на фармацевтическую композицию, содержащую одно или множество антител по изобретению,согласно изобретению понимают как означающее количество указанной фармацевтической композиции,которое способно прекращать у пациента снижение порога чувствительности к внешним стимулам с возвратом этого порога чувствительности к уровню, сравнимому с наблюдаемым у здоровых субъектов."Расстройство" представляет собой любое состояние, при котором благоприятно лечение согласно настоящему изобретению. "Расстройство" и "состояние" используют здесь взаимозаменяемо, и они включают хронические и острые расстройства иммунной системы или заболевания иммунной системы,обусловленные неадекватным иммунным ответом, включая такие патологические состояния, которые предрасполагают млекопитающее к рассматриваемому расстройству. Ряд состояний и расстройств, при которых благоприятно лечение согласно настоящему изобретению, описан, например, в международной заявке на патент PCT/US 00/01871 (номер публикации WO 00/46240), описание которой включено путем ссылки в полном объеме. Термины "заболевание иммунной системы" и "состояние иммунной системы" охватывают любые медицинские состояния или расстройства, обусловленные повышенными уровнями B7RP1, повышенной чувствительностью к B7RP1, или заболевания, опосредованные Т-клетками, включающие, но не ограниченные, аутоиммунное заболевание, приживаемость трансплантата, трансплантацию костного мозга и- 11021669 органа, аллосенсибилизацию при переливании крови, синдром токсического шока, заболевания, зависимые от Т-клеток и опосредованные В-клетками, хронические воспалительные заболевания, обусловленные хронической дисфункцией иммунных клеток, лимфопролиферативные расстройства (такие как множественная миелома, макроглобулинемия Вальденстрема и криоглобулинемии) и рак. Не ограничивающие примеры аутоиммунных заболеваний включают системную красную волчанку, ревматоидный артрит, иммунную тромбоцитопеническую пурпуру (ИТП), рассеянный склероз, диабет и псориаз. Не ограничивающие примеры хронических воспалительных заболеваний включают воспалительное кишечное заболевание (например, болезнь Крона и неспецифический язвенный колит), болезнь Грейвса, тиреоидит Хасимото и сахарный диабет. Термины "заболевание иммунной системы" и "состояние иммунной системы" также охватывают любое клиническое состояние, которое можно облегчить посредством ингибирования продуцирования антитела, такое как аллергические реакции. Аллергические реакции могут быть вызваны, например, сенной лихорадкой, аллергиями, астмой, атопией и острым отеком. Не ограничивающие примеры заболеваний, которые вызывают опосредованные антителами аллергические реакции, включают системную красную волчанку, артрит (такой как ревматоидный артрит, реактивный артрит, псориатический артрит),нефропатии (такие как гломерулонефрит, мембранная, мезангиокапиллярная, фокально-сегментарная,фокально-некротическая, полулунная и пролиферативная нефропатии, например, тубулярные нефропатии), кожные расстройства (такие как пемфигус и пемфигоид, узловатая эритема), заболевания желез внутренней секреции (такие как тиреоидит, болезнь Грейвса, болезнь Хасимото, инсулинозависимый сахарный диабет), различные пневмопатии (такие как экзогенный аллергический альвеолит), различные вазопатии, целиакию, заболевания, обусловленные аберрантным продуцированием IgA, многие анемии и тромбоцитопении, синдром Гийена-Барре и тяжелую миастению. Используемые здесь термины "эффективное количество" и "терапевтически эффективное количество" при использовании по отношению к наполнителю или фармацевтической композиции, содержащей одно или более чем одно человеческое антитело против B7RP1 человека, относятся к количеству или дозировке, которые достаточны для получения желаемого результата (то есть, где для терапии с носителем или человеческими антителами против B7RP1 человека по настоящему изобретению желаемым результатом является, например, желаемое модулирование Т-клеточных ответов) или для поддержания наблюдаемого снижения уровня одной или более чем одной биологической активности B7RP1. Более конкретно терапевтически эффективное количество представляет собой количество человеческого антитела(антител) против B7RP1 человека, достаточное для ингибирования в течение некоторого периода времени одного или более чем одного клинически определенного патологического процесса, обусловленного рассматриваемым состоянием, например, иммунных расстройств и заболеваний, у субъекта, которого лечат этим агентом in vivo. В настоящем изобретении "эффективное количество" антитела антиB7RP1 может модулировать Т-клеточные ответы у пациента. В способах по настоящему изобретению термин "контроль" и его грамматические варианты используют по отношению к предупреждению, частичному или полному ингибированию, уменьшению, задержке или замедлению нежелательного события, например, иммунного ответа. Эффективное количество может варьировать в зависимости от конкретного выбранного носителя или человеческого антитела (антител) против B7RP1 человека, а также зависит от разнообразия факторов и условий, связанных с субъектом, подлежащим лечению, и от тяжести расстройства. Например, если носитель или человеческое антитело(а) против B7RP1 человека нужно вводить in vivo, среди прочего следует учитывать такие факторы, как возраст, массу и состояние здоровья пациента, а также кривые доза-ответ и данные по токсичности, полученные в доклинических испытаниях на животных. Если агент нужно приводить в контакт с клетками in vitro, можно также разработать разнообразные доклинические исследования in vitro, чтобы оценить такие параметры, как всасывание, период полувыведения, дозу, токсичность и т.д. Определение эффективного количества или терапевтически эффективного количества для данного агента находится в пределах компетенции специалистов в данной области техники. Используемые здесь термины "В 7-связанный белок-1" и "B7RP1" определены как все виды нативной последовательности B7RP1 млекопитающих, которая описана в международной заявке на патент,номер публикации WO 00/46240, которая включена здесь путем ссылки. Используемые здесь термины "по существу, чистый" или "по существу, очищенный" означает соединение или тип молекулы, которые составляют преобладающий присутствующий тип (то есть на молярной основе они составляют большее количество, чем любые другие индивидуальные типы молекул в композиции). В определенных воплощениях, по существу, очищенная фракция представляет собой композицию, где тип молекул включает по меньшей мере примерно 50 процентов (на молярной основе) всех присутствующих типов макромолекул. В определенных воплощениях, по существу, чистая композиция содержит более чем примерно 80%, 85%, 90%, 95% или 99% всех типов макромолекул, присутствующих в композиции. В определенных воплощениях тип молекул очищают до существенной однородности (загрязняющие типы молекул не могут быть обнаружены в композиции общепринятыми методами обнаружения), где эта композиция состоит, по существу, из единственного типа макромолекул. Термин "пациент" включает субъектов человека и животных."Лечение" или "лечить" относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Нуждающиеся в лечении включают тех, кто уже страдает расстройством, а также тех, кто склонен к этому расстройству, или тех, у кого нужно предупреждать это расстройство. Если контекст не требует иного, термины в единственном числе включают термины во множественном числе, а термины во множественном числе включают термины в единственном числе. Согласно определенным воплощениям изобретения антитела, направленные на B7RP1, можно применять для лечения расстройств иммунной системы и заболеваний иммунной системы, включая, но не ограничиваясь ими, упомянутые выше. В одном аспекте изобретения предложены полностью человеческие моноклональные антитела, вызванные против B7RP1 человека и обладающие биологической и иммунологической специфичностью связывания с ним. В другом аспекте в изобретении предложены нуклеиновые кислоты, включающие нуклеотидные последовательности, кодирующие аминокислотные последовательности для тяжелых и легких цепей молекул иммуноглобулина, в частности последовательности, соответствующие их вариабельным областям. Конкретные воплощения данного аспекта изобретения представляют собой последовательности, соответствующие гипервариабельным участкам (CDR), а именно CDR1-CDR3, тяжелых и легких цепей, предложенных изобретением. Еще в одном аспекте в изобретении предложены клетки и клеточные линии гибридом, которые экспрессируют молекулы иммуноглобулина и антитела, такие как моноклональные антитела по изобретению. В изобретении также предложены биологически и иммунологически очищенные препараты антител, таких как моноклональные антитела, вызванные противB7RP1 человека и обладающие биологической и иммунологической специфичностью связывания с ним. Возможность клонировать и реконструировать человеческие локусы размера мегабаз в искусственных хромосомах дрожжей (YAC) и вводить их в эмбриональные линии мыши обеспечивает выгодный подход к объяснению роли функциональных компонентов очень больших или грубо картированных локусов, а также для создания полезных моделей заболевания человека. Кроме того, использование такой технологии для замены локусов мыши их человеческими эквивалентами обеспечивает уникальные возможности проникновения в суть экспрессии и регуляции человеческих генных продуктов в процессе развития, их взаимодействия с другими системами и их вовлеченность в возникновение и прогрессирование заболевания. Важным практическим применением такой стратегии является "гуманизация" гуморальной иммунной системы мыши. Введение локусов иммуноглобулина человека (Ig) в мышей, у которых инактивированы эндогенные гены Ig, дает возможность изучить механизмы, лежащие в основе программируемой экспрессии и сборки антител, а также их роли в развитии В-клеток. Кроме того, такая стратегия предоставляет источник получения полностью человеческих моноклональных антител (mAb). Термин "человеческое антитело" включает антитела, имеющие вариабельные и константные области, существенно соответствующие последовательностям иммуноглобулина гаметического типа человека. В определенных воплощениях антитела человека получают в млекопитающих, кроме человека, включая,но не ограничиваясь, грызунов, таких как мыши и крысы, а также зайцеобразных, таких как кролики. В определенных воплощениях человеческие антитела продуцируют в клетках гибридом. В определенных воплощениях человеческие антитела получают рекомбинантным путем. Термин "рекомбинантный" в отношении антитела включает антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными способами. Репрезентативные примеры включают антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, трансфецированного в клетку-хозяина, антитела, выделенные из комбинаторной библиотеки рекомбинантных антител человека, антитела, выделенные из животного (например, мыши), которое является трансгенным по генам иммуноглобулина человека (см., например, Taylor et al., 1992, Nucl. Acids Res. 20: 6287-6295); или антитела, которые получены, экспрессированы, созданы или выделены любыми способами, которые включают сплайсинг последовательностей генов иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области,образованные из последовательностей иммуноглобулина человека гаметического типа. Антитела человека имеют по меньшей мере три преимущества перед нечеловеческими и химерными антителами при применении в терапии человека 1) поскольку эффекторный участок антитела является человеческим, он может лучше взаимодействовать с другими частями иммунной системы человека (например, более эффективно разрушать клеткимишени за счет комплемент-зависимой цитотоксичности (CDC) или антителозависимой клеточноопосредованной цитотоксичности (ADCC; 2) иммунная система человека не должна распознавать антитело человека как чужеродное, и поэтому ответ антитела против такого инъецированного антитела должен быть меньше, чем против полностью чужеродного нечеловеческого антитела или частично чужеродного химерного антитела; 3) сообщали, что инъецированные нечеловеческие антитела обладают значительно более коротким периодом полувыведения в системе кровообращения человека, чем период полувыведения антител человека. Инъецированные антитела человека будут иметь период полувыведения, по существу, идентичный антителам человека естественного происхождения, позволяя давать меньшие и менее частые дозы.- 13021669 Таким образом, полностью человеческие антитела, как ожидают, минимизируют иммуногенные и аллергические ответы, свойственные мышиным mAb или mAb мышиного происхождения, и таким образом увеличат эффективность и безопасность вводимых антител. Полностью человеческие антитела по изобретению, следовательно, можно применять при лечении заболеваний и расстройств, обусловленных неадекватным иммунным ответом, лечение которых требует повторного введения антитела. Таким образом, одно из конкретных преимуществ антител анти-B7RP1 по изобретению состоит в том, что эти антитела являются полностью человеческими, и их можно вводить пациентам неострым методом, при этом сводя к минимуму неблагоприятные реакции, обычно связанные с антителами человека против мыши или с другими ранее описанными не полностью человеческими антителами, полученными из вида, кроме человека. Специалист в данной области техники может сконструировать линии мыши, дефектные по продуцированию антител мыши, с большими фрагментами локусов Ig человека, так что такие мыши продуцируют человеческие антитела в отсутствие мышиных антител. Большие фрагменты Ig человека могут сохранять большое разнообразие вариабельных генов, а также правильную регуляцию продуцирования и экспрессии антител. В результате использования мышиных клеточных механизмов для диверсификации и селекции антитела, а также отсутствия иммунологической толерантности к человеческим белкам воспроизведенный спектр антител человека в этих линиях мыши дает антитела с высоким сродством против любого интересующего антигена, включая антигены человека. Используя гибридомную технологию,можно продуцировать и отбирать специфичные человеческие mAb желаемой антигенной специфичности. Трансгенных животных (например, мышей) можно также использовать для продуцирования антител человека в отсутствие эндогенного продуцирования иммуноглобулина. Например, перенос ряда генов иммуноглобулина человека гаметического типа в зародышевые линии таких мутантных мышей приводит в результате к продуцированию антител человека после антигенной стимуляции (см., например,публикации Jakobovits et al., 1993, Proc. Natl. Acad Sci. USA 90: 2551-2555; Jakobovits et al., 1993, Nature 362: 255-258; Bruggemann et al., 1993, Year in Immun. 7: 33, 1994, Nature 148: 1547-1553 и 1996, NatureBiotechnology 14: 826; Gross et al., 2000, Nature 404:995-999; а также патенты США 5877397, 5874299,5814318, 5789650, 5770429, 5661016, 5633425, 5625126, 5569825 и 5545806 (каждая из которых полностью включена здесь путем ссылки для всех целей. Антитела человека можно также продуцировать в библиотеках фагового дисплея (Hoogenboom and Winter, 1992, J. Mol. Biol. 227: 381; Marks et al., 1991, J.Mol. Biol. 222: 581). Методы Cole et al. и Boerner et al. также доступны для получения моноклональных антител человека (Cole et al., 1985, MONOCLONAL ANTIBODIES AND CANCER THERAPY Alan R.Liss, p. 77; и Boerner et al., 1991, J. Immunol. 147: 86-95). Рекомбинантные антитела человека также могут быть подвергнуты мутагенезу in vitro (или, когда используют животное, трансгенное по последовательностям Ig человека, то соматическому мутагенезу invivo), и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя имеют происхождение от последовательностей,родственных последовательностям человеческих VH и VL гаметического типа, могут не существовать в природе в спектре человеческих антител гаметического типа in vivo. В определенных воплощениях специалист в данной области техники может использовать константные области от видов, отличных от человека, параллельно с человеческой вариабельной областью(ями) в таких мышах для продуцирования химерных антител. Антитело двойной специфичности или гетеровалентное антитело типично представляет собой искусственное гибридное антитело, имеющее две различных пары тяжелой цепи/легкой цепи и два различных сайта связывания. Антитела двойной специфичности могут быть получены разнообразными методами, включая, но не ограничиваясь, слияние гибридом или сшивание фрагментов F(ab') (см., например,SongsivilaiLachmann, 1990, Clin. Exp Immunol. 79: 315-321; Kostelny et al., 1992, J. Immunol. 148: 15471553). В изобретении предложены антитела, которые связываются с B7RP1 человека. Эти антитела могут быть получены путем иммунизации полноразмерным B7RP1 или его фрагментами. Антитела по изобретению могут быть поликлональными или моноклональными и/или могут представлять собой рекомбинантные антитела. В предпочтительных воплощениях антитела по изобретению представляют собой антитела человека, полученные, например, путем иммунизации трансгенных животных, способных к продуцированию антител человека (см., например, международную заявку на патент, номер публикации WO 93/12227). Гипервариабельные участки (CDR) вариабельных областей легкой цепи и тяжелой цепи антител анти-B7RP1 по изобретению могут быть привиты к каркасным областям (FR) того же или другого вида. В определенных воплощениях CDR вариабельных областей легкой цепи и тяжелой цепи антитела антиB7RP1 могут быть привиты к согласованным человеческим областям FR. Для создания согласованных человеческих областей FR области FR от нескольких аминокислотных последовательностей тяжелых цепей или легких цепей человека выравнивают для идентификации согласованной аминокислотной последовательности. Области FR тяжелой цепи или легкой цепи антитела анти-B7RP1 могут быть замене- 14021669 ны областями FR от другой тяжелой цепи или легкой цепи. Редкие аминокислоты в областях FR тяжелых и легких цепей антитела анти-B7RP1 обычно не заменяют, хотя остальные аминокислоты области FR могут быть заменены. Редкие аминокислоты представляют собой специфичные аминокислоты, которые находятся в положениях, в которых они обычно не находятся в областях FR. Привитые вариабельные области от антител анти-B7RP1 по изобретению можно использовать с константной областью, которая отличается от константной области антитела анти-B7RP1. Альтернативно, привитые вариабельные области составляют часть одноцепочечного антитела Fv. Прививание CDR описано, например, в патентах США 6180370, 5693762, 5693761, 5585089 и 5530101, которые включены здесь путем ссылки для любой цели. Антитела по изобретению могут быть получены с использованием трансгенных мышей, у которых существенная часть локуса, продуцирующего антитело человека, встроена в клетки мышей, продуцирующие антитело, и у которых, кроме того, генно-инженерным путем сконструирован дефицит по продуцированию эндогенных мышиных антител. Такие мыши способны к продуцированию молекул иммуноглобулина и антител человека и не продуцируют или продуцируют существенно сниженные количества молекул иммуноглобулина и антител мыши. Технологии, используемые для достижения этого результата, раскрыты в патентах, заявках и ссылках, приведенных в данном описании. В определенных воплощениях специалист в данной области техники может использовать методы,раскрытые в международной заявке на патент, номер публикации WO 98/24893, которая включена здесь путем ссылки для любой цели (см. также публикацию Mendez et al., 1997, Nature Genetics 15:146-156,которая включена здесь путем ссылки для любой цели). Моноклональные антитела (mAb) по изобретению могут быть получены разнообразными методами,включая общепринятую методологию моноклональных антител, например стандартную методику соматической гибридизации клеток Kohler and Milstein (1975, Nature 256: 495). Можно использовать другие методы продуцирования моноклональных антител, например вирусную или онкогенную трансформацию В-лимфоцитов. Примерной животной системой для получения гибридом является мышь. Получение гибридомы у мыши известно в данной области техники, и протоколы иммунизации и методы выделения иммунизированных спленоцитов для слияния также известны в данной области техники. Сливающиеся клетки (например, клетки миеломы мыши) и методы слияния также известны. В определенном воплощении моноклональные антитела человека, направленные против B7RP1,могут быть получены с использованием трансгенных мышей, вероятнее несущих части иммунной системы человека, чем систему мыши. Эти трансгенные мыши, упоминаемые здесь как мыши "HuMab", содержат минилокус генов иммуноглобулина человека, который кодирует не перегруппированные последовательности тяжелой ( и ) и -легкой цепи иммуноглобулина человека, вместе с направленными мутациями, которые инактивируют локусы эндогенных - и -цепей (Lonberg et al., 1994, Nature 368: 856859). Соответственно, эти мыши проявляют сниженную экспрессию IgM или -цепи мыши, и в ответ на иммунизацию введенные трансгены тяжелой и легкой цепи человека претерпевают переключение класса и соматическую мутацию с образованием моноклональных антител IgG к человеку с высоким сродством(Lonberg et al., см. выше; Lonberg and Huszar, 1995, Intern. Rev. Immunol. 13: 65-93; Harding and Lonberg,1995, Ann. NY. Acad. Sci. 764:536-546). Получение HuMab мышей подробно описано в публикациях (см.Tuaillon et al., 1994, J. Immunol. 152: 2912-2920; Lonberg et al., 1994, Nature 368: 856-859; Lonberg, 1994,Handbook of Exp. Pharmacology 113: 49-101; Taylor et al., 1994, International Immunology 6: 579-591; LonbergHuszar, 1995, Intern. Rev. Immunol. 13: 65-93; HardingLonberg, 1995, Ann. N.Y. Acad. Sci 764: 536-546; Fishwild et al., 1996, Nature Biotechnology 14: 845-851, содержание которых включено здесь путем ссылки в полном объеме). См. дополнительно патенты США 5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 и 5770429; все от авторов Lonberg и Kay, а также патент США 5545807, Surani et al.; международные заявки на патент, номер публикации WO 93/1227, опубликована 24 июня 1993; WO 92/22646, опубликована 23 декабря 1992; и WO 92/03918, опубликована 19 марта 1992, описание которых для всех включено здесь путем ссылки в их полном объеме. Альтернативно,трансгенные линии мышей, описанные в примерах ниже, можно использовать для получения человеческих антител против B7RP1 человека. В настоящем изобретении предложены человеческие моноклональные антитела, которые являются специфичными к биологически активным полипептидам B7RP1 человека и нейтрализуют их. Также предложены аминокислотные последовательности тяжелой и легкой цепи антитела, которые являются высокоспецифичными к полипептидам B7RP1 и нейтрализуют их при связывании с ними. Эта высокая специфичность обеспечивает эффективную иммунотерапию для заболеваний, связанных с B7RP1, человеческими антителами против B7RP1 человека и моноклональными антителами человека с подобной специфичностью. В одном аспекте в изобретении предложены изолированные антитела человека, которые связываются с тем же или, по существу, с тем же эпитопом, что и предложенное здесь антитело 16 Н.- 15021669 В одном аспекте в изобретении предложены изолированные антитела человека, включающие по меньшей мере одну из аминокислотных последовательностей, представленных в последовательностяхSEQ ID NO: 1-40 или 44-58, которые связываются с эпитопом полипептида B7RP1 с высоким сродством и обладают способностью антагонизировать активность полипептида B7RP1. Эти антитела могут связаться с тем же или, по существу, с тем же эпитопом, что и антитела анти-B7RP1, показанные здесь в примерах. В определенных воплощениях изолированные антитела связываются с полипептидом B7RP1 с константой диссоциации (KD), примерно равной 10-6 М, 10-7 М, 10-8 М, 10-9 М, 10-10 М, 10-11 М или менее, и ингибируют индуцированное B7RP1 выживание в анализе нейтрализации in vitro со значением ЕС 50,примерно равным 10-6 М, 10-7 М, 10-8 М, 10-9 М или менее. Примеры человеческих антител против B7RP1 человека, которые соответствуют вышеупомянутым критериям связывания и нейтрализации, представлены здесь. В определенных воплощениях человеческие антитела против B7RP1 человека по изобретению упоминаются здесь как 16 Н, 16Hg (гаметический тип), 5D, 2 Н, 2Hg (гаметический тип), 15 Н, 41H и 43 Н. Антитело 16 Н включает полипептидные последовательности VL и VH, как представлено в последовательности SEQ ID NO: 7 и SEQ ID NO: 1, соответственно. Антитело 16Hg включает полипептидные последовательности вариабельной области легкой цепи (VL) и вариабельной области тяжелой цепи (VH), как представлено в последовательности SEQ ID NO: 1 и SEQ ID NO: 8 соответственно. Антитело 5D включает полипептидные последовательности VL и VH, как представлено в последовательности SEQ ID NO: 2 иSEQ ID NO: 9 соответственно. Антитело 2 Н включает полипептидные последовательности VL и VH, как представлено в последовательности SEQ ID NO: 3 и SEQ ID NO: 10 соответственно. Антитело 2Hg включает полипептидные последовательности VL и VH, как представлено в последовательности SEQ IDNO: 3 и SEQ ID NO: 11 соответственно. Антитело 15 Н включает полипептидные последовательности VL и VH, как представлено в последовательности SEQ ID NO: 4 и SEQ ID NO: 12 соответственно. Антитело 41H включает полипептидные последовательности VL и VH, как представлено в последовательности SEQVL и VH, как представлено в последовательности SEQ ID NO: 6 и SEQ ID NO: 14 соответственно. Свойства человеческих антител против B7RP1 человека по настоящему изобретению конкретно раскрыты в примерах. Особенно примечательно высокое сродство к полипептиду B7RP1 и высокая способность к антагонизации активности полипептида B7RP1, как продемонстрировано здесь. Константа диссоциации (KD) человеческого антитела против B7RP1 человека может быть определена с помощью поверхностной плазмонной резонансной спектроскопии, описанной в общих чертах в примерах ниже. Обычно при анализе с применением поверхностной плазмонной резонансной спектроскопии в реальном масштабе времени измеряют связывающие взаимодействия между лигандом (рекомбинантным полипептидом B7RP1, иммобилизованным на матрице биодатчика) и анализируемым веществом (антителами в растворе) с помощью поверхностной плазмонной резонансной спектроскопии (ППР спектроскопии) с использованием системы BIAcore (Pharmacia Biosensor, Piscataway, NJ). Анализ с применением поверхностной плазмонной резонансной спектроскопии также может быть выполнен путем иммобилизации анализируемого вещества (антител на матрице биодатчика) и презентирования лиганда(рекомбинантного V в растворе). Константу диссоциации (KD) человеческого антитела против B7RP1 человека также можно определить с использованием методологии KinExA. В определенных воплощениях изобретения антитела связываются с B7RP1 с KD, примерно равной 10-5 М, 10-6 М, 10-7 М, 10-8 М, 10-9 М, 10-10 М, 10-11 М или 10-12 М. Термин "KD", используемый здесь, следует относить к константе диссоциации конкретного взаимодействия антитело-антиген. Для целей настоящего изобретения KD определяли, как показано в примерах ниже. В определенных воплощениях антитела по изобретению относятся к изотипу IgG1, IgG2, IgG3 илиIgG4. Антитела могут относиться к изотипу IgG2 или IgG1. В других воплощениях антитела по изобретению могут относиться к изотипу IgM, IgA, IgE или IgD. В определенных воплощениях изобретения антитела включают легкую цепь каппа и тяжелую цепь IgG1, IgG2, IgG3 или IgG4 человека. Экспрессия антител по изобретению, включающих константную область тяжелой цепи IgG1 или IgG2, описана в примерах ниже. В конкретных воплощениях вариабельные области антител лигированы с константной областью, отличной от константной области для изотипа IgG1, IgG2, IgG3 или IgG4. В определенных воплощениях антитела по изобретению клонированы для экспрессии в клетках млекопитающих. В определенных воплощениях в результате консервативных модификаций тяжелых цепей и легких цепей антител анти-B7RP1 (и соответствующих модификаций кодирования нуклеотидов) получают антитела анти-B7RP1, обладающие функциональными и химическими характеристиками, подобными таковым для антител анти-B7RP1, раскрытых здесь. Напротив, существенные модификации функциональных и/или химических характеристик антител анти-B7RP1 могут быть выполнены путем отбора замен в аминокислотной последовательности тяжелых и легких цепей, которые значительно отличаются по своему воздействию на сохранение (а) структуры молекулярного каркаса в области замещения, например, в виде пластинчатой или спиральной конформации, (б) заряда или гидрофобности молекулы в сайте-мишени или (в) объема боковой цепи.- 16021669 Например, "консервативная аминокислотная замена" может включать замену нативного аминокислотного остатка ненативным остатком таким образом, что эффект на полярность или заряд аминокислотного остатка в данном положении является небольшим или отсутствует. Кроме того, любой нативный остаток в полипептиде может быть также заменен аланином, как описано ранее для "сканирующего аланином мутагенеза". Аминокислотные замены (консервативные или неконсервативные) могут быть определены специалистом в данной области техники тогда, когда такие замены желательны. В определенных воплощениях аминокислотные замены можно использовать для идентификации тех аминокислотных остатков антитела анти-B7RP1, которые вовлечены в специфичность связывания и/или сродство антитела к B7RP1 (например, остатки, которые вовлечены в связывание антитела с конкретным эпитопом), таких как аминокислотные остатки в CDR1, CDR2 и/или CDR3 областях легких или тяжелых цепей, как описано здесь. Такие аминокислотные замены могут увеличить или уменьшить сродство антител анти-B7RP1, описанных здесь. Минорные изменения в аминокислотной последовательности, такие как делеция, добавление или замена одной, немногих или даже нескольких аминокислот могут привести к аллельной форме исходного белка, которая обладает, по существу, идентичными свойствами. Поэтому, в дополнение к антителам,конкретно описанным здесь, другие "по существу, гомологичные" антитела могут быть легко сконструированы и изготовлены с использованием различных методов рекомбинантных ДНК, хорошо известных специалистам в данной области техники. Вообще, модификации генов могут быть легко осуществлены разнообразными хорошо известными способами, такими как сайт-направленный мутагенез. Поэтому в настоящем изобретении рассмотрены "вариантные" или "мутантные" человеческие антитела антиB7RP1, обладающие характеристиками, по существу, подобными человеческим антителам анти-B7RP1,раскрытым здесь (см., например, публикацию WO 00/56772, которая включена здесь путем ссылки полностью). Таким образом, термин "вариантный" или "мутантный" по отношению к человеческому антителу анти-B7RP1 означает любую связывающую молекулу (молекулу X) (i) в которой гипервариабельные участки CDR1, CDR2 и CDR3 тяжелой цепи или гипервариабельные участки CDR1, CDR2 и CDR3 легкой цепи, взятые вместе, являются по меньшей мере примерно на 80% гомологичными, по меньшей мере примерно на 90% гомологичными или по меньшей мере примерно на 95% гомологичными гипервариабельным участкам, как представлено в последовательностях SEQ ID NO: 15-SEQ ID NO: 26 или SEQ IDNO: 27-SEQ ID NO: 40 соответственно, и (ii) где вариант или мутант способны к ингибированию активности B7RP1 человека до такой же степени, что и эталонное человеческое антитело анти-B7RP1, каркасные области которого идентичны таковым молекулы X. Такие антитела могут связываться с B7RP1 человека или с B7RP1 мыши или с тем и с другим. Последовательность B7RP1 мыши описана в публикацииWO 00/46240, которая включена путем ссылки. Обычно вариант человеческого антитела анти-B7RP1 имеет области CDR легкой и/или тяжелой цепи, которые взятые вместе имеют по меньшей мере примерно 80% идентичности аминокислотной последовательности, по меньшей мере примерно 85% идентичности последовательности, по меньшей мере примерно 90% идентичности последовательности, по меньшей мере примерно 91% идентичности последовательности, по меньшей мере примерно 92% идентичности последовательности, по меньшей мере примерно 93% идентичности последовательности, по меньшей мере примерно 94% идентичности последовательности, по меньшей мере примерно 95% идентичности последовательности, по меньшей мере примерно 96% идентичности последовательности, по меньшей мере примерно 97% идентичности последовательности, по меньшей мере примерно 98% идентичности последовательности или по меньшей мере примерно 99% идентичности аминокислотной последовательности с аминокислотной последовательностью, представленной в последовательностях SEQ ID NO: 15-SEQ ID NO: 26 и/или SEQ ID NO: 27-SEQID NO: 40 соответственно. Такие антитела могут связываться либо с человеческим B7RP1, либо с мышиным B7RP1, либо с обоими. Вариант человеческого антитела анти-B7RP1 имеет вариабельную область легкой цепи, которая взятая в целом имеет по меньшей мере примерно 80% идентичности аминокислотной последовательности, по меньшей мере примерно 81% идентичности последовательности, по меньшей мере примерно 82% идентичности последовательности, по меньшей мере примерно 83% идентичности последовательности,по меньшей мере примерно 84% идентичности последовательности, по меньшей мере примерно 85% идентичности последовательности, по меньшей мере примерно 86% идентичности последовательности,по меньшей мере примерно 87% идентичности последовательности, по меньшей мере примерно 88% идентичности последовательности, по меньшей мере примерно 89% идентичности последовательности,по меньшей мере примерно 90% идентичности последовательности, по меньшей мере примерно 91% идентичности последовательности, по меньшей мере примерно 92% идентичности последовательности,по меньшей мере примерно 93% идентичности последовательности, по меньшей мере примерно 94% идентичности последовательности, по меньшей мере примерно 95% идентичности последовательности,по меньшей мере примерно 96% идентичности последовательности, по меньшей мере примерно 97% идентичности последовательности, по меньшей мере примерно 98% идентичности последовательности,по меньшей мере примерно 99% идентичности аминокислотной последовательности с аминокислотной- 17021669 последовательностью, представленной в последовательностях SEQ ID NO: 1-SEQ ID NO: 6, и/или вариабельную область тяжелой цепи, которая взятая в целом имеет по меньшей мере примерно 70% идентичности аминокислотной последовательности, по меньшей мере примерно 75% идентичности последовательности, по меньшей мере примерно 80% идентичности последовательности, по меньшей мере примерно 81% идентичности последовательности, по меньшей мере примерно 82% идентичности последовательности, по меньшей мере примерно 83% идентичности последовательности, по меньшей мере примерно 84% идентичности последовательности, по меньшей мере примерно 85% идентичности последовательности, по меньшей мере примерно 86% идентичности последовательности, по меньшей мере примерно 87% идентичности последовательности, по меньшей мере примерно 88% идентичности последовательности, по меньшей мере примерно 89% идентичности последовательности, по меньшей мере примерно 90% идентичности последовательности, по меньшей мере примерно 91% идентичности последовательности, по меньшей мере примерно 92% идентичности последовательности, по меньшей мере примерно 93% идентичности последовательности, по меньшей мере примерно 94% идентичности последовательности, по меньшей мере примерно 95% идентичности последовательности, по меньшей мере примерно 96% идентичности последовательности, по меньшей мере примерно 97% идентичности последовательности, по меньшей мере примерно 98% идентичности последовательности или по меньшей мере примерно 99% идентичности аминокислотной последовательности с аминокислотной последовательностью, представленной в последовательностях SEQ ID NO: 7-SEQ ID NO: 14. Такие антитела могут связываться с человеческим B7RP1 и/или с мышиным B7RP1. Как понятно специалистам в данной области техники, многие из потенциальных остатков, контактирующих с CDR, поддаются замене другими аминокислотами и при этом позволяют сохранять существенное сродство антитела к антигену. Подобным образом, многие из остатков каркасной области, не находящиеся в контакте с CDR в тяжелых и легких цепях, могут приспособиться к заменам аминокислот из соответствующих положений других антител человека аминокислотами согласованной последовательности человека или из других антител мыши без значительной потери сродства или неиммуногенности человеческого антитела. Можно использовать отбор различных альтернативных аминокислот, чтобы предложить варианты раскрытых антител анти-B7RP1 и их фрагментов, которые имеют варьирующие комбинации сродства, специфичности, отсутствия иммуногенности, легкости изготовления и других желательных свойств."Вариант" по отношению к полинуклеотиду следует относить к молекуле нуклеиновой кислоты,имеющей по меньшей мере примерно 75% идентичности последовательности нуклеиновой кислоты с полинуклеотидной последовательностью по настоящему изобретению. Обычно вариант полинуклеотида имеет по меньшей мере примерно 75% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 80% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 81% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 82% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 83% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 84% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 85% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 86% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 87% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 88% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 89% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 90% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 91% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 92% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 93% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 94% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 95% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 96% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 97% идентичности последовательности нуклеиновой кислоты, по меньшей мере примерно 98% идентичности последовательности нуклеиновой кислоты или по меньшей мере примерно 99% идентичности последовательности нуклеиновой кислоты с новой последовательностью нуклеиновой кислоты,раскрытой здесь. В альтернативных воплощениях антитела по изобретению можно экспрессировать в иных клеточных линиях, чем гибридомные клеточные линии. В этих воплощениях последовательности, кодирующие конкретные антитела, можно использовать для трансформации подходящей клетки-хозяина млекопитающих. Согласно этим воплощениям трансформация может быть достигнута с использованием любого известного метода введения полинуклеотидов в клетку-хозяина, включая, например, упаковку полинуклеотида в вирус (или в вирусный вектор) и трансформацию клетки-хозяина вирусом (или вектором), либо в соответствии с методиками трансфекции, известными в данной области техники, примеры которой приведены в патентах США 4399216, 4912040, 4740461 и 4959455 (все из которых включены здесь путем ссылки для любой цели). Вообще используемая методика трансформации может зависеть от хозяина, подлежащего трансформации. Методы введения гетерологичных полинуклеотидов в клетки мле- 18021669 копитающих хорошо известны в данной области техники и включают, но не ограничены, трансфекцию,опосредованную декстраном, кальций-фосфатную преципитацию, трансфекцию, опосредованную полибреном, слияние протопластов, электропорацию, инкапсуляцию полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядра. Молекулу нуклеиновой кислоты, кодирующую аминокислотную последовательность константной области тяжелой цепи, вариабельной области тяжелой цепи, константной области легкой цепи или вариабельной области легкой цепи антитела анти-B7RP1 по изобретению, встраивают в соответствующий экспрессионный вектор с использованием стандартных методик лигирования. В одном воплощении константную область тяжелой цепи или легкой цепи антитела анти-B7RP1 присоединяют к С-концу соответствующей вариабельной области и лигируют в экспрессионный вектор. Этот вектор типично выбран таким образом, чтобы он был функциональным в конкретной используемой клетке-хозяине (то есть вектор совместим с клеточным аппаратом клетки-хозяина таким образом, чтобы могла происходить амплификация гена и/или экспрессия гена). Для обзора экспрессионных векторов см. METHODS IN ENZYMOLOGY 185 (Goeddel, ed., 1990, Academic Press). Как правило, экспрессионные векторы, используемые в любой из клеток-хозяев, содержат последовательности для поддержания плазмиды и для клонирования и экспрессии экзогенных нуклеотидных последовательностей. Такие последовательности, все вместе называемые "фланкирующими последовательностями", в определенных воплощениях обычно включают одну или более чем одну из приведенных ниже нуклеотидных последовательностей: промотор, одну или более чем одну энхансерную последовательность, точку начала репликации, последовательность терминации транскрипции, полноразмерную интронную последовательность, содержащую донорный и акцепторный сайт сплайсинга, последовательность, кодирующую лидерную последовательность для секреции полипептида, сайт связывания рибосомы, последовательность полиаденилирования, полилинкерную область для встраивания нуклеиновой кислоты, кодирующей экспрессируемый полипептид, и селективный маркерный элемент. Каждая из этих последовательностей обсуждена ниже. Возможно вектор может содержать последовательность, кодирующую "метку", то есть олигонуклеотидную молекулу, расположенную при 5' или 3' конце кодирующей последовательности полипептида антитела анти-B7RP1; эта олигонуклеотидная последовательность кодирует polyHis (такой как hexaHis) или другую "метку", такую как FLAG, НА (гемагглютинин вируса гриппа) или MYC, для которых существуют имеющиеся в продаже антитела. Эту метку обычно сливают с полипептидом при экспрессии полипептида, и она может служить средством для аффинной очистки или обнаружения антитела антиB7RP1 в клетке-хозяине. Аффинную очистку можно осуществлять, например, путем колоночной хроматографии с использованием антител против метки в качестве аффинной матрицы. Возможно метку впоследствии можно удалить из очищенного полипептида антитела анти-B7RP1 различными способами,такими как использование определенных пептидаз для отщепления. Фланкирующие последовательности могут быть гомологичными (то есть от того же вида и/или линии, что и клетка-хозяин), гетерологичными (то есть от вида или линии, отличных от вида или линии клетки-хозяина), гибридными (то есть комбинацией фланкирующих последовательностей более чем из одного источника), синтетическими или нативными. Источником фланкирующей последовательности как таковым может быть любой прокариотический или эукариотический организм, любой позвоночный или беспозвоночный организм или любое растение при условии, что фланкирующая последовательность функциональна в клетке-хозяине и может быть активирована ее механизмом. Фланкирующие последовательности, полезные в векторах по данному изобретению, могут быть получены с помощью любого из нескольких методов, хорошо известных в данной области техники. Как правило, фланкирующие последовательности, используемые здесь, предварительно идентифицируют путем картирования и/или переваривания рестрикционной эндонуклеазой и могут, таким образом, быть выделены из соответствующего источника ткани с использованием подходящих рестрикционных эндонуклеаз. В некоторых случаях может быть известна полноразмерная нуклеотидная последовательность фланкирующей последовательности. Здесь фланкирующую последовательность можно синтезировать с использованием методов, описанных здесь для синтеза или клонирования нуклеиновых кислот. Независимо от того, известна вся фланкирующая последовательность или только ее часть, она может быть получена с использованием полимеразной цепной реакции (ПЦР) и/или путем скрининга геномной библиотеки подходящим зондом, например фрагментом олигонуклеотидной и/или фланкирующей последовательности из того же или другого вида. Если фланкирующая последовательность неизвестна, фрагмент ДНК, содержащей фланкирующую последовательность, может быть выделен из большего участка ДНК, который может содержать, например, кодирующую последовательность или даже другой ген или гены. Выделение можно осуществить путем переваривания рестрикционной эндонуклеазой с получением правильного фрагмента ДНК с последующим выделением, используя очистку из агарозного геля, колоночную хроматографию Qiagen (Chatsworth, CA) или другие методы, известные специалистам в данной области техники. Выбор подходящих ферментов для достижения этой цели легко очевиден для обычного специалиста в данной области техники. Точка начала репликации обычно представляет собой участок тех прокариотических экспрессион- 19021669 ных векторов, которые имеются в продаже, и эта точка начала репликации способствует амплификации вектора в клетке-хозяине. Если выбранный вектор не содержит точку начала репликации, ее можно синтезировать химическим путем на основе известной последовательности и лигировать в вектор. Например, точка начала репликации из плазмиды pBR322 (New England Biolabs, Beverly, MA) является пригодной для большинства грамотрицательных бактерий, а различные точки начала репликации вирусов (например, SV40, вируса полиомы, аденовируса, вируса везикулярного стоматита (VSV) или вирусов папилломы, например HPV или BPV) полезны при клонировании векторов в клетках млекопитающих. Вообще компонент точки начала репликации не является необходимым для экспрессионных векторов млекопитающих (например, точку начала репликации SV40 часто используют только потому, что она также содержит ранний промотор этого вируса). Последовательность терминации транскрипции обычно располагается в 3' направлении от конца кодирующей области полипептида и служит для терминации транскрипции. Обычно последовательность терминации транскрипции в прокариотических клетках представляет собой G-C-обогащенный фрагмент,за которым следует поли-Т последовательность. Хотя эту последовательность легко клонировать из библиотеки или даже приобрести из коммерческих источников как часть вектора, ее можно также легко синтезировать, используя методы синтеза нуклеиновых кислот, таких как описаны здесь. Ген селективного маркера кодирует белок, необходимый для выживания и роста клетки-хозяина в селективной культурной среде. Типичные гены селективных маркеров кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, тетрациклину или канамицину для прокариотических клеток-хозяев; (б) комплементируют ауксотрофные дефициты клетки или (в) поставляют наиболее важные питательные вещества, недоступные из сложных питательных сред или питательных сред определенного состава. Примерами селективных маркеров являются ген устойчивости к канамицину, ген устойчивости к ампициллину и ген устойчивости к тетрациклину. Преимущественно ген устойчивости к неомицину можно также использовать для отбора и в прокариотических, и в эукариотических клетках-хозяевах. Другие селективные гены можно использовать для амплификации гена, который нужно экспрессировать. Амплификация представляет собой процесс, при котором гены, требуемые для продуцирования белка, наиболее важного для роста или выживания клетки, повторно воспроизводятся в тандеме в хромосомах последовательных поколений рекомбинантных клеток. Примеры подходящих селективных маркеров для клеток млекопитающих включают дигидрофолатредуктазу (DHFR) и гены тимидинкиназы без промотора. Трансформанты клеток млекопитающих помещают в условия давления отбора, при которых только трансформанты являются уникально адаптированными к выживанию благодаря селективному гену, присутствующему в векторе. Давление отбора прилагают путем культивирования трансформированных клеток в условиях, в которых концентрация селективного агента в среде последовательно возрастает, таким образом, приводя к амплификации как селективного гена, так и ДНК, которая кодирует другой ген, такой как антитело, которое связывается с полипептидом B7RP1. В результате с амплифицированной ДНК синтезируются повышенные количества полипептида, например антитела анти-B7RP1. Сайт связывания рибосомы обычно необходим для инициации трансляции мРНК и характеризуется последовательностью Шайна-Дальгарно (прокариоты) или последовательностью Козака (эукариоты). Этот элемент типично локализован в 3' направлении к промотору и в 5' направлении к кодирующей последовательности экспрессируемого полипептида. В некоторых случаях, например, если гликозилирование желательно в экспрессионной системе эукариотической клетки-хозяина, можно манипулировать с различными пре- или пропоследовательностями для улучшения гликозилирования или выхода. Например, можно изменить участок отщепления пептидазой конкретного сигнального пептида или добавить пропоследовательности, которые также могут влиять на гликозилирование. Конечный белковый продукт может иметь в положении 1 (относительно первой аминокислоты зрелого белка) одну или более чем одну дополнительную аминокислоту, свойственную экспрессии, которая может не быть полностью удалена. Например, конечный белковый продукт может иметь один или два аминокислотных остатка, обнаруживаемых в сайте отщепления пептидазы,присоединенных к аминоконцу. Альтернативно, использование некоторых сайтов отщепления ферментом может привести к слегка укороченной форме желаемого полипептида, если этот фермент режет в такой области зрелого полипептида. Векторы экспрессии и клонирования по изобретению обычно содержат промотор, который распознается организмом-хозяином и оперативно сцеплен с молекулой, кодирующей антитело анти-B7RP1. Промоторы представляют собой нетранскрибируемые последовательности, расположенные выше (то есть в 5' направлении) от стартового кодона структурного гена (вообще в пределах примерно 100-1000 п.н.), который регулирует транскрипцию структурного гена. Промоторы традиционно относят к одному из двух классов: индуцибельные промоторы и конститутивные промоторы. Индуцибельные промоторы инициируют повышенные уровни транскрипции с ДНК под своим контролем в ответ на некоторое изменение в условиях культивирования, такое как присутствие или отсутствие питательного вещества или изменение температуры. Конститутивные промоторы, с другой стороны, однородно транскрибируют гены, с которыми они оперативно сцеплены, то есть при незначительном контроле или отсутствием кон- 20021669 троля генной экспрессии. Хорошо известно большое количество промоторов, распознаваемых разнообразными потенциальными клетками-хозяевами. Подходящий промотор оперативно сцеплен с ДНК, кодирующей тяжелую цепь или легкую цепь, включая антитело анти-B7RP1 по изобретению, путем удаления промотора из исходной ДНК путем переваривания ферментом рестрикции и вставки желаемой последовательности промотора в вектор. Подходящие промоторы для использования с клетками-хозяевами дрожжей также хорошо известны в данной области техники. С промоторами дрожжей преимущественно используют дрожжевые энхансеры. Подходящие промоторы для использования с клетками-хозяевами млекопитающих хорошо известны и включают, но не ограничены, промоторы, полученные из геномов вирусов, таких как вирус полиомы,вирус оспы птиц, аденовирус (такой как Аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирусы, вирус гепатита В и вирус обезьян 40 (SV40). Другие подходящие промоторы млекопитающих включают гетерологичные промоторы млекопитающих, например промоторы теплового шока и актиновый промотор. Дополнительные промоторы, которые могут быть интересны, включают, но не ограничены: ранний промотор SV40 (Bernoist and Chambon, 1981, Nature 290: 304-10); промотор CMV (Thomsen et al., 1984,Proc. Natl. Acad. Sci. USA 81; 659-663); промотор, содержащийся в 3' длинном концевом повторе вируса саркомы Рауса (Yamamoto et al., 1980, Cell 22: 787-97); промотор тимидинкиназы вируса герпеса (Wagneret al., 1981, Proc. Natl. Acad. Sci. U.S.A. 78: 1444-45); промотор и регуляторные последовательности из гена металлотионеина (Brinster et al., 1982, Nature 296: 39-42) и прокариотические промоторы, такие как промотор бета-лактамазы (Villa-Kamaroff et al., 1978, Proc. Natl. Acad. Sci U.S.A., 75: 3727-31); или tacпромотор (DeBoer et al., 1983, Proc. Natl. Acad Sci. U.S.A., 80: 21-25). Также представляют интерес следующие области регуляции транскрипции животных, которые проявляют тканевую специфичность и используются в трансгенных животных: регуляторная область гена эластазы I, которая является активной в панкреатических ацинарных клетках (Swift et al., 1984, Cell 38: 639-46; Ornitz et al., 1986, ColdSpring Harbor Symp. Quant Biol. 50: 399-409 (1986); MacDonald, 1987, Hepatology 7: 425-515); регуляторная область гена инсулина, которая активна в панкреатических бета-клетках (Hanahan, 1985, Nature 315: 115-22); регуляторная область гена иммуноглобулина, которая активна в лимфоидных клетках (Grosschedl et al., 1984, Cell 38: 647-58; Adames et al., 1985, Nature 318: 533-38; Alexander et al., 1987, Mol. Cell.Biol., 7: 1436-44); регуляторная область вируса опухоли молочной железы мышей, которая активна в клетках семенников, молочной железы, лимфоидных клетках и мастоцитах (Leder et al., 1986, Cell 45: 485-95); регуляторная область гена альбумина, которая активна в печени (Pinkert et al., 1987, Genes andDevel 1; 268-76); регуляторная область гена альфа-фетопротеина, которая активна в печени (Krumlauf etal., 1985, Mol. Cell Biol., 5: 1639-48; Hammer et al., 1987, Science 235: 53-58); регуляторная область гена альфа 1-антитрипсина, которая активна в печени (Kelsey et al., 1987, Genes and Devel. 1. 161-71); регуляторная область гена бета-глобина, которая активна в миелоидных клетках (Mogram et al., 1985, Nature 315: 338-40; Kollias et al., 1986, Cell 46: 89-94); регуляторная область гена основного белка миелина, которая активна в клетках олигодендроцитах в головном мозге (Readhead et al., 1987, Cell 48: 703-12); регуляторная область гена легкой цепи-2 миозина, которая активна в скелетных мышцах (Sani, 1985, Nature 314: 283-86); и регуляторная область гена рилизинг-фактора гормона гонадотропина, которая активна в гипоталамусе (Mason et al., 1986, Science 234: 1372-78). Энхансерная последовательность может быть встроена в вектор для усиления транскрипции ДНК,кодирующей легкую цепь или тяжелую цепь, составляющие антитело анти-B7RP1 по изобретению, высшими эукариотами. Энхансеры представляют собой цис-действующие элементы ДНК, обычно длиной примерно 10-300 п.н., которые действуют на промотор с усилением транскрипции. Энхансеры относительно независимы от ориентации и положения, находясь в положениях как 5', так и 3' к единице транскрипции. Известно несколько энхансерных последовательностей, доступных из генов млекопитающих(например, глобина, эластазы, альбумина, альфа-фетопротеина и инсулина). Однако обычно используют энхансер из вируса. Энхансер SV40, энхансер раннего промотора цитомегаловируса, энхансер полиомы и энхансеры аденовируса, известные в данной области техники, представляют собой примеры энхансерных элементов для эукариотических промоторов. Хотя энхансер может быть расположен в векторе либо 5', либо 3' к кодирующей последовательности, он обычно расположен в сайте в 5' направлении от промотора. Экспрессионные векторы по изобретению могут быть сконструированы из исходного вектора, например, имеющегося в продаже вектора. Такие векторы могут содержать или не содержать все желаемые фланкирующие последовательности. Если одна или более чем одна фланкирующая последовательность,описанная здесь, еще отсутствует в векторе, она может быть получена индивидуально и лигирована в вектор. Методы, используемые для получения каждой из фланкирующих последовательностей, хорошо известны специалистам в данной области техники. После того как вектор уже построен и молекула нуклеиновой кислоты, кодирующая легкую цепь,тяжелую цепь или легкую и тяжелую цепь и включающая анти-B7RP1 антитело, введена в подходящий участок вектора, законченный вектор может быть введен в подходящую клетку-хозяина для усиления и/или экспрессии полипептида. Трансформацию вектора экспрессии для анти-B7RP1 антитела в выбран- 21021669 ную клетку-хозяина можно осуществить известными методами, включающими трансфекцию, инфекцию,соосаждение фосфатом кальция, электропорацию, микроинъекцию, липофекцию, DEAE-декстранопосредованную трансфекцию или другие известные методы. Выбранный метод частично зависит от типа используемой клетки-хозяина. Эти методы и другие подходящие методы известны квалифицированному специалисту в данной области и сформулированы (см., например, в публикации Sambrook et al.,см. выше). Клетка-хозяин при культивировании в соответствующих условиях синтезирует антитело антиB7RP1, которое затем можно собрать из культуральной среды (если клетка-хозяин секретирует его в среду) или непосредственно из клетки-хозяина, продуцирующей его (если она не секретирует). Выбор соответствующей клетки-хозяина зависит от различных факторов, например, желаемых уровней экспрессии,модификаций полипептида, которые являются желательными или необходимыми для активности (например, гликозилирования или фосфорилирования) и легкости укладки в биологически активную молекулу. Линии клеток млекопитающих, доступные в качестве хозяев для экспрессии, хорошо известны в данной области и включают, но не ограничены, иммортализованные линии клеток, доступные из Американской коллекции типовых культур (АТСС), включая, но не ограничиваясь, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почек детенышей хомячков (BHK), клетки почек обезьян (COS),клетки гепатоцеллюлярной карциномы (например, HepG2) и ряд других линий клеток. В определенных воплощениях линии клеток могут быть выбраны посредством определения того, какие линии клеток имеют высокие уровни экспрессии и конститутивно продуцируют антитела с B7RP1-связывающими свойствами. В другом воплощении может быть выбрана линия клеток из В-клеточной линии, которая не производит свое собственное антитело, но обладает способностью производить и секретировать гетерологичное антитело. Антитела по изобретению полезны для обнаружения B7RP1 в биологических образцах и идентификации клеток или тканей, которые продуцируют белок B7RP1. Антитела по изобретению, которые специфично связываются с B7RP1, могут быть полезными при лечении B7RP1-опосредованных заболеваний. Указанные антитела можно использовать в анализах связывания для обнаружения B7RP1 и для ингибирования образования комплекса B7RP1 с рецепторами B7RP1. Указанные антитела, которые связываются с B7RP1 и блокируют взаимодействие с другими связывающими соединениями, могут найти терапевтическое применение при модулировании B7RP1-опосредованных заболеваний. В определенных воплощениях антитела к B7RP1 могут блокировать связывание B7RP1 с его рецептором, что может привести к разрушению B7RP1-индуцированного каскада преобразования сигнала. Настоящее изобретение также относится к применению одного или более чем одного антитела по настоящему изобретению при изготовлении лекарственного средства для лечения расстройства или состояния, вызванного повышенной экспрессией B7RP1 или повышенной чувствительностью к B7RP1 у пациента, например, любого из расстройств или состояний, раскрытых здесь. В определенных воплощениях в изобретении предложены фармацевтические композиции, содержащие терапевтически эффективное количество одного или множества антител по изобретению вместе с фармацевтически приемлемым разбавителем, носителем, солюбилизатором, эмульгатором, консервантом и/или адъювантом. Приемлемые вещества для препаратов нетоксичны для реципиентов при применяемых дозировках и концентрациях. В предпочтительных воплощениях предложены фармацевтические композиции, содержащие терапевтически эффективное количество антител анти-B7RP1. В определенных воплощениях вещества для препаратов нетоксичны для реципиентов при применяемых дозировках и концентрациях. В определенных воплощениях фармацевтическая композиция может содержать вещества для препарата для модифицирования, поддержания или сохранения, например, значения рН, осмолярности, вязкости, прозрачности, цвета, изотоничности, запаха, стерильности, стабильности, скорости растворения или высвобождения, адсорбции или проницаемости композиции. В таких воплощениях пригодные вещества для препаратов включают, но не ограничены, аминокислоты (такие как глицин, глутамин, аспарагин, аргинин или лизин); антибактериальные препараты; антиоксиданты (такие как аскорбиновая кислота, сульфит натрия или гидросульфит натрия); буферные вещества (например, борат, бикарбонат, ТрисHCl, соли лимонной кислоты, фосфаты или другие органические кислоты); наполнители (такие как маннит или глицин); хелатирующие агенты (такие как этилендиаминтетрауксусная кислота (ЭДТА; комплексообразующие агенты (такие как кофеин, поливинилпирролидон, бета-циклодекстрин или гидроксипропил-бета-циклодекстрин); добавки; моносахариды; дисахариды и другие углеводы (такие как глюкоза, манноза или декстрины); белки (такие как сывороточный альбумин, желатин или иммуноглобулин); красители, корригенты и разбавители; эмульгаторы; гидрофильные полимеры (такие как поливинилпирролидон); низкомолекулярные полипептиды; солеобразующие противоионы (такие как ион натрия); консерванты (такие как бензалкония хлорид, бензойная кислота, салициловая кислота, тимеросал, фенетиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновая кислота или перекись водорода); растворители (такие как глицерин, пропиленгликоль или полиэтиленгликоль); сахарные спирты (такие как маннит или сорбит); суспендирующие агенты; сурфактанты или увлажняющие агенты (такие как- 22021669 плюроники, ПЭГ, эфиры сорбитана, полисорбаты, такие как полисорбат 20, полисорбат 80, тритон, трометамин, лецитин, холестерин, тилоксапал); агенты, усиливающие стабильность (такие как сахароза или сорбит); агенты, усиливающие тоничность (такие как галогениды щелочных металлов, например, хлорид натрия или калия, маннит, сорбит); носители для доставки; разбавители; эксципиенты и/или фармацевтические адъюванты (см. REMINGTON'S PHARMACEUTICAL SCIENCES, 18th Edition (Gennaro A.R.,ed.), 1990, Mack Publishing Company). В определенных воплощениях оптимальную фармацевтическую композицию определяет специалист в данной области техники в зависимости, например, от назначенного пути введения, формата доставки и желательной дозировки (см., например, REMINGTON'S PHARMACEUTICAL SCIENCES, выше). В определенных воплощениях на такие композиции могут влиять физическое состояние, стабильность,скорость высвобождения in vivo и скорость клиренса антител по изобретению in vivo. В определенных воплощениях основной наполнитель или носитель в фармацевтической композиции может быть водным или неводным по природе. Например, подходящий наполнитель или носитель может представлять собой воду для инъекций, физиологический солевой раствор или искусственную спинномозговую жидкость, возможно с добавлением других веществ, обычных в композициях для парентерального введения. Нейтральный буферный солевой раствор или солевой раствор, смешанный с сывороточным альбумином, представляют собой дополнительные наполнители. В определенных воплощениях фармацевтические композиции по настоящему изобретению содержат Трис-буфер со значением рН примерно 7,0-8,5 или ацетатный буфер со значением рН примерно 4,0-5,5 и могут дополнительно включать сорбит, сахарозу, Твин-20 и/или их подходящий заменитель. В определенных воплощениях изобретения можно готовить композиции антитела анти-B7RP1 для хранения путем смешивания выбранной композиции, имеющей желаемую степень чистоты, с дополнительными агентами для приготовления препарата (REMINGTON'S PHARMACEUTICAL SCIENCES, см. выше) в форме лиофилизированного кека или водного раствора. Далее, в определенных воплощениях продукт антитела анти-B7RP1 может быть приготовлен в виде лиофилизата с использованием соответствующих эксципиентов, таких как сахароза. Фармацевтические композиции по изобретению могут быть выбраны для парентеральной доставки. Альтернативно, композиции могут быть выбраны для ингаляции или для доставки через пищеварительный тракт, например, перорально. Изготовление таких фармацевтически приемлемых композиций находится в компетенции специалиста в данной области техники. Компоненты препарата присутствуют в концентрациях, которые являются приемлемыми для сайта введения. В определенных воплощениях используют буферы для поддержания физиологического или несколько более низкого значения рН в композиции, обычно в пределах диапазона значений рН от примерно 5 до примерно 8. При рассмотрении парентерального введения терапевтические композиции для применения в данном изобретении могут быть представлены в форме апирогенного парентерально приемлемого водного раствора, содержащего желаемое антитело анти-B7RP1 в фармацевтически приемлемом носителе. Особенно пригодным носителем для парентеральной инъекции является стерильная дистиллированная вода,в которой антитело анти-B7RP1 включено в препарат в виде стерильного изотонического раствора, консервированного должным образом. В определенных воплощениях изготовление препарата может включать изготовление препарата желаемой молекулы с агентом, таким как инъекционные микросферы, биоразрушаемые частицы, полимерные соединения (такие как полимер молочной кислоты или полигликолевая кислота), гранулы или липосомы, которые могут обеспечить регулируемое или пролонгированное высвобождение продукта, который можно доставить путем инъекции депонируемого препарата. В определенных воплощениях также можно использовать гиалуроновую кислоту, обладающую эффектом стимуляции пролонгированного пребывания в системе кровообращения. В определенных воплощениях можно использовать имплантируемые устройства доставки лекарственного средства для введения желаемой молекулы антитела. Фармацевтические композиции по изобретению можно готовить для ингаляции. В этих воплощениях препарат антител анти-B7RP1 предпочтительно готовят в виде сухого ингаляционного порошка. В определенных воплощениях можно также готовить растворы антитела анти-B7RP1 для ингаляции с пропеллентом для доставки в виде аэрозоля. В определенных воплощениях растворы могут быть распыляемыми. Введение через легкие и способы изготовления препаратов дополнительно описаны в международной заявке на патент, номер публикации PCT/US 94/001875, которая включена здесь путем ссылки и описывает доставку химически модифицированных белков через легкие. Также рассматривают, что препараты можно вводить перорально. Препараты антител анти-B7RP1,которые вводят этим способом, можно готовить с носителями или без носителей, обычно используемых при компаундировании твердых лекарственных форм, таких как таблетки и капсулы. В определенных воплощениях может быть разработана капсула для высвобождения активной части препарата в таком месте желудочно-кишечного тракта, где биодоступность достигает максимума, а досистемный распад сведен к минимуму. Могут быть включены дополнительные агенты для облегчения всасывания антитела анти-B7RP1. Также можно использовать разбавители, корригенты, легкоплавкие воски, растительные- 23021669 масла, смазывающие агенты, суспендирующие агенты, разрыхлители для таблеток и связующие вещества. Предложена фармацевтическая композиция по изобретению, содержащая эффективное количество одного или множества антител анти-B7RP1 в смеси с нетоксичными эксципиентами, которые пригодны для изготовления таблеток. Путем растворения таблеток в стерильной воде или другом подходящем растворителе могут быть получены растворы в виде разовой дозы. Подходящие эксципиенты включают, но не ограничены, инертные разбавители, такие как карбонат кальция, карбонат или бикарбонат натрия,лактоза или фосфат кальция; или связующие агенты, такие как крахмал, желатин или аравийская камедь; или смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Дополнительные фармацевтические композиции очевидны для специалистов в данной области техники, включая препараты, содержащие антитела анти-B7RP1 в препаратах пролонгированной или регулируемой доставки. Методики изготовления ряда других средств пролонгированной или регулируемой доставки, например липосомные носители, биоразрушаемые микрочастицы или пористые гранулы и инъекция депонируемого препарата, также известны специалистам в данной области техники (см., например, международную заявку на патент, номер публикации PCT/US 93/00829, которая включена здесь путем ссылки и описывает регулируемое высвобождение пористых полимерных микрочастиц для доставки фармацевтических композиций). Препараты пролонгированного высвобождения могут включать полупроницаемые полимерные матрицы в виде формованных изделий, например пленок или микрокапсул. Матрицы замедленного высвобождения могут включать полиэфиры, гидрогели, полилактиды (как раскрыто в патенте США 3773919 и заявке на европейский патент, номер публикации ЕР 058481, каждая из которых включена здесь путем ссылки), сополимеры L-глутаминовой кислоты и гамма этил-Lглутамата (Sidman et al., 1983, Biopolymers 22: 547-556), поли(2-гидроксиэтил-метакрилат) (Langer et al.,1981, J. Biomed. Mater. Res. 15: 167-277 и Langer, 1982, Chem. Tech. 12: 98-105), этилена и винилацетата(Langer et al., выше) или поли-D(-)-3-гидроксимасляную кислоту (заявка на европейский патент, номер публикации ЕР 133988). Композиции пролонгированного высвобождения могут также включать липосомы, которые могут быть получены любым из нескольких методов, известных в данной области техники(см., например, публикацию Eppstein et al., 1985, Proc. Natl. Acad. Sci. USA 82: 3688-3692; заявки на европейский патент, номера публикаций ЕР 036676; ЕР 088046 и ЕР 143949, включенные путем ссылки). Фармацевтические композиции, применяемые для введения in vivo, обычно поставляют в виде стерильных препаратов. Стерилизация может быть достигнута путем фильтрации через стерильные фильтрующие мембраны. Когда композиция является лиофилизированной, стерилизацию с использованием этого метода можно провести либо до, либо после лиофилизации и восстановления. Композиции для парентерального введения можно хранить в лиофилизированной форме или в растворе. Парентеральные композиции обычно помещают в контейнер, имеющий стерильное входное отверстие, например в пакет или флакон для внутривенного раствора, имеющий пробку, которую протыкают иглой для подкожной инъекции. Приготовленную фармацевтическую композицию можно хранить в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого вещества или в виде дегидратированного или лиофилизированного порошка. Такие препараты можно хранить либо в форме, готовой к применению, либо в форме (например, лиофилизированной), которую восстанавливают перед введением. В изобретении также предложены наборы для получения однократной вводимой дозы. Наборы по изобретению может каждый содержать первый контейнер, содержащий высушенный белок, и второй контейнер, содержащий водный препарат. В определенных воплощениях данного изобретения предложены наборы, содержащие однокамерные и многокамерные предварительно заполненные шприцы (например, шприцы для жидкостей и шприцы для лиофилизированных продуктов). Эффективное количество фармацевтической композиции, содержащей антитело анти-B7RP1, для терапевтического применения зависит, например, от терапевтической ситуации и целей. Специалист в данной области техники понимает, что соответствующие уровни дозировки для лечения варьируют в зависимости отчасти от доставляемой молекулы, от показания, для которого применяют антитело антиB7RP1, от пути введения и от размера (массы тела, площади поверхности тела или размера органа) и/или состояния (возраста и общего состояния здоровья) пациента. В определенных воплощениях врач может титровать дозировку и модифицировать путь введения для получения оптимального терапевтического эффекта. Типичная дозировка может находиться в интервале от примерно 0,1 мкг/кг до примерно 30 мг/кг или более в зависимости от упомянутых выше факторов. В определенных воплощениях дозировка может находиться в интервале от 0,1 мкг/кг до примерно 30 мг/кг; от 1 мкг/кг до примерно 30 мг/кг или от 5 мкг/кг до примерно 30 мг/кг. Частота дозирования зависит от фармакокинетических параметров конкретного антитела антиB7RP1 в применяемом препарате. Как правило, врач назначает композицию до тех пор, пока не будет достигнута дозировка, при которой получают желаемый эффект. Поэтому композицию можно вводить в виде однократной дозы или в виде двух или более чем двух доз (которые могут содержать или не содержать одинаковое количество желаемой молекулы) за определенный промежуток времени, либо путем непрерывной инфузии через имплантированное устройство или катетер. Дальнейшее усовершенствова- 24021669 ние соответствующей дозировки обычно проводят специалисты в данной области техники, и оно находится в рамках задач, обычно выполняемых ими. Соответствующие дозировки могут быть установлены путем использования соответствующих данных доза-ответ. В определенных воплощениях антитела по изобретению можно вводить пациентам в течение продолжительного периода времени. Длительное введение антитела по изобретению сводит к минимуму неблагоприятный иммунный или аллергический ответ, обычно связанный с антителами, которые вызваны против антигена человека у животного, отличного от человека, например, не полностью человеческих антител, продуцируемых у вида, отличного от человека. Путь введения фармацевтической композиции находится в соответствии с известными методами,например, перорально, путем внутривенной, внутрибрюшинной, внутримозговой (интрапаренхимной),интрацеребровентрикулярной, внутримышечной, внутриглазной, внутриартериальной инъекции, инъекции в воротную вену или внутрь поражнных тканей; с помощью систем пролонгированного высвобождения или имплантационных устройств. В определенных воплощениях композиции можно вводить путем болюсной инъекции или непрерывно путем инфузии, либо с помощью имплантационного устройства. Композицию также можно вводить местным путем посредством имплантации мембраны, губки или другого подходящего материала, на который адсорбирована или в который инкапсулирована желаемая молекула. В определенных воплощениях, где применяют имплантационное устройство, это устройство можно имплантировать в любую подходящую ткань или орган, и доставка желаемой молекулы может быть осуществлена путем диффузии, болюсов с отсроченным высвобождением или непрерывного введения. Может быть также желательным применение фармацевтических композиций антитела анти-B7RP1 согласно изобретению ex vivo. В таких случаях клетки, ткани или органы, которые извлечены у пациента, подвергают воздействию фармацевтических композиций антитела анти-B7RP1, после чего клетки,ткани и/или органы имплантируют обратно пациенту. В частности, антитела анти-B7RP1 могут быть доставлены путем имплантации определенных клеток, которые сконструированы генно-инженерным путем, с использованием методов, таких как описаны здесь, для экспрессии и секреции полипептида. В определенных воплощениях такие клетки могут представлять собой клетки животных или человека и могут быть аутологичными, гетерологичными или ксеногенными. В определенных воплощениях клетки могут быть иммортализованы. В других воплощениях для снижения вероятности иммунологического ответа клетки могут быть инкапсулированы, чтобы избежать инфильтрации окружающих тканей. В следующих воплощениях материалы для инкапсуляции типично представляют собой биологически совместимые полупроницаемые полимерные оболочки или мембраны, которые допускают высвобождение белкового продукта(ов), но предотвращают разрушение клеток иммунной системой пациента или другими вредными факторами из окружающих тканей. Примеры Следующие примеры, включая проводимые эксперименты и достигнутые результаты, представлены только в иллюстративных целях и не должны рассматриваться как ограничение изобретения. Пример 1 Получение моноклональных антител человека против В 7-связанного белка-1 (B7RP1) Антиген В качестве антигена использовали очищенный рекомбинантный B7RP-1 человека (hB7RP-1), полученный, как описано в международной заявке на патент, номер публикации WO 00/46240, которая включена здесь путем ссылки, или клетки СНО, трансфецированные для экспрессии hB7RP-1. Зрелый B7RP-1 человека имеет аминокислотную последовательность остатков от X до 302 в последовательности, представленной в публикации WO 00/46240 как SEQ ID NO: 17, где X может представлять собой остаток 19,20, 21, 22, 24 или 28. Трансгенные мыши HuMab Полностью человеческие моноклональные антитела к B7RP-1 были получены с использованием линий НСо 7 и НСо 12 трансгенных мышей HuMab, обе из которых экспрессируют гены антител человека. В обеих из этих линий мышей эндогенный ген легкой цепи каппа мыши прерван в гомозиготном состоянии, как описано в публикации (см. Chen et al. (1993) EMBO J. 12: 811-820), a эндогенный ген тяжелой цепи мыши прерван в гомозиготном состоянии, как описано в примере 1 публикации РСТ WO 01/09187. Каждая из этих линий мышей несет трансген легкой цепи каппа человека, KCo5, как описано в публикации (см. Fishwild et al. (1996) Nature Biotechnology 14: 845-851). Линия НСо 7 несет трансген тяжелой цепи человека НСо 7, как описано в патентах США 5545806; 5625825 и 5545807. Линия НСо 12 несет трансген тяжелой цепи человека НСо 12, как описано в примере 2 публикации WO 01/09187. Иммунизации HuMab Для получения полностью человеческих моноклональных антител к B7RP-1 линии мышей HuMabHCo7 или НСо 12 иммунизировали очищенным рекомбинантным B7RP-1 или клетками СНО, трансфецированными для экспрессии B7RP-1. Общие схемы иммунизации мышей HuMab описаны в публикациях- 25021669 и в публикации РСТ WO 98/24884). Возраст мышей в момент первой инфузии антигена составлял 6-16 недель. Очищенный рекомбинантный препарат антигена B7RP-1 (50 мкг) или препарат трансфецированных клеток СНО (3,5106-1107 клеток) использовали для внутрибрюшинной иммунизации мышей HuMab. Трансгенных мышей дважды иммунизировали очищенным антигеном в полном адъюванте Фрейнда внутрибрюшинно с последующими внутрибрюшинными иммунизациями через 2-4 недели (всего вплоть до 8 иммунизации) очищенным антигеном в неполном адъюванте Фрейнда. Иммунизацию трансфецированными клетками СНО для экспрессии B7RP-1 проводили так же, за исключением того, что с этими клетками не использовали полный адъювант Фрейнда и неполный адъювант Фрейнда. Мониторинг иммунного ответа проводили путем забора крови из ретроорбитальных пазух. Скрининг плазмы проводили с помощью ЭЛАЙЗА (как описано ниже), и мышей с достаточными титрами иммуноглобулина человека анти-B7RP-1 использовали для слияния. Мышей повторно иммунизировали внутривенно антигеном за 3 и за 2 суток до умерщвления и извлечения селезенки. Как правило, проводили 10-20 слияний для каждого антигена. На каждый антиген иммунизировали несколько дюжин мышей. Всего 28 мышей линий НСо 7 и НСо 12 иммунизировали B7RP-1. Отбор мышей HuMab, продуцирующих антитела анти-B7RP-1 Для отбора мышей HuMab, продуцирующих антитела, которые связывают B7RP-1, сыворотки от иммунизированных мышей тестировали с помощью ЭЛАЙЗА, как описано Fishwild et al. (1996). Кратко,микротитрационные планшеты покрывали очищенным рекомбинантным B7RP-1 при концентрации 1-2 мкг/мл в буфере ФСБ, 50 мкл/лунка, инкубировали при 4 С в течение ночи, затем блокировали 200 мкл/лунка 5% сыворотки цыплят в буфере ФСБ/Твин (0,05%). Разведения плазмы от мышей, иммунизированных B7RP-1, добавляли в каждую лунку и инкубировали в течение 1-2 ч при температуре окружающей среды. Планшет промывали буфером ФСБ/Твин, а затем инкубировали с поликлональным антителом Fc коза против IgG человека, конъюгированным с пероксидазой хрена (HRP) в течение 1 ч при комнатной температуре. После промывки планшеты проявляли субстратом ABTS (Sigma, А-1888, 0,22 мг/мл) и анализировали с помощью спектрофотометра при оптической плотности 415-495. Мышей, которые проявляли самые высокие титры антител анти-B7RP-1, использовали для слияний. Слияния проводили, как описано ниже, и надосадочные жидкости гибридомы тестировали на активность противB7RP-1 с помощью ЭЛАЙЗА. Получение гибридом, продуцирующих моноклональные антитела человека к B7RP-1 Спленоциты мыши, выделенные из мышей HuMab, подвергали слиянию с помощью ПЭГ с клеточной линией миеломы мыши, основываясь на стандартных протоколах. Полученные в результате гибридомы подвергали скринингу на продуцирование антител, специфичных к антигену. Одноклеточные суспензии селезеночных лимфоцитов от иммунизированных мышей подвергали слиянию с одной четвертью от числа SP2/0-несекретирующих клеток миеломы мыши (АТСС, CRL 1581) с помощью 50% ПЭГ(Sigma). Клетки высевали в плоскодонный микротитрационный планшет в количестве примерно 1105/лунка, после чего инкубировали в течение примерно двух недель в селективной среде, содержащей 10% фетальную бычью сыворотку, 10% среды, кондиционированной P388D1 (АТСС, CRL TIB-63), 3-5%(Sigma, CRL Р-7185). Через 1-2 недели клетки культивировали в среде, в которой HAT был заменен НТ. Затем индивидуальные лунки подвергали скринингу с помощью ЭЛАЙЗА (описан выше) на моноклональные антитела человека IgG анти-B7RP-1. Как только появлялся интенсивный рост гибридомы, проводили мониторинг среды, обычно через 10-14 суток. Гибридомы, секретирующие антитела, пересевали,снова подвергали скринингу и, если оно проявляло положительную реакцию на IgG человека, моноклональные антитела анти-B7RP-1 субклонировали по меньшей мере дважды путем предельного разведения. Затем стабильные субклоны культивировали in vitro с получением небольших количеств антитела в среде для тканевых культур для дальнейшей характеристики. Пример 2 Клонирование тяжелых и легких цепей антитела анти-B7RP1 Гибридому, экспрессирующую B7RP1-связывающее моноклональное антитело 16 Н, использовали в качестве источника для выделения суммарной РНК с использованием реагента TRIzol (Invitrogen). Олигонуклеотиды 5' RACE (быстрая амплификация концов кДНК) (5'-CGA CUG GAG CAC GAG GACACU GAC AUG GAC UGA AGG AGU AGA AA-3'; SEQ ID NO: 69) лигировали в РНК, используя компоненты и протокол набора GeneRacer (Invitrogen). Первую нить кДНК синтезировали с использованием случайного праймера с адаптером удлинения (5'-GGC CGG ATA GGC CTC CAN NNN NNT-3') (SEQ IDNO: 59) и препаративный анализ 5' RACE (быстрая амплификация концов кДНК) проводили с использованием набора GeneRacer (Invitrogen) в соответствии с инструкциями от производителя. Для получения ДНК, кодирующей полноразмерную легкую цепь, прямой праймер представлял собой внутренний праймер из набора GeneRacer, а обратный праймер представлял собой (5'-GGG GTC AGG CTG GAA CTGAGG-3') (SEQ ID NO: 60). Для получения кДНК, кодирующей вариабельную область тяжелой цепи, пря- 26021669 мой праймер представлял собой праймер из набора GeneRacer, а обратный праймер представлял собой(Invitrogen) и определяли последовательности. Согласованные последовательности использовали для конструирования праймеров для ПЦР амплификации полноразмерной цепи антитела. Для получения кДНК, кодирующей легкую цепь каппа 16 Н анти-B7RP1, 5' праймер ПЦР кодировал аминоконец сигнальной последовательности, сайт рестрикции фермента XbaI и оптимизированную последовательность Козака (5'-CAG CAG AAG СТТ СТА GAC CAC CAT GGA CAT GAG GGT CCT CGCTCA GCT CCT GGG-3') (SEQ ID NO: 62). Праймер 3' кодировал карбоксильный конец и кодон терминации, а также сайт рестрикции SalI (5'-СТТ GTC GAC TCA АСА СТС ТСС CCT GTT GAA GCT С-3')(SEQ ID NO: 63). Полученный в результате фрагмент продукта ПЦР очищали, переваривали XbaI и SalI,a затем выделяли из геля и лигировали в экспрессионном векторе млекопитающих pDSR20 (см. международную заявку, номер публикации WO 90/14363, которая включена здесь путем ссылки для любой цели. pDSR20 получили путем замены нуклеотида 2563 в pDSR19 с гуанозина на аденозин с помощью сайт-направленного мутагенеза). Для получения кДНК, кодирующей тяжелую цепь 16 Н анти-B7RP1, 5' праймер ПЦР кодировал аминоконец сигнальной последовательности, сайт рестрикции фермента XbaI и оптимизированную последовательность Козака (5'-АСА АСА AAG СТТ СТА GAC CAC CAT GGA GTT GGG GCT GAA CTGG-3') (SEQ ID NO: 64). Праймер 3' кодировал карбоксильный конец вариабельной области, включая природный сайт смысловой нити BsmBI (5'-GTG GAG GCA СТА GAG ACG GTG ACC AGG ATT CC-3';SEQ ID NO: 65). Полученный в результате продукт очищали, переваривали XbaI и BsmBI, выделяли из геля и лигировали в векторе pDSR20, содержащем константную область IgG1 человека, а также в векторе pDSR20, содержащем константную область IgG2 человека. Все гибридомы, имеющие происхождение от вариабельных областей тяжелой цепи анти-B7RP1, независимо от ассоциированной нативной константной области клонировали, как описано выше, в обоих векторах pDSR20, содержащих константные области IgG1 человека и IgG2 человека. Пример 3 Экспрессия антител анти-B7RP1 в клетках яичников китайского хомячка (СНО) Стабильная экспрессия mAb 16H анти-B7RP1 была достигнута путем котрансфекции плазмид 16 Нтяжелая цепь/pDSR19 IgG2 B7RP1-каппа/pDSR19 в свободные от сыворотки клетки яичников китайского хомячка (СНО), дефицитные по дигидрофолатредуктазе (DHFR-), с использованием кальцийфосфатного метода (полноразмерная последовательность тяжелой цепи 16 Н представлена в последовательности SEQ ID NO: 44; последовательность каппа-цепи 16 Н представлена в последовательности SEQID NO: 45). Трансфецированные клетки отбирали в среде, содержащей диализированную сыворотку, но не содержащей гипоксантин-тимидин, чтобы обеспечить рост клеток, экспрессирующих фермент DHFR(дигидрофолатредуктазу). Трансфецированные клоны подвергали скринингу с использованием анализов,таких как ЭЛАЙЗА, для обнаружения экспрессии mAb 16H анти-B7RP1 в кондиционированной среде. Клоны с самой высокой экспрессией подвергали воздействию возрастающих концентраций метотрексата(МТХ) для амплификации DHFR. Амплифицированные с помощью МТХ клоны подвергали скринингу с использованием анализов, таких как ЭЛАЙЗА, для обнаружения экспрессии mAb 16H анти-B7RP1 в кондиционированной среде. Клоны с самой высокой экспрессией подвергали субклонированию для получения однородной популяции и создания клеточных банков. Другие рекомбинантные антитела анти-B7RP1 по изобретению могут быть получены в клетках яичников китайского хомячка, дефицитных по DHFR, с использованием такого же протокола, как описано выше для моноклонального антитела анти-B7RP1. Последовательности ДНК, кодирующие полноразмерную тяжелую цепь или легкую цепь каждого антитела анти-B7RP1 по изобретению, клонировали в экспрессионных векторах. Клетки CHOd котрансфецируют экспрессионным вектором, способным к экспрессии полноразмерной тяжелой цепи, и экспрессионным вектором, экспрессирующим полноразмерную легкую цепь соответствующего антитела анти-B7RP1. Например, для образования антитела 5D анти-B7RP1 клетки котрансфецируют вектором, способным к экспрессии полноразмерной тяжелой цепи,включающей аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 47, и вектором, способным к экспрессии полноразмерной легкой цепи, включающей аминокислотную последовательность, как представлено в последовательности SEQ ID NO: 48. В табл. 2 суммированы примеры полноразмерных легких цепей и примеры полноразмерных тяжелых цепей для антител антиB7RP1, имеющих константные области тяжелой цепи IgG человека. Специалисту в данной области техники понятно, что IgG1 или IgG2 можно заменить друг на друга (то есть там, где в таблице приведенIgG1, может присутствовать IgG2, и наоборот). Альтернативно, любой другой иммуноглобулин (например, IgM, IgA, IgE или IgH) можно использовать для получения антител по изобретению. Пример 4 Продуцирование антитела анти-B7RP1 Антитело анти-B7RP1 продуцируют путем экспрессии в клональной линии клеток СНО. Для каждого цикла продуцирования клетки из единственного флакона оттаивают в клеточной культуральной среде без сыворотки. Клетки выращивают первоначально в Т-образной колбе, затем во вращающихся колбах, а затем их выращивают в реакторах из нержавеющей стали возрастающего масштаба вплоть до биореактора на 2000 л. Продуцирование осуществляют в биореакторе на 2000 л с использованием культуры с подпиткой, в которую добавляют концентрированную среду, содержащую питательные вещества,для поддержания роста клеток и жизнеспособности культуры. Продуцирование длится в течение примерно двух недель, в течение которых антитело анти-B7RP1 конститутивно продуцируется клетками и секретируется в клеточную культуральную среду. Реактором для продуцирования управляют при заранее определенных значениях рН, температуры и уровня растворенного кислорода: значение рН регулируют добавлением углекислого газа и карбоната натрия; растворенный кислород регулируют потоками газообразного воздуха, азота и кислорода. В конце продуцирования клеточный бульон подают в тарелочный сепаратор, и надосадочную жидкость культуры отделяют от клеток. Концентрат далее осветляют, пропуская через объемный фильтр, а затем через фильтр 0,2 мкм. Затем осветленные кондиционированные среды концентрируют с помощью тангенциальной ультрафильтрации. Кондиционированные среды концентрируют в 15-30 раз. Затем полученную в результате концентрированную кондиционированную среду подвергают очистке или замораживают для последующей очистки. Пример 5 Преобразование mAb 16H в гаметический тип Выравнивание последовательности антитела 16 Н с последовательностями человека гаметического типа показало, что каркасная последовательность в вариабельной области антитела 16 Н наиболее идентична последовательностям VH 3-07 и JH4 гаметического типа, только с тремя различиями в аминокислотах (фиг. 1 А). Было обнаружено, что каркасная последовательность для области VK антитела 16 Н идентична последовательности VK1-L15 гаметического типа. Теоретически возможно, что соматические сверхмутации распознаются иммунным ответом пациента как чужеродные; в таком случае у пациента генерируется антиидиотипический ответ, который может нейтрализовать терапевтический. Для уменьшения этой возможности три замены аминокислоты в каркасной области VH были преобразованы обратно в последовательности VH 3-07 и JH4 гаметического типа (фиг. 1 А). Поскольку сегменты генов VH и JH гаметического типа присутствуют в каждом человеческом геноме, вариант 16 Н гаметического типа маловероятно будет распознан иммунным ответом дозируемого пациента как чужеродный. Были проведены планшетные биологические анализы на костимуляцию, чтобы определить, могут ли антитела, преобразованные в гаметический тип, индуцировать пролиферацию Т-клеток при IC50 подобной IC50 антител,не преобразованных в гаметический тип. Анализ костимуляции, проведенный, как описано ниже, с использованием анти-CD3 и гибридного белка hB7RP-1-Fc, подтвердил, что это антитело, преобразованное в гаметический тип, называемое 16Hgermline или 16Hg, сохраняет свою биологическую активность (фиг. 1 Б).- 28021669 Пример 6 Измерение сродства моноклональных антител методами Biacore и KinExA Три антитела (5D и 16 Н, полученные, как описано в примере 1, и 16 Н гаметического типа, полученное, как описано в примере 5) очищали и подвергали анализу на сродство связывания. B7RP1-Fc иммобилизовали при высокой плотности на чипе датчика СМ 5 с использованием стандартной химии сочетания аминов. Затем фиксированную концентрацию mAb инкубировали с варьирующими концентрациямиB7RP-1 или B7RP1-Fc в течение по меньшей мере 8 ч при комнатной температуре, чтобы дать им достичь равновесия. Затем образцы впрыскивали на поверхность B7RP1-Fc и наблюдали сигнал связывания,который дает свободное антитело, остающееся в растворе в равновесии. Путем использования двух различных концентраций антитела (0,2 нМ и 1 нМ) KD взаимодействия между конкретным mAb и лигандом вычисляли на основании нелинейного регрессионного анализа кривых конкурирования, используя модель двойной кривой однородного связывания единственного участка (Adamczyk et al., 1999, Bioconjugate Chem. 10: 1032-37; Adamczyk et al., 2000, Methods 20: 319-28). Как показано на фиг. 2 и в табл. 3, всеmAb 16H, 16Hg и 5D связываются растворимыми белками B7RP-1 и B7RP-1-Fc с высоким сродством. Кроме того, результаты показали, что 16 Н (не гаметического типа) и 16Hg (гаметического типа) реагируют подобным образом, что указывает на то, что преобразование в гаметический тип не оказывает значительного влияния на связывание между антителом и лигандом. Таблица 3 Связывание антител гаметического типа 5D, 2 Н и 2 Н также проверяли с использованием технологии KinExA (анализа кинетического исключения). В этом испытании hB7RP-1 связывали с агарозными гранулами. Эти гранулы использовали для создания колонки с гранулами. Затем образцы, содержащие антитело при фиксированной концентрации, которые оставляли для достижения равновесия с варьирующими концентрациями hB7RP-1, пропускали через колонку с гранулами. Антитело, не образовавшее комплекс с лигандом, связывалось с покрытыми гранулами. Вторичное антитело против Fc человека с флуоресцентной меткой использовали для обнаружения связанного тестируемого антитела. Полученный сигнал был пропорционален содержанию свободного антитела в растворе при данной концентрации лиганда. Используя две различных концентрации антитела, вычисляли KD взаимодействия на основании нелинейного регрессионного анализа кривых конкурирования, используя модель двойной кривой однородного связывания единственного участка (Adamczyket al., 1999, Bioconjugate Chem. 10: 1032-37; Adamczyk et al., 2000, Methods 20: 319-28). На фиг. 3-5 показаны двойные кривые соответствия для антител 5D, 2 Н и 2 Н (гаметический тип). С использованием этой методики наблюдали примерно 10-кратное различие KD для антител 5D и 2 Н. Результаты анализов Biacore и KinExA показали, что антитело 5D обладает более высоким сродством к hB7RP-1, чем 2 Н или 16 Н. Кроме того, вариант антитела 2 Н гаметического типа не проявляет существенного различия с конструкцией не гаметического типа. Пример 7 Функциональные характеристики антител анти-B7RP1 Функциональные характеристики антител B7RP-1 по изобретению оценивали с использованием анализов конкурентного связывания, анализа костимуляции in vitro и анализа со столбнячным анатоксином in vitro. Исследования конкурентного связывания Исследования конкурентного связывания проводили с mAb 16H, чтобы показать, что они могут конкурировать за связывание с B7RP-1 с ICOS. Клетки СНО, трансфецированные геном, кодирующим полноразмерный B7RP-1 человека, сначала инкубировали с понижающимися количествами немеченогоmAb 16H, а затем окрашивали гибридным белком ICOS-Fc с флуоресцентной меткой. Затем клетки анализировали с использованием проточной цитометрии. Как показано на фиг. 6, клетки СНО, трансфецированные B7RP-1, окрашены ICOS-Fc; 0,4 мкг/мл mAb 16H не оказывают влияния на связывание ICOSFc. Однако 6 и 25 мкг/мл 16 Н эффективно конкурировали за связывание ICOS-Fc, что указывает на то,что mAb 16H действительно конкурирует за связывание ICOS на B7RP-1. Анализ костимуляции Планшеты для клеточных культур (Falcon, Cat No.353077, U-образное дно) покрывали 1 мкг/мл антител против CD3 человека (PharMingen Cat No. 555336) и 10 мкг/мл антител против IgG человека (Fcспецифичные, Sigma Cat No. 13391). Антитела анти-CD3 и против иммуноглобулина человека в фосфатно-солевом буфере (ФСБ) добавляли в каждую лунку (10 мкл/лунка). Покрытые планшеты инкубировали при 4 С в течение ночи или при комнатной температуре в течение 2 ч. Затем планшеты дважды промывали буфером ФСБ. После промывки в каждую лунку добавляли 1 мкг/мл B7-2Fc человека (RD System,Cat No. 141-B2) или 5 мкг/мл hB7RP1Fc, каждый растворен в ФСБ (10 мкл на лунку). Затем планшеты
МПК / Метки
МПК: G01N 33/577, A61P 11/06, G01N 33/68, A61P 37/00, A61K 39/395, C12N 15/13, C07K 16/28, C12N 5/10
Метки: антитела, против, b7rp1, нейтрализующие, человека
Код ссылки
<a href="https://eas.patents.su/30-21669-nejjtralizuyushhie-antitela-cheloveka-protiv-b7rp1.html" rel="bookmark" title="База патентов Евразийского Союза">Нейтрализующие антитела человека против b7rp1</a>
Предыдущий патент: Способ подготовки обезэфиренного кориандра к прессованию
Следующий патент: Способ получения 5-гидроксиметилфурфураловых эфиров
Случайный патент: Носитель записи и устройство для сканирования носителя записи












