Производные фенэтаноламина для лечения респираторных заболеваний
Номер патента: 6646
Опубликовано: 24.02.2006
Авторы: Мур Ребекка Джейн, Коу Дайан Мэри, Монтейт Майкл Джон, Пэйтил Рэджникант, Лукер Брайан Эдгар, Гантрип Стивен Барри, Прокопиу Панайотис Александру, Биггадик Кейт, Эдни Дин Дейвид, Хэлтон Абигайль
Формула / Реферат
1. Соединение формулы (I)
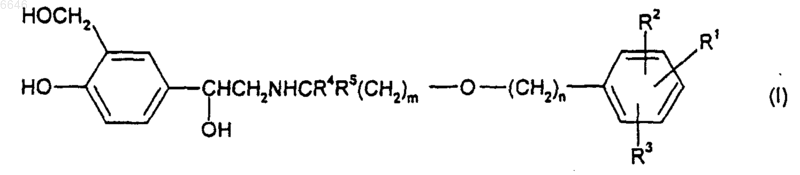
или его соль, сольват или физиологически функциональное производное,
где m представляет собой целое число от 2 до 8;
n представляет собой целое число от 3 до 11; при условии, что m+n равно от 5 до 19;
R1 представляет собой -XSO2NR6R7, где X представляет собой -(CH2)p- или C2-6алкенилен;
R6 и R7 независимо выбраны из водорода, C1-6алкила, C3-7циклоалкила, C(O)NR8R9, фенила и фенил(C1-4алкил)- или R6 и R7 вместе с азотом, к которому они присоединены, образуют 5-, 6- или 7-членное азотсодержащее кольцо и R6 и R7 каждый возможно замещен одной или двумя группами, выбранными из галогено, C1-6алкила, C1-6галогеноалкила, C1-6алкокси, гидроксизамещенного C1-6алкокси, -CO2R8, -SO2NR8R9, -CONR8R9, -NR8C(O)R9 или 5-, 6- или 7-членного гетероциклического кольца;
R8 и R9 независимо выбраны из водорода, C1-6алкила, C3-6циклоалкила, фенила и фенил(C1-4алкил)- и
p представляет собой целое число от 0 до 6;
R2 и R3 независимо выбраны из водорода, C1-6алкила, C1-6алкокси, галогено, фенила и C1-6галогеноалкила; и
R4 и R5 независимо выбраны из водорода и C1-4алкила при условии, что общее количество атомов углерода в R4 и R5 не превышает 4.
2. Соединение формулы (I) по п.1 или его соль, сольват или физиологически функциональное производное, где группа R1 присоединена в мета-положении относительно -O-(CH2)n-связи.
3. Соединение формулы (I) по п.1 или 2 или его соль, сольват или физиологически функциональное производное, где группа R1 представляет собой -SO2NR6R7, где R6 и R7 независимо выбраны из водорода и C1-6алкила.
4. Соединение формулы (I) по любому из пп.1-3 или его соль, сольват или физиологически функциональное производное, где R1 представляет собой -SO2NH2.
5. Соединение формулы (I) по любому из пп.1-4 или его соль, сольват или физиологически функциональное производное, где R4 и R5 оба представляют собой водород.
6. Соединение формулы (I) по любому из пп.1-5 или его соль, сольват или физиологически функциональное производное, где m равно 5 или 6 и n равно 3 или 4 с условием, что m+n равно 8, 9 или 10.
7. Соединение формулы (Iа)
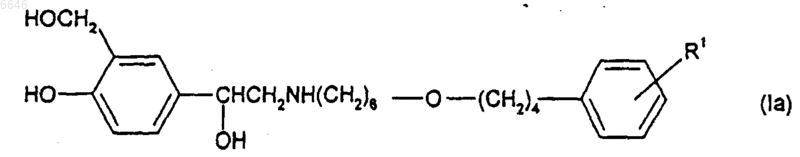
или его соль, сольват или физиологически функциональное производное, где R1 такой, как определено в п.1 для формулы (I).
8. Соединение формулы (Iа) по п.7 или его соль, сольват или физиологически функциональное производное, где R1 представляет собой -SO2NR6R7, где R6 и R7 независимо выбраны из водорода и C1-6алкила.
9. Соединение формулы (Iа) по п.7 или 8 или его соль, сольват или физиологически функциональное производное, где R1 представляет собой -SO2NH2.
10. Соединение формулы (Iа) по любому из пп.7-9 или его соль, сольват или физиологически функциональное производное, где R1 присоединен в мета-положении относительно -O-(CH2)4-связи.
11. Соединение формулы (Iб)
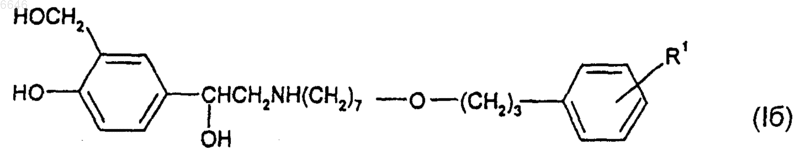
или его соль, сольват или физиологически функциональное производное, где R1 такой, как определено в п.1 для формулы (I).
12. Соединение формулы (Iб) по п.11 или его соль, сольват или физиологически функциональное производное, где R1 представляет собой -SO2NR6R7, где R6 и R7 независимо выбраны из водорода и C1-6алкила.
13. Соединение формулы (Iб) по п.11 или 12 или его соль, сольват или физиологически функциональное производное, где R1 представляет собой -SO2NH2.
14. Соединение формулы (Iб) по любому из пп.11-13 или его соль, сольват или физиологически функциональное производное, где R1 присоединен к мета-положению относительно -O-(CH2)3-связи.
15. Соединение формулы (I) или (Iа) по п.7, которое представляет собой 3-(4-{[6-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гексил]окси}бутил)бензолсульфонамид или его соль, сольват или физиологически функциональное производное.
16. Соединение формулы (I) или (Iб) по п.11, которое представляет собой 3-(3-{[7-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гептил]окси}пропил)бензолсульфонамид или его соль, сольват или физиологически функциональное производное.
17. Соединение по любому из пп.1-16, где указанные соль или сольват являются фармацевтически приемлемыми.
18. Соединение по любому из пп.1-17, которое находится в форме соли, образованной с фармацевтически приемлемой кислотой, выбранной из коричной, замещенной коричной, трифенилуксусной, сульфаминовой, сульфаниловой, нафталинакриловой, бензойной, 4-метоксибензойной, 2- или 4-гидроксибензойной, 4-хлорбензойной и 4-фенилбензойной кислоты.
19. Соединение по п.15, которое представляет собой циннамат 3-(4-{[6-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гексил]окси}бутил)бензолсульфонамида.
20. Соединение по п.16, которое представляет собой (E)-3-(нафталин-2-ил)-2-пропеноат 3-(3-{[7-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гептил]окси}пропил)бензолсульфонамида.
21. Способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан селективный агонист b2-адренорецепторов, при котором вводят терапевтически эффективное количество соединения формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного.
22. Соединение формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для применения в терапевтическом лечении.
23. Фармацевтический препарат, содержащий соединение формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное, и фармацевтически приемлемый носитель или эксципиент, и возможно один или более чем один дополнительный терапевтический ингредиент.
24. Комбинация, содержащая соединение формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное и один или более чем один дополнительный терапевтический ингредиент.
25. Комбинация по п.24, где дополнительным терапевтическим ингредиентом является PDE4 ингибитор, или антихолинергическое средство, или кортикостероид.
26. Комбинация по п.25, содержащая соединение формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное и 6a,9a-дифтор-17a-[(2-фуранилкарбонил)окси]-11b-гидрокси-16a-метил-3-оксо-андроста-1,4-диен-17b-карботионовой кислоты S-фторметиловый эфир.
27. Комбинация по п.26, где соединение формулы (I) представляет сосющ 3-(4-{[6-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гексил]окси}бутил)бензолсульфонамид или его соль, сольват или физиологически функциональное производное.
28. Комбинация по п.26, где соединение формулы (I) представляет собой 3-(3-{[7-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гептил]окси}пропил)бензолсульфонамид или его соль, сольват или физиологически функциональное производное.
29. Комбинация по п.25, содержащая соединение формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его соль, сольват или физиологически функциональное производное и 6a,9a-дифтор-11b-гидрокси-16a-метил-17a-[(4-метил-1,3-триазол-5-карбонил)окси]-3-оксо-андроста-1,4-диен-17b-карботионовой кислоты S-фторметиловый эфир.
30. Комбинация по п.29, где соединение формулы (I) представляет собой 3-(4-{[6-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гексил]окси}бутил)бензолсульфонамид или его соль, сольват или физиологически функциональное производное.
31. Комбинация по п.29, где соединение формулы (I) представляет собой 3-(3-{[7-({(2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил}амино)гептил]окси}пропил)бензолсульфонамид или его соль, сольват или физиологически функциональное производное.
32. Применение соединения формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного в изготовлении лекарства для профилактики или лечения клинического состояния, для которого показан селективный агонист b2-адренорецепторов.
33. Способ получения соединения формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его соли, сольвата или физиологически функционального производного, при котором удаляют защиту с защищенного промежуточного соединения формулы (II)
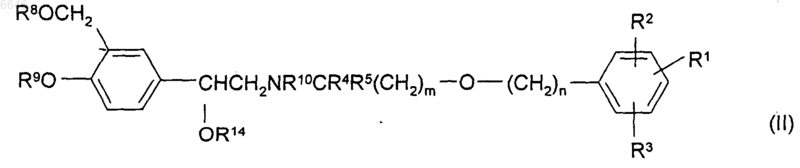
или его соли или сольвата, где R1, R2, R3, R4, R5, m и n такие, как определено для соединения формулы (I), (Iа) или (Iб), а R8, R9 и R10, каждый независимо, представляет собой либо водород, либо защитную группу при условии, что по меньшей мере один из R8, R9 и R10 является защитной группой и R14 представляет собой либо водород, либо защитную группу;
после чего осуществляют следующие стадии в любом порядке:
(2) возможно выделяют энантиомер из смеси энантиомеров;
(3) возможно превращают продукт в его соответствующую соль, сольват или физиологически функциональное производное.
34. Способ получения соединения формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его соли, сольвата или физиологически функционального производного, при котором осуществляют алкилирование амина формулы (XII)
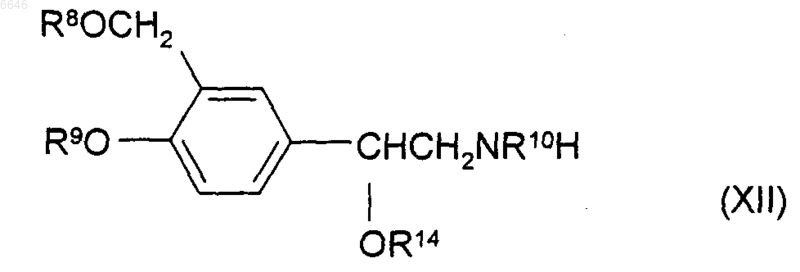
где R8, R9 и R10, каждый независимо, представляет собой либо водород, либо защитную группу, и R14 представляет собой либо водород, либо защитную группу, соединением формулы (XIII)
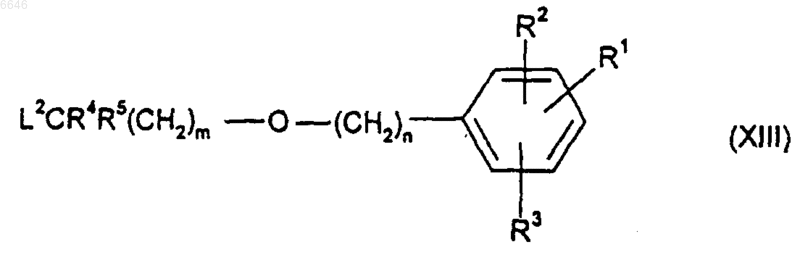
где R1, R2, R3, R4, R5, m и n такие, как определено для соединения формулы (I) или (Iа), и L2 является уходящей группой;
после чего осуществляют следующие стадии в любом порядке:
(1) возможно удаляют любые защитные группы;
(2) возможно выделяют энантиомер из смеси энантиомеров;
(3) возможно превращают продукт в его соответствующую соль, сольват или физиологически функциональное производное.
35. Способ получения соединения формулы (I), (Iа) или (Iб) по любому из пп.1-20 или его соли, сольвата или физиологически функционального производного, при котором осуществляют взаимодействие соединения формулы (XVII)
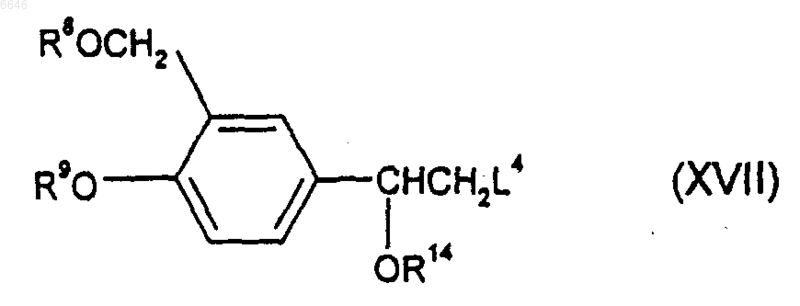
где R8, R9 и R14 такие, как определено выше, и L4 является уходящей группой, с амином формулы (XVIII)

где R1-R5, R10, m и n такие, как определено выше;
после чего осуществляют следующие стадии в любом порядке:
(1) возможно удаляют любые защитные группы;
(2) возможно выделяют энантиомер из смеси энантиомеров;
(3) возможно превращают продукт в его соответствующую соль, сольват или физиологически функциональное производное.
36. Способ получения соединения формулы (I), (Ia) или (Iб) по любому из пп.1-20 или его соли, сольвата или физиологически функционального производного, при котором удаляют хиральную вспомогательную группировку из соединения формулы (IIа)
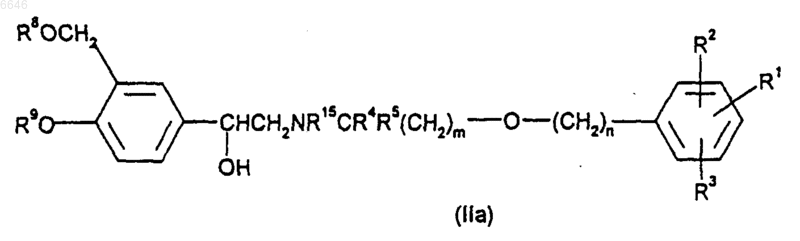
где R1-R5, R8, R9, m и n такие, как определено выше, и R15 представляет собой хиральную вспомогательную группировку;
после чего осуществляют следующие стадии в любом порядке:
(1) возможно удаляют любые защитные группы;
(2) возможно выделяют энантиомер из смеси энантиомеров;
(3) возможно превращают продукт в его соответствующую соль, сольват или физиологически функциональное производное.
37. Промежуточное соединение формулы (II)
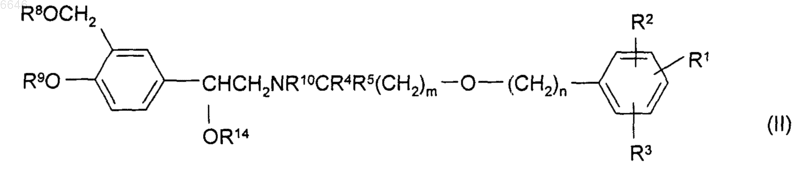
или его соль или сольват, где R1, R2, R3, R4, R5, m и n такие, как определено для соединения формулы (I), (Iа) или (Iб), а R8, R9 и R10, каждый независимо, представляет собой либо водород, либо защитную группу при условии, что по меньшей мере один из R8, R9 и R10 является защитной группой и R14 представляет собой либо водород, либо защитную группу.
38. Промежуточное соединение по п.37 формулы (III)
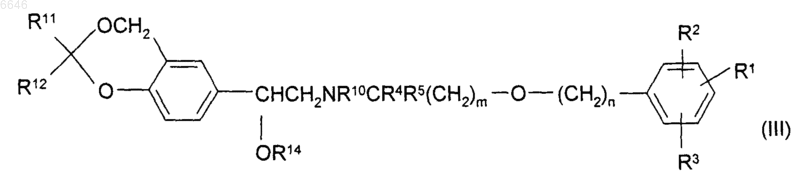
или его соль или сольват, где R11 и R12, каждый независимо, представляет собой C1-6алкил.
39. Промежуточное соединение формулы (IV)
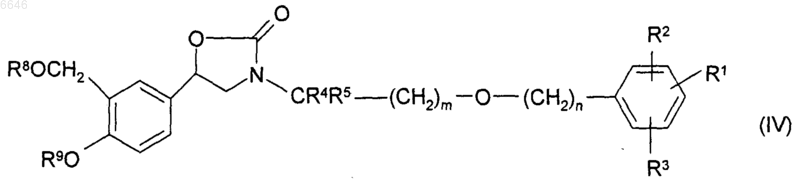
или его соль или сольват, где R1, R2, R3, R4, R5, m и n такие, как определено для соединений формулы (II) или (III).
Текст
006646 Настоящее изобретение относится к производным фенэтаноламина, к способам их получения, к композициям, содержащим их, и их применению в медицине, в частности в профилактике и лечении респираторных заболеваний. В данной области техники известно, что некоторые фенэтаноламинные соединения обладают селективным стимулирующим действием на 2-адренорецепторы и, следовательно, являются полезными при лечении бронхиальной астмы и родственных нарушений. Так в GB 2140800 описаны фенэтаноламинные соединения, включая 4-гидрокси-1-6-(4-фенилбутокси)гексил]амино]метил]-1,3-бензолдиметанола 1-гидрокси-2-нафталинкарбоксилат (сальметерола ксинафоат), который в настоящее время используется клинически при лечении таких медицинских состояний. Хотя сальметерол и другие имеющиеся в продаже агонисты 2-адренорецепторов являются эффективными бронходилататорами, максимальная длительность их действия составляет 12 ч, следовательно,часто требуется принимать дозу лекарства два раза в сутки. Следовательно, существует клиническая потребность в соединениях, обладающих сильным и селективным стимулирующим действием на 2 адренорецепторы и имеющих полезные характеристики действия. Согласно настоящему изобретению предложено соединение формулы (I) или его соль, сольват или физиологически функциональное производное, гдеm представляет собой целое число от 2 до 8;n представляет собой целое число от 3 до 11, предпочтительно от 3 до 7; при условии, что m+n равно от 5 до 19, предпочтительно от 5 до 12;R6 и R7 независимо выбраны из водорода, С 1-6 алкила, С 3-7 циклоалкила, C(O)NR8R9, фенила и фенил(С 1-4 алкил)-,или R6 и R7 вместе с азотом, к которому они присоединены, образуют 5-, 6-или 7-членное азотсодержащее кольцо,и R6 и R7 каждый возможно замещен одной или двумя группами, выбранными из галогено, С 1-6 алкила, С 1-6 галогеналкила, С 1-6 алкокси, гидроксизамещенного С 1-6 алкокси, -CO2R8, -SO2NR8R9, -CONR8R9,-NR8C(O)R9 или 5-, 6- или 7-членного гетероциклического кольца;R8 и R9 независимо выбраны из водорода, С 1-6 алкила, С 3-6 циклоалкила, фенила и фенил(С 1-4 алкил)-; и р представляет собой целое число от 0 до 6, предпочтительно от 0 до 4;R2 и R3 независимо выбраны из водорода, С 1-6 алкила, С 1-6 алкокси, галогено, фенила и C1-6 галогеналкила; иR4 и R5 независимо выбраны из водорода и С 1-4 алкила, при условии, что общее количество атомов углерода в R4 и R5 не превышает 4. В соединениях формулы (I) группа R1 предпочтительно присоединена в мета-положении относительно -O-(СН 2)n- связиR1 предпочтительно представляет собой -SO2NR6R7, где R6 и R7 независимо выбраны из водорода и С 1-6 алкила, более предпочтительно R1 представляет собой -SO2NH2.R4 и R5 независимо выбраны из водорода и метила, более предпочтительно R4 и R5 оба являются водородом.m соответственно равно 4, 5 или 6, и n соответственно равно 3, 4, 5 или 6. Предпочтительно m равно 5 или 6 и n равно 3 или 4, так что m+n равно 8, 9 или 10, предпочтительно 9. Согласно предпочтительному аспекту изобретения, предложено соединение формулы (Ia) или его соль, сольват или физиологически функциональное производное, гдеR1 такой, как определено выше для формулы (I). Согласно еще одному предпочтительному аспекту изобретения, предложено соединение формулы-1 006646 или его соль, сольват или физиологически функциональное производное, гдеR1 такой, как определено выше для формулы (I). В соединениях формул (Iа) и (Iб) группа R1 предпочтительно присоединена в мета-положении к -O(СН 2)n-, -O-(СН 2)4- или -O-(СН 2)3- связи соответственно. В соединениях формул (Iа) и (Iб) группа R1 предпочтительно представляет собой -SO2NR6R7, где R6 7 и R независимо выбраны из водорода и С 1-6 алкила, более предпочтительно R1 представляет собой-SO2NH2. Очевидно, что настоящее изобретение охватывает все комбинации отдельных и предпочтительных групп, описанных в заявке выше. Предпочтительные соединения по изобретению включают в себя 3-(4-[6-2R)-2-гидpoкcи-2-[4-гидpoкcи-3-(гидpoкcимeтил)фeнил]этиламино)гексил]оксибутил) бензолсульфонамид; 4-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил) бензолсульфонамид; 2-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил) бензолсульфонамид; 3-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)N-метилбензолсульфонамид; 2-(гидроксиметил)-4-(1R)-1-гидрокси-2-[(6-4-[3-(морфолин-4-илсульфонил)фенил]бутоксигексил)амино]этилфенол; 3-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)-N,N-диметилбензолсульфонамид; 3-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)-N-изопропилбензолсульфонамид;N2-[3-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]окси бутил)фенил]сульфонилглицинамид и их соли, сольваты и физиологически функциональные производные. В частности предпочтительные соединения по изобретению включают в себя 3-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил) бензолсульфонамид; 3-(4-[6-2S)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил) бензолсульфонамид; 3-(4-[6-2R/S)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)бензолсульфонамид; 3-(3-[7-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гептил]оксипропил)бензолсульфонамид; 3-(3-[7-2S)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гептил]оксипропил)бензолсульфонамид; 3-(3-[7-2R/S)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гептил]оксипропил)бензолсульфонамид и их соли, сольваты и физиологически функциональные производные. Из этих соединений 3-(4-[6-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино) гексил]оксибутил)бензолсульфонамид и 3-(3-[7-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил) фенил]этиламино)гептил]оксипропил)бензолсульфонамид являются особенно предпочтительными. В определении R1, где "R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 5-,6- или 7-членное азотсодержащее кольцо", термин "5-, 6- или 7-членное азотсодержащее кольцо" означает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, которое содержит сульфонамидный атом азота и возможно 1 или 2 другие гетероатома, независимо выбранные из азота, серы и кислорода. Подходящие примеры такого кольца включают в себя пиперидинил, морфолинил и пиперазинил. В определении R1, а именно возможных заместителей на R6 и R7, термин "5-, 6- или 7-членное гетероциклическое кольцо" означает 5-, 6- или 7-членное полностью или частично насыщенное или ненасыщенное кольцо, которое содержит 1, 2, 3 или 4 гетероатома, независимо выбранные из азота, серы и ки-3 006646 слорода. Подходящие примеры такого кольца включают в себя пирролил, фурил, тиенил, пиридинил,пиразинил, пиридазинил, имидазолил, тетразолил, тетрагидрофуранил, оксазолил, тиазолил, тиадиазолил, пиперидинил, морфолинил и пиперазинил. В определении X термин "алкенилен" включает в себя как цис, так и транс структуры. Подходящие примеры алкениловых групп включают в себя -СН=СН-. Соединения формул (I), (Ia) и (Iб) содержат центр асимметрии, а именно углеродный атом группы. Настоящее изобретение включает в себя как (S), так и (R) энантиомеры, либо, по существу, в чистой форме, либо в смеси в любых соотношениях. Аналогично, когда R4 и R5 являются разными группами, атом углерода, к которому они присоединены, является центром асимметрии, и настоящее изобретение включает в себя как (S), так и (R) энантиомеры в этом центре, либо, по существу, в чистой форме, либо в смеси в любых соотношениях. Таким образом, соединения формул (I), (Ia) и (Iб) включают в себя все энантиомеры и диастереомеры, а также их смеси в любых соотношениях. Соли и сольваты соединений формулы (I), (Ia) и (Iб), которые подходят для применения в медицине, являются такими, где противоион или ассоциированный растворитель является фармацевтически приемлемым. Однако соли и сольваты, имеющие фармацевтически неприемлемые противоионы или ассоциированные растворители, входят в объем данного изобретения, например, для применения в качестве промежуточных соединений при получении других соединений формул (I), (Ia) и (Iб) и их фармацевтически приемлемых солей, сольватов и физиологически функциональных производных. Под термином "физиологически функциональное производное" подразумевается химическое производное соединения формулы (I), (Ia) или (Iб), обладающее таким же физиологическим действием, как родительское соединение формулы (I), (Ia) или (Iб), например, при привращении в него в организме. Согласно настоящему изобретению, примеры физиологически функциональных производных включают в себя сложные эфиры. Подходящие соли по данному изобретению включают в себя соли, образованные как органическими, так и неорганическими кислотами или основаниями. Фармацевтически приемлемые соли присоединения кислот включают в себя соли, образованные соляной, бромисто-водородной, серной, лимонной,винной, фосфорной, молочной, пировиноградной, уксусной, трифторуксусной, трифенилуксусной, сульфаминовой, сульфаниловой, янтарной, щавелевой, фумаровой, малеиновой, яблочной, глутаминовой,аспарагиновой, щавелево-уксусной, метансульфоновой, этансульфоновой, арилсульфоновой (например пара-толуолсульфоновой, бензолсульфоновой, нафталинсульфоновой или нафталиндисульфоновой), салициловой, глутаровой, глюконовой, трикарбаллиловой, коричной, замещенной коричной (например фенил, метил, метокси или галогено замещенной коричной, включая 4-метил и 4-метоксикоричную кислоту), аскорбиновой, олеиновой, нафтойной, гидроксинафтойной (например 1- или 3-гидрокси-2 нафтойной), нафталинакриловой (например нафталин-2-акриловой), бензойной, 4-метоксибензойной, 2 или 4-гидроксибензойной, 4-хлорбензойной, 4-фенилбензойной, бензолакриловой (например 1,4 бензолдиакриловой) и изетионовой кислотами. Фармацевтически приемлемые соли оснований включают в себя соли аммония, щелочных металлов, таких как натрий и калий, соли щелочно-земельных металлов,таких как кальций и магний, и соли с органическим основаниями, например дициклогексиламином и Nметил-D-глюкамином. Преимущественно, предпочтительные соединения по изобретению, такие как 3-(4-[6-2R)-2 гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)бензолсульфонамид и 3-(3-[7-2R)-2-гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гептил]оксипропил)бензолсульфонамид предложены в форме кристаллической соли, например выбранной из приведенных в качестве примера в экспериментальном разделе ниже. Указанные кристаллические соли обладают благоприятными физическими свойствами, такими как низкая гигроскопичность и/или улучшенная стабильность. Особенно предпочтительные соли включают в себя циннамат, 4-метоксициннамат, 4 метилциннамат, нафталинпропеноат и 4-фенилциннамат. Фармацевтически приемлемые сложные эфиры соединений формул (I), (Ia) и (Iб) могут иметь гидроксильную группу, превращенную в C1-6 алкил, арил, арилС 1-6 алкил или аминоэфир кислоты. Как указано выше, соединения формул (I), (Ia) и (Iб) являются селективными агонистами 2 адренорецепторов, как показано с использованием считывания с функционального гена или генарепортера клеточных линий, трансфектированных человеческими бета-адренорецепторами, как описано ниже. Соединения по настоящему изобретению также обладают способностью объединять большую длительность действия с быстрым началом действия. Кроме того, некоторые соединения показали улучшенный терапевтический индекс в моделях на животных по сравнению с существующими 2 агонистическими бронходилататорами длительного действия. В качестве таковых соединения по данному изобретению могут быть полезными для введения один раз в сутки. Соединения формулы (I), (Ia) и (Iб) и их фармацевтически приемлемые соли, сольваты и физиологически функциональные производные имеют применение в профилактике и лечении клинических со-4 006646 стояний, для которых показан селективный агонист 2-адренорецепторов. Такие состояния включают в себя заболевания, связанные с обратимой непроходимостью дыхательных путей, такие как астма, хронические обструктивные заболевания легких (ХОЗЛ) (например хронический и сопровождающийся шумами бронхит, эмфизема), инфекция дыхательных путей и заболевание верхних дыхательных путей (например ринит, включая сезонный и аллергический ринит). Другие состояния, которые можно лечить, включают в себя преждевременные роды, депрессию, застойную сердечную недостаточность, кожные заболевания (например воспалительные, аллергические,псориазные и пролиферативные кожные заболевания), состояния, когда желательна пониженная кислотность желудка (например изъязвление желудка и двенадцатиперстной кишки) и гипотрофии мышц. Соответственно, в настоящем изобретении предложен способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которых показан селективный агонист 2 адренорецепторов, при котором вводят терапевтически эффективное количество соединения формулы(I), (Ia) или (Iб) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного. В частности, в настоящем изобретении предложен такой способ профилактики или лечения заболевания, связанного с обратимой непроходимостью дыхательных путей, такого как астма,хроническое обструктивное заболевание легких (ХОЗЛ), инфекция дыхательных путей или заболевание верхних дыхательных путей. В еще одном аспекте изобретения предложен такой способ профилактики или лечения клинического состояния, выбранного из преждевременных родов, депрессии, застойной сердечной недостаточности, кожных заболеваний (например воспалительных, аллергических, псориазных и пролиферативных кожных заболеваний), состояний, когда желательна пониженная кислотность желудка (например изъязвление желудка и двенадцатиперстной кишки), и гипотрофии мышц. Альтернативно в изобретении также предложено соединение формулы (I), (Ia) или (Iб) или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для применения в терапевтическом лечении, в частности, для применения в профилактике или лечении клинического состояния у млекопитающего, такого как человек, для которого показан селективный агонист 2 адренорецепторов. В частности, в изобретении предложено соединение формулы (I), (Ia) или (Iб) или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для профилактики или лечения заболевания, связанного с обратимой непроходимостью дыхательных путей, такого как астма, хроническое обструктивное заболевание легких (ХОЗЛ), инфекция дыхательных путей или заболевание верхних дыхательных путей. В еще одном аспекте предложено соединение формулы (I),(Ia) или (Iб) или его фармацевтически приемлемая соль, сольват или физиологически функциональное производное для профилактики или лечения клинического состояния, выбранного из преждевременных родов, депрессии, застойной сердечной недостаточности, кожных заболеваний (например воспалительных, аллергических, псориазных и пролиферативных кожных заболеваний), состояния, когда желательна пониженная кислотность желудка (например изъязвление желудка и двенадцатиперстной кишки), и гипотрофии мышц. В настоящем изобретении также предложено применение соединения формулы (I), (Ia) или (Iб) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного в изготовлении лекарства для профилактики или лечения клинического состояния, для которого показан селективный агонист 2-адренорецепторов, например заболевания, связанного с обратимой непроходимостью дыхательных путей, такого как астма, хроническое обструктивное заболевание легких (ХОЗЛ),инфекция дыхательных путей или заболевание верхних дыхательных путей. В еще одном аспекте предложено соединение формулы (I), (Ia) или (Iб) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного в изготовлении лекарства для профилактики или лечения клинического состояния, выбранного из преждевременных родов, депрессии, застойной сердечной недостаточности, кожных заболеваний (например воспалительных, аллергических, псориазных и пролиферативных кожных заболеваний), состояния, когда желательна пониженная кислотность желудка (например изъязвление желудка и двенадцатиперстной кишки), и гипотрофии мышц. Количество соединения формулы (I), (Ia) или (Iб) или его фармацевтически приемлемой соли, сольвата или физиологически функционального производного, которое требуется, чтобы достичь терапевтического действия, будет, конечно, меняться в зависимости от конкретного соединения, пути введения,субъекта, которого лечат, и конкретного нарушения или заболевания, которое лечат. Соединения по данному изобретению можно вводить путем ингаляции в дозе от 0,0005 до 10 мг, предпочтительно от 0,005 до 0,5 мг. Интервал дозировки для взрослых людей составляет обычно от 0,0005 до 100 мг в сутки и предпочтительно от 0,01 до 1 мг в сутки. Хотя соединение формулы (I), (Ia) или (Iб) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное можно вводить само по себе, предпочтительно представлять его в виде фармацевтического препарата. Соответственно, в настоящем изобретении, кроме того, предложен фармацевтический препарат, содержащий соединение формул (I), (Ia) или (Iб) или его фармацевтически приемлемую соль, сольват или-5 006646 физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один терапевтический ингредиент. Ниже термин "активный ингредиент" означает соединение формулы (I), (Ia) или (Iб) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное. Данные препараты включают в себя препараты, пригодные для перорального, парентерального(включая подкожное, внутрикожное, внутримышечное, внутривенное и внутрисуставное), ингаляционного (включая тонкодисперсные порошки или тонкое распыление, которое можно получить при помощи различных типов дозированных аэрозолей под давлением, небулайзеров или инсуффляторов), ректального и местного (включая кожное, защечное, подъязычное и внутриглазное) введение, хотя наиболее подходящий путь может зависеть от, например, состояния и нарушения у пациента. Препараты могут быть представлены для удобства в виде стандартной лекарственной формы, и их можно получить любыми способами, хорошо известными в области фармации. Все способы включают стадию, на которой объединяют активный ингредиент с носителем, который составляет один или более чем один вспомогательный ингредиент. В общем случае препараты получают путем равномерного и однородного объединения активного ингредиента с жидкими носителями или тонко диспергированными твердыми носителями, или обоими из них, и затем, если необходимо, доводят продукт до желаемого препарата. Препараты по настоящему изобретению, подходящие для перорального введения, можно представить в виде отдельных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит определенное заранее количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости; или в виде жидкой эмульсии масло-в воде или жидкой эмульсии вода-в-масле. Активный ингредиент также можно представить в виде болюса, электуария или пасты. Таблетку можно изготовить путем прессования или формовки, возможно с одним или более чем одним дополнительным ингредиентом. Прессованные таблетки можно получить путем прессования на подходящем аппарате активного ингредиента в сыпучей форме, такой как порошок или гранулы, возможно смешанного со связывающим веществом, смазывающим веществом, инертным разбавителем, замасливающим, поверхностно-активным или диспергирующим агентом. Формованные таблетки можно получить путем формовки на подходящем аппарате смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки могут быть возможно покрыты оболочкой или иметь риску, и их можно приготовить в виде препарата таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента. Препараты для парентерального введения включают в себя водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические средства, и растворы, которые делают препарат изотоническим с кровью намеченного реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загущающие агенты. Препараты могут быть представлены в контейнерах для единичной дозы и многодозовых контейнерах,например в герметично закупоренных ампулах и флаконах, и их можно хранить высушенными сублимационной сушкой (лиофилизированными), требующими только добавления стерильного жидкого носителя, например солевого раствора или воды для инъекции, непосредственно перед применением. Приготовленные для немедленной инъекции растворы и суспензии можно готовить из стерильных порошков,гранул и таблеток, предварительно описанного типа. Сухие порошковые композиции для местной доставки в легкие путем ингаляции можно, например,представить в виде капсул или картриджей из, например, желатина, или блистеров из, например, ламинированной алюминиевой пленки, для применения в ингаляторе или инсуффляторе. Препараты обычно содержат порошковую смесь соединения по изобретению для ингаляции и подходящую порошковую основу (вещество-носитель), такую как лактоза или крахмал. Применение лактозы является предпочтительным. Каждая капсула или картридж может в общем случае содержать 20 мкг -10 мг соединения формулы (I), возможно в комбинации с другим терапевтически активным ингредиентом. Альтернативно, соединение по изобретению может быть представлено без эксципиентов. Упаковка препарата может подходить для доставки единичной дозы или многих доз. В случае многодозовой доставки, препарат можно предварительно дозировать (например как в Diskus, смотри GB 2242134 илиDiskhaler, смотри GB 2178965, 2129691 и 2169265) или дозировать при применении (например как в Turbuhaler, смотри ЕР 69715). Примером однодозового устройства является Rotahaler (смотри GB 2064336). Ингаляционный аппарат Diskus содержит удлиненную полоску, образованную из основного листа,имеющего множество углублений, расположенных вдоль его длины, и закрывающий лист, который герметично, но легко снимаясь, закрывает его с получением множества контейнеров, причем каждый контейнер содержит вдыхаемый препарат, включающий в себя соединение формулы (I), предпочтительно объединенное с лактозой. Предпочтительно, полоска является достаточно гибкой, чтобы ее можно было смотать в валик. Покрывающий лист и основной лист предпочтительно имеют части передней кромки,которые не припаяны друг к другу, и по меньшей мере одна из указанных частей передней кромки сконструирована так, чтобы прикрепляться к средствам для намотки. Также предпочтительно, чтобы герметичное запечатывание между основным и покрывным листами распространялось на всю ширину. По-6 006646 крывной лист можно предпочтительно снять с основного листа в продольном направлении с первой кромки указанного основного листа. Спреевые композиции для местного высвобождения в легких путем ингаляции можно, например,приготовить в виде водных растворов или суспензий или аэрозолей, высвобождаемых из упаковок под давлением, таких как дозированный ингалятор, с использованием подходящего сжиженного пропеллента. Аэрозольные композиции, подходящие для ингаляции, могут представлять собой либо суспензию,либо раствор, и обычно содержат соединение формулы (I), возможно в комбинации с другим терапевтически активным ингредиентом и подходящим пропеллентом, таким как фторуглерод или водородсодержащий хлорфторуглерод или их смесь, в частности гидрофторалканы, например дихлордифторметан,трихлорфторметан, дихлортетра-фторэтан, особенно 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафтор-нпропан или их смесь. Диоксид углерода или другой подходящий газ также можно использовать в качестве пропеллента. Аэрозольная композиция может быть без эксципиента или может возможно содержать дополнительные эксципиенты для препаратов, хорошо известные в данной области техники, такие как поверхностно-активные вещества, например олеиновая кислота или лецитин, и сорастворители, например этанол. Препараты под давлением в общем случае содержат в контейнере (например алюминиевом контейнере), закрытом клапаном (например дозирующим клапаном) и прилегающем к исполняющему механизму с мундштуком. Лекарства для введения путем ингаляции имеют контролируемый размер частиц. Оптимальный размер частиц для ингаляции в систему бронхов составляет обычно 1-10 мкм, предпочтительно 2-5 мкм. Частицы, имеющие размер около 20 мкм, обычно слишком велики при ингаляции для того, чтобы достичь мелких дыхательных путей. Чтобы достичь таких размеров, частицы активного ингредиента при производстве можно уменьшить в размере традиционными способами, например микронизацией. Требуемую фракцию можно отделить при помощи пневмоклассификации или просеивания. Предпочтительно частицы являются кристаллическими. Когда используют эксципиенты, такие как лактоза, в общем случае размер частиц эксципиента будет намного больше, чем в ингаляционном лекарстве по настоящему изобретению. Когда эксципиент представляет собой лактозу, она обычно представлена истолченной лактозой, где не более 85% частиц лактозы имеет MMD (средний массовый диаметр) 60-90 мкм и не менее 15% имеют MMD менее 15 мкм. Интраназальные спреи можно приготовить в виде препарата с водными или неводными разбавителями с добавлением агентов, таких как загущающие агенты, буферные соли или кислота, или щелочь для доведения рН, агентов, регулирующих изотоничность или антиоксидантов. Растворы для ингаляции путем распыления можно изготовить с водным разбавителем с добавлением агентов, таких как кислота или щелочь, буферных солей, агентов, доводящих изотоничность, или противомикробных агентов. Их можно стерилизовать фильтрацией или нагреванием в автоклаве или представлять в виде нестерильного продукта. Препараты для ректального введения можно представить в виде суппозитория с обычными носителями, такими как какао-масло или полиэтиленгликоль. Препараты для местного введения в рот, например защечно или подъязычно, включают в себя лепешки, содержащие активный ингредиент в ароматизированном основании, таком как сахароза и гуммиарабик или трагакант, и пастилки, содержащие активный ингредиент в основании, таком как желатин и глицерин или сахароза и гуммиарабик. Предпочтительными стандартными лекарственными препаратами являются препараты, содержащие эффективную дозу, как изложено ранее, или соответствующую часть активного ингредиента. Очевидно, что в дополнение к ингредиентам, конкретно упомянутым выше, препараты по изобретению могут включать в себя другие агенты, традиционные в данной области техники, имеющие отношение к рассматриваемому вопросу, например препараты, подходящие для перорального введения, могут содержать ароматизирующие агенты. Соединения и фармацевтические препараты по изобретению могут быть использованы в комбинации с терапевтическими агентами или могут включать один или более чем один терапевтический агент,например выбранный из противовоспалительных агентов, антихолинергических агентов (в частности антагонистов М 1, М 2, М 1/М 2 или М 3 рецепторов), других антагонистов 2-адренорецепторов, противоинфекционных агентов (например антибиотиков, противовирусных средств) или противогистаминных средств. Таким образом, в данном изобретении предложена, в еще одном аспекте, комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с одним или более чем одним терапевтически активным агентом,например выбранным из противовоспалительного агента (например кортикостероида или NSAID), антихолинергического агента, другого агониста 2-адренорецепторов, противоинфекционного агента (например антибиотика или противовирусного средства) или антигистаминного средства. Предпочтительными являются комбинации, содержащие соединение формулы (I) или его фармацевтически приемлемую соль,сольват или физиологически функциональное производное вместе с кортикостероидом и/или антихоли-7 006646 нергическим средством, и/или ингибитором PDE-4. Предпочтительными комбинациями являются содержащие один или два других терапевтических агента. Специалистам в данной области техники очевидно, что, когда это удобно, другой(ие) терапевтический(е) ингредиент(ы) можно использовать в форме солей (например солей щелочного металла или аминных солей, или в виде солей присоединения кислот) или пролекарств, или в виде сложных эфиров(например низших алкилэфиров), или в виде сольватов (например гидратов) для оптимизации активности и/или стабильности, и/или физических характеристик (например растворимости) терапевтического ингредиента. Также очевидно, что, когда это удобно, терапевтические ингредиенты можно использовать в оптически чистой форме. Подходящие противовоспалительные агенты включают в себя кортикостероиды и NSAIDs (нестроидные противовоспалительные средства). Подходящими кортикостероидами, которые можно использовать в комбинации с соединениями по изобретению, являются такие пероральные и ингаляционные кортикостероиды и их пролекарства, которые обладают противовоспалительной активностью. Примеры включают в себя метилпреднизолон, преднизолон, дексаметазон, флутиказона пропионат, 6,9-дифтор 17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17-тионовой кислоты S-фторметиловый эфир, 6,9-дифтор-11-гидрокси-16-метил-3-оксо-17-пропионилоксиандроста 1,4-диен-17-карботионовой кислоты S-(2-оксотетрагидрофуран-3S-ил) эфир, сложные эфиры беклометазона (например 17-пропионатный сложный эфир или 17,21-дипропионатный сложный эфир), будесонид, флунизолид, сложные эфиры мометазона (например фуроатный эфир), триамцинолона ацетонид,рофлепонид, циклесонид, бутиксокорта пропионат, RPR-106541 и ST-126. Предпочтительные кортикостероиды включают в себя флутикозона пропионат, 6,9-дифтор-11-гидрокси-16-метил-17-[(4 метил-1,3-тиазол-5-карбонил)окси]-3-оксоандроста-1,4-диен-17-тионкарбоновой кислоты S-фторметиловый эфир и 6,9-дифтор-17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метил-3-оксоандроста 1,4-диен-17-тионкарбоновой кислоты S-фторметиловый эфир, более предпочтительно 6,9-дифтор 17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17-тионкарбоновой кислоты S-фторметиловый эфир. Подходящие NSAIDs (нестероидные противовоспалительные средства) включают в себя хромогликат натрия, недохромил натрия, ингибиторы фосфодиэстеразы (PDE) (например теофиллин, ингибиторыPDE4 или смешанные PDE3/PDE4 ингибиторы), антагонисты лейкотриена, ингибиторы лейкотриенового синтеза, ингибиторы iNOS (индуцибельной синтазы окиси азота), ингибиторы триптазы и эластазы, антагонисты бета-2-интегрина и антагонисты или агонисты аденозиновых рецепторов (например антагонисты аденозина-2 а), антагонисты цитокина (например антагонисты хемокина) или ингибиторы синтеза цитокина. Другие подходящие агонисты 2-адренорецепторов включают в себя сальметерол (например, в виде ксинафоата), сальбутамол (например, в виде сульфата или свободного основания), формотерол (например, в виде фумарата), фенотерол или тербуталин и их соли. Особенный интерес представляет применение соединения формулы (I) в комбинации с ингибитором фосфодиэстеразы 4 (PDE4) или смешанным PDE3/PDE4 ингибитором. Ингибитором, специфичным к PDE4, полезным в данном аспекте изобретения, может быть любое соединение, про которое известно,что оно ингибирует PDE4 фермент, или у которого обнаружено действие в качестве ингибитора PDE4, и которые являются только PDE4 ингибиторами, но не соединениями, которые ингибируют другие членыPDE семейства также как и PDE4. Обычно предпочтительно применять PDE4 ингибитор, который имеет отношение IС 50 около 0,1 или выше, рассчитанное как IC50 PDE4 каталитической формы, которая связывает ролипрам с высоким сродством, разделенное на IC50 формы, которая связывает ролипрам с низким сродством. Для целей настоящего описания, каталитический сайт сАМР (циклический аденозинмонофосфат), который связывает R и S ролипрам с низким сродством, назван сайтом связывания "с низким сродством" (LPDE 4) и другая форма этого каталитического сайта, которая связывает ролипрам с высоким сродством, называется сайтом связывания "с высоким сродством" (HPDE 4). Этот термин "HPDE4" не следует путать с термином "hPDE4", который используют для обозначения человеческой PDE4. Можно выполнить начальные эксперименты для установления и подтверждения анализа связывания [3 Н]-ролипрама. Подробности этой работы приведены в Анализах связывания, подробно описанных ниже. Анализы связывания фосфодиэстеразы и ролипрама Метод анализа 1 А. Было определено, что изолированная человеческая моноцитарная PDE4 и hrPDE (человеческая рекомбинантная PDE4) существуют в основном в форме с низким сродством. Следовательно, активность испытуемых соединений по сравнению с формой PDE4 с низким сродством можно оценить, используя стандартные анализы PDE4 каталитической активности, используя 1 мкМ [3 Н]сАМР в качестве субстрата(Torphy et al., J. of Biol. Chem., Vol. 267, No.3. pp. 1798-1804, 1992). Высокоскоростные супернатанты мозга крысы использовали как источник протеина, и оба энантиомера [3 Н]-ролипрама готовили со специфической активностью 25,6 Ки/ммоль. Стандартные условия анализа были модифицированы по сравнению с опубликованной методикой так, чтобы они стали аналогичными условиям PDE анализа, за ис-8 006646 ключением остатка сАМР: 50 мМ Трис HCl (рН 7,5), 5 мМ MgCl2, 50 мкМ 5'-АМР и 1 нМ [3 Н]-ролипрама(Torphy et al., J. of Biol. Chem., vol. 267, No. 3, pp. 1798-1804, 1992). Анализ выполняли в течение 1 ч при 30 С. Реакцию заканчивали, и связанный лиганд отделяли от свободного лиганда, используя сборщик клеток Бранделя (Brandel). Конкуренцию за сайт связывания с высокой активностью оценивали в условиях, идентичных используемым для измерения PDE активности с низким сродством, за исключением того, что отсутствовал [3 Н]-сАМР. Метод анализа 1 Б. Измерение фосфодиэстеразной активности.PDE активность измеряли, используя [3 Н]-сАМР SPA (полиакрилат натрия) или [3H]-cGMP (циклический гуанинмонофосфат) SPA ферментный анализ, как описано поставщиком (Amersham LifeSciences). Реакции осуществляли в 96-ячеечных планшетах при комнатной температуре в 0,1 мл реакционного буфера, содержащего (конечные концентрации): 50 мМ Трис-HCl, рН 7,5, 8,3 мМ MgCl2, 1,7 мМEGTA (Этиленгликоль-бис(-аминоэтилэфир)тетрауксусную кислоту), [3 Н]-сАМР или [3H]-cGMP (приблизительно 2000 dpm/пмоль), фермент и различные концентрации ингибиторов. Анализ проходил в течение 1 ч, и его заканчивали добавлением 50 мкл бусинок силиката иттрия на SPA в присутствии сульфата цинка. Планшеты встряхивали и оставляли стоять при комнатной температуре в течение 20 мин. Образование меченого изотопами продукта оценивали при помощи сцинтилляционной спектрометрии. Анализ связывания [3 Н]-R-ролипрама Анализ связывания [3 Н]-R-ролипрама осуществляли при помощи модифицированного метода Шнайдера и сотрудников, смотри Nicholson, et al. Trends Pharmacol. Sci., Vol. 12, pp. 19-27 (1991) иPDE4, см. Torphy et al. Mol. Pharmacol., Vol. 39, pp. 376-384 (1991). Следовательно, конкуренция за связывание [3 Н]-R-ролипрама обеспечивает независимое подтверждение PDE4 ингибирующих возможностей немеченных конкурентов. Анализ осуществляли при 30 С в течение 1 ч в 0,5 мкл буфера, содержащего (конечная концентрация): 50 мМ Трис-HCl, рН 7,5, 8,3 мМ MgCl2, 0,05% бычьего сывороточного альбумина, 2 нМ [3 Н]-R-ролипрама (5,7 х 104 dpm/пмоль) и различные концентрации немеченных изотопами ингибиторов. Реакцию останавливали добавлением 2,5 мл ледяного реакционного буфера (без [3H]R-ролипрама) и быстрой вакуумной фильтрацией (сборщик клеток Бранделя) через фильтры WhatmanGF/B, которые были пропитаны 0,3%-ным полиэтиленимином. Фильтры промывали дополнительно 7,5 мл холодного буфера, сушили и обсчитывали при помощи жидкостной сцинтилляционной спектрометрии. Предпочтительные ингибиторы PDE4 для применения по данному изобретению представляют собой те соединения, которые обладают полезным терапевтическим соотношением, то есть которые преимущественно ингибируют сАМР каталитическую активность, где фермент находится в форме, которая связывает ролипрам с низким сродством, таким образом уменьшая побочные эффекты, которые предположительно связаны с ингибированием формы, связывающей ролипрам с высоким сродством. Другим способом установления того, что предпочтительные соединения будут иметь отношение IC50 около 0,1 или выше, рассчитанное как IC50 PDE4 каталитической формы, которая связывает ролипрам с высоким сродством, разделенное на IC50 формы, которая связывает ролипрам с низким сродством. Еще одним усовершенствованием этих стандартных условий является то, что когда ингибиторPDE4 имеет IC50 отношение приблизительно 0,1 или выше; указанное отношение представляет собой отношение IC50 значения для конкуренции со связыванием 1 нМ [3 Н]-R-ролипрама с образование PDE4,который связывает ролипрам с высоким сродством по сравнению к IC50 значению для ингибированияPDE4 каталитической активности формы, которая связывает ролипрам с низким сродством, используя 1 мкМ [3 Н]-сАМР в качестве субстрата. Примерами полезных ингибиторов PDE4 являются:(S)-(-)-этил-[4-(3-циклопентилокси-4-метоксифенил)пирролидин-2-илиден]ацетат. Наиболее предпочтительными являются те ингибиторы PDE4, которые имеют отношение IC50 более 0,5, и в частности соединения, имеющие отношение более 1,0. Предпочтительными соединениями являются цис-4-циано-4-(3-циклопентилокси-4-метоксифенил)циклогексан-1-карбоновая кислота, 2-карбометокси-4-циано-4-(3-циклопропилметокси-4-дифторметоксифенил)циклогексан-1-он и цис-[4-циано 4(3-циклопропилметокси-4-дифторметоксифенил)циклогексан-1-ол]; они являются примерами соединений, которые предпочтительно связываются с сайтом связывания с низким сродством и которые имеют отношение IC50 0,1 или выше. Другие полезные соединения включают в себя соединения, описанные в патенте США 5552438,опубликованном 03 сентября 1996; этот патент и соединения, которые он раскрывает, включены в данное описание посредством ссылки во всей своей полноте. Особый интерес представляет соединение, раскры-9 006646 тое в патенте США 5552438, цис-4-циано-4-[3-(циклопентилокси)-4-метоксифенил]циклогексан-1 карбоновая кислота (также известное как циломаласт) и ее соли, сложные эфиры, пролекарства или физические формы;(CAS ссылка 162401-32-3) и фталазинон (WO 99/47505, описание которого включено в данное описание изобретения посредством ссылки) от Byk-Gulden; Pumafentrine, (-)-пара-[(4aR,10bS)-9-этокси 1,2,3,4,4 а,10b-гексагидро-8-метокси-2-метилбензо[с][1,6]нафтиридин-6-ил]-N,N-диизопропилбензамид,который является смешанным ингибитором PDE3/PDE4, который был получен и описан в публикацииByk-Gulden, теперь Altana; арофиллин в разработке Almirall-Prodesfarma; VM554/UM565 от Vemalis; или Т-440 (Tanabe Seiyaku; Fuji K. et al., J. Pharmacol. Exp. Ther. 1998, 284 (1) и Т 2585. Другие возможные PDE-4 и смешанные PDE3/PDE4 ингибиторы включают перечисленные в WO 01/13953, описания которых включены в данное описание изобретения посредством ссылки. Подходящими антихолинергическими агентами являются соединения, которые действуют как антагонисты на мускариновый рецептор, в частности такие соединения, которые являются антагонистами М 1 и М 2 рецепторов. Примеры соединений включает в себя алкалоиды растения белладонны, что продемонстрировано такими алкалоидами как атропин, скополамин, гоматропин, гиосциамин; эти соединения,являющиеся третичными аминами, обычно вводят в виде соли. Эти лекарственного средства, в частности их солевые формы, легко доступны из коммерческих источников или их можно получить по литературным данным, а именно: Атропин - CAS-51-55-8 или CAS-51-48-1 (безводная форма), атропина сульфат - CAS-5908-99-6; атропина оксид-CAS-4438-22-6 или его HCl соль - CAS-4574-60-1 или метилатропина нитрат - CAS-5288-0. Гоматропин - CAS-87-00-3, бромисто-водородная соль - CAS-51-56-9, метилбромидная соль - CAS80-49-9. Гиосциамин (d, l) - CAS-101-31-5, бромисто-водородная соль - CAS-306-03-6 и сульфатная соль CAS-6835-16-1. Скополамин - CAS-51-34-3, бромисто-водородная соль - CAS-6533-68-2, метилбромидная соль CAS-155-41-9. Предпочтительные антихолинергические агенты включают в себя ипратропий (например в виде бромида), продаваемые под названием Atrovent, окситропий (например в виде бромида) и тиотропий(например в виде бромида) (CAS-139404-48-1). Также представляют интерес: метантелин (CAS-53-46-3),пропантелина бромид (CAS-50-34-9), анизотропина метилбромид или Valpin 50 (CAS-80-50-2), клидиния бромид (Quarzan, CAS-3485-62-9), копирролат (Robinul), изопропамида иодид (CAS-71-81-8), мепензолата бромид (патент США 2918408), тридигексэтила хлорид (Pathilone, CAS-4310-35-4) и гексоциклия метилсульфат (Tral, CAS-15-63-9). Смотри также циклопентолата гидрохлорид (CAS-5870-29-1), тропикамид (CAS-1508-75-4), тригексифенидила гидрохлорид (CAS-144-11-6), пирензепин (CAS-29868-97-1),телензепин (CAS-80880-90-9), AF-DX 116 или метоктрамин, и соединения, раскрытые в WO 01/04118,описания которых включены в данное описание изобретения посредством ссылки. Подходящие антигистаминные средства (также упоминаемые как антагонисты Н 1-рецепторов) включают в себя один или более чем один из многочисленных известных антагонистов, которые ингибируют Н 1-рецепторы и безопасны для применения у человека. Все они представляют собой обратимые,конкурентные ингибиторы взаимодействия гистамина с Н 1-рецепторами. Большинство этих ингибиторов, главным образом антагонисты первого поколения, имеют структуру с активным ядром, которое можно представить следующей формулой: Эта обобщенная формула представляет три типа обычно доступных антигистаминных средств: этаноламинов, этилендиаминов и алкиламинов. Кроме того, другие антигистаминные средства первого поколения включают в себя средства, которые можно охарактеризовать как основанные на пиперизине и фенотиазинах. Антагонисты второго поколения, которые не являются седативными, обладают сходным соотношением структура-активность, они содержат центральную этиленовую группу (алкиламины) или имитируют третичную аминную группу пиперазином или пиперидином. Примерами антагонистов являются следующие: этаноламины: карбиноксамина малеат, клемастина фумарат, дифенгидрамина гидрохлорид и дименгидринат;- 10006646 этилендиамины: пириламина амлеат, трипеленнамина HCl и трипеленнамина цитрат; алкиламины: хлорфенирамин и его соли, такие как малеатная соль и акривастин; пиперазины: гидроксизина HCl, гидроксизина памоат, циклизина HCl, циклизина лактат, меклизинаHCl и цетиризина HCl. пиперидины: астемизол, левокабастина HCl, лоратадин или его дезкарбоэтокси аналог, и терфанадина и фексофенадина гидрохлорид или другая фармацевтически приемлемая соль. Азеластина гидрохлорид является еще одним антагонистом Н 1-рецепторов, который можно применять в комбинации с ингибитором PDE4. Примеры предпочтительных антигистаминных средств включают в себя метапирилен и лоратадин. Таким образом, в еще одном аспекте изобретения предложена комбинация, содержащая соединение формулы (I), его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с ингибитором PDE4. Таким образом, в еще одном аспекте изобретения предложена комбинация, содержащая соединение формулы (I), его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с кортикостероидом. Таким образом, в еще одном аспекте изобретения предложена комбинация, содержащая соединение формулы (I), его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с антихолинергическим средством. Таким образом, в еще одном аспекте изобретения предложена комбинация, содержащая соединение формулы (I), его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с антигистаминным средством. Таким образом, в еще одном аспекте изобретения предложена комбинация, содержащая соединение формулы (I), его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с ингибитором PDE4 и кортикостероидом. Таким образом, в еще одном аспекте изобретения предложена комбинация, содержащая соединение формулы (I), его фармацевтически приемлемую соль, сольват или физиологически функциональное производное вместе с антихолинергическим средством и ингибитором PDE4. Комбинации, упоминаемые выше, могут для удобства быть представлены в форме фармацевтического препарата, и таким образом фармацевтические препараты, содержащие комбинацию, как она определена выше, вместе с физиологически приемлемым разбавителем или носителем представляют собой еще один аспект изобретения. Отдельные соединения из таких комбинаций можно вводить либо последовательно, либо одновременно в раздельных и объединенных фармацевтических препаратах. Подходящие дозы известных терапевтических агентов очевидны для специалиста в данной области техники. Согласно еще одному аспекту изобретения предложен способ получения соединения формулы (I),(Ia) или (Iб) или его соли, сольвата или физиологически функционального производного, который включает в себя процедуру (а), (б), (в) или (с), как определено ниже, за которыми в любом порядке следуют следующие стадии:(1) возможно удаляют любые защитные группы;(2) возможно выделяют энантиомер из смеси энантиомеров;(3) возможно превращают продукт в его соответствующую соль, сольват или физиологически функциональное производное. В одном общем процессе (а), можно получить соединение формулы (I), (Ia) или (Iб) путем удаления защиты с защищенного промежуточного соединения, например формулы (II) или его соли или сольвата, где R1, R2, R3, R4, R5, m и n такие, как определено для соединения формулы (I),(Ia) или (Iб), R8, R9 и R10 каждый независимо является либо водородом, либо защитной группой, при условии, что по меньшей мере один из R8, R9 и R10 является защитной группой, и R14 является либо водородом, либо защитной группой. Подходящими защитными группами могут быть любые подходящие защитные группы, такие как описанные в "Protective Groups in Organic Synthesis" Theodora W. Greene and Peter G. M. Wuts, 3-е издание(John WileySons, 1999). Примерами подходящих защитных групп, представленных R8 и R9, являются сложные эфиры, такие как уксусный эфир, аралкильные группы, такие как бензил, дифенилметил или трифенилметил или тетрагидропиранил. Примеры подходящих защитных групп амина, представленныхR10, включают в себя бензил, -метилбензил, дифенилметил, трифенилметил, бензилоксикарбонил, третбутоксикарбонил и ацильные группы, такие как трихлорацетил или трифторацетил.- 11006646 Специалисту в данной области техники будет очевидно, что применение таких защитных групп может включать в себя ортогональную защиту групп в соединениях формулы (II) для облегчения селективного удаления одной группы в присутствии другой, таким образом делая возможной селективную функционализацию одной амино или гидроксильной функции. Например, СН(ОН) группу можно ортогонально защитить как -CHOR14, используя, например триалкилсилильную группу, такую как триэтилсилил. Специалисту в данной области техники также будут очевидны другие стратегии ортогональной защиты, доступные традиционными способами, такими как описано в Theodora W. Greene (смотри выше). Удаление защиты с получением соединения формулы (I), (Ia) или (Iб) можно осуществить, используя традиционные методики. Так, например, когда R8, R9 и/или R10 представляют собой аралкильную группу, ее можно расщепить путем гидрогенолиза в присутствии металлического катализатора (например палладия на угле). Когда R8 и/или R9 представляет собой тетрагидропиранил, его можно расщепить гидролизом в кислых условиях. Ацильную группу, представленную R10, можно удалить гидролизом, например основанием, таким как гидроксид натрия, или такую группу, как трихлорэтоксикарбонил, можно удалить восстановлением, например, цинком и уксусной кислотой. Другие способы удаления защиты можно найти вTheodora W. Greene (смотри выше). В частном воплощении способа (a), R8 и R9 могут вместе представлять собой защитную группу, как в соединении формулы (III) или его соли или сольвате, где R1, R2, R3, R4, R5, R14, m и n такие, как определено для соединения формулы (I), (Ia) или (Iб), R11 и R12 независимо выбраны из водорода, C1-6 алкила или арила. В предпочтительном аспекте оба R11 и R12 являются метилом. Соединение формулы (III) можно превратить в соединение формул (I), (Ia) или (Iб) гидролизом разбавленной водной кислотой, например уксусной кислотой или соляной кислотой, в подходящем растворителе или путем транскетализации в спирте, например этаноле, в присутствии катализатора, такого как кислота (например толуолсульфоновая кислота) или соль (такая как пиридиния тозилат) при нормальной или повышенной температуре. Очевидно, что защитные группы R8, R9, R10 и R14 (включая циклизованную защитную группу, образованную R8 и R9, как изображено в формуле (III можно удалить за одну стадию или последовательно. Точный порядок, в котором удаляют защитные группы, частично зависит от природы указанных групп и очевиден специалисту. Предпочтительно, когда R8 и R9 вместе образуют защитную группу, как в формуле (III), эту защитную группу удаляют вместе с любой защитной группой на СН(ОН) группировке, затем удаляют R10. Соединения формулы (II) и (III), где R10 является водородом, можно получить из соответствующего соединения формулы (IV) или его соли или сольвата, где R1, R2, R3, R4, R5, R8, R9, m и n такие, как определено для соединения формулы (II) или (III). Превращение соединения формулы (IV) в соединение формулы (II) или (III) можно осуществить путем обработки основанием, например неводным основанием, таким как триметилсиланоат калия, или водным основанием, таким как водный гидроксид натрия, в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы (IV) можно получить из соответствующего соединения формулы (V): или его соли или сольвата, где R4, R5, R8, R9, m и n такие, как определено для соединения формулы (IV); путем связывания с соединением формулы (VI) где R1, R2 и R3 такие, как определены для соединения формулы (IV), и L является уходящей группой,такой как группа галогена (обычно бром или йод) или сульфонатный эфир, такой как галогеналкилсульфонат (обычно трифторметансульфонат), с последующим восстановлением. Связывание соединения формулы (V) с соединением формулы (VI) удобно осуществлять в присутствии системы катализаторов, такой как бис(трифенилфосфин)палладия дихлорида, с органическим основанием, таким как триалкиламин, например триэтиламин, в подходящем растворителе, например ацетонитриле или диметилформамиде. Полученный в результате алкин можно затем восстановить либо с выделением, либо без выделения, с образование соединения формулы (IV). Восстановление можно осуществить любым подходящим методом, таким как гидрирование в присутствии катализатора, например палладий/уголь или оксид платины. Альтернативно, в соединениях формулы (VI) R1, R2 и R3 могут представлять собой группы, превращаемые в R1, R2 и R3, например группы галогена. Это особенно полезно, когда одна из групп R1, R2 и R3 может подвергаться воздействию при любой из следующих трансформаций. Так, например, когда R1 содержит алкениленовую группировку, ее предпочтительно вводить после восстановления алкина, образованного при взаимодействии соединения (V) или (VI). Соединения формулы (VI) имеются в продаже или их можно получить способами, хорошо известными специалисту в данной области техники. Соединения формулы (V) можно получить путем связывания соединения формулы (VII) или его соли или сольвата, где R8 и R9 такие, как определены для соединения формулы (V) с соединением формулы (VIII)L1CR4R5(CH2)m-О-(CH2)n-2- ССН (VIII) 4 5 где R , R , m и n такие, как определено для соединения формулы (V), и L1 является уходящей группой, например группой галогена (обычно бром или йод) или сульфонатом, таким как алкилсульфонат(обычно трифторметансульфонат). Связывание соединения формулы (VII) с соединением формулы (VIII) можно осуществить в присутствии основания, такого как гидрид металла, например гидрид натрия, или неорганического основания, такого как карбонат цезия, в апротонном растворителе, например диметилформамиде. Соединения формулы (VIII) можно получить из соответствующих дигалогеналкана и гидроксиалкина при помощи традиционных химических методов, обычно в присутствии неорганического основания, такого как водный гидроксид натрия, в условиях фазового перехода в присутствии соли, такой как тетраалкиламмония бромид. Соединения формулы (VII) можно получить путем замыкания кольца соединения формулы (IX) где R8 и R9 такие, как определено для соединения формулы (VII), и R13 является С 1-6 алкилом, например трет-бутилом, или арилом, например фенилом. Замыкание кольца можно осуществить путем обработки основанием, таким как гидрид металла, например гидрид натрия, в присутствии апротонного растворителя, например диметилформамида. Соединения формулы (IX) можно получить из соответствующего кетона формулы (X) где R8 и R9, и R13 такие, как определено для соединения формулы (IX), путем восстановления любым подходящим способом, например обработкой бораном, в присутствии хирального катализатора, такого как CBS-оксазаборолидин, в подходящем растворителе, таком как тетрагидрофуран. Соединение формулы (X) можно получить из соответствующего галогенида формулы (XI) где R8 и R9 такие, как определены для соединения формулы (X) и Y является галогено, возможно бромо. Превращение соединения формулы (XI) в соединение формулы (X) можно осуществить путем взаимодействия с защищенным амином HN(COOR13)2, где R13 такой, как определено для соединения формулы (X), в присутствии неорганического основания, такого как карбонат цезия, с последующим селективным удалением одной из COOR13 групп, например путем обработки кислотой, такой как трифторуксусная кислота. Соединения формулы (XI) можно получить из соответствующего соединения, имеющего свободные гидроксиметильные и гидроксильные заместители (которые можно получить из 2-бром-1-(4-гидрокси)-3 гидроксиметил-фенетил)этанона, получение которого описано в GB2140800, путем обработки 2 метоксипропаном в ацетоне в присутствии кислоты, например пара-толуолсульфоновой кислоты в атмосфере азота или другими стандартными методами) путем образования защищенных групп R8OCH2- иR9O-, где R8 и R9 такие, как определены для соединения формулы (XI). Такие методы описаны в DE 3513885 (Glaxo). Соединения формулы (II) или (III), где R10 представляет собой защитную группу, можно получить,как описано в способе (б) ниже, или способами, аналогичными нижеприведенному способу (в). В еще одном способе (б), соединение формулы (I), (Ia) или (Iб) можно получить путем алкилирования амина формулы (XII) где R8, R9, R10 и R14 представляют собой независимо либо водород, либо защитную группу; подходящие защитные группы обсуждаются в определении соединений формулы (II); с соединением формулы (XIII) где R1, R2, R3, R4, R5, m и n такие, как определено для соединения формулы (I), (Ia) или (Iб), и L2 является уходящей группой, такой как группа галогена (обычно бром); с последующим удалением любой присутствующей защитной группы традиционными способами, как описано выше, для удаления защиты с соединений формулы (II). Взаимодействие соединений формул (XII) и (XIII) обычно осуществляют в присутствии органического основания, такого как триалкиламин, например диизопропилэтиламин, и в подходящем растворителе, например диметилформамиде. Соединения формулы (XII) известны в данной области техники (например ЕР-А 0947498) или могут быть легко приготовлены специалистом в данной области техники. Соединения формулы (XIII) можно легко получить путем связывания соединения формулы (VI),как определено выше, или его предшественника (где один или более чем один заместитель R1, R2 или R3 является группой, превращаемой в требуемую группу R1, R2 или R3) с соединением формулы (VIII), как показано выше, где R4, R5, m и п такие, как определено для соединения формулы (XIII), и L1 является уходящей группой, как определено выше. Связывание соединения формулы (VIII) с соединением формулы (VI) можно осуществить способами, аналогичными описанным выше для связывания соединения формулы (V) с соединением формулы(VI), с последующим восстановлением полученного в результате алкина формулы (XIV) также как описано выше. Если необходимо, заместители R1, R2 и/или R3 могут быть образованы путем традиционных превращений, в которых участвует предшественник. Алкин формулы (XIV) также можно получить путем взаимодействия соединения формулы (XV): используя традиционные способы, например как описано для получения соединений (VIII). Соединения формулы (XVI) можно получить путем взаимодействия гидроксиалкина с соединением формулы (VI), используя методы, аналогичные описанным выше, для связывания соединения (V) с соединением (VI). В еще одном способе (в) соединение формулы (I), (Ia) или (Iб) можно получить путем взаимодействия, при котором соединение формулы (XVII) с последующим удалением любых присутствующих защитных групп, осуществляемым традиционными методами, как описано выше, для удаления защиты соединений формулы (II). Взаимодействие можно осуществить, используя условия, стандартные для таких реакций замещения. Соединения формулы (XVII) можно получить методами, известными в данной области техники. Соединения формулы (XVIII) можно получить путем взаимодействия соединения формулы (XIII) с амином R10NH2. В еще одном способе (г) соединение формулы (I), (Ia) или (Iб) можно получить путем удаления хиральной вспомогательной группировки из соединения формулы (IIа) где R1-R5, R8, R9, m и n такие, как определено ранее, и R15 представляет собой хиральную вспомогательную группировку."Хиральная вспомогательная группировка" представляет собой группировку, которую вводят в молекулу, чтобы оказать воздействие на стереохимию образуемого продукта, и позже целиком или частично удаляют. Хиральная вспомогательная группировка может одновременно выступать и в качестве защитной группы. Многие хиральные вспомогательные группировки имеются в продаже, и специалистам в данной области техники следует выбирать ее, исходя из желательных свойств, то есть желательной абсолютной стереохимии и совместимости с используемыми методиками. Хиральные вспомогательные группировки,пригодные для применения в этом способе, включают в себя S-изомер и/или R-изомер фенилглицинола и его замещенные производные, но не ограничены ими. Хиральная вспомогательная группировка предпочтительно представляет собой группировку формулы- 15006646 или ее один энантиомер, где R16 представляет собой С 1-6 алкил или возможно замещенный фенил или бензил, где возможный заместитель представляет собой один или более чем один, выбранный из С 1-6 алкила, галогена, гидрокси, C1-6 алкокси или нитро, например парагидроксифенил. Более предпочтительно хиральная вспомогательная группировка представляет собой группировку где R16 такой, как определен выше. Альтернативно, это может быть группировка формулы где R16 такой, как определен выше. Предпочтительно R16 представляет собой фенил, возможно замещенный так, как описано выше. Наиболее предпочтительно, R представляет собой незамещенный фенил. Хиральную вспомогательную группировку в этом способе обычно можно удалить при помощи гидрогенолиза, используя, например, катализатор палладий на угле, или предпочтительно используя гидроксид палладия (катализатор Пирлмана). Удаление хиральной вспомогательной группировки наиболее эффективно преимущественно тогда, когда используют катализатор Пирлмана. Этот способ удаления особенно пригоден, когда R1 представляет собой фенил или замещенный фенил. Альтернативно, можно получить производные азота, к которому присоединена вспомогательная группировка, в условиях окисления с образованием N-оксида, с последующим его удалением путем нагревания с получением вторичного амина. Соединение формулы (IIа) можно получить путем восстановления соответствующего алкина формулы (XIX) Предпочтительно в соединениях формул (IIа) и (XIX) защитные группы R8 и R9 вместе образуют группу -CR11R12- как в соединениях формулы (III). Восстановление алкина формулы (XIX) можно осуществить способами, хорошо известными в данной области техники, например, путем каталитического гидрирования, используя палладий на угле или более предпочтительно гидроксид палладия (катализатор Пирлмана). Хиральную дополнительную группу также можно удалить в восстанавливающих условиях. Следовательно, восстановление алкина и удаление хиральной вспомогательной группы можно преимущественно осуществить реакцией в "одной емкости". Алкин формулы (XIX) можно получить путем взаимодействия соединения формулы (XX) с соединением формулы (VI) в условиях, описанных выше, для связывания соединений (V) и (VI). Соединение формулы (XX) можно получить путем взаимодействия соединения формулы (XIIа) используя известные способы для осуществления восстановительного аминирования, например триацетоксиборгидридом натрия в растворителе, таком как хлороформ.- 16006646 Альдегид формулы (XXI) можно получить из соответствующего галогенида формулы (VIII), используя стандартные методики, такие как обработка бикарбонатом натрия в растворителе, таком какDMSO (диметилсульфоксид), при повышенной температуре, предпочтительно в пределах 130-160 С. Соединение формулы (ХIIа) можно получить из соединения формулы (XXII) где R8, R9 и R15 такие, как определено ранее, путем обработки восстанавливающим агентом, таким как источник гидрида, например боргидрид натрия. Предпочтительно этот способ осуществляют в присутствии соли инертного металла, такой как хлорид кальция, подходящим образом при неэкстремальной температуре, например, ниже температуры окружающей среды, такой как 0 С. Это позволяет ввести требуемую стереометрию эффективно, с большим энантиомерным избытком на ранней стадии синтеза, используя недорогие и относительно безвредные реагенты. Кроме того, энантиомерный избыток можно увеличить путем перекристаллизации продукта по этому способу. Соединение формулы (XXII) можно получить из соединения формулы (XI), как определено ранее в заявке, путем взаимодействия с соответствующим хиральным амином, например (S)-фенилглицинолом, в присутствии ненуклеофильного основания в инертном растворителе при неэкстремальных температурах. Подробное изложение способа, аналогичного cпособу (г), можно найти в опубликованной международной заявке номер WO/0196278. В изложенном выше способе (г) предпочтительно, чтобы защитные группы R8 и R9 вместе образовывали защитную группу, как показано в формуле (III). Очевидно, что при любом из способов (а)-(г), описанных выше, точный порядок стадий синтеза, посредством которых в молекулу вводят различные группы и группировки, может меняться. Благодаря своей квалификации в данной области техники, исполнитель должен обеспечить, чтобы на группы и группировки, вводимые на одной стадии данного способа, не воздействовали последующие трансформации и реакции, и соответственно выбрать порядок стадий синтеза. Энантиомерные соединения по изобретению можно получить (1) путем разделения компонентов соответствующей рацемической смеси, например при помощи хиральной колоночной хроматографии,методами ферментативного разделения или получая и разделяя соответствующие диастереомеры или (2) путем прямого синтеза из соответствующих хиральных промежуточных соединений методами, описанными выше. Возможные превращения соединения формулы (I), (Ia) или (Iб) в соответствующую соль можно легко осуществить путем взаимодействия с соответствующей кислотой или основанием. Возможное превращение соединения формулы (I), (Ia) или (Iб) в соответствующий сольват или физиологически функциональное производное можно осуществить способами, известными специалистам в данной области техники. В соответствии с еще одним аспектом, в настоящем изобретении предложены новые промежуточные соединения для получения соединений формулы (I), (Ia) или (Iб), например: соединения формулы (II) и (III), как определено выше, или его оптического изомера, соли, или защищенного производного, в частности, соединения, выбранного из 3-4-[(6-[(2R)-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексил)окси]бутилбензолсульфонамида; 4-4-[(6-[(2R)-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексил)окси]бутилбензолсульфонамида; 2-4-[(6-[(2R)-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексил)окси]бутилбензолсульфонамида; 3-4-[(6-[(2R)-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексил)окси]бутил-N-метилбензолсульфонамида;[1,1'-бифенил]-3-сульфонамида; 3-4-[(6-[(2R)-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексил)окси]бутил-5-пентилбензолсульфонамида; соединения формулы (IV), как определено выше, или их оптический изомер, соль или защищенное производное; в частности, соединение, выбранное из 3-[4-(6-[(5R)-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексилокси) бутил]бензолсульфонамида;- 19006646 Перечень фигур Фиг. 1 - XRPD картина (картина дифракции рентгеновских лучей на порошке) соединения примера 48(2); фиг. 2 - XRPD картина соединения примера 48(3); фиг. 3-XRPD картина соединения примера 48(4); фиг. 4 - XRPD картина соединения примера 48(5); фиг. 5-XRPD картина соединения примера 48(6). Для лучшего понимания данного изобретения, в качестве иллюстрации приведены следующие примеры. Примеры синтеза В примерах использованы следующие сокращения:XRPD: дифракция рентгеновских лучей на порошке. Все температуры приведены в градусах Цельсия. Силикагель относится к Merck силикагелю 60 с артикуляционным номером 7734. Флэш-силикагель относится к Merck силикагелю 60 с артикуляционным номером 9385.Biotage относится к предварительно упакованным картриджам силикагеля, содержащим KP-Sil, нанесенный на флэш 12i хроматографический модуль.Bond Elut представляют собой предварительно упакованные картриджи, используемые при параллельных очистках, обычно под вакуумом. Они имеются в продаже у Varian.LC осуществляют на Luna C18(2) колонке (5 см х 2,0 мм внутр. диаметр), элюируя 0,05%-ной об./об. трифторуксусной кислотой в воде (растворитель А) и 0,05%-ной об./об. трифторуксусной кислотой в ацетонитриле (растворитель Б), используя следующий градиент элюирования 0,00-8,00 мин 0% Б,8,00-8,01 мин 95% Б, 8,01-10,00 мин 0% Б со скоростью потока 1,0 мл/мин при температуре колонки 40 С. ЯМР (ядерный магнитный резонанс) эксперименты выполняли при 400 МГц (если не указано иначе).LCMS выполняли на Supelcosil LCABZ+PLUS колонке (3,3 см х 4,6 мм внутр. диаметр), элюируя 0,1%-ным НСO2 Н и 0,01 М ацетатом аммония в воде (растворитель А), и 0,05%-ным НСO2 Н 5%-ной водой в ацетонитриле (растворитель Б), используя следующий градиент элюирования 0-0,7 мин 0% Б, 0,74,2 мин 100% Б, 4,2-5,3 мин 0% Б, 5,3-5,5 мин 0% Б со скоростью потока 3 мл/мин. Масс-спектры записывали на Fisons VG Platform спектрометре, используя положительный и отрицательный режим в электроспрее (ES+ve и ES-ve).(47,15 г) в ацетонитриле (600 мл) в атмосфере азота. После интенсивного перемешивания при 21 в течение 24 ч, смесь разбавляли водой (приблизительно 800 мл), и продукт экстрагировали диэтиловым эфиром (1 л, затем 200 мл). Объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали до приблизительно 400 мл. Белые кристаллы собирали фильтрацией, промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (24,4 г)(CDCl3) 7.78 (1 Н, dd, J 8, 2 Гц), 7.65 (1 Н, brs), 6.87 (1 Н, d, J 8 Гц), 4.97 (2 Н, s), 4.88 (2 Н, s), 1.56 (6 Н, s) и 1.48 (18 Н, s). После дальнейшего концентрирования маточных жидкостей получали дополнительный продукт (13,8 г). Третью порцию (7,1 г) получали путем хроматографирования маточных жидкостей на силикагеле, выпаривая соответствующий элюат и растирая с диэтиловым эфиром. 2) трет-Бутил-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксоэтилкарбамат. Трифторуксусную кислоту (92 мл) добавляли к перемешиваемому раствору ди(трет-бутил)-2-(2,2 диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксоэтилимидодикарбоната (352,55 г) в дихлорметане (3,6 л) при 21 С, и реакционную смесь перемешивали в течение 1,5 ч. Добавляли водный раствор NaOH (1,75 л), и через 10 мин фазы разделяли. Органический слой промывали водой, сушили (MgSO4) и упаривали до масла. Его оставляли под глубоким вакуумом в течение ночи и затем растирали со смесью гексан:эфир(3:1) с получением неочищенного продукта (226,61 г). Его очищали перекристаллизацией из диэтилового эфира с получением указанного в заголовке соединения (122,78 г). Дополнительно продукт (61,5 г) получали из маточных жидкостей путем выпаривания и хроматографии на Biotage, используя 15%-ный этилацетат в гексане. LCMS RT = 3,37 мин. 3) трет-Бутил-2R-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтилкарбамат. 2 М раствор боран-диметилсульфида в THF (28 мл) медленно добавляли к 1 М раствору (R)тетрагидро-1-метил-3,3-дифенил-1 Н,3 Н-пирроло[1,2-с][1,3,2]оксазаборола в толуоле (56 мл) при 0 С в атмосфере азота. Медленно добавляли раствор трет-бутил-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2 оксоэтилкарбамата (108,2 г) в THF (1,3 л), поддерживая температуру ниже 5C, затем 2 М раствор борандиметилсульфида в THF (252 мл) за 50 мин. Через 1 ч добавляли 2 М HCl (170 мл) при охлаждении, и смесь разделяли между этилацетатом и водой. Органический слой промывали насыщенным растворомNаНСО 3 и рассолом и сушили (MgSO4). Раствор концентрировали, и продукт очищали хроматографией на флэш-силикагеле (800 г), элюируя последовательно смесью гексан:этилацетат (4:1, затем 3:1) с получением указанного в заголовке соединения (93,3 г), LCMS RT = 3,31 мин. 4) (5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-1,3-оксазолидин-2-он. трет-Бутил-(2R)-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтилкарбамат (86,37 г) вDMF (600 мл) по каплям добавляли к перемешиваемой суспензии гидрида натрия (60%-ная дисперсия в масле, 11,9 г) в DMF (160 мл) при охлаждении, таким образом, чтобы внутренняя температура оставалась при 0C в атмосфере азота. Смесь перемешивали при 21C в течение 2 ч. Смесь повторно охлаждали до 0C, и добавляли 2 М HCl (134 мл). Смесь разбавляли водой, и продукт экстрагировали дважды этилацетатом. Раствор дважды промывали рассолом, сушили (MgSO4) и упаривали с получением указанного в заголовке соединения (63,55 г) LCMS RT = 2,66 мин. 5) 6-Бромгексил-бут-3-иниловый эфир. 3-Бутин-1-ол (42,4 мл) перемешивали интенсивно с 1,6-дибромгексаном (260 мл) и тетрабутиламмония бисульфатом (2,4 г) в 50%-ном водном растворе гидроксида натрия (200 мл) в атмосфере азота в течение 3 суток. Добавляли воду (приблизительно 700 мл), и органический слой отделяли. Водный слой дважды экстрагировали дихлорметаном (2 х 100 мл), и объединенные органические слои промывали водой, сушили (MgSO4) и концентрировали. Остаток в петролейном эфире (точка кипения 40-60C) наносили на колонку силикагеля (1,5 кг), и колонку элюировали петролейным эфиром (точка кипения 4060C), затем 10%-ным диэтиловым эфиром в петролейном эфире (точка кипения 40-60) с получением указанного в заголовке соединения (103,3 г),(CDCl3) 3.56 (2 Н, t, J 7 Гц), 3.47 (2 Н, t, J 7 Гц), 3.42 (2 Н, t, J 7 Гц), 2.45 (2 Н, m), 1.99 (1 Н, t, J 2 Гц), 1.87 (2 Н, m), 1.60 (2 Н, m) и от 1.50 до 1,33 (4 Н,m). 6) (5R)-3-[6-(Бут-3-инилокси)гексил]-5-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-1,3-оксазолидин-2 он.(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиокси-6-ил)-1,3-оксазолидин-2-он (10 г) в DMF (100 мл) по каплям добавляли к перемешиваемой суспензии гидрида натрия (60%-ная дисперсия в масле, 2,33 г) в DMF(50 мл) при перемешивании и поддерживая внутреннюю температуру 0C. Перемешивание продолжали при 0-5C в течение 1 ч. Смесь повторно охлаждали до 0C, и добавляли за 1 мин раствор 6-бромгексилбут-3-инилового эфира (14,7 г) в DMF (50 мл). Смесь затем перемешивали при 20-30C в течение 2 ч. Добавляли 2 М HCl (9 мл), и смесь разделяли между водой и диэтиловым эфиром. Водный слой экстрагировали дополнительно диэтиловым эфиром, и объединенные органические слои дважды промывали рассолом. После сушки (MgSO4) раствор концентрировали и наносили на колонку силикагеля (600 г), набитую в смеси диэтиловый эфир : петролейный эфир (точка кипения 40-60C) (1:2). Колонку элюировали последовательно этой смесью, затем (1:1) и затем диэтиловым эфиром с получением указанного в заголовке соединения (13,88 г) LCMS RT = 3,45 мин. 7) 3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бут-1-инил]бензолсульфониламид.(1,79 г) перемешивали с 3-иодбензолсульфонамидом (1,4 г) в смеси ацетонитрил:триэтиламин (1:1, 42 мл) в атмосфере азота в течение 10 мин. Добавляли иодид меди (0,083 г) и дихлорбис(трифенилфосфин)палладий (0,192 г), и смесь перемешивали в течение 17 ч в атмосфере азота при 21C. Смесь упаривали досуха, и остаток хроматографировали на силикагеле (250 г) в 30%-ной смеси этилацетат : петролейный эфир (точка кипения 40-60C), затем 50%-ной, затем 70%-ной смеси, и наконец этилацетатом с получением указанного в заголовке соединения (2,35 г), LCMS RT = 3,44 мин. 8) 3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бутил]бензолсульфониламид. 3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексилокси)бут-1-инил]бензолсульфониламид (2,35 г) перемешивали с оксидом платины (0,3 г) в THF (30 мл) в- 21006646 атмосфере водорода в течение 2 ч. Катализатор удаляли фильтрацией, используя ускоритель фильтрования, и остаток на фильтре выщелачивали этилацетатом. Объединенные фильтраты пропускали через силикагель (200 г) в этилацетате, и элюат выпаривали с получением указанного в заголовке соединения(2,32 г), LCMS RT = 3,49 мин. 9) 3-4-[(6-[(2R)-2-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексил)окси] бутилбензолсульфониламид. 3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексилокси)бутил]бензолсульфониламид (0,43 г) перемешивали в THF (10 мл), продувая интенсивным потоком азота в течение 5 мин. Добавляли триметилсиланоат калия (0,43 г), и смесь перемешивали при 70 в атмосфере азота в течение 2,5 ч. Смесь разделяли между дихлорметаном и фосфатным буфером с рН 6,4, и водный слой экстрагировали дополнительно дихлорметаном. Соединенные органические слои промывали водой, сушили (MgSO4) и концентрировали. Остаток очищали на силикагеле (60 г), элюируя последовательно смесью этилацетат:петролейный эфир (точка кипения 40-60) (1:1), этилацетат, 10%-ный, затем 20%-ный метанол в этилацетате с получением указанного в заголовке соединения (0,286 г), LCMS RT = 2,56 мин. 10) 3-(4-[6-[(2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этил]аминогексил]оксибутил)бензолсульфониламида ацетат. 3-4-[(6-[(2R)-2-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтил]аминогексилокси]бутилбензолсульфониламид (0,283 г) перемешивали с уксусной кислотой (8 мл) и водой (4 мл) при 70 в течение 35 мин, затем упаривали досуха. Остаток снова дважды выпаривали с толуолом с получением указанного в заголовке соединения (0,318 г) LCMS RT = 2,34 мин, ES+ve 495 (МН)+. Пример 2. 4-(4-[6-2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил] оксибутил)бензолсульфониламида ацетат. 1) 4-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бут-1-инил]бензолсульфониламид получали, используя способы, аналогичные описанным в примере 1 (7). LCMS RT = 3,47 мин. 2) 4-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бутил]бензолсульфониламид получали, используя способы, аналогичные описанным в примере 1(10). LCMS RT = 2,54 мин, ES+ve 565 (МН)+. Пример 6. 3-(4-[6-2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)-фенил]этиламино)гексил] оксибутил)-N,N-диметилбензолсульфониламида ацетат. 1) 3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бут-1-инил]-N,N-диметилбензолсульфониламид. Смесь (5R)-3-[6-(бут-3-инилокси)гексил]-5-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-1,3-оксазолидин-2-она (0,256 г) и 3-бром-N,N-диметилбензолсульфонамида (0,208 г) в пирролидине (4 мл) дегазировали, используя цикл вакуум/азот. Добавляли иодид меди (0,005 г) и дихлорбис(трифенилфосфин)палладий (0,037 г), и смесь перемешивали при 80 в течение 45 мин в атмосфере азота. Смесь разбавлялиEtOAc и промывали водой. Водную фазу экстрагировали EtOAc, и объединенные органические фазы промывали рассолом, сушили (Na2SO4) и выпаривали досуха. Остаток растворяли в CH2Cl2 и наносили на картридж Bond Elut с силикагелем (10 г). Картридж элюировали CH2Cl2, смесью циклогексан/Еt2O, Et2O и EtOAc. После выпаривания эфирных фракций получали масло, которое снова очищали на кремнеземе(10). LCMS RT = 2,72 мин, ES+ve 563 (МН)+. Пример 10. 1-[3-(4-[6-2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)фенил]метансульфонамид. 1) Натрия (3-йодфенил)метансульфонат. Раствор 3-йодбензилбромида (3 г) и сульфита натрия (1,26 г) в ацетоне (15 мл) и воде (30 мл) нагревали при 70 в течение 3 ч. Растворитель удаляли при пониженном давлении, и остаток растирали в эфире с получением указанного в заголовке соединения (3,8 г). LCMS RT = 3,66 мин. 2) (3-Йодфенил)метансульфонилхлорид. Перемешиваемую смесь натрия (3-йодфенил)метансульфоната (3,6 г) и фосфорилхлорида (10 мл) в сульфолане (20 мл) и ацетонитриле (30 мл) нагревали при 70 в течение 2 ч. Смесь выливали на дробленый лед (200 мл), и выпавший в осадок продукт собирали и сушили с получением указанного в заголовке продукта (2,8 г) LCMS RT = 3,47 мин. 3) (3-Йодфенил)метансульфонамид. Перемешиваемый раствор (3-йодфенил)метансульфонилхлорида (1 г) в THF (20 мл) обрабатывали 0,88 аммиаком (25 мл) при комнатной температуре в течение 30 мин. Растворитель удаляли при пониженном давлении, и остаток растирали в эфире с получением указанного в заголовке соединения (0,35 г).LCMS RT = 2,47 мин, ES+ve 495 (МН)+. Пример 14. 4-[3-(4-[6-2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]оксибутил)фенил]бутан-1-сульфонамид. 1) 4-(3-Йодфенил)бутилметансульфонат. 4-(3-Йодфенил)бутан-1-ол (1,7 г) перемешивали с диизопропиламином (1,74 мл) и метансульфонилхлоридом (0,66 мл) в дихлорметане (50 мл) при 21C в течение 2 ч. Раствор промывали последовательно раствором бикарбоната натрия, водой, водой, подкисленной несколькими каплями 2 М HCl, и водой, каждый раз экстрагируя обратно дихлорметаном. Объединенные органические слои сушили(MgSO4) и упаривали с получением указанного в заголовке соединения (2,23 г), ТСХ (тонкослойная хроматография) Rf=0,28 (1:3 этилацетат в циклогексане). 2) 4-(3-Йодфенил)бутан-1-сульфонамид. 4-(3-Йодфенил)бутилметансульфонат (0,354 г) перемешивали с иодидом натрия (0,75 г) в ацетоне (5 мл) в атмосфере азота в течение 3 ч и при 35C в течение 30 мин. Смесь разделяли между дихлорметаном и водой. Водный слой экстрагировали еще дихлорметаном, и объединенные органические слои промывали водой. После сушки (MgSO4) раствор упаривали до масла. Его растворяли в этаноле (10 мл) и воде(5 мл), и смесь кипятили с обратным холодильником на паровой бане в течение 12 ч с сульфитом натрия(0,138 г). Смесь охлаждали, и твердое вещество собирали фильтрацией, промывали водой и сушили. Этот остаток кипятили с обратным холодильником с оксихлоридом фосфора (4 мл) в атмосфере азота в течение 4 ч и затем продували потоком азота. Добавляли 0,880 раствор аммиака (5 мл), и смесь кипятили с обратным холодильником в течение 2 ч. Добавляли еще раствор аммиака (5 мл), и кипячение с обратным холодильником продолжали в течение 45 мин. Смесь охлаждали, и твердое вещество собиралиRT = 3,15 мин. 3) 4-(3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бут-1-инил]фенил)бутан-1-сульфонамид получали, используя способы, аналогичные описанным в примере 1 (7) LCMS RT = 3,62 мин. 4) 4-3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексилокси)бутил]фенилбутан-1-сульфонамид получали, используя способы, аналогичные описанным в примере 1 (8). LCMS RT = 3,71 мин. 5) 4-[3-(4-[6-2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]окси бутил)фенил]бутан-1-сульфонамид. 4-3-[4-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)бутил]фенилбутан-1-сульфонамид (0,097 г) перемешивали и кипятили с обратным холодильником с триметилсиланоатом калия (0,1 г) в атмосфере азота в течение 2 ч. Смесь выпаривали досуха и еще раз выпаривали с метанолом. Остаток переносили в метанол и наносили на Bond Elut SCX2 картридж (10 г),который предварительно обрабатывали метанолом. Картридж оставляли на 30 мин и затем элюировали последовательно метанолом и затем 1% 0,880 водным раствором аммиака в метаноле. Получали указанное в заголовке соединение (0,064 г) LCMS RT = 2,72 мин, ES+VE 551 (МН)+. Пример 15. 3-(5-[6-2R)-2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил] оксипентил)бензолсульфонамид. 1) 5-[(6-Бромгексил)окси]пент-1-ин получали, используя способы, аналогичные описанным в примере 1 (5). GCMS RT = 5,6 мин. 2) (5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-3-[6-(пент-4-инилокси)гексил]-1,3-оксазолидин 2-он получали, используя способы, аналогичные описанным в примере 1 (4). LCMS RT = 3,65 мин. 3) 3-[5-(6-[(5R)-5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)пент-1-инил]бензолсульфонамид получали, используя способы, аналогичные описанным в примере 1 (7). LCMS RT = 3,76 мин. 4) 3-[5-(6-[(5R)-5-(2,2-Диметил-4H-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексил окси)пентил]бензолсульфонамид получали, используя способы, аналогичные описанным в примере 1 (8).K2 СO3 (0,055 г) в ацетоне (2 мл). Смесь нагревали с обратным холодильником в течение 2 ч, затем добавляли этилизоцианат (0,005 г). Через 0,5 ч реакционную смесь охлаждали и гасили водой (1 мл). Смесь разделяли между EtOAc (20 мл) и Н 2O (20 мл). Водную фазу экстрагировали EtOAc (20 мл). Объединенные EtOAc фазы промывали рассолом (10 мл), затем сушили (Na2SO4) и концентрировали. Остаток очищали SPE (кремнезем 5 г) с CH2Cl2 (2x15 мл), Et2O (2x15 мл) и EtOAc (2x15 мл), после выпариванияEtOAc фракций получали указанное в заголовке соединение (0,067 г). ES+ve 632 (МН)+. 2) 4-(1R)-2-[(6-4-[3-([(Этиламино)карбонил]аминосульфонил)фенил]бутоксигексил)амино]-1 гидроксиэтил-1-гидрокси-2-(гидроксиметил)бензола ацетат получали, используя способы, аналогичные описанным в примере 1 (10). LCMS RT = 2,86 мин, ES+ve 606 (МН)+. Пример 24. 3-(4-[6-(2-Гидрокси-2-[4-гидрокси-3-(гидроксиметил)фенил]этиламино)гексил]окси бутил)бензолсульфонамида ацетат. 1) трет-Бутил-2-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-2-гидроксиэтилкарбамат. После перекристаллизации партии 3:1 (R:S) примера 1 (3) (78,94 г) получали указанное в заголовке соединение (27,6 г). LCMS RT = 3,31 мин. 2) 5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-1,3-оксазолидин-2-он получали, используя способы,аналогичные описанным в примере 1 (4). ES+ve 250 (МН)+. 3) 3-[6-(Бут-3-инилокси)гексил]-5-(2,2-диметил-4 Н-1,3-бензодиоксин-6-ил)-1,3-оксазолидин-2-он получали, используя способы, аналогичные описанным в примере 1 (6). ES+ve 402 (МН)+. 4) 3-[4-(6-[5-(2,2-Диметил-4 Н-1,3-бензодиоксин-6-ил)-2-оксо-1,3-оксазолидин-3-ил]гексилокси) бут-1-инил]бензолсульфонамид получали, используя способы, аналогичные описанным в примере 1 (7).
МПК / Метки
МПК: C07D 295/12, A61P 11/06, C07C 311/27, C07D 295/26, C07C 311/29, A61K 31/18, C07C 311/58
Метки: производные, лечения, фенэтаноламина, респираторных, заболеваний
Код ссылки
<a href="https://eas.patents.su/30-6646-proizvodnye-fenetanolamina-dlya-lecheniya-respiratornyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фенэтаноламина для лечения респираторных заболеваний</a>
Предыдущий патент: Производные аминофталазинона, активные как ингибиторы киназ, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Сочетание действующих ингредиентов для медикаментозной терапии зависимостей, вызываемых наркотическими или одурманивающими веществами
Случайный патент: Устройство и способ для формирования пучка акустической энергии из ствола скважины и их применение


































