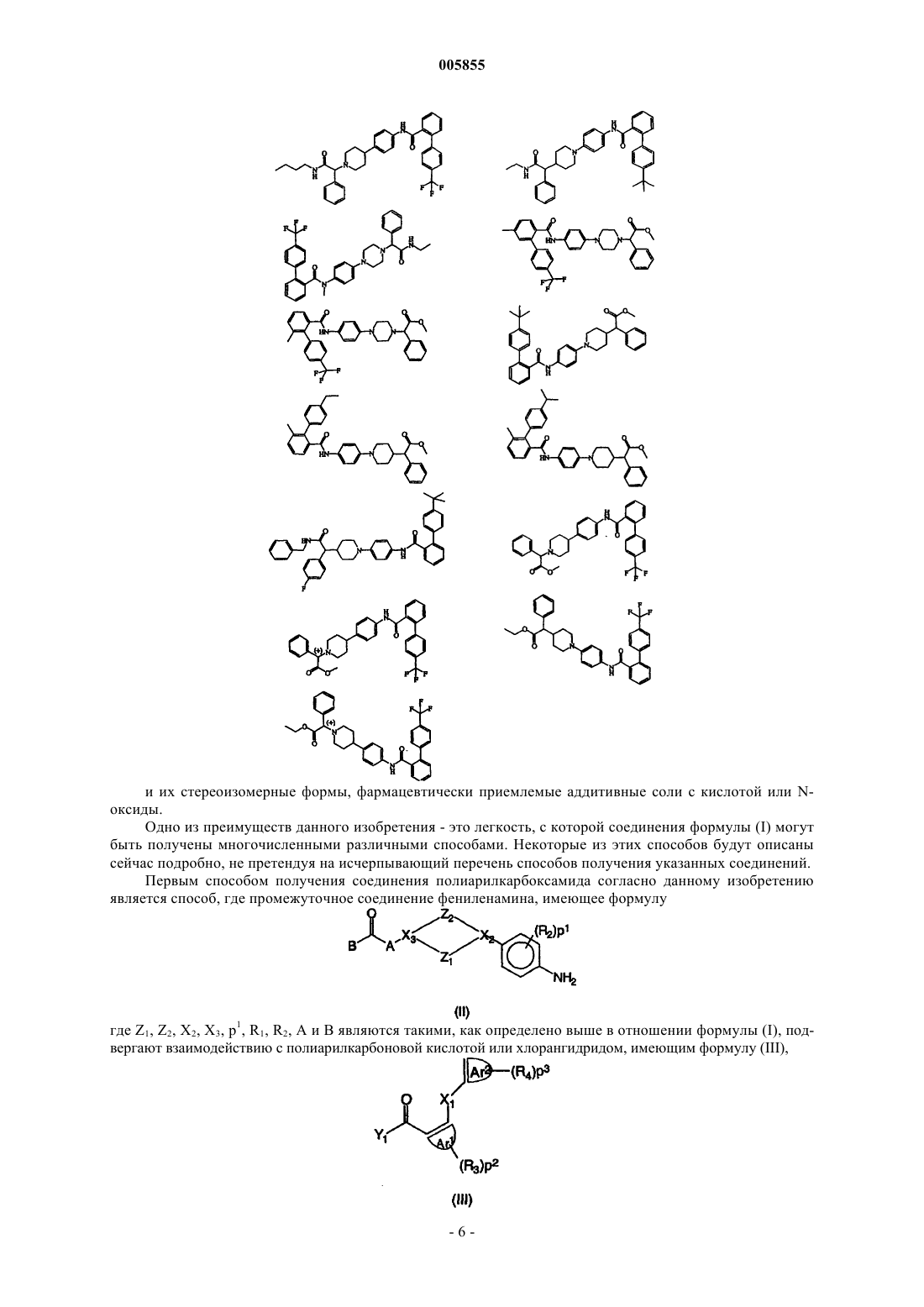
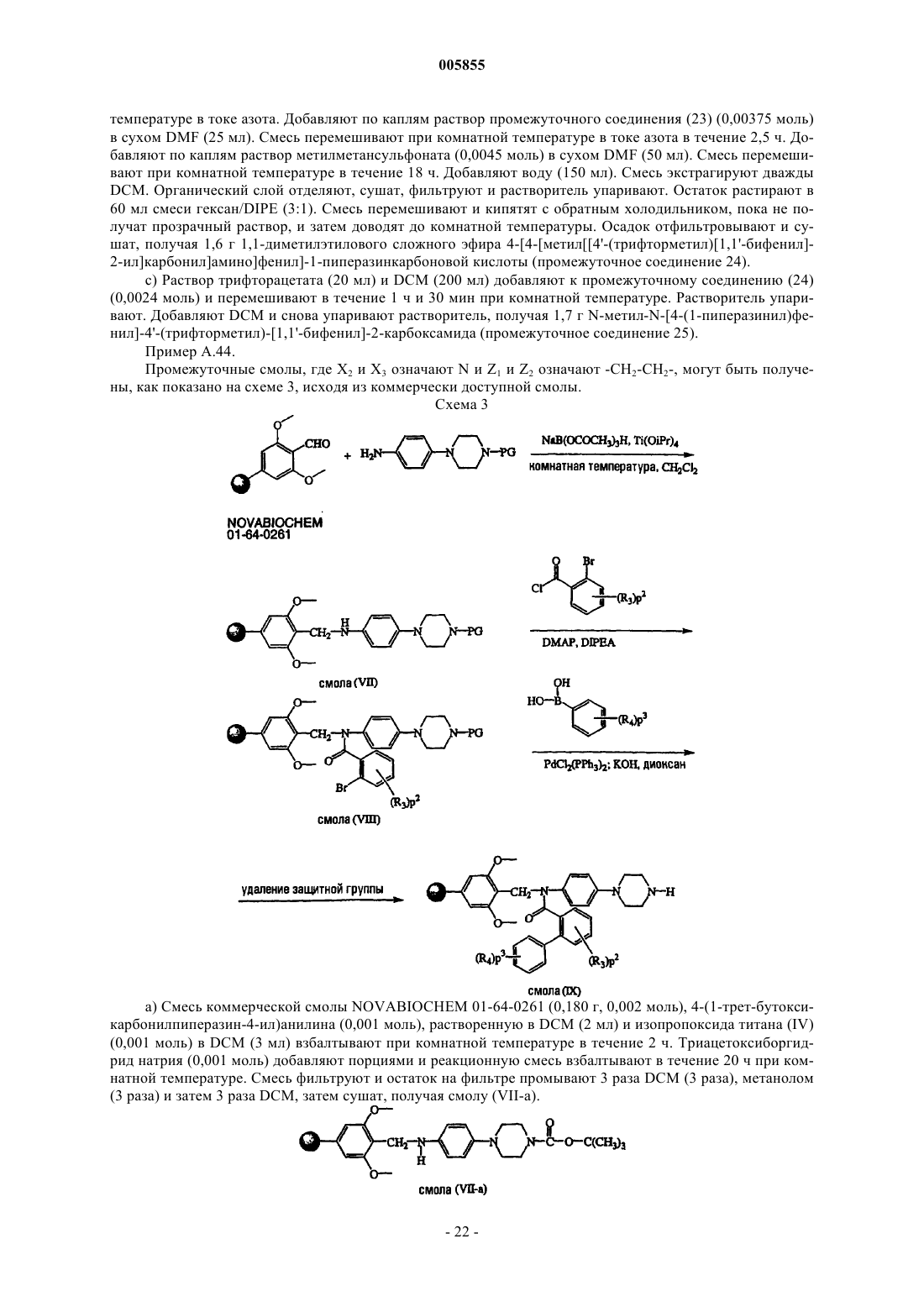
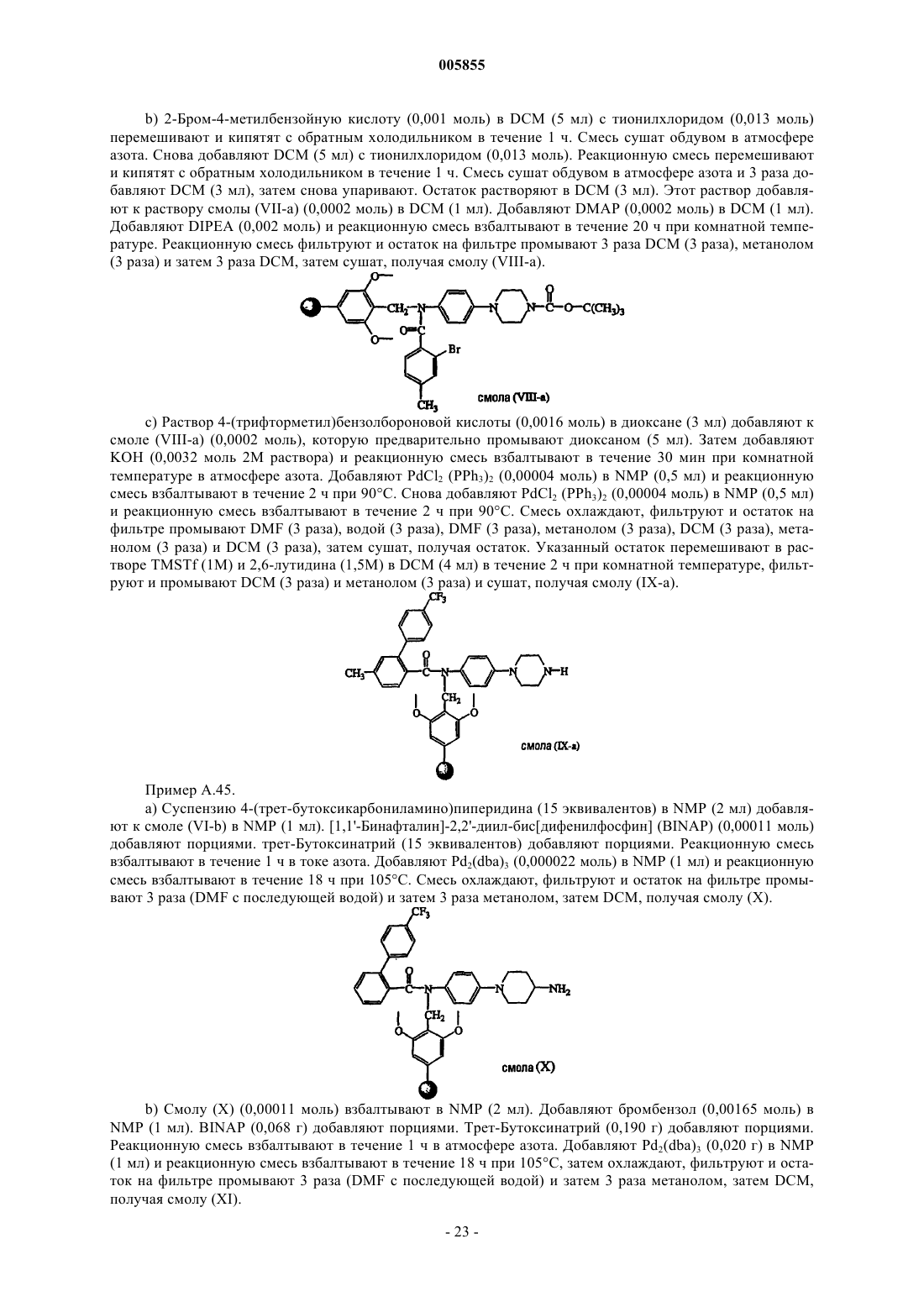
Полиарилкарбоксамиды, применимые в качестве агентов, снижающих содержание липидов
Номер патента: 5855
Опубликовано: 30.06.2005
Авторы: Вьейевуа Марсель, Мерпул Ливен, Ван Дер Векен Луи Йозеф Элизабет, Рувенс Петер Вальтер Мария, Бакс Лео Якобус Йозеф
Формула / Реферат
1. Соединения полиарилкарбоксамида формулы (I)
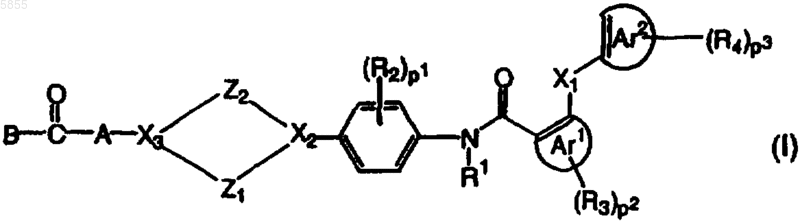
их N-оксиды, фармацевтически приемлемые соли присоединения (аддитивные) и стереохимически изомерные формы, где
Z1 выбран из (CH2)n, где n имеет значения от 1 до 3, CH2CH2O и OCH2CH2;
Z2 означает (CH2)m, где m равно 1 или 2,
X1 означает O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 или прямую связь;
X2 и X3, каждый независимо, выбраны из CH, N и sp2 углеродного атома;
R1 означает водород или C1-4алкил;
Ar1 означает ароматическое кольцо, выбранное из таких, как фенил, нафталенил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним или двумя заместителями R3;
Ar2 означает ароматическое кольцо, выбранное из таких, как фенил, нафталенил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним, двумя или тремя заместителями R4;
каждый R2 и R3 независимо выбран из таких групп, как C1-4алкил, C1-4алкилокси, галоген и трифторметил;
каждый R4 независимо выбран из таких групп, как C1-4алкил, C1-4алкилокси, галоген, гидрокси, меркапто, циано, нитро, C1-4алкилтио или полигалоген-C1-6алкил, амино, C1-4алкиламино и ди(C1-4алкил)амино;
p1 и p2, каждый, имеет значение от 0 до 2;
p3 имеет значение от 0 до 3;
X1 и R4, взятые вместе с ароматическими кольцами Ar1 и Ar2, к которым они присоединены, могут образовывать группу флуорен-1-ил или флуорен-4-ил;
A означает C1-6алкандиил, замещенный одной или двумя группами, выбранными из таких групп, как арил, гетероарил и C3-10циклоалкил; или, когда X3 означает CH, A также может означать атом азота, замещенный такими группами, как водород, C1-10алкил, арил, гетероарил, арил-C1-10алкил, гетероарил-C1-10алкил или C3-10циклоалкил;
B означает водород, C1-10алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, нитро, C1-4алкилокси, амино, C1-10алкиламино, ди(C1-10алкил)амино, C1-10ацил, C1-10алкилтио, C1-10алкоксикарбонил, C1-10алкиламинокарбонил и ди(C1-10алкил)аминокарбонил; арил-C1-6алкил; гетероарил-C1-10алкил; C3-10циклоалкил; полигалоген-C1-6алкил; C3-6алкенил; C3-6алкинил; NR6R7 или OR8;
R6 и R7, каждый независимо, означают водород, C1-10алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, C1-4алкилокси, амино, C1-10алкиламино, ди(C1-10алкил)амино, C1-10ацил, C1-10алкилтио, C1-10алкиламинокарбонил и ди(C1-10алкил)аминокарбонил; арил-C1-10алкил; гетероарил-C1-10алкил; C3-10циклоалкил; C7-10полициклоалкил; полигалоген-C1-6алкил; C3-8алкенил; C3-8алкинил; конденсированный бензо-C5-8циклоалкил и
где R6 и R7, взятые вместе с атомом азота, к которому они присоединены, могут образовывать C4-8 насыщенный гетероциклический радикал;
R8 означает C1-10алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, нитро, C1-4алкилокси, амино, C1-10алкиламино, ди(C1-10алкил)амино, C1-10ацил, C1-10алкилтио, C1-10алкиламинокарбонил и ди(C1-10алкил)аминокарбонил; арил-C1-10алкил; гетероарил-C1-10алкил; C3-10циклоалкил; C7-10полициклоалкил; полигалоген-C1-6алкил; C3-8алкенил; C3-8алкинил или конденсированный бензо-C5-8циклоалкил.
2. Соединения полиарилкарбоксамида по п.1, где Z1, Z2, X2 и X3, взятые вместе, образуют шестичленный гетероцикл.
3. Соединения полиарилкарбоксамида по п.1 или 2, где Z1, Z2, X2 и X3, взятые вместе, образуют группу пиперидина или пиперазина и X1 означает прямую связь.
4. Соединения полиарилкарбоксамида по любому из пп.1-3, где R2 и R3, каждый, означают водород и R4 означает водород, трифторметил, хлор или трет-бутил.
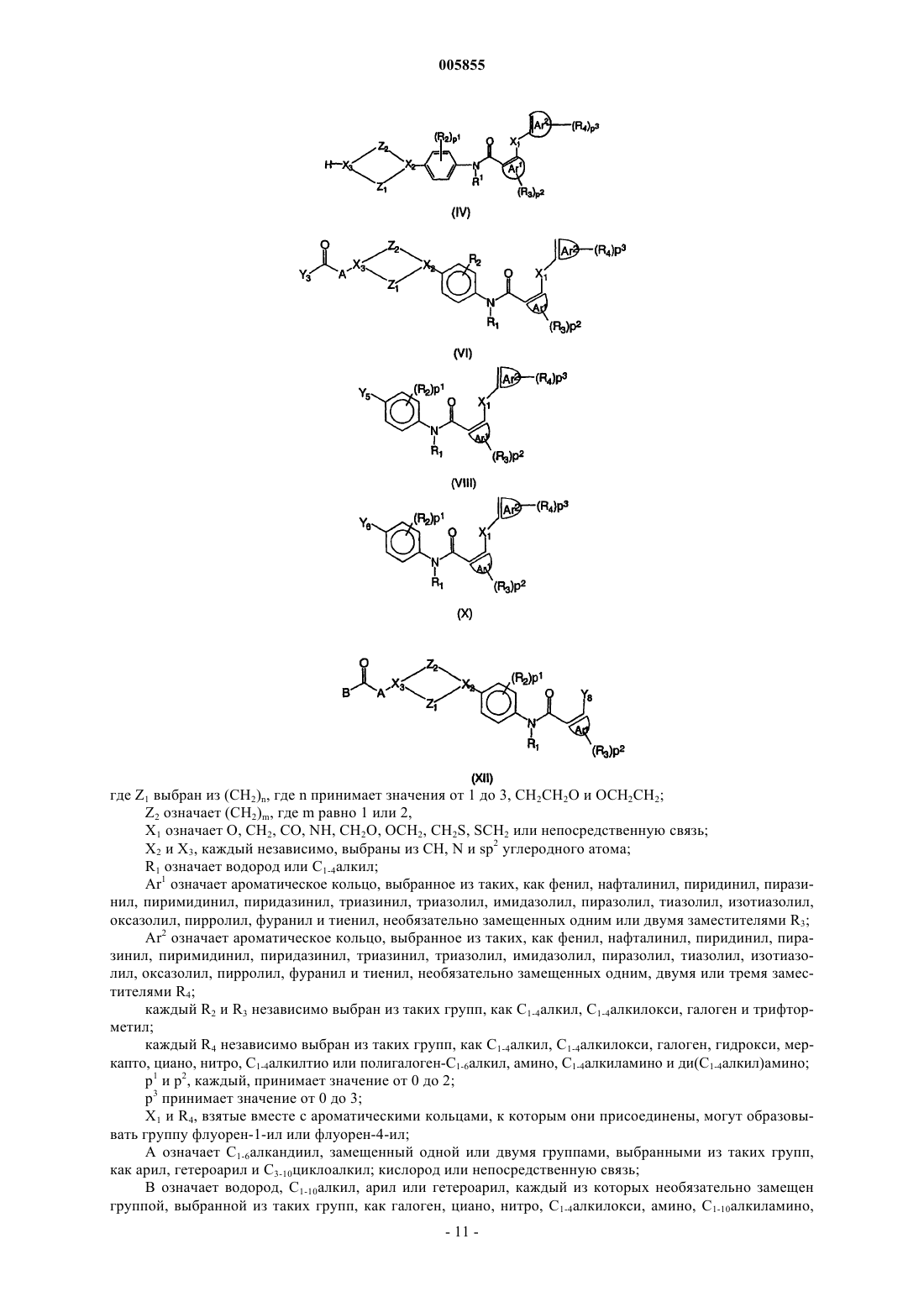
5. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4,в котором промежуточное соединение фениленамина, имеющее формулу (II)
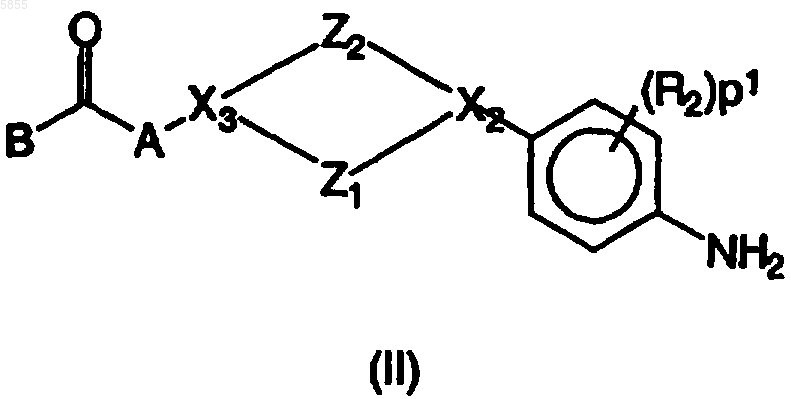
где Z1, Z2, X2, X3, p1, R1, R2, A и B являются такими, как определено в отношении формулы (I), подвергают взаимодействию с полиарилкарбоновой кислотой или ее галогенангидридом, имеющим формулу (III)
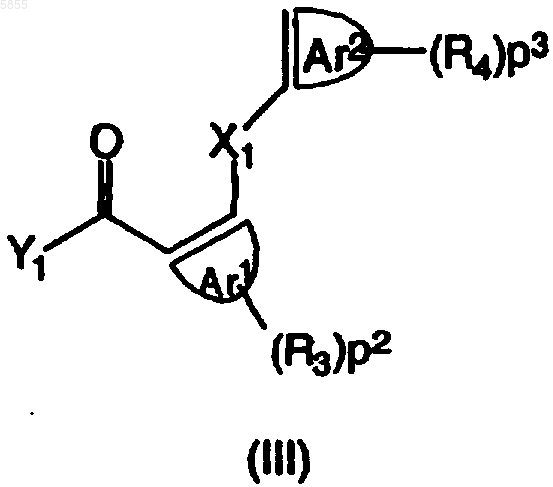
где X1, Ar1, Ar2, p2, p3, R3 и R4 являются такими, как определено в отношении формулы (I), и Y1 выбран из гидрокси и галогена, по меньшей мере в одном реакционноинертном растворителе и, необязательно, в присутствии подходящего основания, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
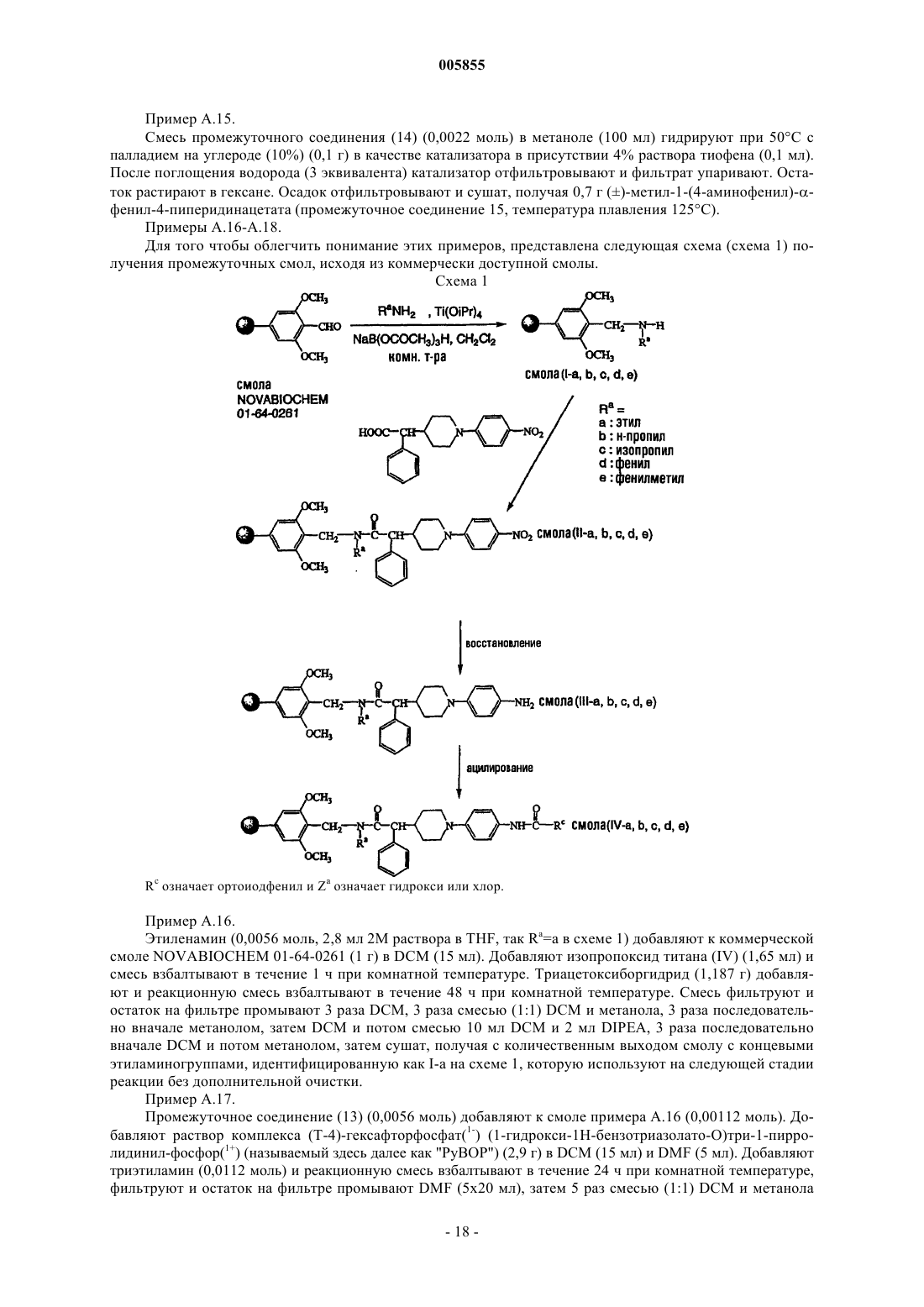
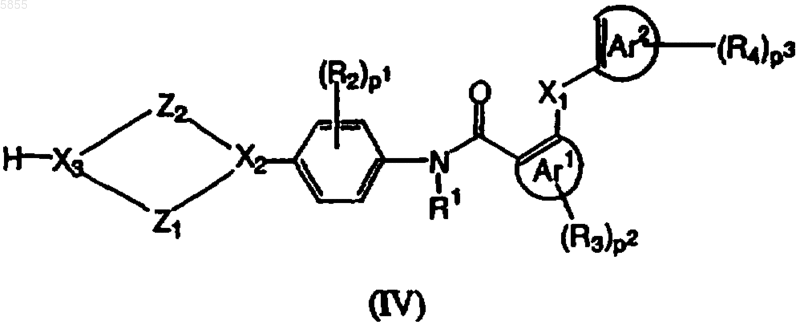
6. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, где X3 означает азот, в котором промежуточное соединение, имеющее формулу (IV)
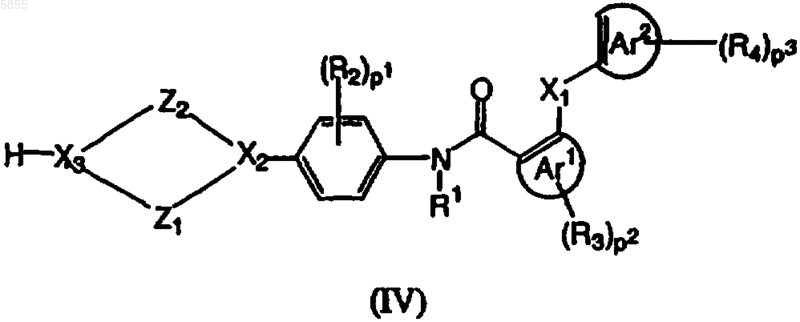
где Z1, Z2, X1, X2, p1, p2, p3, Ar1, Ar2, R1, R2, R3 и R4 являются такими, как определено в отношении формулы (I), и X3 означает азот, подвергают взаимодействию с реагентом, имеющим формулу (V)
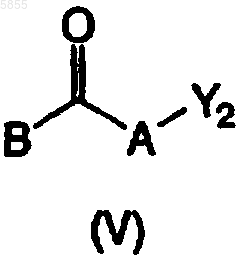
где A и B являются такими, как определено в отношении формулы (I), и Y2 выбран из галогена, тозилокси, мезилокси, нафтилсульфонилокси, или -A-Y2 означает R'5COR5, где R5 и R'5 являются такими, что радикал R'5CHR5 охватывается определением A в отношении формулы (I), по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного подходящего активатора нуклеофильного замещения и/или подходящего основания, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
7. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, в котором промежуточное соединение, имеющее формулу
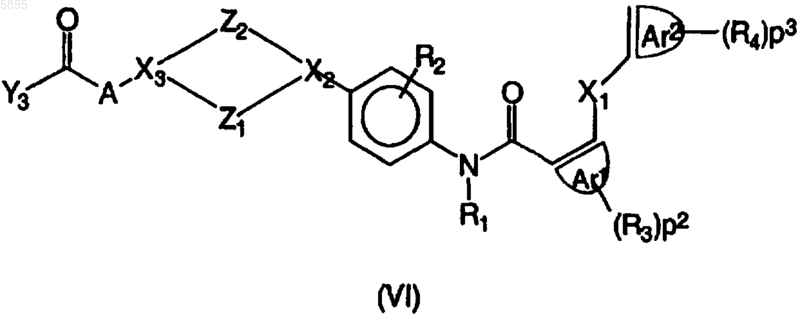
где Z1, Z2, X1, X2, X3, p1, p2, p3, Ar1, Ar2, R1, R2, R3, R4 и A являются такими, как определено в отношении формулы (I), и Y3 выбран из галогена и гидрокси, подвергают взаимодействию с реагентом формулы BH, где B означает NR6R7 или OR8 и R6, R7 и R8 являются такими, как определено в отношении формулы (I), по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного подходящего агента связывания и/или подходящего основания, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
8. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, где X3 означает азот и где A означает группу, подходящую для проведения реакции присоединения Михаэля, в котором промежуточное соединение, имеющее формулу
где Z1, Z2, X1, X2, Ar1, Ar2, R1, R2, R3 и R4 являются такими, как определено в отношении формулы (I), и X3 означает азот, подвергают взаимодействию с реагентом формулы (VII)
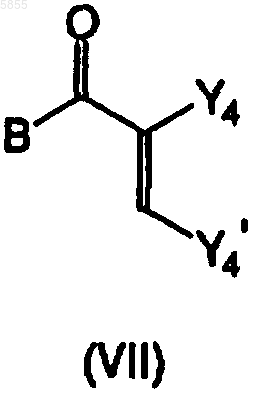
где B является таким, как определено в отношении формулы (I), и Y4 и Y'4 являются такими, что радикал
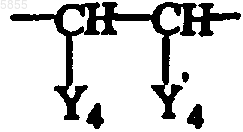
охватывается определением A, приведенным для формулы (I), по меньшей мере в одном реакционноинертном растворителе, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
9. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, в котором промежуточное соединение, имеющее формулу (VIII)
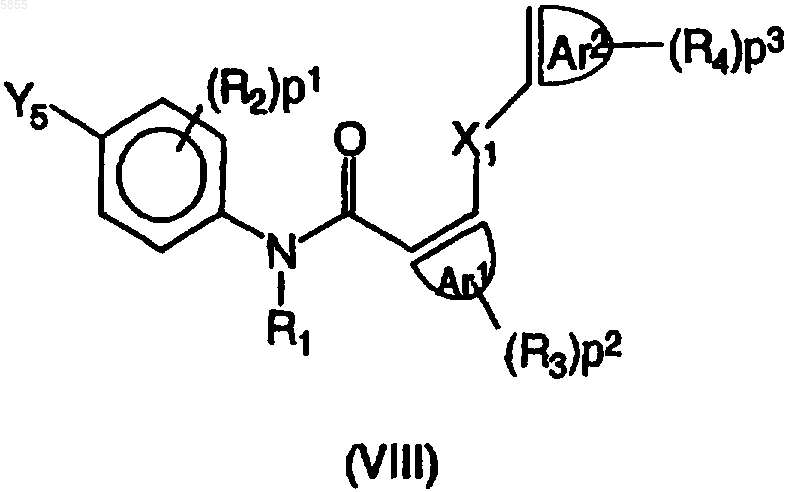
где X1, p1, p2, p3, Ar1, Ar2, R1, R2, R3 и R4 являются такими, как определено в отношении формулы (I), и Y5 выбран из галогена, B(OH)2, алкилборонатов и их циклических аналогов, подвергают взаимодействию с реагентом, имеющим формулу (IX)

где Z1, Z2, X3, A и B являются такими, как определено в отношении формулы (I), по меньшей мере в одном реакционноинертном растворителе и, необязательно, в присутствии по меньшей мере одного агента связывания на основе переходного металла и/или по меньшей мере одного подходящего лиганда, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
10. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, в котором промежуточное соединение, имеющее формулу (X)
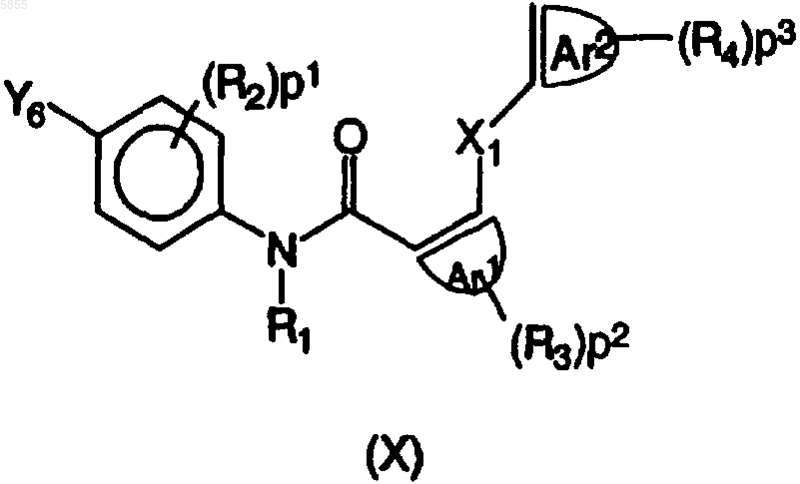
где p1, p2, p3, Ar1, Ar2, X1, R1, R2, R3 и R4 являются такими, как определено в отношении формулы (I), подвергают взаимодействию с реагентом, имеющим формулу (XI)
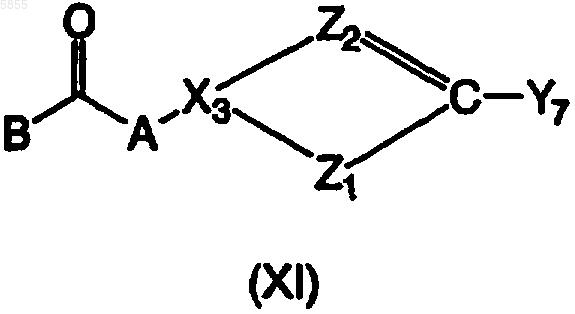
где Z1, Z2, X3, A и B являются такими, как определено в отношении формулы (I), один из Y6 и Y7 выбран из брома, иода и трифторметилсульфоната и другой из Y6 и Y7 выбран из три(C1-4алкил)олова, B(OH)2, алкилборонатов и их циклических аналогов, по меньшей мере в одном реакционноинертном растворителе и, необязательно, в присутствии по меньшей мере одного агента связывания на основе переходного металла и/или по меньшей мере одного подходящего лиганда, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
11. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, в котором промежуточное соединение, имеющее формулу (XII)
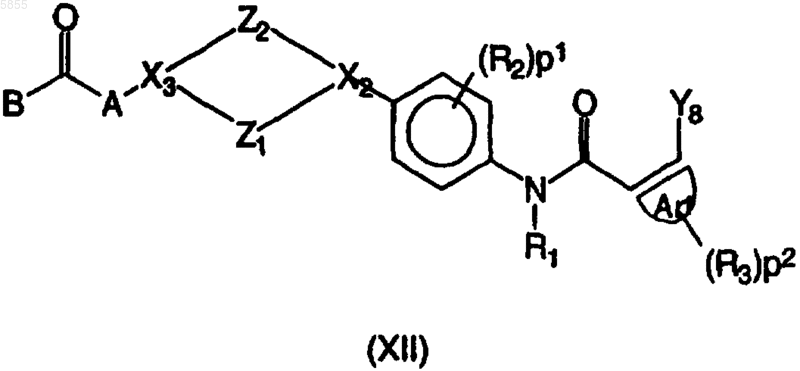
где Z1, Z2, X2, X3, p1, p2, Ar1, R1, R2, R3, A и B являются такими, как определено в отношении формулы (I), и Y8 выбран из брома, иода и трифторметилсульфоната, подвергают взаимодействию либо с арилборной кислотой, имеющей формулу (XIIIa)
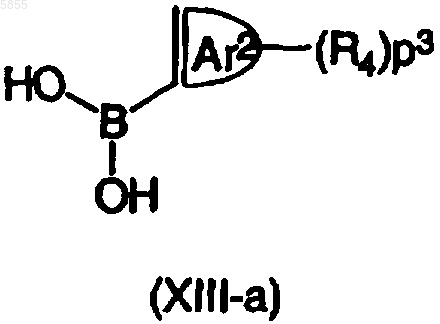
где p3, Ar2 и R4 являются такими, как определено в отношении формулы (I), либо с реагентом арил-олово, имеющим формулу (XIIIb)

где R3, R4, Ar2 и p3 являются такими, как определено в отношении формулы (I), по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного агента связывания на основе переходного металла и/или по меньшей мере одного подходящего лиганда, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм.
12. Способ получения соединения полиарилкарбоксамида по любому из пп.1-4, в котором B означает NR6R7, из соединения полиарилкарбоксамида по п.1, в котором B означает OR5, включающий на первой стадии гидролиз последнего, на второй стадии взаимодействие полученной в результате соответствующей карбоновой кислоты с амином формулы HNR6R7, по меньшей мере в одном реакционноинертном растворителе и необязательно дополнительно включающий превращение полученного в результате соединения формулы (I), где B означает NR6R7, в его аддитивную соль и/или получение его стереохимических изомерных форм.
13. Соединения, выбранные из соединений формул
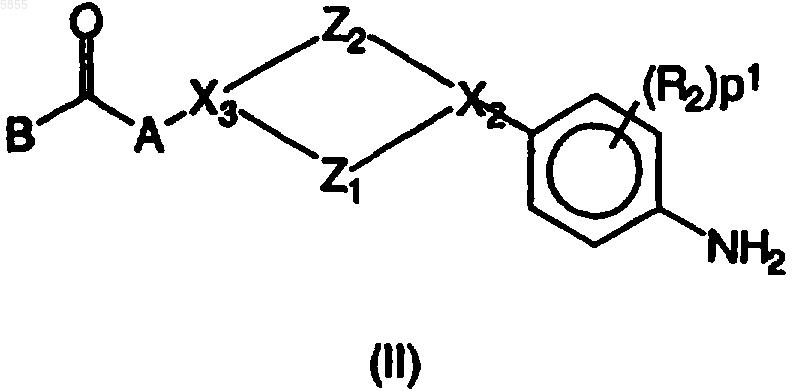
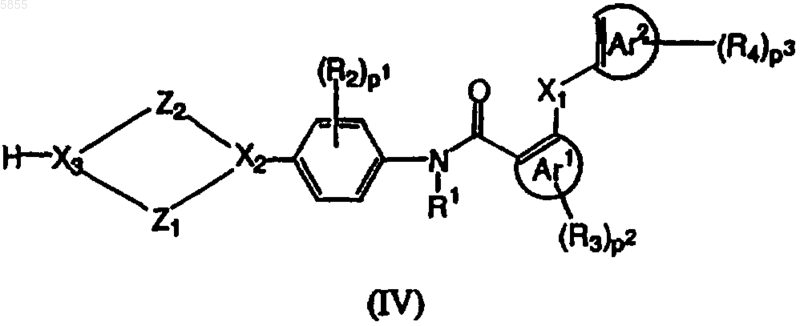
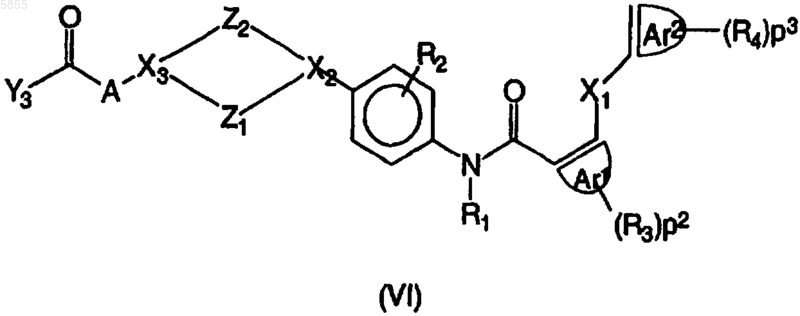
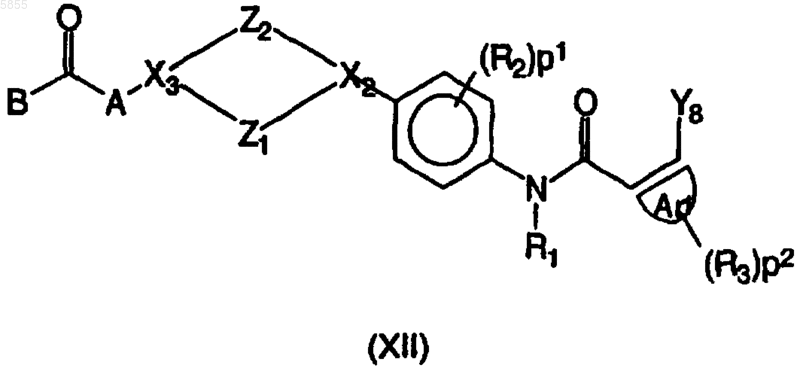
где Z1 выбран из (CH2)n, где n имеет значения от 1 до 3, CH2CH2O и OCH2CH2;
Z2 означает (CH2)m, где m равно 1 или 2,
X1 означает O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 или прямую связь;
X2 и X3, каждый независимо, выбраны из CH, N и sp2 углеродного атома;
R1 означает водород или C1-4алкил;
Ar1 означает ароматическое кольцо, выбранное из таких, как фенил, нафталенил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним или двумя заместителями R3;
Ar2 означает ароматическое кольцо, выбранное из таких, как фенил, нафталенил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним, двумя или тремя заместителями R4;
каждый R2 и R3 независимо выбран из таких групп, как C1-4алкил, C1-4алкилокси, галоген и трифторметил;
каждый R4 независимо выбран из таких групп, как C1-4алкил, C1-4алкилокси, галоген, гидрокси, меркапто, циано, нитро, C1-4алкилтио или полигалоген-C1-6алкил, амино, C1-4алкиламино и ди(C1-4алкил)амино;
p1 и p2, каждый, имеет значения от 0 до 2;
p3 имеет значения от 0 до 3;
X1 и R4, взятые вместе с ароматическими кольцами Ar1 и Ar2, к которым они присоединены, могут образовывать группу флуорен-1-ил или флуорен-4-ил;
A означает C1-6алкандиил, необязательно замещенный одной или двумя группами, выбранными из таких групп, как арил, гетероарил и C3-10циклоалкил; кислород или прямую связь;
B означает водород, C1-10алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, нитро, C1-4алкилокси, амино, C1-10алкиламино, ди(C1-10алкил)амино, C1-10ацил, C1-10алкилтио, C1-10алкоксикарбонил, C1-10алкиламинокарбонил и ди(C1-10алкил)аминокарбонил; арил-C1-10алкил; гетероарил-C1-10алкил; C3-10циклоалкил; полигалоген-C1-6алкил; C3-6алкенил; C3-6алкинил; NR6R7 или OR8;
R6 и R7, каждый независимо, означают водород, C1-10алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, C1-4алкилокси, амино, C1-10алкиламино, ди (C1-10алкил) амино, C1-10ацил, C1-10алкилтио, C1-10алкиламинокарбонил и ди(C1-10алкил)аминокарбонил; арил-C1-10алкил; гетероарил-C1-10алкил; C3-10циклоалкил; C7-10полициклоалкил; полигалоген-C1-6алкил; C3-8алкенил; C3-8алкинил; конденсированный бензо-C5-8циклоалкил и
где R6 и R7, взятые вместе с атомом азота, к которому они присоединены, могут образовывать C4-8 насыщенный гетероциклический радикал,
R8 означает C1-10алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, нитро, C1-4алкилокси, амино, C1-10алкиламино, ди(C1-10алкил)амино, C1-10ацил, C1-10алкилтио, C1-10алкиламинокарбонил и ди(C1-10алкил)аминокарбонил; арил-C1-10алкил; гетероарил-C1-10алкил; C3-10циклоалкил; C7-10полициклоалкил; полигалоген-C1-6алкил; C3-8алкенил; C3-8алкинил; или конденсированный бензо-C5-8циклоалкил;
когда X3 означает CH, A может также представлять атом азота, замещенный такими группами, как водород, C1-10алкил, арил, гетероарил, арил-C1-10алкил, гетероарил-C1-10алкил или C3-10циклоалкил;
Y1 и Y3, каждый независимо, выбраны из гидрокси и галогена;
Y5 выбран из галогена, B(OH)2, алкилборонатов и их циклических аналогов и
Y6 и Y8, каждый независимо, выбраны из брома, иода и трифторметилсульфоната,
в качестве промежуточных соединений для получения соединений полиарилкарбоксамида по любому из пп.1-4.
14. Фармацевтическая композиция, содержащая по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-4.
15. Фармацевтическая композиция по п.14, дополнительно включающая по меньшей мере один дополнительный снижающий содержание липидов агент.
16. Применение соединений полиарилкарбоксамида по любому из пп.1-4 для уменьшения секреции аполипопротеина B.
17. Применение по п.16 для лечения гиперлипидемии, ожирения, диабета типа II, атеросклероза, ишемической болезни сердца, болезни периферических сосудов, болезни сосудов мозга, гиперхолестеринемии, гипертриглицеридемии, панкреатита или заболеваний коронарных артерий.
18. Способ лечения состояния, выбранного из гиперлипидемии, ожирения, диабета типа II, атеросклероза, ишемической болезни сердца, болезни периферических сосудов, болезни сосудов мозга, гиперхолестеринемии, гипертриглицеридемии, панкреатита или заболеваний коронарных артерий, включающий введение млекопитающему при необходимости такого лечения соединения полиарилкарбоксамида по любому из пп.1-4 в количестве, достаточном для уменьшения секреции аполипопротеина B.
Текст
005855 Данное изобретение относится к новым полиарилкарбоксамидам, имеющим аполипопротеин, ингибирующую В активность и сопутствующую активность по снижению содержания липидов. Изобретение,кроме того, относится к способам получения таких соединений, фармацевтическим композициям, содержащим указанные соединения, а также к применению указанных соединений в качестве медикамента для лечения гиперлипидемии, ожирения и диабета типа II. Предпосылки к созданию изобретения Ожирение является причиной огромного числа серьезных проблем со здоровьем, таких как начало в зрелом возрасте диабета и болезни сердца. Кроме того, снижение массы тела становится навязчивой идеей все возрастающей части населения. Причинная взаимосвязь между гиперхолестеринемией, особенно той, которая ассоциируется с повышенными концентрациями в плазме липопротеинов низкой плотности(называемых здесь далее как LDL) и липопротеинов очень низкой плотности (называемых здесь далее как VLDL), и преждевременным атеросклерозом и/или сердечно-сосудистым заболеванием сейчас широко известна. Однако в настоящее время для лечения гиперлипидемии имеется ограниченное число лекарств. Лекарства, используемые, главным образом, для устранения гиперлипидемии, включают смолы,усиливающие экскрецию желчных кислот, такие как холестирамин и колестипол, производные фибровой(fibric) кислоты, такие как безафибрат, клофибрат, фенофибрат, ципрофибрат и гемфиброзил, никотиновая кислота и ингибиторы синтеза холестерина, такие как ингибиторы HMG редуктазы кофермента (коэнзима) А. Главными недостатками смол, усиливающих экскрецию желчных кислот, являются неудобство введения (гранулированная форма должна быть диспергирована в воде или апельсиновом соке) и значительные побочные эффекты (желудочно-кишечный дискомфорт и запор). Производные фибровой кислоты вызывают умеренное снижение (от 5 до 25%) содержания холестерина LDL (за исключением гипертриглицеридемических пациентов, у которых первоначально низкие уровни содержания имеют тенденцию к повышению) и, хотя являются обычно хорошо переносимыми, вызывают побочные эффекты, включая усиление варфарина (антикоагулянт), зуд, усталость, головную боль, бессонницу, болезненную обратимую миопатию и ригидность больших мышечных групп, импотенцию и нарушение функции почек. Никотиновая кислота является сильнодействующим агентом, снижающим содержание липидов, что выражается 1540%-ным снижением содержания холестерина LDL (и даже 45-60%-ным при использовании в сочетании со смолой, усиливающей экскрецию желчных кислот), но с высокой частотой, вызывающей побочные эффекты, имеющие отношение к связанному с лекарством сосудорасширяющим действием, такиe как головная боль, приливы крови, сердцебиения, тахикардия и случайные обмороки, а также другие побочные эффекты,такие как желудочно-кишечный дискомфорт, гиперуринемия и недостаточная толерантность к глюкозе. В семействе HMG ингибиторов редуктазы кофермента А ловастатин и симвастатин - два неактивных пролекарства, содержащих лактоновое кольцо, которое гидролизуется в печени с образованием соответствующего активного производного гидроксикислоты. Вызывая снижение содержания холестерина LDL на 35-45%,они обычно являются хорошо переносимыми с низкой частотой незначительных побочных эффектов. Однако все еще сохраняется потребность в новых агентах с улучшенной эффективностью, снижающих содержание холестерина и/или действующих посредством механизмов иных, чем вышеупомянутые лекарства. Липопротеины плазмы являются растворимыми в воде комплексами высокой молекулярной массы,которые образованы из липидов (холестерин, триглицерид, фосфолипиды) и аполипопротеинов. Определены пять главных классов липопротеинов, происходящих из печени и/или кишечника, в соответствии с их плотностью (которую измеряют ультрацентрифугированием). Они включают LDL, VLDL, липопротеины средней плотности (упоминаемые здесь далее как IDL), липопротеины высокой плотности (упоминаемые здесь далее как HDL) и хиломикроны. Идентифицированы главные (10) аполипротеины плазмы человека. VLDL, который выделяется печенью и содержит аполипопротеин В (упоминаемый здесь далее как Аро-В), подвергается деградации до LDL, который переносит 60-70% всего сывороточного холестерина. Аро-В является также главным белковым компонентом LDL. Повышенное содержаниеLDL-холестерина в сыворотке, благодаря избыточному синтезу или недостаточному метаболизму, имеет причинную связь с атеросклерозом. Напротив, липопротеины высокой плотности (упоминаемые здесь далее как HDL), которые содержат аполипопротеин А 1, имеют защитный эффект и обратно пропорционально соотносятся с риском ишемической болезни сердца. Поэтому отношение HDL/LDL является удобным методом оценки атерогенного потенциала индивидуального липидного профиля плазмы индивидуума. Две изоформы аполипопротеина, (аро) В, аро В-48 и аро В-100, являются важными протеинами в липопротеиновом метаболизме человека. Аро В-48, называемый так, потому что он проявляется на полиакриламидных гелях с додецилсульфатом натрия как 48% от В-100, синтезируется в кишечнике человека. Аро В-48 необходим для образования хиломикронов и поэтому играет неотъемлемую роль в кишечной абсорбции пищевых жиров. Аро В-100, который образуется в печени людей, требуется для синтеза и секреции VLDL. LDL, которые составляют около 2/3 холестерина плазмы человека, являются метаболическими продуктами VLDL. Аро В-100 действительно является единственным белковым компонентом LDL. Повышенные концентрации аро В 100 и LDL холестерина в плазме считаются факторами риска для развития атеросклероза коронарных артерий. Большое число генетических и приобретенных болезней может приводить к гиперлипидемии. Они могут быть классифицированы как первичные и вторичные гиперлипидемические состояния. Наиболее распространенными причинами вторичных гиперлипидемий являются сахарный диабет, алкогольная-1 005855 зависимость, лекарства, гипотиреоз, хроническая почечная недостаточность, нефротический синдром,холестаз и булимия. К первичным гиперлипидемиям также относят обычную гиперхолестеринемию, семейную комбинированную гиперлипидемию, семейную гиперхолестеринемию, остаточную гиперлипидемию, синдром хиломикронемии и семейную гиперглицеридемию. Микросомный триглицерид, переносящий протеин (упоминаемый здесь далее как МТР), известен как катализирующий перенос преимущественно триглицерида и холестерилового сложного эфира, а не фосфолипидов, таких как фосфатидилхолин. D. Sharp et al., Natura (1993) 365:65, продемонстрировано,что дефект, вызывающий абеталипопротеинемию, находится в гене МТР. Это показывает, что МТР требуется для синтеза Аро В-содержащих липопротеинов, таких как VLDL, предшественник LDL. Отсюда следует, что ингибитор МТР должен ингибировать синтез VLDL и LDL, снижая тем самым уровни содержания VLDL и LDL, холестерина и триглицерида у людей. Об ингибиторах МТР сообщается в патентной заявке Канады 2091102 и в WO 96/26205. Об ингибиторах МТР, принадлежащих к классу полиарилкарбоксамидов, сообщается в патенте США 5760246, а также в WO 96/40640 и WO 98/27979. Одна из целей данного изобретения - обеспечить улучшенное лечение пациентов, страдающих от ожирения или атеросклероза, особенно коронарного атеросклероза и еще, как правило, от болезней, которые имеют отношение к атеросклерозу, таких как ишемическая болезнь сердца, болезнь периферических сосудов и болезнь сосудов мозга. Другая цель данного изобретения - вызвать обратное развитие (регрессию) атеросклероза и ингибировать его клинические последствия, особенно болезненность и смертность. Краткое описание изобретения Данное изобретение основано на неожиданном открытии класса новых соединений полиарилкарбоксамида, которые действуют в качестве селективных ингибиторов МТР, т.е. способны селективно блокировать МТР на уровне кишечной стенки у млекопитающих, и поэтому являются перспективными кандидатами в качестве медикаментов, в частности, для лечения гиперлипидемии. Данное изобретение дополнительно относится к нескольким способам получения соединений полиарилкарбоксамида, а также к фармацевтическим композициям, содержащим такие соединения. Кроме того, изобретение относится к конкретному числу новых соединений, которые являются полезными промежуточными соединениями для получения терапевтически активных соединений полиарилкарбоксамида, а также к способам получения таких промежуточных соединений. И, наконец, изобретение относится к способу лечения состояний, выбранных из атеросклероза, панкреатита, ожирения, гиперхолестринемии, гиперглицеридемии,гиперлипидемии, диабета и диабета типа II, включающему введение терапевтически активного соединения полиарилкарбоксамида млекопитающему. Подробное описание изобретения Данное изобретение относится к классу новых соединений полиарилкарбоксамида формулы (I) их N-оксидов, фармацевтически приемлемых солей присоединения (аддитивных солей) и стереохимически изомерных форм, гдеZ1 выбран из (СН 2)n, где n принимает значение от 1 до 3, СН 2 СН 2O и OCH2CH2;R1 означает водород или С 1-4 алкил; Аr1 означает ароматическое кольцо, выбранное из таких, как фенил, нафталинил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил,оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним или двумя заместителями R3; Аr2 означает ароматическое кольцо, выбранное из таких, как фенил, нафталинил, пиридинил, пиразинил,пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним, двумя или тремя заместителями R4; каждый R2 и R3 независимо выбран из таких групп, как C1-4 алкил, С 1-4 алкилокси, галоген, трифторметил; каждый R4 независимо выбран из таких групп, как С 1-4 алкил, С 1-4 алкилокси, галоген, гидрокси, меркапто, циано, нитро, C1-4 алкилтио или полигалоген-С 1-6 алкил, амино, С 1-4 алкиламино и ди(С 1-4 алкил)амино; р 1 и р 2, каждый, принимают значение от 0 до 2; р 3 принимает значение от 0 до 3;X1 и R4, взятые вместе с ароматическими кольцами Аr1 и Аr2, к которым они присоединены, могут образовывать группу флуорен-1-ил или флуорен-4-ил; А означает C1-6 алкандиил, замещенный одной или двумя группами, выбранными из таких групп,как арил, гетероарил и С 3-10 циклоалкил; или, когда Х 3 означает СН, А также может означать атом азота,замещенный группой, выбранной из таких, как водород, C1-10 алкил, арил, гетероарил, арил-С 1-10 алкил,гетероарил-С 1-10 алкил или С 3-10 циклоалкил;-2 005855 В означает водород, C1-10 алкил, арил или гетероарил, каждый из которых необязательно замещен группой,выбранной из таких групп, как галоген, циано, нитро, С 1-4 алкилокси, амино, C1-10 алкиламино, ди(C1-10 алкил)амино,C1-10 ацил, C1-10 алкилтио, C1-10 алкоксикарбонил, C1-10 алкиламинокарбонил и ди(C1-10 алкил)аминокарбонил; арил-С 1-10 алкил; гетероарил-С 1-10 алкил; С 3-10 циклоалкил; полигалоген-С 1-6 алкил; С 3-6 алкенил; С 3-6 алкинил; NR6R7 или OR8;R6 и R7, каждый независимо, означают водород, C1-10 алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, C1-4 алкилокси, амино,С 1-10 алкиламино, ди(С 1-10 алкил)амино, C1-10 ацил, C1-10 алкилтио, C1-10 алкиламинокарбонил и ди(С 1-10 алкил) аминокарбонил; арил-С 1-10 алкил; гетероарил-С 1-10 алкил; С 3-10 циклоалкил; С 7-10 полициклоалкил; полигалоген-С 1-6 алкил; С 3-8 алкенил; С 3-8 алкинил; конденсированный бензо-С 5-8 циклоалкил и где R6 и R7, взятые вместе с атомом азота, к которому они присоединены, могут образовывать С 4-8 насыщенный гетероциклический радикал, иR8 означает C1-10 алкил, арил или гетероарил, каждый из которых необязательно замещен группой,выбранной из таких групп, как галоген, циано, нитро, С 1-4 алкилокси, амино, C1-10 алкиламино, ди(C1-10 алкил)амино, C1-10 ацил, C1-10 алкилтио, C1-10 алкиламинокарбонил и ди(C1-10 алкил)аминокарбонил; арил-С 1-10 алкил; гетероарил-C1-10 алкил; С 3-10 циклоалкил; С 7-10 полициклоалкил; полигалоген-С 1-6 алкил; С 3-8 алкенил; С 3-8 алкинил; или конденсированный бензо-С 5-8 циклоалкил. Если не указано иначе, используемые в предшествующих определениях, здесь и далее галоген является родовым понятием для фтора, хлора и иода; С 1-4 алкил означает насыщенные углеводородные радикалы с прямой и разветвленной цепью,имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, н-бутил, 1-метилэтил, 2 метилпропил, 1,1-диметилэтил и тому подобное;C1-6 алкил, включая С 1-4 алкил (как определено здесь выше), означает и более высокие гомологи его,имеющие 5 или 6 атомов углерода, такие как, например, 2-метилбутил, н-пентил, диметилпропил, нгексил, 2-метилпентил, 3-метилпентил и тому подобное;C1-10 алкил, включая C1-6 алкил (как определено здесь выше), означает и более высокие гомологи его, имеющие 7 до 10 атомов углерода, такие как, например, гептил, этилгексил, октил, нонил, децил и тому подобное; С 3-10 циклоалкил является родовым понятием для таких групп, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил и циклодецил; полигалоген-С 1-6 алкил определен как полигалогензамещенный C1-6 алкил, в частности C1-6 алкил (как определено здесь выше), замещенный 2-13 атомами галогена, такой как дифторметил, трифторметил,трифторэтил, октафторпентил и тому подобное; арил определен как моно- и полиароматические группы, такие как фенил или нафталинил, необязательно замещенные одним-тремя заместителями, каждый из которых независимо выбран из таких заместителей, как нитро, азидо, циано, галоген, гидрокси, C1-6 алкил, С 3-7 циклоалкил, С 1-4 алкилокси, полигалоген-С 1-6 алкил, амино, моно- или ди(C1-6 алкил)амино; гетероарил определен как моно- или полигетероароматические группы, такие как те, которые включают один или несколько гетероатомов, выбранных из атомов азота, кислорода, серы и фосфора, в частности пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил, тиенил и тому подобное, включая все их возможные изомерные формы; С 3-6 алкенил определяет углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и имеющие от 3 до 6 атомов углерода, такие как, например, 2-пропенил, 3-бутенил,2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, 3-гексенил, 2-гексенил и тому подобное; С 3-6 алкинил определяет углеводородные радикалы с прямой или разветвленной цепью, содержащие одну тройную связь и имеющие от 3 до 6 атомов углерода, такие как, например, 2-пропинил, 3-бутинил,2-бутинил, 2-пентинил, 3-пентинил, 3-метил-2-бутинил, 3-гексинил, 2-гексинил и тому подобное; С 4-8 циклоалкенил определяет циклические углеводородные радикалы, содержащие одну двойную связь и имеющие от 4 до 8 атомов углерода, такие как, например, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и тому подобное; конденсированный бензо-С 5-8 циклоалкил определяет радикалы, такие как инданил, 1,2,3,4-тетрагидронафталинил, флуоренил и тому подобное; С 7-10 полициклоалкил определяет радикалы, имеющие от 7 до 10 атомов углерода, такие как, например, норборнил;C1-6 алкиламино определяет первичные аминорадикалы, имеющие от 1 до 6 атомов углерода, такие как, например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино и тому подобное; ди(С 1-6 алкил)амино определяет вторичные аминорадикалы, имеющие от 1 до 6 атомов углерода, такие как, например, диметиламино, диэтиламино, дипропиламино, диизопропиламино, N-метил-N'-этиламино, N-этил-N'-пропиламино и тому подобное;-3 005855 Фармацевтически приемлемые соли присоединения (аддитивные соли), которые упоминались здесь выше, включают терапевтически активные нетоксичные аддитивные солевые формы, которые соединения формулы (I) способны образовывать и которые могут быть легко получены обработкой таких соединений в форме основания подходящей кислотой. Примеры таких подходящих кислот включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например, хлористо-водородная или бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая,янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, циклогесансульфаминовая, салициловая (т.е. 2-гидроксибензойная), п-аминосалициловая, памовая и тому подобное. И, наоборот, солевая форма может быть превращена в форму свободного основания обработкой подходящей щелочью. Используемый здесь выше термин "фармацевтически приемлемая аддитивная соль" включает также сольваты, которые соединения формулы (I), а также их соли способны образовывать, такие как, например, гидраты, алкоголяты и тому подобное.N-оксидные формы соединений формулы (I) включают такие соединения, где один или несколько атомов азота окислены с использованием хорошо известных в технике методов превращения трехвалентного азота в N-оксидную форму. Указанная реакция N-окисления обычно может быть проведена путем взаимодействия соединения формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с подходящим органическим или неорганическим пероксидом по меньшей мере в одном подходящем растворителе. Подходящие неорганические пероксиды включают, например, пероксид водорода и пероксиды щелочных металлов или щелочно-земельных металлов, например пероксиды натрия или калия. Подходящие органические пероксиды могут содержать пероксикислоты, такие как, например, бензолкарбопероксикислота или замещенная галогеном бензолкарбопероксикислота (например, 3-хлорбензолкарбопероксикислота), пероксоалкановые кислоты (например, пероксоуксусная кислота) и алкилгидропероксиды (например, трет-бутилгидропероксид). Подходящие растворители для этой реакции включают, например, воду,низшие спирты (например, этанол и тому подобное), углеводороды (например, толуол), кетоны (например, 2-бутанон), галогенированные углеводороды (например, дихлорметан) и смеси таких растворителей. Соединения полиарилкарбоксамида формулы (I) могут иметь по меньшей мере один хиральный центр в группе А, и/или в группе В, и/или в циклической группе, включающей Х 2 и Х 3. Используемый здесь термин "стереохимически изомерные формы" определяет все возможные изомерные формы, которыми могут принимать соединения формулы (I). Если не указано иначе, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь или R-, или S-конфигурацию, заместители на двухвалентных циклических насыщенных радикалах могут иметь или цис-, или трансконфигурацию. Такое же определение применимо к различным новым описанным здесь промежуточным соединениям, которые используются для получения соединений полиарилкарбоксамида формулы (I). Чистые стереоизомерные формы указанных соединений и промежуточных соединений определены как изомеры, по существу не содержащие других энантиомерных или диастереомерных форм той же самой основной молекулярной структуры. В частности, термин "стереоизомерно чистый" или "хирально чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере 80% (например, по меньшей мере 90% одного изомера и самое большее 10% других возможных изомеров), предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 94% и наиболее предпочтительно по меньшей мере 97%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогично, как относящиеся к энантиомерному избытку, соответственно диастереомерному избытку, смеси, о которой идет речь. Следовательно, если смесь энантиомеров получают путем какого-либо из следующих способов получения, она может быть разделена жидкостной хроматографией с использованием подходящей хиральной стационарной фазы. Подходящими хиральными стационарными фазами являются, например, полисахариды, в частности производные целлюлозы и амилозы. Коммерчески доступными хиральными стационарными фазами на основе полисахарида являются ChiralCel СА, ОА, ОВ, ОС, OD, OF, OG, OJ иOK и Chiralpak AD, AS, ОР(+) и ОТ(+). Подходящими элюентами или мобильными фазами для использования в сочетании с указанными полисахаридными хиральными стационарными фазами являются гексан и тому подобное, модифицированные спиртом, таким как этанол, изопропанол и тому подобное. Термины "цис" и "транс" использованы здесь в соответствии с номенклатурой Chemical Abstracts и относятся к положению заместителей на кольцевой части молекулы. Абсолютная стереохимическая конфигурация соединений полиарилкарбоксамида формулы (I) и промежуточных соединений, используемых для их получения, легко может быть определена специалистами с использованием хорошо известных методов, таких как, например, дифракция рентгеновских лучей. Кроме того, некоторые соединения полиарилкарбоксамида формулы (I) и некоторые промежуточные соединения, используемые для их получения, могут обнаруживать полиморфизм. Следует понимать,-4 005855 что данное изобретение охватывает любые полиморфные формы, обладающие свойствами полезными при лечении состояний, указанных здесь выше. Группа представляющих интерес соединений состоит из таких соединений формулы (I), в отношении которых применимы одно или несколько следующих ограничений:b) R2 означает водород или С 1-4 алкил;c) R3 означает водород или С 1-4 алкил;i) В означает С 1-4 алкилокси или C1-10 алкиламино. Представляющими интерес соединениями являются те соединения формулы (I), где Z1, Z2, Х 2 и Х 3,взятые вместе, образуют шестичленный гетероцикл. Особо важными соединениями являются те соединения формулы (I), где радикал В представлен метилокси или этилокси. Другими особо важными соединениями являются те соединения формулы (I), где R2 и/или R3 означают С 1-4 алкил. Следующей группой особо важных соединений являются те соединения формулы (I), где R4 означает С 1-4 алкил или трифторметокси. Более предпочтительными соединениями являются те соединения формулы (I), где Z1, Z2, Х 2 и Х 3,взятые вместе, образуют группу пиперидина или пиперазина и X1 означает непосредственную связь. Более предпочтительными соединениями формулы (I) являются те соединения, где R2 и R3, каждый,означают водород и R4 означает водород, трифторметил, хлор или трет-бутил. Наиболее предпочтительными соединениями формулы (I) являются и их стереоизомерные формы, фармацевтически приемлемые аддитивные соли с кислотой или Nоксиды. Одно из преимуществ данного изобретения - это легкость, с которой соединения формулы (I) могут быть получены многочисленными различными способами. Некоторые из этих способов будут описаны сейчас подробно, не претендуя на исчерпывающий перечень способов получения указанных соединений. Первым способом получения соединения полиарилкарбоксамида согласно данному изобретению является способ, где промежуточное соединение фениленамина, имеющее формулу где Z1, Z2, Х 2, Х 3, p1, R1, R2, А и В являются такими, как определено выше в отношении формулы (I), подвергают взаимодействию с полиарилкарбоновой кислотой или хлорангидридом, имеющим формулу (III),-6 005855 где X1, Ar1, Аr2, р 2, p3, R3 и R4 являются такими, как определено в отношении формулы (I), и Y1 выбран из гидрокси и галогена, по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии подходящего основания, причем указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. В случае, когда Y1 означает гидрокси, может быть удобно активировать бифенилкарбоновую кислоту формулы (III) добавлением эффективного количества промотора реакции. Неограничительные примеры таких промоторов реакции включают карбонилдиимидазол, диимиды, такие как N,N'дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид, и их функциональные производные. Для этого типа процедуры ацилирования предпочтительно использовать полярный апротонный растворитель, такой как, например, метиленхлорид. Подходящие основания для проведения этого первого способа включают третичные амины, такие как триэтиламин, триизопропиламин и тому подобное. Подходящие температуры для проведения первого способа по изобретению обычно находятся в пределах от около 20 до около 140 С, в зависимости от конкретного используемого растворителя, и в большинстве случаев будет температурой кипения указанного растворителя. Вторым способом получения соединения полиарилкарбоксамида согласно данному изобретению,где Х 3 означает азот, является способ, где промежуточное соединение, имеющее формулу где Z1, Z2, X1, X2, p1, p2, p3, Ar1, Ar2, R1, R2, R3 и R4 являются такими, как определено в отношении формулы (I), и Х 3 означает азот, подвергают взаимодействию с реагентом, имеющим формулу (V), где А и В являются такими, как определено в отношении формулы (I), и Y2 выбран из галогена, тозилокси, мезилокси, нафтилсульфонилокси, или -A-Y2 означает R'5COR5, где R5 и R'5 являются такими, что радикал R'5CHR5 охватывается определением А в формуле (I), по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного подходящего активатора нуклеофильного замещения и/или подходящего основания, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. Когда Y2 означает галоген, процедура алкилирования может быть осуществлена, например, в присутствии карбоната натрия или калия или третичного амина, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как диметилформамид или метилизопропилкетон, и необязательно в присутствии каталитического количества иодида калия для того, чтобы усовершенствовать нуклеофильное замещение. Промежуточные соединения формулы (IV), где Х 3 означает азот, также могут быть восстановительно N-алкилированы посредством альдегида или кетона формулы(V), где -A-Y2 означает R'5COR5, формируя таким образом соединения формулы (I). Указанное восстановительное N-алкилирование может быть осуществлено в реакционноинертном растворителе, таком как,например, толуол, метанол, тетрагидрофуран или их смесь, и в присутствии восстановителя. Неограничительные примеры таких восстановителей включают водород и бор гидриды, например боргидрид натрия, боргидрид цинка, боргидрид лития, цианоборгидрид натрия, триацетоксиборгидрид и тому подобное. Когда в качестве восстановителя используют боргидрид, может быть удобно проводить N-алкилирование при дополнительном присутствии катализатора. Неограничительные примеры таких катализаторов включают алкоксиды переходных металлов, например изопропоксид титана (IV), н-бутоксид титана (IV) и тому подобное, как раскрыто в J. Org. Chem. (1990), 55:2552-4. Когда в качестве восстановителя используют водород, может быть удобно проводить N-алкилирование при дополнительном присутствии катализатора. Неограничительные примеры катализаторов, подходящих для этой цели, включают благородный металл на носителе, такой как, например, палладий на угле или платина на угле. Образование основания Шиффа на первой стадии указанной реакции восстановительного N-алкилирования может быть дополнительно усовершенствовано дополнительным присутствием подходящего реагента, такого как трет-бутоксид алюминия, оксид кальция, гидрид кальция и тому подобное. К реакционной смеси может быть также добавлен подходящий каталитический яд, например тиофен, бутантиол, тиохинолин или тому подобное, для того чтобы предотвратить нежелательное гидрирование конкретных функциональных групп в реагентах и/или в продукте реакции. Перемешивание и необязательно повышенная температура и/или давление могут дополнительно способствовать скорости такой реакции.-7 005855 Третьим способом получения соединения полиарилкарбоксамида согласно данному изобретению является способ, где промежуточное соединение, имеющее формулу где Z1, Z2, X1, Х 2, Х 3, p1, р 2, p3, Ar1, Ar2, R1, R2, R3, R4 и А являются такими, как определено в отношении формулы (I), и Y3 выбран из галогена и гидрокси, подвергают взаимодействию с реагентом формулы ВН,где В означает NR6R7 или OR8 и R6, R7 и R8 являются такими, как определено в отношении формулы (I),по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного подходящего агента связывания и/или подходящего основания, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. В случае, когда Y3 означает гидрокси, может быть удобно активировать карбоновую кислоту формулы (VI) добавлением эффективного количества промотора реакции. Неограничительные примеры таких промоторов реакции включают карбонилдиимидазол,диимиды, такие как N,N'-дициклогексилкарбодиимид или 1-(3-диметиламинопропил)-3-этилкарбодиимид, и их функциональные производные. В случае, когда используют хирально чистый реагент формулы (V), может быть проведена быстрая реакция без изомеризации промежуточного соединения формулы (VI) с указанным реагентом при дополнительном присутствии эффективного количества такого соединения, как гидроксибензотриазол, гексафторфосфат бензотриазолилокситрис-(диметиламино) фосфония, гексафторфосфат тетрапирролидинфосфония, гексафторфосфат бромтрипирролидинфосфония, или его функционального производного, так, как раскрыто D. Hudson в J. Org. Chem. (1988), 53:617. В случае, когда Y3 означает гидрокси и В означает OR8, тогда реакция этерификации может быть удобно проведена в присутствии эффективного количества кислоты, такой как серная кислота и тому подобное. Четвертым способом получения соединения полиарилкарбоксамида согласно данному изобретению, где Х 3 означает азот и где А является группой, подходящей для реакции присоединения Михаэля,является способ, где промежуточное соединение, имеющее формулу (IV), где Х 3 означает азот, подвергают взаимодействию с реагентом формулы (VII) охватывается определением А формулы (I), по меньшей мере в одном реакционноинертном растворителе, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. Реакционноинертным растворителем может быть, например, диметилформамид или метанол, и температурой реакции может быть температура кипения указанного растворителя. В противоположность большинству альтернативных способов получения соединений полиарилкарбоксамида по данному изобретению, четвертый способ не требует присутствия катализатора или иного связывающего агента для того, чтобы количественно получить целевое соединение. К реакционной смеси необязательно может быть добавлено основание, такое как карбонат натрия, карбонат калия, карбонат цезия и тому подобное. Как обычно принято в технике, А предпочтительно является ,-ненасыщенным карбонильным соединением, таким как кетон или сложный эфир, -атом углерода которого подвержен нуклеофильному воздействию. Неограничительные примеры групп А, подходящих для такой реакции присоединения Михаэля, включают, например Пятым способом получения соединения полиарилкарбоксамида согласно данному изобретению является способ, где промежуточное соединение, имеющее формулу (VIII) где Z1, Z2, Х 3, А и В являются такими, как определено в отношении формулы (I), по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного агента связывания на основе переходного металла и/или по меньшей мере одного подходящего лиганда, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. Этот тип реакции известен в технике как реакция Бухвальдта, ссылки на применимые металлические агенты связывания и/или подходящие лиганды, например соединения палладия, такие как палладий-тетра(дифенилфосфин), трис(дибензилиденацетондипалладий), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил и тому подобное, могут быть найдены, например, в Tetrahedron Letters (1996) 37(40) 7181-7184 и J. Am. Chem. Soc. (1996) 118:7216. ЕслиY5 означает В(ОН)2, в качестве агента связывания вместо ацетата меди, скорее, должны быть использованы алкилборонат или его циклический аналог согласно Tetrahedron Letters (1998) 39:2933-6. Шестым способом получения соединения полиарилкарбоксамида согласно данному изобретению является способ, где промежуточное соединение, имеющее формулу (X) где Z1, Z2, Х 3, А и В являются такими, как определено в отношении формулы (I) , один из Y6 и Y7 выбран из брома, иода и трифторметилсульфоната и другой из Y6 и Y7 выбран из три(C1-4 алкил)олова, В(ОН)2,алкилборонатов и их циклических аналогов, по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного агента связывания на основе переходного металла и/или по меньшей мере одного подходящего лиганда, такого как палладий, связанный с трифенилфосфином, трифениларсином и тому подобное, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. Этот тип реакции известен в технике как реакция Stille или реакция Сузуки,ссылка на применимые агенты связывания на основе переходного металла и/или подходящие лиганды может быть найдена, например, в Syn. Letters (1998)6, 671-5, в Chem. Rev. (1999)99(6) 1549-1581 и в TheStille Reaction (John WileySons, Inc.) ISBN 0-471-31273-8. Седьмым способом получения соединения полиарилкарбоксамида согласно данному изобретению является способ, где промежуточное соединение, имеющее формулу (XII)-9 005855 где Z1, Z2, Х 2, Х 3, p1, р 2, Ar1, R1, R2, R3, А и В являются такими, как определено в отношении формулы (I),и Y8 выбран из брома, иода и трифторметилсульфоната, подвергают взаимодействию либо с арил-борной кислотой, имеющей формулу (XIIIa) где R3, R4, Ar2 и р 3 являются такими, как определено в отношении формулы (I), по меньшей мере в одном реакционноинертном растворителе и необязательно в присутствии по меньшей мере одного агента связывания на основе переходного металла и/или по меньшей мере одного подходящего лиганда, где указанный способ необязательно дополнительно включает превращение соединения формулы (I) в его аддитивную соль и/или получение его стереохимически изомерных форм. Этот тип реакции известен в технике как реакция Stille или реакция Сузуки, ссылки на применимые агенты связывания на основе переходного металла и/или подходящие лиганды могут быть найдены, например, в литературе, цитированной выше. Примерами агентов связывания для этого способа являются, например, бис(трифенилфосфин)дихлорпалладий и диацетилпалладий. Примерами реакционноинертных растворителей для этой реакции являются 1,4-диоксан, толуол, диметилформамид, тетрагидрофуран, диметиловый простой эфир и тому подобное. Кроме того, способом получения соединения полиарилкарбоксамида формулы (I), где В означаетNR6R7 из соединения полиарилкарбоксамида формулы (I), где В означает OR5, является способ, включающий на первой стадии гидролиз последнего и на второй стадии взаимодействие полученной в результате соответствующей карбоновой кислоты с амином, имеющим формулу HNR6R7, по меньшей мере в одном реакционноинертном растворителе и дополнительно необязательно содержащий превращение полученного в результате соединения формулы (I), где В означает NR6R7, в его аддитивную соль и/или получение его стереохимических изомерных форм. Первую стадию гидролиза проводят в кислой среде,такой как сильно концентрированная хлористо-водородная кислота, и необязательно в присутствии органического растворителя, такого как диоксан. Соединения формулы (I) могут быть также удобно получены с использованием технологии твердофазного синтеза. Как правило, твердофазный синтез включает во взаимодействие промежуточное соединение в синтезе с полимерным носителем. Это промежуточное соединение на полимерном носителе может быть затем проведено через несколько стадий синтеза. После каждой стадии загрязняющие примеси удаляют фильтрованием смолы и промыванием несколько раз различными растворителями. На каждой стадии смола может быть отделена так, чтобы она взаимодействовала с различными промежуточными соединениями на следующей стадии, позволяя таким образом синтезировать большое число соединений. После последней стадии в методике смолу обрабатывают таким реагентом или способом, чтобы отделить смолу от образца. Более подробное объяснение методик, используемых в твердофазной химии, дано, например, в "The Combinatorial Index" (B. Bunin, Academic Press) и в Novabiochem's 1999 CataloguePeptideSynthesis Handbook (Novabiochem AG, Switzerland), оба источника приведены здесь в виде ссылки. Кроме того, изобретение относится к соединениям любой из формул (II), (III), (IV), (VI), (VIII), (X) и (XII) здесь ниже: где Z1 выбран из (СН 2)n, где n принимает значения от 1 до 3, CH2CH2O и ОСН 2 СН 2;R1 означает водород или С 1-4 алкил; Аr1 означает ароматическое кольцо, выбранное из таких, как фенил, нафталинил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил,оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним или двумя заместителями R3; Аr2 означает ароматическое кольцо, выбранное из таких, как фенил, нафталинил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, триазолил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, пирролил, фуранил и тиенил, необязательно замещенных одним, двумя или тремя заместителями R4; каждый R2 и R3 независимо выбран из таких групп, как C1-4 алкил, С 1-4 алкилокси, галоген и трифторметил; каждый R4 независимо выбран из таких групп, как С 1-4 алкил, С 1-4 алкилокси, галоген, гидрокси, меркапто, циано, нитро, C1-4 алкилтио или полигалоген-С 1-6 алкил, амино, С 1-4 алкиламино и ди(С 1-4 алкил)амино; р 1 и р 2, каждый, принимает значение от 0 до 2; р 3 принимает значение от 0 до 3;X1 и R4, взятые вместе с ароматическими кольцами, к которым они присоединены, могут образовывать группу флуорен-1-ил или флуорен-4-ил; А означает C1-6 алкандиил, замещенный одной или двумя группами, выбранными из таких групп,как арил, гетероарил и С 3-10 циклоалкил; кислород или непосредственную связь; В означает водород, C1-10 алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, нитро, С 1-4 алкилокси, амино, C1-10 алкиламино,- 11005855 ди(С 1-10 алкил)амино, C1-10 ацил, C1-10 алкилтио, C1-10 алкоксикарбонил, C1-10 алкиламинокарбонил и ди(С 1-10 алкил)аминокарбонил; арил-С 1-10 алкил; гетероарил-С 1-10 алкил; С 3-10 циклоалкил; полигалоген-С 1-6 алкил; С 3-6 алкенил; С 3-6 алкинил; NR6R7 или OR8;R6 и R7, каждый независимо, означают водород, C1-10 алкил, арил или гетероарил, каждый из которых необязательно замещен группой, выбранной из таких групп, как галоген, циано, C1-4 алкилокси, амино,C1-10 алкиламино, ди(С 1-10 алкил)амино, C1-10 ацил, C1-10 алкилтио, C1-10 алкиламинокарбонил и ди(С 1-10 алкил)аминокарбонил; арил-С 1-10 алкил; гетероарил-С 1-10 алкил; С 3-10 циклоалкил; С 7-10 полициклоалкил; полигалоген-С 1-6 алкил; С 3-8 алкенил; С 3-8 алкинил; конденсированный бензо-С 5-8 циклоалкил и где R6 и R7, взятые вместе с атомом азота, к которому они присоединены, могут образовывать С 4-8 насыщенный гетероциклический радикал,R8 означает C1-10 алкил, арил или гетероарил, каждый из которых необязательно замещен группой,выбранной из таких групп, как галоген, циано, нитро, С 1-4 алкилокси, амино, C1-10 алкиламино, ди(C1-10 алкил)амино, C1-10 ацил, C1-10 алкилтио, C1-10 алкиламинокарбонил и ди(C1-10 алкил)аминокарбонил; арил-С 1-10 алкил; гетероарил-C1-10 алкил; С 3-10 циклоалкил; С 7-10 полициклоалкил; полигалоген-С 1-6 алкил; С 3-8 алкенил; С 3-8 алкинил или конденсированный бензо-С 5-8 циклоалкил; когда Х 3 означает СН, А может также представлять атом азота с таким заместителем, как водород,C1-10 алкил, арил, гетероарил, арил-С 1-10 алкил, гетероарил-С 1-10 алкил или С 3-10 циклоалкил;Y1 и Y3, каждый независимо, выбраны из гидрокси и галогена;Y6 и Y8, каждый независимо, выбраны из брома, иода и трифторметилсульфоната,которые применимы в качестве промежуточных соединений для получения соединений полиарилкарбоксамида по данному изобретению. Кроме того, данное изобретение относится к способам получения указанных семейств промежуточных соединений, таким как раскрытые в предшествующих примерах. Соединения полиарилкарбоксамида формулы (I), их N-оксидные формы, фармацевтически приемлемые соли и стереоизомерные формы обладают благоприятной активностью ингибирования аполипопротеина В и сопутствующей активностью снижения содержания липидов. Поэтому данные соединения применимы в качестве медикамента, особенно в способе лечения пациентов, страдающих от гиперлипидемии, ожирения, атеросклероза или диабета типа II. В частности, данные соединения могут быть использованы для получения медикамента для лечения расстройств, вызываемых избытком липопротеинов очень низкой плотности (VLDL) или липопротеинов низкой плотности (LDL), и особенно расстройств,вызываемых холестерином, связанным с указанными VLDL и LDL. Причинная взаимосвязь между гиперхолестеринемией - особено той, которая ассоциируется с повышенными концентрациями в плазме липопротеинов низкой плотности (LDL) и липопротеинов очень низкой плотности (VLDL) - и преждевременным атеросклерозом и/или сердечно-сосудистыми заболеваниями является доказанной. VLDL секретируется печенью и содержит аполипопротеин В (аро-В), эти частицы подвергаются деградации в процессе кровообращения до LDL, который переносит 60-70% всего сывороточного холестерина. Аро-В является также главным белковым компонентом LDL. Повышенное содержание LDL-холестерина в сыворотке благодаря избыточному синтезу или недостаточному метаболизму имеет причинную связь с атеросклерозом. Напротив, липопротеины высокой плотности (HDL),которые содержат аполипопротеин А 1, имеют защитный эффект и обратно пропорционально соотносятся с риском ишемической болезни сердца. Поэтому отношение HDL/LDL является удобным методом оценки атерогенного потенциала индивидуального липидного профиля плазмы. Главный механизм действия соединений формулы (I) проявляется в том, что вызывает ингибирование активности МТР (микросомного переносящего триглицерид протеина) в гепатоцитах и эпителиальных клетках кишечника, что имеет результатом повышенное продуцирование VLDL и хиломикронов,соответственно. Это новый и новаторский подход к гиперлипидемии и, как предполагается, к снижениюLDL-холестерина и триглицеридов через уменьшенное продуцирование печенью VLDL и кишечное продуцирование хиломикронов. Большое число генетических и приобретенных болезней может приводить к гиперлипидемии. Они могут быть классифицированы на первичные и вторичные гиперлипидемические состояния. Наиболее распространенными причинами вторичных гиперлипидемий являются сахарный диабет, алкогольная зависимость, лекарства, гипотиреоз, хроническая почечная недостаточность, нефротический синдром,холестаз и булимия. К первичным гиперлипидемиям относятся гиперхолестеринемия, семейная комбинированная гиперлипидемия, семейная гиперхолестеринемия, остаточная гиперлипидемия, синдром хиломикронемии, семейная гиперглицеридемия. Данные соединения также могут быть использованы для профилактики и лечения пациентов, страдающих от ожирения или от атеросклероза, особенно коронарного атеросклероза, и еще, как правило, от расстройств, которые имеют отношение к атеросклерозу, таких как ишемическая болезнь сердца, болезнь периферических сосудов, болезнь сосудов мозга. Данные соединения могут вызывать обратное развитие атеросклероза и ингибировать клинические последствия атеросклероза, особенно болезненность и смертность. Ввиду полезности соединений формулы (I), следует, что данное изобретение относится также к способу лечения теплокровных животных, включая людей (обычно называемых здесь пациентами), страда- 12005855 ющих от расстройств, вызванных избытком липопротеинов очень низкой плотности (VLDL) или липопротеинов низкой плотности (LDL), и особенно расстройств, вызванных холестерином, связанным с указанными VLDL и LDL. Следовательно, предложен способ лечения и облегчения состояния пациентов, страдающих от таких состояний, как, например, гиперлипидемия, ожирение, атеросклероз или диабет типа II. Аро В-48, синтезируемый кишечником, необходим для образования хиломикронов и поэтому играет обязательную роль в кишечной абсорбции пищевых жиров. Данное изобретение относится к соединениям полиарилкарбоксамида, которые действуют в качестве селективных ингибиторов МТР на уровне кишечной стенки. Дополнительно данное изобретение относится к фармацевтическим композициям, содержащим по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения полиарилкарбоксамида, имеющего формулу (I). Для того чтобы приготовить фармацевтические композиции по данному изобретению, эффективное количество конкретного соединения в форме основания или аддитивной соли в качестве активного ингредиента объединяют в тонкую смесь по меньшей мере c одним фармацевтически приемлемым носителем, который может иметь большое разнообразие форм в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции желательны в унифицированной (стандартной) дозированной форме, подходящей предпочтительно для орального введения, ректального введения, чрескожного введения или парентеральной инъекции. Например, при получении композиций в оральной дозированной форме могут быть использованы любые обычные жидкие фармацевтические носители, такие как, например, вода, гликоли, масла, спирты и тому подобное, в случае оральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые фармацевтические носители, такие как крахмалы, сахара, каолин, смазки, связующие, дезинтегрирующие агенты и тому подобное, в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения таблетки и капсулы представляют наиболее выгодную унифицированную(стандартную) дозированную форму, в этом случае явно используют твердые фармацевтические носители. Для композиций для парентеральной инъекции фармацевтический носитель будет содержать, главным образом, стерильную воду, хотя в состав композиции могут быть включены другие ингредиенты для того, чтобы улучшить растворимость активного ингредиента. Растворы для инъекций могут быть приготовлены, например, с использованием фармацевтического носителя, содержащего раствор соли, раствор глюкозы или их смесь. Суспензии для инъекций также могут быть приготовлены с использованием подходящих жидких носителей, суспендирующих агентов и тому подобного. В композициях для чрескожного введения фармацевтический носитель необязательно может содержать агент, улучшающий проницаемость, и/или подходящий смачивающий агент, необязательно объединенный с небольшими количествами подходящих добавок, которые не оказывают значительного повреждающего действия на кожу. Указанные добавки могут быть выбраны для того, чтобы облегчить введение активного ингредиента в кожу и/или чтобы способствовать приготовлению желательных композиций. Эти композиции для местного применения могут быть введены различными путями, например чрескожным пластырем, наклейкой или мазью. Аддитивные соли соединений формулы (I) благодаря их повышенной растворимости в воде по сравнению с соответствующей формой основания очевидно являются более подходящими для получения водных композиций. Особенно выгодно составлять фармацевтические композиции по изобретению в унифицированной(стандартной) дозированной форме для облегчения введения и равномерности дозирования. "Унифицированная дозированная форма", как используется здесь, относится к физически дискретным единицам,подходящим в качестве стандартных доз, каждая единица содержит предопределенное количество активного ингредиента, рассчитанное так, чтобы получить желательный терапевтический эффект, в сочетании с необходимым фармацевтическим носителем. Примерами таких унифицированных дозированных форм являются таблетки (включая таблетки с насечкой и с покрытием), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, дозы, отмеряемые чайной ложкой, дозы, отмеряемые столовой ложкой, и тому подобное и их разделяемые составные структуры. Для орального введения фармацевтические композиции по данному изобретению могут принимать форму твердых дозированных форм, например таблеток (в формах как для глотания, так и для жевания),твердых или мягких капсул, полученных обычными способами с фармацевтически приемлемыми разбавителями и носителями, такими как связующие агенты (например, предварительно клейстеризованный кукурузный крахмал, поливинилпирролидон, гидроксипропилметилцеллюлоза и тому подобное), наполнители (например, лактоза, микрокристаллическая целлюлоза, фосфат кальция и тому подобное), смазки(например, стеарат магния, тальк, диоксид кремния и тому подобное), дезинтегрирующие агенты (например, картофельный крахмал, натриевый гликолят крахмала и тому подобное), смачивающие агенты(например, лаурилсульфат натрия) и тому подобное. Такие таблетки могут быть также покрыты способами, хорошо известными в технике. Жидкие препараты для орального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут быть приготовлены как сухой продукт для смешивания с водой и/или другим подходящим жидким носителем перед применением. Такие жидкие препараты могут быть приготов- 13005855 лены обычными средствами необязательно с другими фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры), эмульгирующие агенты (например, лецитин или камедь акации), неводные носители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт), подслащиватели, ароматизаторы, маскирующие вкус агенты и консерванты (например,метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащиватели, применимые в фармацевтических композициях по данному изобретению, содержат предпочтительно по меньшей мере один интенсивный подслащиватель,такой как аспартам, ацесульфам калий, цикламат натрия, алитам, дигидрохалконовый подслащиватель,монелин, стевиозид сукралоза (4,1',6'-трихлор-4,1',6'-тридезоксигалактосахароза) или, предпочтительно,сахарин, натриевая или кальциевая соль сахарина, или необязательно по меньшей мере один объемный подслащиватель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, гидрогенизированный сироп глюкозы, ксилит, карамель или мед. Интенсивные подслащиватели обычно используют в низких концентрациях. Например, в случае натриевой соли сахарина указанная концентрация может находиться в пределах от около 0,04 до 0,1% (масса/объем) конечного состава. Объемный подслащиватель может быть эффективно использован в более высоких концентрациях в пределах от около 10 до около 35%, предпочтительно от около 10 до 15% (масса/объем). Фармацевтически приемлемые ароматизаторы, которые могут маскировать ингредиенты горького вкуса в рецептурах малых доз, являются предпочтительно фруктовыми ароматизаторами, такими как вишневый, малиновый, черносмородиновый или клубничный ароматизатор. Сочетание двух ароматизаторов может давать очень хорошие результаты. В рецептурах высоких доз могут быть необходимы более сильные фармацевтически приемлемые ароматизаторы, такие как карамельный, шоколадный, холодный мятный, фантази и тому подобное. Каждый ароматизатор может присутствовать в конечной композиции в концентрации в пределах от около 0,05 до 1% (масса/объем). Могут быть удачно использованы сочетания указанных сильных ароматизаторов. Предпочтительно ароматизатор используют так, чтобы он не подвергался какому-либо изменению или потере вкуса и/или цвета в условиях приготовления композиции. Соединения полиарилкарбоксамида по данному изобретению могут быть приготовлены для парентерального введения путем инъекции, обычно внутривенной, внутримышечной или подкожной инъекции, например инъекции болюсом или непрерывным внутривенным вливанием. Препараты для инъекций могут быть представлены в унифицированной дозированной форме, например в ампулах или в мультидозовых контейнерах, включающих добавленный консервант. Они могут принимать такие формы, как суспензии, растворы или эмульсии в маслянистых или водных носителях и могут содержать составляющие агенты, такие как изотонирующие, суспендирующие, стабилизирующие и/или диспергирующие агенты. В качестве варианта, активный ингредиент может быть представлен в порошковой форме для смешивания с подходящим носителем, например со стерильной апирогенной водой, перед применением. Соединения полиарилкарбоксамида по данному изобретению могут быть приготовлены в виде ректальных композиций, таких как суппозитории или удерживаемые клизмы, например, содержащие обычные основы суппозитория, такие как какао-масло и/или другие глицериды. Соединения полиарилкарбоксамида по данному изобретению могут быть использованы в сочетании с другими фармацевтическими агентами, в частности фармацевтические композиции по данному изобретению могут дополнительно содержать по меньшей мере один дополнительный агент, снижающий содержание липидов, что приводит к так называемой комбинированной терапии, снижающей содержание липида. Указанным дополнительным снижающим содержание липидов агентом может быть, например,известное лекарство, обычно используемое для устранения гиперлипидемии, такое как, например, смола,усиливающая экскрецию желчных кислот, производное фибровой кислоты или никотиновая кислота, как ранее упоминалось в разделе о предпосылках создания изобретения. Подходящие дополнительные снижающие содержание липидов агенты также включают другие ингибиторы биосинтеза холестерина и ингибиторы абсорбции холестерина, особенно ингибиторы редуктазы HMG-CoA и ингибиторы синтазыHMG-CoA, ингибиторы экспрессии генов редуктазы HMG-CoA, ингибиторы СЕТР, ингибиторы АСАТ,ингибиторы сквален-синтетазы и тому подобное. Любой ингибитор редуктазы HMG-CoA может быть использован в качестве второго соединения в аспекте комбинированной терапии по данному изобретению. Используемый здесь термин "ингибитор редуктазы HMG-CoA", если не указано иначе, относится к соединению, которое ингибирует биопревращение гидроксиметилглутарил-кофермента А в мевалоновую кислоту, катализируемое ферментом редуктазой HMG-CoA. Такое превращение легко может быть определено специалистом согласно стандартным анализам, например Methods of Enzymology (1981) 71:455-509. Примеры соединений описаны, например, в патенте США 4231938 (включая ловастатин), патенте США 4444784 (включая симвастатин), патенте США 4739073 (включая флувастатин), патенте США 4346227 (включая правастатин),в ЕР-А-491226 (включая ривастатин) и в патенте США 4647576 (включая аторвастатин). Любой ингибитор синтазы HMG-CoA может быть использован в качестве второго соединения в аспекте комбинированной терапии по данному изобретению. Используемый здесь термин "ингибитор синтазы HMG-CoA", если не установлено иначе, относится к соединению, которое ингибирует биосинтез- 14005855 гидроксиметилглутарил-кофермента А из ацетил-кофермента А и ацетоацетил-кофермента А, катализируемый ферментом синтазой HMG-CoA. Такое ингибирование легко может быть определено специалистом согласно стандартным анализам, например Methods of Enzymology (1985) 110:19-26. Примеры соединений описаны, например, в патенте США 5120729, относящемся к производным бета-лактама,патенте США 5064856, относящемся к производным спиролактона, и в патенте США 4847271, относящемся к соединениям оксетана. Любой ингибитор экспрессии генов редуктазы HMG-CoA может быть использован в качестве второго соединения в аспекте комбинированной терапии по данному изобретению. Этими агентами могут быть ингибиторы траскрипции редуктазы HMG-CoA, которые блокируют транскрипцию ДНК, или ингибиторы трансляции, которые предотвращают трансляцию mRNA, которая кодирует редуктазу HMG-CoA в протеин. Такие ингибиторы либо непосредственно могут влиять на транскрипцию или трансляцию,либо могут быть биотрансформированы в соединения, имеющие указанные выше атрибуты, одним или несколькими ферментами в каскаде биосинтеза холестерина, или могут приводить к накоплению метаболита, имеющего указанные выше активности. Такая регуляция легко может быть определена специалистом согласно стандартным анализам, например Methods of Enzymology (1985) 110:9-19. Примеры соединений описаны, например, в патенте США 5041432 и в E.I. Mercer, Prog. Lip. Res. (1993) 32:357-416. Любой ингибитор СЕТР может быть использован в качестве второго соединения в аспекте комбинированной терапии по данному изобретению. Используемый здесь термин "ингибитор СЕТР", если не установлено иначе, относится к соединению, которое ингибирует белок переноса сложного холестерилового эфира (СЕТР), опосредующий перенос различных сложных холестериловых эфиров и триглицеридов от HDL до LDL и VLDL. Примеры соединений описаны, например, в патенте США 5512548, в J.Antibiot. (1996) 49(8):815-816 и в Bioorg. Med. Chem. Lett. (1996)6:1951-1954. Любой ингибитор АСАТ может быть использован в качестве второго соединения в аспекте комбинированной терапии по данному изобретению. Используемый здесь термин "ингибитор АСАТ", если не установлено иначе, относится к соединению, которое ингибирует внутриклеточную этерификацию холестерина пищи ферментом ацил-СоА:холестеринацилтрансферазой. Такое ингибирование легко может быть определено специалистом согласно стандартным анализам, например методом Heider et al., JournalWO 96/26948 и в WO 96/10559. Любой ингибитор сквален-синтетазы может быть использован в качестве второго соединения в аспекте комбинированной терапии по данному изобретению. Используемый здесь термин "ингибитор сквален-синтетазы", если не установлено иначе, относится к соединению, которое ингибирует конденсацию двух молекул фарнезилпирофосфата до образования сквалена, катализируемую ферментом скваленсинтетазой. Такое ингибирование легко может быть определено специалистом согласно стандартным анализам, например Methods of Enzymology (1985) 110:359-373. Примеры соединений описаны, например, в ЕР-А-567026, в ЕР-А-645378 и в ЕР-А-645377. Специалисты по лечению гиперлипидемии легко определят терапевтически эффективное количество соединения полиарилкарбоксамида по данному изобретению, исходя из результатов испытаний, представленных здесь далее. Как правило, предполагается, что терапевтически эффективная доза должна быть от около 0,001 до около 5 мг/кг массы тела, более предпочтительно от около 0,01 до около 0,5 мг/кг массы тела пациента, которого нужно лечить. Может быть приемлемо вводить терапевтически эффективную дозу в виде двух и более субдоз с подходящими интервалами в течение дня. Указанные субдозы могут быть приготовлены как унифицированные дозированные формы, например, когда каждая содержит от около 0,1 до около 350 мг, более конкретно от около 1 до около 200 мг, активного ингредиента на унифицированную дозированную форму. Точная доза и частота введения зависят от конкретного используемого соединения полиарилкарбоксамида формулы (I), конкретного состояния, которое требует лечения, тяжести состояния, требующего лечения, возраста, массы и общего физического состояния конкретного пациента, а также других возможно принимаемых пациентом медикаментов (включая указанные выше дополнительные снижающие содержание липидов агенты), как это хорошо известно специалистам. Более того, указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от реакции принимающего лечение пациента и/или в зависимости от оценки врача, предписывающего соединения полиарилкарбоксамида по данному изобретению. Пределы эффективного суточного количества, указанные здесь выше,являются поэтому только рекомендациями. Экспериментальная часть В методиках, описанных здесь далее, использованы следующие аббревиатуры: "ACN" означает ацетонитрил, "THF" означает тетрагидрофуран, "DCM" означает дихлорметан, "DIPE" означает диизопропиловый простой эфир, "DMF" означает N,N-диметилформамид, "NMP" означает N-метил-2-пирролидон,"TFA" означает трифторуксусную кислоту, "TIS" означает триизопропилсилан, "DIPEA" означает диизопропилэтиламин, "TMSOTf" означает триметилсилилтрифлат и "MIK" означает метилизобутилкетон.Extrelut является продуктом Merck KgaA, Darmstadt, Германия, и представляет собой короткую колонку, содержащую диатомовую землю.-Бромметиловый сложный эфир бензолуксусной кислоты (0,026 моль) добавляют по каплям к смеси 1-(4-нитрофенил)пиперазина (0,028 моль) и Na2 СО 3 (0,024 моль) в DMF (150 мл) при перемешивании. Смесь перемешивают при комнатной температуре в течение 66 ч, выливают в воду со льдом (500 мл) и перемешивают 30 мин. Осадок отфильтровывают и растворяют в DCM. Органический раствор сушат,фильтруют и растворитель упаривают. Эту фракцию очищают на силикагеле на стеклянном фильтре(элюент СН 2 Сl2/СН 3 ОН 99/1). Чистые фракции собирают и растворитель упаривают. Часть этой фракции перемешивают в этаноле. Осадок отфильтровывают и сушат, получая 0,04 г -метил-4-(4-нитрофенил)-фенил-1-пиперазинацетата (промежуточное соединение 1, температура плавления 92 С). Пример А.2. Смесь промежуточного соединения (1) (0,026 моль) и KОН (0,13 моль) в этаноле (150 мл) перемешивают при комнатной температуре в течение 18 ч, нагревают при 50 С в течение 2,5 ч и охлаждают до комнатной температуры. Осадок отфильтровывают, перемешивают в 2-пропаноле, отфильтровывают,промывают 3 раза 2-пропанолом и сушат. Эту фракцию перемешивают и кипятят с обратным холодильником в 2-пропаноле. Добавляют 6 н. НСl/2-пропанол (19,94 мл). Смесь перемешивают и кипятят с обратным холодильником, фильтруют теплой и перемешивают в воде (350 мл). Осадок отфильтровывают и сушат, получая 5,94 г моногидрата -4-(4-нитрофенил)фенил-1-пиперазинуксусной кислоты (промежуточное соединение 2). Пример А.3. Смесь промежуточного соединения (1) (0,0136 моль) и 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,02 моль) в DCM (125 мл) перемешивают в течение 2 ч, чтобы получить смесь (1). Смесь 2,2,2 трифторэтиламина (0,014 моль) в DCM (25 мл) перемешивают. Добавляют триэтиламин (1,5 г) и смесь перемешивают в течение 5 мин, чтобы получить смесь (2). Смеси (1) и (2) объединяют. Полученную в результате смесь перемешивают в течение ночи и промывают водой. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирают и растворитель упаривают. Эту фракцию очищают колоночной хроматогрфией на силикагеле (элюент: DCM/гексан/этилацетат 50/20/30). Чистые фракции собирают и растворитель упаривают, получая 2,3 г -4-(4-нитрофенил)фенил-N-(2,2,2-трифторэтил)-1-пиперазинацетамида (промежуточное соединение 3). Пример А.4. Смесь промежуточного соединения (3) (0,0054 моль) в метаноле (150 мл) гидрируют с Pd/C 10% (1 г) в качестве катализатора в присутствии 4% раствора тиофена (1 мл). После поглощения водорода (2 эквивалента) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 1,5 г -4-(4-аминофенил)фенил-N-(2,2,2-трифторэтил)-1-пиперазинацетамида (промежуточное соединение 4, температура плавления 136 С). Пример А.5. Смесь 4'-(трифторметил)-[1,1'-бифенил]-2-карбонилхлорида (0,185 моль) в DCM (1500 мл) и триэтиламина (50 мл) перемешивают на ледяной бане в течение 5 мин. Добавляют по каплям 4-[4-(фенилметил)-1-пиперазинил]бензоламин (0,37 моль) в DCM (500 мл). Смесь перемешивают в течение 3 ч. Органический слой отделяют, промывают водой, сушат, фильтруют и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 99,8 г N-[4-[4-(фенилметил)-1-пиперазинил]фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 5, температура плавления 180 С). Пример А.6. Смесь промежуточного соединения (5) (0,19 моль) в метаноле (600 мл) и THF (600 мл) гидрируют сPd/C 10% (3 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в DIPE. Осадок отфильтровывают, сушат и растворяют в воде. Смесь подщелачивают Nа 2 СО 3 и затем экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 40 г N-[4-(1-пиперазинил)фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида(5 мл) перемешивают. Добавляют по каплям этандиоилдихлорид (0,09 моль). Смесь перемешивают в течение 1 ч, чтобы получить смесь (1). Смесь 4-[1-(фенилметил)-4-пиперидинил]бензоламина (0,046 моль) в DCM (500 мл) и триэтиламина (20 мл) перемешивают на ледяной бане. Добавляют по каплям смесь (1). Смесь перемешивают и кипятят с обратным холодильником в течение ночи, затем охлаждают и промывают водой. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирают и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 5,6 гN-[4-[1-(фенилметил)-4-пиперидинил]фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 7, температура плавления 134 С). Пример А.8. Смесь промежуточного соединения (7) (0,025 моль) в метаноле (250 мл) гидрируют при 50 С в течение ночи с Pd/C 10% (2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат. Часть (0,2 г) этой фракции очищают жидкостной хроматографией высокого разрешения на RP-18RP 1008 мкм). Чистые фракции собирают и растворитель упаривают, получая 0,119 г ацетата N-[4-(4 пиперидинил)фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 8,температура плавления 150 С). Пример А.9. Смесь 4-[4-(фенилметил)-1-пиперазинил]бензоламина (0,12 моль) в THF (300 мл) и триэтиламина(50 мл) перемешивают. Добавляют по каплям [1,1'-бифенил]-2-карбонилхлорид (0,12 моль). Смесь перемешивают в течение ночи. Растворитель упаривают. Остаток растворяют в DCM. Органический слой отделяют, промывают, сушат, фильтруют и растворитель упаривают. Остаток растирают в DIPE/2-пропаноле. Осадок отфильтровывают и сушат. Часть (1 г) этой фракции очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 9,9/1). Чистые фракции собирают и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 0,84 г N-[4-[4-(фенилметил)1-пиперазинил]фенил]-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 9, температура плавления 162 С). Пример А.10. Смесь промежуточного соединения (9) (0,1 моль) в метаноле (500 мл) гидрируют в течение 2 ч с палладием на углероде (10%) (10 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в 2-пропаноле. Осадок отфильтровывают и сушат, получая 29 г N-[4-(1-пиперазинил)фенил]-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 10, температура плавления 176 С). Пример А.11.b) [1,1'-Бифенил]-2-карбонилхлорид (0,05 моль) добавляют по каплям к перемешиваемой смеси 4[1,2,3,6-тетрагидро-1-(фенилметил)-4-пиридинил]бензоламина (0,045 моль) в THF (300 мл) и триэтиламина (25 мл). Смесь перемешивают в течение ночи. Растворитель упаривают. Остаток растворяют в DCM. Органический слой отделяют, промывают, сушат, фильтруют и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 18,5 г N-[4-[1,2,3,6-тетрагидро-1-(фенилметил)4-пиридинил]фенил]-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 11, температура плавления 142 С). Пример А.12. Смесь гидрохлорида -фенил-4-пиперидинацетонитрила (0,05 моль), 1-фтор-4-нитробензола (0,06 моль) и карбоната калия (0,15 моль) в DMF (200 мл) перемешивают при 50 С в течение 4 ч. Добавляют воду и-1-(4-нитрофенил)фенил-4-пиперидинацетонитрила (промежуточное соединение 12, температура плавления 118 С). Пример А.13. Смесь промежуточного соединения (12) (0,036 моль) в 48% водном растворе бромида водорода (100 мл) перемешивают и кипятят с обратным холодильником в течение 3 ч, охлаждают, выливают в воду и экстрагируют дважды DCM. Органический слой отделяют, промывают водой, сушат, фильтруют и растворитель упаривают. Остаток растирают с 2-пропанолом. Осадок отфильтровывают и сушат, получая 9,5 г-1-(4-нитрофенил)фенил-4-пиперидинуксусной кислоты (промежуточное соединение 13, температура плавления 216 С). Пример А.14. Тионилхлорид (0,01 моль) добавляют к смеси промежуточного соединения (13) (0,0029 моль) вDCM (10 мл). Смесь перемешивают в течение 1 мин и затем оставляют стоять в течение ночи. Растворитель упаривают. Остаток растворяют в DCM (10 мл). Добавляют метанол (10 мл). Смеси дают постоять в течение 4 ч, затем выливают в раствор NaHCO3 и экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток растирают в гексане/DIPE. Осадок отфильтровывают и сушат, получая 0,9 г -метил-1-(4-нитрофенил)фенил-4-пиперидинацетата (промежуточное соединение 14, температура плавления 124 С).- 17005855 Пример А.15. Смесь промежуточного соединения (14) (0,0022 моль) в метаноле (100 мл) гидрируют при 50 С с палладием на углероде (10%) (0,1 г) в качестве катализатора в присутствии 4% раствора тиофена (0,1 мл). После поглощения водорода (3 эквивалента) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в гексане. Осадок отфильтровывают и сушат, получая 0,7 г -метил-1-(4-аминофенил)-фенил-4-пиперидинацетата (промежуточное соединение 15, температура плавления 125 С). Примеры А.16-А.18. Для того чтобы облегчить понимание этих примеров, представлена следующая схема (схема 1) получения промежуточных смол, исходя из коммерчески доступной смолы. Схема 1Rc означает ортоиодфенил и Za означает гидрокси или хлор. Пример А.16. Этиленамин (0,0056 моль, 2,8 мл 2 М раствора в THF, так Ra=а в схеме 1) добавляют к коммерческой смоле NOVABIOCHEM 01-64-0261 (1 г) в DCM (15 мл). Добавляют изопропоксид титана (IV) (1,65 мл) и смесь взбалтывают в течение 1 ч при комнатной температуре. Триацетоксиборгидрид (1,187 г) добавляют и реакционную смесь взбалтывают в течение 48 ч при комнатной температуре. Смесь фильтруют и остаток на фильтре промывают 3 раза DCM, 3 раза смесью (1:1) DCM и метанола, 3 раза последовательно вначале метанолом, затем DCM и потом смесью 10 мл DCM и 2 мл DIPEA, 3 раза последовательно вначале DCM и потом метанолом, затем сушат, получая с количественным выходом смолу с концевыми этиламиногруппами, идентифицированную как I-а на схеме 1, которую используют на следующей стадии реакции без дополнительной очистки. Пример А.17. Промежуточное соединение (13) (0,0056 моль) добавляют к смоле примера А.16 (0,00112 моль). Добавляют раствор комплекса (Т-4)-гексафторфосфат(1-) (1-гидрокси-1 Н-бензотриазолато-O)три-1-пирролидинил-фосфор(1+) (называемый здесь далее как "РуВОР") (2,9 г) в DCM (15 мл) и DMF (5 мл). Добавляют триэтиламин (0,0112 моль) и реакционную смесь взбалтывают в течение 24 ч при комнатной температуре,фильтруют и остаток на фильтре промывают DMF (5 х 20 мл), затем 5 раз смесью (1:1) DCM и метанола(20 мл), 5 раз смесью (95:5) DCM с уксусной кислотой (20 мл), 5 раз DMF (20 мл) и 3 раза NMP (20 мл),количественно получая смолу с концевыми нитрогруппами, идентифицированную как II-а на схеме 1. Пример А.18. Смесь смолы примера А. 17 (0,00112 моль) и SnCl22H2O (0,0224 моль) в NMP (20 мл) взбалтывают в течение 6 дней при 55 С, затем охлаждают, фильтруют и остаток на фильтре промывают DMF (3 раза),смесью 10 мл DMF и 2 мл DIPEA и затем 3 раза последовательно вначале DCM, а потом метанолом, затем сушат, получая количественно смолу с концевыми аминогруппами, идентифицированную как III-a на схеме 1. Пример А.19. Триизопропиламин (0,011 моль) добавляют к смоле примера А.18 (0,00112 моль) в DCM (10 мл). Добавляют N,N-диметил-4-пиридинамид (0,0003 моль) в DCM (3 мл). Добавляют раствор о-иодбензоилхлорида (0,00336 моль) в DCM (5 мл) и реакционную смесь взбалтывают в течение ночи при комнатной температуре. Смесь фильтруют, остаток промывают 3 раза DCM, 1 раз смесью DCM (10 мл) и DIPEA (2 мл),3 раза DCM, затем метанолом, затем сушат. Полученный в результате продукт обрабатывают бензиламином (1 мл) в DCM (10 мл) и взбалтывают в течение 60 ч при комнатной температуре. Смесь фильтруют,промывают 3 раза DCM, 1 раз смесью DCM/метанол 50/50, 3 раза DCM, затем метанолом, затем сушат,получая 0,00515 г (46%) смолы, идентифицированной как IV-a на схеме 1. Пример А.20. Процедуру примера А.16 повторяют, заменяя этиламин н-пропиламином, количественно получая,таким образом, смолу с концевыми н-пропиламиногруппами, идентифицированную как I-b на схеме 1. Пример А.21. Первую экспериментальную процедуру примера А.17 повторяют, заменяя смолу примера А.16 смолой примера А.20, количественно получая, таким образом, смолу, идентифицированную как II-b на схеме 1. Пример А.22. Процедуру примера А.18 повторяют, заменяя смолу примера А.17 смолой примера А.21, количественно получая, таким образом, смолу, идентифицированную как III-b на схеме 1. Пример А.23. Процедуру примера А.19 повторяют, заменяя смолу примера А.18 смолой примера А.22, получая,таким образом, смолу, идентифицированную как IV-b на схеме 1. Пример А.24. Процедуру примера А.16 повторяют, заменяя этиламин изопропиламином, количественно получая,таким образом, смолу с концевыми изопропиламиногруппами, идентифицированную как I-с на схеме 1. Пример А.25. Первую экспериментальную процедуру примера А.17 повторяют, заменяя смолу примера А.16 смолой примера А.24, количественно получая, таким образом, смолу, идентифицированную как II-с на схеме 1. Пример А.26. Процедуру примера А.18 повторяют, заменяя смолу примера А.17 смолой примера А.25, количественно получая, таким образом, смолу, идентифицированную как III-c на схеме 1. Пример А.27. Процедуру примера А.19 повторяют, заменяя смолу примера А.18 смолой примера А.26, получая,таким образом, смолу, идентифицированную как IV-b на схеме 1. Пример А.28. Процедуру примера А.16 повторяют, заменяя этиламин фениламином, количественно получая, таким образом, смолу с концевыми фениламиногруппами, идентифицированную как I-d на схеме 1. Пример А.29. Первую экспериментальную процедуру примера А.17 повторяют, заменяя смолу примера А.16 смолой примера А.28, количественно получая, таким образом, смолу, идентифицированную как II-d на схеме 1. Пример А.30. Процедуру примера А.18 повторяют, заменяя смолу примера А.17 смолой примера А.29, количественно получая, таким образом, смолу, идентифицированную как III-d на схеме 1. Пример А.31. Процедуру примера А.19 повторяют, заменяя смолу примера А.18 смолой примера А.30, получая,таким образом, смолу, идентифицированную как IV-d на схеме 1. Пример А.32. Процедуру примера А.16 повторяют, заменяя этиламин бензиламином, количественно получая, таким образом, смолу с концевыми бензиламиногруппами, идентифицированную как I-е на схеме 1. Пример А.33. Первую экспериментальную процедуру примера А.17 повторяют, заменяя смолу примера А.16 смолой примера А.32, количественно получая, таким образом, смолу, идентифицированную как II-е на схеме 1. Пример А.34. Процедуру примера А.18 повторяют, заменяя смолу примера А.17 смолой примера А.33, количественно получая, таким образом, смолу, идентифицированную как III-е на схеме 1.- 19005855 Пример А.35. Процедуру примера А.19 повторяют, заменяя смолу примера А.18 смолой примера А.34, получая,таким образом, смолу, идентифицированную как IV-e на схеме 1. Примеры А.36-А.38. Для того чтобы облегчить понимание этих примеров, далее представлена другая схема (схема 2) получения промежуточных смол, исходя из коммерчески доступной смолы. Схема 2 Пример А.36. Смесь коммерческой смолы NOVABIOCHEM 01-64-0261 (25,1 г, 0,028 моль), 4-броманилина (24 г,0,140 моль) и изопропоксида титана (IV) (41 мл, 0,140 моль) в DCM (400 мл) слабо перемешивают в течение 1 ч при комнатной температуре. Триацетоксиборгидрид натрия (30 г, 0,140 моль) добавляют и реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют метанол (50 мл) и смесь перемешивают в течение 1 ч, затем фильтруют, промывают 1 раз DCM, 1 раз метанолом, затем 1 разDCM (200 мл) + DIPEA (20 мл), промывают 3 раза последовательно вначале DCM, затем метанолом, затем сушат, получая 29,28 г смолы, идентифицированной как V на схеме 2, которую используют на следующей стадии реакции без дополнительной очистки. Пример А.37. 4-Фенилбензойную кислоту (8,3 г, 0,042 моль) растворяют в DCM (100 мл). Добавляют тионилхлорид (10 г, 0,084 моль). Добавляют DMF (10 капель) и смесь перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель упаривают. Добавляют DCM (3 раза 50 мл). Растворитель упаривают. Остаток растворяют в DCM (50 мл). Этот раствор добавляют к смеси смолы примера А.36 (14,64 г,0,0133 моль), DIPEA (24 мл, 0,140 моль) и 4-диметиламинопиридина (называемый здесь далее какDMAP) (0,5 г) в DCM (150 мл). Реакционную смесь взбалтывают в течение ночи при комнатной температуре, затем фильтруют и остаток на фильтре промывают 100 мл DMF + 20 мл DIPEA, затем метанолом,водой, DCM и метанолом и сушат, получая 15,73 г смолы, идентифицированной как VI-a на схеме 2. Пример А.38. 4'-(Трифторметил)-2-бифенилкарбоновую кислоту (14,64 г, 0,042 моль) растворяют в DCM (100 мл). Добавляют DMF (1 мл). Добавляют тионилхлорид (10 г, 0,084 моль) и смесь перемешивают и кипятят с обратным холодильником в течение часа. Растворитель упаривают. Добавляют DCM (дважды по 50 мл),затем растворитель упаривают. Остаток растворяют в DCM (50 мл). Этот раствор добавляют к смеси смолы примера А.36 (14,64 г, 0,0133 моль), DIPEA (24 мл, 0,140 моль) и DMAP (0,5 г) в DCM (150 мл). Реакционную смесь взбалтывают в течение 4 ч при комнатной температуре, затем фильтруют и остаток на фильтре промывают 100 мл DMF + 20 мл DIPEA, затем промывают 3 раза сначала DCM, затем метанолом и, наконец, сушат. Этот реакционный продукт снова взаимодействует с половиной исходных количеств 4'-(трифторметил)-2-бифенилкарбоновой кислоты, тионилхлорида, DIPEA и DMAP. Реакционную смесь взбалтывают в течение ночи при комнатной температуре, затем фильтруют и остаток на фильтре взбалтывают с DMF + 20 мл DIPEA, затем метанолом, водой, метанолом, DCM, метанолом,DCM и метанолом, затем сушат, получая 17,48 г смолы, идентифицированной как VI-b на схеме 2.DMF (5 мл) перемешивают. Добавляют по каплям этандиоилдихлорид (0,09 моль). Смесь перемешивают в течение 1 ч, чтобы получить смесь (1). Смесь соли гидрохлорида 4-[1-(фенилметил)-4-пиперидинил] бензоламина (1:1) (0,046 моль) в DCM (500 мл) и триэтиламина (20 мл) перемешивают на ледяной бане. Добавляют по каплям смесь (1). Смесь перемешивают и кипятят с обратным холодильником в течение ночи, затем охлаждают и промывают водой. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 98/2). Чистые фракции собирают и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 5,6 г N-[4-[1-(фенилметил)-4-пиперидинил]фенил]-4'-(трифторметил)[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 16, температура плавления 134 С).b) Смесь промежуточного соединения (16) (0,025 моль) в метаноле (250 мл) гидрируют при 50 С в течение ночи с Pd/C 10% (2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 7,7 г N-[4-(4-пиперидинил)фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида(промежуточное соединение 17). Пример А.40. а) [1,1'-Бифенил]-2-карбоновую кислоту (0,25 моль) растворяют в DCM (500 мл) и DMF (0,5 мл). Добавляют по каплям тионилхлорид (0,51 моль). Смесь перемешивают и кипятят с обратным холодильником в течение 1 ч в токе азота. Растворитель упаривают. Дважды добавляют DCM (500 мл). Растворитель упаривают дважды. Остаток растворяют в DCM (200 мл) и затем добавляют по каплям при 0 С к смеси 4-[1-(фенилметил)-4-пиперидинил]бензоламина (0,25 моль) и N-(1-метилэтил)-2-пропанамина(0,75 моль) в DCM (800 мл). Смесь доводят до комнатной температуры и затем перемешивают при комнатной температуре в течение ночи в токе азота. Смесь промывают 3 раза водой (800 мл). Органический слой отделяют, сушат, фильтруют и растворитель упаривают, получая 125 г N-[4-[1-(фенилметил)-4 пиперидинил]фенил]-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 18).b) Смесь промежуточного соединения (18) (0,145 моль) в метаноле (500 мл) гидрируют при 50 С в течение 48 ч с Pd/C (10%, 3 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат,получая 49 г N-[4-(4-пиперидинил)фенил]-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 19). Пример А.41.a) 4'-(Трифторметил)-[1,1'-бифенил]-2-карбонилхлорид (0,12 моль) добавляют по каплям к перемешиваемой смеси 4-[1,2,3,6-тетрагидро-1-(фенилметил)-4-пиридинил]бензоламина (0,095 моль) в DCMb) 1-Хлорэтилхлорформиат (0,078 моль) добавляют по каплям к перемешиваемой смеси промежуточного соединения (20) (0,039 моль) в 1,2-дихлорэтане (500 мл). Смесь перемешивают в течение 30 мин и затем перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель упаривают. Добавляют метанол (500 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 20,8 гN-[4-(1,2,3,6-тетрагидро-4-пиридинил]фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 21). Пример А.42. Смесь промежуточного соединения (11) (0,04 моль) в 1,2-дихлорэтане (200 мл) перемешивают на ледяной бане. 1-Хлорэтилхлорформиат (15 мл) добавляют по каплям при температуре ниже 5 С. Смесь перемешивают в течение 1 ч и затем перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель упаривают. Добавляют метанол (200 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 2 ч. Растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 16,7 г N-[4-(1,2,3,6-тетрагидро-4-пиридинил)фенил]-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 22). Пример А.43.a) Смесь промежуточного соединения (6) (0,0047 моль) и ди-трет-бутилдикарбоната (0,0052 моль) вDCM (50 мл) перемешивают при комнатной температуре в течение 2 ч. Добавляют DMF (5 мл). Смесь перемешивают при комнатной температуре в течение 3 ч. Растворитель упаривают. Остаток растирают вb) NaH 60% в минеральном масле (0,0056 моль) обрабатывают гексаном, перемешивают в токе азота и декантируют. К остатку добавляют сухой DMF (25 мл). Суспензию перемешивают при комнатной- 21005855 температуре в токе азота. Добавляют по каплям раствор промежуточного соединения (23) (0,00375 моль) в сухом DMF (25 мл). Смесь перемешивают при комнатной температуре в токе азота в течение 2,5 ч. Добавляют по каплям раствор метилметансульфоната (0,0045 моль) в сухом DMF (50 мл). Смесь перемешивают при комнатной температуре в течение 18 ч. Добавляют воду (150 мл). Смесь экстрагируют дваждыDCM. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток растирают в 60 мл смеси гексан/DIPE (3:1). Смесь перемешивают и кипятят с обратным холодильником, пока не получат прозрачный раствор, и затем доводят до комнатной температуры. Осадок отфильтровывают и сушат, получая 1,6 г 1,1-диметилэтилового сложного эфира 4-[4-[метил 4'-(трифторметил)[1,1'-бифенил]2-ил]карбонил]амино]фенил]-1-пиперазинкарбоновой кислоты (промежуточное соединение 24). с) Раствор трифторацетата (20 мл) и DCM (200 мл) добавляют к промежуточному соединению (24)(0,0024 моль) и перемешивают в течение 1 ч и 30 мин при комнатной температуре. Растворитель упаривают. Добавляют DCM и снова упаривают растворитель, получая 1,7 г N-метил-N-[4-(1-пиперазинил)фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида (промежуточное соединение 25). Пример А.44. Промежуточные смолы, где Х 2 и Х 3 означают N и Z1 и Z2 означают -СН 2-СН 2-, могут быть получены, как показано на схеме 3, исходя из коммерчески доступной смолы. Схема 3 а) Смесь коммерческой смолы NOVABIOCHEM 01-64-0261 (0,180 г, 0,002 моль), 4-(1-трет-бутоксикарбонилпиперазин-4-ил)анилина (0,001 моль), растворенную в DCM (2 мл) и изопропоксида титана (IV)(0,001 моль) в DCM (3 мл) взбалтывают при комнатной температуре в течение 2 ч. Триацетоксиборгидрид натрия (0,001 моль) добавляют порциями и реакционную смесь взбалтывают в течение 20 ч при комнатной температуре. Смесь фильтруют и остаток на фильтре промывают 3 раза DCM (3 раза), метаноломb) 2-Бром-4-метилбензойную кислоту (0,001 моль) в DCM (5 мл) с тионилхлоридом (0,013 моль) перемешивают и кипятят с обратным холодильником в течение 1 ч. Смесь сушат обдувом в атмосфере азота. Снова добавляют DCM (5 мл) с тионилхлоридом (0,013 моль). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 1 ч. Смесь сушат обдувом в атмосфере азота и 3 раза добавляют DCM (3 мл), затем снова упаривают. Остаток растворяют в DCM (3 мл). Этот раствор добавляют к раствору смолы (VII-a) (0,0002 моль) в DCM (1 мл). Добавляют DMAP (0,0002 моль) в DCM (1 мл). Добавляют DIPEA (0,002 моль) и реакционную смесь взбалтывают в течение 20 ч при комнатной температуре. Реакционную смесь фильтруют и остаток на фильтре промывают 3 раза DCM (3 раза), метанолом с) Раствор 4-(трифторметил)бензолбороновой кислоты (0,0016 моль) в диоксане (3 мл) добавляют к смоле (VIII-a) (0,0002 моль), которую предварительно промывают диоксаном (5 мл). Затем добавляютKОН (0,0032 моль 2 М раствора) и реакционную смесь взбалтывают в течение 30 мин при комнатной температуре в атмосфере азота. Добавляют PdCl2 (РРh3)2 (0,00004 моль) в NMP (0,5 мл) и реакционную смесь взбалтывают в течение 2 ч при 90 С. Снова добавляют PdCl2 (РРh3)2 (0,00004 моль) в NMP (0,5 мл) и реакционную смесь взбалтывают в течение 2 ч при 90 С. Смесь охлаждают, фильтруют и остаток на фильтре промывают DMF (3 раза), водой (3 раза), DMF (3 раза), метанолом (3 раза), DCM (3 раза), метанолом (3 раза) и DCM (3 раза), затем сушат, получая остаток. Указанный остаток перемешивают в растворе TMSTf (1M) и 2,6-лутидина (1,5 М) в DCM (4 мл) в течение 2 ч при комнатной температуре, фильтруют и промывают DCM (3 раза) и метанолом (3 раза) и сушат, получая смолу (IX-a). Пример А.45. а) Суспензию 4-(трет-бутоксикарбониламино)пиперидина (15 эквивалентов) в NMP (2 мл) добавляют к смоле (VI-b) в NMP (1 мл). [1,1'-Бинафталин]-2,2'-диил-бис[дифенилфосфин] (BINAP) (0,00011 моль) добавляют порциями. трет-Бутоксинатрий (15 эквивалентов) добавляют порциями. Реакционную смесь взбалтывают в течение 1 ч в токе азота. Добавляют Pd2(dba)3 (0,000022 моль) в NMP (1 мл) и реакционную смесь взбалтывают в течение 18 ч при 105 С. Смесь охлаждают, фильтруют и остаток на фильтре промывают 3 раза (DMF с последующей водой) и затем 3 раза метанолом, затем DCM, получая смолу (X).NMP (1 мл). BINAP (0,068 г) добавляют порциями. Трет-Бутоксинатрий (0,190 г) добавляют порциями. Реакционную смесь взбалтывают в течение 1 ч в атмосфере азота. Добавляют Рd2(dbа)3 (0,020 г) в NMP(1 мл) и реакционную смесь взбалтывают в течение 18 ч при 105 С, затем охлаждают, фильтруют и остаток на фильтре промывают 3 раза (DMF с последующей водой) и затем 3 раза метанолом, затем DCM,получая смолу (XI).(5 мл). Добавляют трихлорметилхлорформиат (0,001 моль) и реакционную смесь взбалтывают в течение 4 ч при комнатной температуре. Смесь фильтруют, промывают 3 раза DCM, затем сушат, получая смолу (XII). Пример А.46. а) Гидрохлорид 1-этил-3-(3'-диметиламинопропил)карбодиимида (EDCI) (0,096 моль) добавляют при комнатной температуре к смеси этилового эфира 4-(4-аминофенил)-1-пиперазинкарбоновой кислотыDCM (500 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду. Смесь экстрагируют DCM. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток забирают в DIPE. Осадок отфильтровывают и сушат, получая 39 г этилового эфира 4-[4-[(2-иодбензоил)амино]фенил]-1-пиперазинкарбоновой кислоты (промежуточное соединение 27).b) Смесь промежуточного соединения (27) (0,041 моль) и гидроксида калия (0,41 моль) в изопропаноле (200 мл) перемешивают и кипятят с обратным холодильником в течение 3 ч и растворитель упаривают до сухости. Добавляют воду. Смесь экстрагируют DCM и растворитель упаривают, получая 2-иодN-[4-(1-пиперазинил)фенил]бензамид (промежуточное соединение 28).c) Метиловый эфир -бромбензолуксусной кислоты (0,0123 моль) добавляют при комнатной температуре к смеси промежуточного соединения (28) (0,0123 моль) и Nа 2 СО 3 (0,0123 моль) в DMF (50 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют воду. Смесь перемешивают при комнатной температуре в течение 15 мин. Осадок отфильтровывают, промывают простым диэтиловым эфиром и сушат, получая 5,8 г метилового эфира 4-[4-[(2-иодбензоил)амино]фенил]фенил-1-пиперазинуксусной кислоты (промежуточное соединение 29).d) Смесь промежуточного соединения (29) (0,0036 моль), трибутил-2-фуранилстаннана (0,029 моль),PdCl2(РРh3)2 (0,0007 моль) и Na2CO3 (0,0576 моль) в диоксане (30 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Добавляют воду. Смесь экстрагируют этилацетатом. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: циклогексан/этилацетат 80/20). Чистые фракции собирают и растворитель упаривают, получая метиловый эфир 4-[4-2-(2-фуранил)бензоил]амино]фенил]фенил-1-пиперазинуксусной кислоты (промежуточное соединение 30, т.пл. 90 С). е) Смесь промежуточного соединения (30) (0,0006 моль) и гидроксида калия (0,006 моль) в изопропаноле (5 мл) перемешивают при комнатной температуре в течение ночи. Растворитель упаривают. Остаток растворяют в смеси изопропанол/НСl 6 н. и превращают в соль хлористо-водородной кислоты. Осадок отфильтровывают и сушат, получая 0,31 г гидрохлорида 4-[4-2-(2-фуранил)бензоил]амино]фенил]фенил-1-пиперазинуксусной кислоты (промежуточное соединение 31). В. Получение соединений полиарилкарбоксамида по изобретению. Пример В.1. Смесь 4'-(трифторметил)-[1,1'-бифенил]-2-карбоновой кислоты (0,012 моль) в DCM (100 мл) и DMF(8 капель) перемешивают. Добавляют этандиоилдихлорид (0,012 моль). Смесь перемешивают в течение 2 ч,чтобы получить смесь (I). Триэтиламин (8 мл) добавляют к смеси промежуточного соединения (4) (0,005 моль) в DCM (100 мл). Смесь перемешивают на ледяной бане, чтобы получить смесь (II). Смесь (I) добавляют- 24005855 по каплям к смеси (II) и полученную в результате реакционную смесь перемешивают и кипятят с обратным холодильником в течение 2 дней. Растворитель упаривают. Остаток растворяют в DCM. Органический слой отделяют, промывают, сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматогрфией на силикагеле (элюент DCM/СН 3 ОН 99/1). Желательные фракции собирают и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 2,99 гN-[4-[4-[2-оксо-1-фенил-2-[(2,2,2-трифторэтил)амино]этил]-1-пиперазинил]фенил]-4'-(трифторметил)-[1,1'бифенил]-2-карбоксамида (температура плавления 208 С), идентифицированного как соединение 1 в следующей табл. F-1. Пример В.2. Флуорен-4-карбоновую кислоту (0,00032 моль) в 1 мл смеси 1/1 DCM/NMP добавляют к РуВОР(0,00064 моль) в DCM (1 мл). Смесь оставляют стоять на 30 мин, затем добавляют к смоле примера А.34. Добавляют DCM (5 мл), затем DIPEA (0,00085 моль). Реакционную смесь взбалтывают в течение 24 ч при комнатной температуре, затем фильтруют, промывают 3 раза DCM, 3 раза метанолом, а затем DCM. Добавляют смесь TFA/DCM/TIS (5/93/2) (4 мл) и смесь взбалтывают в течение 1 ч при комнатной температуре. Смесь фильтруют, остаток на фильтре промывают смесью TFA/DCM/TIS (5/93/2) (2 мл) и DCM(2 мл). Фильтрат сушат обдувом при 50 С в умеренном потоке газообразного азота, растворяют в DCM(5 мл) и DMF (1 мл) и добавляют смолу NOVABIOCHEM 01-64-0171 во время перемешивания смеси при комнатной температуре. Затем, спустя 1 ч, добавляют смолу Argonaut P/N 800277 (0,40 г). Смесь перемешивают в течение 4 ч при комнатной температуре, фильтруют и фильтрат сушат обдувом при 50 С в потоке азота, получая 0,027 г соединения, идентифицированного как 2 в следующей табл. F-1. Соединения, идентифицированные как 3- 11 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру и заменяя флуорен-4-карбоновую кислоту подходящей реакционноспособной кислотой. Пример В.3. Флуорен-4-карбоновую кислоту (0,00028 моль) в 1 мл смеси 1/1 DCM/NMP добавляют к РуВОР(0,00028 моль) в DCM (1 мл). Смесь оставляют стоять на 30 мин, затем добавляют к смоле примера А.22. Добавляют DCM (5 мл), затем триэтиламин (0,00057 моль). Реакционную смесь взбалтывают в течение 20 ч при комнатной температуре, затем фильтруют, промывают 3 раза DCM, 3 раза вначале метанолом,затем DCM. Добавляют 4 мл смеси TFA/DCM/TIS (5/93/2) и смесь взбалтывают в течение 1 ч при комнатной температуре. Смесь фильтруют, остаток на фильтре промывают смесью TFA/DCM/TIS (2 мл,5/93/2) и DCM (1 мл). Фильтрат сушат обдувом при 50 С в умеренном потоке азота. Фракцию очищают жидкостной хроматографией высокого разрешения на Hyperprep RP-С 18 BDS (100 г), 100 , 8 мкм, элюент: [(0,5% NH4OAc в Н 2O)/CH3CN 90/10]/СН 3 ОН/СН 3 СN (0 мин) 75/25/0, (10 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0]. Чистые фракции собирают и органический растворитель упаривают. Водные концентраты экстрагируют смесью DCM/водный раствор K2 СО 3, затем разделяют на Extrelut. Органическую фазу сушат обдувом в атмосфере азота при 50 С. Остаток сушат далее в вакууме при 60 С, получая 0,002 г соединения, идентифицированного как 12 в следующей табл. F-1. Соединения, идентифицированные как 13- 20 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру и заменяя флуорен-4-карбоновую кислоту подходящей реакционноспособной кислотой. Пример В.4. Флуорен-4-карбоновую кислоту (0,00015 моль) в 1 мл смеси 1/1 DCM/NMP добавляют к РуВОР(0,0003 моль) в DCM (1 мл). Эту смесь оставляют стоять на 30 мин, затем добавляют к смоле примера А.26. Добавляют DCM (5 мл), затем DIPEA (0,00057 моль). Реакционную смесь взбалтывают в течение 24 ч при комнатной температуре, затем фильтруют, промывают 3 раза DCM, 3 раза вначале метанолом,затем DCM. Добавляют 4 мл смеси TFA/DCM/TIS (5/93/2) и смесь взбалтывают в течение 1 ч при комнатной температуре. Смесь фильтруют, остаток на фильтре промывают 2 мл смеси TFA/DCM/TIS(5/93/2) и DCM (1 мл). Фильтрат сушат обдувом при 50 С в умеренном потоке азота. Эту фракцию очищают жидкостной хроматографией высокого разрешения на Hyperprep C18 BDS (100 г), 100 , 8 мкм,элюент: [(0,5% NH4OAC в Н 2O)/CH3CN 90/10]/CH3OH/CH3CN (0 мин) 75/25/0, (10 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0]. Чистые фракции собирают и органический растворитель упаривают. Водный концентрат экстрагируют смесью DCM/водный раствор карбоната калия, затем разделяют наExtrelut. Органическую фазу сушат обдувом в атмосфере азота при 50 С. Остаток сушат далее в вакууме при 60 С, получая 0,002 г соединения, идентифицированного как 21 в следующей табл. F-1. Соединения, идентифицированные как 22- 28 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру и заменяя флуорен-4-карбоновую кислоту подходящей реакционноспособной кислотой. Пример В.5. Флуорен-4-карбоновую кислоту (0,00023 моль) в 1 мл смеси 1/1 DCM/NMP добавляют к РуВОР(0,00046 моль) в DCM (1 мл). Эту смесь оставляют стоять на 30 мин, затем добавляют к смоле примера А.30. Добавляют DCM (5 мл), затем DIPEA (0,00057 моль). Реакционную смесь взбалтывают в течение 24 ч при комнатной температуре, затем фильтруют, промывают 3 раза DCM, 3 раза вначале метанолом,- 25005855 затем DCM. Добавляют смесь TFA/DCM/TIS (4 мл, 75/23/2) и смесь взбалтывают в течение 1 ч при комнатной температуре. Смесь фильтруют, остаток на фильтре промывают 2 мл смеси TFA/DCM/TIS(75/23/2) и DCM (2 мл). Фильтрат сушат обдувом при 50 С в умеренном потоке азота. Остаток растворяют в DCM (5 мл), затем снова сушат обдувом. Эту фракцию очищают жидкостной хроматографией высокого разрешения на Hyperprep RP-C18 BDS (100 г, 100 , 8 мкм, элюент: [(0,5% NH4OAc в Н 2 О)/CH3CN 90/10]/CH3OH/CH3CN (0 мин) 75/25/0, (10 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Чистые фракции собирают и органический растворитель упаривают. Водный концентрат экстрагируют смесью DCM/водный раствор карбоната калия, затем разделяют на Extrelut. Органическую фазу сушат обдувом в атмосфере азота при 50 С. Остаток сушат далее в вакууме при 60 С, получая 0,0046 г соединения, идентифицированного как 29 в следующей табл. F-1. Соединения, идентифицированные как 30- 36 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру и заменяя флуорен-4-карбоновую кислоту подходящей реакционноспособной кислотой. Пример В.6. Смесь коммерческой смолы NOVABIOCHEM 01-64-0261 (0,00011 моль), промежуточного соединения (15) (0,00061 моль) и изопропилтитаната (0,18 мл) в DCM (5 мл) взбалтывают в течение 1 ч при комнатной температуре. Добавляют триацетоксиборгидрид (0,128 г) и реакционную смесь взбалтывают в течение 16 ч при комнатной температуре. Добавляют метанол (1 мл) и смесь взбалтывают в течение 5 мин,затем фильтруют, промывают 3 раза DCM, метанолом и сушат в вакууме, получая остаток (1). Тионилхлорид (0,0020 моль) добавляют к 4'-(трифторметил)-[1,1'-бифенил]-2-карбоновой кислоте(0,00055 моль) в DCM (2 мл) и смесь кипятят с обратным холодильником в течение 30 мин при перемешивании с последующим упариванием растворителя. Остаток растворяют в DCM (5 мл) и раствор добавляют к полученному ранее остатку (1). Добавляют DIPEA (0,0011 моль) с последующим добавлениемN,N-диметил-4-пиридинамина (0,00008 моль). Реакционную смесь взбалтывают в течение 21 ч при комнатной температуре, затем фильтруют, промывают 3 раза DCM, затем 3 раза вначале смесью 4% уксусная кислота/DCM, затем DCM и окончательно 3 раза вначале DCM и затем метанолом, затем сушат и добавляют 4 мл смеси TFA/DCM/TIS (49/49/2). Эту смесь взбалтывают в течение 1 ч, фильтруют, промывают 2 мл смеси TFA/DCM/TIS (49/49/2) и DCM (2 мл). Фильтрат сушат обдувом азотом при 50 С. DCM(5 мл) добавляют, затем удаляют в потоке азота при 50 С, получая 0,080 г метил -фенил-1-[4-4'(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-4-пиперидинацетата трифторацетата (1:1),идентифицированного как соединение 37 в следующей табл. F-1. Пример В.7. 4'-(Трифторметил)-[1,1'-бифенил]-2-карбоновую кислоту (0,00033 моль) и РуВОР (0,171 г) растворяют в DCM (5 мл). Эту смесь добавляют к смоле примера А.22 (0,00066 моль). Добавляют DIPEA(0,00066 моль) и реакционную смесь взбалтывают в течение 48 ч при комнатной температуре, фильтруют и остаток промывают три раза DMF, затем 3 раза DCM и метанолом, сушат, получая остаток. Указанный остаток и TFA/DCM/TIS (5/93/2) (4 мл) взбалтывают в течение 30 мин при комнатной температуре, затем фильтруют, промывают смесью TFA/DCM/TIS (5/93/2) (2 мл) и DCM (2 мл), затем фильтраты сушат обдувом газообразным азотом при 50 С, затем сушат дополнительно в вакууме при 60 С, получая 0,030 гN-[4-[4-[2-оксо-1-фенил-2-(пропиламино)этил]-1-пиперидинил]фенил]-4'-(трифторметил)-[1,1'-бифенил]2-карбоксамида трифторацетата (1:1), идентифицированного как соединение 38 в следующей табл. F-1. Пример В.8.DMF (0,5 мл) добавляют к раствору 4'-(трифторметил)-[1,1'-бифенил]-2-карбоновой кислоты (0,014 моль) в DCM (50 мл) и тионилхлориде (0,028 моль). Смесь перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель упаривают. DCM (50 мл) добавляют дважды и растворитель упаривают. Остаток растворяют в DCM (20 мл) и этот раствор добавляют к смеси промежуточного соединения (15)(0,014 моль) и DIPEA (0,028 моль) в DCM (80 мл). Смесь перемешивают при комнатной температуре в течение 3 ч и промывают водой. Органический слой сушат и растворитель упаривают. Остаток кристаллизуют из 2-пропанола. Осадок отфильтровывают и сушат, получая 6,2 г метил -фенил-1-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-4-пиперидинацетата (температура плавления 151 С), идентифицированного как соединение 39 в следующей табл. F-1. Пример В.9. Смесь промежуточного соединения (6) (0,023 моль) и Na2CO3 (0,023 моль) в DMF (150 мл) перемешивают. Метил -бромфенилацетат (0,023 моль) добавляют по каплям. Смесь перемешивают в течение ночи. Растворитель упаривают. Остаток растворяют в DCM. Органический слой отделяют, промывают, сушат, фильтруют и растворитель упаривают. Остаток растирают в DIPE. Осадок отфильтровывают и сушат, получая 11,4 г метил -фенил-4-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино] фенил]-1-пиперазинацетата, идентифицированного как соединение 40 в следующей табл. F-1. Пример В.10. Смесь промежуточного соединения (8) (0,018 моль) и Nа 2 СО 3 (0,03 моль) в DMF (100 мл) перемешивают. Метил -бромфенилацетат (0,025 моль) добавляют по каплям. Смесь перемешивают в тече- 26005855 ние ночи. Растворитель упаривают. Остаток растворяют в DCM. Органический слой отделяют, промывают, сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматогрфией на силикагеле (элюент СН 2 Сl2/СН 3 ОН 99/1). Чистые фракции собирают и растворитель упаривают, получая 7,2 г метилфенил-4-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-1-пиперидинацетата (температура плавления 138 С), идентифицированного как соединение 41 в следующей табл. F-1. Пример В.11. Метил -бромфенилацетат (0,1 моль) добавляют по каплям к перемешиваемой смеси промежуточного соединения (10) (0,07 моль) и Nа 2 СО 3 (13 г) в DMF (300 мл). Смесь перемешивают в течение ночи. Растворитель упаривают. Остаток кристаллизуют из метанола. Осадок отфильтровывают и сушат,получая 30,2 г метил 4-[4-[([1,1'-бифенил]-2-илкарбонил)амино]фенил]фенил-1-пиперазинацетата(температура плавления 125 С), идентифицированного как соединение 52 в следующей табл. F-1. Пример В.12.a) Смесь соединения (40) (0,19 моль) в НСl (36%) (100 мл) перемешивают и кипятят с обратным холодильником в течение 5 ч, затем перемешивают в течение ночи при комнатной температуре. Осадок отфильтровывают и растирают с 2-пропанолом, отфильтровывают и сушат, получая 5 г промежуточного соединения моногидрохлорида -фенил-4-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино] фенил]пиперазинуксусной кислоты.b) Смесь промежуточного соединения, полученного на стадии (а) (0,00016 моль), РуВОР (0,00032 моль) и триэтиламина (0,1 мл) перемешивают в течение 30 мин. Добавляют этиламин (0,0005 моль) и реакционную смесь перемешивают в течение ночи при 40 С. Реакционную смесь охлаждают. Добавляют воду(2 мл) и смесь перемешивают 15 мин, затем фильтруют через Extrelut и желательное соединение изолируют жидкостной хроматографией высокого разрешения, получая 0,046 г N-[4-[4-[2-(этиламино)-2 оксо-1-фенилэтил]-1-пиперазинил]фенил]-4'-(трифторметил) [1,1'-бифенил]-2-карбоксамида (температура плавления 123 С) , идентифицированного как соединение 54 в следующей табл. F-1. Соединения, идентифицированные как 55- 61 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру и заменяя этиламин подходящим реакционноспособным амином. Пример В.13. Смесь моногидрохлорида -фенил-4-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино] фенил]-1-пиперазинуксусной кислоты (0,011 моль) в серной кислоте (10 мл) и пропаноле (150 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель упаривают. Остаток растворяют в DCM и промывают раствором Nа 2 СО 3. Органический слой отделяют, промывают, сушат,фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН 95/5). Чистые фракции собирают и растворитель упаривают. Остаток растирают с DIPE. Осадок отфильтровывают и сушат, получая 2,6 г пропилфенил-4-[4-4'-(трифторметил)[1,1'бифенил]-2-ил]карбонил]амино]фенил]-1-пиперазинацетата (температура плавления 151 С), идентифицированного как соединение 62 в следующей табл. F-1. Пример В.14. Смесь промежуточного соединения (6) (0,017 моль) и этил-2-фенилакрилата (0,017 моль) в DMF(100 мл) перемешивают в течение 2 дней. Добавляют Nа 2 СО 3 (1 г). Смесь перемешивают в течение 2 дней. Растворитель упаривают. Остаток растворяют в DCM. Органический слой отделяют, промывают,сушат, фильтруют и растворитель упаривают. Остаток растирают с DIPE. Осадок отфильтровывают и сушат, получая 10,6 г этилфенил-4-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-1 пиперазинпропаноата (температура плавления 105 С), идентифицированного как соединение 81 в следующей табл. F-1. Пример В.15. а) Смесь соединения 81 (0,016 моль) в НСl (36%) (100 мл) перемешивают и кипятят с обратным холодильником в течение 8 ч, затем охлаждают и фильтруют. Остаток растирают в 2-пропаноле. Осадок отфильтровывают и сушат. Часть (0,2 г) этой фракции очищают жидкостной хроматографией высокого разрешения на RP-18 (элюент: NH4OAc 0,5%/CH3CN 90/10/СН 3 ОН/СН 3 СN 75/25/0, 0/50/50 и 75/25/0; колонка: Hyperprep 8 мкм). Чистые фракции собирают и растворитель упаривают. Остаток растирают вb) Смесь промежуточного соединения, полученного на стадии (а) (0,00016 моль), РуВОР (0,00032 моль) и триэтиламина (0,1 мл) в DCM (5 мл) перемешивают в течение 30 мин. Добавляют пропиламин(0,0004 моль) и реакционную смесь перемешивают в течение ночи при 40 С. Реакционную смесь охлаждают, промывают водой (2 мл), затем фильтруют через Extrelut и растворитель экстракта упаривают. Желательное соединение изолируют жидкостной хроматографией высокого разрешения на HyperprepRP-C18 BDS (100 г, 100 , 8 мкм, элюент: [(0,5% NH4OAc в Н 2O)/CH3CN 90/10]/СН 3 ОН/СН 3 СN (0 мин) 75/25/0, (10 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Чистые фракции собирают и рас- 27005855 творитель упаривают, получая N-[4-[4-[3-оксо-2-фенил-3-(пропиламино)пропил]-1-пиперазинил]фенил]4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамид, идентифицированный как соединение 63 в следующей табл. F-1. Соединения, идентифицированные как 64- 67 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру и заменяя пропиламин подходящим реакционноспособным амином. Пример В.16. а) Смесь соединения 41 (0,012 моль) в НСl (36%) (100 мл) перемешивают и кипятят с обратным холодильником в течение 6 ч, затем перемешивают в течение ночи при комнатной температуре. Осадок отфильтровывают и растирают в 2-пропаноле. Осадок отфильтровывают и сушат, получая 6,2 г промежуточного соединения моногидрохлорида -фенил-4-[4-4'-(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-1-пиперидинуксусной кислоты.b) Смесь промежуточного соединения, полученного на стадии (а) (0,00017 моль), РуВОР (0,3 г) и триэтиламина (0,1 мл) в DCM (5 мл) перемешивают в течение 30 мин. Добавляют этиламин (0,00017 моль). Реакционную смесь перемешивают в течение ночи при 40 С, затем охлаждают и добавляют воду (2 мл). Смесь. перемешивают в течение 1 ч, затем фильтруют через Extrelut и фильтрат упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 90/10). Продуктовые фракции собирают и растворитель упаривают, получая 0,010 г N-[4-[1-[2-(этиламино)-2-оксо-1-фенилэтил]-4-пиперидинил]фенил]-4'-(трифторметил)-[1,1'-бифенил]-2-карбоксамида, идентифицированного как соединение 69 в следующей табл. F-1. Соединения, идентифицированные как 70- 80 в следующей табл. F-1, получают подобным образом, иcпользуя такую же экспериментальную процедуру и заменяя этиламин подходящим реакционноспособным амином. Пример В.17. Смолу примера А.23 (0,000045 моль) промывают дважды диоксаном. Добавляют 1,4-диоксан (1 мл). Добавляют 2,4-дифторфенилбороновую кислоту (0,0004 моль) в 1,4-диоксане (1 мл). Добавляют KОН(0,00001 моль) в NMP (0,250 мл). Смесь перемешивают в течение 90 мин при 98 С. Снова добавляют РdСl2(РРh3)2 и реакционную смесь нагревают в течение 90 мин при 98 С. Смеси позволяют охладиться до комнатной температуры, затем фильтруют и остаток на фильтре промывают 3 раза диоксаном, 3 раза водой и 3 раза метанолом, затем 3 раза DCM, затем метанолом и, наконец, 3 раза DCM. Добавляют F (4 мл). Смесь взбалтывают в течение 30 мин, фильтруют, промывают TFA/DCM/TIS (2 мл, 5/93/2) и DCM (2 мл) и фильтраты сушат обдувом потоком азота. Остаток очищают жидкостной хроматографией высокого разрешения на Purospher Star RP-18 (20 г, 5 мкм; элюент: [(0,5% NH4OAc в Н 2O)/CH3CN 90/10]/СН 3 ОН/ СН 3 СN (0 мин) 75/25/0, (10 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Желательные фракции собирают и органический растворитель упаривают. Водный концентрат экстрагируют раствором CH2Cl2/Na2CO3. Экстракт очищают через Extrelut и органическую фазу сушат обдувом потоком азота. Остаток сушат в вакууме при 60 С, получая 0,008 г 2',4'-дифтор-N-[4-[4-[2-оксо-1-фенил-2(пропиламино)этил]-1-пиперидинил]фенил]-[1,1'-бифенил]-2-карбоксамида, идентифицированного как соединение 84 в следующей табл. F-1. Соединение, идентифицированное как 68 в следующей табл. F-1, получают подобным образом,используя такую же экспериментальную процедуру. Пример В.18. Смолу примера А.19 (0,0001 моль) промывают 3 раза диоксаном. Добавляют 1,4-диоксан (3 мл). Добавляют 2-метилфенилбороновую кислоту (0,0008 моль) в диоксане (1 мл). Добавляют KОН (2 М) (0,8 мл). Смесь взбалтывают в течение 30 мин в атмосфере аргона. Добавляют PdCl2(РРh3)2 (0,00002 моль) в NMP(0,5 мл). Смесь взбалтывают в течение 2 ч при 96 С. Снова добавляют PdCl2(РРh3)2 в 0,5 мл NMP и смесь нагревают в течение 2 ч при 96 С. Смеси позволяют охладиться до комнатной температуры, затем фильтруют и остаток на фильтре промывают 3 раза DMF, 3 раза H2O, 3 раза DMF, 3 раза метанолом, 3 разаDCM, 3 раза метанолом и 3 раза метанолом. Добавляют смесь TFA/DCM/TIS (4 мл). Смесь взбалтывают в течение 60 мин при комнатной температуре, фильтруют, промывают смесью TFA/DCM/TIS (2 мл) иDCM (2 мл) и фильтраты сушат обдувом потоком азота. Остаток очищают жидкостной хроматографией высокого разрешения на Purospher Star RP-18 (20 г, 5 мкм; элюент: 0,5% NH4OAc в Н 2O)/CH3CN 90/10)/N-[4-[4-[2-(этиламино)-2-оксо-1-фенилэтил]-1-пиперидинил]фенил]-2'-метил-[1,1'-бифенил]-2-карбоксамида, идентифицированного как соединение 85 в следующей табл. F-1. Соединения, идентифицированные как 86-96 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру. Пример В.19. Газ аргон барботируют через смесь смолы примера А.23 (0,0001 моль) и 3,5-дихлорбензолбороновой кислоты (0,0008 моль) в K2 СО 3 (2 М в H2O) (0,0008 моль) и 1,4-диоксане (5 мл) в течение 5 мин. Добавляют ацетат палладия (II) (0,00001 моль) в диоксане (0,5 мл) и реакционную смесь нагревают и взбал- 28005855 тывают в течение 16 ч при 97 С, затем охлаждают, фильтруют, промывают DMF (3 раза), водой (3 раза),DMF (3 раза), затем 3 раза вначале метанолом и затем DCM. Добавляют смесь TFA/DCM/TIS (2 мл,5/93/2). Смесь взбалтывают в течение 1 ч, затем фильтруют. Добавляют смесь TFA/DCM/TIS (2 мл,5/93/2). Смесь взбалтывают в течение 10 мин, затем фильтруют, промывают DCM (3 мл) и фильтрат сушат обдувом в атмосфере азота при 50 С. Остаток очищают ВЭЖХ на Purospher Star RP-18-e (20 г, 5 мкм; элюент: 0,5% NH4OAc в H2O)/CH3CN 90/10)/СН 3 ОН/СН 3 СN (0 мин) 75/25/0, (10 мин) 0/50/50, (16,00 мин) 0/0/100, (18,10-20 мин) 75/25/0). Желательные фракции собирают и органический растворитель упаривают. Водный концентрат экстрагируют смесью СН 2 Сl/водный раствор K2 СО 3. Экстракт очищают черезExtrelut и органическую фазу сушат обдувом потоком азота. Остаток сушат в вакууме при 60 С, получая 0,008 г 3',5'-дихлор-N-[4-[4-[2-оксо-1-фенил-2-(пропиламино)этил]-1-пиперидинил]фенил]-[1,1'-бифенил]-2-карбоксамида, идентифицированного как соединение 97 в следующей табл. F-1. Соединения, идентифицированные как 42-51, 53, 82, 83 и 98-118 в следующей таблице F-1, получают подобным образом, используя такую же экспериментальную процедуру. Пример В.20. а) Суспензию 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (0,086 г, 0,00014 моль) в NMP (1 мл) добавляют к смоле примера А.38 (0,2 г, 0,00014 моль) и трет-бутоксиду натрия (0,242 г, 0,00252 моль). Добавляют гомопиперазин (0,126 г, 0,0021 моль) в NMP (2 мл) и смесь перемешивают в атмосфере аргона. Добавляют трис(дибензилиденацетон)дипалладий (0,026 г, 0,00028 моль) в NMP (1 мл) и реакционную смесь взбалтывают в течение 19 ч при 105 С. Смесь охлаждают, фильтруют и остаток промывают DMF,водой, DMF (3 раза), Н 2 О (3 раза), DMF (3 раза), СН 3 ОН (3 раза), СН 2 Сl2 (3 раза), СН 3 ОН (3 раза) и NMPb) К продукту, полученному на стадии (а), добавляют метилбромфенилацетат (0,16 г, 0,0007 моль) вTFA/TIS/CH2Cl2 (49/2/49) (1,5 мл). Смесь взбалтывают в течение 15 мин, фильтруют, промывают DCM (2 мл),затем фильтраты сушат обдувом в атмосфере азота. Остаток очищают жидкостной хроматографией высокого разрешения на Purospher Star RP-18 (20 г, 5 мкм; элюент: 0,5% NH4OAc в H2O)/CH3CN 90/10)/СН 3 СN/СН 3 ОН (0 мин) 75/25/0, (10,00 мин) 0/50/50, (16,00 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Желательные фракции собирают и органический растворитель упаривают. Водный концентрат обрабатывают водным раствором карбоната натрия, затем экстрагируют DCM. Экстракт отделяют через Extrelut и фильтраты сушат обдувом в атмосфере азота при 50 С, получая 0,021 г соединения, идентифицированного как соединение 119 в следующей табл. F-1. Соединения, идентифицированные как 120- 128 в следующей табл. F-1, получают подобным образом, используя такую же экспериментальную процедуру. Пример В.21. Смесь промежуточного соединения (17) (0,019 моль) и Na2CO3 (0,019 моль) в DMF (125 мл) перемешивают при комнатной температуре. Добавляют по каплям метил -бромфенилацетат (0,01907 моль). Смесь перемешивают в течение 3 ч. Растворитель упаривают. Остаток забирают в воду и DCM. Отделенный органический слой сушат, фильтруют и растворитель упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 100/0, 99,5/0,5). Чистые фракции собирают и растворитель упаривают, получая остаток, который разделяют на его энантиомеры жидкостной хроматографией высокого разрешения на Chiralpak AD (элюент: гексан/этанол 70/30). Желательные фракции собирают и растворитель упаривают, получая после кристаллизации из 2-пропанола соединение (229), температура плавления 158 С, []D20=-28,86 (с=24,95 мг/5 мл в СН 3 ОН), и соединение (230), температура плавления 160 С, []D20=+27,69 (с=24,95 мг/5 мл в СН 3 ОН). Пример В.22. Метил -бромфенилацетат (0,0010 моль) в NMP (1 мл) добавляют к смоле (IХ-а) (0,0002 моль) вNMP (3 мл). Добавляют N,N-диизопропилэтиламин (0,0023 моль) и реакционную смесь взбалтывают в течение 48 ч при комнатной температуре, затем фильтруют и остаток на фильтре промывают DMF (3 раза), водой (3 раза), DMF (3 раза), метанолом (3 раза), DCM (3 раза), метанолом (3 раза) и DCM (3 раза). Добавляют смесь TFA/TIS/CH2Cl2 (49/2/49) (4 мл). Реакционную смесь взбалтывают в течение 2 ч при комнатной температуре, затем фильтруют и снова добавляют смесь TFA/TIS/CH2Cl2 (49/2/49) (4 мл). Реакционную смесь взбалтывают в течение 15 мин, затем фильтруют и фильтраты сушат обдувом в атмосфере азота. Остаток очищают жидкостной хроматографией высокого разрешения на Purospher Star RP-18(20 г, 5 мкм; элюент: 0,5% NH4OAC в Н 2O)/CH3CN 90/10) /СН 3 СN/СН 3 ОН (0 мин) 75/25/0, (10,00 мин) 0/50/50, (16,00 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Желательные фракции собирают и органический растворитель упаривают. Водный концентрат обрабатывают водным раствором карбоната натрия, затем экстрагируют DCM. Экстракт отделяют через Extrelut и фильтраты сушат обдувом в атмосфере азота при 50 С, получая соединение (184) в следующей табл. F-1.- 29005855 Пример В.23. Диметилаллиловый спирт (0,00017 моль) добавляют к смеси моногидрохлорида -фенил-4-[4-4'(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-1-пиперидинуксусной кислоты (который получен в примере В.16.а) (0,000084 моль) в DCM (4 мл) и N,N-диизопропилэтиламина (0,00010 моль),перемешиваемой в атмофере азота при -20 С, и смесь перемешивают в течение 10 мин. Добавляют 1[бис(диметиламино)метилен]тетрафторборат(1-)-1 Н-бензотриазолий-3-оксид (TBTU) (0,00013 моль) и реакционную смесь перемешивают в течение 30 мин при -20 С. Смеси позволяют постепенно нагреваться до комнатной температуры и реакционную смесь перемешивают в течение 75 ч при комнатной температуре. Реакционную смесь промывают водой (1 мл), затем фильтруют через Extrelut и остаток на фильтре промывают 3 раза 3 мл DCM. Фильтрат упаривают и остаток очищают ВЭЖХ (колонка Waters сXterra MS C18; элюент: [(0,5% NH4OAc в Н 2O)/CH3CN 90/10]/СН 3 ОН/СН 3 СN (0 мин) 75/25/0, (10,00 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Продуктовые фракции собирают и органический растворитель упаривают. Водные концентраты распределяют между DCM и водным раствором Na2CO3. Объединенные органические слои отделяют, сушат, фильтруют и фильтрат сушат обдувом в атмосфере азота при 50 С. Остаток сушат (вакуум, 60 С), получая соединение (220). Пример В.24.N,N-диизопропилэтиламин (0,0010 моль) добавляют к смеси моногидрохлорида -фенил-4-[4-4'(трифторметил)[1,1'-бифенил]-2-ил]карбонил]амино]фенил]-1-пиперидинуксусной кислоты (который получен в примере В.16.а) (0,000084 моль) в DCM (4 мл). Добавляют этанол (0,00017 моль) и 1[бис(диметиламино)метилен]тетрафторборат(1-)-1H-бензотриазолий-3-оксид (TBTU) (0,00013 моль). Реакционную смесь перемешивают в течение 75 ч при комнатной температуре. Добавляют воду (1 мл). Смесь перемешивают в течение 30 мин, затем фильтруют через Extrelut, промывают 3 раза DCM (3 мл каждый раз) и фильтрат упаривают. Остаток растворяют в DCM, промывают 1 мл 1 н. НСl, фильтруют через Extrelut и фильтрат промывают насыщенным водным раствором NаНСО 3 (1 мл). Смесь фильтруют через Extrelut. Фильтрат собирают и остаток на фильтре промывают DCM (2 х 4 мл). Фильтрат упаривают. Каждый остаток очищают ВЭЖХ (колонка Waters с Xterra MS C18; элюент: [(0,5% NH4OAc в Н 2O)/СН 3 СN 90/10]/СН 3 ОН/СН 3 СN (0 мин) 75/25/0, (10 мин) 0/50/50, (16 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Продуктовые фракции собирают и органический растворитель упаривают. Водные концентраты распределяют между DCM и водным раствором Nа 2 СО 3. Объединенные органические слои отделяют,сушат, фильтруют и фильтрат сушат обдувом в атмосфере азота при 50 С. Остаток сушат (вакуум, 60 С),получая соединение (222). Пример В.25.b) Этилбромид (1,2 эквивалента, 0,00010 моль) добавляют к смеси промежуточного соединения (26)(0,000084 моль) в DMF (5 мл) и Сs2 СО 3 (0,00018 моль) и реакционную смесь перемешивают в течение 3 ч при 70 С. Растворитель упаривают. Остаток распределяют между водой и DCM. Растворитель экстракта упаривают. Остаток очищают ВЭЖХ (колонка Waters с Xterra MS C18; элюент: [(0,5% NH4OAc в Н 2O)/СН 3 СN 90/10]/CH3CN (0 мин) 85/15, (10 мин) 10/90, (16 мин) 0/100, (18,10-20,00 мин) 85/15). Продуктовые фракции собирают и органический растворитель упаривают. Водные концентраты экстрагируют и растворитель экстракта упаривают, получая соединение (243). Пример В.26. Ацетилхлорид (0,0007 моль) добавляют к смоле (XI) (0,00011 моль) в DCM (4 мл). Добавляют N,Nдиметил-4-пиридинамин (0,00011 моль). Добавляют N,N-диизопропилэтиламин (0,0011 моль) и реакционную смесь взбалтывают в течение ночи при комнатной температуре. Смесь фильтруют и oстaтoк на фильтре промывают DCM, метанолом, DCM, метанолом, CHDCM2Cl2, метанолом и DCM. ДобавляютTFA/TIS/CH2Cl2 (49/2/49) (4 мл) и смесь взбалтывают в течение 2 ч при комнатной температуре. Смесь фильтруют, добавляют еще TFA/TIS/CH2Cl2 (49/2/49) (2 мл) и смесь взбалтывают в течение 15 мин, затем фильтруют и остаток на фильтре промывают DCM (2 мл). Фильтраты сушат обдувом в атмосфере азота. Остаток очищают ВЭЖХ на Purospher Star RP-18 (20 г, 5 мкм; элюент: 0,5% NH4 ОАс в Н 2O)/CH3CN 90/10)/CH3OH/CH3CN (0 мин) 75/25/0, (10,00 мин) 0/50/50, (16,00 мин) 0/0/100, (18,10-20,00 мин) 75/25/0). Желательные фракции собирают и органический растворитель упаривают. Водный концентрат экстрагируют и растворитель экстракта упаривают, получая 0,001 г соединения (253). Пример В.27. Метанол (0,5 мл) добавляют к смоле (XII) (0,0002 моль) в DCM (4 мл). Добавляют N,N-диметил-4 пиридинамин (0,0002 моль). Добавляют DIPEA (0,002 моль) и реакционную смесь взбалтывают в течение 18 ч при комнатной температуре. Смесь фильтруют и остаток на фильтре промывают DCM (3 х), метано- 30
МПК / Метки
МПК: A61K 31/495, A61P 3/06, C07D 211/34
Метки: полиарилкарбоксамиды, липидов, применимые, качестве, агентов, содержание, снижающих
Код ссылки
<a href="https://eas.patents.su/30-5855-poliarilkarboksamidy-primenimye-v-kachestve-agentov-snizhayushhih-soderzhanie-lipidov.html" rel="bookmark" title="База патентов Евразийского Союза">Полиарилкарбоксамиды, применимые в качестве агентов, снижающих содержание липидов</a>
Предыдущий патент: Производные 3-ароилиндола и их применение в качестве агонистов рецепторов cb2
Следующий патент: Тетрагидротиопиранфталазиноновые производные в качестве ингибиторов pde4