Сложные эфиры l-карнитина или алканоил l-карнитинов, полезные в качестве катионных липидов для внутриклеточной доставки фармакологически активных соединений
Номер патента: 4459
Опубликовано: 29.04.2004
Авторы: Сальватори Джованни, Пизано Клаудио, Тинти Мария Орнелла, Сантаньелло Мозе, Крителли Лучана
Формула / Реферат
1. Соединение формулы (I)
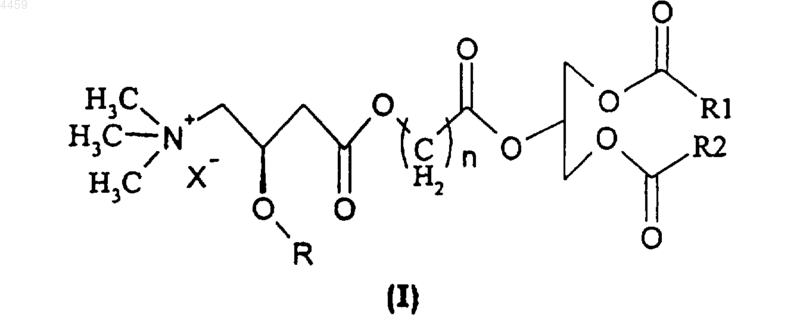
в которой n равно целому числу от 1 до 3;
R обозначает водород или алканоил, линейный или разветвленный, с 2-6 атомами углерода;
R1 и R2, которые могут быть одинаковыми или различными, представляют насыщенную или ненасыщенную линейную ацильную цепь с 3-20 атомами углерода; и
X- обозначает анион фармакологически приемлемой кислоты.
2. Соединение по п.1, в котором R выбран из группы, состоящей из ацетила, пропионила, бутирила, валерила и изовалерила.
3. Соединение по п.1, в котором R1 и R2 выбраны из группы гексаноил, ундеканоил, миристоил, пальмитоил или олеоил.
4. Соединение по п.1, в котором X- выбран из группы: хлорид, бромид, иодид, аспартат, кислый аспартат, цитрат, кислый цитрат, тартрат, кислый тартрат, фосфат, кислый фосфат, фумарат, кислый фумарат, глицерофосфат, глюкозофосфат, лактат, малеат, кислый малеат, мукат, оротат, оксалат, кислый оксалат, сульфат, кислый сульфат, трихлорацетат, трифторацетат, метансульфонат, памоат и кислый памоат.
5. Соединение по п.1, выбранное из группы
эфир L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином;
эфир ацетил L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином;
эфир пропионил L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином;
эфир изобутирил L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином;
эфир изовалерил L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином;
эфир L-карнитинбромида с 1,3-дигексаноил-2-гидроксиацетилглицерином;
эфир ацетил L-карнитинбромида с 1,3-дигексаноил-2-гидроксиацетилглицерином;
эфир пропионил L-карнитинбромида с 1,3-дигексаноил-2-гидроксиацетилглицерином.
6. Применение соединения по любому из пп.1-5 для получения липосом.
7. Липосома, включающая соединение по любому из пп.1-5.
8. Липосома по п.7, дополнительно включающая липиды-помощники.
9. Липосома по п.8, в которой указанный липид-помощник выбран из группы, состоящей из холестерина, 1-пальмитоил-2-олеоилфосфатидилхолина или диолеилфосфатидилхолина.
10. Применение липосомы по любому из пп.7-9 для получения композиции, полезной для транспорта фармакологически активных соединений.
11. Применение по п.10, при котором фармакологически активное соединение является встречающейся в природе или модифицированной плазмидой или полинуклеотидом.
12. Применение по п.11, при котором плазмида или полинуклеотид полезны в генной терапии.
13. Применение по п.11, при котором плазмида или полинуклеотид кодирует пептид или белок, полезный в качестве вакцины.
14. Применение по п.10, при котором активное соединение представляет лекарственное средство.
15. Применение по п.14, при котором лекарственное средство выбрано из группы, состоящей из противораковых, антиангиогенных, противовирусных, антибактериальных, противогрибковых, антипротозойных агентов, соединений, активных по отношению к сердечно-сосудистой системе, или иммуногенных пептидов.
16. Применение по п.15, при котором указанное лекарственное средство является противораковым или антиангиогенным агентом.
17. Применение по п.16, при котором указанный противораковый агент выбран из группы, состоящей из таксола или производных камптотецина.
18. Применение по п.17, при котором указанное производное камптотецина выбрано из группы, состоящей из следующих:
7-карбонитрилкамптотецин;
7-бензилоксииминометилкамптотецин и
7-бутоксииминометилкамптотецин.
19. Применение липосом по пп.7-9 для получения косметической композиции.
20. Фармацевтическая композиция, включающая липосомы по пп.7, 8 или 9.
21. Композиция по п.20, в которой указанная липосома содержит фармакологически активное соединение.
22. Композиция по п.21, в которой активное соединение является встречающейся в природе или модифицированной плазмидой или полинуклеотидом.
23. Композиция по п.22, в которой плазмида или полинуклеотид полезны в генной терапии.
24. Композиция по п.22, в которой плазмида или полинуклеотид кодирует пептид или белок, полезный в качестве вакцины.
25. Косметическая композиция, включающая липосомы по любому из пп.7-9.
26. Композиция по п.25, в которой указанная липосома содержит вещество с косметической активностью.
27. Композиция по п.21, в которой указанное соединение выбрано из группы, состоящей из противораковых, антиангиогенных, противовирусных, антибактериальных, противогрибковых, антипротозойных агентов, соединений, активных по отношению к сердечно-сосудистой системе, или иммуногенных пептидов.
28. Композиция по пп.20-27, которую можно вводить перорально, парентерально, внутривенно, внутримышечно, подкожно, трансдермально или в виде спреев для носа или рта.
Текст
1 Описанное изобретение касается класса новых сложных эфиров L-карнитина и ацил Lкарнитинов и их применения в качестве катионных липидов для содействия внутриклеточной доставке фармакологически активных соединений, облегчения их трансмембранного транспорта или для содействия их взаимодействию со специфическими сайтами клеточных мембран(рецепторами). Описанное изобретение касается также известных сложных эфиров L-карнитина и ацил Lкарнитинов, полезных для тех же целей, что и указанные выше новые соединения. Использованное здесь выражение "внутриклеточная доставка" обозначает клеточную трансфекцию полинуклеотидами или плазмидами, природного происхождения или модифицированных, наделенных терапевтической активностью (доставка гена), или введение в клетки лекарственных средств или иммуногенетических пептидов. Многие из фармакологически активных веществ, такие как, например, полипептиды и белки или лекарственные препараты, для проявления своего действия обычно должны проникать в клетку, воздействуя на функции клетки на внутриклеточном или молекулярном уровне. Для данных молекул клеточная мембрана является селективно непроницаемым барьером. Фактически клеточная мембрана представляет собой защитную функцию, предотвращая вход потенциально токсических веществ, а также прохождение соединений с терапевтической активностью. Сложный состав клеточной мембраны включает фосфолипиды, гликолипиды и белки; на ее функцию влияют цитоплазматические компоненты, такие как Са и другие ионы,АТФ, микрофиламенты, микроканальцы, ферменты и белки, которые связывают Са. Взаимодействие между структурными и цитоплазматическими компонентами клеток и отклик на внешние сигналы ответственны за селективность, демонстрируемую клетками разных типов. Барьерный эффект мембран можно преодолеть комбинированием веществ в комплексах с липидными препаратами, которые воспроизводят состав встречающихся в природе мембранных липидов. Данные липиды способны сливаться с мембранами и высвобождать комбинированные с ними вещества в клетки. Комплексы липидов способны не только облегчать внутриклеточный перенос посредством слияния с мембранами, но также уменьшать отталкивание зарядов между мембраной и молекулой, которая должна проникать в клетку. Амфипатические липиды, такие как мембранные фосфолипиды, в водных системах образуют липидные пузырьки или липосомы. Липосомы представляют собой пузырьки,в которых водный объем полностью окружен одной или более мембранами, составленными из молекул липидов, обычно фосфолипидов. Фос 004459 2 фолипиды, которые состоят из гидрофильной головы и пары углеродных цепей (гидрофобные хвосты), являются основными компонентами биологических мембран. В водном растворе гидрофобные хвосты самоассоциируются, исключая воду, тогда как гидрофильные головы взаимодействуют со средой, самопроизвольно образуя популяции пузырьков различного диаметра. Обычно липиды являются цвиттерионными, нейтральными или анионными. Такие пузырьки можно использовать в качестве носителей для лекарств, небольших молекул, белков,нуклеотидов и плазмид. На протяжении последних лет катионные липосомы, класс положительно заряженных пузырьков, получаемых из синтетических липидов, использовали для переноса в клетки генетического материала. Отрицательный заряд ДНК может взаимодействовать с положительными зарядами катионных липидов, образуя стабильный комплекс ДНК-липосома. Простота и многосторонность данной технологии сделали липосомы важными носителями для доставки генов для генной терапии людей. В настоящее время большинство векторов, используемых для генной терапии и одобренных NIH RecombinantAdvisory Committee (Рекомбинантный Консультативный Комитет Института Здравоохранения(США, включают вирусные и синтетические системы. Вирусная инфекция включает ряд сложных механизмов, чтобы быть способной атаковать специфическую клетку и нести ДНК в ядро. Основная причина использования вирусных векторов для генной терапии основана на возможности замещения вирусных генов генами, которые кодируют терапевтическую функцию, не исключая способности вирусной частицы инфицировать клетки. Ограничения вирусной терапии связаны с теми вирусными элементами,которые могут быть иммуногенными, цитопатическими и рекомбиногенными. Большие надежды возлагают на использование катионных липидов для генной терапии. Данные вектора обладают большим потенциалом по сравнению с векторами биологического происхождения, так как они более безопасны,менее токсичны, а также способны включать гены большого размера. Однако по сравнению с векторами биологического типа они имеют низкий выход внутриклеточной генной транскрипции. Тем не менее, следует иметь в виду, что использование таких трансфекционных систем находится на начальной стадии исследования. Катионные липиды играют очень важную роль в образовании комплекса ДНК-липид, во взаимодействии клетка-комплекс, в слиянии с мембраной, в высвобождении ДНК внутри клетки и в транскрипции. Существуют важные примеры примененияin vivo катионных липосом. Первое клиническое испытание по генной терапии было проведено 3 путем введения вектора экспрессии, содержащего комплекс с липосомой гена HLA-B7 человека, для лечения меланомы. Еще одно важное применение касается лечения кистозного фиброза легких путем введения через легкие или в виде носового спрея липосомного комплекса вектора экспрессии SV-40C-FTR. В настоящее время проводятся другие клинические испытания, включающие применение липосом в генной терапии. В структуре катионных липидов обычно идентифицируют четыре составных элемента: положительно заряженную катионную голову,спейсер, якорный липид и линкерную связь. Катионная голова отвечает за взаимодействия между катионными липосомами и ДНК,между комплексом ДНК-липосома и клеточной мембраной и другими компонентами клетки. Она состоит из моно- или поликатионных групп(в зависимости от числа зарядов), которые могут попеременно замещаться. Спейсер является частью молекулы, которая отделяет катионную голову от гидрофобного хвоста и включена в обеспечение оптимального контакта между катионной головой и отрицательными зарядами ДНК-фосфатов. Якорный липид является неполярной углеводородной частью молекулы и определяет физические свойства двойного липидного слоя,такие как его жесткость и скорость обмена с мембранными липидами. Выражение "линкерная связь" обозначает связь между углеводородными цепями и остатком молекулы. Данная связь определяет химическую стабильность и биоразлагаемость катионных липидов. В последние годы постоянно увеличивается использование липосом в косметике. Успех липосом в данной области обусловлен тем фактом, что данные соединения очень хорошо переносятся кожей. Их используют и как носители для активных ингредиентов, и как соединения,способствующие абсорбции последних. В научной и патентной литературе имеется много ссылок на получение и применение липосом; однако, почти нет ссылок, описывающих использование производных карнитина, полезных для доставки генов, и при этом нет никаких документов по доставке лекарств, касающиеся известных приемов получения соединений, отдаленно напоминающих описанные в заявке соединения изобретения. Патентная заявка ЕР 0279887 описывает использование производных карнитина, а именно фосфатидилкарнитина, необязательно в смеси с другими фосфолипидами и липидами (холестерин, фосфатидилхолин, фосфатидилсерин) для получения липосом. В представленном примере, касающемся получения липосом, получают липосомы фосфатидилкарнитина, которые включают пропранолол, лекарственное средство, известное как 4 активное в качестве агента против гипертензии,стенокардии и аритмии. Данное производное карнитина используется здесь вследствие резко выраженного миокардиального тропизма карнитина. Данный тропизм дает возможность избежать метаболизма липосом печенью прежде,чем они достигнут нужного целевого места. Присутствие фосфатидилкарнитина также дает возможность принимать липосомы перорально, так как они устойчивы к действию кишечных липаз. В J. Med. Chem. 1998 Jun 18; 41(13): 2207-15 описан ряд сложных эфиров Lкарнитина, полезных для доставки генов, но они не описаны и не предлагались в качестве полезных агентов для доставки лекарственных средств.WO 96/39193 описывает новые целевые лекарственные агенты, которые предназначены для входа в митохондрии через систему карнитин-ацилкарнитинтраслоказа, но их не предлагают в качестве полезных агентов для получения липосом. ЕР 559625 В 1 описывает ряд сложных эфиров L-карнитина и ацил L-карнитинов, наделенных активностью по селективному расслаблению мышц желудочно-кишечного тракта. В последние годы молекулярные биологи идентифицировали многочисленные дефекты на хромосомном уровне, которые являются причиной наследственных заболеваний у людей. Важная часть современной медицины касается лечения данных наследственных генетических заболеваний с помощью использования схем генной терапии. Как уже упоминалось, катионные липосомы широко используют для внутриклеточной доставки фармакологически активных соединений, ускорения трансмембранного транспорта или содействия их взаимодействию со специфическими сайтами мембраны (рецепторами). Данные векторы обладают большими возможностями по сравнению с векторами биологического происхождения, поскольку они более безопасны, менее токсичны, а также способны включать гены большого размера. Однако по сравнению с векторами биологического типа они имеют низкий выход внутриклеточной генной транскрипции. Кроме того, для опосредованного обычными катионными липидами переноса гена необходимо, чтобы плазмидная ДНК и катионные липиды хранились отдельно и чтобы их смешение происходило непосредственно перед переносом гена. Попытки стабилизировать данные полинуклеотидные комплексы до сих пор не удавались, чтобы дать обнадеживающие результаты; фактически комплексы оставались стабильными только в течение короткого времени. Таким образом, в области генной терапии или доставки генов и лекарственных средств 5 существует остро ощутимая потребность в стабильных воспроизводимых сайт-специфических системах, которые являются также активными по истечении подходящего периода времени. В настоящее время обнаружено, что класс катионных липидов, высоко активных в содействии внутриклеточной доставке фармакологически активных соединений, включает новые сложные эфиры L-карнитина и ацил Lкарнитинов. Данные новые соединения стабильны и высокоселективны, поскольку они являются сайт-специфическими в достижении целевого органа. Данная характеристика делает их особенно полезными для транспорта активных соединений непосредственно к участку, где они могут проявить свою фармакологическую активность. Согласно изобретению описанные здесь соединения представляют соединения общей формулы (I) в которой n равно целому числу от 1 до 3;R обозначает водород или алканоил, линейный или разветвленный, с 2-6 атомами углерода;R1 и R2, которые могут быть одинаковыми или различными, представляют насыщенную или ненасыщенную линейную ацильную цепь с 3-20 атомами углерода; иX- обозначает анион фармакологически приемлемой кислоты. Примерами R являются ацетил, пролионил,бутирил, валерил и изовалерил. Примерами R1 и R2 являются гексаноил,ундеканоил, миристоил, пальмитоил или олеоил. Предпочтительными примерами соединений согласно изобретению являются эфир L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином (ST 770); эфир ацетил L-карнитинбромида с 2 гидроксиацетил-1,3-дипальмитоилглицерином 6 эфир ацетил L-карнитинбромида с 1,3 дигексаноил-2-гидроксиацетилглицерином (ST 809); эфир пропионил L-карнитинбромида с 1,3 дигексаноил-2-гидроксиацетилглицерином (ST 808). Под анионом фармакологически приемлемой кислоты понимают любой анион кислоты,который не вызывает нежелательных токсических или побочных эффектов. Данные кислоты хорошо известны фармацевтам и экспертам фармацевтической технологии. Примерами данных анионов являются (но не исключительно перечисленные анионы) хлорид, бромид, иодид, аспартат, кислый аспартат,цитрат, кислый цитрат, тартрат, кислый тартрат,фосфат, кислый фосфат, фумарат, кислый фумарат, глицерофосфат, фосфат глюкозы, лактат,малеат, кислый малеат, мукат, оротат, оксалат,кислый оксалат, сульфат, кислый сульфат, трихлорацетат, трифторацетат, метансульфонат,памоат и кислый памоат. Соединения формулы (I) в форме липосом являются агентами, полезными как для доставки встречающихся в природе или модифицированных плазмид или нуклеотидов, полезных в генной терапии, или которые кодируют пептиды или белки, полезные в качестве вакцины, так и для общей доставки лекарственных средств,таких как, например, противораковые, противовирусные, антибактериальные, противогрибковые, антипротозойные агенты, лекарства, полезные для терапии заболеваний сердечнососудистой системы, или иммуногенные пептиды и другие полезные в терапии лекарственные средства. Липосомы, содержащие соединение формулы (I), получают обычными способами, хорошо известными специалистам в данной области, см., например, Allen T.M. Drugs 56, 74756 (1998). Липосомы согласно настоящему изобретению можно также получить, используя другие компоненты, хорошо известные в практике липосомной технологии. В одном варианте настоящего изобретения липосомы могут содержать липиды-помощники, этот термин хорошо понятен специалистам в данной области. Примерами липидов-помощников являются холестерин, 1-пальмитоил-2-олеоилфосфатидилхолин или диолеилфосфатидилхолин. Липосомы согласно настоящему изобретению подходящим образом представляют в виде композиций. В варианте, относящемся к доставке фармакологически активных соединений, под композициями понимают фармацевтические композиции, необязательно включающие фармацевтически приемлемые носители и/или наполнители (эксципиенты). Соединения формулы (I) в форме липосом могут также быть полезны в приготовлении косметических композиций, как включающих 7 липосомы сами по себе в качестве косметически активного агента, так и для доставки веществ с косметической активностью, таких как, например, гидратирующие агенты, питательные вещества, вещества для очистки лица, агенты против морщин, антицеллюлитные агенты и агенты против растяжения и шрамов или рубцов. Липосомы, включающие соединения формулы (I), можно вводить перорально или парентерально, внутривенно, внутримышечно, подкожно, трансдермально или в виде спреев для носа или рта. Описанное в заявке изобретение касается также дополнительных катионных липидов общей формулы (II), уже известных для различного применения (упоминавшийся выше ЕР 559625). Согласно настоящему изобретению соединения формулы (II) являются сложными эфирами L-карнитина, полезными для получения липосом, которые обладают высокой активностью в доставке лекарств и имеют характеристики стабильности и селективности в достижении целевого органа, сравнимые с характеристиками описанных выше соединений формулы (I). Те же полезные свойства применимы в области косметики. Указанные соединения имеют общую формулу (II) в которой R3 обозначает насыщенную или ненасыщенную линейную или разветвленную ацильную цепь с 4-26 атомами углерода;R4 обозначает насыщенную или ненасыщенную линейную или разветвленную алкильную цепь с 4-26 атомами углерода; иX- обозначает анион фармакологически приемлемой кислоты. Предпочтительными примерами R3 являются нонаноил, додеканоил, миристоил, пальмитоил, стеароил или олеил. Предпочтительными примерами R4 являются нонил, ундецил, тетрадецил, гексадецил или олеил. Примерами конкретных соединений формулы (II) согласно описанному здесь изобретению являются ундециловый эфир пальмитоил L-карнитинхлорида (ST 983); ундециловый эфир стеароил L-карнитинхлорида (ST 1055); тетрадециловый эфир стеароил L-карнитинхлорида (ST 1351); тетрадециловый эфир пальмитоил Lкарнитинхлорида (ST 1379); тетрадециловый эфир миристоил Lкарнитинхлорида (ST 1380); 8 гексадециловый эфир пальмитоил Lкарнитинбромида (ST 1390); олеиловый эфир олеил L-карнитинхлорида(ST 1392). Ряд соединений формулы (II), а именно ST 1380, ST 1390 и ST 1392, известны и описаны в указанной выше работе J. Med. Chem. 1998 Jun 18; 41(13):2207-15 в качестве полезных агентов для получении липосом для клеточной трансфекции, наделенных терапевтической активностью, но они никогда не описывались как полезные агенты для получения липосом для доставки лекарств. Специалисты со средним опытом в области получения фармацевтических препаратов хорошо знают трудности, встречающиеся при получении комплексов липосома-лекарство; фактически невозможно заранее установить,можно ли липосому, полезную для доставки генов, использовать для доставки лекарств из-за многочисленных проблем, которые нужно преодолеть для получения липосом, способных образовывать комплекс с лекарственным средством и доставлять его предпочтительно к органу,в котором оно должно проявлять свою целительную активность. Соединения формулы (II) в форме липосом являются полезными агентами для доставки лекарственных средств, таких как, например,противораковые, антиангиогенные, противовирусные, антибактериальные, противогрибковые,антипротозойные агенты, или лекарства, полезные для терапии сердечно-сосудистых заболеваний, или иммуногенные пептиды и другие полезные в терапии лекарственные средства. Соединения формулы (II) в форме липосом полезны также в приготовлении косметических композиций в качестве косметических агентов самих по себе или для доставки веществ с косметической активностью, таких как, например,гидратирующие агенты, питательные вещества,агенты для очистки лица, агенты против морщин, антицеллюлитные агенты и агенты против растяжения кожи или шрамов. Указанные липосомы могут необязательно включать вспомогательные липиды как в случае липосом, включающих соединения формулы (I). Липосомы, включающие соединения формулы (II), можно вводить перорально или парентерально, внутривенно, внутримышечно,подкожно, трансдермально или в виде спреев для носа или рта. Описанное здесь изобретение касается также дополнительных катионных липидов общей формулы (III), уже известных для различного применения (упоминавшийся выше ЕР 559625). Согласно настоящему изобретению соединения формулы (III) являются сложными эфирами L-карнитина, полезными для получения липосом, которые обладают высокой активностью в содействии доставке лекарств и имеют 9 характеристики стабильности и селективности в достижении целевого органа, сравнимые с характеристиками описанных выше соединений формулы (I). Данные соединения имеют общую формулу (III) в которой R5 обозначает насыщенную или ненасыщенную линейную или разветвленную ацильную цепь с 4-26 атомами углерода;R6 обозначает насыщенную или ненасыщенную линейную или разветвленную алкильную цепь с 4-26 атомами углерода; и Х- обозначает анион фармакологически приемлемой кислоты; при условии, что когда R5 является стеароилом, R6 не является стеарилом; когда R5 является олеоилом, R6 не является стеарилом; когда R5 является пальмитоилом, R6 не является пальмитилом; когда R5 является миристоилом, R6 не является миристилом; когда R5 является лауроилом, R6 не является лаурилом; когда R5 является олеоилом, R6 не является олеилом. Исключенные из заявленных соединения в виде липосом раскрыты в J. Med. Chem. 1998Jun 18; 41(13):2207-2215 исключительно для доставки генов. Предпочтительными примерами R5 являются нонаноил, додеканоил, миристоил, пальмитоил, стеароил или олеоил. Предпочтительными примерами R6 являются нонил, ундецил, тетрадецил, гексадецил или олеил. Предпочтительными примерами соединений формулы (III) согласно изобретению являются ундециловый эфир пальмитоил L-карнитинхлорида (ST 983); ундециловый эфир стеароил L-карнитинхлорида (ST 1055); тетрадециловый эфир стеароил L-карнитинхлорида (ST 1351); тетрадециловый эфир пальмитоил Lкарнитинхлорида (ST 1379). Соединения формулы (III) являются полезными агентами для доставки встречающихся в природе или модифицированных плазмид или нуклеотидов, полезных в генной терапии, или которые кодируют пептиды или белки, полезные в качестве вакцин. Соединения формулы (III) можно вводить перорально или парентерально, внутривенно, 004459 10 внутримышечно, подкожно, трансдермально или в виде спреев для носа или рта. Процедура получения соединений формулы (I) согласно изобретению представлена на следующей реакционной схеме, причем имеется в виду, что данная схема касается в целом общей формулы (I). Специалист может легко получить все группы, указанные в R, R1 и R2, поскольку все необходимые реагенты промышленно доступны или раскрыты в литературе, а реакционные условия обще применимы ко всему объему настоящего изобретения, в пределах общих знаний свободно осуществляют, если необходимо, любые модификации. Ниже проиллюстрировано получение соединений формулы (I) согласно изобретению со ссылкой на приведенную выше реакционную схему 1. Пример 1. Получение сложных эфиров пропионил L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином (SТ 772). а). Получение 1,3-дигидроксипропан-2-он 1,3-дипальмитата (1). Дигидроксиацетон (7 г, 0,078 моль) растворяют в 300 мл безводного хлороформа при 0 С (внешняя температура) под током безводного азота. К полученному таким образом раствору добавляют по каплям пальмитоилхлорид (44 г,0,16 моль) и безводный пиридин (15 мл). Полученную смесь, температуру которой доводят до комнатной, перемешивают в течение 24 ч. Затем смесь экстрагируют в следующем порядке: 300 мл 0,5% водного раствора соляной кислоты, 300 мл 5% водного раствора бикарбоната натрия и, наконец, 300 мл воды. Отделенную органическую фазу дегидратируют над безводным сульфатом натрия,фильтруют через целлюлозный фильтр и концентрируют досуха, получая сырой продукт (1). Чистый продукт (1) получают кристаллизацией из 500 мл этилового спирта. Получают 30,4 г продукта (1). Выход: 73%,т.пл.= 80-81 С. 1 Н ЯМР (CDCl3): 0,9 (6 Н, т, СН 3 СН 2-); 1,3b). Получение 1,2,3-тригидроксипропан 1,3-дипальмитата (2). Воду (7,5 мл) медленно при перемешивании добавляют к продукту (1) (5 г, 9 ммоль),растворенному в тетрагидрофуране (125 мл) и толуоле (25 мл). Температуру полученной молочно-белой суспензии доводят до 5 С (внешняя температура) и добавляют небольшими порциями боргидрид натрия (500 мг, 13 ммоль). Суспензию перемешивают в течение 30 мин при 5 С. Затем медленно добавляют ледяную уксусную кислоту до тех пор, пока не прекратится выделение газа вследствие разложения избытка боргидрида натрия, получая в конечном счете раствор. К раствору добавляют хлороформ (100 мл),получая двухфазную систему. Нижнюю органическую фазу, состоящую из СНСl3, отделяют и экстрагируют в следующем порядке: водой (25 мл), бикарбонатом натрия (25 мл 10% водного раствора) и водой (25 мл). Органический раствор, содержащий (2),дегидратируют над сульфатом натрия, фильтруют и концентрируют досуха, получая воскообразный продукт. Продукт (2) получают кристаллизацией из ацетона сырого воскообразного продукта. Получают 4,8 г продукта (2). Выход: 94%,т.пл.= 71-72 С. 1c). Получение 1,3-дипальмитоил-2-бромацетилглицерина (3). Продукт (2) (2,5 г, 4,4 ммоль) растворяют в безводном хлороформе (50 мл) при перемешивании и температуре 0 С (внешняя температура). К полученному таким образом раствору медленно добавляют пиридин (0,42 мл) и по каплям 3 мл хлороформного раствора, содержащего бромацетилхлорид (0,43 мл, 5,2 ммоль). Реакционную смесь выдерживают 30 мин при 0 С (внешняя температура) и 30 мин при комнатной температуре. Затем реакционную смесь обрабатывают в следующем порядке: 1% водным раствором соляной кислоты (примерно 50 мл), 5% водным раствором бикарбоната натрия (примерно 50 мл) и водой. Продукт (3) очищают кристаллизацией из ацетона после дегидратации реакционной смеси(0,95 г, 4,4 ммоль), предварительно высушенную в вакууме при 40 С, суспендируют в безводном диметилформамиде (примерно 20 мл). Продукт (3) (3 г, 4,7 ммоль) добавляют небольшими порциями к суспензии. Суспензию нагревают до 38 С и выдерживают в данных условиях до тех пор, пока не получится раствор. Спустя 10 мин доводят температуру раствора до 0 С в течение 30 мин. Получают осадок, который отфильтровывают, промывают этиловым эфиром и растворяют в хлороформе(30 мл) фильтруют через целит и концентрируют. К последнему раствору добавляют гексан(100 мл) и полученный осадок продукта (4) фильтруют и сушат в вакууме при 35 С. Получают 3,19 г указанного в заголовке соединения. Выход: 80%,т.пл.= 127-128 С(9 Н, с, N (СН 3)3); 4,2 (4 Н, м, -СН 2 ОСОСН 2-); 4,35 (2 Н, м, -CH2N-); 4,65 (2 Н, д,д, -ОСН 2 СО-); 5,25 (1 Н, т, -ОСН 2 СНСН 2O-); 5,75 (1 Н, м,-CHCH2N-). Примеры 2-7. Следующие соединения получают аналогичным образом как в предыдущем примере: эфир L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином (ST 770); эфир ацетил L-карнитинбромида с 2 гидроксиацетил-1,3-дипальмитоилглицерином 13 эфир пропионил L-карнитинбромида с 1,3 дигексаноил-2-гидроксиацетилглицерином (ST 808). Один предпочтительный вариант описанного здесь изобретения состоит в получении липосом с противораковыми лекарственными средствами, в особенности липосом, которые действуют как носители для камптотецинов,например, описанных в WO 97/31003. В более предпочтительном варианте настоящее изобретение обеспечивает липосомы для доставки камптотецинов общей формулы (IV)C1-C5 алкильную или C1-C5 алкенильную группу,линейную или разветвленную, или С 3 С 10 циклоалкильную группу, или линейную или разветвленную(С 3-С 10)циклоалкил(C1C5)алкильную группу, или C6-C14 арил, или линейную или разветвленную (С 6-C14)арил(C1-С 5) алкильную группу, или гетероциклическую, или линейную, или разветвленную гетероцикл(C1C5)алкильную группу, причем указанная гетероциклическая группа содержит по меньшей мере один гетероатом, выбранный из атомов азота, необязательно замещенного (С 1-С 5) алкильной группой, и/или кислорода, и/или серы; причем указанные алкильные, алкенильные,циклоалкильные, арильные, арилалкильные,гетероциклические или гетероциклалкильные группы необязательно замещены другими группами, выбранными из: галогена, гидроксила, C1C5 алкила, C1-C5 алкокси, фенила, циано, нитро,NR12R13, где R12 и R13, которые могут быть одинаковыми или разными, представляют водород,линейный или разветвленный (C1-C5)алкил,группу -СООН или один из фармацевтически приемлемых сложных эфиров; или группы-CONR14R15, где R14 и R15, которые могут быть одинаковыми или различными, представляют водород, линейный или разветвленный (C1-C5) алкил; илиR10 обозначает С 6-С 10 ароильный остаток,необязательно замещенный одной или более группами, выбранными из: галогена, гидроксила, линейного или разветвленного C1-C5 алкила,линейного или разветвленного C1-C5 алкокси,фенила, циано, нитро, -NR16R17, где R16 и R17,которые могут быть одинаковыми или различными, представляют водород, линейный или разветвленный C1-C5 алкил;R11 обозначает водород, линейный или разветвленный C1-C5 алкил, линейный или разветвленный C1-C5 алкенил, С 3-С 10 циклоалкил,линейный или разветвленный(С 3-С 10) циклоалкил(C1-C5)алкил, C6-C14 арил, линейный или разветвленный (С 6-С 14)арил(C1-C5)алкил;R8 и R9, которые могут быть одинаковыми или различными, обозначают водород, гидроксил, линейный или разветвленный C1-C5 алкокси; их N1-оксиды, отдельные изомеры, особенно син- и антиизомеры группы -C(R11)=NO(n)R10, их возможные энантиомеры, диастереоизомеры и их смеси, их фармацевтически приемлемые соли и их активные метаболиты. Соединения формулы (IV) описаны в европейской патентной заявке 99830124.6 от 9 марта 1999 г. Что касается соединений формулы (IV), в которых n равно 1 и R10 имеет значения, определенные выше, за исключением ароила, данные соединения можно получить, исходя из камптотецин 7-альдегида (формула IVa, R11 - водород) или камптотецин 7-кетона (формула IVa, R11 отличен от водорода). где R7 обозначает группу -C(R11)=O, и R11 имеет значения, определенные для формулы (IV), R8 и(IV), в котором R7 обозначает группу -С(R11)=NO-R10, R10 имеет значения, определенные для формулы (IV) за исключением ароила. Реакцию можно осуществлять обычными методами, известными специалистам в данной области, с помощью процесса обычного образования оксимов. Предпочтительно, чтобы молярное отношение камптотецин 7-альдегида или 7 кетона к гидрокситамину находилось в диапазоне от 1:3 до 3:1. Можно также использовать соответствующие соли гидроксиламина. Реакцию проводят в присутствии основания, например,неорганического основания, такого как карбонат калия, или органического основания, такого как триэтиламин или диазабициклононан, используя полярные растворители, предпочтительно метанол или этанол, и температуру в диапазоне от комнатной до температуры кипения растворителя, необязательно в присутствии дегидратирующих агентов, например, сульфата 15 натрия или магния, молекулярных сит. Если требуется, реакцию можно также проводить в присутствии катализатора, например, кислоты Льюиса. Альтернативно, указанные выше соединения можно получать из оксима камптотецин 7 альдегида (полученного, как описано в работеSawada et al. Chem. Pharm. Bull. 39, 2574 (1991,или 7-кетона, или из соответствующего 7 ацилкамптотецина по реакции с галогенидомR10-Х, в котором X предпочтительно является иодом, в полярном растворителе, например,тетрагидрофуране или спиртах, и в присутствии основания, например, гидрида натрия или карбоната калия. Что касается соединений формулы (IV), в которой n равно 1 и R10 обозначает ароил, как определено в формуле (IV), данные соединения можно получать, исходя из камптотецин 7 оксима, получение которого описано в предыдущем абзаце, с ацилхлоридом R10-COCl в полярных растворителях и в присутствии основания, предпочтительно пиридина, или непосредственно в пиридине, как описано Cho et al. J.Org. Chem. 62, 2230 (1997). Что касается соединений формулы (IV), в которой n равно 0 и R10 имеет значения, определенные выше, за исключением ароила, данные соединения можно получать, исходя из камптотецин 7-альдегида, (формула IVa, R11 - водород) или камптотецин 7-кетона (формула IVa, R11 отличен от водорода). где R7 обозначает группу -C(R11)=O и R11 имеет значения, определенные для формулы (IV), R8 и(IV), в которой R7 обозначает группу -C(R11)=NR10, R10 такой, как определен для формулы (IV),за исключением ароила. Реакцию можно проводить обычными способами, известными специалистам в области фармацевтической технологии, способами, включающими обычное получение иминов. Предпочтительно, чтобы молярное отношение камптотецин 7-альдегида или 7 кетона к имину находилось в диапазоне от 1:3 до 3:1. Можно также использовать соответствующие соли амина. Реакцию проводят в присутствии основания, например, неорганического основания, такого как карбонат калия, или органического основания, такого как триэтиламин или диазабициклононан, используя полярные 16 растворители, предпочтительно метанол или этанол, и температуру в диапазоне от комнатной до температуры кипения растворителя, необязательно в присутствии дегидратирующих агентов, например, сульфата натрия или магния,молекулярных сит. Если требуется, реакцию можно также проводить в присутствии катализатора, например, кислоты Льюиса, как описано,например, в работе Moretti and Torre, Synthesis,1970, 141; или Kobayashi et al. Synlett, 1977, 115. Камптотецин 7-альдегид и камптотецин 7 оксим описаны в европейской патентной заявке ЕР 0056692 и цитированной выше статье SawadaN1-оксиды соединений формулы (IV) получают в соответствии с известными способами окисления гетероароматического азота, предпочтительно окислением уксусной или трифторуксусной кислотой и пероксидом водорода,или по реакции с органическими пероксикислотами (A. Albini and S. Pietra, Heterocyclic Noxides, CRC, 1991). Что касается вариации значения R10, присутствующего в различных формулах реагентовV, данные реагенты промышленно доступны или могут быть получены по способам, известным из литературы, к которой может обратиться специалист в дополнение к своим знаниям по данному вопросу. Фармацевтически приемлемые соли получают обычными способами, которые описаны в литературе и не требуют дополнительного описания. Пример 8. 7-Бензилоксииминометилкамптотецин (СРТ 172). 500 мг (1,33 ммоль) 7-формилкамптотецина растворяют в 100 мл этанола. Добавляют 15 мл пиридина и 638 мг (4 ммоль) гидрохлорида O-бензилгидроксиламина. Раствор кипятят с обратным холодильником в течение 5 ч. Растворитель выпаривают в вакууме и полученный таким образом остаток очищают с помощью флэш-хроматографии на силикагеле, используя смесь гексан:этилацетат = 4:6 в качестве элюента. Выход: 65%,т.пл.= 200-205 С (разл). Полученный продукт состоит из смеси примерно 8:2 двух изомеров, син и анти (изомерA: Rf 0,32; изомер В: Rf 0,19 силикагель Merck 60 F254; элюент смесь гексан:этилацетат = 3:7). ВЭЖХ: анализы выполняют на приборе,оснащенном четвертичным насосом (HP 1050) с инжектором Rheodyne (петля 20 мкл) и детектором с диодной матрицей (HP 1050) по программе HPLC-ChemStation. Спектры снимают в диапазоне от 200 до 600 нм и хроматограммы регистрируют при 360 и 400 нм. Используют колонку с обращенной фазой С 18 (Rainin C18; 250,4 см, Varian) с предколонкой RP18. Анализ выполняют при линейном градиентном элюировании, начиная со смеси 17 ацетонитрил:вода = 30:70, до 100% ацетонитрила за 20 мин при скорости потока 1 мл/мин. Время удерживания составляет 12,51 мин для изомера В и 14,48 мин для изомера А. 1 Н ЯМР (300 MHz; DMCO-d6): : 0,88 (т,Н 3-18 А+Н 3-18 В), 1,87 (8 м, Н 2-19 А+Н 2-19 В), 5,18(30) 273 (20) 243 (20) 91 (34). Пример 9. 7-Бутоксиминометилкамптотецин (СРТ 184). 400 мг (1,06 ммоль) 7-формилкамптотецина растворяют в 80 мл этанола. Добавляют 12 мл пиридина и 400 мг (3,18 ммоль) гидрохлорида O-трет-бутилгидроксиламина. Раствор кипятят с обратным холодильником в течение 4 ч. Растворитель выпаривают в вакууме и полученный таким образом остаток очищают флэшхроматографией на силикагеле, используя смесь гексан:этилацетат = 4:6 в качестве элюента. Получают 322 мг (0,72 ммоль) желтого твердого вещества. Выход: 68%,т.пл.= 250 С (разл.). Полученный продукт состоит из смеси примерно 8:2 двух изомеров, син и анти (изомерA: Rf 0,31; изомер В: Rf 0,24, силикагель Mekck 60 F254; элюент: смесь гексан:этилацетат = 3:7). ВЭЖХ: анализы выполняют на приборе,оснащенном четвертичной помпой (HP 1050) с инжектором Rheodyne (петля 20 мкл) и детектором с диодной матрицей (HP 1050), по программе HPLC-ChemStation. Спектры снимают в диапазоне от 200 до 600 нм и хроматограммы регистрируют при 360 и 400 нм. Используют колонку с обращенной фазой С 18 (Rainin C18; 250,4 см, Varian) с предколонкой RP18. Анализ выполняют при линейном градиентном элюировании, начиная от смеси ацетонитрил:вода = 30:70, до 100% ацетонитрила за 20 мин при скорости потока 1 мл/мин. Время удерживания составляет 12,92 мин для изомера В и 14,61 мин для изомера А. 1 18 Получение липосом Соединения изобретения можно использовать для получения мультиламеллярных липосом (MLV) и юниламеллярных липосом (SUV),как в виде сухих порошков, так и в виде суспензий в водных растворах. Соединения согласно изобретению, полученные, как описано в примерах 1-7, используют для получения липосом согласно следующей методике. Подходящее количество указанного соединения растворяют в хлороформе; раствор концентрируют в вакууме досуха в роторном испарителе до тех пор, пока не образуется липидная пленка. Липидную пленку сушат в высоком вакууме до тех пор, пока не будут удалены последние оставшиеся следы растворителя и затем растворяют в трет-бутиловом спирте или с водой. Полученный таким образом раствор лиофилизуют, получая мягкий сухой порошок. Порошки гидратируют подходящим количеством водного раствора, получая липосомы использованного соединения, которые затем комплексуют с полинуклеотидом или желаемым лекарственным средством. Еще один способ получения липосом включает адсорбцию липидной пленки, состоящей из соединения согласно изобретению в растворителе, на подходящем инертном носителе,таком как сорбит, маннит или другие фармакологически приемлемые карбогидраты. Смесь сушат в вакууме, получая твердое вещество,которое можно легко и очень быстро гидратировать перед применением. Препараты в виде сухих порошков дают преимущество в отношении стабильности в течение длительных периодов, и их легко применять. Кроме того, соединения изобретения можно применять для получения липосом в виде комплекса с ДНК или с необходимым лекарственным средством в форме сухих порошков согласно следующей процедуре. Соединение согласно изобретению растворяют в третбутиловом спирте или воде; полученный таким образом раствор смешивают с ДНК или желаемым лекарством и смесь лиофилизуют, получая комплекс, который можно определить как пролипосома-ДНК или пролипосома-лекарство, в виде мягкого сухого порошка. Полученные таким образом порошки (пролипосомы) можно применять для получения фармацевтических композиций, которые можно вводить с помощью аэрозоля, или, альтернативно, когда их реконструируют водой или подходящим буферным раствором, они могут вводиться парентерально или перорально. Липосомы в комплексе с ДНК или лекарственным средством в твердой форме можно также получать способом адсорбции липидной пленки на инертном носителе, таком как сорбит,маннит или другие карбогидраты, применяя описанный выше способ. 19 Тестирование образования липосом Образование липосом тестируют колориметрическим способом, используя водорастворимый краситель, согласно следующей методике. Получают водный раствор водорастворимого красителя арсеназо III (мМ = 776,37; 2,3 мг/мл). Данный раствор используют вместо воды для гидратации липидных пленок из указанного выше получения. Аликвоту суспензии, содержащей липосомы с включением красителя, разбавляют водой в 100 раз. Для получения первой оптической плотности при 660 нм используют 2 мл суспензии липосом; определение выполняют относительно равного образца, определенного как холостой. Добавляют к первому образцу 200 мкл раствора СаСl2 (15 мг/мл; 100 мМ) и измеряют оптическую плотность при 660 нм относительно холостого образца, к которому добавлено 200 мкл воды. Полученную величину поглощения указывают, как значение 2. Процесс продолжают,добавляя к образцу 100 мкл раствора Triton X100 (5% об./об.; конечная концентрация 0,26%),а к холостому раствору 200 мкл воды; величину оптической плотности при 660 нм представляют как значение 3. Для расчета процентного содержания инкапсулированного красителя используют следующую формулу: Процентное содержание инкапсулированного красителя дает меру образования липосом и в среднем составляет примерно 40%: проверку размера липосом проводят, используя рассеяние лазерного света с положительным выходом. Примеры получения липосом Получение липосом ундецилового эфира пальмитоил L-карнитинхлорида (ST 983) в форме а). Лиофилизованных порошков. 65 мг (0,11 ммоль) ундецилового эфира пальмитоил L-карнитинхлорида растворяют в 20 мл хлороформа в колбе на 100 мл. Раствор выпаривают до тех пор, пока не получится липидная пленка, которую сушат в вакууме в течение 3 ч. Полученный таким образом продукт растворяют в трет-бутиловом спирте, раствор быстро охлаждают до -70 С жидким азотом и лиофилизуют в течение 24 ч. Получают пористое мягкое белое твердое вещество.b). Адсорбированных порошков. 143 мг (0,231 ммоль) ундецилового эфира пальмитоил L-карнитинхлорида растворяют в 10 мл хлороформа. Полученный таким образом раствор выливают небольшими порциями в 100 мл колбы, содержащие 750 мг сорбита. В конце добавления различных порций хлороформного раствора хлороформ быстро выпаривают. 20 Полученное таким образом твердое вещество сушат в вакууме в течение 3 ч. Получают 893 мг твердого белого продукта. Перед использованием данный продукт быстро гидратируют подходящим объемом воды, получая изотонический раствор.c). Суспензий MLV. 65 мг (0,11 ммоль) ундецилового эфира пальмитоил L-карнитинхлорида растворяют в 20 мл хлороформа в 100 мл колбе. Полученный таким образом раствор выпаривают до тех пор, пока не получится липидная пленка, которую затем сушат в вакууме 3 ч. Липидную пленку гидратируют 10 мл воды при 30 С в течение 3 ч, получая суспензиюMLV. Образуют комплекс суспензии MLV, разбавленной подходящим образом, с полинуклеотидом или лекарственным средством и используют его для биологических исследований.d). Суспензий SUV. 65 мг (0,11 ммоль) ундецилового эфира пальмитоил L-карнитинхлорида растворяют в 20 мл хлороформа в 100 мл колбе. Полученный таким образом раствор выпаривают до тех пор, пока не получится липидная пленка, которую затем сушат в вакууме 3 ч. Липидную пленку гидратируют 10 мл воды при 30 С в течение 3 ч, получая суспензиюMLV. Проводят экструзию суспензии MLV 10 раз через поликарбонатный фильтр с размером пор 200 нм. Образуют комплекс полученной таким образом юниламеллярной липосомной суспензии с полинуклеотидом или лекарственным средством и используют его для биологических исследований.f). Испытание физической стабильности липосом. Физическую стабильность липосомных суспензий тестируют с помощью турбидиметрии в течение периода 30 дней. Для каждой испытываемой суспензии выполняют измерение поглощения при 600 нм в течение определенных интервалов времени. Среднее значение поглощения, измеренное в момент времени 0, остается постоянным для всех исследуемых препаратов. Рассматриваемые молекулы демонстрируют подходящие значения в течение рассматриваемых периодов времени. Суспензии MLV и SUV липосом можно получить комбинированием соединений данного изобретения с липидами-помощниками, такими как холестерин,1-пальмитоил-2 олеоилфосфатидилхолин (РОРС) или диолеилфосфатидилхолин (DOPE). Соединения объединяют с липидамипомощниками для получения липосом с более стабильными мембранами. Далее в разделе,описывающем получение липосом, приведен 21 пример получения, в котором соединение изобретения объединяют с липидом-помощником,таким как холестерин или РОРС. Примеры получения липосом для доставки лекарств Пример 10. Получение MLV липосом таксол-SТ 983 (1:40). 20 мг (0,0234 ммоль) таксола и 556 мг(0,9417 ммоль) ST 983 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью вакуумного насоса добавляют к липидной пленке 20 мл трет-бутилового спирта и полученный таким образом раствор делят на 19 фракций, которые сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Каждая фракция твердого вещества содержит таксол (1,05 мг) и ST 983 (29,2 мг). Для получения конечной липосомной суспензии лиофилизованный продукт гидратируют во время использования водой (450 мкл) или другим физиологическим раствором, перемешивают в течение 10 мин и оставляют в течение 30 мин для завершения процесса набухания (гидратации). Получают MLV липосомы. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 800 нм и 20 С в течение 20 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Исследование химической стабильности таксола в препарате. Химическую стабильность таксола исследуют методом ВЭЖХ. Условия хроматографии следующие: Колонка: Bondapack C-18 Элюент: ацетонитрил:вода = 70:30 Детектор УФ-VIS: 227 нм Скорость потока: 1 мл/мин Время удерживания: 4,5 мин Концентрация таксола, определенная относительно стандарта, составляет 2,13 мг/мл. Процентное содержание инкапсулированного таксола составляет 98%. Пример 11. Получение SUV липосом таксол-ST 983. 20 мг (0,0234 ммоль) таксола и 556 мг(0,9417 ммоль) ST 983 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. 22 После удаления последних следов хлороформа с помощью высоковакуумного насоса добавляют к липидной пленке 20 мл третбутилового спирта и полученный таким образом раствор делят на 19 фракций, которые сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Каждая фракция твердого вещества содержит таксол (1,05 мг) и ST 983 (29,2 мг). Для получения конечной суспензии SUV липосом лиофилизованный продукт, гидратированный раствором PBS (1 мл), обрабатывают ультразвуком в течение 20 мин при 0 С. Затем проводят фильтрование через 400 нм фильтр для удаления следов титана, выделяемого датчиком ультразвука. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 800 нм и 20 С в течение 20 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Исследование химической стабильности таксола в препарате. Химическую стабильность таксола исследуют методом ВЭЖХ. Условия хроматографии следующие: Колонка: Bondapack C-18 Элюент: ацетонитрил:вода = 70:30 Детектор УФ-VIS: 227 нм Скорость потока: 1 мл/мин Время удерживания: 4,5 мин ВЭЖХ-анализ липосомной суспензии SUV дает такие же результаты, как для соответствующей липосомной суспензии MLV, и в данном случае также процент инкапсулированного таксола составляет 98%. ВЭЖХ-анализ, повторенный через 24 ч, не обнаруживает новых пиков, отличных от пика таксола, указывая на стабильность активного ингредиента. Пример 12. Получение липосом таксол-ST 983-холестерин (1:15). Липосомы данного типа готовят для получения комплексов с более стабильными мембранами. 6 мг (0,0101 ммоль) таксола, 62,2 мг (0,105 ммоль) ST 983 и 40 мг холестерина растворяют в 10 мл хлороформа. Полученный таким образом раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью высоковакуумного насоса добавляют к липидной пленке 6,3 мл третбутилового спирта и полученный таким образом раствор делят на 5 фракций, которые сразу замораживают при -70 С жидким азотом и лио 23 филизуют в течение 24 ч. Каждая фракция твердого вещества содержит таксол (1,2 мг), ST 983(12,44 мг) и холестерин (8 мг). Для получения конечной липосомной суспензии лиофилизованный продукт гидратируют во время использования водой (1000 мкл) или другими физиологическими растворами, перемешивают 10 мин и оставляют стоять в течение 30 мин для завершения процесса набухания(гидратации). Получают MLV липосомы. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 800 нм и 20 С в течение 6 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Пример 13. Получение SUV липосом таксол-ST 772 (1:70). 20 мг (0,0234 ммоль) таксола и 1485 мг(1,638 ммоль) ST 772 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью высоковакуумного насоса добавляют к липидной пленке 20 мл третбутилового спирта. Для получения прозрачного раствора его нагревают до 60 С. Данный раствор сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Для получения конечной липосомной суспензии SUV на лиофилизованный продукт, гидратированный раствором PBS (20 мл), воздействуют ультразвуком в течение 20 мин при 0 С. Затем проводят фильтрование через 400 нм фильтр для удаления следов титана, выделяемого датчиком ультразвука. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 800 нм и 20 С в течение 6 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Пример 14. Получение MLV липосом СРТ 83-ST 983 (1:40). 6,3 мг (0,0168 ммоль) СРТ 83 (7 карбонитрилкамптотецин, описанный в WO 97/31003) и 400 мг (0,667 ммоль) ST 983 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью вакуумного насоса добавля 004459 24 ют к липидной пленке 26 мл трет-бутилового спирта и полученный таким образом раствор делят на 12 фракций, которые сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Каждая фракция твердого вещества содержит СРТ 83 (0,525 мг) и ST 983 (33,33 мг). Для получения конечной липосомной суспензии лиофилизованный продукт гидратируют во время использования водой (1000 мкл) или другими физиологическими растворами и перемешивают в течение 10 мин. Получают MLV липосомы. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 800 нм и 20 С в течение 20 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Исследование химической стабильности СРТ 83 в препарате. Химическую стабильность СРТ 83 исследуют методом ВЭЖХ. Условия хроматографии следующие: Колонка: Supelcosil LC-ABZ Элюент: фосфатный буфер 20 мкМ:метанол = 40:60, рН=7,3 Детектор УФ-VIS: 360 нм Скорость потока: 1 мл/мин Время удерживания: 4,033 мин Концентрация СРТ 83, определяемая относительно стандарта, составляет 0,502 мг/мл. Процент инкапсулированного СРТ 83 составляет 99%. Пример 15. Получение SUV липосом СРТ 83-ST 983 (1:40). 6,3 мг (0,0168 ммоль) СРТ 83 и 400 мг(0,667 ммоль) ST 983 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью высоковакуумного насоса добавляют к липидной пленке 26 мл третбутилового спирта и полученный таким образом раствор делят на 12 фракций, которые сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Каждая фракция твердого вещества содержит СРТ 83 (0,525 мг) и ST 983 (33,33 мг). Для получения конечной липосомной суспензии SUV на лиофилизованный продукт, гидратированный водой (1000 мкл), воздействуют ультразвуком в течение 40 мин при 0 С. Затем проводят фильтрование через 400 нм фильтр для удаления следов титана, выделяемого датчиком ультразвука. 25 Исследование химической стабильности СРТ 83 в препарате. Химическую стабильность СРТ 83 исследуют методом ВЭЖХ. Условия хроматографии следующие: Колонка: Supelcosil LC-ABZ Элюент: фосфатный буфер 20 мкМ:метанол = 40:60, рН=7,3 Детектор УФ-VIS: 360 нм Скорость потока: 1 мл/мин Время удерживания: 4,033 мин Концентрация СРТ 83, определяемая относительно стандарта, составляет 0,3 мг/мл. Процент инкапсулированного СРТ 83 составляет 59%. ВЭЖХ-анализ, повторенный через 24 ч, не обнаруживает новых пиков, отличных от пика СРТ 83, указывая на стабильность данного соединения. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 600 нм и 20 С в течение 20 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Пример 16. Получение MLV липосом СРТ 184-ST 983 (1:40). 7,29 мг (0,0168 ммоль) СРТ 184 и 400 мг(0,667 ммоль) ST 983 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью вакуумного насоса добавляют к липидной пленке 26 мл трет-бутилового спирта и полученный таким образом раствор делят на 12 фракций, которые сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Каждая фракция твердого вещества содержит СРТ 184 (0,607 мг) и ST 983(33,33 мг). Для получения конечной липосомной суспензии лиофилизованный продукт во время использования гидратируют водой (1000 мкл) или другими физиологическими растворами и перемешивают в течение 10 мин. Получают MLV липосомы. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 600 нм и 20 С в течение 20 ч. Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. Исследование химической стабильности СРТ 184 в препарате. 26 Химическую стабильность СРТ 184 исследуют методом ВЭЖХ. Условия хроматографии следующие: Колонка: Supelcosil LC-ABZ Элюент: фосфатный буфер 20 мкМ:метанол = 40:60, рН=7,3 Детектор УФ-VIS: 360 нм Скорость потока: 1 мл/мин Время удерживания: 25,5 мин Концентрация СРТ 184, определяемая относительно стандарта, составляет 0,600 мг/мл. Процент инкапсулированного СРТ 184 составляет 99%. Пример 17. Получение SUV липосом СРТ 184-ST 983 (1:40). 7,29 мг (0,0168 ммоль) СРТ 184 и 400 мг(0,667 ммоль) ST 983 растворяют в 20 мл хлороформа. Раствор концентрируют до тех пор, пока на поверхности стеклянной колбы не получится липидная пленка. После удаления последних следов хлороформа с помощью высоковакуумного насоса добавляют к липидной пленке 26 мл третбутилового спирта и полученный таким образом раствор делят на 12 фракций, которые сразу замораживают при -70 С жидким азотом и лиофилизуют в течение 24 ч. Каждая фракция твердого вещества содержит СРТ 184 (0,607 мг) иST 983 (33,33 мг). Для получения конечной липосомной суспензии SUV лиофилизованный продукт, гидратированный водой (1000 мкл), воздействуют ультразвуком в течение 40 мин при 0 С. Затем проводят фильтрование через 400 нм фильтр для удаления следов титана, выделяемого датчиком ультразвука. Исследование химической стабильности СРТ 184 в препарате. Химическую стабильность СРТ 184 исследуют методом ВЭЖХ. Условия хроматографии следующие: Колонка: Supelcosil LC-ABZ Элюент: фосфатный буфер 20 мкМ:метанол = 40:60, рН=7,3 Детектор УФ-VIS: 360 нм Скорость потока: 1 мл/мин Время удерживания: 25,5 мин Концентрация СРТ 184, определенная относительно стандарта, составляет 0,36 мг/мл. Процент инкапсулированного СРТ 184 составляет 70%. ВЭЖХ-анализ, повторенный через 24 ч, не обнаруживает новых пиков, отличных от СРТ 184, указывая на стабильность активного ингредиента. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии с регистрацией TDC (кривая движения во времени) при 600 нм и 20 С в течение 20 ч. 27 Регистрируют постоянную мутность, показатель стабильности препарата, без каких-либо явлений осаждения. В следующих примерах липосомы получают, используя липиды-помощники и/или криозащитные агенты. Пример 18. Получение липосом СРТ 184ST 983. В 2 л колбу к 20 мг СРТ 184 и 600 мг ST 983 добавляют 100 мл метилхлороформа и смесь слегка подогревают до полного растворения. Полученный раствор концентрируют в роторном испарителе до тех пор, пока не получится липидная пленка, которую затем сушат в течение 2 ч, используя высоковакуумный насос. Липидную пленку гидратируют раствором лактозы (6 г/300 мл воды) при 45 С и оставляют при перемешивании в роторном испарителе примерно на 2 ч. Затем воздействуют на суспензию ультразвуком в течение 2 ч, каждый цикл продолжается полчаса. После этого продукт фильтруют через 200 нм фильтр и лиофилизуют. Исследование химической стабильности СРТ 184 в препарате. Химическую стабильность СРТ 184 определяют методом ВЭЖХ. Данный продукт стабилен в течение 24 ч исследования. Исследование физической стабильности препарата. Физическую стабильность препарата исследуют методом турбидиметрии. Данный продукт стабилен в течение 24 ч исследования. Размер частиц также стабилен (среднее значение 100 нм). Пример 19. Получение липосом СРТ 184ST 983. Для получения 1 мл липосомного препарата (РОРС - 1-пальмитоил-2-олеоилфосфатидилхолин 5 мМ; ST 983 1,25 мМ; СРТ 184 0,25 мМ и трегалоза 150 мМ) применяют следующую процедуру: 0,11 мг (0,25 мкмоль) СРТ 184 растворяют в 250 мкл этилацетата, 3,79 мг (4,89 мкмоль) РОРС растворяют в 100 мкл этанола и 0,74 мг(1,25 мкмоль) ST 983 растворяют в 100 мкл этанола. Три раствора смешивают вместе и перемешивают. Растворители выпаривают на роторном испарителе при комнатной температуре и 80 мбар. Липидную пленку сушат в течение 2 ч в темноте. Суспендируют липидную пленку в 1 мл 150 мМ растворе дигидрата D(+)-трегалозы(Fluka, ВЭЖХ 99%), стерилизуют путем фильтрования через 0,22 нм фильтр и перемешивают 2 мин. Проводят экструзию суспензии 21 раз через 200 нм поликарбонатные фильтры. Экструдированную липосомную суспензию замораживают в жидком азоте и лиофилизуют в течение 2 ночей. Получают белое твердое вещество. 28 Пример 20. Получение липосом СРТ 184ST 983. Применяют методику, аналогичную методике примера 19, исключая 500 мМ трегалозу. Противораковая активность комплекса липосома ST 983-противораковый агент Липосома ST 983 показывает преобладающее накопление на легочном уровне. Данная характеристика сайт-специфичности благоприятствует ее применению на моделях легочного карциногенеза у крыс. Противораковым агентом, используемым в данном эксперименте, является таксол. Для индуцирования опухоли in vivo мышам Balb/c без анестезии делают инъекции 3105 клеток крысиной легочной карциномыM109 в 0,1 мл RPMI-1640 (Sigma) в четырехглавую бедренную мышцу правой задней лапы. Через десять дней после имплантации комплекс липосома-таксол разбавляют физиологическим раствором с фосфатным буфером+4 С, защищая от света. При использовании его разбавляют физиологическим раствором с фосфатным буфером (PBS, SIGMA) и инъецируют внутривенно в том же объеме и концентрации,как описано для таксола, транспортируемого ST 983-липосомами. Кремофор приготавливают разбавлением 1:1 этиловым спиртом. Приведены введения для семи последовательных дней, начиная с 10 дня после инокуляции опухоли. Животных держат под наблюдением вплоть до 17 дня после инокуляции и умерщвляют путем шейного смещения, их легкие удаляют для определения количества метастаз. Для детектирования метастаз окрашивают легкие инкубированием их в течение 10 дней в 5 мл раствора Боуина, состоящем из 71% насыщенного раствора пикриновой кислоты, 4,8% ледяной уксусной кислоты (Merck) и 24% 10% формальдегида (Fluka). В конце периода инкубации в растворе Боуина подсчитывают количество метастаз. По сравнению с необработанными контрольными мышами транспортируемый кремофором таксол не обнаруживает снижения легочных метастаз, хотя в последнем случае они меньше, чем метастазы необработанных контрольных животных, тогда как таксол в комплексе с ST 983-липосомами дает существенное снижение как количества, так и размеров легочных метастаз. Статистический анализ данных по количеству легочных метастаз проводят с использова 29 нием непараметрических тестов Манн-Уитни для непарных данных. Ниже в табл. 1 представлены полученные результаты. Таблица 1 Легочные метастазы на 17 день после инокуляции мышам BALB/c опухоли М 109 после обработки таксолом и таксол/SТ 983-липосома Метастазы Метастазы Группа Средн. станд. откл. размер Контроль 2112 М Таксол 229In vitro испытания на цитотоксичность. Исследования токсичности проводят на клетках HeLa и M109 на 96-луночных планшетах. В день после посева клетки обрабатывают исследуемыми молекулами в течение следующих 48 ч. Затем клетки промывают PBS и оставляют в обычных условиях культивирования на 48 ч. После удаления питательной среды клетки инкубируют на льду с 16% ТСА, промывают 3 раза в Н 2O, обрабатывают в течение 30 мин сульфородамином В (SRB) в 1% уксусной кислоте, промывают 3 раза в одной 1% уксусной кислоте, инкубируют 20 мин в 10 мМ TRIS (рН 10,5) и, наконец, снимают показания при 540 нм. 30 Испытания на цитотоксичность с СРТ 83.In vitro исследования цитотоксичности с СРТ 83 проводят с целью оценки цитотоксичности противоракового агента в комплексе с липосомами, в качестве предварительного указания эффективного действия. Для оценки способности липосом транспортировать СРТ 83 в клетки M109 in vitro применяют описанный выше тест с сульфородамином В. Кроме того, оценивают также цитотоксичность СРТ 83, растворенного в диметилсульфоксиде (ДМСО), по сравнению с цитотоксичностью тех же молекул в комплексе с ST 983 липосомами. В исследованиях цитотоксичности используют комплекс липосома-СРТ 83 в концентрациях, указанных здесь ниже в табл. 2.1, 2.2 и 2.3,как в SUV, так и в MLV конфигурациях. Используют молярное отношение липосома:СРТ 83 = 40:1. Приведенные здесь ниже в табл. 2.1, 2.2 и 2.3 средние значения для комплексов ST 983CPT 83 в обеих конфигурациях SUV и MLV показывают, что ST 983-липосома способна транспортировать СРТ 83 почти таким же образом как ДМСО, показывая уровни цитотоксичности того же порядка. Таблица 2.1 Цитотоксичность (SRB) SТ 983 SUV-CPT 83 Концентрации в мкМ Контроль 1,3 0,13 0,013 0,911 0,294 0,705 0,908 0,745 0,198 0,525 0,821 0,884 0,204 0,801 0,906 0,833 0,25 0,748 0,856 0,854 0,254 0,778 0,867 0,793 0,231 0,739 0,802 0,792 0,193 0,602 0,827 0,901 0,248 0,69 0,904 Среднее 0,839125 0,352444 0,635333 0,767111 Ст. откл. 0,060645 0,034513 0,092925 0,042054 Приведенные в таблице значения относятся к оптической плотности при 540 нм. Таблица 2.2 Цитотоксичность (SRB) ST 983 MLV-CPT 83 Концентрации в мкМ Контроль 1,3 0,13 0,013 0,895 0,038 0,04 0,095 0,82 0,038 0,046 0,109 0,896 0,041 0,049 0,128 0,847 0,041 0,042 0,105 0,863 0,041 0,053 0,111 0,794 0,043 0,041 0,073 0,829 0,039 0,044 0,08 0,893 0,041 0,044 0,064 Контроль 0,854625 0,04025 0,044875 0,095625 Ст. откл. 0,038682 0,001753 0,004357 0,021738 Приведенные в таблице значения относятся к оптической плотности при 540 нм. Цитотоксичность (SRB) ДМСО-СРТ 83 Концентрации в мкМ Контроль 13 1,3 0,13 0,898 0,281 0,33 0,406 0,774 0,267 0,302 0,407 0,857 0,3 0,285 0,57 0,787 0,286 0,287 0,383 0,808 0,285 0,318 0,474 0,745 0,288 0,317 0,467 0,775 0,312 0,328 0,429 0,864 0,318 0,305 0,421 Среднее 0,8135 0,292125 0,309 0,444625 Ст. откл. 0,053519 0,016848 0,017205 0,059269 Приведенные в таблице значения относятся к оптической плотности при 540 нм. Биологическая активность комплекса ST 983 липосома-СРТ 184. Исследуют биологическую активность липосом примера 18 (ниже обозначена как липосома А) и примера 20 (ниже обозначена как липосома В). Токсичность у здоровых мышей. Липосомы А и В вводили перорально,внутривенно, сравнивая со свободным СРТ 184,в дозе 1,2 мг/кг согласно схеме q4dx4. Две липосомы не оказывали существенного действия на вес тела, легких, селезенки и почек. Внутривенное введение липосом В и пероральное введение липосом А воздействует на вес тимуса аналогично свободному СРТ 184. Внутривенное введение липосом А оказывает лишь минимальное действие. Гематологические параметры не показывали существенных изменений через 24 ч с обеими липосомами. Внутривенное введение липосом А согласно схеме qd5 дает токсичность, сравнимую с токсичностью свободного СРТ 184. Легочный тропизм липосом. Липосомы А и В показали преобладающее накопление на легочном уровне. Липосомы вводили внутривенно 1,2 мг/кг. Свободный СРТ 184 вводили перорально, 1,2 мг/кг в ДМСО. Животных, здоровых мышей, умерщвляют через 24 ч после последнего введения. Легкие вырезают и замораживают в жидком азоте. Сразу после оттаивания органы объединяют и гомогенизируют в смеси 0,1% уксусная кислота/ацетонитрил = 1:5. Гомогенаты делят на три аликвоты, к двум из которых добавляют СРТ 184 для расчета выхода. Три образца центрифугируют при 16000g в течение 5 мин. Супернатанты собирают и экстрагируют дихлорметаном. Органическую фазу сушат с использованием спидвака и остаток повторно растворяют в ацетонитриле, чтобы иметь количество, соответствующее одному животному, в 50 мкл для загрузки в ВЭЖХ. ВЭЖХ проводят на WatersSymmetry С 18 3,5 мкм (4,67,5 мм). Детектором служит флуориметр Merck, возбуждение при 370 нм и излучение при 510 нм. Элюентом является изократическая смесь вода/ацетонитрил = 60:40. Объем образца 50 мкл. Выход СРТ 184 составляет около 70%. Как показано на фиг. 3,липосомы обоих типов: и А и В - дают уровень накопления СРТ 184 выше, чем свободный СРТ 184 в ДМСО. Доставка генов Получение комплекса липосома-ДНК. Липосомы и плазмидную ДНК отдельно разбавляют подходящим образом в PBS. Затем добавляют к липосомам ДНК и комплекс липосома-ДНК оставляют примерно на 30 мин при 4 С для облегчения образования стабильного взаимодействия липосома-ДНК. В экспериментах in vitro в качестве сравнительного катионного липида используют 1,2 диолеоилокси-3-триметиламмонийпропан(DOTAP); 2,5 мкг плазмидной ДНК используют на 2105 клеток HeLa, а концетрация липосом составляет 9 мкМ. В экспериментах in vivo в качестве сравнительных катионных липидов используют как[2,3-(диолеоил)пропил] триметиламмоний (DOTMA). Молярные соотношения, определенные в результатах, относятся к наномолярным концентрациям соответствующих катионных липидов на мг ДНК. В in vivo экспериментах по трансфекции используют 25 мкг плазмидной ДНК на животное. Использованная в данных экспериментах плазмида pCMVluc содержит кДНК гена люциферазы под транскрибционным контролем цитомегаловирусного (CMV) промотора. Количественное определение люциферазной активности. Люцеферазную активность белков в клетках и тканях определяли, с использованием набора Boehringer Mannheim (cat no. 1669 893). Клетки промывают 3 раза в PBS, а затем удаляют с планшета скребком в лизисный буфер(100 мМ фосфат калия, рН 7,8, 1 мМ дитиотреитол - DTT) и подвергают трем последовательным циклам замораживания и оттаивания. После центрифугирования в 1,5 мл пробирках Эппендорфа супернатанты используют для люминесцентного исследования не более чем через 5 ч после экстракции белков. Измерения люми 33 несцентного излучения выполняют, используя люминометр при 562 нм. После первого замораживания в жидком N2 с последующим мелким измельчением в порошок ткани повторно суспендируют в лизисном буфере и инкубируют в течение 5-10 мин на льду. Затем образцы центрифугируют в 2 мл пробирках Эппендорфа и исследуют супернатант на люциферазную активность. Дот-блот анализ. Клеточную ДНК экстрагируют согласно процедуре щелочного лизиса, описанной Sanbrook, Fritsch and Maniatis в Molecular Cloning,1989. 5 мкл экстрагированной из клеток ДНК предварительно абсорбируют на нейлоновых фильтрах (Boehringer), используя прибор Biorad для дот-блот анализа. Затем проводят предварительную гибридизацию фильтров в течение 4 ч при 65 С раствором, содержащим 0,5 М пирофосфат натрия (NaPi), 1 мМ EDTA, 7% SDS. Зонд, меченый 32 Р(альфа), приготавливают с использованием ДНК плазмиды pCMVluc в качестве матрицы и случайным образом инициированного набора Amersham Kit. Гибридизацию фильтра проводят в том же буфере предварительной гибридизации, в течение 12 ч при 42 С,используя 1106 СРМ/мл. Затем фильтр 3 раза по 10 мин промывают при 65 С в буфере, содержащем 40 мМ NaPi, 1% SDS. Авторадиографический анализ выполняют с помощью фосфорного визуализатора, который использует фосфофорные экраны, активированные бетаизлучением, с которых, производя считывание,и осуществляют количественные определения с помощью фотоумножительной системы в сочетании с программой анализа изображения. Денситометрический дот-блот анализ выполняют,используя программу анализа изображения IPLabGel. Исследование трансфекции плазмидной ДНК. Проведен ряд исследований in vitro и invivo по трансфекции плазмидной ДНК. Оба вещества DOTAP и DOTMA используют в качестве сравнительных катионных липидов, способность к трансфекции которых достаточно охарактеризована и описана Abkenet etal., в Proc. Natl. Acad. Sci. USA 1993, 90, 6518. В экспериментах in vivo анализируют разные молярные соотношения катионных липидов и плазмидной ДНК с целью определения активности катионных липидов и соответствующих наиболее эффективных концентраций для переноса генов. Способность к трансфекции различных липосом оценивают in vitro и in vivo, используя люцеферазный генный транспортер,содержащийся в плазмиде pCMVluc, активность которого для простоты количественного определения выражена в относительных единицах люминесценции (RLU) (описано ранее). В качестве альтернативы эффективность трансфекции ряда катионных липосом оценивают посредством денситометрического анализа(фосфорный визуализатор) образцов ДНК, экстрагированных из трансфицированных клеток,предварительно абсорбированных на нитроцеллюлозных фильтрах (дот-блот) и гибридизованных маркерами 32 Р-меченой плазмидной ДНК,как описано ранее. Исследование трансфекцииin vivo Зависимость эффективности in vivo трансфекции от молярного отношения ST 983 липосома:ДНК. В данном эксперименте оценивают зависимость эффективности трансфекции печени,легких и сердце от молярного соотношения ST 983-липосома:ДНК. Исследуют следующие наномолярные отношения липосом на мкг ДНК: 12:1, 24:1, 36:1 и 48:1. Группу из 6 мышей Balb/c весом примерно 20 г обрабатывают внутривенно указанными выше количествами комплекса липосома-ДНК в объемах по 200 мкл PBS и умерщвляют через 24 ч после введения комплекса. Активность люциферазы, экстрагированной из ткани легких, сердца и печени, обнаружила предпочтительное легочное распределение люциферазы при всех анализированных соотношениях. Фактически примерно 99% общей люциферазы, экстрагированной из ткани легких,сердца и печени, локализовано в легких. Наилучшим оказалось молярное отношение липосома:ДНК 12:1. Полученные результаты представлены ниже в табл. 3. Таблица 3 Эффективность in vivo трансфекции ST 983 как функция молярного отношения 35 Зависимость эффективности in vivo трансфекции от различий между ST 983 липосомными препаратами. В табл. 4 представлены величины активности люциферазы в виде относительных единиц люминесценции (RLU), экстрагированной из легких мышей Balb/c, обработанных внутривенно различными ST 983-липосомными препаратами при молярном отношении липосома:ДНК= 12:1. Полученные данные в дополнение к демонстрации способности ST 983-липосом транспортировать плазмидную ДНК in vivo со степенью эффективности более высокой и/или сравнимой с эффективностью DOTMA, показывают также степень изменчивости среди различных препаратов ST 983. Это может быть обусловлено рядом физико-химических характеристик, таких как размер липосомных пузырьков или относительные количества пузырьков по отношению к юниламеллярной (SUV) или мультиламеллярной (MLV) структуре различных препаратов ST 983. Фактически физикохимические параметры, перечисленные выше,достаточно описаны как определяющие факторы в достижении оптимальной эффективности Зависимость эффективности in vivo трансфекции от времени прединкубации липосомного комплекса ST 983-ДНК. В табл. 5 представлены относительные единицы люминесценции (RLU) экстрактов из печени, легких и сердца мышей, обработанных внутривенно ST 983-липосомами, предварительно инкубированными с плазмидной ДНК в течение 30 мин или в течение 3 ч до введения. Животные, обработанные ST 983, предварительно инкубированным в течение 3 ч с ДНК,показывают примерно 5-кратное увеличение люциферазной активности в легких и сердце по сравнению с животными, обработанными такими же липосомами, предварительно инкубированными в течение 30 мин. Данный результат предполагает, что образование стабильного комплекса липосома-ДНК зависит от времени и играет решающую роль в качестве определяющего фактора эффективности in vivo трансфекции. Таблица 5 Эффективность in vivo трансфекции ST 983 как функция времени предварительной инкубации комплекса липосома/ДНК Молярн. отн. ST Среднее RLU/мг белкаст. откл. 983:ДНК Время печень легкие сердце 3526260 87488265917 8118263 30 мин 12:1 3 ч 2497682 4225656211731 371001853 12:1 Трансфекция плазмидной ДНК в клеткиHeLa ST 772-липосомами. На фиг. 1 и 2 показана эффективность трансфекции плазмидной ДНК ST 772-липосомами в клетки HeLa. Для этой цели проводят денситометрический анализ ДНК, экстрагированной из клеток, трансфицированных ST 772 иDOTAP в качестве сравнительного катионного липида. Результаты блот-анализа обнаруживают количества плазмидной ДНК того же порядка увеличения, что и получен с DOTAP. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой n равно целому числу от 1 до 3;R обозначает водород или алканоил, линейный или разветвленный, с 2-6 атомами углерода;R1 и R2, которые могут быть одинаковыми или различными, представляют насыщенную или ненасыщенную линейную ацильную цепь с 3-20 атомами углерода; и Х- обозначает анион фармакологически приемлемой кислоты. 2. Соединение по п.1, в котором R выбран из группы, состоящей из ацетила, пропионила,бутирила, валерила и изовалерила. 3. Соединение по п.1, в котором R1 и R2 выбраны из группы гексаноил, ундеканоил, миристоил, пальмитоил или олеоил. 4. Соединение по п.1, в котором Х- выбран из группы хлорид, бромид, иодид, аспартат,кислый аспартат, цитрат, кислый цитрат, тартрат, кислый тартрат, фосфат, кислый фосфат, 37 фумарат, кислый фумарат, глицерофосфат, глюкозофосфат, лактат, малеат, кислый малеат, мукат, оротат, оксалат, кислый оксалат, сульфат,кислый сульфат, трихлорацетат, трифторацетат,метансульфонат, памоат и кислый памоат. 5. Соединение по п.1, выбранное из группы эфир L-карнитинбромида с 2-гидроксиацетил-1,3-дипальмитоилглицерином; эфир ацетил L-карнитинбромида с 2 гидроксиацетил-1,3-дипальмитоилглицерином; эфир пропионил L-карнитинбромида с 2 гидроксиацетил-1,3-дипальмитоилглицерином; эфир изобутирил L-карнитинбромида с 2 гидроксиацетил-1,3-дипальмитоилглицерином; эфир изовалерил L-карнитинбромида с 2 гидроксиацетил-1,3-дипальмитоилглицерином; эфир L-карнитинбромида с 1,3-дигексаноил-2-гидроксиацетилглицерином; эфир ацетил L-карнитинбромида с 1,3 дигексаноил-2-гидроксиацетилглицерином; эфир пропионил L-карнитинбромида с 1,3 дигексаноил-2-гидроксиацетилглицерином. 6. Применение соединения по любому из пп.1-5 для получения липосом. 7. Липосома, включающая соединение по любому из пп.1-5. 8. Липосома по п.7, дополнительно включающая липиды-помощники. 9. Липосома по п.8, в которой указанный липид-помощник выбран из группы, состоящей из холестерина, 1-пальмитоил-2-олеоилфосфатидилхолина или диолеилфосфатидилхолина. 10. Применение липосомы по любому из пп.7-9 для получения композиции, полезной для транспорта фармакологически активных соединений. 11. Применение по п.10, при котором фармакологически активное соединение является встречающейся в природе или модифицированной плазмидой или полинуклеотидом. 12. Применение по п.11, при котором плазмида или полинуклеотид полезны в генной терапии. 13. Применение по п.11, при котором плазмида или полинуклеотид кодирует пептид или белок, полезный в качестве вакцины. 14. Применение по п.10, при котором активное соединение представляет лекарственное средство. 15. Применение по п.14, при котором лекарственное средство выбрано из группы, состоящей из противораковых, антиангиогенных, 004459 38 противовирусных, антибактериальных, противогрибковых, антипротозойных агентов, соединений, активных по отношению к сердечнососудистой системе, или иммуногенных пептидов. 16. Применение по п.15, при котором указанное лекарственное средство является противораковым или антиангиогенным агентом. 17. Применение по п.16, при котором указанный противораковый агент выбран из группы, состоящей из таксола или производных камптотецина. 18. Применение по п.17, при котором указанное производное камптотецина выбрано из группы, состоящей из следующих: 7-карбонитрилкамптотецин; 7-бензилоксииминометилкамптотецин и 7-бутоксииминометилкамптотецин. 19. Применение липосом по пп.7-9 для получения косметической композиции. 20. Фармацевтическая композиция, включающая липосомы по пп.7, 8 или 9. 21. Композиция по п.20, в которой указанная липосома содержит фармакологически активное соединение. 22. Композиция по п.21, в которой активное соединение является встречающейся в природе или модифицированной плазмидой или полинуклеотидом. 23. Композиция по п.22, в которой плазмида или полинуклеотид полезны в генной терапии. 24. Композиция по п.22, в которой плазмида или полинуклеотид кодирует пептид или белок, полезный в качестве вакцины. 25. Косметическая композиция, включающая липосомы по любому из пп.7-9. 26. Композиция по п.25, в которой указанная липосома содержит вещество с косметической активностью. 27. Композиция по п.21, в которой указанное соединение выбрано из группы, состоящей из противораковых, антиангиогенных, противовирусных, антибактериальных, противогрибковых, антипротозойных агентов, соединений,активных по отношению к сердечно-сосудистой системе, или иммуногенных пептидов. 28. Композиция по пп.20-27, которую можно вводить перорально, парентерально,внутривенно,внутримышечно,подкожно,трансдермально или в виде спреев для носа или рта. Предварительные данные по содержанию в ткани (легкие) SТ 1481-липосом, введенных мышам внутривенной инъекцией (q4dx4) Мышей умерщвляли через 24 ч послепоследней обработки. Величины представляют объединенные образцы легких и выражены как средние значенияSE.
МПК / Метки
МПК: C07C 229/22, A61K 7/00
Метки: качестве, эфиры, соединений, липидов, доставки, катионных, алканоил, l-карнитинов, сложные, фармакологически, внутриклеточной, активных, полезные, l-карнитина
Код ссылки
<a href="https://eas.patents.su/21-4459-slozhnye-efiry-l-karnitina-ili-alkanoil-l-karnitinov-poleznye-v-kachestve-kationnyh-lipidov-dlya-vnutrikletochnojj-dostavki-farmakologicheski-aktivnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Сложные эфиры l-карнитина или алканоил l-карнитинов, полезные в качестве катионных липидов для внутриклеточной доставки фармакологически активных соединений</a>
Предыдущий патент: Гербицидные средства, содержащие n-[(4,6-диметоксипиримидин-2-ил) аминокарбонил]-5-метилсульфонамидометил-2-алкоксикарбонилбензолсульфонамиды
Следующий патент: Соединения индазола, фармацевтические препараты для ингибирования протеинкиназ и способы их применения
Случайный патент: Смесь производных фурфураля и 5-алкоксиметилфурфураля из сахаров и спиртов












