Производные гетероциклического амида
Формула / Реферат
1. Соединение формулы
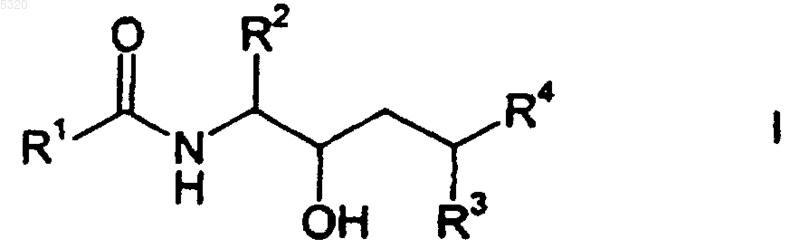
или его фармацевтически приемлемая соль, где
R1 означает хинолинил или хиноксалинил, необязательно замещенные по меньшей мере одной группой галогено;
R2 означает бензил, необязательно замещенный по меньшей мере одной группой галогено;
R3 означает группу (C1-C4)алкил или (C5-C8)циклоалкил, необязательно замещенные по меньшей мере одной группой галогено или гидрокси; и
R4 означает имидазолил, дигидроимидазолил, триазолил, оксадиазолил, оксадиазолонил, оксазолил, дигидрооксазолил, сульфонил, -C(=S)H или -(CH(=NH), необязательно замещенные по меньшей мере одной группой, независимо выбранной из -NH2, -CN, -C(=O)CH3 и -SO2CH3;
при условии, что когда R4 обозначает пятичленную гетероциклическую группу, то либо R2, либо R3 должен быть замещен функциональной группой, отличной от (C1-C6)алкила, гидрокси(C1-C6)алкила, (C1-C6)алкокси, (C1-C6)алкил-(C=O)-O-, (C1-C6)алкил-(C=O)-O-(C1-C6)алкила, амино, (C1-C6)алкиламино, [(C1-C6)алкил]2амино, амино (C1-C6)алкила, бензофурила, индолила, азациклоалкила, азабициклоалкила или бензопиперидинила.
2. Соединение по п.1, отличающееся тем, что указанное соединение имеет точную стереохимическую структуру, описываемую формулой
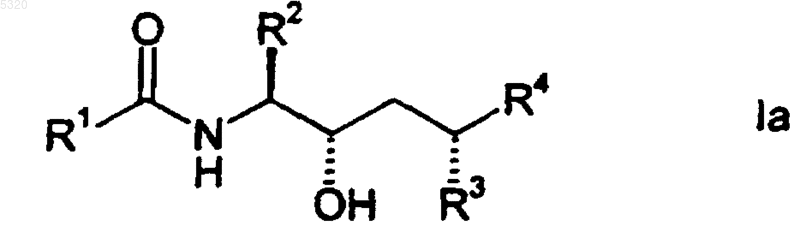
где R1, R2, R3 и R4 описаны в п.1.
3. Соединение по п.1, отличающееся тем, что R1 означает необязательно замещенный хиноксалин-2-ил, хиноксалин-6-ил, хинолин-2-ил, хинолин-3-ил, хинолин-4-ил или хинолин-6-ил.
4. Соединение по п.1, отличающееся тем, что R3 означает необязательно замещенный н-бутил, трет-бутил, изобутил, н-пентил, 2-метилпентил, циклопентил или циклогексил.
5. Соединение по п.3, отличающееся тем, что R3 означает необязательно замещенный н-бутил, трет-бутил, изобутил, н-пентил, 2-метилпентил, циклопентил или циклогексил.
6. Соединение по п.1, отличающееся тем, что R3 замещен фтором или гидроксигруппой.
7. Соединение по п.3, отличающееся тем, что R3 необязательно замещен фтором или гидроксигруппой.
8. Соединение по п.1, отличающееся тем, что R3 означает 4,4-дифторциклогексилметил, 2-фтор-2-метилбутил, изобутил или 1-гидроксициклогексил.
9. Соединение по п.3, отличающееся тем, что R3 означает 4,4-дифторциклогексилметил, 2-фтор-2-метилбутил, изобутил или 1-гидроксициклогексил.
10. Соединение по п.1, отличающееся тем, что указанное соединение представляет собой
[1(S)-(3-фторбензил)-2(S),7-дигидрокси-4(R)-(1H-имидазол-2-ил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-2(S),7-дигидрокси-4(R)-(1H-имидазол-2-ил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[7-фтор-1(S)-(3-фторбензил)-2(S)-гидрокси-4(R)-(1H-имидазол-2-ил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-7-фтор-2(S)-гидрокси-4(R)-(1H-имидазол-2-ил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-(3-фторбензил)-2(S),7-дигидрокси-7-метил-4(R)-сульфамоилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-2(S),7-дигидрокси-7-метил-4(R)-сульфамоилоктил]амид хиноксалин-2-карбоновой кислоты;
[7-фтор-1(S)-(3-фторбензил)-2(S)-гидрокси-7-метил-4(R)-сульфамоилоктил]амид хиноксалин-2-карбоновой кислоты;
(1(S)-бензил-7-фтор-2(S)-гидрокси-7-метил-4(R)-сульфамоилоктил)амид хиноксалин-2-карбоновой кислоты;
[1(S)-(3-фторбензил)-2(S),7-дигидрокси-7-метил-4(R)-метилсульфамоилоктил]амид хиноксалин-2-карбоновой кислоты;
(1(S)-бензил-2(S)-7-дигидрокси-7-метил-4(R)-метилсульфамоилоктил)амид хиноксалин-2-карбоновой кислоты;
[(S)-(3-фторбензил)-2(S),7-гидрокси-7-метил-4(R)-метилсульфамоилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-7-фтор-2(S)-гидрокси-7-метил-4(R)-метилсульфамоилоктил]амид хиноксалин-2-карбоновой кислоты;
[4(R)-(4-хлор-1H-имидазол-2-ил)-1(S)-(3-фторбензил)-2(S)-7-фторбензил)-2(S)-гидроксидигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-4(R)(4-хлор-1H-имидазол-2-ил)-2(S),-7-гидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[4(R)-(4-хлор-1H-имидазол-2-ил)-7-фтор-1(S)-(3-фторбензил)-2(S)-гидрокси-7-метил-октил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-4(R)(4-хлор-1H-имидазол-2-ил)-7-фтор-2(S)-гидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-(3-фторбензил)-4(R)-(4-фтор-1H-имидазол-2-ил)-2(S),7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[1(S)-бензил-4(R)-(4-фтор-1H-имидазол-2-ил)-2(S)-7-дигидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты;
[7-фтор-1(S)-(3-фторбензил)-4(R)-(4-фтор-1H-имидазол-2-ил)-2(S)-гидрокси-7-метил-октил]амид хиноксалин-2-карбоновой кислоты и
[1(S)-бензил-7-фтор-4(R)-(4-фтор-1H-имидазол-2-ил)-2(S)-гидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты.
11. Фармацевтическая композиция, предназначенная для лечения или профилактики заболевания или состояния, лечение или профилактику которого можно осуществлять посредством ингибирования связывания MIP-1a с рецептором CCR1 у млекопитающего, включающая эффективное для лечения или профилактики такого заболевания или состояния количество соединения по п.1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
12. Фармацевтическая композиция, предназначенная для лечения или профилактики заболевания или состояния, лечение или профилактику которого можно осуществлять посредством антагонизации рецептора CCR1 у млекопитающего, включающая эффективное для антагонизации рецептора CCR1 количество соединения по п.1 или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель.
13. Фармацевтическая композиция по п.11 или 12, отличающаяся тем, что указанное заболевание или состояние выбирают из аутоиммунных заболеваний, острого и хронического воспаления, аллергических состояний, инфекции, связанной с воспалением, вирусной инфекции, хронического бронхита, ксенотрансплантации, реакции отторжения ткани трансплантата, атеросклероза, рестеноза, ВИЧ инфекции и гранулематоза.
14. Способ лечения или профилактики заболевания или состояния, лечение или профилактику которого можно осуществлять посредством антагонизации рецептора CCR1, у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1 или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого заболевания или состояния.
15. Способ по п.14, отличающийся тем, что указанное заболевание или состояние выбирают из аутоиммунных заболеваний, острого и хронического воспаления, аллергических состояний, инфекции, связанной с воспалением, вирусной инфекции, хронического бронхита, ксенотрансплантации, реакции отторжения ткани трансплантата, атеросклероза, рестеноза, ВИЧ инфекции и гранулематоза.
Текст
005320 Предпосылки создания изобретения Настоящее изобретение относится к новым производным гексановой кислоты, способам их использования и к содержащим их фармацевтическим композициям. Соединения согласно настоящему изобретению представляют собой мощные и селективные ингибиторы связывания МIР-1 с его рецептором CCR1, обнаруженным на воспалительных и иммуномодулирующих клетках (предпочтительно на лейкоцитах и лимфоцитах). Рецептор CCR1 иногда также обозначают как рецептор CC-CKR1. Указанные соединения также ингибируют МIР-1 (и родственные хемокины, которые, как было показано, взаимодействуют с CCR1 (например RANTES и МIР-1, индуцирующие хемотаксис клеток ТНР-1 и лейкоцитов человека, и являются потенциально полезными для лечения или профилактики аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с ранним началом), воспалительное заболевание кишечника, ретробульварный неврит, псориаз, множественный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресссиндром младенцев, ишемическое повреждение при реперфузии и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекций, связанных с воспалением (таких как вирусное воспаление (включая грипп и гепатит), и синдром Гийена-Барре-Штроля), хронического бронхита, ксенотрансплантации, реакции отторжения тканей при трансплантации (хронической и острой),реакции отторжения органов (хронической и острой), атеросклероза, рестеноза, ВИЧ-инфекции (при использовании корецептора) и гранулематозных заболеваний (включая саркоидоз, лепру и туберкулез). МIР-1 и RANTES относятся к растворимым хемотактическим пептидам (хемокинам), которые продуцируются воспалительными клетками, в частности лимфоцитами CD8+, полиморфноядерными лейкоцитами (ПМЯ) и макрофагами. (J. Biol. Chem., 270 (30) 29671-29675 (1995. Указанные хемокины действуют посредством стимулирования миграции и активации ключевых воспалительных и иммуномодулирующих клеток. У пациентов с ревматоидным артритом и у пациентов с хронической реакцией отторжения трансплантата ткани обнаружены повышенные уровни хемокина в синовиальной жидкости, а у пациентов с аллергическим ринитом после воздействия аллергена - в назальном секрете (Teran, et al., J.Immunol., 1806-1812 (1996) и Kuna et al., J. Allergy Clin. Immunol. 321 (1994. Наличие антител, которые препятствуют взаимодействию хемокина/рецептора посредством нейтрализации МIР-1 или разрушения гена, непосредственно свидетельствует в пользу роли МIР-1 и RANTES в развитии заболевания посредством ограничения мобилизации моноцитов и лимфоцитов CD8+ (Smith et al., J. Immunol. 153, 4704(1994) и Cook et al., Science, 269, 1583 (1995. В совокупности указанные данные показывают, что антагонисты CCR1 могут быть эффективными при лечении некоторых иммунных заболеваний. Приведенные в настоящем описании соединения представляют собой мощные и селективные антагонисты CCR1. Краткое описание сущности изобретения Настоящее изобретение относится к соединениям формулы или их фармацевтически приемлемой соли, гдеR1 обозначает (С 2-С 9)гетероарил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из водорода, дейтерия, галогена, CN, (C1-С 6)алкила,необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси (C1-С 6)алкила,(C1-С 6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1-C6)алкокси (C1C6)алкила, НО-(С=О)-, (C1-C6)алкил-O-(С=О)-, НО-(С=О)-(C1-C6)алкила, (C1-C6)алкил-O-(С=О)-(C1C6)алкила, (C1-C6)алкил-(С=О)-O-, (C1-C6)алкил-(С=О)-О-(C1-C6)алкила, Н(О=С)-, Н(О=С)-(C1-C6)алкила, (C1C6)алкил(О=С)-, (C1-C6)алкил(O=С)-(C1-С 6)алкила, NO2, амино, (C1-C6)алкиламино, [(C1-C6)алкил]2 амино,амино(C1-C6)алкила, (С 1-С 6)алкиламино(C1-C6)алкила, [(C1-C6)алкил]2 амино (С 1-С 6)алкила, H2N-(C=O)-, (С 1 С 6)алкил-NН-(С=О)-, [(C1-C6)алкил]2N-(С=O)-, H2N-(С=O)-(C1-C6)алкила, (C1-C6)алкил-HN-(С=O)-(С 1-С 6)алкила,[(C1-C6)алкил]2N-(С=O)-(C1-C6)алкила, Н(ОС)-NH-, (C1-C6)алкил(С=O)-NH, (C1-С 6)алкил(С=O)-[NH](C1C6)алкила, (C1-C6)алкил-(С=O)-[N(C1-С 6)алкил](C1-C6)алкила, (C1-C6)алкил-S-, (C1-C6)алкил-(S=O)-, (C1C6)алкил-SO2-, (C1-C6)алкил-SO2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1-С 6)алкилHN-SO2-(C1C6)алкила, [(C1-C6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1-С 6)алкил-SO3-, фенила, (С 3-С 10)циклоалкила, (С 2-С 9)гетероциклоалкила и (С 2-С 9) гетероарила;R2 обозначает фенил-(СН 2)m-, нафтил-(СН 2)m-, (С 3-С 10)циклоалкил-(СН 2)m-, (C1-С 6)алкил или (С 2 С 3)гетероарил-(СН 2)m-, где m обозначает целое число от нуля до четырех, и каждая из указанных фенильной, нафтильной, (С 3-С 10)циклоалкильной или (С 2-С 9)гетероарильной частей в указанных фенил(СН 2)m-, нафтил-(СН 2)m-, (С 3-С 10)циклоалкил-(СН 2)m- или (С 2-С 9)гетероарил- (СН 2)m-группах может быть необязательно замещена одним или несколькими заместителями, необязательно выбираемыми из водорода, дейтерия, галогена, CN, (C1-С 6)алкила, необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси-(C1-С 6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1-C6)алкокси(C1-С 6)алкила, НО-(С=О)-, (C1-С 6)алкил-О-(С=O)-, НО-(С=O)-1 005320R3 обозначает водород, дейтерий, (C1-C10)алкил, (С 3-С 10)циклоалкил-(СН 2)n-, (С 2-С 9)гетероциклоалкил(СН 2)n-, (С 2-С 9)гетероарил-(СН 2)n- или арил-(СН 2)n-, где n обозначает целое число от нуля до шести; где указанная для R3 (C1-С 10)алкильная группа может быть необязательно замещена одним или несколькими заместителями, независимо выбираемыми из водорода, дейтерия, галогена, CN, (C1-C6)алкила,необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси- (C1-C6) алкила,(C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1-C6)алкокси (C1C6)алкила, НО-(С=О)-, (C1-C6)алкил-О-(С=O)-, НО-(С=O)-(C1-C6)алкила, (C1-C6)алкил-О-(С=O)-(C1-C6)алкила,(C1-C6)алкил-(С=O)-O-,(C1-C6)алкил-(С=O)-О-(C1-C6)алкила,Н(О=С)-,Н(О=С)-(C1-C6)алкила,(C1C6)алкил(O=С)-, (C1-C6)алкил(O=С)-(C1-C6)алкила, NO2, амино, (C1-C6)алкиламино, [(C1-C6)алкил]2 амино,амино(C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, [(C1-C6)алкил]2 амино(C1-C6)алкила, H2N-(C=O)-, (C1C6)ал-кил-NН-(С=O)-, [(C1-C6)алкил]2N-(C=O)-,H2N-(С=O)-(C1-C6)алкила,(C1-C6)алкил-HN(С=О)-(C1C6)алкила, [(C1-C6)алкил]2N-(С=O)-(C1-C6)алкила, Н(O=С)-NH-, (C1-C6)алкил (С=O)-NH, (C1-C6)алкил(С=O)[NH](C1-C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1-C6)алкила, (C1-C6)алкил-S-, (C1-C6)алкил(S=O)-, (C1C6)алкил-SО 2-, (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1-C6)алкилHN-SО 2-(C1-C6)алкила, [(C1C6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1-C6)алкил-SО 3-, фенила, (С 3-С 10)циклоалкила, (С 2-С 9)гетероциклоалкила и (С 2-С 9)гетероарила; и где любая из углерод-углеродных одинарных связей в указанном(C1-С 10)алкиле может быть необязательно заменена двойной углерод-углеродной связью; где (С 3-С 10)циклоалкильная часть в указанной для R3 (С 3-С 10)циклоалкил-(СН 2)n-группе может быть необязательно замещена от одного до трех заместителей, независимо выбираемыми из группы, состоящей из водорода, дейтерия, галогена, CN, (C1-С 6)алкила, необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси-(C1-C6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1-C6)алкокси(C1-C6)алкила, НО-(С=О)-, (C1-C6)алкил-О-(С=O)-, НО(С=O)-(C1-C6)алкила, (C1-C6)алкилО-(С=O)-(C1-C6)алкила, (C1-C6)алкил-(С=O)-O-, (C1-C6)алкил-(С=O)-О-(C1C6)алкила, Н(О=С)-, Н(О=С)-(C1-C6)алкила, (C1-C6)алкил(O=С)-, (C1-C6)алкил(O=С)-(C1-C6)алкила, NO2, амино,(C1-C6)алкиламино, [(C1-C6)алкил]2 амино, амино(C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, [(C1C6)алкил]2 амино(C1-C6)алкила, H2N-(C=O)-, (С 1-С 6)алкил-NН-(С=O)-, [(C1-C6)алкил]2N-(С=O)-, H2N(C=O)-(C1-C6)алкила, (C1-C6)алкил-HN(С=O)-(C1-C6)алкила, [(C1-C6)алкил]2N-(С=O)-(C1-C6)алкила, Н(O=С)NH-, (C1-C6)алкил(С=O)-NH, (C1-C6)алкил(С=O)-[NH](C1-C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1C6)алкила, (C1-C6)алкил-S-, (C1-C6)алкил(S=O)-, (C1-C6)алкил-SО 2-, (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2(C1-C6)алкила, (C1-C6)алкилНN-SО 2-(C1-C6)алкила, [(C1-C6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1C6)алкил-SO3-, фенила, (С 3-С 10)циклоалкила, (С 2-С 9)гетероциклоалкила и (С 2-С 9)гетероарила; где (С 2-С 9)гетероциклоалкильная часть в указанной для R3 (С 2-С 9)гетероциклоалкил-(СН 2)n-группе может содержать от одного до трех гетероатомов, независимо выбранных из азота, серы, кислорода,S(=O), SO2 или NR6, где указанная (С 2-С 9)гетероциклоалкильная часть в указанной (С 2 С 9)гетероциклоалкил-(СН 2)n-группе может быть необязательно замещена по любому из атомов углерода кольца, способному к образованию дополнительной связи, заместителем, независимо выбираемым из группы, состоящей из водорода, дейтерия, галогена, CN, (C1-C6)алкила, необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси(C1-C6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1-C6)алкокси(C1-C6)алкила, НО-(С=O)-, (C1C6)алкил-О-(С=O)-, НО-(С=О)-(C1-C6)алкила, (C1-C6)алкил-О-(С=О)-(C1-C6)алкила, (C1-C6)алкил-(С=O)O-, (C1-C6)алкил-(С=О)-О-(C1-C6)алкила, Н(О=С)-, Н(О=С)-(C1-C6)алкила, (C1-C6)алкил(О=С)-, (C1C6)алкил(О=С)-(C1-C6)алкила, NO2, амино, (C1-C6)алкиламино, [(C1-C6)алкил]2 амино, амино(C1C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, [(C1-C6)алкил]2 амино(C1-C6)алкила, H2N-(C=O)-, (С 1-Сб)алкилNН-(С=О)-, [(С 1-С 6)алкил]2N-(C=O)-, H2N-(С=O)-(C1-C6)алкила, (C1-C6)алкил-HN(С=O)-(C1-C6)алкила, [(C1C6)алкил]2N-(C=O)-(C1-C6)алкила, H(O=C)-NH-, (C1-C6)алкил(С=O)-NH, (C1-C6)алкил(С=O)-[NH](C1-C6)алкила,(C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1-C6)алкила, (C1-C6)алкил-S-, (C1-C6)алкил(S=O)-, (C1-C6)алкил-SО 2, (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1-C6)алкилНN-SО 2-(C1-C6)алкила, [(C1C6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1-C6)алкил-SО 3-, фенила, (С 3-С 10)циклоалкила, (С 2-С 9) гетероциклоалкила и (С 2-С 9)гетероарила; где (С 2-С 9)гетероарильная часть в указанной для R3 (С 2-С 9)гетероарил-(СН 2)n-группе может содержать от одного до трех гетероатомов, независимо выбираемых из азота, серы или кислорода, причем указанная (С 2-С 9)гетероарильная часть в указанной (С 2-С 9)гетероарил-(СН 2)n-группе может быть необяза-2 005320 тельно замещена по любому из атомов углерода кольца, способному к образованию дополнительной связи, заместителем, независимо выбираемым из группы, состоящей из водорода, дейтерия, галогена, CN,(C1-C6)алкила, необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси(C1-C6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1C6)алкокси (C1-C6)алкила, НО-(С=О)-, (C1-C6)алкил-О-(С=O)-, НО-(С=O)-(C1-C6)алкила, (C1-C6)алкил-О(С=O)-(C1-C6)алкила, (C1-C6)алкил-(С=O)-O-, (C1-C6)алкил-(С=O)-О-(C1-C6)алкила, Н(O=С)-, Н(О=С)-(C1C6)алкила, (C1-C6)алкил(O=С)-, (C1-C6)алкил(O=С)-(C1-C6)алкила, NO2, амино, (C1-C6)алкиламино, [(C1C6)алкил]2 амино, амино(C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, [(C1-C6)алкил]2 амино(C1C6)алкила, H2N-(C=O)-, (C1-C6)алкил-NН-(С-О)-, [(С 1-С 6)алкил]2N-(С=О)-, H2N-(C=O) -(C1-C6)алкила, (C1C6)алкил-НN(С=О)-(C1-C6)алкила, [(C1-C6)алкил]2N-(С=O)-(C1-C6)алкила, Н(O=С)-NH-, (C1-C6)алкил(С=O)-NH,(C1-C6)алкил(С=O)-[NH](C1-C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](С 1-С 6)алкила, (C1-C6)алкил-S, (C1-C6)алкил-(S=O)-, (С 1-С 6)алкил-SО 2-, (C1-C6)алкил-SO2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1C6)алкилНN-SO2-(C1-C6)алкила, [(C1-C6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1-C6)алкил-SO3-, фенила,(С 3-С 10)циклоалкила, (С 2-С 9)гетероциклоалкила и (C2-C9)гетероарила; и где указанная арильная часть в указанной для R3 арил-(СН 2)n-группе необязательно замещена фенилом или нафтилом, причем указанный фенил и нафтил могут быть необязательно замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из водорода, дейтерия, галогена, CN, (C1-С 6)алкила, необязательно замещенного одним или несколькими атомами фтора,гидрокси, гидрокси(C1-C6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1-C6)алкокси(C1-C6)алкила, НО-(C=O)-, (C1-C6)алкил-O-(С=O)-, НО-(С=O)-(C1C6)алкила, (C1-C6)алкил-O-(С=O)-(С 1-С 6)алкила, (C1-C6)алкил-(С=O)-O, (С 1-С 6)алкил-(С=O)-О-(C1C6)алкила, Н(O=С)-, Н(О=С)-(C1-C6)алкила, (C1-C6)алкил(O=С)-, (C1-C6)алкил (O=С)-(C1-C6)алкила, NO2,амино, (C1-C6)алкиламино, [(C1-C6)алкил]2 амино, амино(C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила,[(C1-C6)алкил]2 амино(C1-C6)алкила, H2N-(C=O)-, (С 1-С 6)алкил-NН-(С=O)-, [(C1-C6)алкил]2N-(C=O)-, H2N(С=O)-(C1-C6)алкила, (C1-C6)алкил-HN(С=O)-(C1-C6)алкила, [(C1-C6)алкил]2N-(C=O)-(C1-C6)алкила, H(O=C)-NH-,(C1-C6)алкил(С=O)-NH, (C1-C6)алкил(С=O)-[NH](C1-C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1C6)алкила, (C1-C6)алкил-S-, (C1-C6)алкил-(S=O)-, (С 1-С 6)алкил-SО 2- (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2(C1-C6)алкила, (C1-C6)алкилНN-SО 2-(C1-C6)алкила, [(C1-C6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1-C6)алкилSО 3-, фенила, (С 3-С 10)циклоалкила, (С 2-С 9)гетероциклоалкила и (С 2-С 9)гетероарила; или R3 и атом углерода, к которому он присоединен, образуют пяти-семичленное карбоциклическое кольцо, причем любой атом углерода в указанном пятичленном карбоциклическом кольце может быть необязательно замещен заместителем, выбираемым из группы, состоящей из водорода, дейтерия, галогена, CN, (C1-C6)алкила, необязательно замещенного одним или несколькими атомами фтора (предпочтительно от одного до трех атомов фтора), гидрокси, гидрокси(С 1-С 6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора (предпочтительно от одного до трех атомов фтора),(C1-C6)алкокси (C1-C6)алкила, НО-(С=О)-, (C1-C6)алкил-О-(С=O)-, НО-(С=O)-(C1-C6)алкила, (C1C6)алкил-О-(С=O)-(C1-C6)алкила, (C1-C6)алкил-(С=O)-O-, (C1-C6)алкил-(С=O)-О-(C1-C6)алкила, Н(O=С)-,Н(O=С)-(C1-C6)алкила, (C1-C6)алкил(O=С)-, (C1-C6)алкил(O=С)-(C1-C6)алкила, NO2, амино, (C1C6)алкиламино, [(C1-C6)алкил]2 амино, амино (C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, [(C1C6)алкил]2 амино(C1-C6)алкила, H2N-(C=O)-, (С 1-С 6)алкил-NН-(С=O)-, [(C1-C6)алкил]2N-(C=O)-, H2N-(С=O)-(С 1 С 6)алкила, (C1-C6)алкил-HN(С=O)-(С 1-С 6)алкила, [(C1-C6)алкил]2N-(C=O)-(C1-C6)алкила, H(O=C)-NH-, (C1 С 6)алкил (С=O)-NH, (C1-C6)алкил(С=O)-[NH](C1-C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1-C6)алкила,(C1-C6)алкил-S-, (C1-C6)алкил (S=O)-, (C1-C6)алкил-SO2-, (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1-C6)алкилНN-SО 2-(C1-C6)алкила, [(С 1-С 6)алкил]2N-SO2-(C1-C6)алкила, CF3SO3-, (C1-C6)алкил-SO3-,фенила, (С 3-С 10)циклоалкила, (С 2-C9)гетероциклоалкила и (С 2-С 9)гетероарила; причем одна из углеродуглеродных связей в указанном пяти-семичленном карбоциклическом кольце может быть необязательно сконденсирована с необязательно замещенным фенильным кольцом, где указанные заместители могут быть необязательно выбраны из водорода, дейтерия, галогена, CN, (C1-С 6) алкила, необязательно замещенного одним или несколькими атомами фтора (предпочтительно от одного до трех атомов фтора),гидрокси, гидрокси- (C1-C6)алкила, (C1-C6)алкокси, необязательно замещенного одним или несколькими атомами фтора (предпочтительно от одного до трех атомов фтора), (C1-C6)алкокси(C1-C6)алкила, НО(С=О)-, (C1-C6)алкил-О-(С=O)-, НО-(С=О)-(C1-C6)алкила, (C1-C6)алкил-О-(С=O)-(C1-C6)алкила, (C1C6)алкил-(С=O)-O-,(C1-C6)алкил-(С=O)-О-(C1-C6)алкила,Н(О=С)-,Н(О=С)-(C1-C6)алкила,(C1C6)алкил(O=С)-, (C1-C6)алкил(O=С)-(C1-C6)алкила, NO2, амино, (C1-C6)алкиламино, [(C1-C6)алкил]2 амино, амино(C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, [(C1-C6)алкил]2 амино (C1-C6)алкила, H2N-(C=O)-, (C1-C6)алкил-NH-(С=O)-, [(C1-C6)алкил]2N-(C=O)-, H2N-(С=O)-(C1-C6)алкила, (C1-C6)алкил-HN(С=O)-(C1-C6)алкила,[(C1-C6)алкил]2N-(С=O)-(C1-C6)алкила, Н(O=С)-NH-, (C1-C6)алкил(С=O)-NH, (C1-C6)алкил(С=O)-[NH](C1C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1-C6)алкила, (C1-C6) алкил-S-, (C1-C6)алкил(S=O)-, (С 1 С 6)алкил-SО 2-, (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2- (C1-C6)алкила, (C1-C6)алкилНN-SО 2-(C1C6)алкила,[(C1-C6)алкил]2N-SO2-(C1-C6)алкила,CF3SO3-,(C1-C6)алкил-SO3-,фенила,(С 3 С 10)циклоалкила, (С 2-С 9)гетероциклоалкила и (C2-C9)гетероарила; где R5 обозначает водород, дейтерий, (C1-C6)алкил, гидрокси, (С 1-С 6)алкокси, гидрокси (C1-C6)алкил, (C1C6)алкокси(С=O)-, (С 3-С 10)циклоалкил-(СН 2)p-, (С 2-С 9)гетероциклоалкил-(СН 2)р-, (С 2-С 9)гетероарил(СН 2)р-, фенил-(СН 2)Р- или нафтил-(СН 2)р-, где р обозначает целое число от нуля до четырех; и где указанные (С 2-С 9)гетероциклоалкильная, (С 2-С 9)гетероарильная, фенильная и нафтильная группы в указанных (С 2-С 9)гетероциклоалкил-(СН 2)Р-, (С 2-С 9)гетероарил-(СН 2)Р-, фенил-(СН 2)Р- или нафтил-(СН 2)Р- могут быть необязательно замещены по любому из атомов кольца, способных к поддержанию дополнительной связи, заместителем, выбираемым из группы, состоящей из водорода, галогена, CN, (C1C6)алкила, необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси-(C1 С 6)алкила, (C1-С 6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1 С 6)алкокси(C1-С 6)алкила, НО-(С=О)-, (C1-С 6)алкил-О-(С=O)-, НО-(С=O)-(C1-C6)алкила, (C1-C6)алкил-О-(С=O)(C1-С 6)алкила, (C1-С 6)алкил-(С=O)-O-, (C1-C6)алкил-(С=O)-О-(C1-C6)алкила, Н(О=С)-, Н(О=С)-(C1-С 6)алкила,(C1-С 6)алкил(O=С)-, (C1-С 6)алкил(O=С)-(C1-С 6)ал-кила, NO2, амино, (C1-С 6)алкиламино, [(C1-С 6)алкил]2 амино,амино(C1-С 6)алкила, (C1-С 6)алкиламино(C1-С 6)алкила, [(C1-С 6)алкил]2 амино (C1-С 6)алкила, H2N-(C=O)-, (С 1 С 6)алкил-NН-(С=O)-, [(C1-C6)алкил]2N-(C=O)-, H2N-(С=O)-(C1-С 6)алкила, (C1-С 6)алкил-HN(С=O)-(C1-С 6)алкила,[(C1-С 6)алкил]2N-(С=O)-(C1-С 6)алкила, Н(O=С)-NH, (C1-С 6)алкил(С=O)-NH, (С 1-С 6)алкил(С=O)-[NH](C1 С 6)алкила, (C1-С 6)алкил(С=O)-[N(C1-С 6)алкил](C1-С 6)алкила, (C1-С 6)алкил-S-, (C1-С 6)алкил (S=O) -, (C1-С 6)алкилSО 2-, (C1-C6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1-C6)алкилНN-SО 2-(C1-C6)алкила, [(C1C6)алкил]2N-SO2-(C1-С 6)алкила,CF3SO3-,(C1-С 6)алкил-SО 3-,фенила,(С 3-С 10)циклоалкила,(С 2 С 9)гетероциклоалкила и (С 2-С 9)гетероарила; или R5 и R6 вместе с атомом азота, к которому они присоединяются, образуют (С 2 С 9)гетероциклоалкильную группу, где любой из атомов кольца указанной (С 2-С 9)гетероциклоалкильной группы может быть необязательно замещен заместителем, выбираемым из группы, состоящей из водорода, галогена,CN, (C1-С 6)алкила, необязательно замещенного одним или несколькими атомами фтора, гидрокси, гидрокси-(C1 С 6)алкила, (C1-С 6)алкокси, необязательно замещенного одним или несколькими атомами фтора, (C1 С 6)алкокси(C1-С 6)алкила, НO-(С=О)-, (C1-C6)алкил-О-(С=O)-, НО-(С=O)-(C1-C6)алкила, (C1-C6)алкил-О-(С=O)(C1-C6)алкила, (C1-С 6)алкил-(С=O)-O-, (C1-С 6)алкил-(С=O)-О-(C1-C6)алкила, Н(О=С)-, Н(О=С)-(C1-С 6)алкила,(C1-С 6)алкил(O=С)-, (C1-С 6)алкил (O=С)-(C1-С 6)алкила, NO2, амино, (C1-С 6)алкиламино, [(C1-С 6)алкил]2 амино,амино (C1-С 6)алкила, (C1-С 6)алкиламино(C1-С 6)алкила, [(C1-С 6)алкил]2 амино(C1-С 6)алкила, H2N-(C=O)-, (C1 С 6)алкил-NН-(С=О)-, [(C1-C6)алкил]2N-(С=O)-, H2N-(С=O)-(C1-С 6)алкила, (C1-C6)алкил-HN(С=O)-(C1-C6)алкила,[(С 1-С 6)алкил]2N-(C=O)-(С 1-С 6)алкила, H(O=C)-NH-, (C1-C6)алкил(С=O)-NH, (C1-С 6)алкил(С=O)-[NH](C1C6)алкила, (C1-C6)алкил(С=O)-[N(C1-C6)алкил](C1-C6)алкила, (C1-C6)алкил-S-, (C1-C6)алкил-(S=O)-, (C1-C6)алкилSО 2-, (С 1-С 6)алкил-SО 2-NH-, H2N-SO2-, H2N-SO2-(C1-C6)алкила, (C1-C6)алкилНN-SО 2-(С 1-С 6)алкила, [(C1C6)алкил]2N-SO2-(C1-C6)алкила,CF3SO3-,(C1-C6)алкил-SО 3-,фенила,(С 3-С 10)циклоалкила,(С 2 С 9)гетероциклоалкила и (С 2-С 9)гетероарила;R6 обозначает водород, дейтерий, (C1-С 6)алкил или амино; X обозначает NR7 или S, где R7 определен так же, как R4 выше; и при условии, что когда R4 обозначает пятичленную гетероциклическую группу, то либо R2, либо R3 должен быть замещен функциональной группой, отличной от (C1-C6)алкила, гидрокси(С 1-С 6) алкила, (C1C6)алкокси, (C1-C6)алкил-(С=O)-О, (C1-C6)алкил-(С=O)-О-(C1-C6)алкила, амино, (C1-С 6)алкиламино, [(C1C6)алкил]2 амино, амино(C1-C6)алкила, бензофурила, индолила, азациклоалкила, азабициклоалкила или бензопиперидинила. Настоящее изобретение также относится к фармацевтически приемлемым кислотно-аддитивным солям соединений формулы I. Кислоты, используемые для получения фармацевтически приемлемых кислотно-аддитивных солей указанных выше основных соединений согласно настоящему изобретению,относятся к тем кислотам, которые образуют нетоксичные кислотно-аддитивные соли, например соли,содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид,нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [(т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Настоящее изобретение также относится к основно-аддитивным солям соединений формулы I. Химические основания, которые могут использоваться в качестве реагентов для получения фармацевтически приемлемых основно-аддитивных солей соединений формулы I, кислых по природе, относятся к тем основаниям, которые образуют нетоксичные основные соли с такими соединениями. Такие нетоксичные основные соли включают, не ограничиваясь ими, те из них, которые получают из таких фармакологически приемлемых катионов, как катионы щелочного металла (например, калия и натрия) и катионы щелочно-земельного металла (например, кальция и магния), аммония или водорастворимые соли присоеди-4 005320 нения амина, такого как N-метилглюкамин-(меглумин) и низший алканоламмоний, и другие основные соли с фармацевтически приемлемыми органическими аминами. Соединения согласно настоящему изобретению могут содержать олефиноподобные двойные связи. В том случае, когда такие связи присутствуют, соединения согласно настоящему изобретению существуют в цис- и транс-конфигурациях и в виде их смесей. Если особо не оговорено иное, алкильные и алкенильные группы, рассматриваемые в настоящем изобретении, а также алкильные группировки в других рассматриваемых группах (например алкокси),могут быть линейными или разветвленными, а также они могут быть циклическими (например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил) или они могут быть линейными или разветвленными и содержать циклические группировки. Если особо не оговорено иное, галоген включает фтор, хлор, бром и йод. В контексте настоящего описания (С 3-С 10)циклоалкил относится к циклоалкильным группам, содержащим ненасыщенность от нулевого до второго порядка, таким как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, 1,3-циклогексадиен, циклогептил, циклогептенил, бицикло[3.2.1]октан, норборнанил и др.(С 2-С 9)гетероциклоалкил в контексте настоящего описания относится к пирролидинилу, тетрагидрофуранилу, дигидрофуранилу, тетрагидропиранилу, пиранилу, тиопиранилу, азиридинилу, оксиранилу,метилендиоксилу, хроменилу, изоксазолидинилу, 1,3-оксазолидин-3-илу, изотиазолидинилу, 1,3 тиазолидин-3-илу, 1,2-пиразолидин-2-илу, 1,3-пиразолидин-1-илу, пиперидинилу, тиоморфолинилу, 1,2 тетра-гидротиазин-2-илу, 1,3-тетрагидротиазин-3-илу, тетрагидротиадиазинилу, морфолинилу, 1,2 тетрагидродиазин-2-илу, 1,3-тетрагидродиазин-1-илу, тетрагидроазепинилу, пиперазинилу, хроманилу и др. Для любого специалиста со средним уровнем знаний в данной области понятно, что связывание указанных (С 2-С 9)гетероциклоалкильных колец осуществляется через углерод или через sp3 гибридизированный гетероатом азота.(С 2-С 9)гетероарил в контексте настоящего описания относится к фурилу, тиенилу, тиазолилу, пиразолилу, изотиазолилу, оксазолилу, изоксазолилу, пирролилу, триазолилу, тетразолилу, имидазолилу,1,3,5-оксадиазолилу, 1,2,4-оксадиазолилу, 1,2,3-оксадиазолилу, 1,3,5-тиадиазолилу, 1,2,3-тиадиазолилу,1,2,4-тиадиа-золилу, пиридилу, пиримидилу, пиразинилу, пиридазинилу, 1,2,4-триазинилу, 1,2,3-триазинилу, 1,3,5-триазинилу, пиразоло[3,4-b]пиридинилу, циннолинилу, птеридинилу, пуринилу, 6,7 дигидро-5 Н-[1]пиридинилу, бензо[b]тиофенилу, 5,6,7,8-тетрагидрохинолин-3-илу, бензоксазолилу, бензотиазолилу, бензизотиазолилу, бензизоксазолилу, бензимидазолилу, тианафтенилу, изотианафтенилу,бензофуранилу, изобензофуранилу, изоиндолилу, индолилу, индолизинилу, индазолилу, изохинолилу,хинолилу, фталазинилу, хиноксалинилу, хиназолинилу, бензоксазинилу и др. Для любого специалиста со средним уровнем знаний в данной области понятно, что связывание указанных (С 2 С 9)гетероциклоалкильных колец осуществляется через атом углерода или через sp3 гибридизованный гетероатом азота. В случае использования термина арил, он обозначает фенил или нафтил. Соединения согласно настоящему изобретению включают все конформационные изомеры (то есть цис- и транс-изомеры) и все оптические изомеры соединений формулы I (например энантиомеры и диастереомеры), а также рацемические, диастереомерные и другие смеси таких изомеров. Предпочтительные соединения формулы I включают те из них, которые характеризуются стереохимией, показанной в формуле Iа Предпочтительные соединения формулы I включают те из них, в которых R1 обозначает необязательно замещенный пиразоло[3,4-b]пи-ридинил, циннолинил, пиридинил, 6,7-дигидро-5 Н-[1]пиридинил,бензотиазолил, индолил, пиразинил, бензоимидазолил, бензофуранил, бензо[b]тиофенил, нафталинил,хиноксалинил, изохинолинил, 5,6,7,8-тетрагидрохинолин-3-ил или хинолинил, более предпочтительно пиразоло[3,4-b]пиридин-5-ил, цинолин-4-ил, пиридин-2-ил, 6,7-дигидро-5 Н-[1]пиридин-3-ил, бензотиазол-2-ил, индол-2-ил, пиразин-2-ил, бензоимидазол-2-ил, бензофуран-2-ил, бензо[b]тиофен-2-ил, нафталин-2-ил, хиноксалин-2-ил, хиноксалин-6-ил, изохинолин-1-ил, изохинолин-3-ил, изохинолин-4-ил,5,6,7,8-тетрагидрохинолин-3-ил, хинолин-2-ил, хинолин-3-ил, хинолин-4-ил или хинолин-6-ил, и наиболее предпочтительно, хиноксалин-6-ил, хинолин-2-ил, хинолин-3-ил, хиноксалин-2-ил, хинолин-4-ил или хинолин-6-ил. Другие предпочтительные соединения формулы I включают те из них, в которых R2 обозначает необязательно замещенные фенил, бензил, нафтил, циклогексил, тиенил, тиазолил, пиридил, оксазолил, фуранил или тиофенил; где указанные заместители выбирают независимо из водорода, галогена, (С 1-С 6)алкила, трифторметила, трифторметокси, гидрокси, -С(=O)-ОН, (C1-С 6)алкокси, (C1-С 6)алкокси(С=O)-, NO2, амино, (C1 С 6)алкиламино, [(C1-С 6)алкил]2 амино, (C1-С 6)алкил-O-(С=O)-, НО-(С=O)-(C1-С 6)алкила, (C1-С 6)алкил-O(С=O)-(C1-С 6)алкила, (C1-С 6)алкил-(С=O)-O-, (C1-С 6)алкил-(С=O)-О-(C1-С 6)алкила, H2N-(C=O)-, (C1-С 6)ал-5 005320 кил-NН-(С=O)-, [(C1-С 6)алкил]2N-(C=O)-, H2N-(С=O)-(C1-С 6)алкила, (C1-С 6)алкил-HN (С=O)-(C1-С 6)алкила,[(C1-С 6)алкил]2N-(C=O)-(C1-С 6)алкила, H(O=C)-NH-, (C1-С 6)алкил (С=O)-NH, (C1-С 6)алкил(С=O)-[NH](C1 С 6)алкила, (C1-С 6)алкил(С=O)-[N(C1-С 6)алкил](C1-С 6)алкила, фенокси и бензилокси. Другие предпочтительные соединения формулы I включают те из них, в которых R3 обозначает необязательно замещенный (C1-С 6)алкил, бензил, пиранил или (С 3-С 10)циклоалкил-(СН 2)n-, где любая из углерод-углеродных одинарных связей в указанном (C1-С 10)алкиле может быть необязательно замещена двойной углерод-углеродной связью; более предпочтительно включают необязательно замещенный нбутил, изобутил, н-пентил, 3-метилбутил, 2-метилпентил, аллил, циклопентил, циклогексил или циклогептил, более предпочтительно при этом заместитель представляет собой фтор, (C1-C6)алкил или гидрокси. Примеры конкретных предпочтительных соединений формулы I включают следующие соединения:[1(S)-бензил-7-фтор-4(R)-(4-фтор-1 Н-имидазол-2-ил)-2(S)-гидрокси-7-метилоктил]амид хиноксалин-2 карбоновой кислоты. Настоящее изобретение также относится к фармацевтической композиции, предназначенной для лечения или профилактики заболевания или состояния, выбираемого из аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с ранним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, множественный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресс-синдром младенцев, ишемическое повреждение после реперфузии и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит),инфекций, связанных с воспалением (таких как вирусная инфекция (включая грипп и гепатит), и синдром Гийена-Барре-Штроля), хронического бронхита, ксенотрансплантации, реакции отторжения тканей при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции (при использовании дополнительного рецептора) и гранулематозных заболеваний (включая саркоидоз, лепру и туберкулез) у млекопитающего,-6 005320 предпочтительно у человека, включающей количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для лечения или профилактики указанного заболевания или состояния, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтической композиции, предназначенной для лечения или профилактики заболевания или состояния, лечение или профилактику которого можно проводить посредством ингибирования связывания MIP-1 с рецептором CCR1 у млекопитающего, предпочтительно у человека, включающей определенное количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для лечения или профилактики такого заболевания или состояния, и фармацевтически приемлемый носитель. Примеры таких заболеваний или состояний перечислены в предшествующем абзаце. Настоящее изобретение также относится к способу лечения или профилактики заболевания или состояния, выбираемого из аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с ранним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, множественный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресссиндром младенцев, ишемическое повреждение после реперфузии и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекций, связанных с воспалением (таких как вирусная инфекция (включая грипп и гепатит) и синдром Гийена-Барре-Штроля), хронического бронхита, ксенотрансплантации, реакции отторжения тканей при трансплантации, атеросклероза, рестеноза,ВИЧ-инфекции (при использовании корецептора) и гранулематозных заболеваний (включая саркоидоз,лепру и туберкулез) у млекопитающего, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или такой профилактике, такого количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого заболевания или состояния. Настоящее изобретение также относится к способу лечения или профилактики заболевания или состояния, лечение или профилактику которого можно проводить посредством антагонистического воздействия на рецептор CCR1 у млекопитающего, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или такой профилактике, такого количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики такого заболевания или состояния. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики заболевания или состояния, выбираемого из аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с ранним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, множественный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресс-синдром младенцев, ишемическое повреждение после реперфузии и гломерулонефрит), аллергических состояниях (таких как астма и атопический дерматит), инфекций, связанных с воспалением (таких как вирусная инфекция (включая грипп и гепатит), и синдром Гийена-БарреШтроля), хронического бронхита, ксенотрансплантации, реакции отторжения тканей при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции (при использовании корецептора) и гранулематозных заболеваний (включая саркоидоз, лепру и туберкулез) у млекопитающего, предпочтительно у человека,включающей эффективное для антагонистического действия на рецептор CCR1 количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики заболевания или состояния, лечение и профилактику которого можно проводить посредством антагонистического воздействия на рецептор CCR1 у млекопитающего, предпочтительно у человека,включающей эффективное в антагонистическом отношении для CCR1 рецептора количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения или профилактики заболевания или состояния, выбираемого из аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с ранним началом), воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, множественный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистрессмладенцев, ишемическое повреждение после реперфузии и гломерулонефрит), аллергических состояний(таких как астма и атопический дерматит), инфекций, связанных с воспалением (такой как вирусная инфекция (включая грипп и гепатит) и синдром Гийена-Барре-Штроля), хронического бронхита, ксенотрансплантации, реакции отторжения тканей после трансплантации, атеросклероза, рестеноза, ВИЧинфекции (при использовании корецептора) и гранулематозных заболеваний (включая саркоидоз, лепру и туберкулез) у млекопитающего, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или такой профилактике, эффективного для антагонистического действия на рецептор CCR1 количества соединения формулы I или его фармацевтически приемлемой соли.-7 005320 Подробное описание изобретения Приведенные ниже схемы иллюстрируют получение соединения согласно настоящему изобретению. Если особо не оговорено иное, R1, R2 R3 и R4 в реакционных схемах и в приведенном далее обсуждении определены, как указано выше. Соединения формулы I могут быть получены с помощью способов, описанных в документе WO 98/38167, который полностью включен в настоящее описание в качестве ссылки. В реакции 1 на схеме 1 спиртовое соединение формулы XII превращают в соответствующий ацетат формулы XI посредством взаимодействия XII с уксусным ангидридом в присутствии 4 диметиламинопиридина (ДМАП) и пиридина. Реакционную смесь 1 перемешивают при температуре от примерно 0 С до примерно комнатной температуры, предпочтительно примерно при 0 С, в течение периода времени от примерно 1 до примерно 3 ч, предпочтительно примерно 2 ч. В реакции 2 на схеме 1 соединение формулы XI превращают в соответствующее соединение формулы X посредством проведения реакции XII с диметилацеталем N,N-диметилформамида в присутствии полярного протонного растворителя, такого как метанол. Реакционную смесь перемешивают при температуре от примерно 40 до примерно 60 С, предпочтительно при температуре примерно 50 С, в течение периода времени от примерно 30 мин до примерно 2 ч, предпочтительно примерно 1 ч.-11 005320 В реакции 3 на схеме 1 соединение формулы X превращают в соответствующее триазольное соединение формулы IX посредством проведения реакции X с гидразином в присутствии уксусной кислоты. Реакционную смесь перемешивают при температуре от примерно 40 до примерно 60 С, предпочтительно при температуре примерно 50 С, в течение периода времени от примерно 30 мин до примерно 2 ч, предпочтительно примерно 1 ч. В реакции 4 на схеме 1 соединение формулы IX превращают в соответствующее соединение формулы II посредством удаления защитной группы от соединения IX с помощью карбоната калия в присутствии метанола при комнатной температуре в течение ночи. В реакции 1 на схеме 2 лактоновое соединение формулы XIV превращают в соответствующее гидразидное соединение формулы XIII посредством проведения реакции XIV с гидразином в полярном протонном растворителе, таком как метанол. Реакционную смесь перемешивают при комнатной температуре в течение ночи. В реакции 2 на схеме 2 гидразиновое соединение формулы XIII превращают в соответствующее 1,2,4-оксадиазольное соединение формулы III посредством проведения реакции XIII с цианогенбромидом в присутствии диоксана и воды. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение периода времени от примерно 30 мин до примерно 2 ч, предпочтительно примерно 1 ч. В реакции 3 на схеме 2 гидразидное соединение формулы XIII превращают в соответствующее соединение формулы IV посредством проведения реакции XIII с карбонилдиимидазолом в присутствии основания, такого как триэтиламин, и полярного апротонного растворителя, такого как тетрагидрофуран. Реакционную смесь перемешивают при комнатной температуре в течение периода времени от примерно 10 ч до примерно 20 ч, предпочтительно в течение ночи. В реакции 1 на схеме 3 лактоновое соединение формулы XVIII превращают в соответствующее соединение формулы XVII посредством проведения реакции XVIII с диметилацеталем аминоацетальдегида в присутствии диоксана. Реакционную смесь перемешивают в течение ночи при температуре от примерно 30 до примерно 70 С, предпочтительно при температуре примерно 50 С. В реакции 2 на схеме 3 спиртовое соединение формулы XVII превращают в соответствующее ацетатное соединение формулы XVI по методике, описанной выше для реакции 1 на схеме 1. В реакции 3 на схеме 3 соединение формулы XVI превращают в соответствующее имидазольное соединение формулы XV посредством проведения реакции XVI с ацетатом аммония в присутствии уксусной кислоты. Реакционную смесь перемешивают при температуре от примерно 105 до примерно 125 С, предпочтительно при температуре примерно 115 С, в течение периода времени от примерно 3 до примерно 5 ч, предпочтительно в течение примерно 4 ч. В реакции 4 на схеме 3 соединение формулы XV превращают в соответствующее соединение формулы V по методике, описанной выше для реакции 4 на схеме 1. В реакции 1 на схеме 4 эпоксидное соединение формулы XXI превращают в соответствующее соединение формулы XX посредством проведения реакции XXI с соединением формулы CHR3R4 в присутствии основания, такого как н-бутиллитий, и полярного апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре примерно от -78 С до примерно 0 С, предпочтительно примерно при -78 С, в течение периода времени от примерно 1 до примерно 4 ч, предпочтительно примерно 2 ч. В реакции 2 на схеме 4 соединение формулы XX превращают в соответствующее соединение формулы XIX посредством удаления защитной карбобензилоксигруппы через гидрирование XX в присутствии палладия на угле и полярного протонного растворителя, такого как этанол. Реакцию проводят при температуре от примерно 0 С до комнатной температуры, предпочтительно при комнатной температуре в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 15 ч. В реакции 3 на схеме 4 соединение формулы XIX превращают в соответствующее соединение формулы I при проведении реакции XIX с соединением формулы R1-CO-Cl в присутствии основания, такого как триэтиламин, и полярного апротонного растворителя, такого как метиленхлорид. Реакцию проводят при температуре от примерно -20 до примерно 40 С, предпочтительно примерно при 0 С, в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 2 ч. В реакции 1 на схеме 5 соединение формулы XXVI превращают в соответствующее соединение формулы XXV по методике, описанной выше для реакции 1 на схеме 1. В реакции 2 на схеме 5 амидное соединение формулы XXV превращают в тиоацетамидное соединение формулы XXIV посредством проведения реакции XXV с реактивом Лавессона ([2,4-бис(4 метоксифенил)-1,3-дитиа-2,4-дифосфэтан-2,4-дисульфид]) в присутствии полярного апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре от примерно 0 до примерно 60 С, предпочтительно при температуре 25 С, в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 5 ч. В реакции 3 на схеме 5 тиоацетамидное соединение формулы XXIV превращают в соответствующее соединение формулы XXIII вначале посредством обработки XXIV метилйодидом и затем при проведении реакции образованного соединения с аммиаком в метиловом спирте. Реакцию проводят при тем-12 005320 пературе от примерно 0 до примерно 60 С, предпочтительно при 25 С, в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 15 ч. В реакции 4 на схеме 5 соединение формулы XXIII превращают в соответствующее соединение формулы XXII взаимодействием XXIII с (a) R8 - сульфонилхлоридом, когда R7 обозначает R8S(O)2; (b) бромцианом, когда R7 обозначает циано; (с) L-N=C=O, когда R7 обозначает амид и L обозначает удаляемую группу; или (d) ацилхлоридным соединением формулы R8-CO-Cl, когда R8 обозначает R9C(O). В реакции 5 на схеме 5 соединение формулы XXII превращают в соответствующее соединение формулы VI по методике, описанной выше для реакции 1 на схеме 1. В реакции 1 на схеме 6 лактон формулы XXXII превращают в соответствующее соединение формулы XXXI при проведении реакции XXXII с основанием, таким как гидроксид лития, в присутствии смеси воды и полярного апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре от примерно 0 до примерно 60 С, предпочтительно при 25 С, в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 2 ч. В реакции 2 на схеме 6 соединение формулы XXXI превращают в соответствующее соединение формулы XXX взаимодействием XXXI с трет-бутилдиметилсилилхлоридом в присутствии имидазола и полярного протонного растворителя, такого как диметилформамид. Реакцию проводят при температуре от примерно 0 до примерно 60 С, предпочтительно при 25 С, в течение периода времени от примерно 1 дня до примерно 7 дней, предпочтительно в течение 1 дня. В реакции 3 на схеме 6 соединение формулы XXX превращают в соответствующее соединение формулы XXIX взаимодействием XXX с соединением формулы в присутствии гидрата 1-гидроксибензотриазола, 1-(3-диметиламинопропил)-3-этилкарбодиимида и полярного апротонного растворителя, такого как метиленхлорид. Реакцию проводят при температуре от примерно 0 до примерно 30 С, предпочтительно при температуре примерно 25 С, в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 25 ч. В реакции 4 на схеме 6 соединение формулы XXIX превращают в соответствующее оксазольное соединение формулы XXVII, вначале при окислении XXIX периодинановым окислителем-реактивом Десса-Мартина формулы и затем обработкой полученного соединения трифенилфосфином, триэтиламином, гексахлорэтаном и полярным апротонным растворителем, таким как метиленхлорид. Реакцию проводят при температуре от примерно 0 до примерно 40 С, предпочтительно примерно при температуре 25 С, в течение периода времени от примерно 5 до примерно 24 ч, предпочтительно в течение примерно 15 ч. В реакции 5 на схеме 6 соединение формулы XXIX превращают в соответствующее оксазолиновое соединение формулы XXVIII при обработке XXIX трифенилфосфином, гексахлорэтаном, триэтиламином и полярным апротонным растворителем, таким как метиленхлорид. Реакцию проводят при температуре от примерно 0 до примерно 40 С, предпочтительно при температуре примерно 25 С, в течение периода времени от примерно 5 до примерно 24 ч, предпочтительно в течение примерно 15 ч. В реакции 6 на схеме 6 соединение формулы XXVII превращают в соответствующее соединение формулы VII при обработке XXVII фторидом трет-бутиламмония. Реакцию проводят при температуре от примерно 0 до примерно 40 С, предпочтительно при температуре примерно 25 С, в течение периода времени от примерно 1 до примерно 24 ч, предпочтительно в течение примерно 2 ч. В реакции 7 на схеме 6 соединение формулы XXVIII превращают в соответствующее соединение формулы VIII по процедуре, описанной выше для реакции 6 на схеме 6. Если особо не оговорено иное, давление в каждой из указанных выше реакций не является решающим фактором. В основном, реакции проводят при давлении от примерно одной до примерно трех атмосфер, предпочтительно при давлении окружающей среды (примерно одна атмосфера). Соединения формулы I, которые по своей природе являются основными, способны к образованию большого числа различных солей с многочисленными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, зачастую на практике бывает желательно вначале выделить соединения формулы I из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить полученную таким образом соль снова в свободное основание обработкой щелочным реагентом, а затем превратить свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений согласно настоящему изобретению можно легко получить при обработке основного соединения-13 005320 практически эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя получают желательную твердую соль. Кислоты, которые используются для получения фармацевтически приемлемых кислотноаддитивных солей основных соединений согласно настоящему изобретению, включают те из них, которые образуют нетоксичные кислотно-аддитивные соли, например соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат или бисульфат,фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат,малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат и памоат [например, соли 1,1'-метиленбис-(2-гидрокси-3-нафтоата)]. Те соединения формулы I, которые также являются кислыми по своей природе, способны к образованию основных солей с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочного металла или щелочно-земельного металла, и в частности соли калия и натрия. Указанные соли получают с помощью традиционных методик. Химические основания, которые используются в качестве реагентов для получения фармацевтически приемлемых основно-аддитивных солей согласно настоящему изобретению, представляют собой те основания, которые образуют нетоксичные основные соли с рассматриваемыми кислыми соединениями формулы I. Указанные нетоксичные основные соли включают те из них, которые получены на основе фармакологически приемлемых катионов,таких как натрий, калий, кальций, магний и др. Указанные соли могут быть легко получены при обработке соответствующих кислых соединений водным раствором, содержащим желательные фармакологически приемлемые катионы, с последующим выпариванием досуха полученного раствора, предпочтительно под пониженным давлением. Альтернативно, они могут быть получены при смешивании растворов кислотных соединений в низших спиртах с алкоксидом желательного щелочного металла, с последующим выпариванием полученного раствора досуха тем же способом, что указан ранее. В любом случае предпочтительно использовать стехиометрические количества для гарантии полноты прохождения реакции и достижения максимального выхода продукта. Соединения формулы I и их фармацевтически приемлемые соли (обозначаемые в описании обобщенно как "активные соединения") представляют собой мощные антагонисты рецептора CCR1. Активные соединения полезны при лечении или профилактике аутоиммунных заболеваний (таких как ревматоидный артрит, диабет типа I (с ранним началом) , воспалительное заболевание кишечника, ретробульбарный неврит, псориаз, множественный склероз, ревматическая полимиалгия, увеит и васкулит), острых и хронических воспалительных состояний (таких как остеоартрит, респираторный дистресс-синдром взрослых, респираторный дистресс-синдром младенцев, ишемическое повреждение после реперфузии и гломерулонефрит), аллергических состояний (таких как астма и атопический дерматит), инфекций, связанных с воспалением (таких как вирусное воспаление (включая грипп и гепатит) и синдром ГийенаБарре-Штроля), хронического бронхита, ксенотрансплантации, реакции отторжения тканей при трансплантации, атеросклероза, рестеноза, ВИЧ-инфекции (при использовании дополнительного рецептора) и гранулематозных заболеваний (включая саркоидоз, лепру и туберкулез). Активность соединений согласно настоящему изобретению может быть оценена с использованием методик, известных специалистам в данной области техники. Примеры известных методов, используемых для определения CCR1-индуцированной миграции, содержатся в литературе (Coligan J.E., Kruisbeek,A.M., Margulies, D.H., Shevach, E.M., Strober, W. Editors: Current Protocols In Immunology, 6.12.1-6.12.3(John Wiley and Sons, NY, 1991. Ниже подробно описан один конкретный пример определения активности соединения по ингибированию миграции. Тест по определению хемотаксиса Способность соединения ингибировать хемотаксис различных хемокинов может быть оценена с использованием стандартных 48- или 96-ячеечных камер Бойдена с поликарбонатным фильтром 5 микрон. Все реагенты и смеси клеток приготовлены в стандартной культуральной среде для тканей RPM1 (BioWhitikker Inc.) с добавкой 1 мг/мл бычьего сывороточного альбумина. В общих чертах MIP-1 (Peprotech,Inc., P.O. Box 275, Rocky Hill NJ) или другие исследуемые агонисты помещают в нижние камеры аппарата Бойдена. Затем вставляют поликарбонатный фильтр и верхнюю камеру закрепляют. Количество выбранного агониста определяется таким образом, чтобы оно давало максимальный уровень хемотаксиса в данной системе (например, для МIР-1 будет адекватна концентрация 1 нМ). Затем в верхние камеры вместе с различными концентрациями исследуемого соединения могут быть введены в тройном количестве клетки ТНР-1 (АТСС TIB-202), первичные моноциты человека или первичные лимфоциты, выделенные по стандартным методикам. Делают разведения соединения по стандартной серологической методике и затем смешивают их с клетками перед введением в камеру. После инкубирования в течение подходящего периода времени при 37C (например, в течение 3,5 ч для клеток ТНР-1 и 90 мин для первичных моноцитов) камеру удаляют, клетки из верхней камеры отсасывают, верхнюю часть фильтра промакивают и определяют количество мигрировавших клеток с помощью следующего метода.-14 005320 Для клеток ТНР-1 камеру (96-ячеечный вариант, производимый компанией Neuroprobe) центрифугируют для выталкивания клеток в нижнюю камеру и подсчитывают количество клеток по калибровочной кривой по изменению цвета флуоресцеиндиацетатного красителя. Для первичных моноцитов человека или лимфоцитов фильтр может быть окрашен красителем DifQuik (American Scientific Products), и количество мигрировавших клеток определяют с помощью микроскопа. Количество клеток, мигрировавших в присутствии соединения, делят на количество клеток, мигрировавших в контрольных ячейках (без соединения). Частное представляет собой процент ингибирования под действием соединения, который используют для построения графика зависимости от концентрации использованного соединения с помощью стандартной графической методики. Затем определяют точку 50%-ного ингибирования с использованием линейной аппроксимации для всех исследованных концентраций. Линейная аппроксимация всех точек должна характеризоваться коэффициентом корреляции (R квадрат) 90% для того, чтобы рассматриваться как достоверная. Все соединения согласно настоящему изобретению, которые использовались для тестирования,имеют значение IC50 в тесте на хемотаксис менее, чем 25 мкМ. Композиции согласно настоящему изобретению могут быть приготовлены традиционным способом с использованием одного или нескольких фармацевтически приемлемых носителей. Так, активные соединения согласно настоящему изобретению могут быть введены в композицию, пригодную для перорального, трансбуккального, интраназального, парентерального (например внутривенного, внутримышечного или подкожного) или ректального введения, или в форме, приемлемой для введения ингаляцией или инсуффляцией. Активные соединения согласно настоящему изобретению могут быть также введены в композицию, пригодную для пролонгированной доставки. Для целей перорального введения фармацевтические композиции могут иметь вид, например, таблеток или капсул, приготовленных традиционными способами с использованием фармацевтически приемлемых наполнителей, таких как связующие вещества (например предварительно желированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например лактоза, микрокристаллическая целлюлоза или фосфат кальция), смазывающие агенты (например стеарат магния, тальк или силикагель), разрыхлители (например картофельный крахмал или натрий-гликоляткрахмал) или смачивающие вещества (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой с использованием известных в технике методов. Жидкие препараты для перорального введения могут иметь вид, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для последующего разведения водой или другим приемлемым носителем непосредственно перед использованием. Такие жидкие препараты могут быть приготовлены традиционными способами с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты(например, сироп сорбита, метилцеллюлоза или гидрогенизированные пищевые жиры), эмульгаторы (например лецитин или аравийская камедь), неводные носители (например миндальное масло, сложные эфиры жирных кислот или этиловый спирт) и консерванты (например метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Для целей трансбуккального введения композиция может иметь вид таблеток или леденцов, приготовленных традиционным способом. Активные соединения согласно настоящему изобретению могут быть введены в композицию, пригодную для парентерального введения инъекцией, включая использование обычных методик введения катетеров, или инфузией. Композиции для инъекций могут быть представлены в виде стандартной дозированной формы, например в виде ампул или контейнеров с множественной дозой, с добавлением консерванта. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать средства, способствующие приготовлению композиций, такие как средства, способствующие суспендированию, стабилизации и/или диспергированию. Альтернативно, активный ингредиент может иметь форму порошка для последующего разведения соответствующим носителем, например стерильной, свободной от пирогенов водой, непосредственно перед использованием. Активные соединения согласно настоящему изобретению могут быть также включены в состав ректальных композиций, таких как суппозитории или удерживающие клизмы, содержащие, например, традиционные основы для суппозитория, такие как масло какао или другие глицериды. Для целей интраназального введения или введения ингаляцией активные соединения согласно настоящему изобретению обычно доставляются в виде раствора или суспензии из контейнера с распыляющим насосом, из которого содержимое выдавливается или выталкивается пациентом, или в виде аэрозольного спрея из контейнера под давлением или из небулайзера при использовании соответствующего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого подходящего газа. В случае аэрозольного контейнера под давлением, стандартная доза может определяться с помощью клапана, позволяющего подавать отмеренное количество аэрозоля. Контейнер под давлением или небулайзер могут включать раствор или суспензию активного соединения. Капсулы и картриджи (сделанные, например, из желатина), используемые в ингаляторе или инсуффлято-15 005320 ре, могут включать в состав композиции порошковую смесь соединения согласно настоящему изобретению с соответствующей порошковой основой, такой как лактоза или крахмал. Предлагаемая доза активных соединений согласно настоящему изобретению для перорального, парентерального или трансбуккального введения среднему взрослому человеку с целью лечения указанных выше состояний (например ревматоидного артрита) составляет от 0,1 до 1000 мг активного ингредиента на стандартную дозу, которая может быть введена, например, при приеме от 1 до 4 раз в день. Аэрозольные композиции для лечения указанных выше состояний (например ревматоидного артрита) у среднего взрослого человека предпочтительно изготавливаются таким образом, чтобы каждая отмеряемая доза или впрыск аэрозоля содержала от 20 до 1000 мкг соединения согласно настоящему изобретению. Общая дневная доза употребляемого аэрозоля находится в диапазоне от 0,1 до 1000 мг. Введение может быть распределено на несколько раз в день, например на 2, 3, 4 или 8 раз, при этом каждый раз могут вводиться 1, 2 или 3 дозы. Активные агенты могут быть введены в композицию, позволяющую осуществлять пролонгированную доставку с использованием известных в технике методов. Примеры таких композиций могут быть найдены в патентах США 3 538 214, 4 060 598, 4 173 626, 3 119 742 и 3 492 397. Соединения согласно настоящему изобретению могут также применяться в сочетанной терапии вместе с другими терапевтическими средствами, такими как средства для иммуносупрессии Т-клеток,такими как циклоспорин А или FK-506, со стероидными агентами, такими как Cellcept, или с классическими противовоспалительными средствами (например с ингибиторами циклооксигеназы/липоксигеназы), такими как тенидап, аспирин, ацетаминофен, напроксен и пироксикам. Приведенные ниже примеры иллюстрируют способы получения соединений согласно настоящему изобретению. Точки плавления не корректированы. Данные ЯМР приведены в частях на миллиони относятся к сигналу дейтерия от растворителя для образца (к дейтерию хлороформа, если особо не оговорено иное). Коммерческие реагенты используются без дополнительной очистки. ТГФ обозначает тетрагидрофуран. ДМФ обозначает N,N-диметилформамид. Хроматография означает колоночную хроматографию, которую проводят на колонках с силикагелем 32-63 мм под давлением азота (флэшхроматография). Масс-спектры низкого разрешения (LRMS) записывают либо на приборе Hewlett Packard 5989 с использованием химической ионизации (аммония), либо на платформе с химической ионизацией при атмосферном давлении (APCI) типа Fisons (или Micro Mass), которая использует в качестве ионизирующего агента смесь 50/50 ацетонитрила и воды с 0,1% муравьиной кислотой. Комнатная температура или температура окружающей среды составляет 20-25 С. Все неводные реакции проводят в атмосфере азота из соображений удобства и достижения максимальных выходов. Концентрирование при пониженном давлении означает использование роторного испарителя. Названия соединений согласно настоящему изобретению указываются согласно компьютерной версии Autonom 2.0 batch-2 от производителя информационных систем Beilstein Informationssysteme GmbH (ISBN 3-89536-976-4). Пример 1. [1-(3-фторбензил)-2,7-дигидро-кси-4-(1 Н-имидазол-2-ил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты. К раствору 3-(5-2-(3-фторфенил)-1-[(хиноксалин-2-карбонил)амино]этил-2-оксотетрагидрофуран 3-ил)-1,1-диметилпропилового эфира трифторуксусной кислоты (212 мг; 0,378 ммоль) в метаноле (4 мл) добавляют диметилацеталь аминоацетальальдегида (0,375 мл; 3,44 мМ) и перемешивают в течение 14 дней. Реакционную смесь концентрируют с получением сырого продукта, который очищают хроматографией на силикагеле с получением указанного в заголовке соединения (197 мг; 91%). 3-(2,2-диметоксиэтилкарбамоил)-1-2-(3-фторфенил)-1-[(хиноксалин-2-карбонил)амино]этил-6 гидрокси-6-метилгептиловый эфир уксусной кислоты К раствору [4-(2,2-диметоксиэтилкарбамоил)-1-(3-фторбензил)-2,7-дигидрокси-7-метилоктил]амида хиноксалин-2-карбоновой кислоты (192 мг; 0,336 ммоль) в пиридине (0,6 мл) добавляют диметиламинопиридин (ДМАП) (10 мг; 0,082 ммоль) и уксусный ангидрид (0,093 мл; 0,984 ммоль). Полученный раствор перемешивают в течение 3 ч, затем разбавляют метиленхлоридом и промывают 1 М хлористоводородной кислотой. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют с получением указанного в заголовке соединения в виде белой пены (198 мг; 96%).[1-2-(3-фторфенил)-1-[(хиноксалин-2-карбонил)амино]этил-6-гидрокси-3-(1 Н-имидазол-2-ил)-6 метилгептиловый эфир уксусной кислоты К раствору 3-(2,2-диметоксиэтилкарбамоил)-1-2-(3-фторфенил)-1-[(хиноксалин-2-карбонил)амино]этил-6-гидрокси-6-метилгептилового эфира уксусной кислоты (150 мг; 0,245 ммоль) в уксусной кислоте (2 мл) добавляют ацетат аммония (1,5 г; 19,5 ммоль). Полученную смесь нагревают до 115 С в течение 3 ч, охлаждают до температуры окружающей среды и разбавляют этилацетатом. Затем раствор нейтрализуют насыщенным водным раствором бикарбоната натрия. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (22,5 мг; 17%).[1-(3-фторбензил)-2,7-дигидрокси-4-(1 Н-имидазол-2-ил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты К раствору 1-2-(3-фторфенил)-1-[(хиноксалин-2-карбонил)амино]этил-6-гидрокси-3-(1 Нимидазол-2-ил)-6-метилгептилового эфира уксусной кислоты (32 мг; 0,058 ммоль) в метаноле (1 мл) добавляют карбонат калия (100 мг; 0,724 ммоль). Полученный раствор перемешивают в течение 2 ч и затем концентрируют. Сырой продукт растворяют в смеси метиленхлорида и воды. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (32 мг; 100%). Соединения, указанные в заголовках примеров 2-15, получают по методике, аналогичной приведенной в примере 1.[1-Бензил-7-фтор-2-гидрокси-7-метил-4-(4 Н-[1,2,4]триазол-3-ил)октил]амид хиноксалин-2-карбоновой кислоты. 3-Карбамоил-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]этилгептиловый эфир уксусной кислоты К раствору(65 мг; 0,533 ммоль) и уксусный ангидрид (0,400 мл; 4,23 ммоль). Полученный раствор перемешивают в течение 2 ч, затем разбавляют метиленхлоридом и промывают 1 М хлористо-водородной кислотой. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют с получением указанного в заголовке соединения в виде белой пены (1,16 г; 100%). 3-(диметиламинометиленкарбамоил)-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]этилгептиловый эфир уксусной кислоты Раствор 3-карбамоил-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]этилгептилового эфира уксусной кислоты (522 мг; 1,03 ммоль) в диметилацетале N,N-диметилформамида (2 мл) нагревают до 50 С в течение 2 ч, охлаждают до температуры окружающей среды и разбавляют метиленхлоридом и водой. Органический слой промывают насыщенным водным раствором хлорида натрия,сушат над сульфатом натрия, фильтруют и концентрируют с получением указанного в заголовке соединения в виде белой пены (580 мг; 100%). 6-Фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]этил-3-(4 Н-[1,2,4]триазол-3 ил)гептиловый эфир уксусной кислоты К раствору 3-(диметиламинометиленкарбамоил)-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2 карбонил)амино]этилгептилового эфира уксусной кислоты (580 мг; 1,03 ммоль) в уксусной кислоте (2,5 мл) добавляют гидразин (35 мас.% в воде; 0,040 мл). Полученный раствор нагревают до 50 С в течение 4 ч, охлаждают до температуры окружающей среды, разбавляют этилацетатом и нейтрализуют насыщенным водным раствором бикарбоната натрия. Органический слой сушат над сульфатом натрия, фильтруют и концентрируют с получением указанного в заголовке соединения в виде белой пены (580 мг, 00%).[1-Бензил-7-фтор-2-гидрокси-7-метил-4-(4 Н-[1,2,4]триазол-3-ил)октил]амид хиноксалин-2-карбоновой кислоты. К раствору 6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]-этил-3-(4 Н-[1,2,4]триазол-3-ил)гептилового эфира уксусной кислоты (575 мг; 1,08 ммоль) в метаноле (10 мл) добавляют карбонат калия (276 мг; 2,00 ммоль), перемешивают в течение 5 ч и концентрируют. Сырой продукт растворяют в этилацетате и воде. Затем органический слой промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (459 мг; 87%).[1-Бензил-4-(4,5-дигидро-1 Н-имидазол-2-ил)-7-фтор-2-гидрокси-7-метилоктил]амид хиноксалин-2 карбоновой кислоты К раствору этилендиамина (0,040 мл; 0,598 ммоль) в толуоле (2 мл) при -10 С добавляют триметилалюминий (2,0 М в гексанах; 0,300 мл; 0,600 ммоль) и перемешивают в течение 15 мин. Затем добавляют раствор 1-[4-(3-фтор-3-метилбутил)-5-оксотетрагидрофуран-2-ил]-2-фенилэтиламида хиноксалин-2 карбоновой кислоты (250 мг; 0,556 ммоль) в толуоле (3 мл) и реакционную смесь нагревают до температуры окружающей среды, после чего кипятят с обратным холодильником в течение 3 ч. Далее реакционную смесь охлаждают до температуры окружающей среды и реакцию гасят путем осторожного добавления воды (1 мл). Раствор разбавляют метиленхлоридом и метанолом и затем фильтруют, промывая фильтрат метанолом. Органический материал концентрируют и сырой продукт очищают хроматографией на силикагеле с получением указанного в заголовке соединения (74 мг; 17%). Соединения, указанные в заголовках примеров 20-21, получают, следуя методике, аналогичной той,что описана в примере 19.(0,500 мл) и перемешивают в течение 18 ч. Реакционную смесь концентрируют с получением указанного в заголовке соединения (222 мг, 94%).-19 005320 К раствору (1-бензил-7-фтор-4-гидразинокарбонил-2-гидрокси-7-метилоктил]амида хиноксалин-2 карбоновой кислоты (110 мг; 0,228 ммоль) в диоксане (0,5 мл) и воде (0,5 мл) добавляют бромциан (31 мг; 0,296 ммоль) и гидрокарбонат калия (31 мг; 0,310 ммоль). Реакционную смесь нагревают до кипения с обратным холодильником в течение 1 ч и затем охлаждают до температуры окружающей среды. Смесь диоксан/вода удаляют посредством добавления бензола (5 мл) и последующего концентрирования (2 х). Оставшийся твердый материал растворяют в этилацетате и воде. Слои разделяют и водный слой экстрагируют этилацетатом. Объединенные органические фракции сушат над сульфатом натрия и концентрируют. Перекристаллизация сырого продукта с использованием смеси этилацетата, гексанов и метанола дает указанное в заголовке соединение (64 мг; 55%). Соединения, указанные в заголовках примеров 23-33, получают, следуя методике, аналогичной той,что описана в примере 22.(1-Бензил-7-фтор-2-гидрокси-7-метил-4-(5-оксо-4,5-дигидро-[1,3,4]оксадиазол-2-ил)октил] амид хиноксалин-2-карбоновой кислоты К раствору (1-бензил-7-фтор-4-гидразинокарбонил-2-гидрокси-7-метилоктил]амида хиноксалин-2 карбоновой кислоты (62 мг; 0,129 ммоль) в тетрагидрофуране (2 мл) добавляют триэтиламин (0,018 мл; 0,129 ммоль) и при 0 С добавляют карбонилдиимидазол (23 мг; 0,142 ммоль). Реакционной смеси позволяют нагреться до температуры окружающей среды и перемешивают ее в течение 20 ч, после чего разбавляют этилацетатом (10 мл) и гексаном (2 мл). Смесь промывают насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия. Органический слой сушат над сульфатом магния, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (54 мг; 82%). Соединения, указанные в заголовках примеров 35-36, получают, следуя методике, аналогичной той,что описана в примере 34.[1-Бензил-4-(4,5-дигидрооксазол-2-ил)-7-фтор-2-гидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты 2-(3-Фтор-3-метилбутил)-4-гидрокси-6-фенил-5-[(хиноксалин-2-карбонил)-амино]гексановая кислота К раствору 1-[4-(3-фтор-3-метилбутил)-5-оксотетрагидрофуран-2-ил]-2-фенилэтиламида хиноксалин-2-карбоновой кислоты (4 г; 8,90 ммоль) в тетрагидрофуране добавляют гидроксид лития (1 М в воде, 28 мл) и перемешивают в течение 2 ч. Затем реакционную смесь концентрируют и далее концентрируют из бензола (2 х) с получением указанного в заголовке соединения (4,2 г; 100%). 4-(Трет-бутилдиметилсиланилокси)-2-(3-фтор-3-метилбутил)-6-фенил-5-[(хиноксалин-2-карбонил)амино]гексановая кислота К раствору 2-(3-фтор-3-метилбутил)-4-гидрокси-6-фенил-5-[(хиноксалин-2-карбонил)амино]гексановой кислоты (1,63 г; 3,49 ммоль) в диметилформамиде (10 мл) добавляют тбутилдиметилсилилхлорид (3,2 г; 20,9 ммоль) и имидазол (2,9 г; 41,9 ммоль). Реакционную смесь перемешивают в течение 4 дней, после чего реакцию гасят метанолом и перемешивают еще в течение 0,5 ч. Раствор затем разбавляют диэтиловым эфиром и водой. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (784 мг; 39%).[1-Бензил-2-(трет-бутилдиметилсиланилокси)-7-фтор-4-(2-гидроксиэтилкарбамоил)-7-метилоктил]амид хиноксалин-2-карбоновой кислоты К раствору 4-(трет-бутилдиметилсила-нилокси)-2-(3-фтор-3-метилбутил)-6-фенил-5-[(хиноксалин 2-карбонил)амино]гексановой кислоты (515 мг; 0,885 ммоль) в метиленхлориде (9 мл) добавляют этаноламин (0,080 мл; 1,33 ммоль), 1-гидроксибензотриазол (215 мг; 1,59 ммоль), гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида (288 мг; 1,50 ммоль) и триэтиламин (0,247 мл; 1,77 ммоль). Полученный раствор перемешивают в течение 17 ч, затем разбавляют этилацетатом и промывают водой и затем насыщенным водным раствором хлорида натрия. Далее органический слой сушат над сульфатом натрия, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (343 мг; 62%).(0,045 мл; 0,320 ммоль). Реакционную смесь перемешивают в течение 2 ч и затем хроматографируют на силикагеле с получением указанного в заголовке соединения (72,5 мг; 75%).[1-Бензил-4-(4,5-дигидрооксазол-2-ил)-7-фтор-2-гидрокси-7-метилоктил]амид хиноксалин-2 карбоновой кислоты К раствору [1-бензил-2-(трет-бутилдиметилсиланилокси)-4-(4,5-дигидрооксазол-2-ил)-7-фтор-7 метилоктил]амида хиноксалин-2-карбоновой кислоты (41 мг; 0,068 ммоль) в тетрагидрофуране (0,70 мл) добавляют трис(диметиламино)сульфо(триметилсилил)дифторид (56 мг; 0,203 ммоль). Реакционную смесь перемешивают в течение 1 ч, после чего гасят реакцию метанолом и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (27,8 мг; 84%). Соединения, указанные в заголовках примеров 38-49, получают, следуя методике, аналогичной той,что описана в примере 37.[1-Бензил-2-(трет-бутилдиметилсиланилокси)-7-фтор-7-метил-4-(2-оксоэтилкарбамоил)октил]амид хиноксалин-2-карбоновой кислоты К раствору [1-бензил-2-(трет-бутилдиметилсиланилокси)-7-фтор-4-(2-гидроксиэтилкарбамоил)-7 метилоктил]амида хиноксалин-2-карбоновой кислоты (250 мг; 0,400 ммоль) в метиленхлориде добавляют 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1 Н)-он [периодинан Десса-Мартина] (340 мг; 0,800 ммоль). Реакционную смесь перемешивают в течение 2 ч, после чего разбавляют диэтиловым эфиром и гасят реакцию смесью (1:1) насыщенного водного раствора тиосульфата натрия и бикарбоната натрия. Слои разделяют и водный слой экстрагируют этилацетатом. Объединенные органические фракции промывают смесью (1:1) насыщенного водного раствора тиосульфата натрия и бикарбоната натрия, водой и-23 005320 насыщенным водным раствором хлорида натрия. Органический слой затем сушат над сульфатом натрия,фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (233 мг; 94%).(0,103 мл; 0,739 ммоль). Реакционную смесь перемешивают в течение 16 ч и затем концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (137 мг; 62%).[1-бензил-2-(трет-бутилдиметилсиланилокси)-7-фтор-7-метил-4-оксазол-2 илоктил]амида хиноксалин-2-карбоновой кислоты (133 мг; 0,220 ммоль) в тетрагидрофуране (2 мл) добавляют (триметилсилил)дифторид трис(диметиламино)серы (180 мг; 0,660 ммоль). Реакционную смесь перемешивают в течение 1 ч, после чего гасят реакцию метанолом и смесь концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение (73 мг; 68%). Соединения, указанные в заголовках примеров 51-61, получают в соответствии с методикой, аналогичной той, что описана в примере 50.(4-Бензолсульфонил-1-бензил-2-гидрокси-7-метилоктил)амид хиноксалин-2-карбоновой кислоты Бензиловый сложный эфир (4-бензолсульфонил-1-бензил-2-гидрокси-7-метилоктил)карбаминовой кислоты К раствору 3,0 эквивалентов (4-метилпентан-1-сульфонил)бензола (предварительно приготовленного по Гаони [Gaoni, J. Org. Chem. 1982, 47, 2564]) в тетрагидрофуране, охлажденному до -78 С, добавляют 3,0 эквивалента н-бутиллития и перемешивают смесь в течение 30 мин. Затем добавляют по каплям один эквивалент бензилового сложного эфира (1-оксиранил-2-фенилэтил)карбаминовой кислоты (предварительно приготовленного по Калдору [Kaldor, et al., J. Med. Chem., 1997, p.3979]) в ТГФ и перемешивают реакционную смесь в течение 1,5 ч. После этого реакцию гасят насыщенным водным раствором бикарбоната натрия и нагревают реакционную смесь до температуры окружающей среды. После проведения стандартных процедур водной обработки и экстракции с последующими концентрированием и хроматографией на силикагеле получают указанное в заголовке соединение. 2-Амино-5-бензолсульфонил-8-метил-1-фенилнонан-3-ол К раствору бензилового сложного эфира(4-бензолсульфонил-1-бензил-2-гидрокси-7 метилоктил)карбаминовой кислоты в этаноле добавляют 10 мол.% гидроксида палладия на угле. Смесь затем встряхивают на встряхивающем устройстве Парра (Parr shaker) в атмосфере водорода при давлением 50 фунтов/кв.дюйм) в течение примерно 18 ч. Катализатор удаляют фильтрованием и раствор концентрируют с получением указанного в заголовке соединения.(4-Бензолсульфонил-1-бензил-2-гидрокси-7-метилоктил)амид хиноксалин-2-карбоновой кислоты К раствору одного эквивалента 2-амино-5-бензолсульфонил-8-метил-1-фенилнонан-3-ола в метиленхлориде добавляют, по 1,05 эквивалента каждого 2-хиноксалинкарбоновой кислоты Nметилморфолина и гексафторфосфата O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония. Реакционную смесь перемешивают при температуре окружающей среды в течение 18 ч. После проведения стандартных процедур водной обработки и экстракции с последующими концентрированием и хроматографией на силикагеле получают указанное в заголовке соединение. Соединения, указанные в заголовках примеров 63-72, получают, следуя методике, аналогичной той,что описана в примере 62.(1-Бензил-7-фтор-2-гидрокси-7-метил-4-тиокарбамоилоктил)амид хиноксалин-2-карбоновой кислоты. 6-Фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]этил-3-тиокарбамоилгептиловый эфир уксусной кислоты К раствору 1,0 эквивалента 3-карбамоил-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]этилгептилового эфира уксусной кислоты в тетрагидрофуране, охлажденному до 0 С, по каплям добавляют 0,5 эквивалента реактива Лавессона. Желтой суспензии дают нагреться до комнатной температуры и перемешивают в течение примерно 5 ч. Далее реакционную смесь концентрируют досуха и затем очищают хроматографией на силикагеле с получением указанного в заголовке соединения.(1-Бензил-7-фтор-2-гидрокси-7-метил-4-тиокарбамоилоктил)амид хиноксалин-2-карбоновой кислоты. К раствору 1,0 эквивалента 6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил) амино]этил-3-тиокарбамоилгептилового эфира уксусной кислоты в метаноле добавляют 2,0 эквивалента карбоната калия, перемешивают в течение примерно 5 ч и концентрируют. Неочищенный продукт растворяют в этилацетате и воде. Органический слой затем промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение.(1-Бензил-4-карбамимидоил-7-фтор-2-гидрокси-7-метилоктил)амид хиноксалин-2-карбоновой кислоты 3-Карбамимидоил-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)-амино]этилгептиловый сложный эфир уксусной кислоты К раствору 6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2-карбонил)амино]-этил-3-тиокарбамоилгептилового эфира уксусной кислоты в ацетоне добавляют избыток метилиодида. Затем реакционную смесь кипятят с обратным холодильником в течение примерно 2 ч, после чего охлаждают и концентрируют. Неочищенный продукт поглощают насыщенным раствором аммиака в метаноле и перемешивают в течение примерно 15 ч. Реакционную смесь концентрируют досуха и затем очищают хроматографией на силикагеле с получением указанного в заголовке соединения.(1-Бензил-4-карбамимидоил-7-фтор-2-гидрокси-7-метилоктил)амид хиноксалин-2-карбоновой кислоты. К раствору 1,0 эквивалента 3-карбамимидоил-6-фтор-6-метил-1-2-фенил-1-[(хиноксалин-2 карбонил)амино]этилгептилового эфира уксусной кислоты в метаноле добавляют 2,0 эквивалента карбоната калия, перемешивают в течение примерно 5 ч и концентрируют. Неочищенный продукт растворяют в этилацетате и воде. Органический слой затем промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют. Хроматография на силикагеле дает указанное в заголовке соединение. Соединения, указанные в заголовках примеров 78-80, получают, следуя методике, аналогичной той,что описана в примере 77.[4-(Ацетилиминоаминометил)-1-бензил-7-фтор-2-гидрокси-7-метилоктил]амид хиноксалин-2-карбоновой кислоты К раствору 1,0 эквивалента (1-бензил-4-карбамимидоил-7-фтор-2-гидрокси-7-метилоктил)амида хиноксалин-2-карбоновой кислоты в метиленхлориде добавляют 1,0 эквивалента триэтиламина и затем 1,0 эквивалента ацетилхлорида. Реакционную смесь перемешивают при температуре окружающей среды в течение примерно 5 ч. После проведения стандартных процедур водной обработки и экстракции с последующим концентрированием и хроматографией на силикагеле получают указанное в заголовке соединение. Соединения, указанные в заголовках примеров 82-86, получают, следуя методике, аналогичной той,что описана в примере 81.(1-бензил-4-карбамимидоил-7-фтор-2-гидрокси-7-метилоктил)амида хиноксалин-2-карбоновой кислоты в метиленхлориде добавляют 1,0 эквивалент триэтиламина и затем 1,0 эквивалент метансульфонилхлорида. Реакционную смесь перемешивают при температуре окружающей среды в течение примерно 5 ч. После проведения стандартных процедур водной обработки и экстракции с последующим концентрированием и хроматографией на силикагеле получают указанное в заголовке соединение. Соединения, указанные в заголовках примеров 88-94, получают по методике, аналогичной той, что описана в примере 87.(1-бензил-4-карбамимидоил-7-фтор-2-гидрокси-7-метилоктил)амида хиноксалин-2-карбоновой кислоты в метиленхлориде добавляют 1,0 эквивалента бромциана. Реакционную смесь перемешивают при температуре окружающей среды в течение примерно 15 ч. После проведения стандартных процедур водной обработки и экстракции с последующими концентрированием и хроматографией на силикагеле получают указанное в заголовке соединение. или его фармацевтически приемлемая соль, гдеR1 означает хинолинил или хиноксалинил, необязательно замещенные по меньшей мере одной группой галогено;R2 означает бензил, необязательно замещенный по меньшей мере одной группой галогено;R3 означает группу (С 1-С 4)алкил или (C5-C8)циклоалкил, необязательно замещенные по меньшей мере одной группой галогено или гидрокси; иR4 означает имидазолил, дигидроимидазолил, триазолил, оксадиазолил, оксадиазолонил, оксазолил,дигидрооксазолил, сульфонил, -C(=S)H или -(CH(=NH), необязательно замещенные по меньшей мере одной группой, независимо выбранной из -NH2, -CN, -С(=О)СН 3 и -SO2CH3; при условии, что когда R4 обозначает пятичленную гетероциклическую группу, то либо R2, либо R3 должен быть замещен функциональной группой, отличной от (C1-С 6)алкила, гидрокси(C1-С 6)алкила, (C1C6)алкокси, (C1-C6)алкил-(С=O)-O-, (С 1-С 6)алкил-(С=O)-O-(C1-C6)алкила, амино, (C1-C6)алкиламино,[(C1-C6)алкил]2 амино, амино (C1-C6)алкила, бензофурила, индолила, азациклоалкила, азабициклоалкила или бензопиперидинила. 2. Соединение по п.1, отличающееся тем, что указанное соединение имеет точную стереохимическую структуру, описываемую формулой где R1, R2, R3 и R4 описаны в п.1. 3. Соединение по п.1, отличающееся тем, что R1 означает необязательно замещенный хиноксалин 2-ил, хиноксалин-6-ил, хинолин-2-ил, хинолин-3-ил, хинолин-4-ил или хинолин-6-ил. 4. Соединение по п.1, отличающееся тем, что R3 означает необязательно замещенный н-бутил, третбутил, изобутил, н-пентил, 2-метилпентил, циклопентил или циклогексил. 5. Соединение по п.3, отличающееся тем, что R3 означает необязательно замещенный н-бутил, третбутил, изобутил, н-пентил, 2-метилпентил, циклопентил или циклогексил. 6. Соединение по п.1, отличающееся тем, что R3 замещен фтором или гидроксигруппой. 7. Соединение по п.3, отличающееся тем, что R3 необязательно замещен фтором или гидроксигруппой. 8. Соединение по п.1, отличающееся тем, что R3 означает 4,4-дифторциклогексилметил, 2-фтор-2 метилбутил, изобутил или 1-гидроксициклогексил.
МПК / Метки
МПК: A61K 31/47, C07D 403/12, C07D 401/12
Метки: гетероциклического, амида, производные
Код ссылки
<a href="https://eas.patents.su/30-5320-proizvodnye-geterociklicheskogo-amida.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гетероциклического амида</a>
Предыдущий патент: Новые оксабиспидиновые соединения, полезные при лечении сердечных аритмий
Следующий патент: Способ и композиция для улучшения газобарьерных свойств полимерных контейнеров и пленок
Случайный патент: Производные имидазола, как антагонисты глутаматного рецептора












