Азабициклоалканы как модуляторы рецептора хемокинов ccr5
Номер патента: 4988
Опубликовано: 28.10.2004
Авторы: Прайс Дэвид Энтони, Стаммен Бланда Люциа Криста, Эдвардс Мартин Пол, Вуд Энтони, Армур Дункан Роберт, Перрос Маноуссос
Формула / Реферат
1. Соединение формулы
[фрагмент a] - [фрагмент b] - [фрагмент g] - [фрагмент d] (1)
или его фармацевтически приемлемая соль, где
[фрагмент a] представляет собой структурный фрагмент
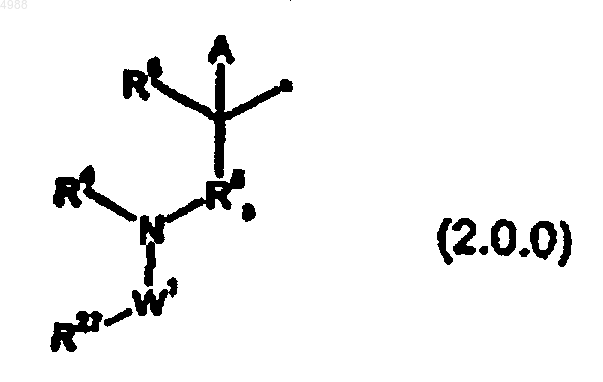
где символ * указывает точку присоединения фрагмента формулы (2.0.0) к [фрагменту b]; R4 является водородом; R6 является водородом; A является фенилом; R5a является простой связью; W1 = -CO- и R27 выбирают из C1-4алкила, CH3OC1-4алкилена, CF3CH2-,
где символ R указывает место присоединения R27 к W, Rx является C1-4алкилом или C1-4алкоксилом, Ry является C1-4алкилом и R2 является OH, OCH3, NH2 или NHCOCH3;
[фрагмент b] представляет собой этилен;
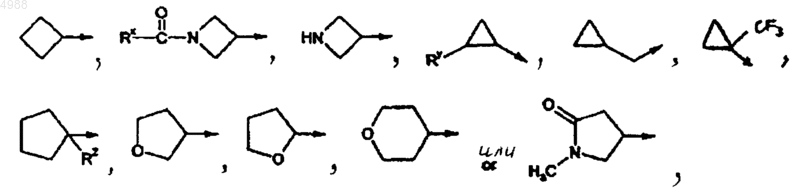
[фрагмент g] представляет собой азабицикло[3.2.1]октил, азабицикло[3.1.0]гексил, 3-оксаазабицикло[3.3.1]нонил и 3-тиаазабицикло [3.3.1]нонил и
[фрагмент d] выбран из следующих фрагментов:
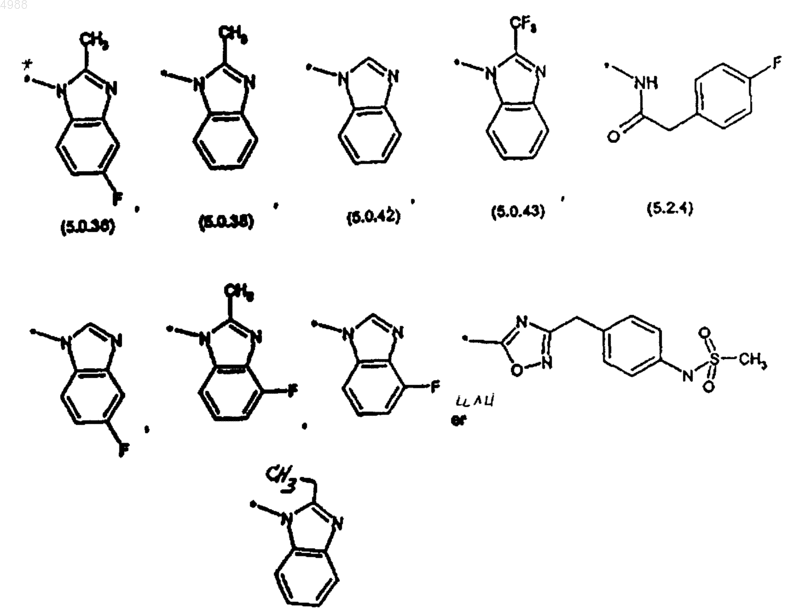
2. Соединение, которое выбрано из группы, состоящей из
N-{3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклобутанкарбоксамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклобутанкарбоксамида,
N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклобутанкарбоксамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}тетрагидро-2H-пиран-4-карбоксамида,
1-ацетил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
1-гидрокси-H-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклопентанкарбоксамида,
2-метил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклопропанкарбоксамида,
2-циклопропил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}тетрагидро-3-фуранкарбоксамида,
3,3,3-трифтор-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}тетрагидро-2-фуранкарбоксамида,
1-(ацетиламино)-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклопентанкарбоксамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
1-метокси-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклопентанкарбоксамида,
l-амино-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклопентанкарбоксамида,
1-метил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-2-оксо-4-пирролидинкарбоксамида,
1-ацетил-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[6-(2-метил-1H-бензимидазол-1-ил)-3-азабицикло[3.1.0]гекс-3-ил]-1-фенилпропил}циклобутанкарбоксамида,
2-циклопропил-N-{(1S)-3-[3-экзо-(3-{4-[(метилсульфонил)амино]бензил}-1,2,4-оксадиазол-5-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[7-экзо-(2-метил-1H-бензимидазол-1-ил)-3-окса-9-азабицикло[3.3.1]нон-9-ил]-1-фенилпропил}циклобутанкарбоксамида,
2-циклопропил-N-{(1S)-3-[7-экзо-(2-метил-1H-бензимидазол-1-ил)-3-окса-9-азабицикло[3.3.1]нон-9-ил]-1-фенилпропил}ацетамида,
3,3,3-трифтор-N-{(1S)-3-[7-экзо-(2-метил-1H-бензимидазол-1-ил)-3-окса-9-азабицикло[3.3.1]нон-9-ил]-1-фенилпропил}пропанамида,
N-{(1S)-3-[7-эндо-(2-метил-1H-бензимидазол-1-ил)-3-окса-9-азабицикло[3.3.1]нон-9-ил]-1-фенилпропил}циклобутанкарбоксамида,
2-циклопропил-N-{(1S)-3-[7-эндо-(2-метил-1H-бензимидазол-1-ил)-3-окса-9-азабицикло[3.3.1]нон-9-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[7-экзо-(2-метил-1H-бензимидазол-1-ил)-3-тиа-9-азабицикло[3.3.1]нон-9-ил]-1-фенилпропил}циклобутанкарбоксамида,
2-циклопропил-N-[(1S)-3-{3-эндо-{[2-(4-фторфенил)ацетил]амино}-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-[(1S)-3-(3-{[3-эндо-(4-фторфенил)пропаноил]амино}-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклобутанкарбоксамида,
N-[(1S)-3-(3-{[3-экзо-(4-фторфенил)пропаноил]амино}-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}циклобутанкарбоксамида,
2-циклопропил-N-[(1S)-3-(3-экзо-{[2-(4-(фторфенил)ацетил]амино}-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}тетрагидро-3-фуранкарбоксамида,
N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}тетрагидро-2H-пиран-4-карбоксамида,
N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}тетрагидро-2-фуранкарбоксамида,
1-ацетил-N-{(1S)-3-[3-эндо-(1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-эндо-(1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
метил 3-[({(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}амино)карбонил]-1-азетидинкарбоксилата,
N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
1-ацетил-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-2-азетидинкарбоксамида,
2-[ацетил(метил)амино]-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
3-[ацетил(метил)амино]-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
2-метокси-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
3-метокси-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
1-ацетил-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-пирролидинкарбоксамида,
1-метил-N-{(1S)-3-[3-эндо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-2-оксо-4-пирролидинкарбоксамида,
1-ацетил-N-{(1S)-3-[3-экзо-(2-этил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(2-этил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
1-ацетил-N-((1S)-1-фенил-3-{3-экзо-[2-(трифторметил)-1H-бензимидазол-1-ил]-8-азабицикло[3.2.1]окт-8-ил}пропил)-3-азетидинкарбоксамида,
N-((1S)-1-фенил-3-{3-экзо-[2-(трифторметил)-1H-бензимидазол-1-ил]-8-азабицикло[3.2.1]окт-8-ил}пропил)-1-пропионил-3-азетидинкарбоксамида,
N-((1S)-1-фенил-3-{3-экзо-[2-(трифторметил)-1H-бензимидазол-1-ил]-8-азабицикло[3.2.1]окт-8-ил}пропил)ацетамида,
2-[ацетил(метил)амино]-N-((1S)-1-фенил-3-{3-экзо-[2-(трифторметил)-1H-бензимидазол-1-ил]-8-азабицикло[3.2.1]окт-8-ил}пропил)ацетамида,
1-ацетил-N-{(1S)-3-[3-экзо-(1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
1-ацетил-N-{(1S)-3-[3-экзо-(5-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(5-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
1-ацетил-N-{(1S)-3-[3-экзо-(5-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(5-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
1-метил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
(2S)-1-ацетил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-2-азетидинкарбоксамида,
(2R)-1-ацетил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-2-азетидинкарбоксамида,
2-[ацетил(метил)амино]-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
3-[ацетил(метил)амино]-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
1-ацетил-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-пирролидинкарбоксамида,
N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-(трифторметил)циклопропанкарбоксамида,
2-метокси-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
3-метокси-N-{(1S)-3-[3-экзо-(2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
1-ацетил-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
1-метил-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
2-метокси-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
3-метокси-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
2-[ацетил(метил)амино]-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
3-[ацетил(метил)амино]-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида,
N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-метил-3-оксэтанкарбоксамида,
3-этил-N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-оксэтанкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-2-метил-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-оксэтанкарбоксамида,
3-этил-N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-оксэтанкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-метил-3-оксэтанкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-оксэтанкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-метил-3-азетидинкарбоксамида,
1-ацетил-N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-1-пропионил-3-азетидинкарбоксамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-2-метоксиацетамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида,
N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}-3-метоксипропанамида,
2-[ацетил(метил)амино]-N-{(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}ацетамида и
3-[ацетил(метил)амино]-N-[(1S)-3-[3-экзо-(4-фтор-1H-бензимидазол-1-ил)-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропил}пропанамида
и их фармацевтически приемлемых солей.
3. Фармацевтическая композиция, включающая соединение формулы (I) или его фармацевтически приемлемую соль по любому из предшествующих пунктов вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем.
4. Фармацевтическая композиция по п.3, дополнительно включающая ингибитор протеазы ВИЧ или ингибитор обратной трансктиптазы ВИЧ.
5. Фармацевтическая композиция по п.4, где ингибитор протеазы ВИЧ представляет собой индинавир, ритонавир, саквинавир, нелфинавир и ампренавир и ингибитор обратной транскриптазы ВИЧ представляет собой невирапин, делавирдин, эфавиренз, зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абакавир и адефовир дипивоксил.
6. Фармацевтическая композиция по п.3, дополнительно включающая ингибитор пролиферации, иммуномодулятор, интерферон, производные интерферона, ингибитор слияния, ингибитор интегразы, ингибитор РНКазыН, ингибитор транскрипции вируса и ингибитор репликации РНК.
7. Фармацевтическая композиция по п.6, где ингибитор пролиферации представляет собой гидроксимочевину, указанный иммуномодулятор представляет собой сарграмостим, указанный ингибитор слияния представляет собой AMD3100, T-20, PRO-542, AD-349 или BG-10010 и указанный ингибитор интегразы представляет собой AR177.
8. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-2 в качестве лекарственного средства.
9. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-2 для получения лекарственного средства для профилактики или лечения заболевания или состояния, опосредованного или связанного с модуляцией активности рецептора хемокина CCR5.
10. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-2 для получения лекарственного средства для профилактики или лечения инфекции вируса иммунодефицита человека (ВИЧ), включая профилактику или лечение синдрома приобретенного иммунодефицита (СПИД), вызванного этим вирусом.
11. Применение соединения формулы (I), или его фармацевтически приемлемой соли, или композиции по любому из пп.1-2 для получения лекарственного средства для профилактики или лечения респираторного заболевания.
12. Способ оценки предполагаемого мутированного вируса ВИЧ в отношении устойчивости к терапевтическим лекарственным средствам, направленным против ВИЧ, включающий выделение указанного предполагаемого мутированного вируса из его культуры in vitro; из его животной модели инфекции in vitro; или из образцют пациентов, когда указанный пациент подвергается оптимальному или субоптимальному лечению, включающему введение соединения по п.1 самого по себе или в любом его сочетании с одним или более терапевтическими средствами для лечения или профилактики ВИЧ инфекции.
13. Способ определения присутствия и/или подтверждения активности модулятора хемокина, обладающего активностью против мутированного вируса ВИЧ, включающий использование в качестве зонда для осуществления такого определения и/или подтверждения мутированного вируса ВИЧ или компонента этого вируса распознанного согласно способу оценки по п.12.
14. Диагностическое средство для применения с целью выбора схемы лечения и/или прогнозирования результата у пациента, подвергаемого лечению в отношении инфекции мутированным вирусом ВИЧ, где указанное диагностическое средство включает мутированный вирус ВИЧ или компонент этого вируса, распознанного согласно способу по п.12.
Текст
1 Настоящее изобретение относится к новым химическим соединениям. Данные соединения находят особое, но не исключительное применение в качестве фармацевтических средств,особенно в качестве модуляторов CCR5. Настоящее изобретение также относится к составам или дозированным лекарственным формам, включающим данные соединения, к применению данных соединений в производстве фармацевтических составов или дозированных лекарственных форм и к способам лечения, особенно противовоспалительного лечения заболеваний и состояний, а также лечения и профилактики ВИЧ-1 и генетически родственных ретровирусных инфекций. Соединения настоящего изобретения могут быть модуляторами, особенно антагонистами активности CCR5 рецепторов хемокинов,особенно тех, которые находятся на поверхности определенных клеток человеческого организма. Модуляторы CCR5 рецепторов могут быть полезны при лечении и профилактике различных воспалительных заболеваний и состояний, а также лечения и профилактики инфекций,вызываемых ВИЧ-1 и генетически родственными ретровирусами. Название "хемокин" является сокращением"хемотаксических цитокинов". Хемокины включают большое семейство белков, которые имеют общие важные структурные характеристики и которые обладают способностью привлекать лейкоциты. Как хемотаксические факторы лейкоцитов, хемокины играют исключительную роль в привлечении лейкоцитов в различные ткани организма, процессе, который существенен как для воспаления, так и для ответа организма на инфекцию. Поскольку хемокины и их рецепторы являются центральным звеном в патофизиологии воспалительных и инфекционных заболеваний, агенты, которые активны в отношении модуляции, предпочтительно, антагонистической, активности хемокинов и их рецепторов, полезны при терапевтическом лечении таких воспалительных и инфекционных заболеваний.CCR5 рецептор хемокинов особенно важен при лечении воспалительных и инфекционных заболеваний. CCR5 представляет собой рецептор хемокинов, особенно воспалительных белков макрофагов (MIP), обозначаемых как МIР 1 и МIР-1, и белка, который регулируется при активации и экспрессируется и секретируется нормальными Т-клетками (RANTES). Взаимоотношения между модуляторами, особенно антагонистами активности CCR5, и их терапевтическая пригодность при лечении воспаления и ВИЧ инфекции, а также способ, с помощью которого могут быть продемонстрированы такие взаимоотношения, более подробно объясняется дополнительно ниже. В данной области ведутся широкие исследования различных классов модуляторов актив 004988 2 ности рецепторов хемокинов, особенно CCR5 рецепторов хемокинов. Примером является открытие Mills et al., патент WO 98/25617, относящийся к замещенным арилпиперазинам как модуляторам активности рецепторов хемокинов. Однако описанные в указанном источнике композиции отличаются и не предполагают сходства с представленными в настоящем изобретении. Дополнительно композиции в качестве модуляторов рецепторов хемокинов раскрыты в патентах WO 98/025605; WO 98/025604;WO 98/002151; WO 98/004554 и WO 97/024325. Настоящее изобретение относится к соединениям, которые можно в качестве удобства рассматривать как имеющие четыре независимых варьирующих района, обозначаемых слева направо указанного соединения как: Фрагмент[Фрагмент ] - [Фрагмент ] - [Фрагмент ] [Фрагмент ] (I) и к их фармацевтически приемлемым солям, а также к их пролекарственным производным. Соединения настоящего изобретения могут быть избирательными модуляторами CCR5 рецептора и являются непептидильными по структуре. Как представлено в формуле (I), соединения могут содержать один или более стереогенных центров, и настоящее изобретение включает представленные соединения как в их разделенной, так и в неразделенной формах. Разделенные формы могут быть получены традиционными способами, например, асимметричным синтезом, с помощью высокоэффективной жидкостной хроматографии с использованием хиральной стационарной фазы, или путем химического разделения через образование подходящих солей или производных. Должно быть понятно, что отдельные оптически активные формы композиций настоящего изобретения, так же как их рацемические смеси, должны обычно варьироваться в отношении их биологических свойств из-за зависимой от хиральности конформации активных мест фермента, рецептора и тому подобное. Далее описание раскрывает отдельные части (фрагменты), которые включают каждый из указанных фрагментов, причем каждая главная группа в каждом фрагменте представлена с одним тире ("-"), и каждое последующее подразделение внутри каждой указанной группы представлено в свою очередь двумя, тремя и более, сколько потребуется, тире. В данном описании и формуле изобретения ссылка на ряд или класс групп, например,(C1-С 3)алкил, должна быть понята и как выражающая осуществление, и как ссылка на каждый член ряда или класса, включая изомеры. В соответствии с настоящим изобретением предлагается соединение формулы (I):[Фрагмент ] - [Фрагмент ] - [Фрагмент ] [Фрагмент ] (I),где [фрагмент ] представляет собой структурный фрагмент где символуказывает точку присоединения фрагмента формулы (2.0.0) к [фрагменту ]; R4 является водородом; R6 является водородом; А является фенилом; R5a является прямой связью;W1 = -СО- и R27 выбирают из С 1-4 алкила,СН 3 ОС 1-4 алкилена, CF3CH2 где символуказывает место присоединения R27 к W,Rx является С 1-4 алкилом или С 1-4 алкоксилом, Ry является C1-4 алкилом и R2 является ОН,ОСН 3, NH2 или NHCOCH3;[фрагмент ] выбран из следующих фрагментов: В данном изобретении предлагаются также фармацевтические составы и лекарственные формы, включающие в качестве активного ингредиента соединение формулы I. Предлагаются также применение соединения формулы I в производстве состава или лекарственной формы и способы лечения.[Фрагмент ] представляет собой левый конец модулятора рецептора CCR5 настоящего изобретения. Предпочтительные алкильные группы R27 включают: метил; этил; изопропил; трет-бутил. Эти алкильные группы могут быть замещены от 0 до 3 заместителями. Предпочтительно чтобы,когда заместитель присутствует, то он являетсяCF3; ОСН 3. Соединения настоящего изобретения могут быть применены в форме кислот, эфиров 4 или других химических производных. В рамках настоящего изобретения находится также применение данных соединений в форме фармацевтически приемлемых солей, полученных из различных органических и неорганических кислот и оснований в соответствии с процедурами, хорошо известными в данной области. Применяемый здесь термин "фармацевтически приемлемая соль" предназначен для обозначения активного ингредиента, включающего соединение формулы (I), применяемого в форме его соли, в особенности, когда указанная солевая форма придает указанному активному ингредиенту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного ингредиента или другой ранее раскрытой солевой формой. Фармацевтически приемлемая солевая форма указанного активного ингредиента может также исходно придавать желаемое фармакокинетическое свойство указанному активному ингредиенту, которым он ранее не обладал, и может даже положительно влиять на фармакодинамику указанного активного ингредиента в отношении его терапевтической активности в организме. Фармакокинетические свойства указанного активного ингредиента, которые могут быть благоприятно изменены, включают, например,способ транспортировки указанного активного ингредиента через клеточные мембраны, что в свою очередь может прямо и положительно влиять на абсорбцию, распределение, биотрансформацию или экскрецию указанного активного ингредиента. Хотя важен путь введения фармацевтической композиции, и на биологическую доступность могут оказывать решающее влияние различные анатомические, физиологические и патологические факторы, растворимость указанного активного ингредиента обычно зависит от характера его применяемой конкретной солевой формы. Кроме того, водный раствор может обеспечивать наиболее быструю абсорбцию активного ингредиента в организме больного,подвергаемого лечению, в то время как масляные растворы и суспензии, а также твердые лекарственные формы могут приводить к менее быстрой абсорбции. Пероральное введение указанного активного ингредиента является наиболее предпочтительным путем введения по соображениям безопасности, удобства и экономии,но на абсорбцию такой пероральной лекарственной формы могут неблагоприятно влиять такие физические характеристики, как полярность, рвота, вызванная раздражением слизистой желудочно-кишечного тракта, повреждение ферментов пищеварения и низкий рН, неправильная абсорбция или продвижение в присутствии пищи или других лекарств и метаболизм ферментами слизистой, кишечной флоры или печени. Перевод указанного активного ингредиента в различные фармацевтически при 5 емлемые солевые формы может быть эффективным для преодоления или смягчения одной или более упомянутых выше проблем, встречающихся при захвате пероральных лекарственных форм. Хорошо известные фармацевтически приемлемые соли включают, но не ограничиваются этим, ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бесилат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецисульфат, этансульфонат, фумарат, глюкогептаноат,глюконат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, изэтионат, лактат, лактобионат,малеат, манделат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат,памоат, пектинат, персульфат, 3-фенилпропионат, фосфонат, пикрат, пивалат, пропионат,салицилат, фосфат натрия, стеарат, сукцинат,сульфат, сульфосалицилат, тартрат, тиоцианат,тиомалат, тозилат и ундеканоат. Основные соли соединений настоящего изобретения включают, но не ограничиваются этим, соли аммония; соли щелочных металлов,таких как натрий и калий; соли щелочноземельных металлов, таких как кальций и магний; соли органических оснований, таких как дициклогексиламин, меглюмин, N-метил-D-глюкамин,трис-(гидроксиметил)метиламин (трометамин) и соли с аминокислотами, такими как аргинин,лизин и т.д. Соединения настоящего изобретения, которые включают основные содержащие азот группы, могут быть переведены в форму четвертичного основания с помощью таких агентов, как (С 1-С 4)алкилгалоиды, например,метил-, этил-, изопропил- и трет-бутилхлориды,бромиды и йодиды; ди (С 1-С 4)алкилсульфат,например, диметил, диэтил и диамилсульфаты;(С 10-C18)алкилгалоиды, например, децил-, додецил-, лаурил-, миристил- и стеарилхлориды,бромиды и йодиды; и арил (C1-C4) алкилгалоиды, например, бензилхлорид и фенэтилбромид. Такие соли обеспечивают получение как водорастворимых, так и растворимых в масле соединений настоящего изобретения. Среди перечисленных выше фармацевтических солей, те, которые являются предпочтительными, включают, но не ограничиваются этим, ацетат, бесилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изэтионат, манделат, меглюмин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат,тиомалат, тозилат и трометамин. В объем настоящего изобретения включаются множественные солевые формы, в которых соединение настоящего изобретения содержит более чем одну группу, способную к образованию таких фармацевтически приемлемых солей. Примеры типичных множественных солевых 6 форм включают, но не ограничиваются этим,битартрат, диацетат, дифумарат, димеглюмин,дифосфат, двузамещенный натрий и тригидрохлорид. Соединения настоящего изобретения можно вводить отдельно, но обычно их следует вводить в смеси с одним или более подходящими фармацевтическими наполнителями, разбавителями или носителями, выбранными в соответствии с предназначенным путем введения и стандартной фармацевтической практикой. Например, соединения формулы (I) можно вводить перорально или подъязычно в форме таблеток, капсул, овул (каплет), эликсиров, растворов или суспензий, которые могут содержать отдушки или окрашивающие агенты, с немедленным или контролируемым высвобождением. Такие таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,двузамещенный фосфат кальция и глицин, разрыхляющие агенты, такие как крахмал (предпочтительно, кукурузный, картофельный или крахмал тапиоки), альгиновая кислота и определенные сложные силикаты, и связующие агенты гранулирования, такие как поливинилпирролидон, сахароза, желатин и камедь. Кроме того,могут быть включены смазывающие агенты,такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции сходного типа могут также применяться в качестве наполнителей желатиновых капсул. Предпочтительные в этом отношении наполнители включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть объединены с различными подслащивающими агентами или отдушками, окрашивающим материалом или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, и их сочетаниями. Соединения формулы (I) можно также вводить парентерально, например, внутривенно,внутрибрюшинно, с помощью введения под оболочку и внутрижелудочкового введения, в ствол мозга, с помощью внутричерепного введения, внутримышечно или подкожно, или их можно вводить с помощью инфузионных способов. Лучше всего их применять в форме стерильного водного раствора, который может содержать другие вещества, например, достаточное количество солей или глюкозы для получения раствора, изотоничного с кровью. Водные растворы следует подходящим образом забуферивать (предпочтительно до рН от 3 до 9), если это необходимо. Получение подходящих парентеральных составов при стерильных условиях легко достигается с помощью стандартных фармацевтических способов, хорошо известных специалистам в данной области. 7 Для перорального и парентерального введения больным людям ежедневный уровень дозы соединений формулы (I) обычно должен составлять от 1 мкг/кг до 25 мг/кг (в разовой или разделенных дозах). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 0,05 мг до 1,0 г активного соединения для введения по одной или две, или более, как подходит. Врач в любом случае должен определить действительную дозу, которая будет наиболее подходящей для каждого отдельного больного, и она должна изменяться в зависимости от возраста,веса и реакции конкретного больного. Указанные выше дозы являются примерами усредненного случая. Конечно, могут быть индивидуальные случаи, когда разумно применение более высоких или более низких диапазонов дозы, и такие случаи включены в объем настоящего изобретения. Соединения формулы (I) можно также вводить интраназально или с помощью ингаляции и их удобно доставлять в виде ингаляции сухого порошка или представлять в виде аэрозольного спрея, поступающего из контейнера под давлением, или в виде распылителя с применением подходящего пропеллента, например,дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134 а), двуокиси углерода или другого подходящего газа. В случае аэрозоля под давлением доза лекарственной формы может быть определена с помощью снабжения клапаном для доставки дозированного количества. Контейнер под давлением или распылитель может содержать раствор или суспензию активного соединения, например, с применением смеси этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающее средство,например, триолеат сорбитана. Состав капсул и картриджей (сделанных, например, из желатина) для применения в ингаляторе или аппарате для вдувания может содержать смесь порошков соединения формулы (I) и подходящей порошковой основы, такой как лактоза или крахмал. Аэрозольные составы или составы в виде сухого порошка предпочтительно создают так,что каждая единица дозы или "аэрозоля" содержит от 20 мкг до 20 мг соединения формулы (I) для доставки больному. Общая суточная доза в виде аэрозоля должна быть в интервале от 20 мкг до 20 мг, и может вводиться в виде разовой дозы или, более традиционно, в раздельных дозах в течение дня. В альтернативном варианте соединения формулы (I) можно вводить в форме суппозитория или пессария, или они могут наноситься местно в форме лосьона, раствора, крема, мази или порошковой присыпки. Соединения формулы (I) можно также вводить трансдермально с применением кожных пластырей. Их можно 8 также вводить в окологлазное пространство,особенно для лечения неврологических расстройств глаза. Для использования в офтальмологии соединения могут быть составлены в виде микронизированных суспензий в изотоническом стерильном солевом растворе с доведенным рН или, предпочтительно, в виде растворов в изотоническом стерильном солевом растворе с доведенным рН, необязательно в сочетании с консервантом, таким как хлористый бензилалконий. В другом варианте они могут быть составлены в виде мази, такой как вазелин. Для местного нанесения на кожу соединения формулы (I) могут быть составлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный,например, в смеси одного или более из следующего: минерального масла, жидкого вазелина,белого вазелина, пропиленгликоля, полиоксиэтиленового полиоксипропиленового соединения, эмульгируемого воска и воды. В другом варианте они могут быть составлены в виде подходящего лосьона или крема, будучи суспендированными или растворенными, например, в смеси одного или более из следующего: минерального масла, моностеарата сорбитана,полиэтиленгликоля, жидкого парафина, полисорбата 60, цетиловых эфиров воска, цетарилового спирта, 2-октил-додеканола, бензилового спирта и воды. Соединения формулы (I) описаны здесь как обладающие биологической активностью,такой, что они способны модулировать активность рецептора CCR5 хемокинов и возникающие в результате этого или связанные с этим патогенетические процессы, опосредуемые рецептором CCR5 и его лигандами. Применяемое здесь выражение "модулировать активность рецептора CCR5 хемокинов" предназначено для отнесения к манипулированию основными физиологическими процессами и факторами, в которые вовлечены рецепторы CCR5 хемокинов и их лиганды. Включенными в объем этого предложенного значения являются все типы и подтипы рецепторов CCR5, в каких бы то ни было тканях конкретного больного они не находились, и в или на каких бы то ни было компонентах клеток, включенных в данные ткани, они не локализовались. Наиболее часто рецепторыCCR5 находятся на клеточных мембранах определенных типов клеток, таких как моноциты. Рецепторы CCR5 участвуют в и определяют совместно с различными эндогенными лигандами, с которыми они связаны в естественных условиях, пути сигнализации, которые контролируют важные функции клетки и ткани посредством влияния, которое они оказывают на движение агентов, таких как хемокины, в и из данных клеток и тканей. Основное функционирование рецепторовCCR5 и их лигандов можно модулировать не 9 сколькими путями, и объем настоящего изобретения не ограничен в данном отношении любым конкретно существующим или гипотетическим путем или процессом. Таким образом, включенным в предложенное значение модуляции активности рецептора CCR5 хемокинов является применение синтетически полученных модуляторов, введенных больному, подвергаемому лечению, таких как описанные здесь соединения формулы (I). Такие экзогенные агенты могут модулировать активность рецепторов CCR5 посредством таких хорошо известных механизмов,как конкурентное связывание, при котором природные лиганды вытесняются и присущие им функции блокируются. Однако настоящее изобретение не ограничено любым таким конкретным механизмом или способом действия. Таким образом, применяемый здесь термин "модуляция" предназначен для охвата предпочтительно антагонизма, но также и агонизма, частичного антагонизма и/или частичного агонизма. Соответственно термин "терапевтически эффективное количество" обозначает количество рассматриваемого соединения, которое вызывает биологический или медицинский ответ ткани,системы, животного или человека, который находится под наблюдением. Термин "больной" в данном описании относится в особенности к людям. Однако соединения, способы и фармацевтические композиции настоящего изобретения могут быть применены в лечении животных. В объем настоящего изобретения дополнительно включаются метаболиты или остатки соединений формулы (I), которые обладают биологической активностью, такой, что они способны модулировать активность рецепторовCCR5 хемокинов и последующие или ассоциированные патогенетические процессы, опосредуемые в дальнейшем рецептором CCR5 и его лигандами. После синтеза активность и специфичность соединений формулы (I), согласно настоящему изобретению, в отношении модуляции активности рецептора CCR5 хемокинов может быть определена с помощью анализов invitro и in vivo, которые подробно описаны далее ниже. Желаемая биологическая активность соединений формулы (I) может быть также улучшена путем присоединения к ним подходящих функциональных групп, которые усиливают имеющиеся биологические свойства соединения, улучшают избирательность соединения в отношении имеющихся биологических активностей, или добавляют к существующим биологическим активностям дополнительные желаемые биологические активности. Такие модификации известны в данной области и включают те, которые повышают биологическое вхождение в данную биологическую систему, например,кровь, лимфатическую систему и центральную нервную систему; повышают пероральную дос 004988 10 тупность; повышают растворимость для обеспечения введения путем инъекции; изменяют метаболизм; и изменяют скорость экскреции соединения формулы (I). Норма дозировки и дозы соединений формулы (I), эффективные для лечения или профилактики заболеваний и состояний у больного,которые опосредованы или ассоциированы с модуляцией активности рецептора CCR5 хемокинов, как здесь описано, а также для благоприятного исхода данных состояний у указанного больного, в соответствии со способами лечения настоящего изобретения, включающими введение указанному больному терапевтически эффективного количества соединения формулы (I),должна зависеть от множества факторов, таких как природа активного ингредиента, конституция больного, цель лечения, природа подвергаемой лечению патологии, конкретная применяемая фармацевтическая композиция, одновременно проводимое лечение, которому может подвергаться больной, и наблюдения и заключения лечащего врача. В целом, однако, эффективная терапевтическая доза соединения формулы (I), которую следует вводить больному, должна составлять между приблизительно 10 мкг (0,01 мг)/кг и приблизительно 60,0 мг/кг массы тела в день,предпочтительно между приблизительно 100 мкг (0,1 мг)/кг и приблизительно 10 мг/кг массы тела в день, более предпочтительно между приблизительно 1,0 мг/кг и приблизительно 6,0 мг/кг массы тела в день и наиболее предпочтительно между приблизительно 2,0 мг/кг и приблизительно 4,0 мг/кг массы тела в день активного ингредиента формулы (I). В объем настоящего изобретения включаются осуществления, включающие совместное введение, и композиции, которые содержат в дополнение к соединению настоящего изобретения в качестве активного ингредиента, дополнительные терапевтические агенты и активные ингредиенты. Такие многокомпонентные лекарственные схемы, часто обозначаемые как комбинированная терапия, могут применяться в лечении и профилактике любых заболеваний или состояний, опосредуемых или ассоциированных с модуляцией рецептора CCR5 хемокинов, в особенности инфекции вирусом иммунодефицита человека, ВИЧ. Применение таких сочетаний терапевтических агентов является особенно уместным в отношении лечения или профилактики инфекции и размножения вируса иммунодефицита человека, ВИЧ, и сходных патогенетически ретровирусов у пациента, нуждающегося в лечении, или имеющего риск стать таким больным. Способность таких ретровирусных патогенов превращаться в течение относительно короткого периода времени в штаммы,резистентные к любой монотерапии, которую применяли к указанному больному, хорошо известна в технической литературе. 11 В дополнение к требованию терапевтической эффективности, которое может вызывать необходимость применения активных агентов дополнительно к соединениям формулы (I), модулирующим рецептор CCR5 хемокинов, могут иметься дополнительные причины, которые заставляют или усиленно рекомендуют применение сочетаний лекарств, включающих активные ингредиенты, которые представляют сопутствующую терапию, т.е. которая дополняет и пополняет функцию, выполняемую соединениями настоящего изобретения, модулирующими рецептор CCR5 хемокинов. Такие дополнительные терапевтические агенты, применяемые с целью дополнительного лечения, включают лекарства, которые вместо прямого лечения или профилактики заболевания или состояния, опосредуемого или ассоциированного с модуляцией рецептора CCR5 хемокинов, лечат заболевания или состояния, которые прямо возникают из или косвенно сопровождают основное или вытекающее из него, опосредуемое модуляцией рецептора CCR5 хемокинов заболевание или состояние. Например, когда основное опосредуемое модуляцией рецептора CCR5 хемокинов заболевание или состояние является ВИЧ инфекцией и размножением вируса, может быть необходимым или, по меньшей мере, желательным лечить условно-патогенные инфекции, неоплазмы и другие состояния, которые возникают в результате нарушения иммунного статуса больного, подвергаемого лечению. Другие активные агенты могут быть применены с соединениями формулы (I), например, для обеспечения иммунной стимуляции или для лечения боли и воспаления, которые сопровождают начальную и основную ВИЧ инфекцию. Таким образом, способы лечения и фармацевтические композиции настоящего изобретения могут использовать соединения формулы (I) в форме монотерапии, но указанные способы и композиции могут быть также применены в форме множественной терапии, при которой одно или более соединений формулы (I) совместно вводят в сочетании с одним или более известных терапевтических агентов, таких как те,которые подробно описаны здесь далее. В настоящем изобретении также предлагаются способы лечения, при которых указанные фармацевтические композиции вводят больному. Такие способы относятся к лечению или профилактике заболевания или состояния путем модуляции активности рецептора CCR5 хемокинов и последующих или ассоциированных патогенетических процессов, опосредуемых впоследствии рецептором CCR5 и активными лигандами, с которыми он взаимодействует или связывается. CCR5 и другие рецепторы хемотаксических цитокинов, т.е. хемокинов, играют ключевую роль в контроле ряда процессов,имеющих место в организме животных. Рецепторы хемокинов, которых в настоящее время 12 известно более сорока различных видов, которые подразделены на четыре семейства, являются белками, обладающими рядом общих структурных особенностей, которые действуют посредством химической сигнализации. В семействе а хемокинов одна аминокислота (X) разделяет первые два цистеиновых остатка, в то время как в -хемокинах первые два остатка цистеина находятся рядом друг с другом (С-С). Соответственно, эти два семейства обозначают соответственно как СХС и СС хемокины. Хемокины связывают специфические находящиеся на поверхности клетки рецепторы, принадлежащие к семейству сопряженных с G-белками белков с семью трансмембранными доменами, называемых "рецепторы хемокинов", обозначаемых соответственно классу хемокинов, который они связывают, в сопровождении "R" и числа. Так,"CCR5" является рецептором С-С хемокинов. См. Horuk, Trends Pharm. Sci., 15, 159-165 (1994) для дополнения. Таким образом, CCR5 принадлежит к семейству рецепторов -хемокинов,которое, как известно в настоящее время, содержит восемь членов, от CCR1 до CCR8. СС тип рецептора хемокинов взаимодействует с различными сигнальными белками,включая хемоаттрактантные белки моноцитов,МСР-1, -2, -3, -4 и -5; эотаксином-1; воспалительными белками макрофагов МIР-1 и MIP1; и теми, которые регулируются при активации, которые экспрессируются и секретируются нормальными Т-клетками, RANTES. Известно,в частности, что тип CCR5 рецептора хемокинов взаимодействует с MIP-1, МIР-1 и RANTES в моноцитах, активированных Т-клетках, дендритных клетках и естественных киллерных клетках. Данные -хемокины не действуют на нейтрофилы, но предпочтительно привлекают моноциты, эозинофилы, базофилы и лимфоциты с варьирующей степенью избирательности. Настоящее изобретение относится к соединениям формулы (I), которые пригодны для лечения или профилактики ВИЧ инфекции, и к способам лечения и фармацевтическим композициям, содержащим такие соединения в качестве активного ингредиента. Следует понимать,что применяемый здесь термин "ВИЧ" относится к вирусу иммунодефицита человека (ВИЧ),который является этиологическим агентом СПИДа (синдрома приобретенного иммунодефицита), заболевания, которое заключается в прогрессивном разрушении иммунной системы и дегенерации центральной и периферической нервной системы. В настоящее время в качестве терапевтических или профилактических агентов против СПИДа применяют несколько ингибиторов репликации ВИЧ, и много других агентов в настоящее время находятся в разработке. Недавно было показано, что в дополнение к CD4 клеточной поверхности для вхождения в клетки-мишени вирусам иммунодефицита чело 13 века среди других требуется рецептор хемокинов, CCR5 и CXCR-4, а также первичный вирусный рецептор CD4. Главным кофактором опосредуемого гликопротеинами оболочки вхождения первичных тропных в отношении макрофагов штаммов ВИЧ-1 является CCR5, который, как уже упоминалось, является рецепторомDeng, et al., Nature, 381, 661-666 (1996) для дальнейшего описания опосредуемого CCR5 вхождения ВИЧ. ВИЧ присоединяется к молекуле CD4 на клетках через участок белка его оболочки,gр 120, а gр 120 является частью мультисубъединичного комплекса, наиболее вероятно тримераgр 160, т.е. gр 120+gр 41. Предполагается, что место, связывающее CD4 на gр 120 ВИЧ, взаимодействует с молекулой CD4 на клеточной поверхности, являясь триггером конформационных изменений вдоль тримера, что позволяет ему взаимодействовать с другим рецептором клеточной поверхности, таким как CCR5. Это в свою очередь дает возможность gр 41 индуцировать слияние с клеточной мембраной и вход основы вируса в клетку. Кроме того, тропные в отношении макрофагов белки оболочки ВИЧ иCCR5 на CD4 + клетках, что может увеличить репликацию вируса. Смотри Weissman, et al.,Nature, 389, 981-985 (1997) для описания данного феномена. Далее, было показано, что комплекс gр 120 и растворимого CD4 специфически взаимодействует с CCR5 и тормозит связывание природных лигандов CCR5, как описано у Wu,et al., Nature, 384, 179-183 (1996); и Trkola, et al.,Nature, 384, 184-187 (1996). Дополнительно было показано, что -хемокины и родственные им молекулы, например, (АОР)-RANTES, предотвращают слияние ВИЧ с клеточной мембраной и последующее инфицирование как in vitro, как описано Dragic, et al., Nature, 381, 667-673 (1996) так и на животных моделях. Наконец, отсутствие CCR5, очевидно, создает защиту от инфицирования ВИЧ-1, как описано в Nature, 382,668-669 (1996). В частности, наследуемая мутация сдвига рамки считывания в гене CCR5, 32,как показано, выключает функциональную экспрессию гена in vitro, и индивидуумы, гомозиготные по данной мутации, видимо, не восприимчивы к ВИЧ инфекции, тогда как в то же время они, как кажется, не имеют недостатков иммунной системы, вызванных этим вариантом гена. Более того, заболевание у тех гетерозиготных индивидуумов, которые были инфицированы ВИЧ, прогрессирует более медленно до полного клинического проявления СПИДа. В дополнение к утверждению о значении CCR5 в инфекционном цикле ВИЧ, указанные выше наблюдения предполагают, что CCR5 несущественен во взрослом организме. 14 Хотя большинство изолятов ВИЧ-1, изученных до сих пор, используют CCR5 илиCXCR-4, по меньшей мере, девять других рецепторов хемокинов или других структурнородственных им молекул описано также как поддерживающее индуцированное ВИЧ-1, опосредованное оболочкой слияние с мембраной или вхождение вируса in vitro. Они включаютTYMSTR, GPR1, CCR8, US28, V28/CX3CR1,LTB-4 и APJ. Существует надежное доказательство того, что CCR3 может быть эффективно использован значительной долей изолятов ВИЧ 1 in vitro, в случаях, когда этот белок гиперэкспрессируется в трансфецированных клетках. Тем не менее, имеются надежные данные, свидетельствующие о том, что лекарства против ВИЧ, направленные на рецепторы хемокинов,не могут быть скомпрометированы этой вариабельностью. Действительно,хемокиныRANTES, MIP-1, MIP-1, SDF-1, как было показано, подавляют репликацию первичных изолятов ВИЧ. Производное RANTES, (АОР)RANTES, является антагонистом в субнаномолярной области функции CCR5 в моноцитах. Моноклональные антитела к CCR5, как сообщалось, блокируют инфекцию клеток ВИЧ in vitro. Низкомолекулярный антагонист CXCR4, обозначенный как AMD3100, как сообщалось, тормозит инфекцию чувствительных культур зависимыми от CXCR4 первичными и адаптированными к лабораторным условиям вирусами ВИЧ,в то время как другая малая молекула, названная ТАК 779, блокирует вхождение тропных по отношению к CCR5 штаммов (Baba, et al.,PNAS, 96 (10), 5698-5703 (1999); кроме того,большинство первичных штаммов с ранних и поздних стадий заболевания используют CCR5 исключительно или в дополнение к другим рецепторам хемокинов, что указывает на то, что зависимая от CCR5 инфекция может играть существенную роль в инициации и поддержании продуктивной инфекции ВИЧ у хозяина. Соответственно, резонно ожидать, что агент, который блокирует CCR5 у больных, включая млекопитающих и особенно человека, которые обладают нормальными рецепторами хемокинов,будет предотвращать инфекцию у здоровых индивидуумов и замедлять или останавливать вирусную прогрессию у инфицированных больных. Соответственно, настоящее изобретение направлено на соединения формулы (I), которые тормозят вхождение вируса иммунодефицита человека в клетки-мишени и таким образом ценны в плане профилактики и/или лечения инфекции ВИЧ, а также в профилактике и/или лечении развивающегося в результате синдрома приобретенного иммунодефицита (СПИД). Могут быть получены веские доказательства того факта, что описанные здесь соединения формулы (I) тормозят вхождение вируса посредством 15 избирательной блокады зависимого от CCR5 слияния. Следовательно, настоящее изобретение также относится к фармацевтическим композициям, содержащим соединения формулы (I) в качестве активного ингредиента, а также к соответствующему способу использования соединений формулы (I) в качестве самостоятельных агентов или совместно с другими агентами для профилактики и лечения инфекции ВИЧ и развивающегося в результате этого СПИДа. Применение соединений формулы (I) настоящего изобретения в качестве ингибиторов ВИЧ инфекции может быть продемонстрировано с помощью одной или более методик, известных в данной области, таких как анализ ВИЧ в микрокультуре, описанный Dimitrov etal., J. Clin. Microbiol. 28, 734-737 (1990, и анализ репортера псевдотипированного ВИЧ, описанный Connor et al., Virology 206 (2) 935-44(1995). В частности, конкретные соединения формулы (I), раскрытые здесь в качестве предпочтительных осуществлений, как показано,тормозят образование р 24 после репликации адаптированных к лабораторным условиям и первичных штаммов ВИЧ в первичных лимфоцитах крови (PBLs) и клональных линиях клеток, которые, как известно, поддерживают репликацию вирусов, тропных в отношении CCR5 и CXCR-4, например, РМ-1 и МОLТ 4-клона 8. Следует также отметить, что, как показано, ингибируются только штаммы вируса, для которых известно использование CCR5, в то время как репликация вирусов, тропных в отношенииCXCR-4, как показано, не меняется, что указывает на то, что соединения формулы (I), раскрытые здесь, способны предотвращать вхождение вируса посредством избирательной блокады зависимого от CCR5 слияния. Более того, соединения формулы (I), как показано, тормозят вхождение химерных репортерных ВИЧ вирусов, псевдотипированных оболочкой из зависимого от CCR5 штамма (ADA). Наконец, соединения формулы (I), как показано, тормозят инфекцию первичных клеток ВИЧ, выделенным из крови инфицированного больного. Дополнительное подтверждение данного механизма действия против ВИЧ представлено в экспериментах, раскрытых ниже. Способность соединений формулы (I) модулировать активность рецептора хемокинов демонстрируется с помощью методики, известной в данной области, такой как анализ связывания CCR5 согласно процедурам, раскрытым(1996); и/или анализы мобилизации внутриклеточного кальция, описанные теми же авторами. Клеточные линии, экспрессирующие интересующий рецептор, включают такие экспрессирующие в естественных условиях рецепторы,как лимфоциты периферической крови (PBL),стимулированные РМ-1 или ИЛ-2, или сконструированные для экспрессии рекомбинантного 16 рецептора клетки, такие как СНО, 300.19, L1.2 или НЕК-293. В частности, раскрытые здесь соединения формулы (I), как показано, обладают активностью в предотвращении связывания всех известных хемокинных лигандов с CCR5 в упомянутых выше анализах связывания. Кроме того, раскрытые здесь соединения формулы (I),как показано, предотвращают мобилизацию внутриклеточного кальция в ответ на эндогенные агонисты, что соответствует их функционированию в качестве антагонистов CCR5. Для лечения ВИЧ инфекции и профилактики и/или лечения развивающегося в результате этого синдрома приобретенного иммунодефицита(СПИД) соединения формулы (I), которые, как показано, являются антагонистами, являются предпочтительными по отношению к соединениям формулы (I), которые, как показано, являются агонистами. Настоящее изобретение в одном из его предпочтительных осуществлений направлено на применение раскрытых здесь соединений формулы (I) для профилактики или лечения инфекции, вызванной ретровирусом, в частности,вирусом иммунодефицита человека (ВИЧ) и лечения и/или приостановки наступления последующих патологических состояний, включая СПИД, но не ограничиваясь им. Применяемые здесь выражения "лечение или профилактика СПИД" и "профилактика или лечение инфекции ВИЧ" предназначены для обозначения лечения широкого спектра состояний ВИЧ инфекции: СПИД, ARC (связанный со СПИДом комплекс),оба как с наличием симптомов, так и бессимптомные, и действительный или потенциальный контакт с ВИЧ. Выражения, заключенные в кавычки, не следует рассматривать, однако как ограниченные цитированным лечением, но напротив, они предполагают включение всех благоприятных применений, имеющих отношение к состояниям, присущим вызывающему СПИД агенту. Например, соединения формулы (I) пригодны для лечения ВИЧ инфекции после предполагаемой последней экспозиции с ВИЧ путем,например, трансфузии крови, трансплантации органа, замены жидкостей тела, полового сношения, укусов, укола иглой или экспозиции с кровью больного. Кроме того, соединение формулы (I) может быть применено для профилактики ВИЧ инфекции и профилактики СПИД,такой как пре- или посткоитальная профилактика или профилактика передачи вируса ВИЧ от матери плоду или ребенку, либо в момент родов, либо во время периода кормления, либо любым другим способом, как описано выше. В предпочтительном осуществлении настоящего изобретения соединение формулы (I) может быть применено в способе торможения связывания вируса иммунодефицита человека с рецептором хемокинов, таким как CCR5, который включает введение в контакт клеткимишени с терапевтически эффективным коли 17 чеством соединения формулы (I), которое эффективно в отношении торможения связывания вируса с рецептором хемокинов. Субъектом,подвергаемым лечению данными предпочтительными способами настоящего изобретения,является млекопитающее, предпочтительно человек, мужчина или женщина, у которого желательна модификация активности рецептора хемокинов, и которая рассматривается как эффективная. Как уже указывалось, применяемый здесь термин "модуляция" предназначен для охвата предпочтительно антагонизма, но также агонизма, частичного антагонизма и/или частичного агонизма. Также применяемое здесь выражение "терапевтически эффективное количество" предназначено для обозначения количества, раскрытого здесь соединения формулы (I),которое должно вызывать биологический или медицинский ответ рассматриваемой ткани,системы или животного, в особенности человека. В другом предпочтительном осуществлении настоящего изобретения соединение формулы (I) может быть применено для оценки предполагаемых мутантов ретровирусов, в особенности ВИЧ, которые рассматриваются как резистентные к терапевтическим агентам против ВИЧ, включая раскрытые здесь соединения формулы (I). Мутантные вирусы могут быть выделены из культур in vitro известными в данной области способами, но могут быть также выделены из животных моделей инфекции invivo, которые были раскрыты в данной области. Более существенно, мутантные вирусы могут быть выделены из образцов от больных, подвергнутых лечению, оптимальному или субоптимальному, включающему введение соединения формулы (I) или любой его комбинации с другими известными или открытыми в будущем терапевтическими агентами. Такие мутантные вирусы или их компоненты, в особенности белки их оболочки, могут быть применены для нескольких полезных целей, включая, но не ограничиваясь этим, следующее: (i) оценка и/или создание новых модуляторов хемокинов или других агентов, обладающих улучшенной активностью против таких мутантных вирусов; и(ii) создание диагностических средств, способных помочь врачам или другим клиницистам в выборе режима терапии и/или в прогнозе исхода для больного. В следующем предпочтительном осуществлении настоящего изобретения раскрытые здесь соединения формулы (I) применяют в качестве инструментов для определения корецепторного сродства ретровирусов, включая ВИЧ иSIV, или их компонентов, в особенности белков их оболочки. Эти данные о сродстве могут быть применены для нескольких благоприятных целей, включая, но не ограничиваясь этим, фенотипирование данной вирусной популяции, например, перед применением терапии против 18 ретровирусов. Данные о сродстве могут быть также применены для предсказания прогрессии и исхода инфекции, связанной с вовлеченной вирусной популяцией. В другом предпочтительном осуществлении настоящего изобретения соединение формулы (I) применяют для получения и проведения анализов по скринингу соединений, которые модулируют активность хемокинов, в особенности рецепторов CCR5. Например, раскрытые здесь соединения формулы (I) пригодны для выделения мутантных рецепторов, которые затем могут быть превращены в инструменты скрининга для раскрытия даже более сильных соединений в соответствии с процедурами, хорошо известными в данной области. Более того,соединения формулы (I) пригодны для установления или характеристики сайтов связывания других лигандов, включая соединения, отличные от таковых формулы (I), и белки вирусной оболочки, с рецепторами хемокинов, например,с помощью конкурентного ингибирования. Соединения формулы (I) также пригодны для оценки предполагаемых специфических модуляторов различных рецепторов хемокинов. Как должно быть оценено специалистом, тщательная оценка специфических агонистов и антагонистов описанных выше рецепторов хемокинов была затруднена отсутствием непептидильных,т.е. метаболически резистентных соединений с высоким связывающим сродством к данным рецепторам. Таким образом, соединения формулы (I) пригодны в качестве продуктов, которые могут быть коммерчески использованы для данных или других выгодных целей. В объем настоящего изобретения включены сочетания соединений формулы (I) с одним или более терапевтическими агентами, пригодными для профилактики или лечения СПИДа. Например, соединения настоящего изобретения можно эффективно вводить либо в периоды до экспозиции, либо/и после экспозиции с ВИЧ в сочетании с терапевтически эффективными количествами известных противовирусных агентов против СПИДа, иммуномодуляторов, агентов против инфекций или вакцин, знакомых специалистам в данной области. Должно быть понятным, что объем таких сочетаний, которые включают соединения формулы (I), не ограничивается цитированным выше перечнем, но включает также любое сочетание с другим фармацевтически активным агентом, который пригоден для профилактики или лечения ВИЧ и СПИД. Предпочтительные сочетания настоящего изобретения включают одновременное или последовательное лечение соединением формулы(I) и одним или более ингибиторами протеазы ВИЧ и/или ингибиторами обратной транскриптазы ВИЧ, предпочтительно выбранными из класса ненуклеозидных ингибиторов обратной транскриптазы (NNRTI), включая, но не ограни 19 чиваясь этим, невирапин, делавирдин и эфавиренз; из нуклеозид/нуклеотидных ингибиторов,включая, но не ограничиваясь этим, зидовудин,диданозин, зальцитабин, ставудин, ламивудин,абакавир и адефовир дипивоксила; и из протеазных ингибиторов, включая, но не ограничиваясь этим, индинавир, ритонавир, саквинавир,нелфинавир и ампренавир. Другие агенты, пригодные для описанных выше предпочтительных сочетаний осуществления настоящего изобретения, включают существующие или будущие,находящиеся в стадии изучения лекарства любого из указанных выше классов ингибиторов,включая, но не ограничиваясь этим, FTС; РМРА; фозивудина тидоксил; талвиралин; S1153; МКС-442; MSC-204; MSH-372; DMP450;PNU-140690; АВТ-378 и KNI-764. В объем предпочтительных осуществлений настоящего изобретения включаются также сочетания соединения формулы (I) с дополнительным терапевтическим агентом, применяемым с целью дополнительного лечения, в которых указанный дополнительный терапевтический агент включает один или более членов, независимо выбранных из группы, состоящей из ингибиторов пролиферации, например, гидроксимочевины; иммуномодуляторов, например, сарграмостима и различных форм интерферона или производных интерферона; ингибиторов слияния, например, AMD3100, Т-20, PRO-542, AD-349, ВВ 10010 и других агонистов/антагонистов рецептора хемокинов; ингибиторов интегразы, например, AR177; ингибиторов РНКазыН; ингибиторов транскрипции вируса и репликации РНК; и других агентов, которые ингибируют вирусную инфекцию или улучшают состояние или исход ВИЧ-инфицированных индивидуумов, действующих посредством различных механизмов. Предпочтительные способы лечения настоящего изобретения для профилактики ВИЧ инфекции или лечения субъектов с авиремией или без симптомов потенциально или действительно инфицированных ВИЧ, включают, но не ограничиваются этим, введение независимо одного из: (i) соединения в объеме формулы (I),как здесь раскрыто; (ii) одного NNRTI в дополнение к соединению (i); (iii) двух NRTI в дополнение к соединению (i); (iv) одного NRTI в дополнение к сочетанию (ii); и (v) соединения,выбранного из класса протеазных ингибиторов,применяемого вместо NRTI в сочетаниях (iii) и(iv). Предпочтительные способы настоящего изобретения для лечения ВИЧ-инфицированных индивидуумов с выявляемой виремией и ненормально низкими показателями CD4 дополнительно включают в качестве члена, выбранного из: (vi) лечения, согласно (i) выше, в дополнение к стандартно рекомендуемым начальным режимам для лечения установленных ВИЧ инфекций, например, как описано Bartlett, J. G., 004988"1998 Medical management of HIV infection",Johns Hopkins University publishers, ISBN 09244-2809-0. Такие стандартные режимы включают, но не ограничиваются этим, агент из класса протеазных ингибиторов в сочетании с двумя NRTIs; и (vii) стандартно рекомендуемые начальные режимы для лечения установленных ВИЧ инфекций, например, как описано Bartlett,J. G., "1998 Medical management of HIVinfection", Johns Hopkins University publishers,ISBN 0-9244-2809-0), где либо компонент протеазного ингибитора, либо один или оба NRTIs заменен/заменены соединением, находящимся в объеме формулы (I), как здесь раскрыто. Предпочтительные способы настоящего изобретения для лечения ВИЧ инфицированных индивидуумов, которые не отвечали на противовирусную терапию, дополнительно включают введение, выбранного из: (viii) лечения, согласно (i), как описано выше, в дополнение к стандартно рекомендуемым режимам лечения таких больных, например, как описано Bartlett, J. G.,"1998 Medical management of HIV infection",Johns Hopkins University publishers, ISBN 09244-2809-0); и (ix) стандартно рекомендуемых начальных режимов лечения больных, которые не отвечали на терапию против ретровирусов,например, Bartlett, J. G., "1998 Medical management of HIV infection", Johns Hopkins Universitypublishers, ISBN 0-9244-2809-0), где либо один из компонентов протеазного ингибитора, либо один или оба NRTIs заменен/заменены соединением, находящимся в объеме формулы (I), как здесь раскрыто. В описанных выше предпочтительных сочетаниях осуществления настоящего изобретения соединение формулы (I) и другие терапевтически активные агенты могут быть введены в лекарственных формах либо раздельно, либо совместно друг с другом, а время их введения может быть либо последовательно, либо одновременно. Так, введение однокомпонентного агента может предшествовать, быть одновременным, либо следовать за введением агента(тов) другого компонента. Соединения формулы (I) можно вводить в соответствии с режимом от 1 до 4 раз в день,предпочтительно один или два раза в день. Конкретная величина дозы и частота дозировки для конкретного больного может варьировать и должна зависеть от множества факторов, включая активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия данного соединения,возраст, массу тела, общее состояние здоровья,пол, диету, способ и время введения, скорость экскреции, сочетание лекарств, тяжесть конкретного состояния, и терапию, которой подвергается хозяин. В частности, однако, при лечении ретровирусных инфекций и более конкретно ВИЧ можно руководствоваться генотипированием и фенотипированием вируса в ходе или 21 перед началом введения терапевтического агента. Таким путем можно оптимизировать режимы дозировки и эффективность при введении соединения формулы (I) для профилактики или лечения инфекции ретровирусом, в частности вирусом иммунодефицита человека (ВИЧ). Соединения данного изобретения могут быть применены для лечения респираторных заболеваний, включая: синдром респираторного дистресса взрослых (ARDS), бронхит, хронический бронхит, хроническое обструктивное заболевание легких, кистозный фиброз, астму, эмфизему, ринит и хронический синусит. Изобретение дополнительно описано с помощью примеров, но без какого-либо ограничивающего значения. Применялись следующие общие синтетические пути. Синтез I Получение соединений формулы II из аминокислотного производного I, где Р является подходящей защитной группой (предпочтительно ВОС), может быть осуществлено, например,с помощью реакции с ди-третбутилдикарбонатом в присутствии основания,такого как водный гидроксид натрия, в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы III могут быть получены восстановлением соединений формулы II с применением подходящего восстанавливающего агента, предпочтительно, гидроксида диизобутилалюминия в дихлорметане, при -78 С. Соединения общей формулы IV могут быть получены с помощью восстановительного алкилирования подходящего амина формулы V альдегидом формулы III. Реакцию можно проводить в присутствии избытка подходящего восстанавливающего агента (например, триацетоксиборгидрида натрия) в системе протонного растворителя (уксусная кислота в дихлорметане или 1,1,1-трихлорэтане) при комнатной температуре. Последующее удаление защитной группы азота может быть осуществлено с помощью трифторуксусной кислоты или соляной кислоты 22 в растворителе, таком как диоксан или дихлорметан, при комнатной температуре в течение от 1 до 60 ч для получения соединения формулыVI. Соединения общей формулы VII могут быть получены путем связывания амина формулы VI с кислотой (Z = ОН) или производным кислоты(например, Z = Сl) формулы VIII с применением традиционных способов образования амидной связи. Например, кислота VIII может быть активирована с помощью карбодиимида, такого как 3-(3-диметиламино-1-пропил)-1-этилкарбодиимид, необязательно в присутствии гидрата 1 гидроксибензотриазола. Эти реакции можно проводить в подходящем растворителе, таком как дихлорметан, необязательно в присутствии третичного амина, такого как триэтиламин илиN-этилдиизопропиламин, при приблизительно комнатной температуре. В другом варианте хлористый ацил формулы VIII может быть подвергнут взаимодействию с амином формулы VI в присутствии третичного амина, такого как триэтиламин или Nэтилдиизопропиламин, в подходящем растворителе, таком как дихлорметан, при комнатной температуре в течение приблизительно 3 ч. В дополнительном варианте соединение формулы VII может быть образовано в процедуре "в одной емкости" путем снятия защиты с соединения формулы IV и связывания полученного амина формулы VI с кислотным производным формулы VIII с применением ранее описанных способов. Синтез II Соединения формулы IX могут быть получены связыванием аминокислотного производного формулы I с хлоридом кислоты формулыVIII в присутствии третичного амина, такого как триэтиламин, в подходящем растворителе,таком как дихлорметан, между 0 С и комнатной температурой. Соединения формулы X могут быть получены восстановлением соединений формулы IX согласно способу, описанному в синтезе I. Восстановительное алкилирование амина формулы V альдегидом формулы X в соответствии со способом, описанным в синтезе I,может давать соединения формулы VII. Синтез III Соединения общей формулы XII могут быть получены путем связывания амина формулы VI с защищенным аминокислотным производным формулы XI (где Z = Сl или ОН и Р предпочтительно является ВОС или бензилом) с помощью способов, ранее описанных в синтезеI. Удаление защитной группы азота с помощью стандартной методики дает соединение формулы XIII. Обычно удаление Cbz защитной группы может быть осуществлено в условиях каталитического гидрирования с применением катализатора, такого как катализатор Pearlman, в присутствии избытка формиата аммония в подходящем растворителе, таком как этанол, в условиях кипения с обратным холодильником. Соединения формулы XIV могут быть получены связыванием амина формулы XIII с подходящим ацилхлоридом с применением способов, описанных ранее в синтезе II. В другом варианте соединение формулыXIV может быть образовано в процедуре "в одной емкости" путем снятия защиты с азотной группы и связывания полученного промежуточного продукта с ацилхлоридом, как описано выше. Синтез IV Соединения формулы XVI могут быть получены путем алкилирования аминов формулыXV с применением подходящего алкилирующего агента, предпочтительно 2-фторнитробензола, в присутствии избытка подходящего основания, обычно карбоната калия, в растворителе,таком как N,N-диметилформамид, при температуре между 100 С и 140 С в течение приблизительно от 2 до 18 ч. Соединения формулы XVII могут быть получены восстановлением соответствующих соединений формулы XVI. Это восстановление можно проводить при множестве условий реакции, например, путем каталитического гидрирования (10% палладий на угле в 24 растворителе, таком как этилацетат, необязательно в присутствии спирта, такого как метанол, при давлении 1 атм. Н 2 при комнатной температуре) или путем восстановления, катализируемого переходным металлом (при температуре кипения с обратным холодильником в присутствии избытка порошка железа в уксусной кислоте или порошка железа и хлористого кальция в водном этаноле, или избытка дигидрата хлористого олова в этаноле в течение приблизительно 2 ч). Специалистам должно быть ясно,что когда P1 является кислотонеустойчивым,(например, ВОС), условия, необходимые для катализируемого переходным металлом восстановления, могут также вызывать одновременное снятие зашиты с группы, содержащей азот. Соединения формулы XVIII могут быть получены путем конденсации амина формулыXVII и подходящего орто-эфира в условиях кипения с обратным холодильником, необязательно в присутствии кислого катализатора (например, соляной кислоты или п-толуолсульфокислоты). Удаление защитной группы азота (когда это необходимо) для получения амина формулыV может быть осуществлено с помощью способа Genet et al. (Tet. Lett. 36; 8; 1267, 1995) или с помощью способов, описанных выше. Синтез V Амин формулы XX может быть получен из спирта формулы XIX путем взаимодействия защищенного амина (P2NH2), например, фталимида, согласно способу Mitsunobu (Org. React. 1992; 42; 335). Соединение формулы XXI может быть получено согласованным метилированием и защитой амина формулы XX. Обычно это достигается с помощью большого избытка этилхлорформиата в подходящем растворителе, таком как толуол, при приблизительно 90 С. Удаление защиты с азота (Р 2) соединения формулыXXI с использованием, например, гидразингидрата, в подходящем растворителе, таком как этанол, при температуре кипения с обратным холодильником давало амин формулы XV. Синтез VI Оксимы общей формулы XXIII могут быть получены путем конденсации соединений общей формулы XII с гидрохлоридом гидроксиламина в присутствии основания, такого как 25 пиридин, и в подходящем растворителе, обычно этаноле, при температуре кипения с обратным холодильником в течение приблизительно 2 ч. Восстановление соединений формулы XXIII может быть осуществлено с помощью натрия в присутствии спирта, обычно пентанола, для получения амина формулы XV. Синтез VIIXXI может быть получен в другом варианте путем взаимодействия кетона формулы XXII с защищенным амином (предпочтительно бензилом) с помощью методологии восстановительного аминирования, как описано ранее в синтезеI. Снятие защиты этой бензильной группы обычно с применением условий каталитического гидрирования, используя палладий на угле в качестве катализатора, в подходящем растворителе, таком как этилацетат, при давлении 1 атм. Н 2 при температуре между приблизительно комнатной температурой и 50 С дает амин формулы XV. Синтез VIII Соединения формулы XXIII могут быть получены путем связывания защищенного амина формулы XV (P1 представляет собой, например, ВОС или бензил) с карбоновой кислотой формулы (R5CH2COOH). Связывание может быть осуществлено с помощью обычных способов образования амидной связи, как описано в синтезе I. Например, кислота может быть активирована с помощью карбодиимида, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид,в присутствии 1-гидроксибензотриазола в подходящем растворителе, таком как дихлорметан,в присутствии третичного амина, такого как диизопропиламин. Соединения формулы V могут быть получены путем снятия защиты азота соединений формулы XXIII с помощью способов, ранее описанных выше. Соединения формулы VI могут быть получены восстановительным аминированием аминов формулы V подходящим альдегидом формулы III. Реакцию можно проводить в присутствии подходящего восстанавливающего агента (например, триацетоксиборгидрида натрия) в системе протонного растворителя (например, в уксусной кислоте, 004988 26 дихлорметане). Снятие защиты азота с помощью стандартной методологии, как описано ранее, дает соединения общей формулы VI. Синтез IX Соединения формулы XXIV могут быть получены из карбонильных соединений формулы XXII путем обработки сначала подходящим основанием, таким как диизопропиламин лития,при -78 С и гашением полученного аниона подходящим электрофильным трифлатом, таким как N-(5-хлор-2-пиридил)трифлимид, в растворителе, таком как тетрагидрофуран, в соответствии со способом Comins (Tet. Lett. 33; 6299; 1992). Соединения формулы XXV могут быть получены из соединений формулы XXIV путем катализируемой палладием функционализации винильной трифлатной группы. Например, обработка соединения XXIV палладиевым катализатором (полученным in situ из ацетата палладия и трифенилфосфина) в присутствии подходящего основания, такого как триэтиламин, в смеси ДМФ и метанола в атмосфере окиси углерода дает соединения формулы XXV. Соединения формулы XXVI могут быть получены в двухстадийной процедуре "в одной емкости" из соединений формулы XXIV. Восстановление двойной связи в условиях гидрирования, обычно с помощью катализатора, такого как никель Raney, в спирте (например, метаноле) при давлении Н 2 60 фунт/кв. дюйм (413,4 кн/м 2) при комнатной температуре. Гидролиз промежуточного алкилэфира в соответствии с множеством в настоящее время доступных способов давал соединения формулы XXVI. Например, обработка гидроксидом натрия в смеси тетрагидрофурана и воды при комнатной температуре. Соединения формулы XXVII могут быть получены связыванием кислоты формулы XXVI с подходящим оксимом с последующей in situ циклоконденсацией. Например, кислоту можно активировать с помощью фторирующего агента,такого как гексафторфосфат 27 комнатной температуре. Циклоконденсация полученного промежуточного продукта может быть впоследствии осуществлена нагреванием в подходящем растворителе, таком как диоксан,при повышенной температуре (например,130 С) в течение приблизительно 3 ч. Снятие защитной группы азота (обычно ВОС) соединений формулы XXVII с помощью стандартной методологии, такой как протонолиз, с помощью соляной кислоты в соответствии со способами, описанными ранее, дает соединения формулы XXVIII. Получение 1. Гидрохлорид метил 3-амино 3-фенилпропаноата. 3-Фенилаланин (13,0 г, 78,8 ммоль) растворяли в метанольном растворе НСl (200 мл,2,25 М). Реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 18 ч, затем охлажденную смесь концентрировали при пониженном давлении для получения соединения, указанного в заголовке, в виде желтого масла, 16,9 г. 1 Н-ЯМР (400 МГц, CD3OD)[м.д.] 3,003,19 (2 Н, м), 3,72 (3 Н, с), 4,74 (1 Н, т), 7,48 (5 Н,с). Получение 2. Метил 3-[(циклобутилкарбонил)амино]-3-фенилпропаноат. Хлорид циклобутанкарбонила (6,91 мл,86,7 ммоль) добавляли по каплям к раствору соединения, указанного в заголовке получения 1, (16,9 г, 78,8 ммоль) и триэтиламина (24,2 мл,173,4 ммоль) в дихлорметане (200 мл) при 0 С. Реакционную смесь перемешивали в течение 56 ч при комнатной температуре, после чего смесь промывали водой, затем насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель удаляли при пониженном давлении для получения соединения, указанного в заголовке, в виде желтого масла, 20,8 г. 1 Н-ЯМР (400 МГц, CDC13):[м.д.] 2,002,10 (2 Н, м), 2,10-2,35 (4 Н, м), 2,80-3,00 (2 Н, м),3,03 (1 Н, м), 3,62 (3 Н, с), 5,42 (1 Н, м), 6,50 (1 Н,д), 7,25-7,35 (5 Н, м). Гидрид диизобутилалюминия (42,1 мл, 1,0 М раствор в дихлорметане, 42,1 ммоль) добавляли по каплям к раствору соединения, указан 004988 28 ного в получении 2, (5,0 г, 19,1 ммоль) в дихлорметане (100 мл) при -78 СС. Реакционную смесь перемешивали при этой температуре в течение часа, затем добавляли метанол (5 мл),предварительно охлажденный до -78 С. Смесь нагревали до комнатной температуры и промывали 2 н. НСl, водой, насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде желтого масла, 3,3 г. 1 Н-ЯМР (400 МГц, CDCl3):[м.д.] 1,812,35 (6 Н, м), 2,90-3,10 (3 Н, м), 5,50 (1 Н, м), 6,00 Раствор трет-бутил (3S)-3-амино-3-фенилпропаноата (5,04 г, 22,9 ммоль) в 2,25 М метанольном растворе соляной кислоты (100 мл) нагревали при температуре кипения с обратным холодильником в течение 2 1/2 ч. Смесь охлаждали до комнатной температуры, подщелачивали насыщенным раствором карбоната натрия до рН 8 и фазы разделяли. Водный слой экстрагировали дихлорметаном (4), объединенные органические растворы промывали насыщенным раствором соли, сушили (MgSО 4), фильтровали и упаривали при пониженном давлении для получения указанного в заголовке соединения,3,97 г. 1 Н-ЯМР (400 МГц, CDC13):[м.д.] 1,70 Соединение, указанное в заголовке получения 4 (5,38 г, 30 ммоль), и ди-третбутилдикарбонат (8,72 г, 40 ммоль) в тетрагидрофуране (50 мл) и 2 н. раствор гидроксида натрия (25 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разводили этилацетатом, слои разделяли и водную фазу экстрагировали этилацетатом (2). Объединенные органические растворы промывали водой, насыщенным раствором соли, сушили(MgSО 4), фильтровали и упаривали при пониженном давлении для получения соединения,указанного в заголовке, в виде белого твердого вещества, 8,39 г. Получен из соединения, указанного в заголовке получения 4, и циклобутанкарбонилхлорида в виде коричневого твердого вещества с 82% выходом с применением процедуры, сходной с описанной в получении 2. 1 Н-ЯМР (300 МГц, CDC13):[м.д.] 1,812,06 (2 Н, м), 2,10-2,40 (5 Н, м), 2,82-3,08 (2 Н, м) ,3,62 (3 Н, с), 5,42 (1 Н, м), 6,42 (1 Н, д), 7,22-7,38-78 С и добавляли по каплям к раствору соединения, указанного в заголовке получения 5 (8,39 г, 30 ммоль), в дихлорметане (150 мл) при-78 С. Реакционную смесь перемешивали в течение 90 мин, затем добавляли метанол (предварительно охлажденный до -78 С) (40 мл). Смеси давали нагреться до комнатной температуры и вливали в 2 М НСl (200 мл). Слои разделяли и водную фазу экстрагировали дихлорметаном (2). Объединенные органические слои сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде белого твердого вещества, 6,72 г. 1 Получен из соединения, указанного в заголовке получения 6, в виде коричневого масла с 82% выходом с применением процедуры, сходной с описанной в получении 7. 1 Н-ЯМР (300 МГц, CDC13):[м.д.] 1,812,35 (6 Н, м), 2,90-3,10 (3 Н, м), 5,53 (1 Н, м), 5,98 30 Диэтилазодикарбоксилат (61,36 мл, 0,39 моль) добавляли по каплям в течение 1 ч к смеси трифенилфосфина (102,2 г, 0,39 моль), фталимида (52,04 г, 0,35 моль) и тропина (50 г, 0,35 моль) в тетрагидрофуране (400 мл) при 0 С. Реакционную смесь перемешивали в течение 20 ч при комнатной температуре, и растворитель упаривали при пониженном давлении. Остаток растворяли в дихлорметане, раствор экстрагировали НСl (21 н.) и объединенные водные экстракты подщелачивали карбонатом калия. Этот водный раствор затем экстрагировали дихлорметаном (3), объединенные органические экстракты сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Неочищенный продукт растирали с эфиром и фильтровали для получения указанного в заголовке соединения (12 г). Фильтрат упаривали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол (от 95:5 до 90:10) для дополнительного получения соединения, указанного в заголовке, (30 г суммарно). 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,40 Этил хлорформиат (22 мл, 0,2 моль) добавляли к раствору соединения, указанного в заголовке получения 9 (20 г, 7,4 ммоль), в толуоле (200 мл). Раствор нагревали до 90 С в течение 6 ч, затем смесь охлаждали, и растворитель выпаривали при пониженном давлении для получения указанного в заголовке соединения в виде твердого вещества, 22,3 г. 1 Н-ЯМР (400 МГц, CDCl3):[м.д.] 1,33 Гидрат гидразина (3,73 г, 74,6 ммоль) добавляли к раствору соединения, указанного в заголовке получения 10 (22,4 г, 68,2 ммоль), в этаноле (200 мл) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 1 3/4 ч. К охлажденной смеси добавляли воду (500 мл), данный раствор подкисляли, применяя концентрированную НСl(100 мл), преципитат отфильтровали и водный фильтрат подщелачивали до рН 8 применяя карбонат натрия. Данный водный раствор экстрагировали дихлорметаном (3), объединенные органические экстракты сушили (MgSO4),фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде желтого масла, 12,7 г. 1 Н-ЯМР (300 МГц, CDC13):[м.д.] 1,24(50 г, 378 ммоль) в 0,025 М НСl (160 мл) охлаждали до 0 С в течение 16 ч. Добавляли гидрохлорид бензиламина (65 г, 453 ммоль), кетомалоновую кислоту (55 г, 377 ммоль) и водный раствор ацетата натрия (300 мл, 0,69 М) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь нагревали до 50 С в течение дополнительных 90 мин и затем охлаждали на бане со льдом, подщелачивая до рН 12 2 н. раствором гидроксида натрия. Слои разделяли, и водную фазу экстрагировали этилацетатом (3). Объединенные органические растворы промывали водой, сушили (MgSO4),фильтровали и упаривали при пониженном давлении. Остаточное коричневое масло перегоняли при пониженном давлении (126 С 3 мм ртутного столба) для получения соединения,указанного в заголовке, в виде не совсем белого твердого вещества, 37,81 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,64 Смесь соединения, указанного в заголовке получения 12 (15,0 г, 69,7 ммоль), ди-третбутилдикарбоната (18,2 г, 83,4 ммоль) и 20% мас./мас. гидроксида палладия на угле (3,0 г) в этилацетате (165 мл) перемешивали в течение 4 ч при комнатной температуре в атмосфере водорода при 39 фунт/кв. дюйм (268,71 кн/м 2) . Смесь фильтровали через Arbocel и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью гексан:эфир (от 100:0 до 50:50) для по 004988 32 лучения соединения, указанного в заголовке, в виде бесцветного масла, которое кристаллизовалось при стоянии, 16,2 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,48 Диэтилацеталь гликольальдегида (45,4 г,338 ммоль) добавляли по каплям к перемешиваемому раствору гидрида натрия (14,3 г, 60% диспергированный раствор в минеральном масле, 357 ммоль) в ксилоле (100 мл) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли диэтилацеталь бромацетальдегида (100 г, 507 ммоль). Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 20 ч, затем охлаждали до комнатной температуры, растворитель удаляли при пониженном давлении, и оставшийся раствор перегоняли при пониженном давлении (80 С 6 мм ртутного столба) для получения соединения, указанного в заголовке, в виде бесцветного масла, 60,8 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,22 Раствор соединения, указанного в заголовке получения 14 (53,6 г, 214 ммоль), в 0,025 М НСl (90 мл) перемешивали при комнатной температуре в течение 16 ч. Добавляли гидрохлорид бензиламина (30,7 г, 213 ммоль), кетомалоновую кислоту (26 г, 178 ммоль), и раствор ацетата натрия (8 г, 97 ммоль) в воде (180 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем нагревали до 50 С в течение 3 ч. Реакционную смесь охлаждали на бане со льдом, подщелачивая до рН 12, применяя 1 н. раствор гидроксида натрия. Слои разделяли, и водную фазу экстрагировали этилацетатом (2). Объединенные органические растворы промывали водой, сушили (MgSO4),фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования этилацетат, для получения соединения,указанного в заголовке, в виде белого твердого вещества, 41,5 г. 1 Н ЯМР (400 МГц, CD3OD):[м.д.] 0,75 Смесь соединения, указанного в заголовке получения 15 (10 г, 43,2 ммоль), 20% гидроксида палладия на угле (2 г) и ди-третбутилдикарбоната (11,32 г, 51,8 ммоль) в этилацетате (100 мл) гидрировали в атмосфере водорода при 40 фунт/кв. дюйм (275,6 кн/м 2) в течение 16 ч при комнатной температуре. Реакционную смесь фильтровали через Arbocel и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол (от 98:2 до 94:6) для получения соединения, указанного в заголовке, в виде белого твердого вещества, 9,80 г. 1 Н ЯМР (300 МГц, CDC13):[м.д.] 1,25 Раствор бис(диэтилацеталь)тиодигликольальдегида (30 г, 112,3 ммоль) (Carbohydr. Res. 1981 90(2) 309) в 0,025 М НСl (90 мл) перемешивали при 100 С в течение 1 ч. Раствор охлаждали до комнатной температуры и добавляли гидрохлорид аллиламина (13,65 г, 146 ммоль), кетомалоновую кислоту (16,4 г, 112,7 ммоль) и ацетат натрия (5,1 г, 62 ммоль) в воде (180 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем нагревали до 50 С в течение 2 ч. Реакционную смесь охлаждали на бане со льдом, подщелачивая до рН 12 раствором гидроксида натрия 1 н. Слои разделяли и водную фазу экстрагировали этилацетатом (3). Объединенные органические растворы промывали водой, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол (99:1) для получения соединения,указанного в заголовке, в виде розового твердого вещества, 6,41 г. 1 Н ЯМР (400 МГц, CD3C13):[м.д.] 2,15(36 мл, 71 ммоль) добавляли к перемешиваемому раствору соединения, указанного в заголовке получения 13 (13,41 г, 59 ммоль), в тетрагидрофуране при 78 С, и реакционную смесь перемешивали в течение 2 ч. Добавляли по каплям раствор(25,71 г, 65,45 ммоль) в тетрагидрофуране (60 мл) и реакционную смесь перемешивали в течение 2 ч при -78 С, затем ей давали нагреться до комнатной температуры. Раствор распределяли между дихлорметаном и водой, слои разделяли и органическую фазу промывали насыщенным раствором соли, сушили (MgSO4) и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на основной активированной окиси алюминия, применяя градиентное элюирование смесью дихлорметан:метанол (от 100:0 до 98:2) для получения указанного в заголовке соединения в виде желтого масла, 14,1 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,50 Смесь соединения, указанного в заголовке получения 18 (14,1 г, 39,4 ммоль), ацетата палладия (270 мг), трифенилфосфина (620 мг, 2,37 ммоль), триэтиламина (11 мл, 78,9 ммоль) и метанола (60 мл) перемешивали в N,N-диметилформамиде (150 мл) при комнатной температуре в атмосфере окиси углерода в течение 12 ч. Раствор распределяли между водой и этилацетатом, и водный слой экстрагировали этилацетатом (3). Объединенные органические растворы промывали водой, затем насыщенным раствором соли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Маслянистый остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол (от 100:0 до 95:5) для получения соединения, указанного в заголовке, в виде черного масла, 10,4 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,45 Смесь соединения, указанного в заголовке получения 19 (10,4 г, 38,9 ммоль), и никеля Raney (4 г) в метаноле (70 мл) перемешивали в атмосфере водорода при 60 фунт/кв. дюйм(413,4 кн/м 2) в течение 7 ч при комнатной температуре. Реакционную смесь фильтровали через Celite и растворитель удаляли при пониженном давлении. Полученное белое твердое вещество перемешивали с гидроксидом натрия(1,32 г, 33 ммоль), водой (10 мл) и тетрагидрофураном (70 мл) в течение 20 ч при комнатной температуре. Реакционную смесь распределяли между водой и дихлорметаном, слои разделяли и водную фазу экстрагировали дихлорметаном(2). Объединенные органические растворы сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол (98:2) для получения соединения, указанного в заголовке, в бесцветного масла, 3,23 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,45 (9 Н с), 1,65 (2 Н, м), 1,59 (2 Н, м), 1,90 (2 Н, м), 2,00 Раствор соединения, указанного в заголовке получения 13 (10,0 г, 44,4 ммоль), бензил амина (4,85 мл, 49,7 ммоль) и триацетоксиборгидрида натрия (14,11 г, 66,6 ммоль) перемешивали в течение 16 ч при комнатной температуре в смеси ледяная уксусная кислота:дихлорметан(290 мл) (1:9). Растворители выпаривали при пониженном давлении, и остаток растворяли в этилацетате, промывали насыщенным раствором карбоната натрия и затем водой. Органический раствор сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак (98:2:0,25) для получения соединения, указанного в заголовке,в виде белого твердого вещества 7,00 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,421,48 (11 Н м) , 1,52-1,61 (2 Н, м), 1,85-2,19 (5 Н,м), 2,95-3,03 (1 Н, м), 3,74 (2 Н, с), 4,03-4,23 (2 Н,м) , 7,20-7,26 (1 Н, м), 7,26-7,32 (4 Н, м) . Получение 23. 9-Бензил-3-окса-9-азабицикло[3.3.1]нонан-7-он оксим.(7,2 мл, 8 9 ммоль), нагревали при температуре кипения с обратным холодильником в этаноле(500 мл) в течение 20 ч. Реакционной смеси давали остыть до комнатной температуры и разводили раствором насыщенного карбоната натрия. Смесь фильтровали, и фильтрат упаривали при пониженном давлении. Остаток распределяли между дихлорметаном и водой, слои разделяли и водный слой экстрагировали дихлорметаном (2). Объединенные органические экстракты промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде бледно-коричневого твердого вещества, 18,10 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,451,56 (1 Н, м), 1,60-1,67 (1 Н, м), 1,96-2,07 Раствор соединения, указанного в заголовке получения 15 (7 г, 30 ммоль), гидрохлорид гидроксиламина (2,31 г, 33 ммоль) и пиридин (3 мл, 37 ммоль) в этаноле (300 мл) нагревали при температуре кипения с обратным холодильником в течение 2 ч. Реакционной смеси давали охладиться до комнатной температуры и добавляли насыщенный водный раствор карбоната натрия. Смесь фильтровали, и растворитель удаляли при пониженном давлении. Остаток распределяли между водой и дихлорметаном и слои разделяли. Водную фазу экстрагировали дополнительно дихлорметаном (2). Объединенные органические растворы промывали насыщенным раствором соли, сушили (MgSO4),фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде бледно-коричневого твердого вещества, 6,6 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 2,25 (1 Н с), 2,32 (1 Н, с), 2,40 (2 Н, м), 2,70 (2 Н, м), 2,90(5,32 мл, 48,7 ммоль), триацетоксиборгидрида натрия (12,9 г, 60,9 ммоль) и ледяной уксусной кислоты (2,5 мл) в дихлорметане (120 мл) перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь подщелачивали до рН 8, применяя насыщенный водный раствор карбоната натрия. Слои разделяли и водную фазу экстрагировали дихлорметаном (2). Объединенные органические растворы промывали насыщенным раствором соли, сушили (MgSO4),фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде масла, 2,45 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,45 Соединение, указанное в заголовке получения 17 (6,4 г, 32,4 ммоль), гидрохлорид гидроксиламина (2,48 г, 37,7 ммоль) и пиридин (3,2 мл, 39 ммоль) нагревали при температуре кипения с обратным холодильником в этаноле (140 мл) в течение 2 ч. Реакционной смеси давали охладиться до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток распределяли между насыщенным раствором карбоната натрия и дихлорметаном,слои разделяли и водную фазу экстрагировали дихлорметаном (2). Объединенные органические растворы промывали насыщенным раствором соли, сушили (MgSО 4), фильтровали и упаривали при пониженном давлении для получения указанного в заголовке соединения в виде коричневого твердого вещества, 6,33 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 2,152,45 (4 Н, м), 2,65 (1 Н, м), 3,1 (1 Н, д), 3,2-3,4 (6 Н,м) 5,1-5,3 (2 Н, м), 5,8 (1 Н, м), 8,0-8,6 (1 Н, уш.с).(500 мл) нагревали при температуре кипения с обратным холодильником, добавляя по порциям натрий (22,0 г, 957 ммоль) в течение 2 1/2 ч. Реакционную смесь затем нагревали при темпе 004988 38 ратуре кипения с обратным холодильником в течение дополнительных 2 ч, затем охлаждали до 0 С на бане со льдом и добавляли воду до тех пор, пока не переставал выделяться газообразный водород. Смесь подкисляли, применяя 6 н. НСl, и фазы разделяли. Органический слой экстрагировали 6 н. НСl (3), объединенные водные экстракты подщелачивали до рН 12 гранулами гидроксида натрия (400 г) и водный раствор экстрагировали этилацетатом (3). Объединенные органические растворы сушили (MgSO4),фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, 15,65 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,201,40 (2 Н, уш.м), 1,48 (2 Н, м), 1,58 (2 Н, д), 1,641,76 (2 Н, уш.м), 2,00 (2 Н, уш.м), 2,95 (1 Н, м),3,19 (2 Н, уш.с), 3,57 (2 Н, с), 7,18-7,26 (1 Н, м),7,30 (2 Н, м), 7,37 (2 Н, д). Смесь соединения, указанного в заголовке получения 22 (7,00 г, 22,1 ммоль), формиат аммония (7,00 г, 111 ммоль) и 20% мас./мас. гидроксида палладия на угле (700 м) в этаноле (200 мл) нагревали до 50 С до прекращения выделения газа. Охлажденную смесь фильтровали черезArbocel и фильтрат упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол:0,88 аммиак (от 98:2:0,25 до 95:5:0,5) для получения соединения, указанного в заголовке, в виде бесцветного масла, 4,70 г. Указанное в заголовке соединение получали (64%) из соединения, указанного в заголовке получения 23, с применением процедуры, сходной с описанной в получении 26. 1 Н ЯМР (300 МГц, CDC13):[м.д.] 1,70 39 Смесь соединения, указанного в заголовке получения 24 (2,45 г, 7,7 ммоль), и 10% палладий на угле (300 мг) в этилацетате (40 мл) гидрировали при 50 фунт/кв. дюйм (344,5 кн/м 2) в течение 36 ч при 50 С. Охлажденную реакционную смесь фильтровали через Arbocel и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак (79:20:1) для получения соединения, указанного в заголовке,в виде бесцветного масла, 1,44 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,45 Соединение, указанное в заголовке получения 25 (5,33 г, 25,1 ммоль), нагревали при температуре кипения с обратным холодильником в пентаноле (200 мл), добавляя по порциям натрий (5,8 г, 251,1 ммоль) в течение 1 ч. Реакционную смесь затем нагревали при температуре кипения с обратным холодильником в течение дополнительных 2 ч, затем охлаждали до 0 С на бане со льдом и добавляли воду до тех пор, пока не переставал выделяться газообразный водород. Смесь подкисляли 6 н. НСl, слои разделяли и органическую фазу экстрагировали 6 н. НСl (3). Объединенные водные экстракты подщелачивали до рН 12, применяя гранулы гидроксида натрия и раствор экстрагировали дихлорметаном (2). Объединенные органические слои сушили (MgSO4), фильтровали и упаривали при пониженном давлении и сушили вымораживанием из воды/ацетонитрила для получения соединения, указанного в заголовке,в виде коричневого порошка, 4,73 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,301,70 (4 Н, м), 1,90 (2 Н, м), 2,10 (2 Н, д), 3,06-4,42 Смесь соединения, указанного в заголовке получения 11 (12,79, 64,1 ммоль), карбоната калия (9,0 г, 65,1 ммоль) и 1-фтор-2 нитробензола (7,44 мл, 70,5 ммоль) в N,Nдиметилформамиде (30 мл) нагревали при 150 С в течение 2 1/2 ч. Охлажденную реакционную смесь концентрировали при пониженном давлении, и остаток распределяли между водой 40 и этилацетатом. Фазы разделяли, органический слой сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол (от 100:0 до 98:2) для получения соединения, указанного в заголовке, в виде твердого вещества, 16,9 г. 1 Н ЯМР (300 МГц, CDC13):[м.д.] 1,32(5,50 г, 40 ммоль) нагревали до 120 С в N,Nдиметилформамиде в течение 4 1/2 ч. Реакционной смеси давали охладиться до комнатной температуры и ее концентрировали при пониженном давлении. Остаток переносили в этилацетат и промывали водой. Органический слой сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак (98:2:0,25) для получения соединения, указанного в заголовке, в виде яркого оранжево-желтого твердого вещества,8,80 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,661,80 (4 Н, м) , 1,92-2,02 (2 Н, м), 2,08-2,20 (2 Н, м),3,32 (2 Н, с), 3,60 (2 Н, с), 3,85 (1 Н, м), 6,60 (1 Н,м) , 6,87 (1 Н, д) , 7,20-7,28 (1 Н, м), 7,32 (2 Н, м),7,38 (ЗН, м), 7,97 (1 Н, уш.д), 8,16 (1 Н, д). Смесь соединения, указанного в заголовке получения 27 (4,69 г, 20,7 ммоль), 1-фтор-2 нитробензола (3,21 г, 22,7 ммоль) и карбоната калия (3,21 г, 23,3 ммоль) нагревали в течение 2 ч в N,N-диметилформамиде (75 мл) при 100 С. Растворитель удаляли при пониженном давлении, и остаток распределяли между этилацетатом и водой. Слои разделяли и водную фазу экстрагировали этилацетатом. Органические растворы сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получе 41 ния указанного в заголовке соединения в виде ярко-оранжевого масла, которое кристаллизовалось при стоянии, 7,50 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,48[3.1.0]гекс-6-иламина (WO 9318001) (2,50 г, 13,3 ммоль) в N,N-диметилформамиде (40 мл) добавляли карбонат калия (4,59 г, 33,2 ммоль) и затем 1-фтор-2-нитробензол (1,87 г, 13,3 ммоль) и реакционную смесь перемешивали при 130 С в течение 18 ч. Охлажденную смесь фильтровали, и фильтрат концентрировали при пониженном давлении. Остаток распределяли между этилацетатом и водой, фазы разделяли, и водный слой экстрагировали этилацетатом (3). Объединенные органические растворы промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и упаривали при пониженном давлении. Оставшееся коричневое масло очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью пентан:этилацетат (от 95:5 до 90:10),для получения 3,11 г соединения, указанного в заголовке, в виде оранжевой кристаллической пены. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,64 Указанное в заголовке соединение получали (63%) в виде ярко оранжево-желтого твердого вещества из соединения получения 28 в соответствии с процедурой, описанной в получении 32. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,902,10 (4 Н, м) , 1,90 (2 Н, с), 3,82 (2 Н, д), 3,90 (2 Н,с), 3,97 (2 Н, д) , 4,90 (1 Н, м), 6,60 (1 Н, м), 7,00 Указанное в заголовке соединение получали в виде желто-оранжевого масла (99%) из соединения, указанного в заголовке получения 29,и 1-фтор-2-нитробензола в соответствии с процедурой, описанной в получении 32. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,50 Указанное в заголовке соединение получали в виде желто-оранжевого масла (53%) из соединения, указанного в заголовке получения 30,и 1-фтор-2-нитробензола в соответствии с процедурой, описанной в получении 32. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,90 Смесь соединения, указанного в заголовке получения 31, (16,9 г, 52,9 ммоль) и 10% палладия на угле (2,0 г) в метаноле (50 мл) и этилацетате (300 мл) гидрировали при 1 атм водорода и комнатной температуре в течение 15 ч. Реакционную смесь фильтровали через Arbocel, и фильтрат упаривали при пониженном давлении для получения 14,7 г соединения, указанного в заголовке, в виде темного твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3)[м.д.] 1,30 Смесь соединения, указанного в заголовке получения 32, (8,80 г, 26 ммоль) и 10% палладия на угле (1,0 г) в этилацетате (300 мл) и метаноле 43 Реакционную смесь фильтровали черезArbocel и фильтрат удаляли при пониженном давлении для получения 7,23 г указанного в заголовке соединения в виде темно-коричневого масла. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,59 К раствору соединения, указанного в заголовке получения 33, (7,50 г, 21,6 ммоль) в этаноле (200 мл) в течение 25 мин добавляли дигидрат хлористого олова(II) (25,0 г, 111 ммоль) в пяти равных порциях по 5 г и смесь нагревали при кипении с обратным холодильником в течение 2 ч. Охлажденную смесь концентрировали при пониженном давлении, и остаток обрабатывали 6 М раствором гидроксида натрия до появления щелочной реакции. Добавляли этилацетат, смесь фильтровали через Celite, и слои разделяли. Органическую фазу сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения 3,10 г указанного в заголовке соединения в виде бесцветного масла. К раствору соединения, указанного в заголовке получения 34, (1,50 г, 4,85 ммоль) добавляли порошок железа (2,44 г, 43,6 ммоль) и хлористый кальций (269 мг, 2,42 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 18 ч. Охлажденную смесь фильтровали через Celite,промывая этанолом, фильтрат упаривали при пониженном давлении, и азеотропировали толуолом. Остаток очищали колоночной хроматографией на силикагеле с применением в качестве элюента смеси дихлорметан:метанол:0,88 аммиак (97,5:2,5:0,25) для получения 751 мг указанного в заголовке соединения в виде темно-коричневого масла. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,58 Смесь соединения, указанного в заголовке получения 35, (4 г, 11 ммоль) и 10% палладия на угле (0,5 г) в этилацетате (60 мл) гидрировали при 1 атмосфере водорода в течение 4 ч при комнатной температуре. Реакционную смесь фильтровали через Arbocel и растворитель удаляли при пониженном давлении для получения 2,87 г соединения, указанного в заголовке, в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,80 Указанное в заголовке соединение получали в виде темного масла (97%) из соединения,указанного в заголовке получения 36, в соответствии с процедурой, описанной в получении 42. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,00 Смесь соединения, указанного в заголовке получения 37, (3,9 г, 12,211 ммоль), порошка железа (10 г) и ледяной уксусной кислоты (10 мл) нагревали до кипения с обратным холодильником в смеси вода:этанол (2:1, 150 мл) в течение 1 ч. Реакционной смеси давали остыть до комнатной температуры, подщелачивали 1 М раствором гидроксида натрия и разводили этилацетатом. Смесь фильтровали, слои разделяли и водную фазу экстрагировали этилацетатом (3). Объединенные органические растворы промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и упаривали при пониженном давлении для получения 3,7 г соединения, указанного в заголовке, в виде коричневого масла. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,77 Раствор соединения, указанного в заголовке получения 38 (14,7 г, 50,8 ммоль), в триэтилортоацетате (200 мл) нагревали при температуре кипения с обратным холодильником в течение 18 ч. Охлажденную реакционную смесь упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде коричневого масла, которое кристаллизовалось при стоянии, 15,9 г. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 1,191,31 (2 Н, м), 1,40 (3 Н, м), 1,82 (4 Н, м), 2,20 (2 Н,м), 2,62 (3 Н, с), 4,31 (2 Н, м), 4,57 (2 Н, уш.с),4,74 (1 Н, м), 7,18 (2 Н, м), 7,49 (1 Н, м), 7, 64 (1 Н,м). Смесь соединения, указанного в заголовке получения 39, (17,00 г, 55 ммоль) нагревали при температуре кипения с обратным холодильником в триэтилортоацетате (250 мл) в течение 16 ч, затем охлаждали. Избыток триэтилортоацетата выпаривали при пониженном давлении и остаток и 4-толуолсульфокислоту (3,00 г) нагревали при температуре кипения с обратным холодильником в толуоле (250 мл) в течение 18 ч. Охлажденную смесь упаривали при пониженном давлении, остаток суспендировали в дихлорметане, и промывали раствором насыщенного карбоната натрия, водой и насыщенным раствором соли. Органический раствор сушили(MgSO4), фильтровали и упаривали при пониженном давлении для получения указанного в заголовке соединения, 18,32 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,651,74 (2 Н, м), 1,74-1,82 (2 Н, м), 2,14-2,28 (2 Н, м),2,58-2,72 (5 Н, м), 3,40 (2 Н, уш.с), 3,66 (2 Н, с),4,56 (1 Н, м), 7,16-7,32 (3 Н, м), 7,37 (2 Н, м), 7,47 Раствор соединения, указанного в заголовке получения 41 (751 мг, 2,69 ммоль) в уксусном ангидриде (10 мл), перемешивали при 130 С в течение 18 ч. Охлажденный раствор подщелачивали до рН 8, применяя насыщенный водный 46 раствор бикарбоната натрия, и данную смесь экстрагировали этилацетатом (3). Объединенные органические экстракты промывали насыщенным раствором соли, сушили (MgSO4),фильтровали и упаривали при пониженном давлении. Остаточное коричневое масло очищали колоночной хроматографией на силикагеле,применяя для злюирования смесь дихлорметан:метанол:0,88 аммиак (97,5:2,5:0,25), для получения соединения, указанного в заголовке, в виде коричневого масла, 200 мг. 1 Н ЯМР (300 МГц, CDCl3):[м.д.] 2,02 Раствор соединения, указанного в заголовке получения 20 (1,0 г, 3,91 ммоль), в дихлорметане (10 мл) обрабатывали N-этилдиизоопропиламином (815 мкл, 4,69 ммоль). Добавляли гексафторфосфат бис(тетраметилен)фторформамидиния (1,48 г, 4,68 ммоль) и раствор перемешивали при комнатной температуре в течение 1 ч. Добавляли N-гидрокси-2-4-[(метилсульфонил)амино]фенил этаниминовую кислоту (J. Med. Chem. 1993; 36(11); 1529), (1,14 г, 4,69 ммоль) и N-этилдиизопропиламин (680 мкл, 3,91 ммоль), полученный раствор перемешивали при комнатной температуре в течение 48 ч, затем нагревали до 50 С для концентрирования раствора. Добавляли диоксан (20 мл), раствор нагревали до 120 С в течение 3 ч, охлаждали до комнатной температуры, разводили этилацетатом и подщелачивали 10% водным раствором бикарбоната натрия. Слои разделяли,водную фазу экстрагировали этилацетатом, и объединенные органические растворы сушили(MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол (98:2) для получения соединения, указанного в заголовке, в виде масла, 1,48 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,45 47 Смесь соединения, указанного в заголовке получения 42 (2,87 г, 8,9 ммоль) в триэтилортоацетате (20 мл) нагревали при температуре кипения с обратным холодильником в течение 8 ч. Охлажденную реакционную смесь упаривали при пониженном давлении. Маслянистый остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования этилацетат:пентан (20:80) для получения соединения, указанного в заголовке, в виде желтого масла, 1,47 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,78 Раствор соединения, указанного в заголовке получения 43 (1,88 г, 5,6 ммоль), в триэтилортоацетате (20 мл) нагревали при температуре кипения с обратным холодильником в течение 7 ч. Охлажденную смесь концентрировали при пониженном давлении и остаток перерастворяли в толуоле (250 мл). Добавляли 4-толуолсульфокислоту (300 мг, 1,57 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 2 ч, затем охлаждали. Растворитель выпаривали при пониженном давлении, остаток суспендировали в этилацетате, и промывали 10% водным раствором бикарбоната натрия. Органический слой сушили (Na2SO4), фильтровали и упаривали при пониженном давлении для получения указанного в заголовке соединения, 1,64 г. Найдено: С 67,00; Н 7,67; N 11,64%. Для C20H27N3O3 вычислено: С 67,20; Н 7,67; N 11,64%. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,30 Раствор соединения, указанного в заголовке получения 44 (3,68 г, 12,21 ммоль), нагревали при температуре кипения с обратным холодильником в триэтилортоацетате (20 мл) в течение 48 16 ч. Избыток триэтилортоацетата упаривали при пониженном давлении. Полученное масло очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан: метанол (99,5:1). Продукт суспендировали в толуоле (80 мл), добавляли паратолуолсульфокислоту (каталитическую), и смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч, затем охлаждали и концентрировали при пониженном давлении. Остаток растворяли в этилацетате и промывали водным насыщенным раствором бикарбоната натрия, водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде желтовато-коричневого твердого вещества, 1,25 г. Найдено: С 67,81; Н 7,44; N 12,86%. Для C18H23N3S;0,35H2O вычислено: С 67,61; Н 7,47; N 13,14%. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,50 Смесь соединения, указанного в заголовке получения 45 (1,3 г, 4,15 ммоль) в НСl (6 н., 30 мл) нагревали до 120 С в течение 20 ч. Охлажденную реакционную смесь подщелачивали раствором гидроксида натрия (15%) и раствор экстрагировали дихлорметаном (4). Объединенные органические экстракты сушили(MgSO4), фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак (95:5:0,5) для получения указанного в заголовке соединения в виде твердого вещества, 620 мг. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 1,641,98 (6 Н, м), 2,49 (2 Н, м), 2,59 (3 Н, с), 3,66 (2 Н,м) 4,50 (1 Н, м), 7,12 (2 Н, м), 7,51 (1 Нм), 7,63LRMS: m/z 242 (МН+). Альтернативный способ Формиат аммония (2,82 г, 44,8 ммоль) добавляли к соединению, указанному в заголовке получения 46 (2,84 г, 8,6 ммоль), и гидроксиду палладия (2,0 г) в этаноле (60 мл). Смесь нагревали при температуре кипения с обратным холодильником в течение 1 1/2 ч и реакционной смеси давали охладиться до комнатной температуры и ее фильтровали через Arbocel. Рас 49 творитель упаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол:0,88 аммиак(с 98:2:0,25 до 95:5:0,5) для получения указанного в заголовке соединения, 1,74 г. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 1,741,87 (4 Н, м), 1,90-2,02 (2 Н, м), 2,53 (2 Н, м), 2,63 Раствор соединения, указанного в заголовке получения 40 (2,0 г, 9,2 ммоль), и триэтилортоацетата (50 мл) нагревали при температуре кипения с обратным холодильником при 150 С в течение 1 ч. Охлажденную смесь концентрировали при пониженном давлении. Остаток растворяли в этилацетате и промывали насыщенным водным раствором карбоната натрия, затем водой. Органический раствор сушили (MgSO4),фильтровали и упаривали при пониженном давлении. Остаток растворяли в 50 мл 2,25 М метанолового раствора НСl и нагревали при температуре кипения с обратным холодильником в течение 24 ч. Растворитель удаляли при пониженном давлении для получения соединения,указанного в заголовке, в виде не совсем белого твердого вещества, 1,05 г. 1 Н ЯМР (400 МГц, D2O): 5 [м.д.] 2,20-2,42 Раствор соединения, указанного в заголовке получения 40 (1,10 г, 5,06 ммоль), в 30 мл триэтилортоформиата нагревали при температуре кипения с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении, и остаток нагревали при температуре кипения с обратным холодильником в течение 1 ч в 30 мл смеси диоксан : концентрированная НСl (2:1). Растворители удаляли при пониженном давлении. Остаток подщелачивали насыщенным раствором карбоната натрия и экстрагировали дихлорметаном (3). Объединенные органические растворы сушили(MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол: Смесь соединения, указанного в заголовке получения 47 (200 мг, 0,70 ммоль), формиата аммония (1,4 г, 22,2 ммоль), и 10% палладия на угле (90 мг) в метаноле (10 мл) нагревали при температуре кипения с обратным холодильником в течение 2 ч. Охлажденную реакционную смесь фильтровали через Celite, дополнительно промывая метанолом. Фильтрат упаривали при пониженном давлении для получения желтого масла. Неочищенный продукт очищали колоночной хроматографией на силикагеле,применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак (95:5:1) для получения соединения, указанного в заголовке, 56 мг. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 2,12 Раствор соединения, указанного в заголовке получения 48 (1,48 г, 3,20 ммоль), в 4 М НСl в диоксане (15 мл) перемешивали в течение 2 ч при комнатной температуре. Растворитель выпаривали при пониженном давлении, и маслянистый остаток распределяли между дихлорметаном и раствором карбоната натрия. Фазы разделяли, и водный слой экстрагировали дихлорметаном (2). Объединенные органические растворы сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан : метанол: 0,88 аммиак (с 98:2:0 до 89:10:1) для получения соединения, указанного в заголовке, в виде коричневого твердого вещества, 375 мг. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,70 К соединению, указанному в заголовке получения 49, (1,12 г, 3,2 ммоль) и гидроксиду палладия (0,1 г) в этаноле (50 мл) добавляли формиат аммония (1 г, 15,8 ммоль) и смесь нагревали при температуре кипения с обратным холодильником в течение 2 ч. Реакционной смеси давали охладиться до комнатной температуры и фильтровали через Arbocel. Растворитель упаривали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан:метанол:0,88 аммиак (от 97:3:0 до 89:5:1) для получения 651 мг указанного в заголовке соединения. Найдено: С 67,86; Н 7,79; N 15,47%. Для C15H19N2O;0,5H2O вычислено: С 67,64; Н 7,57; N 15,78%. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 2,10 Раствор соединения, указанного в заголовке получения 50, (1,64 г, 4,59 ммоль) и 4 М НСl в диоксане (15 мл) перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали при пониженном давлении, и остаток подщелачивали до рН 8 насыщенным водным раствором карбоната натрия. Водный слой экстрагировали дихлорметаном (2). Объединенные органические растворы промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения 1,08 г соединения, указанного в заголовке, в виде темного твердого вещества. 1 Н ЯМР (400 МГц, CDC13):[м.д.] 2,20 52 бензойной кислоты (0,70 г 4,6 ммоль) в тетрагидрофуране (10 мл) и раствор перемешивали в течение 16 ч, после чего упаривали при пониженном давлении. Красное твердое вещество очищали колоночной хроматографией на силикагеле, применяя в качестве элюента смесь дихлорметан: метанол (97:3). Продукт растворяли в дихлорметане и промывали насыщенным раствором бикарбоната натрия, водой и насыщенным раствором соли. Органический слой сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения 0,66 г соединения, указанного в заголовке, в виде желтовато-коричневого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 2,05(2,20 мл, 12,6 ммоль) нагревали при температуре кипения с обратным холодильником в дихлорметане (20 мл) в течение 20 мин. Реакционную смесь охлаждали на бане со льдом и добавляли бензил хлорформиат (0,92 мл, 6,4 ммоль). Смесь перемешивали при комнатной температуре в течение 72 ч перед гашением насыщенным водным раствором бикарбоната натрия. Слои разделяли, водную фазу подкисляли до рН 2 2 н. НСl и экстрагировали этилацетатом (3). Объединенные органические экстракты сушили(MgSO4), фильтровали и упаривали при пониженном давлении для получения 1,01 г соединения, указанного в заголовке, в виде коричневого масла. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 3,44 К суспензии 3-азетидинкарбоновой кислоты (1 г, 10 ммоль) и карбоната калия (1,8 г, 13 ммоль) в воде (18 мл) и диоксане (18 мл) при 0 С добавляли ди-трет-бутилдикарбонат (3,02 г,13,8 ммоль) при перемешивании и давали нагреться до комнатной температуры. Смесь перемешивали в течение 15 ч и затем концентри 53 ровали при пониженном давлении. Остаток подкисляли до рН 4 добавлением 1 М раствора лимонной кислоты и экстрагировали дихлорметаном (3). Объединенные органические экстракты промывали водой, затем насыщенным раствором соли, сушили (MgSO4), фильтровали и растворитель выпаривали при пониженном давлении для получения 2,1 г соединения, указанного в заголовке, в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,44(75 мг, 1,25 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Смесь подщелачивали 10% водным раствором карбоната натрия и экстрагировали дихлорметаном (2). Объединенные органические экстракты промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения 444 мг указанного в заголовке соединения в виде белой пены. 1 Н-ЯМР (400 МГц, CDCl3):[м.д.] 1,37 Раствор соединений, указанных в заголовках получений 7 (480 мг, 1,93 ммоль) и 53 (600 мг, 1,91 ммоль), и триацетоксиборгидрида натрия (600 мг, 2,83 ммоль), перемешивали вместе в 30 мл смеси ледяная уксусная кислота:дихлорметан (1:9) в течение 30 мин при комнатной температуре. Растворители удаляли при пониженном давлении, остаток подщелачивали 6 н. NaOH и затем экстрагировали дихлормета 004988 54 ном (3). Объединенные органические экстракты сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения 900 мг соединения, указанного в заголовке, в виде пены. Указанное в заголовке соединение получали из соединений, указанных в заголовках получений 7 и 56, следуя процедуре, сходной с описанной в получении 62. Неочищенный продукт очищали колоночной хроматографией на силикагеле, применяя градиентное элюирование смесью дихлорметан: метанол (от 99:1 до 98:2) для получения 392 мг соединения, указанного в заголовке, в виде белой пены. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,38 Указанное в заголовке соединение получали в виде белого твердого вещества (90%) из соединений, указанных в заголовках получений 7 и 57, следуя процедуре получения 64. Найдено: С 69,10; Н 7,91; N 10,47%. Для С 29 Н 38N4 О 3;0,8 Н 2 О вычислено: С 68,97; Н 7,90; N 10,37%. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,40 Указанное в заголовке соединение получали в виде белого твердого вещества (77%) из 55 соединений, указанных в заголовках получений 7 и 59, следуя процедуре получения 64. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,4 (9 Н,с), 1,80-2,0 (4 Н, м), 2,36 (2 Н, т), 2,64 (3 Н, с),2,70-2,90 (4 Н, м), 3,35 (2 Н, с), 3,45 (2 Н, т), 4,90 Раствор соединения, указанного в заголовке получения 62 (1,00 г, 2,1 ммоль), и трифторуксусную кислоту (8 мл) в дихлорметане (20 мл) перемешивали в течение 60 ч при комнатной температуре. Растворитель концентрировали при пониженном давлении, и остаток гасили насыщенным водным раствором карбоната натрия. Данную водную смесь экстрагировали дихлорметаном (3) и объединенные органические экстракты промывали насыщенным раствором соли, сушили (MgSO4) , фильтровали и упаривали при пониженном давлении для получения указанного в заголовке соединения, 600 мг. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,601,84 (6 Н, м), 1,92 (2 Н, м), 2,01-2,14 (2 Н, уш.м),2,51 (3 Н, м) 2,54-2,66 (4 Н, м), 3,44 (2 Н, м), 4,17 Раствор соединения, указанного в заголовке получения 63 (900 мг, 1,90 ммоль), перемешивали в течение 1 ч при 40 С в 30 мл смеси дихлорметан:трифторуксусная кислота (4:1) . Растворители удаляли при пониженном давлении, остаток подщелачивали насыщенным раствором карбоната натрия и экстрагировали дихлорметаном (3). Объединенные органические экстракты сушили (MgSO4), фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде пены, 330 мг.(115 мл) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь разводили водным раствором насыщенного карбоната натрия, и фазы разделяли. Водный слой экстрагировали дихлорметаном (2) и объединенные органические экстракты промывали насыщенным раствором соли,сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Полученную коричневую пену перемешивали в 4 М НСl в диоксане(20 мл) в течение 1 ч. Избыток растворителя упаривали при пониженном давлении, и остаток подщелачивали водным раствором насыщенного карбоната натрия. Водный слой экстрагировали дихлорметаном (3). Объединенные органические растворы промывали насыщенным раствором соли, сушили (Na2SО 4), фильтровали и упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде коричневого твердого вещества, 729 мг. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,90 Раствор соединения, указанного в заголовке получения 65 (1,10 г, 2,24 ммоль), в 4 М НСl в диоксане (10 мл) перемешивали в течение 1 ч. Растворитель упаривали при пониженном давлении для получения соединения, указанного в заголовке, в виде белого твердого вещества, 1,30 г. 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 2,452,70 (3 Н, м), 2,92 (3 Н, с), 3,40 (4 Н, м) , 3,72 (1 Н,м), 3,83 (1 Н, м), 3,95-4,10 (2 Н, м), 4,30 (1 Н, д),4,45 (2 Н м), 5,82 (1 Н, м), 7,35-7,55 (5 Н, м), 7,60 Раствор соединения, указанного в заголовке получения 67 (222 мг, 0,59 ммоль), в дихлорметане (5 мл) добавляли к соединению, указанному в заголовке получения 60 (136 мг, 0,58 ммоль), гидрохлориду 1-(3-диметиламинопропил)-3-этилкарбодиимида (136 мг, 0,71 ммоль),N-этилдиизопропиламину (108 мкг, 0,62 ммоль) и гидрату 1-гидроксибензотиазола (88 мг, 0,65 ммоль) в дихлорметане (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Растворитель упаривали при пониженном давлении, и остаток переносили в этилацетат, промывали водой, насыщенным раствором соли, сушили (MgSО 4), фильтровали и упаривали при пониженном давлении. Остаточное бледно-коричневое твердое вещество очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан : метанол : 0,88 аммиак (95:5:0,5) для получения соединения, указанного в заголовке,в виде белого твердого вещества, 279 мг. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,621,72 (2 Н, уш.м), 1,76 (2 Н, м), 1,94-2,18 (4 Н, м),2,44-2,58 (3 Н, м), 2,58-2,68 (4 Н, м), 3,21-3,32 Соединение, указанное в заголовке, получали в виде белого твердого вещества (85%) из соединения, указанного в заголовке получения 67, и 1-[(трет-бутоксикарбонил)амино]циклопентан-карбоновой кислоты (J. Med. Chem. 14; 1971; 904), (61 мг, 0,27 ммоль), следуя процедуре, описанной в получении 71. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,42(750 мг, 3,54 ммоль) перемешивали совместно в 25 мл смеси ледяная уксусная кислота : дихлорметан (1:9) в течение 30 мин при комнатной температуре. Растворители удаляли при пониженном давлении, остаток суспендировали в насыщенном растворе карбоната натрия и экстрагировали дихлорметаном (3). Объединенные органические экстракты сушили (MgSO4),фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак Раствор соединения, указанного в заголовке получения 73, (750 мг, 1,63 ммоль) перемешивали в течение 5 ч при комнатной температуре в смеси дихлорметан:трифторуксусная кислота (4:1), (20 мл). Растворители удаляли при пониженном давлении, остаток подщелачивали с помощью насыщенного раствора бикарбоната натрия и экстрагировали дихлорметаном (3). Объединенные органические экстракты сушили(MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол: 0,88 аммиак (98:2:0,25), для получения 480 мг соединения, указанного в заголовке, в виде пены. Смесь данного промежуточного амина(480 мг, 1,33 ммоль), соединения, указанного в заголовке получения 61, (250 мг, 1,33 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (280 мг, 1,46 ммоль) перемешивали вместе в течение 1 ч при комнатной температуре в дихлорметане (10 мл). Растворитель удаляли при пониженном давлении, остаток 59 растворяли в этилацетате и промывали насыщенным раствором бикарбоната натрия и водой. Органический раствор сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, применяя для элюирования смесь дихлорметан:метанол:0,88 аммиак (98:2:0,25) для получения 730 мг соединения, указанного в заголовке, в виде пены. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,42 К 4-фторфенилуксусной кислоте (1,42 г,9,2 ммоль), N-этилдиизопропиламину (1,6 мл,9,2 ммоль), гидрохлориду 1-(3-диметиламинопропил)-3-этилкарбодиимида (1,77 г, 9,2 ммоль) и 1-гидроксибензотриазолгидрату (1,41, 9,2 ммоль) в дихлорметане (20 мл) добавляли соединение, указанное в заголовке получения 26,(2,0 г, 9,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, после чего добавляли насыщенный водный раствор карбоната натрия (30 мл). Слои разделяли и водную фазу экстрагировали дихлорметаном (2). Объединенные органические экстракты промывали водой, сушили (MgSO4),фильтровали и упаривали при пониженном давлении. Остаток очищали колоночной хроматографией на силикателе, применяя градиентное элюирование смесью дихлорметан:метанол: 0,88 аммиак (от 98:2:0 до 95,5:4:0,5), для получения 1,04 г соединения, указанного в заголовке, в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,40 Указанное в заголовке соединение получали (86%) в виде белого твердого вещества из соединения, указанного в заголовке получения 27, и 4-фторфенилуксусной кислоты, следуя Смесь соединения, указанного в заголовке получения 75, (2,69 г, 7,63 ммоль) и 10% палладия на угле (0,5 г) в этилацетате (30 мл) гидрировали при 50 фунт/кв. дюйм (344,5 кн/м 2) при 50 С в течение 48 ч. Реакционную смесь фильтровали через Arbocel и фильтрат удаляли при пониженном давлении для получения 1,96 г указанного в заголовке соединения в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3):[м.д.] 1,30 Раствор соединения, указанного в заголовке получения 76, (2,04 г, 5,62 ммоль) перемешивали в 4 М растворе НСl в диоксане (20 мл). Избыточный растворитель выпаривали при пониженном давлении для получения 1,55 г соединения, указанного в заголовке, в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 1,85 Соединение, указанное в заголовке, получали в виде белого твердого вещества (68%) из соединений, указанных в заголовках получений 7 и 78, следуя процедуре, сходной с описанной в получении 64. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,0-2,0
МПК / Метки
МПК: C07D 451/04, A61K 31/445
Метки: модуляторы, рецептора, азабициклоалканы, хемокинов
Код ссылки
<a href="https://eas.patents.su/30-4988-azabicikloalkany-kak-modulyatory-receptora-hemokinov-ccr5.html" rel="bookmark" title="База патентов Евразийского Союза">Азабициклоалканы как модуляторы рецептора хемокинов ccr5</a>
Предыдущий патент: Производные пурина
Следующий патент: Трициклические ингибиторы поли(adp-рибозо) полимераз
Случайный патент: Заколка для волос


































